Способ получения гидроксамовых кислот
Формула / Реферат
1. Способ получения соединения формулы
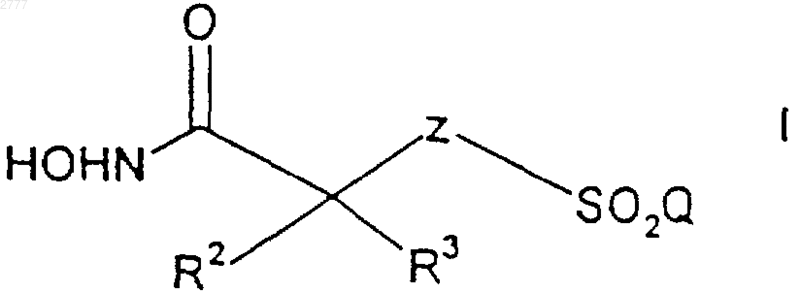
Z представляет собой >СН2 или >NR1;
Q представляет собой (C1-C6)алкил, (С6-С10)арил, (С2-С9)гетероарил, (C6-С10)арилокси(C1-C6)алкил, (C6-C10)арилокси(С6-С10)арил, (С6-С10)арилокси(С2-С9)гетероарил, (C6-C10)арил(С1-С6)алкил, (С6-С10)арил(С6-С10)арил, (С6-С10)арил(С2-С9)гетероарил, (С6-С10)арил(С6-С10)арил(C1-C6)алкил, (С6-С10)арил(C6-C10)арил(С6-С10)арил, (C6-C10)арил(С6-С10)арил(С2-С9)гетероарил, (С2-С9)гетероарил(С1-С6)алкил, (С2-С9)гетероарил(С6-С10)арил, (С2-С9)гетероарил(С2-С9)гетероарил, (С6-С10)арил(C1-С6)алкокси(С1-С6)алкил, (С6-С10)арил(C1-С6)алкокси(С6-С10)арил, (C6-С10)арил(C1-C6)алкокси(C2-C9)гетероарил, (С2-С9)гетероарилокси(C1-С6)алкил, (С2-С9)гетеро-арилокси(С6-С10)арил, (С2-С9)гетероарилокси(С2-С9)гетероарил, (С2-С9)гетероарил(C1-C6)алкокси(C1-C6)алкил, (С2-С9)гетероарил(C1-C6)алкокси(С6-С10)арил или (C2-C9)гетероарил(C1-C6)алкокси(С2-С9)гетероарил;
где каждый остаток (С6-С10)арил или (С2-С9)гетероарил указанных (С6-С10)арила, (С2-С9)гетероарила, (С6-С10)арилокси(C1-С6)алкила, (С6-С10)арилокси(С6-С10)арила, (С6-С10)арилокси(С2-С9)гетероарила, (С6-С10)арил(C1-С6)алкила, (С6-С10)арил(С6-С10)арила, (С6-С10)арил(С2-С9)гетероарила, (С6-С10)арил(С6-С10)арил(С1-С6)алкила, (С6-С10)арил(С6-С10)арил(С6-С10)арила, (С6-С10)арил(С6-С10)арил(С2-С9)гетероарила, (С2-С9)гетероарил(C1-С6)алкила, (С2-С9) гетероарил(С6-С10)арила, (С2-С9)гетероарил(С2-С9)гетероарила, (С6-C10)арил(С6-С10)алкокси(C1-С6)алкила, (С6-С10)арил(C1-C6)алкокси(С6-С10)арила, (С6-С10)арил(C1-C6)алкокси(C2-C9)гетероарила, (C2-C9)гетероарилокси(C1-C6)алкила, (С2-С9)гетероарилокси(С6-C10)арила, (С2-С9)гетероарилокси(С2-С9)гетероарила, (С2-С9)гетероарил(С1-С6)алкокси(C1-С6)алкила, (С2-С9)гетероарил(C1-C6)алкокси(С6-С10)арила или (C2-C9)гетероарил(С1-С6)алкокси(С2-С9)гетероарила является необязательно замещенным и содержит в цикле один или большее количество заместителей, которые могут находиться при любом из атомов углерода цикла, способном образовывать дополнительную связь с заместителем, который независимо выбран из группы, включающей фтор, хлор, бром, (C1-C6)алкил, (С1-С6) алкоксигруппу, перфтор(C1-С3)алкил, перфтор(C1-C3)алкокси- и (С6-С10)арилоксигруппу,
R1 представляет собой водород, (С1-С6)алкил, (С6-С10)арил(C1-С6)алкил, (С2-С9)гетероарил(C1-C6)алкил или группу формулы
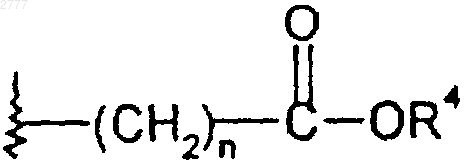
где R2 и R3 независимо представляют собой водород, (C1-C6)алкил или R2 и R3 вместе образуют циклоалкил, содержащий от трех до семи атомов, пиран-4-ила или бицикл формулы
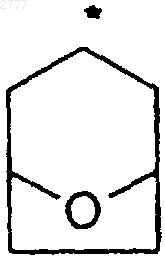
где звездочкой обозначен атом углерода, общий для R2 и R3; и
R4 представляет собой (С1-С6)алкил;
n представляет собой целое число от единицы до шести;
способ включает:
a) взаимодействие гидроксиламина или его соли с ((C1-C6)алкил)3силилгалогенидом в присутствии первого основания с образованием in situ ((C1-С6)алкил)3силилированного гидроксиламина,
b) взаимодействие указанного ((C1-C6)алкил)3силилированного гидроксиламина с соединением формулы
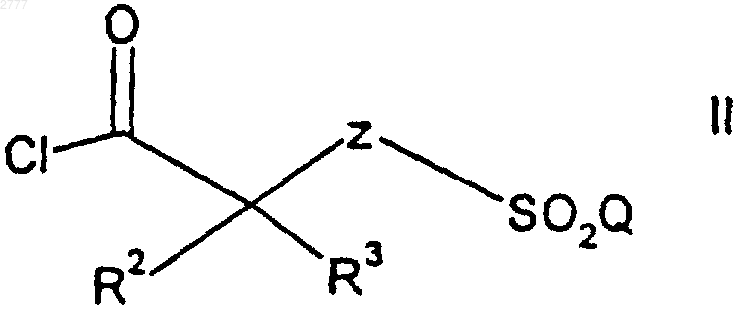
где R2, R3, Z и Q принимают значения, определенные выше,
со вторым основанием с образованием соединения формулы
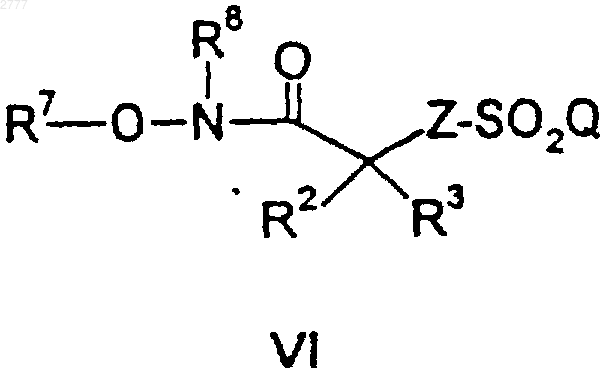
где R7 представляет собой ((C1-C6)алкил)3-Si- и R8 представляет собой водород или ((C1-С6)алкил)3-Si-, и
с) гидролиз указанного соединения формулы VI кислотой.
2. Способ по п.1, где указанное первое основание представляет собой пиридин, 2,6-лутидин или диизопропилэтиламин.
3. Способ по п.1, в котором указанное первое основание представляет собой пиридин.
4. Способ по п.1, в котором указанный ((С1-С6)алкил)3силилгалогенид представляет собой триметилсилилхлорид.
5. Способ по п.1, в котором указанное второе основание представляет собой пиридин, 2,6-лутидин или диизопропилэтиламин.
6. Способ по п.1, в котором указанное второе основание представляет собой пиридин.
Текст
1 Предпосылки изобретения Данное изобретение относится к способу получения гидроксамовых кислот из промежуточных карбоновых кислот, в котором промежуточная карбоновая кислота не содержит реакционноспособных заместителей, таких как гидроксильные или аминогруппы. Хорошо известно, что ингибиторы матричной металлопротеиназы (ММР) полезны для лечения состояния, выбранного из группы,включающей артриты (в том числе остеоартрит и ревматоидный артрит), воспаление кишечника, болезнь Крона, эмфизему, острый респираторный дистресс-синдром, астму, хроническое заболевание, связанное с закупоркой легкого,болезнь Альцгеймера, токсичность органических трансплантатов, кахексия, аллергические реакции, аллергическую повышенную контактную чувствительность, рак, тканевые язвы, рестеноз, периодонтальное заболевание, врожденный буллезный эпидермолиз, остеопороз, ослабление искусственных суставных имплантатов, атеросклероз (в том числе разрыв, вызванный атеросклеротической бляшкой), аневризму аорты (в том числе брюшную аневризму аорты и мозговую аневризму аорты), застойную сердечную недостаточность, инфаркт миокарда,удар, церебральную ишемию, травму головы,повреждение спинного мозга,нервнодегенеративные расстройства (острые и хронические), аутоиммунные расстройства, болезнь Хантингтона, болезнь Паркинсона, мигрень,депрессию, периферическую невропатию, боль,церебральную амилоидную ангиопатию, феномен ноотропной или познавательной активации,боковой амиотрофический склероз, рассеянный склероз, ангиогенез глазных кровеносных сосудов, повреждение роговицы, дегенерацию желтого пятна, патологическое заживление раны,ожоги, диабет, инвазию опухоли, рост опухоли,метастаз опухоли, рубцевание роговицы, склерит, СПИД, сепсис, септический шок и другие заболевания, характеризуемые ингибированием металлопротеиназы или экспрессией ADAM(включая TNF-). Кроме того, продукты, которые могут быть получены с помощью соединений и способов данного изобретения, могут использоваться в комбинированной терапии со стандартными нестероидными противовоспалительными лекарствами (далее обозначаемыми как NSAID), ингибиторами СОХ-2 и аналгетиками для лечения артрита и в сочетании с цитотоксическими лекарственными средствами, такими как адриамицин, дауномицин, цисплатина, этопозид, таксол, таксотер, и алкалоидами, такими как винкристин, при лечении рака. Ингибиторы матричной металлопротеиназы описаны в литературе. Например, в международной заявке РСТ WO 96/33172, опубликованной 24 октября 1996 г., описываются циклические арилсульфониламиногидроксамовые кислоты, которые полезны в качестве ингибито 002777 2 ров ММР. В Патенте США 5672615, в опубликованных международных заявках РСТ WO 97/20824, WO 98/08825, WO 98/27069 и РСТWO 98/34918, опубликованной 13 августа 1998 г. под названием "Производные арилсульфонилгидроксамовых кислот", описываются циклические гидроксамовые кислоты, которые полезны в качестве ингибиторов ММР. В опубликованных международный заявках РСТ WO 96/27583 и WO 98/07697, опубликованных 7 марта 1996 г. и 26 февраля 1998 г. соответственно, описываются арилсульфонилгидроксамовые кислоты. В международной заявке РСТ WO 98/03516, опубликованной 20 января 1998 г.,описываются фосфинаты с ММР активностью. В международной заявке РСТ WO 98/34915,опубликованной 13 августа 1998 г. под названием "Производные N-гидроксисульфонилпропионамида", описываются пропионилгидроксамиды, полезные в качестве ингибиторов ММР. В международной заявке РСТ WO 98/33768, опубликованной 6 августа 1998 г. под названием Производные арилсульфониламиногидроксамовых кислот", описываются Nнезамещенные арилсульфониламиногидроксамовые кислоты. В международной заявке РСТWO 98/30566, опубликованной 16 июля 1998 г. под названием "Производные циклических сульфонов", описываются циклические сульфонгидроксамовые кислоты в качестве ингибиторов ММР. В публикации United States Provisional Patent Application 60/55208, выданной 8 августа 1997 г., описываются биарилгидроксамовые кислоты в качестве ингибиторов ММР. В публикации United States Provisional Patent Application Serial60/55207 - "Производные арилоксиарилсульфониламиногидроксамовых кислот", поданной 8 августа 1997 г., описываются арилоксиарилсульфонилгидроксамовые кислоты, которые используются в качестве ингибиторов ММР. Все известные источники предшествующего уровня техники раскрывают только получение гидроксамовокислотных продуктов по реакции хлорангидридов кислот и алкилсилилированных гидроксиламинов, однако, в них нет каких-либо упоминаний о том, откуда берутся и как получаются алкилсилилированные гидроксиламины. По-видимому в соответствии с практикой известных изобретений ключевое вещество H2NOSi(СН 3)3 просто предоставляется в виде предварительно закупаемого реагента. В патенте США 5672615 наиболее близкой технологией по-видимому является технология, упоминаемая в столбце 16 (в абзацах 2, 3), в строках 8, 13, например. Согласно практике данного изобретения опять-таки ключевое соединениеH2NOSi(СН 3)3 является предварительно закупаемым реагентом. Однако данное вещество является крайне дорогим и непрактичным в обращении с ним в значительных количествах, 3 поскольку оно крайне восприимчиво к загрязнениям (и следовательно и к разложению) парами воды. В противоположность известной информации предлагаемое в настоящей заявке изобретение предоставляет удобную, экономичную, осуществляемую в одной мкости реакцию, согласно которой(1) алкилсилилированный гидроксиламин приготавливается in situ, затем(2) силилированный гидроксиламин подвергается реакции с хлорангидридом алифатической кислоты с образованием соединения(3) гидролизом с образованием подукта соединения формулы "I". Таким образом, ценным признаком настоящего изобретения является то, что такое вещество генерируется in situ, по мере необходимости, в единственной реакционной мкости,позволяя таким образом синтез лекарственных средств в крупном масштабе, а не просто реакции в небольшом масштабе, которые проводятся в исследовательских лабораториях. В дополнение к изложенному, источники известного уровня техники не раскрывают получение in situ подходящих алкилсилилированных гидроксиламинов. Получение алкилсилилированных гидроксиламинов описывается в ссылках Burchardt et al., "Ergiebige Synthese Nsubstituierter Arylglyoxylohydroxamsautren" Arch.Bottaro раскрывается процедура реакции гидроксиламина (в виде гидрохлоридной соли) и триалкилсилилгалогенида. Однако ключевым для данной реакции является использование дигидрохлорида этилендиамина (см. стр. 1334 публикации, строки 18-20), что совершенно ясно не является предпочтительным для практики настоящего изобретения, поскольку этилендиамин способствует нежелательной и преждевременной реакции, по которой этилендиамин превращает галоид ангидриды карбоновых кислот в амиды RC(=O)Cl в RC(=O)NHCH2CH2NH2 или двойные амиды R(=O)NHCH2CH2NHC(=O)R. Каждая из указанных выше публикаций и заявок включается в данное описание во всей полноте для сведения. Краткое описание изобретения Данное изобретение относится к способу получения производных гидроксамовой кислоты, который предусматривает взаимодействие гидроксиламина или его соли с C1-C6)алкил)3 силилгалогенидом, предпочтительно с C1C6)алкил)3 силилхлоридом, в присутствии основания с последующим взаимодействием с галогенангидридным производным карбоновой кислоты, и последующим взаимодействием с кислотой при условии, что галогенангидридное 4 производное карбоновой кислоты не содержит гидроксильной группы, первичной аминогруппы, вторичной аминогруппы или тиольной группы. Данное изобретение относится к способу получения соединения формулы(C1-С 6)алкил,(С 2-С 9)гетероарил(C1-С 6)алкокси(С 6-С 10)арил или (С 2-С 9)гетероарил(C1-С 6) алкокси(С 2-С 9)гетероарил; где каждый остаток (С 6-С 10)арил или (С 2 С 9)гетероарил указанных (С 6-С 10)арила, (С 2 С 9)гетероарила, (С 6-С 10)арилокси(C1-С 6)алкила,(С 6-С 10)арилокси(С 6-С 10)арила,(С 6-С 10)арилокси(C2-C9)гетероарила, (С 6-С 10)арил(C1-С 6)алкила, (С 6-С 10)арил(С 6-С 10)арила, (С 6-С 10)арил(C1-С 6)алкокси(C1-С 6)алкила,(C2-C9)гетероарил(C1-С 6)алкокси(С 6-С 10)арила или (С 2-С 9) гетероарил(C1-С 6)алкокси(С 2-С 9)гетероарила является необязательно замещенным и содержит в цикле один или большее количество заместителей, которые могут находиться на любом из атомов углерода цикла, способном образовывать дополнительную связь с заместителем,который независимо выбран из группы, включающей фтор, хлор, бром, (C1-С 6)алкил, (C1-C6) алкоксигруппу, перфтор(C1-С 3)алкил, перфтор где R2 и R3 независимо представляют собой водород, (C1-С 6)алкил или R2 и R3 вместе образуют циклоалкил, содержащий от трех до семи атомов, цикл пиран-4-ила или бицикл формулы где звездочкой обозначен атом углерода,общий для R2 и R3; иn представляет собой целое число от единицы до шести; способ включает:a) взаимодействие гидроксиламина или его соли с C1-С 6)алкил)3 силилгалогенидом, предпочтительно триметилсилилхлоридом, в присутствии первого основания (предпочтительно пиридина, 2,6-лутидина или диизопропилэтиламина) в растворителе (предпочтительно пиридине) с образованием in situ C1-C6) алкил)3 силилированного гидроксиламина,b) взаимодействие указанного C1C6)алкил)3 силилированного гидроксиламина с соединением формулы где R7 представляет собой C1-С 6)алкил)3Si-, и R8 представляет собой водород или C1C6)алкил)3-Si-, и с) гидролиз указанного соединения формулы VI кислотой. Термин "алкил", используемый в данном описании, если не указано другого значения,относится к насыщенным одновалентным углеводородным радикалам, содержащим прямые,разветвленные или циклические фрагменты или их сочетания. Термин "алкокси", используемый в данном описании, включает O-алкильные группы, где 6 Термин "арил", используемый в данном описании, если не указано другого значения,относится к органическому радикалу, полученному из ароматического углеводорода посредством удаления одного водорода, например фенил или нафтил. Термин "гетероарил", используемый в данном описании, если не указано другого значения, относится к органическому радикалу,полученному из ароматического гетероциклического соединения посредством удаления одного атома водорода, такому как пиридил, фурил,пироил, тиенил, изотиазолил, имидазолил, бензимидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, бензофурил, изобензофурил, бензотиенил, пиразолил, индолил,изоиндолил, пуринил, карбазолил, изоксазолил,тиазолил, оксазолил, бензтиазолил или бензоксазолил. Предпочтительные гетероарилы включают пиридил, фурил, тиенил, изотиазолил, пиразинил, пиримидил, пиразолил, изоксазолил,тиазолил или оксазолил. Наиболее предпочтительные гетероарилы включают пиридил, фурил или тиенил. Термин "ацил", используемый в данном описании, если не указано другого значения,относится к радикалу общей формулы R-(С=O),где R представляет собой алкил, алкоксигруппу,арил, арилалкил или арилалкоксигруппу, а термины "алкил" или "арил" принимают определенные выше значения. Термин "ацилокси", используемый в данном описании, относится к О-ацильным группам, где "ацил" принимает значения, определенные выше. Соединения формул I-VI могут иметь хиральные центры и, следовательно, могут существовать в различных диастереомерных или энантиомерных формах. Данное изобретение относится ко всем оптическим изомерам и стереоизомерам соединений формулы I-VI и их смесям. Предпочтительно соединения формулы I' существуют в виде экзоизомера формулы Подробное описание изобретения Приведенные далее схемы реакций иллюстрируют получение соединений данного изобретения. Если не указано других значений, n,R1, R2, R3, R4, R5, Q и Z в схемах реакций и следующем далее обсуждении принимают значения, определенные выше. Схема 1 относится к получению матричных металлопротеиназных соединений формулы I. В соответствии со схемой 1, соединения формулы I получают из гидроксиламина формулы VIII, где R9 представляет собой гидрохлорид, гидросульфат или R9 отсутствует. В частности, соединения формулы VIII взаимодейст 002777 8 вуют с C1-C6)алкил)3 силилгалогенидом в присутствии основания с образованием in situ соединения формулы VII, где R7 представляет собой C1-C6)алкил)3-Si-, и R8 представляет собой водород или C1-C6)алкил)3-Si-. ПодходящиеC1-C6)алкил)3 силилгалогениды включают триметилсилилхлорид, триэтилсилилхлорид, триметилсилилйодид, триэтилсилилйодид, триметилсилилбромид, трет-бутилдиметилсилилхлорид или триэтилсилилбромид, предпочтительно триметилсилилхлорид. Подходящие основания включают пиридин, 2,6-лутидин или диизопропилэтиламин, предпочтительно пиридин. Реакцию проводят при температуре в интервале от приблизительно 0 до приблизительно 22 С (то есть при комнатной температуре) в течение от приблизительно 1 до приблизительно 12 ч,предпочтительно в течение приблизительно 1 ч. Полученное in situ соединение формулыVII затем взаимодействует с соединением формулы II или хлорангидридом соединения формулы V из схемы 2 в присутствии основания для получения in situ соединения формулы VI, гдеR2, R3, R7, R8 и Q принимают значения, определенные выше, и Z представляет собой NR1. Подходящие основания включают пиридин, 2,6 лутидин или диизопропилэтиламин, предпочтительно пиридин. Реакцию проводят при температуре в интервале от приблизительно 0 до приблизительно 22 С (то есть при комнатной температуре) в течение от приблизительно 1 до приблизительно 12 ч, предпочтительно в течение приблизительно 1 ч. Соединение формулы VI превращают в соединение формулы I, где Z представляет собойNR1, посредством кислотного гидролиза. Подходящие кислоты включают соляную или серную кислоту, предпочтительно применение соляной кислоты. Реакцию проводят при температуре в интервале от приблизительно 0 до приблизительно 22 С (то есть при комнатной температуре) в течение от приблизительно 1 до приблизительно 12 ч, предпочтительно в течение приблизительно 1 ч. В качестве альтернативы соединения формулы I, где Z представляет собой -(СН 2)-, могут быть получены посредством взаимодействия соединения формулы где R2 и R3 и Q принимают значения, определенные выше, с соединением формулы VII. Соединения формулы IX могут быть получены способами, хорошо известными квалифицированному специалисту. Схема 2 относится к получению соединений формулы II, которые представляют собой промежуточные продукты, используемые при получении соединений формулы I согласно способам схемы 1. 9 В соответствии со схемой 2, соединения формулы II получают из соединений формулыIII, где R10 представляет собой водород, взаимодействием с оксалилхлоридом или тионилхлоридом, предпочтительно с оксалилхлоридом, и катализатором, предпочтительно применение приблизительно 2% N,N-диметилформамида, в инертном растворителе, таком как метиленхлорид или толуол. Описанную выше реакцию проводят при температуре в интервале от приблизительно 0 (то есть комнатной температуры) до приблизительно 70 С, предпочтительно в интервале от приблизительно 20 до приблизительно 50 С, наиболее предпочтительно при приблизительно 20 С. Продолжительность указанной реакции составляет примерно от 1 до 7 ч,предпочтительно примерно 2 ч. Соединения формулы III, где R10 представляет собой водород, могут быть получены из соединений формулы IV, где R6 представляет собой необязательно замещенный бензил, восстановлением в полярном растворителе. Подходящие восстановители включают палладиевые реагенты, восстанавливающие посредством каталитических реакций, такие как водород над палладием, водород над палладием на углероде или гидроксидом палладия на углероде, предпочтительно водород над палладием на углероде. Подходящие растворители включают тетрагидрофуран, метанол, этанол и изопропанол и их смеси, предпочтительно этанол. Указанную реакцию проводят при температуре приблизительно 22 С (то есть при комнатной температуре) в течение от 1 до 7 дней, предпочтительно в течение приблизительно 2 дней. Соединения формулы III, где R10 отличен от водорода, например, протонированный амин(такой как протонированный первичный амин,вторичный амин или третичный амин), щелочной металл или щелочно-земельный металл,могут быть получены из соединений формулыIII, где R10 представляет собой водород, обработкой водным или алканольным раствором,содержащим приемлемый катион (например,натрий, калий, дициклогексиламин, кальций и магний, предпочтительно дициклогексиламин),с последующим упариванием образующегося раствора досуха, предпочтительно под пониженным давлением, или выделением осадка фильтрованием, предпочтительно осадка дициклогексиламинной соли. Соединения формулы IV могут быть получены из соединений формулы V, где R6 представляет собой необязательно замещенный бензил, реакцией присоединения Михаэля к сложному пропиолатовому эфиру в присутствии основания в полярном растворителе. Подходящие пропиолаты представляют собой соединения формулы H-CC-CO2R4, где R4 представляет собой (C1-C6)алкил. Подходящие основания включают фторид тетрабутиламмония, карбонат 10 калия, третичные амины и карбонат цезия,предпочтительно фторид тетрабутиламмония. Подходящие растворители выключают тетрагидрофуран, ацетонитрил, трет-бутанол, третамиловые спирты и N,N-диметилформамид,предпочтительно тетрагидрофуран. Указанную реакцию проводят при температуре в интервале от приблизительно -10 до приблизительно 60 С,предпочтительно в интервале от 0 до приблизительно 22 С (то есть при комнатной температуре). Соединения формулы IV получают в виде смесей геометрических изомеров относительно двойной олефиновой связи; разделение изомеров не обязательно. Соединения формулы V, где R2 и R3 представляют собой тетрагидропиран-4-ил или бицикл формулы где звездочкой обозначен атом углерода, общий для R2 и R3, могут быть получены в соответствии со способами, аналогичными способам,описанным в примерах 3 и 4. Соединения формулы V, где R6 представляет собой необязательно замещенный бензил,могут быть получены в соответствии со способами, известными в литературе. Примеры таких способов получения включают следующие публикации и заявки. Ингибиторы матричной металлопротеиназы хорошо известны и описаны в литературе. В частности, в международной заявке РСТ WO 96/33172, опубликованной 24 октября 1996 г., описываются циклические арилсульфониламиногидроксамовые кислоты, которые полезны в качестве ингибиторов ММР. В патенте США 5672615, в опубликованных международных заявках РСТ WO 97/20824, WO 98/08825, WO 98/27069 и WO 98/34918, опубликованной 13 августа 1998 г. под названием"Производные арилсульфонилгидроксамовых кислот", описываются циклические гидроксамовые кислоты, которые полезны в качестве ингибиторов ММР. В международных заявках РСТWO 96/27583 и WO 98/07697, опубликованных 7 марта 1996 г. и 26 февраля 1998 г. соответственно, описываются арилсульфонилгидроксамовые кислоты. В международной заявке РСТ WO 98/03516, опубликованной 29 января 1998 г.,описываются фосфинаты с ММР активностью. В международной заявке РСТ WO 98/34915,опубликованной 13 августа 1998 г. под названием "Производные N-гидроксисульфонилпропионамида", описываются пропионилгидроксамиды как полезные ингибиторы ММР. В международной заявке РСТ WO 98/33768, опубликованной 6 августа 1998 г. под названием "Производные арилсульфониламиногидроксамовых кислот", описываются N-незамещенные арилсульфониламиногидроксамовые кислоты. В международной заявке РСТ WO 98/30566, опубли 11 кованной 16 июля 1998 г. под названием "Производные циклических сульфонов", описываются циклические сульфонгидроксамовые кислоты в качестве ингибиторов ММР. В публикацииUnited States Provisional Application 60/55208,заявленной 8 августа 1997 г., описываются биарилгидроксамовые кислоты в качестве ингибиторов ММР. В публикации United States Provisional Patent Application Serial60/55207, заявленной 8 августа 1997 г. под названием "Производные арилоксиарилсульфониламиногидроксамовых кислот", описываются арилоксиарилсульфонилгидроксамовые кислоты в качестве ингибиторов ММР. Каждая из указанных публикаций и заявок введена в описание посредством ссылки во всей полноте. Соединения формулы I, которые являются основными по природе, способны образовывать большое количество различных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным,зачастую на практике необходимо сначала выделить соединение формулы I из реакционной смеси в виде фармацевтически неприемлемой соли, затем просто превратить последнюю в свободное основание обработкой щелочным реагентом и после этого превратить свободное основание в фармацевтически приемлемую кислотно-аддитивную соль. Кислотно-аддитивные соли основных соединений данного изобретения легко получают обработкой основного соединения, по существу, эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После осторожного упаривания растворителя получают целевую соль в виде твердого вещества. Кислоты, которые применяют для получения фармацевтически приемлемых кислотноаддитивных солей основных соединений данного изобретения, представляют собой кислоты,которые образуют нетоксичные кислотноаддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлориды, гидробромиды, гидройодиды,нитраты, сульфаты или бисульфаты, фосфаты или кислые фосфаты, ацетаты, лактаты, цитраты или кислые цитраты, тартраты или битартраты,сукцинаты, малеаты, фумараты, глюконаты,сахараты, бензоаты, метансульфонаты и памоаты [т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоаты)]. Те соединения формулы I, которые являются также кислотными по природе, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных или щелочно-земельных металлов, в частности,натриевые и калиевые соли. Все эти соли получают общеизвестными методами. Химические 12 основания, которые используются в качестве реагентов для получения фармацевтически приемлемых основных солей данного изобретения,являются основаниями, которые образуют нетоксичные основные соли с описанными в данной заявке кислотными соединениями формулыI. Эти нетоксичные основные соли включают соли, полученные из таких фармакологически приемлемых катионов, как натрий, калий, кальций и магний и т.д. Эти соли легко могут быть получены обработкой соответствующих кислотных соединений водным раствором, содержащим необходимые фармакологически приемлемые катионы, и затем выпариванием полученного раствора досуха, предпочтительно при пониженном давлении. В качестве альтернативы, они могут быть получены также смешением растворов кислотных соединений в низших алканолах с необходимыми алкоксидами щелочных металлов с последующим упариванием полученного раствора досуха способом, описанным выше. В любом случае для обеспечения полноты реакции и максимальных выходов продукта используют предпочтительно стехиометрические количества реагентов. Способность соединений формулы I и их фармацевтически приемлемых солей (далее называемых также активными соединениями) ингибировать матричные металлопротеиназы или продуцировать фактор некроза опухоли (TNF)(и таким образом показать их эффективность для лечения заболеваний, характеризуемых матричной металлопротеиназой или выработкой фактора некроза опухоли) можно определить в соответствии с тестами оценки in vitro, хорошо известными квалифицированному в данной области специалисту. Приведенные далее примеры иллюстрируют получение соединений данного изобретения. Температуры плавления не корректировались. Данные ЯМР-анализа приводятся в миллионных доляхи относятся к сигналу захвата дейтерия из типичного раствора (обычно дейтериохлороформа, если не указан другой растворитель). Коммерческие реагенты использовались без дополнительной очистки. Аббревиатурой THF обозначается тетрагидрофуран. Аббревиатурой DMF обозначается N,N-диметилформамид. Термин "хроматография" относится к колоночной хроматографии, выполненной с использованием 32-63 мм силикагеля и проводимой под давлением азота(флэшхроматография). Термин "комнатная температура" или "температура окружающей среды" относится к температуре в интервале 20-25 С. Все неводные реакции проводят под атмосферой азота для удобства и получения максимальных выходов. Термин "упаривание под пониженным давлением" означает, что использовался роторный испаритель.A). Бензиловый эфир 1-[4-(4-фторфенокси)бензолсульфониламино]циклопентанкарбоновой кислоты. К смеси 12,41 г (0,032 моль) толуол-4 сульфонатной соли бензилового эфира 1 аминоциклопентанкарбоновой кислоты (может быть получена в соответствии с методами, описанными в патенте США 4745124) и 10 г (0,035 моль, 1,1 эквивалент) 4-(4-фторфенокси) бензолсульфонилхлорида в 113 мл толуола добавляют 11,0 мл (0,079 моль, 2,5 эквивалента) триэтиламина. Полученную смесь перемешивают в течение ночи при комнатной температуре,промывают 2N соляной кислотой (2100 мл) и насыщенным солевым раствором (100 мл), сушат над сульфатом натрия и упаривают до 30 мл. В течение 3 ч по каплям добавляют гексан(149 мл), получая твердый осадок, который оставляют гранулироваться при 0 С в течение часа, затем фильтруют, в результате получают 12,59 г (85%) бензилового эфира 1-[4-(4 фторфенокси)бензолсульфониламино]циклопентанкарбоновой кислоты. ПМР (СDСl3)7,78-7,82 (м, 2 Н), 7,30-7,39(м, 2 Н), 1,92-1,98 (м, 2 Н), 1,62-1,69 (м, 4 Н). Образец массой 4,0 г перекристаллизовывают из смеси 4 мл этилацетата и 40 мл гексана в течение ночи, получают 3,72 г (93% выход) бензилового эфира 1-[4-(4-фторфенокси)бензолсульфониламино]циклопентанкарбоновой кислоты в виде твердого вещества светлого желтовато-коричневого цвета, т. пл. 97,0-97,5 С.B) Бензиловый эфир 1-(2-этоксикарбонилвинил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты. Раствор 25,0 г (53,2 ммоль) бензилового эфира 1-[4-(4-фторфенокси)бензолсульфониламино]циклопентанкарбоновой кислоты и 10,8 мл (106 ммоль, 2 эквивалента) этилпропиолата в 200 мл сухого тетрагидрофурана при 1 С обрабатывают 53,2 мл (53,2 ммоль, 1 эквивалент) раствора фторида тетрабутиламмония в тетрагидрофуране (1 М) в течение 45 мин. Полученному раствору дают медленно нагреться до комнатной температуры и перемешивают его в течение ночи. Тетрагидрофуран замещают толуолом при пониженном давлении, толуольный раствор промывают водой и насыщенным солевым раствором, добавляют толуол до объема 600 мл, смешивают с 90 г силикагеля и продолжают перемешивание в течение 3 ч, затем фильтруют и упаривают, в результате получают 25,14 г (83%) бензилового эфира 1-(2 этоксикарбонилвинил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты в виде масла оранжевого цвета. 14 ПМР (CDCl3)показывает, что соотношение транс/цис изомеров составляет 1,5:5. Транс 7,74-7,78 (м, 2 Н), 7,72 (д, J = 14 Hz,1H), 7,26-7,36 (м, 5 Н), 6,96-7,12 (м, 4 Н), 6,786,84 (м, 2 Н), 5,44 (д, J = 14 Hz, 1H), 5,11 (с, 2H),4,12 (кв., J = 7,1 Hz, 2H), 2,08-2,43 (м, 4 Н), 1,631,80 (м, 4 Н), 1,24 (т, J = 7,1 Hz, 3H). Цис 7,68-7,72 (м, 2H), 7,26-7,36 (м, 5 Н),6,96-7,12 (м, 4 Н), 6,86-6,91 (м, 2H), 6,47 (д, J = 8,1 Hz, 1H), 5,90 (д, J = 8,1 Hz, 1H), 5,11 (с, 2H),3,93 (кв., J = 7,2 Hz, 2H), 2,08-2,43 (м, 4 Н), 1,631,80 (м, 4 Н), 1,17 (т, J = 7,2 Hz, 3H) С) 1-(2-Этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновая кислота. Раствор 2,50 г (4,4 ммоль) бензилового эфира 1-(2-этоксикарбонилвинил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты в 25 мл этанола обрабатывают 2,5 г 10% палладия на углероде, содержащего 50% водной влаги, и подвергают вибрации под атмосферой водорода 53 пси в течение 21 ч. Катализатор отфильтровывают и промывают этанолом (425 мл). Фильтрат и промывные растворы соединяют и упаривают под вакуумом в результате получают 1,74 г (82%) неочищенной 1-(2-этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты в виде вязкого масла. ПМР (СDСl3)7,78-7,82 (м, 2H), 6,94-7,09D) 1-(2-Этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновая кислота,дициклогексиламмониевая соль. Раствор 3,10 г (6,5 ммоль) технической 1(2-этоксикарбонилэтил)-[4-(4-фторфенокси) бензолсульфонил]аминоциклопентанкарбоновой кислоты в 30 мл этанола обрабатывают 1,28 мл (6,5 ммоль, 1 эквивалент) дициклогексиламина при комнатной температуре, в результате в течение 5 мин образуется твердый осадок. Смесь перемешивают при комнатной температуре в течение ночи, затем при 0 С в течение 5 ч. Белый твердый осадок выделяют фильтрованием, промывают 10 мл охлажденного этанола и сушат на воздухе, в результате получают 2,89 г 15 Е) 1-(2-Этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновая кислота. Раствор 3,0 г (4,5 ммоль) дициклогексиламмониевой соли 1-(2-этоксикарбонилэтил)[4-(4-фторфенокси)бензолсульфонил]амино циклопентанкарбоновой кислоты в 30 мл дихлорметана обрабатывают 30 мл 2N соляной кислоты при комнатной температуре, что вызывает немедленное выпадение твердого осадка. Смесь перемешивают при комнатной температуре в течение 3 ч. Твердый осадок отфильтровывают, водную фазу экстрагируют дихлорметаном, соединенные органические фазы промывают водой, сушат над сульфатом натрия и упаривают под вакуумом, в результате получают 2,2 г (100%) 1-(2-этоксикарбонилэтил)-[4-(4 фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты в виде прозрачного масла. ПМР (DMSO-d6)12,68 (уш. с. 1 Н), 7,767,80 (м, 2 Н), 7,25 -7,31 (м, 2 Н), 7,16-7,21 (м, 2 Н),7,03-7,08 (м, 2 Н), 4,01 (кв., J = 7,1 Hz, 2 Н), 4,483,54 (м, 2 Н), 2,64-2,70 (м, 2 Н), 2,13-2,21 (м, 2 Н),1,90-1,98 (м, 2 Н), 1,52-1,59 (м, 4 Н), 1,14 (т, J = 7,1 Hz, 3 Н).F) Этиловый эфир 3-(1-хлоркарбонилциклопентил)-[4-(4-фторфенокси)бензолсульфонил]аминопропионовой кислоты. Раствор 7,26 г (15,1 ммоль) 1-(2 этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты в 73 мл дихлорметана обрабатывают 1,4 мл (17 ммоль, 1,1 эквивалента) оксалилхлорида и 0,02 мл (0,3 ммоль, 0,02 эквивалента) диметилформамида при комнатной температуре, что вызывает образование и выделение некоторого количества пузырьков, и перемешивают в течение ночи. Полученный раствор этилового эфира 3-(1-хлоркарбонилциклопентил)-[4(4-фторфенокси)бензолсульфонил]аминопропионовой кислоты используют для получения этилового эфира 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил) амино]пропионовой кислоты без выделения целевого продукта. Аналогично полученный раствор этилового эфира 3-(1-хлоркарбонилциклопентил)-[4(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты упаривают под вакуумом до масла. ПМР (СDСl3)7,84-7,87 (м, 24), 6,97-7,12 16 ммоль, 7,5 эквивалента) сухого пиридина при 0 С обрабатывают 5,8 мл (45 ммоль, 3,0 эквивалента) триметилсилилхлорида, что вызывает выпадение твердого белого осадка, и дают смеси нагреться до комнатной температуры в течение ночи. Смесь охлаждают до 0 С и обрабатывают раствором 7,54 г (15,1 ммоль) этилового эфира 3-(1-хлоркарбонилциклопентил)-[4-(4 фторфенокси)бензолсульфонил]аминопропионовой кислоты в 73 мл дихлорметана, полученного, как описано выше, без выделения, что вызывает нагрев смеси до 8 С. Эту смесь перемешивают при 0 С в течение 30 мин и при комнатной температуре в течение одного часа, затем обрабатывают 50 мл 2N водной соляной кислоты и перемешивают при комнатной температуре в течение одного часа. Водную фазу экстрагируют дихлорметаном и соединенные органические фазы промывают 2N водной соляной кислотой (250 мл) и водой (50 мл). Этот раствор этилового эфира 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты в дихлорметане используют для получения 3-4-(4 фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты без выделения целевого продукта. Аликвоту упаривают до пены. ПМР (DMSO-d6)10,37 (с, 1 Н), 8,76 (с,1 Н), 7,74-7,79 (м, 2 Н), 7,24-7,30 (м, 2 Н), 7,147,20 (м, 2 Н), 7,01-7,05 (м, 2 Н), 3,99 (кв., J = 7,1Hz, 2 Н), 3,42-3,47 (м, 2 Н), 2,62-2,67 (м, 2 Н),2,16-2,23 (м, 2 Н), 1,77-1,85 (м, 2 Н), 1,43-1,52 (м,4 Н), 1,13 (т, J = 7,1 Hz, 3 Н). Аналогично полученный раствор упаривают под вакуумом, в результате получают 6,71 г (89%) этилового эфира 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты в виде твердой сухой пены. Н) 3-4-(4-Фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино] пропионовая кислота. Раствор 7,48 г (15,1 ммоль) этилового эфира 3-4-(4-фторфенокси)бензолсульфонил]-(1 гидроксикарбамоилциклопентил)амино]пропионовой кислоты в дихлорметане упаривают на роторном испарителе с добавлением 75 мл толуола. Этот раствор обрабатывают 75 мл воды,охлаждают до 0 С и обрабатывают 6,05 г (151 ммоль, 10 эквивалентов) гидроксида натрия в гранулах в течение 10 мин при энергичном перемешивании. Эту смесь перемешивают в течение 15 мин и нагревают до комнатной температуры в течение одного часа. Водную фазу отделяют, разбавляют 7,5 мл тетрагидрофурана, охлаждают до 0 С и обрабатывают 33 мл 6N водной соляной кислоты в течение 20 мин. Полученную смесь смешивают с 75 мл этилацетата при температуре в интервале от 0 С до комнатной температуры, этилацетат отделяют и про 17 мывают водой. Этилацетатный раствор медленно обрабатывают 150 мл гексанов при комнатной температуре, что приводит к выпадению твердого осадка, и перемешивают в течение ночи. Осадок отфильтровывают, в результате получают 5,01 г 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил) амино]пропионовой кислоты в виде твердого белого вещества (выход 71% из 1-(2-этоксикарбонилэтил)-4-(4-фторфенокси)бензолсульфонил]амино]циклопентанкарбоновой кислоты. ПМР (DMSO-d6)12,32 (с, 1 Н), 10,43 (с,1 Н), 8,80 (с, 1 Н), 7,82 (д, J = 8,6 Hz, 2 Н), 7,287,35 (м, 2 Н), 7,20-7,26 (м, 2 Н), 7,08 (д, J = 8,9 Hz,2 Н), 3,44-3,49 (м, 2 Н), 2,61-2,66 (м, 2 Н), 2,742,29 (м, 2 Н), 1,86-1,90 (м, 2 Н), 1,54-1,55 (м, 4 Н). Т. пл. 162,9-163,5 С (разл.). Пример 2. 34-(4-Фторфенокси)бензолсульфонил]-(4-гидроксикарбамоилтетрагидропиран-4-ил)амино]пропионовая кислота. А) Бензиловый эфир 4-[N-(дифенилметилен)амино]тетрагидропиран-4-карбоновой кислоты. К суспензии гидрида натрия (6,56 г, 0,164 моль) в диметиловом эфире этиленгликоля (150 мл) при 0 С по каплям с помощью капельной воронки добавляют раствор бензилового эфираN-(дифенилметилен)глицина (0,07398 моль) в диметиловом эфире этиленгликоля (50 мл). Затем в этот раствор добавляют раствор простого 2-бромэтилового эфира (23,21 г, 0,090 моль) в диметиловом эфире этиленгликоля (50 мл) порциями по 10 мл в течение примерно 5 мин. Ледяную баню удаляют и реакционную массу перемешивают при комнатной температуре в течение 16 ч. Смесь разбавляют диэтиловым эфиром и промывают водой. Водный слой экстрагируют диэтиловым эфиром. Соединенные органические экстракты промывают насыщенным солевым раствором, сушат над сульфатом магния и упаривают, в результате получают технический продукт. После хроматографии на силикагеле с использованием в качестве элюента сначала 4 л 5% смеси этилацетат/гексан, а затем 4 л 10% смеси этилацет/гексан получают бензиловый эфир 4-[N-(дифенилметилен)амино]тетрагидропиран-4-карбоновой кислоты в виде прозрачного масла желтого цвета.B) Бензиловый эфир 4-аминотетрагидропиран-4-карбоновой кислоты. К раствору бензилового эфира 4-[N(дифенилметилен)амино]тетрагидропиран-4 карбоновой кислоты (16,0 г, 0,047 моль) в диэтиловом эфире (120 мл) добавляют 1N водный раствор соляной кислоты (100 мл). Смесь энергично перемешивают при комнатной температуре в течение 16 ч. Фракции разделяют и водный слой промывают диэтиловым эфиром. рН водного слоя доводят до 10 с помощью разбавленного водного раствора гидроксида аммония и водный слой экстрагируют дихлорметаном. 18 Органический экстракт сушат над сульфатом натрия и упаривают, в результате получают бензиловый эфир 4-аминотетрагидропиран-4 карбоновой кислоты.C) Бензиловый эфир 4-[4-(4-(фторфенокси)бензолсульфонил)амино]тетрагидропиран-4 карбоновой кислоты. К раствору бензилового эфира 4 аминотетрагидропиран-4-карбоновой кислоты(0,0404 моль) в N,N-диметилформамиде (40 мл) добавляют триэтиламин (5,94 мл, 0,043 моль). К полученному раствору порциями добавляют твердый 4-(4-фторфенокси)бензолсулфонилхлорид (12,165 г, 0,0424 моль). Полученную смесь перемешивают при комнатной температуре в течение 16 ч и затем большую часть растворителя отгоняют под вакуумом. Остаток распределяют между насыщенным раствором бикарбоната натрия и дихлорметаном. Водный слой отделяют и экстрагируют дихлорметаном. Соединенные органические фракции промывают насыщенным солевым раствором и сушат над сульфатом натрия. После отгонки растворителя под вакуумом получают неочищенный бензиловый эфир 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты. Флэш-хроматография на силикагеле(элюент: 25% этилацетат/гексан, затем 50% этилацетат/гексан) приводит к получению бензилового эфира 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты.D) Бензиловый эфир 4-[(2-этоксикарбонилвинил)-[4-(4 фторфенокси)бензолсульфонил]амино]тетрагидропиран-4-карбоновой кислоты. Раствор (53,2 ммоль) продукта предыдущей стадии и 10,8 мл (106 ммоль, 2 эквивалента) этилпропиолата в 200 мл сухого тетрагидрофурана при 1 С обрабатывают 53,2 мл (53,2 ммоль, 1 эквивалент) раствора фторида тетрабутиламмония в тетрагидрофуране (1 М) в течение 45 мин. Полученному раствору дают медленно нагреться до комнатной температуры и перемешивают его в течение ночи. Тетрагидрофуран замещают толуолом при пониженном давлении и толуольный раствор промывают водой и насыщенным солевым раствором, добавляют толуол, доводя толуолом объем смеси до 600 мл,смешивают с 90 г силикагеля, перемешивают еще 3 ч, фильтруют и упаривают, в результате получают целевое соединение. Е) 4-[(2-Этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]амино]тетрагидропиран-4-карбоновая кислота. Раствор (4,4 ммоль) продукта стадии D в 25 мл этанола обрабатывают 2,5 г катализатора 10% палладия на углероде, содержащего 50% водной влаги, подвергают вибрации под атмосферой водорода 53 пси в течение 21 ч. Катализатор отфильтровывают, промывают этанолом(425 мл), фильтрат и промывные растворы соединяют и упаривают под вакуумом, в результате получают неочищенный продукт.F) Этиловый эфир 3-(4-хлоркарбонилтетрагидропиран-4-ил)-[4-(4-фторфенокси)бензолсульфонил]аминопропионовой кислоты. Раствор продукта стадии Е (15,1 ммоль) в 73 мл дихлорметана обрабатывают 1,4 мл (17 ммоль, 1,1 эквивалента) оксалилхлорида и 0,02 мл (0,3 ммоль, 0,02 эквивалента) диметилформамида при комнатной температуре, что приводит к образованию и выделению некоторого количества пузырьков, и перемешивают в течение ночи. Образующийся раствор целевого соединения используют в следующей стадии без выделения целевого соединения.(19,7 ммоль, 1,3 эквивалента) в 9,2 мл (114 ммоль, 7,5 эквивалента) сухого пиридина при 0 С обрабатывают 5,8 мл (45 ммоль, 3,0 эквивалента) триметилсилилхлорида, что приводит к образованию твердого белого осадка. Смеси дают нагреться до комнатной температуры в течение ночи. Затем смесь охлаждают до 0 С и обрабатывают раствором продукта стадии F(15,1 ммоль) в 73 мл дихлорметана, что приводит к экзотермическому нагреву приблизительно до 8 С. Смесь перемешивают при 0 С в течение 30 мин и при комнатной температуре в течение приблизительно 1 ч. Затем реакционную массу обрабатывают 50 мл 2N водной соляной кислоты и перемешивают при комнатной температуре в течение часа. Водную фазу экстрагируют дихлорметаном, соединенные органические фазы промывают 2N водной соляной кислотой (250 мл) и водой (50 мл). Этот раствор целевого соединения в дихлорметане используют в следующей стадии.(Н) 3-4-(4-Фторфенокси)бензолсульфонил]-(4-гидроксикарбамоилтетрагидропиран-4 ил)амино]пропионовая кислота. Раствор продукта стадии G (15,1 ммоль) в дихлорметане упаривают с помощью роторного испарителя с добавлением 75 мл толуола. Этот раствор обрабатывают 75 мл воды, охлаждают до 0 С и обрабатывают 6,05 г (151 ммоль, 10 эквивалентов) гидроксида натрия в виде гранул в течение 10 мин при энергичном перемешивании. Полученную смесь перемешивают в течение 15 мин при 0 С и нагревают до комнатной температуры в течение одного часа. Водную фазу отделяют, разбавляют 7,5 мл тетрагидрофурана, охлаждают до 0 С и обрабатывают 33 мл 6N водной соляной кислоты в течение 20 мин. Эту смесь смешивают с 75 мл этилацетата,перемешивают при температуре в интервале от 0 С до комнатной температуры, и этилацетатную фазу отделяют и промывают водой. Этил 002777 20 ацетатный раствор упаривают, в результате получают целевое соединение. Пример 3. 3-4-(4-Фторфенокси)бензолсульфонил]-(3-гидроксикарбамоил-8-оксабицикло[3.2.1]окт-3-ил)амино]пропионовая кислота. А). Бензиловый эфир 3-(бензгидрилиденамино)-8-оксабицикло-[3.2.1]октан-3-карбоновой кислоты. К суспензии гидрида натрия (0,41 г, 17,1 ммоль) в N,N-диметилформамиде (50 мл) при 0 С по каплям добавляют раствор сложного бензилового эфира N-дифенилметиленглицина(7,8 ммоль) в N,N-диметилформамиде (50 мл). После перемешивания в течение 30 мин при комнатной температуре по каплям добавляют раствор цис-2,5-бис(гидроксиметил)тетрагидрофурана дитозилата (4,1 г, 9,3 ммоль) (получают методами, описанными в литературе, например,в публикации JOC, 47, 2429-2435 (1982 в N,Nдиметилформамиде (50 мл). Реакционную смесь постепенно нагревают на масляной бане до 100 С и перемешивают при этой температуре в течение ночи. Растворитель отгоняют под вакуумом, остаток переносят в воду и дважды экстрагируют диэтиловым эфиром. Соединенные органические экстракты промывают насыщенным солевым раствором, сушат над сульфатом магния и упаривают, в результате получают неочищенный продукт.B). Бензиловый эфир 3-амино-8-оксабицикло[3.2.1]октан-3-карбоновой кислоты. Двухфазную смесь бензилового эфира 3(бензгидрилиденамино)-8-оксабицикло[3.2.1] октан-3-карбоновой кислоты (3,9 ммоль) в водном 1N растворе соляной кислоты (100 мл) и диэтилового эфира (100 мл) перемешивают при комнатной температуре в течение ночи. Водный слой упаривают, в результате получают целевое соединение.C). Бензиловый эфир 3-экзо-[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3-карбоновой кислоты. Раствор бензилового эфира 3-амино-8 оксабицикло[3.2.1]октан-3-карбоновой кислоты гидрохлорида (2,9 ммоль), 4-(4-фторфенокси) бензолсульфонилхлорида (923 мг, 3,2 ммоль) и триэтиламина (0,9 мл, 6,5 ммоль) в N,Nдиметилформамиде (45 мл) перемешивают при комнатной температуре в течение ночи. Растворитель отгоняют под вакуумом и остаток переносят в насыщенный водный раствор бикарбоната натрия. После двукратного экстрагирования метиленхлоридом соединенные органические фракции промывают насыщенным солевым раствором, сушат над сульфатом магния и упаривают до коричневого масла. Целевое соединение выделяют хроматографией на диоксиде кремния, используя в качестве элюента 1% раствор метанола в метиленхлориде. нил]амино-8-оксабицикло[3.2.1]октан-3-карбоновой кислоты. Раствор продукта предыдущей стадии(53,2 ммоль) и 10,8 мл (106 ммоль, 2 эквивалента) этилпропиолата в 200 мл сухого тетрагидрофурана при 1 С обрабатывают 53,2 мл (53,2 ммоль, 1 эквивалент) раствора фторида тетрабутиламмония в тетрагидрофуране (1 М) в течение 45 мин. Полученному раствору дают медленно нагреться до комнатной температуры и перемешивают его в течение ночи. Тетрагидрофуран замещают толуолом при пониженном давлении,толуольный раствор промывают водой и насыщенным солевым раствором, добавляют толуол,доводя объем до 600 мл, смешивают с 90 г силикагеля, перемешивают в течение трех часов,фильтруют и упаривают, в результате получают целевое соединение. Е). 3-(2-Этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]амино-8-окcабицикло[3.2.1]октан-3-карбоновая кислота. Раствор продукта стадии D (4,4 ммоль) в 25 мл этанола обрабатывают 2,5 г катализатора 10% палладия на углероде, содержащего 50% водной влаги, и подвергают вибрации под атмосферой водорода 53 пси в течение 48 ч. Катализатор отфильтровывают и промывают этанолом(425 мл). Фильтрат и промывные растворы соединяют и упаривают под вакуумом, в результате получают неочищенный целевой продукт.F). Этиловый эфир 3-(3-хлоркарбонил-8 оксабицикло[3.2.1]окт-3-ил)-[4-(4-фторфенокси) бензолсульфонил]аминопропионовой кислоты. Раствор продукта стадии Е (15,1 ммоль) D 73 мл дихлорметана обрабатывают 1,4 мл (17 ммоль, 1,1 эквивалента) оксалилхлорида и 0,02 мл (0,3 ммоль, 0,02 эквивалента) диметилформамида при комнатной температуре, что вызывает образование и выделение некоторого количества пузырьков, и перемешивают в течение ночи. Полученный раствор целевого соединения используют в следующей стадии без выделения целевого продукта.(19,7 ммоль, 1,3 эквивалента) в 9,2 мл (114 ммоль, 7,5 эквивалента) сухого пиридина при 0 С обрабатывают 5,8 мл (45 ммоль, 3,0 эквивалента) триметилсилилхлорида, что приводит к образованию твердого белого осадка. Смеси дают нагреться до комнатной температуры в течение ночи. Затем смесь охлаждают до 0 С и обрабатывают раствором продукта стадии F(15,1 ммоль) в 73 мл дихлорметана, что вызывает экзотермический нагрев приблизительно до 8 С. Смесь перемешивают при 0 С в течение 30 мин и при комнатной температуре в течение 22 приблизительно 1 ч. Затем реакционную массу обрабатывают 50 мл 2N водной соляной кислоты и перемешивают при комнатной температуре в течение часа. Водную фазу экстрагируют дихлорметаном и соединенные органические фазы промывают 2N водной соляной кислотой (250 мл) и водой (50 мл). Этот раствор целевого соединения в дихлорметане используют в следующей стадии. Н). 3-4-(4-Фторфенокси)бензолсульфонил]-(3-гидроксикарбамоил-8-оксабицикло[3.2.1]окт-3-ил)амино]пропионовая кислота. Раствор продукта со стадии G (15,1 ммоль) в дихлорметане упаривают на роторном испарителе с добавлением 75 мл толуола. Этот раствор обрабатывают 75 мл воды, охлаждают до 0 С и обрабатывают 6,05 г (151 ммоль, 10 эквивалентов) гидроксида натрия в виде гранул в течение 10 мин при энергичном перемешивании. Смесь перемешивают в течение 15 мин при 0 С и нагревают до комнатной температуры в течение часа. Водную фазу отделяют, разбавляют 7,5 мл тетрагидрофурана, охлаждают до 0 С и обрабатывают 33 мл 6N водной соляной кислоты в течение 20 мин. Смесь смешивают с 75 мл этилацетата при 0 С и перемешивают при изменении температуры от 0 С до комнатной температуры, этилацетатную фазу отделяют и промывают водой. Этилацетатный раствор упаривают,в результате получают целевое соединение. Пример 4. Гидроксиамид 3-экзо-[4-(4 фторфенокси)бензолсульфонилметил]-8-оксабицикло[3.2.1]октан-3-карбоновой кислоты. А). Диэтиловый эфир 8-оксабицикло[3.2.1] октан-3,3-дикарбоновой кислоты. Гидрид натрия (2,28 г, 95 ммоль) добавляют при перемешивании порциями в раствор диэтилмалоната (15 мл, 99 ммоль) в N,Nдиметилформамиде (400 мл). Смесь перемешивают в течение 45 мин, в процессе чего выделение водорода завершается. После этого по каплям добавляют раствор цис-2,5-бис(гидроксиметил)тетрагидрофурана дитозилата (19 г, 43 ммоль) в N,N-диметилформамиде (400 мл). Смесь нагревают на масляной бане до температуры 140 С и выдерживают при этой температуре в течение ночи. После охлаждения до комнатной температуры смесь гасят насыщенным водным раствором хлорида аммония и упаривают под вакуумом. Остаток в виде масла переносят в воду и экстрагируют диэтиловым эфиром. Органический экстракт промывают водой и насыщенным солевым раствором, сушат над сульфатом магния и упаривают до масла.B). Этиловый эфир 3-экзо-гидроксиметил 8-оксабицикло[3.2.1]октан-3-карбоновой кислоты. 1,2 М раствор гидрида диизобутилалюминия в толуоле (75 мл) по каплям добавляют к раствору диэтилового эфира 8-оксабицикло 23 нагреться до 0 С при перемешивании в течение 3 ч. Затем смесь охлаждают до -15 С и медленно, поддерживая эту температуру, добавляют этанол (8 мл). После перемешивания при 15 С в течение 1 ч добавляют боргидрид натрия (1,1 г,30 ммоль). Смесь перемешивают при комнатной температуре в течение ночи и гасят, добавляя по каплям насыщенный водный раствор сульфата натрия. Добавляют этилацетат и после перемешивания в течение 20 мин нерастворимый материал выделяют фильтрованием через целит (Celite). Фильтрат промывают насыщенным солевым раствором, сушат над сульфатом магния и упаривают, в результате получают целевое соединение в виде прозрачного масла.[3.2.1]октан-3-карбоновая кислота. Гидроксид лития гидрат (59,5 ммоль) добавляют в раствор этилового эфира 3-экзогидроксиметил-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты (23,8 ммоль) в смеси метанола (25 мл), тетрагидрофурана (25 мл) и воды(2,5 мл). Смесь кипятят с обратным холодильником в течение ночи, охлаждают и гасят, добавляя ионно-обменную смолу Amberlite IR120. После перемешивания в течение 20 мин смолу удаляют фильтрованием, промывая тетрагидрофураном. Отгонка растворителей и растирание остатка с диэтиловым эфиром приводит к получению целевого соединения.D). 3,8-Диоксаспиро[бицикло[3.2.1]октан 3,1-циклобутан]-2-он. Бензолсульфонилхлорид (13,5 ммоль) по каплям добавляют в раствор 3-окзогидроксиметил-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты (12,3 ммоль), триэтиламина (24,7 ммоль) и 4-диметиламинопиридина (2,5 ммоль) в метиленхлориде (50 мл) при 0 С. Смесь перемешивают при 0 С в течение 1 ч,разбавляют метиленхлоридом и промывают водным 1N раствором соляной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. После сушки над сульфатом магния растворитель упаривают, в результате получают целевое соединение. Е). 3-экзо-[4-(4-Фторфенокси)фенилсульфонилметил]-8-оксабицикло[3.2.1]октан-3 карбоновая кислота. Раствор 4-(4-фторфенокси)тиофенола (10 ммоль) в тетрагидрофуране (10 мл) по каплям добавляют в суспензию гидрида натрия (11,3 ммоль) в тетрагидрофуране (20 мл) при 10 С. Смеси дают нагреться до комнатной температуры при перемешивании в течение 30 мин. После охлаждения снова до -10 С по каплям добавляют раствор 3,8-диоксаспиро[бицикло[3.2.1] октан-3,1-циклобутан]-2-она (10 ммоль) в тетрагидрофуране (20 мл). Охлаждающую баню удаляют и продолжают перемешивание при комнатной температуре в течение 2 ч, после 24 чего смесь гасят водным 1N раствором соляной кислоты и дважды экстрагируют метиленхлоридом. Соединенные органические экстракты промывают водой и насыщенным солевым раствором, сушат над сульфатом магния и упаривают до получения твердого остатка.F). Хлорангидрид 3-[4-(4-фторфенокси)фенилсульфонилметил]-8-оксабицикло[3.2.1] октан-3-карбоновой кислоты. Раствор продукта со стадии Е (15,1 ммоль) в 73 мл дихлорметана обрабатывают 1,4 мл (17 ммоль, 1,1 эквивалента) оксалилхлорида и 0,02 мл (0,3 ммоль, 0,02 эквивалента) диметилформамида при комнатной температуре, что приводит к образованию и выделению некоторого количества пузырьков, и перемешивают в течение ночи. Полученный раствор целевого соединения используют в следующей стадии без выделения целевого соединения.(19,7 ммоль, 1,3 эквивалента) в 9,2 мл (114 ммоль, 7,5 эквивалента) сухого пиридина при 0 С обрабатывают 5,8 мл (45 ммоль, 3,0 эквивалента) триметилсилилхлорида, что вызывает выпадение твердого белого осадка. Смеси дают нагреться до комнатной температуры в течение ночи. Полученную смесь охлаждают до 0 С и обрабатывают раствором продукта стадии F(15,1 ммоль) в 73 мл дихлорметана, что вызывает экзотермический нагрев до приблизительно 8 С. Эту смесь перемешивают при 0 С в течение 30 мин и при комнатной температуре в течение приблизительно 1 ч. Затем реакционную смесь обрабатывают 50 мл 2N водной соляной кислоты и перемешивают при комнатной температуре один час. Водную фазу экстрагируют дихлорметаном и соединенные органические фазы промывают 2N водной соляной кислотой(250 мл) и водой (50 мл). Органическую фазу упаривают, в результате получают целевое соединение. Н). Гидроксамид 3-[4-(4-фторфенокси)бензолсульфонилметил]-8-оксабицикло[3.2.1]октан-3-карбоновой кислоты. В раствор продукта предыдущей стадии(3,63 ммоль) в смеси воды (30 мл), метанола (40 мл) и тетрагидрофурана (12 мл) добавляют Охоn (8,63 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи, разбавляют водой и дважды экстрагируют этилацетатом. Соединнные органические экстракты промывают насыщенным солевым раствором, сушат над сульфатом магния и упаривают, в результате получают целевое соединение. Пример 5. Гидроксиамид 4-[4-(4 фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты.A). Бензиловый эфир 4-[N-(дифенилметилен)амино]тетрагидропиран-4-карбоновой кислоты. К суспензии гидрида натрия (6,56 г, 0,164 моль) в диметиловом эфире этиленгликоля (150 мл) при 0 С по каплям из капельной воронки добавляют раствор бензилового эфира N(дифенилметилен)глицина (0,07398 моль) в диметиловом эфире этиленгликоля (50 мл). После этого в этот раствор добавляют порциями по 10 мл в течение приблизительно 5 мин раствор простого 2-бромэтилового эфира (23,21 г, 0,090 моль) в диметиловом эфире этиленгликоля (50 мл). Ледяную баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Смесь разбавляют диэтиловым эфиром и промывают водой. Водный слой экстрагируют диэтиловым эфиром. Соединенные органические экстракты промывают насыщенным солевым раствором, сушат над сульфатом магния и упаривают, в результате получают неочищенный продукт. После очистки методом хроматографии на силикагеле, элюируя, сначала 4 л 5% смеси этилацетат/гексан, а затем 4 л 10% смеси этилацетат/гексан, получают бензиловый эфир 4-[N-(дифенилметилен)амино]тетрагидропиран-4-карбоновой кислоты в виде прозрачного желтого масла.B). Бензиловый эфир 4-аминотетрагидропиран-4-карбоновой кислоты. К раствору бензилового эфира 4-[N(дифенилметилен)амино]тетрагидропиран-4 карбоновой кислоты (16,0 г, 0,047 моль) в диэтиловом эфире (120 мл) добавляют 1N водный раствор соляной кислоты (100 мл). Смесь энергично перемешивают при комнатной температуре в течение 16 ч. Фракции разделяют, водную фракцию промывают диэтиловым эфиром. Значение рН водного слоя доводят до 10 с помощью водного раствора гидроксида аммония и экстрагируют дихлорметаном. Органический экстракт сушат над сульфатом натрия и упаривают, в результате получают бензиновый эфир 4-аминотетрагидропиран-4-карбоновой кислоты.C). Бензиловый эфир 4-[4-(4-фторфенокси) бензолсульфониламино]тетрагидропиран-4 карбоновой кислоты. К раствору бензилового эфира 4 аминотетрагидропиран-4-карбоновой кислоты(0,0404 моль) в N,N-диметилформамиде (40 мл) добавляют триэтиламин (5,94 мл, 0,043 моль). В полученную смесь порциями добавляют твердый 4-(4-фторфенокси)бензолсульфонилхлорид(12,165 г, 0,0424 моль). Полученную смесь перемешивают при комнатной температуре в течение 16 ч и затем большую часть растворителя отгоняют под вакуумом. Остаток распределяют между насыщенным раствором бикарбоната натрия и дихлорметаном. Водный слой отделяют и экстрагируют дихлорметаном. Соединенные органические фракции промывают насы 002777 26 щенным солевым раствором и сушат над сульфатом натрия. После отгонки растворителя под вакуумом получают технический бензиловый эфир 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты. После очистки методом флэш-хроматографии(элюент 25% этилацетат/гексан, 50% этилацетат/гексан) получают бензиловый эфир 4-[4-(4 фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты.D). Бензиловый эфир 4-(2-этоксикарбонилвинил)-[4-(4-фторфенокси)бензолсульфонил]аминотетрагидропиран-4-карбоновой кислоты. Раствор продукта предыдущей стадии(53,2 ммоль) и 10,8 мл (106 ммоль, 2 эквивалента) этилпропиолата в 200 мл тетрагидрофурана при 1 С обрабатывают 53,2 мл (53,2 ммоль, 1 эквивалент) раствора фторида тетрабутиламмония в тетрагидрофуране (1 М) в течение 45 мин. Полученному раствору дают медленно нагреться до комнатной температуры и перемешивают в течение ночи. Тетрагидрофуран заменяют толуолом при пониженном давлении, толуольный раствор промывают водой и насыщенным солевым раствором, добавляют толуол, доводя объем до 600 мл, смешивают с 90 г силикагеля, перемешивание продолжают в течение 3 ч, фильтруют и фильтрат упаривают с получением целевого соединения. Е). Хлорангидрид 4-[4-(4-фторфенокси) бензолсульфониламино]тетрагидропиран-4 карбоновой кислоты. Раствор 4,40 кг (11,13 моль) 4-[4-(4 фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты в 40 л дихлорметана обрабатывают 19 мл диметилформамида и 1,075 л (12,32 моль, 1,1 эквивалента) оксалилхлорида при комнатной температуре и перемешивают в течение 16 ч. Полученный раствор целевого соединения используют в стадииF без выделения целевого продукта.(84,08 моль, 7,5 эквивалента) пиридина при 010 С обрабатывают 2,8 л (22,06 моль, 2,0 эквивалента) триметилсилилхлорида, что приводит к образованию твердого белого осадка. Смесь перемешивают в течение 4 ч при 0-2 С, затем обрабатывают раствором продукта стадии Е в дихлорметане, что приводит к выделению теплоты. Реакционную смесь перемешивают в течение 1 ч при 0-2 С, затем в течение 1,5 ч при 20 С. Затем реакционную смесь обрабатывают 132 л 2N водной соляной кислоты и перемешивают при комнатной температуре в течение 1 ч. Водную фазу экстрагируют этилацетатом (3100 л) и соединенные органические фазы про 27 мывают водой (2130 л) и упаривают до объема 17 л. Полученную суспензию перемешивают при 0 С в течение 3 ч и фильтруют, в результате получают 4,068 кг (89%) целевого соединения в виде твердого белого вещества. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулыZ представляет собой СН 2 или NR1;(С 2-С 9)гетероарил,(С 2-С 9)гетероарил(C1-C6) алкокси(C1-C6)алкил, (С 2-С 9)гетероарил(C1-C6) алкокси(С 6-С 10)арил или (C2-C9)гетероарил(C1C6)алкокси(С 2-С 9)гетероарил; где каждый остаток (С 6-С 10)арил или (С 2 С 9)гетероарил указанных (С 6-С 10)арила, (С 2 С 9)гетероарила, (С 6-С 10)арилокси(C1-С 6)алкила,(С 6-С 10)арилокси(С 6-С 10)арила,(С 6-С 10)арилокси(С 2-С 9)гетероарила, (С 6-С 10)арил(C1-С 6)алкила, (С 6-С 10)арил(С 6-С 10)арила, (С 6-С 10)арил(С 2-С 9)гетероарила, (С 6-С 10)арил(С 6-С 10)арил(С 1 С 6)алкила,(С 6-С 10)арил(С 6-С 10)арил(С 6-С 10) арила,(С 6-С 10)арил(С 6-С 10)арил(С 2-С 9)гетероарила, (С 2-С 9)гетероарил(C1-С 6)алкила, (С 2-С 9) гетероарил(С 6-С 10)арила, (С 2-С 9)гетероарил(С 2 С 9)гетероарила, (С 6-C10)арил(С 6-С 10)алкокси(C1 С 6)алкила, (С 6-С 10)арил(C1-C6)алкокси(С 6-С 10) арила, (С 6-С 10)арил(C1-C6)алкокси(C2-C9)гетероарила, (C2-C9)гетероарилокси(C1-C6)алкила, (С 2 С 9)гетероарилокси(С 6-C10)арила, (С 2-С 9)гетероарилокси(С 2-С 9)гетероарила,(С 2-С 9)гетероарил(С 1-С 6)алкокси(C1-С 6)алкила, (С 2-С 9)гетероарил(C1-C6)алкокси(С 6-С 10)арила или (C2-C9) гетероарил(С 1-С 6)алкокси(С 2-С 9)гетероарила является необязательно замещенным и содержит в цикле один или большее количество заместителей, которые могут находиться при любом из атомов углерода цикла, способном образовывать дополнительную связь с заместителем,который независимо выбран из группы, включающей фтор, хлор, бром, (C1-C6)алкил, (С 1-С 6) где R2 и R3 независимо представляют собой водород, (C1-C6)алкил или R2 и R3 вместе образуют циклоалкил, содержащий от трех до семи атомов, пиран-4-ила или бицикл формулы где звездочкой обозначен атом углерода, общий для R2 и R3; иn представляет собой целое число от единицы до шести; способ включает:a) взаимодействие гидроксиламина или его соли с C1-C6)алкил)3 силилгалогенидом в присутствии первого основания с образованием inR8 представляет собой водород или C1 С 6)алкил)3-Si-, и с) гидролиз указанного соединения формулы VI кислотой. 2. Способ по п.1, где указанное первое основание представляет собой пиридин, 2,6 лутидин или диизопропилэтиламин. 3. Способ по п.1, в котором указанное первое основание представляет пиридин. 4. Способ по п.1, в котором указанный С 1-С 6)алкил)3 силилгалогенид представляет собой триметилсилилхлорид. 5. Способ по п.1, в котором указанное второе основание представляет собой пиридин, 2,6 лутидин или диизопропилэтиламин. 6. Способ по п.1, в котором указанное второе основание представляет собой пиридин.
МПК / Метки
МПК: C07C 317/44, A61P 25/00, A61K 31/16
Метки: способ, гидроксамовых, получения, кислот
Код ссылки
<a href="https://eas.patents.su/15-2777-sposob-polucheniya-gidroksamovyh-kislot.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения гидроксамовых кислот</a>
Предыдущий патент: Фармацевтические композиции, содержащие циклодекстрины и таксоиды
Следующий патент: Селективные бетта 3-адренергические агонисты
Случайный патент: Способ лечения офтальмологических неоваскулярных расстройств












