Замещенные гомопиперидильные аналоги бензимидазола как фундальные релаксанты
Номер патента: 5851
Опубликовано: 30.06.2005
Авторы: Янссенс Франс Эдуард, Гиллемон Жером Эмиль Жорж, Соммен Франсуа Мария
Формула / Реферат
1. Соединение формулы (I)
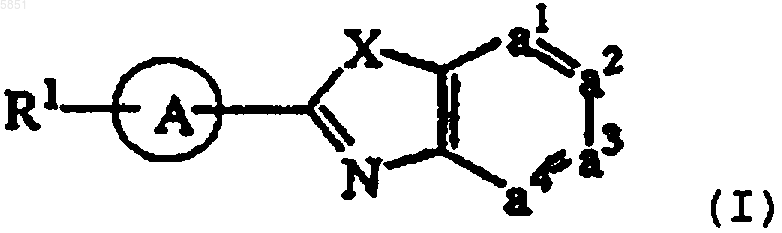
его N-оксиды, аддитивные соли и стереохимически изомерные формы
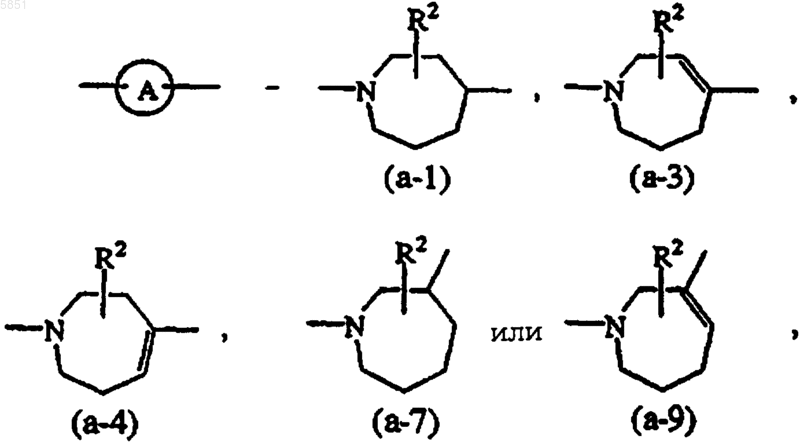
где R2 обозначает водород, гидрокси, C1-4алкил или C1-4 алкилокси, и когда R2 обозначает гидрокси или C1-4алкилокси, то указанный R2 присоединяется в ином положении, нежели a-положение относительно азота кольца, или когда R2 обозначает гидрокси, то указанный R2 присоединяется в ином положении, нежели положение винила в радикале (a-3), (a-4) или (a-9);
-a1=a2-a3=a4- обозначает двухвалентный радикал формулы
| -CH=CH-CH=CH- | (b-1), |
| -N=CH-CH=CH- | (b-2), |
| -CH=N-CH=CH- | (b-3), |
| -CH=CH-N=CH- | (b-4), |
| -CH=CH-CH=N- | (b-5), |
| -N=CH-CH=N- | (b-7) или |
| -N=CH-N=CH- | (b-8), |
где каждый атом водорода в радикалах (b-1)-(b-5) и (b-7) и (b-8) может быть необязательно замещен галогеном, C1-6алкилом, нитро, амино, гидрокси, C1-6алкилокси, C1-6алкилоксикарбонилом;
или два атома водорода при соседних атомах углерода в радикалах (b-1), (b-2) или (b-5) могут быть необязательно замещены -(CH2)4-;
R1 обозначает водород, C1-6алкил, арил1, C1-6алкил, замещенный арилом1, C1-4алкилоксикарбонил, арилlкарбонил, арил1C1-6алкилкарбонил, арил1карбонилС1-6алкил, арил1оксикарбонил, арил1C1-4алкилоксикарбонил, C1-4алкилкарбонил, трифторметил, трифторметилкарбонил, C1-6алкилсульфонил, арил1сульфонил или метансульфонил;
X обозначает O, S или NR3, где R3 обозначает водород; C1-6 алкил; метансульфонил; диметилсульфамоил; арил2карбонилC1-4 алкил; C1-4алкилоксикарбонил; или C1-4алкил, замещенный арилом2 и необязательно гидрокси;
арил1 обозначает фенил; фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбирают из галогена, гидрокси, C1-6алкила, C1-6алкилокси, нитро, амино, циано и трифторметила; пиридинил; нафтил; хинолинил; 1,3-бензодиоксолил; фуранил или бензофуранил; и
арил2 обозначает фенил или фенил, замещенный 1 или 2 галогенами.
2. Соединение по п.1, в котором двухвалентный радикал  означает радикал формулы (a-1), (a-3) или (a-4), где R2 обозначает водород или гидрокси.
означает радикал формулы (a-1), (a-3) или (a-4), где R2 обозначает водород или гидрокси.
3. Соединение по п.1, в котором двухвалентный радикал -a1=a2-a3=a4- имеет формулу (b-1), где каждый атом водорода в указанных радикалах (b-1) может быть необязательно замещен галогеном, C1-6алкилом, гидрокси или C1-6алкилокси.
4. Соединение по п.1, в котором двухвалентный радикал -a1=a2-a3=a4- имеет формулу (b-2), где каждый атом водорода в указанных радикалах (b-2) может быть необязательно замещен галогеном, C1-6алкилом, гидрокси или C1-6алкилокси.
5. Соединение по любому из пп.1-4, в котором R1 обозначает водород, C1-6алкил, фенилметил или фуранилметил.
6. Соединение по любому из пп.1-5, в котором X обозначает NR3, где R3 обозначает водород, диметилсульфамоил или C1-4алкил, замещенный арилом2.
7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-6.
8. Способ получения фармацевтической композиции по п.7, в котором терапевтически активное количество соединения по любому из пп.1-6 однородно смешивают с фармацевтически приемлемым носителем.
9. Способ получения соединения формулы (I) взаимодействием исходных соединений формулы (II) и формулы (III) в присутствии полифосфорной кислоты (ПФК) или оксихлорида фосфора (POCl3) при температуре, варьирующей от комнатной до температуры флегмы реакционной смеси, причем необязательно указанная реакция может быть проведена в реакционно-инертном растворителе
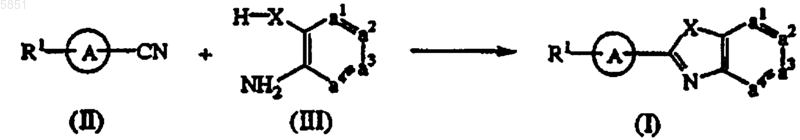
с последующим превращением, в случае необходимости, полученных соединений формулы (I) друг в друга с помощью известных в технике реакций; и, при необходимости, с последующим превращением соединения формулы (I) в кислотно-аддитивную соль или, наоборот, с последующим превращением кислотно-аддитивной соли соединения формулы (I) в форму свободного основания с помощью щелочи; и, при необходимости, с получением его стереохимически изомерных форм.
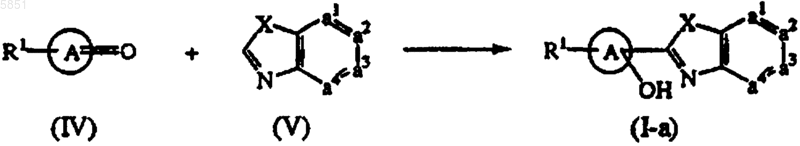
10. Способ получения соединения формулы (I-a), в котором промежуточное соединение формулы (IV), определяемое как производное промежуточного соединения формулы  , в котором два геминальных атома водорода замещены карбонильной группой, подвергают реакции с промежуточным соединением формулы (V), что приводит к образованию соединений формулы (I-a), определяемых как соединения формулы (I), в которых R2 обозначает гидрокси
, в котором два геминальных атома водорода замещены карбонильной группой, подвергают реакции с промежуточным соединением формулы (V), что приводит к образованию соединений формулы (I-a), определяемых как соединения формулы (I), в которых R2 обозначает гидрокси
Текст
005851 Настоящее изобретение относится к новым соединениям формулы (I), обладающим фундальной релаксантной активностью. Настоящее изобретение относится также к способам получения таких соединений, фармацевтическим композициям, содержащим указанные соединения, а также к применению указанных соединений в качестве лекарственного средства. В ЕР-А-0079545 раскрываются замещенные пиперазинилом производные бензимидазола, обладающие антигистаминной активностью. Неожиданно было обнаружено, что новые соединения формулы (I) согласно настоящему изобретению обладают фундальными релаксантными свойствами и, следовательно, полезны для облегчения симптомов, возникающих в результате нарушения процессов релаксации фундальных структур при приеме пищи. Настоящее изобретение относится к соединениям формулы (I) где R2 обозначает водород, гидрокси, С 1-4 алкил или C1-4 алкилокси, и когда R2 обозначает гидрокси или С 1-4 алкилокси, то указанный R2 присоединяется в ином положении, нежели -положение относительно азота кольца, или когда R2 обозначает гидрокси, то указанный R2 присоединяется в ином положении,нежели положение винила в радикале (а-3), (а-4) или (а-9);-a1=a2-a3=a4- обозначает двухвалентный радикал формулы-СН=СН-СН=СН(b-1),-N=CH-CH=CH(b-2),-CH=N-CH=CH(b-3),-CH=CH-N=CH(b-4),-CH=CH-CH=N(b-5),-N=CH-CH=N(b-7),-N=СН-N=СН(b-8),где каждый атом водорода в радикалах (b-1)-(b-5) и (b-7)-(b-8) может быть необязательно замещен галогеном, C1-6 алкилом, нитро, амино, гидрокси, C1-6 алкилокси, C1-6 алкилоксикарбонилом; или где два атома водорода при соседних атомах углерода в радикалах (b-1)-(b-2) или (b-5) могут быть необязательно замещены -(СН 2)4-;apил кapбoнил, apил 1C1-6aлкилкарбонил, apил 1 кapбoнилC1-6aлкил, арил 1oксикарбонил, apил 1C1-4aлкилоксикарбонил, С 1-4 алкилкарбонил, трифторметил, трифторметилкарбонил, C1-6 алкилсульфонил, apил 1cyльфoнил, метансульфонил; Х обозначает О, S или NR3, где R3 обозначает водород; C1-6 алкил; метансульфонил; диметилсульфамоил; apил 2 кapбoнилC1-4 алкил; С 1-4 алкилоксикарбонил; С 1-4 алкил, замещенный арилом 2 и необязательно гидрокси; арил 1 обозначает фенил; фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбирают из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси, нитро, амино, циано и трифторметила; пиридинил; нафтил; хинолинил; 1,3-бензодиоксолил; фуранил; или бензофуранил; и арил 2 обозначает фенил, или фенил, замещенный 1 или 2 галогенами. Во всех соединениях формулы (I) заместитель R1 присоединяется к атому азота в кольце двухвалентного-1 005851 Термин пролекарство означает фармакологически приемлемые производные, например сложные эфиры и амиды, такие, которые при биотрансформации дают продукт, представляющий собой активное лекарство, соответствующее определению соединений формулы (I). В настоящее описание включена ссылка на соответствующее руководство Гудмана и Гилмана (Goodman and Gilman, The PharmacologicalBasis of Therapeutics, 8th ed., McGraw-Hill, Int. Ed. 1992, Biotransformation of Drugs, p. 13-15), описывающее, в основном, пролекарства. Как использовано в приведенных выше определениях, галоген представляет собой родовое обозначение, охватывающее фтор, хлор, бром и йод; С 1-4 алкил обозначает прямые и разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 4 атомов углерода, такие как, например, метил, этил,пропил, бутил, 1-метилэтил, 2-метилпропил и подобные; C1-6 алкил включает C1-4 алкил и его высшие гомологи, содержащие 5 или 6 атомов углерода, такие как, например, 2-метилбутил, пентил, гексил и подобные; и полигалогенС 1-6 алкил обозначает полигалогензамещенный C1-6 алкил, содержащий от одного до шести атомов галогена, такой как, например, дифтор- или трифторметил. Термин гидроксиС 1-6 алкил относится к C1-6 алкилу, замещенному гидроксильной группой. Термин аминоС 1-6 алкил относится к C1-6 алкилу, замещенному аминогруппой. Термин сульфонил относится к -SO2-группе, и термин диметилсульфамоил относится к (СН 3)2N-SO2-группе. Для терапевтических целей применимы соли соединений формулы (I) и те из них, которые содержат фармацевтически приемлемый противоион. Однако могут найти применение также соли кислот и оснований, которые не являются фармацевтически приемлемыми, например, при изготовлении или очистке фармацевтически приемлемого соединения. Все соли, независимо от того, являются они фармацевтически приемлемыми или нет, включены в рамки настоящего изобретения. Термин фармацевтически приемлемые кислотно-аддитивные соли в контексте настоящего описания охватывает терапевтически активные нетоксичные кислотно-аддитивные солевые формы, которые могут образовывать соединения формулы (I). Фармацевтически приемлемые кислотно-аддитивные соли могут быть получены обработкой основной формы такой соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как гидрогалогеновые кислоты, например хлористо-водородная или бромисто-водородная кислота, серная кислота, азотная, фосфорная и др. кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая (то есть этандиовая), малоновая, янтарная (то есть бутандиовая), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и подобные кислоты. И, наоборот, указанные солевые формы могут быть превращены обработкой соответствующим основанием в форму свободного основания. Термин аддитивная соль в приведенном выше контексте включает также сольваты, которые могут образовывать соединения формулы (I) и их соли. Указанные сольваты представляют собой, например, гидраты, алкоголяты и подобные соединения. Четвертичные амины соединений формулы (I), как использовано в настоящем описании, определяются как соединения, которые соединения формулы (I) могут образовывать в ходе реакции между основным азотом соединения формулы (I) и соответствующим кватернизирующим агентом, таким как, например, необязательно замещенный C1-6 алкилгалогенид, фенилметилгалогенид, например метилиодид или бензилиодид. Могут также использоваться другие реагенты с легко уходящими группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин содержит положительно заряженный азот. Фармацевтически приемлемые противоионы включают хлор,бром, йод, трифторацетат и ацетат. Выбираемый противоион может быть получен с помощью колонок с ионообменной смолой.N-оксидные формы соединений формулы (I), которые могут быть получены с помощью известных в технике способов, включают те соединения формулы (I), в которых атом азота окислен до N-оксида. Использованный выше термин стереохимически изомерные формы относится ко всем возможным изомерным формам, которые могут иметь соединения формулы (I). Если особо не оговорено или не указано иное, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию, заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь либо цис-,либо транс-конфигурацию. Если особо не оговорено и не указано иное, химическое обозначение соединений означает смесь всех возможных стереоизомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. То же самое относится к промежуточным соединениям, как раскрывается в описании, которые используют для получения конечных продуктов формулы (I). Термины цис- и транс, используемые в настоящем описании, соответствуют номенклатуреChemical Abstracts и относятся к положению заместителей в кольцевом фрагменте, более конкретно, на гомопиперидинильном кольце в соединениях формулы (I).-2 005851 Абсолютная стереохимическая конфигурация некоторых соединений формулы (I) и промежуточных соединений, используемых при их получении, экспериментально не была определена. В таких случаях стереохимически изомерная форма, которая была выделена первая, обозначена как А, и вторая как В, без дальнейшей ссылки на фактическую стереохимическую конфигурацию. Однако указанные А и В изомерные формы могут быть однозначно охарактеризованы, например, их оптическим вращением, в том случае, когда А и В имеют энантиомерную взаимосвязь. Специалист в данной области может без труда определить абсолютную конфигурацию таких соединений с помощью известных в технике методов, например по дифракции рентгеновских лучей. Первая группа соединений представляет те соединения формулы (I), в которыхR3 обозначает водород, C1-6 алкил, метансульфонил, бензолсульфонил, трифторметансульфонил,диметилсульфамоил, С 1-4 алкил, замещенный арилом 2 и необязательно гидрокси, С 1-4 алкилкарбонилС 1-4 алкил, замещенный арилом 2; и арил 1 обозначает фенил; фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбирают из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси, нитро, амино, циано или трифторметила; пиридинил; пиридинил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбирают из галогена, гидрокси, C1-6 алкила, амино, диС 1-4 алкиламино; нафтил; хинолинил; или 1,3 бензодиоксолил. Предпочтительные соединения представляют собой те соединения формулы (I), в которых Х обозначает NR3, где R3 обозначает водород, диметилсульфамоил или С 1-4 алкил, замещенный арилом 2. Другие предпочтительные соединения представляют собой те соединения формулы (I), в которых двухвалентный радикал обозначает радикал формулы (а-1), (а-3) или (а-4), где R2 обозначает водород или гидрокси. Особенно предпочтительные соединения представляют собой те соединения формулы (I), в которых двухвалентный радикал -a1=a2-a3=a4- имеет формулу (b-1), где каждый атом водорода в указанных радикалах (b-1) может быть необязательно замещен галогеном, C1-6 алкилом, гидрокси или C1-6 алкилокси. Другие конкретные соединения представляют собой те соединения формулы (I), в которых двухвалентный радикал -a1=a2-a3=a4- имеет формулу (b-2), где каждый атом водорода в указанных радикалах (b2) может быть необязательно замещен галогеном, C1-6 алкилом, гидрокси или C1-6 алкилокси. Еще другие конкретные соединения представляют собой те соединения формулы (I), в которых двухвалентный радикал -a1=a2-a3=a4- имеет формулу (b-4), где каждый атом водорода в указанных радикалах (b-4) может быть необязательно замещен галогеном, C1-6 алкилом, гидрокси или C1-6 алкилокси. Еще другие конкретные соединения представляют собой те соединения формулы (I), в которых двухвалентный радикал -a1=a2-a3=a4- имеет формулу (b-5), где каждый атом водорода в указанных радикалах (b-5) может быть необязательно замещен галогеном, С 1-6 алкилом, гидрокси или C1-6 алкилокси. Предпочтительные соединения формулы (I) представляют собой соединения формулы (I), в которых радикал R1 обозначает водород, C1-6 алкил, фенилметил или фуранилметил. Соединения согласно настоящему изобретению могут быть, в основном, получены реакцией промежуточного соединения формулы (II) или его функционального производного, такого как карбоновая кислота, с промежуточным соединением формулы (III) в присутствии полифосфорной кислоты (ПФК) или оксихлорида фосфора (РОСl3) при температуре, варьирующей от комнатной до температуры флегмы реакционной смеси, причем необязательно указанная реакция может быть проведена в реакционноинертном растворителе. Соединения формулы (I-а), определяемые как соединения формулы (I), в которых R2 обозначает гидрокси, могут быть получены посредством реакции промежуточного соединения формулы (IV) с промежуточным соединением формулы (V). Указанное промежуточное соединение формулы (IV) определяется как производное промежуточного соединения формулы рода замещены карбонильной группой., где два геминальных атома водо Соединения формулы (I) могут быть также превращены друг в друга с помощью известных в технике реакций или трансформаций функциональной группы.-3 005851 Так, например, соединения формулы (I), где R1 обозначает фенилметил, могут быть превращены в соединения формулы (I), в которых R1 обозначает водород, с помощью известных в технике процедур дебензилирования. Указанное дебензилирование может быть осуществлено с помощью известных в технике процедур, таких как каталитическое гидрирование с использованием соответствующих катализаторов, например платины на угле, палладия на угле, в соответствующих растворителях, таких как метанол,этанол, 2-пропанол, диэтиловый эфир, тетрагидрофуран и подобные. Соединения формулы (I), где R1 отличается от водорода, указанный R1 обозначается как R1' и указанные соединения формулой (I-с), могут быть получены посредством N-алкилирования соединения формулы (I), в котором R1 обозначает водород, указанное соединение представляется формулой (I-b),алкилирующим реагентом формулы (VI). В формуле (VI) и далее W обозначает соответствующую уходящую группу, такую как, например,галоген, например хлор, бром и подобные; или сульфонилоксигруппу, такую как, например, метансульфонилокси, 4-метилбензолсульфонилокси и подобные. Указанная реакция N-алкилирования может быть с успехом проведена в реакционно-инертном растворителе, таком как, например, ароматический углеводород, например бензол, метилбензол, диметилбензол и подобные; алканол, например метанол, этанол,1-бутанол и подобные; кетон, например 2-пропанон, 4-метил-2-пентанон и подобные; простой эфир, например тетрагидрофуран, 1,4-диоксан, 1,1'-окси-бис-этан и подобные; биполярный апротонный растворитель, например N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, нитробензол, 1 метил-2-пирролидинон и подобные; или смесь таких растворителей. Добавление соответствующего основания, такого как, например, карбонат щелочного или щелочно-земельного металла, гидрокарбоната,алкоксида, гидрида, амида, гидроксида или оксида, например карбоната натрия, гидрокарбоната натрия,карбоната калия, метоксида натрия, этоксида натрия, трет-бутоксида калия, гидрида натрия, амида натрия, гидроксида натрия, карбоната кальция, гидроксида кальция, оксида кальция и подобных; или органического основания, такого как, например, амин, например, N,N-диэтилэтанамин, N-(1-метилэтил)-2 пропанамин, 4-этилморфолин, пиридин и подобные, могут быть использованы для связывания кислоты,которая высвобождается в ходе реакции. В некоторых случаях приемлемо добавление иодидной соли,предпочтительно иодида щелочного металла. Несколько повышенные температуры и перемешивание могут увеличить скорость реакции. Альтернативно, указанное N-алкилирование может быть осуществлено использованием условий каталитических реакций фазового переноса, известных в технике. Кроме того, соединения формулы (I), в которых R1 обозначает водород, определяемые как соединения формулы (I-b), могут быть алкилированы с использованием известных в технике процедур, таких как, например, восстановительное N-алкилирование соответствующим альдегидом или кетоном, или соединения формулы (I), в которых R1 обозначает водород, могут быть подвергнуты реакции с ацилгалогенидом или ангидридом кислоты. Также соединения формулы (I), в которых Х обозначает NR3, где R3 обозначает метансульфонил,бензолсульфонил, трифторметансульфонил, диметилсульфамоил, могут быть превращены в соединения формулы (I), где Х обозначает NH, с помощью известных в технике процедур гидролиза, например при обработке водным раствором кислоты, такой как НСl. Указанные соединения формулы (I), где R2 обозначает гидрокси, могут быть превращены в соединения формулы (I), где R2 обозначает C1-6 алкилокси, с использованием подходящих условий алкилирования, таких как, например, обработка гидридом натрия в тетрагидрофуране и добавление C1-6 алкилиодида. обозначает радикал формулы Соединения формулы (I), в которых двухвалентный радикал(а-1) или (а-7), в которых R3 обозначает гидрокси, могут быть превращены в соединения формулы (I), в обозначает радикал формулы (а-3), (а-4) или (а-9), где R2 обокоторых двухвалентный радикал значает водород, с помощью известных в технике процедур дегидрирования, таких как обработка метансульфонилхлоридом в реакционно-инертном растворителе, таком как СН 2 Сl2, или обработка полифосфорной кислотой (ПФК), при температуре, варьирующей от комнатной до температуры флегмы реакционной смеси, необязательно указанная реакция может проводиться в реакционно-инертном растворителе. И, наоборот, соединения формулы (I), в которых двухвалентный радикал обозначает радикал формулы (а-3), (а-4) или (а-9), в которых R2 обозначает водород, могут быть превращены в соединения формулы (I), в которых двухвалентный радикал обозначает радикал формулы (а-1) или (а-7), гдеR2 обозначает водород, с помощью известных в технике процедур гидрирования, таких как обработка газообразным водородом в сочетании с подходящим катализатором, таким как, например, палладий на угле, родий на углероде или платина на угле.-4 005851 Исходные материалы и некоторые из промежуточных соединений представляют собой известные соединения, и они коммерчески доступны или могут быть получены с помощью традиционных реакционных процедур, известных в технике. Так, например, коммерчески доступны гексагидро-4 Н-азепин-4 он, являющийся промежуточным соединением формулы (IV), 1H-бензимидазол и 1H-имидазо[4,5-b]пиридин как промежуточные соединения формулы (V). Соединения формулы (I), получаемые с использованием указанных выше способов, могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут быть отделены друг от друга с помощью известных в технике процедур разделения. Рацемические соединения формулы (I) могут быть превращены в соответствующие формы диастереомерной соли посредством реакции с соответствующей хиральной кислотой. Указанные диастереомерные солевые формы впоследствии разделяют, например, с помощью селективной или фракционированной кристаллизации, и энантиомеры высвобождаются из них под действием щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает проведение жидкостной хроматографии с использованием хиральной стационарной фазы. Указанные стереохимически чистые изомерные формы могут быть получены также из соответствующих стереохимически чистых изомерных форм соответствующих исходных материалов, при условии, что реакция происходит в стереоспецифических условиях. Предпочтительно, если требуется конкретный стереоизомер, указанное соединение синтезируют с помощью стереоспецифических методов получения. Указанные методы основаны на применении энантиомерно чистых исходных материалов. Ввиду способности соединений согласно настоящему изобретению расслаблять фундальные структуры, рассматриваемые соединения полезны для лечения состояний, связанных с затрудненной или нарушенной релаксацией фундальных структур, таких как гастроэзофагальный рефлюкс, изжога (включая эпизодическую изжогу, ночную изжогу и изжогу, связанную с приемом пищи), диспепсия, раннее насыщение, вздутие живота и анорексия. Диспепсия рассматривается как нарушение перистальтики. Симптомы могут быть вызваны задержкой в опорожнении желудка, нарушенной релаксацией фундальной структуры при приеме пищи или в связи с гиперчувствительностью к релаксации желудка. Симптомами диспепсии являются, например,потеря аппетита, ощущение наполненности, раннее насыщение, тошнота, рвота, вспучивание живота и отрыжка газами. Теплокровные животные, включая человека (в основном, называемые в настоящем описании пациентами), страдающие от симптомов диспепсии в результате задержки опорожнения желудка, обычно имеют нормальную релаксацию фундальной структуры и могут получить облегчение от симптомов диспепсии при употреблении прокинетического средства, такого как, например, цизаприд. Пациенты могут иметь симптомы диспепсии без нарушения процесса опорожнения желудка. Симптомы диспепсии у них могут возникать в результате чрезмерной сократимости фундальной структуры,что вызывает ослабленную пластичность и приводит к аномалиям в адаптивной фундальной релаксации. Симптомы диспепсии могут также возникнуть в результате гиперчувствительности фундальной структуры к релаксации. Чрезмерное сокращение фундальной структуры приводит к сниженной эластичности желудка. Понятие эластичность желудка может быть выражено в виде отношения объема желудка под давлением,оказываемым стенкой желудка. Эластичность желудка связана с желудочным тонусом, который является результатом тонического сокращения мышечных волокон проксимальной части желудка. Указанная проксимальная часть желудка, посредством влияния регулируемого тонического сокращения (гастрического тонуса), осуществляет резервуарную функцию желудка. Пациенты, страдающие от состояния раннего насыщения, не могут завершить нормальный прием пищи, поскольку они чувствуют насыщение до того, как они способны завершить указанный нормальный прием пищи. Обычно, когда субъект начинает прием пищи, желудок осуществляет адаптивную релаксацию, то есть желудок расслабляется для приема вводимой пищи. Указанная адаптивная релаксация невозможна в том случае, когда эластичность желудка затруднена, что приводит к нарушению релаксации фундальной структуры. Ввиду полезности соединений формулы (I) следует, что настоящее изобретение также относится к способу лечения теплокровных животных, включая человека (в основном, называемыx в настоящем описании пациентами), страдающих нарушенной релаксацией фундальной структуры при приеме пищи. Соответственно, предлагается способ лечения, приводящий к улучшению самочувствия пациентов, страдающих от таких состояний, как, например, гастроэзофагальный рефлюкс, изжога (включая эпизодическую изжогу, ночную изжогу и изжогу, связанную с приемом пиши), диспепсия, раннее насыщение,вздутие живота и анорексия. Следовательно, предлагается применение соединения формулы (I) в качестве лекарственного средства, и в частности применение соединения формулы (I) для изготовления лекарственного средства,предназначенного для лечения состояний, включающих нарушенную релаксацию фундальной структуры при приеме пищи. В изобретении рассматриваются как профилактическое, так и терапевтическое лечение. Симптомы нарушенной фундальной релаксации могут также возникать в связи с приемом химических веществ, например приемом селективных ингибиторов повторного поглощения серотонина (SSRI),-5 005851 таких как флуоксетин, пароксетин, флувоксамин, циталопрам, сертралин; или эритромицина и эритромицинподобных макролидных антибиотиков, таких как, например, ЕМ-523, ЕМ-574, АВТ-229, GM-611,(8R)-4"-дезокси-6,9-эпоксиэритромицин A, (8S)-4"-дезокси-6,9-эпоксиэритромицин А, А-81648, А 173508, А-182061 и КС-11458. Другим функциональным расстройством желудочно-кишечного тракта является синдром раздражения кишечника, при котором считается, что один из ее признаков относится к гиперчувствительности кишки к растяжению. В этой связи, считается, что модуляция указанной гиперчувствительности с помощью соединений согласно настоящему изобретению, обладающих свойством фундальной релаксации,может привести к ослаблению симптомов у субъектов, страдающих от указанного СРК. Соответственно,предлагается применение соединений формулы (I) для изготовления лекарственного средства, предназначенного для лечения СРК (синдрома раздражения кишечника). Кроме того, соединения формулы (I) также способны снижать болевые ощущения, связанные с гиперчувствительностью желудочнокишечного тракта. Для получения фармацевтических композиций согласно настоящему изобретению эффективное количество конкретного соединения в форме аддитивной соли основания или кислоты в качестве активного ингредиента объединяют в однородной смеси с фармацевтически приемлемым носителем, причем указанный носитель может быть представлен широким множеством форм, в зависимости от формы препарата, желательной для введения. Указанные фармацевтические композиции желательно иметь в разовой лекарственной форме, приемлемой предпочтительно для орального, ректального введения или для парентеральной инъекции. Так, например, при получении композиций в оральной лекарственной форме могут использоваться любые обычно применяемые фармацевтические среды, такие как, например, вода,гликоли, масла, спирты и подобные, в случае жидких оральных препаратов, таких как суспензии, сиропы, эликсиры и растворы; или в случае порошков, пилюль, капсул и таблеток - твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, дезинтегранты и подобные. В связи с легкостью введения, таблетки и капсулы представляют собой наиболее удобные оральные единичные лекарственные формы, и в этом случае очевидно использование твердых фармацевтических носителей. Для парентеральных композиций носитель будет обычно содержать стерильную воду, по меньшей мере, в основной части, хотя могут включаться и другие ингредиенты, например, для улучшения растворимости. Могут быть, например, приготовлены инъецируемые растворы, в которых носитель включает солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Могут быть также приготовлены инъецируемые суспензии, в которых используются соответствующие жидкие носители, суспендирующие средства и подобное. В композициях, пригодных для чрескожного введения,носитель необязательно включает средства для усиления проникновения и/или подходящий увлажнитель, необязательно объединенный с небольшой долей приемлемых добавок любой природы, так чтобы указанные добавки не оказывали заметного вредного эффекта на кожу. Указанные добавки могут облегчать введение в кожу и/или могут быть полезны для получения желательных композиций. Такие композиции могут вводиться различными способами, например в виде чрескожных пластырей, в виде пластырей для ограниченного участка или в виде мазей. Кислотно-аддитивные соли (I) благодаря их повышенной растворимости в воде в сравнении с соответствующей формой основания являются, очевидно, более подходящими для получения водных композиций. Особенно удобно готовить указанные выше фармацевтические композиции в единичной лекарственной форме для легкости введения и однородности дозировки. Единичная лекарственная форма в контексте настоящего описания и прилагаемой формулы изобретения относится к физически дискретным единицам, пригодным в качестве разовых дозировок, причем каждая единица содержит рассчитанное заданное количество активного ингредиента для обеспечения требуемого терапевтического действия в сочетании с требуемым фармацевтическим носителем. Примерами таких единичных лекарственных форм являются таблетки (в том числе таблетки с насечкой или покрытые оболочкой), капсулы, пилюли,пакетики с порошком, облатки, инъецируемые растворы или суспензии, дозировки, соответствующие чайной ложке, столовой ложке и подобные, а также многочисленные формы, включающие их сочетания. Для целей орального введения фармацевтические композиции могут иметь форму твердой дозированной формы, например таблетки (как формы, используемые только для глотания, так и формы, подходящие для жевания), капсулы или гелевые капсулы, получаемые с помощью традиционных методов при использовании фармацевтически приемлемых эксципиентов, таких как связующие вещества (например,предварительно желатинированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); дезинтегранты (например, картофельный крахмал или натрийгликолят крахмал); или смачивающие вещества (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой с помощью методов, известных в технике. Жидкие препараты для орального введения могут иметь форму, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для восстановления водой или другим подходящим носителем перед применением. Такие жидкие препараты могут быть получены традиционными способами, необязательно с использованием фармацевтически приемлемых добавок, таких-6 005851 как суспендирующие средства (например, сироп сорбита, метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрогенизированные пищевые жиры), эмульгаторы (например, лецитин или аравийская камедь); неводные носители (например, минеральное масло, сложные эфиры масел или этиловый спирт); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подсластители включают, предпочтительно, по меньшей мере один сильный подсластитель, такой как сахарин, натрий- или кальцийсахарин, аспартам, калийацесульфам,натрийцикламат, алитам, дигидрохалконовый подсластитель, монеллин, стевиозид или сукралоза (4,1',6'трихлор-4,1',6'-тридезоксигалактосахароза), предпочтительно сахарин, натрий- или кальцийсахарин, и необязательно объемный подсластитель, такой как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальтоза, глюкоза, сироп гидрогенизированной глюкозы, ксилит, карамель или мед. Сильные подсластители обычно используют в низких концентрациях. Так, например, в случае натрийсахарина концентрация может варьировать от 0,04 до 0,1% (вес/объем) от общего объема готовой композиции и предпочтительно составляет примерно 0,06% в композициях с низкой дозой и примерно 0,08% в композициях с высокой дозой. Объемный подсластитель может быть эффективно использован в больших количествах, варьирующих от примерно 10 до примерно 35%, предпочтительно от примерно 10 до 15% (вес/объем). Фармацевтически приемлемые вкусовые добавки, которые могут маскировать горький вкус ингредиентов в композициях с низкой дозой, предпочтительно представляют фруктовые вкусовые добавки,такие как вишня, малина, черная смородина или клубника. Сочетание двух вкусовых добавок может приводить к очень хорошим результатам. Для композиций с высокой дозой могут потребоваться более сильные вкусовые добавки, такие как карамельно-шоколадная добавка, охлаждающая мятная добавка,фантазийная добавка и подобные фармацевтически приемлемые сильные вкусовые добавки. Каждая вкусовая добавка может содержаться в готовой композиции в концентрации от 0,05 до 1% (вес/объем). Могут с успехом использоваться сочетания указанных сильных вкусовых добавок. Предпочтительно используют такую вкусовую добавку, которая не меняет или не теряет вкуса и цвета при попадании композиции в кислые условия. Соединения согласно настоящему изобретению могут быть введены в композицию для парентерального введения инъекцией, подходяще внутривенной, внутримышечной или подкожной инъекцией,например болюс-инъекцией или непрерывной внутривенной инфузией. Композиции для инъекции могут быть представлены в единичной дозированной форме, например в виде ампул или контейнеров с множественными дозами, с добавкой консерванта. Композиции могут принимать такие формы, как суспензии,растворы или эмульсии в масляном или водном носителях, и могут включать средства, способствующие приготовлению композиций, такие как средства для достижения изотоничности, суспендирующие, стабилизирующие средства и/или диспергирующие средства. Альтернативно, активный ингредиент может находиться в виде порошка для восстановления, перед употреблением, соответствующим носителем,например стерильной апирогенной водой. Соединения согласно настоящему изобретению могут быть также введены в состав композиции для ректального введения, такие как суппозитории или удерживающие клизмы, например, содержащие традиционные основания для суппозитория, такие как масло какао или другие глицериды. Специалисты, знакомые с лечением состояний, связанных с затрудненной или нарушенной релаксацией фундальных структур, могут легко определить эффективное ежедневное количество на основе результатов представленного ниже тестирования. В основном, считается, что терапевтически эффективная доза будет составлять от 0,001 до 5 мг/кг веса тела, более предпочтительно от 0,01 до 0,5 мг/кг веса тела. Может быть удобно вводить терапевтически эффективную дозу в виде двух, трех, четырех или более субдоз с соответствующими интервалами в течение всего дня. Указанные субдозы могут быть приготовлены в виде единичных дозированных форм, например, содержащих от 0,1 до 350 мг, и в частности от 1 до 200 мг, активного ингредиента на единичную дозированную форму. Как хорошо известно специалистам в данной области, точная дозировка и частота введения зависят от конкретного используемого соединения формулы (I), от конкретного состояния, подлежащего лечению, тяжести состояния, которое предстоит лечить, возраста, веса и общего физического состояния конкретного пациента, а также от других видов лечения, которое пациент может принимать. Кроме того,очевидно, что указанное эффективное дневное количество может быть снижено или увеличено в зависимости от реакции пациента, проходящего лечение, и/или в зависимости от оценки лечащего врача, который назначает для лечения соединения согласно настоящему изобретению. Эффективное дневное количество в указанных выше диапазонах дано лишь как примерный ориентир. Экспериментальная часть В описанных ниже процедурах использованные сокращения обозначают: Ацн - ацетонитрил,ТГФ - тетрагидрофуран, ДХМ -дихлорметан, ДИПЭ - диизопропиловый эфир и ДМФ - N,N-диметилформамид. Для некоторых химических веществ использованы химические формулы, например H2 - для газообразного водорода, N2 - для газообразного азота, CH2Cl2 - для дихлорметана, СН 3 ОН - для метанола, NH3 для аммиака, НСl - для хлористо-водородной кислоты и NaOH - для гидроксида натрия.-7 005851 В тех случаях, когда стереохимически изомерная форма была сначала выделена, она обозначена как А, тогда как вторая форма обозначена как В, без дальнейших ссылок на фактическую стереохимическую конфигурацию. А. Получение промежуточных соединений. Пример A.1. Смесь гексагидро-1-(фенилметил)-4 Н-азепин-4-она (0,2 моль) и 4-толуолсульфонилметилизоцианида (0,25 моль) в ДМФ (200 мл) перемешивают при 0 С. Добавляют по каплям при 0 С раствор третбутоксида калия (0,4 моль) в смеси 2-метил-2-пропанола (200 мл) и 1,2-диметоксиэтана (200 мл). Смеси позволяют достичь комнатной температуры и перемешивание продолжают в течение 1 ч. Затем смесь перемешивают в воде и указанную смесь экстрагируют с использованием ДХМ. Отделенный органический слой сушат, фильтруют и растворитель выпаривают с получением 48 г -гексагидро-1-(фенилметил)1 Н-азепин-4-карбонитрила (промежуточное соединение 1). Пример А.2. Диметилсульфамоилхлорид (0,39 моль) добавляют к смеси 1H-имидазо[4,5-b]-пиридина (0,26 моль) и триэтиламина (0,65 моль) в толуоле (500 мл). Смесь перемешивают при 100 С в течение 24 ч. Растворитель выпаривают. Остаток отбирают в ДХМ. Органический раствор промывают водой и K2 СО 3 (10%),сушат, фильтруют и растворитель выпаривают с получением 45,4 г (77%) смеси N,N-диметил-1 Нимидазо[4,5-b]пиридин-1-сульфонамида (промежуточное соединение 2) и N,N-диметил-3 Н-имидазо[4,5b]пиридин-3-сульфонамида (промежуточное соединение 3). Пример А.3.a) Смесь этил гексагидро-4-оксоазепин-1-карбоксилата (0,585 моль), 1,2-этандиола (0,585 моль) и птолуолсульфоновой кислоты (0,0058 моль) в толуоле (800 мл) перемешивают и кипятят с обратным холодильником в течение ночи с использованием водного сепаратора (отделяют 10,5 мл). Растворитель выпаривают с получением 142,5 г этил 1,4-диокса-8-азаспиро[4,6]ундекан-8-карбоксилата (промежуточное соединение 4).b) Смесь промежуточного соединения (4) (0,585 моль) и KОН (5,85 моль) в 2-пропаноле (1200 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель выпаривают. Остаток перемешивают в воде и указанную смесь экстрагируют с помощью ДХМ. Отделенный органический слой сушат, фильтруют и растворитель выпаривают с получением 57,7 г 1, 4-диокса-8-азаспиро[4,6]ундекана (промежуточное соединение 5).c) Смесь промежуточного соединения (5) (0,114 моль), 1-(2-бромэтил)-4-метоксибензола (0,172 моль) и K2 СО 3 (0,219 моль) в Ацн (200 мл) перемешивают при 80 С в течение 2 ч. Добавляют воду и смесь экстрагируют с использованием ДХМ. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток чистят хроматографией на колонке на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH,95/5/0,2). Чистые фракции собирают и выпаривают растворитель с получением 28,5 г 8-[2-(4-метоксифенил)этил]-1,4-диокса-8-азаспиро[4,6]ундекана (промежуточное соединение 6).d) Смесь промежуточного соединения (6) (0,098 моль) в НСl (3N, 300 мл) и ТГФ (300 мл) перемешивают при 60 С в течение 1 ч. Смесь подщелачивают твердым K2 СО 3 и экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают с получением 22,6 г гексагидро-1-[2-(4-метоксифенил)этил]-4 Н-азепин-4-она (промежуточное соединение 7). Пример А.4.a) 5,6,7,8-Тетрагидро-2(1 Н)-хинолинон (0,134 моль) добавляют порциями при 5 С к серной кислоте(200 мл). Затем добавляют порциями НNO3 (0,235 моль), поддерживая температуру ниже 10 С. Смесь перемешивают при 5 С в течение 1 ч, выливают осторожно в небольшое количество ледяной воды и перемешивают при 0 С в течение 10 мин. Осадок отфильтровывают и сушат с получением 14,2 г (55%) 5,6,7,8-тетрагидро-3-нитро-2(1H)-хинолинона (промежуточное соединение 8).b) Раствор промежуточного соединения (8) (0,072 моль) и ВТЕАС (0,0362 моль) в Ацн (150 мл) перемешивают при комнатной температуре. Добавляют по каплям трихлорид фосфора (0,222 г). Смесь перемешивают и кипятят с обратным холодильником в течение 8 ч. Растворитель выпаривают досуха. Остаток выливают в воду и NH4OH. Смесь экстрагируют с использованием ДХМ. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают с получением 15 г 2-хлор-5,6,7,8-тетрагидро-3-нитрохинолина (промежуточное соединение 9).c) Смесь промежуточного соединения (9) (0,0658 моль) в 7N NН 3/СН 3 ОН (60 мл) перемешивают при 120 С в течение 12 ч в автоклаве. Растворитель выпаривают досуха. Остаток отбирают в 2-пропанон. Осадок отфильтровывают и сушат с получением 8,6 г 5,6,7,8-тетрагидро-3-нитро-2-хинолинамина (промежуточное соединение 10).d) Смесь промежуточного соединения (10) (0,031 моль) в метаноле (100 мл) гидрируют при комнатной температуре под давлением 3x105 Па (3 бар) в течение 30 мин в аппарате Парра. После поглощения водорода (3 эквивалента) катализатор отфильтровывают через целит, промывают метанолом и фильтрат выпаривают досуха. Продукт используют с дополнительной очисткой с получением 5,07 г 5,6,7,8-тетрагидро-2,3-хинолиндиамина (промежуточное соединение 11).-8 005851 В. Получение конечных соединений. Пример B.1. Полифосфорную кислоту (ПФК) (100 г) нагревают до 160 С. Добавляют промежуточное соединение (1) (0,0467 моль) и 2,3-диаминопиридин (0,0513 моль). Смесь перемешивают при 180 С в течение 1 ч,выливают на твердый K2 СО 3 и лед, промывают 10% K2 СО 3 и экстрагируют ДХМ. Водный слой промывают ДХМ. Органический слой сушат, фильтруют и растворитель выпаривают. Указанную фракцию очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 94/6/0,5). Чистые фракции собирают и выпаривают растворитель. Часть указанной фракции (6 г) кристаллизуют из ДИПЭ и 2-пропанона. Осадок отфильтровывают и сушат с получением 3,16 г -2-[гексагидро-1-(фенилметил)1 Н-азепин-4-ил]-1H-имидазо[4,5-b]пиридина (соединение 69). Аналогично получают соединение (207) реакцией промежуточного соединения (1) с 2-аминобензолтиолом. Пример В.2. Соединение (69) (0,0653 моль) разделяют на его энатиомеры посредством хиральной хроматографии на колонке (элюент: гексан/этанол/Et3N, 95/5/0,1; колонка CHIRALPAK AD 20 мкм). Разделенные фракции собирают, выпаривают растворители и затем кристаллизуют из ДИПЭ или 2-пропанона с получением 4,64 г (23%) (-)-2-[гексагидро-1-(фенилметил)-1 Н-азепин-4-ил]-1H-имидазо[4,5-b]пиридина (соединение 80). []20D=-15,08 (с=8,49 мг/мл в СН 3 ОН), и 6,19 г (31%) (+)-2-[гексагидро-1-(фенилметил)1H-азепин-4-ил]-1H-имидазо[4,5-b]пиридина (соединение 81), []20D=+15,52 (с=8,70 мг/5 мл в СН 3 ОН). Пример В.3. Добавляют по каплям н-бутиллитий (1,6 М в гексанах, 0,164 моль) при -30 С в потоке N2 к смеси N(1-метилэтил)-2-пропанамина (0,164 моль) в ТГФ (70 мл). Смесь охлаждают до -70 С. Добавляют по каплям смесь 1-метил-1 Н-имидазо[4,5-b]пиридина (0,0751 моль) в ТГФ (70 мл). Затем смесь перемешивают в течение 1 ч. Добавляют при -70 С смесь гексагидро-1-(фенилметил)-1 Н-азепин-4-она (0,0787 моль) в ТГФ (60 мл). После этого смесь перемешивают при -70 С в течение 2 ч, доводят температуру до 0 С,выливают в воду и NH4Cl и экстрагируют ДХМ с небольшим количеством метанола. Органический слой отделяют, сушат, фильтруют и выпаривают досуха. Остаток очищают хроматографией на колонке на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 97/3/0,5). Нужные фракции собирают и выпаривают растворитель с получением 8,8 г -гексагидро-4-(1-метил-1 Н-имидазо[4,5-b]пиридин-2-ил)-1-(фенилметил)1 Н-азепин-4-ола (соединение 152). Пример В.4. Смесь соединения (81) (0,0068 моль) в метаноле (20 мл) гидрируют при 40 С под давлением 3 х 105 Па(3 бар) с использованием палладия на угле (1 г) в качестве катализатора. После поглощения водорода(1 эквивалент) катализатор отфильтровывают через целит и фильтрат выпаривают. Остаток кристаллизуют из Ацн. Осадок отфильтровывают и сушат с получением 0,95 г (А)-2-(гексагидро-1 Н-азепин-4-ил)1H-имидазо[4,5-b]пиридина (соединение 102). Пример В.5. К смеси соединения (87) (0,011 моль) в Ацн (80 мл) добавляют K2 СО 3 (0,011 моль) и затем 1(хлорметил)-4-метоксибензол (0,011 моль). Смесь перемешивают при комнатной температуре в течение ночи. Затем растворитель выпаривают досуха. Остаток отбирают в ДХМ и воду. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают хроматографией на колонке на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NH4OН, 93/7/0,5). Чистые фракции собирают и выпаривают растворитель. Остаток кристаллизуют из Ацн. Осадок отфильтровывают и сушат с получением 1,2 г -2[гексагидро-1-[(4-метоксифенил)метил]-1H-азепин-4-ил]-1H-имидазо [4,5-b] пиридина (соединение 101). Пример В.6. Полифосфорную кислоту (ПФК) (10 г) нагревают до 160 С. Добавляют соединение (155) (0,0043 моль). Смесь перемешивают в течение 20 мин, охлаждают, выливают в ледяную воду, насыщенную K2 СО 3 (порошок), и экстрагируют СН 2 Сl2/СН 3 ОН (95/5). Органический слой отделяют, сушат, фильтруют и растворитель выпаривают досуха. Остаток отбирают в СН 3 ОН/СН 3 СN. Осадок отфильтровывают, промывают и сушат с получением 1,55 г (20,9%) 2-(2,3,6,7-тетрагидро-1 Н-азепин-4-ил)-1H-имидазо[4,5-b]пиридина (соединение 116). Маточный слой выпаривают досуха с получением 5,5 г смеси соединения (116) и 2-(2,5,6,7-тетрагидро-1 Н-азепин-4-ил)-1H-имидазо-[4,5-b]пиридина (соединение 115). Пример В.7. Смесь соединения (136) (0,0276 моль) в ДХМ (80 мл) охлаждают до 5 С. Добавляют 3-хлорбензолкарбопероксовую кислоту (0,044 моль). Смесь выдерживают при температуре 5 С в течение 1 ч и затем переносят в условия комнатной температуры на ночь. Добавляют 10% K2 СО 3. Смесь насыщают K2 СО 3(порошок) и экстрагируют CH2Cl2/CH3OH. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают досуха. Остаток очищают хроматографией на колонке на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН, 92/8/0,5). Чистые фракции собирают и выпаривают растворитель с получением 6,5 г (74,7%) -1-(2,2-диметил-1-оксопропил)-4-(1H-имидазо[4,5-b]пиридин-2-ил)-1H-азепин, N4-оксида (соединение 161).-9 005851 Пример В.8. К смеси соединения (69) (0,013 моль) в ДХМ (80 мл) добавляют порциями при комнатной температуре 3-хлорбензолкарбопероксовую кислоту (0,0157 моль). Смесь перемешивают при комнатной температуре в течение 4 ч. Добавляют насыщенный раствор NаНСО 3. Смесь экстрагируют ДХМ, насыщаютK2 СО 3 и экстрагируют СН 2 Сl2/2-пропанолом. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают при температуре ниже 40 С. Остаток очищают хроматографией на колонке на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 88/12/1). Собирают две чистые фракции и выпаривают растворитель с получением 2,3 г (А)-2-[гексагидро-1-(фенилметил)-1 Н-азепин-4-ил]-1H-имидазо[4,5-b]пиридина,N-оксида (соединение 113) и 1,6 г (В)-2-[гексагидро-1-(фенилметил)-1 Н-азепин-4-ил]-1H-имидазо[4,5-b] пиридина, N-оксида (соединение 114). Пример В.9. К смеси соединения -2-[гексагидро-1-(фенилметил)-1 Н-азепин-4-ил]-1H-имидазо[4,5-b]пиридина(0,0195 моль) в ДМФ (100 мл) добавляют порциями при 5 С 80% NaH (0,0195 моль). Смесь перемешивают в течение 15 мин. Добавляют 2-бром-1-фенилэтанон (0,0214 моль). Смесь перемешивают в течение 30 мин. Добавляют воду и смесь экстрагируют этилацетатом. Органический слой отделяют, сушат,фильтруют и растворитель выпаривают. Остаток очищают хроматографией на колонке на силикагеле(элюент: СН 2 Сl2/СН 3 ОН/NН 4OН, 97/3/0,1). Три чистые фракции собирают, выпаривают из них растворители, переводят их в соли хлористо-водородной кислоты (1:2) с использованием HCl/2-пропанола и кристаллизуют из 2-пропанола с получением 3,3 г гидрохлорида -2-[2-[гексагидро-1-(фенилметил)-1 Назепин-4-ил]-3 Н-имидазо [4,5-b]пиридин-3-ил]-1-фенилэтанона (1:2) (соединение 76). Пример В.10. Раствор соединения (143) (0,00838 моль) в 3N НСl (35 мл) и ТГФ (35 мл) перемешивают при комнатной температуре в течение ночи, нейтрализуют твердым K2 СО 3 и экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают хроматографией на колонке на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН, 90/10/0,5). Чистые фракции собирают и выпаривают растворитель. Остаток кристаллизуют из 2-пропанона. Осадок отфильтровывают и сушат с получением 1,54 г -гексагидро-4-(1H-имидазо[4,5-b]пиридин-2-ил)-1-(фенилметил)-1 Н-азепин-4-ола(соединение 149). Пример В.11. Смесь соединения (54) и соединения (55) в метаноле (50 мл) гидрируют при 40 С под давлением 5 х 105 Па (5 бар) в течение 8 ч с использованием палладия на угле (0,45 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают через целит, промывают метанолом и фильтрат выпаривают. Остаток очищают хроматографией на колонке на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН, 90/10/1). Чистые фракции собирают и выпаривают растворитель. Остаток кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат с получением 1,8 г соединения (14). Пример В.12. Смесь соединения (27) (0,0059 моль) в метаноле (100 мл) перемешивают при 5 С. Добавляют порциями в потоке N2 боргидрид натрия (0,0059 моль). Смесь перемешивают при комнатной температуре в течение 2 ч и гидролизуют в воде. Метанол выпаривают. Остаток отбирают в ДХМ и проводят экстракцию смеси. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток превращают в соль этандиовой кислоты (1:2). Смесь кристаллизуют из 2-пропанона. Осадок отфильтровывают и сушат с получением 2,37 г соединения (29). Пример В.13. Смесь соединения (31) (0,00659 моль) и метилиодида (0,00923 моль) в 2-пропаноне (80 мл) перемешивают при комнатной температуре в течение 12 ч. Осадок отфильтровывают, промывают 2-пропаноном и сушат с получением 2,45 г соединения (154). Пример В.14. Смесь соединения (161) в 12N НСl (50 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель выпаривают досуха. Остаток отбирают в 10% K2 СО 3 и насыщают порошкомK2 СО 3. Смесь экстрагируют СН 2 Сl2/СН 3 ОН, 90/10. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают досуха. Остаток кристаллизуют из СН 3 ОН/СН 3 СN/ДИПЭ. Осадок отфильтровывают и сушат с получением 1,2 г соединения (162). Пример В.15. Смесь соединения (126) (0,00594 моль) в 48% НВr в воде (60 мл) перемешивают при 90 С в течение 12 ч. Растворитель выпаривают. Остаток промывают раствором K2 СО 3 и экстрагируют этилацетатом и ДХМ. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток отбирают в этилацетат. Смесь оставляют для кристаллизации. Осадок отфильтровывают и сушат с получением 0,8 г соединения (127). Пример В.16. Смесь соединения (92) (0,006 моль) в метаноле (20 мл) гидрируют при комнатной температуре под давлением 3 х 105 Па (3 бар) в течение 2 ч с использованием никелевого катализатора Ренея (2 г). После- 10005851 поглощения водорода (3 эквивалента) катализатор отфильтровывают через целит и фильтрат выпаривают с получением 2,1 г соединения (105). Пример В.17. Смесь соединения (87) (0,0139 моль) в триэтиламине (2,9 мл) и ДХМ (30 мл) перемешивают при комнатной температуре в течение 15 мин. Добавляют 3-пиридинкарбоновую кислоту (0,0209 моль). Добавляют при 5 С в потоке N2 смесь 1-гидрокси-1 Н-бензотриазола (0,0209 моль) в ДХМ (30 мл). Затем добавляют по каплям смесь N,N'-метантетраилбисциклогексанамина (0,0209 коль) в ДХМ (30 мл). Смесь перемешивают при комнатной температуре в течение 6 ч. Осадок отфильтровывают. Фильтрат промывают водой. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают хроматографией на колонке на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 92/8/0,5). Две фракции собирают и растворители из них выпаривают. Обе фракции объединяют и кристаллизуют из ДХМ и ДИПЭ с получением 2,3 г соединения (118). Пример В.18. Триэтиламин (0,0111 моль) добавляют к смеси соединений (115) и (116), как получено в примере В.6, в ДМФ (40 мл). Смесь охлаждают на ледяной бане. Добавляют метансульфонилхлорид (0,01 моль). Смесь перемешивают при 5 С в течение 1 ч и затем перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают досуха. Остаток отбирают в смесь ДХМ и воды. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают досуха. Остаток очищают хроматографией на колонке на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН, 95/5/0,1) и кристаллизуют из 2-пропанона и ДИПЭ. Осадок отфильтровывают и сушат с получением 1,25 г соединения (180) (Тпл.260 С). Пример В.19. Триэтиламин (0,0168 моль) добавляют к смеси соединений (115) (0,007 моль) и (116) (0,007 моль),как получено в примере В.6, в ДМФ (60 мл). Смесь охлаждают при 5 С и добавляют 2-фенилацетилхлорид (0,0154 моль). Смесь перемешивают при 5 С в течение 1 ч, затем при комнатной температуре в течение ночи, выпаривают досуха и отбирают в смесь ДХМ и воды. Органический слой отделяют,сушат, фильтруют и растворитель выпаривают досуха. Остаток очищают хроматографией на колонке на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН, 95/5/0,2). Две фракции собирают и растворители из них выпаривают. Одну фракцию кристаллизуют из СН 3 СN/ДИПЭ. Осадок отфильтровывают и сушат с получением 0,25 г соединения (182) (Тпл. 169 С). Вторую фракцию кристаллизуют из СН 3 СN/ДИПЭ. Осадок отфильтровывают и сушат с получением 1,55 г соединения (183) (Тпл. 157 С). Пример В.20. Триэтиламин (0,037 моль) и затем этилхлорформиат (0,074 моль) добавляют по каплям при комнатной температуре к смеси соединения (87) (0,0185 моль) в толуоле (60 мл). Смесь перемешивают при 95 С в течение 2 ч, выливают в ледяную воду и экстрагируют этилацетатом. Органический слой отделяют,сушат, фильтруют и растворитель выпаривают. Остаток очищают хроматографией на колонке на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН, 97/3/0,5). Одну фракцию отбирают и растворитель выпаривают с получением 3,7 г соединения (187). Пример В.21. Смесь соединения (187) (0,0083 моль) и гидроксида калия (0,053 моль) в 2-пропаноле (30 мл) перемешивают и кипятят с обратным холодильником в течение ночи, выливают в ледяную воду, экстрагируют ДХМ и промывают водой. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают досуха. Смесь отбирают диэтиловым эфиром/ДИПЭ. Осадок отфильтровывают, промывают и сушат с получением 1,45 г соединения (188). (Тпл. 141 С). Пример В.22. Смесь метил-5,6-диаминоникотината (0,0104 моль) и гексагидро-1-(фенилметил)-1 Н-азепин-4-карбоновой кислоты (0,0087 моль) в оксихлориде фосфора (50 мл) перемешивают при 110 С в течение 8 ч. Растворитель выпаривают. Остаток подщелачивают K2 СО 3/Н 2 О. Смесь насыщают K2 СО 3 и экстрагируют смесью этилацетата и изопропанола. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают хроматографией на колонке на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН,95/5/0,5) и кристаллизуют из СН 3 СN/ДИПЭ с получением 1,02 г соединения (217) (Тпл. 150 С). Пример В.23.a) Смесь 3-амино-2-пиридинола (0,018 моль) в ДХМ (40 мл) охлаждают до 5 С. Добавляют триэтиламин (0,0216 моль). Затем добавляют смесь гексагидро-1-(фенилметил)-1 Н-азепин-4-карбонилхлорида(0,018 моль) в Ацн (40 мл). Смесь перемешивают при 5 С в течение 1 ч, затем перемешивают при комнаткой температуре в течение ночи и выливают в воду. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают досуха. Остаток используют далее без дополнительной очистки с получением промежуточного соединения (12).b) Смесь промежуточного соединения (12) (0,018 моль) в оксихлориде фосфора (80 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Выпаривают досуха оксихлорид фосфора. Остаток отбирают в 10% K2 СО 3 и экстрагируют ДХМ. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают досуха. Остаток очищают хроматографией на колонке на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH, 90/10/0,1), кристаллизуют из Ацн и превращают в соль этандиовой кислоты с получением 0,8 г соединения (213) (Тпл. 102 С). Пример В.24. Смесь N-(2-амино-3-пиридинил)гексагидро-1-(фенилметил)-1 Н-азепин-3-карбоксамида (0,0151 моль) иAPTS (0,1 г) в ксилоле (150 мл) перемешивают и кипятят с обратным холодильником в течение 12 ч, выпаривают и отбирают в 10% K2 СО 3/СН 2 Сl2. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают хроматографией на колонке на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4 ОН,от 96/4/0,5 до 90/10/0,5). Чистые фракции собирают и кристаллизуют из смеси СН 3 СN/ДИПЭ с получением 2,57 г соединения (195) (Тпл. 139 С). Пример В.25. Смесь N-(2-хлор-3-пиридинил)гексагидро-1-(фенилметил)-1 Н-азепин-4-карбоксамида (0,096 моль),реагента Lawesson'a (0,0096 моль) в НМРТ (33 мл) перемешивают при 150 С в течение ночи. Смесь выливают в K2 СО 3/лед и экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают хроматографией на колонке на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4 ОН, 97,5/2,5/0,1). Чистые фракции собирают и растворитель выпаривают. Остаток растворяют в 2-пропаноне и превращают в соль этандиовой кислоты. Осадок отфильтровывают и сушат с получением 0,52 г соединения (218) (Тпл. 163 С). Пример В.26. Добавляют по каплям при 0 С к смеси соединения (207) (0,0172 моль) в 1,2-дихлорэтане (100 мл) смесь 1-хлорэтилхлороформиата (0,0188 моль) в 1,2-дихлорэтане (20 мл). Температуру смеси доводят до комнатной и затем перемешивают при 80 С в течение 1 ч. Растворитель выпаривают досуха. Добавляют метанол (60 мл). Смесь выдерживают при комнатной температуре в течение 12 ч, затем перемешивают и кипятят с обратным холодильником в течение 30 мин. Растворитель выпаривают. Добавляют 10%K2 СО 3/СН 2 Сl2. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток кристаллизуют из Ацн с получением 0,9 г соединения (220). Пример В.27. Смесь соединения (171) (0,015 моль) в ТГФ (30 мл) охлаждают до 0 С. Добавляют порциями гидрид натрия (60% в масле) (0,015 моль). Затем добавляют по каплям диметилсульфат (0,0165 моль). Смесь перемешивают при температуре от 0 С до комнатной температуры в течение 4 ч, выливают в воду и экстрагируют ДХМ. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают хроматографией на колонке на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН, 95/5/0,1) с получением 4,5 г соединения (175). Пример В.28. Смесь диэтилового сложного эфира карбамодитиовой кислоты 4-гексагидро-1-(фенилметил)-1 Назепин-4-ил]карбонил]амино]-3-пиридинила (0,00876 моль) в муравьиной кислоте (50 мл) перемешивают при температуре 100 С в течение 3 ч. Растворитель выпаривают. Остаток выливают в лед, подщелачивают K2 СО 3 (порошок) и экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток растворяют в 2-пропаноне и превращают в соль хлористо-водородной кислоты. Осадок отфильтровывают и сушат с получением 1,16 г соединения (215) (Тпл. 184 С). Пример В.29. При комнатной температуре к смеси соединения (87) (0,0083 моль) в Ацн (100 мл) добавляют 2-бензофуранкарбоксальдегид (0,00915 моль) и затем NaBH3CN (0,001 моль). При комнатной температуре добавляют уксусную кислоту (1,8 мл). Смесь перемешивают при комнатной температуре в течение 2 ч, выливают в 10% K2 СО 3 и экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают досуха. Остаток отбирают в метанол в 10 мл 2-пропанола/НСl (5N). Смесь перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель выпаривают досуха. Остаток отбирают в 10% K2 СО 3. Смесь экстрагируют ДХМ. Органический слой отделяют, сушат, фильтруют и выпаривают досуха. Остаток очищают хроматографией на колонке на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4OН, 95/5/0,2; 2-пропанон/СН 3 СN). Осадок фильтруют и сушат с получением 0,9 г соединения (236) (Тпл. 125 С). В табл.1-7 перечислены соединения, которые были получены с использованием процедур одного из указанных выше примеров. В приведенных таблицах сокращение .C2H2O4 обозначает этандиоатную соль. Таблица 1C.1. Желудочный тонус, измеряемый электронным баростатом у собак, находящихся в сознании. Желудочный тонус не может быть измерен манометрическими методами. Следовательно, для этой цели используют электронный баростат. Его применение позволяет проводить изучение физиологической картины и регуляции желудочного тонуса у собак в состоянии сознания и влияния исследуемых соединений на указанный тонус. Баростат состоит из системы впрыска воздуха, соединенной поливиниловой трубкой 14-French, имеющей двойной просвет, с ультратонкой слабой полиэтиленовой сумкой (максимальный объем: 700 мл). Вариации в желудочном тонусе измеряют посредством записи изменения объема воздуха внутри внутрижелудочной сумки, поддерживаемой при постоянном давлении. Баростат поддерживает постоянное давление (выбранное заранее) в наполненной воздухом сумке, вводимой в желудок, и изменения объема воздуха внутри сумки с помощью электронной системы с обратной связью. Таким образом, баростат позволяет измерять моторную активность желудка (сокращение или релаксацию) как изменения внутрижелудочного объема (уменьшения или увеличения, соответственно) при постоянном внутрижелудочном давлении. Баростат состоит из тензодатчика, соединенного через электронное реле с системой инъекции-аспирации воздуха. И тензодатчик, и инъекционная система соединены с помощью поливиниловой трубки с двойным просветом с ультратонкой полиэтиленовой сумкой. Циферблат в баростате позволяет выбирать уровень давления, поддерживаемый внутри внутрижелудочной сумки.
МПК / Метки
МПК: A61P 1/06, C07D 471/04, A61K 31/55
Метки: релаксанты, бензимидазола, аналоги, фундальные, замещенные, гомопиперидильные
Код ссылки
<a href="https://eas.patents.su/30-5851-zameshhennye-gomopiperidilnye-analogi-benzimidazola-kak-fundalnye-relaksanty.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные гомопиперидильные аналоги бензимидазола как фундальные релаксанты</a>
Предыдущий патент: Каталитические композиции для полимеризации и способы получения полимеров и бимодальных полимеров
Следующий патент: Пирроло[2,3-d]пиримидины
Случайный патент: Неводные суспензии, снижающие сопротивление течению углеводородов в трубопроводах












