Производные бензимидазола
Номер патента: 2305
Опубликовано: 28.02.2002
Авторы: Дитон Дэвид Норман, Дрэч Джон Чарльз, Фриимэн Джордж Андрю, Таунсэнд Лирой Б., Андерсен Марк В., Бойд Фрэнк Лесли, Дэлудж Сьюзан Мэри, Чемберлен Стенли Дэйвс
Формула / Реферат
1. Соединение формулы (I)
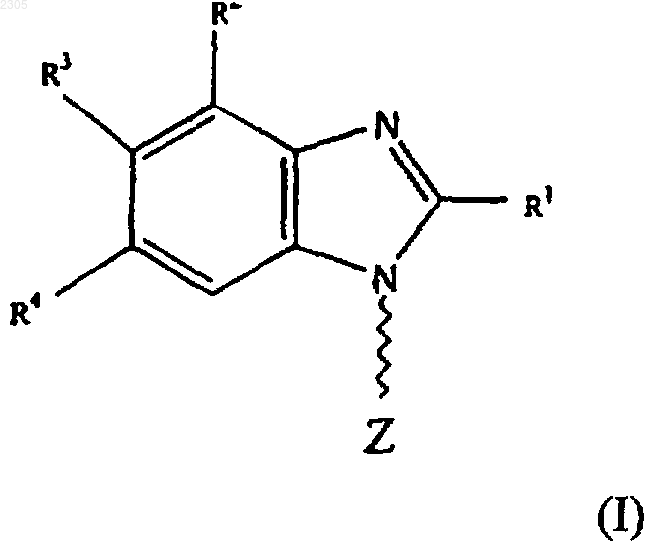
где R1 - галоген, гидроксильная, азидная, С1-8алкильная, C1-8алкоксильная, С2-6алкенильная, С2-6алкинильная, С6-14арилС2-6алкенильная, С6-14арилС2-6алкинильная группа или группа -NR19R20 (где R19 и R20 могут быть одинаковыми или различными и представляют собой водород, С1-8алкильную, цианоС1-8алкильную, гидроксиС1-8алкильную, галоидС1-8алкильную, С3-7циклоалкильную, С1-8алкилС3-7циклоалкильную, С2-6алкенильную, С3-7циклоалкилС1-8алкильную, С2-6алкинильную, С6-14арильную, С6-14арилС1-6алкильную, гетероциклическиС1-8алкильную, С1-8алкилкарбонильную, С6-14арилсульфонильную группу или R19R20 вместе с атомом N, к которому они присоединены, образуют 3-, 4-, 5- или 6-членное гетероциклическое кольцо), OR21 (где R21 - водород, С1-8алкильная, гидроксиС1-8алкильная, С3-7циклоалкильная или С6-14 арильная группа), или группа -SR22 (где R22 - водород, С1-8алкильная, гидроксиС1-8алкильная, С3-7циклоалкильная или С6-14арильная группа);
R2 - галоген или водород;
R3 и R4 могут быть одинаковыми или различными и представляют собой водород, галоген, С1-8алкильную, С6-14арильную, гетероциклическиС6-14арильную, C1-8алкоксильную, галоидС1-8алкильную группу или группу -SR24 (где R24 - водород, С1-8алкильная, С6-14арильная или С6-14арилС1-8алкильная группа);
Z - заместитель формулы (Iа) или (Ib)
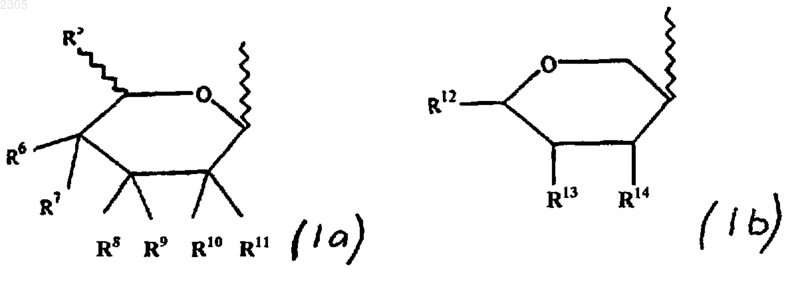
где R5 - водород, С1-8алкильная, галоидС1-8 алкильная или C1-8алкоксильная группа;
R6 - водород, галоген, гидроксильная, С1-8алкильная, гидроксиС1-8 алкильная, галоидС1-8алкильная или С1-8алкоксильная группа;
R7 - водород, галоген, гидроксильная, С1-8алкильная, гидроксиС1-8алкильная, галоид-С1-8алкильная, С1-8алкоксильная группа или R6 и R7 совместно образуют кетонную или алкеновую группу;
R8-R11 могут быть одинаковыми или различными и представляют собой водород, галоген, гидроксильную, С2-8алкильную, гидроксиС1-8алкильную, галоидС1-8алкильную, С1-8алкоксильную группу или любая пара групп R8 и R9 или R10 и R11 совместно образуют кетонную или алкеновую группу;
R12-R14 могут быть одинаковыми или различными и представляют собой водород, гидроксильную, С1-8алкильную или гидроксиС1-8алкильную группу;
или фамацевтически приемлемая соль, сложный эфир или соль сложного эфира, при условии, что соединением формулы (I) не может являться 2,5-диметил-1-(2,3,4-три-O-ацетил-b-D-ксилопиранозил)-1Н-бензимидазол и 5,6-диметил-1-(2,3,4-три-О-ацетил-b-D-арабинопиранозил)бензимидазол-2-тион;
а также при условии, что, если Z является заместителем формулы (Iа), то
a) ни один из заместителей R2, R3 и R4 не может представлять собой водород и
b) R1 не может представлять собой -NR19R20, где R19 и R20 вместе с атомом N, к которому они присоединены, образуют 5-членное гетероциклическое кольцо, содержащее атом S, а также при условии, что, если Z является заместителем формулы (Ib), то
a) R1 не может представлять собой -NR19R20, где R19 и R20 вместе с атомом N, к которому они присоединены, образуют 5-членное гетероциклическое кольцо, содержащее атом S.
2. Соединение формулы (II)
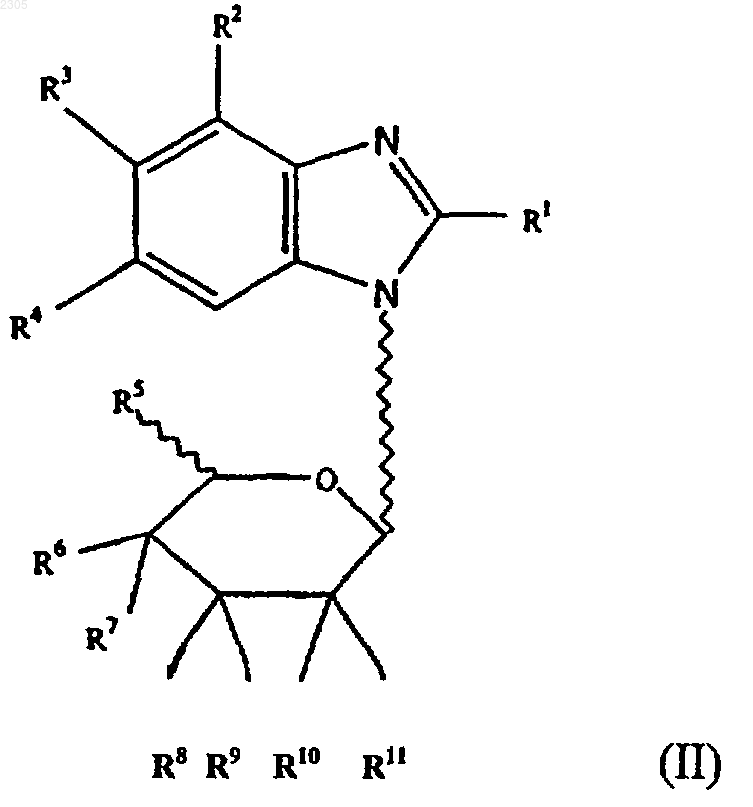
где R1 - галоген, гидроксильная, азидная, С1-8 алкильная, C1-8алкоксильная, С2-6алкенильная, С2-6алкинильная, С6-14арилС2-6алкенильная, С6-14арилС2-6алкинильная группа или группа -NR19R20 (где R19 и R20 могут быть одинаковыми или различными и представляют собой водород, С1-8алкильную, цианоС1-8алкильную, гидроксиС1-8алкильную, галоидС1-8алкильную, С3-7циклоалкильную, С1-8алкилС3-7циклоалкильную, С2-6алкенильную, С3-7циклоалкилС1-8алкильную, С2-6алкинильную, С6-14арильную, С6-14арилС1-6алкильную, гетероциклическиС1-8алкильную, С1-8алкилкарбонильную, С6-14арилсульфонильную группу или R19R20 вместе с атомом N, к которому они присоединены, образуют 3-, 4-, 5- или 6-членное гетероциклическое кольцо), OR21 (где R21 - водород, С1-8алкильная, С3-7циклоалкильная или С6-14арильная группа), или группу -SR22 (где R22 - водород, С1-8алкильная, гидроксиС1-8алкильная, С3-7циклоалкильная или С6-14арильная группа);
R2 - галоген или водород;
R3 и R4 могут быть одинаковыми или различными и представляют собой водород, галоген, С1-8алкильную, С6-14арильную, гетероциклическиС6-14арильную, С1-8алкоксильную, галоидС1-8алкильную группу или группу -SR24 (где R24 - водород, С1-8алкильная, С6-14арильная или С6-14арилС1-8алкильная группа);
R5 - водород, С1-8алкильная, галоидС1-8 алкильная, С1-8алкоксильная группа;
R6 - водород, галоген, гидроксильная, С1-8 алкильная, гидроксиС1-8алкильная, галоид С1-8 алкильная, С1-8алкоксильная группа;
R7 - водород, галоген, гидроксильная, С1-8 алкильная, гидроксиС1-8 алкильная, галоидС1-8 алкильная, С1-8алкоксильная группа или R6 и R7 совместно образуют кетонную или алкеновую группу;
R8-R11 могут быть одинаковыми или различными и представляют собой водород, галоген, гидроксильную, С2-8алкильную, гидрокси С1-8алкильную, галоидС1-8алкильную, С1-8алкоксильную группу или любая пара групп R8 и R9 или R10 и R11 совместно образуют кетонную или алкеновую группу;
или фармацевтически приемлемая соль, сложный эфир или соль сложного эфира, при условии, что соединением формулы (II) не может являться 2,5-диметил-1-(2,3,4-три-О-ацетил-b-D-ксилопиранозил)-1Н-бензимидазол и 5,6-диметил-1-(2,3,4-три-О-ацетил-b-D-арабинопиранозил)бензимидазол-2-тион;
а также при условии, что
a) ни один из заместителей R2, R3 и R4 не может представлять собой водород и
b) R1 не может представлять собой -NR19R20, где R19 и R20 вместе с атомом N, к которому они присоединены, образуют 5-членное гетероциклическое кольцо, содержащее атом S.
3. Соединение формулы (III)
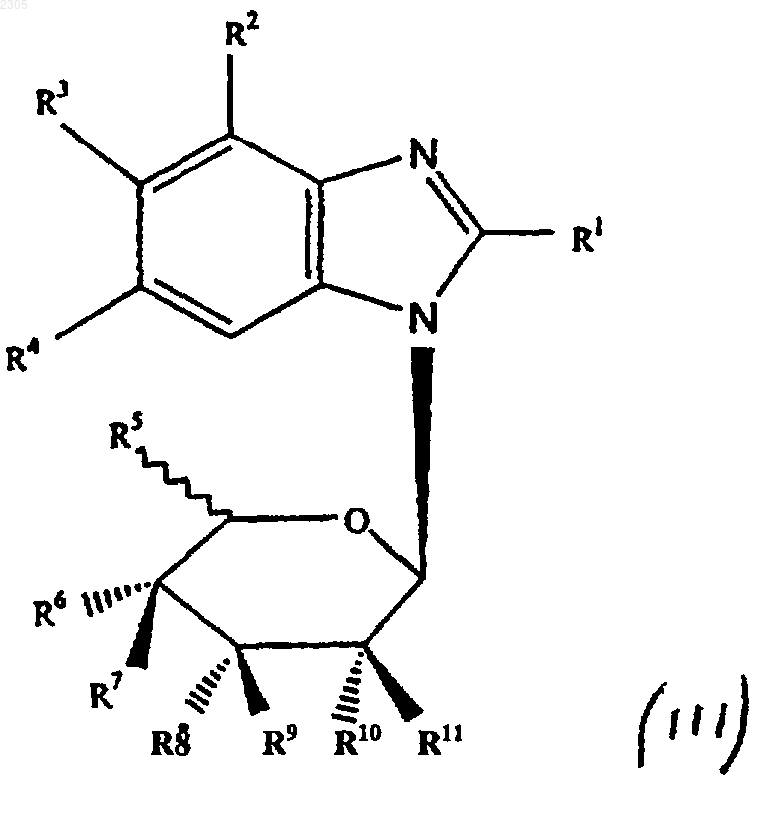
где R1 - галоген, гидроксильная, азидная, С1-8алкильная, С1-8алкоксильная, С2-6алкенильная, С2-6aлкинильная, С6-14арилС2-6алкенильная, С6-14арилС2-6алкинильная группа или группа -NR19R20 (где R19 и R20 могут быть одинаковыми или различными и представляют собой водород, С1-8алкильную, цианоС1-8алкильную, гидрокси С1-8алкильную, галоидС1-8алкильную, С3-7циклоалкильную, С1-8алкилС3-7циклоалкильную, С2-6алкенильную, С3-7циклоалкилC1-8алкильную, С2-6алкинильную, С6-14арильную, С6-14арилС1-6алкильную, гетероциклическиC1-8алкильную, С1-8алкилкарбонильную, С6-14арилсульфонильную группу или R19R20 вместе с атомом N, к которому они присоединены, образуют 3-, 4-, 5- или 6-членное гетероциклическое кольцо), OR21 (где R21 - водород, С1-8алкильная, С3-7циклоалкильная или С6-14арильная группа), или группу -SR22 (где R22 - водород, С1-8алкильная, гидроксиС1-8алкильная, С3-7циклоалкильная или С6-14арильная группа);
R2 - галоген или водород;
R3 и R4 могут быть одинаковыми или различными и представляют собой водород, галоген, С1-8алкильную, С6-14арильную, гетероциклическиС6-14арильную, C1-8алкоксильную, галоидС1-8алкильную группу, или группу -SR24 (где R24 - водород, C1-8алкильная, С6-14арильная или С6-14арилС1-8алкильная группа);
R5 - водород, C1-8алкильная, галоидС1-8 алкильная, С1-8алкоксильная группа;
R6 - водород, галоген, гидроксильная, С1-8 алкильная, гидроксиС1-8алкильная, галоидС1-8алкильная, С1-8алкоксильная группа;
R7 - водород, галоген, гидроксильная, C1-8 алкильная, гидроксиС1-8алкильная, галоидС1-8алкильная, С1-8алкоксильная группа или R6 и R7 совместно образуют кетонную или алкеновую группу;
R8-R11 могут быть одинаковыми или различными и представляют собой водород, галоген, гидроксильную, С2-8алкильную, гидроксиС1-8алкильную, галоидС1-8алкильную, C1-8алкоксильную группу или любая пара групп R8 и R9 или R10 и R11 совместно образуют кетонную или алкеновую группу;
или фармацевтически приемлемая соль, сложный эфир или соль сложного эфира,
при условии, что соединением формулы (III) не может являться 2,5-диметил-1-(2,3,4-три-O-ацетил-b-D-ксилопиранозил)-1Н-бензимидазол и 5,6-диметил-1-(2,3,4-три-O-ацетил-b-D-арабинопиранозил)бензимидазол-2-тион;
а также при условии, что
a) ни один из заместителей R2, R3 и R4 не может представлять собой водород и
b) R1 не может представлять собой -NR19R20, где R19 и R20 вместе с атомом N, к которому они присоединены, образуют 5-членное гетероциклическое кольцо, содержащее атом S.
4. Соединение формулы (I)

где Z - заместитель формулы (Iа) или (Ib)
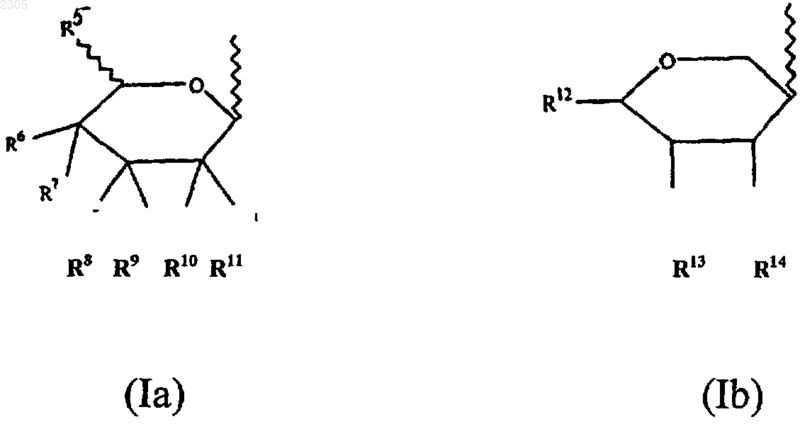
и где R1 - галоген; R2 - водород; R3 и R4 - галогены; R5 и R7 - водороды; R6 - гидроксильная группа или водород; R8 и R10 - гидроксильные группы; R9 и R11 - водороды; R12 - водород, С1-8 алкоксильная или гидроксиС1-8алкильная группа; R13 - гидроксильная группа; R14 - представляет собой водород или гидроксильную группу; или фамацевтически приемлемая соль, сложный эфир или соль сложного эфира.
5. Соединение формулы (II)
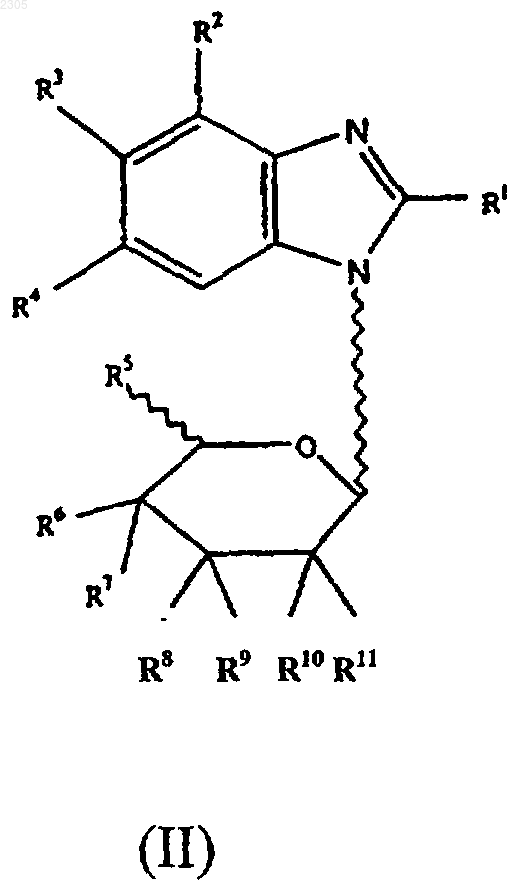
где R1 - галоген; R2 - водород; R3 и R4 - галогены; R5 и R7 - водороды; R6 - гидроксильная группа или водород; R8 и R10 - гидроксильные группы; R9 и R11 - водороды; или фаpмацевтически приемлемая соль, сложный эфир или соль сложного эфира.
6. Соединение формулы (III)
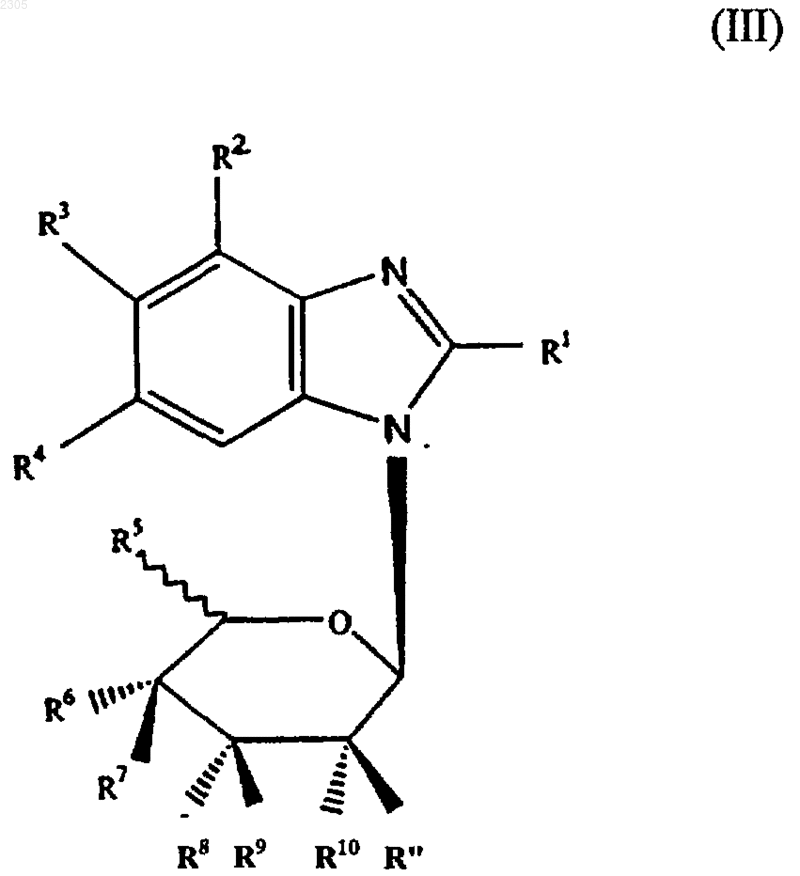
где R1 - галоген; R2 - водород; R3 и R4 - галогены; R5 и R7 - водороды; R6 - гидроксильная группа или водород; R8 и R10 - гидроксильные группы; R9 и R11 - водороды; или фамацевтически приемлемая соль, сложный эфир или соль сложного эфира.
7. Соединение, выбранное из группы, включающей
(3S,4R,5R,6S)-2-Бром-5,6-дихлор-1-(тетрагидро-4,5-дигидрокси-6-(гидроксиметил)-2Н-пиран-3-ил)-1Н-бензимидазол;
(+)Транс-2-(2-бром-5,6-дихлор-1Н-бензимидазол-1-ил)циклогексанол;
(+)-(1R*,2S*,3R*)-3-(2-бром-5,6-дихлор-1Н-бензимидазол-1-ил)-1,2-циклогександиол;
2-бром-5,6-дихлор-1-b-D-рибопиранозил-1Н-бензимидазол;
5,6-дихлор-N-(1-метилэтил)-1-b-D-рибопиранозил-1Н-бензимидазол-2-амин;
2-бром-5,6-дихлор-4-фтор-1-b-D-рибопиранозил-1Н-бензимидазол;
2-бром-5,6-дихлор-1-(2,3,4-три-O-ацетил-b-D-рибопиранозил)-1Н-бензимидазол;
2-бром-5,6-дихлор-1-b-L-рибопиранозил-1Н-бензимидазол;
2-бром-6-хлор-5-метил-1-b-D-рибопиранозил-1Н-бензимидазол;
2-бром-5,6-дихлор-1-(4-дезокси-b-D-эритропентопиранозил)-1Н-бензимидазол;
и фаpмацевтически приемлемая соль, сложный эфир или соль сложного эфира.
8. Фармацевтическая композиция, включающая соединение, описанное в любом из пунктов от 1 до 7 совместно с его носителем, пригодным для фармацевтического применения.
9. Применение соединения по любому из пунктов от 1 до 7 для изготовления лекарственного препарата, предназначенного для лечения или профилактики вирусной инфекции.
10. Способ лечения вирусной инфекции животного, который заключается в лечении указанного животного эффективным с терапевтической точки зрения количеством соединения, описанного в любом из пунктов от 1 до 7.
11. Способ по п.10, отличающийся тем, что вирусная инфекция представляет собой герпесную вирусную инфекцию.
12. Способ по п.10, отличающийся тем, что вирусная инфекция представляет собой цитомегаловирусную инфекцию.
13. Способ по п.10, отличающийся тем, что вирусная инфекция представляет собой инфекцию вируса гепатита В.
14. Соединение формулы (XI)
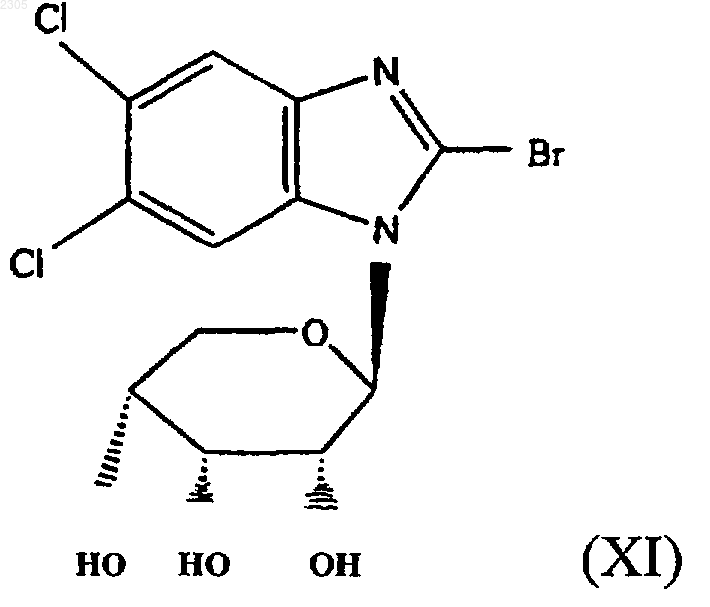
или фармацевтически приемлемая соль, сложный эфир или соль сложного эфира.
15. 2-Бром-5,6-дихлор-1-b-D-рибопиранозил-1Н-бензимидазол или фамацевтически приемлемая соль, сложный эфир или соль сложного эфира.
16. Фармацевтическая рецептура, включающая 2-бром-5,6-дихлор-1-b-D-рибопиранозил-1H-бензимидазол совместно с его носителем, пригодным для фармацевтического применения.
17. Применение соединения по п.14 или 15 для изготовления лекарственного препарата, предназначенного для лечения или профилактики вирусной инфекции.
18. Споёюс лечения или предотвращения симптомов или эффектов вирусной инфекции у инфицированного животного, который заключается в лечении указанного животного эффективным с терапевтической точки зрения количеством соединения, описанного в п.14 или 15.
19. Способ по п.18, отличающийся тем, что вирусная инфекция представляет собой герпесную вирусную инфекцию.
20. Способ по п.18, отличающийся тем, что вирусная инфекция представляет собой цитомегаловирусную инфекцию.
Текст
1 Область применения изобретения Настоящее изобретение относится к некоторым производным бензимидазола и их применению для лекарственного лечения, в особенности для лечения и профилактики вирусных инфекций, таких как инфекции, вызванные вирусами герпеса. Настоящее изобретение также относится к изготовлению производных бензимидазола и фармацевтических препаратов, содержащих эти производные. Предпосылки изобретения Из ДНК-содержащих вирусов вирусы группы герпеса являются источником большинства распространенных вирусных заболеваний человека. В эту группу входят вирусы простого герпеса типов 1 и 2 (HSV), вирус Varicella Zoster(VZV), цитомегаловирус (CMV), вирус Эпштейна-Бара (EBV), вирус герпеса человека типа 6 (HHV-6) и вирус герпеса человека типа 7(HHV-7) и типа 8 (HHV-8). HSV-1 и HSV-2 являются одними из самых распространенных возбудителей инфекции человека. Большинство из этих вирусов способны существовать в нервных клетках хозяина; после первоначального инфицирования пациенты подвержены риску рецидивных клинических проявлений инфекции, что может оказаться физически и психологически болезненным. Инфицирование с помощью HSV часто характеризуется обширными и ослабляющими поражениями кожи, рта и/или половых органов. Первоначальное инфицирование пациента может протекать бессимптомно, хотя и склонно протекать в более тяжелой форме, чем у пациентов, уже подвергавшихся инфицированию этим вирусом. Инфицирование глаз с помощьюHSV может привести к кератиту или катаракте,тем самым подвергая опасности зрение человека. Инфицирование новорожденных, пациентов с ослабленным иммунитетом или проникновение инфекции в центральную нервную систему может оказаться смертельным.VZV - это вирус герпеса, который вызывает ветряную оспу и опоясывающий лишай. Ветряная оспа - это первичное заболевание, возникающее у инфицированного человека, не обладающего иммунитетом, и у детей раннего возраста оно обычно является легким заболеванием, характеризуемым везикулезной сыпью и лихорадкой. Опоясывающий лишай или опоясывающий герпес - это возвратная форма заболевания, наблюдающаяся у взрослых, которые ранее были инфицированы с помощью VZV. Клиническое проявление опоясывающего лишая характеризуется невралгией и везикулезной сыпью на коже, которая появляется с одной стороны на поверхности кожи. Распространение воспаления может привести к параличу и судорогам. Если поражены оболочки мозга - может возникнуть коматозное состояние. VZV является весьма опасным для пациентов, принимающих иммунодепрессанты при трансплантации 2 или при лечении злокачественной неоплазии, и представляет собой опасное осложнение для пациентов, страдающих СПИДом, поскольку их иммунная система нарушена. Аналогичной случаям других вирусов герпеса, инфицирование с помощью CMV приводит к пожизненной связи вируса и организмахозяина. Врожденное заболевание, вызванноеCMV человека (HCMV), характеризуется желтухой, гепатоспленомегалией, петехиальной сыпью и дисфункцией различных органов, а также связывается с длительными осложнениями, такими как потеря слуха и умственная отсталость. Инфекция может вызвать воспаление сетчатки, которое может привести к слепоте или, при менее тяжелых формах, нарушениям зрения, а также к восприимчивости по отношению к инфекциям грудной клетки и ушей. Инфицирование с помощью CMV пациентов с недоразвитой иммунной системой или пациентов,у которых она ослаблена, например, вследствие злокачественной опухоли, лечения иммунодепрессантами после трансплантации или вследствие инфицирования вирусом иммунодефицита человека, может привести к воспалению сетчатки, колиту, воспалению пищевода, гепатиту,менингоэнцефалиту, пневмонии, заболеваниям желудочно-кишечного тракта и заболеваниям нервной системы. Кроме того, эти синдромы заболевания, вызванного CMV, могут повлиять на пациентов, иммунная система которых не ослаблена. Основным заболеванием, вызываемымEBV, является острый или хронический мононуклеоз (болезнь Пфейффера). К примерам других заболеваний, вызываемых EBV или сопутствующих инфицированию с помощью EBV,относятся лимфопролиферативные заболевания,которые часто возникают у лиц с врожденным или приобретенным клеточным иммунодефицитом, Х-сцепленное лимфопролиферативное заболевание, которое встречается именно у детей раннего возраста, сопутствующие инфицированию с помощью EBV В-клеточные опухоли,болезнь Ходжкинса, рак носоглотки, лимфома Беркитта, не-ходжкинская В-клеточная лимфома, опухоли вилочковой железы и волосистая лейкоплакия полости рта. Также обнаружено,что инфицирование с помощью EBV сопутствует различным опухолям, возникшим из эпителиальных клеток верхних и нижних дыхательных путей, включая легкие. Показано, что HHV-6 является причиной детской краснухи (infantum subitum) и отторжения почки и интерстициальной пневмонии у лиц, которым соответственно проведена пересадка почки и костного мозга, и ей могут сопутствовать другие заболевания, такие как рассеянный склероз. Также имеются данные об уменьшении количества стволовых клеток у пациентов, которым пересажен костный мозг. Этиология заболеваний при инфицировании с помо 3 щью HHV-7 не установлена. HHV-8 связывался с возникновении рака. Вирус гепатита В (HBV) является патогеном, широко распространенным по всему миру. Этот вирус этиологически связан с первичным гепатоцеллюлярным раком и считается причиной 80% встречающихся в мире случаев заболеваний раком печени. Клинические последствия инфицирования с помощью HBV проявляются в головной боли, лихорадке, недомогании, тошноте, рвоте, анорексии и болях в животе. Репликация вируса обычно управляется с помощью иммунного ответа, при этом процесс выздоровления у человека длится недели или месяцы,однако, инфекция может оказаться более серьезной и привести к стойкому хроническому заболеванию печени, описанному выше. В патентах Великобритании 682960,690119 и 696952 раскрыты гликозиды бензимидазола, используемые в качестве промежуточных продуктов при синтезе лекарственных препаратов. Мочалин и др. (Авт. свид. СССР; Журнал органической химии, 12 (1), 58 - 63 (1976 описали синтез некоторых незамещенных пиранозидов бензимидазола. Gosselin et al. (AntiviralChem. Chemother. 5 (4), 243-56, 1994) раскрыли некоторые 5,6-дихлорбензимидазоларабинопиранозильные соединения, обладающие противовирусной активностью. Townsend et al. (Chemical Reviews, vol. 70 no. 3, 1970) раскрыли некоторые 1-гликозилбензимидазолы. В патенте США 5585394 раскрыты производные 1-бензолсульфонил-1,3-дигидро-2 Н-бензимидазол-2-она,которые обладают сродством к вазопрессиновым и окситоциновым рецепторам. В Европейском патенте 0521463 А 2 описаны некоторые аналоги циклогексанона, предназначенные для борьбы с вирусами и паразитами. Подробное описание изобретения В настоящее время показано, что некоторые производные бензимидазола, содержащие 6-членные циклы, применимы для лечения и профилактики вирусных инфекций. В соответствии с первой особенностью настоящего изобретения предлагаются соединения формулы (I)R1 - это галоген, гидроксильная, азидная,С 1-8 алкильная, С 1-8 алкоксильная, C2-6 алкенильная, С 2-6 алкинильная, С 6-14 арилС 2-6 алкенильная,С 6-14 арилС 2-6 алкинильная группа или группа-NR19R20 (где R19 и R20 могут быть одинаковыми или различными и представляют собой водород,С 1-8 алкильную, цианоС 1-8 алкильную, гидроксиС 1-8 алкильную, галоидС 1-8 алкильную, С 3 С 1-8 алкилС 3-7 циклоалкиль 7 циклоалкильную, 002305 4 ную, С 2-6 алкенильную, С 3-7 циклоалкилС 1-8 алкильную, С 2-6 алкинильную, С 6-14 арильную, С 6-14 арилС 1-6 алкильную,гетероциклическиС 1-8 алкильную, С 1-8 алкилкарбонильную, С 6-14 арилсульфонильную группу или R19R20 вместе с атомом N, к которому они присоединены, образуют 3-, 4-, 5- или 6-членное гетероциклическое кольцо), OR21 (где R21 - это водород, С 1-8 алкильная, гидроксиС 1-8 алкильная, С 3-7 циклоалкильная или С 6-14 арильная группа), или группа -SR22 (гдеR2 - это галоген или водород;R3 и R4 могут быть одинаковыми или различными и представляют собой водород, галоген, С 1-8 алкильную, С 6-14 арильную, гетероциклическиС 6-14 арильную, C1-8 алкоксильную, галоидС 1-8 алкильную группу или группу -SR24 (гдеZ - это заместитель формулы (Ia) или (Ib)R7 - это водород, галоген, гидроксильная,С 1-8 алкильная, гидроксиС 1-8 алкильная, галоид С 1-8 алкильная, С 1-8 алкоксильная группа или R6 иR7 совместно образуют кетонную или алкеновую группу;R8 - R11 могут быть одинаковыми или различными и представляют собой водород, галоген, гидроксильную, С 2-8 алкильную, гидрокси С 1-8 алкильную, галоидС 1-8 алкильную, С 1-8 алкоксильную группу или любая пара групп R8 и R9 или R10 и R11 совместно образуют кетонную или алкеновую группу;R12-R18 могут быть одинаковыми или различными и представляют собой водород, гидроксильную, С 1-8 алкильную или гидроксиС 1-8 алкильную группу; или их производные, пригодные для фармацевтического применения,при условии, что соединением формулы (I) не может являться 2,5-диметил-1-(2,3,4-три-ОацетилD-ксилопиранозил)-1 Н-бензимидазол и 5,6-диметил-1-(2,3,4-три-O-ацетилD-арабинопиранозил)бензимидазол-2-тион; а также при условии, что, если Z является заместителем формулы (Iа), тоa) ни один из заместителей R2, R3 и R4 не может представлять собой водород иb) R1 не может представлять собой 19 20-NR R , где R19 и R20 вместе с атомом N, к ко 5 торому они присоединены, образуют 5-членное гетероциклическое кольцо, содержащее атом S,а также при условии, что если Z является заместителем формулы (Ib), тоa) R1 не может представлять собой 19 20-NR R , где R19 и R20 вместе с атомом N, к которому они присоединены, образуют 5-членное гетероциклическое кольцо, содержащее атом S,а также при условии, что, если Z является заместителем формулы (Iс), тоa) если все R15-R18 представляют собой водород, то R1 не может представлять собой гидроксильную, аминную группу и группу -SR22,где R22 представляет собой Н иb) R1 не может представлять собой 19 20-NR R , где R19 и R20 вместе с атомом N, к которому они присоединены, образуют 5-членное гетероциклическое кольцо, содержащее атом S. Особенно предпочтительные группы R1 включают галоген и -NR19R20, где R19 - это водород иR20 - это С 1-8 алкильная (в особенности C1-3 алкильная, причем особенно предпочтительной является изопропильная группа), С 3-7 циклоалкильная (особенно предпочтительной является циклопропильная группа), С 1-8 алкилС 3-7 циклоалкильная или С 3-7 циклоалкилС 1-8 алкильная группа. В некоторых особенно предпочтительных соединениях R2 - это водород. Особенно предпочтительные группы R3 и R4 включают водород, галоген (особенно предпочтительным является хлор) и С 1-8 алкоксильная группа (в особенности C1-3 алкоксильная, причем особенно предпочтительной является метоксигруппа). В некоторых особенно предпочтительных соединенияхR3 или R4 или обе эти группы, предпочтительно обе, представляют собой хлор. В некоторых особенно предпочтительных соединениях R5 - это водород. Особенно предпочтительные заместители при R6-R18 включают водород, гидроксильную,С 1-8 алкильную (в особенности C1-3 алкильную,причем особенно предпочтительными являются метильная и этильная группы) и гидроксиС 18 алкильную группу (в особенности гидроксиС 13 алкильную, причем особенно предпочтительной является гидроксиметильная группа). Предпочтительными соединениями формулы (I) являются соединения, в которых Z является заместителем формулы (Iа). Другими предпочтительными соединениями формулы (I) являются соединения, в которыхZ является заместителем формулы (Ib). В соответствии с другой особенностью настоящего изобретения предлагаются соединения формулы (II)R1 - это галоген, гидроксильная, азидная,С 1-8 алкильная, С 1-8 алкоксильная, С 2-6 алкенильная, С 2-6 алкинильная, С 6-14 арилС 2-6 алкенильная,С 6-14 арилС 2-6 алкинильная группа или группа-NR19R20 (где R19 и R20 могут быть одинаковыми или различными и представляют собой водород,С 1-8 алкильную, цианоС 1-8 алкильную, гидрокси С 1-8 алкильную, галоидС 1-8 алкильную, С 3-7 циклоалкильную,С 1-8 алкилС 3-7 циклоалкильную,С 2-6 алкенильную, С 3-7 циклоалкилС 1-8 алкильную,С 2-6 алкинильную, С 6-14 арильную, С 6-14 арилС 1-6 алкильную,гетероциклическиС 1-8 алкильную,С 1-8 алкилкарбонильную, С 6-14 арилсульфонильную группу или R19R20 вместе с атомом N, к которому они присоединены, образуют 3-, 4-, 5 или 6-членное гетероциклическое кольцо), OR21R2 - это галоген или водород;R3 и R4 могут быть одинаковыми или различными и представляют собой водород, галоген, С 1-8 алкильную, С 6-14 арильную, гетероциклическиС 6-14 арильную, C1-8 алкоксильную, галоидС 1-8 алкильную группу, или группу -SR24 (гдеR7 - это водород, галоген, гидроксильная,С 1-8 алкильная, гидроксиС 1-8 алкильная, галоид С 1-8 алкильная, С 1-8 алкоксильная группа или R6 иR7 совместно образуют кетонную или алкеновую группу;R8-R11 могут быть одинаковыми или различными и представляют собой водород, галоген, гидроксильную, С 2-8 алкильную, гидроксиС 1-8 алкильную, галоидС 1-8 алкильную, С 1-8 алкоксильную группу или любая пара групп R8 и R9 или R10 и R11 совместно образуют кетонную или алкеновую группу; или их производные, пригодные для фармацевтического применения, при условии, что соединением формулы (II) не может являться 2,5-диметил-1-(2,3,4-три-О-ацетилD-ксилопиранозил)-1 Н-бензимидазол и 5,6-диметил-1(2,3,4-три-O-ацетилD-арабинопиранозил) ензимидазол-2-тион; тогдаa) ни один из заместителей R2, R3 и R4 не может представлять собой водород иb) R1 не может представлять собой 19 20 7 Предпочтительной реализацией настоящего изобретения являются соединения формулыR1 - галоген, гидроксильная, азидная, С 18 алкильная, С 1-8 алкоксильная, С 2-6 алкенильная,С 2-6 алкинильная, С 6-14 арилС 2-6 алкенильная, С 6 группа или группа 14 арилС 2-6 алкинильная-NR19R20 (где R19 и R20 могут быть одинаковыми или различными и представляют собой водород,С 1-8 алкильную, цианоС 1-8 алкильную, гидроксиС 1-8 алкильную, галоидС 1-8 алкильную, С 3-7 циклоалкильную, С 1-8 алкилС 3-7 циклоалкильную,С 2-6 алкенильную, С 3-7 циклоалкилС 1-8 алкильную,С 2-6 алкинильную, С 6-14 арильную, С 6-14 арилС 1-6 алкильную,гетероциклическиС 1-8 алкильную,С 1-8 алкилкарбонильную, С 6-14 арилсульфонильную группу или R19R20 вместе с атомом N, к которому они присоединены, образуют 3-, 4-, 5 или 6-членное гетероциклическое кольцо), OR21R3 и R4 могут быть одинаковьми или различными и представляют собой водород, галоген, С 1-8 алкильную, С 6-14 арильную, гетероциклическиС 6-14 арильную, C1-8 алкоксильную, галоидС 1-8 алкильную группу, или группу -SR24 (гдеR7 - водород, галоген, гидроксильная, С 1-8 алкильная, гидроксиС 1-8 алкильная, галоидС 1-8 алкильная, С 1-8 алкоксильная группа или R6 и R7 совместно образуют кетонную или алкеновую группу;R8-R11 могут быть одинаковыми или различными и представляют собой водород, галоген, гидроксильную, С 2-8 алкильную, гидроксиС 1-8 алкильную, галоидС 1-8 алкильную,С 1-8 алкоксильную группу или любая пара групп R8 и R9 или R10 и R11 совместно образуют кетонную или алкеновую группу; или их производные, пригодные для фармацевтического применения, 002305(III) не может являться 2,5-диметил-1-(2,3,4-триO-ацетилD-ксилопиранозил)-1H-бензимидазол и 5,6-диметил-1-(2,3,4-три-O-ацетилDарабинопиранозил)-бензимидазол-2-тион; тогдаa) ни один из заместителей R2, R3 и R4 не может представлять собой водород иb) R1 не может представлять собой 19 20-NR R , где R19 и R20 вместе с атомом N, к которому они присоединены, образуют 5-членное гетероциклическое кольцо, содержащее атом S. Предпочтительными соединениями формул (I), (II) и (III) являются такие, в которыхR6 - гидроксильная группа или водород;R12 - водород, C1-8 алкильная или гидроксиС 1-8 алкильная группа;R14-R18 могут быть одинаковыми или различными и представляют собой водород или гидроксильную группу; или их производные, пригодные для фармацевтического применения. Предпочтительным соединением формулы Соединения формулы (I), включая соединения формул (II) и (III) приведенные выше, и их производные, пригодные для фармацевтического применения, далее будут называться соединениями, соответствующими настоящему изобретению. Соединения, соответствующие настоящему изобретению, содержат один или большее количество асимметричных атомов углерода и по этой причине встречаются в виде рацематов и рацемических смесей, отдельных энантиомеров, диастереоизомерных смесей и отдельных диастереоизомеров. Все такие изомерные формы этих соединений явно включены в настоящее изобретение. Каждый асимметрический атом углерода может находиться в R или S конфигурации. Хотя конкретные соединения, приведенные в качестве примера в настоящей заявке, могут быть изображены в конкретной стереохимической конфигурации, также имеются в виду соединения, обладающие любой противоположной стереохимической конфигурацией на любом данном хиральном центре, а также их смеси. 9 В рамках своего объема настоящее изобретение включает все возможные - и аномерные формы соединений формулы (I) и их обладающие физиологическим воздействием функциональные производные, практически не содержащие другой аномерной формы, т.е. содержащие другую аномерную форму в количестве не более примерно 5% в отношении масса/масса. Предпочтительными являются соединения формулы (I) в -аномерной форме. Предпочтительные соединения, соответствующие настоящему изобретению, включают:-(1R,2S,3R)-3-(2-бром-5,6-дихлор 1 Н-бензимидазол-1-ил)-1,2-циклогександиол; 2-Бром-5,6-дихлор-1D-рибопиранозил 1 Н-бензимидазол; 5,б-Дихлор-N-(1-метилэтил)-1D-рибопиранозил-1 Н-бензимидазол-2-амин; 2-Бром-5,6-дихлор-4-фтор-1D-рибопиранозил-1 Н-бензимидазол; 2-Бром-5,6-дихлор-1-(2,3,4-три-O-ацетил-D-рибопиранозил)-1 Н-бензимидазол; 2-Бром-5,6-дихлор-1L-рибопиранозил 1 Н-бензимидазол; 2-Бром-6-хлор-5-метил-1D-рибопиранозил-1 Н-бензимидазол; 2-Бром-5,6-дихлор-1-(4-дезоксиDэритропентопиранозил)-1 Н-бензимидазол; 2-Бром-5,6-дихлор-1-(-L-рибопиранозил)1 Н-бензимидазол; 2-Бром-5,6-дихлор-1-(-L-ксилопиранозил)-1 Н-бензимидазол; 2-Бром-5,6-дихлор-1-(2-дезоксиDэритропентопиранозил)-1 Н-бензимидазол; и их производные, пригодные для фармацевтического применения. Термин "алкильная группа", используемый по отдельности или совместно с любым другим термином, относится к линейному или обладающему разветвленной цепью насыщенному алифатическому углеводородному радикалу,содержащему указанное количество атомов углерода, или, если их количество не указано,предпочтительно от 1 до 10, а более предпочтительно от 1 до 6 атомов углерода. Примеры алкильных радикалов включают (но не ограничиваются только ими) метальный, этильный, нпропильный, изопропильный, н-бутильный,изобутильный, втор-бутильный, трет-бутильный, пентильный, изоамильный, н-гексильный и т.п., причем предпочтительными являются метильный и этильный. Термин "алкенильная группа", используемый по отдельности или совместно с любым другим термином, относится к линейному или 10 обладающему разветвленной цепью моно- или полиненасыщенному алифатическому углеводородному радикалу, содержащему указанное количество атомов углерода, или, если их количество не указано, предпочтительно от 2 до 10, а более предпочтительно от 2 до 6 атомов углерода. Указания на алкенильные группы подразумевают группы, которые могут находиться в Еили Z-форме, или их смесь, и которые, если они содержат не менее трех атомов углерода, могут быть разветвленными. Примеры алкенильных радикалов включают (но не ограничиваются только ими) этенильный, Е- и Z-пропенильный,изопропенильный, Е- и Z-бутенильный, Е- и Zизобутенильный, Е- и Z-пентенильный, Е- и Zгексенильный, Е,Е-, E,Z-, Z,E- и Z,Z-гексадиенильные и т. п. Термин "алкинильная группа" относится к линейным или обладающим разветвленной цепью углеводородным группам, содержащим одну или большее количество тройных углеродуглеродный связей, которые могут располагаться на любом устойчивом участке цепи, таким как этинильный, пропинильный, бутинильный,пентинильный и т. п. Термин "алкоксильная группа" относится к алкилэфирному радикалу,причем термин "алкильная группа" определен выше. Примеры алкоксильных радикалов включают (но не ограничиваются только ими) метоксильный, этоксильный, н-пропоксильный, изопропоксильный, н-бутоксильный, изобутоксильный, втор-бутоксильный, трет-бутоксильный и т.п, причем предпочтительным является метоксильный. Алкенильные и алкинильные заместители также могут содержать один или большее количество гетероатомов, таких как атомы азота,серы и кислорода. Термин "арильная группа", используемый по отдельности или совместно с любым другим термином, относится к карбоциклическому ароматическому радикалу (такому как фенильный и нафтильный), содержащему указанное количество атомов углерода, предпочтительно от 6 до 14 атомов углерода, а более предпочтительно от 6 до 10 атомов углерода, которые могут содержать один или большее количество заместителей, выбранных из группы, включающей С 1-6 алкоксильную (например, метоксильную), галоген (например, хлор), нитро-, амино-, карбоксильную и гидроксильную группы. Примеры арильных радикалов включают (но не ограничиваются только ими) фенильный, нафтильный,инденильный, инданильный, азуленильный,флуоренильный, антраценильный и т.п. Термин "гетероцикл" и "гетероциклический радикал", если в настоящей заявке не указано иного, означает стабильное 3-7-членное гетероциклическое кольцо или 8-11-членное бициклическое гетероциклическое кольцо, которое является насыщенным или ненасыщенным и, если оно моноциклическое, может быть 11 сконденсировано с бензольным кольцом. Каждый гетероцикл содержит один или большее количество атомов углерода и от одного до трех гетероатомов, выбранных из группы, включающей атомы азота, кислорода и серы. В соответствии с использованием в настоящей заявке термины "гетероатомы азот и сера" означают любую окисленную форму азота и серы и четвертичную форму любого основного атома азота. Гетероциклический радикал может быть присоединен к любому эндоциклическому атому углерода или гетероатому, так чтобы образовывалась стабильная структура. Предпочтительными гетероциклами являются 5-7-членные гетероциклы и 8-10-членные бициклические гетероциклы. Примеры таких групп включают имидазолильную, имидазолиноильную, имидазолидинильную, хинолильную, изохинолильную, индолильную, индазолильную, индазолиноильную, пергидропиридазильную, пиридазильную, пиридильную, лирролильную, пирролинильную, пирролинидильную, пиразолильную, пиразинильную, хиноксолильную, пиперидинильную, пиранильную, пиразолинильную,пиперазинильную, пиримидинильную, пиридазинильную, морфолильную, тиаморфолильную,фурильную, тиенильную, триазолильную, тиазолильную, карболинильную, тетразолильную,тиазолидинильную, бензофураноильную, тиаморфолинилсульфоновую, оксазолильную, бензоксазолильную, оксопиперидинильную, оксопирролидинильную, оксоазепинильную, азепинильную, изоксозолильную, изотиазолильную,фуразанильную, тетрагидропиранильную, тетрагидрофуранильную, тиазолильную, тиадиазоильную, диоксолильную, диоксинильную, оксатиолильную, бензодиоксолильную, дитиолильную, тиофенильную, тетрагидротиофенильную,сульфоланильную, диоксанильную, диоксаланильную, тетрагидрофуродигидрофуранильную,тетрагидропиранодигидрофуранильную, дигидропиранильную, тетрагидрофурофуранильную и тетрагидропиранофуранильную группы. Предпочтительные гетероциклы включают имидазолильную, пирролильную, пирролинильную, пиперидинильную, пиперазинильную и морфолинильную группы. Термин "галоген" относится к фторидному, хлоридному, бромидному или йодидному радикалам. Термин "галоидС 1-8 алкильная группа" означает С 1-8 алкильную группу, в которой один или большее количество атомов водорода замещено на галоген, и предпочтительно содержащую одну, две или три галогенидные группы. Примеры таких групп включают трифторметильную и фторизопропильную группы. Термин "количество, эффективнее с фармацевтической точки зрения", относится к количеству, эффективному при лечении пациента с вирусной инфекцией, например, инфицирования с помощью CMV или HBV, проводимого посредством одного лекарственного препарата 12 или в комбинации с другими средствами. Термин "лечение", используемый в настоящей заявке, означает частичное снятие симптомов конкретного заболевания пациента или улучшение соответствующих измеряемых характеристик конкретного заболевания и может включать подавление симптомов рецидива у бессимптомного пациента, такого как пациент, у которого вирусная инфекция стала скрытой. Термин "количество, эффективное с профилактической точки зрения", относится к количеству, эффективному для предотвращения вирусной инфекции, например, инфицирования с помощью CMV илиHBV, или предотвращения появления у пациента симптомов такой инфекции. Термин "пациент", используемый в настоящей заявке, означает млекопитающее, в том числе человека. Термин "носитель или вспомогательный лекарственный препарат, пригодный для фармацевтического применения", относится к носителю или вспомогательному лекарственному препарату, который можно назначить пациенту совместно с соединением, соответствующим настоящему изобретению, и который не препятствует проявлению фармакологической активности указанного соединения и является нетоксичным при назначении в дозах, достаточных для переноса количества противовирусного агента, оказывающего лечебное воздействие. Используемое в настоящей заявке определение соединения, соответствующего настоящему изобретению, включает его производные,пригодные для фармацевтического применения,или пролекарства. Термины "производное, пригодное для фармацевтического применения" и"пролекарство, пригодное для фармацевтического применения" означают любую пригодную для фармацевтического применения соль, сложный эфир, соль сложного эфира или другое производное соединения, соответствующего настоящему изобретению, которое при назначении реципиенту способно образовывать (прямо или косвенно) соединение, соответствующее настоящему изобретению, или обладающий ингибирующей активностью его метаболит или остаток. Особенно предпочтительными производными и пролекарствами являются такие, которые увеличивают биодоступность соединений,соответствующих настоящему изобретению,когда такие соединения назначаются млекопитающим (например, для вводимого перорально соединения обеспечение более быстрого попадания в кровь), или которые усиливают передачу исходного соединения в определенную область тела (например, в мозг или лимфатическую систему). Соединения, соответствующие настоящему изобретению, можно использовать в виде солей, полученных из неорганических или органических кислот. В число таких солей входят, в частности, следующие: ацетат, адипат, альгинат,аспартат, бензоат, бензолсульфонат, бисульфат, 13 бутират, цитрат, камфорат, камфорсульфонат,циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, флюкогептаноат, глицерофосфат, гемисульфат, гептаноат,гексаноат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат,метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, памоат, пектианат, персульфат,фенилпропионат, пикрат, пивалат, пропионат,сукцинат, тартрат, тиоцианат, тозилат и ундеканоат. Пригодные для фармацевтического применения соли соединений, соответствующих настоящему изобретению, включают соли, полученные из пригодных для фармацевтического применения неорганических и органических кислот и оснований. Примеры подходящих кислот включают хлористо-водородную, бромисто-водородную, серную, азотную, хлорную,фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-п-сульфоновую, винную, уксусную, лимонную, метансульфоновую, этансульфоновую,муравьиную, бензойную, малоновую, нафталин 2-сульфоновую и бензолсульфоновую кислоты. Другие кислоты, такие как щавелевая, которые сами непригодны для фармацевтического применения, можно использовать при получении солей, применимых в качестве промежуточных продуктов при получении соединений, соответствующих настоящему изобретению, и их кислых солей, пригодных для фармацевтического применения. Соли, полученные из подходящих оснований, включают соли щелочного металла (например, натрия), щелочно-земельного металла(например, магния), аммония и N-W+4 (где W это С 1-4 алкильная группа). Пригодные с физиологической точки зрения кислые соли и соли аммония включают соли органических карбоновых кислот, таких как уксусная, молочная, винная, яблочная, малеиновая, изотионовая, лактобионовая, п-аминобензойная и янтарная кислоты; органических сульфоновых кислот, таких как метансульфоновая, этансульфоновая, бензолсульфоновая и п-толуолсульфоновая кислоты, и неорганических кислот, таких как хлористо-водородная, серная, фосфорная, сульфаминовая кислоты. Пригодные с физиологической точки зрения соли соединения с гидроксильной группой включают анион указанного соединения в комбинации с подходящим катионом, таким как Nа+, NH4+ и NW4+ (где W - это С 1-4 алкильная группа). Пригодные для фармацевтического применения соли включают соли органических карбоновых кислот, таких как аскорбиновая, уксусная, лимонная, молочная, винная,яблочная, малеиновая, изотионовая, лактобионовая, п-аминобензойная и янтарная; органических сульфоновых кислот, таких как метансульфоновая, этансульфоновая, бензолсульфоновая и п-толуолсульфоновая, и неорганических 14 кислот, таких как хлористо-водородная, серная,фосфорная, сульфаминовая и пирофосфорная кислоты. Чтобы являться пригодными для терапевтического применения, соли соединений, соответствующих настоящему изобретению, должны быть пригодными для фармацевтического применения. Однако соли кислот и оснований,которые непригодны для фармацевтического применения, могут все же использоваться, например, при получении или очистке соединения, пригодного для фармацевтического применения. Предпочтительные соли включают соли хлористо-водородной, серной, уксусной, янтарной, лимонной и аскорбиновой кислот. Предпочтительные сложные эфиры соединений, соответствующих настоящему изобретению, включают эфиры, независимо выбранные из следующих групп: (1) сложные эфиры карбоновых кислот, полученные этерификацией гидроксильных групп, в которых некарбонильный фрагмент участка карбоновой кислоты сложноэфирной группы выбран из числа групп, включающих линейную или разветвленную алкильную (например, ацетильную, н-пропильную,трет-бутильную и н-бутильную группы), алкоксиалкильную (например, метоксиметильную группу), арилалкильную (например, бензильную группу), арилоксиалкильную (например, феноксиметильную группу), арильную (например,фенильную группу, которая может содержать заместители, например, галоген, C1-4 алкильную или С 1-4 алкоксильную или аминогруппу); (2) сложные эфиры сульфоновых кислот, такие как алкил- или арилалкилсульфонильный (например, метансульфонильный); (3) сложные эфиры аминокислот (например, L-валильный или Lизолейцильный); (4) фосфонатные сложные эфиры и (5) моно-, ди- и трифосфатные сложные эфиры. Фосфатные сложные эфиры могут быть дополнительно этерифицированы, например, с помощью С 1-20 спирта или его реакционноспособного производного, или с помощью 2,3-ди(С 6-24) ацилглицерина. В таких сложных эфирах, если не указано иного, предпочтительно, чтобы алкильный фрагмент содержал от 1 до 18 атомов углерода,более предпочтительно от 1 до 6 атомов углерода, а еще более предпочтительно от 1 до 4 атомов углерода. Предпочтительно, чтобы любой циклоалкильный фрагмент, присутствующий в таких сложных эфирах, содержал от 3 до 6 атомов углерода. Предпочтительно, чтобы любой арильный фрагмент, присутствующий в таких сложных эфирах, представлял собой фенильную группу. Предпочтительные сложныe эфиры карбоновых кислот и соединений, соответствующих настоящему изобретению, включают ацетатные,бутиратные и валератные сложные эфиры. Особенно предпочтительным сложным эфиром аминокислоты является L-валильный. 15 Любая ссылка на любое из вышеуказанных соединений также означает и ссылку на его соли, пригодные для фармацевтического применения. В соответствии с еще одной особенностью настоящего изобретения предлагаются соединения, соответствующие настоящему изобретению и предназначенные для применения при лекарственном лечении, в особенности для лечения и профилактики вирусных инфекций, таких как герпесные вирусные инфекции. Показано, что соединения, соответствующие настоящему изобретению, способны обладают активностью при инфицировании с помощью CMV, хотя первоначальные результаты показали, что эти соединения могут также обладать активностью при инфицировании другими герпесными вирусными инфекциями, такими как HSV-1, HSV-2,HHV-6, 7 и 8, VZV и EBV, а также при инфицировании с помощью HBV. Другие вирусные заболевания, которые можно лечить в соответствии с настоящим изобретением, рассмотрены выше во введении. Соединения, соответствующие настоящему изобретению, особенно хорошо подходят для лечения и профилактики инфекций, вызванныхCMV и сопутствующих заболеваний. Примеры заболеваний, вызванных CMV, которые можно лечить в соответствии с настоящим изобретением, рассмотрены выше во введении. В соответствии с другой особенностью, в настоящем изобретении предложен способ лечения или предотвращения симптомов и воздействия вирусной инфекции на инфицированное животное, например, млекопитающее, в том числе человека, который состоит в лечении указанного животного с помощью оказывающего лечебное воздействие количества соединения,соответствующего настоящему изобретению. В соответствии с конкретным способом реализации этой особенности настоящего изобретения,вирусная инфекция представляет собой герпесную вирусную инфекцию, такую как CMV,HSV-1, HSV-2, VZV, EBV, HHV-6, HHV-7 иHHV-8. Другая особенность настоящего изобретения включает способ лечения или предотвращения симптомов и воздействия инфекцииHBV. Соединения, соответствующие настоящему изобретению, также можно использовать при вспомогательной терапии для лечения при инфицировании посредством HIV (вирус иммунодефицита человека) или сопутствующих HIV симптомов и заболеваний, например, саркомы Капоши. В настоящем изобретении также предложен способ лечения клинического проявления патологических состояний животного, например млекопитающего, в том числе человека, причем эти патологические состояния включают состояния, рассмотренные во введении выше, заключающийся в лечении указанного животного 16 с помощью эффективного с терапевтической точки зрения количества соединения, соответствующего настоящему изобретению. Настоящее изобретение также включает способ лечения или профилактики любых из вышеуказанных инфекций и патологических состояний. Еще одна особенность настоящего изобретения - это применение соединения, соответствующего настоящему изобретению, при изготовлении лекарственного препарата, предназначенного для лечения или профилактики любых из вышеуказанных вирусных инфекций или патологических состояний. Вышеуказанные соединения, соответствующие настоящему изобретению, и их пригодные для фармацевтического применения производные можно использовать для лечения вышеуказанных инфекций и патологических состояний. Комплексное лечение, соответствующее настоящему изобретению, включает прием не менее одного соединения, соответствующего настоящему изобретению, и не менее одного другого агента, обладающего фармакологической активностью. Это активное соединение(соединения) и агенты, обладающие фармакологической активностью, можно назначать одновременно в одной или разных фармацевтических рецептурах или последовательно в любом порядке. Количества активного соединения (соединений) и агента (агентов), обладающего фармакологической активностью, и режим приема выбирают так, чтобы достичь желаемого комплексного лечебного эффекта. Предпочтительно, чтобы комплексное лечение включало прием одного соединения, соответствующего настоящему изобретению, и одного агента, указанного ниже. Примеры таких дополнительных лечебных агентов включают агенты, которые эффективны при лечении вирусных инфекций или сопутствующих патологических состояний, такие как(2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]тетрагидро-3-фураниловый сложный эфир (141W94), аналоги оксатиоланового нуклеозида, такие как (-)-цис-1-[(2-гидроксиме 17 тил)-1,3-оксатиолан-5-ил]цитозин (ламивудин) или цис-1-[(2-гидроксиметил)-1,3-оксатиолан-5 ил)-5-фторцитозин (FTC), 3'-дезокси-3'-фтортимидин,5-хлор-2',3'-дидезокси-3'-фторуридин,(-)-цис-4-[2-амино-6-(циклопропиламино-9 Нпурин)-9-ил]-2-циклопентен-1-метанол, рибавирин, 9-[4-гидрокси-2-(гидроксиметил)бут-1-ил]гуанин (H2G), ингибиторы тирозинаминотрансферазы, такие как 7-хлор-5-(2-пиррил)-3 Н-1,4 бензодиазепин-2-(Н)он (Ro5-3335), 7-хлор-1,3 дигидро-5-(1 Н-пиррол-2-ил)-3 Н-1,4-бензодиазепин-2-амин (Ro24-7429), интерфероны, такие как -интерферон, ингибиторы процесса выделения почками, такие как пробенецид, ингибиторы переноса нуклеозидов, такие как дипиридамол; пентоксифиллин,N-ацетилцистеин(NAC), процистеин, -трихозантин, фосфономуравьиная кислота, а также иммуномодулирующие средства, такие как интерлейкин II и тимозин, колониестимулирующие факторы макрофагов гранулоцитов, эритропоетин, растворимый CD4 (антигенный маркер хелперных Тлимфоцитов) и его производные, полученные с помощью генной инженерии и ненуклеозидные ингибиторы обратной транскриптазы (NNRTI),такие как невипарин (BI-RG-587), ловирид (АРА) и делавуридин (ВНАР), и фосфономуравьиная кислота, и 1,4-дигидро-2 Н-3,1-бензоксазин-2-оновые производные NNRTI, такие как(L743, 746 или DMP-266) и хиноксалиновые производные NNRTI, такие как изопропил-(2S)-7 фтор-3,4-дигидро-2-этил-3-оксо-1(2 Н)-хиноксалинкарбоксилат(НВY1293). Более предпочтительно, чтобы комплексное лечение включало прием одного из вышеуказанных агентов и соединения, входящего в одну из предпочтительных или особенно предпочтительных подгрупп, охарактеризованных выше и описываемых формулой (I). Наиболее предпочтительно, чтобы комплексное лечение включало совместное применение одного из вышеназванных агентов совместно с одним из соединений формулы (I), особо указанным в настоящей заявке. Настоящее изобретение дополнительно включает применение соединения, соответствующего настоящему изобретению, при изготовлении лекарственного препарата, предназначенного для одновременного или последовательного назначения с хотя бы одним лечебным агентом, таким как описанные выше. В соответствии с еще одной особенность настоящего изобретения предложен способ лечения или профилактики рестеноза путем назначения соединения, соответствующего настоящему изобретению. Рестеноз представляет собой сужение кровеносных сосудов, которое может произойти после повреждения стенки сосуда, например, 002305 18 повреждения, вызванного баллонной ангиопластикой или другим оперативным методом, и которое характеризуется избыточной пролиферацией гладких мышечных клеток стенки оперированного сосуда. Рестеноз после ангиопластики (RFA) случается у пациентов, которых лечили от ишемической болезни сердца с помощью баллонной ангиопластики. Предполагается, что у многих пациентов, страдающих отRFA, вирусные инфекции, в особенности вызванные инфицированием с помощью CMV и/или HHV-6, играют основную роль в пролиферации гладких мышечных клеток оперированного сосуда. Рестеноз может возникнуть после применения различных оперативных методов, например, трансплантации, пересадки вен, коронарного шунтирования и, чаще всего, после ангиопластики. Ангиопластика - это оперативный метод,при котором артериосклеротическое сужение периферической, почечной и коронарной сосудистой сети расширяется путем сжатия и/или разрушения бляшки, находящейся на стенке сосуда, обычно с помощью расширяющегося баллонного катетера. К сожалению, в 25-50% случаев, в особенности в случае коронарной сосудистой сети, рестеноз оперированного сосуда происходит через несколько месяцев, так что операцию необходимо повторять. Методы,альтернативные применению баллонного катетера, такие как импульсные лазеры и транслюминальная ангиопластика с помощью вращающегося режущего катетера, разработаны для снижения и предотвращения рестеноза после ангиопластики, но применяются с ограниченным успехом. Также испытан ряд лекарственных препаратов, в том числе антикоагулянты и сосудорасширяющие средства, однако, полученные результаты являются разочаровывающими или сомнительными. В настоящее время имеются убедительные доказательства, полученные на основании исследований, проведенных in vitro и in vivo, показывающие, что рестеноз является многофакторным процессом. Различные цитокины и факторы роста при совместном воздействии стимулируют миграцию и пролиферацию гладких мышечных клеток сосудов (SMC) и выработку внеклеточного матричного материала, который накапливается и закупоривает кровеносный сосуд. В дополнение к этому супрессоры роста ингибируют пролиферацию SMC и выработку внеклеточного матричного материала. Настоящее изобретение дополнительно включает процесс изготовления соединений формулы (I) и их производных, пригодных для фармацевтического применения, состоящий из следующих стадий:A) Введения соединения формулы (I), где(NBS); или если R1 - это подходящий отщепляющийся атом или группа, например, атом галогена, такой как бром, или органический сульфон (например, алкилсульфон), или органический (например, алкил- или арилалкил-) сульфонат, такой как метилсульфон (MeS(О)2-), метилсульфонат (MeS(О)2 О-) или метилтозилат (4MePhS(О)2 О-), в реакцию с нуклеофильным агентом, таким как амины, алкоксиды, меткаптиды; илиB) Введения соединения формулы (IV), где R1 - водород, атом галогена, -NR19R20 и где R5-R18 - такие, как определено выше, a L это подходящая отщепляющаяся группа, например, галоген (например, фтор, хлор или бром),органическая сульфонилоксильная, алкил- или арилтиогруппа (например, фенилтиогруппа) или арильная или алифатическая сложноэфирная группа, такая как бензоат или ацетат, или метоксигруппа. Альтернативно, промежуточные продукты формул (Vb) и (Vc), где L - это аминогруппа, можно ввести в реакцию с подходящим ароматическим нитросоединением, как это описано в заявке WO 96/07646. После этого или одновременно с этим в любой желаемой или необходимой последовательности можно дополнительно осуществить следующие стадии:(i) удаления любой оставшейся защитной группы (групп);(ii) превращения соединения формулы (I) или его защищенной формы в другое соединение формулы (I) или его защищенную форму;(iii) превращения соединения формулы (I) или его защищенной формы в пригодное для фармацевтического применения производное соединения формулы (I) или его защищенную форму;(iv) превращения пригодного для фармацевтического применения производного соединения формулы (I) или его защищенной формы в соединение формулы (I) или его защищенную форму;(v) превращения пригодного для фармацевтического применения производного соединения формулы (I) или его защищенной формы в другое пригодное для фармацевтического 20 применения производное соединения формулы(I) или его защищенную форму;(vi) при необходимости выполнения разделения энантиомеров и диастереоизомеров соединения формулы (I) или его защищенной формы или пригодного для фармацевтического применения производного соединения формулы(I) с использованием методов, известных специалистам. А. Процесс А можно легко использовать для получения соединения формулы (I), где R1 это галоген. Такие соединения можно легко получить путем проведения реакции соединения формулы (I), где R1 - это водород и R5-R18 - такие, как определено выше, с галогенирующим агентом. Галогенирование можно провести обычным способом, например, бромирование - с использованием бромирующего агента, такого как N-бромсукцинимид (NBS) в апротонном растворителе, таком как тетрагидрофуран(THF), или предпочтительно 1,4-диоксан при нагревании до 60-150 С. Соединения формулы (I), где R1 - это 19 20-NR R (где R19 и R20 - такие, как определено выше), можно легко получить из соединений формулы (I), где R1 - атом галогена, такой как атом брома или хлора, путем проведения реакции с подходящим амином HNR19R20, где R19 иR20 - такие, как определено выше. Обычно реакцию проводят при повышенной температуре,70-80 С, в органическом растворителе, таком как этанол или диметилсульфоксид. Амины формулы HNR19R20 имеются в продаже или легко могут быть получены специалистом. Соединения формулы (I), где R1 - это -OR21(где R21 - такие, как определено выше), можно легко получить из соединений формулы (I), гдеR1 - это атом галогена, такой как атом брома или хлора, путем проведения реакции с подходящим спиртом формулы HOR21 (где R21 - такие, как определено выше). Обычно реакцию проводят при температуре от -20 до 100 С, предпочтительно при 25 С, используя HOR21 или диметилсульфоксид в качестве растворителя и в присутствии сильного основания, такого как гидрид натрия. Спирты формулы HOR21 имеются в продаже или легко могут быть получены специалистом. Соединения формулы (I), где R1 - это -SR22(где R22 - такие, как определено выше), можно легко получить из соединений формулы (I), гдеR1 - это атом галогена, такой как атом брома или хлора, путем проведения реакции с подходящим тиолом формулы HSR22 (где R22 - такие, как определено выше). Обычно реакцию проводят при температуре от -20 до 100 С, предпочтительно при 25 С, используя N,N-диметилформамид или диметилсульфоксид в качестве растворителя и в присутствии сильного основания, такого как гидрид натрия или калия. Тиолы формулыHOR22 имеются в продаже или легко могут быть получены специалистом. 21 Соединения формулы (I), где R3 или R4 это арильная или гетероциклическая группа, aR5-R18 - такие, как определено выше, можно получить из соединений формулы (I), где R3 илиR4 - это атом галогена, такой как атом брома,путем проведения реакции с реагентом - арильным или гетероциклическим производным триалкилолова (IV). Эти реакции обычно проводят в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладия (0),ацетат палладия (II) или бис(ацетонитрил) палладий (II) хлорид, также в присутствии растворителя, такого как N,N-диметилформамид, при повышенной температуре, предпочтительно при 90 С. Необходимый реагент - арильное или гетероциклическое производное триалкилолова(IV) - имеется в продаже или легко может быть получен специалистом. Защитные группы могут быть отщеплены обычными химическими методами, известными специалистам. Соединения формулы (I), где любой из R618R - это гидроксильная группа или R6-R11 - это гидроксильная группа или атом фтора, a R1-R5 такие, как определено выше, можно получить из соединений формулы (I), где любой из R6-R18 это защищенная гидроксильная группа или R6R11 - это защищенная гидроксильная группа или атом фтора. Для R6-R18 можно использовать обычные защитные группы. Также с успехом можно использовать сложноэфирные группы,такие как описанные выше для сложных эфиров соединения формулы (I). Эти защитные группы можно отщепить с помощью обычных химических методов, таких как обработка раствором карбоната натрия в воде или метаноле, или ферментативным путем, например, с помощью эстеразы печени свиньи. Альтернативно, R6-R18 могут включать силиловые эфиры, такие как трет-бутилдифенильный, трет-бутилдиметильный и триизопропилсилильный эфиры, от которых можно отщепить защитные группы с получением гидроксильных групп с использованием подходящего фторсодержащего реагента, например, HF/пиридин,Вu4NF, или Et4NF, или циклический ацеталь или кеталь, такой как бензилиденовый или изопропилиденовый, который можно удалить в кислой среде, например, с использованием п-толуолсульфокислоты и метанола. Альтернативно, соединения формулы (I),где любой из R6-R18 - это защищенная гидроксильная группа или R6-R11 - это защищенная гидроксильная группа или атом фтора и R2, R3,R4 и R5 - такие, как определено выше, можно ввести в реакцию с агентом или в условиях, при которых отщепляющаяся группа R1 превращается в необходимую группу R1 одновременно с отщеплением защитных групп. Примеры таких агентов включают циклопропиламин и другие первичные и вторичные амины, при условии что эти агенты обладают достаточной нуклеофиль 002305 22 ной реакционной способностью и не являются стерически заторможенными. В. Соединения формулы (I), где R1 - такие,как определено выше, можно получить по реакции соединений формулы (IV), где R1 - такие,как определено выше, и R2, R3 и R4 -такие, как определено выше, с соединениями формулы(V), где R5-R18 - такие, как определено выше, и защищены подходящими группами и L - такой,как описано выше. Реакцию соединений формулы (IV) с соединениями формулы (V) можно провести с использованием кислоты Льюиса,такой как триметилсилилтрифторметансульфонат, тетрахлорид олова или трифторид бора,первая является предпочтительной. Реакцию обычно проводят в апротонном растворителе при повышенной температуре, например, в ацетонитриле при 15-30 С или в 1,2-дихлорэтане при 70-90 С. Альтернативно, реакции соединений формулы (IV) с соединениями формулы (V) можно провести с использованием методик синтеза пиримидинового нуклеозида, как описанная и рекомендованная в работе Tohru Ueda in(Leroy В. Towsend, ed.) pp. 1-112, Plenum Press,New York, 1988, или синтеза пуринового нуклеозида, как описанная и рекомендованная в работе Prem С. Srivastva, Roland К. Robbins andRich В. Meyer, Jr., ibid, pp. 113-281, или синтеза пиранозного нуклеозида, как описанная и рекомендованная в работе Р. Herdewiijn, A. Van Aerschot, J. Balzarini and E De Clerq in Nucleosidesand Nucleotides, vol. 10, 1991, pp. 119-127 и в патенте США 5399580, которые включены в настоящее изобретение для ссылки. При проведении вышеописанных процедур для улучшения растворимости соединение формулы (IV) полезно триметилсилилировать в положение N1; например, путем обработки триметилсилилхлоридом,гексаметилдисилазаном или, что наиболее предпочтительно, N,Oбис(триметилсилил)ацетамидом (BSA). Силилирование можно провести в растворителе,предпочтительно в 1,2-дихлорэтане или ацетонитриле, предпочтительно при 70-80 С. После завершения реакции силилирования можно прибавить кислоту Льюиса, а затем соединение формулы (V). Соединение формулы (Va) можно приобрести, например, у фирмы Aldrich (Milwaukee,IL) или Pfanstiehl (Waukegan, IL) или получить методами, описанными в литературе и хорошо известными специалистам, например, в работахChem., 30 (1987), pp. 1521-1525. Соединения формулы (Va), где R5 - такие,как определено выше, и только один из R6-R11 представляет собой незащищенную гидроксильную группу и L - это метоксигруппа, можно подвергнуть деоксигенированию с помощью 23 фенилтиокарбоната, полученного по реакции указанной незащищенной гидроксильной группы с хлортиоформиатом, таким как фенилхлортиоформиат. Промежуточный тионокарбонат преобразуется с помощью восстановителя, такого как гидрид трибутилолова. Эту реакцию обычно проводят в присутствии инициатора радикальной реакции, например, 2,2'-азобисизобутиронитрила, и в присутствии ароматического растворителя, например, толуола. Затем этот промежуточный продукт в конечном счете можно превратить в соединение формулы (Va),в котором гидроксильные группы защищены путем превращения в сложноэфирные, например, ацетильные, путем реакции с кислотой,например, уксусной, и ацилирующим агентом,например, уксусным ангидридом. Эту реакцию обычно проводят в ацилирующем агенте, выступающим в роли растворителя, при температуре 0 - 100 С. Альтернативно, деоксигенирование можно провести, например, по методу, описанному в работе Р. Collins and R. Ferrier inYork, p. 213 и цитированная там литература. Фторированные соединения формулы (Va) можно получить методами, известными специалистам, например, по реакции незащищенной гидроксильной группы соединения формулы(Va) с фторирующим агентом, например, диэтиламинотрифторидом серы. Эту реакцию обычно проводят в апротонном растворителе, таком как хлороформ или толуол, и при повышенной температуре, предпочтительно 75 С. Фторированные и другие галогенированные дезоксисахара формулы (Va) можно также получить аналогично тому, как это предложено для сходных и иных углеводов в работе Р. Collins and R. Ferrierin Monosaccharides (1995), John WileySons,New York, pp. 248 - 262 и цитированной там литературе. Соединения формулы (Va), где R5 - такие,как определено выше, и только один из R6-R11 представляет собой незащищенную гидроксильную группу, можно окислить в кетоны методами, известными специалистам, например,методами, которые описаны и рекомендованы в работах R.C. Petter et al. in Tetrahedron Letters, 30Monograph 186 (1990), American Chemical Society, Washington D.C. Такие кетоны можно обработать подходящими реактивами Гриньяра или металлалкилами и углеродсодержащими нуклеофильными агентами, чтобы провести алкилирование и получить новое соединение формулы (Va), например, как это описано в работе Р.Collins and R. Ferrier in Monosaccharides (1995),John WileySons, New York, p. 3092 и цитированной там литературе. Кроме того, для получения олефинов формулы (Va) можно использовать реагенты Виттига, например, как это опи 002305 24 сано в работе Р. Collins and R. Ferrier, ibid, p. 263 и цитированной там литературе или как это описано в работе R.C. Petter et al. in Tetrahedron(Va). Кроме того, гидридные реагенты можно использовать для осуществления инверсии стереохимической конфигурации гидроксильной группы в R6-R11 описанного кетона с помощью методов, известных специалистам, и с помощью общепринятых методов восстановления карбонильной группы, как описанный в работе М.Monograph 188 (1996), American Chemical Society, Washington D.C., pp. 149-190. Соединения формулы (Vb) можно получить методами, известными специалистам. Соединения формулы (IV), где R1 - это водород или атом галогена, наиболее предпочтительно атом хлора или брома, и R2, R3 и R4 - такие, как определено выше, можно получить методами, изложенными в описании изобретения РСТ WО 92/07867, которое включено в настоящее изобретение для ссылки. Альтернативно,соединения формулы (IV), где R1 - водород или атом галогена, наиболее предпочтительно атом хлора или брома, и R2, R3 и R4 - такие, как определено выше, можно получить методами, которые описаны в работе Leroy Townsend et al., J.Med. Chem., Vol. 38, 1995, pg. 4098. Альтернативно, соединения формулы (IV),где R1 - это -NR19R20, где R19 и R20 - такие, как определено выше, можно получить по реакции соединения формулы (VI) где R2, R3 и R4 - такие, как определено выше, с агентом, который способен циклизовать диамин в бензимидазол. Обычно соединения формулы(VII) 19 где R - такие, как определено выше. Эту реакцию можно провести в присутствии агента,стимулирующего циклизацию, такого как метилйодид, или карбодиимида, такого как дициклогексилкарбодиимид или 1-циклогексил-3-(2 морфолиноэтил)карбодиимид-мето-п-толуолсульфонат в присутствии апротонного ароматического растворителя, такого как толуол, а наиболее предпочтительно пиридина и при повышенной температуре, предпочтительно 75150 С. 25 Соединения формулы (VII) можно получить методами, хорошо известными специалистам или легко доступными из химической литературы, или закупить. Соединения формулы (IV), где R1 - это водород, можно закупить или, альтернативно, получить по реакции соединения формулы (IV),где R2, R3 и R4 - такие, как определено выше, с формамидом или, наиболее предпочтительно, с муравьиной кислотой при температуре от температуры окружающей среды до 100 С, лучше всего при 80 С. Соединения формулы (VI) можно закупить или получить методами, хорошо известными специалистам или легко доступными из химической литературы. Альтернативно, соединения формулы (VI) можно получить из соединений формулы (VIII) где R2, R3 и R4 - такие, как определено выше, в присутствии восстанавливающего агента, например, восстановленного железа, и в присутствии кислоты, наиболее предпочтительно хлористо-водородной кислоты, и в присутствии растворителя, такого как этиловый спирт, и при температуре в диапазоне 50-78 С (В. Fox andT.L. Threlfall, Org. Syn. Coll. Vol. 5, 1973, p. 346). Альтернативно, такие ортофенилендиамины можно получить в присутствии восстанавливающего агента, такого как никель Ренея, также в присутствии водорода. Эту реакцию также проводят в присутствии растворителя, например, этилового спирта, при температуре окружающей среды (К. Dimroth, et al. Org. Syn. Coll.Vol. 5, 1973, p. 1130). Альтернативно, такие ортофенилендиамины можно получить в присутствии восстанавливающего агента, такого как гидросульфит натрия. Обычно эту реакцию проводят в присутствии полярного протонного растворителя, предпочтительно смеси воды с этанолом и при повышенной температуре, предпочтительно при кипячении с обратным холодильником. Соединения формулы (VIII) можно получить методами, хорошо известными специалистам или закупить. Альтернативно, соединения формулы (VIII), где R2 - это атом галогена, такой как атом фтора, хлора или брома, а R3 и R4 такие, как определено выше, можно получить из соединений формулы (VIII), где R2 - это водород, по реакции с подходящим галогенирующим агентом, таким как 1-фтор-1,4-диазониобицикло[2.2.2]октан-бис(тетрафторборат), N-хлорсукцинимид или N-бромсукцинимид, в присутствии апротонного растворителя, такого как ацетонитрил или N,N-диметилформамид, при повышенной температуре от 50 до 100 С.(VII), где R4 - это -SR24 (где R24 - такие, как определено выше), можно получить из соединений формулы (VIII), где R4 - это атом галогена, а R2 и R3 - такие, как определено выше, по реакции сHSR24. Эту реакцию обычно проводят в присутствии сильного основания, такого как гидрид натрия или калия, и в присутствии растворителя, такого как диметилсульфоксид или N,Nдиметилформамид, при температуре окружающей среды. Альтернативно, соединения формулы(VIII) легко можно получить из соединений формулы (IX) где R25 - это водород, R26 - это защитная группа,например, такая как амидная, трифторацетатная,а R2, R3 и R4 - такие, как определено выше, по реакции с нитрующим агентом, таким как азотная кислота. Эту реакцию проводят в растворителе, таком как серная кислота, при температуре от -20 до 25 С, наиболее предпочтительно при 0 С. Защитную группу легко удалить в конце последовательности реакции с помощью кислоты, например, 2 н. раствора серной кислоты, или основания, например, раствора карбоната натрия в метаноле и воде, при температурах 25100 С. Соединения формулы (IX), где R25 - это водород, R26 - это защитная группа, например,такая как амидная, трифторацетатная, а R2, R3 иR4 - такие, как определено выше, можно получить из соединений формулы (IX), где R25 - это водород, а R2, R3 и R4 - такие, как определено выше, по реакции с подходящим ацилирующим агентом, таким как трифторуксусный ангидрид. Эти реакции проводят в присутствии апротонного растворителя, такого как ацетонитрил,наиболее предпочтительно-1,4-диоксан, при температуре от -10 до 40 С, предпочтительно при 0 С. Альтернативно, соединения формулы(VIII), где R2, R3 и R4 - такие, как определено выше, можно получить из соединений формулы где R27 - это атом галогена, например, атом фтора или хлора, по реакции с аммиаком. Эти реакции обычно проводят в присутствии растворителя, такого как этиловый спирт или 1,4 диоксан, и при повышенных температурах,предпочтительно при 100 С. Соединения формулы (IX), где R25 и R26 это водород, а R2, R3 и R4 - такие, как определе 27 но выше, можно получить методами, хорошо известными специалистам, или методами, описанными в химической литературе, или закупить. Соединения формулы (X) можно закупить или получить методами, хорошо известными специалистам. Соединения формулы (I), где Z - это заместитель формулы (Ib), можно получить по схемеI или методом, известным специалистам. Схема (на примере ряда производных Dглюкозы) Обозначения: а) 5,6-дихлорбензимидазол 1 а, РРН 3, диэтилацетилендикарбосилат, тетрагидрофуран, 12 ч; b) 0,1 н. раствор НСl, тетрагидрофуран, при комнатной температуре, 12 ч; с) Ас 2 О, пиридин; d) 2 эквивалента Nбромсукцинимида, кипячение с обратным холодильником в тетрагидрофуране, 10 мин; е) 1 эквивалент Nа 2 СО 3, МеОН, EtOH, H2 О, 2 ч; f) трет-бутилдиметилсилилхлорид, имидазол, N,Nдимeтилфopмaмид; g) метансульфонилхлорид,триэтиламин, метиленхлорид, 0 С; h) 1,8 диазабицикло[5.4.0]ундец-7-ен, толуол, кипячение с обратньм холодильником, 10 ч; i) катализатор тетраоксид осмия, 4-метилморфолин-Nоксид, ацетон/Н 2 О, 12 ч; j) NH2-циклопропил,этанол, кипячение с обратным холодильником. Соединения формулы (I), где Z - заместитель формулы (Vb), можно получить методами,описанными в патенте США 5399580 или в патенте США 5534535, или в WО 96/07646,которые включены в настоящее изобретение для ссылки. Соединения, соответствующие настоящему изобретению и называемые здесь активными ингредиентами, при лечении можно принимать любым подходящим способом, включая пероральный, ректальный, носовой, местный (включая чрескожный, внутриротовой и подъязычный), вагинальный и парентеральный (включая подкожный, внутримышечный, внутривенный,внутрикожный и введение в стекловидное тело). Следует иметь в виду, что предпочтительный 28 способ меняется в зависимости от заболевания и возраста реципиента, природы инфекции и выбранного активного ингредиента. Обычно для лечения всех вышеуказанных патологических состояний используются дозы в диапазоне от 0,01 до 250 мг/кг массы тела реципиента (например, человека) в сутки, предпочтительно в диапазоне от 0,1 до 100 мг/кг массы тела в сутки, наиболее предпочтительно в диапазоне от 0,5 до 30 мг/кг массы тела в сутки, а в особенности в диапазоне от 1,0 до 20 мг/кг массы тела в сутки. Если не указано иного, все массы активного ингредиента приведены в расчете на исходное соединение формулы (I); для его солей и сложных эфиров массы должны быть пропорционально увеличены. Необходимую дозу можно предоставить в виде одной, двух,трех, четырех, пяти, шести или большего количества разделенных доз, принимаемых через соответствующие промежутки времени в течение суток. В некоторых случаях необходимые дозы можно принимать через сутки. Эти разделенные дозы можно принимать в виде разовых дозировочных форм, содержащих, например, от 10 до 1000 мг, или от 50 до 500 мг, предпочтительно от 20 до 500 мг, а наиболее предпочтительно от 100 до 400 мг активного ингредиента в разовой дозировочной форме. Если возможно принимать только активный ингредиент, то предпочтительно использовать его в виде лекарственной рецептуры. Рецептура, соответствующая настоящему изобретению, включает хотя бы один активный ингредиент, определенный выше, совместно с одним или большим количеством его носителей и,возможно, другими лекарственными средствами. Каждый носитель должен являться "пригодным" в том смысле, что он должен быть совместимым с другими компонентами рецептуры и не оказывать вредного воздействия на пациента. Рецептуры включают пригодные для перорального, ректального, носового, местного(включая подкожный, внутримышечный, внутривенный, внутрикожный и введение в стекловидное тело) приема. Эти рецептуры легко предоставить в виде разовой дозировочной формы и их можно изготовить с помощью любых способов, хорошо известных в фармацевтике. Такие способы представляют собой еще одну особенность настоящего изобретения и включают стадию связывания активных ингредиентов с носителем, который состоит из одного или большего количества вспомогательных ингредиентов. Обычно рецептуры готовят путем равномерного и тщательного связывания активных ингредиентов с жидкими носителями или с тонкоизмельченными твердыми носителями, или с теми и другими, с последующим формованием продукта, если это необходимо. 29 Настоящее изобретение дополнительно включает фармацевтическую рецептуру, определенную выше, в которой соединение формулы(I) или его производное, пригодное для фармацевтического применения, и не менее одного вспомогательного лекарственного препарата предоставляются по отдельности или в виде комплекта. Композиции; пригодные для чрескожного введения, могут быть представлены в виде небольших пластырей, пригодных для обеспечения тесного контакта с эпидермисом реципиента в течение длительного времени. Такие пластыри содержат активные соединения 1) в возможно содержащем буферную систему водном растворе или 2) растворенные и/или диспергированные в клее или 3) диспергированные в полимере. Подходящая концентрация активного соединения составляет примерно от 1 до 25%,предпочтительно от примерно 3 до 15%. Дополнительной возможностью является выведение активного соединения из пластыря посредством электропереноса и ионтофореза, как это описано в работе Pharmaceutical Research, 3(6), 318(1986). Рецептуры, соответствующие настоящему изобретению, пригодные для перорального приема, могут быть представлены в виде разовых форм, таких как капсулы, овальные таблетки с покрытием, облатки или таблетки, каждая из которых содержит заданное количеcтво активных ингредиентов; в виде порошка или гранул; в виде раствора или суспензии в воде или неводной жидкости; или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Активный ингредиент может быть также представлен в виде пилюль, электуария или пасты. Таблетка может быть изготовлена посредством прессования или формования, возможно с добавлением одного или более вспомогательных ингредиентов. Прессованные таблетки могут быть приготовлены прессованием в специальной машине активного ингредиента, находящегося в сыпучей форме, такой как порошок или гранулы, возможно дополнительно смешанного со связующим (например, поливинилпирролидоном, желатином, гидроксипропилметилцеллюлозой), смазывающим веществом, нейтральным разбавителем, консервантом, дезинтегрирующим агентом (например, комплексом гликолята натрия с крахмалом, сшитым поливинилпирролидоном, сшитой натрийкарбоксиметилцеллюлозой), поверхностно-активным или диспергирующим агентом. Формованные таблетки могут быть изготовлены путем формования в соответствующей машине смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Таблетки могут дополнительно обладать оболочкой или рисками и могут быть составлены так, чтобы обеспечить медленное или регулируемое выделение актив 002305 30 ного ингредиента путем введения, например,переменных количеств гидроксипропилметилцеллюлозы, обеспечивающих необходимый профиль выделения. Таблетки также могут быть снабжены энтеросолюбильным покрытием для обеспечения выделения в частях кишечника,исключая желудок. Рецептуры, пригодные для местного введения через полость рта, включают лепешки, в состав которых входят активный ингредиент во вкусовой основе, обычно сахарозе и камеди акации или траганте; пастилки, содержащие активный ингредиент в нейтральной основе,например, желатине и глицерине или сахарозе и камеди акации; и жидкости для промывания полости рта, в состав которых входит активный ингредиент в подходящем жидком носителе. Рецептуры для ректального введения могут быть представлены в виде суппозитория с подходящей основой, в состав которой входит,например, масло какао или салицилат. Рецептуры, пригодные для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или аэрозолей, содержащих в дополнение к активному ингредиенту такие носители, которые специалистами считаются приемлемыми для применения. Наиболее предпочтительно, чтобы фармацевтические рецептуры, пригодные для ректального введения, в которых носитель представляет собой твердое вещество, представляли собой разовые суппозитории. Подходящими носители включают масло какао и другие вещества, обычно используемые для этой цели. Суппозитории можно легко изготовить смешиванием комбинации активных веществ с размягченным или расплавленным носителем (носителями) с последующим охлаждением и формованием. Рецептуры, пригодные для парентерального введения, включают водные или неводные изотонические стерилизованные растворы для инъекций, которые могут содержать антиоксиданты, буферные растворы, антимикробные добавки и растворенные вещества, которые делают рецептуру изотонической с кровью реципиента,и стерильные водные и неводные суспензии,которые могут включать суспендирующие агенты и загущающие агенты, и липосомы и другие системы измельченных до микроскопического размера частиц, которые предназначены для подачи данного соединения в различные разделы кровеносной системы или к одному или большему количеству органов. Рецептуры могут быть представлены в виде разовой или многократной дозы в герметичных контейнерах, например, ампулах и флаконах, и могут храниться в виде продукта, подвергнутого сублимационной сушке (лиофилизации), к которому непосредственно перед применением необходимо лишь добавить стерильный жидкий носитель,например, воду для инъекций. Растворы и суспензии для инъекций, предназначенные для не 31 медленного введения, могут быть приготовлены из стерильных порошков, гранул и таблеток описанного выше типа. Предпочтительными рецептурами для разовой дозы являются такие, которые содержат суточную дозу или разделенную суточную дозу активных ингредиентов, описанных выше, или соответствующую долю активного ингредиента. Следует иметь ввиду, что в дополнение к ингредиентам, явно указанным выше, рецептуры, соответствующие настоящему изобретению,могут включать и другие агенты, обычно применяющиеся в данной области с учетом типа используемой рецептуры, например рецептуры,пригодные для перорального приема, могут включать такие дополнительные компоненты,как подсластители, загустители и вкусовые добавки. Следующие примеры приведены исключительно в иллюстративных целях и не предназначены для какого-либо ограничения сферы применения настоящего изобретения. Термин активный ингредиент, используемый в примерах,означает соединение формулы, соответствующей настоящему изобретению, или несколько таких соединений или физиологически активное функциональное производное любого из вышеуказанных соединений. Общие методики Общая методика I. Восстановление замещенных нитроанилинов в замещенные фенилендиамины. Соответствующий замещенный нитроанилин (115-145 ммоль), этанол и никель Ренея (7-8 г во влажном состоянии) (производства фирмыAldrich, Milwaukee) помещают в реактор Парра с мешалкой, в которой под давлением (200-300 пси 1,379-2,068 МПа, барометрическое) находится водород. Смесь перемешивают в течение ночи при комнатной температуре, после чего давление в реакторе сбрасывают и смесь фильтруют через целит (вид инфузорной земли) и растворители удаляют в вакууме, получая твердое вещество, пригодное для проведения реакции замыкания цикла в бензимидазол, как это описано в общей методике II. Общая методика II. Синтез замещенных бензимидазольных оснований из замещенных фенилендиаминов. К соответствующему замещенному фенилендиамину, растворенному в количестве 1 н. водного раствора НСl, достаточном для получения раствора концентрации 100 ммоль/л, прибавляют 1,25-1,3 эквивалента (в расчете на фенилендиамин) водного раствора муравьиной кислоты концентрации 88%. Полученный раствор кипятят с обратным холодильником в течение 3-18 ч, затем охлаждают до комнатной температуры и нейтрализуют до рН 7 по индикаторной бумаге с помощью водного раствора гидроксида натрия или гидроксида аммония. Образовавшееся твердое вещество отфильтро 002305 32 вывают на стеклянном пористом фильтре, промывают большим количеством воды, сушат на воздухе, а затем в вакууме при 50 С в течение 24 ч или дольше. Полученные таким образом бензимидазолы пригодны для сочетания с перацетилированной рибопиранозой. Общая методика III. Сочетание 2-бром-1 Нбензимидазолов или бензимидазолов, не содержащих заместителей в положении 2, с перацетилированными пиранозами. Соответствующий бензимидазол перемешивают с помощью магнитной мешалки в атмосфере азота в высушенной в сушильном шкафу круглодонной колбе с обратным холодильником, в которую помещен перемешивающий стержень, с безводным 1,2-дихлорэтаном (производства фирмы Aldrich, Milwaukee) или ацетонитрилом (производства фирмы Aldrich, Milwaukee). К перемешиваемой суспензии прибавляют 1 эквивалент (в расчете на бензимидазол)N,O-бис(триметилсилил)ацетамида и полученную смесь кипятят с обратным холодильником в течение 1-3 ч. Полученному раствору дают охладиться до комнатной температуры. К этому раствору прибавляют 1 эквивалент (в расчете на бензимидазол) перацетилированной пиранозы, а затем от 0,50 до 1,1 эквивалента (в расчете на бензимидазол) триметилсилилтрифторметансульфоната (производства фирмы Aldrich, Milwaukee) или от 1,4 до 5 эквивалентов (в расчете на бензимидазол) раствора тетрахлорида олова в дихлорметане концентрации 1 моль/л (производства фирмы Aldrich, Milwaukee). Эту новую смесь затем нагревают на масляной бане при температуре около 85 С в течение периода времени от 0,5 до 24 ч в зависимости от превращения исходного материала в продукт (продукты),устанавливаемого с помощью ТСХ (тонкослойная хроматография). Реакцию останавливают,выливая реакционную смесь в водный раствор бикарбоната натрия концентрации около 7%, и затем проводят экстракцию с помощью дихлорметана или этилацетата, пока продукт не перейдет из водного слоя. Органический слой сушат над сульфатом магния, фильтруют и растворитель удаляют с помощью роторного испарителя. Затем продукты подвергают дополнительной очистке путем хроматографии на колонке, заполненной силикагелем. Общая методика IV. Бромирование N-1 бензимидазолпиранозидов, не содержащих заместителей у атома С-2. Обычно бензимидазолпиранозиды, не содержащие заместителей у атома С-2, растворяют в количестве тетрагидрофурана (ТГФ), достаточном для получения раствора концентрации от 10 до 30 ммоль/л. Этот раствор кипятят на масляной бане в круглодонной колбе с обратным холодильником и магнитной мешалкой в атмосфере азота при температуре около 85 С. К кипящему с обратным холодильником раствору каждые 15 мин прибавляют 2 эквива 33 лента (в расчете на бензимидазолпиранозид) Nбромсукцинимида (NBS, производства фирмыAldrich, Milwaukee), пока по данным ТСХ не завершится бромирование исходного вещества. Реакцию останавливают, выливая реакционную смесь в холодный водный раствор бикарбоната натрия концентрации около 7%, и затем проводят экстракцию с помощью дихлорметана, пока продукт не перейдет из водного слоя. Дихлорметановый слой дополнительно промывают 4 эквивалентными объемами водного раствора бикарбоната натрия, а затем 1 объемом воды. Органический слой сушат над сульфатом магния, фильтруют и растворитель удаляют с помощью роторного испарителя. Затем продукты подвергают дополнительной очистке путем хроматографии на колонке, заполненной силикагелем. Общая методика V. Отщепление защитных групп от ацетилированных N-1 2-бромбензимидазолпиранозидов с помощью водного раствора гидроксида лития концентрации 1 моль/л Соответствующий ацетилированный N-1 2-бромбензимидазолпиранозид растворяют в количестве диоксана, достаточном для получения раствора концентрации от 100 до 200 ммоль/л. К этому раствору для отщепления защитных групп прибавляют 1,3 эквивалента (в расчете на ацетат) водного раствора LiOH концентрации 1 моль/л. Смесь перемешивают в течение периода времени от 0,25 до 1 ч, затем прибавляют количество фосфатного буферного раствора с рН 7 (производства фирмы VWR,West Chester), достаточное для получения раствора с нейтральной реакцией по индикаторной бумаге. Затем смесь экстрагируют с помощью этилацетата, пока по данным ТСХ продукт не перейдет из водного слоя. Этилацетатный слой промывают 1 эквивалентом воды, затем сушат над сульфатом магния, фильтруют и растворитель удаляют с помощью роторного испарителя. Затем продукты подвергают дополнительной очистке путем растирания твердого вещества в дихлорметане и отделения твердого вещества с помощью вакуумного фильтрования через стеклянный пористый фильтр. Общая методика VI. Отщепление защитных групп от ацетилированных N-1 2-бромбензимидазолпиранозидов с помощью раствора карбоната натрия в смеси этанол:метанол:вода состава 4:4:1. Каждые 100 мг соответствующего ацетилированного N-1 2-бромбензимидазолпиранозида растворяют в 4 мл метанола, а затем прибавляют эквивалентный объем этанола. Для отщепления защитных групп к этому спиртовому раствору по каплям прибавляют 2,2 эквивалента(в расчете на ацетат) водного раствора карбоната натрия, содержащего четверть ранее использованного объема метанола. Суспензию перемешивают в течение промежутка времени от 2 до 24 ч. Когда по данным ТСХ отщепление аце 002305 34 татных групп пиранозида завершено, суспензию фильтруют, разбавляют водой и с помощью уксусной кислоты ее реакцию доводят до нейтральной по индикаторной бумаге. Проводят распределение смеси между этилацетатным и водным слоями. Водный слой несколько раз экстрагируют этилацетатом, пока весь продукт не перейдет в органический слой. Объединенные этилацетатные экстракты сушат над сульфатом магния, фильтруют и выпаривают на роторном испарителе. Затем продукты подвергают дополнительной очистке путем растирания полученного твердого вещества в дихлорметане и отделения нового твердого вещества с помощью вакуумного фильтрования через стеклянный пористый фильтр. Пример синтезов Пример 1. 2-Бром-5,6-дихлор-1-(2,3,4-триО-ацетилD-рибопиранозил)-1 Н-бензимидазол. Как описано в общей методике III, 2-бром 5,6-дихлорбензимидазол (4,0 г, 15 ммоль), N,Oбис(триметилсилил)ацетамидSeal, 75 мл) смешивают и кипятят с обратным холодильником в течение 0,5 ч. Раствор охлаждают до комнатной температуры и прибавляют триметилсилилтрифторметансульфонат (производства фирмы Aldrich, 3,2 мл, 16 ммоль). Сразу же прибавляют 4,8 г (15 ммоль) твердой 1,2,3,4 тетра-O-ацетилD-рибопиранозы(1,2,3,4 тетраацетат -D-рибопиранозы, производства фирмы Aldrich, Milwaukee). Раствор перемешивают при кипячении с обратным холодильником в токе азота в течение 0,5 ч, затем выливают в водный раствор бикарбоната натрия концентрации 7% и экстрагируют дихлорметаном. Органические слои сушат над сульфатом магния(безводным), фильтруют и выпаривают. Неочищенный остаток очищают на колонке с силикагелем (5 х 20 см, 230-400 меш) с использованиемCH2Cl2 и получают 2-бром-5,6-дихлор-1-(2,3,4 три-O-ацетилD-рибопиранозил)-1 Н-бензимидазол, который при элюировании разделяют на две фракции. Более быстро элюировавшаяся фракция продукта загрязнена (1,9 г) и ее очищают на второй колонке, получая 1,4 г (2,7 ммоль); медленнее элюировавшаяся фракция продукта составила 3,0 г (5,7 ммоль), а полный выход - 56%; температура плавления 100-110 С; 1 Н ЯМР (DMSO-d6) (пердейтерированный диметилсульфоксид) : 8,39 (синглет, 1 Н), 7,91 Пример 2. 2-Бром-5,6-дихлор-1Dрибопиранозил-1 Н-бензимидазол. От 3,0 г (5,7 моль) 2-бром-5,6-дихлор-1(2,3,4-три-O-ацетилD-рибопиранозил)-1 Нбензимидазола отщепляют защитные группы,как это описано в общей методике V, растворяя его в 60 мл диоксана и охлаждая полученный раствор в бане со льдом при температуре от 0 до 5 С. К этому раствору одной порцией прибавляют 22 мл (22 ммоль) водного раствора LiOH концентрации 1 моль/л. Затем смесь извлекают из бани со льдом и перемешивают при комнатной температуре в течение 1 ч. Смесь разбавляют с помощью 120 мл фосфатного буферного раствора с рН 7 и экстрагируют этилацетатом. Этилацетатный слой сушат над сульфатом магния (безводным), фильтруют и выпаривают растворитель. Остаток растирают с дихлорметаном и с помощью вакуумного фильтрования получают 1,7 г (4,3 ммоль, выход 75%) 2-бром-5,6 дихлор-1D-рибопиранозил-1H-бензимидазола. Продукт сушат в вакуумном сушильном шкафу при 50 С в течение ночи; температура плавления 175 С (с разложением); 1 Н ЯМР (DMSO-d6) : 7,96 (синглет, 1 Н),7,07 (синглет, 1 Н), 5,64-5,62 (дублет, J=9,2 Гц),5,19-5,17 (дублет, 1 Н, J=6,4 Гц), 5,13-5,12 (дублет, 1 Н, J=3,2 Гц), 4,86-4,84 (дублет, 1 Н, J=6,5 Гц), 4,12-4,06 (мультиплет, 1H), 3,98-3,92 (мультиплет, 2 Н), 3,68-3,63 (мультиплет, 2 Н). Анализ. Вычислено для C12H11N2O4Cl2Br: С 36,21; Н 2,79; N 7,04. Найдено: С 36,18; Н 2,91; N 6,88. Пример 3. 5,6-Дихлор-N-1-(1-метилэтил)1D-рибопиранозил-1 Н-бензимидазол-2-амин. 2-Бром-5,6-дихлор-1D-рибопиранозил 1 Н-бензимидазол (0,15 г, 0,29 ммоль) растворяют в 5 мл абсолютного этанола, обработанного с помощью 5 мл изопропиламина (производства фирмы Fluka, Ronkonkoma, NY), нагревают в стеклянной пробирке высокого давления (производства фирмы Асе, Vineland, NJ) при перемешивании с помощью магнитной мешалки. Пробирку герметизируют с помощью винтового колпачка и нагревают на масляной бане при 85 С в течение 3 суток. К этому моменту по данным ТСХ исходное вещество подверглось полной конверсии и растворители удаляют на роторном испарителе. Остаток продукта растирают с дихлорметаном и получают 5,6-дихлорN-1-(1-метилэтил)-1D-рибопиранозил-1 Нбензимидазол-2-амин в виде желтоватокоричневого твердого вещества (0,070 г, 0,19 ммоль, выход 66%); МС (масс-спектрометрия)(производства фирмы Aldrich, 1,9 мл, 7,6 ммоль) и ацетонитрил (производства фирмы Aldrich Sure Seal, 75 мл) смешивают и кипятят с обратным холодильником в токе азота в течение 0,5 ч. Раствор охлаждают до комнатной температуры и прибавляют раствор тетрахлорида олова в дихлорметане концентрации 1 моль/л (производства фирмы Aldrich, 15,2 мл, 15 ммоль). Сразу же прибавляют 2,4 г (7,6 ммоль) твердой 1,2,3,4 тетра-O-ацетилL-рибопиранозы (полученной по методике для D-тетраацетата из работы Н.М.Chem. Soc. 1955, 77, 18-24; температура плавления 110 С). Раствор кипятят с обратным холодильником в токе азота при перемешивании в течение ночи, а затем выливают в водный раствор бикарбоната натрия концентрации 7% и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния (безводным),фильтруют и выпаривают. Неочищенный остаток очищают на колонке с силикагелем (2,5 х 20 см, 230-400 меш) в ступенчатом градиентном режиме с использованием гексанов, содержащих от 10 до 20% этилацетата, и получают 2 бром-5,6-дихлор-1-(2,3,4-три-О-ацетилLрибопиранозил)-1H-бензимидазол (1,61 г, 3,1 ммoль, выход 40%); МС (API+): m/z (относительная интенсивность) 524 (0,17, М+); 1 Н ЯМР (DMSO-d6) : 8,39 (синглет, 1 Н),7,91 (синглет, 1 Н), 5,95-5,92 (дублет, 1 Н, J=9,6 Гц), 5,73-5,70 (дублет, 1 Н, J=9,6 Гц), 5,67 (широкий синглет, 2 Н), 4,13-4,09 (дублет дублетов,1 Н, J=6,3 Гц и J=5,8 Гц), 4,00-3,95 (перекрывающийся дублет дублетов, 1 Н), 2,19 (синглет,3 Н), 1,98 (синглет, 3 Н), 1,74 (синглет, 3 Н). Пример 5. 2-Бром-5,6-дихлор-1Lрибопиранозил-1 Н-бензимидазол. В спиртовом растворе 2-бром-5,6-дихлор 1-(2,3,4-три-O-ацетилL-рибопиранозил)-1Hбензимидазола (0,50 г, 0,95 ммоль) в соответствии с общей методикой VI отщепление защитной группы проводят с помощью раствора 0,61 г(5,8 ммоль) карбоната натрия в 5 мл воды. После перемешивания в течение ночи при температуре окружающей среды смесь фильтруют и обрабатывают, как это описано в общей методике VI, и получают 2-бром-5,6-дихлор-1Lрибопиранозил-1 Н-бензимидазол (0,27 г, 0,68 ммоль, выход 72%); МС (API+): m/z (относительная интенсивность) 398 (1,0, М+);(мультиплет, 2 Н), 3,68-3,63 (мультиплет, 2 Н). Пример 6. 5,6-Дихлор-N-1-(1-метилэтил)1L-рибопиранозил-1 Н-бензимидазол-2-амин. 2-Бром-5,6-дихлор-1-(2,3,4-три-O-ацетил-L-рибопиранозил)-1 Н-бензимидазол (1,0 г, 1,9 ммоль) растворяют в 5 мл этанола и обрабатывают с помощью 8 мл изопропиламина в стеклянной пробирке высокого давления (производства фирмы Асе) при перемешивании с помощью магнитной мешалки. Пробирку герметизируют с помощью винтового колпачка и нагревают при 100 С в течение 3 суток. К этому моменту по данным ТСХ исходное вещество подверглось полному превращению и растворители удаляют на роторном испарителе. Остаток продукта растирают с дихлорметаном и получают 5,6-дихлор-N-1-(1-метилэтил)-1L-рибопиранозил-1 Н-бензимидазол-2-амин в виде белого твердого вещества (0,070 г, 0,19 ммоль, выход 66%); МС (API+): m/z (относительная интенсивность) 376 (1,0, M+); 1 Н ЯМР (DMSO-d6) : 7,37 (синглет, 1 Н),7,33 (синглет, 1H), 6,476-6,45 (дублет, 1 Н, J=7,0 Гц), 5,36-5,34 (дублет, 1 Н, J=8,8 Гц), 5,08-5,07Sure Seal, 20 мл) перемешивают с обратным холодильником в атмосфере азота в течение 1,5 ч. К силилированному основанию прибавляют 0,30 г (0,94 ммоль) 1,2,3,4-тетра-О-ацетилксилопиранозы (производства фирмы Aldrich,Milwaukee), а затем тетрахлорид олова (1,4 ммоль, 0,12 мл, производства фирмы Aldrich,Milwaukee). Этот раствор перемешивают в атмосфере азота в течение ночи и на следующий день дополнительно прибавляют тетрахлорид олова (0,35 мл, 4,1 ммоль). Через час после прибавления второй порции тетрахлорида олова реакционную смесь выливают в насыщенный водный раствор сульфата натрия и фильтруют через слой целита, который промывают хлороформом и водой. Полученные после фильтрования слои разделяют. Хлороформовый слой промывают с помощью 2 порций по 150 мл насы 1 38 щенного водного раствора бикарбоната натрия,а затем с помощью 150 мл воды. Органический слой сушат над сульфатом магния (безводным),фильтруют и выпаривают растворитель. Неочищенный остаток очищают на колонке с силикагелем (2,5 х 20 см, 230-400 меш) в ступенчатом градиентном режиме с использованием гексанов, содержащих от 0 до 25% этилацетата, и получают продукт, 2-бром-5,6-дихлор-1-(2,3,4 три-О-ацетилD-ксилопиранозил)-1 Н-бензимидазол (0,13 г, 0,24 ммоль, выход 26%); 1(мультиплет, 2 Н), 2,02 (синглет, 3 Н), 1,99 (синглет, 3 Н), 1,77 (широкий синглет, 3 Н). Анализ. Вычислено для C18H17N2O7Cl2Br: С 41,25; Н 3,27; N 5,34. Найдено: С 41,32; Н 3,29; N 5,31. Пример 8. 2-Бром-5,6-дихлор-1Dксилопиранозил-1 Н-бензимидазол. К раствору 2-бром-5,6-дихлор-1-(2,3,4-триO-ацетилD-рибопиранозил)-1 Н-бензимидазола (0,083 г, 0,16 ммоль) в 7 мл тетрагидрофурана при перемешивании магнитной мешалкой прибавляют раствор карбоната натрия (0,13 г,1,2 ммоль) в 1 мл воды. Смесь перемешивают при комнатной температуре в течение 7 суток,затем кипятят с обратным холодильником в течение 2 ч. Смесь охлаждают до комнатной температуры, нейтрализуют уксусной кислотой(0,059 мл, 1,0 ммоль) и дополнительно перемешивают при комнатной температуре в течение 0,5 ч. Продукт, 2-бром-5,6-дихлор-1D-ксилопиранозил-1H-бензимидазол, очищают на колонке с силикагелем (2,5 х 10 см, 230-400 меш),элюируя этилацетатом (0,40 г, 0,10 ммоль, выход 63%); температура плавления 149,6 С (c разложением); 1 Н ЯMP (DMSO-d6) : 7,95 (синглет, 1H),7,90-7,80 (широкий синглет, 1H), 5,48-5,46 (дублет, J=5,2 Гц), 5,40-5,30 (широкий синглет, 1H),5,23-5,19 (мультиплет, 2 Н), 3,96-3,90 (мультиплет, 1 Н), 3,85-3,50 (2 перекрывающихся широких синглета, 2 Н), 3,43-3,20 (мультиплет, 2 Н замаскирован пиком HOD). Пример 9. 6-Хлор-5-метил-(2,3,4-три-OацетилD-рибопиранозил)-1 Н-бензимидазол и 5-хлор-6-метил-(2,3,4-три-O-ацетилD-рибопиранозил)-1 Н-бензимидазол. В соответствии с описанием в общей методике III, 5-хлор-6-метилбензимидазол (1,0 г, 6 ммоль), N,O-бис(триметилсилил)ацетамид (производства фирмы Aldrich, 1,3 мл, 5,2 ммоль) и 1,2-дихлорэтан (производства фирмы AldrichSure Seal, 30 мл) смешивают и кипятят с обратным холодильником в атмосфере азота в течение 0,5 ч. Раствор охлаждают до комнатной температуры и прибавляют триметилсилилтрифторметансульфонат (производства фирмыAldrich, 1,3 мл, 6,7 ммоль). Сразу же прибавляют 2,0 г (6,3 ммоль) твердой 1,2,3,4-тетра-OацетилD-рибопиранозы (1,2,3,4-тетраацетатAldrich, Milwaukee). Раствор перемешивают при кипячении с обратным холодильником в токе азота в течение ночи, затем выливают в водный раствор бикарбоната натрия концентрации 7% и экстрагируют хлороформом. Органические слои сушат над сульфатом магния (безводным),фильтруют и выпаривают. Неочищенный остаток очищают на колонке с силикагелем (5 х 20 см, 230-400 меш), элюируя в ступенчатом градиентном режиме раствором метанола в хлороформе концентрации от 0,25 до 2,5%, и получают 0,07 г (0,16 ммоль) 5-хлор-6-метил-(2,3,4 три-O-ацетилD-рибопиранозил)-1 Н-бензимидазола; МС (АР+): m/z, (относительная интенсивность) 447 (0,17, М+23 (Na; 1 Н ЯМР (DMSO-d6) : 8,36 (синглет, 1 Н),7,90 (синглет, 1 Н), 7,68 (синглет; 1 Н), 5,97-5,95(синглет, 3 Н) и 0,13 г (0,31 ммоль) смеси этих двух региоизомеров (полный выход 11%). Пример 10. 2-Бром-5-хлор-6-метил-(2,3,4 три-O-ацетилD-рибопиранозил)-1 Н-бензимидазол. Указанное соединение получают в соответствии с общей методикой IV с использованием 5-хлор-6-метил-(2,3,4-три-O-ацетилDрибопиранозил)-1 Н-бензимидазола (0,12 г, 0,28 ммоль), 20 мл тетрагидрофурана (производства фирмы Aldrich Sure Seal, Milwaukee) и всего 2,0 г (11 ммоль) N-бромсукцинимида, который прибавляют в течение 2 ч. Продукт, полученный по общей методике IV, подвергают частичной очистке на колонке с силикагелем (5 х 20 см, 230-400 меш), элюируя дихлорметаном, содержащим 0,5% метанола, и получают 2-бром-5-хлор-6 метил-(2,3,4-три-O-ацетилD-рибопиранозил)1 Н-бензимидазол (0,097 г), обладающий достаточной чистотой для проведения следующей стадии реакции; 1 40 Защитные группы от 2-бром-5-хлор-6 метил-(2,3,4-три-O-ацетилD-рибопиранозил)1H-бензимидазола (0,097 г) отщепляют, как это описано в общей методике V, растворяя его в 5 мл диоксана и охлаждая полученный раствор в бане со льдом при температуре от 0 до 5 С. К этому раствору одной порцией прибавляют 0,78 мл (0,78 ммоль) водного раствора LiOH концентрации 1 моль/л. Смесь вынимают из бани со льдом и перемешивают при комнатной температуре в течение 0,5 ч. Смесь разбавляют с помощью 50 мл фосфатного буферного раствора с рН 7 и экстрагируют этилацетатом. Этилацетатный слой сушат над сульфатом магния (безводным),фильтруют и выпаривают растворитель. Остаток растирают с дихлорметаном и с помощью вакуумного фильтрования получают 0,028 г(0,074 ммоль) 2-бром-5-хлор-6-метил-1Dрибопиранозил-1 Н-бензимидазола. Продукт сушат в вакуумном сушильном шкафу при 50 С в течение ночи; температура плавления 150 С(широкий синглет, 2 Н), 3,93 (мультиплет, 1 Н),2,40 (синглет, 3 Н). Пример 12. 2-Бром-6-хлор-5-метил-(2,3,4 три-О-ацетилD-рибопиранозил)-1 Н-бензимидазол. Указанное соединение получают в соответствии с общей методикой IV с использованием 6-хлор-5-метил-(2,3,4-три-O-ацетилDрибопиранозил)-1 Н-бензимидазола (0,37 г, 0,87 ммоль), 30 мл тетрагидрофурана (производства фирмы Aldrich Sure Seal, Milwaukee) и всего 1,2 г (7,0 ммоль) N-бромсукцинимида, который прибавляют каждые 15 мин в течение 1 ч в количестве около 0,2 эквивалента (в расчете на бензимидазол). Полученный по общей методикеIV продукт очищают на колонке с силикагелем(синглет, 3 Н), 2,25 (синглет, 3 Н), 2,04 (синглет,3 Н), 1,78 (синглет, 3 Н). Пример 13. 2-Бром-6-хлор-5-метил-1Dрибопиранозил-1 Н-бензимидазол. Защитные группы с 2-бром-6-хлор-5 метил-(2,3,4-три-O-ацетилD-рибопиранозил) 41 1H-бензимидазола (0,097 г) отщепляют, как это описано в общей методике V, растворяя его в 6 мл диоксана при комнатной температуре. К этому раствору одной порцией прибавляют 2,6 мл (2,6 ммоль) водного раствора LiOH концентрации 1 моль/л. Смесь перемешивают при комнатной температуре в течение 0,25 ч. Смесь разбавляют с помощью 50 мл фосфатного буферного раствора с рН 7 и экстрагируют этилацетатом. Этилацетатный слой сушат над сульфатом магния (безводным), фильтруют и выпаривают растворитель. Остаток растирают с дихлорметаном и с помощью вакуумного фильтрования получают 2-бром-6-хлор-5-метил-1D-рибопиранозил-1 Н-бензимидазол. Продукт сушат в вакуумном сушильном шкафу при 50 С в течение ночи, пока он по данным микроанализа и 1 Н ЯМР не станет содержать 0,2 моль дихлорметана; температура плавления 170-175 С (с разложением); 1 Н ЯМР (DMSO-d6) : 7,76 (синглет, 1 Н),7,62 (синглет, 1 Н), 5,67-5,63 (дублет, 1H, J=9,3 Гц), 5,20-5,15 (мультиплет, 2 Н), 4,92-4,89 (дублет, 1 Н, J=6,6 Гц), 4,15 (мультиплет, 1H), 4,05(производства фирмы Aldrich Sure Seal, Milwaukee) в атмосфере азота при 85 С в течение 0,75 ч и затем дают смеси охладиться до комнатной температуры. Прибавляют триметилсилилтрифторметансульфонат (1,4 мл, 7,2 ммоль) и 2,0 г-Dрибопиранозы, производства фирмы Aldrich,Milwaukee) и смесь нагревают на масляной бане в атмосфере азота при 85 С в течение 24 ч. Затем реакционную смесь выливают в водный раствор бикарбоната натрия концентрации 7% и экстрагируют дихлорметаном. Органический слой сушат над сульфатом магния (безводным),фильтруют и выпаривают. Неочищенный остаток очищают на колонке с силикагелем (2,5 х 20 см, 230-400 меш) в ступенчатом градиентном режиме с использованием СН 2 Сl2, содержащего 0,25-0,5% метанола, и получают искомое соединение в виде смеси региоизомеров. Региоизомеры разделяют с помощью ВЭЖХ (высокоэффективная жидкостная хроматография) на полупрепаративной колонке Chiralpak OD lot No. 369 002305 42 712-30802, элюируя подвижной фазой, представляющей собой смесь 90% гексанов и 10% этанола, со скоростью потока 0,8 мл/мин при давлении 260 пси 1,793 Мпа с детектированием при длине волны 254 нм. Первьм элюируется 5-хлор-(2,3,4-три-O-ацетилD-рибопиранозил)-1 Н-бензимидазол (время удерживания 18,8 мин) и после выпаривания растворителя получают 0,13 г. 1(синглет, 3 Н). 6-Хлор-(2,3,4-три-O-ацетилD-рибопиранозил)-1 Н-бензимидазол элюируется из колонки для разделения хиральных соединений последним (время удерживания = 28,9 мин) и после выпаривания растворителя получают 0,20 г. 1 Н ЯМР (DMSO-d6) : 8,43 (синглет, 1 Н),8,10-8,09 (дублет, 1 Н, J=2,0 Гц), 7,64-7,62 (дублет, 1 Н, J=8,8 Гц), 7,25-7,23 (дублет дублетов,1 Н, J=2,0 Гц, J=8,7 Гц), 6,03-6,00 (дублет, 1 Н,J=9,5 Гц), 5,76-5,60 (мультиплет, 2 Н), 5,50-5,40(синглет, 3 Н). Пример 15. 2-Бpoм-5-xлop-(2,3,4-тpи-OaцeтилD-pибoпиpaнoзил)-1H-бeнзимидaзoл. Указанное соединение получают в соответствии с общей методикой IV с использованием 5-хлор-(2,3,4-три-O-ацетилD-рибопиранозил)-1 Н-бензимидазола (0,17 г, 0,41 ммоль), 30 мл тетрагидрофурана (производства фирмы Aldrich Sure Seal, Milwaukee) и всего 2,6 г (7,0 ммоль) N-бромсукцинимида, который прибавляют в течение 2 ч. Продукт, полученный по общей методике IV, подвергают очистке на колонке с силикагелем (2,5 х 20 см, 230-400 меш),элюируя дихлорметаном, содержащим 1,0% метанола, и получают 2-бром-5-хлор-(2,3,4-триO-ацетилD-рибопиранозил)-1 Н-бензимидазол(синглет, 3 Н), 1,73 (синглет, 3 Н). Пример 16. 2-Бром-5-хлор-1D-рибопиранозил-1 Н-бензимидазол. Защитные группы от 2-бром-5-хлор-(2,3,4 три-O-ацетилD-рибопиранозил)-1 Н-бензимидазола (0,15 г, 0,31 ммоль) отщепляют, как это описано в общей методике V, растворяя его в 5 43 мл диоксана при комнатной температуре. К этому раствору одной порцией прибавляют 1,2 мл (1,2 ммоль) водного раствора LiOH концентрации 1 моль/л. Смесь перемешивают при комнатной температуре в течение 0,25 ч. Смесь разбавляют с помощью 15 мл фосфатного буферного раствора с рН 7 и экстрагируют этилацетатом. Этилацетатный слой сушат над сульфатом магния (безводным), фильтруют и выпаривают растворитель. Остаток растирают с дихлорметаном и с помощью вакуумного фильтрования получают 2-бром-5-хлор-1D-рибопиранозил 1 Н-бензимидазол. Продукт сушат в вакуумном сушильном шкафу при 50 С (0,041 г, 0,11 ммоль, выход 37%); температура плавления 120 С (со вспениванием); 1 Н ЯМР (DMSO-d6) : 7,70-7,67 (мультиплет, 2 Н), 7,24-7,22 (дублет, 1 Н, J=8,7 Гц), 5,645,61 (дублет, 1 Н, J=9,2 Гц), 5,16 (широкий синглет, 1 Н), 4,07-4,05 (перекрывающийся дублет дублетов, 1 Н), 3,98 (широкий синглет, 1 Н), 3,873,66 (мультиплет, 1 Н), 3,68-3,66 (дублет, 2 Н,J=8,5 Гц). Пример 17. 2-Бром-6-хлор-(2,3,4-три-ОацетилD-рибопиранозил)-1 Н-бензимидазол. Указанное соединение получают в соответствии с общей методикой IV с использованием 6-хлор-(2,3,4-три-O-ацeтилD-рибопиранозил)-1 Н-бензимидазола (0,20 г, 0,41 ммоль),30 мл тетрагидрофурана (производства фирмыAldrich Sure Seal, Milwaukee) и всего 0,30 г (0,17 ммоль) N-бромсукцинимида, который прибавляют в течение 0,5 ч. Продукт, полученный по общей методике IV, подвергают очистке на колонке с силикагелем (2,5 х 20 см, 230-400 меш),элюируя дихлорметаном, содержащим 1,0% метанола, и получают 2-бром-6-хлор-(2,3,4-триO-ацетилD-рибопиранозил)-1 Н-бензимидазол(дублет, 1 Н, J=9,7 Гц), 5,67-5,60 (мультиплет,3 Н), 4,13-4,09 (дублет дублетов, 1 Н, J=5,3 Гц,J=9,2 Гц), 4,00-3,90 (перекрывающийся дублет дублетов, 1 Н), 2,20 (синглет, 3 Н), 1,98 (синглет,3 Н), 1,74 (синглет, 3 Н). Пример 18. 2-Бром-6-хлор-1D-рибопиранозил-1H-бензимидазол. Защитные группы от 2-бром-6-хлор-(2,3,4 три-O-ацетилD-рибопиранозил)-1 Н-бензимидазола (0,11 г, 0,22 ммоль) отщепляют, как это описано в общей методике V, растворяя его в 5 мл диоксана при комнатной температуре. К этому раствору одной порцией прибавляют 0,86 мл (0,86 ммоль) водного раствора LiOH концентрации 1 моль/л. Смесь перемешивают при комнатной температуре в течение 0,25 ч. Смесь разбавляют с помощью 15 мл фосфатного буферно 002305 44 го раствора с рН 7 и экстрагируют этилацетатом. Этилацетатный слой сушат над сульфатом магния (безводным), фильтруют и выпаривают растворитель. Остаток растирают с дихлорметаном и с помощью вакуумного фильтрования получают 2-бром-6-хлор-1D-рибопиранозил 1H-бензимидазол. Продукт сушат в вакуумном сушильном шкафу при 50 С (0,028 г, 0,077 ммоль, выход 35%); температура плавления 100 С (с образованием дымов), 140 С (с разложением); 1 Н ЯМР (DMSO-d6) : 7,74-7,73 (дублет,1 Н, J=1,8 Гц), 7,60-7,58 (дублет, 1 Н, J=8,7 Гц),7,26-7,23 (дублет дублетов, 1 Н, J=1,9 Гц, J=8,7 Гц), 5,64-5,61 (дублет, 1 Н, J=9,3 Гц), 5,13 (широкий синглет, 1 Н), 4,12-4,10 (дублет, 1H, J=9,3 Гц), 3,99 (синглет, 1 Н), 3,94-3,90 (мультиплет,1 Н), 3,68 (синглет, 1 Н), 3,67-3,66 (дублет, 1 Н,J=3,9 Гц). Пример 19. 5,6-Дифтор-1-(2,3,4-три-OацетилD-рибопиранозил)-1 Н-бензимидазол. В соответствии с общей методикой III 5,6 дифтор-1H-бензимидазол (1,0 г, 6,5 ммоль),N,O-бис(триметилсилил)ацетамид (1,6 мл, 6,6 ммоль) нагревают в 50 мл 1,2-дихлорэтана(производства фирмы Aldrich Sure Seal, Milwaukee) в атмосфере азота при 85 С в течение 2,5 ч и затем дают смеси охладиться до комнатной температуры. Прибавляют триметилсилилтрифторметансульфонат (1,4 мл, 7,2 ммоль) и 2,0 гAldrich,Milwaukee) и смесь нагревают на масляной бане в атмосфере азота при 85 С в течение 24 ч. Затем реакционную смесь выливают в водный раствор бикарбоната натрия концентрации 7% и экстрагируют дихлорметаном. Органический слой сушат над сульфатом магния (безводным),фильтруют и выпаривают. Неочищенный остаток очищают на колонке с силикагелем (2,5 х 20 см, 230-400 меш) в ступенчатом градиентном режиме с использованием CH2Cl2, содержащего от 0,5 до 2% метанола, и получают искомое соединение в виде белой пены (1,1 г, 2,6 ммоль,выход 40%); МС (API+): m/z (относительная интенсивность) 524 (0,10, М+1). 1 Н ЯМР (DMSO-d6) : 8,47 (синглет, 1 Н),8,20-8,16 (мультиплет, 1 Н), 7,76-7,71 (мультиплет, 1 Н), 6,02-6,00 (дублет, 1 Н, J=9,5 Гц), 5,755,69 (мультиплет, 2 Н), 5,53-5,40 (мультиплет,1 Н), 4,05-3,94 (мультиплет, 1H), 2,22 (синглет,3H), 2,00 (синглет, 3 Н), 1,73 (синглет, 3 Н). Пример 20. 2-Бром-5,6-дифтор-1-(2,3,4 три-О-ацетилD-рибопиранозил)-1 Н-бензимидазол. Указанное соединение получают в соответствии с общей методикой IV с использованием 5,6-дифтор-(2,3,4-три-O-ацетилD-рибопиранозил)-1 Н-бензимидазола (1,1 г, 2,6 ммоль), 45 60 мл тетрагидрофурана (производства фирмыAldrich Sure Seal, Milwaukee) и всего 2,8 г (16 ммоль) N-бромсукцинимида, который прибавляют тремя приблизительно одинаковыми порциями. Продукт, полученный по общей методике IV, подвергают очистке на колонке с силикагелем (2,5 х 20 см, 230-400 меш) с использованием гексанов, содержащих от 5 до 20% этилацетата, и получают 1,0 г (2,0 ммоль, выход 77%); МС (ES+): m/z (относительная интенсивность) 514 (1,0, М+23 (Na. 1 Н ЯМР (DMSO-d6) : 8,26-8,21 (мультиплет, 1 Н), 7,73-7,69 (мультиплет, 1 Н), 5,93-5,91(дублет, 1 Н, J=9,4 Гц), 4,10-4,08 (дублет, 1 Н,J=9,4 Гц), 3,97-3,95 (широкий синглет, 2 Н), 3,673,65 (дублет, 2 Н, J=8,2 Гц). Пример 22. 5,6-Дихлор-4-фтор-1-(2,3,4 три-O-ацетилD-рибопиранозил)-1 Н-бензимидазол. В соответствии с описанием, приведенным в общей методике III, 5,6-дихлор-4-фторбензимидазол (1,3 г, 6,3 ммоль), N,O-бис (триметилсилил)ацетамид (производства фирмы Aldrich, 1,6 мл, 6,3 ммоль) и 1,2-дихлорэтан (производства фирмы Aldrich Sure Seal, 30 мл) смешивают и кипятят с обратным холодильником в атмосфере азота в течение 0,5 ч. Раствору дают охладиться до комнатной температуры и прибавляют триметилсилилтрифторметансульфонат(0,67 мл, 3,5 ммоль). Затем сразу же прибавляют 2,0 г (6,3 ммоль) твердой 1,2,3,4-тетра-OацетилD-рибопиранозы (1,2,3,4-тетраацетатAldrich, Milwaukee). Раствор кипятят с обратным холодильником в атмосфере азота в течение ночи и затем выливают в водный раствор бикарбоната натрия концентрации 7% и экстрагируют дихлорметаном. Органический слой сушат над сульфатом магния (безводным),фильтруют и выпаривают. Неочищенный остаток очищают на колонке с силикагелем (5 х 20 см, 230-400 меш), элюируя раствором метанола в хлороформе концентрации 0,5%, с последующей очисткой на хроматографической системе с 46 патроном Biotage среднего давления, элюируя смесью этилацетата с гексанами состава 1:1, и получают 1,3 г (2,8 ммоль, выход 44%) 5,6 дихлор-4-фтор-1-(2,3,4-три-O-ацетилD-рибопиранозил)-1 Н-бензимидазола; МС (ES+): m/z (относительная интенсивность) 485 (1,0, М+23 (Na. 1(синглет, 3 Н), 1,98 (синглет, 3 Н), 1,71 (синглет,3 Н). Пример 23. 2-Бpoм-5,6-диxлop-4-фтop-1(2,3,4-три-О-ацетилD-рибопиранозил)-1 Нбензимидазол. Указанное соединение получают в соответствии с общей методикой IV с использованием 5,6-дихлор-4-фтор-1-(2,3,4-три-O-ацетил-D-рибопиранозил)-1 Н-бензимидазола (1,3 г, 2,8 ммоль), 30 мл тетрагидрофурана (производства фирмы Aldrich Sure Seal, Milwaukee) и всего 5,0 г (28 ммоль) N-бромсукцинимида, который прибавляют в виде 5 приблизительно одинаковых порций в течение 35 мин. Продукт, полученный по общей методике IV, подвергают очистке на колонке с силикагeлем (2,5 х 20 см, 230-400 меш), элюируя дихлорметаном, содержащим 0,5% метанола, и получают 1,5 г (2,8 ммоль) 2 бром-5,6-дихлор-4-фтор-1-(2,3,4-три-O-ацетил-D-рибопиранозил)-1 Н-бензимидазол; МС (АР+): m/z (относительная интенсивность) 564 (0,02, М+23 (Na. 1 Н ЯМР (DMSO-d6) : 8,31 (синглет, 1 Н),5,97-5,95 (дублет, 1H, J=9,1 Гц), 5,70-5,62 (мультиплет, 3 Н), 4,14-4,10 (дублет дублетов, 1 Н),4,02-3,97 (перекрывающийся дублет дублетов,1 Н), 2,20 (синглет, 3 Н), 1,98 (синглет, 3 Н), 1,75 47 Пример 25. 6-Хлор-5-фтор-1-(2,3,4-триацетилD-рибопиранозил)-1 Н-бензимидазол и 5 хлор-6-фтор-1-(2,3,4-триацетилD-рибопиранозил)-1 Н-бензимидазол. Готовят суспензию 6-хлор-5-фторбензимидазола (производства фирмы Maybridge,0,536 г, 3,1 ммоль) в 1,2-дихлорэтане (производства фирмы Aldrich Sure Seal, 35 мл). Прибавляют N,O-бис(триметилсилил) ацетамид (производства фирмы Aldrich, 3,88 мкл,1,5 ммоль, 1 эквивалент) и смесь кипятят на масляной бане с обратным холодильником при температуре 90 С в течение 1 ч. 2,3,4-ТриацетилD-пиранозид (производства фирмы Aldrich, 1,0 г, 3,1 ммоль, 1 эквивалент) сушат путем кипячения в толуоле. Избыток толуола удаляют в вакууме. Углевод растворяют в 1,2 дихлорэтане (15 мл) и с помощью трубочки прибавляют к реакционной смеси. Осторожно прибавляют триметилсилилтрифторметансульфонат (производства фирмы Aldrich, 668 мкл,3,4 ммоль, 1,1 эквивалента) и реакционную смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь охлаждают до комнатной температуры и трижды промывают рассолом, пока рН не станет равным около 7. Дихлорметановый раствор сушат над MgSO4,фильтруют и растворитель удаляют в вакууме. Продукты (в соотношении 1:1) очищают в виде смеси на 300 г силикагеля, элюируя смесью этилацетат/гексан (состава 2:1, в отношении объем/объем), а затем неразбавленным этилацетатом; выход 33%, 0,45 г. 1(синглет, 6 Н, ацетат), 1,95 (синглет, этилацетат),1,70 (синглет, 6 Н, ацетат), 1,14 (триплет, этилацетат). Пример 26. 2-Бром-6-хлор-5-фтор-1-(2,3,4 триацетилD-рибопиранозил)-1 Н-бензимидазол и 2-бром-5-хлор-6-фтор-1-(2,3,4-триацетил-D-рибопиранозил)-1 Н-бензимидазол. 6-Хлор-5-фтор-1-(2,3,4-триацетилDрибопиранозил)-1 Н-бензимидазол и 5-хлор-6 фтор-1-(2,3,4-триацетилD-рибопиранозил)1 Н-бензимидазол сушат путем кипячения в толуоле. Избыток толуола удаляют в вакууме. Прибавляют тетрагидрофуран (производства фирмы Aldrich Sure Seal, 13 мл) и раствор нагревают с обратным холодильником при температуре 85 С на масляной бане. Прибавляют Nбромсукцинимид (производства фирмы Aldrich,0,31 г, 1,8 ммоль, 2 эквивалента) и реакционную смесь кипятят с обратным холодильником в течение 7 мин. Реакционную смесь охлаждают и 48 выливают в холодный насыщенный раствор бикарбоната натрия. Продукты экстрагируют этилацетатом. Органический раствор сушат надMgSO4, фильтруют и растворитель удаляют в вакууме. Остаток очищают с помощью хроматографии на 40 г силикагеля, элюируя смесью этилацетат/гексан (состава 1:2, в отношении объем/объем). Фракции, содержащие продукт,объединяют и удаляют растворитель. Продукты получаются в соотношении приблизительно 1:1 с выходом 30%, 0,14 г. 1 Н ЯМР (DMSO-d6) : 8,34 (дублет, 1 Н, ArH, J=7 Гц), 8,22 (дублет, 1H, Ar-H, J=10 Гц), 7,86(производства фирмы Aldrich, 0,037 г, 0,88 ммоль, 3 эквивалента), растворяют в воде (2 мл) и прибавляют к реакционной смеси. Раствор перемешивают при комнатной температуре в течение 1 ч. С помощью 1 н. раствора НСl значение рН реакционной смеси доводят до 7. Продукты дважды экстрагируют этилацетатом, сушат над MgSO4, фильтруют и растворитель удаляют в вакууме. Остаток очищают с помощью хроматографии на 30 г силикагеля, элюируя смесью этилацетат/гексан (состава 2:1, в отношении объем/объем). Фракции, содержащие продукт, объединяют и растворитель удаляют в вакууме. Продукты получаются в соотношении приблизительно 1:1 с выходом 50%, 0,14 г.(широкий синглет, 4 Н, ОН), 4,8 (широкий синглет, 2 Н, ОН), 4,1 (мультиплет, 2H), 4,0 (мультиплет, перекрывается с сигналом этилацетата),3,65 (мультиплет, 4 Н), 1,95 (синглет, этилацетат), 1,14 (триплет, этилацетат). Пример 28. 5,6-Дихлор-1D-рибопиранозил-1H-бензимидазол. 5,6-Дихлор-1-(2,3,4-триацетилD-рибопиранозил)-1 Н-бензимидазол получают, исходя из 5,6-дихлорбензимидазола (Townsend and Revankar, Chem. Rev. 1970, 70:389), по методике, 49 использованной в примере 25. Искомое соединение получают из триацетилированного продукта методом, описанным в примере 26. МС (АРСН(-: m - 1/z, 317. 1 Н ЯМР (DMSO-d6) : 8,43 (синглет, 1 Н, Н 2), 7,97 (синглет, 1 Н, Ar-H), 7,92 (синглет, 1 Н,Ar-H), 5,54 (дублет, 1 Н, Н-1', J=9 Гц), 5,1 (широкий синглет, 2 Н, ОН), 4,86 (широкий синглет,1 Н, ОН), 4,0 (мультиплет, перекрывается с сигналом этилацетата), 3,8 (мультиплет, 1 Н), 3,7(синглет, этилацетат), 1,14 (триплет, этилацетат). Пример 29. 4,5,6-Трифторбензимидазол. 2,3,4-Трифтор-6-нитроанилин (производства фирмы Maybridge, 30 г, 156 ммоль) растворяют в этаноле (200 мл). Прибавляют воду, а затем катализатор - никель Ренея (3 г, во влажном состоянии). Восстановление при давлении Н 2, равном 50 пси 0,344 МПа, проводят в течение 4 ч. Реакционную смесь фильтруют и растворитель удаляют в вакууме. Остаток растворяют в 4 н. растворе НСl (1 л) и прибавляют муравьиную кислоту (6,5 мл, 1,1 эквивалента). Реакционную смесь кипятят с обратным холодильником в течение ночи. После фильтрования значение рН доводят до 7 с помощью NaOH (5 н. раствор). Неочищенный продукт (24 г) собирают путем фильтрования и очищают с помощью хроматографии на силикагеле (500 г),элюируя смесью этилацетат/гексан (состава 7:1,в отношении объем/объем). Фракции, содержащие продукт, объединяют и растворитель удаляют в вакууме. Продукт получают с выходом 71%, 19 г. МС (АРСН(+: m + 1/z, 173. 1H ЯМР (DMSO-d6) : 8,31 (синглет, 1 Н, H2), 7,49 (мультиплет, 1 Н, H-7). Пример 30. 1-(2,3,4-ТриацетилD-рибопиранозил)-4,5,6-трифтор-1 Н-бензимидазол и 1(2,3,4-триацетилD-рибопиранозил)-5,6,7 трифтор-1 Н-бензимидазол. Продукт, полученный в примере 6, превращают в искомые соединения методом, использованным в примере 26. Продукты получаются в соотношении изомеров 7-фтор/4-фтор 1:5. Соотношение изомеров подтверждено с помощью корреляционной спектроскопии ЯМР(синглет, 6 Н, ацетат), 1,97 (синглет, 6 Н, ацетат),1,95 (синглет, этилацетат), 1,70 (синглет, 6 Н,ацетат), 1,14 (триплет, этилацетат). Пример 32. 2-Бром-1-(-D-рибопиранозил)-4,5,6-трифтор-1 Н-бензимидазол и 2-бром 1-(-D-рибопиранозил)-5,6,7-трифтор-1 Нбензимидазол. Продукты, полученные в примере 31, превращают в искомые соединения методом, испoльзованным в примере 27. Частичная очистка с помощью хроматографии приводит к соотношению изомеров 7-фтор/4-фтор 1:7. 1 Н ЯМР (DMSO-d6) : 7,75 (мультиплет,1 Н, Н-2, (4-фторизомер, 7,65 (синглет, 0,15 Н,Н-2, (7-фторизомер, 5,63 (дублет, 1 Н, Н-1', J=9 Гц), 5,25 (широкий синглет, 0,15 Н, ОН), 5,2a) 4-Хлор-2,3-дифтор-6-нитроанилин. 2,3-Дихлор-6-нитроанилин (15,4 г, 88,7 ммоль), N-бромсукцинимид (14,9 г, 111,4 ммоль) и N,N-диметилформамид (250 мл) смешивают и несколько часов нагревают при температуре 80-90 С, после чего смесь выливают в воду со льдом. Продукт экстрагируют этилацетатом, экстракт промывают водой, насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и удаляют растворитель в вакууме, получая вязкое, желтое масло. 1c) 6-Хлор-4,5-дифтор-1-(2,3,4-триацетил-D-рибопиранозил)-1 Н-бензимидазол и 5-хлор 6,7-дифтор-1-(2,3,4-триацетилD-рибопиранозил)-1 Н-бензимидазол. Продукт, полученный в примере 33b, превращают в искомые соединения методом, использованным в примере 1. Продукты получаются в соотношении изомеров 7-фтор/4-фтор 1:6. Соотношение изомеров подтверждено с помощью корреляционной спектроскопии ЯМР(синглет, 3,45 Н, ацетат), 1,70 (синглет, 3,45 Н,ацетат). Пример 34. 2-Бром-6-хлор-4,5-дифтор-1(2,3,4-триацетилD-рибопиранозил)-1 Н-бензимидазол и 2-бром-5-хлор-6,7-дифтор-1-(2,3,4 триацетилD-рибопиранозил)-1 Н-бензимидазол. Продукты, полученные в примере 33 с,превращают в искомые соединения методом,использованным в примере 2. Частичная очистка с помощью хроматографии приводит к соотношению изомеров 7-фтор/4-фтор 1:5. МС (ЕI(+: m + 1/z, 524. 1 Н ЯМР (DMSO-d6) : 8,23 (дублет, 1 Н, Н 7, J=5 Гц, (4-фторизомер, 7,82 (дублет, 0,2 Н,Н-4, J=6 Гц, (7-фторизомер, 5,95 (мультиплет,1,2 Н), 5,7 (мультиплет, 2,4 Н), 5,3 (мультиплет,0,2 Н), 5,1 (мультиплет, 0,2 Н), 4,2 (мультиплет,0,2 Н), 4,1 (мультиплет, 1,2 Н), 4,0 (мультиплет,перекрывается с сигналом этилацeтата), 3,9(синглет, 3,4 Н, ацетат), 1,97 (синглет, 3,4 Н, ацетат), 1,95 (синглет, этилацетат), 1,70 (синглет,3,4 Н, ацетат), 1,14 (триплет, этилацетат). Пример 35. 2-Бром-6-хлор-4,5-дифтор-1(-D-рибопиранозил)-1 Н-бензимидазол. Продукт, полученный в примере 34, превращают в искомые соединения методом, использованным в примере 27. Искомое соединение выделено с помощью хроматографии. МС(производства фирмы Aldrich, 4,16 г, 15,87 ммоль в расчете на чистоту 99%) и 5,6 дихлорбензимидазол (Towsend and Revankar,Chem. Rev. 1970, 70:389 и цитированная там литература) (3,00 г, 15,87 ммоль) перемешивают в безводном тетрагидрофуране (50 мл) при температуре 0 С (наружная баня со льдом) в токе азота и в течение 30 мин прибавляют раствор диэтилазокарбоксилата (производства фирмыAldrich, 2,60 мл, 15,87 ммоль в расчете на чистоту 97%) в тетрагидрофуране (10 мл). Реакционной смеси дают нагреться до комнатной температуры, перемешивают 72 ч, затем разбавляют хлороформом (300 мл) и промывают насыщенным водным раствором бикарбоната натрия(100 мл). Органический слой сушат (над сульфатом натрия), фильтруют и растворитель выпаривают при пониженном давлении. Оставшуюся смолу обрабатывают с помощью 300 мл водного раствора уксусной кислоты концентрации 80% при 80 С в течение 1 ч. Реакционную смесь разбавляют с помощью 100 мл воды и экстрагируют 4 порциями диэтилового эфира по 100 мл. Водную фазу концентрируют и очищают с помощью флэш-хроматографии на силикагеле 60. Искомое соединение элюируют раствором метанола в хлороформе концентрации 525% и получают белое твердое вещество (2,20 г,выход 65%); температура плавления 197 С; 1 Н ЯМР (DMSO-d6, 200 МГц) : 8,56, 8,09,7,99 (синглет, все 1H), 4,92 (дублет, J=5,5 Гц,1H), 4,87 (широкий синглет, 1 Н), 4,69 (триплет,J=6,3 Гц, 1H), 4,25 (дублет, J=12 Гц, 1H), 3,91(3S,5S,6R)-5,6-дихлор-1(тетрагидро-5-гидрокси-6-(гидроксиметил)-2 Нпиран-3-ил)-1 Н-бензимидазола (часть а) настоящего примера, 1,00 г, 3,47 ммоль) в безвод 53 ном пиридине (10 мл) прибавляют уксусный ангидрид (1,30 мл, 13,9 ммоль). Через 12 ч эту реакционную смесь концентрируют при пониженном давлении, выпаривая с толуолом, и получают вязкое масло. Прибавляют этанол (около 5 мл) (при охлаждении с помощью наружной бани со льдом) и повторно проводят выпаривание с толуолом (2 раза), пока не исчезнет запах уксусной кислоты. Это масло повторно растворяют в хлороформе (200 мл) и последовательно промывают с помощью 0,1 н. раствора НСl (50 мл), насыщенного водного раствора бикарбоната натрия (50 мл) и рассола (50 мл). Органический слой сушат (над сульфатом натрия), а затем фильтруют на вакуум-фильтре через слой свежепрокаленного силикагеля 60 (3 х 4 см),промывая этилацетатом. Выпаривание растворителя при пониженном давлении приводит к получению не совсем белого полутвердого остатка (1,37 г). Раствор этого твердого вещества в безводном тетрагидрофуране (20 мл) кипятят с обратным холодильником и одной порцией прибавляют N-бромсукцинимид (производства фирмы Aldrich, 1,22 г, 6,83 ммоль). После 10 мин кипячения образовавшийся желтый раствор охлаждают до комнатной температуры, разбавляют хлороформом (75 мл) и промывают насыщенными водным раствором бикарбоната натрия (3 порции по 50 мл). Органический слой сушат (над сульфатом натрия), фильтруют и концентрируют при пониженном давлении, получая 1,95 г (выход 86%) искомого соединения в виде коричневой смолы, которую используют без дополнительной очистки; 1 Н ЯМР (DMSO-d6, 200 МГц) : 8,45, 7,98(3S,5S,6R)-5,6-Дихлор-1-(тетрагидро-5 гидрокси-6-(гидроксиметил)-2 Н-пиран-3-ил)1 Н-бензимидазол (часть b) настоящего примера,0,80 г, 1,67 ммоль) в смеси метанол-этанол состава 1:1 (10 мл) перемешивают с раствором карбоната натрия (0,200 г, 1,68 ммоль) в воде (5 мл) в течение 5 ч при комнатной температуре, а затем 2 ч при температуре 60 С. Затем с помощью ледяной уксусной кислоты доводят значение рН до 5 и растворители выпаривают в вакууме. Оставшееся твердое вещество суспендируют в воде, отфильтровывают и сушат в вакууме, получая искомое соединение в виде белого твердого вещества (0,500 г, выход 90%); температура плавления 286-288 С; 54 1H), 3,74-3,39 (мультиплет, 4 Н), 2,18 (мультиплет, 2 Н). Анализ. Вычислено для С 13 Н 13 ВrCl2N2 О 3: С, 39,42; Н, 3,31; N, 7,07; сумма галогенов в пересчете на Сl,17,90. Найдено: С, 39,51; Н, 3,35; N, 6,98; сумма галогенов в пересчете на Сl,17,88. Пример 37. (3S,5S,6R)-5,6-Дихлор-2-(циклопропиламино)-1-(тетрагидро-5-гидрокси-6(гидроксиметил)-2 Н-пиран-3-ил)-1 Н-бензимидазол. Раствор (3S,5S,6R)-2-бром-5,6-дихлор-1(тетрагидро-5-гидрокси-6-(гидроксиметил)-2 Нпиран-3-ил)-1H-бензимидазода (часть с) предыдущего примера, 1,00 г, 2,08 ммоль) и циклопропиламина (производства фирмы Aldrich, 1,50 мл, 20,0 ммоль) в абсолютном этаноле (20 мл) кипятят с обратным холодильником в атмосфере азота в течение 24 ч, после чего ТСХ (пластины с силикагелем, проявляемые раствором метанола в хлороформе концентрации 5%) указывают на полное превращение в продукт с более низким Rf. Прибавляют 1 н. раствор гидроксида натрия (2,10 мл) и реакционную смесь концентрируют при пониженном давлении. Оставшиеся твердые вещества хроматографируют на силикагеле 60. Искомое соединение элюируют раствором метанола в хлороформе концентрации 10% и после выпаривания растворителя оно имеет вид белой пены (0,60 г, выход 75%); температура плавления 130 С; []20D +24,8 (с 0,25, этанол); 1 Н ЯМР (DMSO-d6, 200 МГц) : 7,77(мультиплет, 2 Н), 0,75-0,48 (мультиплет, 4 Н). Анализ. Вычислено для С 16 Н 19 ВrСl2N3 О 5H2 О: С 50,41; Н, 5,29; N 11,02; Cl 18,60. Найдено: С 50,29; Н 5,29; N 11,00; Cl 18,66. Пример 38. (3R,5R,6S)-2-Бром-5,6-дихлор 1-(тетрагидро-5-гидрокси-6-(гидроксиметил)2 Н-пиран-3-ил)-1 Н-бензимидазол. Искомое соединение получено, как это описано в примере 1, исходя из L-глюкозного производного 2S,4S,7S,8R-пергидро-7 гидрокси-2-фенилпирано(3,2-D)-1,3-диоксина(Tetrahedron Letters, 1996, 8147 и цитированная там литература): температура плавления 286287 С; []20D +0,16 (с 0,62, 1:1 метанол/хлороформ); 1 Н ЯМР (CDCl3, 200 МГц),данные совпадают с данными для его энантиомера (пример 6). Анализ. Вычислено для C13H13BrCl2N2O3: С 39,42; Н 3,31; N 7,07; сумма галогенов в пересчете на Сl 17,90. Найдено: С 39,70; Н 3,45; N 7,02, сумма галогенов в пересчете на Сl 17,85.(3R,5R,6S)-5,6-Дихлор-2(циклопропиламино)-1-(тетрагидро-5-гидрокси 6-(гидроксиметил)-2 Н-пиран-3-ил)-1 Н-бензимидазол. Искомое соединение получено таким же способом, что и энантиомер (пример 37), исходя из L-глюкозного производного 2S,4S,7S,8-R-пергидро-7-гидрокси-2-фенилпирано(3,2-D)1,3-диоксина (Tetrahedron Letters, 1996, 8147 и цитированная там литература); температура плавления 98-99 С; []20D -23,2 (с 0,28, этанол); 1H ЯМР (CDCl3, 200 МГц), данные совпадают с данными для его энантиомера (пример 37). Анализ. Вычислено для С 16 Н 19 ВrСl2N3 О 3 3,0H2 О: С 45,08; Н 5,91; N 9,86; Cl 16,63. Найдено С 45,00; Н 5,87; N 9,79; Cl 16,70. Пример 40. (3R,4S,5S,6R)-2-Бром-5,6-дихлор-1-(тетрагидро-4,5-дигидрокси-6-(гидроксиметил)-2 Н-пиран-3-ил)-1 Н-бензимидазол. а) (3S,5S,6R)-5,6-Дихлор-1-(6-трет-бутилдиметилсилил)окси)метил)(гидроксиметил)-2 Нпиран-3-ил)-1 Н-бензимидазол. К перемешиваемой суспензии (3S,5S,6R)5,6-дихлор-1-(тетрагидро-5-гидрокси-6-(гидроксиметил)-2 Н-пиран-3-ил)-1 Н-бензимидазолаN,N-диметилформамида при 0 С прибавляют имидазол (0,40 г, 5,68 ммоль), а затем третбутилдиметилсилилхлорид (0,81 г, 5,20 ммоль). Реакционной смеси дают нагреться до комнатной температуры, перемешивают ее в течение ночи, а затем разбавляют водой (100 мл) и экстрагируют хлороформом (100 мл). Органический слой сушат над сульфатом натрия, фильтруют и растворители удаляют при пониженном давлении. Очистка с помощью флэш-хроматографии на силикагеле 60 с элюированием раствором этилацетата в гексанах концентрации 50% дает искомое соединение в виде белого твердого вещества (1,00 г, выход 50%), а также приводит к выделению 0,40 г исходного вещества; температура плавления 143-155 С; 1 Н ЯМР (DMSO-d6) : 8,51, 8,09, 8,00(часть а) настоящего примера, 1,51 г, 3,58 ммоль) в 20 мл безводного метиленхлорида при 0 С при перемешивании прибавляют триэтиламин (1,50 мл, 10,74 ммоль), а затем по каплям прибавляют метансульфонилхлорид (0,42 мл,5,37 ммоль). Реакционную смесь перемешивают в течение 10 мин, а затем выливают в воду со льдом (50 мл) и экстрагируют метиленхлоридом(2 порции по 50 мл). Объединенные органические экстракты последовательно промывают насыщенным раствором хлорида аммония и рассолом (по 50 мл), затем сушат над сульфатом натрия. Фильтрование и удаление растворителей при пониженном давлении приводит к неочищенному метилсульфонату (1,83 г), имеющему вид белой пены, которую растворяют в толуоле (25 мл), обрабатывают с помощью 1,8 диазабицикло[5.4.0]ундец-7-ена (1,40 мл, 8,95 ммоль) и кипятят с обратным холодильником в течение 48 ч. Затем реакционную смесь охлаждают до комнатной температуры, разбавляют этилацетатом (100 мл) и промывают насыщенным водным раствором хлорида аммония (50 мл), а затем рассолом (50 мл). Органические экстракты фильтруют на вакуумном фильтре через слой свежепрокаленного силикагеля, промывая его еще одной порцией этилацетата (50 мл), и растворители удаляют при пониженном давлении, получая 1,37 г (выход 94%) искомого соединения в виде желтовато-коричневого масла; 1 Н ЯМР (DMSO-d6, 200 МГц) : 8,39, 8,14,7,98 (синглет, все 1 Н), 6,25 (широкий дублет,J=10,5 Гц, 1 Н), 6,10 (широкий дублет, J=10,2 Гц,1 Н), 5,15 (мультиплет, 1 Н), 4,28 (мультиплет,1 Н), 3,84 (мультиплет, 4 Н), 0,91 (синглет, 9 Н),0,11, 0,91 (синглет, все 3 Н). с)(часть b) настоящего примера, 1,30 г, 3,14 ммоль) в 30 мл смеси ацетон-вода (состава 8:1) прибавляют 4-метилморфолин-N-оксид (0,42 г,3,45 ммоль), а затем тетраоксид осмия (0,60 мл раствора в трет-бутаноле концентрации 2,5%). Реакционную смесь перемешивают в течение 24 ч, а затем обрабатывают с помощью еще 0,6 мл раствора тетраоксида осмия и перемешивают еще 24 ч. Реакционную смесь концентрируют и хроматографируют на силикагеле 60. Искомое соединение элюируют раствором метанола в хлороформе концентрации 2% и после выпаривания растворителей получают белое стеклоd) (3R,4S,5S,6R)-5,6-Дихлор-1-(тетрагидро 4,5-дигидрокси-6-(гидроксиметил)-2 Н-пиран-3 ил)-1 Н-бензимидазол. Раствор (3R,4S,5S,6R)-1-(6-трет-бутилдиметилсилил)окси)-тетрагидро-4,5-дигидрокси-2 Н-пиран-3-ил)-5,6-дихлор-1 Н-бензимидазо ла (часть с) настоящего примера, 1,08 г, 3,00 ммоль) в тетрагидрофуране (100 мл) и 1 н. растворе НСl (3 мл) перемешивают в течение ночи. Реакционную смесь концентрируют при пониженном давлении и неочищенный остаток очищают с помощью флэш-хроматографии на силикагеле 60. Искомое соединение элюируют раствором метанола в хлороформе концентрации 10% и после выпаривания растворителей получают белое кристаллическое веществоe) (3R,4S,5S,6R)-2-Бром-5,6-дихлор-1-(4,5 диацетокси-6-(ацетоксиметил)тетрагидро-2 Нпиран-3-ил)-1 Н-бензимидазол. К раствору (3R,4S,5S,6R)-5,6-Дихлор-1(тетрагидро-4,5-дигидрокси-6-(гидроксиметил)2 Н-пиран-3-ил)-1 Н-бензимидазола (часть d) настоящего примера, 0,600 г, 1,80 ммоль) в безводном пиридине (50 мл) при перемешивании прибавляют уксусный ангидрид (2,00 мл, 2,0 ммоль). Через 12 ч реакционную смесь концентрируют при пониженном давлении, выпаривая с толуолом до получения вязкого масла. Прибавляют этанол (охлаждая снаружи льдом) и смесь повторно выпаривают с толуолом (2 раза). Это масло повторно растворяют в хлороформе(500 мл) и последовательно промывают с помощью 0,1 н. раствора НСl (100 мл), насыщенного водного раствора бикарбоната натрия (100 мл) и рассола (50 мл). Органический слой сушат (над сульфатом натрия), а затем фильтруют на вакуум-фильтре через слой (3 х 4 см) свежепрокаленного силикагеля 60, промывая хлороформом. Выпаривание растворителя при пониженном давлении приводит к получению не совсем белой пены (0,867 г, 1,89 ммоль), которую растворяют в безводном тетрагидрофуране (производства фирмы Aldrich Sure Seal, 15 мл) кипятят с обратным холодильником и к которой одной порцией прибавляют N-бромсукцинимид (про 002305 58 изводства фирмы Aldrich, 0,670 г, 3,78 ммоль). После 10 мин кипячения ТСХ на пластинках,покрытых силикагелем, при проявлении с помощью раствора метанола в хлороформе концентрации 10% показывает, что реакция завершена. Желтый раствор охлаждают до комнатной температуры; разбавляют хлороформом (200 мл) и промывают насыщенными водным раствором бикарбоната натрия (3 порции по 50 мл). Органический слой сушат (над сульфатом натрия), фильтруют и концентрируют при пониженном давлении. Неочищенный остаток очищают с помощью флэш-хроматографии на силикагеле 60. Элюирование раствором метанола в хлороформе концентрации 2% после удаления растворителей дает желтую пену. Растирание в смеси этанол-вода и фильтрование дает искомое соединение в виде белого кристаллического твердого вещества (0,98 г, выход 83%); температура плавления 196-199 С; 1 Н ЯМР (DMSO-d6, 200 МГц) : 8,27 8,00(3R,4S,5S,6R)-2-Бpoм-5,6-дихлор-1-(4,5 диацетокси-6-(ацетоксиметил)тетрагидро-2 Нпиран-3-ил)-1 Н-бензимидазол (часть е) настоящего примера, 0,810 г, 1,53 ммоль), растворяют в смеси метанол-этанол состава 1:1 (100 мл) и обрабатывают раствором карбоната натрия(0,163 г, 1,53 ммоль) в воде (10 мл). После выдерживания в течение 0,5 ч при комнатной температуре анализ с помощью ТСХ обнаруживает одно новое пятно (силикагель, раствор метанола в хлороформе концентрации 10%). Затем значение рН доводят до 5 с помощью ледяной уксусной кислоты и растворители выпаривают в вакууме. Оставшееся твердое вещество суспендируют в воде, так чтобы твердое вещество не содержало комков, затем фильтруют на вакуумном фильтре и сушат в вакууме в течение ночи,получая искомое соединение в виде белого твердого вещества (0,510 г, выход 81%); температура плавления 207-209 С; 59 Анализ. Вычислено для C13H13BrCl2N2O4: С 37,89; Н 3,18; N 6,080; сумма галогенов в пересчете на Сl 17,20. Найдено: С 38,08; Н 3,2; N 6,86; сумма галогенов в пересчете на Сl 17,15. Пример 41. (3R,4S,5S,6R)-5,6-Дихлор-2(циклопропиламино)1-(тетрагидро-4,5-дигидрокси-6-(гидроксиметил)-2 Н-пиран-3-ил)-1 Нбензимидазол. Раствор (3R,4S,5S,6R)-5,6-дихлоp-1-(тетрагидро-4,5-дигидрокси-6-(гидроксиметил)-2 Нпиран-3-ил)-1 Н-бензимидазола (пример 40,часть е), 0,300 г, 0,728 ммоль) и циклопропиламина (производства фирмы Aldrich, 2,50 мл, 36 ммоль) в абсолютном этаноле (10 мл) кипятят с обратным xолодильником в атмосфере азота в течение 24 ч. Прибавляют 1 н. раствор гидроксида натрия (0,73 мл) и реакционную смесь концентрируют при пониженном давлении. Оставшиеся твердые вещества хроматографируют на силикагеле 60. Искомое соединение элюируют раствором метанола в хлороформе концентрации 10% и после выпаривания растворителей получают белую пену (0,100 г, выход 34%); температура давления 244 С (с разложением);(синглет, все 1 Н), 7,37 (широкий синглет, 1 Н),5,33 (мультиплет, 1H), 4,91 (мультиплет, 2 Н),4,36 (мультиплет, 1 Н), 4,10-3,90 (мультиплет,3 Н), 3,69 (мультиплет, 3 Н), 2,80 (мультиплет,1H), 2,45 (мультиплет, 1H), 0,72-0,51 (мультиплет, 4 Н). Анализ. Вычислено для С 16 Н 19 Сl2N3O4 3,0 Н 2 О: С 43,10; Н 5,74; N 9,42; Cl 15,90. Найденo: С 43,27; Н 5,56; N 9,37; Cl 15,64. Пример 42. (3S,4R,5R,6S)-2-Бром-5,6 дихлор-1-(тетрагидро-4,5-дигидрокси-6-(гидроксиметил)-2 Н-пиран-3-ил)-1 Н-бензимидазол. Искомое соединение получают таким же образом, что и энантиомер, описанный в примере 40, исходя из L-глюкозного производного 2S,4S,7S,8R-пергидро-7-гидрокси-2-фенилпирано(3,2-D)-1,3-диоксина[]20D +175 (с 0,25, этанол); 1 Н ЯМР (CDCl3, 200 МГц), данные совпадают с данными для его энантиомера. Анализ. Вычислено для C13H13BrCl2N2O4: С 37,89; Н 3,18; N 6,80; сумма галогенов в пересчете на Сl 17,20. Найдено: С 38,17; Н 3,24; N 6,76; сумма галогенов в пересчете на Сl 17,13. Пример 43. (3S,4R,5R,6S)-5,6-Дихлор-2(циклопропиламино)1-(тетрагидро-4,5-дигидрокси-6-(гидроксиметил)-2 Н-пиран-3-ил)-1 Нбензимидазол. Искомое соединение получают таким же образом, что и энантиомер (пример 41), исходя из L-глюкозного производного 2S,4S,7S,8- 002305H ЯМР (CDCl3 200 МГц), данные совпадают с данными, приведенными в примере 41. Анализ. Вычислено для C16H19Cl2N3O4 0,60H2O: С 48,16; Н 5,10; N 10,53; Cl 17,77. Найдено: С 48,87; Н 5,05; N 10,38; Cl 17,65. Пример 44. (3S,4R,5R,6S)-5,6-Дихлор-2(изопрoпиламино)1-(тетрагидро-4,5-дигидрокси-6-(гидроксиметил)-2 Н-пиран-3-ил)-1 Нбензимидазол. Раствор (3S,4R,5R,6S)-2-бром-5,6-дихлор 1-(тетрагидро-4,5-дигидрокси-6-(гидроксиметил)-2 Н-пиран-3-ил)-1 Н-бензимидазола (пример 43, 0,328 г, 0,795 ммоль) в изопропиламине (10 мл) в течение ночи нагревают в запаянной трубке при температуре 100 С. Прибавляют 1 н. раствор гидроксида натрия (0,80 мл) и реакционную смесь концентрируют при пониженном давлении. Оставшиеся твердые вещества хроматографируют на силикагеле 60. Искомое соединение элюируют раствором метанола в хлороформе концентрации 2-10% и после выпаривания растворителя оно имеет вид белой пеныRevankar, Chem. Rev. 1970, 70:389 и цитированная там литература) (5,00 г, 26,0 ммоль) растворяют в N,N-диметилформамиде (65 мл) и прибавляют гидрид натрия (дисперсия в масле концентрации 60%, 50 мг). Раствор нагревают до 145 С и 3 порциями в течение 3 ч прибавляют циклогексеноксидAldrich, 7,8 г, 26 ммоль). Раствор нейтрализуют 1 н. раствором хлористо-водородной кислоты и выпаривают до получения пурпурного твердого вещества. Твердое вещество перекристаллизовывают из этанола и получают искомое соединение в виде розовых кристаллов (12,55 г, выход 88%); температура плавления 236-238 С. Анализ. Вычислено для С 13 Н 14 Сl2N2 О: С 54,74; Н 4,95; N 9,82; Cl 24,86. Найдено: С 54,91; Н 4,84; N 9,80; Cl 24,93.
МПК / Метки
МПК: A61P 31/12, C07H 19/052, C07D 235/06, A61K 31/7056
Метки: бензимидазола, производные
Код ссылки
<a href="https://eas.patents.su/30-2305-proizvodnye-benzimidazola.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензимидазола</a>
Предыдущий патент: Способ измерения геронтологической ценности биоактивных веществ и композиций, преимущественно пищевых и косметических продуктов
Следующий патент: Нефтеводяной центробежно-фильтрующий сепаратор
Случайный патент: Способ дистилляции (мет) акриловых кислот












