Полиморфная форма гемисульфата 3-(n-метил) – 2 (r) – пирролидинилметил-5-(2-фенилсульфонилэтил) – 1н-индола
Номер патента: 4510
Опубликовано: 29.04.2004
Авторы: Ховард-Филд Саймон Арнольд, Огилви Рональд Джеймс, Бентли Артур
Формула / Реферат
1. Кристаллическая полиморфная форма соединения формулы (I)

характеризующаяся картиной рентгеновской дифракции порошка, полученной с использованием излучения меди K-альфа1 (l = 0,15046 нм), которая демонстрирует основные пики при 9,28; 10,38; 11,37; 12,40; 16,84; 17,46; 17,53; 17,78; 17,98; 19,48; 20,70; 21,29; 21,45; 22,21; 22,64; 23,08; 25,20 и 25,79.
2. Соединение по п.1, которое дополнительно характеризуется инфракрасным спектром (таблетки KBr), демонстрирующим значительные полосы абсорбции при n=3385,3; 3172,0; 3143,8; 3058,0; 3022,6; 2954,8; 2928,3; 2893,5; 2650,7; 2436,4; 1622,6; 1584,1; 1480,8; 1445,6; 1362,4; 1354,4; 1304,8; 1246,0; 1229,9; 1164,3; 1149,6; 1137,5; 1087,1; 1071,7; 1019,5; 958,9; 929,8; 899,1; 878,9; 842,6; 793,8; 759,3; 751,4; 731,3; 690,4; 619,9; 606,3; 564,9; 533,7; 512,2; 503,6; 485,3; 457,5 и 428,9 см-1.
3. Соединение по п.2, которое дополнительно характеризуется кривой дифференциальной сканирующей калориметрии DSC, которая демонстрирует пик эндотермы при 226шC.
4. Фармацевтическая композиция, содержащая соединение по любому из пп.1-3 вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем.
5. Фармацевтическая композиция по п.4, в виде твердой или жидкой дозированной формы.
6. Фармацевтическая композиция по п.5, которая представляет собой обычную таблетку или таблетку с контролируемым высвобождением или быстро распадающуюся либо раствор для интраназального или внутривенного введения.
7. Соединение по любому из пп.1-3 для использования в качестве медикамента.
8. Применение соединения по любому из пп.1-3 для получения медикамента для лечения или профилактики состояний, при которых показан агонист 5-HT1 рецептора.
9. Применение по п.8, где указанное состояние представляет собой мигрень или связанные состояния, такие как мигрень, хроническая пароксимальная гемикрания или головная боль, связанная с сосудистыми заболеваниями.
10. Применение по п.8, где указанное состояние представляет собой депрессию, тревожное состояние, нарушение питания, ожирение, злоупотребление лекарствами, гипертонию и рвоту.
11. Способ лечения или профилактики состояния, при котором показан агонист 5-HT1-рецептора, который включает введение терапевтически эффективного количества соединения по изобретению по любому из пп.1-3.
12. Способ по п.11, где медицинское состояние представляет собой мигрень или связанные состояния, такие как мигрень, хроническая пароксимальная гемикрания или головная боль, связанная с сосудистыми заболеваниями.
13. Способ по п.11, где медицинское состояние представляет собой депрессию, тревожное состояние, нарушение питания, ожирение, злоупотребление лекарствами, гипертонию и рвоту.
14. Способ получения кристаллической полиморфной формы соединения формулы (I), характеризующейся картиной рентгеновской дифракции порошка, полученной с использованием излучения меди K-альфа1 (l = 0,15046 нм), которая демонстрирует основные пики при 9,28; 10,38; 11,37; 12,40; 16,84; 17,46; 17,53; 17,78; 17,98; 19,48; 20,70; 21,29; 21,45; 22,21; 22,64; 23,08; 25,20 и 25,79, включающий обработку раствора соединения формулы (II)
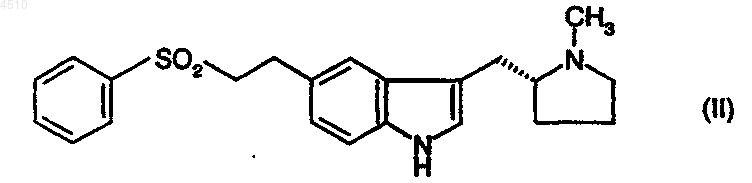
в первом растворителе концентрированной серной кислотой с последующим
(a) нагреванием при кипячении с обратным холодильником в первом растворителе, охлаждением и выделением требуемого полиморфа либо
(b) отделением полученной взвеси, поглощением вторым растворителем, нагреванием при кипячении с обратным холодильником, охлаждением и выделением требуемого полиморфа.
15. Способ по п.14, в котором первый растворитель представляет собой ацетон или тетрагидрофуран.
16. Способ по п.14, в котором первый растворитель представляет собой ацетон или тетрагидрофуран, второй растворитель представляет собой ацетон, тетрагидрофуран, этанол, изопропанол или промышленный метилированный спирт.
17. Способ по любому из пп.14-16, где кристаллизация требуемого полиморфа индуцируется введением затравки.
18. Способ по любому из пп.14-17, в котором полиморф, полученный таким образом, дополнительно характеризуется своим инфракрасным спектром (таблетки KВr), демонстрирующим значительные полосы абсорбции при n= 3385,3; 3172,0; 3143,8; 3058,0; 3022,6; 2954,8; 2928,3; 2893,5; 2650,7; 2436,4; 1622,6; 1584,1; 1480,8; 1445,6; 1362,4; 1354,4; 1304,8; 1246,0; 1229,9; 1164,3; 1149,6; 1137,5; 1087,1; 1071,7; 1019,5; 958,9; 929,8; 899,1; 878,9 842,6; 793,8; 759,3; 751,4; 731,3; 690,4; 619,9; 606,3; 564,9; 533,7; 512,2; 503,6; 485,3; 457,5 и 428,9 см-1.
19. Способ по п.18, где полусульфатный полиморф, полученный таким образом, дополнительно характеризуется кривой DSC, демонстрирующей пик эндотермы при 226шC.
Текст
1 Настоящее изобретение относится к гемисульфатной соли лекарственного средства против мигрени 3-(N-метил)-2(R)-пирролидинилметил-5-(2-фенилсульфонилэтил)-1 Н-индола,имеющего формулу (I) Более конкретно изобретение относится к определенной поли морфной форме названной ими гемисульфатной соли, к способу получения названной формы, к содержащим ее фармацевтическим композициям и к их использованию в медицине, в частности при лечении состояний,при которых показан агонист 5-НТ 1-рецептора,например, мигрени. Международная патентная заявка РСТ/США 91/07194 описывает ряд 3,5-двузамещенных индолов и их фармацевтически приемлемые соли. В ней, в частности, описывается гемисукцинатная соль 3-(N-метил)-2(R)-пирролидинилметил-5-(2-фенилсульфонилэтил)-1 Ниндола, как некристаллическая пена, не пригодная для получения фармацевтических композиций, но последующие исследования показали,что гемисульфатная, хлористо-водородная и бромисто-водородная соли являются достаточно кристаллическими и высокоплавкими, чтобы считаться пригодными для этой цели. Так европейский патент 0776323 касается конкретных полиморфных форм соответствующих бромисто-водородных солей и с целью сравнения описывает две полиморфные формы гемисульфатной соли, которые определяются здесь, как - и -формы. В противоположность полиморфам (полиморфным формам) бромистоводородной соли, - и -полиморфы гемисульфатной соли описаны как гигроскопичные полиморфно нестабильные и склонные к изменению цвета и пленкообразованию на пуансоне(штампе) в процессе таблетирования. Короче говоря, полусульфатные полиморфы, описанные в '323, считаются не пригодными для получения твердых дозированных форм. Международная патентная заявка PCT/ED 98/04176 касается водных фармацевтических композиций, содержащих предпочтительные бромисто-водородные полиморфы, описанные в'323, и с целью сравнения описывает получение соответствующей гемисульфатной композиции. Гемисульфатная соль, использующаяся для получения названной композиции, представляет собой -полиморф, описанный в '323. Авторы заявки неожиданно обнаружили,что существует третий полиморф гемисульфатной соли 3-(N-метил)-2(R)-пирролидинилметил 5-(2-фенилсульфонилэтил)-1 Н-индола, в котором преодолены невыгодные свойства, связанные с - и -формами, описанными в европейском патенте 0776323. Кроме того, он имеет преимущества над предпочтительным поли 004510 2 морфом соответствующей бромисто-водородной соли с точки зрения получения жидкого дозированного препарата. Так, проблема, на которую направлено настоящее изобретение состоит в обеспечении фармацевтически приемлемой гемисульфатной соли 3-(N-метил)-2(R)-пирролидинилметил-5(2-фенилсульфонилэтил)-1 Н-индола,которая может подвергаться эффективной обработке для получения стабильных и эффективных фармацевтических композиций в особенности в твердой или жидкой дозированной форме. Важный критерий, который должен быть удовлетворенinter alia состоит в том, что выбранная соль должна быть кристаллической, не гигроскопичной и способной к прессованию, стабильной в твердом состоянии, и иметь подходящую точку плавления и приемлемые характеристики растворимости. Как было указано, эта проблема неожиданно разрешена обнаружением новых полиморфных форм гемисульфатной соли 3-(Nметил)-2(R)-пирролидинилметил-5-(2-фенилсульфонилэтил)-1 Н-индола, которые удовлетворяют вышеприведенным требованиям, и преодолевают неудобства, связанные с - и полиморфами, описанными в Европейском патенте 0776323, и имеет преимущества в отношении стабильности и способности к получению жидкой дозированной формы в сравнении с предпочтительными полиморфами соответствующей бромисто-водородной соли. Так, в соответствии с настоящим изобретением, предлагается кристаллическая полиморфная форма соединения формулы (I), характеризующаяся картиной рентгеновской дифракции порошка,имеющей основные пики при 9,28; 10,38; 11,37; 12,40; 16,84; 17,46; 17,53; 17,78; 17,98; 19,48; 20,70; 21,29; 21,45; 22,21; 22,64; 23,08; 25,20 и 25,79. Полиморф по изобретению дополнительно характеризуется инфракрасным (IR) спектром,который демонстрирует значительные полосы абсорбции при = 3385,3; 3172,0; 3143,8; 3058,0; 3022,6; 2954,8; 2928,3; 2893,5; 2650,7; 2436,4; 1622,6; 1584,1; 1480,8; 1445,6; 1362,4; 1354,4; 1304,8; 1246,0; 1229,9; 1164,3; 1149,6; 1137,5; 1087,1; 1071,7; 1019,5; 958,9; 929,8; 899,1; 878,9; 842,6; 793,8; 759,3; 751,4; 731,3; 690,4; 619,9; 606,3; 564,9; 533,7; 512,2; 503,6; 485,3; 457,5 и 428,9 см-1. Полиморф по изобретению, кроме того,характеризуется кривой дифференциальной сканирующей калориметрии (DSC), которая показывает пик эндотермы при 226 С, соответствующей его точке плавления. Существенным отличием по отношению к- и - полиморфам гелисульфатный полиморф настоящего изобретения показывает незначительную гигроскопичность, отсутствие изменений в его полиморфной форме через семь меся 3 цев, что продемонстрировано с помощью рентгеновской дифракции порошка (PXRD) и дифференциальной сканирующей калориметрии(DSC), и отсутствие значительного изменения цвета или образования пленки на пуансоне(штампе) при компрессии. При рН 4,0 полиморф по изобретению имеет растворимость, подобную растворимости предпочтительного гидробромида '323, но при более биологически важном рН 6,0 его растворимость выражает до 478 мг/мл по сравнению с 2,90 мг/мл гидробромида. Следующие свойства делают полиморфы по изобретению чрезвычайно подходящими для получения фармацевтических композиций, в особенности в твердой или жидкой дозированной форме. Так, в соответствии со следующим аспектом настоящего изобретения, полиморф по изобретению и его фармацевтические композиции предлагаются для использования в качестве медикаментов. Настоящее изобретение также предлагает способ получения названного полиморфа или в одном растворителе, или путем повторной обработки изначально полученного продукта в другом растворителе. Повторная обработка обычно проводится в виде кипячения с обратным холодильником изначально образованного продукта в другом растворителе с последующим выделением требуемого полиморфа. Полиморф по изобретению может, например, быть получен(i) обработкой раствора 3-(N-метил)-2(R)пирролидинил метил-5-(2-фенилсульфонилэтил)-1 Н-индола в первом подходящем растворителе, например ацетоне или тетрагидрофуране,концентрированной серной кислотой обычно при температуре от -2 до 2 С с последующим нагреванием при кипячении с обратным холодильником в том же растворителе; или(ii) обработкой раствора 3-(N-метил)-2(R)пирролидинилметил-5-(2-фенилсульфонилэтил)-1 Н-индола в первом подходящем растворителе, обычно ацетоне, концентрированной серной кислотой обычно при температуре от -2 до 2 С с последующим отделением полученной в результате взвеси и повторной обработкой во втором подходящем растворителе, например тетрагидрофуране. В обоих случаях полученный в результате раствор охлаждают, и выделяют требуемый полиморф. Для индуцирования кристаллизации может быть использовано выделение затравки,но обычно это не является необходимым. В соответствии со следующим аспектом настоящего изобретения предлагается фармацевтическая композиция, содержащая гемисульфатный полиморф по настоящему изобретению вместе с фармакологически приемлемым эксципиентом, разбавителем или носителем. Так, соединение по изобретению может вводиться само по себе, но обычно вводится в смеси с подходящим фармацевтическим эксци 004510 4 пиентом, разбавителем или носителем, выбранным исходя из предусмотренного пути введения и в соответствии со стандартной фармацевтической практикой. Например, соединение по изобретению можно вводить перорально, буккально или подъязычно в форме необязательно ароматизированных и/или окрашенных таблеток, капсул,овули, эликсиров, растворов или суспензий,пригодных для введения с немедленным, отсроченным или контролируемым высвобождением. Соединение может быть введено внутривенно. Такие таблетки могут содержать эксципиенты, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция,двухосновный фосфат кальция или глицин, дезинтегрирующие агенты, такие как крахмал(предпочтительно кукурузный, картофельный или крахмал тапиоки, натрий крахмал гликолят,натрийкроскармелоза или определенные комплексные силикаты и связывающие вещества для грануляции, такие как поливинилпирролидон,гидроксипропилметилцеллюлоза(НРМС), гидроксипропилцеллюлоза (НРС), сахароза, желатин или акация. Дополнительно могут быть включены смазывающие агенты,такие как стеарат магния, стеариновая кислота,глицинбегенат или тальк. Твердые композиции подобного типа могут также использоваться как наполнители желатиновых капсул. Предпочтительные эксципиенты с этом случае включают лактозу, крахмал,целлюлозу, молочный сахар или полиэтиленгликоль с высоким молекулярным весом. Для водных суспензий и/или эликсиров соединение может быть объединено с различными подслащивающими или ароматизирующими агентами,красителями или пигментами, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как вода, этанол, пропиленгликоль или глицин, или их сочетанием. Соединение также может вводиться парентерально, например, внутривенно, внутриартериально, интраперитонеально, внутриоболочечно (интравентрикулярно), интрастенально,интракраниально, внутримышечно или подкожно, или оно может вводиться с помощью инфузионных методик. Лучше всего его использовать в форме стерильного водного раствора,который может содержать другие вещества, например, достаточно солей или глюкозы, чтобы сделать раствор изотоничным крови. При необходимости водный раствор может быть соответствующим образом буферирован, предпочтительно до рН от 3 до 9. Получение подходящей парентеральной готовой препаративной формы в стерильных условиях легко выполнимо с помощью стандартных фармацевтических методик, хорошо известных в уровне техники. Для перорального и парентерального введения человеку ежедневная доза соединения 5 формулы (I) обычно составляет от 0,01 до 20 мг/кг (в одной или двух дозах). Так, таблетки или капсулы соединения по изобретению могут содержать от 0,5 мг до 0,5 г активного соединения для введения в один, или два, или большее количество приемов, если приемлемо. Лечащий врач в каждом случае определит фактическую дозу, которая будет наиболее подходящей для любого конкретного,больного, и она различается в зависимости от возраста, веса и индивидуальной реакции конкретного больного. Вышеприведенные дозы являются примерными, определенными для среднего случая. Могут быть, конечно, отдельные случаи, когда приемлемы более высокие и более низкие дозы, которые также входят в область настоящего изобретения. Соединение по изобретению также может вводиться интраназально или путем вдыхания, и их удобно использовать в форме ингалятора с сухим порошком или аэрозоля, распыляемого из контейнера под давлением, насоса, спрея или распылителя, используя подходящий пропеллент, например, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, гидрофторалкан, такой как 1,1,1,2-тетрафторэтан(HFA 134 А [торговая марка]) или 1,1,1,2,3,3,3 гептафторпропан (HFA 227 ЕА [торговая марка]), диоксид углерода или другие подходящие газы. В случае аэрозоля под давлением дозированная единица может определяться наличием клапана для доставки(высвобождения) отмеренного количества. Контейнер под давлением, насос, спрей или небулайзер (распылитель) может содержать раствор или суспензию активного соединения, например, используя смесь этанола и пропеллента как растворитель, который может дополнительно содержать смазывающее вещество, например сорбитантриолеат. Капсулы и картриджи (сделанные, например, из желатина) для использования в ингаляторе или инсуффляторе могут быть приготовлены таким образом,что содержат смесь порошка соединения и подходящую порошкообразную основу, такую как лактоза или крахмал. Готовую препаративную форму в виде аэрозоля или порошка предпочтительно готовят так, чтобы каждая отмеренная доза или пшик содержала от 25 мкг до 10 мг соединения формулы (I) для введения больному. Полная дневная доза при аэрозольном введении колеблется в пределах от 100 мкг до 10 мг, и может вводиться одной дозой или, наиболее часто, быть разделена на несколько доз, вводимых в течение дня. Альтернативно соединение по изобретению можно вводить в форме суппозитория или пессария, или его можно вводить местно в форме лосьона, раствора, крема, мази или мелкого порошка (присыпки). Соединение также можно вводить трансдермально, например с помощью кожного пластыря, или глазным путем. 6 Для глазного пути введения соединение может быть оформлено в виде микронизированной суспензии в изотоническом, рН-доведенном стерильном физиологическом растворе или предпочтительно, в виде растворов в изотоническом, рН-доведенном стерильном физиологическом растворе, необязательно в сочетании с консервантом, таким как бензилалкония хлорид. Альтернативно он может быть приготовлен в виде мази, такой как петролатум. Для местного применения на коже соединение по изобретению может быть приготовлено в виде подходящей мази, содержащей активное соединение, суспендированное или растворенное, например, в смеси одного или большего количества следующих ингредиентов: минеральное масло, жидкий петролатум, белый петролатум, пропиленгликоль, полиоксиэтиленполиоксипропиленовое соединение, эмульгированный воск или вода. Альтернативно, оно может быть приготовлено в виде подходящего лосьона или крема, суспендировано или растворено, например, в смеси одного или большего количества следующих ингредиентов: минеральное масло, сорбитанмоно-стеарат, полиэтиленгликоль, жидкий парафин, полисорбат 60,цетиловые сложные эфиры воска, цетариловый спирт, 2-октилдодеканол, бензиловый спирт или вода. Особенно предпочтительные композиции в соответствии с изобретением включают обычные таблетки, а также таблетки с контролируемым высвобождением или быстрораспадающиеся либо интраназальные и внутривенные растворы, все легко приготовить общепринятыми способами, используя полиморф по изобретению. Наконец, изобретение предлагает использование гемисульфатного полиморфа по изобретению для получения медикаментов для лечения или профилактики состояний, при которых показан агонист 5-HT1-рецептора, а также для способа лечения или профилактики медицинских состояний, при которых показан агонист 5-HT1 рецептора, которые включают введение терапевтически эффективного количества гемисульфатного полиморфного соединения по изобретению. Такие состояния включают мигрень и связанные с ней состояния, такие как мигрень,хроническая пароксимальная гемикрания и головная боль, связанная с сосудистыми заболеваниями, депрессией, тревожными состояниями,нарушением питания, ожирением, злоупотреблением лекарствами, гипертонией и рвотой. Получение гемисульфатного полиморфа по изобретению и его фармацевтических композиций проиллюстрировано следующими примерами. Пример 1. Раствор 3-(N-метил-2(R)пирролидинилметил)-5-(2-фенилсульфонилэтил)-1 Н-индола (14 г) в ацетоне (221 мл) нагретый до температуры кипения с обратным холо 7 дильником обрабатывают раствором 98% серной кислоты (1,795 г) в ацетоне (59 мл), добавляя этот кислый раствор по каплям в течение 50 мин. Полученную в результате взвесь перемешивают при кипячении с обратным холодильником в течение 2 ч, затем охлаждают до 0 С в течение 1 ч, затем собирают фильтрацией, промывают ацетоном (42 мл) и сушат в вакууме(14,74 г). Выделенная соль показывает однуDSC эндотерму при 226 С, соответствующую требуемому полиморфу. Пример 2. Раствор 3-(N-метил-2(R)пирролидинилметил)-5-(2-фенилсульфонилэтил)-1 Н-индола (14 г) в тетрагидрофуране (100 мл), охлажденный на бане со льдом, обрабатывают раствором 98% серной кислоты (1,795 г) в тетрагидрофуране (35 мл), добавляя этот раствор кислоты по каплям в течение приблизительно 1 ч. Полученную в результате взвесь нагревают до комнатной температуры, разбавляют дополнительным количеством тетрагидрофурана (60 мл), затем нагревают до кипячения с обратным холодильником и поддерживают при этой температуре в течение ночи. Полученную в результате взвесь охлаждают на бане со льдом и перемешивают в течение 30 мин, затем фильтруют, промывают тетрагидрофураном (20 мл) и сушат в вакууме (15,28 г). Выделенная соль показывает одну DSC эндотерму при 226 С, соответствующую требуемому полиморфу. Пример 3. 3-(N-метил-2(R)-пирролидинилметил)-5-(2-фенилсульфонилэтил)-1 Н-индола(344,3 г, 0,9 моль) растворяют в ацетоне (4 л) и фильтруют, промывая ацетоном (2,89 л). К раствору добавляют серную кислоту (43,8 г, 0,438 моль) при температуре от -2 до 2 С. Образуется гранулированная взвесь. Это вещество фильтруют, промывают ацетоном (2 х 350 мл) с получением полусульфата смешанной морфологии(381,5 г, 98%). Соль сушат, измельчают в ступке, и затем из 370 г вновь получают взвесь в кипящем с обратным холодильником тетрагидрофуране (2,96 л) в течение 20 ч. Смесь охлаждают и фильтруют, промывают тетрагидрофураном (200 мл) и сушат в вакууме при 50 С (361 г, 97,6%). Выделенная соль показывает однуDSC эндотерму при 226 С и ИК-спектр (в таблетке КВr), соответствующие требуемому полиморфу. Пример 4. Из гемисульфата смешанной морфологии, полученного способом из примера 3 (1,5 г), получают взвесь в кипятящем с обратным холодильником этаноле (30 мл) в течение 23 ч. Смесь охлаждают, затем фильтруют, промывают этанолом (1 мл) и сушат в вакууме при 50 С. Выделенная соль показывает одну DSC эндотерму при 226 С, соответствующую требуемому полиморфу. Пример 5. Из гемисульфата смешанной морфологии, полученного способом из примера 3 (1,5 г), получают взвесь в кипящем с обратным холодильником изопропаноле (30 мл) в 8 течение 23 ч. Смесь охлаждают, затем фильтруют, промывают изопропанолом (1 мл) и сушат в вакууме при 50 С. Выделенная соль показывает одну DSC эндотерму при 226 С, соответствующую требуемому полиморфу. Пример 6. Из гемисульфата смешанной морфологии, полученного способом из примера 3 (1,5 г), получают взвесь в кипящем с обратным холодильником промышленном метилированном спирте (ПМС) (30 мл) в течение 23 ч. Смесь охлаждают, затем фильтруют, промывают ПМС (1 мл) и сушат в вакууме при 50 С. Выделенная соль показывает одну DSC эндотерму при 226 С, соответствующую требуемому полиморфу. Пример 7. Таблетки для перорального введения. А. Прямое прессование Активный ингредиент Микрокристаллическая целлюлоза РН Eur (Европейская Фармакопея) Лактоза РН Eur Натрий кроскармелоза NF(Национальная Фармакопея) Стеарат магния РН Eur Активный ингредиент просеивают и смешивают с другими компонентами. Полученную смесь прессуют в таблетки, используя ротарный пресс для таблетирования. (Manestry Betapress), снабженный 6 мм нормальными вогнутыми пуансонами (штампами). Полученные таблетки могут быть покрыты пленкой из соответствующего пленкообразующего вещества. В. Влажная грануляция Активный ингредиент Лактоза РН Eur Маисовый крахмал РН Eur Поливинилпирролидон(5% вес./объем раствор) Натрий-кроскармелоза NF Стеарат магния РН Eur Поливинилпирролидон растворяют в очищенной воде до соответствующей концентрации. Активный ингредиент просеивают и перемешивают со всеми остальными компонентами,за исключением стеарата магния. Добавляют подходящие объемы раствора поливинилпирролидона и порошки гранулируют. После сушки гранулы просеивают и смешивают со стеаратом магния. Гранулы затем прессуют в таблетки,используя пуансоны подходящего диаметра. Можно получить таблетки другой твердости, изменяя соотношение активного ингредиента и эксципиентов или силу компрессии и используя подходящие пуансоны. Пример 8. Таблетка с контролируемым высвобождением мг/табл. Активный ингредиент 48,48 Лактоза РН Eur 49,52 Гидроксипропилметилцеллюлоза РН Eur 100,00 Стеарат магния РН Eur 2,0 Активный ингредиент просеивают и смешивают с другими компонентами. Полученную смесь прессуют в таблетки, используя ротационный пресс для таблетирования (Manestry Betapress), снабженный 8 мм нормальными вогнутыми штампами. Полученные таблетки могут быть покрыты пленкой из соответствующего пленкообразующего покрывающего вещества. Пример 9. Таблетки быстрораспадающиеся Активный ингредиент Желатин РН Eur Маннитол РН Eur Аспартам РН Eur Пример 10. Капсулы Активный ингредиент Лактоза РН Eur Маисовый крахмал РН Eur Коллоидная безводная окись кремния РН Eur Стеарат магния РН Eur Вес содержимого капсулы Активный ингредиент просеивают и смешивают с другими компонентами. Смесью заполняют твердые желатиновые капсулы размером 2, используя подходящее устройство. Другие дозы могут быть получены при изменении веса содержимого капсулы и если необходимо размера капсулы. Пример 11. Подъязычные таблетки Активный ингредиент Лактоза РН Eur Маисовый крахмал РН Eur Маннитол РН Eur Натрий кроскармелоза NF Стеарат магния РН Eur Активный ингредиент просеивают через подходящее сито, смешивают с эксципиентами и прессуют таблетки, используя подходящие пуансоны. Можно получить таблетки другой твердости, изменяя отношение активных ингредиентов к эксципиентам или компрессионную силу и используя подходящие пуансоны. Пример 12. Интраназальный раствор Активный ингредиент Глицерин Аскорбиновая кислота рН готовой препаративной формы доводится до 4,0-5,0, предпочтительно до около рН 4,5, используя водный раствор гидроокиси натрия. Пример 13. Внутривенный раствор Активный ингредиент Хлорид натрия 10 рН готовой препаративной формы доводится до рН около 6,0 водным раствором гидроокиси натрия. Характеристика с помощью PXRD, IR и DSC анализа(a) PXRD. Картину PXRD получают, используя дифрактометр Siemens D5000, снабженный автоматическом устройством для смены образцов,тета-тета гониометром, автоматической щелью для расходящегося пучка лучей, вторичным монохроматором и сцинцилляционным счетчиком. Образцы для анализа получают, размещая порошкообразный образец в полости диаметром 12 мм и глубиной 0,25 мм, которая вырезана в силиконовой подложке для крепления образца. Образец вращают, облучая излучением меди Kальфа 1 ( = 0,15046 нм) с помощью рентгеновской трубки, работающей при 40 кВ/40 мА. Анализ осуществляют гониометром, работающим в постоянном режиме, установленном на 5 секундный сигнал, на шаг 0,02 в интервале 2 тета от 2 до 55. Для идентификации главного пика (степень 2 тета), видного на каждой картине (фиг. 1, где 'Р 226' является полиморфом по изобретению и 'CPS ' представляет сигналы в минуту) см. выше.(b) ИК-спектроскопия. ИK(IR) спектр определяют при длине волныот 4000 до 4 00 см-1, используя спектрометр Nicolet 800 FT-IR, снабженный детекторомd-TGS. Спектр получают при разрешении 2 см-1 на образце, приготовленном из таблетки KВr. Для идентификации значенияполосы поглощения (фиг. 2, где 'Р 226' является полиморфом по изобретению), см. выше.(c) Дифференциальная сканирующая калориметрия. Образец (около 3 мг) 3226 анализируют,используя Perkin Elmer DSC7 с анализаторомрегулятором температуры при скорости сканирования со сканирующей скоростью 20 в минуту в интервале от 25 до 300 С. Для идентификации эндотермы (фиг. 3, где 'Р 226' является полиморфом по изобретению), см. выше. Исследование гигроскопичности Сорбцию влаги тремя известными полиморфами (- и -формами и настоящего изобретения) гемисульфата 3-(N-метил)-2(R)-пирролидинилметил-5-(2-фенилсульфонилэтил)-1 Ниндола определяют, используя динамическое поглощение пара (DVS) на приборе DVS-1 для автоматического анализа поглощения производства Surface Measurements Systems Ltd, UK. Каждый полиморф анализируют путем тщательного взвешивания приблизительно 25 мг в чашечке для образца, который затем подвергают воздействию влаги в интервале от 0 до 75% ОВ (относительная влажность). Температура анализа составляет 30 С при скорости потока азота 200 см 3 мин-1.'Р 226' представляет полиморф по изобретению),иллюстрирует изотерму сорбции влаги для трех полиморфов, гемисульфатной соли 3-(N-метил)2(R)-пирролидинилметил-5-(2-фенилсульфонилэтил)-1 Н-индола. Данные показывают, что полиморф по изобретению значительно менее гигроскопичен, чем - и -формы, в особенности при ОВ выше 40%. Исследование стабильности Образец полиморфного соединения, хранящийся в течение нескольких месяцев в условиях окружающей среды, вновь подвергаютPXRD и DSC и обнаруживают, что он остался полностью неизменным, то есть в течение интересующего периода не произошло никаких полиморфных превращений. Компрессионное исследование Прессование образца полиморфного соединения по изобретению в прессе IR bench при давлении 5 т в течение 1 мин используя 13 мм пуансон и фиксирующий краситель не произвело никакого значительного изменения цвета и очевидного пленкообразования на штампе. Исследование растворимости При рН 4,0 обнаружено, что полиморф по изобретению имеет растворимость, сравнимую с растворимостью предпочтительного гидробромида, описанного в европейском патенте 0776323. При рН 6,0, однако, растворимость повышается до 478 мг/мл, в сравнении с растворимостью гидробромида, составляет только 2,90 мг/мл. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая полиморфная форма соединения формулы (I) характеризующаяся картиной рентгеновской дифракции порошка, полученной с использованием излучения меди K-альфа 1 (= 0,15046 нм),которая демонстрирует основные пики при 9,28; 10,38; 11,37; 12,40; 16,84; 17,46; 17,53; 17,78; 17,98; 19,48; 20,70; 21,29; 21,45; 22,21; 22,64; 23,08; 25,20 и 25,79. 2. Соединение по п.1, которое дополнительно характеризуется инфракрасным спектром (таблетки KВr), демонстрирующим значительные полосы абсорбции при = 3385,3; 3172,0; 3143,8; 3058,0; 3022,6; 2954,8; 2928,3; 2893,5; 2650,7; 2436,4; 1622,6; 1584,1; 1480,8; 1445,6; 1362,4; 1354,4; 1304,8; 1246,0; 1229,9; 1164,3; 1149,6; 1137,5; 1087,1; 1071,7; 1019,5; 958,9; 929,8; 899,1; 878,9; 842,6; 793,8; 759,3; 751,4; 731,3; 690,4; 619,9; 606,3; 564,9; 533,7; 512,2; 503,6; 485,3; 457,5 и 428,9 см-1. 12 3. Соединение по п.2, которое дополнительно характеризуется кривой дифференциальной сканирующей калориметрии DSC, которая демонстрирует пик эндотермы при 226 С. 4. Фармацевтическая композиция, содержащая соединение по любому из пп.1-3 вместе с фармацевтически приемлемым эксципиентом,разбавителем или носителем. 5. Фармацевтическая композиция по п.4, в виде твердой или жидкой дозированной формы. 6. Фармацевтическая композиция по п.5,которая представляет собой обычную таблетку или таблетку с контролируемым высвобождением или быстро распадающуюся либо раствор для интраназального или внутривенного введения. 7. Соединение по любому из пп.1-3 для использования в качестве медикамента. 8. Применение соединения по любому из пп.1-3 для получения медикамента для лечения или профилактики состояний, при которых показан агонист 5-HT1 рецептора. 9. Применение по п.8, где указанное состояние представляет собой мигрень или связанные состояния, такие как мигрень, хроническая пароксимальная гемикрания или головная боль, связанная с сосудистыми заболеваниями. 10. Применение по п.8, где указанное состояние представляет собой депрессию, тревожное состояние, нарушение питания, ожирение,злоупотребление лекарствами, гипертонию и рвоту. 11. Способ лечения или профилактики состояния, при котором показан агонист 5-НТ 1 рецептора, который включает введение терапевтически эффективного количества соединения по изобретению по любому из пп.1-3. 12. Способ по п.11, где медицинское состояние представляет собой мигрень или связанные состояния, такие как мигрень, хроническая пароксимальная гемикрания или головная боль, связанная с сосудистыми заболеваниями. 13. Способ по п.11, где медицинское состояние представляет собой депрессию, тревожное состояние, нарушение питания, ожирение,злоупотребление лекарствами, гипертонию и рвоту. 14. Способ получения кристаллической полиморфной формы соединения формулы (I),характеризующейся картиной рентгеновской дифракции порошка, полученной с использованием излучения меди K-альфа 1 (= 0,15046 нм) ,которая демонстрирует основные пики при 9,28; 10,38; 11,37; 12,40; 16,84; 17,46; 17,53; 17,78; 17,98; 19,48; 20,70; 21,29; 21,45; 22,21; 22,64; 23,08; 25,20 и 25,79, включающий обработку раствора соединения формулы (II) в первом растворителе концентрированной серной кислотой с последующим(a) нагреванием при кипячении с обратным холодильником в первом растворителе, охлаждением и выделением требуемого полиморфа либо(b) отделением полученной взвеси, поглощением вторым растворителем, нагреванием при кипячении с обратным холодильником, охлаждением и выделением требуемого полиморфа. 15. Способ по п.14, в котором первый растворитель представляет собой ацетон или тетрагидрофуран. 16. Способ по п.14, в котором первый растворитель представляет собой ацетон или тетрагидрофуран, второй растворитель представляет собой ацетон, тетрагидрофуран, этанол, изопропанол или промышленный метилированный спирт. 14 17. Способ по любому из пп.14-16, где кристаллизация требуемого полиморфа индуцируется введением затравки. 18. Способ по любому из пп.14-17, в котором полиморф, полученный таким образом, дополнительно характеризуется своим инфракрасным спектром (таблетки KВr), демонстрирующим значительные полосы абсорбции при = 3385,3; 3172,0; 3143,8; 3058,0; 3022,6; 2954,8; 2928,3; 2893,5; 2650,7; 2436,4; 1622,6; 1584,1; 1480,8; 1445,6; 1362,4; 1354,4; 1304,8; 1246,0; 1229,9; 1164,3; 1149,6; 1137,5; 1087,1; 1071,7; 1019,5; 958,9; 929,8; 899,1; 878,9 842,6; 793,8; 759,3; 751,4; 731,3; 690,4; 619,9; 606,3; 564,9; 533,7; 512,2; 503,6; 485,3; 457,5 и 428,9 см-1. 19. Способ по п.18, где полусульфатный полиморф, полученный таким образом, дополнительно характеризуется кривой DSC, демонстрирующей пик эндотермы при 226 С.
МПК / Метки
МПК: A61K 31/404, A61P 25/06, C07D 403/06
Метки: форма, гемисульфата, 3-(n-метил, полиморфная, пирролидинилметил-5-(2-фенилсульфонилэтил, 1н-индола
Код ссылки
<a href="https://eas.patents.su/8-4510-polimorfnaya-forma-gemisulfata-3-n-metil-2-r-pirrolidinilmetil-5-2-fenilsulfoniletil-1n-indola.html" rel="bookmark" title="База патентов Евразийского Союза">Полиморфная форма гемисульфата 3-(n-метил) – 2 (r) – пирролидинилметил-5-(2-фенилсульфонилэтил) – 1н-индола</a>












