Пиримидинаминометилпиридиновые производные, их получение и их применение для борьбы с бактериями р.helicobacter
Номер патента: 3553
Опубликовано: 26.06.2003
Авторы: Ханауэр Гуидо, Опферкух Вольфганг, Постиус Штефан, Симон Вольфганг-Александер, Зенн-Бильфингер Йорг, Коль Бернхард
Формула / Реферат
1. Соединение формулы I
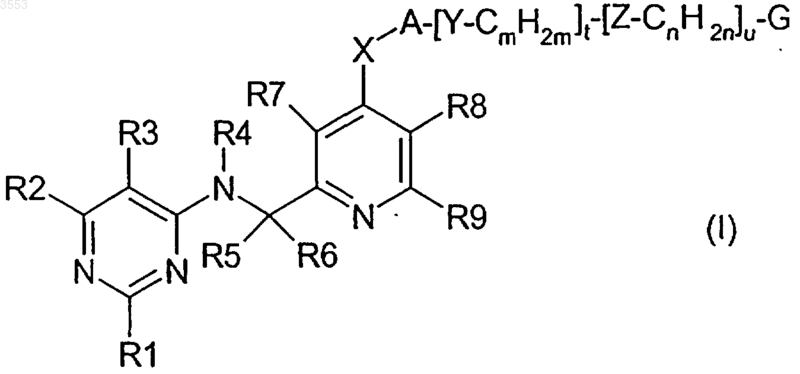
где R1, R2 и R3 имеют одинаковые или отличающиеся друг от друга значения и обозначают водород, C1-C4алкил или галоген,
R4 обозначает водород или C1-C4алкил,
R5 обозначает водород или C1-C4алкил,
R6 обозначает водород или C1-C4алкил,
R7 обозначает водород, C1-C4алкил, C1-C4алкокси или галоген,
R8 обозначает водород, C1-C4алкил, C1-C4алкокси или галоген,
R9 обозначает водород или C1-C4алкил,
A обозначает C1-C7алкилен, C2-C7алкенилен, C3-C7циклоалкилен или фенилен,
G обозначает водород, гидроксил, C1-C7алкил, C1-C4алкил, полностью или в основном замещенный фтором, C2-C7алкенил, C3-C7циклоалкил, моно- или диC1-C4алкилкарбамоильную или -тиокарбамоильную группу, N-C1-C4алкил-N'-цианамидиногруппу, 1-N-C1-C4алкиламино-2-нитроэтиленовую группу, N-2-пропинил-N'-цианамидиногруппу, аминосульфониламидиногруппу, группу -N(R10)R11, фрагмент соединения приведенной выше формулы I, связанный с A (включая X и через X), глюкопиранозидную группу или циклическую систему или бициклическую систему, которая является незамещенной или замещена R12 и R13 и которую выбирают из ряда, включающего бензол, нафталин, фуран, тиофен, пиррол, оксазол, оксазолин, оксазолидинон, изоксазол, тиазол, тиазолин, изотиазол, имидазол, имидазолин, пиразол, триазол, тетразол, тиадиазол, тиадиазол-1-оксид, оксадиазол, пиридин, пиридин-N-оксид, пиримидин, галопиримидин, пиперидин, триазин, пиридон, бензимидазол, имидазопиридин, бензотиазол, бензоксазол, хинолин и имидазопиридазин,
где R10 обозначает C1-C7алкил, C3-C7циклоалкил или Ar-C1-C4алкил, и
R11 обозначает C1-C7алкил, C3-C7циклоалкил или Ar-C1-C4алкил,
где Ar обозначает фенил, фурил, нафтил, тетрагидронафтил или фенил, замещенный R14, R15 и R16,
или где R10 и R11 вместе с атомом азота, к которому они присоединены, обозначают незамещенную или замещенную 5- или 6-членную кольцевую гетеро(би)циклическую систему, которую выбирают из ряда, включающего пирролидин, пиперидин, пиперазин, морфолин, тиоморфолин, индолин, 1,2,3,4-тетрагидрохинолин и 1,2,3,4-тетрагидроизохинолин,
где замещенная пирролидиногруппа замещена одним или двумя идентичными или различными заместителями, выбранными из ряда, включающего C1-C4алкил, C1-C4алкокси, C1-C4алкокси-C1-C4алкил, C1-C4алкоксикарбонил, C1-C4алкилкарбонилокси, гидроксиC1-C4алкил, гидроксил и карбоксил,
замещенная пиперидиногруппа замещена одним, двумя или тремя идентичными или различными заместителями, выбранными из ряда, включающего C1-C4алкил, C1-C4алкоксикарбонил, гидроксиC1-C4алкил, фенил или фенилC1-C4алкил, замещенный R14, R15 и R16, бензоил, бензоил, замещенный галогеном, и карбоксил,
замещенная пиперазиногруппа может быть замещена в 2-, 3-, 5- или 6-м положении C1-C4алкильной группой и замещена в 4-м положении заместителем, выбранным из ряда, включающего C1-C4алкил, C3-C7циклоалкил, C3-C7циклоалкил-C1-C4алкил, C1-C4алкоксикарбонил-C1-C4алкил и карбамоил,
замещенная морфолиногруппа замещена одной или двумя идентичными или различными C1-C4алкильными группами,
замещенная тиоморфолиногруппа замещена одной или двумя идентичными или различными C1-C4алкильными группами или карбоксильной группой,
замещенная индолин-1-ильная группа может быть замещена в 2- и/или 3-м положении карбоксильной группой или одной или двумя идентичными или различными C1-C4алкильной(ыми) группой(ами) и может быть замещена в бензогруппе одним или двумя идентичными или различными заместителем(ями), выбранными из ряда, включающего C1-C4алкил, галоген и нитро,
замещенная 1,2,3,4-тетрагидрохинолиновая группа замещена одним или двумя идентичными или различными заместителями, выбранными из ряда, включающего C1-C4алкил, C1-C4алкоксикарбонил и галоген,
замещенная 1,2,3,4-тетрагидроизохинолиновая группа замещена одним или двумя идентичными или различными заместителями, выбранными из ряда, включающего C1-C4алкил, карбоксил и фенил,
R12 обозначает водород, C1-C4алкил, гидроксил, C1-C4алкокси, галоген, нитро, гуанидино, карбоксил, C1-C4алкоксикарбонил, C1-C4алкил, замещенный R17, фенил, замещенный R14, R15 и R16, или -N(R18)R19,
R13 обозначает водород, C1-C4алкил, гидроксил, C1-C4алкокси, галоген или трифторметил,
R14 обозначает водород, C1-C4алкил, гидроксил, C1-C4алкокси, C1-C4алкоксикарбонил, галоген, трифторметил, C1-C4алкиламино или нитро,
R15 обозначает водород, C1-C4алкил, гидроксил, C1-C4алкокси, галоген или нитро и
R16 обозначает водород или трифторметил,
R17 обозначает гидроксил, C1-C4алкокси, карбоксил, C1-C4алкоксикарбонил, пиридинил или -N(R18)R19, где
R18 обозначает водород, C1-C4алкил или -CO-R20 и
R19 обозначает водород или C1-C4алкил,
или где R18 и R19 вместе с атомом азота, к которому они оба присоединены, обозначают пиперидино- или морфолиногруппу,
R20 обозначает водород, C1-C4алкил или C1-C4алкокси,
X обозначает O (кислород), N-C1-C4алкил, NH или S,
Y обозначает O (кислород), H-C1-C4алкил, NH, S, 1,4-пиперазинилен или 1,4-пиперидинилен,
Z обозначает O (кислород), N-C1-C4алкил, NH или S или CO,
m обозначает число от 1 до 7,
n обозначает число от 0 до 4,
t обозначает число 0, 1 или 2 и
u обозначает число 0 или 1,
или его соли.
2. Соединение формулы I по п.1, где
R1, R2 и R3 имеют одинаковые или отличающиеся друг от друга значения и обозначают водород, C1-C4алкил или галоген,
R4 обозначает водород или C1-C4алкил,
R5 обозначает водород или C1-C4алкил,
R6 обозначает водород или C1-C4алкил,
R7 обозначает водород, C1-C4алкил, C1-C4алкокси или галоген,
R8 обозначает водород, C1-C4алкил, C1-C4алкокси или галоген,
R9 обозначает водород или C1-C4алкил,
A обозначает C1-C7алкилен, C2-C7алкенилен, C3-C7циклоалкилен или фенилен,
G обозначает водород, C1-C7алкил, C1-C4алкил, полностью или в основном замещенный фтором, C2-C7алкенил, C3-C7циклоалкил, моно- или диC1-C4алкилкарбамоильную или -тиокарбамоильную группу, N-C1-C4алкил-N'-цианамидиногрупяу, 1-N-C1-C4алкиламино-2-нитроэтиленовую группу, N-2-пропинил-N'-цианамидиногруппу, аминосульфониламидиногруппу, группу -N(R10)R11, фрагмент соединения приведенной выше формулы I, связанный с A (включая X и через X), или циклическую систему или бициклическую систему, которая является незамещенной или замещена R12 и R13 и которую выбирают из ряда, включающего бензол, нафталин, фуран, тиофен, пиррол, оксазол, оксазолин, изоксазол, тиазол, тиазолин, изотиазол, имидазол, имидазолин, пиразол, триазол, тетразол, тиадиазол, тиадиазол-1-оксид, оксадиазол, пиридин, пиридин-N-оксид, пиримидин, галопиримидин, пиперидин, триазин, пиридон, бензимидазол, имидазопиридин, бензотиазол, бензоксазол, хинолин и имидазопиридазин,
где R10 обозначает C1-C7алкил, C3-C7циклоалкил или Ar-C1-C4алкил и
R11 обозначает C1-C7алкил, C3-C7циклоалкил или Ar-C1-C4алкил,
где Ar обозначает фенил, фурил, нафтил, тетрагидронафтил или фенил, замещенный R14, R15 и R16,
или где R10 и R11 вместе с атомом азота, к которому они присоединены, обозначают незамещенную или замещенную 5- или 6-членную кольцевую гетеро(би)циклическую систему, которую выбирают из ряда, включающего пирролидин, пиперидин, пиперазин, морфолин, тиоморфолин, индолин, 1,2,3,4-тетрагидрохинолин и 1,2,3,4-тетрагидроизохинолин,
где замещенная пирролидиногруппа замещена одним или двумя идентичными или различными заместителями, выбранными из ряда, включающего C1-C4алкил, C1-C4алкокси, C1-C4алкокси-C1-C4алкил, C1-C4алкоксикарбонил, C1-C4алкилкарбонилокси, гидроксиC1-C4алкил, гидроксил и карбоксил,
замещенная пиперидиногруппа замещена одним, двумя или тремя идентичными или различными заместителями, выбранными из ряда, включающего C1-C4алкил, C1-C4алкоксикарбонил, гидроксиC1-C4алкил, фенил или фенилC1-C4алкил, замещенный R14, R15 и R16, бензоил, бензоил, замещенный галогеном, и карбоксил,
замещенная пиперазиногруппа может быть замещена в 2-, 3-, 5- или 6-м положении C1-C4алкильной группой и замещена в 4-м положении заместителем, выбранным из ряда, включающего C1-C4алкил, C3-C7циклоалкил, C3-C7циклоалкил-C1-C4алкил, C1-C4алкоксикарбонил-C1-C4алкил и карбамоил,
замещенная морфолиногруппа замещена одной или двумя идентичными или различными C1-C4алкильными группами,
замещенная тиоморфолиногруппа замещена одной или двумя идентичными или различными C1-C4алкильными группами или карбоксильной группой,
замещенная индолин-1-ильная группа может быть замещена в 2- и/или 3-м положении карбоксильной группой или одной или двумя идентичными или различными C1-C4алкильной(ыми) группой(ами) и может быть замещена в бензогруппе одним или двумя идентичными или различными заместителем(ями), выбранными из ряда, включающего C1-C4алкил, галоген и нитро,
замещенная 1,2,3,4-тетрагидрохинолиновая группа замещена одним или двумя идентичными или различными заместителями, выбранными из ряда, включающего C1-C4алкил, C1-C4алкоксикарбонил и галоген,
замещенная 1,2,3,4-тетрагидроизохинолиновая группа замещена одним или двумя идентичными или различными заместителями, выбранными из ряда, включающего C1-C4алкил, карбоксил и фенил,
R12 обозначает водород, C1-C4алкил, гидроксил, C1-C4алкокси, галоген, нитро, гуанидино, карбоксил, C1-C4алкоксикарбонил, C1-C4алкил, замещенный R17, фенил, замещенный R14, R15 и R16, или -N(R18)R19,
R13 обозначает водород, C1-C4алкил, гидроксил, C1-C4алкокси, галоген или трифторметил,
R14 обозначает водород, C1-C4алкил, гидроксил, C1-C4алкокси, C1-C4алкоксикарбонил, галоген, трифторметил, C1-C4алкиламино или нитро,
R15 обозначает водород, C1-C4алкил, гидроксил, C1-C4алкокси, галоген или нитро и
R16 обозначает водород или трифторметил,
R17 обозначает гидроксил, C1-C4алкокси, карбоксил, C1-C4алкоксикарбонил, пиридинил или -N(R18)R19,
где R18 обозначает водород, C1-C4алкил или -CO-R20 и
R19 обозначает водород или C1-C4алкил,
или где R18 и R19 вместе с атомом азота, к которому они оба присоединены, обозначают пиперидино- или морфолиногруппу,
R20 обозначает водород, C1-C4алкил или C1-C4алкокси,
X обозначает O (кислород), N-C1-C4алкил, NH или S,
Y обозначает O (кислород), N-C1-C4алкил, NH, S, 1,4-пиперазинилен или 1,4-пиперидинилен,
Z обозначает O (кислород), N-C1-C4алкил, NH или S или CO,
m обозначает число от 1 до 7,
n обозначает число от 0 до 4,
t обозначает число 0 или 1 и
u обозначает число 0 или 1,
или его соли.
3. Соединение формулы I по п.1, где
R1 обозначает водород или C1-C4алкил,
R2 обозначает водород или C1-C4алкил,
R3 обозначает галоген,
R4 обозначает водород,
R5 обозначает водород,
R6 обозначает водород,
R7 обозначает C1-C4алкил или галоген,
R8 обозначает водород,
R9 обозначает водород,
A обозначает C1-C7алкилен,
G обозначает водород, гидроксил, C1-C4алкил, полностью или в основном замещенный фтором, группу -N(R10)R11, глюкопиранозидную группу или циклическую систему, которая является незамещенной или замещена R12 и R13 и которую выбирают из ряда, включающего бензол, фуран, тиофен, оксазол, оксазолин, оксазолидинон, тиазол, имидазол, триазол, тетразол, пиридин, пиримидин, хлорпиримидин, пиперидин и имидазопиридазин,
где R10 и R11 вместе с атомом азота, к которому они оба присоединены, обозначают незамещенную или замещенную 5- или 6-членную кольцевую гетеро(би)циклическую систему, которую выбирают из ряда, включающего пирролидин, пиперидин, пиперазин, морфолин, 1,2,3,4-тетрагидрохинолин и 1,2,3,4-тетрагидроизохинолин,
где замещенная пиперазиногруппа замещена в 4-м положении заместителем, выбранным из ряда, включающего C1-C4алкил и карбамоил,
R12 обозначает водород, C1-C4алкил, гидроксил, галоген, нитро, карбоксил, фенил, замещенный R14, R15 и R16, C1-C4алкил, замещенный R17 или C1-C4алкоксикарбонил,
R13 обозначает водород или C1-C4алкил,
R14 обозначает водород, C1-C4алкил, гидроксил или C1-C4алкокси,
R15 обозначает водород,
R16 обозначает водород,
R17 обозначает пиридинил,
X обозначает O (кислород), N-C1-C4алкил или S,
Y обозначает O (кислород), S или 1,4-пиперазинилен,
Z обозначает O (кислород), NH или S,
m обозначает число от 1 до 4,
n обозначает число от 0 до 2,
t обозначает число 0, 1 или 2 и
u обозначает число 0 или 1,
и его соли.
4. Соединение формулы I по п.1, где
R1 обозначает водород или C1-C4алкил,
R2 обозначает водород или C1-C4алкил,
R3 обозначает хлор,
R4 обозначает водород,
R5 обозначает водород,
R6 обозначает водород,
R7 обозначает C1-C4алкил или хлор,
R8 обозначает водород,
R9 обозначает водород,
A обозначает C1-C4алкилен,
G обозначает водород, C1-C4алкил, полностью или в основном замещенный фтором, группу -N(R10)R11 или циклическую систему, которая является незамещенной или замещена R12 и R13 и которую выбирают из ряда, включающего фуран, тиофен, оксазолин, оксазолидинон, имидазол, пиридин, пиримидин, хлорпиримидин и пиперидин,
где R10 и R11 вместе с атомом азота, к которому они оба присоединены, обозначают пиперазин или 1,2,3,4-тетрагидроизохинолин,
R12 обозначает водород, C1-C4алкил, нитро, фенил, замещенный R14, R15 и R16, или C1-C4алкил, замещенный R17,
R13 обозначает водород или C1-C4алкил,
R14 обозначает водород или C1-C4алкил,
R15 обозначает водород и
R16 обозначает водород,
R17 обозначает пиридинил,
X обозначает O (кислород), N-C1-C4алкил или S,
Y обозначает O (кислород), S или 1,4-пиперазинилен,
Z обозначает O (кислород), NH или S,
m обозначает число от 1 до 4,
n обозначает число от 0 до 2,
t обозначает число 0 или 1 и
u обозначает число 0 или 1,
и их соли.
5. Соединение формулы I по п.1, где
A обозначает C2-C7алкилен,
X обозначает S и
Y обозначает S,
t равно 1 и
u равно 0.
6. Соединение формулы I по п.1, где
A обозначает C2-C7алкилен,
X обозначает S и
Y обозначает 1,4-пиперазинилен,
t равно 1 и
u равно 0.
7. Соединение формулы I по п.1, где
A обозначает C2-C7алкилен,
X обозначает O (кислород) и
Y обозначает S,
t равно 1 и
u равно 0.
8. Соединение формулы I по п.1, выбранное из группы, включающей (5-хлор-2,6-диметилпиримидин-4-ил){3-метил-4-[2-(пиридин-4-илметилсульфанил)этокси]пиридин-2-илметил}амин, (5-хлор-2,6-диметилпиримидин-4-ил)(3-метил-4-{ 2-[2-(2-метил-5-нитроимидазол-1-ил)этилсульфанил]этокси}пиридин-2-илметил)амин, (5-хлор-2,6-диметилпиримидин-4-ил)(3-метил-4-{ 3-[2-(2-метил-5-нитроимидазол-1-ил)этилсульфанил]пропокси}пиридин-2-илметил)амин, (5-хлор-2,6-диметилпиримидин-4-ил)(3-метил-4-{2-[2-(пиридин-4-илметилсульфанил)этокси]этилсульфанил}пиридин-2-илметил)амин, (5-хлор-2,6-диметилпиримидин-4-ил){3-метил-4-[3-(пиридин-2-илметилсульфанил)пропилсульфанил]пиридин-2-илметил}амин и (5-хлорпиримидин-4-ил)(3-метил-4-{2-[2-(2-метил-5-нитроимидазол-1-ил)этилсульфанил]этокси}пиридин-2-илметил)амин или его соли.
9. Лекарственное средство, включающее соединение формулы I по п.1 и/или его фармакологически переносимые соли вместе с обычными вспомогательными веществами.
10. Применение соединений формулы I по п.1 и/или их фармакологически переносимых солей для борьбы с бактериями р.Helicobacter.
Текст
1 Область техники Изобретение относится к соединениям,предназначенным для применения в фармацевтической промышленности в качестве действующих веществ для приготовления лекарственных средств. Известный уровень техники В WO 94/13290, 94/19346, 95/01351,95/15324, 96/00224, 95/34554, 95/34553, 96/02534 и 96/02505 описаны бензимидазольные и имидазопиридиновые производные, пригодные для борьбы с бактериями р.Helicobacter. Описание изобретения Изобретение относится к соединениям формулы I где R1, R2 и R3 имеют одинаковые или отличающиеся друг от друга значения и обозначают водород, С 1-С 4 алкил или галоген,R4 обозначает водород или С 1-С 4 алкил,R5 обозначает водород или С 1-C4 алкил,R6 обозначает водород или С 1-С 4 алкил,R7 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкокси или галоген,R8 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкокси или галоген,R9 обозначает водород или С 1-С 4 алкил,А обозначает С 1-С 7 алкилен, С 2-С 7 алкенилен, С 3-С 7 циклоалкилен или фенилен,G обозначает водород, гидроксил, С 1 С 7 алкил, С 1-С 4 алкил, полностью или в основном замещенный фтором, С 2-С 7 алкенил, С 3-С 7 циклоалкил, моно- или диС 1-С 4 алкилкарбамоильную или -тиокарбамоильную группу, N-C1-С 4 алкилN'-цианамидиногруппу, 1-N-С 1-С 4 алкиламино 2-нитроэтиленовую группу, N-2-пропинил-N'цианамидиногруппу,аминосульфониламидиногруппу, группу -N(R10)R11, фрагмент соединения приведенной выше формулы I, связанный с А (включая Х и через X), глюкопиранозидную группу или циклическую систему или бициклическую систему, которая является незамещенной или замещена R12 и R13, и которую выбирают из ряда, включающего бензол, нафталин, фуран, тиофен, пиррол, оксазол, оксазолин,оксазолидинон, изоксазол, тиазол, тиазолин,изотиазол, имидазол, имидазолин, пиразол,триазол, тетразол, тиадиазол, тиадиазол-1 оксид, оксадиазол, пиридин, пиридин-N-оксид,пиримидин, галопиримидин, пиперидин, триазин, пиридон, бензимидазол, имидазопиридин,бензотиазол, бензоксазол, хинолин и имидазопиридазин,где R10 обозначает С 1-С 7 алкил, С 3 С 7 циклоалкил или Аr-С 1-С 4 алкил, и 2 где Аr обозначает фенил, фурил, нафтил,тетрагидронафтил или фенил, замещенный R14,R15 и R16, или где R10 и R11 вместе с атомом азота, к которому они присоединены, обозначают незамещенную или замещенную 5- или 6-членную кольцевую гетеро(би)циклическую систему,которую выбирают из ряда, включающего пирролидин, пиперидин, пиперазин, морфолин,тиоморфолин, индолин, 1,2,3,4-тетрагидрохинолин и 1,2,3,4-тетрагидроизохинолин,где- замещенная пирролидиногруппа замещена одним или двумя идентичными или различными заместителями, выбранными из ряда,включающего С 1-С 4 алкил, С 1-С 4 алкокси, С 1 С 4 алкокси-С 1-С 4 алкил, С 1-С 4 алкоксикарбонил,С 1-С 4 алкилкарбонилокси, гидроксиС 1-С 4 алкил,гидроксил и карбоксил,- замещенная пиперидиногруппа замещена одним, двумя или тремя идентичными или различными заместителями, выбранными из ряда,включающего С 1-С 4 алкил, С 1-C4 алкоксикарбонил, гидроксиС 1-С 4 алкил, фенил или фенилС 1 С 4 алкил, замещенный R14, R15 и R16, бензоил,бензоил, замещенный галогеном, и карбоксил,- замещенная пиперазиногруппа может быть замещена в 2-, 3-, 5- или 6-м положении С 1-С 4 алкильной группой и замещена в 4-м положении заместителем, выбранным из ряда,включающего С 1-С 4 алкил, C3-С 7 циклоалкил, С 3 С 7 циклоалкил-С 1-С 4 алкил, С 1-С 4 алкоксикарбонил-С 1-С 4 алкил и карбамоил,- замещенная морфолиногруппа замещена одной или двумя идентичными или различными С 1-С 4 алкильными группами,- замещенная тиоморфолиногруппа замещена одной или двумя идентичными или различными С 1-С 4 алкильными группами или карбоксильной группой,- замещенная индолин-1-ильная группа может быть замещена в 2- и/или 3-м положении карбоксильной группой или одной или двумя идентичными или различными С 1-С 4 алкильной(ыми) группой(ами) и может быть замещена в бензогруппе одним или двумя идентичными или различными заместителем(ями), выбранными из ряда, включающего С 1-С 4 алкил, галоген и нитро,- замещенная 1,2,3,4-тетрагидрохинолиновая группа замещена одним или двумя идентичными или различными заместителями, выбранными из ряда, включающего С 1-С 4 алкил, С 1 С 4 алкоксикарбонил и галоген,- замещенная 1,2,3,4-тетрагидроизохинолиновая группа замещена одним или двумя идентичными или различными заместителями, выбранными из ряда, включающего С 1-С 4 алкил,карбоксил и фенил,R12 обозначает водород, С 1-С 4 алкил, гидроксил, С 1-С 4 алкокси, галоген, нитро, гуанидино, карбоксил, С 1-С 4 алкоксикарбонил, С 1 3 С 4 алкил, замещенный R17, фенил, замещенныйR16 обозначает водород или трифторметил,R17 обозначает гидроксил, С 1-С 4 алкокси,карбоксил, С 1-С 4 алкоксикарбонил, пиридинил или -N(R18)R19, гдеR19 обозначает водород или С 1-С 4 алкил,или где R18 и R19 вместе с атомом азота, к которому они оба присоединены, обозначают пиперидино- или морфолиногруппу,R20 обозначает водород, С 1-С 4 алкил или С 1-С 4 алкокси,Х обозначает О (кислород), N-C1-C4 алкил,NH или S,Y обозначает О (кислород), N-С 1-С 4 алкил,NH, S, 1,4-пиперазинилен или 1,4-пиперидинилен,Z обозначает О (кислород), N-C1-C4 алкил,NH или S или СО,m обозначает число от 1 до 7,n обозначает число от 0 до 4,t обозначает число 0, 1 или 2, иu обозначает число 0 или 1,и к их солям. С 1-С 4 алкил обозначает алкильные группы с прямой или разветвленной цепью, имеющие 14 атома углерода. Примерами, которые следует отметить, являются бутил, изобутил, вторбутил, трет-бутил, пропил, изопропил, этил и метил. С 1-С 4 алкокси обозначает группу, которая в дополнение к атому кислорода содержит одну из указанных выше С 1-С 4 алкильных групп. Примерами, которые следует отметить, являются метокси и этокси. Галоген в контексте настоящего изобретения обозначает бром, хлор или фтор. С 1-С 7 алкилен обозначает С 1 С 7 алкиленовые группы с прямой или разветвленной цепью, например, метилен (-СН 2-), этилен (-СН 2-СН 2-), триметилен (-СН 2-СН 2-СН 2-),тетраметилен (-СН 2-СН 2-СН 2-СН 2-), 1,2-диметилэтилен [-СН(СН 3)-СН(СН 3)-], 1,1-диметилэтилен [-C(CH3)2-CH2-], 2,2-диметилэтилен(-СH2-СH2-СН 2-СН 2-СН 2-), гексаметилен (-CH2CH2-CH2-CH2-CH2-CH2-) и гептаметилен (-СН 2 СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-). Если t равно 1 или t равно 0 и в это же время u равно 1, то А 4 предпочтительно обозначает С 2-С 7 алкилен. Среди алкиленовых групп А предпочтительными являются этилен, пропилен и бутилен. С 2-С 7 алкенилен обозначает С 2-С 7 алкениленовые группы с прямой или разветвленной цепью, под которыми подразумеваются моно- или полиненасыщенные двухвалентные углеводородные радикалы. Примерами, которые следует отметить, являются винилен (-СН=СН-), 1 пропенилен (-СН=СН-СН 2-), 2-бутенилен (-СH2 СН=СН-СH2-) и 1,3-бутадиенилен (-СН=СНСН=СН-). С 3-С 7 циклоалкил обозначает циклопропил,циклобутил, циклопентил, циклогексил и циклогептил. С 3-С 7 циклоалкилен обозначает одну из указанных выше С 3-С 7 циклоалкильных групп,имеющих две связи. В качестве примера следует отметить 1,4-циклогексилен. Фенилен обозначает 1,2-, 1,3- и 1,4-фениленовые группы, среди которых предпочтительным является 1,4-фенилен. С 1-С 7 алкил обозначает алкильные группы с прямой или разветвленной цепью, имеющие 17 атомов углерода. Примерами, которые следует отметить, являются гептил, изогептил (5 метилгексил), гексил, изогексил (4-метилпентил), неогексил (3,3-диметилбутил), пентил,изопентил (3-метилбутил), неопентил (2,2 диметилпропил), бутил, изобутил, втор-бутил,трет-бутил, пропил, изопропил, этил и метил. Примерами С 1-С 4 алкила, полностью или в основном замещенного фтором, являются 2,2,3,3,3-пентафторпропил, перфторэтил и 1,2,2 трифторэтил и, в частности, 1,1,2,2-тетрафторэтил, 2,2,2-трифторэтил, трифторметил и дифторметил. С 2-С 7 алкенил обозначает алкенильные группы с прямой или разветвленной цепью,имеющие 2-7 атомов углерода. Примерами, которые следует отметить, являются 2-бутенил, 3 бутенил, 1-пропенил, 2-пропенил (аллил) и винил. Моно- или диС 1-С 4 алкилкарбамоильные группы представляют собой карбамоильные группы (-CO-NH2), замещенные одной или двумя идентичными или различными С 1 С 4 алкильными группами из числа указанных выше. Примерами, которые следует отметить,являются метилкарбамоил, изопропилкарбамоил и диметилкарбамоил. Моно- или диС 1-С 4 алкилтиокарбамоильные группы представляют собой тиокарбамоильные группы (-CS-NH2), замещенные одной или двумя идентичными или различными С 1 С 4 алкильными группами из числа указанных выше. Примерами, которые следует отметить,являются метилтиокарбамоил, изопропилтиокарбамоил и диметилтиокарбамоил. Примером N-С 1-С 4 алкил-N'-цианамидиногруппы, который следует отметить, является, в[-C(=NCN)-NH-СН 3]. Примером 1-N-С 1-С 4 алкиламино-2-нитроэтиленовой группы, который следует отметить,является, в частности, 1-N-метиламино-2 нитроэтилен [-С(NНСН 3)=СНNO2]. Примерами групп -[Z-СnH2n]u-G, где G обозначает N-С 1-С 4 алкил-N'-цианамидиногруппу,1-N-С 1-С 4 алкиламино-2-нитроэтиленовую группу или N-2-пропинил-N'-цианамидиногруппу,являются, в частности, группы, в которых Z обозначает NH и n равно 0. В этой связи группами -[Z-СnН 2n]u-G, которые следует особо отметить, являются -NH-C(=NCN)NH-CH3, -NHС(NНСН 3)=СНNO2 и-NH-C(=NCN)NHCH2CCH. С 1-С 4 алкокси-С 1-С 4 алкил обозначает одну из указанных выше С 1-С 4 алкильных групп, замещенную одной из указанных выше С 1 С 4 алкоксигрупп. Примерами, которые следует отметить, являются метоксиметил, метоксиэтил и бутоксиэтил. С 1-С 4 алкоксикарбонил обозначает карбонильную группу, к которой присоединена одна из указанных выше С 1-С 4 алкоксигрупп. Примерами, которые следует отметить, являются метоксикарбонил (СН 3 О-С(О)-) и этоксикарбонил(СН 3 СН 2O-С(O)-). В дополнение к атому кислорода С 1 С 4 алкоксикарбонилоксигруппа содержит одну из указанных выше С 1-C4 алкилкарбонильных групп. Примером, который следует отметить,является ацетоксигруппа (СН 3 СО-O-). ГидроксиС 1-С 4 алкил обозначает одну из указанных выше С 1-С 4 алкильных групп, замещенную гидроксильной группой. Примерами,которые следует отметить, являются гидроксиметил, 2-гидроксиэтил и 3-гидроксипропил. С 3-С 7 циклоалкил-С 1-С 4 алкил обозначает одну из указанных выше C1-С 4 алкильных групп,замещенную одной из указанных выше С 3 С 7 циклоалкильных групп. Примерами, которые следует отметить, являются циклопропилметил,циклогексилметил и циклогексилэтил. С 1-С 4 алкоксикарбонил-С 1-С 4 алкил обозначает одну из указанных выше С 1-С 4 алкильных групп, замещенную одной из указанных выше С 1-С 4 алкоксикарбонильных групп. Примером,который следует отметить, является этоксикарбонилметил (CH3CH2OC(O)CH2-). ФенилС 1-С 4 алкил обозначает одну из указанных выше С 1-С 4 алкильных групп, замещенную фенилом. Примерами, которые следует отметить, являются фенэтил и бензил. Примерами С 1-С 4 алкильных групп, замещенных R17, которые следует отметить, являются 2-метоксикарбонилэтил, 2-этоксикарбонилэтил, метоксикарбонилметил, карбоксиметил, 2-гидроксиэтил, метоксиметил, 2-метоксиэтил, 2-гидроксиэтил, диметиламинометил и 2 диметиламиноэтил, в частности пиридин-4 илметил. 6 Возможные группы -СmН 2m- представляют собой группы с прямой или разветвленной цепью. Примерами, которые следует отметить,являются гептилен, изогептилен (2-метилгексилен), гексилен, изогексилен (2-метилпентилен), неогексилен (2,2-диметилпропилен),бутилен, изопентилен (3-метилбутилен), неопентилен (2,2-диметилпропилен), бутилен,изобутилен, втор-бутилен, трет-бутилен, пропилен, изопропилен, этилен и метилен. Предпочтительными группами -СmН 2m-, которые следует отметить, являются метилен (-СН 2-), этилен(-СН 2 СН 2-), бутилен (-СН 2 СН 2 СН 2 СН 2-) и пропилен (-СН 2 СН 2 СН 2-). Возможные группы -СnН 2n- также представляют собой группы с прямой или разветвленной цепью. Примерами, которые следует отметить, являются бутилен, изобутилен, вторбутилен, трет-бутилен, пропилен, изопропилен,этилен и метилен. Предпочтительными группами -СnН 2n-, которые следует отметить, являются метилен(-СН 2-) и этилен (-СН 2 СН 2-). В одном из вариантов осуществления n равно 0, поэтому (при условии, что u равно 1) фрагмент, обозначенный -СnН 2n-, представляет собой связь и группа G непосредственно связана с группой Z. Этот вариант осуществления относится к таким соединениям, в которых G обозначает водород или группу, связанную с Z через атом углерода. Еще в одном из вариантов осуществления t равно 0, поэтому фрагмент, обозначенный YСmН 2m, представляет собой связь. Еще в одном из вариантов осуществленияu равно 0, поэтому фрагмент, обозначенный ZCnH2n, представляет собой связь. Специалисту в данной области на основе его(ее) профессионального опыта должно быть очевидно, что определенные сочетания и конформации X, A, Y, Z, G, m, n, t и u соответствуют химически менее стабильным соединениям. Это относится, в частности, к таким соединениям, в которых два гетероатома (S, О или N) непосредственно соединены друг с другом или разделены лишь одним атомом углерода. Поэтому предпочтительными являются те соединения по изобретению, которые не имеют вышеупомянутых конформаций. Заместители R12 и R13 могут быть связаны с циклическими системами или бициклическими системами G в любом возможном положении, при этом сами замещенные или незамещенные циклические системы или бициклические системы G могут быть связаны с остальной частью молекулы в любом возможном положении. Примерами незамещенных или замещенных R12 и R13 групп G, которые следует отметить, являются фенил, 4-метилфенил, 3-диметиламинометилфенил, 3-пиперидинометилфенил, 3-карбоксиметилфенил, 2-диметиламинометил-5-метил-3-фурил, пиррол-1-ил, 1-метил 7 пиррол-3-ил, 4,5-диметилоксазол-2-ил, 3,5 диметилизоксазол-4-ил,4,5-диметилтиазол-2 ил, 4-метил-5-карбоксиметилтиазол-2-ил, 1 метилимидазол-2-ил, 1-метилпиразол-3-ил, 1-(2 диметиламиноэтил)пиразол-3-ил, 5-метил-1,3,4 оксадиазол-2-ил,1,2,4-триазол-1-ил,1,2,4 триазол-2-ил, 1-метил-1,2,3-триазол-4-ил, 1 метил-1,2,4-триазол-3-ил, 1-(2-диметиламиноэтил)-1,2,3-триазол-4-ил, 1-метилтетразол-5-ил,1-(2-диметиламиноэтил)тетразол-5-ил,1-карбоксиметилтетразол-5-ил,5-метил-1,3,4-тиадиазол-2-ил, 5-трифторметил-1,3,4-тиадиазол-2 ил, 1-(2-гидроксиэтил)тетразол-5-ил, 2-амино 1,3,4-тиадиазол-2-ил, 3-амино-1,2,4-триазол-5 ил, 4-метил-5-трифторметил-1,2,4-триазол-3-ил,4-аминопиримидин-2-ил, 2-фурил, 3-фурил, 3 метил-2-фурил, 2-метил-3-фурил, 5-метил-2 фурил, 5-этил-2-фурил, 3-метокси-2-фурил, 5 диметиламинометил-2-фурил, 5-N-морфолинометил-2-фурил, 5-метоксиметил-2-фурил, 5 гидроксиметил-2-фурил, 5-N-пиперидинометил 2-фурил, 5-хлор-2-фурил, 5-фтор-2-фурил, 2 тиенил, 3-тиенил, 5-метил-2-тиенил, 5-хлор-2 тиенил, 3-метил-2-тиенил, 3-амино-2-тиенил, 3 гуанидино-2-тиенил, 3-метокси-2-тиенил, 2 метил-3-тиенил, 5-диметиламинометил-2-тиенил, 5-N-морфолинометил-2-тиенил, 5-метил-2 пирролил,2,5-диметил-1-пирролил,1,5 диметил-2-пирролил, 1-метил-2-пирролил, 2 тиазолил, 4-тиазолил, 5-тиазолил, 2-амино-4 тиазолил, 2-метил-4-тиазолил, 2-амино-5-метил 4-тиазолил, 4-метил-5-тиазолил, 2-диметиламинометил-4-тиазолил, 2-гуанидино-4-тиазолил, 2 формиламино-4-тиазолил,2-N-морфолинометил-4-тиазолил, 4-метил-5-оксазолил, 3-гуанидино-1-пиразолил, 3-гуанидино-4-пиразолил, 1 имидазолил, 2-имидазолил, 4-имидазолил, 2 метил-4-имидазолил, 5-метил-4-имидазолил, 2 метил-1-имидазолил, 2-метил-5-нитро-1-имидазолил, 4,5-диметил-2-имидазолил, 4-гидроксиметил-5-метил-1-имидазолил, 3-метил-1-пиразолил, 5-амино-1,2,4-тиадиазол-3-ил, 4-метокси 2-пиридинил, 4-метокси-3-метил-2-пиридинил,4-пиридинил,2-пиримидинил,5-хлор-4 пиримидинил, 5-хлор-2,6-диметил-4-пиримидинил, 2-нитро-1-имидазолил, 3,4-диметоксипиридинил, 1 Н-бензимидазол-2-ил, 6-имидазо[1,2b]пиридазинил и 3-нитро-6-имидазо[1,2-b]пиридазинил. Примерами фенильных групп, замещенных 8 Примерами замещенных пирролидиногрупп, которые следует отметить, являются 2 метоксиметилпирролидино-,2-метоксикарбонилпирролидино-, 2-метилпирролидино-, 2,5 диметилпирролидино-, 2-карбоксипирролидино-,4-гидрокси-2-метоксикарбонилпирролидино-, 4-гидрокси-2-этоксикарбонилпирролидино-, 2-(2-гидроксиэтил)пирролидино-, 4-гидрокси-2-карбоксипирролидино-, 2-гидроксиметилпирролидино-, 3-гидроксипирролидино- и 4 ацетокси-2-карбоксипирролидиногруппа. Примерами замещенных пиперидиногрупп, которые следует отметить, являются 2 карбоксипиперидино-, 2-н-пропилпиперидино-,5-этил-2-метилпиперидино-, 4-гидроксиметил 4-фенилпиперидино-, 4-н-пропилпиперидино-,4-(3-фенилпропил)пиперидино-,2,6-диметилпиперидино-, 4-фенил-4-пропилоксикарбонилпиперидино-, 4-этоксикарбонил-4-фенилпиперидино-, 4-карбокси-4-фенилпиперидино-, 4 карбоксипиперидино-, 4-(4-фторбензоил)пиперидино-, 4-(4-хлорбензоил)пиперидино-, 2,3 дикарбоксипиперидино-, 2,4-дикарбоксипиперидино-, 2,6-дикарбоксипиперидино-, 2-этоксикарбонилпиперидино-,2-метилпиперидино-,2,6-диметилпиперидино-,2-гидроксиметилпиперидино-, 2-этилпиперидино-, 2-(2-гидроксиэтил)пиперидино-, 3-этоксикарбонилпиперидино- и 4-бензилпиперидиногруппа. Примерами замещенных пиперазиногрупп,которые следует отметить, являются 4 метилпиперазино-, 4-фенилпиперазино-, 4-(2 метилфенил)пиперазино-, 4-(2,3-диметилфенил) пиперазино-, 4-(2-хлорфенил)пиперазино-, 4-(2 метоксифенил)пиперазино-, 4-(2-этоксифенил) пиперазино-, 4-(3-хлорфенил)пиперазино-, 4-(4 фторфенил)пиперазино-, 4-(4-хлорфенил)пиперазино-, 4-(4-метоксифенил)пиперазино-, 4 карбамоилпиперазино-,3-метил-4-(4-хлорфенил)пиперазино-, 3-метил-4-(4-метоксифенил) пиперазино-,3-метил-4-(4-метилфенил) пиперазино-, 4-(2,4-диметилфенил)пиперазино-,4-(3,4-дихлорфенил)пиперазино-, 4-(3,4-диметилфенил)пиперазино-, 3-метил-4-фенилпиперазино, 3-метил-4-(3-хлорфенил)пиперазино-, 4 бензилпиперазино-, 4-пропилпиперазино-, 4-(3 метилфенил)пиперазино-, 4-(3-метоксифенил) пиперазино-, 4-(4-метилфенил)пиперазино-, 4(2,5-диметилфенил)пиперазино-,4-циклопропилпиперазино-, 4-циклобутилпиперазино-, 4 циклопентилпиперазино-, 4-циклогексилпиперазино-, 4-циклогептилпиперазино-, 3-н-бутилпиперазино-, 4-изобутилпиперазино-, 4-третбутилпиперазино-, 4-(1-фенилэтил)пиперазино-,4-этоксикарбонилметилпиперазино-,4-(2-фенилэтил)пиперазино-,4-(2-циклогексилэтил) пиперазино-, 4-(2-гидроксифенил)пиперазино,4-(3,4-диметоксифенил)пиперазино-, 4-изопропилпиперазино-,3-метил-4-(3-метоксифенил) пиперазино-, 4-(4-гидроксифенил)пиперазино-,3-метил-4-(3-метилфенил)пиперазино-,4-(3 гидроксифенил)пиперазино-, 4-(2,6-динитро-3 9 фторметилфенил)пиперазино-,4-(4-нитрофенил)пиперазино-, 4-(4-ацетилфенил)пиперазино-, 4-(2-хлор-5-тиенилметил)пиперазино- и 4[2-(2-метил-5-нитро-1-имидазолил)этил]пиперазиногруппа. Примером замещенной морфолиногруппы,который следует отметить, является 3,5 диметилморфолиногруппа. Примером замещенной тиоморфолиногруппы, который следует отметить, является 2 карбокситиоморфолиногруппа. Примерами замещенных индолин-1 ильных групп, которые следует отметить, являются 2-карбокси-1-индолинил,6-фтор-1 индолинил, 5-бром-1-индолинил, 2,7-диметил-1 индолинил, 2-метил-1-индолинил, 5-бром-7 нитро-1-индолинил, 5-нитро-1-индолинил, 2,3 диметил-1-индолинил и 6-нитро-1-индолинил. Примерами замещенных 1,2,3,4-тетрагидрохинолиновых групп, которые следует отметить, являются 2-этоксикарбонил-1,2,3,4 тетрагидро-1-хинолинил, 2-метил-1,2,3,4-тетрагидро-1-хинолинил, 6-метил-1,2,3,4-тетрагидро 1-хинолинил, 6-фтор-2-метил-1,2,3,4-тетрагидро-1-хинолинил, 4-метил-1,2,3,4-тетрагидро-1 хинолинил и 2-фтор-6-метил-1,2,3,4-тетрагидро 1-хинолинил. Примером замещенной 1,2,3,4-тетрагидроизохинолиновой группы, который следует отметить, является 3-карбокси-1,2,3,4-тетрагидро-2-изохинолинил. Примерами замещенных пиримидин-4 ильных групп, которые следует отметить, являются 2,6-диметилпиримидин-4-ил, 2,6-дихлорпиримидин-4-ил, 2-хлор-5-фторпиримидин-4-ил и 5-хлорпиримидин-4-ил и, в частности 5-хлор 2,6-диметилпиримидин-4-ил. Пригодными солями соединений формулыI, в зависимости от замещения, являются все кислотно-аддитивные соли или все соли присоединения оснований. Особо следует отметить фармакологически переносимые соли неорганических и органических кислот и оснований,обычно применяемых в фармацевтике. С одной стороны, пригодными солями являются водорастворимые и водонерастворимые кислотноаддитивные соли таких кислот, как, например,соляная кислота, бромисто-водородная кислота,фосфорная кислота, азотная кислота, серная кислота, уксусная кислота, лимонная кислота,D-глюконовая кислота, бензойная кислота, 2-(4 гидроксибензоил)бензойная кислота, масляная кислота, сульфосалициловая кислота, малеиновая кислота, лауриновая кислота, яблочная кислота, фумаровая кислота, янтарная кислота,щавелевая кислота, винная кислота, эмбоновая кислота, стеариновая кислота, толуолсульфоновая кислота, метансульфоновая кислота или 3 гидрокси-2-нафтойная кислота, при этом при получении солей в зависимости от того, является ли кислота одно- или многоосновной кислотой, и в зависимости от того, какую соль требу 003553 10 ется получить, кислоты могут применяться в эквимолярном или в отличном от него количественном соотношении. С другой стороны, также могут применяться соли присоединения оснований. Примерами солей присоединения оснований, которые следует отметить, являются соли щелочных металлов (лития, натрия, калия) или кальция, алюминия, магния, титана, аммония, меглумина или гуанидина, при этом основания также могут применяться в эквимолярном или в отличном от него количественном соотношении. Фармакологически непереносимые соли,которые могут сначала образоваться, например,в качестве промежуточных продуктов при получении соединений по изобретению в промышленном масштабе, превращают в фармакологически переносимые соли методами, известными специалисту в данной области. Специалисту в данной области известно,что соединения по изобретению, а также их соли, при их выделении, например, в кристаллической форме, могут содержать различные количества растворителей. Следовательно, под объем изобретения также подпадают все сольваты и, в частности, все гидраты соединений формулы I, а также все сольваты и, в частности,все гидраты солей соединений формулы I. Один из вариантов (вариант а) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает О (кислород) и Y обозначает S, t равно 1 и u равно 0. Следующий вариант (вариант б) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает S и Y обозначает S, t равно 1 и u равно 0. Следующий вариант (вариант в) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает S и Y обозначает 1,4-пиперазинилен,t равно 1 и u равно 0. Следующий вариант (вариант г) осуществления изобретения относится к соединениям формулы I, где А обозначает С 1-С 7 алкилен, Х обозначает S и t и u равны 0. Следующий вариант (вариант д) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает S и Z обозначает S, n и t равны 0 и u равно 1. Следующий вариант (вариант е) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает S и Y обозначает 1,4-пиперазинилен,t равно 1 и и равно 0 и G представляет собой фрагмент соединения формулы I, присоединенный к А (включающий S и присоединенный через S). Один из вариантов (вариант ж) осуществления изобретения относится к соединениям 11 формулы I, где А обозначает С 1-С 7 алкилен, Х обозначает О (кислород) и t и u равны 0. Следующий вариант (вариант з) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает О (кислород) и Y обозначает 1,4 пиперазинил, t равно 1 и u равно 0. Следующий вариант (вариант и) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает S и Z обозначает NH, n и t равны 0 иu равно 1. Следующий вариант (вариант к) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает О (кислород) и Z обозначает S, n и t равны 0 и u равно 1. Следующий вариант (вариант л) осуществления изобретения относится к соединениям формулы I, где А обозначает С 1-С 7 алкилен, С 2 С 7 алкенилен, С 3-С 7 циклоалкилен или фенилен, t и u равны 0 и G обозначает водород. Следующий вариант (вариант м) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-C7 алкилен, Х обозначает N-C1-С 4 алкил и Y обозначает S, t равно 1 и u равно 0. Следующий вариант (вариант н) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает S, Y обозначает О (кислород) и Z обозначает О (кислород), t и u равны 1, m обозначает число от 2 до 7, n равно 0 и G обозначает С 1-С 4 алкил, полностью или в основном замещенный фтором. Следующий вариант (вариант о) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает N-C1-С 4 алкил и Z обозначает О (кислород), t и n равны 0 и u равно 1. Следующий вариант (вариант п) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает N-C1-С 4 алкил и Z обозначает S, t и n равны 0 и u равно 1. Следующий вариант (вариант р) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает S и Z обозначает О (кислород), t и n равны 0 и u равно 1. Следующий вариант (вариант с) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает N-C1-С 4 алкил и Z обозначает О (кислород), t и n равны 0 и u равно 1 и G обозначает водород. Следующий вариант (вариант т) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает N-C1-С 4 алкил и t и u равны 0. Следующий вариант (вариант у) осуществления изобретения относится к соединениям 12 формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает О (кислород), Y обозначает О (кислород), Z обозначает S, t и u равны 1. Следующий вариант (вариант ф) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает S, Y обозначает S, Z обозначает О(кислород), t и u равны 1. Следующий вариант (вариант х) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает О (кислород), Y обозначает S, Z обозначает О (кислород), t и u равны 1. Следующий вариант (вариант ц) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает S, Y обозначает S, Z обозначает S, t и u равны 1. Следующий вариант (вариант ч) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает S, Y обозначает О (кислород), Z обозначает S, t и u равны 1. Следующий вариант (вариант ш) осуществления изобретения относится к соединениям формулы I, где А обозначает С 2-С 7 алкилен, Х обозначает S, Y обозначает О (кислород), t равно 1 и u равно 0. Среди соединений, соответствующих вариантам м, о, п, с и т, следует особо отметить соединения, в которых R7 обозначает галоген, в частности, хлор. Среди соединений, соответствующих вариантам д, и, к, о, п и р, следует особо отметить соединения, в которых G обозначает 3 нитроимидазо[1,2-b]пиридазин-6-ил. Одна группа соединений по изобретению включает соединения, в которых G обозначает гидроксил или оксазолидинон или глюкопиранозид и/или R17 обозначает пиридинил и/или t равно 2. Другая группа соединений по изобретению включает соединения, в которых G не обозначает гидроксил или оксазолидинон или глюкопиранозид, R17 не обозначает пиридинил и t не равно 2. Среди соединений по изобретению следует выделить соединения формулы I, в которыхR1, R2 и R3 имеют одинаковые или отличающиеся друг от друга значения и обозначают водород, С 1-С 4 алкил или хлор,R4 обозначает водород,R5 обозначает водород,R6 обозначает водород,R7 обозначает водород, С 1-C4 алкил, С 1 С 4 алкокси или галоген,R8 обозначает водород,R9 обозначает водород,А обозначает С 1-С 7 алкилен,G обозначает водород, гидроксил, С 1 С 4 алкил, полностью или в основном замещенный фтором, группу -N(R10)R11, фрагмент со 13 единения приведенной выше формулы I, связанный с А (включая Х и через X), глюкопиранозидную группу или циклическую систему или бициклическую систему, которая является незамещенной или замещена R12 и R13, и которую выбирают из ряда, включающего бензол, нафталин, фуран, тиофен, пиррол, оксазол, оксазолин,оксазолидинон, изоксазол, тиазол, тиазолин,изотиазол, имидазол, имидазолин, пиразол,триазол, тетразол, тиадиазол, тиадиазол-1 оксид, оксадиазол, пиридин, пиридин-N-оксид,пиримидин, хлорпиримидин, пиперидин, триазин, пиридон, бензимидазол, имидазопиридин,бензотиазол, бензоксазол, хинолин и имидазопиридазин, гдеR10 и R11 вместе с атомом азота, к которому они оба присоединены, обозначают незамещенную или замещенную 5- или 6-членную кольцевую гетеро(би)циклическую систему,которую выбирают из ряда, включающего пирролидин, пиперидин, пиперазин, морфолин,тиоморфолин, индолин, 1,2,3,4-тетрагидрохинолин и 1,2,3,4-тетрагидроизохинолин, где- замещенная пирролидиногруппа замещена одним или двумя идентичными или различными заместителями, выбранными из ряда,включающего C1-С 4 алкил, С 1-С 4 алкокси, С 1 С 4 алкокси-С 1-С 4 алкил, С 1-С 4 алкоксикарбонил,С 1-С 4 алкилкарбонилокси, гидроксиС 1-С 4 алкил,гидроксил и карбоксил,- замещенная пиперидиногруппа замещена одним, двумя или тремя идентичными или различными заместителями, выбранными из ряда,включающего С 1-С 4 алкил, С 1-C4 алкоксикарбонил, гидроксиС 1-C4 алкил, фенил или фенилС 1 С 4 алкил, замещенный R14, R15 и R16, бензоил,бензоил, замещенный галогеном, и карбоксил,- замещенная пиперазиногруппа может быть замещена в 2-, 3-, 5- или 6-м положении С 1-С 4 алкильной группой и замещена в 4-м положении заместителем, выбранным из ряда,включающего С 1-С 4 алкил, С 3-С 7 циклоалкил, С 3 С 7 циклоалкил-С 1-С 4 алкил,С 1-С 4 алкоксикарбонил-С 1-С 4 алкил и карбамоил,- замещенная морфолиногруппа замещена одной или двумя идентичными или различными С 1-С 4 алкильными группами,- замещенная тиоморфолиногруппа замещена одной или двумя идентичными или различными С 1-С 4 алкильными группами или карбоксильной группой,- замещенная индолил-1-ильная группа может быть замещена в 2- и/или 3-м положении карбоксильной группой или одной или двумя идентичными или различными С 1-С 4 алкильной(ыми) группой(ами) и может быть замещена в бензо-фрагменте одним или двумя идентичными или различными заместителем, выбранными из ряда, включающего С 1-С 4 алкил, галоген и нитро,- замещенная 1,2,3,4-тетрагидрохинолиновая группа замещена одним или двумя идентич 003553 14 ными или различными заместителями, выбранными из ряда, включающего С 1-С 4 алкил, С 1 С 4 алкоксикарбонил и галоген,- замещенная 1,2,3,4-тетрагидроизохинолиновая группа замещена одним или двумя идентичными или различными заместителями, выбранными из ряда, включающего С 1-С 4 алкил,карбоксил и фенил,R12 обозначает водород, С 1-С 4 алкил, гидроксил, С 1-С 4 алкокси, галоген, нитро, гуанидино, карбоксил, С 1-С 4 алкоксикарбонил, С 1 С 4 алкил, замещенный R17, фенил, замещенныйR16 обозначает водород или трифторметил,R17 обозначает гидроксил, С 1-С 4 алкокси,карбоксил, С 1-С 4 алкоксикарбонил, пиридинил или -N(R18)R19, гдеR19 обозначает водород или С 1-С 4 алкил,или гдеR18 и R19 вместе с атомом азота, к которому они присоединены, обозначают пиперидино- или морфолиногруппу,R20 обозначает водород, С 1-С 4 алкил или С 1-С 4 алкокси,Х обозначает О (кислород), N-С 1-С 4 алкил,NH или S,Y обозначает О (кислород), N-C1-С 4 алкил,NH, S, 1,4-пиперазинилен,Z обозначает О (кислород), N-С 1-С 4 алкил,NH или S,m обозначает число от 1 до 7,n обозначает число от 0 до 4,t обозначает число 0, 1 или 2, иu обозначает число 0 или 1,и их соли. Среди соединений по изобретению следует особо выделить соединения формулы I, в которыхR1 обозначает водород или С 1-С 4 алкил,R2 обозначает водород или С 1-С 4 алкил,R3 обозначает галоген,R4 обозначает водород,R5 обозначает водород,R6 обозначает водород,R7 обозначает С 1-С 4 алкил или галоген,R8 обозначает водород,R9 обозначает водород,А обозначает С 1-С 7 алкилен,G обозначает водород, гидроксил, С 1 С 4 алкил, полностью или в основном замещен 15 ный фтором, группу -N(R10)R11, глюкопиранозидную группу или циклическую систему или бициклическую систему, которая является незамещенной или замещена R12 и R13 и которую выбирают из ряда, включающего бензол, фуран,тиофен, оксазол, оксазолин, оксазолидинон,тиазол, имидазол, триазол, тетразол, пиридин,пиримидин, хлорпиримидин, пиперидин и имидазопиридазин, гдеR10 и R11 вместе с атомом азота, к которому они оба присоединены, обозначают незамещенную или замещенную 5- или 6-членную кольцевую гетеро(би)циклическую систему,которую выбирают из ряда, включающего пирролидин, пиперидин, пиперазин, морфолин,1,2,3,4-тетрагидрохинолин и 1,2,3,4-тетрагидроизохинолин, где- замещенная пиперазиногруппа замещена в 4-м положении заместителем, выбранным из ряда, включающего С 1-С 4 алкил и карбамоил,R12 обозначает водород, С 1-С 4 алкил, гидроксил, галоген, нитро, карбоксил, фенил, замещенный R14, R15 и R16, С 1-С 4 алкил, замещенный R17 или С 1-С 4 алкоксикарбонил,R13 обозначает водород или С 1-С 4 алкил,R14 обозначает водород, С 1-С 4 алкил, гидроксил или С 1-С 4 алкокси,R15 обозначает водород иR16 обозначает водород,R17 обозначает пиридинил,Х обозначает О (кислород), N-С 1-С 4 алкил или S,Y обозначает О (кислород), S или 1,4 пиперазинилен,Z обозначает О (кислород), NH или S,m обозначает число от 1 до 4,n обозначает число от 0 до 2,t обозначает число 0, 1 или 2, иu обозначает число 0 или 1,и их соли. Предпочтительными соединениями по изобретению являются соединения формулы I, в которыхR1 обозначает водород или С 1-С 4 алкил,R2 обозначает водород или С 1-С 4 алкил,R3 обозначает хлор,R4 обозначает водород,R5 обозначает водород,R6 обозначает водород,R7 обозначает С 1-С 4 алкил или хлор,R8 обозначает водород,R9 обозначает водород,А обозначает C1-C7 алкилен,G обозначает водород, С 1-С 4 алкил, полностью или в основном замещенный фтором,группу -N(R10)R11 или циклическую систему,которая является незамещенной или замещенаR12 и R13 и которую выбирают из ряда, включающего фуран, тиофен, оксазолин, оксазолидинон, имидазол, пиридин, пиримидин, хлорпиримидин и пиперидин, гдеR10 и R11 вместе с атомом азота, к которому они оба присоединены, обозначают пиперазин или 1,2,3,4-тетрагидроизохинолин,R12 обозначает водород, С 1-С 4 алкил, нитро, фенил, замещенный R14, R15 и R16, или С 1 С 4 алкил, замещенный R17,R13 обозначает водород или С 1-С 4 алкил,R14 обозначает водород или С 1-С 4 алкокси,R15 обозначает водород иR16 обозначает водород,R17 обозначает пиридинил,Х обозначает О (кислород), N-С 1-С 4 алкил или S,Y обозначает О (кислород), S или 1,4 пиперазинилен,Z обозначает О (кислород), NH или S,m обозначает число от 1 до 4,n обозначает число от 0 до 2,t обозначает число 0 или 1 иu обозначает число 0 или 1,и их соли. Предпочтительные варианты осуществления изобретения представляют собой варианты а-ш, где заместители и символы имеют значения, указанные для предпочтительных соединений по изобретению. Примеры соединений по изобретению перечислены в приведенных ниже таблицах. Таблица 1 Соединения формулы I, соответствующие варианту а (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3 и остальные заместители и символы имеют следующие значения: Таблица 2 Соединения формулы I, соответствующие варианту б (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3 и остальные заместители и символы для A, m и G имеют значения, указанные в табл. 1. Таблица 3 Соединения формулы I, соответствующие варианту в (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3 и остальные заместители и символы для А, m и G имеют значения, указанные в табл. 1. Таблица 4 Соединения формулы I, соответствующие варианту г (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3 и остальные заместители и символы для А, m и G имеют значения, указанные в табл. 1. Таблица 5 Соединения формулы I, соответствующие варианту д (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3 и остальные заместители и символы для А, m и G имеют значения, указанные в табл. 1. Таблица 6 Соединения формулы I, соответствующие варианту е (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3 и остальные заместители и символы имеют следующие значения: Таблица 7 Соединения формулы I, соответствующие варианту ж (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3 и остальные заместители и символы для А и G имеют значения, указанные в табл. 6. Таблица 8 Соединения формулы I, соответствующие варианту д (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3 и остальные заместители и символы имеют следующие значения: 19 остальные заместители и символы для А и G имеют значения, указанные в табл. 8. Таблица 11 Соединения формулы I, соответствующие варианту о (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3 и остальные заместители и символы для А и G имеют значения, указанные в табл. 8. Таблица 12 Соединения формулы I, соответствующие варианту п (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3 и остальные заместители и символы для А и G имеют значения, указанные в табл. 8. Таблица 13 Соединения формулы I, соответствующие варианту р (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3 и остальные заместители и символы для А и G имеют значения, указанные в табл. 8. Таблица 14 Соединения формулы I, соответствующие варианту н (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3 и остальные заместители и символы имеют следующие значения: Таблица 15 Соединения формулы I, соответствующие варианту с (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н и остальные заместители и символы имеют следующие значения: Таблица 16 Соединения формулы I, соответствующие варианту t (см. выше), где R1 обозначает СН 3,R2 обозначает CH3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н и остальные заместители и символы имеют следующие значения:A, m и G имеют значения, указанные в табл. 1. Таблица 18 Соединения формулы I, соответствующие варианту ф (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3, n равно 2 и остальные заместители и символы для А, m и G имеют значения, указанные в табл. 1. Таблица 19 Соединения формулы I, соответствующие варианту х (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3, n равно 2 и остальные заместители и символы для А, m и G имеют значения, указанные в табл. 1. Таблица 20 Соединения формулы I, соответствующие варианту ц (см. выше), где R1 обозначает СН 3,R2 обозначает СН 3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает СН 3, n равно 2 и остальные заместители и символы для А, m и G имеют значения, указанные в табл. 1. Таблица 21 Соединения формулы I, соответствующие варианту ч (см. выше), где R1 обозначает CH3,R2 обозначает CH3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает CH3, n равно 2 и остальные заместители и символы для А, m и G имеют значения, указанные в табл. 1. Таблица 22 Соединения формулы I, соответствующие варианту ш (см. выше), где R1 обозначает CH3,R2 обозначает CH3, R3 обозначает Cl, R4, R5,R6, R8 и R9 обозначают Н, R7 обозначает CH3, n равно 2 и остальные заместители и символы для А, m и G имеют значения, указанные в табл. 1,и соли соединений, приведенных в табл. 1-22. Соединения формулы I по изобретению могут быть получены различными путями. В принципе соединения формулы I могут быть получены путем взаимодействия аминопиримидинов формулы II с 2-галометилпиридинами формулы III (Hal обозначает галоген, в частности хлор) хорошо известным методом. При необходимости может оказаться целесообразным ввести группу -Х-А-[Y-СmН 2m]t-[ZСnН 2n]u-G полностью или частично в положение 4 пиридина только после взаимодействия соответствующим образом замещенного 2-галометилпиридина с аминопиримидином формулы II. Способ, которым могут быть получены соединения по изобретению, проиллюстрирован в следующих примерах. Соединения формулы II являются известными или могут быть получены известным ме 003553 22 тодом аналогично методу получения известных соединений. Соединения формулы III также являются известными (см., например, раздел "Известные предпосылки создания изобретения" в указанных выше международных заявках на патент),или указанное выше полное или частичное введение группы -Х-А-[Y-СmН 2m]t-[Z-СnН 2n]u-G описано в указанных международных заявках на патент. Приведенные ниже примеры служат для более подробного пояснения изобретения и не ограничивают его объем. Приведенные в качестве примера конечные продукты и соли этих соединений являются предпочтительным объектом изобретения. Соединения по изобретению и исходные продукты могут быть получены способом, аналогичным способу, описанному в примерах. Сокращение tпл обозначает температуру плавления, конц. обозначает "концентрированный", ч обозначает час(ы). Примеры Конечные продукты 1.(1,5 ммоль) 1,2,3,4-тетрагидроизохинолина растворяют в 2 мл н-бутанола и перемешивают в течение 48 ч при 120 С. Смесь концентрируют и растворяют в 20 мл полунасыщенного раствора бикарбоната натрия и 20 мл этилацетата. Водную фазу экстрагируют этилацетатом (320 мл). Органические экстракты сушат над сульфатом магния и концентрируют. Получают 0,19 г(27%) указанного в заголовке соединения; tпл 8193 С. 2. 2-(3-Хлор-2-[(5-хлор-2,6-диметилпиримидин-4-иламино)метил]пиридин-4-илметиламино)этанол. 2,2 г (13,9 ммоль) 4-амино-5-хлор-2,6 диметилпиримидина растворяют в 20 мл диметилформамида в атмосфере азота и порциями при интенсивном перемешивании добавляют 1,8 г гидрида натрия (суспензия 60%-й концентрации). Суспензию перемешивают при комнатной температуре еще в течение 0,5 ч. Затем по каплям в течение 0,5 ч добавляют раствор, содержащий 3,3 г (14,0 ммоль) 2-[(3-хлор-2 хлорметилпиридин-4-ил)метиламино]этанола в диметилформамиде (10 мл), и смесь перемешивают при комнатной температуре еще в течение 0,5 ч. Смесь охлаждают до 0 С и осторожно обрабатывают водой (200 мл) при интенсивном перемешивании. Затем смесь экстрагируют этилацетатом (350 мл). Органические экстракты промывают 50 мл воды, сушат над сульфатом магния и концентрируют. Остаток очищают 23 с помощью хроматографии на силикагеле (элюент: петролейный эфир/этилацетат (4:1. Фракции с Rf=0,3 концентрируют. Получают 1,1 г(22%) указанного в заголовке соединения в виде бесцветного твердого вещества; tпл 162-165 С. 3. Гидрохлорид (5-хлор-2,6-диметилпиримидин-4-ил)3-метил-4-[3-(5-фенил-1 Н-имидазол-2-илсульфанил)пропилсульфанил]пиридин 2-илметиламина. 0,9 г (2,0 ммоль) S-(3-2-[(5-хлор-2,6 диметилпиримидин-4-иламино)метил]-3-метилпиридин-4-илсульфанилпропил)изотиомочевины и 0,42 г (3,0 ммоль) карбоната калия суспендируют в 15 мл этанола и по каплям добавляют раствор, содержащий 0,43 г (2,1 ммоль) бромацетофенона в 8 мл этанола. Смесь перемешивают при комнатной температуре в течение 3 дней. Затем смесь добавляют к 100 мл воды и экстрагируют этилацетатом (340 мл). Органические экстракты промывают 50 мл воды,сушат над сульфатом магния и концентрируют. Остаток очищают с помощью хроматографии на силикагеле (элюент: смесь этилацетат/метанол(20:1)+3% раствор аммиака). Фракции с Rf=0,49 концентрируют. Остаток экстрагируют при перемешивании диизопропиловым эфиром. После фильтрации выделяют 0,14 г (14%) указанного в заголовке соединения в виде бесцветного твердого вещества; tпл 188-190 С. 4. Гидрохлорид (5-хлор-2,6-диметилпиримидин-4-ил)(3-метил-4-2-[2-(2,2,2-трифторэтокси)этокси]этилсульфанилпиридин-2-илметил)амина. 0,28 г гидрида натрия (суспензия 60%-й концентрации) суспендируют в 8 мл диметилформамида в атмосфере азота. Затем при интенсивном перемешивании добавляют по каплям в течение 0,5 ч при комнатной температуре раствор, содержащий 0,62 г (3,93 ммоль) 4-амино 5-хлор-2,6-диметилпиримидина в диметилформамиде (5 мл). Суспензию перемешивают при комнатной температуре еще в течение 0,5 ч. Затем по каплям в течение 0,5 ч добавляют раствор, содержащий 0,84 г (2,44 ммоль) 2 хлорметил-3-метил-4-2-[2-(2,2,2-трифторэтокси)этокси]этилсульфанилпиридина в диметилформамиде (5 мл) и смесь перемешивают при комнатной температуре еще в течение 0,5 ч. Смесь охлаждают до 0 С и осторожно обрабатывают водой (10 мл) при интенсивном перемешивании. Смесь экстрагируют этилацетатом(320 мл). Органические экстракты промывают 20 мл воды, сушат над сульфатом магния и концентрируют. Остаток очищают с помощью хроматографии на силикагеле (элюент: толуол/ этилацетат (1:1. Фракции с Rf=0,31 концентрируют и остаток растворяют в изопропаноле. Затем его осаждают с помощью раствора хлористого водорода в простом эфире. После фильтрации фильтрат концентрируют. Выделяют 0,5 г(41%) указанного в заголовке соединения в виде бесцветного твердого вещества; tпл 235-241 С. 5. 5-(3-2-[(5-Хлор-2,6-диметилпиримидин-4-иламино)метил]-3-метилпиридин-4 илсульфанилпропилсульфанилметил)-3 метилоксазолидин-2-он. 4,5 г (11,32 ммоль) гидрохлорида 5-[3-(2 хлорметил-3-метилпиридин-4-илсульфанил) пропилсульфанилметил]-3-метилоксазолидин-2 она растворяют в 30 мл воды и обрабатывают 30 мл дихлорметана. Значение рН доводят до 8 с помощью насыщенного раствора бикарбоната натрия при интенсивном перемешивании. Отделяют органическую фазу. Водную фазу экстрагируют еще один раз с использованием 30 мл дихлорметана. Объединенные органические фазы сушат над сульфатом магния и концентрируют и остаток растворяют в 10 мл диметилформамида. Этот раствор добавляют по каплям в течение 20 мин к предварительно приготовленному раствору, содержащему 2,73 г (16,98 ммоль) 4-амино-5-хлор-2,6-диметилпиримидина и 0,5 г (12,45 ммоль) гидрида натрия (60%-й крепости в парафине) в 35 мл диметилформамида. Смесь перемешивают в течение 20 ч при комнатной температуре. Диметилформамид отгоняют в глубоком вакууме и остаток растворяют в 100 мл воды. Смесь экстрагируют трижды,используя каждый раз по 25 мл дихлорметана. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле с использованием смеси этилацетат/метанол(15:1). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 3,13 г (57%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 121 С. 6.(5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[4-(пиримидин-2-илсульфанил) бутокси]пиридин-2-илметиламин. 1,2 г (3,24 ммоль) [4-(4-хлорбутокси)-3 метилпиридин-2-илметил](5-хлор-2,6-диметилпиримидин-4-ил)амина кипятят с обратным холодильником в течение 5 ч в 30 мл ацетонитрила вместе с 0,41 г (3,57 ммоль) 2-меркаптопиримидина и 0,67 г (6,48 ммоль) карбоната натрия. Ацетонитрил отгоняют в вакууме и остаток растворяют в 70 мл воды. Смесь экстрагируют трижды, используя каждый раз по 30 мл дихлорметана. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле,используя смесь толуол/ этилацетат/метанол/конц. раствор аммиака(6:3,5:0,5:0,05). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 1,25 г(87%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 112114C. 7. 4-[3-(5-Хлор-2,6-диметилпиримидин-4 иламино)пропилсульфанил]-3-метилпиридин-2 илметил(5-хлор-2,6-диметилпиримидин-4-ил) амин. 25 30 г (104,28 ммоль) гидрохлорида 2 хлорметил-4-(3-хлорпропилсульфанил)-3 метилпиридина растворяют в 100 мл воды и обрабатывают при перемешивании насыщенным раствором бикарбоната натрия. Затем смесь трижды экстрагируют дихлорметаном,используя каждый раз по 50 мл. Объединенные органические фазы сушат над сульфатом магния и концентрируют. Остаток растворяют в 15 мл безводного ДМФ и по каплям добавляют к предварительно приготовленному раствору,содержащему 20,12 г (125,13 ммоль) 4-амино-5 хлор-2,6-диметилпиримидина и 4,6 г (114,71 ммоль) гидрида натрия (60%-й крепости в парафине) в 100 мл безводного ДМФ. Смесь перемешивают при комнатной температуре в течение 20 ч. Затем ДМФ отгоняют в вакууме, остаток растворяют в 150 мл воды и раствор трижды экстрагируют дихлорметаном, используя каждый раз по 50 мл. Объединенные органические фазы дважды промывают водой и концентрируют. Остаток хроматографируют на силикагеле,используя смесь толуол/этилацетат/ метанол/конц. раствор аммиака (6:3,6:0,4:0,05). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 7,82 г (14%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 170-174 С. 8. (5-Хлорпиримидин-4-ил)3-метил-4-[3(пиридин-4-илметилсульфанил)пропилсульфанил]пиридин-2-илметиламин. 1,2 г (3,49 ммоль) [4-(3-хлорпропилсульфанил)-3-метилпиридин-2-илметил](5-хлорпиримидин-4-ил)амина и 1,26 г (5,24 ммоль) хлорида 2-пиридин-4-илметилизотиурония суспендируют в 30 мл этанола. По каплям в течение 20 мин добавляют 2,33 мл (13,96 ммоль) 6 н. водного раствора NaOH. Смесь перемешивают в течение 30 мин при комнатной температуре и затем выдерживают при 60 С в течение 2 ч. После охлаждения ее разбавляют 100 мл воды и экстрагируют четыре раза дихлорметаном, используя каждый раз по 30 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле, используя смесь толуол/этилацетат/метанол/конц. раствор аммиака (6:3,6:0,4:0,05). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 1,18 г (78%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 148-149 С. 9. (5-Хлорпиримидин-4-ил)(3-метил-4-3[2-(2-метил-5-нитроимидазол-1-ил)этилсульфанил]пропилсульфанилпиридин-2-илметил) амин. 1,2 г (3,49 ммоль) [4-(3-хлорпропилсульфанил)-3-метилпиридин-2-илметил](5-хлорпиримидин-4-ил)амина и 1,39 г (5,24 ммоль) хлорида 2-[2-(2-метил-5-нитроимидазол-1-ил)этил]изотиурония суспендируют в 30 мл этанола. По каплям в течение 20 мин добавляют 1,75 мл 26 Смесь перемешивают в течение 30 мин при комнатной температуре и затем выдерживают при 60 С в течение 5 ч. После охлаждения ее разбавляют 100 мл воды и трижды экстрагируют этилацетатом, используя каждый раз по 30 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле, используя смесь толуол/этилацетат/ метанол/конц. раствор аммиака (6:3,6:0,4:0,05). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 0,81 г (47%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 119-121 С. 10. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[3-(пиримидин-2-илсульфанил)пропилсульфанил]пиридин-2-илметиламин. 1 г (2,69 ммоль) [4-(3-хлорпропилсульфанил)-3-метилпиридин-2-илметил](5-хлор-2,6 диметилпиримидин-4-ил)амина кипятят с обратным холодильником в 30 мл ацетонитрила в течение 4 ч вместе с 0,34 г (2,96 ммоль) 2 меркаптопиримидина и 0,57 г (5,38 ммоль) карбоната натрия. Ацетонитрил отгоняют в вакууме и остаток растворяют в 75 мл воды. Его трижды экстрагируют смесью дихлорметан/метанол (10:1), используя каждый раз по 25 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле,используя смесь дихлорметан/ метанол/триэтиламин (10:1:0,1). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 1,04 г (87%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 158-159 С. 11. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[4-(4-пиридин-4-илметилпиперазин 1-ил)бутокси]пиридин-2-илметиламин. 1,5 г (3,58 ммоль) (5-хлор-2,6-диметилпиримидин-4-ил)[3-метил-4-(4-пиперазин-1-илбутокси)пиридин-2-илметил]амина кипятят с обратным холодильником в 30 мл ацетона в течение 6 ч вместе с 0,84 г (5,12 ммоль) гидрохлорида 4-хлорметилпиридина, 1,14 г (10,74 ммоль) карбоната натрия и каталитическим количеством йодида натрия. Ацетон отгоняют в вакууме и остаток растворяют в 100 мл воды. Его экстрагируют четыре раза смесью дихлорметан/метанол (10:1), используя каждый раз по 25 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле, используя смесь дихлорметан/метанол/ триэтиламин (10:1:0,1). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 1,34 г (73%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 157-158 С. 12. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[4-(4-пиридин-4-илметилпиперазин 1-ил)бутилсульфанил]пиридин-2-илметиламин. 1 г (2,29 ммоль) (5-хлор-2,6-диметилпиримидин-4-ил)[3-метил-4-(4-пиперазин-1-илбутилсульфанил)пиридин-2-илметил]амина кипятят с 27 обратным холодильником в 30 мл ацетона в течение 5 ч вместе с 0,41 г (2,41 ммоль) гидрохлорида 4-хлорметилпиридина, 0,73 г (6,87 ммоль) карбоната натрия и каталитическим количеством йодида натрия. Ацетон отгоняют в вакууме и остаток растворяют в 100 мл воды. Его экстрагируют четыре раза смесью дихлорметан/метанол (10:1), используя каждый раз по 25 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле, используя смесь дихлорметан/метанол/ триэтиламин (10:1:0,1). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 0,96 г (80%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 139-140 С. 13. 1,4-бис 4-[3-Метил-2-(5-хлор-2,6-диметилпиримидин-4-ил)аминометил]пиридин-4 илсульфанилбутилпиперазин. 2,25 г (5,84 ммоль) [4-(4-хлорбутилсульфанил)-3-метилпиридин-2-илметил](5-хлор-2,6 диметилпиримидин-4-ил)амина кипятят с обратным холодильником в 30 мл ацетонитрила в течение 10 дней вместе с 0,51 г (5,84 ммоль) пиперазина, 1,24 г (11,67 ммоль) карбоната натрия и каталитическим количеством йодида натрия. Затем смесь перемешивают при комнатной температуре в течение двух дней. Ацетонитрил отгоняют в вакууме и остаток растворяют в 150 мл воды. Его трижды экстрагируют смесью дихлорметан/метанол (15:1), используя каждый раз по 50 мл. Объединенные органические фазы промывают дважды водой и концентрируют. Остаток хроматографируют на силикагеле, используя смесь хлороформ/метанол/конц. раствор аммиака (10:2:0,05). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 0,84 г (55%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 188-190 С. 14. (5-Хлор-2,6-диметилпиримидин-4-ил)[3-метил-4-(4-пиперазин-1-илбутокси)пиридин 2-илметил]амин. 5 г (13,53 ммоль) [4-(4-хлорбутокси)-3 метилпиридин-2-илметил](5-хлор-2,6-диметилпиримидин-4-ил)амина кипятят с обратным холодильником в 100 мл ацетонитрила в течение 72 ч вместе с 7,0 г (81,23 ммоль) пиперазина,4,30 г (40,59 ммоль) карбоната натрия и каталитическим количеством йодида натрия. Затем смесь перемешивают при комнатной температуре в течение двух дней. Ацетонитрил отгоняют в вакууме и остаток растворяют в 150 мл воды. Его экстрагируют пять раз смесью дихлорметан/метанол (10:1), используя каждый раз по 50 мл. Объединенные органические фазы промывают дважды водой и концентрируют. Остаток хроматографируют на силикагеле, используя смесь дихлорметан/метанол/триэтиламин(10:2:0,1). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 3,4 г (60%) ука 003553 28 занного в заголовке соединения в виде кристаллического твердого вещества; tпл 140-144 С. 15. (5-Хлор-2,6-диметилпиримидин-4-ил)[3-метил-4-[4-(пиридин-4-илметилсульфанил) бутокси]пиридин-2-илметил]амин. 1,5 г (4,06 ммоль) [4-(4-хлорбутокси)-3 метилпиридин-2-илметил](5-хлор-2,6-диметилпиримидин-4-ил)амина и 1,46 г (6,06 ммоль) хлорида 2-пиридин-4-илметилизотиурония суспендируют в 30 мл этанола. По каплям в течение 30 мин добавляют 2,53 мл (15,18 ммоль) 6 н. водного раствора NaOH. Смесь перемешивают в течение 30 мин при комнатной температуре и затем выдерживают при 60 С в течение 5 ч. После охлаждения ее разбавляют 100 мл воды и экстрагируют четыре раза этилацетатом, используя каждый раз по 25 мл. Объединенные органические фазы однократно промывают водой и концентрируют. Остаток хроматографируют на силикагеле, используя смесь толуол/ этилацетат/метанол/конц. раствор аммиака(6:3,5:0,5:0,05). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 1,15 г(62%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 9092 С. 16. (5-Хлор-2,6-диметилпиримидин-4-ил)(3-метил-4-4-[2-(2-метил-5-нитроимидазол-1 ил)этилсульфанил]бутоксипиридин-2-илметил) амин. 1,5 г (4,06 ммоль) [4-(4-хлорбутокси)-3 метилпиридин-2-илметил](5-хлор-2,6-диметилпиримидин-4-ил)амина и 2,02 г (7,60 ммоль) хлорида 2-[2-(2-метил-5-нитроимидазол-1-ил) этил]изотиурония суспендируют в 30 мл этанола. По каплям в течение 30 мин добавляют 2,53 мл (15,18 ммоль) 6 н. водного раствора NaOH. Смесь перемешивают в течение 30 мин при комнатной температуре и затем выдерживают при 60 С в течение 5 ч. После охлаждения ее разбавляют 100 мл воды и трижды экстрагируют этилацетатом, используя каждый раз по 30 мл. Объединенные органические фазы однократно промывают водой и концентрируют. Остаток хроматографируют на силикагеле, используя смесь толуол/этилацетат/метанол/конц. раствор аммиака (6:3,5:0,5:0,05). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 1,06 г (50%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 114-117C. 17. (5-Хлор-2,6-диметилпиримидин-4-ил)[3-метил-4-(4-пиперазин-1-илбутилсульфанил) пиридин-2-илметил]амин. 5 г (12,97 ммоль) [4-(4-хлорбутилсульфанил)-3-метилпиридин-2-илметил](5-хлор-2,6 диметилпиримидин-4-ил)амина кипятят с обратным холодильником в 100 мл ацетонитрила в течение 18 ч вместе с 6,84 г (77,84 ммоль) пиперазина, 4,12 г (38,91 ммоль) карбоната натрия и каталитическим количеством йодида натрия. 29 Ацетонитрил отгоняют в вакууме и остаток растворяют в 100 мл воды. Его экстрагируют пять раз смесью хлороформ/метанол (10:1), используя каждый раз по 30 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле, используя смесь хлороформ/метанол/триэтиламин (10:2:0,1). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 3,81 г (68%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 143-145 С. 18. (5-Хлор-2,6-диметилпиримидин-4-ил)[3-хлор-4-(метил-3-[2-(2-метил-5-нитроимидазол-1-ил)этилсульфанил]пропиламино) пиридин-2-илметил]амин. К суспензии, содержащей 0,39 г (1,0 ммоль) 3-хлор-4-[(3-хлорпропил)метиламино] пиридин-2-илметил(5-хлор-2,6-диметилпиримидин-4-ил)амина и 0,5 г (1,8 ммоль) гидрохлорида 2-[2-(2-метил-5-нитроимидазол-1-ил)этил] изотиомочевины в этаноле (20 мл), по каплям в атмосфере азота в течение 0,5 ч добавляют 0,5 мл (3,0 ммоль) 6 н. раствора гидроксида натрия. Суспензию перемешивают при 60 С в течение 1 ч и затем концентрируют. Остаток растворяют в 70 мл воды и 50 мл этилацетата. Водную фазу экстрагируют 330 мл этилацетата. Органические экстракты промывают водой, сушат над сульфатом магния и концентрируют. Остаток очищают с помощью хроматографии на силикагеле (элюент: толуол/диоксан (2:1. Концентрируют фракции с Rf=0,22. Получают 0,3 г (49%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 123-126 С. 19. (5-Хлор-2,6-диметилпиримидин-4-ил)NaOH. Смесь перемешивают в течение 30 мин при комнатной температуре и затем выдерживают при 60 С в течение 3 ч. После охлаждения ее разбавляют 80 мл воды и трижды экстрагируют этилацетатом, используя каждый раз по 30 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле, используя смесь толуол/этилацетат/ метанол/конц. раствор аммиака (6:3,6:0,4:0,05). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 0,56 г (45%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 142-144 С. 20. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[4-(пиридин-4-илметилсульфанил) бутилсульфанил]пиридин-2-илметиламин. 30 1,0 г (2,32 ммоль) [4-(4-бромбутилсульфанил)-3-метилпиридин-2-илметил](5-хлор-2,6 диметилпиримидин-4-ил)амина и 0,84 г (3,49 ммоль) хлорида 2-пиридин-4-илметилизотиурония суспендируют в 20 мл этанола. По каплям в течение 30 мин добавляют 1,54 мл (9,24 ммоль) 6 н. водного раствора NaOH. Смесь перемешивают в течение 30 мин при комнатной температуре и затем выдерживают при 60 С в течение 3 ч. После охлаждения ее разбавляют 80 мл воды и трижды экстрагируют этилацетатом, используя каждый раз по 25 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле, используя смесь толуол/этилацетат/метанол/конц. раствор аммиака (6:3,5:0,5:0,05). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 1,09 г (99%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 104-106 С. 21. Полуфумарат 5-(3-2-[(5-хлор-2,6 диметилпиримидин-4-иламино)метил]-3-метилпиридин-4-илсульфанилпропилсульфанилметил)-3-(4-метоксифенил)оксазолидин-2-она. 0,21 г (1,3 ммоль) 4-амино-5-хлор-2,6 диметилпиримидина растворяют в 10 мл диметилформамида в атмосфере азота и порциями при интенсивном перемешивании добавляют 0,05 г гидрида натрия (суспензия 80%-й концентрации). Затем суспензию перемешивают в течение 1 ч при комнатной температуре. Затем по каплям в течение 0,5 ч добавляют раствор, содержащий 0,59 г (1,3 ммоль) 5-[3-(2-хлорметил 3-метилпиридин-4-илсульфанил)пропилсульфанилметил]-3-(4-метоксифенил)оксазолидин-2 она в диметилформамиде (10 мл), и смесь перемешивают в течение ночи при комнатной температуре. Смесь охлаждают до 0 С и осторожно обрабатывают водой (50 мл) при интенсивном перемешивании. Затем ее экстрагируют 350 мл этилацетата. Органические экстракты промывают 50 мл воды, сушат над сульфатом магния и концентрируют. Остаток очищают с помощью хроматографии на силикагеле (элюент: этилацетат). Полученный маслянистый остаток растворяют в 10 мл горячего метанола и по каплям добавляют раствор, содержащий 0,14 г (1,2 ммоль) фумаровой кислоты в 5 мл метанола. После фильтрации и сушки осадка получают 0,49 г (56%) указанного в заголовке соединения;tпл 161-164C. 22. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[3-(1-метилпиперидин-3-илметилсульфанил)пропилсульфанил]пиридин-2-илметиламин. 5 г (14 ммоль) гидрохлорида 2-хлорметил 3-метил-4-[3-(1-метилпиперидин-3-илметилсульфанил)пропилсульфанил]пиридина растворяют в приблизительно 50 мл дихлорметана и выделяют свободное основание с помощью насыщенного водного раствора бикарбоната натрия. Органическую фазу отделяют и концен 31 трируют. Остаток растворяют в 75 мл ацетонитрила и обрабатывают 2,43 г (15,4 ммоль) 4 амино-5-хлор-2,6-диметилпиримидина. Смесь кипятят с обратным холодильником в течение 20 ч. Ацетонитрил отгоняют в вакууме и остаток растворяют в 250 мл воды. Значение рН доводят до 8 с помощью насыщенного водного раствора бикарбоната натрия. Смесь экстрагируют четыре раза этилацетатом, используя каждый раз по 50 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле, используя смесь изопропилацетат/метанол/конц. раствор аммиака(6:1:0,1). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 2,62 г (40%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 92-94 С. 23. Гидрохлорид (5-хлор-2,6-диметилпиримидин-4-ил)3-метил-4-[3-(4-пиридин-4-илметилпиперазин-1-ил)пропилсульфанил]пиридин 2-илметиламина. 1 г (2,37 ммоль) (2-хлор-2,6-диметилпиримидин-4-ил)-[3-метил-4-(3-пиперазин-1 илпропилсульфанил)пиридин-2-илметил]амина кипятят с обратным холодильником в 60 мл ацетона в течение 20 ч вместе с 0,4 г (2,37 ммоль) гидрохлорида 4-хлорметилпиридина,0,75 г (7,1 ммоль) карбоната натрия и каталитическим количеством йодида натрия. Ацетон отгоняют в вакууме и остаток растворяют в 100 мл воды. Его трижды экстрагируют дихлорметаном, используя каждый раз по 25 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле, используя смесь этилацетат/метанол (10:1). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 1,33 г (73%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 166-168 С. 24. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[3-(пиридин-4-илметилсульфанил) пропилсульфанил]пиридин-2-илметиламин. 1,5 г (4,04 ммоль) [4-(3-хлорпропилсульфанил)-3-метилпиридин-2-илметил](5-хлор-2,6 диметилпиримидин-4-ил)амина и 2,0 г (8,4 ммоль) хлорида 2-пиридин-4-илметилизотиурония суспендируют в 30 мл этанола. По каплям в течение 30 мин добавляют 2 мл (12 ммоль) 6 н. водного раствора NaOH. Смесь перемешивают в течение 30 мин при комнатной температуре и затем выдерживают при 60 С в течение 3 ч. После охлаждения ее разбавляют 100 мл воды и трижды экстрагируют этилацетатом, используя каждый раз по 30 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле, используя смесь этилацетат/метанол/конц. раствор аммиака (15:1:0,1). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 1,48 г(80%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 124125 С. 32 25. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[3-(пиперазин-1-ил)пропилсульфанил]пиридин-2-илметиламин. 2 г (5,38 ммоль) [4-(3-хлорпропилсульфанил)-3-метилпиридин-2-илметил](5-хлор-2,6 диметилпиримидин-4-ил)амина кипятят с обратным холодильником в 40 мл ацетонитрила в течение 20 ч вместе с 0,36 г (4,04 ммоль) пиперазина, 1,71 г (16,14 ммоль) карбоната натрия и 0,08 г (0,54 ммоль) йодида натрия. Ацетонитрил отгоняют в вакууме, остаток растворяют в 150 мл воды и значение рН доводят до 8 с помощью 2 М уксусной кислоты. Смесь экстрагируют четыре раза смесью хлороформ/метанол (10:1),используя каждый раз по 25 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле, используя смесь хлороформ/метанол/триэтиламин (10:1: 0,1). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 0,24 г (12%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 144-145 С. 26. 1,4-бис 3-(3-Метил-2-(5-хлор-2,6-диметилпиримидин-4-иламинометил)пиридин-4 илсульфанил)пропилпиперазин. 2 г (5,38 ммоль) [4-(3-хлорпропилсульфанил)-3-метилпиридин-2-илметил](5-хлор-2,6 диметилпиримидин-4-ил)амина кипятят с обратным холодильником в 40 мл ацетонитрила в течение 20 ч вместе с 0,36 г (4,04 ммоль) пиперазина, 1,71 г (16,14 ммоль) карбоната натрия и 0,08 г (0,54 ммоль) йодида натрия. Ацетонитрил отгоняют в вакууме, остаток растворяют в 150 мл воды и значение рН доводят до 8 с помощью 2 М уксусной кислоты. Смесь экстрагируют четыре раза смесью хлороформ/метанол (10:1),используя каждый раз по 25 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на силикагеле, используя смесь хлороформ/метанол/триэтиламин (10:1: 0,1). Неочищенный продукт дигерируют ацетонитрилом. Получают 0,63 г (31%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 234-237 С. 27. (5-Хлор-2,6-диметилпиримидин-4-ил)NaOH. Смесь перемешивают в течение 30 мин при комнатной температуре и затем выдерживают при 60 С в течение 3 ч. После охлаждения ее разбавляют 50 мл воды и трижды экстрагируют дихлорметаном, используя каждый раз по 25 мл. Объединенные органические фазы концентрируют. Остаток хроматографируют на си 33 ликагеле, используя смесь толуол/этилацетат/ метанол/конц. раствор аммиака (6:3:1:0,1). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 0,97 г (69%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 145-147 С. 28. (5-Хлор-2,6-диметилпиримидин-4-ил)[3-метил-4-(2-2-[2-(2-метил-5-нитроимидазол 1-ил)этилсульфанил]этоксиэтокси)пиридин-2 илметил]амин. 1,2 г (3,11 ммоль) (5-хлор-2,6-диметилпиримидин-4-ил)4-[2-(2-хлорэтокси)этокси]-3 метилпиридин-2-илметиламина и 1,84 г (6,92 ммоль) гидрохлорида 2-[2-(2-метил-5-нитроимидазол-1-ил)этил]изотиомочевины суспендируют в 25 мл этанола в атмосфере азота. В течение 30 мин добавляют 1,6 мл (9,6 ммоль) 6 н. раствора NaOH. Смесь перемешивают в течение 30 мин при комнатной температуре и затем при 60 С в течение 6 ч. Смесь сливают на 150 мл воды и трижды экстрагируют дихлорметаном,используя каждый раз по 50 мл. Объединенные органические фазы концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя смесь толуол/этилацетат/ метанол/конц. раствор аммиака (6:3,5:0,5:0,05). Неочищенный продукт дигерируют диэтиловым эфиром. Выход: 0,39 г (23%); tпл 102-105 С. 29. (5-Хлор-2,6-диметилпиримидин-4-ил)(3-метил-4-2-[2-(пиридин-4-илметилсульфанил)этокси]этоксипиридин-2-илметил)амин. Соединение получают аналогично способу, описанному в примере 28, из (5-хлор-2,6 диметилпиримидин-4-ил)4-[2-(2-хлорэтокси) этокси]-3-метилпиридин-2-илметиламина (1,2 г, 3,11 ммоль) и дигидрохлорида S-пиридин-4 илметилизотиомочевины (1,05 г, 4,37 ммоль). Выход: 1,13 г (77%); tпл 103-105 С. 30. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[2-(пиридин-4-илметилсульфанил) этокси]пиридин-2-илметиламин. Соединение получают аналогично способу, описанному в примере 28, из (5-хлор-2,6 диметилпиримидин-4-ил)[4-(2-хлорэтокси)-3 метилпиридин-2-илметил]амина (1,5 г, 4,39 ммоль) и дигидрохлорида(12 ммоль) 6 н. раствора NaOH. Смесь перемешивают в течение 2 ч при 60 С. Смесь сливают на 150 мл воды и трижды экстрагируют дихлорметаном, используя каждый раз по 50 мл. Объединенные органические фазы концентри 003553 34 руют в вакууме. Неочищенный продукт растирают с диэтиловым эфиром. Выход: 1,5 г (90%);(3-метил-4-2-[2-(2-метил-5-нитроимидазол-1 ил)этилсульфанил]этоксипиридин-2-илметил) амин. Соединение получают аналогично способу, описанному в примере 28, из (5-хлор-2,6 диметилпиримидин-4-ил)[4-(2-хлорэтокси)-3 метилпиридин-2-илметил]амина (1,5 г, 4,39 ммоль) и гидрохлорида S-[2-(2-метил-5-нитроимидазол-1-ил)этил]изотиомочевины (3,23 г,12,16 ммоль). Выход: 0,99 г (46%); tпл 139144 С. 33. (5-Хлор-2,6-диметилпиримидин-4-ил)(3-метил-4-3-[2-(2-метил-5-нитроимидазол-1 ил)этилсульфанил]пропоксипиридин-2 илметил)амин. Соединение получают аналогично способу, описанному в примере 28, из (5-хлор-2,6 диметилпиримидин-4-ил)[4-(3-хлорпропокси)-3 метилпиридин-2-илметил]амина (1,3 г, 3,65 ммоль) и гидрохлорида S-[2-(2-метил-5 нитроимидазол-1-ил)этил]изотиомочевины (1,94 г, 7,31 ммоль). Выход: 1,23 г (67%); tпл 169171 С. 34. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[3-(пиридин-4-илметилсульфанил) пропокси]пиридин-2-илметиламин. Соединение получают аналогично способу, описанному в примере 28, из (5-хлор-2,6 диметилпиримидин-4-ил)[4-(3-хлорпропокси)-3 метилпиридин-2-илметил]амина (1,3 г, 3,65 ммоль) и дигидрохлоридаS-пиридин-4 илметилизотиомочевины (1,32 г, 5,48 ммоль). Выход: 1,19 г (73%); tпл 111-113 С. 35. 2-[2-(2-2-[(5-Хлор-2,6-диметилпиримидин-4-иламино)метил]-3-метилпиридин-4 илоксиэтокси)этилсульфанил]этанол. Соединение получают аналогично способу, описанному в примере 31, из (5-хлор-2,6 диметилпиримидин-4-ил)4-[2-(2-хлорэтокси) этокси]-3-метилпиридин-2-илметиламина (1,0 г, 2,59 ммоль) и 2-меркаптоэтанола (0,32 г, 4,10 ммоль). Выход: 0,89 г (80%); tпл 114-116 С. 36. 2-(4-2-[(5-Хлор-2,6-диметилпиримидин-4-иламино)метил]-3-метилпиридин-4 илоксибутилсульфанил)этанол. Соединение получают аналогично способу, описанному в примере 31, из [4-(4 хлорбутокси)-3-метилпиридин-2-илметил](5 хлор-2,6-диметилпиримидин-4-ил)амина (1,5 г,4,06 ммоль) и 2-меркаптоэтанола (0,50 г, 6,41 ммоль). Выход: 1,37 г (82%); tпл 116-118 С. 37. 2-(4-2-[(5-Хлор-2,6-диметилпиримидин-4-иламино)метил]-3-метилпиридин-4-илсульфанилбутилсульфанил)этанол. Соединение получают аналогично способу, описанному в примере 31, из [4-(4 хлорбутилсульфанил)-3-метилпиридин-2 илметил](5-хлор-2,6-диметилпиримидин-4 35 ил)амина (1,5 г, 3,89 ммоль) и 2 меркаптоэтанола (0,48 г, 6,15 ммоль). Выход: 1,29 г (78%); tпл 142-143 С. 38. 5-[4-(3-2-[(5-Хлор-2,6-диметилпиримидин-4-иламино)метил]-3-метилпиридин-4 илсульфанилпропил)пиперазин-1-илметил]-3 пиридин-4-илметилоксазолидин-2-он. 1,5 г (4,03 ммоль) (5-хлор-2,6-диметилпиримидин-4-ил)-[4-(3-хлорпропилсульфанил)3-метилпиридин-2-илметил]амина и 2,23 г (8,04 ммоль) 5-пиперазин-1-илметил-3-пиридин-4 илметилоксазолидин-2-она кипятят с обратным холодильником в 30 мл ацетонитрила в течение 12 ч вместе с 1,1 г (8,08 ммоль) К 2 СО 3 каталитическим количеством йодида натрия. Смесь сливают на 150 мл воды и экстрагируют четыре раза дихлорметаном, используя каждый раз по 25 мл. Объединенные органические фазы концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя смесь толуол/этилацетат/метанол/конц. раствор аммиака (6:3:1:0,05). Неочищенный продукт растирают с диэтиловым эфиром. Выход: 0,46 г (19%); tпл 123-126 С. 39. 2-(3-2-[(5-Хлор-2,6-диметилпиримидин-4-иламино)метил]-3-метилпиридин-4 илсульфанилпропилсульфанил)D-глюкопиранозид. 1,5 г (4,03 ммоль) (5-хлор-2,6-диметилпиримидин-4-ил)-[4-(3-хлорпропилсульфанил)3-метилпиридин-2-илметил]амина и 0,88 г (4,04 ммоль) натриевой соли 1-тиоD-глюкозы суспендируют в 30 мл изопропанола в течение 10 ч. Смесь сливают на 150 мл воды и трижды экстрагируют дихлорметаном, используя каждый раз по 50 мл. Образовавшуюся суспензию экстрагируют 50 мл смеси хлороформ/метанол (9:1). Объединенные органические фазы концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя смесь дихлорметан/метанол (9:1). Неочищенный продукт растирают с диэтиловым эфиром. Выход: 1,03 г (48%); tпл 168-172 С. 40. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[3-(3-нитротиофен-2-илсульфанил) пропилсульфанил]пиридин-2-илметиламин. 0,14 г (6,00 ммоль) гидрида натрия суспендируют в 5 мл ДМФ. Медленно добавляют раствор, содержащий 1,32 г (8,2 ммоль) 4-амино-5 хлор-2,6-диметилпиримидина в 15 мл ДМФ. Раствор перемешивают в течение 1 ч. 2,25 г(5,47 ммоль) гидрохлорида (2-хлорметил-3 метил-4-[3-(3-нитротиофен-2-илсульфанил)пропилсульфанил]пиридина суспендируют в 20 мл воды. Добавляют раствор NаНСО 3 в воде (20 мл). Смесь экстрагируют 20 мл дихлорметана. Органическую фазу сушат над MgSO4 и концентрируют в вакууме. Остаток растворяют в 5 мл ДМФ и медленно добавляют к полученному выше раствору натриевой соли 4-амино-5-хлор 2,6-диметилпиримидина. Смесь перемешивают 36 в течение 18 ч при комнатной температуре и после этого концентрируют в вакууме. Остаток суспендируют в 100 мл воды и четыре раза экстрагируют 25 мл дихлорметана. Объединенные органические фазы концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя смесь толуол/этилацетат/ метанол/конц. раствор аммиака (6:3,6:0,4:0,05). Неочищенный продукт растирают с диэтиловым эфиром. Выход: 1,52 г (56%); tпл 174-180 С. 41. (5-Хлор-2,6-диметилпиримидин-4-ил)(3-метил-4-3-[2-(пиримидин-2-илсульфанил) этилсульфанил]пропилсульфанилпиридин-2 илметил)амин. 1,5 г (3,20 ммоль) гидрохлорида (5-хлор 2,6-диметилпиримидин-4-ил)4-[3-(2-хлорэтилсульфанил)пропилсульфанил]-3-метилпиридин 2-илметиламина, 0,39 г (3,37 ммоль) 2 меркаптопиримидина и 1,0 г (9,6 ммоль) Na2CO3 кипятят с обратным холодильником в 30 мл ацетонитрила в течение 12 ч. Смесь концентрируют в вакууме. Остаток суспендируют в 100 мл воды и экстрагируют четыре раза дихлорметаном, используя каждый раз по 25 мл. Объединенные органические фазы концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя смесь толуол/этилацетат/метанол (6:3,5:0,05). Неочищенный продукт растирают с диэтиловым эфиром. Выход: 0,92 г (57%); tпл 112-115C. 42. (5-Хлор-2,6-диметилпиримидин-4-ил)(3-метил-4-2-[2-(пиридин-4-илметилсульфанил)этокси]этилсульфанилпиридин-2-илметил) амин. Соединение получают аналогично способу, описанному в примере 28, из (5-хлор-2,6 диметилпиримидин-4-ил)4-[2-(2-хлорэтокси) этилсульфанил]-3-метилпиридин-2-илметил амина (1,5 г, 3,73 ммоль) и дигидрохлорида 2 пиридин-4-илметилизотиомочевины (1,35 г, 5,62 ммоль). Выход: 1,34 г (74%); tпл 68-71C. 43. (5-Хлор-2,6-диметилпиримидин-4-ил)[3-метил-4-(2-2-[2-(пиридин-4-илметилсульфанил)этокси]этоксиэтилсульфанил)пиридин-2 илметил]амин. Соединение получают аналогично способу, описанному в примере 28, из (5-хлор-2,6 диметилпиримидин-4-ил)(4-2-[2-(2-хлорэтокси)этокси]этилсульфанил-3-метилпиридин-2 илметил)амина (2,0 г, 4,49 ммоль) и дигидрохлорида 2-пиридин-4-илметилизотиомочевины[3-метил-4-(1-метилпиперидин-3-илметилсульфанил)пиридин-2-илметил]амин. Соединение получают аналогично способу, описанному в примере 40, из 4-амино-5 хлор-2,6-диметилпиримидина (1,55 г, 9,63 37 ммоль) и гидрохлорида 2-хлорметил-3-метил-4(1-метилпиридин-3-илметилсульфанил)пиридина (3,0 г, 9,63 ммоль). Реакцию сочетания проводят при 0 С (продолжительность реакции 2 ч). Хроматографию осуществляют с использованием смеси толуол/этилацетат/метанол/конц. раствор аммиака (6:3,5:0,5:0,05). Неочищенный продукт растирают с диэтиловым эфиром. Выход: 2,23 г (57%); tпл 148-149 С. 45. (5-Хлорпиримидин-4-ил)3-метил-4-[3(4-пиридин-4-илметилпиперазин-1-ил)пропилсульфанил]пиридин-2-илметиламин. 1,0 г (2,54 ммоль) (5-хлорпиримидин-4 ил)[3-метил-4-(3-пиперазин-1-илпропилсульфанил)пиридин-2-илметил]амина и 0,57 г (3,51 ммоль) гидрохлорида 4-пиколилхлорида кипятят с обратным холодильником в 25 мл ацетонитрила в течение 8 ч вместе с 1,0 г (9,43 ммоль) Na2CO3 и каталитическим количеством йодида натрия. Смесь концентрируют в вакууме. Остаток суспендируют в 150 мл воды и экстрагируют четыре раза дихлорметаном, используя каждый раз по 25 мл. Объединенные органические фазы концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя смесь дихлорметан/ метанол/триэтиламин (10:1:0,1). Неочищенный продукт растирают с диэтиловым эфиром. Выход: 0,74 г (60%); tпл 149-151C. 46. (5-Хлор-2,6-диметилпиримидин-4-ил)(10,06 ммоль) К 2 СО 3 перемешивают при 80 С в 14 мл ДМФ в течение 3 дней. Смесь сливают на 100 мл воды и трижды экстрагируют 25 мл дихлорметана. Объединенные органические фазы концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя смесь толуол/этилацетат/метанол/конц. раствор аммиака (6:3,5:0,5:0,01). Неочищенный продукт растирают с диэтиловым эфиром. Выход: 0,46 г (36%); tпл 188-190 С. 47. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[3-(пиридин-3-илметилсульфанил) пропилсульфанил]пиридин-2-илметиламин. Соединение получают аналогично способу, описанному в примере 28, из (5-хлор-2,6 диметилпиримидин-4-ил)[4-(3-хлорпропилсульфанил)-3-метилпиридин-2-илметил]амина (1,5 г,4,04 ммоль) и дигидрохлорида S-пиридин-4 илметилизотиомочевины (1,46 г, 6,08 ммоль). Выход: 1,48 г (80%); tпл 104-105 С. 48. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[3-(пиридин-2-илметилсульфанил) пропилсульфанил]пиридин-2-илметиламин. Соединение получают аналогично способу, описанному в примере 28, из (5-хлор-2,6 диметилпиримидин-4-ил)[4-(3-хлорпропил 003553(1,5 г, 4,04 ммоль) и дигидрохлорида Sпиридин-2-илметилизотиомочевины (1,46 г, 6,08 ммоль). Выход: 1,57 г (85%); tпл 100-101 С. 49. (5-Хлорпиримидин-4-ил)(3-метил-4-2[2-(2-метил-5-нитроимидазол-1-ил)этилсульфанил]этоксипиридин-2-илметил)амин. Соединение получают аналогично способу, описанному в примере 28, из [4-(2 хлорэтокси)-3-метилпиридин-2-илметил](5 хлорпиримидин-4-ил)амина (1,5 г, 4,78 ммоль) и гидрохлорида S-[2-(2-метил-5-нитроимидазол-1 ил)этил]изотиомочевины (1,90 г, 7,18 ммоль). Выход: 0,45 г (20%); tпл 145-147 С. 50. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[4-(пиридин-3-илметилсульфанил) бутокси]пиридин-2-илметиламин. Соединение получают аналогично способу, описанному в примере 28, из [4-(4 хлорбутокси)-3-метилпиридин-2-илметил](5 хлор-2,6-диметилпиримидин-4-ил)амина (1,5 г,4,06 ммоль) и дигидрохлорида S-пиридин-3 илметилизотиомочевины (1,46 г, 6,08 ммоль). Выход: 1,38 г (74%); tпл 94-95 С. 51. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[4-(пиридин-2-илметилсульфанил) бутокси]пиридин-2-илметиламин. Соединение получают аналогично способу, описанному в примере 28, из [4-(4 хлорбутокси)-3-метилпиридин-2-илметил](5 хлор-2,6-диметилпиримидин-4-ил)амина (1,5 г,4,06 ммоль) и дигидрохлорида 2-пиридин-2 илметилизотиомочевины (1,46 г, 6,08 ммоль). Выход: 1,63 г (88%); tпл 113-114 С. 52. (5-Хлор-2,6-диметилпиримидин-4-ил) 3-метил-4-[2-[2-(пиридин-3-илметилсульфанил)этокси]этилсульфанил]пиридин-2-илметил амин. Соединение получают аналогично способу, описанному в примере 28, из (5-хлор-2,6 диметилпиримидин-4-ил)4-[2-(2-хлорэтокси) этилсульфанил]-3-метилпиридин-2-илметил амина (2,0 г, 4,98 ммоль) и дигидрохлорида Sпиридин-3-илметилизотиомочевины (1,79 г, 7,46 ммоль). Выход: 1,75 г (72%); tпл 90-92 С. 53. (5-Хлор-2,6-диметилпиримидин-4-ил)(3-метил-4-2-[2-(пиридин-2-илметилсульфанил)этокси]этилсульфанилпиридин-2-илметил) амин. Соединение получают аналогично способу, описанному в примере 28, из (5-хлор-2,6 диметилпиримидин-4-ил)4-[2-(2-хлорэтокси) этилсульфанил]-3-метилпиридин-2-илметил амина (2,0 г, 4,98 ммоль) и дигидрохлорида Sпиридин-2-илметилизотиомочевины (1,79 г, 7,46 ммоль). Выход: 2,07 г (85%); tпл 70-72 С. 54. (5-Хлорпиримидин-4-ил)3-метил-4-[2(пиридин-4-илметилсульфанил)этокси]пиридин-2-илметиламин. Соединение получают аналогично способу, описанному в примере 28, из [4-(2 39 хлорэтокси)-3-метилпиридин-2-илметил](5 хлорпиримидин-4-ил)амина (1,3 г, 4,15 ммоль) и дигидрохлорида S-пиридин-4-илметилизотиомочевины (1,50 г, 6,25 ммоль). Выход: 1,3 г(78%); tпл 119-121C. 55. 2-(3-Хлор-2-[(5-хлорпиримидин-4 иламино)метил]пиридин-4-илметиламино) этанол. Соединение получают аналогично способу, описанному в примере 2, из 2-[(3-хлор-2 хлорметилпиридин-4-ил)метиламино]этанола(2,60 г, 20 ммоль). Выход: 2,64 г (29%); tпл 158161 С. 56. (5-Хлорпиримидин-4-ил)(3-метил-4-3[2-(2-метил-5-нитроимидазол-1-ил)этилсульфанил]пропоксипиридин-2-илметил)амин. Соединение получают аналогично способу, описанному в примере 28, из (5 хлорпиримидин-4-ил)[4-(3-хлорпропокси)-3 метилпиридин-2-илметил]амина (2,0 г, 6,11 ммоль) и гидрохлорида 2-[2-(2-метил-5 нитроимидазол-1-ил)этил]изотиомочевины (2,43 г, 9,17 ммоль). Выход: 0,9 г (31%); tпл 143-146C. 57. (5-Хлор-2,6-диметилпиримидин-4-ил)(14,94 ммоль) К 2 СО 3 и каталитическое количество йодида натрия суспендируют в 25 мл ацетонитрила и перемешивают при 80 С в течение 20 ч. Смесь сливают на 100 мл воды и трижды экстрагируют 30 мл дихлорметана. Объединенные органические фазы промывают водой и концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя смесь толуол/этилацетат/метанол/конц. раствор аммиака (6:3:1:0,01). Неочищенный продукт растирают с диэтиловым эфиром. Выход: 0,19 г (8%); tпл 160-163 С. 58. (5-Хлорпиримидин-4-ил)4-[2-(фуран 2-илметилсульфанил)этокси]-3-метилпиридин 2-илметиламин. 1,5 г (4,0 ммоль) 2-2-[(5-хлорпиримидин 4-иламино)метил]-3-метилпиридин-4-илсульфанилэтилового эфира метансульфоновой кислоты и 0,7 г (12 ммоль) фурилмеркаптана растворяют в 15 мл ДМФ. Добавляют 0,29 г (12 ммоль) гидроксида лития в 1,5 мл воды. Смесь перемешивают при 60 С в течение 1 ч. Смесь сливают на 100 мл воды и трижды экстрагируют 30 мл дихлорметана. Объединенные органические фазы промывают водой и концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя смесь толуол/этилацетат/метанол/конц. раствор аммиака(6:3,6:0,4:0,01). Неочищенный продукт расти 003553(71%); tпл 129-130 С. 59. (5-Хлорпиримидин-4-ил)[4-(фуран-2 илметилсульфанил)-3-метилпиридин-2-илметил]амин. Соединение получают аналогично способу, описанному в примере 40, из 4-амино-5 хлорпиримидина (1,34 г, 10,33 ммоль) и гидрохлорида 2-хлорметил-4-(фуран-2-илметилсульфанил)-3-метилпиридина (3,0 г, 10,33 ммоль). Продукт хроматографируют с использованием смеси толуол/этилацетат/метанол/конц. раствор аммиака (6:3,5:0,5:0,01). Неочищенный продукт растирают с диэтиловым эфиром. Выход: 1,77 г[4-(фуран-2-илметилсульфанил)-3-метилпиридин-2-илметил]амин. Соединение получают аналогично способу, описанному в примере 40, из 4-амино-5 хлор-2,6-диметилпиримидина (1,63 г, 10,33 ммоль) и гидрохлорида 2-хлорметил-4-(фуран 2-илметилсульфанил)-3-метилпиридина (3,0 г,10,33 ммоль). Продукт хроматографируют с использованием смеси толуол/этилацетат/ метанол/конц. раствор аммиака (6:3,5:0,5:0,01). Неочищенный продукт растирают с диэтиловым эфиром. Выход: 2,17 г (56%); tпл 159-160 С. Исходные соединения А. [4-(3-Хлорпропилсульфанил)-3-метилпиридин-2-илметил](5-хлор-2,6-диметилпиримидин)амин. 1,04 г (26,07 ммоль) гидрида натрия(60%-й крепости в парафине) вносят в 10 мл диметилформамида. По каплям добавляют 5,6 г(34,76 ммоль) 4-амино-5-хлор-2,6-диметилпиримидина в 30 мл диметилформамида. Смесь перемешивают при комнатной температуре в течение 1 ч. Затем 5 г (17,38 ммоль) гидрохлорида 4-(3-хлорпропилсульфанил)-2-хлорметил-3 метилпиридина суспендируют в 100 мл дихлорметана и выделяют свободное основание с использованием насыщенного водного раствора бикарбоната натрия. Органическую фазу сушат над сульфатом магния и концентрируют. Остаток растворяют в 10 мл диметилформамида и по каплям добавляют к предварительно приготовленному раствору. Смесь перемешивают при комнатной температуре в течение 2 ч. Диметилформамид отгоняют в глубоком вакууме и остаток растворяют в 150 мл воды. Раствор экстрагируют четыре раза дихлорметаном, используя каждый раз по 30 мл. Объединенные органические фазы промывают водой, сушат над сульфатом магния и концентрируют. Остаток хроматографируют на силикагеле, используя смесь толуол/этилацетат/метанол/конц. раствор аммиака (5:4:1:0,1). Получают 3,49 г (54%) указанного в заголовке соединения в виде кристаллического твердого вещества, которое используют без дополнительной очистки.[3-метил-4-(3-пиперазин-1-илпропилсульфанил) пиридин-2-илметил]амин. 3 г (8,08 ммоль) (2-хлор-2,6-диметилпиримидин-4-ил)[4-(3-хлорпропилсульфанил)-3 метилпиридин-2-илметил]амина кипятят с обратным холодильником в 60 мл ацетонитрила в течение 20 ч вместе с 4,18 г (48,47 ммоль) пиперазидина, 2,57 г (24,24 ммоль) карбоната натрия и каталитическим количеством йодида натрия. Ацетонитрил отгоняют в вакууме и остаток растворяют в 75 мл воды. Раствор трижды экстрагируют смесью хлороформ/метанол (10:1), используя каждый раз по 30 мл. Объединенные органические фазы промывают водой и концентрируют. Остаток хроматографируют на силикагеле, используя смесь хлороформ/метанол/ триэтиламин (10:2:0,1). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 2,74 г (81%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 144-145 С. В. Гидрохлорид 2-хлорметил-3-метил-4-[3(1-метилпиперидин-3-илметилсульфанил) пропилсульфанил]пиридина. В 1. Гидрохлорид 2-гидроксиметил-3 метил-4-[3-(1-метилпиперидин-3-илметилсульфанил)пропилсульфанил]пиридина. 10 г (37,6 ммоль) гидрохлорида [4-(3 меркаптопропилсульфанил)-3-метилпиридин-2 ил]метанола и 6,58 г (35,73 ммоль) гидрохлорида 3-хлорметил-N-метилпиперидина перемешивают в 70 мл диметилформамида при 50 С в течение 5 ч вместе с 26 г (188 ммоль) карбоната калия. Диметилформамид отгоняют в глубоком вакууме и экстрагируют пять раз этилацетатом,используя каждый раз по 50 мл. Объединенные органические фазы промывают водой, сушат над сульфатом магния и концентрируют. Остаток хроматографируют на силикагеле, используя смесь этилацетат/метанол/конц. раствор аммиака (6:1:0,1). Получают 8 г (63%) указанного в заголовке соединения в виде масла желтого цвета, которое используют без дополнительной очистки. В 2. Гидрохлорид 2-хлорметил-3-метил-4[3-(1-метилпиперидин-3-илметилсульфанил) пропилсульфанил]пиридина. 3 г (8,83 ммоль) гидрохлорида 2-гидроксиметил-3-метил-4-[3-(1-метилпиперидин-3-илметилсульфанил)пропилсульфанил]пиридина растворяют в 50 мл дихлорметана и обрабатывают 1,26 г (10,6 ммоль) тионилхлорида в 10 мл дихлорметана. Смесь перемешивают при комнатной температуре в течение 2 ч. Затем ее концентрируют в вакууме и дважды упаривают совместно с толуолом, используя каждый раз по 30 мл толуола. Остаток сушат в вакууме. Получают 3,5 г (100%) указанного в заголовке соединения в виде масла зеленого цвета, которое используют без дополнительной очистки.[4-(4-Бромбутилсульфанил)-3-метилпиридин-2-илметил](5-хлор-2,6-диметилпиримидин-4-ил)амин. Г 1. [4-(4-Бромбутилсульфанил)-3-метилпиридин-2-ил]метанол. 50 г (185 ммоль) хлорида 2-(2-гидроксиметил-3-метилпиридин-4-ил)изотиурония растворяют в 270 мл этанола и 130 мл воды в атмосфере азота. Добавляют 160 г (740 ммоль) 1,4 дибромбутана. По каплям в течение 45 мин добавляют 126,5 мл 6 н. раствора гидроксида натрия. Смесь перемешивают при 50 С в течение 24 ч. Смесь концентрируют в вакууме и остаток разбавляют 400 мл воды. Смесь трижды экстрагируют дихлорметаном, используя каждый раз по 50 мл. Объединенные органические фазы промывают водой и концентрируют. Остаток снова растворяют в 400 мл воды. Значение рН доводят до 8, используя насыщенный водный раствор бикарбоната натрия. Смесь трижды экстрагируют толуолом, используя каждый раз по 50 мл. Объединенные органические фазы промывают водой, сушат над сульфатом магния и концентрируют. Остаток хроматографируют на силикагеле, используя смесь этилацетат/ метанол/конц. раствор аммиака (19:1:0,1). Получают 11,67 г (22%) указанного в заголовке соединения в виде масла желтого цвета, которое используют без дополнительной очистки. Г 2. Гидрохлорид 4-(4-бромбутилсульфанил)-2-хлорметил-3-метилпиридина. 11,5 г (39,62 ммоль) [4-(4-бромбутилсульфанил)-3-метилпиридин-2-ил]метанола растворяют в 75 мл дихлорметана и обрабатывают в течение 20 мин 7,07 г (59,43 ммоль) тионилхлорида в 20 мл дихлорметана. Смесь перемешивают при комнатной температуре в течение 2 ч. Затем ее концентрируют в вакууме и дважды упаривают совместно с толуолом, используя каждый раз по 50 мл толуола. Неочищенный продукт дигерируют диэтиловым эфиром. Получают 11,97 г (88%) указанного в заголовке соединения в виде кристаллического твердого вещества, которое используют без дополнительной очистки. Г 3. [4-(4-Бромбутилсульфанил)-3-метилпиридин-2-илметил](5-хлор-2,6-диметилпиримидин-4-ил)амин. 0,76 г (19,1 ммоль) гидрида натрия (60%-й концентрации в парафине) вносят в 5 мл диметилформамида. По каплям добавляют 4,2 г(26,07 ммоль) 4-амино-5-хлор-2,6-диметилпиримидина в 25 мл диметилформамида. Смесь перемешивают при комнатной температуре в течение 1 ч. Затем 6 г (17,38 ммоль) гидрохлорида 4-(4-бромбутилсульфанил)-2-хлорметил-3 метилпиридина суспендируют в 100 мл дихлорметана и выделяют свободное основание с использованием насыщенного водного раствора бикарбоната натрия. Органическую фазу сушат над сульфатом магния и концентрируют. Остаток растворяют в 5 мл диметилформамида и по 43 каплям добавляют к предварительно приготовленному раствору. Смесь перемешивают при комнатной температуре в течение 12 ч. Диметилформамид отгоняют в глубоком вакууме и остаток растворяют в 150 мл воды. Раствор экстрагируют четыре раза дихлорметаном, используя каждый раз по 50 мл. Объединенные органические фазы промывают водой, сушат над сульфатом магния и концентрируют. Остаток хроматографируют на силикагеле, используя смесь толуол/этилацетат/метанол/конц. раствор аммиака (6:3,5:0,5:0,05). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 2,27 г (30%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 127-128 С. Д.[4-(4-Хлорбутилсульфанил)-3-метилпиридин-2-илметил](5-хлор-2,6-диметилпиримидин-4-ил)амин. Д 1. Хлорид 2-(2-гидроксиметил-3-метилпиридин-4-ил)изотиурония 40 г (206 ммоль) гидрохлорида 4-хлор-2-гидроксиметил-3-метилпиридина кипятят с обратным холодильником в течение 14 ч в 400 мл ацетона вместе с 18,9 г(248 ммоль) тиомочевины. Затем смесь охлаждают до 0 С и осадившийся твердый продукт отфильтровывают под вакуумом. Твердый продукт перемешивают в 200 мл этанола на холоду,отфильтровывают под вакуумом и сушат в вакууме. Получают 53,5 г (96%) указанного в заголовке соединения в виде кристаллического твердого вещества, которое используют без дополнительной очистки; tпл 142 С. Д 2. 4-(2-Гидроксиметил-3-метилпиридин 4-илсульфанил)бутан-1-ол 50 г (185 ммоль) хлорида 2-(2-гидроксиметил-3-метилпиридин-4 ил)изотиурония растворяют в смеси, состоящей из 200 мл этанола и 100 мл воды, в атмосфере азота. Добавляют 83 г (740 ммоль) 4-хлор-1 бутанола. Смесь перемешивают при комнатной температуре в течение 3 дней. Смесь концентрируют в вакууме и остаток разбавляют 500 мл воды. Смесь трижды экстрагируют дихлорметаном, используя каждый раз по 50 мл. Объединенные органические фазы промывают водой и концентрируют. Остаток снова растворяют в 400 мл воды. Значение рН доводят приблизительно до 1, используя НСl. Смесь дважды экстрагируют этилацетатом, используя каждый раз по 50 мл для удаления избытка 4-хлор-1 бутанола. Значение рН водной фазы доводят приблизительно до 10, используя NaOH. Смесь трижды экстрагируют дихлорметаном, используя каждый раз по 100 мл. Объединенные органические фазы промывают водой, сушат над сульфатом магния и концентрируют. Остаток хроматографируют на силикагеле, используя смесь толуол/диоксан/конц. раствор аммиака(1:1:0,05). Получают 21,8 г (52%) указанного в заголовке соединения в виде кристаллического твердого вещества; tпл 61-63 С. 44 Д 3. Гидрохлорид 4-(4-хлорбутилсульфанил)-2-хлорметил-3-метилпиридина. 15 г (49,9 ммоль) 4-(2-гидроксиметил-3 метилпиридин-4-илсульфанил)бутан-1-ола растворяют в 200 мл дихлорметана. Медленно по каплям добавляют 19,8 г (166,5 ммоль) тионилхлорида. Смесь перемешивают при комнатной температуре в течение 24 ч. Затем ее концентрируют и трижды упаривают совместно с толуолом, используя каждый раз по 100 мл толуола. Неочищенный продукт дигерируют диэтиловым эфиром. Получают 19,8 г (99%) указанного в заголовке соединения в виде кристаллического твердого вещества, которое используют без дополнительной очистки; tпл 154-157 С. Д 4. [4-(4-Хлорбутилсульфанил)-3-метилпиридин-2-илметил](5-хлор-2,6-диметилпиримидин-4-ил)амин. 2,2 г (54,87 ммоль) гидрида натрия (60%-й концентрации в парафине) вносят в 10 мл диметилформамида. По каплям добавляют 12 г(74,83 ммоль) 4-амино-5-хлор-2,6-диметилпиримидина в 60 мл диметилформамида. Смесь перемешивают при комнатной температуре в течение 1 ч. Затем 15 г (49,88 ммоль) гидрохлорида 4-(4-хлорбутилсульфанил)-2-хлорметил-3 метилпиридина суспендируют в 100 мл дихлорметана и выделяют свободное основание с использованием насыщенного водного раствора бикарбоната натрия. Органическую фазу сушат над сульфатом магния и концентрируют. Остаток растворяют в 15 мл диметилформамида и по каплям добавляют к предварительно приготовленному раствору. Смесь перемешивают при комнатной температуре в течение 2 ч. Диметилформамид отгоняют в глубоком вакууме и остаток растворяют в 350 мл воды. Раствор дважды экстрагируют дихлорметаном, используя каждый раз по 50 мл. Объединенные органические фазы промывают водой, сушат над сульфатом магния и концентрируют. Остаток хроматографируют на силикагеле, используя смесь толуол/этилацетат/метанол/конц. раствор аммиака (6:3,5:0,5:0,05). Неочищенный продукт дигерируют диэтиловым эфиром. Получают 14,16 г (76%) указанного в заголовке соединения в виде кристаллического твердого вещества. Е. [4-(4-Хлорбутокси)-3-метилпиридин-2 илметил](5-хлор-2,6-диметилпиримидин-4-ил) амин. Продукт получают из 15 г (52,7 ммоль) гидрохлорида 4-(4-хлорбутокси)-2-хлорметил-3 метилпиримидина, 12,71 г (79 ммоль) 4-амино 5-хлор-2,6-диметилпиримидина и 2,32 г (57,97 ммоль) гидрида натрия (60%-й концентрации в парафине) аналогично способу получения исходных продуктов А, Г и Д. Получают 13,35 г(69%) указанного в заголовке соединения в виде кристаллического твердого вещества, которое используют без дополнительной очистки. 45 Ж. 3-Хлор-4-[(2-хлорэтил)метиламино] пиридин-2-илметил(5-хлор-2,6-диметилпиримидин-4-ил)амин. 0,75 г (4,76 ммоль) 4-амино-5-хлор-2,6 диметилпиримидина растворяют в 10 мл диметилформамида в атмосфере азота и порциями при интенсивном перемешивании добавляют 0,42 г гидрида натрия (60%-й концентрации в парафине). Суспензию перемешивают в течение 30 мин при комнатной температуре. Затем по каплям в течение 30 мин добавляют раствор,содержащий 1,0 г (4,59 ммоль) (3-хлор-2 хлорметилпиридин-4-ил)(2-хлорэтил)метиламина в диметилформамиде (10 мл), и смесь перемешивают при комнатной температуре еще в течение 30 мин. Смесь охлаждают до 0 С и осторожно обрабатывают водой (100 мл) при интенсивном перемешивании. Затем ее экстрагируют 350 мл этилацетата. Органические экстракты промывают 50 мл воды, сушат над сульфатом магния и концентрируют. Остаток очищают с помощью хроматографии на силикагеле(элюент: толуол/диоксан (2:1. Концентрируют фракции с Rf=0,5. Получают 0,6 г (41%) указанного в заголовке соединения в виде бесцветного твердого вещества, которое используют без дополнительной очистки. 3. 2-[(3-Хлор-2-хлорметилпиридин-4-ил) метиламино]этанол. Раствор, содержащий 2,6 мл (35,4 ммоль) тионилхлорида в 10 мл дихлорметана, добавляют по каплям в течение 20 мин при охлаждении на льду к раствору, содержащему 3,5 г (16,1 ммоль) 2-[(3-хлор-2-гидроксиметилпиридин-4 ил)метиламино]этанола в 50 мл безводного дихлорметана. Затем смесь нагревают до комнатной температуры и перемешивают в течение 30 мин. Затем раствор обрабатывают 100 мл воды при интенсивном перемешивании и нейтрализуют с помощью твердого бикарбоната натрия. Водную фазу экстрагируют 320 мл дихлорметана. Органические экстракты сушат над сульфатом магния и концентрируют. Получают 3,32 г (88%) указанного в заголовке соединения. Этот продукт используют непосредственно для дальнейшей реакции без дополнительной очистки. И. Хлорид 2-(3-2-[(5-хлор-2,6-диметилпиримидин-4-иламино)метил]-3-метилпиридин-4 илсульфанилпропил)изотиурония. И 1.[4-(3-Хлорпропилсульфанил)-3-метилпиридин-2-илметил]-(5-хлор-2,6-диметилпиримидин-4-ил)амин. 4,6 г гидрида натрия (60%-й концентрации в парафине) суспендируют в 20 мл диметилформамида в атмосфере азота и по каплям в течение 40 мин добавляют раствор, содержащий 20,1 г (125,1 ммоль) 4-амино-5-хлор-2,6 диметилпиримидина в 100 мл диметилформамида. Суспензию перемешивают при комнатной температуре в течение 1 ч. Затем 30 г (104,3 46 ммоль) гидрохлорида 2-хлорметил-4-(3-хлорпропилтио)-3-метилпиридина растворяют в 100 мл раствора бикарбоната натрия и 50 мл дихлорметана при интенсивном перемешивании. Отделяют водную фазу и экстрагируют 250 мл дихлорметана. Органические экстракты промывают 50 мл воды, сушат над сульфатом магния и концентрируют. Образовавшееся масло фиолетового цвета растворяют в 15 мл диметилформамида и по каплям в течение 45 мин добавляют к предварительно приготовленному раствору. Смесь перемешивают при комнатной температуре в течение ночи. Смесь осторожно обрабатывают водой (150 мл) при интенсивном перемешивании. Смесь экстрагируют 350 мл дихлорметана. Органические экстракты промывают 50 мл воды, сушат над сульфатом магния и концентрируют. Остаток очищают с помощью хроматографии на силикагеле (элюент: толуол/этилацетат/метанол/конц. раствор аммиака)(6:3,6:0,4:0,05). После концентрирования объединенных фракций получают кристаллизат, который дигерируют диэтиловым эфиром. После фильтрации и сушки осадка выделяют 16,5 г(43%) указанного в заголовке соединения в виде бесцветного твердого вещества, которое используют без дополнительной очистки. И 2. Хлорид 2-(3-2-[(5-хлор-2,6-диметилпиримидин-4-иламино)метил]-3-метилпиридин 4-илсульфанилпропил)изотиурония. 16,5 г (44,4 ммоль) [4-(3-хлорпропилсульфанил)-3-илметилпиридин-2-илметил]-(5 хлор-2,6-диметилпиримидин-4-ил)амина и 10,2 г (133,3 ммоль) тиомочевины суспендируют в 160 мл н-пропанола и кипятят с обратным холодильником в течение 26 ч. Затем суспензию фильтруют и осадок промывают н-пропанолом. После сушки осадка получают 17,4 г (88%) указанного в заголовке соединения. Этот продукт используют для дальнейшей реакции без дополнительной очистки. К. 2-Хлорметил-3-метил-4-2-[2-(2,2,2 трифторэтокси)этокси]этилсульфанилпиридин. К 1. 2-(2-(2,2,2-Трифторэтокси)этокси) этилтолуол-4-сульфонилхлорид. 3,2 г (16,8 ммоль) толуол-4-сульфонилхлорида добавляют порциями к раствору, содержащему 3,0 г (15,9 ммоль) 2-(2-(2,2,2 трифторэтокси)этокси)этанола в 15 мл пиридина. Смесь перемешивают при 40 С в течение 1 ч. Затем смесь концентрируют и остаток растворяют в этилацетате (50 мл) и воде (50 мл). Водную фазу экстрагируют 350 мл этилацетата. Органические экстракты сушат над сульфатом магния и концентрируют. Получают 4,0 г(76%) указанного в заголовке соединения в виде масла светло-желтого цвета, которое используют без дополнительной очистки. К 2. (3-Метил-4-2-[2-(2,2,2-трифторэтокси)этокси]этилсульфанилпиридин-2-ил) метанол. 47 К суспензии, содержащей 1,3 г (3,8 ммоль) 2-(2-(2,2,2-трифторэтокси)этокси)этилтолуол-4 сульфонилхлорида и 1,1 г (4,70 ммоля) хлорида 2-(2-гидроксиметил-3-метилпиридин-4-ил) изотиурония в этаноле (10 мл), добавляют в течение 30 мин по каплям в атмосфере азота 5 мл(12 ммоль) 6 н. раствор гидроксида натрия. Суспензию перемешивают при комнатной температуре в течение 1 ч. Затем ее концентрируют и остаток растворяют в 30 мл воды и 30 мл этилацетата. Водную фазу экстрагируют 330 мл этилацетата. Органические экстракты промывают 20 мл воды, сушат над сульфатом магния и концентрируют. Остаток очищают с помощью хроматографии на силикагеле (элюент: толуол/этилацетат (1:1. Концентрируют фракции сRf=0,46. Выделяют 0,85 г (64%) указанного в заголовке соединения в виде бесцветного твердого вещества, которое используют без дополнительной очистки. К 3. 2-Хлорметил-3-метил-4-[2-[2-(2,2,2 трифторэтокси)этокси]этилсульфанил]пиридин. Раствор, содержащий 0,4 мл (3,42 ммоль) тионилхлорида в 5 мл дихлорметана, добавляют по каплям в течение 20 мин при охлаждении на льду к раствору, содержащему 0,8 г (2,46 ммоля)(3-метил-4-2-[2-(2,2,2-трифторэтокси) этокси]этилсульфанилпиридин-2-ил)метанола в 10 мл безводного дихлорметана. Затем смесь нагревают до комнатной температуры и перемешивают в течение 30 мин. Затем раствор обрабатывают 100 мл воды при интенсивном перемешивании и нейтрализуют с помощью твердого бикарбоната натрия. Водную фазу экстрагируют 320 мл дихлорметана. Органические экстракты сушат над сульфатом магния и концентрируют. Получают 0,84 г (99%) указанного в заголовке соединения. Этот продукт используют непосредственно для дальнейшей реакции без дополнительной очистки. Л. [4-(4-Хлорбутокси)-3-метилпиридин-2 илметил](5-хлор-2,6-диметилпиримидин-4-ил) амин. Л 1. 4-(4-гидроксибутокси)-2,3-диметилпиридин-N-оксид. 24,4 г (609,1 ммоль) гидрида натрия (60%й концентрации в парафине) добавляют порциями в атмосфере азота к 320,2 г (3,55 моль) бутандиола. Смесь перемешивают при комнатной температуре в течение выходных дней. Затем смесь нагревают до 100 С и добавляют 80 г(507,6 ммоль) 4-хлор-2,3-диметилпиридин-Nоксида. Сначала смесь перемешивают при 100 С в течение 2 ч, а затем еще в течение 2 ч при 120 С. После этого смесь концентрируют в глубоком вакууме. Остаток суспендируют в 600 мл этанола и нагревают. После отфильтровывания под вакуумом неорганических солей фильтрат концентрируют. Остаток очищают с помощью хроматографии на силикагеле (элюент: этилацетат-этилацетат/метанол (9:1. Элюат 48 концентрируют. Затем остаток дигерируют диэтиловым эфиром. После фильтрации и сушки осадка получают 67,4 г (63%) указанного в заголовке соединения в виде бесцветного твердого вещества, используют без дополнительной очистки. Л 2. 4-(2-Гидроксиметил-3-метилпиридин 4-илокси)бутан-1-ол 30 г (0,14 моль) 4-(4 гидроксибутокси)-2,3-диметилпиридин-Ноксида добавляют порциями в течение 1 ч при 50 С к 174 г (1,7 моль) уксусного ангидрида. После завершения добавления смесь нагревают до 90 С и перемешивают еще в течение 8 ч. Затем смесь концентрируют. Полученный остаток растворяют в 150 мл метанола и 38,3 г (0,71 моля) раствора метоксида натрия (30%-й концентрации в метаноле). Смесь перемешивают при комнатной температуре в течение 1 ч. Затем смесь концентрируют. Остаток растворяют в полунасыщенном растворе хлорида натрия и дихлорметана при интенсивном перемешивании. Водную фазу экстрагируют 350 мл дихлорметана. Органические экстракты сушат над сульфатом магния и концентрируют. Остаток дигерируют диэтиловым эфиром. После фильтрации и сушки осадка получают 21,6 г (72%) указанного в заголовке соединения. Этот продукт применяют непосредcтвенно для дальнейшей реакции без дополнительной очистки. Л 3. Гидрохлорид 4-(4-хлорбутокси)-2 хлорметил-3-метилпиридина. Раствор, содержащий 33,8 мл (284 ммоль) тионилхлорида в 25 мл дихлорметана, добавляют по каплям в течение 30 мин при охлаждении на льду к раствору, содержащему 15 г (71 ммоль) 4-(2-гидроксиметил-3-метилпиридин-4 илокси)бутан-1-ола в 200 мл безводного дихлорметана. Затем смесь нагревают до комнатной температуры и перемешивают в течение 20 ч. Затем смесь концентрируют и совместно упаривают с 320 мл толуола. Полученный остаток дигерируют диэтиловым эфиром. После фильтрации и сушки осадка получают 20,8 г (100%) указанного в заголовке соединения в виде бесцветного твердого вещества. Этот продукт применяют непосредственно для дальнейшей реакции без дополнительной очистки. Л 4. [4-(4-Хлорбутокси)-3-метилпиридин-2 илметил](5-хлор-2,6-диметилпиримидин-4 ил)амин. 2,3 г гидрида натрия (60%-й концентрации в парафине)суспендируют в 10 мл диметилформамида в атмосфере азота и по каплям в течение 40 мин добавляют раствор, содержащий 12,7 г(79 ммоль) 4-амино-5-хлор-2,6-диметилпиримидина в 70 мл диметилформамида. Затем суспензию перемешивают при комнатной температуре в течение 2 ч. Затем 15 г (52,7 ммоль) гидрохлорида 4-(4-хлорбутокси)-2-хлорметил-3 метилпиридина суспендируют в 100 мл дихлорметана и выделяют свободное основание с ис 49 пользованием насыщенного водного раствора бикарбоната натрия. Органическую фазу сушат над сульфатом магния и концентрируют. Остаток растворяют в 100 мл диметилформамида и по каплям добавляют к предварительно приготовленному раствору. Через 45 мин смесь концентрируют в глубоком вакууме. Полученный остаток осторожно обрабатывают водой (150 мл) при интенсивном перемешивании. Затем его экстрагируют 350 мл дихлорметана. Органические экстракты промывают 50 мл воды, сушат над сульфатом магния и концентрируют. Остаток очищают с помощью хроматографии на силикагеле (элюент: толуол/этилацетат/метанол/ конц. раствор аммиака) (6:3,5:0,5:0,05). Элюат концентрируют. Получают 13,5 г (69%) указанного в заголовке соединения в виде бесцветного твердого вещества, которое используют без дополнительной очистки. М. [4-(3-Хлорпропилсульфанил)-3-метилпиридин-2-илметил](5-хлорпиримидин-4-ил) амин. Раствор, содержащий 2,7 г (20,85 ммоль) 4 амино-5-хлорпиримидина в 20 мл диметилформамида, добавляют по каплям к суспензии, содержащей 0,74 г (18,25 ммоль) гидрида натрия(60%-й концентрации в парафине) в 5 мл диметилформамида. Смесь перемешивают при комнатной температуре в течение 20 мин. Затем по каплям в течение 30 мин добавляют раствор,содержащий 5 г (17,38 ммоль) 2-хлорметил-4-(3 хлорпропилсульфанил)-3-метилпиридина в 5 мл диметилфомамида, и затем смесь перемешивают при комнатной температуре в течение 4 ч. После этого смесь концентрируют в глубоком вакууме и остаток растворяют в 150 мл воды и 100 мл дихлорметана при интенсивном перемешивании. Водную фазу экстрагируют 350 мл дихлорметана. Органические экстракты сушат над сульфатом магния и концентрируют. Остаток очищают с помощью хроматографии на силикагеле (элюент: толуол/этилацетат/метанол/конц. раствор аммиака) (6:3,5:0,5:0,05). Элюат концентрируют и остаток дигерируют диэтиловым эфиром. После фильтрации и сушки осадка получают 2,8 г (47%) указанного в заголовке соединения в виде бесцветного твердого вещества,которое используют без дополнительной очистки. Н. 5-[3-(2-Хлорметил-3-метилпиридин-4 илсульфанил)пропилсульфанилметил]-3-метилоксазолидин-2-он.H1. 5-Хлорметил-3-метилоксазолидин-2 он. 3,2 г (81,2 ммоль) гидрида натрия (60%-й концентрации в парафине) суспендируют в 150 мл N-метилпирролидона в атмосфере азота. По каплям в течение 30 мин добавляют раствор,содержащий 10 г (73,7 ммоль) 5-хлорметилоксазолидин-2-она в 40 мл N-метилпирролидона. Суспензию перемешивают при комнатной 50 температуре в течение 1 ч. Затем по каплям добавляют 11,6 г (81,2 ммоль) метилйодида в 10 мл N-метилпирролидона. Смесь перемешивают при комнатной температуре в течение 4 ч. Смесь концентрируют в глубоком вакууме. Полученный остаток осторожно обрабатывают водой (100 мл) при интенсивном перемешивании. Затем его экстрагируют 350 мл дихлорметана. Органические экстракты промывают 50 мл воды, сушат над сульфатом магния и концентрируют. Получают 7,5 г (68%) указанного в заголовке соединения в виде масла, которое используют без дополнительной очистки. Н 2. 5-[3-(2-Гидроксиметил-3-метилпиридин-4-илсульфанил)пропилсульфанилметил]-3 метилоксазолидин-2-он. 7,5 г (28,2 ммоль) гидрохлорида [4-(3 меркаптопропилсульфанил)-3-метилпиридин-2 ил]метанола и 11,7 г (84,72 ммоль) карбоната калия суспендируют в 100 мл диметилформамида в атмосфере азота. Через 30 мин добавляют 7,7 г (31,1 ммоль) 5-хлорметил-3-метилоксазолидин-2-она. Затем смесь перемешивают при 60 С в течение 3 ч. Смеси дают охладиться до комнатной температуры и фильтруют. Фильтрат концентрируют в глубоком вакууме. Остаток растворяют в 50 мл воды. Затем его экстрагируют 330 мл дихлорметана. Органические экстракты промывают 50 мл воды, сушат над сульфатом магния и концентрируют. Остаток очищают с помощью хроматографии на силикагеле(элюент: толуол/диоксан/метанол/конц. раствор аммиака) (5:4:1:0,05). Концентрируют фракции с Rt=0,5. Получают 8,1 г (84%) указанного в заголовке соединения в виде бесцветного масла,которое используют без дополнительной очистки. Н 3. 5-[3-(2-Хлорметил-3-метилпиридин-4 илсульфанил)пропилсульфанилметил]-3-метилоксазолидин-2-он. Раствор, содержащий 3,1 г (25,6 ммоль) тионилхлорида в 20 мл дихлорметана, добавляют по каплям в течение 20 мин при охлаждении на льду к раствору, содержащему 8 г (23,3 ммоль) 5-[3-(2-гидроксиметил-3-метилпиридин 2-илсульфанил)пропилсульфанилметил]-3 метилоксазолидин-2-она в 80 мл безводного дихлорметана. Затем смесь нагревают до комнатной температуры и перемешивают в течение 1 ч. Затем раствор обрабатывают 100 мл воды при интенсивном перемешивании и нейтрализуют с помощью твердого бикарбоната натрия. Водную фазу экстрагируют 350 мл дихлорметана. Органические экстракты сушат над сульфатом магния и концентрируют. Получают 5,0 г(59%) указанного в заголовке соединения в виде масла желтого цвета. Этот продукт применяют непосредственно для дальнейшей реакции без дополнительной очистки.O1. Гидрохлорид (3-хлор-2-хлорметилпиридин-4-ил)(3-хлорпропил)метиламина. Раствор, содержащий 23 мл (317 ммоль) тионилхлорида в 80 мл дихлорметана, добавляют по каплям в течение 20 мин при охлаждении на льду к раствору, содержащему 35,3 г (153 ммоль) (3-хлор-2-гидроксиметилпиридин-4-ил) метиламинопропанола в 300 мл безводного дихлорметана. Затем смесь нагревают до комнатной температуры и перемешивают в течение 1 ч. Затем его концентрируют и остаток растворяют в 200 мл 2 н. раствора NaOH. Водную фазу экстрагируют 3150 мл дихлорметана. Органические экстракты сушат над сульфатом магния и концентрируют. Полученный продукт в виде масла растворяют в метаноле. Затем его осаждают раствором НСl в простом эфире. После фильтрации и сушки осадка получают 27,4 г(67%) указанного в заголовке соединения. Этот продукт применяют непосредственно для дальнейшей реакции без дополнительной очистки.O2. 3-Хлор-4-[(3-хлорпропил)метиламино]пиридин-2-илметил(5-хлор-2,6-диметилпиримидин-4-ил)амин. 1,0 г (6,3 ммоль) 4-амино-5-хлор-2,6 диметилпиримидина растворяют в 20 мл диметилформамида в атмосфере азота. Порциями при интенсивном перемешивании добавляют 0,21 г гидрида натрия (60%-й концентрации в парафине). Затем суспензию перемешивают в течение 30 мин при комнатной температуре. Затем по каплям в течение 30 мин добавляют раствор, содержащий 2,1 г (6,1 ммоль) (3-хлор 2-хлорметилпиридин-4-ил)(3-хлорпропил) метиламина в диметилформамиде (10 мл), и смесь перемешивают при комнатной температуре в течение 1 ч. Смесь охлаждают до 0 С и осторожно обрабатывают водой (100 мл) при интенсивном перемешивании. Затем ее экстрагируют 350 мл этилацетата. Органические экстракты промывают 50 мл воды, сушат над сульфатом магния и концентрируют. Остаток очищают с помощью хроматографии на силикагеле (элюент: толуол/диоксан (4:1. Концентрируют фракции с Rf=0,53. Получают 1,2 г (49%) указанного в заголовке соединения в виде бесцветного твердого вещества, которое используют без дополнительной очистки. П. 5-[3-(2-Хлорметил-3-метилпиридин-4 илсульфанил)пропилсульфанилметил]-3-(4 метоксифенил)оксазолидин-2-он. П 1. 5-[3-(2-Гидроксиметил-3-метилпиридин-4-илсульфанил)пропилсульфанилметил]-3(4-метоксифенил)оксазолидин-2-он. 1,27 г (5,0 ммоль) [4-(3-меркаптопропилсульфанил)-3-метилпиридин-2-ил]метанола растворяют в 10 мл диметилформамида в атмосфере азота и порциями при интенсивном переме 003553(80%-й крепости в парафине). Затем суспензию перемешивают в течение 1 ч при комнатной температуре. Затем по каплям в течение 30 мин добавляют раствор, содержащий 1,0 г (4,1 ммоль) 5-хлорметил-3-(4-метоксифенил)оксазолидин-2-она в диметилформамиде (10 мл), и смесь перемешивают при комнатной температуре в течение 1 ч. Смесь охлаждают до 0 С и осторожно обрабатывают водой (100 мл) при интенсивном перемешивании, очищают с помощью хроматографии на силикагеле (элюент: этилацетат). Концентрируют фракции с Rf=0,23. После кристаллизации из изопропанола получают 0,81 г (49%) указанного в заголовке соединения в виде бесцветного твердого вещества,которое используют без дополнительной очистки. П 2. 5-[3-(2-Хлорметил-3-метилпиридин-4 илсульфанил)пропилсульфанилметил]-3-(4 метоксифенил)оксазолидин-2-он. Раствор, содержащий 0,25 г (2,0 ммоль) тионилхлорида в 5 мл дихлорметана, добавляют по каплям в течение 20 мин при комнатной температуре к раствору, содержащему 0,74 г (1,7 ммоль) 5-[3-(2-гидроксиметил-3-метилпиридин 4-илсульфанил)пропилсульфанилметил]-3-(2 метоксифенил)оксазолидин-2-она в 5 мл безводного дихлорметана и перемешивают в течение ночи. Затем раствор нейтрализуют с помощью раствора бикарбоната натрия при интенсивном перемешивании. Смесь концентрируют до половинного объема, при этом выпадает осадок. После фильтрации и сушки осадка получают 0,75 г (97%) указанного в заголовке соединения. Этот продукт применяют непосредственно для дальнейшей реакции без дополнительной очистки. Р.(5-Хлор-2,6-диметилпиримидин-4-ил) 4-[2-(2-хлорэтокси)этокси]-3-метилпиридин-2 илметиламин. Соединение получают, работая аналогично способу, описанному в примере Л, используя в качестве исходных продуктов диэтиленгликоль и 4-хлор-2,3-диметилпиридин-N-оксид. С. (5-Хлор-2,6-диметилпиримидин-4-ил)[4(2-хлорэтокси)-3-метилпиридин-2-илметил] амин. Соединение получают, работая аналогично способу, описанному в примере Л, используя в качестве исходных продуктов этиленгликоль и 4-хлор-2,3-диметилпиридин-N-оксид. Т. (5-Хлор-2,6-диметилпиримидин-4-ил)[4(3-хлорпропокси)-3-метилпиридин-2-илметил] амин. Соединение получают, работая аналогично способу, описанному в примере Л, используя в качестве исходных продуктов 1,3-пропандиол и 4-хлор-2,3-диметилпиридин-N-оксид. У. 5-Пиперазин-1-илметил-3-пиридин-4 илметилоксазолидин-2-он. 53 У 1. 5-Хлорметил-3-пиридин-4-илметилоксазолидин-2-он. 5,8 г (0,242 моль) гидрида натрия суспендируют в 200 мл NMP (N-метилпирролидон) в атмосфере азота. Медленно в течение 45 мин добавляют раствор-5-хлорметил-2 оксазолидинона (15 г, 0,110 моля) в 60 мл NMP. Смесь перемешивают при комнатной температуре в течение 1 ч. Небольшими порциями в течение 1 ч добавляют гидрохлорид 4 пиколилхлорида (20,46 г, 0,121 моль). Смесь перемешивают в течение 18 ч при комнатной температуре. NMP выпаривают в вакууме. Остаток разбавляют 250 мл воды и четыре раза экстрагируют 50 мл дихлорметана. Объединенные органические фазы промывают водой и концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя смесь этилацетат/метанол (15:1), получая указанное в заголовке соединение (24 г,96%) в виде масла желтого цвета. У 2. 5-Пиперазин-1-илметил-3-пиридин-4 илметилоксазолидин-2-он. 5-Хлорметил-3-пиридин-4-илметилоксазолидин-2-он (18 г, 79,41 ммоль), пиперазин (35 г, 397 ммоль) и К 2 СО 3 (55 г, 397 ммоль) кипятят с обратным холодильником в 350 мл ацетонитрила вместе с каталитическим количеством йодида натрия в течение 24 ч. Смесь фильтруют и ацетонитрил выпаривают в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя смесь этилацетат/метанол (15:1),получая указанное в заголовке соединение (24 г,96%) в виде масла желтого цвета. Ф. Гидрохлорид 2-хлорметил-3-метил-4[3-(3-нитротиофен-2-илсульфанил)пропилсульфанил]пиридина. Ф 1. 2-Гидроксиметил-3-метил-4-[3-(3 нитротиофен-2-илсульфанил)пропилсульфанил]пиридин. Гидрохлорид [4-(3-меркаптопропилсульфанил)-3-метилпиридин-2-ил]метанола (10 г,37,69 ммоль), 2-хлор-3-нитротиофен (6,47 г,39,57 ммоль) и К 2 СО 3 (15,63 г, 113,07 ммоль) перемешивают в 100 мл ДМФ в течение 3 ч при комнатной температуре. Смесь фильтруют и ДМФ выпаривают в вакууме. Остаток разбавляют 150 мл воды и экстрагируют пять раз 30 мл смеси хлороформ/метанол (10:1). Объединенные органические фазы промывают водой и концентрируют в вакууме. Неочищенный продукт растирают с диэтиловым эфиром, получая указанное в заголовке соединение (5,1 г, 38%);tпл 134-138 С. Ф 2. Гидрохлорид 2-хлорметил-3-метил-4[3-(3-нитротиофен-2-илсульфанил)пропилсульфанил]пиридина. 2-Гидроксиметил-3-метил-4-[3-(3-нитротиофен-2-илсульфанил)пропилсульфанил] пиридин (4 г, 10,94 ммоль) суспендируют в 60 мл дихлорметана. Медленно в течение 20 мин добавляют тионилхлорид (1,69 г, 14,23 ммоль) в 54 10 мл дихлорметана. Смесь перемешивают в течение 2 ч при комнатной температуре. Смесь концентрируют в вакууме, получая указанное в заголовке соединение, которое используют без дополнительной очистки.X. Гидрохлорид (5-хлор-2,6-диметилпиримидин-4-ил)4-[3-(2-хлорэтилсульфанил)пропилсульфанил]-3-метилпиридин-2-илметил амина. 2-(3-2-[(5-Хлор-2,6-диметилпиримидин-4 иламино)метил]-3-метилпиридин-4-илсульфанилпропилсульфанил)этанол (12,3 г, 29,78 ммоль) суспендируют в 125 мл дихлорметана. Медленно добавляют тионилхлорид (4,6 г, 38,71 ммоль). Смесь перемешивают в течение 3 ч при комнатной температуре. Смесь концентрируют в вакууме и дважды совместно упаривают с 20 мл толуола. Неочищенный продукт растирают с диэтиловым эфиром, получая указанное в заголовке соединение (14,74 г, 100%). Ц. (5-Хлор-2,6-диметилпиримидин-4-ил) 4-[2-(2-хлорэтокси)этилсульфонил]-3-метилпиридин-2-илметиламин. Ц 1. 4-[2-(2-Хлорэтокси)этилсульфонил]3-метилпиридин-2-илметанол. Соединение получают, работая аналогично способу, описанному в примере 28, из гидрохлорида 2-(2-гидроксиметил-3-метилпиридин-4 ил)изотиомочевины (75 г, 0,277 моль) и 2,2'дихлордиэтилового эфира (158,8 г, 1,11 моль),получая указанное в заголовке соединение(40,36 г, 56%). Ц 2. Гидрохлорид 4-[2-(2-хлорэтокси)этилсульфонил]-2-хлорметил-3-метилпиридина. 4-[2-(2-Хлорэтокси)этансульфонил]-3 метилпиридин-2-илметанол (35 г, 0,133 моль) медленно в течение 1 ч добавляют к 103 г тионилхлорида. Смесь перемешивают в течение 2 ч при комнатной температуре, после чего концентрируют в вакууме. Остаток трижды совместно упаривают с 30 мл толуола и сушат в вакууме. Неочищенный продукт растирают с диэтиловым эфиром, получая указанное в заголовке соединение (40,17 г, 95%). Ц 3. (5-Хлор-2,6-диметилпиримидин-4-ил) 4-[2-(2-хлорэтокси)этилсульфонил]-3-метилпиридин-2-илметиламин. Работая аналогично способу, описанному в примере Д, из гидрохлорида 4-[2-(2-хлорэтокси) этилсульфанил]-2-хлорметил-3-метилпиридина 56 Соединение получают, работая аналогично способу, описанному в примере Л, используя в качестве исходных продуктов этиленгликоль иN-оксид 4-хлор-2,3-диметилпиридина и подвергая взаимодействию на последней стадии 4 амино-5-хлорпиримидин с 4-(2-хлорэтокси)-2 хлорметил-3-метилпиридином. АБ.(5-Хлорпиримидин-4-ил)[4-(3-хлорпропокси)-3-метилпиридин-2-илметил]амин. Соединение получают, работая аналогично способу, описанному в примере Л, используя в качестве исходных продуктов 1,3-пропандиол иN-оксид 4-хлор-2,3-диметилпиридина и подвергая взаимодействию на последней стадии 4 амино-5-хлорпиримидин с 4-(3-хлорпропокси)2-хлорметил-3-метилпиридином. АВ. 2-2-[(5-Хлорпиримидин-4-иламино) метил]-3-метилпиридин-4-илсульфанилэтиловый эфир метансульфоновой кислоты. 2-2-[(5-Хлорпиримидин-4-иламино)метил]-3-метилпиридин-4-илоксиэтанол (3 г,10,11 ммоль) растворяют в смеси дихлорметана(30 мл) и пиридина (1,2 г, 15,17 ммоль). Добавляют ангидрид метансульфоновой кислоты (2,64 г, 15,17 ммоль). Смесь перемешивают в течение 1 ч и затем сливают на 100 мл воды. Значение рН доводят до 8 путем добавления раствораNаНСO3. Смесь экстрагируют три раза 30 мл дихлорметана. Объединенные органические фазы промывают водой (520 мл) и концентрируют в вакууме. Неочищенный продукт растирают с диэтиловым эфиром, получая указанное в заголовке соединение (3,31 г, 88%). АГ. Гидрохлорид 2-хлорметил-4-(фуран-2 илметилсульфанил)-3-метилпиридина. АГ 1. 4-(Фуран-2-илметилсульфанил)-2,3 диметилпиридин-N-оксид. 4-Хлор-2,3-метилпиридин-N-оксид (1200 г,7,61 моль), фурфурилмеркаптан (790 мл, 7,58 моль) и гидроксид натрия (365 г, 9,12 моль) растворяют в 8 л воды в атмосфере азота. Смесь перемешивают при 65 С в течение 8 ч. После охлаждения до комнатной температуры неочищенный продукт фильтруют и сушат в вакууме,получая указанное в заголовке соединение (1493 г, 83%). АГ 2. Гидрохлорид 2-хлорметил-4-(фуран 2-илметилсульфанил)-3-метилпиридина. Соединение получают, работая аналогично способу, описанному в примерах Л 2 и Л 3, используя в качестве исходного продукта 4(фуран-2-илметилсульфанил)-2,3-метилпиридина-N-оксид. Коммерческая ценность Очень высокая активность соединений формулы I и их солей в отношении бактерий р.Helicobacter позволяет применять их в медицине в качестве действующих веществ для лечения болезней у людей, вызываемых бактериями р.Helicobacter. Поэтому изобретение, кроме того, относится к способу лечения млекопитающих, пре 57 жде всего людей, страдающих от болезней, вызываемых бактериями р. Helicobacter. Способ предусматривает введение больному индивидууму терапевтически эффективного и фармакологически переносимого количества одного или нескольких соединений формулы I и/или их фармакологически переносимых солей. Кроме того, изобретение относится к соединениям формулы I и их фармакологически переносимым солям, предназначенным для применения при лечении болезней, вызываемых бактериями р. Helicobacter. Изобретение также относится к применению соединений формулы I и их фармакологически переносимых солей для приготовления лекарственных средств, используемых для борьбы с болезнями, вызываемыми бактериями р. Helicobacter. Кроме того, изобретение относится к лекарственным средствам, предназначенным для борьбы с бактериями р. Helicobacter, которые включают одно или несколько соединений общей формулы I и/или их фармакологически переносимых солей. Среди штаммов Helicobacter, в отношении которых соединения формулы I обладают активностью, следует прежде всего отметить штамм Helicobacter pylori. Лекарственные средства приготавливают хорошо известными методами, которые известны специалисту в данной области. В качестве лекарственных средств фармакологически активные соединения формулы I и их соли (т.е. действующие вещества) применяются либо сами по себе, либо предпочтительно их применяют в сочетании с пригодными фармацевтическими вспомогательными веществами, например, в форме таблеток, таблеток с покрытием,капсул, эмульсий, суспензий, гелей или растворов, при этом содержание действующего вещества преимущественно находится в диапазоне от 0,1 до 95%. Вспомогательные вещества, пригодные для требуемых фармацевтических композиций,известны специалисту в данной области на основе его/ее практического опыта. В дополнение к растворителям, желирующим агентам, вспомогательным веществам для таблеток и другим носителям действующего вещества можно применять, например, антиоксиданты, диспергирующие агенты, эмульгаторы, пеногасители,корригенты, консерванты, солюбилизаторы,красители или агенты, увеличивающие проницаемость, и комплексообразующие агенты (например, циклодекстрины). Действующие вещества могут вводиться,например, парентерально (например, внутривенно) или, прежде всего, орально. В целом действующие вещества в медицине при лечении людей вводят в суточной дозе,составляющей приблизительно от 0,2 до 50,предпочтительно от 1 до 30 мг/кг веса тела, при 58 необходимости в виде нескольких, предпочтительно от 2 до 6, раздельных доз, для достижения требуемого результата. Соединения по изобретению могут также вводиться в виде фиксированной или свободной композиции, включающей вещество, нейтрализующее кислоты желудочного сока и/или ингибирующее секрецию кислот желудочного сока,и/или вещество, применяемое для обычной борьбы с Helicobacter pylori. Веществами, нейтрализующими кислоты желудочного сока, которые следует отметить,являются, например, бикарбонат натрия или другие нейтрализаторы кислот (такие как, например, гидроксид алюминия, алюминат магния или магальдрат). Веществами, ингибирующими секрецию кислот желудочного сока, которые следует отметить, являются, например, блокаторы Н 2 (например, циметидин, ранитидин), ингибиторы Н+/К+ -АТФазы (например, ланзопразол, омепразол, рабепразол или, в частности, пантопразол) и так называемые периферические антихолинергики (например, пирензепин, телензепин). Веществами, применяемыми для обычной борьбы с Helicobacter pylori, которые следует отметить, являются, в частности, вещества, обладающие антимикробной активностью, такие как, например, пенициллин G, гентамицин,эритромицин, кларитромицин, азитромицин,нитрофуразон, тинидазол, нирофурантоин, фуразолидон, метронидазол или амоксициллин,или в альтернативном варианте соли висмута,такие как, например, цитрат висмута. Биологические исследования Активность соединений формулы I в отношении Helicobacter pylori исследовали согласно методу, описанному Tomoyuki Iwahi и др. (Antimicrobial Agents and Chemotherapy, 490496 (1991, с использованием агара Columbia(Oxoid) и периода роста 4 дня. Для исследованных соединений приближенные значения MIC 50 (минимальной ингибирующей концентрации) приведены ниже в табл. А (указанные номера соединений совпадают с номерами примеров в описании). где R1, R2 и R3 имеют одинаковые или отличающиеся друг от друга значения и обозначают водород, С 1-С 4 алкил или галоген,R4 обозначает водород или С 1-С 4 алкил,R5 обозначает водород или С 1-C4 алкил, 60R6 обозначает водород или С 1-С 4 алкил,R7 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкокси или галоген,R8 обозначает водород, С 1-С 4 алкил, С 1 С 4 алкокси или галоген,R9 обозначает водород или С 1-С 4 алкил,А обозначает С 1-С 7 алкилен, С 2-С 7 алкенилен, С 3-С 7 циклоалкилен или фенилен,G обозначает водород, гидроксил, С 1 С 7 алкил, С 1-С 4 алкил, полностью или в основном замещенный фтором, С 2-С 7 алкенил, С 3-С 7 циклоалкил, моно- или диС 1-С 4 алкилкарбамоильную или -тиокарбамоильную группу, N-C1-С 4 алкилN'-цианамидиногруппу, 1-N-С 1-С 4 алкиламино 2-нитроэтиленовую группу, N-2-пропинил-N'цианамидиногруппу,аминосульфониламидиногруппу, группу -N(R10)R11, фрагмент соединения приведенной выше формулы I, связанный с А (включая Х и через X), глюкопиранозидную группу или циклическую систему или бициклическую систему, которая является незамещенной или замещена R12 и R13, и которую выбирают из ряда, включающего бензол, нафталин, фуран, тиофен, пиррол, оксазол, оксазолин,оксазолидинон, изоксазол, тиазол, тиазолин,изотиазол, имидазол, имидазолин, пиразол,триазол, тетразол, тиадиазол, тиадиазол-1 оксид, оксадиазол, пиридин, пиридин-N-оксид,пиримидин, галопиримидин, пиперидин, триазин, пиридон, бензимидазол, имидазопиридин,бензотиазол, бензоксазол, хинолин и имидазопиридазин,где R10 обозначает С 1-С 7 алкил, С 3-С 7 циклоалкил или Аr-С 1-C4 алкил, иR11 обозначает С 1-С 7 алкил,С 3 С 7 циклоалкил или Аr-С 1-С 4 алкил,где Аr обозначает фенил, фурил, нафтил, тетрагидронафтил или фенил, замещенный R14, R15 и R16,или где R10 и R11 вместе с атомом азота, к которому они присоединены, обозначают незамещенную или замещенную 5- или 6-членную кольцевую гетеро(би)циклическую систему,которую выбирают из ряда, включающего пирролидин, пиперидин, пиперазин, морфолин,тиоморфолин, индолин, 1,2,3,4-тетрагидрохинолин и 1,2,3,4-тетрагидроизохинолин,где замещенная пирролидиногруппа замещена одним или двумя идентичными или различными заместителями, выбранными из ряда,включающего С 1-С 4 алкил, С 1-С 4 алкокси, С 1 С 4 алкокси-С 1-С 4 алкил, С 1-С 4 алкоксикарбонил,С 1-С 4 алкилкарбонилокси, гидроксиС 1-С 4 алкил,гидроксил и карбоксил,замещенная пиперидиногруппа замещена одним, двумя или тремя идентичными или различными заместителями, выбранными из ряда,включающего С 1-С 4 алкил, С 1-С 4 алкоксикарбонил, гидроксиС 1-С 4 алкил, фенил или фенилС 1-С 4 алкил, замещенный R14, R15 и R16,бензоил, бензоил, замещенный галогеном, и карбоксил,
МПК / Метки
МПК: A61P 31/04, C07D 401/14, A61K 31/506
Метки: пиримидинаминометилпиридиновые, применение, борьбы, получение, бактериями, р.helicobacter, производные
Код ссылки
<a href="https://eas.patents.su/30-3553-pirimidinaminometilpiridinovye-proizvodnye-ih-poluchenie-i-ih-primenenie-dlya-borby-s-bakteriyami-rhelicobacter.html" rel="bookmark" title="База патентов Евразийского Союза">Пиримидинаминометилпиридиновые производные, их получение и их применение для борьбы с бактериями р.helicobacter</a>
Предыдущий патент: Средство для регулирования йодного обмена или профилактики йоддефицитных состояний
Следующий патент: Фармацевтическая композиция для генерации противовирусного иммунного ответа у человека и животного
Случайный патент: Инъецируемый жидкий состав парацетамола












