Производные бисоксимового эфира, способ и промежуточные продукты для их получения и их применение для борьбы с фитопатогенными грибами и вредителями
Номер патента: 3273
Опубликовано: 24.04.2003
Авторы: Грамменос Вассилиос, Птокк Арне, Лоренц Гизела, Мюллер Бернд, Гроте Томас, Гевер Маркус, Харрис Фолкер, Куллманн Оливер, Штратман Зигфрид, Кейль Михаэль, Аммерманн Эберхард, Байер Герберт, Заутер Хуберт, Гипсер Андреас, Гётц Роланд
Формула / Реферат
1. Производные бисоксимового эфира формулы I
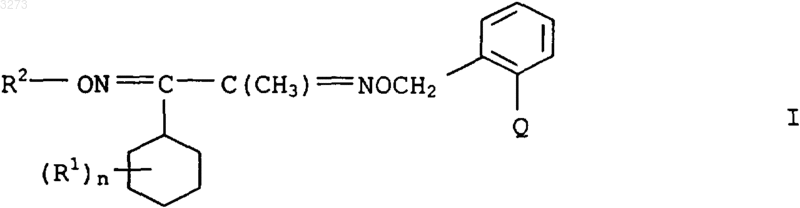
где заместители имеют следующие значения:
R1 означает галоген, C1-C4алкил, C1-C4галогеналкил, C1-C4алкокси или C1-C4галогеналкокси;
n равно от 1 до 5, причем остатки R1 могут быть различными, если n не равно 1;
R2 означает C1-C4алкил, C3-C6алкенил или C3-C6алкинил, причем эти группы могут быть частично или полностью галогенированы;
Q означает группировки C(=CHOCH3)-COOCH3, C(=CHCH3)-COOCH3, C(=NOCH3)-COOCH3 или C(=NOCH3)-CONHCH3;
а также их соли.
2. Способ получения соединений формулы I по п.1, отличающийся тем, что производное бензила формулы II

где L1 означает нуклеофильно замещаемую уходящую группу, подвергают взаимодействию с гидроксиимином формулы III
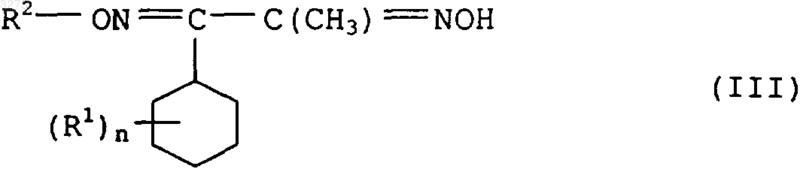
3. Способ получения соединений формулы I по п.1, отличающийся тем, что производное бензила формулы II по п.2 подвергают взаимодействию с дигидроксиимином формулы IV
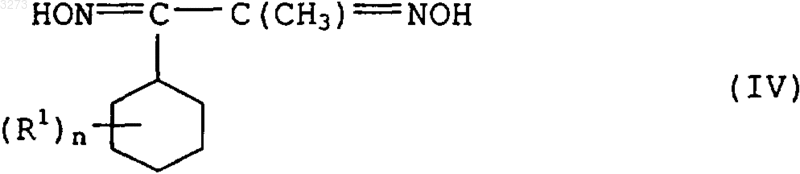
с получением соединения формулы V
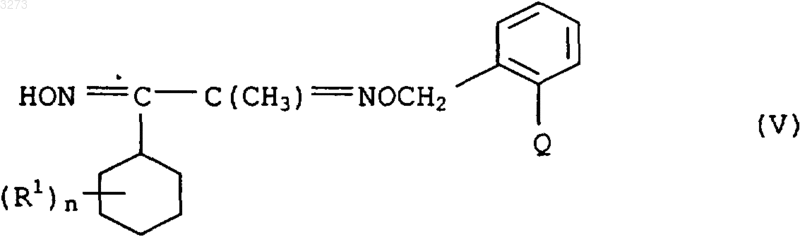
и после этого соединение формулы V подвергают взаимодействию с соединением формулы VI
R2-L2 (VI),
где L2 означает нуклеофильно замещаемую уходящую группу, с получением соединения I.
4. Способ получения соединений формулы I по п.1, отличающийся тем, что производное бензила формулы II по п.2 подвергают взаимодействию с карбонилгидроксиимином формулы VII

с получением соединения формулы VIII
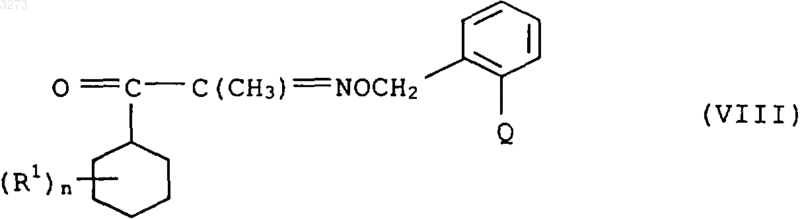
после чего соединение формулы VIII подвергают взаимодействию
a) сначала с гидроксиламином или его солью и потом с соединением формулы VI (R2-L2) по п.3 или
b) с гидроксиламином или солью гидроксиламмония формулы IXa, соответственно IXb,
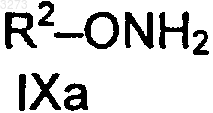
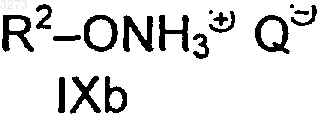
где
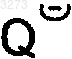
означает анион кислоты.
5. Средство против вредителей или фитопатогенных грибов, содержащее обычные наполнители и эффективное количество соединения формулы I по п.1.
6. Средство по п.5 для борьбы с вредителями из класса насекомых, паукообразных или нематодов.
7. Способ борьбы с вредителями или фитопатогенными грибами, отличающийся тем, что вредители или фитопатогенные грибы, их среду обитания и произрастания или подлежащие защите от них растения, поверхности, материалы или помещения обрабатывают эффективным количеством соединения формулы I по п.1.
8. Применение соединения формулы I по п.1 для получения средств против вредителей или фитопатогенных грибов.
9. Соединения формулы III по п.2.
10. Соединения формулы IV по п.3.
11. Соединения формулы VII по п.4.
12. Соединения формулы VIIA в качестве промежуточного продукта для синтеза соединений формулы I по п.1
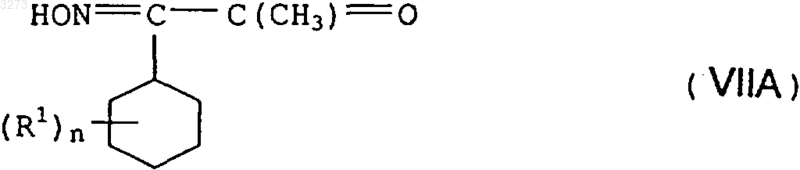
в которой заместители имеют приведенные в п.1 значения.
13. Соединения формулы VIII по п.4.
14. Соединения формулы X в качестве промежуточного продукта для синтеза соединения формулы I по п.1
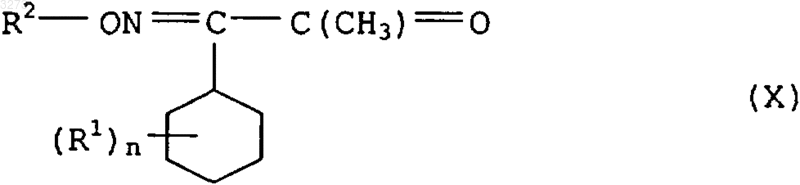
где заместители имеют приведенные в п.1 значения.
15. Соединения формулы XI в качестве промежуточного продукта для синтеза соединений формулы I по п.1
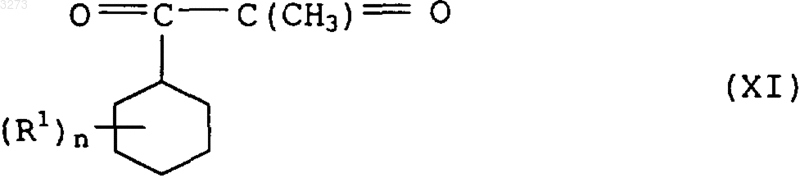
где заместители имею приведенные в п.1 значения.
16. Соединения формулы XIII в качестве промежуточного продукта для синтеза соединений формулы I по п.1
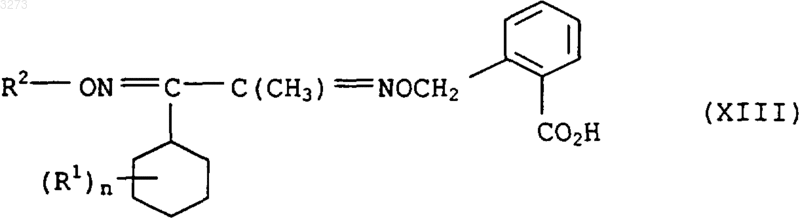
где заместители имею приведенные в п.1 значения.
17. Соединения формулы XV в качестве промежуточного продукта для синтеза соединений формулы I по п.1
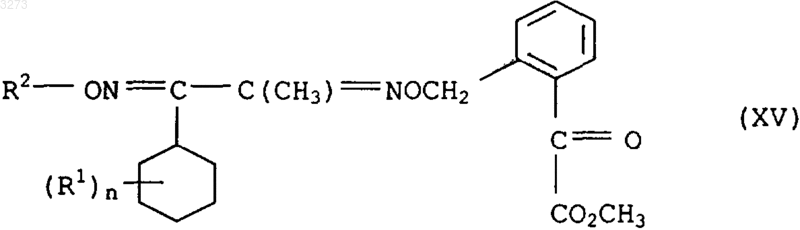
где заместители имеют приведенные в п.1 значения.
18. Соединения формулы XVI в качестве промежуточного продукта для синтеза соединений формулы I по п.1
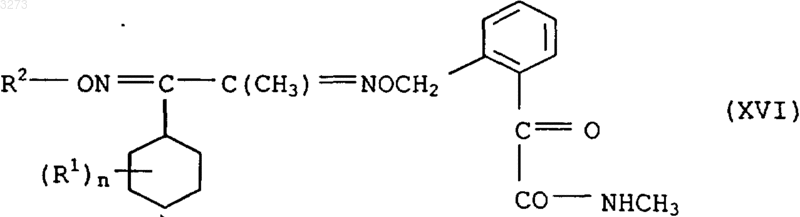
где заместители имеют приведенные в п.1 значения.
19. Применение соединений по пп.9-18 в качестве промежуточных продуктов для синтеза соединений формулы I по п.1.
Текст
1 Настоящее изобретение относится к производным бисоксимового эфира формулы I где заместители имеют следующие значения:R2 означает С 1-С 4 алкил, С 3-С 6 алкенил или С 3-С 6 алкинил, причем эти группы могут быть частично или полностью галогенированы;Q означает группировки С(=СНОСН 3)СООСН 3, С(=СНСН 3)-СООСН 3, С(=NОСН 3)СООСН 3 или С(=NОСН 3)-СОNНСН 3; а также к их солям. Кроме того, изобретение относится к способу и к промежуточным продуктам для получения этих соединений, а также к их применению для борьбы с вредителями и фитопатогенными грибами. Из международных заявок WO-A 95/18789,WO-A 95/21153, WO-A 95/21154 и WO-A 97/05103 известны производные бисоксимового эфира для борьбы с фитопатогенными грибами и вредителями, которые, однако, по их действию не являются удовлетворительными. Задачей изобретения является разработка новых соединений такого типа с улучшенным действием. Эта задача решается вышеприведенными производными бисоксимового эфира формулы I. Кроме того, изобретение относится к способу и к промежуточным продуктам для их получения,а также к содержащим их средствам для борьбы с вредителями и фитопатогенными грибами и к их применению в этом смысле. Соединения формулы I отличаются от известных из вышеприведенных патентных заявок соединений выполнением группировок бисоксимового эфира, которые имеют замещенную циклогексильную группу. Соединения формулы I могут быть получены различными, известными самими по себе способами. При синтезе соединений формулы I не имеет значения, будет ли сначала составлена группировка -Q или группировка Структура группировки Q известна, например, из вышеприведенных заявок, а также из следующих европейских патентных заявок: ЕРА 254 426, ЕР-А 370 629, ЕР-А 463 488, ЕР-А 472 300 и ЕР-А 513 580. При синтезе соединений I исходят в общем из того, что производное бензила формулы IIL1 в формуле II представляет собой нуклеофильно заменяемую, уходящую группу, например галоген или сульфонатные группы,предпочтительно хлор, бром, йод, мезилат, тозилат или трифлат. Взаимодействие осуществляют в инертном органическом растворителе в присутствии основания, например гидрида натрия, гидроокиси калия, гидроокиси натрия, метилата натрия,этилата натрия, карбоната калия или триэтиламина, согласно методам, описанным в публикации Хубен-Вейл, 4-е издание, том. Е 14b, стр. 370 и след. и том 10/1, стр.1189 и след. Требуемый гидроксиимин формулы III получают, например, путем взаимодействия соответствующего дигидроксиимина формулы IV с соединением формулы VIL2 в формуле VI обозначает нуклеофильно заменяемую, уходящую группу, например галоген или сульфонатные группы, предпочтительно хлор, бром, йод, мезилат, тозилат или трифлат. Взаимодействие осуществляют в инертном органическом растворителе в присутствии основания, такого как, например, карбонат калия,гидроокись калия, гидрит натрия, гидроокись натрия, метилат натрия, этилат натрия, пиридин или триэтиламин согласно публикации ХубенаВейла, 4-е издание, том. Е 14b, стр. 307 и след.,стр. 370 и след. и стр. 385 и след; а также, 4-е издание, том. 10/4, стр. 55 и след., стр.180 и след. и стр. 217 и след.; а также, 4-е издание,том Е 5, стр. 780 и след. Соединения формулы IV могут быть получены известными методами [ср. публикацииAcad. Sci. Ser. D Bd. 267, стр. 579 (1968)]. Альтернативно к этому, соединения формулы I могут быть получены таким образом, что производные бензила формулы II сначала подвергают реакции взаимодействия с производными дигидроксиимина IV с получением соответствующего бензилоксима формулы V, причем соединение формулы V после этого подвер 3 гают взаимодействию с соединением формулыVI с получением соединения формулы I Взаимодействие осуществляют в инертном, органическом растворителе в присутствии основания, такого как карбонат калия, гидроокись калия, гидрит натрия, гидроокись натрия,метилат натрия, этилат натрия, пиридин или триэтиламин, согласно методам, приведенным в публикации Хубер-Вейла, 4-е издание, том. 10/1, стр. 1189 и след., том Е 14b, стр. 307 и след., стр. 370 и след. и стр. 385 и след., том 10/4, стр. 55 и след. стр. 180 и след. и стр. 217 и след, том Е 5, стр. 780 и след. Аналогично имеется также возможность получать требуемый гидроксиимин формулы III из карбонилгидроксиимина формулы VII путем взаимодействия с гидроксиламином IХа или его солью IХb 4 осуществляется по реакции Гриньяря при общеизвестных условиях [ср. Organikum, VEBDeutscher Verlag der Wissenschaften, 15-oe издание, стр. 617 и след, Berlin 1981]. Окисление спирта формулы VIIc может осуществляться при общеизвестных условияхThieme Verlag, Stuttgart 1973]. В качестве оксидирующего средства пригодны в общем передающие кислород соединения, как, например,перикись водорода, соединения хрома (VI), соединения марганца, азотно-кислородные соединения (например азотная кислота), диметилсульфоксиды или соединения с положительно индуцированным галогеном (например гипогалогениды). Оксимирование кетона формулы VIId осуществляется обычно в инертном растворителе в присутствии основания или кислоты [ср. публикацию Хубен-Вейла, Методы органической химии, том Х/4, 4-ое издание, стр. 10-27 издательство Georg Thieme Verlag, Stuttgart 1968]. Исходные соединения формул VIIa и VIIb известны и частично могут быть коммерчески приобретены. Альтернативно соединения формулы I могут быть получены также и таким образом: производные бензила II сначала подвергают взаимодействию с производным карбонилгидроксиимином VII с получение соответствующего бензилоксиимина формулы VIII, причем соединение VIII после этого подвергают взаимодействию с гидроксиламином IХа, соответственно,его солью IXb, с получением соединения формулы I в формуле IХb означает анион кислоты, в частности неорганической кислоты, например галогенид, такой как хлорид. Реакция взаимодействия осуществляется в инертном, органическом растворителе согласно заявке ЕР-А 513 580 и публикации Хубен-Вейл,4-ое издание, том 10/4, стр. 73 и след., том Е 14b, стр 369 и след. и стр. 385 и след. Гидроксиимиды формулы VII могут быть получены по следующей схеме синтеза [ср. J. В вышеприведенной схеме синтеза гал. означает атом галогена, в частности хлор или бром. Взаимодействие соединений VIIa и VIIb Реакцию взаимодействия проводят в инертном органическом растворителе согласно методу, описанному в публикации ХубенаВейла Методы органической химии, издательство Georg Thieme Verlag Stuttgart 1980, 4-ое издание, том 4b, стр. 369 и след, том 10/1, стр. 1189 и след. и том 10/4, стр. 73 и след. или в ЕРА 513 580. Другая возможность получения соединения формулы I заключается во взаимодействии производного бензила II с N-гидроксифталимидом и последующего гидразинолиза с получением бензилгидроксиламина IIа и взаимо 5 Взаимодействие осуществляют в инертном растворителе согласно описанным в ЕР-А 463 488 и ЕР-А 585 751 методам. Карбонильные соединения Х получают,например, взаимодействием соответствующего гидроксииминокарбонильного соединения VIIA с соединением формулы VI Аналогично можно получать соединения I таким образом, что бензилгидроксиламин формулы IIа сначала с помощью дикарбонильного производного формулы XI переводят в производное бензилоксиимина формулы VIII и после этого соединение VIII подвергают взаимодействию с гидроксиламином формулы IХа или его солью IХb, как описано выше, с получением соединения I. или взаимодействием соответствующего дикарбонильного соединения XI с гидроксиламиномIXa или его соль IXb Взаимодействие осуществляют в инертном органическом растворителе согласно методам,описанным в ЕР-А 513 580, публикации ХубенВейл, 4-е издание, том 10/4, стр. 55 и след, стр. 73 и след, стр. 180 и след. и стр. 217 и след, том Е 14b, стр. 307 и след. и стр. 369 и след, том Е 5,стр. 780 и след. Соединения формул VIIA, соответственно,XI могут быть получены по известным методам(1986) стр. 1134]. Соединения формулы I можно также получить таким образом, что бензилгидроксиламин формулы IIа сначала подвергают взаимодействию с производным гидроксиимина VIIA с получением соответствующего производного бензилоксиимина формулы V, затем это соединениеV подвергают взаимодействию с соединением формулы VI, как описано выше, с получением соединения формулы I Далее соединения формулы I можно получать также и таким образом, что соединения формулы III переводят согласно описанному в ЕР-А 493 711 методу с помощью лактона XII сначала в соответствующую бензойную кислотуXIII и это соединение XIII посредством соответствующих галогенидов переводят в цианокарбоновые кислоты формулы XIV, которые реакцией Пиннера (см. Angew. Chem. 94, 1 (1982 переводят в -кетоэфиры формулы XV и, в случае необходимости, превращают далее в кетоамиды XVI (ср. ЕР-А 348 766, ЕР-А 280 185, ЕР-А 178 826, ЕР-А 253213, Houben-Weyl,4-е издание, том Е 5, стр. 941 и след.). Сложные -кетоэфиры формулы XV и кетоамиды формулы XVI могут быть переведены в соединения формулы I общеизвестными методами (см. ЕР-А 178 826, ЕР-А 513 580, ЕРА 253 213, ЕР-А 398 692). Соединения формулы I, в которых Q означает С(=NОСН 3)СОNНСН 3, могут быть получены из соответствующих сложных эфиров [Q = С(=NОСН 3)СООСН 3] путем взаимодействия с метиламином. Соединения формулы II известны (см. ЕРА 513 580, ЕР-А 477 631, ЕР-А 463 488, ЕР-А 251 082, ЕР-А 400 417, ЕР-А 585 751) или могут быть получены описанными в этих публикациях методами. Если некоторые из соединений формулы I не могут быть получены вышеприведенными методами, они могут быть получены путем дериватизирования других соединений формулы I. Реакционные смеси перерабатывают обычным образом, например смешением с водой, разделением фаз и, в случае необходимости, хроматографической очисткой сырого продукта. Промежуточные и конечные продукты получают, частично, в форме бесцветных или слегка коричневатых, вязких масел, которые под пониженным давлением и при умеренно повышенной температуре освобождаются или очищаются от летучих составных частей. Если промежуточные и конечные продукты получают в качестве твердых веществ, очистку можно производить также и перекристаллизацией или дигерированием. Соединения формулы I вследствие своих С=С и C=N двойных связей могут иметься в качестве смесей E/Z-изомеров, которые могут быть разделены на отдельные соединения обычными методами кристаллизации или хроматографии. Если при синтезе получают смеси изомеров, в общем разделение не обязательно требуется, так как отдельные изомеры частично во время переработки для применения или при применении (например, под воздействием света,кислот или оснований) могут превращаться друг в друга. 8 Соответствующее превращение может происходить также и после применения, например при обработке растений в обработанных растениях или в подлежащих уничтожению фитопатогенных грибах или вредителях. Относительно двойных связей С=С, соответственноC=N, в группе Q предпочтение отдается Еизомерам соединений I как наиболее эффективным (конфигурация по отношению к группе-ОСН 3-, соответственно, группе -СН 3- по сравнению с группой -СООСН 3, соответственно с группой -СОNНСН 3-). Относительно двойной связи -С(СН 3)=NОСН 2 предпочтительны по их эффективности цизизомеры соединений I (конфигурация относительно метиловой группы по сравнению с группой-ОСН 2-). Относительно двойной связи C=N-OR2 предпочтение отдается циз-изомерам соединений I как наиболее эффективным (конфигурация относительно группы R2O- по сравнению с цикогексильной группой). Особенно предпочтительными формами промежуточных продуктов что касается заместителей являются формамис остатками (R1)n, R2 и Q формулы I. При вышеприведенных соединениях I применяются сборные понятия, которые в общем относятся к следующим группам: галоген означает фтор, хлор, бром и йод; алкил означает разветвленные или неразветвленные алкильные группы с 1 до 4 углеводородных атомов, такие как метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2 метил-пропил или 1,1-диметилэтил; галогеналкил означает разветвленные или неразветвленные алкильные группы с 1 до 4 углеводородных атомов, причем в этих группах атомы водорода могут быть частично или полностью заменены вышеприведенным галогеном,например С 1-С 2 галогеналкил, такой как хлорметил, дихлорметил, трихлорметил, фторметил,дифторметил, трифторметил, хлорфторметил,дихлорфторметил,хлордифторметил,1 фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2 трифторэтил, 2-хлор-2-фторэтил, 2-хлор-2,2 дифторэтил,2,2-дихлор-2-фторэтил,2,2,2 трихлорэтил и пентафторэтил; алкокси означает приведенные выше, разветвленные или неразветвленные алкильные группы с 1 до 4 углеводородных атомов, связанные через атом кислорода (-O-) со скелетом,такие как метилокси, этилокси, пропилокси, 1 метилэтилокси, бутилокси, 1-метилпропилокси,2-метилпропилокси или 1,1-диметилэтилокси; галогеналкокси означает разветвленные или неразветвленные алкильные группы с 1 до 4 углеводородных атомов, причем в этих группах атомы водорода частично или полностью могут быть заменены вышеприведенными атомами галогена и причем эти группы через атом кислорода связаны со скелетом; 9 алкенил означает разветвленные или неразветвленные алкенильные группы с 3 до 6 углеводородными атомами и одной двойной связью в любом положении, такие как 1-пропенил, 2-пропенил, 1-метилэтенил, 1-бутенил, 2 бутенил, 3-бутенил, 1-метил-1-пропенил, 2 метил-1-пропенил,1-метил-2-пропенил,2 метил-2-пропенил, 1-пентенил, 2-пентенил, 3 пентенил, 4-пентенил, 1-метил-1-бутенил, 2 метил-1-бутенил, 3-метил-1-бутенил, 1-метил-2 бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил,1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил 3-бутенил, 1,1-диметил-2-пропенил, 1,2-диметил-1-пропенил, 1,2-диметил-2-пропенил, 1 этил-1-пропенил, 1-этил-2-пропенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-1-пентенил, 2-метил-1-пентенил,3-метил-1-пентенил, 4-метил-1-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-метил-2 пентенил, 4-метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил,4-метил-3-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4 пентенил, 1,1-диметил-2-бутенил, 1,1-диметил 3-бутенил, 1,2-диметил-1-бутенил, 1,2-диметил 2-бутенил, 1,2-диметил-3-бутенил, 1,3-диметил 1-бутенил, 1,3-диметил-2-бутенил, 1,3-диметил 3-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил 1-бутенил, 2,3-диметил-2-бутенил, 2,3-диметил 3-бутенил, 3,3-диметил-1-бутенил, 3,3-диметил 2-бутенил, 1-этил-1-бутенил, 1-этил-2-бутенил,1-этил-3-бутенил, 2-этил-1-бутенил, 2-этил-2 бутенил, 2-этил-3-бутенил, 1,1,2-триметил-2 пропенил, 1-этил-1-метил-2-пропенил, 1-этил-2 метил-1-пропенил и 1-этил-2-метил-2-пропенил; алкинил означает разветвленные или неразветвленные алкинильные группы с 3 до 6 углеродными атомами и с одной тройной связью в любом положении, такие как 2-пропинил,2-бутинил, 3-бутинил, 1-метил-2-пропинил, 2 пентинил, 3-пентинил, 4-пентинил, 1-метил-2 бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 1,1-диметил-2-пропинил, 1-этил-2-пропинил, 2-гексинил, 3-гексинил, 4-гексинил, 5-гексинил, 1-метил-2-пентинил, 1-метил-3-пентинил, 1-метил-4-пентинил, 2-метил-3-пентинил,2-метил-4-пентинил, 3-метил-4-пентинил, 4-метил-2-пентинил, 1,1-диметил-2-бутинил, 1,1 диметил-3-бутинил, 1,2-диметил-3-бутинил, 2,2 диметил-3-бутинил, 1-этил-2-бутинил, 1-этил-3 бутинил, 2-этил-3-бутинил и 1-этил-1-метил-2 пропинил. Определение частично или полностью означает то, что в таких группах атомы водорода частью или полностью могут быть заменены одинаковыми или различными атомами галогена, приведенного выше. С учетом из соответствующего назначению применения производные бисоксимового эфира формулы I особенно предпочтительны со следующим значением заместителей, а именно как по отдельности или в комбинации. 10 Особенно предпочтительны такие соединения формулы I, при которых остаток R1 находится в транс-положении относительно связи с циклогексильным кольцом. В частности, предпочтительны соединения формулы I, при которых остаток R1 означает С 1 С 4 алкил. Кроме того, предпочтительны соединенияI, при которых R1 означает C1-C4-алкокси. Далее предпочтительны соединения формулы I, при которых R1 означает галоген. И предпочтительны соединения формулыI, при которых индекс n равен 1. Наряду с этим предпочтительны соединения формулы I, при которых R2 означает C1-С 3 алкил, С 3-С 4 алкенил или С 3-С 4 алкинил. Особенно предпочтительны соединения формулы I, при которых R2 означает метил или пропаргил. Кроме того, особенно предпочтительны соединения формулы I.1 В одинаковой степени предпочтительны соединения формулы I.2. Особенно предпочтительны соединения формулы I.3. Далее особенно предпочтительны соединения формулы I.4. При учете их применения предпочтительны приведенные в таблицах соединения I. Указанные в таблицах для заместителей группы,независимо от комбинации, в которой они приведены, представляют собой предпочтительные формы выполнения соответствующих заместителей. Таблица 1. Соединения общей формулыI.1, при которых R2 означает метил и (R1)n соответствует соединению одной строки таблицы А. Таблица 2. Соединения общей формулыI.2, при которых R2 означает метил и (R1)n соответствует соединению одной строки таблицы А. Таблица 3. Соединения общей формулыI.3, при которых R2 означает метил и (R1)n соответствует соединению одной строки таблицы А.I.4, при которых R2 означает метил и (R1)n соответствует соединению одной строки таблицы А. Таблица 5. Соединения общей формулыI.1, при которых R2 означает этил и (R1)n соответствует соединению одной строки таблицы А. Таблица 6. Соединения общей формулыI.2, при которых R2 означает этил и (R1)n соответствует соединению одной строки таблицы А. Таблица 7. Соединения общей формулыI.3, при которых R2 означает этил и (R1)n соответствует соединению одной строки таблицы А. Таблица 8. Соединения общей формулыI.4, при которых R2 означает этил и (R1)n соответствует соединению одной строки таблицы А. Таблица 9. Соединения общей формулыI.1, при которых R2 означает н-пропил и (R1)n соответствует соединению одной строки таблицы А. Таблица 10. Соединения общей формулыI.2, при которых R2 означает н-пропил и (R1)n соответствует соединению одной строки таблицы А. Таблица 11. Соединения общей формулыI.3, при которых R2 означает н-пропил и (R1)n соответствует соединению одной строки таблицы А. Таблица 12. Соединения общей формулыI.4, при которых R2 означает н-пропил и (R1)n соответствует соединению одной строки таблицы А. Таблица 13. Соединения общей формулыI.1, при которых R2 означает изопропил и (R1)n соответствует соединению одной строки таблицы А. Таблица 14. Соединения общей формулыI.2, при которых R2 означает изопропил и (R1)n соответствует соединению одной строки таблицы А. Таблица 15. Соединения общей формулыI.3, при которых R2 означает изопропил и (R1)n соответствует соединению одной строки таблицы А. Таблица 16. Соединения общей формулыI.4, при которых R2 означает изопропил и (R1)n соответствует соединению одной строки таблицы А. Таблица 17. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 18. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 19. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 20. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 21. Соединения общей формулыI.1, при которых R2 означает 2,2,2-трифторэтил 1 и (R1)n соответствует соединению одной строки таблицы А. Таблица 22. Соединения общей формулыI.2, при которых R2 означает 2,2,2-трифторэтил 1 и (R1)n соответствует соединению одной строки таблицы А. Таблица 23. Соединения общей формулыI.3, при которых R2 означает 2,2,2-трифторэтил 1 и (R1)n соответствует соединению одной строки таблицы А. Таблица 24. Соединения общей формулыI.4, при которых R2 означает 2,2,2- трифторэтил 1 и (R1)n соответствует соединению одной строки таблицы А. Таблица 25. Соединения общей формулыI.1, при которых R2 означает пропаргил и (R1)n соответствует соединению одной строки таблицы А. Таблица 26. Соединения общей формулыI.2, при которых R2 означает пропаргил и (R1)n соответствует соединению одной строки таблицы А. Таблица 27. Соединения общей формулыI.3, при которых R2 означает пропаргил и (R1)n соответствует соединению одной строки таблицы А. Таблица 28. Соединения общей формулыI.4, при которых R2 означает пропаргил и (R1)n соответствует соединению одной строки таблицы А. Таблица 29. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 30. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 31. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 32. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 33. Соединения общей формулыI.1, при которых R2 означает аллил и (R1)n соответствует соединению одной строки таблицы А. Таблица 34. Соединения общей формулыI.2, при которых R2 означает аллил и (R1)n соответствует соединению одной строки таблицы А. Таблица 35. Соединения общей формулыI.3, при которых R2 означает аллил и (R1)n соответствует соединению одной строки таблицы А. Таблица 36. Соединения общей формулыI.4, при которых R2 означает аллил и (R1)n соответствует соединению одной строки таблицы А.I.1, при которых R2 означает 2-хлораллил и (R1)n соответствует соединению одной строки таблицы А. Таблица 38. Соединения общей формулыI.2, при которых R2 означает 2-хлораллил и (R1)n соответствует соединению одной строки таблицы А. Таблица 39. Соединения общей формулыI.3, при которых R2 означает 2-хлораллил и (R1)n соответствует соединению одной строки таблицы А. Таблица 40. Соединения общей формулыI.4, при которых R2 означает 2-хлораллил и (R1)n соответствует соединению одной строки таблицы А. Таблица 41. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 42. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 43. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 44. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 45. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 46. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 47. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 48. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 49. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 50. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 51. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица 52. Соединения общей формулы(R1)n соответствует соединению одной строки таблицы А. Таблица А Соединения I пригодны в качестве фунгицидов. Они отличаются прекрасной активностью против широкого спектра фитопатогенных грибов, в частности из класса аскомецетов, дейтеромицетов, фикомицетов и базидиомицетов. Они являются частично систематически активными и могут применяться при защите растений в качестве почвенных и лиственных фунгицидов. Они имеют особое значение при борьбе с рядом фитопатогенных грибов на различных культурных растениях, таких как пшеница,рожь, ячмень, овес, рис, кукуруза, злаки, бананы, хлопчатник, соевые, кофе, сахарный тростник, виноград, плодовые и декоративные растения, и на овощных культурах, таких как огурцы,бобовые, томаты, картофель и тыквенные, а также на семенах этих растений. Особенно они пригодны для борьбы против следующих болезней растений: виды Alternaria на овощных и плодовых растениях,Botrytis cinerea (серая гниль) на клубничных, овощных, декоративных культурах и на виноградных лозьях,Cercospora arachidicola на земляных орехах,Erysiphe cichoracearum и Sphaerotheca fuliginea на тыквенных,Erysiphe graminis (мучнистая роса) на зерновых культурах,виды Fusarium- и Verticillium на различных растениях,виды Helminthosporium на зерновых культурах,виды Mycosphaerella на бананах и земляных орехах, 16Phytophthora infestans на картофеле и томатах,Plasmopara viticola на виноградных лозах,Podosphaera leucotricha на яблоневых,Pseudocercosporella herpotrichoides на пшенице и ячмене,виды Pseudoperonospora на хмеле и огурцах,виды Puccinia на зерновых,Pyricularia oryzae на рисе,виды Rhizoctonia на хлопчатнике, рисе и дернине,Septoria nodorum на пшенице,Uncinula necator на виноградных лозьях,виды Ustilago на зерновых и сахарном тростнике, а также виды Venturia (парша) на яблоневых и грушах. Кроме того, соединения I пригодны для борьбы с вредоносными грибами, такими как(например, древесины, бумаги, дисперсий для покрытий, волокна, соответственно, тканей) и при защите складируемых запасов. Соединения I применяются таким образом,что грибы или подлежащие защите от поражения ими растения, материалы или почву обрабатывают фунгицидно активным количеством действующего вещества. Применение может осуществляться как перед, так и после поражения грибами материалов, растений или семян. Фунгицидные средства содержат в общем между 0,1 и 95, предпочтительно между 0,5 и 90 мас.% действующего вещества. Нормы расхода составляют при применении для защиты растений в зависимости от желаемого эффекта между 0,01 и 2,0 кг действующего вещества на гектар. При обработке посевного зерна в общем требуется количества действующего вещества от 0,001 до 0,1 г, предпочтительно от 0,01 до 0,05 г на кг семян. При применении для защиты материалов,соответственно складируемых запасов, норма расхода ориентируется на область применения и на желаемый эффект. Обычные нормы расхода при защите материалов составляют, например,от 0,001 г до 2 кг, предпочтительно от 0,005 г до 1 кг действующего вещества на кубометр обрабатываемого материала. Кроме того, соединения формулы I пригодны для эффективной борьбы против вредителей из класса насекомых, паукообразных и нематодов. Они могут применяться для защиты растений, а также в секторе гигиены, защиты запасов и ветеринарии для борьбы с вредителями. В частности они пригодны для борьбы со следующими вредителями: насекомые из рода чешуекрылых или бабочек (Lepidoptera), например Agrotis ypsilon,Agrotis segetum, Alabama argillacea, AnticarsiaAcheta domestica, Blatta orientalis, Blattella germanica, Forficula auricularia, Gryllotalpa gryllotalpa, Locusta migratoria, Melanoplus bivittatus,Melanoplus femur-rubrum, Melanoplus mexicanus,Melanoplus sanguinipes, Melanoplus spretus, Nomadacris septemfasciata, Periplaneta americana,Schistocerca americana, Schistocerca peregrina,Stauronotus maroccanus и Tachycines asynamorus,клещи, такие как паукообразные (Acarina),например Amblyomma americanum, Amblyommakanzawai, Tetranychus pacificus, Tetranychus telarius и Tetranychus urticae,нематоды, такие как корневые нематоды,например Meloidogyne hapla, Meloidogyne incognita, Meloidogyne javanica, образующие кисты нематоды, например Globodera rostochiensis,Heterodera avenae, Heterodera glycines, Heterodera schachtii, Heterodera trifolii, стеблевые и листьевые нематоды, например Belonolaimuscurvitatus и Pratylenchus goodeyi. Нормы расхода действующего вещества при борьбе с вредителями составляют в условиях открытого грунта от 0,1 до 2,0, предпочтительно от 0,2 до 1,0 кг/га. Соединения I могут быть переведены в обычные препаративные формы, например растворы, эмульсии, суспензии, тонкие порошки,порошки, пасты и гранулят. Препаративная форма зависит от цели применения, она должна в любом случае обеспечивать тонкое и равномерное распределение соединения, предлагаемого по изобретению. Препаративные формы получают известным образом, например путем разбавления действующего вещества в растворителях и/или наполнителях, по желанию с применением эмульгаторов или диспергаторов, причем при применении в качестве разбавителя воды также и другие органические растворители могут применяться в качестве вспомогательных агентов. В качестве вспомогательных агентов пригодны в основном: растворители, такие как ароматы (например, ксилол), хлорированные ароматы (например, хлорбензолы), парафины (например,фракции нефти), спирты (например, метанол,бутанол), кетоны (например, циклогексанон),амины (например, этаноламин, диметилформамид) и вода; наполнители, такие, как естественные измельченные породы (например, каолин, глинозем, тальк, мел) и искусственные измельченные породы (например, высокодисперсная кремниевая кислота, соли кремниевой кислоты); эмульгаторы, такие, как неионогенные и анионные эмульгаторы (например, полиоксиэтиленовый эфир спирта жирного ряда, алкилсульфонаты и арилсульфонаты) и диспергаторы,такие как лигнинсульфитная отработанная щелочь и метилцеллюлоза. В качестве поверхностно-активных веществ применяются соли щелочных, щелочноземельных металлов и аммониевые соли лигнинсульфокислоты, нафталинсульфокислоты,фенолсульфокислоты,дибутилнафталинсульфокислоты, алкиларилсульфонаты, алкил 003273 20 сульфаты, алкилсульфонаты, сульфаты спиртов жирного ряда, кислоты жирного ряда, а также их соли щелочных и щелочно-земельных металлов, соли сульфатированного гликолевого эфира жирного ряда, продукты конденсации сульфонированного нафталина и производных нафталина с формальдегидом, продукты конденсации нафталина, соответственно, нафталинсульфокислот с фенолом и формальдегидом, полиоксиэтиленоктилфенольный эфир,этоксилированный изооктилфенол, октилфенол, нонилфенол, алкилфенолполигликолевый эфир, трибутилфенилполигликолевый эфир, алкиларилполиэфирные спирты, изотридециловый спирт,продукты конденсации этиленоксида жирных спиртов, этоксилированное касторовое масло,полиоксиэтиленалкиловый эфир, этоксилированный полиоксипропилен, ацеталь полигликолевого эфира лаурилового спирта жирного ряда,сложный эфир сорбита, лигнинсульфитные отработанные щелочи и метилцеллюлоза. Для получения предназначенных для непосредственного распыления растворов, эмульсий,паст или маслянных дисперсий применяются фракции минеральных масел со средней и высокой точками кипения, такие, как керосин или дизельное топливо (масло), дегтярные масла растительного или животного происхождения,алифатические, циклические и ароматические углеводороды, например, бензол, толуол, ксилол, парафин, тетрагидронафталин, алкилированные нафталины или их производные, метанол, этанол, пропанол, бутанол, хлороформ,тетрахлоруглерод, циклогексанол, циклогексанон, хлорбензол, изоформ, сильно полярные растворители, например диметилформамид,диэтилсульфоксид, N-метилпирролидон, вода. Порошковые препараты, препараты для опыливания и опудривания могут быть изготовлены путем смешения или совместного промеливания действующих веществ с твердым наполнителем. Гранулят, например оболочковый, импрегнированный или гомогенный гранулят может быть получен путем связывания действующего вещества с твердыми наполнителями. Твердыми наполнителями могут быть, например, минеральные земли, такие как силикагель, кремниевые кислоты, силикаты, тальк, каолин, аттаклау,известняк, известь, мел, болюс, лесс, глина, доломит, диатомовоя земля, сульфат кальция и магния, окись магния, измельченная пластмасса,удобрения, такие как сульфат аммония, фосфат аммония, нитрат аммония, мочевины и растительные продукты, такие как зерновая мука,мука древесной коры, древесная мука и мука ореховой скорлупы, порошок целлюлозы и другие твердые наполнители. Препаративные формы содержат в общем между 0,01 и 95 мас.%, предпочтительно между 0,1 и 90 мас.% действующего вещества. Действующие вещества имеют при этом чистоту от 90I. 5 вес. долей соединения согласно изобретению хорошо перемешивают с 95 вес. долями тонкого коалина. Таким образом получают средство опыливания, содержащее 5 мас.% действующего вещества;II. 30 вес. долей соединения согласно изобретению хорошо перемешивают с 92 вес. долями порошкового силикагеля и 8 вес. долями парафинового масла, которое напрыскивают на поверхность этого силикагеля. Таким образом получают препаративную форму действующего вещества с хорошей адгезионной способностьюIII. 10 вес. долей соединения согласно изобретению растворяют в смеси, которая состоит из 90 вес. долей ксилола, 6 вес. долей продукта присоединения 8-10 молей этиленоксида к 1 молю N-моноэтаноламида олеиновой кислоты, 2 вес. доли кальциевой соли додецилбензолсульфокислоты и 2 вес. доли продукта присоединения 40 молей этиленоксида к 1 молю касторового масла (содержание действующего вещества 9 мас.%);IV. 20 вес. долей соединения согласно изобретению растворяют в смеси, которая состоит из 60 вес. долей циклогексанона, 30 вес. долей изобутанола, 5 вес. долей продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 5 вес. долей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла (содержание действующего вещества 16 мас.%);V. 80 вес. долей соединения согласно изобретению хорошо перемешивают с 3 вес. долями натриевой соли диизобутилнафталин-альфасульфокислоты, 10 вес. долями натриевой соли лигнинсульфокислоты из сульфитного отработанного щелока и 7 вес. долями порошкового силикагеля и перемалывают в молотковой мельнице (содержание действующего вещества 80 мас.%);VI. перемешивают 90 вес. долей соединения согласно изобретению с 10 вес. долями Nметилпирролидона и получают раствор, который пригоден для применения в форме мельчайших капель (содержание действующего вещества 90 мас.%);VII. 20 вес. долей соединения согласно изобретению растворяют в смеси, состоящей из 40 вес. долей циклогексанона, 30 вес. долей изобутанола, 20 вес. долей продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 10 вес. долей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. Путем концентрации и тонкого распределения раствора в 100 000 вес. долей воды получают водную дисперсию, содержащую 0,02 вес.% действующего вещества;VIII. 20 вес. долей соединения согласно изобретению хорошо перемешивают с 3 вес. долями натриевой соли диизобутилнафталин-сульфокислоты, 17 вес. долями натриевой соли лигнинсульфокислоты из сульфитного отработанного щелока и 60 вес. долями порошкового силикагеля и перемалывают в молотковой мельнице. Путем тонкого распределения смеси в 20000 вес. долях воды получают раствор для опрыскивания, который содержит 0,1 мас.% действующего вещества. Действующие вещества могут применяться как таковые, в их препаративной форме или же в приготовленной форме применения, например в форме подлежащих непосредственному распылению растворов, порошков, суспензий или дисперсий, эмульсий, маслянных дисперсий,паст, препаратов для опыливания, препаратов для опудривания, гранулятов путем опрыскивания, мелкокапельного опрыскивания, опыливания, опудривания или полива. Используемые формы зависят от цели применения, но во всех случаях должно быть обеспечено максимально тонкое распределение действующих веществ по изобретению. Водные препаративные формы могут быть приготовлены из концентратов эмульсий, паст или смачиваемых порошков (порошки для разбрызгивания, маслянные дисперсии) путем добавки воды. Для изготовления эмульсий, паст или маслянных дисперсий вещества как таковые, или же растворенные в масле, могут гомогенизироваться в воде с помощью смачивающих агентов, активаторов адгезии, диспергаторов или эмульгаторов. Могут также приготовляться состоящие из действующего вещества, смачивающего агента, активатора адгезии, диспергатора или эмульгатора и, возможно, из растворителя и масла концентраты, которые можно разбавлять водой. Концентрация действующего вещества в готовых к применению препаратах может варьироваться в широких пределах. В общем она составляет от 0,0001 до 10%, предпочтительно от 0,01 до 1%. Действующие вещества могут применяться с успехом при особенно низких нормах расхода,причем имеется возможность использовать препараты с более чем 95 мас.% действующего вещества или даже применять действующее вещество без добавок. К действующим веществам могут добавляться масла различного типа, гербициды, фунгициды, другие средства борьбы с вредителями,бактерициды, в случае необходимости, также и непосредственно перед применением (смеси в баке). Эти средства могут примешиваться к соединениям по изобретению в весовом соотношении 1:10 до 10:1. Соединения по изобретению в форме применения как фунгициды могут применяться вместе с другими действующими веществами, 23 например гербицидами, инсектицидами, регуляторами роста, фунгицидами или же удобрениями. При смешении соединений I, соответственно содержащих их фунгицидных средств с другими фунгицидами во многих случаях обеспечивается увеличение спектра фунгицидного действия. Нижеприведенный перечень фунгицидов,которые можно применять вместе с соединениями по изобретению, поясняет возможности их комбинирования, однако не ограничивает их. К таким фунгицидам относятся следующие: сера, дитиокарбонаты и их производные,такие как ферридиметилдитиокарбамат, цинкдиметилдитиокарбамат, марганецэтиленбисдитиокарбамат, марганеццинкэтилендиаминбисдитиокарбамат, тетраметилтиурамдисульфиды,аммиачный комплекс цинк(N,N-этиленбисдитиокарбамата), аммиачный комплекс цинк(N,N'пропиленбисдитиокарбамата), полимер цинк(N,N'-пропиленбисдитиокарбамата), N,N'-пропиленбис(тиокарбомоил)дисульфид; нитропроизводные, такие как динитро(1 метилгептил)фенилкротонат, 2-втор.-бутил-4,6 динитрофенил-3,3-диметилакрилат,2-втор.бутил-4,6-динитрофенил-изопропилкарбонат,диизопропиловый эфир 5-нитроизофталевой кислоты; гетероциклические соединения, такие как 2-гептадецил-2-имидазолинацетат, 2,4-дихлор 6-(о-хлоранилино)-s-триазин, O,O-диэтилфталимидофосфонотиоат, 5-амино-1-[бис-(диметиламино)фосфинил]-3-фенил-1,2,4-триазол,2,3 дициано-1,4-дитиоантрахинон, 2-тио-1,3-дитиоло[4,5-b]хиноксалин, метиловый эфир 1(бутилкарбамоил)-2-бензимидазолкарбаминовой кислоты, 2-метоксикарбониламинобензимидазол, 2-(фурил-(2-бензимидазол, 2-(тиазолил(4-бензимидазол, N-(1,1,2,2-тетерахлорэтилтио)тетрагидрофталимид, N-трихлорметилтиотетрагидрофталимид, N-трихлорметилтиофталимид, диамид N-дихлорфторметилтио-N',N'диметил-N-фенилсерной кислоты, 5-этокси-3 трихлор-метил-1,2,3-тиадиазол, 2-роданметилтиобензтиазол, 1,4-дихлор-2,5-диметоксибензол, 4-(2 хлорфенилгидразоно)-3-метил-5-изоксазолон, пиридин-2-тио-1-оксид, 8-гидроксихинолин, соответственно его медная соль, 2,3-дигидро-5 карбоксанилидо-6-метил-1,4-оксатиин, 2,3-дигидро-5-карбоксанилидо-6-метил-1,4-оксатиин-4,4 диоксид, анилид 2-метил-5,6-дигидро-4 Н-пиран-3 карбоновой кислоты, анилид 2-метилфуран-3 карбоновой кислоты, анилид 2,5-диметилфуран-3 карбоновой кислоты, анилид 2,4,5-триметилфуран-3-карбоновой кислоты, циклогексиламид 2,5-диметилфуран-3-карбоновой кислоты,амид N-циклогексил-N-метокси-2,5-диметилфуран-3-карбоновой кислоты, 2-анилид метилбензойной кислоты, анилид 2-йодбензойной кислоты,N-формил-N-морфолин-2,2,2-трихлорэтилацеталь,пиперазин-1,4-диилбис-1-(2,2,2 трихлорэтил)формамид, 1-(3,4-дихлоранилино)-1 003273 24 формиламино-2,2,2-трихлорэтан, 2,6-диметил-Nтридецилморфолин, соответственно его соли, 2,6 диметил-N-циклододецилморфолин,соответственно его соли, N-[3-(п-трет.-бутил-фенил)-2 метилпропил]-цис-2,6-диметилморфолин, N-[3-(птрет.-бутилфенил)-2-метилпропил] пиперидин, 1[2-(2,4-дихлорфенил)-4-этил-1,3-диоксолан-2-илэтил]-1 Н-1,2,4-триазол, 1-[2-(2,4-дихлорфенил)-4 н-пропил-1,3-диоксолан-2-илэтил]-1 Н-1,2,4-триазол,N-(н-пропил)-N-(2,4,6-трихлорфеноксиэтил)-N'-имидазолилмочевина, 1-(4-хлорфенокси)3,3-диметил-1-(1 Н-1,2,4-триазол-1-ил)-2-бутанон,1-(4-хлорфенокси)-3,3-диметил-1-(1 Н-1,2,4-триазол-1-ил)-2-бутанол,(2RS,3RS)-1-[3-(2-хлорфенил)-2-(4-фторфенил)-оксиран-2-илметил]-1 Н 1,2,4-триазол, -(2-хлорфенил)(4-хлорфенил)5-пиримидинметанол, 5-бутил-2-диметиламино-4 гидрокси-6-метилпиримидин, бис-(п-хлорфенил)3-пиридинметанол, 1,2-бис-(3-этоксикарбонил-2 тиоуреидо)бензол, 1,2-бис-(3-метоксикарбонил-2 тиоуреидо)бензол,стробилурины, такие как метил-Е-метоксиимино-[-(о-толилокси)-о-толил]ацетат, метилЕ-2-2-[6-(2-цианофенокси)пиримидин-4-илокси]фенил-3-метоксиакрилат, метил-Е-метоксиимино-[-(2-феноксифенил)]ацетамид, метил-Еметоксиимино-[-(2,5-диметилфенокси)-о-толил]ацетамид,анилинопиримидины, такие как N-(4,6-диметилпиримидин-2-ил)анилин, N-[4-метил-6-(1 пропинил)пиримидин-2-ил]анилин, N-[4-метил 6-циклопропилпиримидин-2-ил]анилин,фенилпирролы, такие как 4-(2,2-дифтор 1,3-бензодиоксол-4-ил)пиррол-3-карбонитрил,амиды коричной кислоты, такие как морфолид 3-(4-хлорфенил)-3-(3,4-диметоксифенил) акриловой кислоты,а также различные фунгициды, такие, как додецилнуанидинацетат, 3-[3-(3,5-диметил-2-оксициклогексил)-2-гидроксиэтил]глютаримид, гексахлорбензол, DL-метил-N-(2,6-диметилфенил)-Nфуроил(2)аланинат, метиловый эфир DL-N-(2,6 диметилфенил)-N-(2'-метоксиацетил)аланина, N(2,6-диметилфенил)-N-хлорацетил-D,L-2-аминобутиролактон, метиловый эфир DL-N-(2,6-диметилфенил)-N-(фенилацетил)аланина, 5-метил-5 винил-3-(3,5-дихлорфенил)-2,4-диоксо-1,3-оксазолидин, 3-[3,5-дихлорфенил(-5-метил-5-метоксиметил]-1,3-оксазолидин-2,4-дион, 3-(3,5-дихлорфенил)-1-изопропилкарбамоилгидантоин, имид N(3,5-дихлорфенил)-1,2-диметилциклопропан-1,2 дикарбоновой кислоты, 2-циано-[N-(этиламинокарбонил)-2-метоксимино]ацетамид,1-[2-(2,4 дихлорфенил)пентил]-1 Н-1,2,4-триазол,2,4-дифтор(1 Н-1,2,4-триазолил-1-метил)бензгидриловый спирт, N-(3-хлор-2,6-динитро-4-трифторметилфенил)-5-трифторметил-3-хлор-2-аминопиридин, 1-бис-(4-фторфенил)-метилсилил)метил)1 Н-1,2,4-триазол. 25 Примеры синтеза Приведенные в нижестоящих примерах синтеза стадии применяют при соответствующих изменениях исходных соединений для получения других соединений формулы I. Полученные таким образом соединения приведены в нижестоящей таблице вместе их физическими данными. Пример 1. Получение 1-(4-метилциклогексил)пропанола-1. 180 мл (0,36 моль) 2 М раствора этилмагнийхлорида в тетрагидрофуране после смешения с раствором из 37,8 г (0,3 моль) 4-метилциклогексанкарбальдегида (цис/транс) в 70 мл тетрагидрофурана под защитной газовой атмосферой перемешивают в течение 16 ч при 2025 С. После добавки 250 мл 15 вес.% раствора хлорид аммония реакционную смесь подкисляют полуконцентрированной соляной кислотой,потом экстрагируют с помощью метил-трет.бутилового эфира. Из собранных органических фаз после промывки водой и сушки получают 44 г 1-(4-метилциклогексил)пропанола-1 в виде бесцветного масла. После хроматографического анализа 1H-ЯМР соотношение цис- и транс-изомеров в смеси составляет приблизтельно 35:65. ИК (пленка): 3371, 2946, 2921, 2867, 1455,1448, 1376, 1067, 1043, 946 см-1. Пример 2. Получение (4-метилциклогексил)этилкетона. Раствор из 44 г (0,3 моль) спирта из примера 1 в 200 мл метил-трет.-бутилового эфира при максимально 20 С смешивают с раствором из 42,9 г Na2Cr2O72H2O в 210 мл воды и 35 мл концентрированной H2SO4. После перемешивания в течение 16 ч при 20-25 С разделяют фазы,водную фазу экстрагируют метил-трет.бутиловым эфиром. Собранные органические фазы после промывки водой и сушки дистиллируют. Получают 34,3 г (4-метилциклогексил) этилкетона в виде бесцветного масла с Кр.50 в 114-116 С. По анализу 13 С-НМР соотношение цис- и транс-изомеров в смеси составляет приблизительно 30:70. ИК (пленка): 2926, 2868, 1709, 1457, 1413,1377, 1348, 1148, 1109, 952 см-1. Пример 3. Получение (Е)-1-(4-метилциклогексил)-1-оксопропан-2-оксима. Раствор из 34 г (0,22 моль) кетона из примера 2 в 195 мл толуола смешивают при -20 С с 73 мл насыщенного эфирного раствора HCl,потом с раствором из 26 г (0,25 моль) нбутилнитрита в 65 мл диэтилэфира. После перемешивания в течение 2 ч при 0 С и приблизительно 16 ч при 20-25 С реакционную смесь выливают на ледяную воду и экстрагируют ме 003273 26 тил-трет.-бутиловым эфиром. Органичускую фазу экстрагируют 5%-ным натровым щелоком,щелочную водную фазу подкисляют разбавленной соляной кислотой, потом экстрагируют метил-трет.-бутиловым эфиром. Органическую фазу промывают и сушат. После отгонки растворителя и перекристаллизации из н-гексана получают 19,2 г целевого соединения в виде бежевых кристаллов. По анализу 1H-ЯМР соединения имелись в качестве транс-изомера. ИК (KВr): 3320, 2951, 2945, 2935, 2919,1663, 1449, 1368, 1008 см-1. Пример 4. Получение (Е,Е)-1-(4-метилциклогексил)-2-гидроксиимино-пропан-1-Oметилоксима. Смесь из 18,3 г (0,1 моль) оксима из примера 3, 24 г пиридина и 12,5 г (0,15 моль) Oметилгидроксиламингидрохлорида в 200 мл метанола после перемешивания в течение 16 ч при 20-25 С выливают на воду, подкисляют разбавленной соляной кислотой и экстрагируют метил-трет.-бутиловым эфиром. От органической фазы после ее промывки и сушки отделяют растворитель. Раствор остатка в 300 мл толуола смешивают с 4,1 г AlCl3 и перемешивают в течение 8 ч при 60 С, потом еще 16 ч при 20-25 С. После отгонки растворителя остаток загружают в метиленхлорид. Органическую фазу после промывки 5%-ной соляной кислотой и водой сушат, потом удаляют растворитель. После хроматографии на силикагеле (циклогексан/ метил-трет.-бутиловый эфир 20:1) получают 9,7 г целевого продукта в виде масла цвета охры. По анализу 1H-ЯМР соединено имеется в качестве транс-изомера. ИК (пленка): 2948, 2926, 2868, 2845, 1451,1057, 1006, 976, 909, 865 см-1. Пример 5. Получение соединения I-1. Раствор из 2,12 г (10 ммоль) бисоксима из примера 4 и 2,86 г (10 ммоль) 2-транс-Oметилоксима сложного метилового эфира бромметилфенилглиоксиловой кислоты [см заявку ЕР-А 254 426] в 30 мл N,N-диметилформамида смешивают с 1,98 г 30%-ного раствора метанольного раствора метилата натрия и перемешивают в течение приблизительно 16 ч при 2025 С. Реакционную смесь выливают на ледяную воду, потом экстрагируют метилен-трет.бутиловым эфиром. Органическую фазу отделяют от растворителя промыванием в воде и сушкой. После хроматографии на силикагеле Раствор из 2,3 г (5,5 ммоль) соединения I-1 из примера 5 в 30 мл тетрагидрофурана смешивают с 4,3 г 40%-ного раствора метиламина и перемешивают в течение 3 ч при 45 С и приблизительно 16 ч при 20-25 С. После отгонки растворителя остаток загружают в метил-трет.бутиловый эфир, раствор промывают водой и сушат. После отгонки растворителя получают 2,1 г целевого продукта в виде бесцветных кристаллов. По анализу 1H-ЯМР соединение имеется в качестве транс-изомера. Таблица 1-1 Примеры эффективности против фитопатогенных грибов Фунгицидную активность соединения общей формулы I можно показать с помощью следующих опытов. 28 Действующие вещества подготавливались отдельно или совместно в виде 10%-ной эмульсии в смеси из 70 мас.% циклогексанона, 20 мас.% Nekanil LN (Lutensol AP6, смачивающее средство с эмульгирующим и диспергирующим действием на базе этоксилированных алкилфенолей) и 10 мас.% Wettol ЕМ (неионогенного эмульгатора на базе этоксилированного касторового масла) и разбавляли водой в соответствие с желаемой концентрацией. В качестве сравнительных веществ служат известные из WO-A 97/05103 под номером А.2 таблицы 41, 42, 43 и 44 соединения А, Б, В и Г: Пример 1. Действие против Botrytis cinerea на листьях стручкового перца. Ростки стручкового перца сорта "Neusiedler Ideal Elite" после хорошего развития 4-5 листьев опрыскивают до образования капель водной композицией действующего вещества,состоящей из основного раствора из 10% действующего вещества, 63% циклогексанона и 27% эмульгатора. На следующий день обработанные растения инокулируют суспензией спор Botrytiscinerea, содержащей 1,7 х 106 спор/мл в 2%-ном водном биосолодовом растворе. После этого опытные растения помещают в камеру при 22 до 24 С и с высокой влажностью воздуха. Через 5 дней визуально определяют в процентах степень поражения грибами листьев. Этот опыт показал, что обработанные посредством 250 част./млн. действующего вещества I-1,I-2,I-3, соответственно I-4 растения имели поражение от 0 до 25%, в то время как обработанные посредством 250 част./млн. сравнительного действующего вещества А, Б, В соответственно Г растения имели поражение от 60 до 90% и необработанные растения имели также поражение на 90%. Пример 2. Действие против Puccinia recondita на пшенице (ржавчина пшеницы). Листья выращенных в горшках ростков пшеницы сорта Kazler опыливали спорами ржавчины (Puccinia recondita). После этого горшки помещали на 24 ч в камеру с высокой 29 влажностью воздуха (от 90 до 95%) и с температурой от 20 до 22 С. В течение этого времени споры проростали и спороцисты проникали в ткань листьев. На следующий день инфицированные растения обильно до образования капель опрыскивали водной композицией действующего вещества, приготовленной из исходного раствора, содержащего 10% действующего вещества, 63% циклогексанона и 27% эмульгатора. После подсыхания напрысканного слоя опытные растения культивировали в течение 7 дней в теплице с температурой между 20 и 22 С и с влажностью воздуха от 65 до 70%. После этого определяли степень развития грибов на листьях. Обработанные в этом опыте 1 част./млн. соединений I-2, I-3, I-7, соответственно I-10 растения были поражены максимально на 5%, в то время как обработанные 1 част /млн. сравнительного соединения А, соответственно Б растения и необработанные растения имели поражение в 90%. Пример 3. Действие против Plasmoparaviticola. Листья выращенных в горшках виноградных лоз сорта "MIIer-Thurgau" обильно до образования капель опрыскивают композицией действующего вещества, приготовленной из исходного раствора, содержащего 10% действующего вещества, 63% циклогексанона и 27% эмульгатора. Для оценки длительного действия композиции растения после подсыхания опрысканного слоя помещали на 7 дней в теплицу. Только после этого листья инокулировали водной суспензией спор Plasmopara viticola. Затем опытные растения выдерживали сначала 48 ч в камере с насыщенным паром при 24 С и потом 5 дней в теплице при температуре между 20 и 30 С. По истечении этого времени для ускорения действия опытные растения снова помещали во влажную камеру на 16 ч. Потом визуально оценивали степень развития поражения на нижней стороне листьев. В этом опыте обработанные 16 част./млн. соединения I-2, соответственно I-10 растения были поражены максимально на 3%, в то время как обработанные 16 част./млн. сравнительными соединениями А и Б растения имели поражение в 60 и необработанные растения имели поражение в 85%. Примеры действия против вредителей Действие соединений общей формулы I против вредителей можно показать на следующих опытах. Действующие вещества были подготовлены а) в качестве 0,1%-ного раствора в ацетоне или б) в качестве 10%-ной эмульсии в смеси из 70 мас.% циклогексанона, 20 мас.% Nekanil LN(Lutensol AP6, смачивающий агент с эмульгирующим и диспергирующим действием на базе этоксилированных алкилфенолов) и 10 мас.% 30 этоксилированного касторового масла) и разбавлены в соответствие с желаемой концентрацией ацетоном в случае а, соответственно водой, в случае б. После окончания опытов определяли самую низкую концентрацию, при которой соединения по сравнению с необработанными контрольными опытами вызывали еще 80-100%-ное ингибирование, соответственно смертность (порог действия, соответственно минимальная концентрация). Также и здесь в качестве сравнительных веществ служат известные из WO-А 97/05103 под номеромА.2 таблицы 41, 42, 43 и 44 соединения А, Б, В и Г. Пример 1. Действие против Aphis fabae(черная тля), контактное действие. Сильно пораженные пучковые бобы (Viciafaba) на стадии развития четвертого листа обрабатывают водной композицией действующего вещества. Через 24 ч определяют степень смертности. В этом опыте действующие вещества I-1 иI-4 имеют порог действия от 80 до 100 част./млн., в то время как сравнительные действующие вещества А и Г имеют порог действия при более чем 100 част./млн. Пример 2. Действие против Prodenia litura(египетский червь хлопчатника), контактное действие и действие поедания. На обработанный водной композицией действующего вещества фильтр круглой формы(диаметром 9 см) помещают пять гусениц (червей). Дополнительно кладут два погруженных в раствор действующего вещества кусочка листа кукурузы. Первую оценку проводят через 4 ч. Если еще жива, по крайней мере, одна гусеница,дают кормовую смесь. Через 24 ч определеют степень смертности. При этом опыте действующие вещества отI-1 до I-7 и I-10, I-3 имеют порог действия от 0,04 до 0,2 част./млн., в то время как сравнительные действующие вещества А, Б и В имеют порог действия от более 0,2 част./млн. Пример 3. Действие против Nephotettixcincticeps (зеленые рисовые саговники), контактное действие. Круглые фильтры (диаметром 9 см) обрабатывали посредством 1 мл водной композиции действующих веществ и после этого клали на них по пять выросших саговников. Через 24 ч определяли степень смертности. В этом опыте действующие вещества I-3 иI-4 проявили порог действия в 0,04 млг, в то время как сравнительные действующие вещества А и В имели значение порога действия более 0,2 млг. Пример 4. Действие против Nephotettix(высотой приблизительно 8 см) опрыскивают водной композицией действующего вещества. После подсыхания растения покрывают 20 выросшими саговниками. Через 24 ч определяют степень смертности. При этом опыте действующие вещества I-3 и I-4 имеют порог действия от 20 до 40 част./млн., в то время как сравнительные действующие вещества А и Б имеют порог действия 400 част./млн. Пример 5. Действие против Tetranychustelarius (syn. urticae) (красный паук). Выросшие в горшках бобы, имеющие стадию второй пары листьев, опрыскивают до образования капель водной композицией действующего вещества. Растения имеют сильное поражение выросшими клещами и сильное отложение яиц. Через 15 дней пребывания в теплице определяют поражение с помощью бинокуляра. При этом опыте действующие вещества I-1 и I-3 до I-6 имеют порог действия от 20 до 40 част./млн., в то время как сравнительные действующие вещества А, Б и В имеют порог действия 100 част./млн. с получением соединения формулы V и после этого соединение формулы V подвергают взаимодействию с соединением формулы VI(VI),R2-L2 2 где L означает нуклеофильно замещаемую уходящую группу, с получением соединения I. 4. Способ получения соединений формулыI по п.1, отличающийся тем, что производное бензила формулы II по п.2 подвергают взаимодействию с карбонилгидроксиимином формулы с получением соединения формулы VIII где заместители имеют следующие значения:R2 означает С 1-С 4 алкил, С 3-С 6 алкенил или С 3-С 6 алкинил, причем эти группы могут быть частично или полностью галогенированы;Q означает группировки С(=СНОСН 3)СООСН 3, С(=СНСН 3)-СООСН 3, С(=NОСН 3)СООСН 3 или С(=NОСН 3)-СОNНСН 3; а также их соли. 2. Способ получения соединений формулыI по п.1, отличающийся тем, что производное бензила формулы II где L1 означает нуклеофильно замещаемую уходящую группу, подвергают взаимодействию с гидроксиимином формулы III 3. Способ получения соединений формулыI по п.1, отличающийся тем, что производное бензила формулы II по п.2 подвергают взаимодействию с дигидроксиимином формулы IV после чего соединение формулы VIII подвергают взаимодействиюa) сначала с гидроксиламином или его солью и потом с соединением формулы VI (R2-L2) по п.3 илиb) с гидроксиламином или солью гидроксиламмония формулы IХа, соответственно IХb,где означает анион кислоты. 5. Средство против вредителей или фитопатогенных грибов, содержащее обычные наполнители и эффективное количество соединения формулы I по п.1. 6. Средство по п.5 для борьбы с вредителями из класса насекомых, паукообразных или нематодов. 7. Способ борьбы с вредителями или фитопатогенными грибами, отличающийся тем, что вредители или фитопатогенные грибы, их среду обитания и произрастания или подлежащие защите от них растения, поверхности, материалы или помещения обрабатывают эффективным количеством соединения формулы I по п.1. 8. Применение соединения формулы I по п.1 для получения средств против вредителей или фитопатогенных грибов. 9. Соединения формулы III по п.2. 10. Соединения формулы IV по п.3. 11. Соединения формулы VII по п.4. 12. Соединения формулы VIIA в качестве промежуточного продукта для синтеза соединений формулы I по п.1 в которой заместители имеют приведенные в п.1 значения. 13. Соединения формулы VIII по п.4. 14. Соединения формулы Х в качестве промежуточного продукта для синтеза соединения формулы I по п.1 где заместители имеют приведенные в п.1 значения. 15. Соединения формулы XI в качестве промежуточного продукта для синтеза соединений формулы I по п.1 где заместители имею приведенные в п.1 значения. 16. Соединения формулы XIII в качестве промежуточного продукта для синтеза соединений формулы I по п.1 34 где заместители имею приведенные в п.1 значения. 17. Соединения формулы XV в качестве промежуточного продукта для синтеза соединений формулы I по п.1 где заместители имеют приведенные в п.1 значения. 18. Соединения формулы XVI в качестве промежуточного продукта для синтеза соединений формулы I по п.1 где заместители имеют приведенные в п.1 значения. 19. Применение соединений по пп.9-18 в качестве промежуточных продуктов для синтеза соединений формулы I по п.1.
МПК / Метки
МПК: C07C 251/52, A01N 35/10
Метки: применение, грибами, производные, получения, способ, фитопатогенными, продукты, эфира, вредителями, промежуточные, борьбы, бисоксимового
Код ссылки
<a href="https://eas.patents.su/18-3273-proizvodnye-bisoksimovogo-efira-sposob-i-promezhutochnye-produkty-dlya-ih-polucheniya-i-ih-primenenie-dlya-borby-s-fitopatogennymi-gribami-i-vreditelyami.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бисоксимового эфира, способ и промежуточные продукты для их получения и их применение для борьбы с фитопатогенными грибами и вредителями</a>
Предыдущий патент: Производные дигидро- и тетрагидрохинолина, способ их получения и содержащие их фармацевтические составы
Следующий патент: Оксазолидиноны в качестве активного вещества при лечении инфекционных глазных болезней
Случайный патент: Твердая лекарственная форма, обладающая нейропротекторной, антиамнестической, антиоксидантной, противогипоксической, противоишемической активностью (варианты)












