Производные замещенного бензолсульфонамида-пролекарства ингибиторов сох-2.
Номер патента: 3319
Опубликовано: 24.04.2003
Авторы: Роджир Дональд Дж., Толли Джон Дж., Нагараджан Сринивасан, Ксу Ксиангдонг, Ли Джинглин, Пеннинг Томас Д., Малеча Джеймс В., Кханна Иш К., Грането Метью Дж., Бертеншоу Стефен, Браун Дэвид Л., Вейер Ричард М., Картер Джеффери С.
Формула / Реферат
1. Соединение формулы I
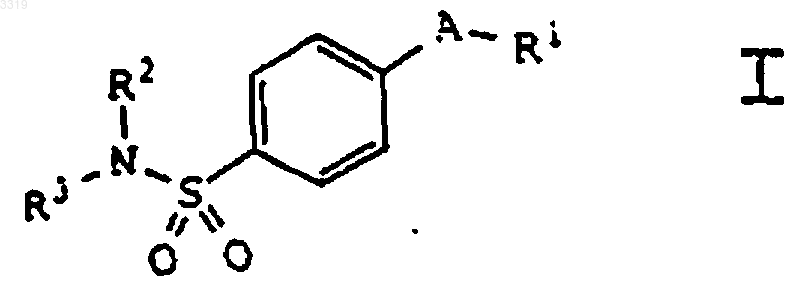
где A представляет заместитель в кольце, выбранный из C4-C8циклоалкенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где A необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C20алкила, гало-C1-C20алкила, гидрокси-C1-C20алкила, C1-C20алкилкарбонилокси-C1-C20алкила и оксогруппы;
где R1 представляет радикал, выбранный из пиридила и фенила;
где R1 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C20алкила, галогена и C1-C10алкокси;
где R2 представляет водород;
и где R3 представляет радикал, выбранный из C1-C20алкила, ацила, карбокси-C1-C20алкила, карбокси-C1-C20алкилкарбонила, C1-C10алкоксикарбонила, C1-C10алкокси-C1-C20алкилкарбонила, C1-C10алкоксикарбонил-C1-C20-алкилкарбонила, C1-C10алкоксикарбонилкарбонила, амино-C1-C20алкилкарбонила и C1-C20алкилкарбониламино-C1-C20алкилкарбонила;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором A представляет заместитель в кольце, выбранный из циклопентенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где A необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C10алкила, гало-C1-C6алкила, C1-C6-гидроксиалкила, C1-C10алкилкарбонилокси-C1-C10алкила и оксогруппы;
где R1 представляет радикал, выбранный из пиридила и фенила; где R1 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C10алкила, галогена и C1-C6алкокси; где R2 представляет водород и где R3 представляет радикал, выбранный из C1-C10алкила, C1-C10алкилкарбонила, бензоила, формила, карбокси-C1-C10алкила, карбокси-C1-C10алкилкарбонила, C1-C6алкоксикарбонила, C1-C6алкокси-C1-C10алкилкарбонила, C1-C6алкоксикарбонил-C1-C10алкилкарбонила, C1-C6алкоксикарбонилкарбонила, амино-C1-C10алкилкарбонила и C1-C10алкилкарбониламино-C1-C10-алкилкарбонила;
или его фармацевтически приемлемая соль.
3. Соединение по п.2, в котором A представляет собой заместитель в кольце, выбранный из циклопентенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где A необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из метила, трифторметила, дифторметила, гидроксиметила, ацетоксиметила и оксогруппы;
где R1 представляет радикал, выбиранный из пиридила и фенила;
где R1 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из метила, фтора, хлора и метокси;
где R2 представляет водород; и
где R3 представляет радикал, выбранный из метила, метилкарбонила, этилкарбонила, пропилкарбонила, изопропилкарбонила, бутилкарбонила, трет-бутилкарбонила, пентилкарбонила, бензоила, формила, карбоксиметила, карбоксиэтилкарбонила, метоксикарбонила, трет-бутоксикарбонила, метоксиметилкарбонила, метоксиэтилкарбонила, этоксиметилкарбонила, метоксикарбонилметилкарбонила, метоксикарбонилэтилкарбонила, метоксикарбонилкарбонила, аминометилкарбонила, и метилкарбониламинометилкарбонила;
или его фармацевтически приемлемая соль.
4. Соединение по п.3, выбранное из группы соединений и их фармацевтически приемлемых солей, включающей
N-[[4-[3-дифторметил-5-(3-фтор-4-метоксифенил)-1H-пиразол-1-ил]фенил]сульфонил]пропанамид;
N-[[4-[3-дифторметил-5-(3-фтор-4-метоксифенил)-1H-пиразол-1-ил]фенил]сульфонил]бутанамид;
N-[[4-[1,5-диметил-3-фенил-1H-пиразол-4-ил]фенил]сульфонил]ацетамид;
N-[[4-[2-(3-пиридинил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]ацетамид;
N-[[4-[2-(5-метилпиридин-3-ил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]ацетамид;
N-[[4-[2-(2-метилпиридин-3-ил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]ацетамид;
N-[[4-[2-(5-метилпиридин-3-ил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]бутанамид;
N-[[4-[2-(2-метилпиридин-3-ил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]бутанамид;
N-[[4-[2-(3-хлор-5-метилфенил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]ацетамид;
N-[[4-[3-(3-фторфенил)-5-метилизоксазол-4-ил]фенил]сульфонил]ацетамид;
2-метил-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]бензамид;
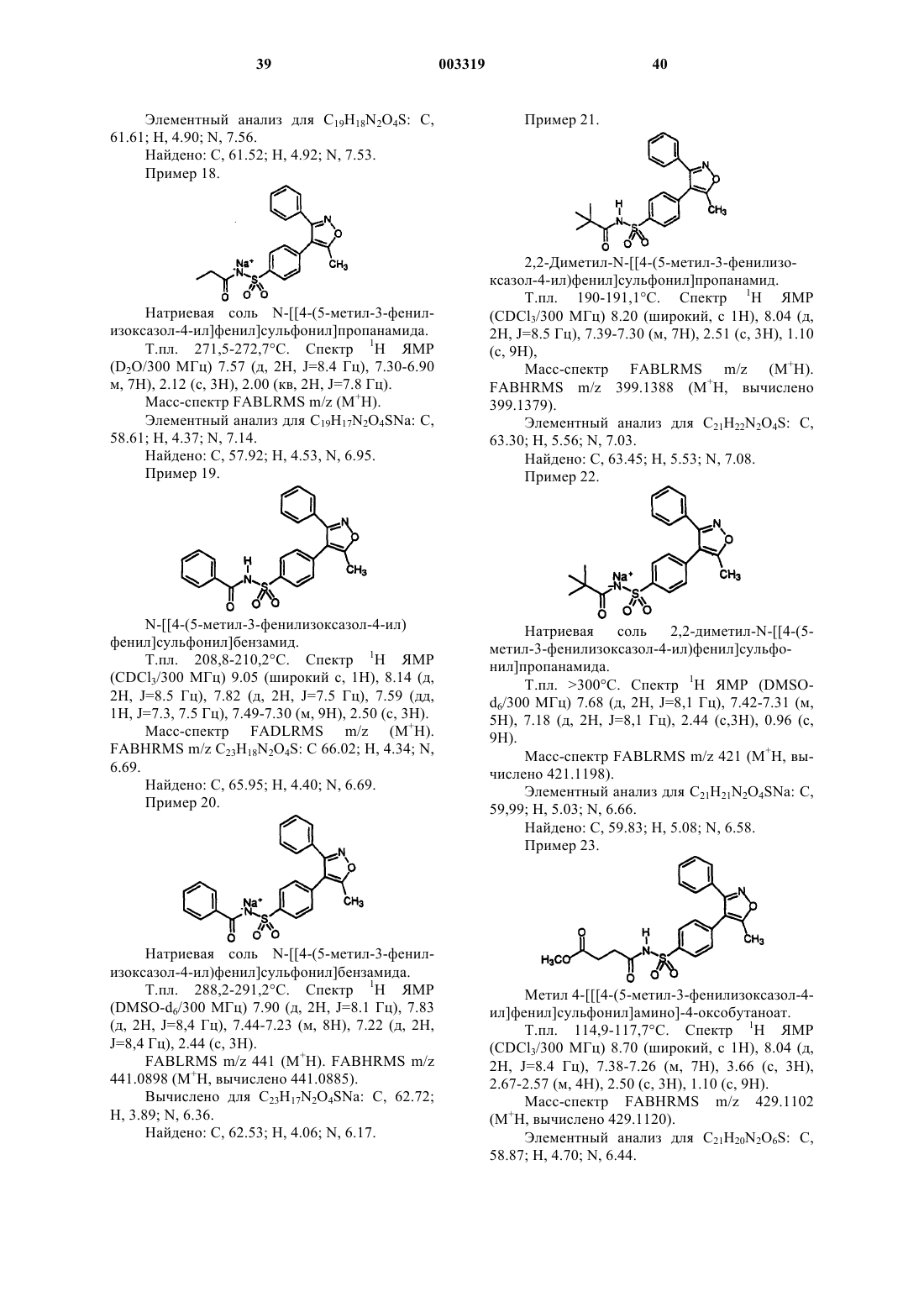
2,2-диметил-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]бутанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пентанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]гексанамид;
3-метокси-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
2-этокси-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
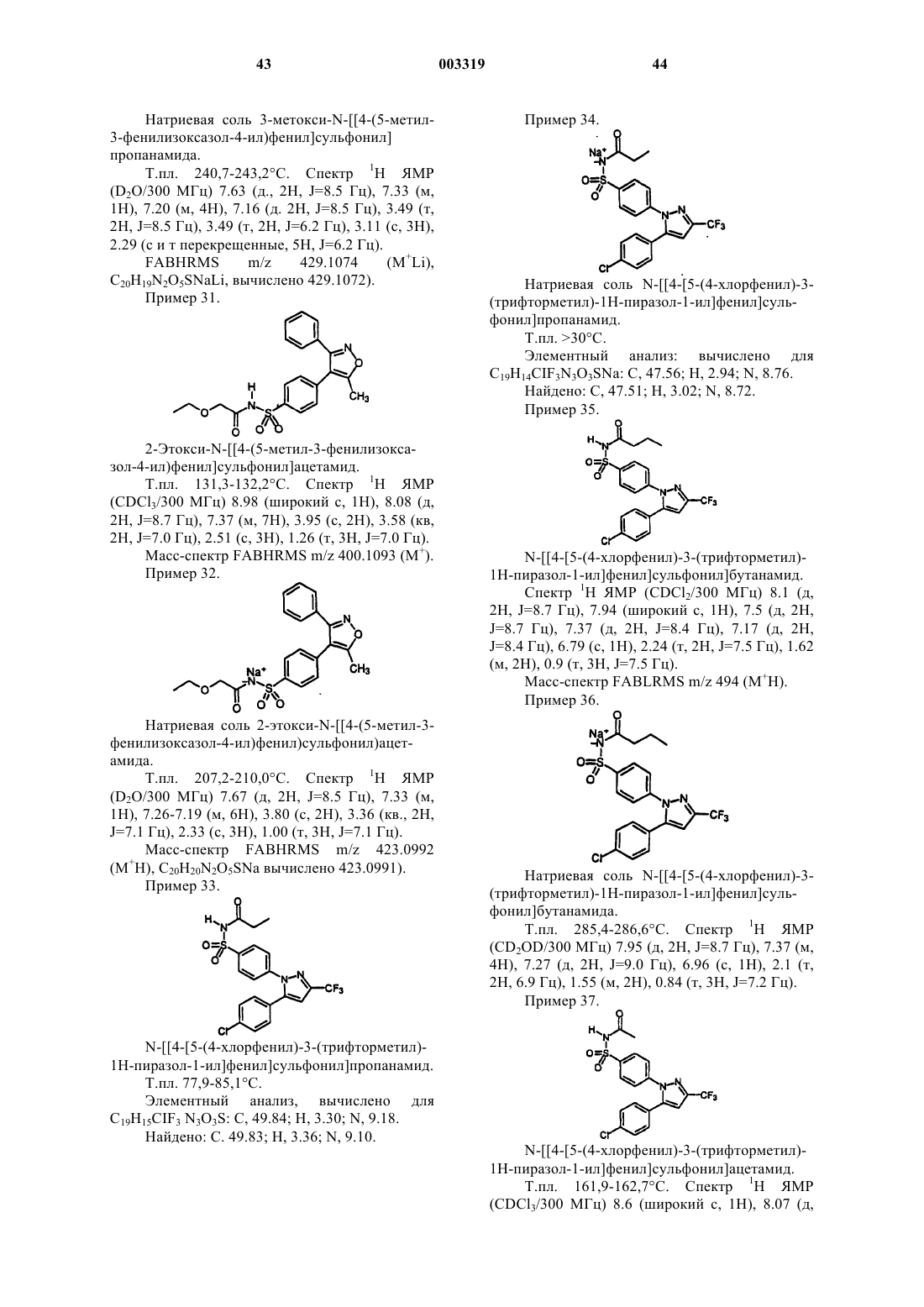
N-[[4-[5-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-1-ил] фенил]сульфонил]пропанамид;
N-[[4-[5-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-1-ил] фенил]сульфонил]бутанамид;
N-[[4-[5-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-1-ил] фенил]сульфонил]ацетамид;
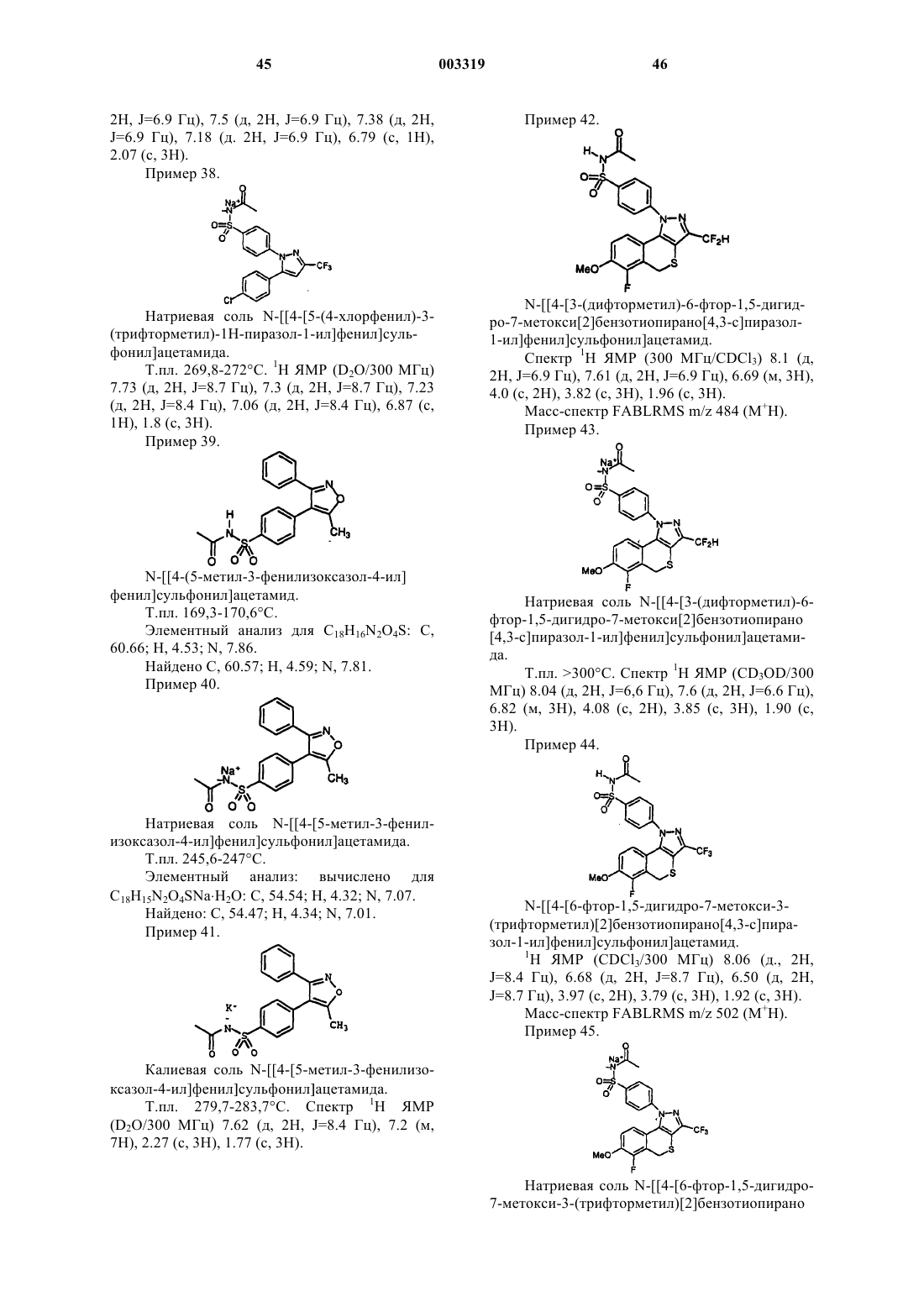
N-[[4-[3-(дифторметил)-6-фтор-1,5-дигидро-7-метокси[2]бензотиопирано[4,3-c]пиразол-1-ил] фенил]сульфонил]ацетамид;
N-[[4-[6-фтор-1,5-дигидро-7-метокси-3-(трифторметил)[2]бензотиопирано[4,3-c]пиразол-1-ил] фенил]сульфонил]ацетамид;
N-[[4-[3-(дифторметил)-5-(3-фтор-4-метоксифенил)-1H-пиразол-1-ил]фенил]сульфонил]ацетамид;
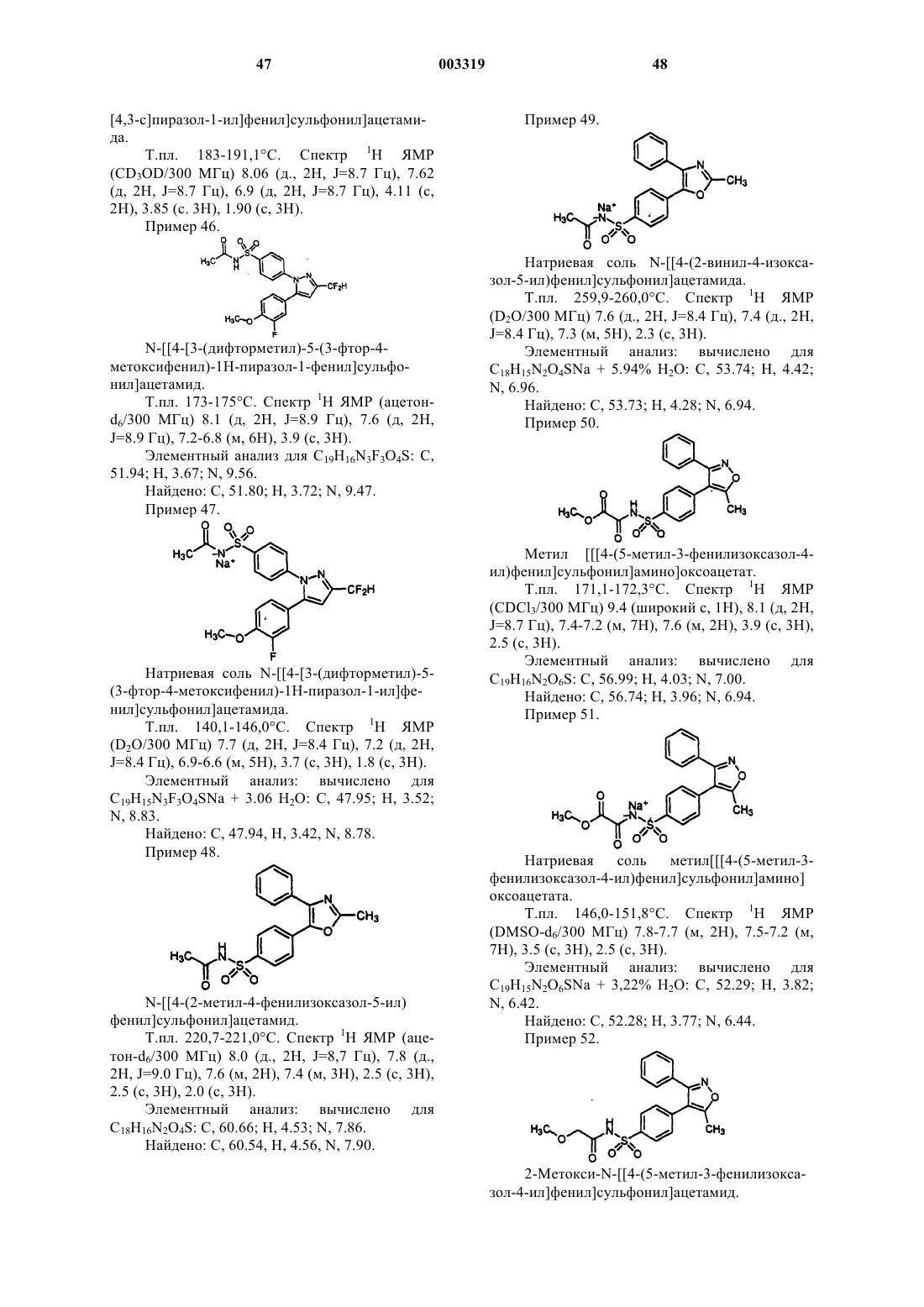
N-[[4-(2-метил-4-фенилоксазол-5-ил)фенил]сульфонил]ацетамид;
метил[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]оксоацетат;
2-метокси-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
N-[[4-(5-дифторметил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
N-[[4-(5-дифторметил-3-фенилизоксазол-4-ил)фенил]сульфонил]бутанамид;
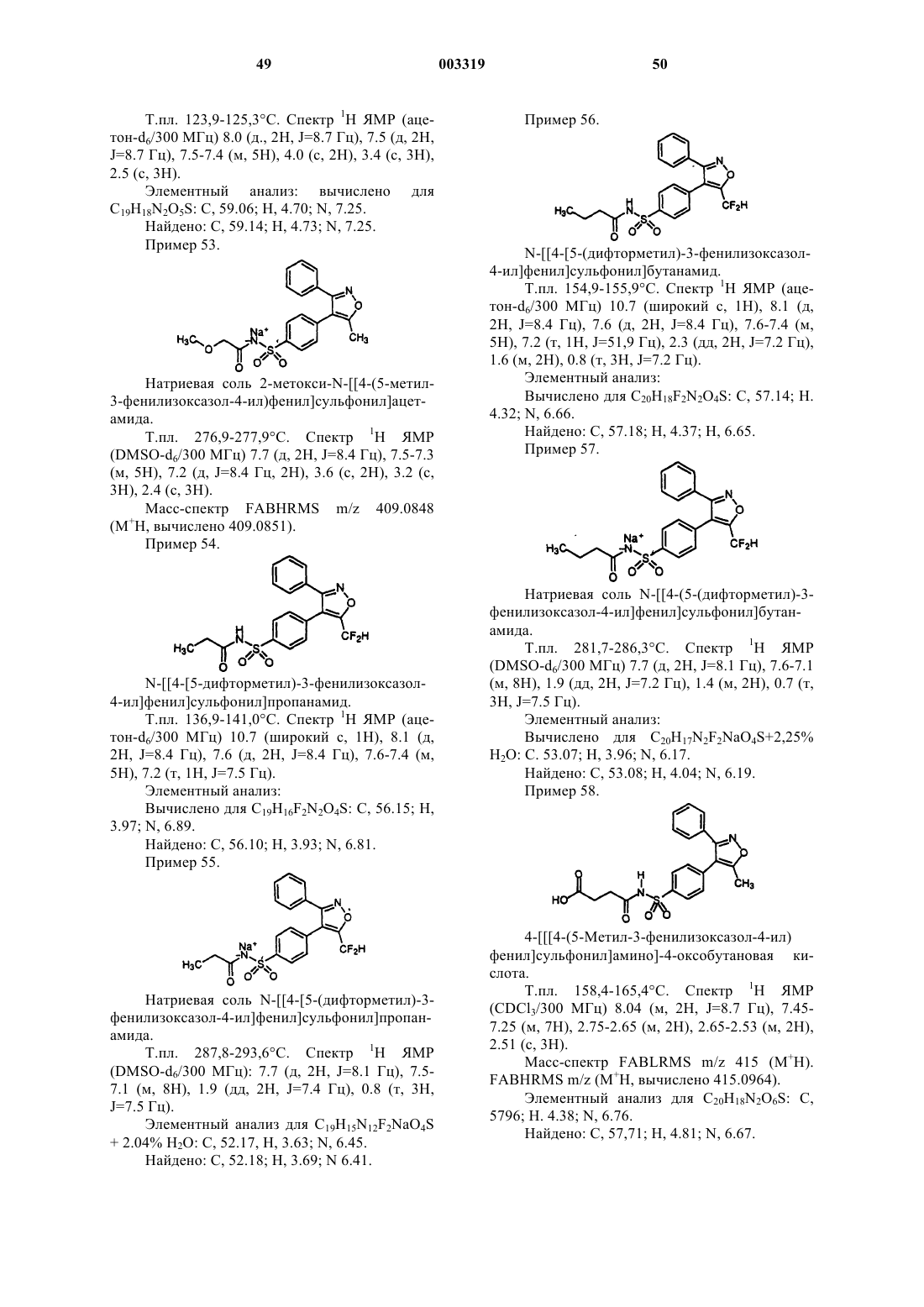
4-[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-4-оксобутановая кислота;
4-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]формамид;
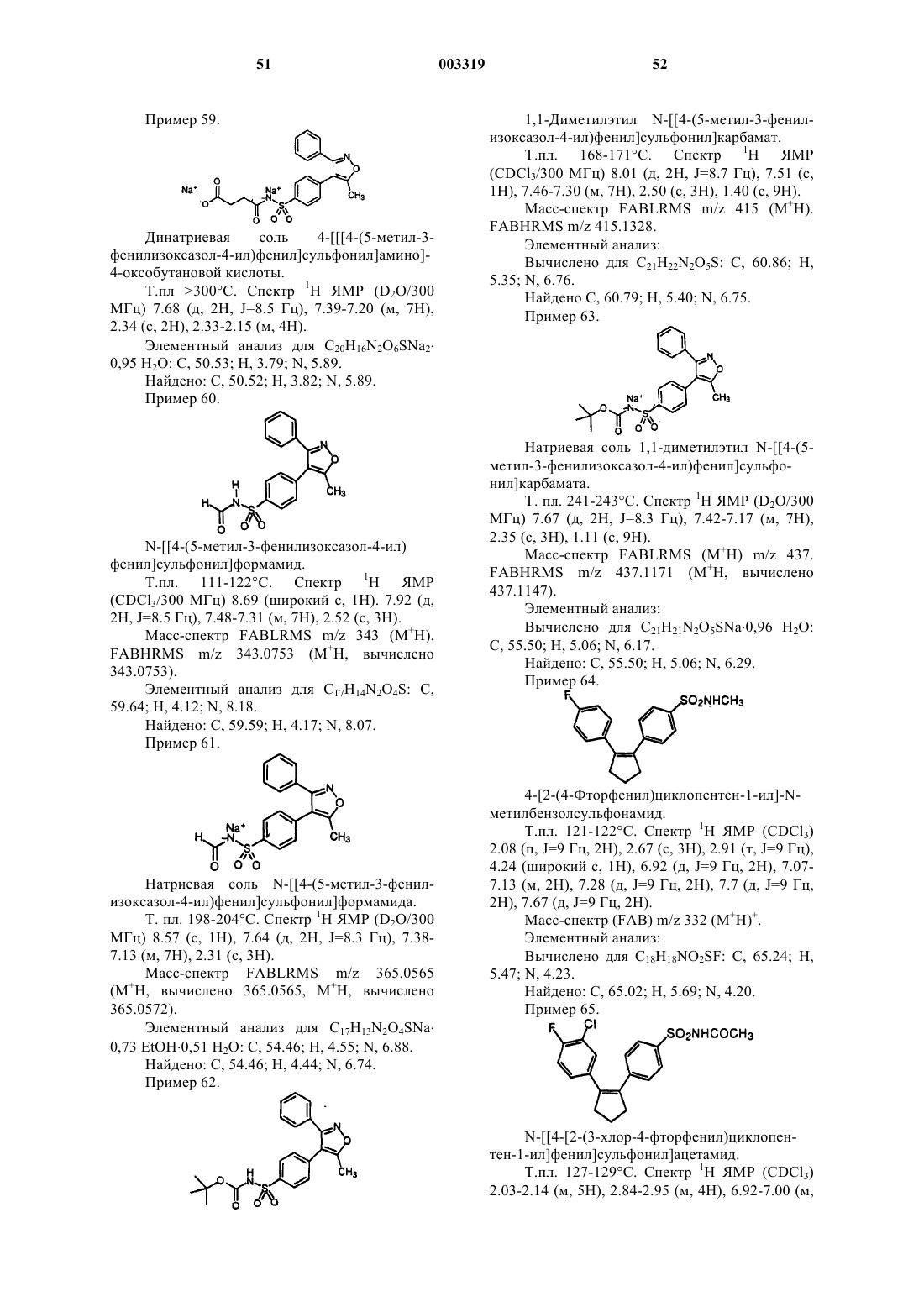
1,1-диметилэтил N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]карбамат;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]глицин;
2-амино-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
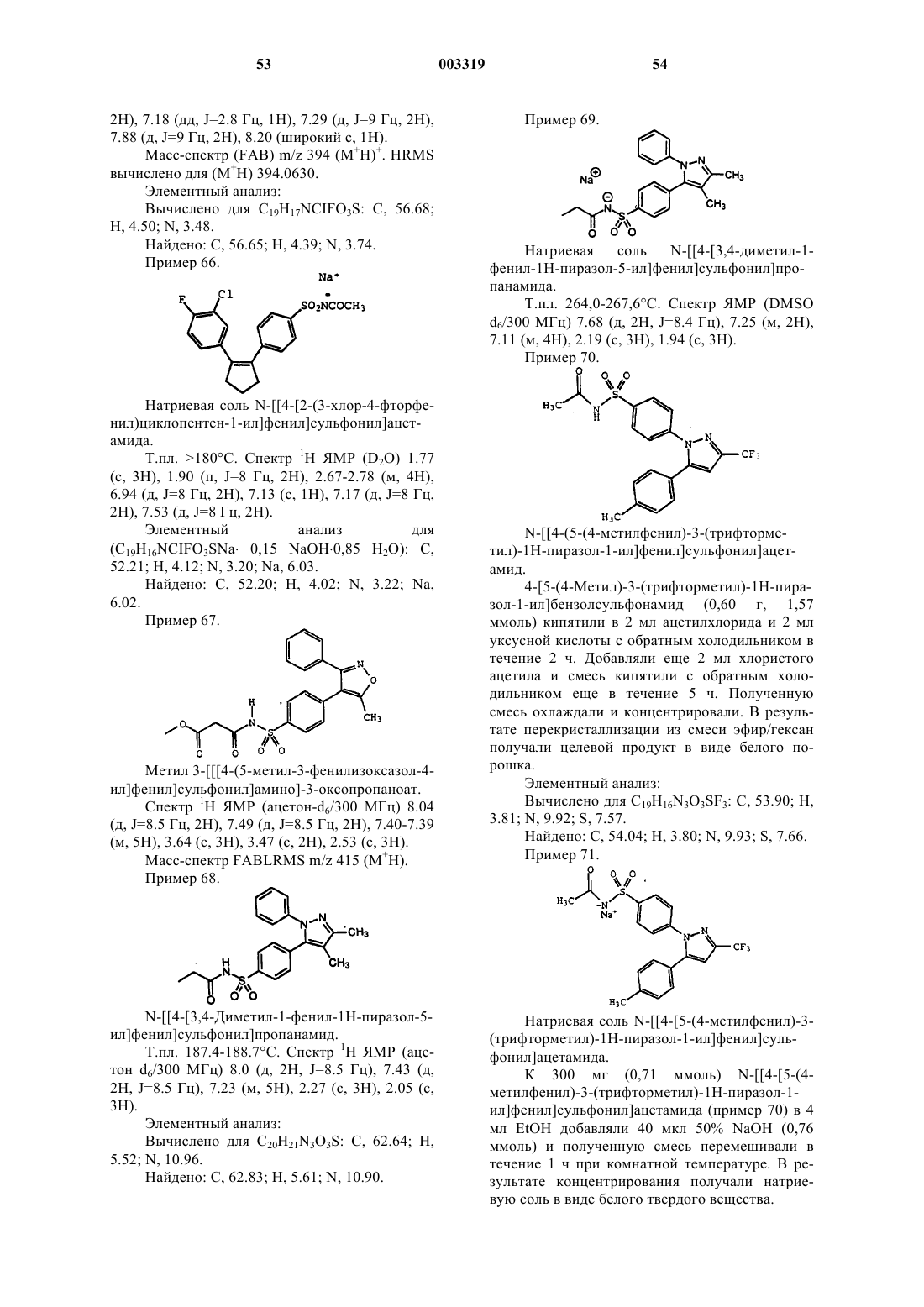
2-(ацетиламино)-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
метил 4-[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-4-оксобутаноат;
метил N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]карбамат;
этиловый эфир N-ацетил-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]глицина;
N-[[4-[5-(4-метилфенил)-3-(трифторметил)-1H-пиразол-1-ил]фенил]сульфонил]ацетамид;
метшы 3-[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-3-оксопропаноат;
4-[5-(3-бром-5-фтор-4-метоксифенил)-2-(трифторметил)оксазол-4-ил]-N-метилбензолсульфонамид;
N-(1,1-диметилэтил)-4-(5-метил-3-фенилизоксазол-4-ил)бензолсульфонамид;
4-[5-(4-фторфенил)-3-(трифторметил)-1H-пиразол-1-ил]-N-метилбензолсульфонамид;
N-метил-4-(5-метил-3-фенилизоксазол-4-ил)бензолсульфонамид;
N-[[4-(5-гидроксиметил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
N-[[4-(5-ацетоксиметил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
1,1-диметилэтил-N-[2-[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-2-оксоэтил]карбамат;
N-[[4-[2-(3-хлор-4-фторфенил)циклопентен-1-ил]фенил]сульфонил]ацетамид;
4-[2-(4-фторфенил)-1H-пиррол-1-ил]-N-метилбензолсульфонамид;
N-[[4-(3,4-диметил-1-фенил-1H-пиразол-5-ил)фенил]сульфонил]пропанамид;
N-[[4-[2-(2-метилпиридин-3-ил)-4-трифторметилимидазол-1-ил]фенил]сульфонил]пропанамид;
4-[2-(4-фторфенил)циклопентен-1-ил]-N-метилбензолсульфонамид и
N-[[4-(3-фенил-2,3-дигидро-2-оксофуран-4-ил)фенил]сульфонил]пропанамид.
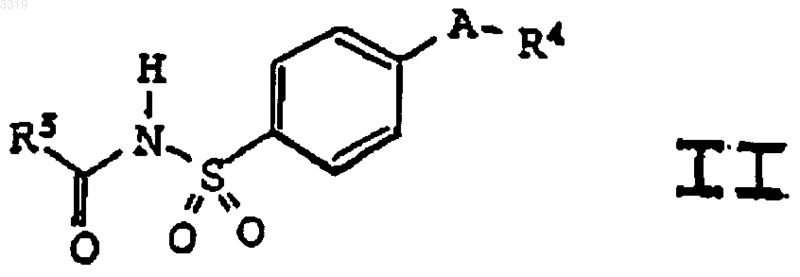
5. Соединение формулы II
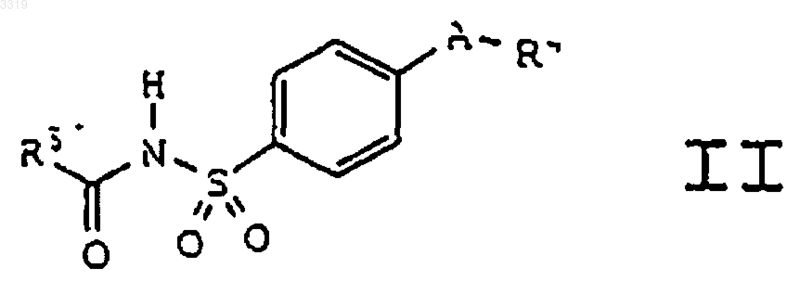
где A представляет заместитель в кольце, выбранный из C4-C8циклоалкенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где A необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C20алкила, гало-C1-C20алкила, гидрокси-C1-C20алкила, C1-C20алкилкарбонилокси-C1-C20алкила и оксогруппы;
где R4 представляет радикал, выбранный из пиридила и фенила;
где R4 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C20алкила, галогена и C1-C10алкокси; и
где R5 представляет радикал, выбранный из водорода, C1-C20алкила, фенила, карбокси-C1-C20алкила, C1-C10алкокси, C1-C10алкокси-C1-C20алкила, C1-C10алкоксикарбонил-C1-C20алкила, C1-C10алкоксикарбонила, амино-C1-C20алкила и C1-C20алкилкарбониламино-C1-C20алкила;
или его фармацевтически приемлемая соль.
6. Соединение по п.5, в котором A представляет собой заместитель в кольце, выбранный из циклопентенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где A необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C10алкила, гало-C1-C6алкила, гидрокси-C1-C6алкила, C1-C10алкилкарбонилокси-C1-C10алкила и оксогруппы;
где R4 представляет радикал, выбранный из пиридила и фенила;
где R4 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C10алкила, галогена и C1-C6алкокси; и
где R5 представляет радикал, выбранный из водорода, фенила, карбокси-C1-C10алкила, C1-C6алкокси, C1-C6-алкокси-C1-C10алкила, C1-C6-алкоксикарбонил-C1-C10алкила, C1-C6алкоксикарбонила, амино-C1-C10алкила и C1-C10алкилкарбониламино-C1-C10алкила;
или его фармацевтически приемлемая соль.
7. Соединение по п.6, в котором A представляет собой заместитель в кольце, выбранный из циклопентенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где A необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из метила, трифторметила, дифторметила, гидроксиметила, ацетоксиметила и оксогруппы;
в которой R4 выбирают из пиридила и фенила; где R4 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из метила, фтора, хлора и метокси; и
в котором R5 представляет радикал, выбранный из водорода, фенила, метила, этила, пропила, изопропила, бутила, трет-бутила, пентила, карбоксиэтила, метокси, трет-бутокси, метоксиметила, метоксиэтила, этоксиметила, метоксикарбонилметила, метоксикарбонилэтила, метоксикарбонила, аминометила и метилкарбониламинометила;
или его фармацевтически приемлемая соль.
8. Соединение по п.7, выбранное из группы соединений и их фармацевтически приемлемых солей, включающей
N-[[4-[3-(дифторметил)-5-(3-фтор-4-метоксифенил)-1H-пиразол-1-ил]фенил]сульфонил]пропанамид;
N-[[4-[3-(дифторметил)-5-(3-фтор-4-метоксифенил)-1H-пиразол-1-ил]фенил]сульфонил]бутанамид;
N-[[4-(1,5-диметил-3-фенил-1H-пиразол-4-ил)фенил]сульфонил]ацетамид;
N-[[4-[2-(3-пиридинил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]ацетамид;
N-[[4-[2-(5-метилпиридин-3-ил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]ацетамид;
N-[[4-[2-(2-метилпиридин-3-ил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]ацетамид;
N-[[4-[2-(5-метилпиридин-3-ил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]бутанамид;
N-[[4-[2-(2-метилпиридин-3-ил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]бутанамид;
N-[[4-[2-(3-хлор-5-метилфенил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]ацетамид;
N-[[4-[3-(3-фторфенил)-5-метилизоксазол-4-ил]фенил]сульфонил]ацетамид;
2-метил-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]бензамид;
2,2-димeтил-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]бутанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пентанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]гексанамид;
3-метокси-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
2-этокси-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
N-[[4-[5-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-1-ил]фенил]сульфонил]пропанамид;
N-[[4-[5-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-1-ил]фенил]сульфонил]бутанамид;
N-[[4-[5-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-1-ил]фенил]сульфонил]ацетамид;
N-[[4-[3-(дифторметил)-6-фтор-1,5-дигидро-7-метокси[2]бензотиопирано[4,3-c]пиразол-1-ил] фенил]сульфонил]ацетамид;
N-[[4-[6-фтор-1,5-дигидро-7-метокси-3-(трифторметил)[2]бензотиопирано[4,3-c]пиразол-1-ил] фенил]сульфонил]ацетамид;
N-[[4-[3-(дифторметил)-5-(3-фтор-4-метоксифенил)-1H-пиразол-1-ил]фенил]сульфонил]ацетамид;
N-[[4-(2-метил-4-фенилоксазол-5-ил)фенил]сульфонил]ацетамид;
метил[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]оксоацетат;
2-метокси-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
N-[[4-(5-дифторметил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
N-[[4-(5-дифторметил-3-фенилизоксазол-4-ил)фенил]сульфонил]бутанамид;
4-[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]оксобутановая кислота;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]формамид;
1,1-диметилэтил-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]карбамат;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]глицин;
2-амино-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
2-(ацетиламино)-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
метил 4-[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-4-оксобутаноат;
метил N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]карбамат;
N-[[4-[5-(4-метилфенил)-3-(трифторметил)-1H-пиразол-1-ил]фенил]сульфонил]ацетамид;
метил 3-[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-3-оксопропаноат;
N-[[4-(5-гидроксиметил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
N-[[4-(5-ацетоксиметил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамид;
1,1-диметилэтил-N-[2-[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-2-оксоэтил]карбамат;
N-[[4-(3,4-диметил-1-фенил-1H-пиразол-5-ил)фенил]сульфонил]пропанамид;
N-[[4-[2-(2-метилпридин-3-ил)-4-трифторметилимидазол-1-ил]фенил]сульфонил]пропанамид;
N-[[4-[2-(3-хлор-4-фторфенил)циклопентен-1-ил]фенил]сульфонил]ацетамид и
N-[[4-(3-фенил-2,3-дигидро-2-оксофуран-4-ил)фенил]сульфонил]пропанамид.
9. Соединение по п.5, в котором фармацевтически приемлемые соли представляют собой соли металлов.
10. Соединение по п.9, в котором фармацевтически приемлемые соли выбирают из солей щелочных металлов и солей щелочно-земельных металлов.
11. Соединение по п.10, в котором фармацевтически приемлемые соли выбирают из солей натрия и калия.
12. Соединение по п.11, выбранное из группы соединений и их фармацевтически приемлемых солей, включающей
натриевую соль N-[[4-[3-(дифторметил)-5-(3-фтор-4-метоксифенил)-1H-пиразол-1-ил]фенил]сульфонил]пропанамида;
натриевую соль N-[[4-[3-(дифторметил)-5-(3-фтор-4-метоксифенил)-1H-пиразол-1-ил]фенил]сульфонил]бутанамида;
натриевую соль N-[[4-(1,5-диметил-3-фенил-1H-пиразол-4-ил)фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[2-(3-пиридинил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[2-(5-метилпиридин-3-ил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[2-(2-метилпиридин-3-ил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[2-(5-метилпиридин-3-ил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]бутанамида;
натриевую соль N-[[4-[2-(2-метилпиридин-3-ил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]бутанамида;
натриевую соль N-[[4-[2-(3-хлор-5-метилфенил)-4-(трифторметил)-1H-имидазол-1-ил]фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[3-(3-фторфенил)-5-метилизоксазол-4-ил]фенил]сульфонил]ацетамида;
натриевую соль 2-метил-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]бензамида;
натриевую соль 2,2-диметил-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]бутанамида;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пентанамида;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]гексанамида;
натриевую соль 3-метокси-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида;
натриевую соль 2-этокси-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамида;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамида;
калиевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[5-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-1-ил]фенил]сульфонил]пропанамида;
натриевую соль N-[[4-[5-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-1-ил]фенил]сульфонил]бутанамида;
натриевую соль N-[[4-[5-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-1-ил]фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[3-(дифторметил)-6-фтор-1,5-дигидро-7-метокси[2]бензотиопирано[4,3-с]пиразол-1-ил]фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[6-фтор-1,5-дигидро-7-метокси-3-(трифторметил)[2]бензотиопирано[4,3-с]пиразол-1-ил]фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[3-(дифторметил)-5-(3-фтор-4-метоксифенил)-1H-пиразол-1-ил]фенил]сульфонил]ацетамида;
натриевую соль N-[[4-(2-метил-4-фенилоксазол-5-ил)фенил]сульфонил]ацетамида;
натриевую соль метил [[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]оксоацетата;
натриевую соль 2-метокси-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[5-(дифторметил)-3-фенилизоксазол-4-ил]фенил]сульфонил]пропанамида;
натриевую соль N-[[4-[5-(дифторметил)-3-фенилизоксазол-4-ил]фенил]сульфонил]бутанамида;
натриевую соль 4-[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-4-оксобутановой кислоты;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]формамида;
натриевую соль 1,1-диметилэтил N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]карбамата;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]глицина;
натриевую соль 2-амино-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамида;
натриевую соль 2-(ацетиламино)-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамида;
натриевую соль метил 4-[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-4-оксобутаноата;
натриевую соль метил N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]карбамата;
натриевую соль N-[[4-[5-гидроксиметил-3-фенилизоксазол-4-ил]фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[5-(4-метилфенил)-3-(трифторметил)-1H-пиразол-1-ил]фенил]сульфонил]ацетамида;
натриевую соль метил 3-[[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-3-оксопропаноата;
натриевую соль N-[[4-[5-(гидроксиметил)-3-фенилизоксазол-4-ил]фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[5-(ацетоксиметил)-3-фенилизоксазол-4-ил]фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[3,4-диметил-1-фенил-1H-пиразол-5-ил]фенил]сульфонил]пропанамида;
натриевую соль N-[[4-[2-(2-метилпиридин-3-ил)-4-трифторметилимидазол-1-ил]фенил]сульфонил]пропанамида;
натриевую соль N-[[4-[2-(3-хлор-4-фторфенил)циклопентен-1-ил]фенил]сульфонил]ацетамида; и
натриевую соль N-[[4-(3-фенил-2,3-дигидро-2-оксофуран-4-ил)фенил]сульфонил]пропанамида.
13. Соединение формулы III
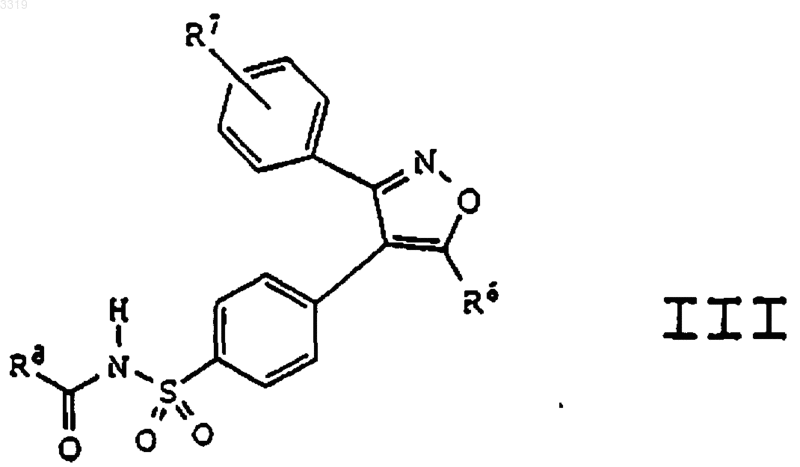
где R6 представляет радикал, выбранный из C1-C10алкила, гало-C1-C6алкила и C1-C6гидроксиалкила;
где R7 представляет радикал, выбранный из водорода и галогена; и
где R8 представляет радикал, выбранный из водорода, C1-C10алкила, C1-C6алкокси, C1-C10алкоксиалкила, фенила, C1-C10карбоксиалкила, C1-C6алкоксикарбонилалкила, C1-C6алкоксикарбонила, C1-C10аминоалкила и C1-C10алкилкарбониламиноалкила;
или его фармацевтически приемлемая соль.
14. Соединение по п.13, в котором R6 представляет радикал, выбранный из метила, дифторметила и гидроксиметила; в котором R7 представляет собой радикал, выбранный из водорода и фтора;
и в котором R8 выбирают из водорода, метила, этила, пропила, изопропила, бутила, трет-бутила, пентила, метокси, трет-бутокси, метоксиметила, метоксиэтила, этоксиметила, фенила, карбоксиэтила, метоксикарбонилметила, метоксикарбонилэтила, метоксикарбонила, аминометила и метилкарбониламинометила;
или его фармацевтически приемлемая соль.
15. Соединение по п.14, выбранное из группы соединений и их фармацевтически приемлемых солей, включающей
N-[[4-[3-(3-фторметил)-5-метилизоксазол-4-ил]фенил]сульфонил]ацетамид;
2-метил-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]бензамид;
2,2-диметил-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]бутанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пентанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]гексанамид;
N-[[4-[5-метил-3-фенилизоксазол-4-ил]фенил]сульфонил]ацетамид;
N-[[4-(5-гидроксиметил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид;
N-[[4-[5-(дифторметил)-3-фенилизоксазол-4-ил]фенил]сульфонил]пропанамид;
N-[[4-[5-(дифторметил)-3-фенилизоксазол-4-ил]фенил]сульфонил]бутанамид;
N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]глицин и
N-[[4-(5-гидроксиметил-3-фенилизоксазол-4-ил)-фенил]сульфонил]ацетамид.
16. Соединение по п.15, которое представляет собой N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид или его фармацевтически приемлемую соль.
17. Соединение по п.13, в котором фармацевтически приемлемые соли выбирают из солей щелочных металлов и солей щелочно-земельных металлов.
18. Соединение по п.15, в котором фармацевтически приемлемые соли выбирают из солей натрия и калия.
19. Соединение по п.18, выбранное из группы соединений и их фармацевтически приемлемых солей, включающей
калиевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамида;
натриевую соль N-[[4-[3-(3-фторфенил)-5-метилизоксазол-4-ил]фенил]сульфонил]ацетамида;
натриевую соль 2-метил-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]бензамида;
натриевую соль 2,2-диметил-N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]бутанамида;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пентанамида;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]гексанамида;
натриевую соль N-[[4-(2-метил-4-фенилизоксазол-5-ил)фенил]сульфонил]ацетамида;
натриевую соль N-[[4-(5-дифторметил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида;
натриевую соль N-[[4-(5-дифторметил-3-фенилизоксазол-4-ил)фенил]сульфонил]бутанамида;
натриевую соль N-[[4-(5-гидроксиметил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида;
натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]глицина и
натриевую соль N-[[4-(5-гидроксиметил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамида.
20. Соединение по п.19, которое представляет собой натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида.
21. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения, причем указанное соединение выбирают из группы соединений по п.1, включая соединения, в которых А представляет собой тетразолий или A представляет собой индан, когда R3 представляет собой алкил или циклоалкил; или по любому из пп.2-19.
22. Фармацевтическая композиция по п.21, где указанное соединение представляет собой N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид или его фармацевтически приемлемую соль.
23. Фармацевтическая композиция по п.21, где указанное соединение представляет собой натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида.
24. Способ получения соединения формулы II
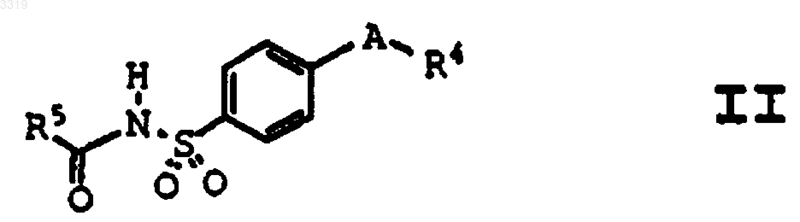
где A представляет заместитель в кольце, выбранный из C4-C8циклоалкенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где A необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C20алкила, гало-C1-C20алкила, гидрокси-C1-C20алкила, C1-C20алкилкарбонилокси-C1-C20алкила и оксогруппы;
где R4 представляет радикал, выбранный из пиридила и фенила;
где R4 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C20алкила, галогена и C1-C10алкокси; и
где R5 представляет радикал, выбранный из водорода, C1-C20алкила, фенила, карбокси-C1-C20алкила, C1-C10алкокси, C1-C10алкокси-C1-C20алкила, C1-C10алкоксикарбонил-C1-C20алкила, C1-C20алкоксикарбонила, амино-C1-C20алкила и C1-C20алкилкарбониламино-C1-C20алкила;
или его фармацевтически приемлемой соли, включающий обработку незамещенного сульфонамида ацилирующим агентом в присутствии основания и растворителя.
25. Способ по п.24, в котором ацилирующий агент выбирают из ангидридов, хлорангидридов, ацила, имидазолов и активных сложных эфиров.
26. Способ по п.25, в котором ацилирующий агент выбирают из уксусного ангидрида, пропионового ангидрида и масляного ангидрида.
27. Способ по п.24, в котором растворитель представляет собой тетрагидрофуран.
28. Способ получения соединения формулы III
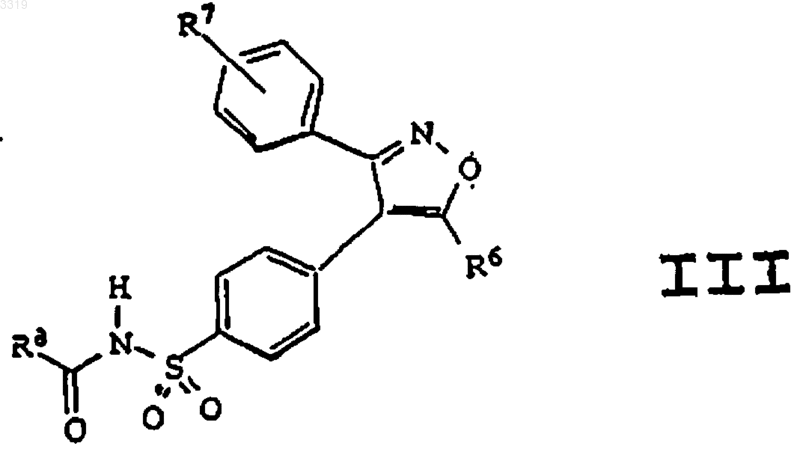
где R6 представляет радикал, выбранный из C1-C10алкила, гало-C1-C6алкила и C1-C6гидроксиалкила;
где R7 представляет радикал, выбранный из водорода и галогена; и
где R8 представляет радикал, выбранный из водорода, C1-C10алкила, C1-C6алкокси, C1-C10алкоксиалкила, фенила, C1-C10карбоксиалкила, C1-C6алкоксикарбонилалкила, C1-C6алкоксикарбонила, C1-C10аминоалкила и C1-C10алкилкарбониламиноалкила;
или его фармацевтически приемлемой соли,
включающий обработку незамещенного изоксазолилбензолсульфонамида ацилирующим агентом в присутствии основания и растворителя.
29. Способ получения соединения формулы II
где A представляет заместитель в кольце, выбранный из C4-C8циклоалкенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где A необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C20алкила, гало-C1-C20алкила, гидрокси-C1-C20алкила, C1-C20алкилкарбонилокси-C1-C20алкила и оксогруппы;
где R4 представляет радикал, выбранный из пиридила и фенила, где R4 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C20алкила, галогена и C1-C10алкокси; и
где R5 представляет радикал, выбранный из водорода, C1-C20алкила, фенила, карбокси-C1-C20алкила, C1-C10алкокси, C1-C10алкокси-C1-C20алкила, C1-C10алкоксикарбонил-C1-C20алкила, C1-C20алкоксикарбонила, амино-C1-C20алкила и C1-C20алкилкарбониламино-C1-C20алкила;
или его фармацевтически приемлемой соли,
включающий образование бис(N-ацилированного)сульфонамида обработкой незамещеннюую сульфонамида избытком ангидрида, хлорангидрида или карбамоилхлорида в присутствии третичного аминного основания и обработкой указанного бис(N-ацилированного)сульфонамида примерно двумя эквивалентами сильного основания с получением соли.
30. Способ получения соединения формулы II

где A представляет заместитель в кольце, выбранный из C4-C8циклоалкенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где A необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C20алкила, гало-C1-C20алкила, гидрокси-C1-C20алкила, C1-C20алкилкарбонилокси-C1-C20алкила и оксогруппы;
где R4 представляет радикал, выбранный из пиридила и фенила; где R4 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-C20алкила, галогена и C1-C10алкокси; и
где R5 представляет радикал, выбранный из водорода, C1-C20алкила, фенила, карбокси-C1-C20алкила, C1-C10алкокси, C1-C10алкокси-C1-C20алкила, C1-C10алкоксикарбонил-C1-C20алкила, C1-C20алкоксикарбонила, амино-C1-C20алкила и C1-C20алкилкарбониламино-C1-C20алкила;
или его фармацевтически приемлемой соли,
включающий обработку незамещенного сульфонамида ацилирующим агентом в присутствии кислоты.
31. Способ по п.30, в котором ацилирующий агент выбирают из ангидридов и хлорангидридов.
32. Способ по п.31, в котором ацилирующий агент выбирают из ацетилхлорида, уксусного ангидрида, пропионового ангидрида и масляного ангидрида.
33. Способ по п.30, в котором A выбирают из оксазолила, фурила, тиазолила, имидазолила, бензофурила, инденила, бензотиенила, изоксазола, пиразолила, циклопентенила, циклопентадиенила, бензиндазолила, бензопиранопиразолила, фенила и пиридила.
34. Способ по п.33, в котором A выбирают из имидазолила, изоксазолила и пиразолила.
35. Применение соединения по п.1, включая соединения, в которых A представляет собой тетразолий, или пиридиний, или инданон, когда R3 представляет собой алкил или карбоксиалкил; или соединений по любому из пп.1-19 для получения лекарственного средства, предназначенного для лечения воспаления или связанного с воспалением расстройства.
36. Применение по п.35, где указанное соединение представляет собой N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамид или его фармацевтически приемлемую соль.
37. Применение по п.35, где указанное соединение представляет собой натриевую соль N-[[4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида.
38. Применение по п.35, в котором болезненное состояние представляет собой воспаление.
39. Применение по п.35, в котором болезненное состояние представляет собой связанное с воспалением расстройство.
40. Применение по п.39, в котором связанное с воспалением расстройство представляет собой боль.
41. Применение по п.40, в котором боль связана с раком.
42. Применение по п.40, в котором боль представляет собой зубную боль.
43. Применение по п.40, в котором соединение вводят внутривенно.
44. Применение по п.40, в котором соединение вводят внутримышечно.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к области противовоспалительных фармацевтических агентов и, в частности, относится к пролекарствам соединений, которые селективно ингибируют циклооксигеназу-2. Описание уровня техники Применение нестероидных противовоспалительных лекарств (NSAIDs) при лечении боли и опухолей, связанных с воспалением также дает серьезные побочные действия, включающие язвы, представляющие угрозу жизни. Недавнее открытие индуцируемого энзима, связанного с воспалительными явлениями ("простагландин G/H синтаза II или "циклооксигеназа-2" (СОХ-2) обеспечило очевидную мишень для ингибирования, которое более эффективно уменьшает воспаление и дает более слабые и менее выраженные побочные эффекты. Ранее описаны соединения, которые селективно ингибируют циклооксигеназу-2. В патенте США 5,30,738 описаны оксазолы, которые селективно ингибируют циклооксигеназу-2. В патенте США 5,344,991 описаны циклопентены,которые селективно ингибируют циклооксигеназу-2. В патенте США 5,393,790 описаны спиросоединения, которые селективно ингибируют циклооксигеназу-2. В WO 94/15932 описаны производные тиофена и фурана, которые селективно ингибируют циклооксигеназу-2. В WO 94/27980 описаны оксазолы, которые селективно ингибируют циклооксигеназу-2. В WO/13635 описаны соединения, которые селективно ингибируют циклооксигеназу-2. В WO 94/20480 описаны соединения, которые селективно ингибируют циклооксигеназу-2. В WO/15316 описаны производные сульфонамида, которые селективно ингибируют циклооксигеназу-2. Однако в некоторых обстоятельствах пролекарства противовоспалительных соединений обладают рядом преимуществ, особенно в тех случаях, когда пролекарства имеют повышенную растворимость в воде или c замедленным началом действия. Описаны замещенные сульфонамиды. Пиразолилсульфонилмочевины описаны, как вещества, обладающие возможной гипогликемической активностью [H.Faid-Allah и H.Mokhtar,Ind.J.Chem, 27,245 (1988)]. В JP 1,045,374 описаны водорастворимые соединения тетразолия,используемые в анализах для определения восстанавливающих веществ D.Mukerjee с сотр.[Acta.Pharma. Yugosl., 31,151 (1981)] описывали сульфонамиды тетразолия, используемые в качестве антивирусных агентов. В JP 4,277,724 описаны трифенил пиразолины, используемые в качестве нелинейного оптического материала. ВJP 5,323,522 описано использование гетероциклических соединений в качестве материалов для черно-белой фотографии. В патенте США 5,389,635 описаны замещенные имидазолы, ис 003319 2 пользуемые в качестве антагонистов ангиотензина II. В патенте США 5,387,592 описаны производные замещенного бензимидазола, используемые в качестве антагонистов ангиотензина II. G.Dorofeenko с сотр. [Khim.Farm.Zh.,16,920 (1982)] описали соли пиридиния, используемые в качестве противовирусных агентов. В патенте США 5,338,749 описаны диарилзамещенные гетероциклические соединения, используемые в качестве противоартритных агентов. WO 94/26731 описывает соединения тиофена, которые селективно ингибируют циклооксигеназу-2. В WO95/00501 описаны соединения,которые селективно ингибируют циклооксигеназу-2, причем, главным образом, описан 3-(4(трифторацетиламиносульфонил)фенил-2-(4 фторфенил)тиофен. T.Ivanov [Mh.Chem. 97,1499(1966)] описал получение производных диарилиндона, как возможных индикаторов, причем отдельно описан 2-(4-(N-метиламиносульфонил)фенил-3-фенилиндон.J.Larsen и H.Bundgard [Int. J. Pharmaceutics,37,87(1987)] оценили N-ацилсульфонамиды, в качестве потенциальных производных пролекарств J.Larsen с сотр. [Int.J. Pharmaceutics. 47,103 (1988)] оценили N-метилсульфонамиды в качестве потенциальных производных пролекарств. В настоящее время существует потребность в соединениях, подходящих для использования в противовоспалительных композициях для инъекций. Обнаружено, что соединения настоящего изобретения оказались полезными в качестве пролекарств. Описание изобретения Класс замещенных сульфонамидных соединений, используемых в качестве пролекарств, определяется формулой I где А представляет заместитель в кольце, выбранный из С 4-С 8 циклоалкенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где А необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1 С 20 алкила, гало-C1-С 20 алкила, гидрокси-С 1-С 20 алкила, С 1-С 20 алкилкарбонилокси-С 1-С 20 алкила и оксогруппы; где R1 предсталяет радикал, выбранный из пиридила и фенила; где R1 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными изC1-С 20 алкила, галогена и C1-С 10 алкокси; где R2 представляет водород; и где R3 представляет радикал, выбранный из С 1-С 20 алкила, ацила, карбокси-С 1-С 20 алкила,карбокси-C1-С 20 алкилкарбонила, C1-С 10 алкоксикарбонила, C1-C10 алкокси-C1-С 20 алкилкарбонила, С 1-С 10 алкоксикарбонил-С 1-С 20 алкилкарбонила, C1-С 10 алкоксикарбонилкарбонила, амино 3 С 1-С 20 алкилкарбонила и С 1-С 20 алкилкарбониламино-C1-С 20 алкилкарбонила; или его фармацевтически приемлемая соль. Соединения формулы I могут использоваться, не ограничиваясь только этим, для лечения воспалительного состояния у субъекта и для лечения других расстройств, медиированных циклооксигеназой-2,например,выполнять функции анальгетика при лечении боли и головной боли или жаропонижающего средства для лечения лихорадки. Так, например, соединения изобретения могут быть полезными в лечении артрита, включая, но не ограничиваясь,ревматоидным артритом, спондилоартропатией,подагрическим артритом, остеоартритом, системной красной волчанкой и юношеским артритом. Такие соединения изобретения могут быть полезными при лечении астмы, бронхита, менструальных спазмов, преждевременных родов,тендинита, бурсита, таких болезненных состояний, связанных с кожным покровом, как псориаз, экзема, ожоги и дерматит, а также постоперативного воспаления, включающего воспаления от офтальмической хирургии, например,хирургического вмешательства по поводу катаракты и рефрактивной хирургии. Соединения изобретения могут также быть полезными при лечении болезненных состояний желудочнокишечного тракта, таких как воспалительное заболевание кишечника, болезнь Крона, гастрит,слизистый колит и язвенный колит. Соединения изобретения могут быть полезными для профилактики или лечения раковых заболеваний, например колоректального рака, а также рака молочной железы, легких, поджелудочной железы,мочевого пузыря, шеи и кожи. Соединения настоящего изобретения могут быть полезными при лечении воспалений при таких заболеваниях, как заболевания сосудов, мигреневые головные боли, узелковый периартериит, тиреодит,апластическая анемия, лимфогранулематоз,склеродома, ревматическая лихорадка, диабет типа I, заболевания нервно-мышечного синапса,включающего тяжелую миастению, заболевания белого вещества мозга, включающего рассеянный склероз, саркоидоз, нефротический синдром, синдром Behcets, полимиозит, гингивит,нефрит, аллергия, опухоль после травмы, миокардиальная ишемия и т.п. Соединения настоящего изобретения могут также быть полезными при лечении таких офтальмологических заболеваний, как ретинит, ретинопатия, увеит, окулярная фотофобия, а также острое повреждение глазной ткани. Эти соединения также могут быть полезными при лечении воспаления легких, например такого, которое связано с вирусными инфекциями и муковисцидозом. Соединения изобретения также могут быть полезны для лечения некоторых нарушений центральной нервной системы, таких как кортикальное слабоумие, включающее болезнь Альцгеймера, а 4 также повреждение центральной нервной системы, возникающее в результате внезапного приступа, ишемии и травмы. Соединения настоящего изобретения могут применяться в качестве противовоспалительных агентов, например, для лечения артрита, причем дополнительное преимущество этих соединений заключается в значительно меньшем числе вредных побочных эффектов. Эти соединения также могут быть полезными для лечения аллергического ринита, респираторного дистресс-синдрома,эндотоксинового шокового синдрома и атеросклероза. Соединения настоящего изобретения могут также быть полезными при лечении болевых ощущений, представляющих собой, не ограниченных ими, постоперационную боль, зубную боль, мышечную боль и боль при онкологическом заболевании. Соединения изобретения могут применяться для профилактики слабоумия, например, при болезни Альцгеймера. Помимо того, что соединения изобретения могут быть полезными при лечении людей, они могут также применяться в ветеринарном лечении домашних животных, экзотических животных и фермерских животных, включающих млекопитающих, грызунов и т.п. Более предпочтительные животные включают лошадей, собак и кошек. Соединения настоящего изобретения могут также применяться в сопутствующей терапии, частично или полностью, вместо других традиционных противовоспалительных агентов,например, вместе со стероидами, NSAIDs, ингибиторами 5-липоксигеназы, анатогонистамиLTB4 и ингибиторами LTA4 гидролазы. Подходящие ингибиторы LTB4 включают среди прочих веществ эбселен, Bayer Bay-x-105,Ciba Geigi соединения CGS-25019 С, соединениеSKF соединение SKF-104493. Предпочтительно, ингибиторы LTB4 выбирают из эбселена,Bayer Bat-x-1005, Ciba Geigy соединения CGS25019C, Leo Denmark соединения ETH-615, Lilli соединения LI-293111, Ono соединения ONO4057, и Terumo соединения TMK-688. Подходящие 5-LO ингибиторы среди прочих веществ включают мазопрокол, тенидап,зилеутон, пранлукаст, тепоксалин, рилопирокс,флезеластин гидрохлорид, эназадрем фосфат и бунапроласт. Соединения настоящего изобретения могут также использоваться в комбинационной терапии вместе с опиоидами и другими анальгетиками, такими как морфин, меперидин, или кодеин. 5 Термин "ингибитор циклооксигеназы-2" охватывает соединения, которые селективно ингибируют циклооксигеназу-2 по сравнению с циклооксигеназой-1. Предпочтительно такие соединения имеют значение IC50 для циклооксигеназы-2 менее примерно 0,5 мкМ, а также обладают соотношением селективности ингибирования циклооксигеназы-2 и селективности ингибирования циклооксигеназы-1 равным, по крайней мере, 50 и более предпочтительно, по крайней мере, 100. Еще более предпочтительно,когда соединения изобретения имеют значениеIC50 в отношении циклооксигеназы-1 выше, чем примерно 1 мкМ и более предпочтительно выше 20 мкМ. Такая предпочтительная селективность указывает на способность снижать вероятность появления обычных HSAIDиндуцированных побочных эффектов. Термин "терапевтически эффективное" определяет количество каждого агента, предназначенное для использования в комбинационной терапии, которое обеспечивает достижение улучшенного действия в отношении тяжести и частоты заболевания по сравнению с лечением каждым из агентов в отдельности, причем при этом удается избежать проявления нежелательных побочных эффектов, обычно связанных с применением альтернативных терапий. Термин "комбинационная терапия" (или"сотерапия"), используемая для определения использования агента, являющегося ингибитором циклооксигеназы-2 и другого агента, включает последовательное введение каждого агента в таком режиме, который будет обеспечивать полезное действие от комбинации лекарств, а также включает совместное введение таких агентов практически одновременно, например, в виде одной капсулы с фиксированным соотношением таких активных агентов, или в виде большого числа отдельных капсул для каждого агента. Термин "пролекарство" относится к соединениям, которые являются предшественниками лекарства и которые после введения объекту и последующей абсорбции превращаются в активные соединения in vivo посредством некоторых процессов, например метаболического процесса. Другие продукты процесса превращения легко выводятся организмом. Наиболее предпочтительные пролекарства дают в процессе превращения продукты, которые обычно считаются безопасными. Предпочтительный класс соединений, которые ингибируют циклооксигеназу-2, включает соединения формулы I, в которых А представляет заместитель в кольце, выбранный из циклопентенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где А необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-С 10 алкила, гало-С 1 С 6 алкила, C1-C6-гидроксиалкила, C1-С 10 алкилкарбонилокси-С 1-С 10 алкила и оксогруппы;R1 представляет радикал, выбранный из пиридила и фенила; где R1 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1-С 10 алкила, галогена и C1-С 6 алкокси; где R2 представляет водород; и где R3 представляет радикал, выбранный изC1-С 10 алкила, C1-С 10 алкилкарбонила, бензоила,формила, карбокси-С 1-С 10 алкила, карбокси-С 1 С 10 алкилкарбонила, C1-С 6 алкоксикарбонила, С 1 С 6 алкокси-С 1-С 10 алкилкарбонила, C1-С 6 алкоксикарбонил-С 1-С 10 алкилкарбонила, C1-С 6 алкоксикарбонилкарбонила, амино-С 1-С 10 алкилкарбонила и C1-С 10 алкилкарбониламино-С 1-С 10 алкилкарбонила; или его фармацевтически приемлемая соль. Более предпочтительный класс соединений, которые ингибируют циклооксигеназу-2,включает соединения формулы I, в которых А представляет собой заместитель в кольце, выбранный из циклопентенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где А необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из метила,трифторметила, дифторметила, гидроксиметила,ацетоксиметила и оксогруппы;R1 представляет радикал, выбранный из пиридила и фенила; где R1 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из метила, фтора, хлора и метокси;R2 представляет водород; и где R3 представляет радикал, выбранный из метила, метилкарбонила, этилкарбонила,пропилкарбонила, изопропилкарбонила, бутилкарбонила, трет-бутилкарбонила, пентилкарбонила, бензоила, формила, карбоксиметила, карбоксиэтилкарбонила, метоксикарбонила, третбутоксикарбонила,метоксиметилкарбонила,метоксиэтилкарбонила, этоксиметилкарбонила,метоксикарбонилметилкарбонила, метоксикарбонилэтилкарбонила, метоксикарбонилкарбонила, аминометилкарбонила и метилкарбониламинометилкарбонила; или его фармацевтически приемлемая соль. Формула I включает подкласс соединений,представляющих большой интерес, которые могут быть представлены формулой II где А представляет заместитель в кольце, выбранный из С 4-С 8 циклоалкенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где А необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из С 1 7 С 20 алкила, гало-C1-С 20 алкила, гидрокси-С 1 С 20 алкила, С 1-С 20 алкилкарбонилокси-С 1-С 20 алкила и оксогруппы; где R4 представляет радикал, выбранный из пиридила и фенила; где R4 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из С 1-С 20 алкила, галогена и C1-С 10 алкокси; и где R5 представляет радикал, выбранный из водорода, С 1-С 20 алкила, фенила, карбокси-С 1 С 20 алкила, C1-С 10 алкокси, С 1-С 10 алкокси-С 1 С 20 алкила, C1-С 10 алкоксикарбонил-С 1-С 10 алкила,С 1-С 20 алкоксикарбонила, амино-С 1-С 20 алкила иC1-С 20 алкилкарбониламино-С 1-С 20 алкила; или его фармацевтически приемлемая соль. Предпочтительный класс соединений включает такие соединения формулы II, в которых А представляет собой заместитель в кольце,выбранный из циклопентенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где А необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из C1 гало-С 1-С 6 алкила,гидрокси-С 1 С 10 алкила,С 6 алкила, С 1-С 10 алкилкарбонилокси-С 1-С 10 алкила и оксогруппы; где R4 предсталяет радикал, выбранный из пиридила и фенила; где R4 необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными изC1-С 10 алкила, галогена и C1-С 6 алкокси; и где R5 представляет радикал, выбранный из водорода, C1-С 10 алкила, фенила, карбокси-С 1 С 10 алкила, C1-С 6 алкокси, С 1-С 6-алкокси-С 1-С 10 алкила, C1-С 6-алкоксикарбонил-С 1-С 10 алкил, C1 С 6 алкоксикарбонила, амино-С 1-С 10 алкила и C1 С 10 алкилкарбониламино-С 1-С 10 алкила; или его фармацевтически приемлемая соль. Класс соединений, представляющих особенный интерес, включает соединения формулыII, в которых А представляет собой заместитель в кольце, выбранный из циклопентенила, фурила, имидазолила, изоксазолила, оксазолила, пиразолила и пирролила; где А необязательно замещен в доступном для замещения положении одним или более радикалами, выбранными из метила, трифторметила, дифторметила, гидроксиметила, ацетоксиметила и оксогруппы;R4 выбирают из пиридила и фенила; где R4 необязательно замещен в доступном для замещения положении одним или более радикалами,выбранными из метила, фтора, хлора и метокси; и 8 нила, аминометила и метилкарбониламинометила; или его фармацевтически приемлемая соль. Формула I включает подкласс соединений,представляющих большой интерес, представленных формулой III где R6 представляет радикал, выбранный из C1 С 10 алкила, гало-С 1-С 6 алкила и C1-С 6 гидроксиалкила; где R7 представляет радикал, выбранный из водорода и галогена; и где R8 представляет радикал, выбранный из водорода, C1-С 10 алкила, C1-С 6 алкокси, C1 С 10 алкоксиалкила, фенила, C1-С 10 карбоксиалкила, C1-С 6 алкоксикарбонилалкила, C1-С 6 алкоксикарбонила, C1-С 10 аминоалкила и C1-С 10 алкилкарбониламиноалкила. Предпочтительный класс соединений включает соединения формулы III, в которых R6 представляет радикал, выбранный из метила,дифторметила и гидроксиметила; в котором R7 представляет собой радикал, выбранный из водорода и фтора;R8 выбирают из водорода, метила, этила,пропила, изопропила, бутила, трет-бутила, пентила, метокси, трет-бутокси, метоксиметила,метоксиэтила, этоксиметила, фенила, карбоксиэтила, метоксикарбонилметила, метоксикарбонилэтила, метоксикарбонила, аминометила и метилкарбониламинометила; или его фармацевтически приемлемая соль. Группа отдельных соединений, представляющих особенный интерес, отвечающих формулам I-III, включает следующие соединения и их фармацевтически приемлемые соли.N-4-(3-фенил-2,3-дигидро-2-оксофуран 4-ил)фенил]сульфонил]пропанамид. Предпочтительная группа отдельных соединений, представляющих особенный интерес,отвечающих формулам I-III, включает следующие соединения: натриевую соль N-4-[2-(2-метилпиридин 6-ил)-4-(трифторметил)-1 Н-имидазол-1-ил] фенил]сульфонил]ацетамида; натриевую соль N-4-[2-(2-метилпиридин 6-ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил]сульфонил]пропанамида; натриевую соль N-4-[2-(2-метилтиазол)4-(трифторметил)-1 Н-имидазол-1-ил]фенил] сульфонил]ацетамида; натриевую соль N-4-[2-(2-метилтиазол-4 ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил] сульфонил]пропанамида; натриевую соль N-4-[2-(4-метилтиазол-2 ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил] сульфонил]ацетамида; натриевую соль N-4-[2-(4-метилтиазол-2 ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил] сульфонил]пропанамида; натриевую соль N-4-[2-(3-пиридинил)-4(трифторметил)-1 Н-имидазол-1-ил]фенил] сульфонил]ацетамида; натриевую соль N-4-[2-(5-метилпиридин 3-ил)-4-(трифторметил)-1 Н-имидазол-1-ил) фенил]сульфонил]ацетамида; натриевую соль N-4-[2-(2-метилпиридин 3-ил)-4-(трифторметил)-1 Н-имидазол-1-ил] фенил]сульфонил]ацетамида; натриевую соль N-4-[2-(5-мeтилпиpидин 3-ил)-4-(трифторметил)-1 Н-имидазол-1-ил] фенил]сульфонил]бутанамида; натриевую соль N-4-[2-(2-метилпиридин 3-ил)-4-(трифторметил)-1 Н-имидазол-1-ил] фенил]сульфонил]бутанамида;[4,3-с]пиразол-1-ил]фенил]сульфонил]ацетамида; натриевую соль N-4-[3-(дифторметил)-5(3-фтор-4-метоксифенил)-1 Н-пиразол-1-ил] фенил]сульфонил]ацетамида; натриевую соль N-4-(2-метил-4-фенилоксазол-5-ил)фенил]сульфонил]ацетамида; натриевую соль метил 4-(5-метил-3 фенилизоксазол-4-ил)фенил]сульфонил]амино] оксоацетата; натриевую соль 2-метокси-N-4-(5-метил 3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамида; натриевую соль N-4-(5-дифторметил-3 фенилизоксазол-4-ил)фенил]сульфонил]пропанамида; натриевую соль N-4-(5-дифтopмeтил-3 фeнилизoкcaзoл-4-ил)фенил]сульфонил]бутанамида; натриевую соль 4-4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-4 оксобутановой кислоты; натриевую соль N-4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]формамида; натриевую соль 1,1-диметилэтил-N-4-(5 метил-3-фенилизоксазол-4-ил)фенил]сульфонил]карбамата; натриевую соль N-4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]глицина; натриевую соль 2-амино-N-4-(5-метил-3 фенилизоксазол-4-ил)фенил]сульфонил]ацетамида; натриевую соль 2-ацетиламино-N-4-(5 метил-3-фенилизоксазол-4-ил)фенил]сульфонил]ацетамида; натриевую соль метил 4-4-(5-метил-3 фенилизоксазол-4-ил)фенил]сульфонил]амино]4-оксобутаноата; натриевую соль N-4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]карбамата; натриевую соль 4-4-(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-4 оксобутановой кислоты; натриевую соль N-4-[5-(4-метилфенил-3 трифторметил)-3-трифторметил-1 Н-пиразол-1 ил]фенил]сульфонил]ацетамида; натриевую соль метил 3-4-(5-метил-3 фенилизоксазол-4-ил)фенил]сульфонил]амино]3-оксопропаноата; натриевую соль N-4-[5-гидроксиметил-3 фенилизоксазол-4-ил]фенил]сульфонил]ацетамида; 14 натриевую соль N-4-(5-ацетоксиметил-3 фенилизоксазол-4-ил)фенил]сульфонил]ацетамида; натриевую соль 1,1-диметилэтил-N-[2-4(5-метил-3-фенилизоксазол-4-ил)фенил]сульфонил]амино]-2-оксоэтил]карбамата; натриевую соль N-4-[2-(3-хлор-4-фторфенил)циклопентен-1-ил]фенил]сульфонил] ацетамида; и натриевую соль N-4-[3-(4-фторфенил)2,3-дигидро-2-оксофуран-4-ил]фенил]сульфонил]ацетамида; натриевую соль N-4-(3-фенил-2,3-дигидро-2-оксофуран-4-ил)фенил]сульфонил]ацетамида; натриевую соль N-4-(3,4-диметил-1 фенил-1 Н-пиразол-5-ил)фенил]сульфонил]пропанамида; натриевую соль N-4-[2-(2-метилпиридин 3-ил)-4-трифторметилимидазол-1-ил]фенил] сульфонил]пропанамида; натриевую соль N-4-[3-(4-фторфенил)2,3-дигидро-2-оксофуран-4-ил]фенил]сульфонил]пропанамида; и натриевую соль N-4-(3-фенил-2,3-дигидро-2-оксофуран-4-ил)фенил]сульфонил]пропанамида. Атом водорода может быть присоединен,например, к атому кислорода с образованием гидроксильного радикала, или два атома водорода могут быть присоединены к атому углерода с образованием метиленового (-СН 2-) радикала. При использовании в тексте отдельно или в таких терминах, как "галоалкил", "алкоксиалкил" и "гидроксиалкил", термин "алкил" обозначает линейные или разветвленные радикалы,содержащие от одного до примерно двадцати углеродных атомов или предпочтительно от одного до примерно двенадцати углеродных атомов. Более предпочтительные алкильные радикалы представляют собой "низшие алкильные" радикалы, содержащие от одного до примерно десяти углеродных атомов. Самыми предпочтительными являются низшие алкильные радикалы, содержащие примерно шесть углеродных атомов. Примерами таких радикалов могут служить метил, этил, нпропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил, пентил, изоамил, гексил и т.п. Термин "циклоалкил" обозначает насыщенные карбоциклические радикалы, содержащие от трех до двенадцати углеродных атомов. Более предпочтительными циклоалкильными радикалами являются "низшие циклоалкильные" радикалы, содержащие от трех до восьми углеродных атомов. Примеры таких радикалов включают циклопропил, циклобутил, циклопентил и циклогексил. Термин "циклоалкенил" обозначает частично ненасыщенные карбоциклические радикалы, содержащие от трех до двена 15 дцати углеродных атомов. Более предпочтительными циклоалкенильными радикалами являются "низшие циклоалкенильные радикалы",содержащие от четырех до восьми углеродных атомов. Примерами таких радикалов могут служить циклобутенил, циклопентенил и циклогексенил. Термин "гало" обозначает такие галогены, как фтор, хлор, бром и иод. Термин "галоалкил" обозначает радикалы, в которых один или более алкильных углеродных атомов замещены указанными выше атомами галогена. Специально этим термином обозначаются моногалоалкильные, дигалоалкильные, и полигалоалкильные радикалы. Так, например, моногалоалкильный радикал может включать атомы иода, брома, хлора или фтора. Дигало- и полигалоалкильные радикалы могут содержать два или более таких же атомов галогенов или комбинацию различных галорадикалов. Термин "низший галоалкил" обозначает радикалы, содержащие от одного до шести углеродных атомов. Примерами галоалкильных радикалов могут служить фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, тетрахлорметил, пентахлорметил, гептафторпропил, дифторхлорметил, дихлорфторметил, дифторэтил,дифторпропил, дихлорэтил и дихлорпропил. Термин "гидроксиалкил" обозначает и разветвленные алкильные радикалы, содержащие от одного до примерно десяти углеродных атомов,любой из которых может быть замещен одним или более гидроксильными радикалами. Более предпочтительными гидроксиалкильными радикалами являются "низшие гидроксильные" радикалы, содержащие от одного до шести углеродных атомов и один или более гидроксильных радикалов. Примерами таких радикалов могут служить гидроксиметил, гидроксиэтил, гидроксипропил, гидроксибутил и гидроксигексил. Термины "алкокси" и "алкилокси" обозначают линейные или разветвленные оксисодержащие радикалы, каждый из которых содержит в алкильной части от одного до примерно десяти углеродных атомов. Более предпочтительными алкоксирадикалами являются "низшие алкокси" радикалы, содержащие от одного до шести углеродных атомов. Примеры таких радикалов включают метокси, этокси, пропокси, бутокси и трет-бутокси. Термин "алкоксиалкил" обозначает алкильные радикалы, содержащие один или более алкокси радикалов, которые присоединены к алкильному радикалу, т.е. с образованием моноалкоксиалкильного и диалкильного радикалов. Такие "алкокси" радикалы могут быть дополнительно замещены одним или более атомами таких галогенов, как фтор, хлор или бром,с образованием галоалкокси радикалов. Более предпочтительными галоалкокси радикалами являются "низшие галоалкокси" радикалы, содержащие от одного до шести углеродных атомов и один или более галорадикалов. Примера 003319 16 ми таких радикалов могут служить фторметокси, хлорметокси, трифторметокси, трифторэтокси, фторэтокси, и фторпропокси. Термин "ацил" обозначает радикал, представляющий собой остаток после удаления гидроксила из органической кислоты. Примерами таких ацильных радикалов могут служить алканоильные и ароильные радикалы. Примеры таких алканоильных радикалов включают формил, ацетил, пропионил, бутирил, изобутирил,валерил, изовалерил, пивалоил, гексаноил, и радикалы, производные от янтарной, гликолевой, глюконовой, молочной, яблочной, винной,лимонной, аскорбиновой, глюкуроновой, малеиновой, фумаровой, пировиноградной, миндальной, пантотеновой, р-оксимаслянной, галактаровой и галактуроновой кислот. Термин "карбонил" независимо от того,используется ли он сам по себе или совместно с другими терминами, например в термине "алкоксикарбонил", обозначает группу -(С=O)-. Термин "карбокси" или "карбоксил", независимо от его использования как такового или с другими терминами, как это имеет место в термине"карбоксиалкил", обозначает группу -СO2 Н. Термин "карбоксиалкил" обозначает алкильные радикалы, замещенные карбокси радикалом. Более предпочтительным термином является"низший карбоксиалкил", который обозначает низшие алкильные радикалы, имеющие указанные выше значения, причем этот радикал может быть дополнительно замещен в алкильном радикале атомом галогена. Примеры таких низших карбоксиалкильных радикалов включают карбоксиметил, карбоксиэтил и карбоксипропил. Термин "алкоксикарбонил" обозначает радикал, содержащий алкокси радикал, имеющий указанные выше значения, присоединенный через атом кислорода к карбонильному радикалу. Более предпочтительными являются "низшие алкоксикарбонильные" радикалы, алкильные фрагменты которых имеют от одного до шести атомов углерода. Примеры таких низших алкоксикарбонильных (сложноэфирных) радикалов включают замещенные или незамещенные метоксикарбонил, этоксикарбонил, бутоксикарбонил и гексилоксикарбонил. Термин "алкилкарбонил" включает радикалы, содержащие алкильный,гидроксиалкильный радикалы,имеющие указанные выше значения, присоединенные к карбонильному радикалу. Примерами таких радикалов могут служить замещенные и незамещенные метилкарбонил, этилкарбонил,пропилкарбонил, бутилкарбонил, пентилкарбонил, гидроксиметилкарбонил, гидроксиэтилкарбонил. Термин "карбоксиалкилкарбонил" обозначает алкилкарбонильные радикалы, замещенные карбоксирадикалом. Более предпочтительным термином является термин "низший карбоксиалкилкарбонил", который обозначает низшие алкильные радикалы, имеющие указанные выше значения, и этот радикал может быть 17 дополнительно замещен в алкильном радикале гидроксилом. Примеры таких низших карбоксиалкилкарбонильных радикалов включают карбоксиметилкарбонил,карбоксиэтилкарбонил,карбоксипропилкарбонил, НO2 С(СНОН)4 С(O)-,НO2 С(СНОН)2 С(O)-,НO2 ССН 2 С(ОН)(СO2 Н)С(O)-. Термин "аминоалкил" обозначает алкильные радикалы, замещенные амино радикалами. Более предпочтительным термином является термин "низший аминоалкил". Примеры таких радикалов включают аминометил, аминоэтил и т.п. Термин "алкиламино" обозначает аминогруппы, которые замещены одним или двумя алкильными радикалами. Предпочтительными являются "низшие алкиламино" радикалы,имеющие алкильные фрагменты, содержащие от одного до шести углеродных атомов. Подходящая низшая алкиламиногруппа может представлять собой монозамещенную N-алкиламино или дизамещенную N,N-алкиламино, например, Nметиламино, N-этиламино, N,N-диэтилaминo,N,N-диэтиламино и т.п. Термин "алкиламинокарбонил" обозначает аминокарбонильную группу, которая замещена одним или двумя алкильными радикалами по атому азота аминогруппы. Предпочтительными являются "N-алкиламинокарбонильный" и "N,Nдиалкиламинокарбонильный" радикалы. Более предпочтительными являются "низший Nалкиламинокарбонильный" и "низший N,Nдиалкиламинокарбонильный" радикалы с низшими алкильными фрагментами, имеющими указанные выше значения. Термин "алкиламиноалкил" обозначает радикалы, содержащие один или более алкильных радикалов, присоединенных к аминоалкильному радикалу. Настоящее изобретение включает фармацевтическую композицию, содержащую терапевтически эффективное количество соединения формулы I совместно, по крайней мере, с одним фармацевтически приемлемым носителем, адьювантом или разбавителем. Настоящее изобретение также включает способ лечения воспаления или связанного с воспалением расстройства у субъекта, который включает лечение субъекта, имеющего или чувствительного к такому воспалению или связанному с воспалением расстройству, соединением формулы I' в которой А представляет собой заместитель в кольце, выбранный из частично ненасыщенного гетероцикла, гетероарила, циклоалкенила и арила, причем А необязательно замещен в доступной для замещения позиции, одним или более радикалами, выбранными из алкилкарбонила,формила, гало, алкила, галоалкила, оксо, циано,нитро, карбоксила, алкокси, аминокарбонила, 003319 18 алкоксикарбонила, карбоксиалкила, цианоалкила, гидроксиалкила, галоалкилсульфонилокси,алкоксиалкилоксиалкила, карбоксиалкилоксиалкила, циклоалкилалкила, алкенила, алкинила,гетероциклилокси, алкилтио, циклоалкила, арила, гетероциклила, циклоалкенила, аралкила,гетероциклилалкила, алкилтиоалкила, арилкарбонила, аралкилкарбонила, аралкенила, алкоксиалкила,арилтиоалкила,арилоксиалкила,аралкилтиоалкила, арилоксиалкила, аралкилтиоалкила, аралкоксиалкила, алкоксикарбонилалкила, аминокарбонилалкила, алкиламинокарбонила, N-ариламинокарбонила, N-алкил-Nариламинокарбонила, алкиламинокарбонилалкила, алкиламино, N-ариламино, N-аралкиламино, N-алкил-N-аралкиламино, N-алкил-N-ариламино, аминоалкила, алкиламиноалкила, Nариламиноалкила, N-аралкиламиноалкила, Nалкил-N-аралкиламиноалкила, N-алкил-N-ариламиноалкила, арилокси, аралкокси, арилтио,аралкилтио, алкилсульфинил, алкилсульфонила,аминосульфонила, алкиламиносульфонила, Nариламиносульфонила, арилсульфонила и Nалкил-N-ариламиносульфонила; где R1 выбирают из гетероциклила, циклоалкила, циклоалкенила и арила, в которой R1 необязательно замещен в доступной для замещения позиции одним или более радикалами, выбранными из алкила,галоалкила, циано, карбоксила, алкоксикарбонила, гидроксила, гидроксиалкила, галоалкокси,амино, алкиламино, ариламино, нитро, алкоксиалкила, алкилсульфинила, гало, алкокси, и алкилтио; в которой R2 выбирают из гидридо и алкоксикарбонилалкила; и в которой R3 выбирают из алкила, карбоксиалкила, ацила, алкоксикарбонила, гетероарилкарбонила, алкоксикарбонилалкилкарбонила, алкоксикарбонилкарбонила, аминокислотного остатка, и алкилкарбониламиноалкилкарбонила; или фармацевтически применимыми солями таких соединений. Способ настоящего изобретения также включает профилактическое лечение. Предпочтительный способ изобретения включает и введение водорастворимых соединений формул IIII инъекцией. Группа соединений формулы I также включает их стереоизомеры. Соединения настоящего изобретения могут иметь один или более асимметричных атомов углерода и, таким образом, способны существовать в виде оптических изомеров, а также в виде их рацемических и нерацемических смесей. В соответствии с этим, некоторые из соединений настоящего изобретения могут находиться в виде рацемических смесей, которые также входят в объем настоящего изобретения. Оптические изомеры могут быть получены разделением рацемических смесей в соответствии с известным способом, например, с помощью образования диастереомерных при обработке оптически активной кислотой или солей основанием. Примерами подходящих кислот могут служить винная кислота, 19 диацетилвинная, дибензоилвинная, дитолуолвинная и камфосульфоновая кислота, с последующим разделением смеси диастереоизомеров кристаллизацией с последующим выделением оптически активных оснований из таких солей. Другой способ разделения оптических изомеров включает использование хиральной хроматографической колонки, оптимально выбранной таким образом, чтобы максимизировать разделение энантиомеров. Еще один доступный способ разделения включает синтез ковалентных диастереоизомерных молекул реакцией аминной функциональной группы предшественников соединений формулы I с оптически чистой кислотой в активированной форме или с оптически чистым изоцианатом. Альтернативно, диастереомерные производные могут быть получены реакцией карбоксильной функциональной группы предшественников соединений формулы I с оптически чистым аминным основанием. Синтезированные диастереоизомеры могут быть разделены такими традиционными методами, как хроматография, дистилляция, кристаллизация и сублимация, с последующим гидролизом с получением энантиомерно чистого соединения. Оптически активные соединения формулы I могут быть также получены с использованием оптически активных исходных материалов. Такие изомеры могут находиться в виде свободной кислоты, свободного основания,сложного эфира, или соли. В группу соединений формулы I также входят их фармацевтически приемлемые соли. Термин "фармацевтически приемлемые соли" обозначает соли, которые обычно используют для получения солей щелочных металлов и для получения солей присоединения свободных кислот или свободных оснований. Природа такой соли не имеет решающего значения, при условии, что она является фармацевтически приемлемой. Фармацевтически приемлемые соли присоединения кислот соединений формулы I могут быть получены с неорганической кислотой или с органической кислотой. Примерами таких неорганических кислот могут служить хлористоводородная, бромисто-водородная, иодистоводородная, азотная, угольная, серная и фосфорная кислота. Подходящие органические кислоты могут быть выбраны из алифатической,циклоалифатической, ароматической, аралифатической, гетероциклической, карбоновой и серной органических кислот, примерами которых могут служить муравьиная, уксусная, пропионовая, янтарная, гликолевая, глюконовая,молочная, яблочная, винная, лимонная, аскорбиновая, глюкуроновая, малеиновая, фумаровая,пировиноградная, аспаргиновая, глутаминовая,антраниловая, мезиловая, стеариновая, салициловая, р-гидроксибензойная, фенилуксусная,миндальная, памовая, метансульфоновая, этансульфоновая, бензолсульфоновая, пантотеновая,толилсульфоновая, 2-гидроксиэтансульфоновая, 003319 20 сульфаниловая, циклогексиламиносульфоновая,альгеновая, -гидроксимасляная, галактаровая,и галактуроновая кислоты. Подходящие фармацевтически приемлемые соли присоединения основания соединений формулы I включают соли металлов и органические соли. Более предпочтительные соли металлов, но ограничиваются ими, соответствующие соли металлов(группы IIа) и других физиологически приемлемых металлов. Такие соли могут быть получены с алюминием, кальцием, литием, магнием, калием, натрием и цинком. Предпочтительные органические соли могут быть получены третичными аминами и солями четвертичного аммония,включая, в частности, трометамин, диэтиламин,N,N-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглюмин(N-метилглюкамин) и прокаин. Все такие соли могут быть получены традиционными способами из соответствующего соединения, отвечающего формулам I-III, реакцией, например, соответствующей кислоты и основания с соединением формул I-III. Общие методики синтеза Пролекарства изобретения, являющегося ингибиторами циклооксигеназы-2 могут быть синтезированы в соответствии со следующими методиками по схемам I-XVII, в которых заместители R1-R8 имеют значения, указанные для формул I-III выше, за исключением специально указанных случаев. Схема I На схеме синтеза I показано получение соединений ингибиторов циклооксигеназы-2, как это описано в WO 95/15316, включенный сюда в качестве ссылки. На стадии 1, кетон 1 обрабатывают основанием, предпочтительно NaOMe или NaH, и сложным эфиром или сложноэфирным эквивалентом с образованием промежуточного дикетона 2 (в енольной форме), который далее используют без дополнительной очистки. На стадии 2, дикетон 2 в безводном протонном растворителе, таком как абсолютный этанол или уксусная кислота, обраба 21 тывают гидрохлоридом или свободным основанием замещенного гидразина при температуре кипения, с получением смеси пиразолов 3 и 4. В результате перекристаллизации или хроматографической очистки получали 3, обычно в виде твердого вещества. Аналогичные пиразолы могут быть получены методами, описанными в патентах США 5401765, 5434178, 4146721, 5051518,5134142, и 4914121, которые также включены сюда в качестве ссылки. Схема II На схеме II продемонстрирована 4 стадийная методика получения пиразолов 8,являющихся ингибиторами циклооксигеназы-2,описанная в патенте США 5486534 (где Ra представляет собой гидридо или алкил) из кетонов 5. На стадии 1 кетон 5 реагирует с таким основанием, как литий-бис(триметилсилил) амид или литийдиизопропиламид (LDA) с образованием аниона. На стадии 2 такой анион реагирует с ацетиллирующим агентом с получением дикетона 6. На стадии 3 реакцией дикетона 6 с гидразином или замещенным гидразином получают пиразол 7. На стадии 4 пиразол 7 окисляют окисляющим реагентом, таким как Охоnе(пероксимоносульфат калия),3-хлорпербензойная кислота (МСРВА) или пероксид водорода, с получением смеси целевого 3(алкилсульфонил)фенилпиразола 8 и 5-(алкилсульфонил)фенилпиразольного изомера. Сульфонамиды 9 могут быть получены, например, по методу Huang [Tet. Lett., 35,7201-04(1994)]. Альтернативно, дикетон 6 может быть получен из кетона 5 обработкой таким основанием, как гидрид натрия, в таком растворителе,как диметилформамид, и дополнительной реакции с нитрилом с образованием аминокетона. В результате обработки аминокетона кислотой образуется дикетон 6. Аналогичные пиразолы могут быть получены по методам, описанным в патенте США 3984431, которые включены сюда в качестве ссылки.S, a Rb представляет собой алкил) могут быть получены способами, описанными в патентах США 4427693, 4302461, 4381311, 4590205,и 4820827 и в документах PCT WO 95/00501 иWO 94/15932, которые включены сюда в качестве ссылки. Аналогичные пирролы (в которых Т представляет собой N), фураноны и фураны(где Т представляет собой О) могут быть получены методами, описанными в документах PCT 23 Ингибиторы циклооксигеназы-2-диарил/ гетероарил оксазолы могут быть получены способами, описанными в патентах США 5380738, 3743656, 3644499 и 3647858, а также в заявках РСТ WO 95/00501 и WO 94/27980, которые включены сюда в качестве ссылки. Схема V Ингибиторы циклооксигеназы-2-диарил/ гетероарил изоксазолы могут быть получены методами, описанными в заявке РСТUS 96/01869, заявках РСТ WO 92/05162 и WO 92/19604, а также в Европейской публикации ЕР 26928, которые включены сюда в качестве ссылки. Сульфонамиды 27 могут быть получены из гидратированного изоксазола 26 в соответствии с двухстадийной методикой. На первой стадии гидратированный изоксазол 26 обрабатывают при примерно 0 С двумя или тремя эквивалентами хлорсульфоновой кислоты с образованием соответствующего сульфонилхлорида. На второй стадии полученный таким образом сульфонилхлорид обрабатывают концентрированным аммиаком с получением сульфонамидного производного 27. Схема VI 24 На схеме VI продемонстрировано трехстадийное получение имидазолов 33, являющихся ингибиторами циклооксигеназы-2. На стадии 1 реакцией замещенных нитрилов(R1CN) 28 с первичными фениламинами 29 в присутствии таких алкилалюминиевых реагентов, как триметиламин, триэтиламин, хлористый диметилалюминий, хлористый диэтилалюминий и в присутствии таких инертных растворителей, как толуол, бензол и ксилол,получали амидины 30. На стадии 2 реакцией амидина 30 с 2-галокетонами (где Х представляет собой Вr или Сl) в присутствии таких оснований, как бикарбонат натрия, карбонат калия, карбонат натрия, бикарбонат калия или таких затрудненных третичных аминов, какN,N'-диизопропилэтиламин, получали 4,5 дигидроимидазолы 31 (где Rb представляет собой алкил). Некоторые из подходящих растворителей для такой реакции представляют собой изопропанол, ацетон и диметилформамид. Такую реакцию можно проводить при температуре 20-90 С. На стадии 3 4,5 дигидроимидазолы 31 могут быть подвергнуты дегидратации в присутствии такого катализатора, как 4-толуол-сульфокислота или минеральные кислоты, с образованием 1,2 дизамещенных имидазолов 32 изобретения. Подходящие для такой дегидратации растворители включают, например, толуол, ксилол и бензол. На этой стадии дегидратации трифторуксусная кислота может использоваться в качестве, как растворителя, так и катализатора. Сульфонамиды 33 могут быть получены по методу Huang [Tet. Lett., 35, 7201-04(1994)]. В некоторых случаях (например, когда R = метил или фенил) бывает трудно выделить промежуточное соединение 31. При описанных выше условиях, реакция протекает с непосредственным образованием целевых имидазолов. Аналогичным образом, могут быть получены имидазолы, содержащие сульфонилфенильный фрагмент, присоединенный в положении 2, и R1, присоединенный к атому азота в положении 1. Диарил/гетероарильные имидазолы могут быть получены способами, описанными в патенте США 4822805 и документах РСТ WO 93/14082 и WO 96/03388, которые включены сюда в качестве ссылки. Соединения 41, являющиеся ингибиторами циклооксигеназы-2, могут быть синтезированы в соответствии с последовательностью реакций, показанной на схеме VII. Альдегид 34 может быть превращен в защищенный цианогидрин 35 реакцией с триалкилсилилцианидом,таким как триметилсилилцианид(KCN). Реакцией цианогидрина 35 с сильным основанием с последующей обработкой бензальдегидом 36 и применением обработки как кислотой, так и основанием, в указанном порядке получали бензоин 37. Примерами сильных оснований, подходящих для такой реакции могут служить диизопропиламид лития(LDA) и гексаметилдисилазан лития. Бензоин 37 может быть превращен в бензин 38 реакцией с подходящим окисляющим агентом, таким как оксид висмута или диоксид марганца, или окислением по Swern с использованием диметилсульфоксида (DMSO) и трифторуксусного ангидрида. Бензил 38 может быть получен непосредственно реакцией аниона 35 с галогенидом замещенной бензойной кислоты. Любое из соединений 37 и 38 может использоваться в качестве промежуточных соединений для превращения в имидазолы 39 в соответствии с химическими методами, известными специалисту в данной области и описанными 26 104 (1970). Превращение 38 в имидазолы 39 осуществляются реакцией с ацетатом аммония и подходящим альдегидом (RCHO) в среде уксусной кислоты. Бензоин 37 может быть превращен в имидазолы 39 реакцией с формамидом. Кроме этого, бензоин 37 может быть превращен в имидазолы ацилированием соответствующей ацильной группой (RCO-), с последующей обработкой гидроксидом аммония. Специалисту в данной области известно,что окисление сульфида в сульфон может быть осуществлено в любой момент, начиная с соединений 36, и оно включает окисление имидазолов 39, с использованием, например,таких реагентов, как пероксид водорода в уксусной кислоте, м-хлорнадбензойная кислота(МСРВА) и пероксимоносульфат калия (OXONE). Сульфонамиды 41 могут быть получены по методу Huang [Tet.Lett., 35, 720104(1994)]. Диарил/гетероарильные имидазолы могут быть получены в соответствии со способами,описанными в патентах США 3707475,4686231, 4503065, 4472422, 4372964, 4576958,3901908, в заявке РСТUS 95/09505, в европейской публикации ЕР 372445 и заявке РСТWO 95/00501, которые включены сюда в качестве ссылки. Схема VIII Диарил/гетероарильные ингибиторы циклопентен циклогексеназы-2 могут быть получены способом, описанным в патенте США 5344991 и заявке РСТ WO 95/00501, которые включены сюда в качестве ссылки.IX показана методика получения агентовингибиторов 51, являющихся ингибиторами 1,2 диарилбензол циклооксигеназы-2 из 2-бромбифенильных промежуточных соединений 49(полученных аналогично тому, как описано для схемы синтеза VIII) и соответствующих замещенных фенилбороновых кислот. В соответствии с методом сочетания, аналогично разработанному Suzuki с сотр. [Sinth. Commun.,11,513(1981), промежуточные соединения 49 реагируют с бороновыми кислотами в среде толуол/этанол при температуре кипения, в присутствии катализатора на основе Pd, например, тетракис(трифенилфосфин)палладия(О), и 2 М карбоната натрия с получением 1,2-диарилбензольных противовоспалительных агентов 50 настоящего изобретения. Сульфонамиды 51 могут быть получены, например, по методу Huang[Tet. Lett., 35, 7201-04 (1994)]. Такие терфенильные соединения могут быть получены по методам, описанным в заявке США 08/346433, которая включена сюда в качестве ссылки. Схема Х Диарил/гетероарильные ингибиторы тиазолциклогеназы-2 могут быть получены по способам, описанным в патентах США 4051250,4632930, европейской заявке ЕР 592664 и заявках PCT WO 96/03392 и WO 95/00501, которые включены сюда в качестве ссылки. Изотиазолы могут быть получены по способу, описанному в заявке PCT WO 95/00501. Диарил/гетероарильные пиридиновые ингибиторы циклооксигеназы-2 могут быть полу 003319 Схема синтеза XI иллюстрирует способ получения ацилированных сульфонамидов 57. Такой способ включает обработку незамещенного сульфонамида 56 таким подходящим агентом, как ангидрид, хлорангидрид, ацилимидазол или активный сложный эфир, в присутствии основания и такого подходящего растворителя,как тетрагидрофуран (TGF) с образованием ацилированного сульфонамида 57. Затем продукт 57 может быть выделен хроматографией или кристаллизацией. Схема XII В схеме синтеза XII показан способ получения соответствующей соли соединения 57. В результате обработки 57 таким подходящим сильным основанием, как гидроксид натрия,гидроксид калия, гидроксид кальция и т.п., получали соответствующую солевую форму 58. Может использоваться большое число растворителей при условии, что они не реагируют с добавленным сильным основанием, причем предпочтительными растворителями являются этанол и тетрагидрофуран. Схема XIII Схема синтеза XIII демонстрирует способ,используемый для получения замещенных сульфонамидов 60. Эта стадия включает обработку подходящего хлористого сульфонила 59 амином с получением замещенного сульфонамида 59. В качестве амина может использоваться первичный амин (R3NH2) или вторичный амин (R3R2NH). Обычно реакцию проводят в присутствии добавленного основания. Такая реакция также может проводиться в присутствии избытка амина. В условиях избытка амина,амин выполняет функции как нуклеофила, так и основания. Схема XIV Схема синтеза XIV демонстрирует способ,который используется для синтеза N 29 замещенных ацилсульфонамидов 61. Такая методика включает обработку соли ацилированного сульфонамида 58 галоидным алкилом (R2-X) с получением соответствующего N-алкилированного ацилсульфонамида 61. Такой способ может проводиться в большом числе растворителей, которые в большей части являются электрофилами. Схема XV Схема синтеза XV иллюстрирует способ,используемый для синтеза некоторых Nацилированных сульфонамидов 57. Такой способ заключается в обработке сульфонамида 56 избытком ангидрида, хлорангидрида или карбамилхлорида в присутствии третичного аминного основания с получением соответствующего бис(N-ацилированного) сульфонамида 62. Такой бис(N-ацилированный) сульфонамид 62 далее обрабатывают двумя эквивалентами такого сильного основания, как гидроксид натрия, с получением натриевой соли 58. Схема XVI Схема синтеза XVI иллюстрирует способ,который используется для синтеза некоторых Nалкилированных пирролсульфонамидов. Спирт 65 синтезировали в соответствии с описанной методикой (J. Org. Chem. 57, 2195, 1992). Спирт 65 окисляли, например, обработкой хлористым оксалилом в таком подходящем растворителе,как хлористый метилен или DMSO. Добавление,например, реагентов Гриньяра приводит к образованию 67. В результате окисления хлорохромиатом пиридиния получали кетоны 68. В результате конденсации с [(N-замещенным ами 003319 30 но)сульфонил]бензоламином в присутствии птолуолсульфокислоты получали замещенный пирролсульфонамид 69. Схема XVII Схема синтеза XVII иллюстрирует способ получения ацилированных изоксазолсульфонамидов 71. Такая стадия заключается в обработке незамещенного сульфонамида 70 таким подходящим ацилирующим агентом, как ангидрид,хлорангидрид, ацил имидазол, или активный сложный эфир, с образованием ацилированного сульфонамида 71. Продукт 71 может быть выделен методом хроматографии или кристаллизацией. Следующие ниже примеры включают детальные описания способов получения соединений формул I-III. Такие подробные описания включены в объем изобретения и служат примерами описанных выше общих методик синтеза, которые составляют часть изобретения. Такие детальные описания представлены лишь в целях иллюстрации и не ограничивают объем изобретения. Все части даны в весовом выражении, а температуры - в градусах Цельсия, если не указано особо. Все соединения имели спектры ЯМР, согласующиеся с предлагаемыми структурами. Используются следующие сокращения: НСl - хлористо-водородная кислота,DMSO - диметилсульфоксид,DMSO-d6 - дейтерированный диметилсульфоксид,CDCl3 - дейтерированный хлороформ,MgSO4 - сульфат магния,NaHCO3 - бикарбонат натрия,KHSO4 - бисульфат калия,DMF - диметилформамид,NaOH - гидроксид натрия,ВОС - трет-бутилоксикарбонил,CD3OD - дейтерированный метанол,EtOH - этанол,LiOH - гидроксид лития,CH2Cl2 - хлористый метилен,Н - час,Нr - час,Min - минуты,TGF - тетрагидрофуран,TLC - тонкослойная хроматография,Et3N - триэтиламин,DBU - 1,8-диазобицикло[5.4]ундец-7-ен,DMAP - 4-диметиламинопиридин.N-4-[2-(3-пиридинил)-4-(трифторметил)1 Н-имидазол-1-ил]фенил]сульфонил]ацетамид. Смесь, состоящую из 4-[2-(пиридин-3-ил)4-(трифторметил)-1 Н-имидазол-1-ил]бензосульфонамида (0,5 г, 1,36 ммоль), уксусного ангидрида (0,42 г, 4,1 ммоль), 4-диметиламинопиридина (DMAP) (0,083 г, 0,68 моль) и триэтиламина (0,17 г, 1,6 ммоль) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли 50 мл воды и экстрагировали этилацетатом. Органический слой промывали водой, рассолом, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали в вакууме и остаток перекристаллизовывали из этилацетата и гексана с образованием 0,5 гN-4-[2-(3-пиридинил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил]сульфонил] ацетамида в виде бесцветного твердого вещества: т.пл. (DSC): 244-246 С. Элементарный анализ: Вычислено для С 17 Н 13F3N4O3S: С,49.76; Н,3.19; N, 13.65; S, 7.81; Найдено: С, 49.66; Н, 3.06; N, 13.55; S,8.11. Пример 2.(0,09 г, 1,6 ммоль) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли 50 мл воды и экстрагировали этилацетатом. Органический слой промывали водой, рассолом, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали в вакууме, а остаток перекристаллизовывали из этилацетата и гексана с образованием 0,4 гN-4-[2-5-метилпиридин-3-ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил]сульфонил]ацетамида в виде бесцветного твердого вещества: т.пл. (DSC) 268-270C. Элементный анализ: Вычислено для C18H15F3N4O3S: С, 50.94; Н,3.56; N, 13.20; S, 7.56. Найдено: С, 50.68; Н, 3.47; N, 12.53; S,7.43. Пример 4.N-4-[2-(3-пиридил)-4(трифторметил)-1 Н-имидазол-1-ил]фенил]сульфонил]ацетамида (пример 1) (0,41 г, 1,0 ммоль) в 10 мл абсолютного этанола добавляли раствор гидроксида натрия (0,04 г, 1,0 ммоль) в 0,4 мл этанола. Смесь перемешивали при комнатной температуре в течение 10 мин. Растворитель выпаривали в вакууме и остаток сушили в высоком вакууме с образованием 0,33 г (76%) натриевой соли N-4-[2-(3-пиридил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил]сульфонил] ацетамида в виде белого порошка: т.пл. (DSC): 291C (разл.). Элементарный анализ: Вычислено для C17H12F3N4O3SNa0,5 Н 2 О: С, 46.26, Н, 2.97; N, 12.69; S, 7.26. Найдено: С, 45.88; Н, 3.02; N, 11.69; S, 713. Натриевая соль N-4-[2-(5-метилпиридин 3-ил)-4-(трифторметил)-1 Н-имидазол-1-ил] фенил]сульфонил]ацетамида. К суспензии N-4-[2-(5-метилпиридин-3 ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил] сульфонил]ацетамида (пример 3) (0,25 г, 0,6 ммоль) в 5 мл абсолютного этанола добавляли раствор гидроксида натрия (0,24 г, 0,6 ммоль) в 0,4 мл этанола. Смесь перемешивали при комнатной температуре в течение 10 мин. Растворитель выпаривали в вакууме и остаток сушили в высоком вакууме с образованием 0,25 г (95%) натриевой соли N-4-[2-(5-метилпиридин-3-ил)4-(трифторметил)-1 Н-имидазол-1-ил]фенил] сульфонил]ацетамида в виде белого порошка: т.пл. (DSC) 278-281C. Элементарный анализ: Вычислено для C18H14F3N4O3SNa1.0 Н 2 О: С, 46.55; Н, 3.47; N, 12.06; S, 6.90.(0,09 г, 0,7 ммоль) и триэтиламина (0,16 г, 1,6 ммоль) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли 50 мл воды и экстрагировали этилацетатом. Органический слой промывали водой, рассолом, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали в вакууме и остаток перекристаллизовывали из этилацетата и гексана с образованием 0,55 г (99%) N-4-[2(2-метилпиридин-3-ил)-1 Н-имидазол-1-ил] фенил]сульфонил]ацетамида в виде бесцветного твердого вещества: т.пл. (DSC) 243-245C. Элементный анализ: Вычислено для С 18 Н 15F3N4O3S: C, 50.94; Н,3.56; N, 13.20; S, 7.56. Найдено: С, 50.64; Н, 3.43; N, 12.64; S,7.37. Пример 6. Натриевая соль N-4-[2(2-метилпиридин 3-ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил]сульфонил]ацетамида. К суспензии N-4-[2-(2-метилпиридин-3 ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил] сульфонил]ацетамида (пример 5) (0,35 г, 0,83 ммоль) в 7,5 мл абсолютированного этанола добавляли раствор гидроксида натрия (0,33 г,0,83 ммоль) в 0,83 мл этанола. Смесь перемешивали при комнатной температуре в течение 10 мин. Растворитель выпаривали в вакууме и остаток сушили в высоком вакууме с образованием 0,37 г (99%) натриевой соли N-4-[2-(2 метилпиридин-3-ил)-4-(трифторметил)-1 Н-имидазол 1-ил]фенил]сульфонил]ацетамида в виде белого порошка: т.пл. (DSC) 313C (разл.). Элементный анализ:(0,09 г, 0,7 ммоль) и триэтиламина (0,16 г, 1,6 ммоль) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли 50 мл воды и экстрагировали этилацетатом. Органический слой промывали водой, рассолом, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали в вакууме и остаток перекристаллизовывали из этилацетата и гексана с образованием 0,50 г (85%) N-4-[2(5-метилпиридин-3-ил)-4-(трифторметил)-1 Нимидазол-1-ил]фенил]сульфонил]бутанамида в виде бесцветного твердого вещества: т.пл. Натриевая соль N-4-[2-(5-метилпиридин 3-ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил]сульфонил]бутанамида. К суспензии N-4-[2-(5-метилпиридин-3 ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил] сульфонил]бутанамида (пример 7) (0,31 г, 0,68 ммоль) в 5 мл абсолютного этанола добавляли раствор гидроксида натрия (0,28 г, 0,68 ммоль) в 0,68 мл этанола. Смесь перемешивали при комнатной температуре в течение 10 мин. Растворитель выпаривали в вакууме и остаток сушили в высоком вакууме с получением 0,28 г (78%) натриевой соли N-4-[2-(5-метилпиридин-3-ил)4-(трифторметил)-1 Н-имидазол-1-ил]фенил] сульфонил]бутанамида в виде белого порошка: т.пл. (DSC) 303 С (разл.).N-4-[2[(2-мeтилпиpидин-3-ил)-4(тpифтopмeтил)-1 Н-имидазол-1-ил]фенил] сульфонил]бутанамид. Смесь 4-[2-(2-метилпиридин-3-ил)-4(трифторметил)-1 Н-имидазол-1-ил]бензолсульфонамида (0,5 г, 1,3 ммоль), масляного ангидрида (0,62 г, 3,9 ммоль), DMAP (0,09 г, 0,7 ммоль) и триэтиламина (0,16 г, 1,6 ммоль) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли 50 мл воды и экстрагировали ацилацетатом. Органический слой промывали водой, рассолом, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали в вакууме и остаток перекристаллизовывали из этилацетата и гексана с получением 0,49 г (84%) N-4-[2-(2 метилпиридин-3-ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил]сульфонил]бутанамида в виде бесцветного твердого вещества: т.пл. (DSC) 250252 С. Элементный анализ: Вычислено для С 20 Н 19F3N4O3S: С, 53.09; Н,4.23; N, 12.38; S, 7.09. Найдено: С, 52.97; Н, 4.21; N, 11.07; S,7.11. Пример 10. Натриевая соль N-4-[2-(2-метилпиридин 3-ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил]сульфонил]бутанамида. К суспензии N-4-[2-(2-метилпиридин-3 ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил] сульфонил]бутанамида (пример 9) (0,3 г, 0,66 ммоль) в 5 мл абсолютированного этанола добавляли раствор гидроксида натрия (0,027 г,0,66 ммоль) в 0,66 мл этанола. Смесь перемешивали при комнатной температуре в течение 10 мин. Растворитель выпаривали в вакууме и остаток сушили в высоком вакууме с получением 0,26 г (83%) натриевой соли N-4-[2-(2 метилпиридин-3-ил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил]сульфонил]бутанамида в виде белого порошка: т.пл. (DSC) 320 С (разл.).N-4-[2-(3-хлор-5-метилфенил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил]сульфонил]ацетамид. К суспензии 4-[2-(3-хлор-5-метилфенил)-4(трифторметил)-1 Н-имидазол-1-ил]бензолсульфонамида (0,30 г, 0,72 ммоль) в 1,5 мл уксусной кислоты добавляли 1,5 мл ацетила хлорида при комнатной температуре. Смесь кипятили с обратным холодильником в течение 5 ч. После охлаждения реакционную смесь обрабатывали эфиром с образованием 0,23 г (70%) N-4-[2-(3 хлор-5-метилфенил)-4-(трифторметил)-1 Н-имидазол-1-ил]фенил]сульфонил]ацетамида в виде белого твердого вещества: т.пл. (DSC) 232235 С. Элементный анализ: Вычислено для С 19 Н 15 СIF3N3O3S: С, 49.84; Н, 3.30; N, 9.18; S, 7.00. Найдено: С, 49.72; Н, 3.48; N, 8.81; S, 7.18. Пример 12.N-4-[2-(3-хлор-5 метилфенил)-4-(трифторметил)-1 Н-имидазол-1 ил]фенил]сульфонил]ацетамида. К суспензии N-4-[2-(3-хлор-5-метилфенил)-4-(трифторметил)-1 Н-имидазол-1-ил] фенил]сульфонил]ацетамида (пример 11) (0,1 г,0,22 ммоль) в 3 мл этанола добавляли раствор гидроксида натрия (0,0088 г, 0,22 ммоль) в 2 мл этанола. Полученную смесь перемешивали при комнатной температуре в течение 10 мин. Растворитель выпаривали в вакууме и остаток сушили в высоком вакууме с образованием 0,09 гN,N-диметилпиридина (0,202 г) в сухом тетрагидрофуране. После перемешивания в течение 18 ч при комнатной температуре, реакционную смесь концентрировали. Остаток растворяли в этилацетате, последовательно промывали 1N хлористо-водородной кислотой и рассолом, сушили над безводным MgSO4 и концентрировали с образованием 1,0 г (81%) целевого продукта в виде кристаллов: 144-145 С. Спектр 1 Н ЯМР (CDCl3) 8.00 (д., 2 Н, J = 7.3 Гц), 7.30-7.27 (м, 4 Н), 7.10-7.06 (м, 3 Н), 2.46 (с,3 Н), 1.99 (с, 3 Н). Элементный анализ: Вычислено для C18H15FN2O4S: С, 57.75; Н,4.04; N, 7.48. Найдено: С, 57.84; Н, 4.06; N, 7.49. Пример 14. Натриевая соль N-4-[3-(3-фторфенил)-5 метилизоксазол-4-ил]фенил]сульфонил]ацетамида. Смесь, состоящую из N-4-[3-(3-фторфенил)-5-метилизоксазол-4-ил]фенил]сульфонил]ацетамида (пример 13) (0,312 г, 0,83 ммоль) и гидроксида натрия (0,33 мл, 2,5N) в этаноле концентрировали досуха. Остаток разбавляли этанолом и снова концентрировали. Полученный остаток сушили в вакууме с образованием 0,32 г (97%) кристаллического продукта: т.пл. 112-131 С. Спектр 1 Н ЯМР (D2 О/300 МГц), 7.64 (д,2 Н, J=8.3 Гц), 7.21-6.91 (м, 6 Н), 2.27 (с, 3H), 1.78(с, 3H). Элементный анализ: Вычислено для C18H14FN2O4SNa0,5 Н 2 О: С, 53.28; Н, 3.73; N, 6.80. Найдено: С, 53.57; Н, 3.73; N, 6.80. Следующие соединения (примеры 15-67) были получены по методикам, аналогичным 38 методикам примеров 13-14, при замене соответствующих сульфонамида и ангидрида. Пример 15.FADLMS m/z 385.1222 (M+H, C20H21N2O4S, вычислено 385.1245). Элементный анализ для C20H20N2O4S: С,62.48; Н, 5.24; N.29. Найдено: С, 62.55; Н, 5.24, N, 7.21. Пример 16. Натриевая соль 2-метил-N-4-(5-метил-3 фенилизоксазол-4-ил]фенил]сульфонил]пропанамида. Т.пл. 300 С. Спектр 1H ЯМР (DMSOd6/300 МГц) 7.71 (д, 2 Н, J=8.1 Гц), 7.43-7.24 (м,5 Н), 7.19 (д, 2 Н, J=8.1), 2.44 (с, 3 Н), 2.15 (септ.,1 Н, J=6.9 Гц), 0.89 (д, 6 Н, J=6.9 Гц). Массспектр FABLMS m/z 407 (М+H, C20H21N2O4SNa,(вычислено 407.1041). Элементный анализ для C20H19N2O4SNa: С,59.10; Н, 4.71; N, 6.89. Найдено: С, 58.98; Н, 4.68; N, 6.94. Пример 17. 39 Элементный анализ для C19H18N2O4S: C,61.61; Н, 4.90; N, 7.56. Найдено: С, 61.52; Н, 4.92; N, 7.53. Пример 18.(D2O/300 МГц) 7.57 (д, 2 Н, J=8.4 Гц), 7.30-6.90 м, 7 Н), 2.12 (с, 3H), 2.00 (кв, 2 Н, J=7.8 Гц). Масс-спектр FABLRMS m/z (M+H). Элементный анализ для C19H17N2O4SNa: C,58.61; Н, 4.37; N, 7.14. Найдено: С, 57.92; Н, 4.53, N, 6.95. Пример 19.FABHRMS m/z 399.1388 (М+H, вычислено 399.1379). Элементный анализ для C21H22N2O4S: С,63.30; Н, 5.56; N, 7.03. Найдено: С, 63.45; Н, 5.53; N, 7.08. Пример 22. Натриевая соль 2,2-димeтил-N-4-(5 метил-3-фенилизоксазол-4-ил)фенил]сульфонил]пропанамида. Т.пл. 300 С. Спектр 1 Н ЯМР (DMSOd6/300 МГц) 7.68 (д, 2 Н, J=8,1 Гц), 7.42-7.31 (м,5 Н), 7.18 (д, 2 Н, J=8,1 Гц), 2.44 (с,3H), 0.96 (с,9 Н). Масс-спектр FABLRMS m/z 421 (М+H, вычислено 421.1198). Элементный анализ для C21H21N2O4SNa: С,59,99; Н, 5.03; N, 6.66. Найдено: С, 59.83; Н, 5.08; N, 6.58. Пример 23.(M+H, вычислено 429.1120). Элементный анализ для C21H20N2O6S: С,58.87; Н, 4.70; N, 6.44.N-4-(5-метил-3-фенилизоксазол-4-ил) фенил]сульфонил]бутанамид. Т.пл. 173,2 С. Спектр 1 Н ЯМР (СDСl3/300 МГц) 8.55 (широкий, с 1 Н), 8.05 (д. 2 Н, J=8.7 Гц), 7.40-7.29 (м, 7 Н), 2.50 (с, 3H), 2.86 (т, 2 Н,J=7.2 Гц), 1.61 (сикстет, 2 Н, J=7.2 Гц), 0.88 (т,3H, J=7.2 Гц). Масс-спектр FABLRMS m/z 391(M+H), вычислено 385.1222). Элементный анализ для C20H20N2O4S: С,62.48; Н, 5.24; N, 7.29. Найдено: С, 62.37; Н, 5.28; N, 7.22. Пример 25.FABHRMS m/z 407.1065 (M+H, вычислено 407.1041). Элементный анализ для С, 58.91; Н, 4.77;FABHRMS m/z 399.1286 (М, вычислено 399.1300). Элементный анализ для C21H22N2O4S: С,63.30; Н, 5.56; N, 7.03. Найдено: С, 63.25; Н, 5.63; N, 9.69.(сикстет, 2 Н, J=7.5 Гц), 0.78 (т, 3H, J=7.5 Гц). Масс-спектр FABLRMS m/z 421 (M+H). Элементный анализ для C21H21N2O4SNa: С,59.99; Н, 5.03; N, 6.66. Найдено: С, 59.85; Н, 5.08; N, 6.62. Пример 28.FABLRMS m/z 413 (M+H). FABHRMS m/z 413.1517 (M+H, вычислено 413.1535). Элементный анализ для C22H24N2O4S: С,64.06; Н, 5.85; N, 6.79. Найдено: С, 64.04; Н, 5.85; N, 6.70. Пример 29.N-4-(5-метил-3-фенилизоксазол-4-ил] фенил]сульфонил]ацетамид. Т.пл. 169,3-170,6 С. Элементный анализ для C18H16N2O4S: С,60.66; Н, 4.53; N, 7.86. Найдено С, 60.57; Н, 4.59; N, 7.81. Пример 40.N-4-[3-(дифторметил)-5-(3-фтор-4 метоксифенил)-1 Н-пиразол-1-фенил]сульфонил]ацетамид. Т.пл. 173-175 С. Спектр 1H ЯМР (ацетонd6/300 МГц) 8.1 (д, 2 Н, J=8.9 Гц), 7.6 (д, 2 Н,J=8.9 Гц), 7.2-6.8 (м, 6 Н), 3.9 (с, 3H). Элементный анализ для С 19 Н 16N3F3O4S: С,51.94; Н, 3.67; N, 9.56. Найдено: С, 51.80; Н, 3.72; N, 9.47. Пример 47. Натриевая соль метил 4-(5-метил-3 фенилизоксазол-4-ил)фенил]сульфонил]амино] оксоацетата. Т.пл. 146,0-151,8 С. Спектр 1 Н ЯМР(DMSO-d6/300 МГц): 7.7 (д, 2 Н, J=8.1 Гц), 7.57.1 (м, 8 Н), 1.9 (дд, 2 Н, J=7.4 Гц), 0.8 (т, 3H,J=7.5 Гц). Элементный анализ для C19H15N12F2NaO4SFABHRMS m/z (M+H, вычислено 415.0964). Элементный анализ для C20H18N2O6S: С,5796; Н. 4.38; N, 6.76. Найдено: С, 57,71; Н, 4.81; N, 6.67. Динатриевая соль 4-4-(5-метил-3 фенилизоксазол-4-ил)фенил]сульфонил]амино]4-оксобутановой кислоты. Т.пл 300 С. Спектр 1 Н ЯМР (D2O/300 МГц) 7.68 (д, 2 Н, J=8.5 Гц), 7.39-7.20 (м, 7 Н),2.34 (с, 2 Н), 2.33-2.15 (м, 4 Н). Элементный анализ для C20H16N2O6SNa2 0,95 Н 2 О: С, 50.53; Н, 3.79; N, 5.89. Найдено: С, 50.52; Н, 3.82; N, 5.89. Пример 60.FABHRMS m/z 343.0753 (M+H, вычислено 343.0753). Элементный анализ для C17H14N2O4S: С,59.64; Н, 4.12; N, 8.18. Найдено: С, 59.59; Н, 4.17; N, 8.07. Пример 61.(М+Н, вычислено 365.0565, M+H, вычислено 365.0572). Элементный анализ для C17H13N2O4SNa 0,73 EtOH0,51 Н 2O: С, 54.46; Н, 4.55; N, 6.88. Найдено: С, 54.46; Н, 4.44; N, 6.74. Пример 62.N-4-(5-(4-мeтилфeнил)-3-(тpифтopмeтил)-1H-пиразол-1-ил]фенил]сульфонил]ацетамид. 4-[5-(4-Метил)-3-(трифторметил)-1 Н-пиразол-1-ил]бензолсульфонамид (0,60 г, 1,57 ммоль) кипятили в 2 мл ацетилхлорида и 2 мл уксусной кислоты с обратным холодильником в течение 2 ч. Добавляли еще 2 мл хлористого ацетила и смесь кипятили с обратным холодильником еще в течение 5 ч. Полученную смесь охлаждали и концентрировали. В результате перекристаллизации из смеси эфир/гексан получали целевой продукт в виде белого порошка. Элементный анализ: Вычислено для С 19 Н 16N3O3SF3: С, 53.90; Н,3.81; N, 9.92; S, 7.57. Найдено: С, 54.04; Н, 3.80; N, 9.93; S, 7.66. Пример 71. Натриевая соль N-4-[5-(4-метилфенил)-3(трифторметил)-1 Н-пиразол-1-ил]фенил]сульфонил]ацетамида. К 300 мг (0,71 ммоль) N-4-[5-(4 метилфенил)-3-(трифторметил)-1 Н-пиразол-1 ил]фенил]сульфонил]ацетамида (пример 70) в 4 мл EtOH добавляли 40 мкл 50% NaOH (0,76 ммоль) и полученную смесь перемешивали в течение 1 ч при комнатной температуре. В результате концентрирования получали натриевую соль в виде белого твердого вещества. Натриевая соль метил N-4-(5-мeтил-3 фeнилизoкcaзoл-4-ил]фенил]сульфонил]карбамата. Раствор 4-[5-метил-3-(фенил)изоксазол-4 ил]бензолсульфонамида (1,920 г, 6,11 ммоль) в 40 мл ТГФ обрабатывали при комнатной температуре метилхлорформиатом (1,16 мл, 1,38 г,14,60 ммоль) и затем 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU) (2,80 мл, 2,79 г, 18,33 ммоль). Через 48 ч полученную смесь распределяли между этилацетатом и раствором KHSO4. Органическую фазу промывали рассолом, сушили над MgSO4, фильтровали и концентрировали в вакууме с образованием прозрачного бледно-желтого масла. Масло очищали на двух колонках для флэш-хроматографии (1-й элюент гексан:этилацетат в соотношении 1:1; 2-й элюент СН 2 Сl2 с ТГФ), получая сырое соединение,которое может использоваться без дополнительной очистки. Полученное сырое соединение, которое может использоваться без дополнительной очистки, растворяли в 8 мл хлороформа и обрабатывали 2 мл насыщенного водного раствора NаНСО 3. Продукт реакции выделяли в виде кристаллического твердого вещества и собирали его фильтрацией, получая чистую соль в виде белых игл (0,607 г, 25%): т.пл. 267,4275,0 С. Спектр 1H ЯМР (D2 О/300 МГц) 7.68 (д,2 Н, J=8.5 Гц), 7.39-7.12 (м, 7 Н), 3.37 (с, 3H), 2.34N-([4-[5-ацетоксиметил-3-фенилизоксазол 4-ил]фенил]сульфонил]ацетамид. Суспензию 4-[5-гидроксиметил-3-(фенил) изоксазол-4-ил]бензолсульфонамида (1,51 г,4,56 ммоль) в 60 мл дихлорметана обрабатывали уксусным ангидридом (1,30 мл, 1,40 г, 13,69 ммоль), триэтиламином (1,90 мл, 1,40 г, 13,70 ммоль) и диметиламинопиридином (0,056 г, 0,46 ммоль). За 5 мин смесь становилась гомогенной,и перемешивание продолжали в течение 40 ч. Реакционную смесь разбавляли этилацетатом и(пример 73) (0,867 г, 2,09 ммоль) в метаноле обрабатывали гидроксидом натрия. Реакционную смесь концентрировали в вакууме, растворяли в воде и медленно подкисляли 1N HCl с образованием твердого вещества. Полученное твердое вещество растворяли в этилацетате,промывали рассолом, сушили над MgSO4,фильтровали и концентрировали в вакууме с образованием N-4-[5-гидроксиметил-3-фенилизоксазол-4-ил]фенил]сульфонил]ацетамида в виде желтой пены (0,513 г, 66%), чистота которой подходит для использования без дополнительной очистки: т.пл. 94-103 С. Спектр 1H ЯМР (СDСl3/300 МГц) 8.18 (широкий с, 1 Н),7.09 (д, 2 Н, J=10.08 Гц), 7.47-7.35 (м, 7 Н), 4.78 Натриевая соль 4-[5-гидроксиметил-3 фенилизоксазол-4-ил]фенил]сульфонил]ацетамида. Раствор N-4-[5-гидроксиметил-3-фенилизоксазол-4-ил]сульфонил]ацетамида (пример 74) (0,468 г, 1,26 ммоль) в метаноле обрабатывали раствором NaOH (0,50 мл, 2,50N раствор,1,26 ммоль). Через 5 мин раствор концентриро 57 вали в вакууме с образованием натриевой соли Натриевая соль N-4-(5-гидроксиметил-3 фенилизоксазол-4-ил]фенил]сульфонил]пропанамида. Стадия 1. Получение N-4-(5-пропоксиметил-3-фенилизоксазол-4-ил]фенил]сульфонил]пропанамида. Суспензию 4-[5-гидроксиметил-3-(фенил) изоксазол-4-ил]бензолсульфонамида (0,314 г,0,947 ммоль) в ТГФ обрабатывали пропионовым ангидридом (0,36 мл, 0,37 г, 2,846 ммоль), триэтиламином (0,40 мл, 0,29 г, 2,85 ммоль и диметиламинопиридином (0,025 г, 0,205 ммоль). Полученный раствор перемешивали в течение 24 ч. Сырую реакционную смесь разбавляли этилацетатом и промывали KHSO4, рассолом,сушили над MgSO4, фильтровали и концентрировали в вакууме. Полученный в результате продукт очищали методом флэш-хроматографии с использованием в качестве элюента смеси гексан/этилацетат (1:1). В результате концентрирования соответствующих фракций получали N-4-(5-пропоксиметил-3-фенилизоксазол-4-ил]фенил]сульфонил]пропанамида(0,33 г, 79%) в виде прозрачного коричневого масла, чистота которого подходила для использования на следующей стадии. Стадия 2. ПолучениеN-4-(5-пропоксиметил-3-фенилизоксазол-4-ил]фенил]сульфонил]пропанамид (стадия 1) растворяли в метаноле и при перемешивании добавляли раствор NaOH (0,89 мл 2,5N раствора, 2,24 ммоль). Через 12 ч реакционную смесь подкисляли 1N раствором HCl и экстрагировали смесью дихлорметана и этилацетата. Объединенные органические фазы сушили над MgSO4,фильтровали и концентрировали в вакууме с образованием N-4-(5-гидроксиметил-3-фенилизоксазол-4-ил]фенил]сульфонил]пропанамида(0,238 г, 83%), обладающего достаточной чистотой для использования на следующей стадии. Стадия 3. Получение натриевой соли N4-(5-гидроксиметил-3-фенилизоксазол-4-ил] фенил]сульфонил]пропанамида. 58 растворяли в метаноле и обрабатывали раствором NaOH (1,23 мл 0,50N раствора, 0,62 ммоль). Полученный в результате раствор концентрировали в вакууме. Полученное масло разбавляли водой и концентрировали в высоком вакууме с образованием натриевой соли(100 мг, 0,26 ммоль) в DMSO (2 мл) добавляли гидрид натрия (6 мг, 0,26 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч. К полученной смеси добавляли йодистый метил (0,025 мл, 0,4 ммоль). Смесь перемешивали при комнатной температуре в течение 16 ч. Полученную смесь разбавляли этилацетатом (15 мл) и промывали водой(310 мл). Органический раствор собирали,сушили (Nа 2SO4) и концентрировали. Остаток подвергали хроматографической очистке (гексан:этилацетат, 3:1) с образованием монометилсульфонамида (22 мг, 21%) в виде смолы. Точная масса: Вычислено для C17H13F4N3O2S: 399.0664. Найдено 399.0662. Пример 78. 4-[2-(4-Фторфенил)-1 Н-пиррол-1-ил]-Nметилбензолсульфонамид. Стадия 1. Получение 5,5-диметил-1,3 диоксан-2-пропанола. 5,5-Диметил-1,3-диоксан-2-пропанол синтезировали по следующей методике, описанной в литературе (J. Org. Chem. 57, 2195, 1992). Стадия 2. Получение 5,5-диметил-1,3 диоксан-2-пропанола DMSO (10,2 мл, 0,14 моль) добавляли к раствору хлористого оксалила (5,5 мл, 63,2 ммоль) в хлористом метилене (25 мл) при -78 С. После перемешивания в течение 15 мин, в течение 10 мин добавляли раствор 5,5 59 диметил-1,3-диоксан-2-пропанола (стадия 1) (10 г, 57,5 ммоль) в хлористом метилене (100 мл). Реакционную смесь перемешивали в течение 1 ч и добавляли триэтиламин (40 мл, 0,2 моль). После перемешивания при -70 С в течение 1 ч,реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 ч. Реакцию останавливали водой и экстрагировали хлористым метиленом. Органические фракции промывали водным раствором бикарбоната натрия и рассолом. После сушки (Na2SO4), фильтрации и концентрирования, сырое соединение подвергали хроматографической очистке (силикагель, гексан/этил, ацетат, 7/3 с получением 5,5-диметил-1,3-диоксан-2-пропанола (6,1 г,61%) в виде бесцветной жидкости. Элементный анализ для C9H16O30,2 Н 2 О: С, 61.48; Н, 9.40. Найдено: С, 61.46; Н, 9.24. Стадия 3. Получение -(4-фторфенил)-5,5 диметил-1,3-диоксан-2-пропанола. Бромистый 4-фторфенилмагний (8,7 мл,2 М раствор в эфире, 17,44 ммоль) добавляли к раствору 5,5-диметил-1,3-диоксан-2-пропанола-70 С. После перемешивания при -70 С в течение 2 ч, реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакцию останавливали водой и экстрагировали этилацетатом. Органические фракции объединяли и последовательно промывали водой и рассолом. После сушки (MgSO4), фильтрации и концентрирования, сырое соединение(3,5 г) подвергали хроматографической очистке с получением -(4-фторфенил)-5,5-диметил-1,3 диоксан-2-пропанола (2,73 г) в виде белого твердого вещества: т.пл. (DSC) 84 С. Элементный анализ: Вычислено для C15P21FO3: С, 67.14; Н, 7.88. Найдено: С, 67.18; Н, 7.98. Стадия 4. Получение 3-(5,5-диметил-1,3 диоксан-2-ил)-1-(4-фторфенил)пропан-1-она. К раствору -(4-фторфенил)-5,5-диметил 1,3-диоксан-2-пропанола (стадия 3) (2,6 г, 10,7 ммоль) в хлористом метилене (100 мл), добавляли хлорхромат пиридиния (3,5 г, 16,05 ммоль). После перемешивания при комнатной температуре в течение 3 ч, реакционную смесь разбавляли эфиром и фильтровали через короткую колонку с силикагелем. Колонку элюировали эфиром и фракции, содержащие 3-(5,5 диметил-1,3-диоксан-2-ил)-1-(4-фторфенил)пропан-1-он объединяли и концентрировали (2,2 г,85%): т.пл. (DSO) 65 С. Элементный анализ для С 15 Н 19FO3: Вычислено, С, 67.65; Н, 7.19. Найдено: С, 67.21; Н, 7.43. Стадия 5. Получение N-метил-4-нитробензолсульфонамида. К суспензии хлористого 4-нитробензолсульфонила (5 г, 22,56 ммоль) в эфире (250 мл), 003319 60 добавляли метиламин (5 мл, 40% водный раствор, 56,4 ммоль) и полученную смесь перемешивали при комнатной температуре. Через 16 ч реакционную смесь концентрировали с целью удаления растворителя и остаток ресуспендировали в хлористом метилене. После промывания 2N HCl и рассолом, органические фракции сушили (MgSO4), фильтровали и концентрировали с получением N-4-нитробензолсульфонамида(4,8 г, 98%): т.пл. (DSC) 109 С. Элементный анализ для C7H8N2O4S: С,38.89; Н, 3.73; N, 12.96. Найдено: С, 38.83; Н, 3.72; N, 12.96. Стадия 6. Получение 4-[(N-метиламино) сульфонил]анилина. К раствору N-метил-4-нитробензолсульфонамида (стадия 5) (4,8 г, 22,2 ммоль) в метаноле (100 мл), помещенному в сосуд Парра добавляли никель Ренея в метаноле. Реакционную смесь несколько раз продували азотом и водородом и выдерживали под давлением водорода 5 фунт/дюйм (0,07 кг/см 2). После перемешивания при 25 С в течение примерно 20 ч давление над реакционной смесью сбрасывали и смесь продували азотом. Реакционную смесь фильтровали и концентрировали с целью удаления растворителя. 4-[(Nметиламино)сульфонил]анилин, полученный в виде белого твердого вещества (4,1 г, 100%) использовали на следующей стадии без дополнительной очистки: т.пл. (DSC) 138 С. Элементный анализ для C7H10N2O4S0,25 Н 2 О: С, 44.08; Н, 5.55; N, 14.69. Найдено: С, 43.83; Н, 5.39; N, 14.81. Стадия 7. Получение 4-[2-(4-фторфенил 1 Н-пиррол-1-ил]-N-метилбензолсульфонамида. Смесь 3-(5,5-диметил-1,3-диоксан-2-ил)-1(4-фторфенил)пропан-1-она (стадия 4) (400 мг,1,5 ммоль),4-[(N-метиламино)сульфонил] анилина (стадия 6) (308 мг, 1,65 ммоль) и птолуолсульфокислоты (40 мг) в толуоле (80 мг) кипятили с обратным холодильником в течение 48 ч. Реакционную смесь охлаждали, фильтровали и концентрировали. Сырое желтоватое твердое вещество (760 мг) подвергали хроматографической очистке(силикагель,гексан/этилацетат 7/3) с получением 4-[2-(4 фторфенил)-1 Н-пиррол-1-ил]-N-метилбензолсульфонамида (198 мг, 40%) в виде белого твердого вещества: т.пл. (DSC) 174 С. Элементный анализ для C17H15N2FO2S0,25 Н 2 О: Вычислено С, 60.97; Н, 4.67; N, 8.01. Пример 79.
МПК / Метки
МПК: A61P 29/00, C07D 261/08, C07C 311/39, A61K 31/422
Метки: ингибиторов, сох-2, замещенного, бензолсульфонамида-пролекарства, производные
Код ссылки
<a href="https://eas.patents.su/30-3319-proizvodnye-zameshhennogo-benzolsulfonamida-prolekarstva-ingibitorov-soh-2.html" rel="bookmark" title="База патентов Евразийского Союза">Производные замещенного бензолсульфонамида-пролекарства ингибиторов сох-2.</a>
Следующий патент: Ингибиторы клеточной адгезии.
Случайный патент: Реакторное устройство для газификации