Модифицированные полипептиды эритропоэтина животных и их применение
Номер патента: 19653
Опубликовано: 30.05.2014
Авторы: Шеффер Джозеф, Хейз Путнэм Анна-Мария А., Силади Марк, Барнетт Ричард С., Сонг Фрэнк, Чу Стефани, Тянь Фэн, Кеннинг Питер К., Эткинсон Кайл, Ли Дарин
Формула / Реферат
1. Полипептид кошачьего эритропоэтина (fEPO), содержащий некодируемую аминокислоту.
2. fEPO полипептид по п.1, где fEPO полипептид связан по меньшей мере с одним дополнительным fEPO полипептидом.
3. fEPO полипептид по п.1, где некодируемая аминокислота связана с водорастворимым полимером.
4. fEPO полипептид по п.3, где водорастворимый полимер содержит молекулу поли(этиленгликоля).
5. fEPO полипептид по п.4, где молекула поли(этиленгликоля) представляет собой бифункциональный полимер.
6. fEPO полипептид по п.5, где бифункциональный полимер связан со вторым полипептидом.
7. fEPO полипептид по п.6, где второй полипептид не является fEPO полипептидом.
8. fEPO полипептид по п.4, содержащий по меньшей мере две аминокислоты, связанные с водорастворимым полимером, содержащим молекулу поли(этиленгликоля).
9. fEPO полипептид по п.8, где по меньшей мере одна аминокислота, связанная с указанным водорастворимым полимером, является некодируемой аминокислотой.
10. fEPO полипептид по п.4, где замену некодируемой аминокислотой производят в положении, выбранном из группы, состоящей из остатков 1-7, 27-54, 84-89, 114-137, 162-166 из SEQ ID NO:2.
11. fEPO полипептид по п.4, где замену некодируемой аминокислотой производят в положении, выбранном из группы, состоящей из остатков 1, 2, 3, 4, 5, 6, 8, 9, 17, 21, 24, 25, 26, 27, 28, 30, 31, 32, 34, 35, 36, 37, 38, 39, 40, 43, 45, 47, 50, 51, 52, 53, 54, 55, 56, 57, 58, 65, 68, 72, 76, 77, 78, 79, 80, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 107, 110, 111, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 136, 154, 157, 158, 159, 160, 162, 163, 164, 165 и 166 из SEQ ID NO:2.
12. fEPO полипептид по п.11, где замену некодируемой аминокислотой производят в положении, выбранном из группы, состоящей из остатков 2, 4, 17, 21, 24, 27, 28, 30, 31, 32, 34, 36, 37, 38, 40, 50, 53, 55, 58, 65, 68, 72, 76, 80, 82, 83, 85, 86, 87, 89, 113, 115, 116, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 134, 136 и 162, а также их комбинации из SEQ ID NO:2.
13. fEPO полипептид по п.11, где замену некодируемой аминокислотой производят в положении, выбранном из группы, состоящей из остатков 21, 24, 28, 30, 31, 36, 37, 38, 55, 72, 83, 85, 86, 87, 89, 113, 116, 119, 120, 121, 123, 124, 125, 126, 127, 128, 129, 130 и 162, а также их комбинации из SEQ ID NO:2.
14. fEPO полипептид по п.11, где замену некодируемой аминокислотой производят в положении, выбранном из группы, состоящей из остатков 21, 24, 38, 83, 85, 86, 89, 116, 119, 121, 124, 125, 126, 127 и 128, а также их комбинации из SEQ ID NO:2.
15. fEPO полипептид по п.4, где замену некодируемой аминокислотой производят в положении, выбранном из группы, состоящей из 24, 36, 38, 58, 65, 83, 86, 113, 115, 126 и их комбинации из SEQ ID NO:2.
16. fEPO полипептид по п.1, где fEPO полипептид содержит замену, вставку или делецию, которые повышают аффинность fEPO полипептида по отношению к рецептору эритропоэтина.
17. fEPO полипептид по п.1, где fEPO полипептид содержит аминокислотную замену, вставку или делецию, которые повышают стабильность или растворимость fEPO полипептида.
18. fEPO полипептид по п.16, содержащий аминокислотную замену, выбранную из группы, состоящей, помимо прочего, из S9A, F48S, Y49S, A50S, Q59A, A73G, G101A, Т106А, L108A, Т132А, R139A, K140А, R143A, S146A, N147A, R150A и K154A а также их комбинации в SEQ ID NO:2.
19. fEPO полипептид по п.1, где некодируемая аминокислота является реакционноспособной по отношению к водорастворимому полимеру, который в ином случае не является реакционноспособным по отношению к любой из 20 стандартных аминокислот.
20. fEPO полипептид по п.1, где некодируемая аминокислота содержит карбонильную, ацетильную, аминоокси, гидразиновую, гидразидную, семикарбазидную, азидную или алкиновую группы.
21. fEPO полипептид по п.20, где некодируемая аминокислота содержит карбонильную группу.
22. fEPO полипептид по п.21, где некодируемая аминокислота имеет структуру

где n равно 0-10;
R1 является алкилом, арилом, замещенным алкилом или замещенным арилом;
R2 является Н, алкилом, арилом, замещенным алкилом или замещенным арилом;
R3 является Н, аминокислотой, полипептидом или аминоконцевой модифицирующей группой;
R4 является Н, аминокислотой, полипептидом или карбоксиконцевой модифицирующей группой.
23. fEPO полипептид по п.20, где некодируемая аминокислота содержит аминооксигруппу.
24. fEPO полипептид по п.20, где некодируемая аминокислота содержит гидразидную группу.
25. fEPO полипептид по п.20, где некодируемая аминокислота содержит гидразиновую группу.
26. fEPO полипептид по п.20, где остаток некодируемой аминокислоты содержит семикарбазидную группу.
27. fEPO полипептид по п.20, где остаток некодируемой аминокислоты содержит азидную группу.
28. fEPO полипептид по п.27, где некодируемая аминокислота имеет структуру
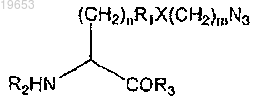
где n равно 0-10;
R1 является алкилом, арилом, замещенным алкилом, замещенным арилом или отсутствует;
X является О, N, S или отсутствует;
m равно 0-10;
R2 является Н, аминокислотой, полипептидом или аминоконцевой модифицирующей группой;
R3 является Н, аминокислотой, полипептидом или карбоксиконцевой модифицирующей группой.
29. fEPO полипептид по п.20, где некодируемая аминокислота содержит алкиновую группу.
30. fEPO полипептид по п.29, где некодируемая аминокислота имеет структуру

где n равно 0-10;
R1 является алкилом, арилом, замещенным алкилом или замещенным арилом;
X является О, N, S или отсутствует;
m равно 0-10;
R2 является Н, аминокислотой, полипептидом или аминоконцевой модифицирующей группой;
R3 является Н, аминокислотой, полипептидом или карбоксиконцевой модифицирующей группой.
31. fEPO полипептид по п.4, где молекула поли(этиленгликоля) имеет молекулярную массу от приблизительно 1 до приблизительно 100 кДа.
32. fEPO полипептид по п.31, где молекула поли(этиленгликоля) имеет молекулярную массу от 1 до 50 кДа.
33. fEPO полипептид по п.4, полученный в результате реакции fEPO полипептида, содержащего карбонилсодержащую аминокислоту, с молекулой поли(этиленгликоля), содержащей аминоокси, гидроксиламиновую, гидразиновую, гидразидную или семикарбазидную группы.
34. fEPO полипептид по п.33, где аминоокси, гидроксиламиновая, гидразиновая, гидразидная или семикарбазидная группы связаны с молекулой поли(этиленгликоля) амидной связью.
35. fEPO полипептид по п.4, полученный в результате реакции молекулы поли(этиленгликоля), содержащей карбонильную группу, с полипептидом, содержащим некодируемую аминокислоту, которая содержит аминоокси, гидроксиламиновую, гидразидную или семикарбазидную группы.
36. fEPO полипептид по п.4, полученный в результате реакции fEPO полипептида, содержащего алкинсодержащую аминокислоту, с молекулой поли(этиленгликоля), содержащей азидную группу.
37. fEPO полипептид по п.4, полученный в результате реакции fEPO полипептида, содержащего азидсодержащую аминокислоту, с молекулой поли(этиленгликоля), содержащей алкиновую группу.
38. fEPO полипептид по п.36 или 37, где азидная или алкиновая группа связана с молекулой поли(этиленгликоля) амидной связью.
39. fEPO полипептид по п.4, где молекула поли(этиленгликоля) представляет собой разветвленный или многолучевой полимер.
40. fEPO полипептид по п.39, где каждая цепь поли(этиленгликолевого) разветвленного полимера имеет молекулярную массу от 5 до 30 кДа.
41. fEPO полипептид по п.1, где полипептид является антагонистом эритропоэтина.
42. fEPO полипептид по п.41, где замену некодируемой аминокислотой производят в положении, выбранном из группы, состоящей из остатков, включающих, помимо прочих, V11, R14, Y15, D96, K97, S100, R103, S104, Т107, L108 и R110, а также их комбинации из SEQ ID NO:2.
43. fEPO полипептид по п.41, где некодируемая аминокислота связана с водорастворимым полимером.
44. fEPO полипептид по п.41, где водорастворимый полимер содержит молекулу поли(этиленгликоля).
45. fEPO полипептид по п.41, где некодируемая аминокислота, связанная с водорастворимым полимером, присутствует в области сайта II fEPO полипептида.
46. fEPO полипептид по п.41, где некодируемая аминокислота, связанная с водорастворимым полимером, предотвращает димеризацию fEPO рецептора, препятствуя связыванию fEPO антагониста со вторым fEPO рецептором.
47. fEPO полипептид по п.41, где замена аминокислотой, отличной от лейцина, произведена в положении L108 в SEQ ID NO:2.
48. fEPO полипептид по п.47, где замена аргинином произведена в положении L108 в SEQ ID NO:2.
49. fEPO полипептид по п.1, где некодируемая аминокислота содержит сахаридную группу.
50. fEPO полипептид по п.3, где водорастворимый полимер связан с полипептидом через сахаридную группу.
51. Способ получения fEPO полипептида по п.4, включающий контактирование выделенного fEPO полипептида, содержащего некодируемую аминокислоту, с водорастворимым полимером, содержащим группу, которая реагирует с некодируемой аминокислотой.
52. Способ по п.51, где водорастворимый полимер содержит молекулу полиэтиленгликоля.
53. Способ по п.51, где остаток некодируемой аминокислоты содержит карбонильную, аминоокси, гидразидную, семикарбазидную, азидную или алкиновую группы.
54. Способ по п.53, где остаток некодируемой аминокислоты содержит карбонильную группу, а водорастворимый полимер содержит аминоокси, гидроксиламиновую, гидразидную или семикарбазидную группы.
55. Способ по п.53, где остаток некодируемой аминокислоты содержит алкиновую группу, а водорастворимый полимер содержит азидную группу.
56. Способ по п.53, где остаток некодируемой аминокислоты содержит азидную группу, а водорастворимый полимер содержит алкиновую группу.
57. Способ по п.52, где молекула полиэтиленгликоля имеет среднюю молекулярную массу от приблизительно 1 до приблизительно 100 кДа.
58. Способ по п.56, где молекула полиэтиленгликоля представляет собой разветвленный или многолучевой полимер.
59. Композиция, содержащая fEPO полипептид по п.1, и фармацевтически приемлемый носитель.
60. Композиция по п.59, где некодируемая аминокислота связана с водорастворимым полимером.
61. Способ лечения пациента, имеющего нарушение, которое модулируется fEPO, включающий введение пациенту терапевтически эффективного количества композиции по п.59.
62. Способ увеличения периода полураспада в сыворотке или времени циркуляции fEPO, включающий замену некодируемой аминокислотой одной или более аминокислот в природном fEPO.
63. fEPO полипептид по п.22, где некодируемая аминокислота представляет собой параацетилфенилаланин.
64. fEPO полипептид по п.63, где замену параацетилфенилаланином производят в положении, выбранном из группы, состоящей из остатков 1, 21, 31, 36, 37, 49, 53, 55, 72, 76, 116, 120, 128, 129, 130, 131, 132, 133 и 163 из SEQ ID NO:2.
65. fEPO полипептид по п.64, где замену параацетилфенилаланином производят в остатке 1 из SEQ ID NO:2.
66. fEPO полипептид по п.65, где параацетилфенилаланин связан с водорастворимым полимером, содержащим молекулу поли(этиленгликоля).

Текст
МОДИФИЦИРОВАННЫЕ ПОЛИПЕПТИДЫ ЭРИТРОПОЭТИНА ЖИВОТНЫХ И ИХ ПРИМЕНЕНИЕ Предложены модифицированные полипептиды эритропоэтина животных и их применение.(71)(73) Заявитель и патентовладелец: АМБРКС ИНК.; ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Область техники, к которой относится изобретение Настоящее изобретение относится к полипептидам кошачьего, собачьего и конского эритропоэтина,модифицированным по меньшей мере одной некодируемой аминокислотой. Уровень техники Супергенное семейство гормона роста (ГР) (Bazan, F. Immunology Today 11: 350-354 (1991); Mott,H.R. and Campbell, I.D. Current Opinion in Structural Biology 5: 114-121 (1995); Silvennomen, O. and Ihle,J.N. (1996), Signaling by the Hematopoietic Cytokine Receptors) представляет собой группу белков с подобными структурными свойствами. Хотя в указанном семействе идентифицированы не все представители,некоторые его представители включают следующие белки: гормон роста, пролактин, плацентарный лактоген, эритропоэтин (ЕРО), тромбопоэтин (ТРО), интерлейкин-2 (IL-2), IL-3, IL-4, IL-5, IL-6, IL-7, IL-9,IL-10, IL-11, IL-12 (р 35 субъединица), IL-13, IL-15, онкостатин М, цилиарный нейротрофический фактор,фактор ингибирования лейкемии, интерферон-альфа, интерферон-бета, интерферон-гамма, интерферономега, интерферон-тау, гранулоцитарный колониестимулирующий фактор (Г-КСФ), гранулоцитарномакрофагальный колониестимулирующий фактор (ГМ-КСФ), макрофагальный колониестимулирующий фактор (М-КСФ) и кардиотрофин-1 (СТ-1) ("супергенное семейство ГР"). Представители супергенного семейства ГР имеют сходную вторичную и третичную структуры, несмотря на то, что они обычно обладают ограниченной идентичностью аминокислотной или ДНК последовательности. Общие структурные особенности позволяют с легкостью идентифицировать новых представителей генного семейства. Одним из представителей супергенного семейства ГР является кошачий эритропоэтин (fEPO). Природный эритропоэтин (ЕРО) представляет собой гликопротеиновый гормон с молекулярной массой 34 килодальтона (кДа), который вырабатывается в почках и печени у млекопитающих. ЕРО является ключевым элементом в эритропоэзе, вызывая пролиферацию и дифференцировку клеток-предшественников эритроцитов. Активность ЕРО также связана с активацией множества эритроид-специфичных генов,включая глобин и карбоангидразу. См., например, Bondurant et al., Mol. Cell Biol. 5:675-683 (1985); Kouryet al., J. Cell. Physiol. 126: 259-265 (1986). Рецептор эритропоэтина (EpoR) является представителем семейства рецепторов гемопоэтических/цитокиновых факторов роста, которое включает несколько других рецепторов фактора роста, таких как рецепторы интерлейкина (IL)-3, -4 и -6, рецептор гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), а также рецепторы пролактина и гормона роста. См. Bazan, Proc. Natl.Acad. Sci. USA 87: 6934-6938 (1990). Представители семейства цитокиновых рецепторов содержат четыре консервативных остатка цистеина и триптофан-серин-Х-триптофан-сериновый мотив, расположенный только вне трансмембранной области. Консервативные последовательности, как полагают, участвуют в белок-белковых взаимодействиях. См., например, Chiba et al., Biochim. Biophys. Res. Comm. 184: 485-490(1992). В патентах США 5441868; 5547933; 5618698 и 5621080 описаны последовательности ДНК, кодирующие человеческий ЕРО, а также очищенный и выделенный полипептид, имеющий частичную или полную первичную структурную конформацию и обладающий биологическими свойствами природного ЕРО. Биологические эффекты ЕРО происходят вследствие его взаимодействия со специфичными клеточными рецепторами. Взаимодействие между ЕРО и внеклеточным доменом его рецептора (EPObp) хорошо изучено. Данные рентгеноструктурного анализа высокого разрешения показали, что ЕРО имеет два рецепторсвязывающих сайта и связывает две молекулы рецептора, последовательно используя различные сайты на молекуле. Два рецепторсвязывающих сайта именуются как сайт I и сайт II. Сайт I включает С-конец спирали D, а также части спирали А и А-В петли, тогда как сайт II охватывает аминоконцевую область спирали А и часть спирали С. Связывание ЕРО с его рецептором происходит последовательно,при этом сначала связывается сайт I. Затем сайт II связывает второй рецептор ЕРО, в результате чего происходит димеризация рецептора и активация внутриклеточных путей передачи сигнала, что приводит к клеточным ответам на гормон. Рекомбинантный человеческий ЕРО используется в качестве терапевтического средства и разрешен для лечения человека. Нехватка ЕРО приводит к развитию анемии, которую можно успешно лечить, например, с помощью экзогенного введения гормона. Анемия может быть широко разделена на две категории: регенеративную и нерегенеративную. Регенеративная анемия обычно развивается вследствие потери крови или в результате разрушения эритроцитов иммунной системой. Нерегенеративная анемия, с другой стороны, является такой формой анемии,при которой костный мозг не отвечает или не может ответить на анемию. Частой причиной анемии является хроническая почечная недостаточность (ХПН), при этом большинство остальных случаев возникает вследствие инфекции, вызванной вирусом лейкоза кошек (FeLV). Указанные два нарушения являются причинами смерти номер 1 (FeLV) и номер 2 (ХПН) у домашних кошек. hEPO использовали в лечении анемии у кошек. К сожалению, при использовании hEPO для лечения анемии у кошек существуют проблемы, связанные с иммуногенностью, и приблизительно у 25-33% кошек, получавших hEPO, развивается аплазия эритроцитов (RCA). Были проведены исследования, включавшие обследование 11 кошек и 6 собак с ХПН, получавших рекомбинантный hEPO, и хотя была продемонстрирована некоторая способность увеличивать количество эритроцитов (Эц) и ретикулоцитов, у 5/11 кошек развивались антитела к rhEPO (L.D. Cowgill, et al., J. Am. Vet. Med. Assoc, 1998 Feb 15; 212 (4):521-8). Исследование безопасности и эффективности рекомбинантного кошачьего эритропоэтина (rfEPO) проводили на 26 кошках и обнаружили, что хотя количество Эц и ретикулоцитов снова повышалось, у восьми из указанных 26 кошек(т.е. более чем у 30%) развивались антитела к r-fEPO (J.E. Randolph, et al., Am J. Vet Res. 2004 Oct; 65(10): 1355-66). В другом исследовании рекомбинантный вектор на основе адено-ассоциированного вируса серотипа 2 (rAAV2), содержащий кДНК кошачьего эритропоэтина, вводили в тестируемой группе из 10 кошек и установили, что антитела к rAAV2 были обнаружены у всех кошек, которым вводили вектор, причем у одной кошки развилась полная аплазия Эц, а у кошек, получавших меньшие количества, не наблюдали никакого эффекта (М.С. Walker, et al., Am. J. Vet. Res. 2005 Mar; 66(3): 450-6). Ковалентное присоединение гидрофильного полимера поли(этиленгликоля), сокращенно ПЭГ, является способом увеличения растворимости в воде, биодоступности, увеличения периода полураспада в сыворотке, увеличения терапевтического периода полураспада, модуляции иммуногенности, модуляции биологической активности или увеличения продолжительности циркуляции многих биологически активных молекул, включая белки, пептиды, и в особенности гидрофобные молекулы. ПЭГ экстенсивно использовали в фармацевтических препаратах, на искусственных имплантах и в других областях, где важна биологическая совместимость, отсутствие токсичности и отсутствие иммуногенности. Для максимального повышения требуемых свойств ПЭГ полная молекулярная масса и состояние гидратации ПЭГ полимера или полимеров, присоединенных к биологически активной молекуле, должны быть достаточно высокими, чтобы придавать выгодные свойства, обычно связываемые с присоединением ПЭГ полимера,такие как увеличение растворимости в воде и периода полураспада циркуляции, без неблагоприятного воздействия на биологическую активность исходной молекулы. ПЭГ производные часто связываются с биологически активными молекулами через активные химические функциональные группы, такие как остатки лизина, цистеина и гистидина, N-конец и углеводные группы. Белки и другие молекулы часто имеют ограниченное количество активных сайтов, доступных для присоединения полимера. Часто сайты, наиболее подходящие для модификации посредством присоединения полимера, играют существенную роль в связывании с рецептором, и необходимы для сохранения биологической активности молекулы. В результате, неразборчивое присоединение полимерных цепей к таким активным сайтам на биологически активной молекуле зачастую приводит к существенному снижению или даже полной потере биологической активности модифицированной полимером молекулы (R. Clark et al. (1996), J. Biol. Chem. 271:21969-21977). С целью получения конъюгатов, несущих полимер с достаточной молекулярной массой для сообщения целевой молекуле требуемых преимуществ, подходы из предшествующего уровня техники обычно включали случайное присоединение многочисленных цепей полимера к молекуле, повышая, таким образом, риск снижения или даже полной потери биологической активности исходной молекулы. Активные сайты, которые формируют участки для присоединения ПЭГ производных к белкам, обусловлены структурой белка. Белки, включая ферменты, собраны из различных последовательностей альфа-аминокислот, которые имеют общую структуру H2N-CHR-COOH. Альфа-аминогруппа (H2N-) одной аминокислоты присоединяется к карбоксильной группе (-СООН) соседней аминокислоты с образованием амидных связей, которые могут быть представлены как -(NH-CHR-CO)n-, где индекс "n" может быть равен сотням или тысячам. Фрагмент, представленный как R, может содержать активные сайты, существенные для биологической активности белка, и сайты для присоединения ПЭГ производных. Например, в случае аминокислоты лизина, в ее молекуле -NH2 группа существует в эпсилонположении, а также в альфа-положении. Эпсилон -NH2 свободна для реакции в условиях основного рН. Большинство способов из уровня техники в области получения ПЭГ производных белков было направлено на разработку ПЭГ производных для присоединения к эпсилон -NH2 группе, присутствующей в остатках лизина в белках ("Polyethylene Glycol and Derivatives for Advanced PEGylation", Nektar MolecularEngineering Catalog, 2003, с. 1-17). Все указанные ПЭГ производные, впрочем, имеют общее ограничение, которое состоит в том, что они не могут быть установлены селективно из обычно большого количества остатков лизина, присутствующих на поверхности белков. Это может послужить существенным ограничением в тех случаях, когда остаток лизина важен для активности белка, существующей, например, в активном сайте фермента, или в тех случаях, когда остаток лизина играет роль в опосредовании взаимодействия белка с другими биологическими молекулами, как в случае связывающих сайтов рецепторов. Второе и столь же важное препятствие в существующих способах ПЭГилирования белков состоит в том, что ПЭГ производные могут подвергаться нежелательным побочным реакциям с другими остатками помимо требуемых. Гистидин содержит активную иминогруппу, структурно представленную как -N(H)-,и при этом многие производные, которые реагируют с эпсилон -NH2, также могут реагировать с -N(H)-. Аналогичным образом, боковая цепь аминокислоты цистеина содержит свободную сульфгидрильную группу, структурно представленную как -SH. В некоторых случаях ПЭГ производные, направленные на эпсилон -NH2 группу лизина, также реагируют с цистеином, гистидином или другими остатками. Это может привести к образованию сложных, гетерогенных смесей ПЭГ-дериватизированных биоактивных молекулы и грозит снижением активности биоактивной молекулы, подвергаемой модификации. Было бы желательно разработать ПЭГ производные, которые позволяют вводить химическую функциональную группу в один сайт в белке, что могло бы тогда позволить селективное пришивание одного или более ПЭГ полимеров к биологически активной молекуле на определенных сайтах на поверхности белка, которые являются хорошо определенными и прогнозируемыми. В дополнение к остаткам лизина, значительные усилия в уровне техники были направлены на разработку активированных ПЭГ реагентов, которые селективно реагируют с боковыми цепями других аминокислот, включая цистеин, гистидин и N-конец (патент США 6610281, "Polyethylene Glycol and Derivatives for Advanced PEGylation", Nektar Molecular Engineering Catalog, 2003, с. 1-17). Остаток цистеина может быть сайт-селективно введен в структуру белков с использованием сайт-направленного мутагенеза и других методов, известных в уровне техники, при этом получаемая свободная сульфгидрильная группа может реагировать с ПЭГ производными, которые несут тиол-активные функциональные группы. Данный подход осложнен, впрочем, тем, что введение свободной сульфгидрильной группы может затруднить экспрессию, нарушить фолдинг и стабильность получаемого белка. Таким образом, было бы желательно располагать способом введения в биологически активные молекулы такой химической функциональной группы, которая позволила бы селективное пришивание одного или более ПЭГ полимеров к белку с одновременной совместимостью (т.е. без участия в нежелательных побочных реакциях) с сульфгидрильными и другими химическими функциональными группами, которые обычно присутствуют в белках. Как может быть видно из уровня техники, многие из таких производных, которые были разработаны для присоединения к боковым цепям белков, в частности -NH2 группа на боковой цепи аминокислоты лизина и -SH группа на боковой цепи цистеина, оказались сложными в своем синтезе и применении. Некоторые образуют с белком неустойчивые связи, которые подвергаются гидролизу и поэтому разрушаются, разрываются или они становятся нестабильными как-либо иначе в водной среде, например, в токе крови. Некоторые образуют более устойчивые связи, но подвергаются гидролизу перед образованием связи, что означает то, что реакционноспособная группа на ПЭГ производном может быть инактивирована до присоединения к белку. Некоторые токсичны и поэтому в меньшей степени подходят для применения in vivo. Некоторые слишком медленно реагируют, чтобы их можно было применять на практике. Некоторые приводят к потере активности белка в результате присоединения к сайтам, отвечающим за активность белка. Некоторые не являются специфичными в сайтах, к которым они присоединяются, что может также приводить к потере необходимой активности и отсутствию воспроизводимости результатов. Для решения проблем, связанных с модификацией белков молекулами поли(этиленгликоля), были разработаны ПЭГ производные, которые являются более устойчивыми (например, патент США 6602498) или селективно реагируют с тиольными группами на молекулах и поверхностях (например, патент США 6610281). В уровне техники существует очевидная потребность в ПЭГ производных, которые являются химически инертными в физиологических средах до применения с целью селективного взаимодействия с формированием устойчивых химических связей. Недавно сообщали об абсолютно новой методике в области белков, которая обещает решить многие из ограничений, связанных с сайт-специфичными модификациями белков. В частности, в аппарат биосинтеза белка прокариота Escherichia coli (E.coli) (например, L. Wang, et al. (2001), Science 292:498-500) и эукариота Sacchromyces cerevisiae (S. cerevisiae) (например, J.J. Chin et al.; Science 301:964-7 (2003 были введены новые элементы, которые позволили включать некодируемые аминокислоты в белки in vivo. С помощью данной методики множество новых аминокислот с новыми химическими, физическими или биологическими свойствами, включая фотоаффинные метки и фотоизомеризуемые аминокислоты, кетоаминокислоты и гликозилированные аминокислоты, были эффективно и с высокой точностью введены в белки в Е.coli и в дрожжах в ответ на амбер-кодон, TAG. См., например, J.W. Chin et al. (2002), Journal(2002), Chem. Comm. 1-10. Указанные исследования продемонстрировали, что можно селективно и рутинно вводить такие химические функциональные группы, как алкиновые группы и азидные группы,которые не присутствуют в белках, которые являются химически инертными ко всем функциональным группам, присутствующим в 20 стандартных, кодируемых аминокислотах, и которые могут использоваться для эффективного и селективного взаимодействия с формированием устойчивых ковалентных связей. Возможность вводить некодируемые аминокислоты в белки позволяет вводить химические функциональные группы, которые могут обеспечивать ценные альтернативы природным функциональным группам, таким как эпсилон -NH2 лизина, сульфгидрил -SH цистеина, иминогруппа гистидина, и т.д. Некоторые химические функциональные группы, как известно, являются инертными по отношению к функциональным группам, присутствующим в 20 стандартных, кодируемых аминокислотах, но чисто и эффективно реагируют, формируя стабильные связи. Азидные и ацетиленовые группы, например, как известно из уровня техники, подвергаются реакции циклоприсоединения Хьюсгена [3+2] в водной среде в присутствии каталитического количества меди. См., например, Tornoe, et al. (2002), Org. Chem. 67:30573064, и Rostovtsev, et al. (2002), Angew. Chem. Int. Ed. 41:2596-2599. При введении азидной группы в структуру белка, например, можно ввести функциональную группу, которая не только является химически инертной по отношению к аминам, сульфгидрильным, карбоксильным, гидроксильным группам,присутствующим в белках, но также мягко и эффективно реагирует с ацетиленовой группой, образуя продукт циклоприсоединения. Важно то, что в отсутствие ацетиленовой группы азид остается химически инертным и неактивным в присутствии других боковых цепей белка и в физиологических условиях. Настоящее изобретение, среди прочего, направлено на решение проблем, связанных с активностью и получением ЕРО, а также относится к получению полипептида hEPO с улучшенными биологическими или фармакологическими свойствами, например улучшенным терапевтическим полупериодом. Краткое изложение сущности изобретения В настоящем изобретении предложены fEPO полипептиды, включающие некодируемую аминокислоту. В некоторых вариантах осуществления fEPO полипептид связан со вторым fEPO полипептидом. В некоторых вариантах осуществления некодируемая аминокислота связана с водорастворимым полимером. В некоторых вариантах осуществления водорастворимый полимер включает молекулу поли(этиленгликоля). В некоторых вариантах осуществления молекула поли(этиленгликоля) является бифункциональным полимером. В некоторых вариантах осуществления бифункциональный полимер связан со вторым полипептидом. В некоторых вариантах осуществления вторым полипептидом являетсяfEPO полипептид. В некоторых вариантах осуществления fEPO полипептид включает по меньшей мере две аминокислоты, связанные с водорастворимым полимером, включающим молекулу поли(этиленгликоля). В некоторых вариантах осуществления по меньшей мере одна аминокислота является некодируемой аминокислотой. В некоторых вариантах осуществления одна или более некодируемых аминокислот введены в любое положение в одной или более следующих областей, соответствующих вторичным структурам в(область между С спиралью и D спиралью), 138-161 (D спираль), 162-166 (С-конец), 39-41 (бетаскладчатый слой 1), 133-135 (бета-складчатый слой 2), 47-52 (мини В петля), 114-121 (мини С петля), 3438 (петля между А спиралью и антипараллельным бета-складчатым слоем 1), 51-57 (С-конец В' спирали,петля между В' спиралью и В спиралью и N-конец В спирали), 82-92 (область между В спиралью и С спиралью) и 120-133 (область между С спиралью и антипараллельным бета-складчатый слоем 2). В некоторых вариантах осуществления одна или более некодируемых аминокислот введены в одно из следующих положений в fEPO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26,27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56,57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86,87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112,113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134,135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156,157, 158, 159, 160, 161, 162, 163, 164, 165 и 166. В некоторых вариантах осуществления одна или более некодируемых аминокислот введены в одно из следующих положений в fEPO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10,11, 12, 13, 14, 15, 16, 17, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41,42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71,72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100,101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122,123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144,145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165 и 166. В некоторых вариантах осуществления одна или более некодируемых аминокислот введены в одно из следующих положений в fEPO: 1, 2, 3, 4, 5, 6, 17, 21, 24, 27, 28, 30, 31, 32, 34, 35, 36, 37, 38, 40, 50, 51, 52, 53,54, 55, 56, 57, 58, 68, 72, 76, 80, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 113, 116, 119, 120, 121, 122, 123,124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 136, 162, 163, 164, 165 и 166. В некоторых вариантах осуществления одна или более некодируемых аминокислот введены в одно из следующих положений вfEPO: 1, 2, 3, 4, 5, 6, 17, 18, 21, 24, 27, 28, 30, 31, 32, 34, 35, 36, 37, 38, 40, 50, 51, 52, 53, 54, 55, 56, 57, 58,68, 72, 76, 80, 82, 83, 84, 85, 86, 87, 88, 90, 91, 92, 113, 116, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128,129, 130, 131, 132, 133, 134, 136, 162, 163, 164, 165 и 166. В некоторых вариантах осуществления fEPO полипептиды по изобретению включают одну или более неприродных аминокислот в одном или более следующих положений: 21, 24, 27, 28, 30, 31, 34, 36, 37, 38, 40, 55, 68, 72, 76, 83, 85, 86, 87, 89, 113, 116,119, 120, 121, 123, 124, 125, 126, 127, 128, 129, 130, 136 и 162. В некоторых вариантах осуществления неприродная аминокислота в указанных или других положениях связана с водорастворимой молекулой,включая, помимо прочих, положения 21, 24, 38, 83, 85, 116 и 119. В некоторых вариантах осуществленияfEPO полипептиды по изобретению включают одну или более неприродных аминокислот в одном или более следующих положений: 18, 53, 58, 116, 121, 89, 94, 72, 77, 86, 91, 31, 36, 132, 137, 163, 168, 120,125, 55 и 60. В некоторых вариантах осуществления fEPO полипептиды по изобретению включают одну или более неприродных аминокислот в одном или более следующих положений: 53, 58, 116, 121, 89, 94,72, 77, 86, 91, 31, 36, 132, 137, 163, 168, 120, 125, 55 и 60. В некоторых вариантах осуществления fEPO полипептиды по изобретению включают одну или более неприродных аминокислот в одном или более следующих положений: 18, 53, 58, 116, 121, 89, 94, 72, 77, 86, 91, 31, 36, 132, 137, 163, 168, 120, 125, 55 и 60. В некоторых вариантах осуществления неприродная аминокислота в указанных или других положениях связана с водорастворимой молекулой, включая, помимо прочего, положения 53, 58, 116, 121, 89,94, 72, 77, 86, 91, 31, 36, 132, 137, 163, 168, 120, 125, 55 и 60. В некоторых вариантах осуществления fEPO полипептиды по изобретению включают одну или более неприродных аминокислот в одном или более следующих положений: 123, 124, 125, 126, 127, 128, 129 и 130. В некоторых вариантах осуществления неприродная аминокислота в указанных или других положениях связана с водорастворимой молекулой,включая, помимо прочего, положения 123, 124, 125, 126, 127, 128, 129 и 130. В некоторых вариантах осуществления fEPO полипептид включает замену, вставку или делецию,которые увеличивают аффинность fEPO полипептида к рецептору эритропоэтина. В некоторых вариантах осуществления fEPO полипептид включает замену, вставку или делецию, которые увеличивают стабильность fEPO полипептида. В некоторых вариантах осуществления fEPO полипептид включает замену, вставку или делецию, которые увеличивают растворимость fEPO полипептида в воде. В некоторых вариантах осуществления fEPO полипептид включает замену, вставку или делецию, которые увеличивают растворимость fEPO полипептида, продуцируемого в клетке-хозяине. В некоторых вариантах осуществления fEPO полипептид включает замену аминокислоты, выбранной из группы, состоящей, помимо прочего, из N24, N36, N38, Q58, Q65, N83, Q86, G113, Q115 и S126, а также их комбинаций в SEQ IDNO:2. В некоторых вариантах осуществления fEPO полипептид включает замену аминокислоты, выбранной из группы, состоящей, помимо прочего, из N24, N36, N38, Q58, Q65, N83, Q86, G113, Q115 иS126, а также их комбинаций в SEQ ID NO:4. В некоторых вариантах осуществления аминокислотные замены в fEPO полипептиде могут быть произведены природными или неприродными аминокислотами, при условии, что по меньшей мере одна замена производится некодируемой аминокислотой. В некоторых вариантах осуществления некодируемая аминокислота включает карбонильную группу, ацетильную группу, аминооксигруппу, гидразиновую группу, гидразидную группу, семикарбазидную группу, азидную группу или алкиновую группу. В некоторых вариантах осуществления некодируемая аминокислота включает карбонильную группу. В некоторых вариантах осуществления некодируемая аминокислота имеет структуруR1 является алкилом, арилом, замещенным алкилом или замещенным арилом;R4 является Н, аминокислотой, полипептидом или группой, модифицирующей карбоксиконец. В некоторых вариантах осуществления некодируемая аминокислота включает аминооксигруппу. В некоторых вариантах осуществления некодируемая аминокислота включает гидразидную группу. В некоторых вариантах осуществления некодируемая аминокислота включает гидразиновую группу. В некоторых вариантах осуществления остаток некодируемой аминокислоты включает семикарбазидную группу. В некоторых вариантах осуществления остаток некодируемой аминокислоты включает азидную группу. В некоторых вариантах осуществления некодируемая аминокислота имеет структуруR1 является алкилом, арилом, замещенным алкилом, замещенным арилом или отсутствует;R3 является Н, аминокислотой, полипептидом или группой, модифицирующей С-конец. В некоторых вариантах осуществления некодируемая аминокислота включает алкиновую группу. В некоторых вариантах осуществления некодируемая аминокислота имеет структуруR1 является алкилом, арилом, замещенным алкилом или замещенным арилом;R3 является Н, аминокислотой, полипептидом или группой, модифицирующей С-конец. В некоторых вариантах осуществления полипептид является агонистом, частичным агонистом, антагонистом, частичным антагонистом или обратным агонистом эритропоэтина. В некоторых вариантах осуществления агонист, частичный агонист, антагонист, частичный антагонист или обратный агонист эритропоэтина включает некодируемую аминокислоту, связанную с водорастворимым полимером. В некоторых вариантах осуществления водорастворимый полимер включает молекулу поли(этиленгликоля). В некоторых вариантах осуществления некодируемая аминокислота, связанная с водорастворимым полимером, присутствует в области сайта 2 (области белка, охватывающего плоскость АС спирального пучка) fEPO. В некоторых вариантах осуществления fEPO полипептид, включающий некодируемую аминокислоту, связанную с водорастворимым полимером, предотвращает димеризациюfEPO рецептора, препятствуя антагонисту fEPO связываться со второй молекулой fEPO рецептора. В некоторых вариантах осуществления аминокислота кроме лейцина заменена на L108 в SEQ ID NO:2. В некоторых вариантах осуществления аргинин или лизин заменены на L108 в SEQ ID NO:2. В некоторых вариантах осуществления некодируемая аминокислота заменена на L108 в SEQ ID NO:2. Настоящее изобретение также относится к выделенным нуклеиновым кислотам, включающим полинуклеотид, который гибридизуется в жестких условиях с SEQ ID NO:24, 25, 26 или 27, где полинуклеотид включает по меньшей мере один селекторный кодон. В некоторых вариантах осуществления селекторный кодон выбран из группы, состоящей из амбер-кодона, охра-кодона, опал-кодона, уникального кодона, редкого кодона и кодона с четырьмя основаниями. Настоящее изобретение также относится к способу получения fEPO полипептида, связанного с водорастворимым полимером. В некоторых вариантах осуществления способ предусматривает контакт выделенного fEPO полипептида, включающего некодируемую аминокислоту, с водорастворимым полимером, включающим молекулу, которая реагирует с некодируемой аминокислотой. В некоторых вариантах осуществления некодируемая аминокислота, вводимая в fEPO, является активной по отношению к водорастворимому полимеру, который в иных условиях не является активным по отношению к какойлибо из 20 стандартных аминокислот. В некоторых вариантах осуществления fEPO полипептид, связанный с водорастворимым полимером, получают в результате реакции fEPO полипептида, включающего карбонилсодержащую аминокислоту, с молекулой поли(этиленгликоля), включающей аминоокси, гидроксиламиновую, гидразиновую,гидразидную или семикарбазидную группы. В некоторых вариантах осуществления аминоокси гидроксиламиновая, гидразиновая, гидразидная или семикарбазидная группы связаны с молекулой поли(этиленгликоля) через амидную связь. В некоторых вариантах осуществления fEPO полипептид, связанный с водорастворимым полимером, получают в результате реакции молекулы поли(этиленгликоля), включающей карбонильную группу, с полипептидом, включающим некодируемую аминокислоту, которая включает гидроксиламиновую,гидразидную или семикарбазидную группы. В некоторых вариантах осуществления fEPO полипептид, связанный с водорастворимым полимером, получают в результате реакции fEPO полипептида, включающего алкинсодержащую аминокислоту,с молекулой поли(этиленгликоля), включающей азидную группу. В некоторых вариантах осуществления азидная или алкиновая группа связаны с молекулой поли(этиленгликоля) через амидную связь. В некоторых вариантах осуществления fEPO полипептид, связанный с водорастворимым полимером, получают в результате реакции fEPO полипептида, включающего азидсодержащую аминокислоту, с молекулой поли(этиленгликоля), включающего алкиновую группу. В некоторых вариантах осуществления азидная или алкиновая группа связана с молекулой поли(этиленгликоля) через амидную связь. В некоторых вариантах осуществления молекула поли(этиленгликоля) имеет молекулярную массу от приблизительно 1 до приблизительно 100 кДа. В некоторых вариантах осуществления молекула поли(этиленгликоля) имеет молекулярную массу от 1 до 50 кДа. В некоторых вариантах осуществления молекула поли(этиленгликоля) является разветвленным полимером. В некоторых вариантах осуществления каждая ветвь разветвленного полимера поли(этиленгликоля) имеет молекулярную массу от 1 до 100 кДа или от 1 до 50 кДа. В некоторых вариантах осуществления водорастворимый полимер, связанный с fEPO, включает молекулу полиалкиленгликоля. В некоторых вариантах осуществления остаток некодируемой аминокислоты, введенной в fEPO, включает карбонильную группу, ацетильную группу, аминооксигруппу, гидра-6 019653 зидную группу, семикарбазидную группу, азидную группу или алкиновую группу. В некоторых вариантах осуществления остаток некодируемой аминокислоты, введенной в fEPO, включает карбонильную группу, а водорастворимый полимер включает аминоокси, гидроксиламиновую, гидразидную или семикарбазидную группу. В некоторых вариантах осуществления остаток некодируемой аминокислоты, введенной в fEPO, включает алкиновую группу, а водорастворимый полимер включает азидную группу. В некоторых вариантах осуществления остаток некодируемой аминокислоты, введенной в fEPO, включает азидную группу, а водорастворимый полимер включает алкиновую группу. Настоящее изобретение также относится к композициям, включающим fEPO полипептид, включающий некодируемую аминокислоту и фармацевтически приемлемый носитель. В некоторых вариантах осуществления некодируемая аминокислота связана с водорастворимым полимером. Настоящее изобретение также относится к клеткам, включающим полинуклеотид, кодирующийfEPO полипептид, включающий селекторный кодон. В некоторых вариантах осуществления клетки включают ортогональную РНК-синтетазу и/или ортогональную тРНК для замены некодируемой аминокислоты в fEPO полипептиде. Настоящее изобретение также относится к способам получения fEPO полипептида, включающего некодируемую аминокислоту. В некоторых вариантах осуществления способы предусматривают культивирование клеток, включающих полинуклеотид или полинуклеотиды, кодирующие fEPO полипептид,ортогональную РНК-синтетазу и ортогональную тРНК, в условиях, позволяющих экспрессию fEPO полипептида; а также очистку fEPO полипептида из клеток и/или культуральной среды. Настоящее изобретение также относится к способам увеличения терапевтического периода полураспада, периода полураспада в сыворотке или продолжительность циркуляции fEPO. В некоторых вариантах осуществления способы предусматривают замену некодируемой аминокислоты какой-либо одной или несколькими аминокислотами в природном fEPO и/или соединение fEPO полипептида с водорастворимым полимером. Настоящее изобретение также относится к способам лечения пациента, нуждающегося в таком лечении, эффективным количеством молекулы fEPO согласно настоящему изобретению. В некоторых вариантах осуществления способы предусматривают введение пациенту терапевтически эффективного количества фармацевтической композиции, включающей fEPO полипептид, включающий некодируемую аминокислоту и фармацевтически приемлемый носитель. В некоторых вариантах осуществления некодируемая аминокислота связана с водорастворимым полимером. Настоящее изобретение также относится к fEPO полипептидам, включающим последовательность,показанную в SEQ ID NO:1, 2, 3 или 4, за исключением того, что по меньшей мере одна аминокислота заменена некодируемой аминокислотой. В некоторых вариантах осуществления некодируемая аминокислота связана с водорастворимым полимером. В некоторых вариантах осуществления водорастворимый полимер включает молекулу поли(этиленгликоля). В некоторых вариантах осуществления некодируемая аминокислота заменена в положении, выбранном из группы, состоящей из остатков, включая,помимо прочих, 1-6, 21-40, 68-89, 116-136, 162-166 из SEQ ID NO:2 или SEQ ID NO:4, или соответствующего аминокислотного положения SEQ ID NO:1 или SEQ ID NO:3. В некоторых вариантах осуществления некодируемая аминокислота включает карбонильную группу, аминооксигруппу, гидразидную группу, гидразиновую группу, семикарбазидную группу, азидную группу или алкиновую группу. Настоящее изобретение также относится к фармацевтическим композициям, включающим фармацевтически приемлемый носитель и fEPO полипептид, включающий последовательность, показанную вSEQ ID NO:1, 2, 3 или 4, в которой по меньшей мере одна аминокислота заменена некодируемой аминокислотой. Настоящее изобретение также относится к фармацевтическим композициям, включающим фармацевтически приемлемый носитель и fEPO полипептид, включающий последовательность, показанную в SEQ ID NO:2 или 4, в которой по меньшей мере одна аминокислота заменена некодируемой аминокислотой. В некоторых вариантах осуществления некодируемая аминокислота включает сахаридную группу. В некоторых вариантах осуществления водорастворимый полимер связан с полипептидом через сахаридную группу. Краткое описание фигур Фиг. 1 - диаграмма выравнивания последовательностей человеческого и кошачьего эритропоэтина. Фиг. 2 - диаграмма, на которой обозначено различие между двумя последовательностями, депонированными в Genbank (регистрационный номер Genbank U00685 и регистрационный номер GenbankL10606), консенсусная последовательность. Фиг. 3 - диаграмма общей структуры четырехспиральных пучков белка эритропоэтина (ЕРО), показанная с рецепторами высокой и низкой аффинности. Фиг. 4 - диаграмма с альтернативным изображением общей структуры четырехспиральных пучков белка эритропоэтина (ЕРО), показанная с рецепторами высокой и низкой аффинности. Фиг. 5 - диаграмма, на которой показаны некоторые выбранные сайты для введения некодируемых аминокислот. Фиг. 6 - диаграмма, на которой показан вид сверху некоторых выбранных сайтов для введения некодируемых аминокислот. Фиг. 7 - диаграмма, на которой показан вид сбоку некоторых выбранных сайтов для введения некодируемых аминокислот и обозначено, какие из указанных участков расположены вблизи от сайтов гликозилирования. Фиг. 8 - таблица с некоторыми выбранными сайтами для введения некодируемых аминокислот,природной аминокислоты, а также положение аминокислоты из SEQ ID NO:2 и SEQ ID NO:4, и среднее Сх для указанных сайтов. Фиг. 9 - диаграмма некоторых выбранных сайтов для введения некодируемых аминокислот, природной аминокислоты, а также положение аминокислот из SEQ ID NO:2 и SEQ ID NO:4, и среднее Сх для указанных сайтов. Фиг. 10 а - оптическая плотность при 450 нм в зависимости от концентрации буфера для композиции. Фиг. 10b - оптическая плотность при 450 нм в зависимости от концентрации эндотоксина. Фиг. 11 - схема анализа пролиферации TF-1. Фиг. 12 - схема гомодимеризации fEPO рецепторов при связывании с лигандом. Фиг. 13 - график зависимости оптической плотности (OD) при 450 нм при повышении концентраций fEPO, на котором показана колоколообразная кривая зависимости эффекта от дозы. Фиг. 14 - изображение различных плотностей клеток TF-1 при посеве. На данной диаграмме показано, что с учетом, например, пути сигнальной трансдукции JAK-STAT, для оптимальной активности в ответ на fEPO отношение между fEPO и fEPO рецептором составляет 1:2. Фиг. 15 - диаграмма экспериментальных результатов, определяющая, приводило ли выращивание клеток на минимальной среде к синхронизации клеточного деления и увеличивало динамический диапазон - результаты показали, что это не было особенно выгодно. Фиг. 16 - график условий, используемых для анализа TF-1 при плотности посева 20000, временем инкубирования 72 ч, начальной концентрацией fEPO 500 нг/мл и разведением 2,5. Фиг. 17 - таблица, определяющая достоверность анализа, в которой приведены данные относительно числа пассажей клеток, ЕС 50, диапазоны OD и динамические диапазоны. Фиг. 18 - таблица и график результатов анализа TF-1 с диким типом fEPO и буфером для композиции. Фиг. 19 - график, на котором сравниваются результаты анализа для человеческого и кошачьего ЕРО дикого типа. Фиг. 20 - график измеренных OD при различных концентрациях СНО обработанной и необработанной сред с fEPO дикого типа в качестве контроля. Фиг. 21 - график, на котором сравнивается fEPO дикого типа, CHO/PEI + 1,25 нг/мл fEPO и толькоCHO/PEI при уменьшении концентраций и их измеренные значения OD. Фиг. 22 - таблица и графики относительной активности вариантов fEPO с введенной неприродной аминокислотой, pAF, по сравнению с fEPO дикого типа. Фиг. 23 - гистограмма нескольких вариантов fEPO с введенным pAF в указанные сайты и каждое из их измеренных показателей ED50 нг/мл. Фиг. 24 - график варианта fEPO Е 72, хранившегося при 4 и минус 80 в течение более чем пяти недель, по сравнению с диким типом fEPO, а также их значения OD. Фиг. 25 - схема вектора Lucy F и положения тРНК, транскрипционного элемента интересующего гена и тРНК-синтетазы. Фиг. 26 - схема вектора Irwin и положения тРНК, транскрипционного элемента интересующего гена и тРНК-синтетазы. Фиг. 27 - схема подавляющей экспрессию конструкции Nat L BB-Opti FEPO в Lucy F для кошачьего эритропоэтина. Фиг. 28 - схема подавляющей экспрессию конструкции Nat L BB-Opti FEPO в Irwin для кошачьего эритропоэтина. Фиг. 29 - схема, на которой показана подавляющая экспрессию конструкция согласно изобретению,кодирующая антитело дженерик с генами легкой и тяжелой цепей. Фиг. 30 - гистограмма, на которой показаны уровни супрессии вариантов fEPO в присутствии pAF при измерении с помощью ELISA (OD-50). Фиг. 31 - показано сравнение перемещения ПЭГилированного fEPO при электрофорезе в ДСНПААГ. Дорожки 1-3: реакции 20 кДа ПЭГ с вариантом fEPO R53 pAF. Дорожка 1: R53, нанесено 8 мкгY49 pAF. Дорожка 7: Y49, нанесено 8 мкг fEPO, без ПЭГ. Дорожка 8: ПЭГилированный Y49, нанесено 8 мкг fEPO. Дорожка 9: ПЭГилированный Y49, нанесено 2 мкг fEPO. Горизонтальная стрелка на уровне 38 кДа указывает положение неПЭГилированного fEPO при движении в геле. Прямоугольная рамка указывает область движения ПЭГилированного fEPO. Фиг. 32 - электрофорезный гель ДСН-ПААГ, на котором показаны реакции ПЭГилирования (30 кДа) для вариантов fEPO D55 и Р 129 pAF, и представлены два соответствующих ПЭГилированных варианта. Дорожка 1: D55, без ПЭГ. Дорожка 2: ПЭГилированный D55. Дорожка 3: fEPO дикого типа, без инкубирования. Дорожка 4: Р 129, нанесено 8 мкг fEPO, без ПЭГ. Дорожка 5: ПЭГилированный Р 129,нанесено 2 мкг fEPO. Дорожка 6: ПЭГилированный Р 129, нанесено 8 мкг fEPO. Горизонтальная стрелка на уровне 38 кДа указывает положение неПЭГилированного fEPO при движении в геле. Прямоугольная рамка указывает область движения ПЭГилированного fEPO. Фиг. 33 - электрофорезный гель ДСН-ПААГ, на котором показана успешная реакция ПЭГилирования (30 кДа) для варианта fEPO Al pAF. На дорожке 1 показан fEPO дикого типа, нанесено 8 мкг, без инкубирования, и на дорожке 2 показан ПЭГилированный А 1. Фиг. 34 - сравнение аминокислотных последовательностей сЕРО (SEQ ID NO:31) и fEPO (SEQ IDNO:4), показана 94%-ная гомология между ними. Фиг. 35 - сравнение аминокислотных последовательностей еЕРО (SEQ ID NO:33) и fEPO (SEQ IDNO:4), показана 94%-ная гомология между ними. Фиг. 36 - график, на котором показаны эффекты различных обработок на гематокрит и эритроциты(Эц) в эксперименте, проведенном в примере 32. Определения Следует отметить, что настоящее изобретение не ограничено конкретной методологией, методиками, линиями клеток, конструкциями и реактивами, описанными в настоящем патенте, и по этой причине может изменяться. Следует также отметить, что терминология, используемая в настоящем патенте, служит исключительно в целях описания конкретных вариантов осуществления и не должна ограничивать объем настоящего изобретения, которое будет ограничено только прилагаемой формулой. Используемое в первоначальном тексте настоящего патента и прилагаемой формуле единственное число включает ссылку на множественное число, если из контекста прямо не следует иное. Таким образом, например, ссылка на "fEPO" является ссылкой на один или несколько таких белков и включает их эквиваленты, известные квалифицированным специалистам, и т.д. Если не определено иначе, то все технические и научные термины, используемые в настоящем патенте, имеют такое же значение, под которым они обычно понимаются средним специалистом в данной области техники, к которой относится настоящее изобретение. Хотя любые способы, устройства и материалы, подобные или эквивалентные описанным в настоящем изобретении, могут использоваться при осуществлении или тестировании изобретения, далее описываются предпочтительные способы, устройства и материалы. Все публикации и патенты, указанные в настоящем патенте, включены в настоящее изобретение путем ссылки для описания и раскрытия, например, конструкций и методологий, которые описаны в публикациях и которые могли бы использоваться в отношении рассматриваемого изобретения. Публикации, описанные в настоящем патенте, приведены исключительно в целях их описания до даты подачи настоящей заявки. Ничто в настоящем патенте не следует рассматривать как допущение того, что авторы настоящего изобретения не имеют права противопоставлять такое описание в силу приоритета более раннего изобретения или по какой-либо другой причине. Термин "по существу очищенный" относится к fEPO, который может по существу или практически не содержать компонентов, которые обычно сопровождают или взаимодействуют с белком, который присутствует в своей природной среде, т.е. в нативной клетке, или клетке-хозяине в случае рекомбинантно продуцируемого fEPO. fEPO, который может по существу не содержать клеточного материала,включает препарат белка, содержащего менее чем приблизительно 30%, менее чем приблизительно 25%,менее чем приблизительно 20%, менее чем приблизительно 15%, менее чем приблизительно 10%, менее чем приблизительно 5%, менее чем приблизительно 4%, менее чем приблизительно 3%, менее чем приблизительно 2% или менее чем приблизительно 1% (от сухого веса) белка-примеси. Если fEPO или его вариант рекомбинантно продуцируются клетками-хозяевами, белок может присутствовать в количестве приблизительно 30%, приблизительно 25%, приблизительно 20%, приблизительно 15%, приблизительно 10%, приблизительно 5%, приблизительно 4%, приблизительно 3%, приблизительно 2% или приблизительно 1% либо в меньшем количестве от сухого веса клеток. Если fEPO или его вариант рекомбинантно продуцируются клетками-хозяевами, белок может присутствовать в среде культивирования в количестве приблизительно 5 г/л, приблизительно 4 г/л, приблизительно 3 г/л, приблизительно 2 г/л, приблизительно 1 г/л, приблизительно 750 мг/л, приблизительно 500 мг/л, приблизительно 250 мг/л, приблизительно 100 мг/л, приблизительно 50 мг/л, приблизительно 10 мг/л или приблизительно 1 мг/л либо в меньшем количестве от сухого веса клеток. Таким образом, "по существу очищенный" fEPO, полученный способами по настоящему изобретению, может иметь чистоту по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, в частности,чистоту по меньшей мере приблизительно 75, 80, 85% и, более конкретно, чистоту по меньшей мере приблизительно 90%, чистоту по меньшей мере приблизительно 95%, чистоту по меньшей мере прибли-9 019653 зительно 99% или больше, как определяют с помощью соответствующих методов, таких как анализ с помощью электрофореза в ДСН-ПААГ, ОФ-ВЭЖХ, гель-фильтрации и капиллярного электрофореза."Рекомбинантная клетка-хозяин" или "клетка-хозяин" относится к клетке, которая включает экзогенный полинуклеотид, независимо от способа, используемого для введения, например, прямого поглощения, трансдукции, f-конъюгации или других методов, известных в уровне техники для создания рекомбинантных клеток-хозяев. Экзогенный полинуклеотид может поддерживаться как неинтегрируемый вектор, например плазмида, или, в альтернативе, может быть интегрирован в геном организма-хозяина. Используемый в настоящем патенте термин "среда" или "среды" включает любую культуральную среду, раствор, твердое, полутвердое вещество или твердую подложку, которые могут поддерживать или содержать любую клетку-хозяина, включая бактериальные клетки-хозяева, дрожжевые клетки-хозяева,клетки-хозяева насекомых, растительные клетки-хозяева, эукариотические клетки-хозяева, клеткихозяева млекопитающих, клетки СНО или Е.coli, а также содержимое клетки. Таким образом, термин может включать среду, в которой клетка-хозяин была выращена, например среду, в которую был секретирован fEPO, включая среду до или после стадии пролиферации. Термин также может включать буферы или реактивы, которые содержат лизаты клеток-хозяев, как, например, в случае, когда fEPO синтезируется внутриклеточно, после чего клетки-хозяева лизируют или разрушают для выделения fEPO. Используемый в настоящем патенте "IRES" или участок внутренней посадки рибосомы известен специалистам, квалифицированным в данной области техники. IRES представляет собой область молекулы нуклеиновой кислоты, например молекулы мРНК, на которой происходит внутренняя посадка/связывание рибосомы, достаточная для инициации трансляции в анализе кэп-независимой трансляции, как, например, в бицистронном репортерном анализе, описанного в патенте США 6715821. НаличиеIRES в молекуле мРНК позволяет проводить кэп-независимую трансляцию связанной последовательности, кодирующей белок, которая иначе не могла бы транслироваться. IRES сначала были идентифицированы в пикорнавирусах и считаются эталоном для кэп-независимой трансляции. 5'-UTR у всех пикорнавирусов являются длинными и опосредуют инициацию трансляции при непосредственном рекрутинге и связывании рибосом, обходя, таким образом, начальную стадию связывания кэпа.IRES-элементы часто присутствуют в вирусных мРНК и редко присутствуют в невирусных мРНК. До настоящего времени невирусные мРНК, которые, как было показано, содержат функциональныеIRES-элементы в своих соответствующих 5'-UTR, включают мРНК, которые кодируют белок, связывающий тяжелую цепь иммуноглобулина (BIP) (Macejak, D.J. et al., Nature 353:90-94 (1991; DrosophilaAntennapedia (Oh, S.K. et al., Genes Dev. 6:1643-53 (1992; Ultrabithoran (Ye, X. et al., Mol. Cell. Biol. 17:1714-21 (1997; фактор роста фибробластов 2 (Vagner et al., Mol. Cell. Biol. 15:35-47 (1915); фактор инициации (Gan et al., J. Biol. Chem. 273:5006-12 (1992); белок-онкоген c-myc (Nambru et al., J. Biol.Chem. 272:32061-6 (1995; Stonely M. Oncogene 16:423-8 (1998; фактор роста эндотелия сосудов(VEGF) (Stein J. et al., Mol. Cell. Biol. 18:3112-9 (1998. Клеточные IRES-элементы не имеют какой-либо очевидной последовательности или структурного подобия с IRES-последовательностями или друг с другом, и поэтому их идентифицируют, используя трансляционный анализ. Другим известным IRES является XIAP IRES, раскрытый в патенте США 6171821, включенном в настоящее изобретение путем ссылки."Восстановитель", используемый в настоящем патенте в отношении рефолдинга белка, определяется как любое соединение или материал, который несет сульфгидрильные группы в восстановленном состоянии и восстанавливает внутри- или межмолекулярные дисульфидные связи. Подходящие восстановители включают, помимо прочих, дитиотреитол (DTT), 2-меркаптоэтанол, дитиоэритрит, цистеин, цистеамин (2-аминоэтантиол) и восстановленный глутатион. Среднему специалисту в данной области техники очевидно, что для использования в способах по настоящему изобретению подходит большое разнообразие восстановителей."Окислитель", используемый в настоящем патенте в отношении рефолдинга белка, определяется как любое соединение или материал, который способен отнимать электрон от окисляемого соединения. Подходящие окислители включают, помимо прочего, окисленный глутатион, цистин, цистамин, окисленный дитиотреитол, окисленный эритрит и кислород. Среднему специалисту в данной области техники очевидно, что для применения в способах по настоящему изобретению подходит большое разнообразие окислителей."Денатурирующий агент" или "денатурант", используемый в настоящем патенте, определяется как любое соединение или материал, который вызывает обратимое разворачивание белка. Сила денатурирующего агента или денатуранта определяется как свойствами, так и концентрацией конкретного денатурирующего агента или денатуранта. Подходящие денатурирующие агенты или денатуранты могут являться хаотропными соединениями, детергентами, органическими, смешивающимися с водой растворителями, фосфолипидами или комбинацией двух или более таких агентов. Подходящие хаотропные соединения включают, помимо прочего, мочевину, гуанидин и тиоционат натрия. Применимые детергенты могут включать, помимо прочего, сильные детергенты, такие как додецилсульфат натрия или эфиры полиоксиэтилена (например, детергенты Tween или Triton), Sarkosyl, мягкие неионные детергенты (например, дигитонин), мягкие катионные детергенты, такие как N2,3-(диолеилокси)пропил-N,N,Nтриметиламмоний, мягкие ионные детергенты (например, холат натрия или дезоксихолат натрия) или цвиттерионные детергенты, включая, помимо прочего, сульфобетаины (Zwittergent), 3-(3 холамидопропил)диметиламмоний-1-пропансульфат (CHAPS) и 3-(3-холамидопропил)диметиламмоний 2-гидрокси-1-пропансульфонат (CHAPSO). В качестве денатурантов могут использоваться органические,смешивающиеся с водой растворители, такие как ацетонитрил, низшие алканолы (в особенности С 2-С 4 алканолы, такие как этанол или изопропанол) или низшие алкандиолы (в особенности С 2-С 4-алкандиолы,такие как этиленгликоль). Фосфолипиды, применимые в настоящем изобретении, могут являться природными фосфолипидами, такими как фосфатидилэтаноламин, фосфатидилхолин, фосфатидилсерин и фосфатидилинозит, или синтетическими производными фосфолипидов либо такими вариантами, как дигексаноилфосфатидилхолин или дигептаноилфосфатидилхолин."Рефолдинг", используемый в настоящем патенте, описывает любой процесс, реакцию или способ,в котором полипептиды, содержащее дисульфидную связь, переводятся из неправильно свернутого или развернутого состояния в нативную или правильно свернутую конформацию в отношении дисульфидных связей."Кофолдинг", используемый в настоящем патенте, относится, в частности, к процессам, реакциям или способам рефолдинга, в которых используются по меньшей мере два полипептида, взаимодействующих друг с другом и которые приводят к трансформации развернутых или неправильно свернутых полипептидов в нативные, правильно свернутые полипептиды. Используемый в настоящем патенте "эритропоэтин" или "ЕРО" включает такие полипептиды и белки, которые обладают по меньшей мере одной биологической активностью кошачьего эритропоэтина(fEPO), а также аналоги эритропоэтина, изоформы эритропоэтина (такие как описанные в патенте США 5856298, который включен в настоящее изобретение путем ссылки), миметики эритропоэтина, такие как описанные в патенте США 6310078, который включен в настоящее изобретение путем ссылки), фрагменты эритропоэтина, гибридные белки эритропоэтина, слитые белки, олигомеры и мультимеры, гомологи,варианты профиля гликозилирования и мутеины, независимо от их биологической активности, а также независимо от способа из синтеза или получения, включая, помимо прочего, рекомбинантные (полученные с кДНК или геномной ДНК), синтетические, трансгенные методы и методы активации генов. Конкретные примеры эритропоэтина включают, помимо прочего, эпоэтин альфа (такой как описанные в патентах США 4667016; 4703008; 5441868; 5547933; 5618698; 5621080; 5756349 и 5955422, которые включены в настоящее изобретение путем ссылки), дарбэпоэтин альфа (такой как описанный в заявке на патент Европы ЕР 640619), DYNEPO (эпоэтин дельта), аналог человеческого эритропоэтина (такой как слитые белки человеческого сывороточного альбумина, описанные в международной заявке WO 9966054 и патентах США 6548653 и 5888772, которые включены в настоящее изобретение путем ссылки), мутанты эритропоэтина (такие как описанные в международной заявке WO 9938890 и патентах США 6489293; 5888772; 5614184 и 5457089, которые включены в настоящее изобретение путем ссылки), эритропоэтин омега (который может быть получен из Ара I рестрикционного фрагмента гена эритропоэтина человека,описанный в патентах США 5688679; 6099830; 6316254 и 6682910, которые включены в настоящее изобретение путем ссылки), измененный гликозилированный человеческий эритропоэтин (такой как описанный в международной заявке WO 9911781 и ЕР 1064951) и ПЭГ-конъюгированные аналоги эритропоэтина (такие как описанные в WO 9805363 и патентах США 5643575; 6583272; 6340742 и 6586398, которые включены в настоящее изобретение путем ссылки). Конкретные примеры клеточных линий, модифицированных с целью экспрессии эндогенного человеческого эритропоэтина, описаны в международных заявках WO 9905268 и WO 9412650 и патенте США 6376218, которые включены в настоящее изобретение путем ссылки. Термин "кошачий эритропоэтин (fEPO)" или "fEPO полипептид" относится к эритропоэтину или ЕРО, как описано выше, а также полипептиду, который сохраняет по меньшей мере одну биологическую активность природного fEPO. fEPO полипептиды включают фармацевтически приемлемые соли и пролекарства, и пролекарства солей, полиморфы, гидраты, сольваты, биологически активные фрагменты,биологически активные варианты и стереоизомеры природного кошачьего эритропоэтина, а также агонист, миметик и варианты антагониста природного человеческого эритропоэтина и его слитые полипептиды. Примеры полипептидов и миметиков fEPO включают описанные в патентах США 6310078; 5106954; 6703480; 6642353; 5986047 и 5712370, которые включены в настоящее изобретение путем ссылки. Слитые полипептиды, включающие дополнительные аминокислоты на аминоконце и/или карбоксиконце, охватываются термином "fEPO полипептид". Примеры слитых полипептидов включают, помимо прочего, например, метионил-эритропоэтин, в котором метионин связан с N-концом fEPO, слитые полипептиды для очистки (включая, помимо прочего, поли-гистидин или аффинные эпитопы), слитые полипептиды с пептидами, связывающими сывороточный альбумин, и слитые полипептиды с сывороточными белками, такими как сывороточный альбумин. Природная нуклеиновая кислота и аминокислотная последовательность fEPO являются известными. Относительно полной природной аминокислотной последовательности fEPO, a также зрелой природной аминокислотной последовательности hEPO, см. SEQ IDNO:1 и SEQ ID NO:2 соответственно в настоящем патенте. Относительно полной консенсусной аминокислотной последовательности fEPO, а также зрелой консенсусной аминокислотной последовательности осуществления fEPO полипептиды согласно изобретению по существу идентичны SEQ ID NO:1, SEQ IDNO:2, SEQ ID NO:3 или SEQ ID NO:4. Молекулы нуклеиновой кислоты, кодирующие мутантные fEPO и мутантные fEPO полипептиды, также известны. Примеры мутантов fEPO включают раскрытые в патентах США 6489293; 6153407; 6048971; 5614184 и 5457089, которые включены в настоящее изобретение путем ссылки. Эритропоэтин или fEPO обладают разнообразными биологическими функциями, включая, помимо прочих, связывание со своим рецептором, приводящее к димеризации его рецептора, стимуляцию выработки эритроцитов и стимуляцию пролиферации клеток. Примеры некоторых из биологических функций эритропоэтина и hEPO описаны в патентах США 6676947; 6579525; 6531121; 6521245; 6489293; 6368854; 6316254; 6268336; 6239109; 6165283; 5986047; 5830851 и 5773569, которые включены в настоящее изобретение путем ссылки. Биологически активные фрагменты/варианты fEPO включают продукт гена, содержащий 192 аминокислоты, из которых первые 26 отщепляются в процессе секреции, а также удаляется одна или более из последних четырех аминокислот в процессе образования зрелой формы эритропоэтина (SEQ ID NO:1 и SEQ ID NO:2). Термин "fEPO полипептид" также включает гликозилированные формы, с участками Nсцепленного гликозилирования в 24, 38 и 83, и участком О-сцепленного гликозилирования в 126 (Takeuchi et al. (1988), JBC 263: 3657-3663; Saski et al. (1988), Biochemistry 27; 8618-8626). Варианты, содержащие однонуклеотидные изменения (т.е. S104N и L105F, P122Q, E13Q, Q58QQ, G113R), также рассматриваются как биологически активные варианты hEPO (Jacobs et al. (1985), Nature 313: 806-810; Funakoshiet al. (1993), Biochem. Biophys. Res. Comm. 195: 717-722). Термин "fEPO полипептид" также включает гетеродимеры fEPO, гомодимеры, гетеромультимеры или гомомультимеры fEPO или любого другого полипептида, белка, углевода, полимера, малой молекулы, лиганда или другой активной молекулы любого типа, связанных химическими способами или экспрессируемых в виде слитого белка (Sytkowski et al.(1998), Proc. Natl. Acad. Sci. USA 95(3):1184-8; и Sytkowski et al. (1999), J.Biol.Chem. 274(35):24773-8, а также патенты США 6187564; 6703480; 5767078, которые включены в настоящее изобретение путем ссылки), а также аналогов полипептида, содержащих специфические делеции и сохраняющих при этом биологическую активность (Boissel et al. (1993), JBC 268: 15983-15993; Wen et al. (1994), JBC 269: 2283922846; Bittorf et al. (1993), FEBS 336: 133-136; и патент США 6153407, которые включены в настоящее изобретение путем ссылки). Все ссылки на положения аминокислот в fEPO, описанные в настоящем патенте, основаны на положении в SEQ ID NO:2, если не определено иное (т.е. когда указано, что сравнение основано на SEQ IDNO:3). Специалисты в данной области сумеют понять, что положения аминокислот, которые соответствуют положениям в SEQ ID NO:2, могут быть с легкостью идентифицированы в слитых белках, вариантах, фрагментах fEPO и т.д. Например, программы выравнивания последовательности, такие как BLAST,могут использоваться для выравнивания и идентификации специфического положения в белке, которое соответствует положению в SEQ ID NO:2. Замены, делеции или вставки аминокислот, описанные в настоящем патенте в отношении SEQ ID NO:2, также относятся к заменам, делециям или вставкам в соответствующих положениях в слитых белках, вариантах, фрагментах fEPO и т.д., описанным в настоящем патенте или известным в уровне техники, и прямо включены в объем настоящего изобретения. Термин "fEPO полипептид" включает fEPO полипептиды, включающие одну или более аминокислотных замен, вставок или делеции. Были описаны примеры замен в большом разнообразии положений аминокислот в природном fEPO, включая, помимо прочего, замены, которые повышают активность агониста, увеличивают растворимость полипептида, превращают полипептид в антагонист и т.д., и также охвачены термином "fEPO полипептид". Антагонисты кошачьего ЕРО включают, помимо прочего, антагонистов fEPO с заменами в V11,R14, Y15, D96, K97, S100, R103, S104, Т 107, L108 и R110 (включая, помимо прочего, V11S, R14Q, Y151,S100E, R103A, S104I и L108K, см. Elliot et al., 1993), обнаруженными в сайте связывания рецептора низкой аффинности (сайт 2). В некоторых вариантах осуществления антагонисты fEPO включают по меньшей мере одну замену в областях 10-15 или 100-108, которые приводят к тому, что fEPO действует как антагонист. См., например, Elliot et al., 1993 и Cheetham et al., 1998. В некоторых вариантах осуществления антагонист fEPO включает некодируемую аминокислоту, связанную с водорастворимым полимером,который присутствует в связывающей области сайта 2 молекулы hEPO. В некоторых вариантах осуществления fEPO полипептид дополнительно модифицирован и содержит следующие замены: V11S, R14Q,Y15I, S100E, R103A, S104I и L108K. В некоторых вариантах осуществления fEPO полипептиды также включают вставку, замену или делецию, которые модулируют биологическую активность fEPO. Например, вставки, замены или делеции могут модулировать аффинность к fEPO рецептору, модулировать (включая, помимо прочего, увеличение или уменьшение) димеризацию рецептора, стабилизировать димер рецептора, модулировать период полураспада в сыворотке, модулировать период полураспада при циркуляции, модулировать стабильность полипептида, модулировать дозу, модулировать высвобождение или биодоступность, облегчать очистку или улучшать либо изменять конкретный путь введения. Аналогичным образом, fEPO полипептиды могут включать последовательности расщепления протеазой, активные группы, антитело- 12019653 связывающие домены (включая, помимо прочего, FLAG или поли-His) или другие основанные на аффинности последовательности (включая, помимо прочего, FLAG, поли-His, GST и т.д.) либо связанные молекулы (включая, помимо прочего, биотин), которые улучшают обнаружение (включая, помимо прочего, GFP), очистку или другие признаки полипептида. Термин "fEPO полипептид" также включает гомодимеры fEPO, гетеродимеры, гомомультимеры и гетеромультимеры, связанные непосредственно через боковые цепи некодируемых аминокислот, с одинаковыми или различными боковыми цепями некодируемых аминокислот, с боковыми цепями природных аминокислот, или опосредованно, через линкер. Примеры линкеров включают, помимо прочего,водорастворимые полимеры, такие как поли(этиленгликоль), или полидекстран, или полипептид."Некодируемая аминокислота" относится к аминокислоте, которая не входит в 20 стандартных аминокислот или не является пирролизином или селеноцистеином. Термин "некодируемая аминокислота" включает, помимо прочего, аминокислоты, которые существуют в природе и образуются в результате модификации природной аминокислоты (включая, помимо прочего, 20 стандартных аминокислот или пирролизин и селеноцистеин), но самостоятельно не включаются в растущую полипептидную цепь комплексом трансляции. Примеры природных аминокислот, которые не являются кодируемыми, включают,помимо прочего, N-ацетилглюкозаминил-L-серин, N-ацетилглюкозаминил-L-треонин и О-фосфотирозин."Группа, модифицирующая аминоконец" относится к любой молекуле, которая может быть присоединена к аминоконцу полипептида. Аналогично, "группа, модифицирующая карбоксиконец" относится к любой молекуле, которая может быть присоединена к карбоксиконцу полипептида. Модифицирующие концевые группы включают, помимо прочего, различные водорастворимые полимеры, пептиды или белки, такие как сывороточный альбумин, или другие молекулы, которые увеличивают период полураспада пептидов в сыворотке. Термины "функциональная группа", "активная группа", "активирующая группа", "уходящая группы", "активный сайт", "химически активная группа" и "химически активная молекула" используется в уровне техники и настоящем изобретении для обозначения различных, определяемых частей или звеньев молекулы. Термины в некоторой степени являются синонимичными в области химии и используются в настоящем патенте для обозначения частей молекул, которые выполняют некоторую функцию или обладают активностью и могут взаимодействовать с другими молекулами. Термин "связь" или "линкер" используются в настоящем патенте для обозначения групп или связей,которые обычно формируются в результате химической реакции и обычно являются ковалентными связями. Гидролитически устойчивые связи означают, что связи по существу устойчивы в воде и не реагируют с водой при используемых значениях рН, включая, помимо прочего, физиологические условия, в течение длительного промежутка времени, возможно, даже неограниченно. Гидролитически неустойчивые или расщепляемые связи означают, что связи расщепляются в воде или в водных растворах, включая, например, кровь. Энзиматически неустойчивые или расщепляемые связи означают, что связь может расщепляться одним или несколькими ферментами. Как известно из уровня техники, ПЭГ и подобные полимеры могут включать расщепляемые связи в полимерной цепи или в линкерной группе между полимерной цепью и одной или несколькими концевыми функциональными группами молекулы полимера. Например, сложноэфирные связи, образованные в реакции ПЭГ-карбоновых кислот или активированных ПЭГ-карбоновых кислот со спиртовыми группами на биологически активном агенте, обычно гидролизируются в физиологических условиях с высвобождением агента. Другие гидролитически расщепляемые связи включают, помимо прочего, карбонатные связи; иминовые связи, образующиеся в результате реакции амина и альдегида; фосфат-сложноэфирные связи, образующиеся в реакции спирта с фосфатной группой; гидразоновые связи, которые являются продуктом реакции гидразида и альдегида; ацетальные связи, которые являются продуктом реакции альдегида и спирта; ортоэфирные связи, которые являются продуктом реакции формиата и спирта; пептидные связи, образуемые аминогруппой, включая, помимо прочего, на конце полимера, такого как ПЭГ, и карбоксильной группой пептида; а также олигонуклеотидные связи, образуемые фосфорамидитной группой, включая, помимо прочего, на конце полимера, и 5'-гидроксильной группой олигонуклеотида. Термин "биологически активная молекула", "биологически активная группа" или "биологически активный агент", при использовании в настоящем описании, означает любое вещество, которое может влиять на любые физические или биохимические параметры биологического организма, включая, помимо прочего, вирусов, бактерий, грибов, растений, животных и людей. В частности, используемые в настоящем описании биологически активные молекулы, включают, помимо прочего, любое вещество, предназначенное для диагностики, терапии, смягчения, лечения или профилактики заболевания у людей или других животных, или иного улучшения физического или умственного состояния людей или животных. Примеры биологически активных молекул включают, помимо прочего, пептиды, белки, ферменты, низкомолекулярные лекарственные соединения, красители, липиды, нуклеозиды, олигонуклеотиды, клетки,вирусы, липосомы, микрочастицы и мицеллы. Классы биологически активных агентов, которые подходят для применения в настоящем изобретении, включают, помимо прочего, антибиотики, фунгициды,противовирусные средства, противовоспалительные средства, противоопухолевые средства, сердечнососудистые средства, анксиолитики, гормоны, факторы роста, стероидные средства и т.п."Бифункциональный полимер" относится к полимеру, включающему две отдельные функциональные группы, которые способны специфично взаимодействовать с другими молекулами (включая, помимо прочего, боковые группы аминокислот) с образованием ковалентных или нековалентных связей. Бифункциональный линкер, имеющий одну функциональную группу, взаимодействующую с группой на конкретном биологически активном компоненте, и другую группу, взаимодействующую с группой на втором биологически активном компоненте, может использоваться для получения конъюгата,который включает первый биологически активный компонент, бифункциональный линкер и второй биологически активный компонент. Известно множество методик и линкерных молекул для присоединения различных соединений к пептидам. См., например, заявку на патент Европы 188256; патенты США 4671958; 4659839; 4414148; 4699784; 4680338; 4569789 и 4589071, которые включены в настоящее изобретение путем ссылки. "Многофункциональный полимер" относится к полимеру, включающему две или более отдельных функциональных группы, которые способны специфично взаимодействовать с другими молекулами (включая, помимо прочего, боковые группы аминокислот) с образованием ковалентных или нековалентных связей. Когда группы заместителей обозначены своими стандартными химическими формулами, написанными слева направо, они в равной мере охватывают химически идентичные заместители, которые являлись бы результатом написания структуры справа налево, например, -СН 2 О- эквивалентно -ОСН 2-. Термин "заместители" включает, помимо прочего "невзаимодействующие заместители". "Невзаимодействующие заместители" являются такими группами, которые дают стабильные соединения. Подходящие невзаимодействующие заместители или радикалы включают, помимо прочего, галоген, C1-С 10 алкил, С 2-С 10-алкенил, С 2-С 10-алкинил, C1-С 10-алкокси, С 1-С 12-аралкил, С 1-С 12-алкарил, С 3-С 12 циклоалкил, С 3-С 12-циклоалкенил, фенил, замещенный фенил, толуоил, ксиленил, бифенил, С 2-С 12 алкоксиалкил, С 2-С 12-алкоксиарил, С 7-С 12-арилоксиалкил, C7-C12-оксиарил, C1-С 6-алкилсульфинил, C1 С 10-алкилсульфонил, -(СН 2)m-О-(C1-С 10-алкил), где m равно 1-8, арил, замещенный арил, замещенный алкокси, фторалкил, гетероциклический радикал, замещенный гетероциклический радикал, нитроалкил,-NO2, -CN, -NRC(О)-(C1-С 10-алкил), -С(О)-(C1-С 10-алкил), С 2-С 10-алкилтиоалкил, -С(O)O-(C1-С 10-алкил),-ОН, -SO2, =S, -COOH, -NR2, карбонил, -C(O)-(C1-C10-алкил)-CF3, -C(O)-CF3, -C(O)NR2, -(C1-С 10-арил)-S(C6-C10-арил), -C(O)-(C1-C10-арил), -(СН 2) m-O-(-(CH2)m-O-(C1-С 10-алкил), где каждое m равно 1-8,-C(O)NR2, -C(S)NR2, -SO2NR2, -NRC(O)NR2, -NRC(S)NR2, их соли и т.п. Каждый R, используемый в настоящем описании, обозначает Н, алкил или замещенный алкил, арил или замещенный арил, аралкил или алкарил. Термин "галоген" включает фтор, хлор, йод и бром. Термин "алкил", отдельно или как часть другого заместителя, обозначает, если не указано иное, линейный или разветвленный либо циклический углеводородный радикал или комбинацию перечисленного, который может быть полностью насыщенным, моно- или полиненасыщенным и может включать дии многовалентные радикалы, содержащие указанное число атомов углерода (т.е. C1-С 10 означает одиндесять атомов углерода). Примеры насыщенных углеводородных радикалов включают, помимо прочего,такие группы, как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, циклогексил, (циклогексил)метил, циклопропилметил, гомологи и изомеры, например, н-пентил, н-гексил, нгептил, н-октил и т.п. Ненасыщенная алкильная группа является группой, содержащей одну или более двойных связей или тройных связей. Примеры ненасыщенных алкильных групп включают, помимо прочего, винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3- (1,4-пентадиенил),этинил, 1- и 3-пропинил, 3-бутинил, а также гомологи и изомеры более высокого порядка. Термин "алкил", если не указано иное, также включает такие производные алкила, которые более подробно определены ниже, такие как "гетероалкил". Алкильные группы, которые ограничены углеводородными группами, называются "гомоалкил". Термин "алкилен", отдельно или как часть другого заместителя, означает двухвалентный радикал,производный алкана, примеры которого включают, помимо прочего, структуры -СН 2 СН 2- и-СН 2 СН 2 СН 2 СН 2-, и дополнительно включает группы, описанные ниже, такие как "гетероалкилен". Как правило, алкильная (или алкиленовая) группа содержит от 1 до 24 атомов углерода, при этом группы,содержащие 10 атомов углерода или меньше, являются предпочтительными в настоящем изобретении."Низший алкил" или "низший алкилен" являются алкильной или алкиленовой группой с более короткой цепью, обычно содержащей восемь или меньше атомов углерода. Термины "алкокси", "алкиламино" и "алкилтио" (или тиоалкокси) используются в своем обычном значении, и относятся к алкильным группам, присоединенным к остальной части молекулы через атом кислорода, аминогруппу или атом серы соответственно. Термин "гетероалкил", отдельно или в комбинации с другим термином, означает, если не указано иное, устойчивый линейный или разветвленный либо циклический углеводородный радикал, или комбинацию перечисленного, состоящий из указанного числа атомов углерода и по меньшей мере одного гетероатома, выбранного из группы, состоящей из О, N, Si и S, и где атомы азота и серы могут быть необязательно окислены, а гетероатом азота может быть необязательно четвертичным. Гетероатом(ы) О, N и S иSi может находиться в любом внутреннем положении гетероалкильной группы или в положении, в кото- 14019653 ром алкильная группа присоединена к остальной части молекулы. Примеры включают, помимо прочего,-СН 2-СН 2-О-СН 3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-СН 3, -СН 2-СН 2, -S(O)-CH3,-CH2-CH2-S(О)2-СН 3, -СН=СН-О-СН 3, Si(CH3)3, -CH2-CH=N-OCH3 и -CH=CH-N(CH3)-CH3. До двух гетероатомов могут располагаться последовательно, как, например, в -CH2-NH-OCH3 и -CH2-O-Si(CH3)3. Аналогично, термин "гетероалкилен", отдельно или как часть другого заместителя, означает двухвалентный радикал, производный гетероалкила, примеры которого включают, помимо прочего, -CH2-CH2-SCH2-CH2- и -CH2-S-CH2-CH2-NH-CH2-. Относительно гетероалкиленовых групп, одинаковые или различные гетероатомы могут также занимать один или оба конца цепи (включая, помимо прочего, алкиленокси, алкилендиокси, алкиленамино, алкилендиамино, аминооксиалкилен и т.п.). Более того, относительно алкиленовых и гетероалкиленовых линкерных групп, никакой ориентации линкерной группы не подразумевается в том направлении, в котором написана формула линкерной группы. Например, формула-C(O)2R'- обозначает и -C(O)2R'-, и -R'C(O)2-. Термины "циклоалкил" и "гетероциклоалкил", сами по себе или в комбинации с другими терминами, если не указано иное, обозначают циклические варианты "алкила" и "гетероалкила" соответственно. Таким образом, циклоалкил или гетероциклоалкил включают насыщенные и ненасыщенные кольцевые связи. Кроме того, относительно гетероциклоалкила, гетероатом может занимать положение, в котором гетероцикл присоединен к остальной части молекулы. Примеры циклоалкила включают, помимо прочего, циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил и т.п. Примеры гетероциклоалкила включают, помимо прочего, 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил,3-пиперидинил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, 1-пиперазинил, 2-пиперазинил и т.п. Используемый в настоящем патенте термин "водорастворимый полимер" относится к любому полимеру, растворимому в водных растворителях. Связь водорастворимых полимеров с fEPO может приводить к изменениям, включая, помимо прочего, увеличенный или модулированный полупериод существования в сыворотке или увеличенный или модулированный терапевтический полупериод по сравнению с немодифицированной формой, модулированную иммуногенность, модулированные свойства физической ассоциации, например, агрегация и образование мультимеров, измененное связывание с рецептором и измененная димеризация или мультимеризация рецептора. Водорастворимый полимер может иметь или не иметь своей собственной биологической активности. Подходящие полимеры включают, помимо прочего, полиэтиленгликоль, полиэтиленгликоль-пропиональдегид, их моно C1-С 10-алкокси или арилокси производные (описанные в патенте США 5252714, который включен в настоящее изобретение путем ссылки), монометоксиполиэтиленгликоль, поливинилпирролидон, поливиниловый спирт, полиаминокислоты, сополимер дивинилового эфира и малеинового ангидрида, N-(2-гидроксипропил)метакриламид, декстран, производные декстрана, включая декстрансульфат, полипропиленгликоль, сополимер полипропиленоксида/этиленоксида, полиоксиэтилированный полиол, гепарин, фрагменты гепарина, полисахариды, олигосахариды, гликаны, целлюлоза и производные целлюлозы, включая, помимо прочего, метилцеллюлозу и карбоксиметилцеллюлозу, крахмал и производные крахмала, полипептиды,полиалкиленгликоль и его производные, сополимеры полиалкиленгликолей и их производных, поливинилэтиловые эфиры и альфа-бета-поли(2-гидроксиэтил)-DL-аспартамид и т.п., или смеси перечисленного. Примеры таких водорастворимых полимеров включают, помимо прочего, полиэтиленгликоль и сывороточный альбумин. Используемый в настоящем патенте термин "полиалкиленгликоль" относится к полиэтиленгликолю, полипропиленгликолю, полибутиленгликолю и их производным. Термин "полиалкиленгликоль" охватывает линейные и разветвленные полимеры со средней молекулярной массой от 1 до 100 кДа. Другие примеры перечислены, например, в каталогах коммерческих производителей, например, в каталоге корпорации Shearwater "Polyethylene Glycol and Derivatives for Biomedical Applications" (2001). Термин "арил" означает, если не указано иное, полиненасыщенный, ароматический углеводородный заместитель, который может иметь одно кольцо или несколько колец (предпочтительно от 1 до 3 колец), которые сконденсированы вместе или связаны ковалентно. Термин "гетероарил" относится к арильным группам (или кольцам), которые содержат от одного до четырех гетероатомов, выбранных изN, О и S, где атомы азота и серы необязательно окислены, а атом(ы) азота необязательно является четвертичными. Гетероарильная группа может быть присоединена к остальной части молекулы через гетероатом. Неограничивающие примеры арильных и гетероарильных групп включают фенил, 1-нафтил, 2 нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5 изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3 пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, 5 индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил и 6-хинолил. Заместители для каждой вышеуказанной известной арильной и гетероарильной кольцевых систем выбраны из группы приемлемых заместителей, описанных ниже. Для краткости, термин "арил", при использовании в комбинации с другими терминами (включая,помимо прочего, арилокси, арилтиокси, арилалкил), включает как арильное, так и гетероарильное коль- 15019653 ца, как определено выше. Таким образом, термин "арилалкил" включает радикалы, в которых арильная группа присоединена к алкильной группе (включая, помимо прочего, бензил, фенэтил, пиридилметил и т.п.), включая алкильные группы, в которых атом углерода (включая, помимо прочего, метиленовую группу) был замещен, например, атомом кислорода (включая, помимо прочего, феноксиметил, 2 пиридилоксиметил, 3-(1-нафтилокси)пропил и т.п.). Каждый из вышеуказанных терминов (включая, помимо прочего, "алкил", "гетероалкил", "арил" и"гетероарил") включают замещенные и незамещенные формы указанного радикала. Примеры заместителей для каждого типа радикалов приведены ниже. Заместители для алкильных и гетероалкильных радикалов (включая группы, часто называемые как алкилен, алкенил, гетероалкилен, гетероалкенил, алкинил, циклоалкил, гетероциклоалкил, циклоалкенил,и гетероциклоалкенил) могут быть одной или несколькими различными группами, выбранными, помимо прочего, из следующего: -OR', =O, =NR', -N-OR', -NR'R", -SR', -галоген, -SiR'R"R'", -OC(O)R', -C(O)R',-CO2R', CONR'R", -OC(O)NR'R", -NR"C(O)R', -NR'-C(O)NR"R'", -NR"C(O)2R', -NR-C(NR'R"R'")=NR,-NR-C(NR'R")=NR'", -S(O)R', -S(O)2R', -S(O)2NR'R", -NRSO2R', -CN и -NO2, в количестве от ноля до(2m'+1), где m' является общим количеством атомов углерода в таком радикале. Каждый R', R", R'" и R независимо относится к водороду, замещенному или незамещенному гетероалкилу, замещенному или незамещенному арилу, включая, помимо прочего, арил, замещенный 1-3 галогенами, замещенному или незамещенному алкилу, алкокси или тиоалкоксигруппам, или арилалкильным группам. Если соединение по изобретению включает больше одной группы R, например, каждая из групп R независимо выбрана из каждой группы R', R", R'" и R, тогда присутствует больше одной из указанных групп. Когда R' и R" присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота, формируя 5-,6- или 7-членное кольцо. Например, -NR'R" включает, помимо прочих, 1-пирролидинил и 4-морфолинил. Из представленного выше описания заместителей специалисту в данной области техники будет очевидно, что термин "алкил" включает группы, в которых к атомам углерода присоединены группы, отличные от водородных групп, такие как галоалкил (включая, помимо прочего, -CF3 и -CH2CF3) и ацил (включая,помимо прочего, -С(О)СН 3, -C(O)CF3, -C(O)CH2OCH3 и т.п.). Аналогично заместителям, описанным для алкильного радикала, заместители для арильных и гетероарильных групп различаются и выбраны, помимо прочего, из следующего: галоген, -OR1, =O, =NR',=N-OR, -NR'R", -SR1, -галоген, -SiR'R"R'", -OC(O)R', -C(O)R', -CO2R', -CONR'R", -OC(O)NR'R",-NR"C(O)R', -NR'-C(O)NR"R'", -NR"C(O)2R', -NR-C(NR'R"R"')=NR, -NR-C(NR'R")=NR" ', -S(O)R',-S(O)2R', -S(O)2NR'R", -NRSO2R', -CN и -NO2, -R', -N3, -CH(Ph)2, фтор(С 1-С 4)алкокси и фтор(C1-C4)алкил,в количестве от ноля до полного количества открытых валентностей на ароматической кольцевой системе; и где R', R", R'" и R независимо выбраны из водорода, алкила, гетероалкила, арила и гетероарила. Если соединение по изобретению включает больше одной группы R, например, каждая из групп R независимо выбрана из каждой группы R', R", R'" и R, тогда присутствует больше одной из указанных групп. Используемый в настоящем описании термин "модулированный период полураспада в сыворотке" означает положительное или отрицательное изменение периода полураспада при циркуляции модифицированной биологически активной молекулы по сравнению с ее немодифицированной формой. Период полураспада в сыворотке измеряют путем забора проб крови в различные моменты времени после введения биологически активной молекулы и определения концентрации данной молекулы в каждой пробе. Соотнесение концентрации сыворотки и времени позволяет вычислить период полураспада в сыворотке. Увеличенный период полураспада в сыворотке предпочтительно увеличен по меньшей мере приблизительно в два раза, однако полезным может быть меньшее увеличение, например, когда это обеспечивает удовлетворительный режим дозирования или позволяет избежать токсического эффекта. В некоторых вариантах осуществления увеличение является по меньшей мере приблизительно трехкратным, по меньшей мере приблизительно пятикратным, или по меньшей мере приблизительно десятикратным. Термин "модулированный терапевтический период полураспада", используемый в настоящем описании, означает положительное или отрицательное изменение периода полураспада терапевтически эффективного количества модифицированной биологически активной молекулы по сравнению с ее немодифицированной формой. Терапевтический период полураспада определяют путем измерения фармакокинетических и/или фармакодинамических свойств молекулы в различные моменты времени после введения. Увеличенный терапевтический период полураспада предпочтительно обеспечивает конкретный выгодный режим дозирования, конкретную выгодную полную дозу или позволяет избежать нежелательного эффекта. В некоторых вариантах осуществления увеличенный терапевтический период полураспада следует из увеличенной активности, увеличенного или уменьшенного связывания модифицированной молекулы с ее мишенью, либо увеличения или уменьшения другого параметра или механизма действия немодифицированной молекулы. Термин "выделенный", применительно к нуклеиновой кислоте или белку, обозначает, что нуклеиновая кислота или белок практически не содержат других клеточных компонентов, с которыми они связаны в нативном состоянии. Они могут находиться в гомогенном состоянии. Выделенные вещества могут находиться или в сухом или в полусухом состоянии, или в растворе, включая, помимо прочего, вод- 16019653 ный раствор. Чистота и однородность обычно определяются с помощью методов аналитической химии,таких как электрофорез в полиакриламидном геле или высокоэффективная жидкостная хроматография. Белок, который является преобладающим компонентом, содержащимся в препарате, является по существу очищенным. В частности, выделенный ген отделен от открытых рамок считывания, которые фланкируют ген и кодируют другой белок, нежели целевой ген. Термин "очищенный" обозначает, что нуклеиновая кислота или белок дают по существу одну полосу на электрофорезном геле. В частности, это означает, что нуклеиновая кислота или белок являются по меньшей мере на 85% чистыми, по меньшей мере на 90% чистыми, по меньшей мере на 95% чистыми, или по меньшей мере на 99% чистыми, или более чистыми. Термин "нуклеиновая кислота" относится к дезоксирибонуклеотидам или рибонуклеотидам и их полимерам в однонитевой или двунитевой форме. Если конкретно не ограничено, термин включает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые обладают подобными связывающими свойствами, как референсная нуклеиновая кислота, и метаболизируются аналогично природным нуклеотидам. Если не указано иное, подразумевается, что конкретная последовательность нуклеиновой кислоты также охватывает соответствующие консервативно модифицированные варианты(включая, помимо прочего, замены вырожденных кодонов) и комплементарные последовательности, а также последовательность, обозначенную в явной форме. В частности, замены вырожденных кодонов могут быть выполнены посредством создания последовательностей, в которых третье положение одного или более выбранных (или всех) кодонов замещено смешанными основаниями и/или остатками дезоксиинозина (Batzer et al., Nucleic Acid Res. 19:5081 (1991); Ohtsuka et al. J. Biol. Chem. 260:2605-2608(1985); и Cassol et al. (1992); Rossolini et al., Mol. Cell. Probes 8:91-98 (1994. Термины "полипептид", "пептид" и "белок" в настоящем патенте используются попеременно для обозначения полимера из аминокислотных остатков. Термины относятся к природным полимерам аминокислот, а также к полимерам аминокислот, в которых один или более аминокислотных остатков являются некодируемой аминокислотой. Используемые термины охватывают аминокислотные цепи любой длины, включая полноразмерные белки (т.е. антигены), в которых аминокислотные остатки связаны ковалентными пептидными связями. Антитела представляют собой белки, которые демонстрируют специфичность связывания со специфическим антигеном. Нативные антитела обычно являются гетеротетрамерными гликопротеинами массой приблизительно 150000 Дальтон, которые состоят из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, при этом число дисульфидных связей в тяжелых цепях у иммуноглобулинов разных изотипов варьирует. Каждая тяжелая и легкая цепь также содержат расположенные на регулярном расстоянии межцепные дисульфидные мостики. Каждая тяжелая цепь на одном конце содержит вариабельный домен (VH), после которого расположено несколько константных доменов. Каждая легкая цепь содержит вариабельный домен на одном конце (VL) и константный домен на ее другом конце; константный домен легкой цепи связан с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи связан с вариабельным доменом тяжелой цепи. Определенные аминокислотные остатки, как полагают, образуют связь между вариабельными доменами легкой и тяжелой цепей. Термин "вариабельный" относится к тому факту, что некоторые части вариабельных доменов у антител существенно отличаются по последовательности и ответственны за специфичность связывания каждого конкретного антитела с его конкретным антигеном. Однако, вариабельность не распределена равномерно по вариабельным доменам антител. Она сосредоточена в трех сегментах, называемых гипервариабельными участками (CDR), расположенных в вариабельных доменах легкой и тяжелой цепей. Более высококонсервативные части вариабельных доменов называются каркасными областями (FR). Вариабельные домены нативной тяжелой и легкой цепей включает четыре FR области, принимающих в основном -складчатую конфигурацию, связанных тремя или четырьмя CDR, которые формируют петли,соединяющие, а в некоторых случаях являющиеся частью, -складчатой структуры. CDR в каждой цепи удерживаются в непосредственной близости FR областями и, вместе с CDR в другой цепи, вносят вклад в формирование антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991. Константные домены не участвуют непосредственно в связывании антитела с антигеном, но проявляют различные эффекторные функции. В зависимости от аминокислотной последовательности константной области своих тяжелых цепей, антитела или иммуноглобулины могут быть отнесены к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, причем несколько из них могут быть далее разделены на подклассы (изотипы), например IgG1, IgG2, IgG3 иIgG4; IgA1 и IgA2. Константные области тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются , , ,исоответственно. Из иммуноглобулинов различных классов у человека только IgG1, IgG2, IgG3 и IgM, как известно, активируют комплемент.In vivo, созревание аффинности антител направляется антигенной селекцией вариантов антитела с более высокой аффинностью, которые формируются прежде всего в процессе соматического гипермута- 17019653 генеза. Часто также происходит "изменение репертуара", при котором преобладающие гены зародышевой линии вторичного или третичного ответа, как можно видеть, отличаются от соответствующих генов первичного или вторичного ответа. Процесс созревания аффинности в иммунной системе может копироваться путем введения мутаций в гены антитела in vitro и с использованием аффинной селекции для выделения мутантов с повышенной аффинностью. Такие мутантные антитела могут быть презентированы на поверхности нитчатого бактериофага или таких микроорганизмов, как дрожжи, после чего антитела могут быть отобраны по их аффинности к антигену или по их кинетике диссоциации (выхода из комплекса) с антигеном (Hawkins et al.J. Mol. Biol. 226:889-896 (1992. Последовательный CDR мутагенез использовали для созревания аффинности человеческих антител, которые связывают гликопротеин оболочки gp120 вируса иммунодефицита человека 1 типа (ВИЧ-1) (Barbas III et al. PNAS (USA) 91: 3809-3813 (1994); и Yang et al. J. Mol. Biol. 254:392-403 (1995; и одноцепочечного Fv фрагмента анти-с-erbB-2 (Schier et al. J. Mol. Biol. 263:551567(1996. Перетасовка цепей антитела и CDR мутагенез использовали для созревания аффинности высокоаффинного человеческого антитела, направленного против третьей гипервариабельной петли ВИЧ(Thompson et al. J. Mol. Biol. 256:77-88 (1996. В работе Balint и Larrick, Gene 137:109-118 (1993), описан компьютерный олигодезоксирибонуклеотид-направленный сканирующий мутагенез, с помощью которого все CDR вариабельной области гена подвергают одновременному и тщательному поиску улучшенных вариантов. Созревание аффинности гуманизированного v3-специфичного антитела проводили с использованием стратегии начального ограниченного мутагенеза, в которой каждое положение всех шестиCDR мутировали с последующей экспрессией и скринингом комбинаторной библиотеки, включающей мутанты с наиболее высокой аффинностью (Wu et al. PNAS (USA) 95: 6037-6-42 (1998. Антитела, полученные методом фагового дисплея, описаны в обзоре Chiswell и McCafferty, TIBTECH 10:80-84 (1992); а также Rader и Barbas, III Current Opinion in Biotech. 8:503-508 (1997). В каждом случае, когда в вышеуказанных ссылках сообщали о мутантных антителах с улучшенной по сравнению с исходным антителом аффинностью, мутантное антитело содержало аминокислотные замены в CDR. Под "созреванием аффинности" в настоящем патенте понимается процесс повышения аффинности антитела к его антигену. Способы созревания аффинности включают, помимо прочего, способы компьютерного скрининга и экспериментальные методы. Под "антителом" в настоящем патенте понимается белок, состоящий из одного или более полипептидов, кодируемых по существу всеми или частью генов антитела. Гены иммуноглобулинов включают,помимо прочего, гены константных областей каппа, лямбда, альфа, гамма (IgG1, IgG2, IgG3 и IgG4),дельта, эпсилон и мю, а также гены многочисленных вариабельных областей иммуноглобулинов. Подразумевается, что в настоящем патенте антитело включает полноразмерные антитела и фрагменты антител,а также включает антитела, которые естественно присутствуют в любом организме или являются рекомбинантными (например, являются вариантами). Под "фрагментом антитела" понимается любая форма антитела за исключением полноразмерной формы. Фрагменты антитела в настоящем описании включают антитела, которые являются более короткими компонентами, которые содержатся в полноразмерных антителах, а также рекомбинантными антителами. Фрагменты антител включают, помимо прочего, Fv, Fc, Fab и (Fab')2, одноцепочечные Fv (scFv),диатела, триатела, тетратела, бифункциональные гибридные антитела, CDR1, CDR2, CDR3, комбинацииCDR, вариабельные области, каркасные области, константные области и т.п. (MaynardGeorgiou, 2000,Annu. Rev. Biomed. Eng. 2:339-76; Hudson, 1998, Curr. Opin. Biotechnol. 9:395-402). Термин "аминокислота" относится к природным и неприродным аминокислотам, а также аналогам аминокислот и миметикам аминокислот, которые функционируют аналогично природным аминокислотам. Кодируемые аминокислоты включают 20 стандартных аминокислот (аланин, аргинин, аспарагин,аспарагиновую кислоту, цистеин, глутамин, глутаминовую кислоту, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин), а также пирролизин и селеноцистеин. Аналоги аминокислот относятся к соединениям, которые имеют такую же основную химическую структуру, как и природная аминокислота, т.е. содержат -атом углерода, связанный с водородом, карбоксильную группу, аминогруппу и R группу, таким как гомосерин, норлейцин,метионинсульфоксид, метилметионинсульфоний. Такие аналоги содержат модифицированные R группы(например, как норлейцин) или модифицированные пептидные скелеты, но сохраняют такую же основную химическую структуру, как и природная аминокислота. Аминокислоты в настоящем описании могут быть обозначены стандартными трехбуквенными символами или однобуквенными символами, рекомендованными Комиссией по биохимической номенклатуре IUPAC-IUB. Нуклеотиды, аналогично, могут быть обозначены своими общепринятыми однобуквенными кодами."Консервативно модифицированные варианты" относятся и к аминокислотным, и к нуклеотидным последовательностям. В отношении конкретных нуклеотидных последовательностей "консервативно модифицированные варианты" относятся к таким нуклеиновым кислотам, которые кодируют идентичные или практически идентичные аминокислотные последовательности, или, в тех случаях, когда нук- 18019653 леиновая кислота не кодирует аминокислотную последовательность, к практически идентичным последовательностям. Из-за вырожденности генетического кода тот или иной белок кодируется большим количеством функционально идентичных нуклеиновых кислот. Например, кодоны GCA, GCC, GCG и GCU кодируют аминокислоту аланин. Таким образом, в каждом положении, в котором кодоном определяется аланин, кодон может быть заменен любым из соответствующих описанных кодонов без замены кодируемого полипептида. Такие изменения нуклеиновых кислот представляют собой "молчащие вариации",которые являются одной из разновидностей консервативно модифицированных вариаций. Каждая последовательность нуклеиновой кислоты в настоящем патенте, которая кодирует полипептид, также описывает каждую возможную молчащую вариацию нуклеиновой кислоты. Специалист в данной области техники осведомлен, что каждый кодон в нуклеиновой кислоте (за исключением кодона AUG, который,как правило, является единственным кодоном для метионина, и кодона TGG, который, как правило, является единственным кодоном для триптофана) может быть изменен с получением функционально идентичной молекулы. Таким образом, каждая молчащая вариация нуклеиновой кислоты, которая кодирует полипептид, подразумевается в каждой описанной последовательности. Что касается аминокислотных последовательностей, специалисту в данной области техники известно, что индивидуальные замены, делеции или вставки в последовательности нуклеиновой кислоты, пептида, полипептида или белка, при которых изменяется, добавляется или удаляется одна аминокислота или небольшой процент аминокислот в кодируемой последовательности, являются "консервативно модифицированным вариантом", в котором изменение приводит к замене аминокислоты химически подобной аминокислотой. Таблицы консервативных замен, в которых представлены функционально подобные аминокислоты, известны в уровне техники. Такие консервативно модифицированные варианты являются дополнительными к полиморфным вариантам, межвидовым гомологам и аллелям по изобретению, и не исключают их. Каждая из следующих восьми групп содержит аминокислоты, которые являются консервативными заменами друг для друга: 1) аланин (А), глицин (G); 2) аспарагиновая кислота (D), глутаминовая кислота (Е); 3) аспарагин (N), глутамин (Q); 4) аргинин (R), лизин (K); 5) изолейцин (I), лейцин (L), метионин (М), валин (V); 6) фенилаланин (F), тирозин (Y), триптофан (W); 7) серин (S), треонин (Т); и 8) цистеин (С), метионин (М);(см., например, Creighton, Proteins: Structures and Molecular Properties; W.H. FreemanCo.; 2nd edition (December 1993. Термины "идентичный" или процент "идентичности", в контексте двух или более нуклеотидных или полипептидных последовательностей, относятся к двум или более последовательностям или субпоследовательностям, которые являются одинаковыми. Последовательности являются "по существу идентичными", если они содержат некоторый процент аминокислотных остатков или нуклеотидов, которые являются одинаковыми (т.е. приблизительно 60% идентичности, необязательно приблизительно 65%,приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90% или приблизительно 95% идентичности в пределах указанной области), при сравнении и выравнивании на предмет максимального соответствия в окне сравнения или указанной области, при определении с использованием одного из следующих алгоритмов сравнения последовательности или ручного выравнивания и визуальной проверки. Данное определение также относится к комплементу тестируемой последовательности. Идентичность может существовать в пределах области, длина которой составляет по меньшей мере приблизительно 50 аминокислот или нуклеотидов, или в пределах области, длина которой составляет 75-100 аминокислот или нуклеотидов, или, если не указано конкретно, в пределах всей последовательности полинуклеотида или полипептида. Для сравнения последовательности обычно одна последовательность выступает в роли референсной последовательности, с которой сравниваются тестируемые последовательности. При использовании алгоритма сравнения последовательности, в компьютер вводят тестируемые и референсную последовательности, определяют координаты подпоследовательности, при необходимости, и указывают параметры программы алгоритма последовательности. Могут использоваться параметры программы по умолчанию или могут быть указаны альтернативные параметры. Затем алгоритм сравнения последовательности вычисляет процент идентичности последовательности тестируемых последовательностей относительно референсной последовательности на основании параметров программы."Окно сравнения", как используется в настоящем описании, включает ссылку на сегмент любого из ряда смежных положений, выбранных из группы, состоящей из от 20 до 600, обычно от приблизительно 50 до приблизительно 200, чаще от приблизительно 100 до приблизительно 150, в которых последовательность может быть сравнена с референсной последовательностью в том же количестве смежных положений, после оптимального выравнивания двух указанных последовательностей. Способы выравнива- 19019653 ния последовательностей для сравнения хорошо известны в уровне техники. Оптимальное выравнивание последовательностей для сравнения может быть проведено, в том числе, с помощью алгоритма локальной гомологии (Smith and Waterman (1970), Adv. Appl. Math. 2:482c), алгоритма выравнивания гомологии(Needleman and Wunsch (1970), J. Mol. Biol. 48:443), методом поиска подобия (Pearson and Lipman (1988),Proc. Nat'1. Acad. Sci. USA 85:2444), а также с помощью компьютерных программ на основе указанных алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программ Wisconsin Genetics Software Package,Genetics Computer Group, 575 Science Dr., Madison, WI) или ручного выравнивания и визуальной проверки (см., например, Ausubel et al., Current Protocols in Molecular Biology (1995, приложение. Одним из примеров алгоритма, который подходит для определения процента идентичности последовательности и подобия последовательности, являются алгоритмы BLAST и BLAST 2.0, которые описаны в статьях Altschul et al. (1977), Nuc. Acids Res. 25:3389-3402, и Altschul et al. (1990), J. Mol. Biol. 215:403-410 соответственно. Программы для выполнения анализов BLAST общедоступны на сервере Национального центра биотехнологической информации (NCBI). Параметры алгоритма BLAST, W, Т иX, определяют чувствительность и скорость выравнивания. В программе BLASTN (для нуклеотидных последовательностей) в качестве параметров по умолчанию используются длина слова (W) 11, ожидание(Е) 10, М=5, N=-4 и сравнение обоих цепей. Для аминокислотных последовательностей в программеBLASTP в качестве параметров по умолчанию используются длина слова 3 и ожидание (Е) 10, а в матрице оценки BLOSUM62 (см. Henikoff and Henikoff (1989), Proc. Natl. Acad. Sci. USA 89:10915) выравнивания (В) 50, ожидание (Е) 10, M=5, N=-4 и сравнение обоих цепей. Алгоритм BLAST обычно выполняют с отключенным фильтром "низкой сложности". Алгоритм BLAST также выполняет статистический анализ подобия между двумя последовательностями (см., например, Karlin and Altschul (1993), Proc. Natl. Acad. Sci. USA 90:5873-5787). Одной из степеней подобия, предоставляемых алгоритмом BLAST, является наименьшая сумма вероятностей (P(N,которая обеспечивает показатель вероятности, с которой совпадение двух нуклеотидных или аминокислотных последовательностей могло бы случайно произойти. Например, нуклеиновая кислота считается подобной референсной последовательности, если наименьшая сумма вероятностей при сравнении тестируемой нуклеиновой кислоты с референсной нуклеиновой кислотой меньше чем приблизительно 0,2,более предпочтительно меньше чем приблизительно 0,01 и наиболее предпочтительно меньше чем приблизительно 0,001. Фраза "селективно (или специфично) гибридизуется с" относится к связыванию, образованию дуплекса или гибридизации молекулы только с конкретной нуклеотидной последовательностью в жестких условиях гибридизации, когда указанная последовательность присутствует в сложной смеси (включая,помимо прочего, суммарную клеточную ДНК или РНК либо ДНК или РНК в библиотеке). Фраза "жесткие условия гибридизации" относится к условиям с низкой ионной силой и высокой температурой, как известно из уровня техники. Как правило, при жестких условиях зонд гибридизуется со своей мишеневой субпоследовательностью в сложной смеси нуклеиновых кислот (включая, помимо прочего, суммарную клеточную ДНК или РНК либо ДНК или РНК в библиотеке), но не гибридизуется с другими последовательностями в сложной смеси. Жесткие условия зависят от последовательности и обычно являются различными при разных обстоятельствах. Более длинные последовательности специфично гибридизуются при более высоких температурах. Подробное руководство по гибридизации нуклеиновых кислот можно найти в Tijssen, Techniques in Biochemistry and Molecular Biology-Hybridizationwith Nucleic Probes, "Overview of principles of hybridization and the strategy of nucleic acid assays" (1993). Как правило, подбираемые жесткие условия приблизительно на 5-10 С ниже, чем точка плавления (Tm) для определенной последовательности при определенной ионной силе и рН. Tm является температурой(при определенной ионной силе, рН и концентрации нуклеиновой кислоты), при которой 50% зондов,комплементарных мишеневой последовательности, гибридизуются с ней в равновесии (так как целевые последовательности присутствуют в избытке, при Tm 50% зондов состоят в равновесии). Жесткие условия могут являться такими условиями, при которых концентрация соли меньше чем приблизительно 1,0 М в расчете на ион натрия, обычно приблизительно от 0,01 до 1,0 М в расчете на ион натрия (или другие соли), при рН 7,0-8,3 и температуре по меньшей мере приблизительно 30 С для коротких зондов(включающих, помимо прочего, 10-50 нуклеотидов) и по меньшей мере приблизительно 60 С для длинных зондов (включающих, помимо прочего, более 50 нуклеотидов). Жесткие условия могут быть также достигнуты при добавлении дестабилизирующих агентов, таких как формамид. Для селективной или специфичной гибридизации положительный сигнал может быть по меньшей мере в два раза интенсивнее фоновой, необязательно в 10 раз интенсивнее фоновой гибридизации. Пример жестких условий гибридизации может быть следующим: 50% формамида, 5SSC и 1% SDS, инкубирование при 42 С, или 53SSC, 1% SDS, инкубирование при 65 С, промывка в 0,2SSC и 0,1% SDS при 65 С. Такие промывки могут выполняться в течение 5, 15, 30, 60, 120 мин или дольше. Используемый в настоящем патенте термин "эукариот" относится к организмам, которые относятся к филогенетическому домену Eucarya, таким как животные (включая, помимо прочего, млекопитающих,насекомых, рептилий, птиц и т.д.), инфузории, растения (включая, помимо прочего, однодольные, дву- 20019653"Эукариотическая клетка" и "эукариотические клетки" включают в качестве примера клетки млекопитающих, такие как СНО, клетки миеломы, ВНК, иммунные клетки, клетки насекомых, клетки птиц,клетки земноводных, например ооциты лягушки, клетки грибов и дрожжей. Дрожжи, в качестве примера, включают Saccharomyces, Schizosaccharomyces, Hansenula, Candida, Torulopsis, Yarrowia, Pichia и др. Наиболее предпочтительные дрожжи для экспрессии включают штаммы метилотрофных дрожжей, например Pichia pastoris, Hansenula polymorpha, Pichia guillermordii, Pichia methanolica, Pichia inositovera и др. (см., например, патенты США 4812405, 4818700, 4929555, 5736383, 5955349, 5888768 и 6258559, каждый из которых настоящим включен путем ссылки во всех отношениях). В указанных и других патентах также описаны промоторы, терминаторы, энхансеры, сигнальные последовательности, а также другие регуляторные последовательности, полезные при экспрессии гетерологичных генов в дрожжах, например генов белков, как в настоящем изобретении. Используемый в настоящем патенте термин "трансформация" должен использоваться в широком смысле для обозначения любого введения ДНК в реципиентную клетку-хозяина, которое изменяет генотип и, следовательно, приводит к изменению реципиентной клетки. Используемый в настоящем патенте термин "неэукариот" относится к неэукариотическим организмам. Например, неэукариотический организм может относиться к филогенетическому домену Eubacteria(включая, помимо прочего, Escherichia coli, Thermus thermophilics, Bacillus stearothermophilus и т.д.) или к филогенетическому домену Archaea (включая, помимо прочего, Methanococcus jannaschii, Methanobaclerium thermoautotrophicum, Halobacterium, например, Haloferax volcanii и Halobacterium вида NRC-1,Archaeoglobus fulgidus, Pyrococcus furiosus, Pyrococcus horikoshii, Aeuropyrum pernix и т.д.). Термин "индивид", используемый в настоящем патенте, относится к животному, предпочтительно млекопитающему, наиболее предпочтительно человеку, который является объектом лечения, наблюдения или эксперимента. Подробное описание Специалист, квалифицированный в данной области техники, сумеет разработать и применить такие же способы, как приведенные ниже, в отношении композиций и способов, связанных с кошачьим эритропоэтином, в отношении композиций и способов, связанных с собачьим эритропоэтином (сЕРО) (зрелая аминокислотная последовательность SEQ ID NO:31, полноразмерная аминокислотная последовательность SEQ ID NO:30) и конским эритропоэтином (еЕРО) (зрелая аминокислотная последовательность SEQ ID NO:33, полноразмерная аминокислотная последовательность SEQ ID NO:32) в отношении сЕРО и еЕРО с искусственной, неприродной и/или некодируемой аминокислотой, введенной в сЕРО и еЕРО полипептиды. Указанные полипептиды также могут использоваться, как раскрыто в настоящем патенте, для лечения животных из семейства кошачьих или других животных, нуждающихся в этом, или они могут использоваться при лечении собак или лошадей. На фиг. 34 и 35 представлены сравнения каждой из аминокислотных последовательностей (длиной 166 ак) сЕРО и еЕРО с fEPO (166 аминокислот),как более подробно описано ниже, однако описание также поддерживает замену, вставку или делецию некодируемой аминокислоты в SEQ ID NO:31 и 33 сЕРО и еЕРО соответственно.I. Введение. В изобретении предложены молекулы кошачьего ЕРО, включающие по меньшей мере одну неприродную аминокислоту. В некоторых вариантах осуществления изобретения ЕРО по меньшей мере с одной неприродной аминокислотой включает по меньшей мере одну посттрансляционную модификацию. В одном из вариантов осуществления по меньшей мере одна посттрансляционная модификация включает присоединение молекулы (включая, помимо прочего, краситель, полимер (включающий, помимо прочего, производное полиэтиленгликоля), фотокросслинкер, цитотоксическое соединение, аффинную метку,производное биотина, смолу, второй белок или полипептид, антитело или фрагмент антитела, металлхелатирующий агент, кофактор, жирную кислоту, углевод, полинуклеотид (включающий, помимо прочего, ДНК, РНК) и т.д.), содержащей вторую активную группу по меньшей мере к одной неприродной аминокислоте, включающей первую активную группу, с применением химического метода, который, как известно среднему специалисту в данной области техники, подходит для конкретных активных групп. Например, первая активная группа является алкинильной группой (содержащейся, помимо прочего, в неприродной аминокислоте п-пропаргилоксифенилаланине, в которой пропаргильная группа также иногда называется ацетиленовой группой), а вторая активная группа является азидогруппой, при этом используется химический метод [3+2] циклоприсоединения. В другом примере первой активной группой является азидогруппа (содержащаяся, помимо прочего, в неприродной аминокислоте п-азидо-Lфенилаланине), а второй активной группой является алкинильная группа. В некоторых вариантах осуществления модифицированного fEPO по настоящему изобретению, по меньшей мере, используется одна неприродная аминокислота (включая, помимо прочего, неприродную аминокислоту, содержащую функциональную кетогруппу), которая включает по меньшей мере одну посттрансляционную модификацию,где по меньшей мере одна посттрансляционная модификация включает сахаридную группу. В некоторых вариантах осуществления посттрансляционная модификация сделана in vivo в эукариотической клетке или в неэукариотической клетке. В некоторых вариантах осуществления белок включает по меньшей мере одну посттрансляционную модификацию, которая сделана in vivo одной клеткой-хозяином, где указанная посттрансляционная модификация обычно не выполняется другим типом клетки-хозяина. В некоторых вариантах осуществления белок включает по меньшей мере одну посттрансляционную модификацию, которая сделана in vivo эукариотической клеткой, где посттрансляционная модификация обычно не выполняется неэукариотической клеткой. Примеры посттрансляционных модификаций включают, помимо прочего, ацетилирование,ацилирование, липидную модификацию, пальмитоилирование, присоединение пальмитата, фосфорилирование, модификацию с гликолипидной связью и т.п. В одном из вариантов осуществления посттрансляционная модификация включает присоединение олигосахарида к аспарагину через GlcNAcаспарагиновую связь (включая, помимо прочего, те случаи, когда олигосахарид включает (GlcNAcMan)2-Man-GlcNAc-GlcNAc и т.п.). В другом варианте осуществления посттрансляционная модификация включает присоединение олигосахарида (включая, помимо прочего, Gal-GalNAc, Gal-GlcNAc, и т.д.) к серину или треонину через GalNAc-сериновую, GalNAc-треониновую, GlcNAc-сериновую или GlcNAcтреониновую связь. В некоторых вариантах осуществления белок или полипептид по изобретению могут включать секрецию или локализацию последовательности, эпитоп-таг, FLAG-таг, полигистидиновый таг,GST-слитый белок или полипептид и/или подобное. Интересующий белок или полипептид могут содержать по меньшей мере одну, по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять или десять либо более неприродных аминокислот. Неприродные аминокислоты могут являться одинаковыми или различными, например,при этом в белке может содержаться 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более различных участков, которые включают 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более различных неприродных аминокислот. В некоторых вариантах осуществления по меньшей мере одна, но не все, из конкретных аминокислот, содержащихся в природном варианте белка, заменены неприродной аминокислотой. В настоящем изобретении предложены способы и композиции, основанные на представителях супергенного семейства ГР, в частности fEPO, включающих по меньшей мере одну некодируемую аминокислоту. Введение по меньшей мере одной некодируемой аминокислоты в представителя супергенного семейства ГР, такого как fEPO, может предусматривать применение методов химического конъюгирования, которые включают определенные химические реакции, включая, помимо прочего, реакции с одной или несколькими некодируемыми аминокислотами, без реакции с 20 стандартными аминокислотами. В некоторых вариантах осуществления представитель супергенного семейства ГР, такой как fEPO, включающий некодируемую аминокислоту, связан с водорастворимым полимером, таким как полиэтиленгликоль (ПЭГ), через боковую цепь некодируемой аминокислоты. Настоящее изобретение относится к высокоэффективному способу селективной модификации белков производными ПЭГ, которая включает селективное введение некодируемых аминокислот, включая, помимо прочего, такие аминокислоты, которые содержат функциональные группы или заместители, не содержащиеся в 20 природных аминокислотах, включая, помимо прочего, азидную или ацетиленовую группы, включаемые в белки в ответ на селекторный кодон, и последующую модификацию указанных аминокислот подходящим реакционноспособным производным ПЭГ. После введения боковые цепи аминокислот могут быть модифицированы с применением химических способов, которые известны средним специалистам в данной области техники, подходящих для конкретных функциональных групп или заместителей, присутствующих в кодируемой аминокислоте. Для применения в настоящем изобретении подходят разнообразные известные химические способы, которые позволяют вводить водорастворимый полимер в белок. Такие методы включают, помимо прочего, реакцию [3+2] циклоприсоединения Хьюсгена (см., например, Padwa, A., Comprehensive Organic Synthesis, Том 4 (1991), под ред. Trost, В.М., Pergamon, Oxford, с. 1069-1109; а также Huisgen, R., 1,3-Dipolar Cvcloaddition Chemistry (1984), под ред. Padwa, A., Wiley, New York, с. 1-176), помимо прочего, с ацетиленовыми или азидными производными соответственно. Поскольку метод [3+2] циклоприсоединения Хьюсгена включает циклоприсоединение, а не реакцию нуклеофильного замещения, белки могут быть модифицированы с чрезвычайно высокой селективностью. Реакция может быть проведена при комнатной температуре, в водной среде с превосходной региоселективностью (1,41,5) при добавлении к реакционной смеси каталитических количеств солей медиInt. Ed. 41:2596-2599; а также WO 03/101972. Молекула, которая может быть присоединена к белку по изобретению посредством [3+2] циклоприсоединения, включает практически любую молекулу с подходящей функциональной группой или заместителем, включая, помимо прочего, азидо или ацетиленовое производное. Указанные молекулы могут быть присоединены к неприродной аминокислоте с ацетиленовой группой, включая, помимо прочего, п-пропаргилоксифенилаланин, или азидогруппой, включая, помимо прочего, п-азидофенилаланин соответственно. Пятичленное кольцо, которое образуется в результате [3+2] циклоприсоединения Хьюсгена, обычно стабильно в восстанавливающих средах и устойчиво к гидролизу в течение длительного периода в водных средах. Следовательно, физические и химические свойства большого разнообразия веществ могут быть модифицированы в требуемых водных условиях активными производными ПЭГ согласно на- 22019653 стоящему изобретению. Более важно даже то, что поскольку азидные и ацетиленовые группы специфичны друг к другу (и не реагируют, например, ни с одной из 20 стандартных, генетически кодируемых аминокислот), белки могут быть модифицированы в одном или нескольких специфических сайтах с чрезвычайно высокой селективностью. Изобретение также относится к водорастворимым и гидролитически устойчивым производным ПЭГ и подобных гидрофильных полимеров, содержащих одну или несколько ацетиленовых или азидных групп. Производные полимера ПЭГ, которые содержат ацетиленовые группы, являются высокоселективными для сочетания с азидными группами, которые были селективно введены в белки в ответ на селекторный кодон. Аналогичным образом, производные ПЭГ полимера, которые содержат азидные группы,являются высокоселективными для сочетания с ацетиленовыми группами, которые были селективно введены в белки в ответ на селекторный кодон. Более конкретно, азидные группы включают, помимо прочего, алкилазиды, арилазиды и производные этих азидов. Производные алкил- и арилазидов могут включать другие заместители, при условии сохранения ацетилен-специфичной активности. Ацетиленовые группы включают алкил- и арилацетилены, а также их производные. Производные алкил- и арилацетиленов могут включать другие заместители, при условии сохранения азидспецифичной активности. В настоящем изобретении предложены конъюгаты веществ, содержащих большое разнообразие функциональных групп или заместителей, с другими веществами, включая, помимо прочего, водорастворимые полимеры, такие как ПЭГ, белки, лекарственные соединения, небольшие молекулы, биоматериалы или любое другое требуемое соединение или вещество. Настоящее изобретение также включает конъюгаты веществ, содержащих азидные или ацетиленовые группы, с производными ПЭГ полимера,содержащими соответствующие ацетиленовые или азидные группы. Например, полимер ПЭГ, содержащий азидную группу, может быть присоединен к биологически активной молекуле в таком положении в белке, которое содержит некодируемую аминокислоту, содержащую ацетиленовую функциональную группу. Связь, которая соединяет ПЭГ и биологически активную молекулу, включает, помимо прочего продукт [3+2] циклоприсоединения Хьюсгена. Из уровня техники хорошо известно, что ПЭГ может использоваться для изменения поверхности биоматериалов (см., например, патент США 6610281; Mehvar, R., J. Pharmaceut. Sci., 3(1):125-136 (2000),который включен в настоящее изобретение путем ссылки). Изобретение также относится к биоматериалам, включающим поверхность, содержащую один или более активных азидных или ацетиленовых сайтов и один или более азид- или ацетиленсодержащих полимеров по изобретению, соединенных с поверхностью через связь, образованную в результате [3+2] циклоприсоединения Хьюсгена. Биоматериалы и другие вещества также могут быть присоединены к азид- или ацетилен-активированным производным полимера через другую связь помимо азидной или ацетиленовой связи, например, через связь, включающую карбоксильную, амино, спиртовую или тиольную группу, чтобы азидная или ацетиленовая группа оставались доступными в последующих реакциях. Изобретение включает способ синтеза азид- и ацетиленсодержащих полимеров по изобретению. В случае азидсодержащего производного ПЭГ азид может быть связан непосредственно с атомом углерода полимера. В альтернативе, азидсодержащее производное ПЭГ может быть получено путем присоединения связывающего агента, который содержит азидную группу на одном конце, со стандартным активированным полимером таким образом, чтобы получаемый полимер содержал азидную группу на своем конце. В случае ацетиленсодержащего производного ПЭГ ацетилен может быть связан непосредственно с атомом углерода полимера. В альтернативе, ацетиленсодержащее производное ПЭГ может быть получено путем присоединения связывающего агента, который содержит ацетиленовую группу на одном конце, со стандартным активированным полимером таким образом, чтобы получаемый полимер содержал ацетиленовую группу на своем конце. Более конкретно, в случае азидсодержащего производного ПЭГ водорастворимый полимер, содержащий по меньшей мере одну активную гидроксильную группу, подвергается реакции с получением замещенного полимера, содержащего более реакционноспособную группу, такую как мезилатная, трезилатная, тозилатная или галогеновая уходящая группа. Получение и применение производных ПЭГ, содержащих сульфонилхлорангидриды, атомы галогена и другие уходящие группы, известны квалифицированному специалисту. Получаемый в результате полимер затем подвергается реакции с замещением более активной группы азидной группой на конце полимера. В альтернативе водорастворимый полимер,содержащий по меньшей мере одну активную нуклеофильную или электрофильную группу, подвергается реакции со связывающим агентом, который содержит азид на одном конце, чтобы между ПЭГ полимером и связывающим агентом формировалась ковалентная связь, при этом азидная группа располагается на конце полимера. Нуклеофильные и электрофильные группы, включая амины, тиолы, гидразиды,гидразины, спирты, карбоксилаты, альдегиды, кетоны, тиоэфиры и т.п., известны квалифицированному специалисту. Более конкретно, в случае ацетиленсодержащего производного ПЭГ водорастворимый полимер, содержащий по меньшей мере одну активную гидроксильную группу, подвергается реакции с замещением галогена или другой активированной уходящей группы в соединении-предшественнике, которое содержит ацетиленовую группу. В альтернативе, водорастворимый полимер, содержащий по меньшей мере одну активную нуклеофильную или электрофильную группу, подвергается реакции со связывающим агентом, который содержит ацетилен на одном конце, чтобы между ПЭГ полимером и связывающим агентом формировалась ковалентная связь, при этом ацетиленовая группа располагается на конце полимера. Применение галогеновых групп, активированной уходящей группы, нуклеофильных и электрофильных групп в контексте органического синтеза, а также получения и применения производных ПЭГ,хорошо известно специалистам-практикам в данной области техники. Изобретение также предоставляет способ селективной модификации белков, позволяющий добавлять другие вещества к модифицированному белку, включая, помимо прочего, водорастворимые полимеры, такие как ПЭГ и производные ПЭГ, содержащие ацетиленовую или азидную группу. Азид- и ацетиленсодержащие производные ПЭГ могут использоваться для модификации свойств поверхностей и молекул, когда важны биосовместимость, стабильность, растворимость и отсутствие иммуногенности,при одновременном обеспечении более селективного способа присоединения производных ПЭГ к белкам, чем было ранее известно в уровне техники.II. Супергенное семейство гормона роста. Данная группа включает следующие белки, кодируемые супергенным семейством гормона ростаand Campbell, I.D., Current Opinion in Structural Biology 5:114-121 (1995); Silvennoinen, О. and Ihle, J.N.,SIGNALLING BY THE HEMATOPOIETIC CYTOKINE RECEPTORS (1996: гормон роста, пролактин,плацентарный лактоген, эритропоэтин (ЕРО), тромбопоэтин (ТРО), интерлейкин-2 (IL-2), IL-3, IL-4, IL-5,IL-6, IL-7, IL-9, IL-10, IL-11, IL-12 (р 35 субъединица), IL-13, IL-15, онкостатин М, цилиарный нейротрофический фактор, фактор ингибирования лейкемии, интерферон-альфа, интерферон-бета, интерферонгамма, интерферон-омега, интерферон-тау, гранулоцитарный колониестимулирующий фактор (Г-КСФ),гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), макрофагальный колониестимулирующий фактор (М-КСФ) и кардиотрофин-1 (СТ-1) ("супергенное семейство ГР"). Предполагается, что дополнительные представители данного генного семейства будут идентифицированы в будущем в результате клонирования и секвенирования генов. Представители супергенного семейства ГР имеют сходную вторичную и третичную структуры, несмотря на тот факт, что они обычно обладают ограниченной идентичностью аминокислотной или ДНК последовательности. Общие структурные особенности позволяют с легкостью идентифицировать новых представителей генного семейства. Учитывая степень структурной гомологии среди представителей супергенного семейства ГР, с помощью настоящего изобретения некодируемые аминокислоты могут быть введены в любых представителей супергенного семейства ГР. Структуры множества цитокинов, включая Г-КСФ (Hill, С.Р., Proc. Natl. Acad. Sci. USA 90:51675171 (1993, ГМ-КСФ (Diederichs, K., et al. Science 154: 1779-1782 (1991); Walter et al., J. Mol. Biol. 224:1075-1085 (1992, IL-2 (Bazan, J.F. Science 257:410-411 (1992); McKay, D.B. Science 257:412 (1992;IL-4 (Redfield et al., Biochemistry 30:11029-11035 (1991); Powers et al., Science 256:1673-1677 (1992 и IL5 (Milburn et al., Nature 363: 172-176 (1993, были определены с помощью рентгеноструктурного анализа и ЯМР-анализа, при этом была показана поразительная консервативность со структурой ГР, несмотря на отсутствие значительной гомологии первичной последовательности. ЕРО, как полагают, является представителем данного семейства на основании моделирования и мутагенеза (Boissel et al., J. Biol. Chera. 268: 15983-15993 (1993); Wen et al., J. Biol. Chem. 269:22839-22846 (1994. К данному семейству относится большое количество дополнительных цитокинов и факторов роста, включая цилиарный нейротрофический фактор (CNTF), фактор ингибирования лейкемии (LIF), тромбопоэтин (ТРО), онкостатин М,макрофагальный колониестимулирующий фактор (М-КСФ), IL-3, IL-6, IL-7, IL-9, IL-12, IL-13, IL-15, а также интерферон-альфа, -бета, -омега, -тау и -гамма (см. обзор Mott and Campbell, Current Opinion inStructural Biology 5: 114-121 (1995); Silvennoinen and Ihle (1996), SIGNALLING BY THE HEMATOPOIETIC CYTOKINE RECEPTORS). Все вышеуказанные цитокины и факторы роста, как теперь полагают,составляют одно большое семейство генов. В дополнение к аналогичной вторичной и третичной структурам, представители данного семейства имеют общее свойство, которое состоит в том, что они должны олигомеризовать поверхностные рецепторы клетки для активации путей внутриклеточной сигнализации. Некоторые представители семейства ГР, включая, помимо прочего, ГР и ЕРО, связываются с одним типом рецептора и заставляют его образовывать гомодимеры. Другие представители семейства, включая, помимо прочего, IL-2, IL-4 и IL-6, связываются более чем с одним типом рецептора и заставляют рецепторы образовывать гетеродимеры или агрегаты более высокого порядка (Davis et al. (1993), Science 260:1805-1808; Paonessa et al. (1995), EMBOJ. 14:1942-1951; Mott and Campbell, Current Opinion in Structural Biology 5:114-121 (1995. Анализы мутагенеза показали, что, как и ГР, указанные другие цитокины и факторы роста содержат несколько сайтов связывания рецепторов, обычно два, и связывают свои соответствующие рецепторы последовательноNatl. Acad. Sci. USA 93:9471-9476). Как и у ГР, первичные сайты связывания рецепторов для указанных других представителей семейства расположены прежде всего в четырех альфа-спиралях и А-В петле. Определенные аминокислоты в спиральных пучках, которые участвуют в связывании рецептора, у разных представителей семейства отличаются. Большинство поверхностных рецепторов клетки, которые взаимодействуют с представителями супергенного семейства ГР, являются структурно родственными и включают второе большое мультигенное семейство. См., например, патент США 6608183. Общий вывод, сделанный из мутационных исследований различных представителей супергенного семейства ГР, заключается в том, что петли, соединяющие альфа-спирали, обычно не участвуют в связывании рецептора. В частности, короткая В-С петля, по-видимому, является несущественной для связывания рецептора у большинства, если не у всех, представителей семейства. Поэтому В-С петля может быть заменена некодируемыми аминокислотами, как описано в настоящем патенте, у представителей супергенного семейства ГР. Петля А-В, петля C-D (и петля D-E интерферон/IL-10-подобных представителей семейства ГР) также могут быть заменены некодируемой аминокислотой. Аминокислоты, расположенные близко к А спирали и удаленные от конечной спирали, также имеют тенденцию не участвовать в связывании рецептора и также могут являться сайтами для введения некодируемой аминокислоты. В некоторых вариантах осуществления некодируемая аминокислота замещается в любом положении в области петли, включая, помимо прочих, первые 1, 2, 3, 4, 5, 6, 7 или более аминокислот А-В, В-С, C-D илиD-E петель. В некоторых вариантах осуществления некодируемая аминокислота замещается в последних 1, 2, 3, 4, 5, 6, 7 или более аминокислот А-В, В-С, C-D или D-E петель. Некоторые представители семейства ГР, включая, помимо прочего, ЕРО, IL-2, IL-3, IL-4, IL-6, ГМКСФ, Г-КСФ, ТРО, IL-10, IL-12 p35, IL-13, IL-15 и интерферон-бета, содержат N-сцепленный и Осцепленный сахарид. Сайты гликозилирования в белках присутствуют почти исключительно в областях петель, а не в альфа-спиральных пучках. Поскольку области петель обычно не участвуют в связывании рецептора и являются сайтами для ковалентного присоединения сахаридных групп, они могут служить в качестве сайтов для введения в белки неприродных аминокислотных замен. Аминокислоты, которые включают N- и O-сцепленные сайты гликозилирования в белках, могут являться сайтами для неприродных аминокислотных замен, поскольку указанные аминокислоты расположены на поверхности. Таким образом, к природному белку в данных сайтах могут быть присоединены большие сахаридные группы,при этом сайты гликозилирования обычно расположены на удалении от сайтов связывания рецепторов. Дополнительные представители генного семейства ГР, вероятно, будут обнаружены в будущем. Новые представители супергенного семейства ГР могут быть идентифицированы посредством автоматизированного анализа вторичной и третичной структуры предсказанных белковых последовательностей. Представители супергенного семейства ГР обычно обладают четырьмя или пятью амфипатическими спиралями, к которым присоединяются неспиральные аминокислоты (области петель). Белки могут содержать гидрофобную сигнальную последовательность на своем N-конце для активации секреции из клетки. Такие открываемые в будущем представители супергенного семейства ГР также относятся к настоящему изобретению. Ссылка на fEPO полипептиды в настоящем патенте служит в целях использования fEPO в качестве примера представителя супергенного семейства ГР. Таким образом, следует понимать, что модификации и химические способы, описанные в настоящем патенте применительно к fEPO, могут быть в равной мере применены к каким-либо другим представителям супергенного семейства ГР, включая конкретно перечисленные в настоящем патенте.III. Система экспрессии, продуцирующая продукты одного или нескольких интересующих генов с одной экспрессионной конструкции и применяемая согласно настоящему изобретению. В настоящем патенте описаны новые системы экспрессии для получения продуктов одного или нескольких интересующих генов с одной экспрессионной конструкции или с нескольких экспрессионных конструкций. В одном из вариантов осуществления настоящее изобретение включает эукариотическую систему супрессии экспрессии, в которую супрессированные гены интересующего белка транскрибируются с одного вектора, кодирующего все элементы, необходимые для супрессии с целью включения искусственной аминокислоты. В частности, система экспрессии содержит вектор, способный к экспрессии белков в эукариотических клетках-хозяевах, при этом указанный белок (белки) содержит искусственную аминокислоту. Система экспрессии содержит вектор, способный к экспрессии белков в эукариотических клетках-хозяевах, при этом указанный белок (белки) содержит неприродную кислоту или искусственную аминокислоту. Система экспрессии содержит вектор, способный к экспрессии белков в эукариотические клетках-хозяевах, при этом указанный белок (белки) содержит некодируемую аминокислоту, такую как,помимо прочего, п-ацетилфенилаланин (pAF). Векторы экспрессии могут включать следующие функционально связанные элементы: одну или много копий последовательности супрессорной тРНК, включая промоторы и терминаторы транскрипции, работающие в эукариотической клетке; промотор, связанный с последовательностью ДНК, кодирующей любой экспрессируемый (супрессируемый) интересующий ген; и промотор, связанный с областью, кодирующей функциональную тРНК синтетазу млекопитающего. Вариант осуществления настоящего изобретения относится к клеткам млекопитающих, содержащим вектор супрессии экспрессии, а также к способу получения функциональных супрессированных белков в клетках млекопитающих, трансфицированных вектором супрессии экспрессии. Настоящее изобретение также относится к супрессии экспрессии функциональных белков при достаточных уровнях экспрессии посредством системы экспрессии в эукариотической клетке-хозяине. В одном из вариантов осуществления изобретение относится к супрессии экспрессии функциональных белков в эукариотические клетках, предпочтительно клетках млекопитающих, грибов или клетках дрожжей, а наиболее предпочтительно в клетках СНО (клетках яичников китайского хомячка), с применением системы супрессии экспрессии. Более конкретно, один вариант осуществления настоящего изобретения относится к супрессии экспрессии функциональных белков в эукариотические клетках, например клетках млекопитающих, грибов или клетках дрожжей, с применением системы супрессии экспрессии, в которой все элементы супрессии содержатся на одном векторе. Один вариант осуществления настоящего изобретения относится к супрессии экспрессии функциональных белков в клетках СНО (клетках яичников китайского хомячка) (клетках, хранящихся в АТСС, а также известных вариантах и клетках и/или клеточных линиях, которые, как известно специалистам в данной области, могут использоваться вместо клеток СНО), с применением системы супрессии экспрессии, в которой все элементы супрессии содержатся в одном векторе. В одном аспекте данного варианта осуществления изобретения супрессия экспрессии функциональных белков в клетках млекопитающих включает применение системы супрессии экспрессии, включающей тРНК,тРНК синтетазу и элементы транскрипции/трансляции интересующего белка. Другой вариант осуществления изобретения обеспечивает опцию включения одного или нескольких тРНК элементов в независимой транскрипционной ориентации для эффективной модуляции внутриклеточных уровней экспрессии. В другом варианте осуществления изобретение относится к опции включения одной транскрипционной единицы, которая кодирует один интересующий белок, в который вводится искусственная аминокислота. Другой вариант осуществления изобретения относится к опции включения нескольких транскрипционных единиц, которые кодируют несколько интересующих белков или соответствующих субъединиц (таких как легкая и тяжелая цепи антитела), в которые вводится искусственная аминокислота, в один или во все белки. Другой вариант осуществления изобретения относится к линии эукариотических клеток, такой как линия клеток СНО, которая секретирует супрессированный белок, где экспрессия указанного белка происходит посредством системы супрессии экспрессии, описанной в настоящем патенте. В некоторых вариантах осуществления эукариотическая клетка является клеткой СНО или дрожжевой клеткой, например клеткой Pichia. Другой вариант осуществления изобретения относится к культуре клеток млекопитающих или клеток дрожжей, включающих систему супрессии экспрессии, способную продуцировать функциональные супрессированные белки. Векторы, содержащие последовательности супрессии экспрессии согласно изобретению, могут быть введены в клетки млекопитающих или клетки дрожжей. В процессе культивирования клеток в мишеневые клетки млекопитающих или клетки дрожжей могут быть введены требуемые экзогенные последовательности ДНК, при этом экзогенная ДНК встраивается в геном клеток млекопитающих или клеток дрожжей случайно или путем гомологичной рекомбинации. В зависимости от используемых последовательностей функциональные супрессированные белки могут быть выделены из биомассы клеточной культуры или из среды культивирования клеток. Еще один вариант осуществления настоящего изобретения относится к способу получения функциональных супрессированных белков, включающему культивирование эукариотических клеток, предпочтительно клеток млекопитающих или дрожжей, содержащих систему супрессии экспрессии, которая экспрессирует последовательности легкой и тяжелой цепей антитела, и выделение функциональных антител из клеточной культуры. Функциональные антитела могут быть получены в клеточных культурах с подпиткой на уровнях, подходящих для терапевтического применения, при условиях, оптимизированных для максимального выхода коммерческого продукта. Например, клетки СНО, выращиваемые в клеточных культурах с подпиткой, в которых непрерывно контролируют уровень глюкозы, могут продуцировать рекомбинантный белок в течение по меньшей мере 12 дней или дольше. См., например, патент США 6180401 по поводу описания, касающегося выработки рекомбинантного белка клетками, выращиваемыми в клеточных культурах с подпиткой. Целый ряд белков различных типов может быть экспрессирован согласно настоящему изобретению. Типы белков включают простые полипептиды или сложные комплексы полипептидов, такие как, помимо прочего, антитела. В рамках настоящего изобретения могут использоваться многочисленные векторные системы супрессии экспрессии. Например, вектор супрессии экспрессии может содержать элементы ДНК, которые получены из бактерий, таких как, помимо прочего, Е.coli, Bacillus, Salmonella; вирусов животных, таких как вирус папилломы крупного рогатого скота, вирус полиомы, аденовирус, вирус коровьей оспы, бакуловирус, ретровирус (RSV, MMTV или MOMLV) или вирус SV40. Дополнительно,клетки, в хромосомы которых интегрирована ДНК-конструкция супрессии экспрессии, могут быть отобраны путем введения одного или более маркеров, которые позволяют производить отбор трансфицированных клеток-хозяев. Маркер может обеспечивать любые средства, известные специалистам, квалифицированным в данной области, для селекции, включая, помимо прочего, прототрофность ауксотрофного хозяина, устойчивость к биоцидам (например, антибиотикам) или устойчивость к тяжелым металлам,таким как медь. Селективный маркерный ген может быть непосредственно связан с экспрессируемыми последовательностями ДНК, или введен в ту же клетку при котрансформации. Дополнительные элементы, которые могут использоваться при оптимизации синтеза мРНК, могут включать сигналы сплайсинга,а также промоторы транскрипции, энхансеры и сигналы терминации. В более общем смысле, после получения вектора или последовательности ДНК, кодирующей субъединицу белка, вектор экспрессии может быть введен в соответствующую клетку-хозяина. Таким образом, клетки-хозяева могут быть трансформированы. Введение плазмиды в клетку-хозяина может быть выполнено различными способами, известными специалистам, квалифицированным в данной области техники. Они включают, помимо прочего, трансфекцию (включая электрофорез и электропорацию), слияние протопластов, осаждение фосфатом кальция, слияние клеток с ДНК оболочки, микроинъекцию, PEI и заражение интактным вирусом. См. Ridgway, A.A.G. "Mammalian Expression Vectors", Chapter 24.2,с. 470-472, Vectors, Rodriguez and Denhardt, Eds. (Butterworths, Boston, Mass. 1988). Наиболее предпочтительно, для стабильно интегрируемых векторов, введение плазмиды в клетку-хозяина осуществляют с помощью электропорации. Трансформированные клетки выращивают в условиях, способствующих продукции белка, и анализируют на предмет синтеза белка. Примеры методов анализа для идентификации и количественного определения продуктов интересующих генов включают твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (RIA) или клеточный сортинг-анализ с активированной флуоресценцией (FACS), иммуногистохимию и т.п. В одном из вариантов осуществления настоящего изобретения линия клеток-хозяев, используемая для экспрессии белка, происходит от млекопитающих. Специалисты, квалифицированные в данной области техники, могут с легкостью определить клетки-хозяева или линии клеток, подходящие для экспрессии продукта требуемого гена. Примеры линий клеток-хозяев включают, помимо прочего, DG44 иDUXB11 (линии клеток яичников китайских хомячков, DHFR минус), производные СНО-K1, CHO-S,HELA (карцинома шейки матки человеческая), CVI (линия клеток почки обезьяны), COS (производные(бычьи эндотелиальные клетки), RAJI (человеческий лимфоцит) и 293 (человеческая почка). Клетки СНО являются наиболее предпочтительными. Клетки-хозяева или линии клеток обычно доступны на основе коммерческих услуг, из Американской коллекции культур тканей или на основе опубликованной литературы.In vitro получение допускает масштабирование с получением больших количеств требуемого полипептида, получаемого с применением системы супрессии экспрессии. Способы культивирования эукариотических клеток, например клеток млекопитающих и дрожжей, в условиях культур тканей известны в уровне техники и включают гомогенную суспензионную культуру, например, в аэролифтном реакторе или в реакторе с непрерывным перемешиванием, в иммобилизованной или прикрепленной клеточной культуре, например в полых волокнах, микрокапсулах, на микрогранулах агарозы или керамических картриджах. Для выделения и получения антител иммуноглобулины в супернатантах культуры могут быть сначала сконцентрированы, например, путем осаждения сульфатом аммония, диализа против гигроскопичного материала, такого как ПЭГ, фильтрации через селективные мембраны и т.п. При необходимости и/или по желанию сконцентрированные растворы поливалентных антител очищают с помощью стандартных хроматографических методов, например с помощью гель-фильтрации, ионообменной хроматографии, хроматографии на DEAE-целлюлозе или (иммуно-)аффинной хроматографии. В одном из вариантов осуществления настоящего изобретения эукариотические клетки, используемые для экспрессии, являются клетками млекопитающих или дрожжей. В другом варианте осуществления настоящего изобретения эукариотические клетки, используемые для экспрессии, являются клетками СНО. В дополнительном варианте осуществления настоящего изобретения эукариотические клетки, используемые для экспрессии, являются другими клетками, которые можно эффективно культивировать с целью продукции белка с высоким уровнем. Как отмечено выше, получение или клонирование генов белка с целью введения в системы супрессии экспрессии согласно изобретению находится в области компетенции среднего специалиста в данной области. Как отмечено, такие гены белка могут кодировать зрелые гены, полноразмерные белки или гены могут быть модифицированы, например, путем химеризации, гуманизации, делеции доменов или сайт-специфического мутагенеза. Белки, полученные с применением системы по настоящему изобретению, включают полноразмерные белки, зрелые белки, расщепленные белки, нерасщепленные белки, белки, раскрытые в настоящем патенте, антитела, фрагменты антител, включая, помимо прочего, Fv, Fc, Fab и (Fab')2, одноцепочечный Fv (scFv), диатела, триатела, тетратела, бифункциональные гибридные антитела, CDR1, CDR2, CDR3, комбинации CDR, вариабельные области, каркасные области, константные области и т.п. В варианте осуществления настоящего изобретения система экспрессии продуцирует белки в эукариотических клетках (неограничивающий пример: клетки млекопитающих, такие как клетки яичников китайского хомячка (СНО), клетки почек золотистого хомячка (BHK), клеточные линии фибробластов и линии клеток миеломы). В одном из вариантов осуществления клетки СНО используются в качестве хозяев для системы супрессии экспрессии, включающей цистрон, который включает следующие последовательности: ген последовательности тРНК, последовательность эукариотического промотора, которая является функциональной в конкретной эукариотической клетке, используемой для экспрессии, такую как последовательности промотора CMV, раннего промотора SV40 или актина, предпочтительно CMV; последовательность ДНК, кодирующую интересующий белок, предпочтительно на ее 5' конце, эукариотическую секреторную лидерную последовательность; и фланкированную 5' старт- и 3' стоп-кодонами, а также поли-А последовательность на ее 3' конце. Как правило, белки, супрессируемые и экспрессируемые согласно настоящему изобретению, могут использоваться в любой из множества конъюгированных (т.е. в форме иммуноконъюгата) или неконъюгированных форм. В частности, белки по настоящему изобретению могут быть конъюгированы с цитотоксинами, такими как радиоизотопы, терапевтические агенты, цитостатические агенты, биологические токсины или пролекарства. В наиболее предпочтительных вариантах осуществления белки, полученные в соответствии с системой экспрессии по настоящему изобретению, могут быть модифицированы, например, путем конъюгирования с радиоизотопами или биоактивными пептидами. Примеры радиоизотопов, используемых согласно изобретению, включают 90Y, 125I, 131I, 123I, 111In, 105Rh, 153Sm, 67Cu, 67Ga, 166Ho,177Lu, 186Re и 188Re, с использованием любых известных металл-хелатирующих агентов или прямого мечения. В одном из вариантов осуществления конъюгированные и неконъюгированные белки могут использоваться вместе в одной терапевтической схеме, как, например, в одобренной на настоящий момент терапевтической схеме с использованием зевалина для лечения некоторых неходжкинских лимфом. В других вариантах осуществления белки по изобретению могут быть включены в композиции, которые включают модифицированные белки, присоединенные к лекарственным соединениям, пролекарствам или модификаторам биологического ответа, таким как метотрексат, адриамицин, а также лимфокинам, таким как интерферон. Другие варианты осуществления настоящего изобретения включают использование модифицированных белков, конъюгированных с определенными биотоксинами, такими как рицин или токсин дифтерии. В других вариантах осуществления модифицированные белки могут находиться в комплексе с другими иммуноактивными лигандами (например, антителами или их фрагментами), где полученная молекула связывается с неопластической клеткой и, необязательно, эффекторной клеткой, такой как Т-клетка. Выбор того, какой модифицированный белок будет применяться, конъюгированный и/или неконъюгированный, зависит от типа и стадии рака, использования дополнительной терапии (например, химиотерапии или внешнего облучения), а также от состояния пациента. Следует понимать, что специалист, квалифицированный в данной области, может с легкостью сделать такой выбор с учетом идей, изложенных в настоящем описании. Изобретение далее иллюстрируется неограничивающими примерами 2, 3 и 4.IV. Общие генно-инженерные способы, применяемые в изобретении. В многочисленных вариантах осуществления настоящего изобретения нуклеиновые кислоты, кодирующие интересующий fEPO, выделяют, клонируют и часто изменяют с применением генноинженерных способов. Такие варианты осуществления применяются, в том числе, для экспрессии белка или в процессе получения вариантов, производных, кассет экспрессии или других последовательностей,полученных на основе fEPO полипептида. В некоторых вариантах осуществления последовательности,кодирующие полипептиды по изобретению, функционально связаны с гетерологичным промотором. Выделение hEPO описано, например, в патентах США 5441868; 5547933; 5618698; 5621080 и 6544748, а получение ЕРО в человеческих клетках описано в WO 93/09222, каждое описание включено в настоящее изобретение путем ссылки, при этом указанные методы могут быть применены специалистом в данной области для выделения и получения fEPO. Нуклеотидная последовательность, кодирующая fEPO полипептид, включающий некодируемую аминокислоту, может быть синтезирована на основе аминокислотной последовательности родительского полипептида, включая, помимо прочего, аминокислотную последовательность, показанную в SEQ IDNO:2 (или SEQ ID NO:4, или в альтернативных известных последовательностях, или SNP, при необходимости), с последующим изменением нуклеотидной последовательности с целью осуществления введения (т.е. вставки или замены) или удаления (т.е. делеции или замены) соответствующего аминокислотного остатка (остатков). Нуклеотидная последовательность предпочтительно может быть изменена посредством сайт-направленного мутагенеза в соответствии со стандартными методами. В альтернативе, нуклеотидная последовательность может быть получена с помощью химического синтеза, в том числе, при использовании синтезатора олигонуклеотидов, где олигонуклеотиды разработаны на основе аминокислотной последовательности требуемого полипептида, и предпочтительно с выбором тех кодонов, которые поддерживаются в клетке-хозяине, в которой продуцируется рекомбинантный полипептид. Например, несколько небольших олигонуклеотидов, кодирующих части требуемого полипептида, могут быть синтезированы и собраны с помощью ПЦР, лигирования или цепной лигазной реакции. См., например,Barany, et al., Proc. Natl. Acad. Sci. 88:189-193 (1991); патент США 6521427, которые включены в настоящее изобретение путем ссылки. В настоящем изобретении используются стандартные способы в области генной инженерии. Основные тексты, раскрывающие общие методики, используемые в настоящем изобретении, включают Общие тексты, в которых описаны методы молекулярной биологии, включают Berger and Kimmel,Guide to Molecular Cloning Techniques, Methods in Enzymology, том 152, Academic Press, Inc., San Diego,CA (Berger); Sambrook et al., Molecular Cloning - A Laboratory Manual (2-е изд., том 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989 ("Sambrook"), а также Current Protocols in MolecularBiology, F.M. Ausubel et al., eds., Current Protocols, совместное предприятие Greene Publishing Associates,Inc. и John WileySons, Inc. (с дополнениями до 1999) ("Ausubel". В указанных текстах описывается мутагенез, применение векторов, промоторов и многих других релевантных тем, связанных, в том числе,с созданием генов, которые включают селекторные кодоны для синтеза белков, содержащих неприродные аминокислоты, ортогональные тРНК, ортогональные синтетазы и их пары. Различные типы мутагенеза используются в изобретении в разнообразных целях, включая, помимо прочего, создание библиотек тРНК, создание библиотек синтетаз, создание селекторных кодонов, введение селекторных кодонов, которые кодируют неприродные аминокислоты в белке или интересующем полипептиде. Они включают, помимо прочего, сайт-направленный, случайный мутагенез, гомологичную рекомбинацию, перетасовку ДНК или другие методы рекурсивного мутагенеза, получение химерных конструкций, мутагенез с использованием урацилсодержащих матриц, олигонуклеотид-направленный мутагенез, мутагенез фосфоротиоат-модифицированной ДНК, мутагенез с использованием двунитевой ДНК с однонитевыми разрывами и т.п., или любую комбинацию перечисленного. Дополнительные подходящие способы включают исправление точковых ошибок спаривания оснований, мутагенез с использованием штаммов-хозяев с дефицитной репаративной системой, рестрикцию с селекцией и рестрикцию с очисткой, делеционный мутагенез, мутагенез путем полного синтеза генов, репарацию двунитевых разрывов и т.п. Мутагенез, включающий, помимо прочего, введение химерных конструкций, также включен в настоящее изобретение. В одном из вариантов осуществления мутагенез может направляться известными данными природной молекулы или измененной, или мутированной природной молекулы, включая,помимо прочего, последовательность, сравнения последовательностей, физические свойства, кристаллическую структуру и т.п. Указанные методики описаны в текстах и примерах, представленных в настоящем патенте. Дополнительную информацию можно найти в следующих публикациях и приведенных в них ссылках:
МПК / Метки
МПК: C07K 1/113, C07H 21/00, C07K 14/505
Метки: полипептиды, применение, эритропоэтина, модифицированные, животных
Код ссылки
<a href="https://eas.patents.su/30-19653-modificirovannye-polipeptidy-eritropoetina-zhivotnyh-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Модифицированные полипептиды эритропоэтина животных и их применение</a>
Предыдущий патент: Способ кондиционирования конвейерной ленты установок для таблетирования и устройство для изготовления таблеток
Следующий патент: Система для гидрирования тетрагалогенида кремния и кремния в тригалогенсилан
Случайный патент: Соединения 1h-индол-пиридинкарбоксамида и 1н-индол-пиперидинкарбоксамида, способ их получения и фармацевтические композиции, которые их содержат












