Производные криптофицина и его конъюгаты, их получение и применение в терапии
Номер патента: 24627
Опубликовано: 31.10.2016
Авторы: Брэн Мари-Присцилл, Бушар Эрве, Чжан Цзидун, Коммерсон Ален
Формула / Реферат
1. Производное криптофицина формулы (II)
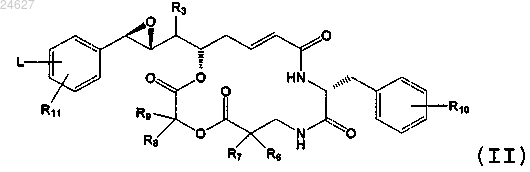
в которой R3 означает (C1-C6)алкильную группу;
R6 и R7 означают, независимо один от другого, Н или (С1-С6)алкильную группу;
R8 и R9 означают, независимо один от другого, Н или (С1-С6)алкильную группу;
R10 означает Н или по меньшей мере один заместитель фенильного кольца, выбранный из групп (С1-С4)алкокси, атома хлора;
R11 означает Н или по меньшей мере один заместитель, выбранный из (С1-С4)алкильной группы;
L означает линкер в положении орто(о)-, мета(м)- или пара(п)-, выбранный из
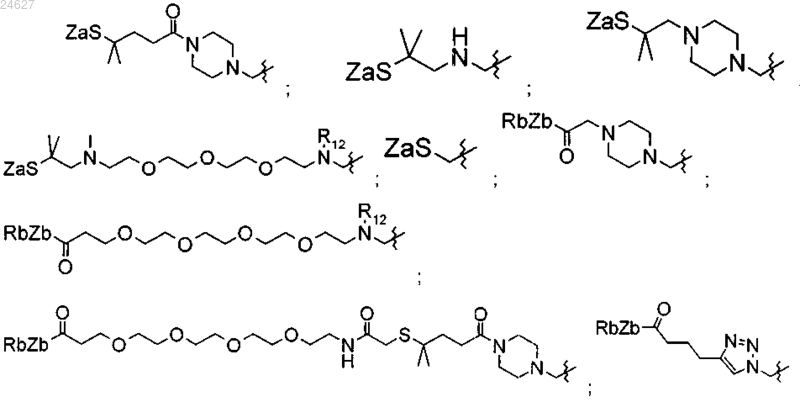
R12 означает Н или (C1-C6)алкильную группу;
Za означает Н или группу -SRa, где Ra означает группу (C1-C6)алкил;
Zb означает простую связь, -О- или -NH-, причем Rb означает Н или группу (C1-C6)алкил;
где группу -SZa или -C(=O)-ZbRb обозначают как химическую реакционноспособную группу (GCR1).
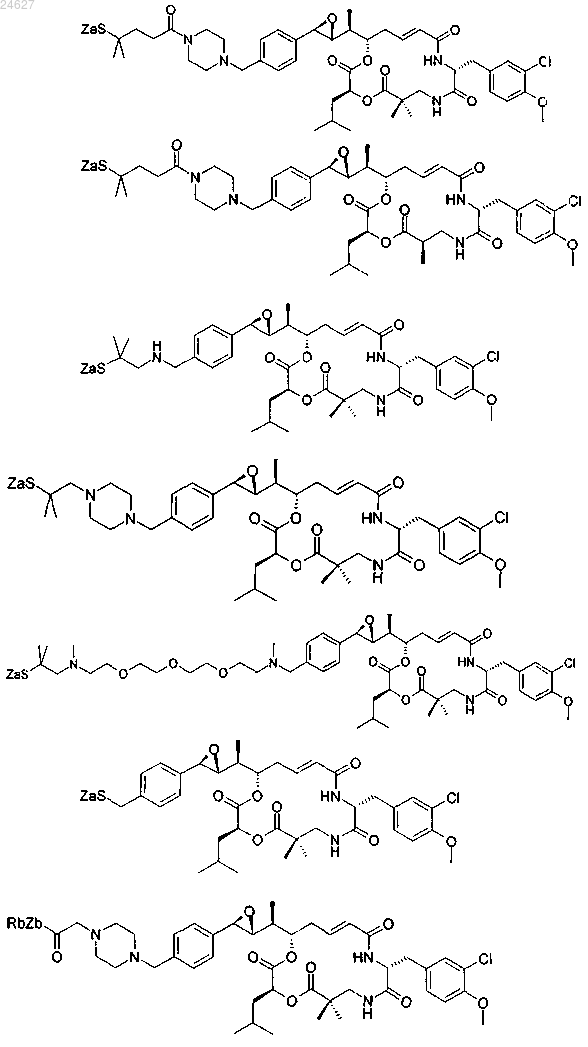
2. Производное криптофицина по п.1, описанное одной из следующих формул:

3. Производное криптофицина по п.1, выбранное из
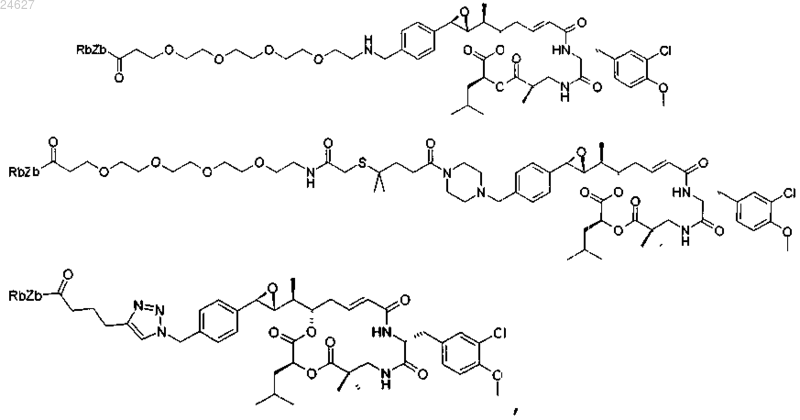
в котором Za, Zb и Rb определены в п.1.
4. Применение производного криптофицина по одному из пп.1-3 для образования конъюгата с моноклональным антителом.
5. Способ получения конъюгата, представляющего собой моноклональное антитело, с которым ковалентно связано по меньшей мере одно производное криптофицина формулы (II) по п.1, содержащее реакционноспособную химическую группу (GCR1), состоящий в том, что (i) вводят в контакт и подвергают взаимодействию водный раствор моноклонального антитела и раствор производного криптофицина, такого как определен в п.1.
6. Способ по п.5, в котором водный раствор моноклонального антитела является забуференным.
7. Способ по п.5 или 6, в котором дополнительно (ii) отделяют конъюгат, полученный на стадии (i), от производного криптофицина, и/или непрореагировавшего моноклонального антитела, и/или от возможно образовавшихся агрегатов.
8. Способ по одному из пп.5-7, в котором в случае производного криптофицина, содержащего реакционноспособную химическую группу GCR1 типа -SZa, подвергают взаимодействию производное криптофицина с моноклональным антителом, содержащим
дисульфидные химические группы, если GCR1 означает -SH;
тиольные химические группы, если GCR1 означает -SZa, где Za¹H;
малеимидо или иодацетамидо химические группы, если GCR1 означает -SH;
в случае производного криптофицина, содержащего реакционноспособную химическую группу GCR1 типа -C(=O)-ZbRb, подвергают взаимодействию производное криптофицина с аминофункциями моноклонального антитела.
9. Способ по одному из пп.5-8, в котором
в случае производного криптофицина, содержащего реакционноспособную химическую группу GCR1 типа -SZa, моноклональное антитело модифицируют с помощью модифицирующего агента, выбранного из соединения формулы
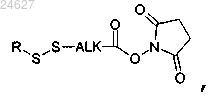
в которой R означает группу (С1-С6)алкил и ALK означает (C1-С6)алкиленовую группу;
в случае производного криптофицина, содержащего реакционноспособную химическую группу GCR1 типа -SH, моноклональное антитело модифицируют с помощью модифицирующего агента, выбранного из сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата; сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата;
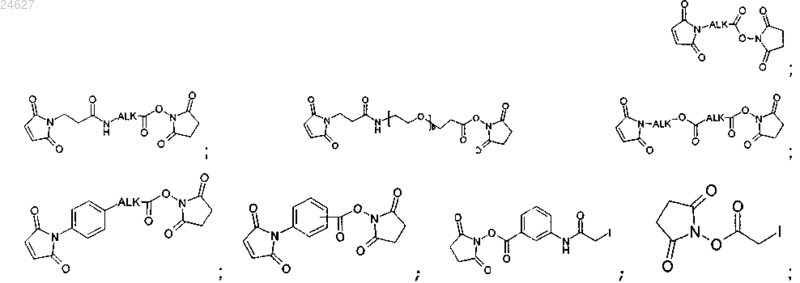
сукцинимидил-N-бромацетата; сукцинимидил-3-(N-бромацетамидо)пропионата;

причем ALK означает (C1-C12)алкиленовую группу и b является целым числом между 0 и 2000.
10. Конъюгат для применения в качестве противоракового агента, получаемый способом по одному из пп.5-9.
Текст
Изобретение относится к производному криптофицина формулы (II), в которой R3 означает (C1C6)алкильную группу; R6 и R7 означают, независимо один от другого, Н или (C1-C6)алкильную группу; R8 и R9 означают, независимо один от другого, Н или (C1-С 6)алкильную группу; R10 означает Н или по меньшей мере один заместитель фенильного кольца, выбранный из группы (C1 С 4)алкокси, атома хлора; R11 означает Н или по меньшей мере один заместитель, выбранный из (C1C4)алкильной группы; L означает линкер в положении орто(о)-, мета(м)- или пара(п)-, выбранный изR12 означает Н или (С 1-С 6)алкильную группу, Za означает Н или группу -SRa, где Ra означает группу (С 1-С 6)алкил; Zb означает простую связь, -О- или -NH-, причем Rb означает Н или группу (C1-C6)алкил. Кроме того, изобретение относится к применению указанного производного криптофицина для образования конъюгата с моноклональным антителом, способу получения коньюгата, представляющего собой моноклональное антитело, с которым ковалентно связано по меньшей мере одно производное криптофицина формулы (II), а также конъюгату для применения в качестве противоракового агента, получаемого описанным способом. 024627 Настоящее изобретение относится к конъюгированным криптофицинам, к содержащим их фармацевтическим композициям и применению их в терапии, в частности, в качестве противораковых агентов. Изобретение относится также к способу получения этих соединений, а также к самим производным криптофицинов. Область техники Криптофицины являются вторичными метаболитами, относящимися к классу депсипептидных макроциклов, продуцируемых цианобактериями вида Nostoc. Их название связано с тем, что эти соединения являются высоко цитотоксичными соединениями по отношению к дрожжам вида Cryptococcus. Первый представитель этого класса молекул, криптофицин-1 (С-1), был выделен в 1990 г. из цианобактерии Nostoc sp (ATCC 53789) (Eiler S., et al., Synthesis 2006, 22, 3747-3789). Структура, общая формула и нумерация атомов углерода в этих соединениях, такие как описано в заявке WO 98/08505, и представлены ниже Криптофицины С-1 и С-52, характеризующиеся наличием эпоксидной функциональной группы, показанной ниже, обладают противораковыми свойствами. Клинические испытания были проведены на раке легких, фаза II, с С-52 (LY 355073): см. Edelman M.J. et al., Lung Cancer 2003, 39, 197-199; Sessa С. etal., Eur. J. Cancer 2002, 38, 2388-96. Сам криптофицин С-55, являющийся пролекарством С-52, характеризуется наличием хлоргидриновой функциональной группы вместо и на месте эпоксидной функциональной группы (Bionpally R.R., et al., Cancer Chemother Pharmacol. 2003, 52, 25-33). C-55 проявил себя очень активным продуктом, но нестабильным в растворе. Описаны также производные типа хлоргидринглицинатных производных, такие как соединение С-55 Gly, для увеличения стабильности (Liang J., et al.,Investigational New Drugs 2005, 23, 213-224). Техническая задача Химия конъюгатов известна в течение несколько лет и была применена для изучения нескольких семейств цитотоксических соединений, таких как, например, майтансиноиды (WO 04103272), таксаны(WO 2007102069); см. также о конъюгированных соединениях: Monneret С., et al., Bulletin du Cancer,2000, 87(11), 829-38; Ricart A.D. et al., Nature Clinical Practice Oncology 2007, 4, 245-255. Однако эта химия не занималась производными криптофицина, конъюгированными с антителами или другими агентами клеточного связывания. Техническая задача, которую предлагает решить настоящее изобретение, заключается в предоставлении новых конъюгатов на основе производных криптофицина, а также новых производных криптофицина, способных к конъюгированию. Уровень техники Документы ЕР 0830136 и WO 98/08505 описывают производные криптофицинов, но не описывают конъюгированные криптофицины. Заявка WO 98/08505 описывает производные криптофицинов формулы (А) в которой Ar может означать группу Ar' формулы которые характеризуются конечной группой -NHC(=O)Ot-Bu. Однако заявка WO 98/08505 не конкретизирует, что эти соединения могут быть конъюгированы или используются для конъюгирования.US 2007/0213511 описывает иммуноконъюгаты калихеамицина. Среди них упоминается MYLOTARG (или СМА-676), который является иммуноконьюгатом калихеамицина, используемым для лечения AML (анти-CD33-калихеамицин). О конъюгатах см. также WO 2006/042240.Al-awar R.S., et al., J. Med. Chem. 2003, 46(14), 2985-3007 и Al-awar R.S., et al., Mol. Cancer Ther. 2004, 3(9), 1061-1067 описывают производные криптофицина, а также оценивают их активность in vivo.WO 08010101 описывает моноклональное антитело против EphA2, а также соответствующие конъюгаты, включающие одну или несколько молекул цитотоксического соединения, связанного(ых) с моноклональным антителом. WO 08047242 описывает моноклональное антитело против CD38, а также соответствующие конъюгаты, включающие одну или несколько молекул цитотоксического соединения, свя-2 024627 занного(ых) с моноклональным антителом. Цитотоксическое соединение может быть выбрано из майтансиноидов, таксанов, томаймицинов, лептомицинов, СС-1065 и его аналогов.WO 2009/126934 описывает антитела против CD70 и их конъюгаты с цитотоксическими соединениями; среди цитотоксических соединений назван криптофицин. WO 2009/134976 описывает конъюгаты с оптимальной степенью замещения для подачи необходимого количества цитотоксических соединений в клетку; среди цитотоксических соединений назван криптофицин.WO 2005/116255 описывает конъюгаты аптамеров с цитотоксическим соединением, которым может быть криптофицин (см. [0037] и табл. 2), причем линкер может включать ПЭГ-цепочку ([0038]). В частности, описан криптофицин Cryp-NH2 формулы а также его конъюгаты на основе аптамеров со следующими линкерами: NHS-ПЭГ-эритритол, pNPПЭГ-эритритол, NHS-ПЭГ-октаПЭГ, pNP-ПЭГ-октаПЭГ и ПЭГ-comb (табл. 3 и 4). Природа цепи на фенильном кольце (-СН 2 О-С(=O)-CMe2-CH2NH-) отличается от того, что предложено в настоящем изобретении. WO 2006/096754 также описывает конъюгаты аптамеров с цитотоксическим соединением, которым тоже может быть криптофицин.WO 2009/002993 описывает конъюгаты цитотоксического соединения формулы B-L-A, включающие гидрофильные линкеры, например линкер формулы Цитотоксическим соединением может быть криптофицин (с.46), при этом не уточнено место присоединения линкера. Примером конъюгированного соединения является ЕС 0262 у которого линкер и место его присоединения отличаются от тех, которые предложены в настоящем изобретении. Определения Подразумевают под конъюгатом: агент клеточного связывания, с которым ковалентно соединена по меньшей мере одна молекула цитотоксического соединения; агентом клеточного связывания (или по-английски "cell binding agent"): молекулу, имеющую сродство к биологической мишени: в настоящей заявке это моноклональное антитело. Функция агента клеточного связывания заключается в том, чтобы направлять биологически активное соединение, такое как цитотоксическое соединение, к биологической мишени. Предпочтительно, чтобы агент клеточного связывания не был аптамером; биологической мишенью: антиген (или группу антигенов), локализованный предпочтительно на поверхности раковых или стромальных клеток, ассоциированных с этой опухолью; этими антигенами могут быть, например, рецептор фактора роста, онкогенный продукт или мутированный ген-"супрессор опухоли", молекула, связанная с ангиогенезом, адгезивная молекула; линкером: совокупность атомов, позволяющая ковалентно соединить цитотоксическое соединение с моноклональным антителом; алкильной группой: углеводородную алифатическую насыщенную группу, получаемую удалением атома водорода из алкана. Алкильная группа может быть линейной или разветвленной. В качестве примера можно назвать группы: метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, 2,2 диметилпропил, гексил; циклоалкильной группой: циклическую алкильную группу, содержащую 3-8 атомов углерода,встроенных в циклическую структуру. В качестве примера можно назвать группы: циклопропил, циклобутил, циклопентил, циклогексил; гетероциклоалкильной группой: циклоалкильную группу, содержащую по меньшей мере один гетероатом (О, S, N), встроенный в цикл и связанный с атомами углерода, образующими цикл; алкоксигруппой: О-алкильную группу, в которой алкильная группа такая, как определена выше; алканоилоксигруппой: O-СО-алкильную группу, в которой алкильная группа такая, как определена выше; алкиленовой группой: двухвалентную насыщенную группу брутто-формулы -CnH2n-, получаемую-3 024627 удалением двух атомов водорода из алкана. В качестве примера можно назвать метиленовую (-СН 2-),этиленовую (-СН 2 СН 2-), пропиленовую (-СН 2 СН 2 СН 2-), бутиленовую (-СН 2 СН 2 СН 2 СН 2-), гексиленовую(-СН 2 СН 2 СН 2 СН 2 СН 2 СН 2-) группу или следующие разветвленные группы предпочтительно алкиленовая группа отвечает формуле -(СН 2)n-, где n означает целое число; в диапазон величин включены граничные значения (например, диапазон типа "n от 1 до 6" или "между 1 и 6" включены граничные значения 1 и 6). Используемая аббревиатура.AcOEt: этилацетат; ALK: группа (C1-C12)алкилен, более конкретно (C1-C6)алкилен, более конкретно в виде -(СН 2)n-, где n означает целое число от 1 до 12, предпочтительно от 1 до 6; aq.: водный; ССМ: хроматография в тонком слое (по-английски TLC); CMS: метансульфонилхлорид; крипто означает звено в частности крипто означает одно из производных криптофицина D1-D8, описанформулы ных ниже, или производное криптофицина согласно какому-либо примеру; Rf: коэффициент удерживания; DAR: степень замещения (drug-antibody ratio); DBU: 1,8-диазабицикло[5.4.0]ундец-7-ен; DCC: N,N'дициклогексилкарбодиимид; DCM: дихлорметан; DEAD: диэтилазодикарбоксилат; DIC: N,N'диизопропилкарбодиимид; DIPEA: N,N-диизопропилэтиламин; DMA: диметилацетамид; DMAP: 4 диметиламинопиридин; DME: диметоксиэтан; DMF: диметилформамид; ДМСО: диметилсульфоксид;SPE: твердофазная экстракция; КТ: комнатная температура; TBDMS: трет-бутилдиметилсилил; ТСЕР: гидрохлорид трис-(2-карбоксиэтил)фосфина; TEA: триэтиламин; TFA: трифторуксусная кислота; TIPS: триизопропилсилил; THF: тетрагидрофуран; tR: время удерживания. Подробное описание изобретения Изобретение относится к моноклональному антителу, с которым соединено по меньшей мере одно производное криптофицина формулы (I)R6 и R7 означают, независимо один от другого, Н или (C1-С 6)алкильную группу;R8 и R9 означают, независимо один от другого, Н или (C1-С 6)алкильную группу;R10 означает Н или по меньшей мере один заместитель фенильного кольца, выбранный из: группыR11 означает Н или по меньшей мере один заместитель фенильного кольца, выбранный из(C1-C4)алкильной группы; при этом моноклональное антитело и производное криптофицина ковалентно соединены и место их соединения находится в орто(о)-, мета(м)- или пара(п)-положении на фенильном кольце, несущем звеноR6 и R7 означают, независимо один от другого, Н или (C1-С 6)алкильную группу; более конкретно они означают, независимо один от другого, Н или группу Me;R8 и R9 означают, независимо один от другого, Н или (C1-C6)алкильную группу; более конкретно R8 означает Н и R9 означает изобутил;R10 представляет собой Н или по меньшей мере один заместитель фенильного кольца, выбранный из группы -ОН, (C1-С 4)алкоксигруппы, атома хлора. Более конкретно на фенильном кольце имеется два заместителя в положении 3 и 4. Предпочтительно ими являются 3-Cl и 4-метокси. R11 представляет собой Н или по меньшей мере один заместитель фенильного кольца, выбранный из (С 1-С 4)алкильной группы; более конкретно Н.-4 024627 В более конкретном случае можно выбрать один из заместителей R3 и R6-R11 среди тех, которые описаны в примерах. Каждый заместитель R3 и R6-R11 может также принять одну из пространственных конфигураций (например, R или S или же Z или Е), как описано в примерах. Связывание производного криптофицина с моноклональным антителом осуществляется через линкер L, занимающий орто(о)-, мета(м)- или пара(п)-положение на фенильном кольце, несущем звено CR1; так, производное криптофицина, способное к конъюгированию, имеет формулу (II) Место соединения с моноклональным антителом находится на другом конце линкера L на уровне реакционноспособной группы, имеющейся на моноклональном антителе. Так, L содержит по меньшей мере одну химическую реакционноспособную группу (GCR1) напротив химической реакционноспособной группы (GCR2), имеющейся на моноклональном антителе. Взаимодействие между GCR1 и GCR2 обеспечивает связывание соединения формулы (II) с моноклональным антителом посредством образования ковалентной связи. Таким путем производное криптофицина формулы (II) способно конъюгироваться с моноклональным антителом. Производные криптофицина согласно настоящему изобретению, в том числе производные криптофицина согласно примерам, могут существовать в форме оснований или кислотно-аддитивных солей с кислотами, в частности с фармацевтически приемлемыми кислотами. В качестве примеров группы GCR1 можно назвать:-ZbRb может означать -ОН, -ОСН 3. Более конкретно группа GCR1 может быть выбрана из тех групп, которые описаны в примерах. В качестве примера GCR2 можно назвать -аминогруппы лизинов, находящиеся на боковых цепях лизиновых остатков, которые имеются на поверхности антитела, сахаридные группы соединительной цепи или тиольные группы цистеинов, образующиеся восстановлением дисульфидных межцепочечных связей (Garnett M.C., et al., Advanced Drug Delivery Reviews 2001, 53, 171-216). В последнее время появились другие технические решения, такие как введение цистеинов путем мутации (Junutula J.R. et al., Nature Biotechnology 2008, 26, 925-932; WO09026274) или введение аминокислот не природного происхождения другими химическими методами (Graaf A.J. et al., Bioconjugate Chem. 2009, Publication Date (Web): февраль, 3, 2009 (Review); DOI: 10.102l/bc800294a; WO 2006/069246 и согласно Chin J.W., et al., JACS 2002, 124, 9026-9027 (технология ReCode. Все эти используемые варианты связывания с антителами можно применять ко всем известным моноклональным антителам в зависимости от их структуры. Можно также химически модифицировать моноклональное антитело так, чтобы можно было ввести новые химические реакционноспособные группы GCR2. Так, специалисту известно, каким путем можно модифицировать антитело с помощью модифицирующего агента (см., в частности, WO 2005/077090,с.14). Модификация позволяет улучшить реакцию конъюгирования и использовать более разнообразные виды групп GCR1. Модифицирующие агенты, позволяющие вводить дисульфидные группы. Модифицирующим агентом может быть активированный сложный эфир NHS формулы в которой R означает группу (C1-C6)алкил и ALK означает (C1-C6)алкиленовую группу; например,можно ввести реакционноспособные дитиопиридильные группы GCR2 (см. Bourdon M.A., et al., Biochem.J. 1978, 173, 723-737; US 5208020), которые затем можно ввести во взаимодействие с химической реакционноспособной группой GCR1 типа -SH, находящейся на линкере производного криптофицина, с образованием новой связи -S-S- (см. пример 9 конъюгата, имеющего дисульфидную связь).N-гидроксисукцинимидная группа взаимодействует предпочтительно с аминогруппами, имеющимися на антителе, с образованием амидных связей. Модифицирующие агенты, позволяющие вводить малеимидные группы. Другим примером модифицирующего агента является сукцинимидил-4-(Nмалеимидометил)циклогексан-1-карбоксилат (SMCC), аналогичное ему соединение описано в ЕР 0306943, или сульфо-SMCC (сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат). В качестве других примеров можно назвать такое как N-сукцинимидил-6-(3-малеимидопропионамидо)гексаноат; где b означает целое число между 0 и 2000, предпочтительно между 1 и 200 (b может принимать любые значения между 0 и 2000),такое какN-сукцинимидил-4-(4 малеимидофенил)бутаноат или такое как N-сукцинимидил-3-малеимидобензоат. Модифицирующие агенты, позволяющие вводить галогенацетамидные группы. Другим примером модифицирующего агента является сукцинимидил-4-(N-иодацетил)аминобензоат или аналогичные соединения, среди которых сукцинимидил-N-иодацетат (SIA)(SIAB) сукцинимидил-N-бромацетат (SBA), или сукцинимидил-3-(N-бромацетамидо)пропионат (SBAP), или аналогичное пэгилированное соединение, описанное в WO 2009/134976 где b имеет указанные выше значения. На фиг. 1 и 2 иллюстрирован способ модификации аминогруппы моноклонального антитела с помощью SPDP или предпочтительного вышеупомянутого иминотиолана. Таким путем можно вводить в моноклональные антителодисульфидные (-SSR) группы GCR2, в случае, когда GCR1 означает -SH. Аналогично этому, можно ввести в моноклональное антителотиольные(-SH) группы GCR2, в случае, когда GCR1 означает дисульфид. В обоих случаях ковалентная связь, образующаяся в результате реакции между GCR1 и GCR2, представляет собой расщепляемую дисульфидную связь. Возможно также, в случае, когда GCR1 означает -SH, ввести на поверхность моноклонального анили иодацетамидо И, наоборот, можно ввести в монотителагруппы GCR2 типа малеимидо клональное антитело тиольные (-SH) группы GCR2, например, с помощью иминотиолана, в случае, когдаGCR1 означает или В этом случае ковалентная связь, образующаяся в результате реакции между GCR1 и GCR2, представляет собой нерасщепляемую сульфидную связь. Таблица I Примеры модификаций агента клеточного связывания в случае, когда GCR1=-SZag - Число функциональных групп GCR2 на модифицированном моноклональном антителе;L - такой фрагмент линкера L, содержащего GCR1=-SZa, чтобы L=-LSZa. В случае, когда GCR1 означает реакционноспособную группу малеимидо где R12 означает Н или (C1-С 6)алкил, более конкретно Me, производное криптофицина может быть представлено нижеописанной формулой (IIa) или (IIb) где L означает такой фрагмент линкера, чтобы L=-L-малеимидо или L=-L-иодацетамидо.-6 024627 Производным криптофицина из серии С-52 и С-1 может быть одно из следующих производных: или эквивалентное звено, описанное в одном из примеров. Более конкретно L находится в пара-положении к звену CR1. Способ получения производных криптофицина Соединения формулы (II) получают согласно схеме 1 из производного криптофицина формулы (III) и предшественника линкера (PL). Схема 1 где G означает группу -СН=СН 2, -(CH2)nY или -(С 1-С 6)алкилен-Y, где n является целым числом от 1 до 6, и Y означает -ОН, -SH, -Cl, -OGP, где GP означает уходящую группу, такую как, например, мезилатная (OMs) или тозилатная группа, или Y означает -N3, NH2, -COOH, -NR12-CH2-CCH, в которой R12 означает Н или (С 1-С 6)алкильную группу, более конкретно метильную группу. Предшественник линкераPL выполняет роль, заключающуюся во введении линкера L в производное криптофицина после взаимодействия группы G с химической функциональной группой, находящейся на PL.G может также означать группу(т.е. Y означает группу дующих групп (R12 и R'12 означают Н или (C1-C6)алкильную группу) выбираемую из 9 сле или -(СН 2)n-SH. Согласно схеме 1 для получения производного криптофицина (II) из производного криптофицина(III) могут быть необходимы несколько стадий и/или реакций. Так, например, в случае, когда Za=H,предпочитают вводить линкер L, в котором Za=-S(C1-С 6)алкил, используя соответствующий предшественник линкера, затем восстанавливают дисульфидную функциональную группу SS(С 1-С 6)алкил до тиольной функциональной группы -SH. Для этого можно использовать, например, ТСЕР: в этой связи см.Burns J.A., et al., J. Org. Chem. 1991, 56(8), 2648-2650. Это превращение -SS (С 1-С 6)алкил-SH может применяться, например, к линкерам L1-4 и L21-23 табл. II. Схемы 1' и 1" иллюстрируют также получение производного криптофицина, включающего линкер,содержащий соответственно группу малеимидо или иодацетамидо (L означает такой фрагмент линкера Эти производные получают взаимодействием производного криптофицина, включающего линкерL', содержащий амино- или тиольную группу, с модифицирующим агентом, позволяющим ввести соответственно малеимидо- или иодацетамидогруппу.-7 024627 Примеры реакций между группой G и химической функциональной группой, находящейся на PL. Реакция нуклеофильного замещения между предшественником линкера PL, несущим аминогруппу-NH- (может быть использована также соль амина) и G=-(CH2)nCl или -(CH2)nOMs (см., например, табл.II, PL1-4, PL7a, PL8-10, PL21-23): эту реакцию можно проводить в полярном апротонном растворителе в присутствии основания, такого как, например, TEA или DIPEA; см. пример 1, соединение 7 или пример 15,соединение 48. Реакция ацилирования между предшественником линкера PL, несущим функциональную карбамоилгалогенидную группу, и G=-(CH2)nOH (см., например, табл. II, PL5): эту реакцию можно вести в полярном апротонном растворителе в присутствии аминного основания, такого как, например, TEA. В соответствии с вариантом можно также осуществить реакцию между предшественником линкераPL, несущим функциональную аминогруппу -NH-, и G=-(СН 2)nO-С(=O)-О-(4-нитрофенил), полученным из G=-(CH2)nOH и п-нитрофенилхлорформиата (активация спирта в форме карбоната) согласно схеме,представленной ниже: (R12=H или (C1-C6)алкил):-NHR12 + крипто-(СН 2)nO-С(=O)-О-(4-нитрофенил)крипто-(CH2)nO-C(=O)-NR12-активация спирта в форме карбоната может быть также использована для осуществления реакции между предшественником линкера, несущим функциональную группу -ОН, и G=-(CH2)nNH2 или -(CH2)nOH для получения соответственно карбаматной (-O-С(=O)-NH-) или карбонатной (-O-С(=O)-О-) функциональной группы согласно соответственно следующим схемам:II, PL6a-6b, PL24-25) реакция этерификации между предшественником линкера PL, несущим функциональную кислотную группу -СООН, и G=-(CH2)nOH (см., например, табл. II, Pb14b): эту реакцию можно вести в полярном апротонном растворителе в присутствии аминного основания, такого как, например, DMAP, и сочетающего агента, например DCC; реакция амидирования между предшественником линкера PL, несущим функциональную кислотную группу -СООН, и G=-(CH2)nNH2 (см., например, табл. II, PL14a): эту реакцию можно вести в полярном апротонном растворителе в присутствии сочетающего агента, например EDCl или HOBt; реакция амидирования между предшественником линкера PL, несущим функциональную группу-NH2, и G=-(СН 2)nCOOH (см., например, табл. II, PL7c): эту реакцию можно вести в полярном апротонном растворителе в присутствии сочетающего агента, например EDCl или HOBt; 1,3-диполярное циклоприсоединение (в химии называемое также "click" реакцией), реакция между предшественником линкера PL, несущим терминальную алкиновую функциональную группу, иG=-(CH2)nN3, или между предшественником линкера PL, несущим азидную функциональную группу, иG=-(CH2)nNR12-CH2CCH (см., например, табл. II, PL15-18): эту реакцию можно вести в полярном растворителе в присутствии Cu(I) в качестве катализатора (см. циклоприсоединение по Хьюзгену: RostovtsevV.V., et al., Angew.Chem.Int.Ed. 2002, 41, 2596-2599; Tornoe C.W., et al., J.Org.Chem. 2002, 61, 3057-3064); метатезис, реакция между предшественником линкера PL, несущим терминальную этиленненасыщенную функциональную группу, и G=-CH=CH2 (см., например, табл. II, PL19, PL20): эту реакцию можно вести в полярном апротонном растворителе в присутствии катализатора Груббса 2-го поколения (CAS 246047-72-3, см. об этой реакции Poeylaut-Palena A.A. et al., J.Org.Chem. 2008, 13, 2024-2027). О линкере L. Линкер L может быть выбран из следующих соединений:Zb означает простую связь, -О- или -NH-, причем Rb означает Н или группу (C1-С 6)алкил; где группу -SZa или -C(=O)-ZbRb обозначают как химическую реакционноспособную группу(GCR1). Получение соединений формулы (III), когда G=-(CH2)nOH или -СН=СН 2.from natural products", TaylorFrance, CRC press book, isbn=0-8493-1863-7, даны схемы синтеза, позволяющего получить различные фрагменты (А, В, С и D) криптофицина и получить в результате P1. Авторами Rej R., et al., J. Org. Chem. 1996, 61, 6289-6295 изображен на схемах 1-6 путь получения одного из производных криптомифицина согласно фиг. 1, однако эти схемы могут быть применимы в случае получения P1 с использованием иодиновых исходных реагентов.P1 позволяет получить другие производные криптофицина с помощью стадий, подробно описанных ниже. Стадия (i): раскрытие эпоксидного цикла P1 в кислой среде с получением диольной функциональной группы. Можно использовать, например, концентрированную перхлорную кислоту. Стадия (ii): окислительное расщепление диола с помощью, например, периодата натрия. Стадия (iii): реакция Виттига, использующая соответствующий галогенид фосфония, например бромид, и сильное основание, такое как, например, BuLi. Стадия (iv): реакция эпоксидирования Кори-Чайковского с использованием хиральной соли сульфония, например трифлата, в присутствии основания, такого как, например, КОН. Стадия (v): снятие защиты с силилированного простого эфира, используя, например, раствор тетрабутиламмонийфторида. Бромид 4-(триизопропилсилоксиметил)бензилтрифенилфосфония получают из 1-(бромметил)-4(триизопропилсилоксиметил)бензола (CAS 934667-38-6), получение которого из 1,4-бензолдиметанола(CAS 589-29-7, рыночный продукт) описано Potter R.G., et al., Organic Letters 2007, 9(7), 1187-1190. Соединения, в которых R11 означает (C1-C4)алкильную группу, получают аналогичным способом, исходя из соответствующего диола, который либо является рыночным продуктом, либо получают С-алкилированием по Фриделю-Крафтсу из 1,4-бензолдиметанола. Исходя из 1-(бромметил)-4-(триизопропилсилоксиметил)бензола (CAS 135408-73-0), получение которого описано на схеме 4 а патента ЕР 0496548, или на странице 83 статьи Nevill C.R. Jr., et al., BioorganicMed. Chem. Lett. 1991, 1(1), 83-86, можно получить соответствующий бромид фосфония. Соединения, в которых R11 означает (C1-С 4)алкильную группу, получают аналогичным способом, исходя из соединения, эквивалентного соединению 1, описанному на странице 83 статьи Nevill C.R. Jr., et al., BioorganicMed. Chem. Lett. 1991, 1(1), 83-86, которое либо является рыночным продуктом, либо получают С-алкилированием по Фриделю-Крафтсу из п-толуолуксусной кислоты. Трифторметансульфонат(1R,4R,5R,6R)-4,7,7-триметил-6-(4-винилбензил)-6-тиониабицикло[3.2.1]октана, используемый на стадии (iv), получают из (1R,4R,5R)-изотиоцинеола (см. Aggarwal V. etal., JACS 2010, 132, 1828-1830), получение которого из (R)-лимонена (CAS95327-98-3), рыночный продукт) описано в этой же самой ссылке. Бромид трифенил(п-винилбензил)фосфония (CAS118766-51-1) получают из соответствующего бромпроизводного (см. Drefahl G., et al., Chem.Ber. 1961, 94(8), 2002-2010), получение которого из 4 винилбензилового спирта (CAS1074-61-9, рыночный продукт) описано в статье Shimomura О., et al.,Tetrahedron 2005, 61, 12160-12167. Исходя из Р 7 или Р 8, которые являются соединениями формулы (III), в которых G=-(CH2)n ОН,можно получить другие соединения формулы (III), имеющие другие группы G. Исходя из группы G=-CH2OH можно получить группы G=-CH2Cl или -CH2N3: введение -Cl может быть осуществлено в присутствии CMS: см. пример 1, соединение 2; азидирование может быть осуществлено в присутствии дифенилфосфоразида (PhO)2P(=O)N3 и основания, например DBU. Схема 3 описывает эти реакции для случая, когда n=1, но способ может быть также применен для случая, когда n1. Случай, когда G=-(СН 2)nCOOH. Схема 4 Исходя из группы G=-CH2OH можно получить группу G=-CH2COOH путем окисления. Схема 4 описывает двойное окисление: 1-е окисление с помощью реагента Десс-Мартина (см. "Encyclopedia ofBoeckman R.K. Jr., et al., J.J. "The Dess-Martin Periodinane" Org. Synth. 2004, 10, 696-702), и последующее 2-е окисление по типу Pinnick в присутствии 2-метил-2-бутена (Pinnick H.W., Tetrahedron 1981, 37, 20912096). Схема 4 описывает эти реакции в случае использования исходного соединения, когда n=2, но этот способ применим также для n2. Случай, когда G=-(CH2)nNH2. Схема 5 Исходя из группы G=-CH2N3, получение которой описано на схеме 3, можно получить группуG=-CH2NH2 с помощью реакции восстановления, используя фосфин, такой как ТСЕР; см. об этой реакции Faucher A.-M. et al., Synthetic Comm 2003, 33, 3503-3511. Схема 5' Согласно варианту исходя из группы G=-CH2OH можно получить группу G=-CH2NH2 с помощью реакции Мицунобу, используя трифенилфосфин и DEAD. Об этой реакции см. Mitsunobu О., Synthesis 1981, 1-28; Hughes D.L., Org. Reactions 1992, 42, 335-656; Hughes D.L., Org. Prep. 1996, 28, 127-164. Схемы 5 и 5' описывают случай, когда n=1, но они могут быть применены также для n1. Случай, когда G=-(CH2)nNR12-CH2CCH. Исходя из группы G=-(CH2)nCl можно получить группу G=-(СН 2)n-NR12-CH2-CCH с помощью нуклеофильного замещения, используя соединение формулы NHR12-CH2-CCH (R12=H:пропаргиламин; Исходя из группы G=-(CH2)nCl можно получить группу G=-(CH2)nSH прямой функционализацией с помощью триметилсилилтиолата тетрабутиламмония, получаемого in situ из тетрабутиламмонийфторида- 10024627 и гексаметилдисилатиана согласно Hu J. et al., J. Org. Chem. 1999, 64, 4959-4961 (см. пример 8). Схема 6 описывает эту реакцию для случая, когда n=1, но способ может быть применен также для n1. В процессе этой реакции может образоваться промежуточный димер формулы Р 3 позволяет получить другие производные криптофицина согласно схеме 7. Стадия (i): реакция Виттига с использованием подходящего галогенида фосфония, например бромида, и сильного основания, например BuLi. Стадия (ii): сочетание Кумады с использованием подходящего реактива Гриньяра, например бромида алкоксимагния, защищенного в форме силилированного простого эфира, в присутствии палладиевого или никелевого катализатора (см., например, Organic Letters 2009, 11, 5686-5689 или Synthesis 2009,141, 2408-2412). Стадии (iii)-(v) описаны на схеме 2, а стадия (vi) описана на схеме 6. Бромид (4-бромбензил)трифенилфосфония является рыночным продуктом (CAS51044-13-4). Бромиды алкоксимагния, защищенные в форме силилированного простого эфира, могут быть получены из соответствующих бромспиртов путем защиты спиртовой группы соответствующим хлорсиланом с последующим получением магнийорганического соединения в присутствии магния, в апротонном полярном безводном растворителе, таком как ТГФ (см., например, Organic Letters 2005, 7, 183-186). Бромспирты, линейные или разветвленные, содержащие 1-6 атомов углерода, являются коммерчески доступными, такие как 3-бром-1-пропанол (CAS 627-18-9) или 1-бром-2-пропанол (CAS19686-73-8), или могут быть получены из соответствующих сложных бромэфиров или бромкетонов согласно способам,описанным в литературе. Хлорсиланом может быть, например, трет-бутилдиметилхлорсилан (CAS18162-48-6) или триизопропилхлорсилан (CAS13154-24-0). Случай, когда G=-(СН 2)n-малеимидо. Схема 8 В дополнение к схеме 1', которая описывает способ получения производных криптофицина, содержащего малеимидное звено, и исходя из группы G=-CH2OH можно получить группу осуществляя реакцию Мицунобу в присутствии трифенилфосфина и DEAD согласно Matuszak N. etal., J. Med. Chem. 2009, 52, 7410-7420. Схема 8 описывает эту реакцию для случая, когда n=1, но она применима и к случаю, когда n1. На схемах 1-8, представленных выше, линкер находится в пара-положении, однако эти схемы одинаково действительны для линкеров в орто- или мета-положениях. Аналогично этому, хотя эти схемы приведены для производного криптофицина, они применимы для получения других производных формулы (II), в частности D1-D8. В частности, в случае С-52 можно использовать следующие соединения, получение которых описано в Al-awar R.S., et al., J. Med. Chem. 2003, 46, 2985-3007 или в WO 9808505 С другой стороны, исходя из соединения 31b, у которого G=-СН 2 ОН, можно получить соединения,у которых G=-CH2Cl или -CH2N3:G=-CH2N3: конверсия -СН 2 ОН в -CH2N3 может быть осуществлена в полярном апротонном растворителе в присутствии дифенилфосфоразида и основания, такого как DBU, см. пример 19, соединение 60. С=-СН 2 малеимидо: конверсия -СН 2 ОН в -СН 2 малеимидо может быть осуществлена в полярном апротонном растворителе в присутствии малеимида, трифенилфосфина и DEAD. Сведения, изложенные в J. Med. Chem. 2003, 46, 2985-3007, могут быть применены для получения других производных криптофицина, содержащих другие заместители R6-R9. Получение предшественников линкера PL.PL может быть одним из следующих предшественников: получаемый согласно нижеописанной схеме Стадия (i): активация кислоты с помощью NHS; активацию проводят при КТ в присутствии сочетающего агента, такого как, например, гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида,растворенного в безводном апротонном растворителе, таком как DCM. Можно использовать условия примера 1 получения соединения 4. Стадия (ii): амидирование N-Boc-пиперидином; пептидное сочетание осуществляют в полярном апротонном растворителе при КТ в присутствии основания, которым может быть третичный амин, такой как TEA или DIPEA. Растворителем может быть DMF. Можно использовать условия примера 1 для получения соединения 5. Стадия (iii): реакция снятия защиты с амина при помощи раствора кислоты, например соляной кислоты (например, растворенной в диоксане). Можно использовать условия примера 1 получения соединения 6. Исходная кислота, например 4-метил-4-(метилдитио)пентановая кислота, может быть коммерчески доступна или получена из галогенсодержащей карбоновой кислоты путем последовательных обработок тиоацетатом калия и производным типа метантиосульфоната; см. также US 2719170. получаемый согласно нижеописанной схеме Стадия (i): восстановительное аминирование с помощью альдегида; реакцию осуществляют при КТ в безводном полярном апротонном растворителе, таком как THF, в две стадии: образование промежуточного комплекса в присутствии изопропоксида титана, затем восстановление in situ восстановительным агентом, таким как, например, цианборгицрид натрия. Можно использовать условия примера 5 получения соединения 17. Стадия (ii): реакиия снятия защиты с амина при помощи раствора кислоты, например соляной кислоты (например, растворенной в диоксане). Можно использовать условия примера 5 получения соединения 18. Исходный альдегид, например 2-метил-2-(метилдитио)пропаналь, может быть коммерчески доступен или получен окислением спирта, несущего дисульфидное звено, получаемого из галогенсодержащего спирта, защищенного должным образом (например, в форме силилированного простого эфира), в результате последовательных обработок тиоацетатом калия и производным типа метантиосульфоната.PL3 ZaS-ALK-NHR12, получаемый согласно нижеописанной схеме. В случае, когда R12=H. Стадия (i): образование оксима; описанный выше альдегид растворяют в полярном протонном растворителе, таком как этанол, затем обрабатывают гидрохлоридом О-метилгидроксиамина при нагревании с обратным холодильником в присутствии основания, такого как гидроксид натрия. Можно исполь- 12024627 зовать условия примера 3 получения соединения 11. Стадия (ii): восстановление оксима; оксим восстанавливают обработкой при нагревании с обратным холодильником раствором диметилсульфидборана в безводном полярном апротонном растворителе, таком как THF. Можно использовать условия примера 3 получения соединения 12. В случае, когда R12H Стадия (i): восстановительное аминирование с помощью альдегида; реакцию осуществляют при КТ в безводном полярном апротонном растворителе, таком как THF, в присутствии восстановительного агента, такого как, например, триацетоксиборгидрид натрия. получаемый согласно нижеописанной схеме Этот линкер получают аналогично способу, описанному для PL2. Стадия (i): восстановительное аминирование с помощью альдегида; реакцию осуществляют при КТ в безводном полярном апротонном растворителе, таком как THF, в две стадии: образование промежуточного комплекса в присутствии изопропоксида титана, затем восстановление in situ восстановительным агентом, таким как, например, цианборгидрид натрия. Можно использовать условия примера 5 получения соединения 17. Стадия (ii): реакция снятия защиты с амина с помощью раствора кислоты, например соляной кислоты (например, растворенной в диоксане). Можно использовать условия примера 5 получения соединения 18. получаемый согласно нижеописанной схеме Стадия (i): снятие защиты с амина; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как DCM, обработкой амина ди-трет-бутилдикарбонатом в присутствии основания, такого как, например, TEA. Стадия (ii): превращение спирта в бромид; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как THF, обработкой спиртовой функциональной группы при помощи CBr4 в присутствии фосфина, например трифенилфосфина; см. об этом Appel R. Angew. Chem. Int. Ed. Engl. 1975,14, 801-811 или Desmaris N., et al., Tetrahedron Letters 2003, 44(41), 7589-7591. Стадия (iii): замещение бромида тиоацетатом; реакцию осуществляют при КТ в безводном полярном апротонном растворителе, таком как DMF, используя в качестве нуклеофила тиоацетат калия. Стадия (iv): образование дисульфидной связи; реакцию осуществляют в полярном протонном безводном растворителе, таком как метанол, в присутствии основания, такого как, например, метанолят натрия, и реагента, содержащего пиридилдисульфидное звено. Согласно варианту стадия (v): активация спирта в форме мезилата; реакцию осуществляют в полярном апротонном безводном растворителе, таком как DCM, обработкой мезилхлоридом в присутствии основания, такого как, например, TEA; стадия (vi): образование свободного тиола; реакцию осуществляют при нагревании с обратным холодильником в полярном протонном растворителе, таком как смесь этанола/воды, в две стадии, осуществляемые последовательно: замещение мезилата на тиомочевину, затем гидролиз in situ соли изотиоурония путем добавления основания, такого как NaOH; стадия (vii): активация тиола в форме пиридилдисульфида; реакцию осуществляют при КТ в полярном протонном растворителе, таком как этанол, при обработке реагентом, содержащим пиридилдисульфидное звено, в присутствии кислоты, такой как уксусная кислота; стадия (viii): снятие защиты с амина при помощи раствора кислоты, например соляной кислоты(например, растворенной в диоксане); стадия (ix): активация амина в форме карбамоилхлорида; реакцию осуществляют в безводном полярном апротонном растворителе, таком как DCM, путем обработки дифосгеном в присутствии основания, такого как TEA.PL6 RbZb-OC-ALK-(ОСН 2 СН 2)1-ОН, получаемый согласно нижеописанной схеме. В случае, когда ALK=CH2CH2- 13024627 путь А путь В Стадия (i): снятие защиты с помощью раствора соляной кислоты (например, раствора в диоксане) или трифторуксусной кислоты. Стадия (ii): защита карбоновой кислоты в форме сложного аллилового эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как, DMF, в присутствии аллилбромида и основания, такого как карбонат калия. Стадия (iii): элонгация ПЭГ цепи; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, путем обработки ненасыщенной кислоты, защищенной в форме сложного эфира, алкоголятом, генерируемым под действием натрия в каталитическом количестве. В случае, когда ALKСН 2 СН 2. Стадия (iv): элонгация ПЭГ цепи; реакцию осуществляют в безводном полярном апротонном растворителе, таком как THF или DMF, путем обработки галогенированного сложного эфира алкоголятом ПЭГ диола, монозащищенного в форме простого эфира тетрагидропирана (ТНР). Получение этого типа монозащищенного ПЭГ диола описано в литературе, см., например, Richard A. et al., Chem. Eur. J. 2005,11, 7315-7321 или Sakellariou E.G., et al., Tetrahedron 2003, 59, 9083-9090. ПЭГ спирты, содержащие кислотную функциональную группу, защищенную в форме сложного трет-бутилового эфира, коммерчески доступны (такой как трет-бутил-12-гидрокси-4,7,10 триоксадодеканоат) или их получают из трет-бутилакрилата и ПЭГ диола. Исходные ПЭГ диолы коммерчески доступны для i=3-12.PL7 RbZb-OC-ALK-(OCH2CH2)1-NHR12, получаемый согласно нижеописанным схемам. В случае, когда ALK=CH2CH2. Случай, когда R12=H. Случай, когда R12H Стадия (i): защита карбоновой кислоты в форме сложного аллилового эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как, DCM, в присутствии аллилового спирта,сочетающего агента, такого как EDCl, и основания, такого как DMAP. Можно использовать условия примера 14 получения соединения 42. Стадия (ii): снятие защиты с помощью раствора соляной кислоты (например, раствора в диоксане) или трифторуксусной кислоты. Можно использовать условия примера 14 получения соединения 43.- 14024627 Стадия (iii): алкилирование атома азота; реакцию осуществляют в безводном полярном апротонном растворителе, таком как THF, путем обработки основанием, таким как NaH, в присутствии реагента, несущего уходящую группу (нуклеофуг), такого как алкилгалогенид. Можно использовать условия примера 15 получения соединения 46. Стадия (iv): элонгация ПЭГ цепи; реакцию осуществляют в безводном полярном апротонном растворителе, таком как THF или DMF, путем обработки галогенированного сложного эфира алкоголятом бензофенонимин-ПЭГ-спирта, генерируемого под действием NaH или нафталенида калия, как описано вWO 2007/127440; Стадия (v): омыление сложного эфира; реакцию осуществляют путем взаимодействия сложного эфира с гидроксидом лития в присутствии воды. Стадия (vi): защита амина; реакцию осуществляют при КТ в полярном апротонном растворителе,таком как DCM, путем обработки амина ди-трет-бутилдикарбонатом в присутствии основания, такого как, например, TEA. Амин-ПЭГ-кислоты являются коммерчески доступными при i=3, 5, 6, 10 или могут быть получены из трет-бутилакрилата и соответствующего амин-ПЭГ-спирта. Амин-ПЭГ-спирты являются коммерчески доступными, например, при i=3, 4, 7, 8 или могут быть получены из ПЭГ диолов, коммерчески доступных при i=3-12, согласно процедуре, описанной в US 7230101. Защита аминофункции бензофеноном может быть осуществлена в процессе азеотропной дегидратации в присутствии кислоты Льюиса, такой как эфират BF3. Стадия (i): снятие защиты с исходного соединения с помощью раствора соляной кислоты (например, раствора в диоксане) или трифторуксусной кислоты. Можно использовать условия примера 16 получения соединения 50. Стадия (ii): защита карбоксильной функциональной группы кислоты в форме сложного аллилового эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как DMF, в присутствии аллилбромида и основания, такого как карбонат калия. Можно использовать условия примера 16 получения соединения 51. Стадия (iii): активация спирта в форме мезилата; реакцию осуществляют в безводном полярном апротонном растворителе, таком как DCM, обработкой мезилхлоридом в присутствии основания, такого как TEA. Стадия (iv): реакция между мезилатной и аминной функиональной группой соединения(алкилирование); реакцию осуществляют при КТ в безводном полярном апротонном растворителе, таком как DCM, в присутствии основания, такого как TEA. Можно использовать условия примера 16 получения соединения 52. В случае, когда ALKСН 2 СН 2. Стадия (v): элонгация ПЭГ цепи; реакцию осуществляют в безводном полярном апротонном растворителе, таком как THF или DMF, путем обработки галогенированного сложного эфира алкоголятом ПЭГ диола, монозащищенного в форме простого эфира тетрагидропирана (ТНР). Получение этого типа монозащищенного ПЭГ диола описано в литературе, см., например, Richard A. et al., Chem. Eur. J. 2005,11, 7315-7321 или Sakellariou E.G., et al., Tetrahedron 2003, 59, 9083-9090. ПЭГ спирты, содержащие кислотную функциональную группу, защищенную в форме сложного трет-бутилового эфира, коммерчески доступны (такой как трет-бутил-12-гидрокси-4,7,10 триоксадодеканоат) или их получают из трет-бутилакрилата и ПЭГ диола. Исходные ПЭГ диолы коммерчески доступны при i=3-12. получаемый согласно нижеописанной схеме. Стадия (i): алкилирование амина; реакцию осуществляют в безводном полярном апротонном растворителе, таком как ацетонитрил, с использованием аллилгалогеналкилкарбоксилата, такого как аллилбромацетат, в присутствии основания, такого как, например, TEA. Можно использовать условия примера 13 получения соединения 38. Стадия (ii): снятие защиты с амина с помощью раствора кислоты, например соляной кислоты (например, растворенной в диоксане). Можно использовать условия примера 13 получения соединения 39. Аллилгалогеналкилкарбоксилат может быть получен из аллилового спирта и соответствующего галогенацилгалогенида и может быть коммерчески доступным, когда ALK=-(CH2)1-6- (такой как бромацетилбромид или 4-бутаноилхлорид).PL10 получаемый согласно нижеописанным схемам. В случае, когда ALK=CH2CH2. Стадия (i): раскрытие циклического ангидрида; реакцию осуществляют при КТ в безводном полярном апротонном растворителе, таком как DCM, в присутствии основания, такого как TEA. Стадия (ii): защита карбоновой кислоты в форме сложного аллилового эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как DCM, в присутствии аллилового спирта,сочетающего агента, такого как EDCl, и основания, такого как DMAP. Стадия (iii): снятие защиты с помощью раствора соляной кислоты (например, раствора в диоксане). Стадия (iv): пептидное сочетание; реакцию между карбоновой кислотой и амином осуществляют при КТ в полярном апротонном растворителе, таком как DCM, в присутствии сочетающего агента, такого как система DIC/HOBt. Стадия (v): омыление сложного метилового эфира; реакцию осуществляют при КТ в смеси полярных растворителей, такой как смесь THF/вода, в присутствии гидроксида лития. Двухосновные кислоты, монозащищенные в форме сложного метилового эфира, являются коммерчески доступными при ALK=-(CH2)1-6- (такого как сложный монометиловый эфир 1,6-гександиовой кислоты).PL11 получаемый согласно нижеописанным схемам. В случае, когда ALK=CH2CH2. Случай, когда R12=H. Стадия (i): образование амида и активация кислоты; осуществляют последовательно две стадии в полярном апротонном растворителе, таком как DCM: реакцию между аминофункцией иN-гидроксисукцинимидил-галогенацетатом, затем введение in situ сочетающего агента, такого как DIC. Можно использовать условия примера 17 получения соединения 56. Стадия (ii): защита карбоновой кислоты в форме сложного метилового эфира и амина в форме трифторацетамида; реакцию осуществляют в две последовательные стадии в полярном апротонном растворителе, таком как, DCM: защита кислоты путем обработки триметилсилилдиазометаном в присутствии метанола, затем защита амина добавлением трифторуксусного ангидрида и основания, такого как TEA. Стадия (iii): алкилирование амина и омыление сложного эфира; реакцию осуществляют в две последовательные стадии в среде полярного апротонного безводного растворителя, такого как THF: алкилирование амина обработкой основанием, таким как NaH, в присутствии реагента, несущего нуклеофуг,такого как алкилгалогенид R12Hal, затем введение гидроксида лития и воды. Стадия (i): продолжение стадии (iii), повторяют реакции стадии (i), описанные для случая R12=H. В случае, когда ALKСН 2 СН 2. Случай, когда R12=H. Стадия (iv): элонгация ПЭГ цепи; реакцию осуществляют в безводном полярном апротонном растворителе, таком как THF или DMF, путем обработки галогенированного сложного эфира алкоголятом бензофенонимин-ПЭГ-спирта, генерируемым под действием NaH или нафталенида калия (см. WO 2007/127440). Стадия (v): селективное расщепление имина путем гидрирования в присутствии палладия на угле(см. Wessjohann, L. et al., Synthesis 1989, 5, 359-63). Стадия (vi): защита амина введением трифторуксусного ангидрида и основания, такого как TEA. Амин-ПЭГ-кислоты являются коммерчески доступными при i=3, 5, 6, 10, или могут быть получены из трет-бутилакрилата и соответствующего амин-ПЭГ-спирта. Амин-ПЭГ-спирты являются коммерчески доступными, например, при i=3, 4, 7, 8, или могут быть получены из ПЭГ диолов, коммерчески доступных при i=3-12, согласно процедуре, описанной в US 7230101. Защита аминофункции бензофеноном может быть осуществлена в процессе азеотропной дегидратации в присутствии кислоты Льюиса, такой как эфират BF3.PL12 где Z=Br или I, получаемый согласно нижеописанным схемам. В случае, когда ALK=CH2CH2 путь А Стадия (i): активация спирта в форме мезилата; реакцию осуществляют в безводном полярном апротонном растворителе, таком как DCM, путем обработки мезилхлоридом в присутствии основания, такого как TEA. Стадия (ii): обмен мезилат/галоген; реакцию осуществляют при нагревании с обратным холодильником в полярном апротонном растворителе, таком как ацетон, с использованием галогенида натрия,такого как иодид натрия. Стадия (iii): снятие защиты с помощью раствора соляной кислоты (например, раствора в диоксане) или трифторуксусной кислоты. Стадия (iv): активация кислоты; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как DCM, путем обработки с помощью NHS в присутствии сочетающего агента, такого какDCC. Стадия (v): элонгация ПЭГ цепи; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, путем обработки ненасыщенной кислоты, защищенной в форме сложного эфира, алкоголятом, генерируемым под действием натрия в каталитическом количестве. Стадия (vi): элонгация ПЭГ цепи; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF или DMF, путем обработки галогенированного сложного эфира алкоголятом ПЭГ диола, монозащищенного в форме простого эфира тетрагидропирана (ТНР). Получение этого типа монозащищенного ПЭГ диола описано в литературе, см., например, Richard A. et al., Chem. Eur. J. 2005,11, 7315-7321 или Sakellariou E.G., et al., Tetrahedron 2003, 59, 9083-9090. Образующееся промежуточное соединение селективно гидролизуют при рН 5 до сложного гидроксиэфира. ПЭГ спирты, содержащие кислотную функциональную группу, защищенную в форме сложного трет-бутилового эфира, коммерчески доступны (такие как трет-бутил-12-гидрокси-4,7,10 триоксадодеканоат) или их получают из трет-бутилакрилата и ПЭГ диола. Исходные ПЭГ диолы коммерчески доступны, когда i=3-12.PL13 RbZb-CO-ALK-(OCH2CH2)i-SH, получаемый согласно нижеописанным схемам. В случае, когда ALK=CH2CH2 путь А Стадия (i): снятие защиты с помощью раствора соляной кислоты (например, раствора в диоксане) или трифторуксусной кислоты. В последнем случае может образоваться трифторацетат гидрокси функциональной группы. Эта соль расщепляется на следующей стадии (ii). Стадия (ii): защита карбоновой кислоты в форме сложного метилового эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как метанол, путем обработки триметилсилилдиазометаном. Стадия (iii): активация спирта в форме мезилата; реакцию осуществляют в полярном апротонном безводном растворителе, таком как DCM, путем обработки мезилхлоридом в присутствии основания,такого как TEA. Стадия (iv): образование свободного тиола и омыление метилового сложного эфира; реакцию осуществляют при нагревании с обратным холодильником в полярном протонном растворителе, таком как смесь этанол/вода, в две последовательные стадии: замещение мезилата тиомочевиной, затем гидролиз insitu соли изотиоурония введением основания, такого как гидроксид натрия.- 18024627 Стадия (v): элонгация ПЭГ цепи; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, путем обработки ненасыщенной кислоты, защищенной в форме сложного эфира, алкоголятом, генерируемым под действием натрия в каталитическом количестве. Стадия (vi): элонгация ПЭГ цепи; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF или DMF, путем обработки галогенировакного сложного эфира алкоголятом ПЭГ диола, монозащищенного в форме простого эфира тетрагидропирана (ТНР). Получение этого типа монозащищенного ПЭГ диола описано в литературе, см., например, Richard A. et al., Chem. Eur. J. 2005,11, 7315-7321 или Sakellariou E.G., et al., Tetrahedron 2003, 59, 9083-9090. Линкер, у которого n=8 (3-[2-меркаптоэтоксигепта-(этиленокси)]пропионовая кислота), коммерчески доступен. ПЭГ спирты, содержащие кислотную функциональную группу, защищенную в форме сложного трет-бутилового эфира, коммерчески доступны, (такие как трет-бутил-12-гидрокси-4,7,10 триоксадодеканоат), или их получают из трет-бутилакрилата и ПЭГ диола. Исходные ПЭГ диолы коммерчески доступны в случае i=3-12.PL14 получаемый согласно нижеописанной схеме. В случае, когда ALK=CH2CH2. Стадия (i): элонгация ПЭГ цепи; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, путем обработки ненасыщенной кислоты, защищенной в форме сложного эфира,алкоголятом, образующимся под действием натрия в каталитическом количестве. Стадия (ii): снятие защиты с помощью раствора соляной кислоты (например, раствора в диоксане) или трифторуксусной кислоты. В последнем случае, может образоваться трифторацетат гидроксильной функциональной группы, необязательно находящейся в структуре соединения. Этот трифторацетат расщепляется на следующей стадии (iii). Стадия (iii): защита карбоновой кислоты в форме сложного метилового эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как метанол, путем обработки триметилсилилдиазометаном. Стадия (iv): омыление метилового сложного эфира; реакцию осуществляют при КТ в смеси полярных растворителей, такой как смесь THF/вода, в присутствии гидроксида лития. Стадия (v): защита карбоновой кислоты в форме сложного аллилового эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как DCM, в присутствии аллилового спирта,сочетающего агента, такого как EDCl, и основания, такого как DMAP. Стадия (vi): элонгация ПЭГ цепи; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF или DMF, путем обработки галогенированного сложного эфира алкоголятом ПЭГ диола, монозащищенного в форме простого тетрагидропиранового эфира (ТНР). Получение этого типа монозащищенного ПЭГ-диола описано в литературе, см., например, Richard A. et al., Chem. Eur. J. 2005, 11, 7315-7321 или Sakellariou E.G., et al., Tetrahedron 2003, 59, 9083-9090. Исходные ПЭГ диолы коммерчески доступны, когда i=3-12. получаемый согласно нижеописанным схемам. Стадия (i): нуклеофильное замещение; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, в присутствии основания, такого как NaH, и алкинилгалогенида, такого как пропаргилбромид или 4-бром-1-бутин. Можно использовать условия примера 20 получения соединения 63. Стадия (ii): снятие защиты с помощью раствора соляной кислоты (например, раствора в диоксане) или трифторуксусной кислоты. Можно использовать условия примера 20 получения соединения 65. Стадия (iii): активация карбоновой кислоты в форме сложного NHS-эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как DCM, путем обработки с помощью NHS в присутствии сочетающего агента, такого как DCC на носителе. Стадия (iv): элонгация ПЭГ цепи; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, путем обработки ненасыщенной кислоты, защищенной в форме сложного эфира, алкоголятом, генерируемым под действием натрия в каталитическом количестве. Можно использовать условия примера 20 получения соединения 64. Стадия (v): элонгация ПЭГ цепи; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF или DMF, путем обработки галогенированного сложного эфира алкоголятом ПЭГ диола, монозащищенного в форме простого эфира тетрагидропирана (ТНР). Получение этого типа монозащищенного ПЭГ диола описано в литературе, см., например, Richard A. et al., Chem. Eur. J. 2005,11, 7315-7321 или Sakellariou E.G., et al., Tetrahedron 2003, 59, 9083-9090. ПЭГ спирты, содержащие кислотную функциональную группу, защищенную в форме сложного трет-бутилового эфира, коммерчески доступны, (такой как трет-бутил-12-гидрокси-4,7,10 триоксадодеканоат), или их получают из трет-бутилакрилата и ПЭГ диола. Исходные ПЭГ диолы коммерчески доступны, когда i=3-12. получаемый согласно нижеописанным схемам. Стадия (i): элонгация ПЭГ цепи; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, путем обработки ненасыщенной кислоты, защищенной в форме сложного эфира,алкоголятом, генерируемым под действием натрия в каталитическом количестве. Стадия (ii): снятие защиты с помощью раствора соляной кислоты (например, раствора в диоксане) или трифторуксусной кислоты. Стадия (iii): активация карбоновой кислоты в форме сложного NHS-эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как DCM, путем обработки с помощью NHS в присутствии сочетающего агента, такого как DCC на носителе. Стадия (iv): элонгация цепи ПЭГ-гидроксиазида; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF или DMF, путем обработки галогенированного сложного эфира алкоголятом ПЭГ-гидроксиазида. Азид-ПЭГ-спирты являются коммерчески доступными или могут быть получены из соответствующих ПЭГ диолов, коммерчески доступных, когда i=3-12. получаемый согласно нижеописанной схеме. Стадия (i): активация карбоновой кислоты в форме сложного NHS-эфира; реакцию осуществляют- 20024627 при КТ в полярном апротонном растворителе, таком как DCM, путем обработки с помощью NHS в присутствии сочетающего агента, такого как DCC на носителе. Кислоты, имеющие ацетиленненасыщенную группу, являются коммерчески доступными при получаемый согласно нижеописанной схеме. Стадия (i): нуклеофильное замещение галогенида азидом; реакцию осуществляют в полярном апротонном растворителе, таком как ацетон, в присутствии азида натрия. Стадия (ii): омыление метилового сложного эфира; реакцию осуществляют при КТ в смеси полярных растворителей, такой как смесь THF/вода в присутствии гидроксида лития. Стадия (iii): активация карбоновой кислоты в форме сложного NHS-эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как DCM, путем обработки с помощью NHS в присутствии сочетающего агента, такого как DCC на носителе. Сложные метиловые эфиры, несущие галогеналкильное звено, являются коммерчески доступными,когда ALK=-(CH2)m, где m=1-6 (такие как метилбромацетат).PL19 получаемый согласно нижеописанным схемам. В случае, когда ALK=CH2CH2 путь А Стадия (i): нуклеофильное замещение; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, в присутствии основания, такого как NaH, и алкенилгалогенида, такого как аллилбромид или 4-бром-1-бутен. Стадия (ii): снятие защиты с помощью раствора соляной кислоты (например, раствора в диоксане) или трифторуксусной кислоты. Стадия (iii): активация карбоновой кислоты в форме сложного NHS-эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как DCM, путем обработки с помощью NHS в присутствии сочетающего агента, такого как DCC на носителе. Стадия (iv): элонгация ПЭГ цепи; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, путем обработки ненасыщенной кислоты, защищенной в форме сложного эфира, алкоголятом, генерируемым под действием натрия в каталитическом количестве. Стадия (v): элонгация ПЭГ цепи; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF или DMF, путем обработки галогенированного сложного эфира алкоголятом ПЭГ диола, монозащищенного в форме простого эфира тетрагидропирана (ТНР). Получение этого типа монозащищенного ПЭГ диола описано в литературе, см., например, Richard A. et al., Chem. Eur. J. 2005,11, 7315-7321 или Sakellariou E.G., et al., Tetrahedron 2003, 59, 9083-9090. ПЭГ спирты, содержащие кислотную функциональную группу, защищенную в форме сложного трет-бутилового эфира, коммерчески доступны (такие как трет-бутил-12-гидрокси-4,7,10 триоксадодеканоат), или их получают из трет-бутилакрилата и ПЭГ диола. Исходные ПЭГ диолы коммерчески доступны, когда i=3-12. получаемый согласно нижеописанной схеме. Стадия (i): активация карбоновой кислоты в форме сложного NHS-эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как DCM, путем обработки с помощью NHS в при- 21024627 сутствии сочетающего агента, такого как DCC на носителе. Кислоты, несущие этиленненасыщенную группу, являются коммерчески доступными приPL21 ZaS-ALK-CH2-NR12-(CH2CH2O)1-CH2CH2-NR'12, получаемый согласно нижеописанным схемам. В случае, когда R12 и R'12=H Стадия (i): активация спирта в форме тозилата; реакцию осуществляют в полярном апротонном растворителе, таком как DCM, обработкой тозилхлоридом в присутствии оксида серебра и иодида калия. Можно использовать условия примера 6 получения соединения 23. Стадия (ii): нуклеофильное замещение тозилата; реакцию осуществляют в полярном апротонном растворителе, таком как ацетонитрил, обработкой азидом натрия. Можно использовать условия примера 6 получения соединения 24. Стадия (iii): реакция азидирования; реакцию осуществляют в полярном растворителе, таком как смесь THF/воды, в присутствии трифенилфосфина. Можно использовать условия примера 6 получения соединения 26. Стадия (iv): восстановительное аминирование с использованием альдегида; реакцию осуществляют при КТ в полярном апротонном безводном растворителе, таком как DCM, в присутствии восстановительного агента, такого как триацетоксиборгидрид натрия, и, если необходимо, уксусной кислоты в качестве катализатора. Можно использовать условия примера 6 получения соединения 27. Стадия (V): снятие защиты с помощью раствора соляной кислоты (например, раствора в диоксане) или трифторуксусной кислоты. Можно использовать условия примера 6 получения соединения 29. Стадия (vi): защита функциональной группы в форме NHBoc; реакцию осуществляют в полярном апротонном растворителе, таком как THF или DMF, обработкой 1 эквивалентом основания, такого как гидрид натрия, с последующей обработкой бензилгалогенидом, таким как бензилхлорид. Стадия (vii): отщепление бензильной группы и восстановление функциональной азидогруппы; реакцию осуществляют в протонном растворителе, таком как метанол, водородом в присутствии катализатора, такого как гидроксид палладия. Стадия (viii): алкилирование амина; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, обработкой основанием, таким как гидрид натрия, в присутствии реагента,несущего нуклеофуг, такого как алкилгалогенид. Можно использовать условия примера 6 получения соединения 25. Амин-ПЭГ-спирты, незащищенные или защищенные группой Boc на аминофункции, являются коммерчески доступными, (такие как N-Вос-аминоэтоксиэтоксиэтанол или 1-амино-3,6,9 триоксаундеканил-11-ол), или могут быть получены из ПЭГ диолов, коммерчески доступных, когда i=312, согласно процедуре, описанной в WO 7230101. Альдегид ZaSS-ALK-CHO, например 2-метил-2(метилтио)пропаналь, является рыночным продуктом, или может быть получен окислением спирта, несущего дисульфидное звено, полученного из галогенированного спирта, защищенного соответствующим- 22024627 образом (например, в форме силилированного простого эфира), путем последовательных обработок сначала тиоацетатом калия, затем производным типа метантиосульфоната. получаемый согласно нижеописанным схемам. Стадия (i): активация спирта в форме тозилата; реакцию осуществляют в полярном апротонном растворителе, таком как DCM, обработкой тозилхлоридом в присутствии оксида серебра и иодида калия. Можно использовать условия примера 6 получения соединения 23. Стадия (ii): нуклеофильное замещение тозилата; реакцию осуществляют в полярном апротонном растворителе, таком как ацетонитрил, обработкой азидом натрия. Можно использовать условия примера 6 получения соединения 24. Стадия (iii): восстановление азида; реакцию осуществляют в полярном растворителе, таком как смесь THF/воды, в присутствии трифенилфосфина. Можно использовать условия примера 6 получения соединения 26. Стадия (iv): пептидное сочетание; реакцию осуществляют в полярном апротонном растворителе,таком как диметилформамид, в присутствии сочетающих агентов, таких как системаN,N'-диизопропилкарбодиимид/1-гидроксибензотриазол, и основания, такого как TEA. Стадия (v): снятие защиты с помощью раствора соляной кислоты (например, раствора в диоксане) или трифторуксусной кислоты. Можно использовать условия примера 7 получения соединения 32. Стадия (vi): защита функциональной группы в форме NHBoc; реакцию осуществляют в полярном апротонном растворителе, таком как THF или DMF, обработкой 1 экв. основания, такого как гидрид натрия, с последующей обработкой бензилгалогенидом, таким как бензилхлорид. Стадия (vii): отщепление бензильной группы и восстановление функциональной азидогруппы; реакцию осуществляют в протонном растворителе, таком как метанол, водородом в присутствии катализатора, такого как гидроксид палладия. Стадия (viii): алкилирование амина путем восстановительного аминирования с использованием альдегида; реакцию осуществляют при КТ в полярном апротонном безводном растворителе, таком какDCM, в присутствии восстановительного агента, такого как триацетоксиборгидриц натрия, и, если необходимо, уксусной кислоты в качестве катализатора. Стадия (ix): алкилирование группы NHBoc; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, обработкой основанием, таким как гидрид натрия, в присутствии- 23024627 реагента, несущего нуклеофуг, такого как алкилгалогенид. Можно использовать условия примера 6 получения соединения 25. Амин-ПЭГ-спирты, незащищенные или защищенные группой Boc на аминофункции, являются коммерчески доступными (такие как N-Вос-аминоэтоксиэтоксиэтанол или 1-амино-3,6,9 триоксаундеканил-11-ол) или могут быть получены из ПЭГ диолов, коммерчески доступных, когда i=312, согласно процедуре, описанной в WO 7230101. Карбоновая кислота ZaS-ALK-CO2H, например 4 метил-4-(метилдитио)пентановая кислота, может быть рыночным продуктом, или может быть получена из галогенсодержащей карбоновой кислоты последовательными обработками сначала тиоацетатом калия, затем производным типа метантиосульфоната.Pb23 ZaS-(CH2CH2O)1-CH2CH2-NHR12, получаемый согласно нижеописанным схемам. В случае, когда R12=H. Стадия (i): активация спирта в форме мезилата; реакцию осуществляют в полярном апротонном безводном растворителе, таком как DCM, обработкой мезилхлоридом в присутствии основания, такого как TEA. Стадия (ii): образование свободного тиола; реакцию осуществляют при нагревании с обратным холодильником в полярном протонном растворителе, таком как смесь этанола/воды в две последовательные стадии: замещение мезилата на тиомочевину, затем гидролиз in situ соли изотиоурония введением основания, такого как гидроксид натрия. Стадия (iii): защита тиола; реакцию осуществляют в смеси полярных растворителей, такой как смесь этанола/воды, с использованием реагента, содержащего метантиосульфонатную функциональную группу, такого как метилметантиосульфонат, в присутствии основания, такого как карбонат натрия. Стадия (iv): снятие защиты с помощью раствора соляной кислоты (например, раствора в диоксане) или трифторуксусной кислоты. Стадия (v): алкилирование амина; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, путем обработки основанием, таким как гидрид натрия, в присутствии реагента, несущего нуклеофуг, такого как алкилгалогенид. Амин-ПЭГ-спирты, незащищенные или защищенные группой Boc на аминофункции, являются коммерчески доступными (такие как N-Вос-аминоэтоксиэтоксиэтанол или 1-амино-3,6,9 триоксаундеканил-11-ол) или могут быть получены из ПЭГ диолов, коммерчески доступных, когда i=312, согласно процедуре, описанной в WO 7230101. получаемый согласно нижеописанной схеме. Стадия (i): активация Fmoc-L-валина в форме сложного NHS-эфира; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, обработкой с помощью NHS в присутствии сочетающего агента, такого как DCC. Стадия (ii): пептидное сочетание между Fmoc-L-валин-NHS и L-цитруллином; реакцию осуществляют в полярном растворителе, таком как смесь диметоксиэтана/ТНР/воды, в присутствии основания,такого как бикарбонат натрия. Стадия (iii): пептидное сочетание с 4-аминобензиловым спиртом; реакцию осуществляют в полярном растворителе, таком как смесь DCM/метанола, в присутствии сочетающего агента, такого как EEDQ. Стадия (iv): снятие защиты с Fmoc-амина; реакцию осуществляют в полярном растворителе, таком как смесь DCM/метанола, в присутствии основания, такого как диэтиламин. Стадия (v): активация карбоновой кислоты в форме сложного NHS-эфира; реакцию осуществляют в полярном апротонном растворителе, таком как DCM, обработкой с помощью NHS в присутствии соче- 24024627 тающего агента, такого как гидрохлорид EDCl. Стадия (vi): пептидное сочетание между дипептидом и сложным NHS-эфиром; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как смесь DCM/ацетонитрила. Дикислоты, монозащищенные в форме сложного аллилового эфира, являются коммерчески доступными, когда n=2 (моноаллилсукцинат) или могут быть получены переэтерификацией метиловых или трет-бутиловых сложных моноэфиров, которые являются коммерчески доступными, когда n=2-6. получаемый согласно нижеописанной схеме. Стадия (i): активация Fmoc-L-валина в форме сложного NHS-эфира; реакцию осуществляют в полярном апротонном безводном растворителе, таком как THF, обработкой с помощью NHS в присутствии сочетающего агента, такого как DCC. Стадия (ii): пептидное сочетание между Fmoc-L-валин-NHS и L-цитруллином; реакцию осуществляют в полярном растворителе, таком как смесь диметоксиэтана/ТНР/воды, в присутствии основания,такого как бикарбонат натрия. Стадия (iii): пептидное сочетание с 4-аминобензиловым спиртом; реакцию осуществляют в полярном растворителе, таком как смесь DCM/метанола, в присутствии сочетающего агента, такого как EEDQ. Стадия (iv): снятие защиты с Fmoc-амина; реакцию осуществляют в полярном растворителе, таком как смесь DCM/метанола, в присутствии основания, такого как диэтиламин. Стадия (v): активация карбоновой кислоты в форме сложного NHS-эфира; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как DCM, обработкой с помощью NHS в присутствии сочетающего агента, такого как DCC на носителе. Стадия (vi): пептидное сочетание между дипептидом и сложным NHS-эфиром; реакцию осуществляют при КТ в полярном апротонном растворителе, таком как смесь DCM/ацетонитрила. Двухосновные ПЭГ кислоты, монозащищенные в аллиловой форме, получают согласно описанию получения линкера L14. йодацетат 2,5-диоксопирролидин-1-ила является рыночным продуктом и имеет номер Таблица II Более подробно см. раздел "Примеры реакций", изложенный выше. Примеры даны на конкретное производное криптофицина, но может быть использовано любое производное криптофицина формулы (II), в частности D1-D8. 3 соответствует расщепляемой дисульфидной структуре линкера, выбираемой из линкеров L1-L4 или L21-L23. 4R12 или R'12: Н или (C1-C6)алкильная группа, например метил; n: целое число от 1 до 6; i: целое число от 1 до 20, более конкретно от 1 до 10, более конкретно от 1 до 8 или от 1 до 6, еще более конкретно от 2 до 5. i может принимать любое значение из указанных диапазонов, в частности 2, 3, 4 или 5. 5 В табл. II L находится в пара-положении, однако можно получить аналогичным способом соединения с L в орто- и мета-положениях. Способ получения конъюгата. Конъюгат получают способом, заключающимся в том, что:(i) вводят в контактирование и осуществляют взаимодействие между водным раствором моноклонального антитела, необязательно забуференного, и раствором производного криптофицина формулы(II);(ii) необязательно, отделяют конъюгат, образовавшийся на стадии (i), от непрореагировавших производного криптофицина и/или моноклонального антитела, и/или от агрегатов, которые могут сформироваться. Более конкретно на стадии (ii) отделяют конъюгат, полученный на стадии (i), только от непрореагировавшего производного криптофицина и возможно образовавшихся агрегатов, и оставляют в растворе моноклональное антитело, который возможно не был прореагирован. Введение в контакт необходимо для реализации взаимодействия химических групп GCR1 и GCR2,чтобы связать таким путем производное криптофицина с моноклональным антителом и образовать ковалентную связь; предпочтительно когда GCR1 означает -SZa: модифицируют моноклональное антитело с помощью модифицирующего агента таким образом, чтобы ввести на поверхность моноклонального антитела подходящие группыGCR2, в частности группы, описанные во 2-й колонке табл. I: химические дисульфидные группы, в случае, когда GCR1 означает -SH; химические тиольные группы, в случае, когда GCR1 означает -SZa, где ZaH; химические малеимидо- или иодацетамидогруппы, в случае, когда GCR1 означает -SH. В случае антител (MAb) в 4-й колонке табл. I приведены формулы конъюгатов: когда GCR1 означает -C(=O)-ZbRb: реакция протекает по аминофункциям агента клеточного связывания, в частности, по группам -амино, которые несут боковые цепи остатков лизина (Lys) антитела. В случае антитела (MAb) получают конъюгат формулы: MAb-[NH-C(=O)-L-Crypto]d, где L=такой фраг 2- 27024627 мент линкера L, содержащего GCR1=-C(=O)-ZbRb, чтобы L=-LC(=O)-ZbRb; в присутствии производного криптофицина формулы (III), где G=-(CH2)nY, моноклональное антитело содержит -SH-группы, если Y=-Cl, группы -ССН, если Y=-N3 или карбоксильные кислотные группы, если Y=-OH или -NH2; в присутствии производного криптофицина, содержащего химическую реакционноспособную группу GCR1 типа малеимидо или йодацетамидо, агент клеточного связывания включает химические тиольные группы. Под термином "агрегаты" понимают ассоциации, которые могут формироваться между двумя или более агентами клеточного связывания, при этом агенты клеточного связывания могут быть модифицированы или нет методом конъюгирования. Агрегаты способны формироваться под действием большого числа параметров, таких как высокая концентрация агента клеточного связывания в растворе, рН раствора, высокие усилия сдвига, число привитых димеров и их гидрофобный характер, температура (см. ссылки, цитированные в предисловии в J. Membrane Sci. 2008, 318, 311-316), однако влияние некоторых из них точно не выяснено до сих пор. В случае работы с белками или антителами, можно сослаться наAAPS Journal, "Protein Aggregation and Bioprocessing" 2006, 8(3), E572-E579. Содержание агрегатов может быть определено при помощи известных методов, таких как SEC (см. в этой связи Analytical Biochemistry 1993, 212(2), 469-480). Водный раствор моноклонального антитела может быть забуферирован посредством, например, таких буферов, как, например, калий-фосфатный буфер или буфер, содержащий N-2 гидроксиэтилпиперазин-N'-2-этансульфоновую кислоту (буфер HEPES), или смесь буферов, такая, как буфер А, описанный ниже. Буфер зависит от природы моноклонального антитела. Производное криптофицина растворяют в полярном органическом растворителе, например в DMSO или DMA. Реакция протекает при температуре главным образом в интервале от 20 до 40 С. Продолжительность реакции варьируется от 1 до 24 ч. За реакцией между антителом и производным криптофицина можно следить при помощи SEC-хроматографии с рефрактометрическим и/или ультрафиолетовым детектором для того, чтобы определять ход реакции. Если степень замещения недостаточна, то можно продлить время реакции и/или добавить производное криптофицина. Можно сослаться на общий метод, раскрытый в части описания примеров осуществления, чтобы узнать подробности относительно конкретных условий реакции. Частные варианты осуществления описаны в примерах 9, 10, 11, 25, 26 или 27. Специалист располагает различными хроматографическими методами для осуществления разделения на стадии (ii): конъюгат может быть очищен, например, методом эксклюзионной стерической хроматографии (SEC), адсорбционной хроматографии (такой как ионообменная хроматография, IEC), хроматографии гидрофобного взаимодействия (HIC), аффинной хроматографии, хроматографии на смешанных носителях, таких как керамический гидроксиапатит, или ВЭЖХ. Может быть также использована очистка методом диализа или диафильтрации. После стадии (i) или (ii) раствор конъюгата можно направить на стадию (iii) ультрафильтрации и/или диафильтрации. После выхода из этих стадий получают таким путем конъюгат в виде водного раствора. Антитела. Антитела (см. о них Janeway et al., "Imraunobiology", 5-е изд., 2001, Garland Pubishing, Нью-Йорк) могут быть выбраны из тех, которые описаны, в частности, в WO 04043344, WO 08010101, WO 08047242,WO 05009369 (против СА 6) или WO 2010014812. Антитело необязательно может быть модифицировано посредством модифицирующего агента для того, чтобы способствовать связыванию с производным криптофицина (см. выше). Антитела могут быть, в частности, моноклональными, поликлональными или мультиспецифичными, предпочтительно моноклональными. Это могут быть также фрагменты антител. Это могут быть также муриновые, человеческие, гуманизированные или химерные антитела. Конъюгат. Конъюгат обычно включает около 1-10 производных криптофицина, связанных ковалентно с моноклональным антителом (речь идет о степени сшивки или, по-английски, о "drag-to-antibody ratio" или"DAR"). Это число меняется в зависимости от природы моноклонального антитела и производного криптофицина, а также от рабочих условий, используемых в способе конъюгирования (например, количество эквивалентов производного криптофицина по отношению к моноклональному антителу, время реакции,природа растворителя и, возможно, сорастворителя). Контактирование моноклонального антитела с производным криптофицина приводит к смеси, содержащей несколько конъюгатов, отличающихся индивидуально друг от друга по различным показателям DAR; при этом возможно, что моноклональное антителоне полностью прореагировало; возможно наличие агрегатов. Следовательно, величина DAR, определяемая в конечном растворе, соответствует средней величине DAR. В случае, когда агентом клеточного связывания является антитело, может быть использован метод УФ-спектроскопии для определения DAR. Этот метод основан на методе, изложенном в Antony S. Dimitrov (ed), LLC, 2009, "Therapeutic Antibodies and Protocols", т. 525, 445, Springer Science. Он заключается в измерении поглощения раствора конъюгата, полученного после стадии разделения (ii), на двух длинах- 28024627 волн, обозначемых 1 и 2. Используют следующие коэффициенты молярной экстинкции голого антитела и производного криптофицина, измеренные перед конъюгированием. Поглощение раствора конъюгата при 1 и 2 (A1) и (А 2) измеряют либо при соответствующем пике спектра SEC (это позволяет расчитать "DAR(SEC)") или с использованием классического УФспектрофотометра (это позволит расчитать "DAR(UV)"). Значения поглощения могут быть выражены в форме уравнений в которых cD и сА обозначают соответственно концентрации в растворе части конъюгата, относящейся к производному криптофицина, и части конъюгата, относящейся к антителу;D1 и D2 обозначают коэффициенты молярного поглощения производного криптофицина перед конъюгированием на двух длинах волн 1 и 2 соответственно, причем коэффициенты измерены с соединениями формулы (II) типа SZa, где Za=-SMe или типа -С(=O)-ZbRb, где ZbRb=OMe; А 1 и А 2 обозначают коэффициенты молярного поглощения голых антител на двух длинах волн 1 и 2 соответственно. Под голым антителом понимают антитело, к которому не присоединено ни одно производное криптофицина, т.е. антитело перед конъюгированием. Решение указанных двух уравнений приводит к Тогда среднее значение DAR соответствует cD/cA. В случае производных криптофицина можно установить длину волны 1=280 нм, и, в зависимости от природы криптофицина, 2 выбирают из интервала специфических длин волны 246-252 нм. Значение DAR(UV)предпочтительно выше 0,5, более конкретно между 1 и 10, еще более конкретно между 2 и 7. Конъюгат может быть использован в качестве противораковых агентов. Благодаря присутствию моноклонального антитела, конъюгат становится значительно более избирательным к опухолевым клеткам, чем к здоровым клеткам. Это позволяет направлять производное криптофицина в пространство,близкое к опухолевым клеткам, или непосредственно внутрь этих клеток (см. об этом следующие публикации, которые описывают использование конъюгатов с моноклональными антителами при лечении раковых опухолей: "Antibody-drug conjugates for cancer therapy" Carter P.J., et al., Cancer J. 2008, 14, 154-169;"Targeted cancer therapy: conferring specificity to cytotoxic drugs" Chari R., Ace. Chem. Res. 2008, 41, 98107). Это также дает возможность лечить солидные и жидкие опухоли. Конъюгат может быть использован индивидуально или в комбинации по меньшей мере с одним другим противораковым агентом. Конъюгат входит в рецептуры, выпускаемые в форме забуференного водного раствора, в концентрации, как правило, между 1 и 10 мг/мл. Этот раствор может быть инъецирован в форме перфузии как таковой или разбавлен с получением перфузионного раствора. Примеры Используемые методы анализа. Жидкостная хроматография высокого давления - масс-спектрометрия (ЖХМС). Метод А 1. Анализ проводят в аппарате Waters ZQ на колонке XBridge C18 2,5 мкм (350 мм) при 70 С со скоростью потока 0,9 мл/мин, градиент элюирования (7 мин)(А)вода/0,1% муравьиная кислота и (В) ацетонитрил/0,1% муравьиная кислота (градиент: от 5 до 100% В за 5,3 мин; 5,5 мин: 100% В; 6,3 мин: 5% В) и ионизация электрораспылением в положительном и/или отрицательном режиме. Метод А 2. Анализ проводят в аппарате Waters UPLC-SQD на колонке Acquity ВЕН C18 1,7 мкм (2,150 мм) при 50 С со скоростью потока 1 мл/мин, градиент элюирования (2 мин) (А)вода/0,1% муравьиная кислота и(В) ацетонитрил/0,1% муравьиная кислота (градиент: от 5 до 50% В за 0,8 мин; 1,2 мин: 100% В; 1,85 мин: 100% В; 1,95 мин: 5% В) и ионизация электрораспылением в положительном и/или отрицательном режиме. Метод A3. Анализ проводят в аппарате Waters UPLC-SQD на колонке Acquity ВЕН C18 1,7 мкм (2,150 мм) при 70 С со скоростью потока 1 мл/мин, градиент элюирования (2 мин) (А)вода/0,1% муравьиная кислота и(В) ацетонитрил/0,1% муравьиная кислота (градиент: от 5 до 50% В за 1 мин; 1,3 мин: 100% В; 1,45 мин: 100% В; 1,75 мин: 5% В) и ионизация электрораспылением в положительном и/или отрицательном режиме. Метод А 4. Анализ проводят в аппарате Waters ZQ на колонке Phenomenex Kinetex C18 100A 2,6 мкм (350 мм) при 45 С со скоростью потока 1 мл/мин, градиент элюирования (6 мин) (А)вода/0,1% муравьиная кислота и (В) ацетонитрил/0,1% муравьиная кислота (градиент: 6% В: 0,8 мин; от 6 до 100% В за 4,1 мин; 4,8
МПК / Метки
МПК: A61K 31/395, C07D 273/08, A61P 35/00
Метки: терапии, получение, криптофицина, применение, конъюгаты, производные
Код ссылки
<a href="https://eas.patents.su/30-24627-proizvodnye-kriptoficina-i-ego-konyugaty-ih-poluchenie-i-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные криптофицина и его конъюгаты, их получение и применение в терапии</a>












