Производные 7-алкинил-1,8-нафтиридонов, их получение и их применение в терапии
Номер патента: 16939
Опубликовано: 30.08.2012
Авторы: Дюкло Оливье, Боно Франсуаз, Блан Изабелль, Бискарра Сандрин, Маккорт Гари, Алам Антуан
Формула / Реферат
1. Соединение, отвечающее формуле (I)

в которой R1 и R2
(1) независимо друг от друга означают
либо атом водорода,
либо (С1-С7)-алкильную группу, где указанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,
либо -СО-(С1-С7)-алкильную группу или (С3-С8)-циклоалкильную группу,
либо фенильную группу, возможно замещенную одной или несколькими группами, выбираемыми из (С1-С4)-алкильных групп,
либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,
(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют
либо (С4-С8)-циклоалкильную группу,
либо насыщенную гетероциклическую группу из 4-8 звеньев цепи, включающую гетероатом, выбираемый из атомов О,
и причем вышеуказанная гетероциклическая группа может быть конденсирована с фенильной группой;
R3 означает
либо линейную или разветвленную (С1-С7)-алкильную группу или (С3-С7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из атомов галогена и гидроксила, алкоксила, -NRR', галогеналкила и -SO2-(C1-C4)-алкила, где R и R' имеют нижеуказанные значения;
либо -(СН2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О, где вышеуказанная гетероциклическая группа возможно замещена оксогруппой;
либо -(СН2)n-гетероарильную группу, где n=0, 1, 2 или 3 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов, выбираемых из атомов азота и кислорода;
R4 означает атом водорода, (С1-С4)-алкильную группу или (С1-С4)-алкоксильную группу;
R и R' независимо друг от друга означают атом водорода или (С1-С4)-алкильную группу;
в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь.
2. Соединение формулы (I) по п.1, отличающееся тем, что
R1 и R2
(1) независимо друг о друга означают
либо атом водорода,
либо (С1-С7)-алкильную группу, где вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,
либо -СО-(С1-С7)-алкильную группу или (С3-С8)-циклоалкильную группу,
либо фенильную группу, возможно замещенную одной или несколькими группами, выбираемыми из (С1-С4)-алкоксильных групп,
либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,
(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют
либо (С4-С8)-циклоалкильную группу,
либо насыщенную гетероциклическую группу из 4-8 звеньев цепи, включающую гетероатом, выбираемый из атомов О,
и причем вышеуказанная гетероциклическая группа может быть конденсирована с фенильной группой;
R3 означает
либо линейную или разветвленную (С1-С7)-алкильную группу или (С3-С7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксила, алкоксила, -NRR', галогеналкила и -SO2-(C1-C4)-алкила, где R и R' имеют нижеуказанные значения;
либо -(СН2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О, где вышеуказанная гетероциклическая группа возможно замещена оксогруппой;
либо -(СН2)n-гетероарильную группу, где n=0 или 1 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов азота;
R4 означает (С1-С4)-алкильную группу или (С1-С4)-алкоксильную группу;
R и R', каждый, означает линейную или разветвленную (С1-С4)-алкильную группу;
в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь.
3. Соединение формулы (I) по п.1, отличающееся тем, что
R1 и R2
(1) независимо друг от друга означают
либо атом водорода,
либо (С1-С7)-алкильную группу, где вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,
либо -СО-(С1-С7)-алкильную группу или (С3-С8)-циклоалкильную группу,
либо фенильную группу, возможно замещенную одной или несколькими (С1-С4)-алкоксильными группами,
либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,
(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют:
либо (С4-С8)-циклоалкильную группу,
либо насыщенную гетероциклическую группу из 4-8 звеньев цепи, включающую гетероатом кислорода,
и причем вышеуказанная гетероциклическая группа может быть конденсирована с фенильной группой;
R3 означает
либо линейную или разветвленную (С1-С7)-алкильную группу или (С3-С7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксила, алкоксила, -NRR', галогеналкила и -SO2-(C1-C4)-алкила, где R и R' имеют нижеуказанные значения;
либо -(СН2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О, где вышеуказанная гетероциклическая группа возможно замещена оксогруппой;
либо -(СН2)n-гетероарильную группу, где n=0 или 1 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов азота;
R4 означает (С1-С4)-алкильную группу или (С1-С4)-алкоксильную группу;
R и R', каждый, означает линейную или разветвленную (С1-С4)-алкильную группу;
в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь.
4. Соединение формулы (I) по п.1, отличающееся тем, что
R1 и R2
(1) независимо друг от друга означают
либо атом водорода,
либо (С1-С7)-алкильную группу, где вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,
либо -СО-(С1-С7)-алкильную группу или (С3-С8)-циклоалкильную группу,
либо фенильную группу, возможно замещенную одной или несколькими (С1-С4)-алкоксильными группами,
либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,
(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют (С4-С8)-циклоалкильную группу;
R3 означает
либо линейную или разветвленную (С1-С7)-алкильную группу или (С3-С7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксила, алкоксила, галогеналкила и -SO2-(C1-C4)-алкила;
либо -(СН2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О, где вышеуказанная гетероциклическая группа возможно замещена оксогруппой;
либо -(СН2)n-гетероарильную группу, где n=0 или 1 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов азота;
R4 означает (С1-С4)-алкильную группу;
в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь.
5. Соединение формулы (I) по п.1, отличающееся тем, что
R1 и R2
(1) независимо друг от друга означают
либо атом водорода,
либо (С1-С7)-алкильную группу, где вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,
либо -СО-(С1-С7)-алкильную группу или (С3-С8)-циклоалкильную группу,
либо фенильную группу, возможно замещенную одной или несколькими (С1-С4)-алкоксильными группами,
либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,
(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют:
либо (С4-С8)-циклоалкильную группу,
либо насыщенную гетероциклическую группу из 4-8 звеньев цепи, включающую гетероатом кислорода,
и причем вышеуказанная гетероциклическая группа может быть конденсирована с фенильной группой;
в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь.
6. Соединение формулы (I) по п.1, отличающееся тем, что R3 означает
либо линейную или разветвленную (С1-С7)-алкильную группу или (С3-С7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксила, алкоксила, -NRR' и галогеналкила, где R и R' имеют нижеуказанные значения;
либо -(СН2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О, где вышеуказанная гетероциклическая группа возможно замещена оксогруппой;
либо -(СН2)n-гетероарильную группу, где n=0 или 1 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов азота;
R и R', каждый, означает линейную или разветвленную (С1-С4)-алкильную группу;
в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь.
7. Соединение формулы (I) по п.1, отличающееся тем, что R4 означает (С1-С4)-алкильную группу или (С1-С4)-алкоксильную группу;
в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь.
8. Соединение формулы (I) по п.1, отличающееся тем, что R и R' означают, каждый, линейную или разветвленную (С1-С4)-алкильную группу;
в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь.
9. Соединение формулы (I) по п.1, отличающееся тем, что его выбирают из
2-амино-1-этил-7-(3-гидрокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-[(1-гидроксициклопентил)этинил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-(3-гидроксибут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-(3-гидрокси-3-метилпент-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3-циклопентил-3-гидроксипроп-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3-циклопропил-3-гидроксипроп-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
2-амино-1-этил-7-[(1-гидроксициклобутил)этинил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3,4-дигидрокси-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
2-амино-1-этил-7-(3-гидрокси-4-метокси-3-(метоксиметил)бут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-(циклопропилметил)-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-(3-гидрокси-3-фенилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-[3-гидрокси-3-(3-тиенил)бут-1-ин-1-ил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-[3-гидрокси-3-(3-метоксифенил)бут-1-ин-1-ил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-[3-гидрокси-3-(4-метоксифенил)бут-1-ин-1-ил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-1-(3-метоксипропил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3 -карбоксамида;
(±)-2-амино-1-циклопентил-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-1-изопропил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-1-изобутил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
2-амино-7-(3-гидрокси-3-метилбут-1-ин-1-ил)-1-(3-метоксипропил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-(3-гидрокси-4-метокси-3-фенилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-(тетрагидропиран-4-ил)-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-циклогексил-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-[3-гидрокси-3-(1,3-тиазол-2-ил)бут-1-ин-1-ил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-[3-гидрокси-3-(метоксиметил)пент-1-ин-1-ил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1-[3-(2-оксопирролидин-1-ил)пропил]-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1-пропил-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1-(2,2,2-трифторэтил)-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3-гидрокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1-(тетрагидрофуран-2-илметил)-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1-(пиридин-2-илметил)-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-(3-гидрокси-3-пиразин-2-илбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3-циклопропил-3-гидрокси-4-метоксибут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-[3-гидрокси-3-(2-тиенил)бут-1-ин-1-ил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-этил-7-[3-гидрокси-3-(2-метоксифенил)бут-1-ин-1-ил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-циклопентил-7-(3,4-дигидрокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(4-этокси-3-гидрокси-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-1-(транс-4-гидроксициклогексил)-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(±)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-1-[3-(метилсульфонил)пропил]-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(-)-2-амино-1-(циклопропилметил)-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(+)-2-амино-1-(циклопропилметил)-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(+)-2-амино-7-(3,4-дигидрокси-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(-)-2-амино-7-(3,4-дигидрокси-3-метилбут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(-)-2-амино-1-этил-7-(3-гидрокси-3-фенилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(+)-2-амино-1-этил-7-(3-гидрокси-3-фенилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(-)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-1-(3-метоксипропил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(+)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-1-(3-метоксипропил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(-)-2-амино-1-циклопентил-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(+)-2-амино-1-циклопентил-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(-)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-1-изопропил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(+)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-1-изопропил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(-)-2-амино-1-циклогексил-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(+)-2-амино-1-циклогексил-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(-)-2-амино-1-этил-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(+)-2-амино-1-этил-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(-)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1-пропил-1,4-дигидро-1,8-нафтиридин- 3 -карбоксамида;
(+)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1-пропил-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(-)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1-(2,2,2-трифторэтил)-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(+)-2-амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1-(2,2,2-трифторэтил)-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(+)-2-амино-1-этил-7-[3-гидрокси-3-метоксиметил)пент-1-ин-1-ил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(-)-2-амино-1-этил-7-[3-гидрокси-3-(метоксиметил)пент-1-ин-1-ил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(+)-2-амино-1-этил-7-[3-гидрокси-3-(3-тиенил)бут-1-ин-1-ил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида;
(-)-2-амино-1-этил-7-[3-гидрокси-3-(3-тиенил)бут-1-ин-1-ил]-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида.
10. Соединение формулы (VII)
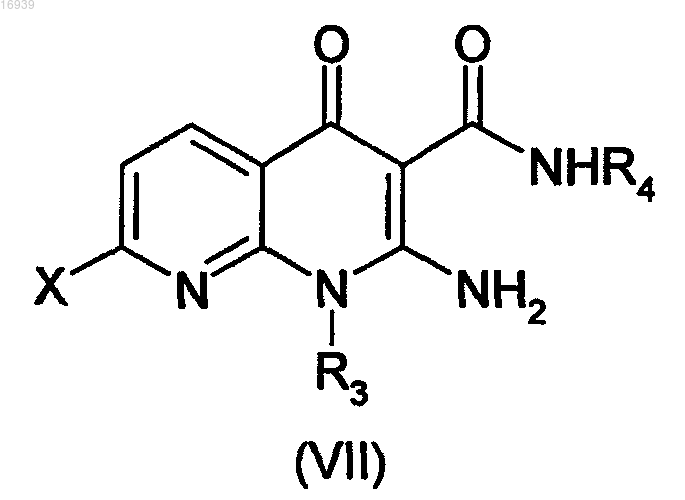
в которой X означает атом галогена и R3 и R4 имеют значения, как указанные в одном из пп.1-9.
11. Способ получения соединения формулы (I) по любому из пп.1-9, отличающийся тем, что соединение формулы (VII)
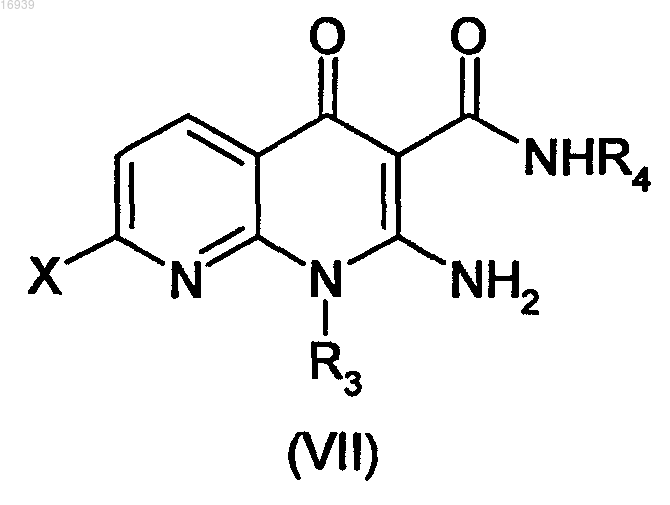
в которой X означает атом галогена и R3 и R4 имеют значения, как указанные в одном из пп.1-9,
вводят в реакцию с соединением формулы (VIII)
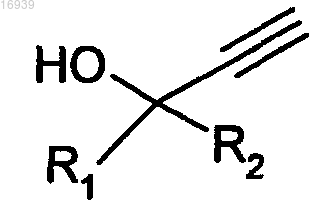
в которой R1 и R2 имеют значения, как указанные в одном из пп.1-9.
12. Лекарственное средство для лечения заболеваний, в которых принимает участие VEGFR-3, отличающееся тем, что оно включает соединение формулы (I) по любому из пп.1-9, или аддитивную соль этого соединения с фармацевтически приемлемой кислотой, или энантиомер, диастереоизомер соединения формулы (I) или их смесь.
13. Фармацевтическая композиция для лечения заболеваний, в которых принимает участие VEGFR-3, отличающаяся тем, что она включает соединение формулы (I) по любому из пп.1-9, или фармацевтически приемлемую соль, или энантиомер, диастереоизомер этого соединения или их смесь, а также по меньшей мере один фармацевтически приемлемый эксципиент.
14. Комбинация по меньшей мере одного соединения формулы (I) по любому из пп.1-9 с по меньшей мере одним химиотерапевтическим агентом, выбираемым из
алкилирующих агентов,
интеркалирующих агентов,
антимикроканальцевых агентов,
антимитотических агентов,
антиметаболических агентов,
антипролиферативных агентов,
антибиотиков,
иммуномодуляторов,
противовоспалительных средств,
ингибиторов киназ,
антиангиогенных агентов,
антиваскулярных агентов,
эстрогенных и андрогенных гормонов,
для получения лекарственного средства для применения в лечении любого заболевания, в котором принимает участие VEGFR-3.
15. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства, предназначенного для лечения любого заболевания, в котором принимает участие VEGFR-3.
16. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства, предназначенного для лечения и/или профилактики раковых заболеваний и их метастазирований.
17. Применение соединения формулы (I) по п.16 для получения лекарственного средства, предназначенного для лечения и/или профилактики глиобластом, множественных миелом, миелодисплазических синдромов, сарком Капоши, кожных ангиосарком, солидных опухолей, лимфом, меланом, раковых заболеваний молочной железы, колоректальных раковых заболеваний, раковых заболеваний легких, включая туда немелкоклеточные раковые заболевания, раковых заболеваний поджелудочной железы, раковых заболеваний простаты, почечных карцином, раковых заболеваний головы и шеи, рака печени, раковых заболеваний яичников, раковых заболеваний дыхательного и торакального аппарата, других опухолей, экспрессируемых VEGFR-3 или причастных к процессу ангиогенеза или лимфангиогенеза.
18. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства, предназначенного для лечения и/или профилактики неонкологических пролиферативных заболеваний и патологических ангиогенезов, связанных с VEGFR-3.
19. Применение соединения формулы (I) по п.18 для получения лекарственного средства, предназначенного для лечения и/или профилактики заболеваний, выбранных из артрозов, рестенозов, псориаза, гемангиом, лимфангиом, глауком, гломерулонефритов, диабетических нефропатий, нефросклерозов, тромботических микроангиопатических синдромов, циррозов печени, атеросклерозов, отторжений трансплантата органа, глазных болезней, причастных к процессу ангиогенеза или лимфангиогенеза.
20. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства для применения в лечении и/или профилактике хронического или иного воспаления, инфекции микроорганизмами и аутоиммунных заболеваний.
21. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства для применения в лечении и/или профилактике лимфангиолейомиоматоза.
22. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства для применения в лечении и/или профилактике ревматоидного артрита.
Текст
016939 Изобретение относится к производным 7-алкинил-1,8-нафтиридонов, их получению и их применению в терапии. Объектом настоящего изобретения являются соединения, отвечающие формуле (I) в которой R1 и R2,(1) независимо друг от друга означают либо атом водорода,либо (С 1-С 7)-алкильную группу, где указанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,либо -СО-(С 1-С 7)-алкильную группу или (С 3-С 8)-циклоалкильную группу,либо фенильную группу, возможно замещенную одной или несколькими группами, выбираемыми из (С 1-С 4)-алкильных групп,либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют: либо (С 4-С 8)-циклоалкильную группу,либо насыщенную гетероциклическую группу из 4-8 звеньев цепи, включающую гетероатом, выбираемый из атомов О,и причем вышеуказанная гетероциклическая группа может быть конденсирована с фенильной группой;R3 означает: либо линейную или разветвленную (С 1-С 7)-алкильную группу или (С 3-С 7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из атомов галогена и гидроксила, алкоксила, -NRR', галогеналкила и -SO2- (C1-C4) -алкила, где R и R' имеют нижеуказанные значения; либо -(СН 2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О,где вышеуказанная гетероциклическая группа возможно замещена оксогруппой; либо -(СН 2)n-гетероарильную группу, где n=0, 1, 2 или 3 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов, выбираемых из атомов азота и кислорода;R и R', независимо друг от друга, означают атом водорода или (С 1-С 4)-алкильную группу. Соединения формулы (I) могут включать один или несколько асимметрических атомов углерода. Следовательно, они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смесь, включая туда их рацемическую смесь, составляют часть изобретения. Соединения формулы (I) могут существовать в виде оснований или могут быть превращены в соли с помощью кислот или оснований, особенно фармацевтически приемлемых кислот или оснований. Такие аддитивные соли составляют часть изобретения. Эти соли преимущественно получают при использовании фармацевтически приемлемых кислот или оснований, однако, соли других кислот или оснований,пригодные, например, для очистки или выделения соединений формулы (I), также составляют часть изобретения. Соединения согласно изобретению также могут существовать в форме гидратов или сольватов, а именно, в форме ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть изобретения. В рамках настоящего изобретения и за исключением другого указания в данном контексте,под алкильной группой понимают насыщенную алифатическую группу, включающую 1-7 атомов углерода (преимущественно, от 1 до 4 атомов углерода) и которая является линейной или, когда алкильная цепь включает по меньшей мере 3 атома углерода, может быть линейной, разветвленной или частично циклизованной. В качестве примеров можно назвать метил, этил, пропил, изопропил, бутил, изобутил,трет-бутил, метиленциклопропил, метиленциклогексил, пентил, 2,2-диметилпропил, гексил, гептил и т.д.; под циклоалкильной группой понимают циклическую алкильную группу, включающую 3-8 атомов углерода и все атомы углерода которой входят в цикл. Можно назвать циклопропил, циклобутил, циклопентил, циклогексил и циклогептил; под алкоксильной группой понимают -О-алкильную группу, где алкильная группа имеет вышеука-1 016939 занное значение; под атомом галогена понимают атом фтора, хлора, брома или иода; под галогеналкильной группой понимают алкильную группу, один или несколько атомов водорода которой заменены атомом галогена; в качестве примера можно назвать -CF3; под галогеналкоксильной группой понимают алкоксильную группу, один или несколько атомов водорода которой заменены атомом галогена; в качестве примера можно назвать -OCF3; под арильной группой понимают моноциклическую ароматическую группу, такую как фенил; под гетероарильной группой понимают ароматическую группу, включающую 5 или 6 звеньев цепи и содержащую один или несколько гетероатомов, выбираемых из атомов азота, кислорода и серы. Можно назвать, например, пиридинил, фуранил, тиенил, пиримидил, пиразинил и тиазолил; и под гетероциклической группой понимают циклическую алкильную группу, включающую от 4 до 8 звеньев цепи и содержащую один или несколько гетероатомов, выбираемых из атомов азота, кислорода и серы. Можно назвать, например, пиперидинил, пирролидинил, оксетанил, тетрагидрофуранил, тетрагидропиранил и тетрагидротиенил. Из соединений формулы (I), являющихся объектами настоящего изобретения, можно назвать подгруппу соединений, определяемую следующим образом:R1 и R2,(1) независимо друг от друга означают либо атом водорода,либо (С 1-С 7)-алкильную группу, где вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,либо -СО-(С 1-С 7)-алкильную группу или (С 3-С 8)-циклоалкильную группу,либо фенильную группу, возможно замещенную одной или несколькими группами, выбираемыми из (С 1-С 4)-алкоксильных групп,либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют: либо (С 4-С 8)-циклоалкильную группу,либо насыщенную гетероциклическую группу из 4-8 звеньев цепи, включающую гетероатом, выбираемый из атомов О,и причем вышеуказанная гетероциклическая группа может быть конденсирована с фенильной группой;R3 означает либо линейную или разветвленную (С 1-С 7)-алкильную группу или (С 3-С 7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксила, алкоксила, -NRR', галогеналкила и -SO2-(C1-C4)-алкила, где R и R' имеют нижеуказанные значения; либо -(СН 2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О,где вышеуказанная гетероциклическая группа возможно замещена оксогруппой;- либо -(СН 2)n-гетероарильную группу, где n=0 или 1 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов азота;R и R' каждый означают линейную или разветвленную (С 1-С 4)-алкильную группу. Из соединений формулы (I), являющихся объектами настоящего изобретения, можно назвать подгруппу соединений, определяемую следующим образом:R1 и R2,(1) независимо друг от друга, означают либо атом водорода,либо (С 1-С 7)-алкильную группу, где вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,либо -СО-(С 1-С 7)-алкильную группу или (С 3-С 8)-циклоалкильную группу,либо фенильную группу, возможно замещенную одной или несколькими (С 1-С 4)-алкоксильными группами,либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют либо (С 4-С 8)-циклоалкильную группу,либо насыщенную гетероциклическую группу из 4-8 звеньев цепи, включающую гетероатом кислорода,и причем вышеуказанная гетероциклическая группа может быть конденсирована с фенильной группой;R3 означает либо линейную или разветвленную (С 1-С 7)-алкильную группу или (С 3-С 7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксила, алкоксила, -NRR', галогеналкила и -SO2-(C1-C4) -алкила, где R и R' имеют нижеуказанные значения; либо -(СН 2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О,где вышеуказанная гетероциклическая группа возможно замещена оксогруппой; либо -(СН 2)n-гетероарильную группу, где n=0 или 1 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов азота;R и R' каждый означает линейную или разветвленную (С 1-С 4)-алкильную группу. Из соединений формулы (I), являющихся объектами настоящего изобретения, можно назвать другую подгруппу соединений, определяемую следующим образом:R1 и R2,(1) независимо друг от друга, означают либо атом водорода,либо (С 1-С 7)-алкильную группу, где вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,либо -СО-(С 1-С 7)-алкильную группу или (С 3-С 8)-циклоалкильную группу,либо фенильную группу, возможно замещенную одной или несколькими (С 1-С 4)-алкоксильными группами,либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,(2) или R1 и R2 вместе с атомом углерода, который их несет,образуют (С 4-С 8)-циклоалкильную группу;R3 означает либо линейную или разветвленную (С 1-С 7)-алкильную группу или (С 3-С 7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксила, алкоксила, галогеналкила и -SO2-(C1-C4)-алкила; либо -(СН 2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О,где вышеуказанная гетероциклическая группа возможно замещена оксогруппой; либо -(СН 2)n-гетероарильную группу, где n=0 или 1 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов азота;R4 означает (С 1-С 4)-алкильную группу. Из соединений формулы (I), являющихся объектами настоящего изобретения, можно назвать третью подгруппу соединений, определяемую следующим образом:R1 и R2,(1) независимо друг от друга, означают либо атом водорода,либо (С 1-С 7)-алкильную группу, где вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,либо -СО-(С 1-С 7)-алкильную группу или (С 3-С 8)циклоалкильную группу,либо фенильную группу, возможно замещенную одной или несколькими (С 1-С 4)-алкоксильными группами,либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют: либо (С 4-С 8)-циклоалкильную группу,либо насыщенную гетероциклическую группу из 4-8 звеньев цепи, включающую гетероатом кислорода,и причем вышеуказанная гетероциклическая группа может быть конденсирована с фенильной группой. Из соединений формулы (I), являющихся объектами настоящего изобретения, можно назвать подгруппу соединений, в которыхR3 означает либо линейную или разветвленную (С 1-С 7)-алкильную группу или (С 3-С 7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксила, алкоксила, -NRR' и-3 016939 галогеналкила, где R и R' имеют нижеуказанные значения; либо -(СН 2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О,где вышеуказанная гетероциклическая группа возможно замещена оксогруппой; либо -(СН 2)n-гетероарильную группу, где n=0 или 1 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов азота;R и R' каждый означает линейную или разветвленную (С 1-С 4)-алкильную группу. Из соединений формулы (I), являющихся объектами настоящего изобретения, можно назвать подгруппу соединений, в которых R4 означает (С 1-С 4)-алкильную группу или (С 1-С 4)-алкоксильную группу. Из соединений формулы (I), являющихся объектами настоящего изобретения, можно назвать подгруппу соединений, в которых R и R' означают, каждый, линейную или разветвленную (С 1-С 4)алкильную группу. Из соединений, являющихся объектами настоящего изобретения, можно назвать, в частности, следующие соединения: 2-амино-1-этил-7-(3-гидрокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин 3 -карбоксамид;(-)-2-амино-1-этил-7-[3-гидрокси-3-(3-тиенил)бут-1-ин-1-ил]-N-метил-4-оксо-1,4-дигидро-1,8 нафтиридин-3-карбоксамид. Согласно изобретению, соединения формулы (I) могут быть получены в соответствии со способом,представленным на схеме 1. Схема 1 Согласно схеме 1 2,6-дигалогенникотиновую кислоту формулы (II), где группы X означают атомы галогена (предпочтительно атомы хлора или брома) и которая является либо коммерчески доступной,либо получаемой согласно способам, известным специалисту в данной области, подвергают монозамещению в положении 2 с помощью амина формулы R3-NH2 (где R3 имеет значение, такое как указанное выше в связи с соединениями формулы (I), объектами данного изобретения), при температуре в диапазоне от 20 до 150 С, в протонном растворителе, таком как спирт или вода, и, в случае необходимости, в герметически закрытой пробирке. Получают 2-аминоникотиновое производное формулы (III), которое превращают в фторангидрид кислоты формулы (IV) путем воздействия цианурилфторида при комнатной температуре, в присутствии основания, такого как триэтиламин или пиридин, и в инертном растворителе,таком как дихлорметан, как описывается G. OLAH и др. в Synthesis, 487 (1973), или при использовании других способов, известных специалисту в данной области, таких как способы, описанные MUKAIYAMA и TANAKA в Chem. Lett., 303 (1976), или ISHIKAWA и SASAKI в Chem. Lett., 1407 (1976). Ацилфториды формулы (IV), очень реакционноспособные, но стабильные, затем вводят во взаимодействие сN-замещенным цианоацетамидом формулы (V) в присутствии сильного основания, такого как гидрид натрия, в апротонном полярном растворителе, таком как диметилформамид. Если используют два эквивалента гидрида натрия, то после выдерживания в течение ночи при комнатной температуре, получают -кетоцианоацетамид формулы (VI), который затем циклизуют с получением аминопиридино[2,3-b]пиридинона формулы (VII) либо путем нагревания при температуре в диапазоне от 90 до 125 С в полярном растворителе, таком как н-бутанол, диметилсульфоксид или диметилформамид (способ А), либо путем обработки при комнатной температуре с помощью сильного основания, такого как трет-бутилат калия, в апротонном растворителе, предпочтительно, в тетрагидрофуране(способ В). Когда используют два эквивалента гидрида натрия на стадии конденсации производного (IV) с производным (V), затем вводят третий эквивалент NaH после перемешивания в течение 10-16 ч при комнатной температуре, образовавшееся депротонированное соединение (VI) циклизуется in situ при той же самой температуре с образованием непосредственно аминопиридино[2,3-b]пиридона формулы (VII)N-Алкилцианоацетамиды формулы (V) получают путем введения во взаимодействие цианоуксусной кислоты с алкилхлорформиатом (таким как этил- или изобутилхлорфррмиат) в присутствии основания, такого как триэтиламин, при температуре ниже или равной 0 С, затем путем введения во взаимодействие образовавшегося смешанного промежуточного ангидрида с избытком амина формулы R4-NH2(где R4 имеет значение, такое как указанное выше в связи с соединениями формулы (I), объектами данного изобретения). Для получения пиридино[2,3-b]пиридинона формулы (I), объекта настоящего изобретения, галогенированный промежуточный продукт формулы (VII), в соответствии с известными специалисту в данной области способами, подвергают реакции связывания с соответствующим производным пропаргилового спирта R1R2CH(ОН)ССН формулы (VIII), где R1 и R2 имеют значения, такие как указанные в случае соединения формулы (I). Например, промежуточный продукт (VII) вводят в реакцию связывания поSonogashira с сответствующим алкином формулы (VIII) в присутствии PdCl2(PPh3)2, иодида меди, триэтиламина и диметилформамида, при температуре в диапазоне от 80 до 120 С. Эта реакция может быть осуществлена в герметически закрытой пробирке и под действием микроволнового излучения. Если необходимо в процессе осуществления реакционных стадий, представленных на схеме 1, гидроксильная группа или некоторые реакционноспособные функциональные группы в случае групп R1, R2 и R3, могут быть временно защищены защитными группами, известными специалисту в данной области,и такими как указанные в руководстве Green и др. "Protective Groups in Organic Synthesis", второе издание(John Wiley and Sons, Inc., Нью-Йорк). На фиг. 1 исходные соединения и реагенты, когда способ их получения не описан, являются коммерчески доступными или описанными в литературе или же могут быть получены способами, которые там описаны или которые известны специалисту в данной области. Объектом изобретения в соответствии с другим из его аспектов являются соединения формулы(VII), указанные на фиг. 1. Эти соединения пригодны в качестве промежуточных продуктов синтеза соединений формулы (I). Нижеследующие примеры поясняют получение некоторых соединений согласно изобретению. Эти примеры не являются ограничивающими объем охраны данного изобретения и служат только для пояснения настоящего изобретения. Номера поясняемых примерами соединений соответствуют таковым,указанным в нижеприводимой таблице, в которой иллюстрируются химические структуры и физические свойства некоторых соединений согласно данному изобретению. Используют следующие аббревиатуры и брутто-формулы: Пример 1. 2-Амино-1-этил-7-(3-гидрокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8 нафтиридин-3-карбоксамид (соединение 2). 1.1. 2-(Аминоэтил)-6-хлорникотиновая кислота. При комнатной температуре в течение 72 ч перемешивают раствор 18,0 г (84,4 ммоль) 2,6 дихлорникотиновой кислоты в 180 мл 70% раствора этиламина в воде. Избыток амина тогда выпаривают при пониженном давлении, затем добавляют 10% водный раствор уксусной кислоты вплоть до осаждения продукта. Твердое вещество бежевого цвета отфильтровывают под вакуумом, промывают холодной-7 016939 водой и высушивают в сушильном шкафу. Получают 10,5 г ожидаемого продукта. Температура плавления: 158-160 С. Выход=62%. 1.2. Фторангидрид 2-(аминоэтил)-6-хлорникотиновой кислоты. К суспензии 5,0 г (24,8 ммоль) 2-(аминоэтил)-6-хлорникотиновой кислоты в 125 мл дихлорметана добавляют 2 мл (24,8 ммоль) пиридина и 4,2 мл (49,8 ммоль) 2,4,6-трифтортриазина. Смесь перемешивают в течение 3 ч при комнатной температуре, затем фильтруют. Твердое вещество промывают с помощью 50 мл дихлорметана и фильтрат промывают два раза с помощью 60 мл смеси воды со льдом. Органическую фазу сушат над Na2SO4 и растворитель выпаривают при пониженном давлении. Получают 5,01 г продукта в виде масла оранжевого цвета. Выход=99%. 1.3. N-метилцианоацетамид. К охлажденному до температуры -30 С раствору 10,0 г (116,36 ммоль) 99% цианоуксусной кислоты и 16,3 мл (116,9 ммоль) триэтиламина в 100 мл безводного ТГФ добавляют, по каплям, 12,28 мл (128,44 ммоль) этилхлорформиата, затем перемешивают при температуре -30 С в течение полутора часов. После этого добавляют, по каплям, 300 мл насыщенного газообразным метиламином метанола, затем перемешивают при комнатной температуре в течение ночи. Растворители выпаривают при пониженном давлении и продукт очищают фильтрацией при использовании силикагеля, элюируя смесью дихлорметан:метанол (95:5). Получают 10,0 г продукта в виде твердого вещества бежевого цвета. Температура плавления = 99 С. Выход=87%. Способ А (нижеприводимые пп.1.4 и 1.5). 1.4. 3-[6-Хлор-2-(этиламино)-3-пиридинил]-2-циано-3-гидрокси-N-метил-2-пропенамид. К охлажденному до температуры 0-5 С раствору 9,80 г (100 ммоль) N-метилцианоацетамида в 100 мл безводного диметилформамида маленькими количествами добавляют 3,98 г (100 ммоль) гидрида натрия в виде 60% дисперсии в минеральном масле. По окончании выделения водорода смесь перемешивают в течение 10 мин при комнатной температуре, затем ее охлаждают снова до температуры 0-5 С. Тогда добавляют раствор 10,09 г (49,8 ммоль) фторангидрида 2-(аминоэтил)-6-хлорникотиновой кислоты в 60 мл диметилформамида и среду перемешивают при комнатной температуре в течение ночи. Добавляют 2,85 мл (49,8 ммоль) уксусной кислоты и летучие компоненты удаляют при пониженном давлении. Остаток обрабатывают водой и продукт экстрагируют два раза смесью дихлорметан:метанол (95:5), затем один раз смесью этилацетат:ТГФ (2:1). Объединенные органические фазы сушат над MgSO4, затем растворители выпаривают при пониженном давлении. Получают 19,0 г продукта, используемого таким, какой есть на следующей стадии. 1.5. 2-Амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамид. Раствор 19,0 г сырого продукта, полученного в конце стадии 1.4, (49,8 ммоль) в 600 мл н-бутанола нагревают в течение 48 ч при температуре 110 С. Растворитель выпаривают при пониженном давлении и полученное твердое вещество порошкуют в метаноле. Твердое вещество затем отфильтровывают под вакуумом и высушивают в сушильном шкафу. Получают 7,9 г ожидаемого продукта в виде твердого вещества бледно-желтого цвета. Температура плавления: 283-286 С. Выход=57%. Способ С (нижеприводимый п.1.6 вместо пп.1.4 и 1.5)/ 1.6. 2-Амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамид. К охлажденному до температуры 0-5 С раствору 0,483 г (4,93 ммоль) N-метилцианоацетамида в 7 мл безводного диметилформамида маленькими количествами добавляют 0,394 г (9,95 ммоль) гидрида натрия в виде 60% дисперсии в минеральном масле. Продолжают перемешивание при этой температуре в течение 10 мин, затем добавляют раствор 1,0 г (4,93 ммоль) фторангидрида 2-(аминоэтил)-6 хлорникотиновой кислоты в 5 мл диметилформамида. Среду перемешивают в течение 1 ночи при комнатной температуре, затем снова добавляют маленькими количествами 0,197 г (4,93 ммоль) гидрида натрия в виде 60% дисперсии в минеральном масле. Продолжают перемешивание при этой температуре в течение 10 мин, после чего добавляют 0,56 мл (9,78 ммоль) уксусной кислоты. Затем добавляют 60 мл воды и отфильтровывают под вакуумом твердое вещество, которое промывают водой, затем высушивают его в сушильном шкафу. Получают 1,30 г ожидаемого продукта. Температура плавления: 283-284 С. МН+=281. Выход=94%. 1(уш.с, 1 Н); 7,40 (д, 1 Н); 4,40 (кв, 2 Н); 2,80 (д, 3H); 1,25 (т, 3 Н). 1.7. 2-Амино-1-этил-7-(3-метил-3-триметилсиланилоксибут-1-ин-1-ил)-N-метил-4-оксо-1,4 дигидро-1,8-нафтиридин-3-карбоксамид. В трехгорлую колбу емкостью 2 л последовательно вводят 40,7 г 2-амино-7-хлор-1-этил-N-метил-4 оксо-1,4-дигидро[1,8]нафтиридин-3-карбоксамида (0,14 5 моль) и 56,2 мл [(1,1-диметил-2-пропинил) окси]триметилсилана (0,290 моль) в смеси из 365 мл диметилформамида и 365 мл триэтиламина. В реакционную смесь барботируют аргон в течение 15 мин, затем последовательно добавляют 0,983 г CuI (5,16 ммоль) и 5,1 г (7,2 ммоль) бис(трифенилфосфин)палладий(II)дихлорида. Реакционную смесь нагревают в течение 15 ч при температуре 90 С, после чего концентрируют в небольшом вакууме. Остаток обрабатывают с помощью 500 мл смеси этилацетат/водный раствор NaHCO3 (об./об.=1:1) и фильтруют через слой целита с промывкой этилацетатом. Водную фазу экстрагируют дихлорметаном (3 раза по 50 мл), затем-8 016939 органические фазы объединяют, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Сырой продукт реакции очищают колоночной хроматографией при использовании диоксида кремния (элюирование градиентом дихлорметан:этилацетат, от 80:20 до 50:50, затем градиентом дихлорметан:метанол, от 95:5 до 90:10), получая 36,2 г ожидаемого продукта (выход=62,3%), а также 7,4 г десилилированного продукта, описываемого на следующей стадии (выход=15,5%). 1.8. 2-Амино-1-этил-7-(3-гидрокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамид. 15 г (37,4 ммоль) 2-амино-1-этил-7-N-метил-3-триметилсиланилоксибут-1-ин-1-ил)-N-метил-4 оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамида растворяют в 815 мл тетрагидрофурана. Раствор охлаждают до температуры 0 С, затем добавляют 13,0 г тригидрата тетрабутиламмонийфторида (41,2 ммоль). Реакционную смесь перемешивают в течение 15 мин при комнатной температуре. Выпаривают досуха и остаток обрабатывают смесью этилацетата, тетрагидрофурана и воды. Водную фазу экстрагируют дихлорметаном, затем органические фазы объединяют, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Получают 15 г сырого продукта, который растворяют при нагревании в 1 л метанола, затем добавляют 6,75 г активированного угля и смесь перемешивают при температуре 7 0 С в течение 5 ч. Фильтруют через целит и после выпаривания в вакууме получают 11,9 г ожидаемого продукта в виде твердого вещества белого цвета. Температура плавления = 255 С. МН+=32 9. Выход=82,9%. 1(1991 в 20 мл тетрагидрофурана добавляют к 20 мл коммерчески доступного 0,5 М раствора этинилмагнийбромида в тетрагидрофуране (10 ммоль, Aldrich), предварительно охлажденного до температуры 0 С. Затем перемешивают в течение 4 ч при комнатной температуре и добавляют водный насыщенный раствор NH4Cl. Экстрагируют этилацетатом, затем органические фазы объединяют, промывают водным насыщенным раствором NaCl, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. После очистки хроматографией при использовании колонки с диоксидом кремния получают 319 мг (2,79 ммоль) -3-этинилтетрагидро-3-фуранола в виде масла желтого цвета с выходом 57%. 2.2. -2-Амино-1-этил-7-[(3-гидрокситетрагидрофуран-3-ил)этинил]-N-метил-4-оксо-1,4-дигидро 1,8-нафтиридин-3-карбоксамид. В пробирку для обработки микроволновым излучением емкостью 10 мл помещают суспензию 0,3 г(2,24 ммоль) 2-амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоксамида в 17 мл смеси диметилформамида и триэтиламина (об./об.=2:1). В эту суспензию барботируют аргон в течение 10 мин, после чего последовательно добавляют 0,319 г (2,79 ммоль) -3-этинилтетрагидро-3 фуранола, 0,043 г (0,23 ммоль) CuI и 0,079 г (0,11 ммоль) бис(трифенилфосфин)палладий(II)дихлорида. Герметически закрытую пробирку помещают в микроволновую печь (аппарат СЕМ, модель Discover) и смесь нагревают под давлением при температуре 90 С в течение 60 мин (мощность = 100 Вт),затем охлаждают и выпаривают досуха. Обрабатывают этилацетатом и органическую фазу промывают последовательно с помощью насыщенного водного раствора NaHCO3, затем насыщенного водного раствора NaCl, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Полученный остаток очищают хроматографией на диоксиде кремния (элюирование градиентом дихлорметан:метанол,от 98:2 до 95:5). Получают 0,412 г ожидаемого продукта в виде твердого вещества бледно-желтого цвета. Температура плавления = 253 С. МН+=357. Выход=52%. 1 Н-ЯМР (ДМСО-d6, 400 МГц,в м.д.) : 11,75 (очень уш.с, 1 Н); 11,00 (уш.кв, 1 Н); 8,45 (д, 1 Н); 8,00 (уш.с, 1 Н); 7,4 (д, 1 Н); 5,6 (д, 1 Н); 4,55-4,30(м, 3 Н); 3,95-3,80 (м, 4 Н); 2,8 (д, 3 Н); 2,20 (м, 1 Н); 1,9-1,35 (м, 8 Н); 1,25 (т, 3 Н). Пример 3. -2-Амино-1-этил-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4 дигидро-1,8-нафтиридин-3-карбоксамид (соединение 8). 3.1. Получение -1-метокси-2-метил-3-бутин-2-ола. В трехгорлую колбу в атмосфере аргона вводят 1400 мл (0,7 моль) коммерчески доступного 0,5 М раствора этинилмагнийхлорида (или -бромида) в тетрагидрофуране. Охлаждают до температуры 2 С с помощью ледяной бани и медленно добавляют раствор 30 г (0,327 моль) метоксиацетона в 600 мл тетрагидрофурана (экзотермическая реакция). Перемешивают в течение 1 ч при температуре 2 С, затем выливают в смесь льда с насыщенным водным раствором NH4Cl. Экстрагируют диэтиловым эфиром, затем органические фазы объединяют, сушат над сульфатом натрия, отфильтровывают и концентрируют в предельном вакууме. Получают ожидаемый продукт в виде масла каштанового цвета в количестве 38 г(количественный выход сырого продукта), которое используют без дальнейшей очистки на следующей стадии. 3.2.-2-Амино-1-этил-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-9 016939 дигидро-1,8-нафтиридин-3-карбоксамид. В пробирку для обработки микроволновым излучением емкостью 80 мл помещают суспензию 3 г(10,69 ммоль) 2-амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоксамида в 20 мл смеси диметилформамида и триэтиламина (об./об.=1:1). В эту суспензию барботируют аргон в течение 10 мин, после чего последовательно добавляют 1,83 г (16,03 ммоль) -1-метокси-2-метил-3-бутин 2-ола, 0,081 г (0,43 ммоль) CuI и 0,375 г (0,53 ммоль) бис(трифенилфосфин)палладий(II)дихлорида. Герметически закрытую пробирку помещают в микроволновую печь (аппарат СЕМ, модель Discover) и смесь нагревают под давлением при температуре 90 С в течение 60 мин (мощность = 100 Вт),затем охлаждают и выпаривают досуха. Остаток обрабатывают смесью этилацетата и тетрагидрофурана,затем промывают водным 0,1 н раствором HCl. Органическую фазу сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Полученный остаток очищают хроматографией на диоксиде кремния (твердый осадок; элюирование градиентом циклогексан:этилацетат, от 30:70 до 20:80). Получают 2,49 г ожидаемого продукта в виде твердого вещества бледно-желтого цвета. Продукт может быть перекристаллизован из этанола с получением кристаллов белого цвета. Температура плавления = 211 С. МН+=358. Выход=65%. 1 Н-ЯМР (ДМСО-d6, 400 МГц,в м.д.) : 11,75 (очень уш.с, 1 Н); 11,00 (уш.кв, 1 Н); 8,45 (д, 1 Н); 8,00 (уш.с, 1 Н); 7,4 (д, 1 Н); 5,8 (с, 1 Н); 4,4 (кв, 2 Н); 3,5-3,3 (м+с, 5 Н); 2,8 (д, 3 Н); 1, 45 (с, 3 Н); 1,2 (т, 3 Н). Пример 4. -2-Амино-7-(3-циклопентил-3-гидроксипроп-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4 дигидро-1,8-нафтиридин-3-карбоксамид (соединение 10). 4.1. -1-Циклопентилпроп-2-ин-1-ол. Раствор 0,87 мл (8,15 ммоль; Aldrich) циклопентанкарбоксальдегида в 10 мл тетрагидрофурана добавляют к 18 мл предварительно охлажденного до температуры 0 С коммерчески доступного 0,5 М раствора этинилмагнийбромида (10 ммоль; Aldrich) в тетрагидрофуране. Затем перемешивают в течение 2 ч при комнатной температуре и добавляют насыщенный водный раствор NH4Cl. Экстрагируют этилацетатом, затем органические фазы объединяют, промывают насыщенным водным раствором NaCl, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Получают 0,931 г -1 циклопентилпроп-2-ин-1-ола в виде масла светло-каштанового цвета с выходом 92%. 4.2. -2-Амино-7-(3-циклопентил-3-гидроксипроп-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4-дигидро 1,8-нафтиридин-3-карбоксамид. В пробирку для обработки микроволновым излучением емкостью 10 мл помещают суспензию 1 г(3,56 ммоль) 2-амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоксамида в 25 мл смеси диметилформамида и триэтиламина (об./об.=2,5:1). В эту суспензию барботируют аргон в течение 10 мин, после чего последовательно добавляют 0,931 г (7,5 ммоль) -1-циклопентилпроп-2-ин-1 ола, 0,068 г (0,36 ммоль) CuI и 0,125 г (0,18 ммоль) бис(трифенилфосфин)палладий(II)дихлорида. Герметически закрытую пробирку помещают в микроволновую печь (аппарат СЕМ, модель Discover) и смесь нагревают под давлением при температуре 80 С в течение 17 мин (мощность = 100 Ватт). Выпаривают досуха, затем обрабатывают этилацетатом. Органическую фазу промывают последовательно насыщенным водным раствором NaHCO3, затем насыщенным водным раствором NaCl, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Полученный остаток очищают хроматографией на диоксиде кремния (элюирование градиентом дихлорметан:метанол, от 98:2 до 95:5). Получают 0,73 г ожидаемого продукта в виде твердого вещества бледно-желтого цвета. Температура плавления = 253 С. МН+=369. Выход=56%. 1 Н-ЯМР (ДМСО-d6, 400 МГц,в м.д.) : 11,75 (очень уш.с, 1 Н); 11,00 (уш.кв, 1 Н); 8,45 (д, 1 Н); 8,00 (уш.с, 1 Н); 7,45 (д, 1 Н); 6,05 (с, 1 Н); 4,4 (кв, 2 Н); 3,95-3,80 (м, 4 Н); 2,8 (д, 3 Н); 2,35-2,10 (м, 2 Н); 1,45-2-Амино-7-(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1(пиридин-2-илметил)-1,4-дигидро-1,8-нафтиридин-3-карбоксамид (соединение 47). 5.1. 6-Хлор-2-[(пиридин-2-илметил)амино]никотиновая кислота. В герметически закрываемую пробирку емкостью 80 мл, содержащую 40 мл трет-бутанола, вносят 4 г (20,83 ммоль; Aldrich) 2,6-дихлорникотиновой кислоты и 10,74 мл (104,17 ммоль) 2(аминометил)пиридина. Нагревают при температуре 100 С в течение ночи и выпаривают досуха. Остаток обрабатывают водой и подкисляют, приливая 10% водный раствор уксусной кислоты. Осадок выделяют путем отфильтровывания и после высушивания в сушильном шкафу в небольшом вакууме получают 4,35 г (выход=79%) ожидаемого продукта в виде порошка желтого цвета. 5.2. 6-Хлор-2-[(пиридин-2-илметил)амино]никотиноилфторид. К суспензии 4,3 г (16,31 ммоль) 6-хлор-2-[(пиридин-2-илметил)амино]никотиновой кислоты в 90 мл дихлорметана последовательно добавляют 2,27 мл (16,31 ммоль) триэтиламина и 1,65 мл (19,57 ммоль) 2,4,6-трифтортриазина. Смесь перемешивают в течение 1 ч при комнатной температуре, затем добавляют смесь дихлорметана со смесью воды со льдом. Органическую фазу промывают 3 раза охлажденным водным раствором NaHCO3, затем сушат над Na2SO4, отфильтровывают и концентрируют в вакууме. Полу- 10016939 чают 3, 97 г ожидаемого продукта в виде твердого вещества оранжевого цвета. Выход=92%. 5.3. 2-Амино-7-хлор-N-метил-4-оксо-1-(пиридин-2-илметил)-1,4-дигидро-1,8-нафтиридин-3 карбоксамид. К охлажденному до температуры 0-5 С раствору 1,31 г (13,36 ммоль) N-метилцианоацетамида (получаемый согласно 1.3) в 20 мл безводного диметилформамида порциями добавляют 1,12 г (28,06 ммоль) гидрида натрия в виде 60% дисперсии в минеральном масле. Продолжают перемешивание при этой температуре в течение 10 мин, затем добавляют раствор 3,55 г (4,93 ммоль) 6-хлор-2-[(пиридин-2 илметил)амино]никотиноилфторида в 20 мл диметилформамида. Среду перемешивают в течение 1 ночи при комнатной температуре, затем снова добавляют, порциями, 0,561 г (14,03 ммоль) гидрида натрия в виде 60% дисперсии в минеральном масле. Продолжают перемешивание при этой температуре в течение 1 ч, после чего реакционную смесь выливают на лед и подкисляют вплоть до рН 5-6 с помощью 10% водного раствора уксусной кислоты. Осадок выделяют путем отфильтровывания и после высушивания в сушильном шкафу получают 3,98 г ожидаемого продукта в виде твердого вещества бежевого цвета. МН+=344. Выход=87%. 1 Н-ЯМР (ДМСО-d6, 400 МГц,в м.д.) : 9,20 (очень уш.с, 1 Н); 8,85 (с, 1 Н); 8,30 (м, 1 Н); 8,10-7,85(уш.м, 2 Н); 7,80 (д, 1 Н); 7,75 (уш.с, 1 Н); 6,90 (д, 1 Н); 4,90 (с, 2 Н); 2,95 (с, 3 Н). 5.4. Гидрохлорид -2-амино-7(3-гидрокси-4-метокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1(пиридин-1-илметил)-1,4-дигидро-1,8-нафтиридин-3-карбоксамида. В пробирку для обработки микрбволновым излучением емкостью 80 мл помещают суспензию 1 г(2,91 ммоль) 2-амино-7-хлор-N-метил-4-оксо-1-(пиридин-2-илметил)-1,4-дигидро-1,8-нафтиридин-3 карбоксамида в смеси из 20 мл диметилформамида и 5,7 мл триэтиламина. В эту суспензию барботируют аргон, затем последовательно добавляют 0,498 г (4,36 ммоль) -1-метокси-2-метил-3-бутин-2-ола, 0,055 г (0,29 ммоль) CuI и 0,102 г (0,15 ммоль) бис(трифенилфосфин)палладий(II) дихлорида. Герметически закрытую пробирку помещают в микроволновую печь (аппарат СЕМ, модель Discover) и смесь нагревают под давлением при температуре 80 С в течение 45 мин (мощность = 100 Вт),затем охлаждают и выпаривают досуха. Остаток обрабатывают этилацетатом и водой. Водную фазу экстрагируют этилацетатом (3 раза), затем органические фазы объединяют, сушат над сульфатом натрия,отфильтровывают и концентрируют в вакууме. Полученный остаток очищают хроматографией на диоксиде кремния (твердый осадок; элюирование градиентом CH2Cl2/метанол/водный раствор NH4OH, от 98:2:0,2 до 95:5:0,5). После порошкования в диэтиловом эфире получают 0,425 г ожидаемого продукта в виде твердого вещества желтого цвета. Температура плавления = 169 С. МН+=422. Выход=35%. 1 Н-ЯМР (ДМСО-d6, 400 МГц,в м.д.) : 11,65 (очень уш.с, 1 Н); 11,00 (уш. кв, 1 Н); 8,50-8,35 (м,2 Н); 8,00 (уш. с, 1 Н); 7,75 (ддд, 1 Н); 7,45-7,20 (м, 3H); 5,80 (уш.с, 2 Н); 5,70 (с, 1 Н); 3,45-3,25 (м+с, 5 Н); 2,80 (д, 3 Н); 1,40 (с, 3 Н). Пример 6. -2-Амино-1-этил-7-(3-гидрокси-3-пиразин-2-илбут-1-ин-1-ил)-N-метил-4-оксо-1,4 дигидро-1,8-нафтиридин-3-карбоксамид (соединение 48). 6.1. -2-Пиразин-2-илбут-3-ин-2-ол. 0,5 М раствор этинилмагнийхлорида в тетрагидрофуране (31,90 ммоль/ Aldrich) разбавляют с помощью 50 мл тетрагидрофурана, затем охлаждают до температуры 0 С. Затем добавляют несколькими порциями 3 г (24,56 ммоль; Lancaster) 1-пиразин-2-илэтанона и перемешивают в течение 4 ч при температуре 0 С. Снова охлаждают на ледяной бане и медленно добавляют водный раствор NH4Cl. Экстрагируют 2 раза этилацетатом, затем органические фазы объединяют, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Полученный маслянистый остаток очищают хроматографией на диоксиде кремния (элюирование градиентом циклогексан:этилацетат, от 70:30 до 50:50) и получают 2,9 г ожидаемого продукта в виде масла желтого цвета (выход=80%). 6.2. -2-Амино-1-этил-7-(3-гидрокси-3-пиразин-2-илбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро 1,8-нафтиридин-3-карбоксамид. В пробирку для обработки микроволновым излучением емкостью 10 мл помещают суспензию 1 г(3,56 ммоль) 2-амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро [1,8] нафтиридин-3-карбоксамида в 25 мл смеси диметилформамида и триэтиламина (об./об.=2,5:1). В эту суспензию барботируют аргон в течение 10 мин, после чего последовательно добавляют 0,792 г (5,34 ммоль) -2-пиразин-2-илбут-3-ин-2 ола, 0,068 г (0,36 ммоль) CuI и 0,125 г (0,18 ммоль) бис(трифенилфосфин)палладий(II)дихлорида. Герметически закрытую пробирку помещают в микроволновую печь (аппарат СЕМ, модель Discover) и смесь нагревают под давлением при температуре 80 С в течение 245 мин (мощность = 50 Вт). После возврата к комнатной температуре выпаривают досуха, затем обрабатывают этилацетатом. Органическую фазу промывают последовательно насыщенным водным раствором NaHCO3, затем насыщенным водным раствором NaCl, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Полученный остаток очищают хроматографией на диоксиде кремния (элюирование градиентом дихлорметан:метанол, от 100:0 до 98:2). Получают 0,2 г загрязненного ожидаемого продукта в виде твердого вещества каштанового цвета. Осуществляют новую очистку колоночной хроматографией при исполь- 11016939 зовании диоксида кремния (элюирование градиентом циклогексан:этилацетат, от 20:80 до 0:100) и получают, в конечном счете, 0,0 68 г ожидаемого продукта в виде твердого вещества желтого цвета. Температура плавления = 271 С. МН+=393. Выход=4,9%. 1(т, 3 Н). Пример 7. -2-Амино-7-(3-циклопропил-3-гидрокси-4-метоксибут-1-ин-1-ил)-1-этил-N-метил-4 оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамид (соединение 50). 7.1. -2-Циклопропил-1-метоксибут-3-ин-2-ол. 7.1.1. N-Метокси-N-метил-2-метоксиацетамид. К раствору гидрохлорида N-метил-О-метилгидроксиламина в 250 мл дихлорметана, охлажденному до температуры 0 С, добавляют 35,96 мл (258 ммоль) триэтиламина, затем раствор 14 г (12 9 ммоль; Aldrich) метоксиацетилхлорида в 250 мл дихлорметана. Перемешивают в течение 3 ч и оставляют температуру повышаться до комнатной. Добавляют 1 н. водный раствор HCl, затем органическую фазу промывают водой, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Получают 13,14 г ожидаемого продукта в виде масла, которое используют без дальнейшей очистки (выход сырого продукта = 76%). 7.1.2: 1-Метокси-4-(триметилсилил)бут-3-ин-2-он. Раствор 14,75 мл (103,62 ммоль) триметилсилилацетилена в 250 мл тетрагидрофурана охлаждают до температуры -70 С, затем добавляют 64,76 мл 1,6 М раствора н-BuLi (103,62 ммоль) в гексане. Перемешивают в течение 25 мин при температуре -70 С, затем быстро добавляют раствор 13,14 г (98,69 ммоль) N-метокси-N-метил-2-метоксиацетамида в 250 мл тетрагидрофурана. Во время добавления температура повышается вплоть до -50 С, затем охлаждающую баню убирают и перемешивают в течение 2 ч при комнатной температуре. Добавляют 1 н водный раствор HCl, после чего экстрагируют 4 раза этилацетатом. Органические фазы объединяют, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Получают 13,4 г 1-метокси-4-(триметилсилил)бут-3-ин-2-она в виде масла светлокаштанового цвета, которое используют без дальнейшей очистки (выход сырого продукта = 80%). 7.1.3. -2-Циклопропил-1-метокси-4-(триметилсилил)бут-3-ин-2-ол. К раствору 3 г (17,62 ммоль) 1-метокси-4-(триметилсилил)бут-3-ин-2-она в 160 мл диэтилового эфира добавляют 52,8 5 мл 0,5 М циклопропилмагнийбромида (26,43 ммоль; Aldrich). Перемешивают при комнатной температуре в течение ночи, затем смесь охлаждают при использовании бани со смесью воды со льдом и добавляют раствор водного NH4Cl и этилацетата. Экстрагируют 3 раза этилацетатом, затем органические фазы объединяют, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Маслянистый остаток очищают колоночной хроматографией при использовании диоксида кремния, элюируя градиентом циклогексан:этилацетат, от 100:0 до 80:20, с получением 1,9 г -2 циклопропил-1-метокси-4-(триметилсилил)бут-3-ин-2-ола в виде масла, с выходом 51%. 7.1.4. -2-Циклопропил-1-метоксибут-3-ин-2-ол. К раствору 1,67 г (7,86 ммоль) -2-циклопропил-1-метокси-4-(триметилсилил)бут-3-ин-2-ола в метаноле добавляют 10,9 г (0,08 ммоль) карбоната калия и перемешивают в течение ночи при комнатной температуре. Метанол выпаривают и обрабатывают смесью этилацетата и воды. Экстрагируют 3 раза этилацетатом, затем органические фазы объединяют, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Получают 0,434 г -2-циклопропил-1-метоксибут-3-ин-2-ола в виде масла,используемого без дальнейшей очистки (выход сырого продукта = 40%). 7.2. -2-Амино-7-(3-циклопропил-3-гидрокси-4-метоксибут-1-ин-1-ил)-1-этил-N-метил-4-оксо-1,4 дигидро-1,8-нафтиридин-3-карбоксамид. В пробирку для обработки микроволновым излучением емкостью 10 мл помещают суспензию 0,47 г (1,68 ммоль) 2-амино-7-хлор-1-этил-N-метил-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоксамида в смеси из 8,4 мл диметилформамида и 3 мл триэтиламина. В эту суспензию барботируют аргон в течение 10 мин, после чего последовательно добавляют 0,433 г (3,09 ммоль) -2-циклопропил-1-метоксибут-3 ин-2-ола, 0,032 г (0,17 ммоль) CuI и 0,059 г (0,08 ммоль) бис(трифенилфосфин)палладий(II)дихлорида. Герметически закрытую пробирку помещают в микроволновую печь (аппарат СЕМ, модель Discover) и смесь нагревают под давлением при температуре 80 С в течение 30 мин (мощность = 50 Вт),затем охлаждают и выпаривают досуха. Обрабатывают этилацетатом и органическую фазу промывают последовательно насыщенным водным раствором NaHCO3, затем насыщенным водным раствором NaCl,сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Полученный остаток очищают хроматографией на диоксиде кремния, элюируя градиентом дихлорметан:метанол, от 100:0 до 97:3. После порошкования в диэтиловом эфире и фильтрации получают 0,316 г ожидаемого продукта в виде твердого вещества бледно-желтого цвета. Температура плавления = 208 С. МН+=385. Выход=49%. 1- 12016939 0,6-0,3 (м, 4 Н). Пример 8. -2-Амино-1-циклопентил-7-(3,4-дигидрокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо 1,4-дигидро-1,8-нафтиридин-3-карбоксамид (соединение 53). 8.1. -2-Метилбут-3-ин-1, 2-диол. Коммерчески доступный 0,5 М раствор этинилмагнийхлорида в тетрагидрофуране разбавляют с помощью 200 мл тетрагидрофурана, затем охлаждают до температуры 0 С. После этого добавляют раствор гидроксиацетона в 200 мл тетрагидрофурана и перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь охлаждают, затем добавляют водный раствор NH4Cl. Экстрагируют 3 раза этилацетатом, затем органические фазы объединяют, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме (примерно 200 мбар). В конечном счете получают 20 г ожидаемого продукта в виде масла каштанового цвета, которое используют без дальнейшей очистки (количественный выход сырого продукта). 8.2. 2-(Аминоциклопентил)-6-хлорникотиновая кислота. В герметически закрываемую пробирку, содержащую 40 мл трет-бутанола, вводят 15 г (70,31 ммоль; Aldrich) 2,6-дихлорникотиновой кислоты и 34,7 мл (351,5 6 ммоль) циклопентил-амина. Нагревают при температуре 100 С в течение ночи и выпаривают досуха. Остаток обрабатывают водой и подкисляют, приливая 10% водный раствор уксусной кислоты, затем экстрагируют хлороформом. Органические фазы объединяют, сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. Твердый остаток порошкуют в смеси диэтиловый эфир/пентан, получая 5 г ожидаемого продукта в виде твердого вещества нечистого белого цвета (выход=29,5%). 8.3. Фторангидрид 2-(аминоциклопентил)-6-хлорникотиновой кислоты. К суспензии 1,0 г (4,15 ммоль) 2-(аминоциклопентил)-6-хлорникотиновой кислоты в 12 мл дихлорметана добавляют 0,34 мл (4,15 ммоль) пиридина и 0,53 мл (6,23 ммоль) 2,4,6-трифтортриазина. Смесь перемешивают в течение 2 ч при комнатной температуре, затем разбавляют дихлорметаном. Органическую фазу промывают 2 раза с помощью холодного водного раствора NaHCO3, затем сушат над Na2SO4, отфильтровывают и концентрируют при пониженном давлении. Получают 1 г продукта в виде масла каштанового цвета, которое непосредственно используют на следующей стадии. Выход сырого продукта количественный. Способ А (нижеприводимый п.8.4). 8.4. 3-[6-Хлор-2-(циклопентиламино)-3-пиридинил]-2-циано-3-гидрокси-N-метил-2-пропенамид + 2-амино-7-хлор-1-циклопентил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамид. К охлажденному до температуры 0-5 С раствору 0,427 г (4,36 ммоль) N-метилцианоацетамида (получение описывается в 1.3) в 10 мл безводного ДМФА маленькими количествами добавляют 0,349 г (8,72 ммоль) гидрида натрия в виде 60% дисперсии в минеральном масле. По окончании выделения водорода смесь перемешивают в течение 10 мин при комнатной температуре, затем снова охлаждают до температуры 0-5 С. Тогда добавляют раствор 1,0 г (4,15 ммоль) фторангидрида 2-(аминоциклопентил)-6 хлорникотиновой кислоты в 10 мл диметилформамида и среду перемешивают при комнатной температуре в течение 1 ч. Добавляют 0,174 мг (4,35 ммоль) гидрида натрия в виде 60% дисперсии в минеральном масле и перемешивают при комнатной температуре в течение ночи. Реакционную смесь выливают в смесь льда и 0,1 н водного раствора HCl и осадок выделяют путем отфильтровывания. После промывки водой и высушивания в сушильном шкафу получают твердое вещество зеленоватого цвета в количестве 1,2 г, состоящее из смеси в соотношении 2:1 3-[6-хлор-2-(циклопентиламино)-3-пиридинил]-2-циано-3 гидрокси-N-метил-2-пропенамида и 2-амино-7-хлор-1-циклопентил-N-метил-4-оксо-1,4-дигидро-1,8 нафтиридин-3-карбоксамида. Способ В (нижеприводимый п. 8.5). 8.5. 2-Амино-7-хлор-1-циклопентил-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин-3-карбоксамид. К раствору 1,2 г смеси, описанной в п.8.4, (3,74 ммоль) в 40 мл безводного тетрагидрофурана добавляют коммерчески доступный 1,0 М раствор трет-бутилата калия (7,48 ммоль; Aldrich) в тетрагидрофуране. Перемешивают в течение 15 мин при комнатной температуре, затем добавляют 0,1 н. водный раствор HCl и экстрагируют 2 раза этилацетатом. Органические фазы сушат над сульфатом натрия, отфильтровывают и концентрируют в вакууме. После порошкования в диэтиловом эфире и высушивания в сушильном шкафу получают 0,53 г ожидаемого продукта в виде твердого вещества жел.того цвета (выход=44%). Температура плавления = 256-258 С. МН+=321. 8.6.-2-Амино-1-циклопропил-7-(3,4-дигидрокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4 дигидро-1,8-нафтиридин-3-карбоксамид. В трехгорлую колбу емкостью 500 мл последовательно вводят 15 г (53,44 ммоль) 2-амино-7-хлор-1 циклопентил-N-метил-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоксамида и 11,11 г (83,39 ммоль) -2 метилбут-3-ин-1,2-диола в смеси из 267 мл диметилформамида и 104 мл триэтиламина. В реакционную смесь в течение 15 мин барботируют аргон, затем последовательно добавляют 1,02 г (5,34 ммоль) CuI и 1,87 г (2,67 ммоль) бис(трифенилфосфин)палладий(II)дихлорида. Реакционную смесь нагревают в течение 30 мин при температуре 100 С, затем концентрируют в небольшом вакууме. Остаток обрабатывают смесью хлороформ/вода и нерастворимую часть отфильтровывают. Получают 20 г твердого вещества,- 13016939 которое очищают хроматографией на диоксиде кремния (твердый осадок после солюбилизации в смеси тетрагидрофуран/метанол, затем элюирование градиентом дихлорметан/метанол, от 99:1 до 80:20), получая 7,5 г ожидаемого продукта в виде твердого вещества бежевого цвета. Температура плавления = 210,5 С. МН+=385. Выход=42%. 1 Н-ЯМР (ДМСО-d6, 400 МГц,в м.д.) : 11,6 (очень уш.с, 1 Н); 11,05 (уш.кв, 1 Н); 8,40 (д, 1 Н); 7,35(д, 1 Н); 5,5 (с, 1 Н); 5,15 (м, 1 Н); 5,0 (т, 1 Н); 3,45 (м, 2 Н); 2,80 (д, 3 Н); 2,3-2,1 (м, 4 Н); 2,05-1,8 (м, 2 Н); 1,75-1,5 (м, 2 Н); 1,4 (с, 3 Н). В нижеприводимой табл. 1 иллюстрируются химические структуры и физические свойства некоторых соединений формулы (I) согласно изобретению. В этой таблице: звездочка указывает, в случае, где R1 и R2 вместе образуют цикл (гетероцикл или циклоалкил),углерод присоединения вышеуказанного цикла к смежному углероду ацетиленовой связи;"HCl" означает соединение в форме гидрохлорида; в колонке "PF" ("Т.пл.") указывается температура плавления, в С, соединения; и в колонке "CL/SM" (жидкостная хроматография/масс-спектрометрия) указываются, последовательно, используемый и подробно описываемый ниже аналитический метод высокоэффективной жидкостной хроматографии (А, В или С), время удерживания соединения, выражаемое в минутах, и пик МН+, идентифицируемый согласно масс-спектрометрии. Метод А. колонка: Kromasil, 502,1 мм, 3,5 мкм; растворитель А: H2O/ACN/ТФУК (1000/30/0,5); растворитель В: ACN/ТФУК (1000/0,5); расход =0,5 мл/мин; градиент: от 100/0 (0 мин) до 0/100 (12 мин) до 0/100 (15 мин); детектирование: 220 нм; ионизация: ESI+ (ионизация электронным распылением с образованием положительных ионов); Метод В: колонка: Gemini, 503 мм, 3 мкм; растворитель А: Н 2 О+0,1% HCO2H; растворитель В: ACN+0,1% HCO2H; расход = 1 мл/мин; градиент: от 95/5 (0 мин) до 0/100 (5,5 мин) до 0/100 (7,5 мин); детектирование: 220 нм; ионизация: ESI+; Метод С: колонка: Cromasil, 502,1 мм, 3,5 мкм; растворитель A: CH3CO2NH4 5 мМ; растворитель В: ACN; расход = 0,5 мл/мин; градиент: от 100/0 (0 мин) до 0/100 (13 мин) до 0/100 (16 мин); детектирование: 220 нм; ионизация: ESI+; в колонке "хиральная CL" указываются, последовательно, для оптически чистых соединений (энантиомерная чистота 95%), используемый и подробно описываемый ниже аналитический метод высокоэффективной жидкостной хроматографии (D или Е), время удерживания соединения, выражаемое в минутах; Метод D: колонка: Chiralpak AD-H, 2504,6 мм, 5 мкм; растворитель А: 2-пропанол/ТФУК (1000/1); растворитель В: гептан/2-пропанол (1000/30); изократический режим: 50% А+50% В; расход: 0,8 мл/мин; детектирование: 220 нм. Метод Е: колонка: Chiralpak AD-H, 2504,6 мм, 5 мкм; растворитель А: 2-пропанол/ТФУК (1000/1); растворитель В: гептан/2-пропанол (1000/30); изократический режим: 20% А+80% В; расход: 0,8 мл/мин; детектирование: 220 нм; В колонке "Хиральность", указание "/" означает ахиральное соединение, указаниеозначает соединение в форме рацемической смеси, указание (-) означает соединение в форме оптически чистого левовращающего энантиомера (энантиомерная чистота 95%) и указание (+) означает соединение в форме оптически чистого правовращающего энантиомера (энантиомерная чистота 95%). В случае оптически чистого соединения, величина оптического вращения, измеряемая при температуре 20 С, указывается вместе с указанием в скобках концентрации "с" соединения и используемого растворителя.- 14016939 Для получения оптически чистых энантиомеров соответствующую рацемическую смесь подвергают препаративной хроматографии при использовании неподвижной хиральной фазы (колонка ChiralpakAD-H, 25021 мм, 5 мм), используя в качестве подвижной фазы: либо СО 2/2-пропанол (70%/30%), с расходом 60 мл/мин при давлении 100 бар; либо смесь изогексан/этанол (70/30) с 0,3% ТФУК и с расходом 120 мл/мин. После элюирования и выпаривания выделяют каждый энантиомер, химическую чистоту и энантиомерную чистоту которого определяют известными специалисту в данной области аналитическими методами. Таблица 1 Соединения согласно данному изобретению составляют объект фармакологических тестов, позволяющих определять их ингибирующее действие на фермент VEGFR-3. Определение тирозинкиназной активности VEGFR-3 методом твердофазного иммуноферментного анализа (ELISA). Ферментативную активность NEGFR-3 оценивали согласно тесту ELISA путем измерения интенстивности фосфорилирования субстрата поли-Glu-Tyr. Действие продуктов количественно определяли по концентрации, которая снижает полную активность фермента на 50% (IC50). Для определения IC50,продукт разводили в ДМСО с получением серии концентраций от 3 нМ до 1000 нМ. Непосредственно до осуществления теста, 125 мкл субстрата поли-Glu-Tyr (250 мкг/мл в PBS 1 (забуференном фосфатом физиологическом растворе 1) без Са 2+, без Mg2+, без бикарбоната натрия) помещали в каждую лунку планшета ELISA (например, планшет ELISA из набора SIGMA для анализа протеинтирозинкиназы, номер по каталогу РТК-101). Планшет затем полностью покрывали адгезивом и инкубировали в течение ночи при температуре 37 С. На следующий день лунки опустошали путем переворачивания, промывали путем добавления 300 мкл буферного раствора (PBS + 0,05% Tween 20) и высушивали путем нового инкубирования планшета в течение 2 ч при температуре 37 С. В каждую лунку вносили 90 мкл реакционной смеси. Эта смесь содержит буфер для киназы 1X, дополненный 30 мкМ АТФ и ингибитора в желательной концентрации. Затем добавляли 20 мкл VEGFR-3-TK (Cell signaling, номер по каталогу 7790),предварительно разведенного в буфере для киназы без АТФ (за исключением лунок отрицательного контроля, куда добавляли 20 мкл буфера без фермента). Планшеты затем инкубировали при несильном встряхивании при комнатной температуре в течение 30 мин. После 3 промывок с помощью буферного раствора (300 мкл на лунку за промывку) в каждую лунку добавляли 100 мкл антитела антифосфотирозин-HRP (1/30000) и снова планшеты инкубировали в течение 30 мин при комнатной температуре при несильном встряхивании. После 3 промывок с помощью буферного раствора (300 мкл на лунку за промывку) определяли фосфорилирование субстрата путем добавления 100 мкл на лунку субстратаOPD, 1 пастилка OPD и 1 пастилка мочевины в 20 мл воды (получение перед самым употреблением и в отсутствие света). После инкубации в течение 7 мин при комнатной температуре и в отсутствие света реакцию прекращали путем добавления 100 мкл 1,25 М (2,5 н.) H2SO4 на лунку и определяли поглощение при 492 нм. Полную активность оценивали по различию оптической плотности, получаемой в случае образцов, инкубированных в присутствии (стимулированных) и в отсутствие (не стимулированных)VEGFR-3. Соединения согласно изобретению имеют IC50 ниже 10 мкМ, для большинства ниже 1 мкМ. В качестве примеров, IC50 некоторых соединений таблицы 1 указаны в нижеприводимой табл. 2. Таблица 2 Следовательно, обнаружено, что соединения согласно изобретению обладают ингибирующей активностью в отношении фермента VEGFR-3; таким образом, они могут быть использованы для получения лекарственных средств, в частности лекарственных средств, ингибирующих VEGFR-3. Так, согласно другому из его аспектов, объектом изобретения являются лекарственные средства,- 19016939 включающие соединение формулы (I) или аддитивную соль этого последнего с фармацевтически приемлемой кислотой или фармацевтически приемлемым основанием, или еще гидрат или сольват, а также энантиомер или диастереоизомер, включая туда их смесь, соединения формулы (I). Другой аспект изобретения включает ассоциацию между по меньшей мере одним соединением согласно данному изобретению и по меньшей мере одним химиотерапевтическим агентом. В самом деле, соединения согласно настоящему изобретению могут быть использованы индивидуально или в виде смеси с по меньшей мере одним химиотерапевтическим агентом, который может быть выбран из алкилирующих агентов,интеркалирующих агентов,антимикроканальцевых агентов,антимитотических агентов,антиметаболических агентов,антипролиферативных агентов,антибиотиков,иммуномодуляторов,противовоспалительных средств,ингибиторов киназ,антиангиогенных агентов,антиваскулярных агентов,эстрогенных и андрогенных гормонов и пролекарств вышеуказанных агентов или производных. Соединения согласно изобретению также можно комбинировать с обработкой путем облучений. Комбинации соединений согласно изобретению с вышеуказанными химиотерапевтическими агентами и/или облучениями составляют другой объект настоящего изобретения. Введения вышеуказанных химиотерапевтических агентов и/или облучения могут быть осуществлены одновременно, раздельно или последовательно. Лечение адаптируется практикующим врачом в зависимости от подвергаемого лечению заболевания. Эти лекарственные средства находят свое применение в терапии, в частности, в случае лечения и/или профилактики раковых заболеваний и их метастазирований, таких как глиобластомы, множественные миеломы,миелодисплазические синдромы, саркомы Капоши, кожные ангиосаркомы, солидные опухоли, лимфомы,меланомы, раковые заболевания молочной железы, колоректальные раковые заболевания, раковые заболевания легких, включая туда немелкоклеточные раковые заболевания, раковые заболевания поджелудочной железы, раковые заболевания простаты, почечные карциномы, раковые заболевания головы и шеи, рак печени, раковые заболевания яичников, раковые заболевания дыхательного и торакального аппарата, другие опухоли, экспрессируемые VEGFR-3 или причастные к процессу ангиогенеза или лимфангиогенеза; неонкологических пролиферативных заболеваний и патологических ангиогенезов, связанных сVEGFR-3, таких как артрозы, рестенозы, псориаз, гемангиомы, лимфангиомы, глаукомы, гломерулонефриты, диабетические нефропатии, нефросклерозы, тромботические микроангиопатические синдромы,циррозы печени, атеросклерозы, отторжения трансплантата органа, глазные болезни, причастные к процессу ангиогенеза или лимфангиогенеза, такие как диабетическая ретинопатия или дегенерация желтого пятна; или в случае лечения и предотвращения воспаления (хронического или нет), инфекции микроорганизмами и аутоиммунных заболеваний, таких как ревматоидный полиартрит; или в случае лечения редко встречающихся заболеваний, таких как лимфангиолейомиоматоз. Согласно другому из его аспектов настоящее изобретение относится к фармацевтическим компрзициям, включающим, в качестве действующего начала, соединение согласно изобретению. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения согласно изобретению или фармацевтически приемлемой соли, гидрата или сольвата вышеуказанного соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. Вышеуказанные эксципиенты выбирают в зависимости от фармацевтической формы и желательного способа введения, среди обычных эксципиентов, известных специалисту в данной области. В случае фармацевтических композиций согласно настоящему изобретению для перорального, сублингвального, подкожного, внутримышечного, внутривенного, топического, местного, интратрахеального, интраназального, чрескожного или ректального введения, действующее начало вышеприведенной формулы (I), или его возможная соль, возможный сольват или гидрат, может быть введено в стандартной лекарственной форме, в смеси с классическими фармацевтическими эксципиентами, животным и людям для лечения или предотвращения вышеуказанных нарушений или заболеваний. Соответствующие стандартные лекарственные формы включают формы для введения пероральным- 20016939 путем, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы и пероральные растворы или суспензии; формы для сублингвального, буккального, интратрахеального, внутриглазного,интраназального введения, введения путем ингаляции; формы для топического, чрескожного, подкожного, внутримышечного или внутривенного введения; формы для ректального введения и имплантаты. Для топического нанесения можно использовать соединения согласно изобретению в кремах, гелях, мазях или лосьонах. В качестве примера стандартная лекарственная форма соединения согласно изобретению в виде таблетки может включать следующие компоненты, мг: Изобретение согласно другому из его аспектов также относится к способу лечения вышеуказанных патологий, который включает введение пациенту эффективной дозы соединения согласно изобретению или одной из его фармацевтически приемлемых солей или гидратов или сольватов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, отвечающее формуле (I)(1) независимо друг от друга означают либо атом водорода,либо (С 1-С 7)-алкильную группу, где указанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,либо -СО-(С 1-С 7)-алкильную группу или (С 3-С 8)-циклоалкильную группу,либо фенильную группу, возможно замещенную одной или несколькими группами, выбираемыми из (С 1-С 4)-алкильных групп,либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют либо (С 4-С 8)-циклоалкильную группу,либо насыщенную гетероциклическую группу из 4-8 звеньев цепи, включающую гетероатом, выбираемый из атомов О,и причем вышеуказанная гетероциклическая группа может быть конденсирована с фенильной группой;R3 означает либо линейную или разветвленную (С 1-С 7)-алкильную группу или (С 3-С 7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из атомов галогена и гидроксила, алкоксила, -NRR', галогеналкила и -SO2-(C1-C4)-алкила, где R и R' имеют нижеуказанные значения; либо -(СН 2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О,где вышеуказанная гетероциклическая группа возможно замещена оксогруппой; либо -(СН 2)n-гетероарильную группу, где n=0, 1, 2 или 3 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов, выбираемых из атомов азота и кислорода;R и R' независимо друг от друга означают атом водорода или (С 1-С 4)-алкильную группу; в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь. 2. Соединение формулы (I) по п.1, отличающееся тем, что- 21016939 либо атом водорода,либо (С 1-С 7)-алкильную группу, где вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,либо -СО-(С 1-С 7)-алкильную группу или (С 3-С 8)-циклоалкильную группу,либо фенильную группу, возможно замещенную одной или несколькими группами, выбираемыми из (С 1-С 4)-алкоксильных групп,либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют либо (С 4-С 8)-циклоалкильную группу,либо насыщенную гетероциклическую группу из 4-8 звеньев цепи, включающую гетероатом, выбираемый из атомов О,и причем вышеуказанная гетероциклическая группа может быть конденсирована с фенильной группой;R3 означает либо линейную или разветвленную (С 1-С 7)-алкильную группу или (С 3-С 7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксила, алкоксила, -NRR', галогеналкила и -SO2-(C1-C4)-алкила, где R и R' имеют нижеуказанные значения; либо -(СН 2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О,где вышеуказанная гетероциклическая группа возможно замещена оксогруппой; либо -(СН 2)n-гетероарильную группу, где n=0 или 1 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов азота;R и R', каждый, означает линейную или разветвленную (С 1-С 4)-алкильную группу; в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь. 3. Соединение формулы (I) по п.1, отличающееся тем, что(1) независимо друг от друга означают либо атом водорода,либо (С 1-С 7)-алкильную группу, где вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,либо -СО-(С 1-С 7)-алкильную группу или (С 3-С 8)-циклоалкильную группу,либо фенильную группу, возможно замещенную одной или несколькими (С 1-С 4)-алкоксильными группами,либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют: либо (С 4-С 8)-циклоалкильную группу,либо насыщенную гетероциклическую группу из 4-8 звеньев цепи, включающую гетероатом кислорода,и причем вышеуказанная гетероциклическая группа может быть конденсирована с фенильной группой;R3 означает либо линейную или разветвленную (С 1-С 7)-алкильную группу или (С 3-С 7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксила, алкоксила, -NRR', галогеналкила и -SO2-(C1-C4)-алкила, где R и R' имеют нижеуказанные значения; либо -(СН 2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О,где вышеуказанная гетероциклическая группа возможно замещена оксогруппой; либо -(СН 2)n-гетероарильную группу, где n=0 или 1 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов азота;R и R', каждый, означает линейную или разветвленную (С 1-С 4)-алкильную группу; в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь. 4. Соединение формулы (I) по п.1, отличающееся тем, что(1) независимо друг от друга означают- 22016939 либо атом водорода,либо (С 1-С 7)-алкильную группу, где вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,либо -СО-(С 1-С 7)-алкильную группу или (С 3-С 8)-циклоалкильную группу,либо фенильную группу, возможно замещенную одной или несколькими (С 1-С 4)-алкоксильными группами,либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют (С 4-С 8)-циклоалкильную группу;R3 означает либо линейную или разветвленную (С 1-С 7)-алкильную группу или (С 3-С 7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксила, алкоксила, галогеналкила и -SO2-(C1-C4)-алкила; либо -(СН 2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О,где вышеуказанная гетероциклическая группа возможно замещена оксогруппой; либо -(СН 2)n-гетероарильную группу, где n=0 или 1 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов азота;R4 означает (С 1-С 4)-алкильную группу; в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь. 5. Соединение формулы (I) по п.1, отличающееся тем, что(1) независимо друг от друга означают либо атом водорода,либо (С 1-С 7)-алкильную группу, где вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксильной и алкоксильной групп,либо -СО-(С 1-С 7)-алкильную группу или (С 3-С 8)-циклоалкильную группу,либо фенильную группу, возможно замещенную одной или несколькими (С 1-С 4)-алкоксильными группами,либо гетероарильную группу, включающую 5 или 6 звеньев и включающую один или более гетероатомов, выбираемых из азота и серы,(2) или R1 и R2 вместе с атомом углерода, который их несет, образуют: либо (С 4-С 8)-циклоалкильную группу,либо насыщенную гетероциклическую группу из 4-8 звеньев цепи, включающую гетероатом кислорода,и причем вышеуказанная гетероциклическая группа может быть конденсирована с фенильной группой; в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь. 6. Соединение формулы (I) по п.1, отличающееся тем, что R3 означает либо линейную или разветвленную (С 1-С 7)-алкильную группу или (С 3-С 7)-алкильную группу, по меньшей мере 3 атома углерода которой циклизованы, причем вышеуказанная алкильная группа возможно замещена одной или несколькими группами, выбираемыми из гидроксила, алкоксила, -NRR' и галогеналкила, где R и R' имеют нижеуказанные значения; либо -(СН 2)n-гетероциклическую группу, где n=0, 1, 2 или 3 и где гетероциклическая группа включает от 4 до 8 звеньев цепи и содержит по меньшей мере один гетероатом, выбираемый из атомов N и О,где вышеуказанная гетероциклическая группа возможно замещена оксогруппой; либо -(СН 2)n-гетероарильную группу, где n=0 или 1 и где гетероарильная группа включает 5 или 6 звеньев цепи и содержит один или несколько гетероатомов азота;R и R' каждый означает линейную или разветвленную (С 1-С 4)-алкильную группу; в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь. 7. Соединение формулы (I) по п.1, отличающееся тем, что R4 означает (С 1-С 4)-алкильную группу или (С 1-С 4)-алкоксильную группу; в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а также их смесь. 8. Соединение формулы (I) по п.1, отличающееся тем, что R и R' означают, каждый, линейную или разветвленную (С 1-С 4)-алкильную группу; в виде основания или аддитивной соли кислоты, а также его энантиомеры и диастереоизомеры, а- 23016939 также их смесь. 9. Соединение формулы (I) по п.1, отличающееся тем, что его выбирают из 2-амино-1-этил-7-(3-гидрокси-3-метилбут-1-ин-1-ил)-N-метил-4-оксо-1,4-дигидро-1,8-нафтиридин 3-карбоксамида; в которой X означает атом галогена и R3 и R4 имеют значения, как указанные в одном из пп.1-9. 11. Способ получения соединения формулы (I) по любому из пп.1-9, отличающийся тем, что соединение формулы (VII) в которой X означает атом галогена и R3 и R4 имеют значения, как указанные в одном из пп.1-9,вводят в реакцию с соединением формулы (VIII) в которой R1 и R2 имеют значения, как указанные в одном из пп.1-9. 12. Лекарственное средство для лечения заболеваний, в которых принимает участие VEGFR-3, отличающееся тем, что оно включает соединение формулы (I) по любому из пп.1-9, или аддитивную соль этого соединения с фармацевтически приемлемой кислотой, или энантиомер, диастереоизомер соединения формулы (I) или их смесь. 13. Фармацевтическая композиция для лечения заболеваний, в которых принимает участие VEGFR3, отличающаяся тем, что она включает соединение формулы (I) по любому из пп.1-9, или фармацевтически приемлемую соль, или энантиомер, диастереоизомер этого соединения или их смесь, а также по меньшей мере один фармацевтически приемлемый эксципиент. 14. Комбинация по меньшей мере одного соединения формулы (I) по любому из пп.1-9 с по меньшей мере одним химиотерапевтическим агентом, выбираемым из алкилирующих агентов,интеркалирующих агентов,антимикроканальцевых агентов,антимитотических агентов,антиметаболических агентов,антипролиферативных агентов,антибиотиков,иммуномодуляторов,противовоспалительных средств,ингибиторов киназ,антиангиогенных агентов,антиваскулярных агентов,эстрогенных и андрогенных гормонов,для получения лекарственного средства для применения в лечении любого заболевания, в котором принимает участие VEGFR-3. 15. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства, предназначенного для лечения любого заболевания, в котором принимает участие VEGFR-3. 16. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства, предназначенного для лечения и/или профилактики раковых заболеваний и их метастазирований. 17. Применение соединения формулы (I) по п.16 для получения лекарственного средства, предназначенного для лечения и/или профилактики глиобластом, множественных миелом, миелодисплазических синдромов, сарком Капоши, кожных ангиосарком, солидных опухолей, лимфом, меланом, раковых заболеваний молочной железы, колоректальных раковых заболеваний, раковых заболеваний легких,включая туда немелкоклеточные раковые заболевания, раковых заболеваний поджелудочной железы,раковых заболеваний простаты, почечных карцином, раковых заболеваний головы и шеи, рака печени,раковых заболеваний яичников, раковых заболеваний дыхательного и торакального аппарата, других опухолей, экспрессируемых VEGFR-3 или причастных к процессу ангиогенеза или лимфангиогенеза.- 26016939 18. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства, предназначенного для лечения и/или профилактики неонкологических пролиферативных заболеваний и патологических ангиогенезов, связанных с VEGFR-3. 19. Применение соединения формулы (I) по п.18 для получения лекарственного средства, предназначенного для лечения и/или профилактики заболеваний, выбранных из артрозов, рестенозов, псориаза,гемангиом, лимфангиом, глауком, гломерулонефритов, диабетических нефропатий, нефросклерозов,тромботических микроангиопатических синдромов, циррозов печени, атеросклерозов, отторжений трансплантата органа, глазных болезней, причастных к процессу ангиогенеза или лимфангиогенеза. 20. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства для применения в лечении и/или профилактике хронического или иного воспаления, инфекции микроорганизмами и аутоиммунных заболеваний. 21. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства для применения в лечении и/или профилактике лимфангиолейомиоматоза. 22. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства для применения в лечении и/или профилактике ревматоидного артрита.
МПК / Метки
МПК: A61K 31/435, C07D 471/04
Метки: производные, терапии, получение, 7-алкинил-1,8-нафтиридонов, применение
Код ссылки
<a href="https://eas.patents.su/28-16939-proizvodnye-7-alkinil-18-naftiridonov-ih-poluchenie-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 7-алкинил-1,8-нафтиридонов, их получение и их применение в терапии</a>
Предыдущий патент: Механизм крепления горловины пластиковой бутылки к сливному каналу устройства для ручного розлива пенящихся и/или газированных напитков
Следующий патент: Способ обработки белья пенообразующим раствором в бытовой стиральной машине
Случайный патент: Одноразовый гинекологический инструмент, предназначенный для дилатации полостей тела путем ввода текучей среды












