Производные 4-арилморфолин-3-она, их получение и их применение в терапии
Формула / Реферат
1. Соединение формулы (I)
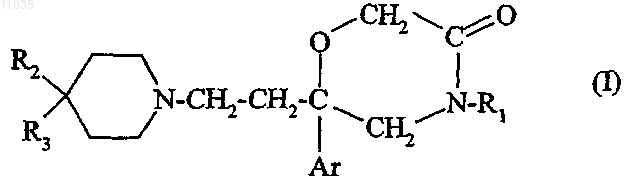
в которой Ar обозначает фенил, дважды замещенный атомом галогена;
R1 обозначает фенил, не замещенный или замещенный один или два раза атомом галогена;
R2 обозначает пиридил; фенил, не замещенный или замещенный один или два раза одним или двумя заместителями, независимо выбранными из атома галогена, (C1-C4)алкила, (C1-C4)алкокси, трифторметильной группы, трифторметоксигруппы;
кроме того, R2 может обозначать гетероциклический радикал, выбранный из азетидина, пирролидина, пиперидина, морфолина, тиоморфолина или пергидроазетидина, если R3 обозначает группу
-CONR11R12;
R3 обозначает группу, выбранную из:
(5) -(CH2)q-OH, в которой q равно 0;
(10) -(CH2)q-NR7COR8, в которой q равно 0;
(11) -(CH2)q-NR7COOR9, в которой q равно 0;
(18) -CONR11R12;
R7 обозначает атом водорода или (C1-C4)алкил;
R8 обозначает атом водорода; (C1-C4)алкил; винил; фенил; бензил; пиридил; (С3-С7)циклоалкил, не замещенный или замещенный одним или несколькими метилами; фурил; тиенил; пирролил; имидазолил;
или R7 и R8 вместе обозначают группу -(CH2)р-;
p равно 3 или 4;
R9 обозначает (C1-C4)алкил или фенил;
или R7 и R9 вместе обозначают группу -(CH2)n-;
n равно 2 или 3;
каждый R11 и R12 независимо обозначает водород или (C1-С4)алкил; кроме того, R12 может обозначать (С3-С7)циклоалкил, (С3-С7)циклоалкилметил, гидрокси, (С1-С4)алкокси, бензил или фенил; или R11 и R12 вместе с атомом азота, с которым они связаны, образуют гетероцикл, выбранный из азетидина, пирролидина, пиперидина, морфолина, тиоморфолина или пергидроазепина;
в форме основания или соли присоединения кислоты, а также в форме гидрата или сольвата.
2. Соединение формулы (I) по п.1, отличающееся тем, что
Ar обозначает 3,4-дихлорфенил или 3,4-дифторфенил;
R1 обозначает фенил, 4-хлорфенил, 4-фторфенил, 3,4-дифторфенил;
R2 обозначает пиридин-2-ил; фенил, 4-хлорфенил, 3-фторфенил, 4-фторфенил, 3,4-дифторфенил, 3-метилфенил, 3,4-диметилфенил, 4-метоксифенил, 3-(трифторметил)фенил, 4-(трифторметил)фенил, 4-(трифторметокси)фенил;
кроме того, R2 может обозначать пиперидин-1-ил, если R3 обозначает группу -CONH2 или группу
-CON(CH3)2;
R3 обозначает группу, выбранную из гидрокси;
в форме основания или соли присоединения кислоты, а также в форме гидрата или сольвата.
3. Соединение по п.1 формулы (I), выбранное из
6-(3,4-дихлорфенил)-6-[2-[4-гидрокси-4-[3-(трифторметил)фенил]пиперидин-1-ил]этил]-4-фенилморфолин-3-он, правовращающий изомер;
N-[1-[2-[2-(3,4-дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4-фенилпиперидин-4-ил]ацетамид, правовращающий изомер;
N-[1-[2-[2-(3,4-дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4-(3-фторфенил)пиперидин-4-ил]ацетамид, правовращающий изомер;
N-[1-[2-[2-(3,4-дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4-(3,4-дифторфенил)пиперидин-4-ил]ацетамид, правовращающий изомер;
N-[1-[2-[2-(3,4-дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4-(4-метилфенил)пиперидин-4-ил]ацетамид, правовращающий изомер;
N-[1-[2-[2-(3,4-дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4-(4-метоксифенил)пиперидин-4-ил]ацетамид, правовращающий изомер;
N-[1-[2-[2-(3,4-дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4-[4-(трифторметокси)фенил]пиперидин-4-ил]ацетамид, правовращающий изомер;
6-(3,4-дихлорфенил)-6-[2-[4-(3-фторфенил)-4-(2-оксопирролидин-1-ил)пиперидин-1-ил]этил]-4-фенилморфолин-3-он, правовращающий изомер;
6-(3,4-дихлорфенил)-6-[2-[4-(3,4-дифторфенил)-4-(2-оксопирролидин-1-ил)пиперидин-1-ил]этил]-4-фенилморфолин-3-он, правовращающий изомер;
6-(3,4-дихлорфенил)-6-[2-[4-(4-метилфенил)-4-(2-оксопирролидин-1-ил)пиперидин-1-ил]этил]-4-фенилморфолин-3-он, правовращающий изомер;
1'-[2-[2-(3,4-дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4'-(4-метилфенил)-1-4'-бипиперидин-2-он, правовращающий изомер;
6-(3,4-дихлорфенил)-6-[2-[4-(3-метилфенил)-4-(2-оксопирролидин-1-ил)пиперидин-1-ил]этил]-4-фенилморфолин-3-он, правовращающий изомер;
6-(3,4-дихлорфенил)-6-[2-[4-(3-фторфенил)-4-(2-оксо-1,3-оксазолидин-3-ил)пиперидин-1-ил]этил]-4-фенилморфолин-3-он, правовращающий изомер;
6-(3,4-дихлорфенил)-6-[2-[4-(4-фторфенил)-4-(2-оксо-1,3-оксазолидин-3-ил)пиперидин-1-ил]этил]-4-фенилморфолин-3-он, правовращающий изомер;
6-(3,4-дихлорфенил)-6-[2-[-4-(3,4-диметилфенил)-4-(2-оксо-1,3-оксазолидин-3-ил)пиперидин-1-ил]этил]-4-фенилморфолин-3-он, правовращающий изомер;
3-[1-[2-[2-(3,4-дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4-фенилпиперидин-4-ил]-1,3-оксазинан-2-он, правовращающий изомер;
3-[1-[2-[2-(3,4-дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4-(4-фторфенил)пиперидин-4-ил]-1,3-оксазинан-2-он, правовращающий изомер;
3-[1-[2-[2-(3,4-дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4-(3,4-дифторфенил)пиперидин-4-ил]-1,3-оксазинан-2-он, правовращающий изомер;
6-(3,4-дихлорфенил)-6-[2-[4-(морфолин-4-илкарбонил)-4-фенилпиперидин-1-ил]этил]-4-фенилморфолин-3-он, правовращающий изомер;
1'-[2-[2-(3,4-дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-1,4'-бипиперидин-4'-карбоксамид, правовращающий изомер;
6-(3,4-дихлорфенил)-6-[2-[4-(3,4-дифторфенил)-4-(2-оксо-1,3-оксазолидин-3-ил)пиперидин-1-ил]этил]-4-фенилморфолин-3-он, правовращающий изомер;
N-[1-[2-[2-(3,4-дифторфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4-фенилпиперидин-4-ил]ацетамид, правовращающий изомер;
N-[1-[2-[2-(3,4-дифторфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4-[4-(трифторметил)фенил]пиперидин-4-ил]ацетамид, правовращающий изомер;
1'-[2-[2-(3,4-дифторфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-1,4'-бипиперидин-4'-карбоксамид, правовращающий изомер;
N-[1-[2-[2-(3,4-дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этил]-4-[3-(трифторметил)фенил]пиперидин-4-ил]ацетамид, правовращающий изомер;
6-(3,4-дихлорфенил)-6-[2-(4-гидрокси-4-пиридин-2-илпиперидин-1-ил)этил]-4-фенилморфолин-3-он, правовращающий изомер;
N-[l-[2-[4-(4-хлорфенил)-2-(3,4-дихлорфенил)-5-оксоморфолин-2-ил]этил]-4-фенилпиперидин-4-ил]ацетамид;
4-(4-хлорфенил)-6-[2-[4-(4-хлорфенил)-4-(2-оксо-1,3-оксазолидин-3-ил)пиперидин-1-ил]этил]-6-(3,4-дихлорфенил)морфолин-3-он;
1'-[2-[4-(4-хлорфенил)-2-(3,4-дихлорфенил)-5-оксоморфолин-2-ил]этил]-N,N-диметил-1,4'-бипиперидин-4'-карбоксамид;
N-[1-[2-[2-(3,4-дихлорфенил)-4-(4-фторфенил)-5-оксоморфолин-2-ил]этил]-4-фенилпиперидин-4-ил]ацетамид;
N-[1-[2-[2-(3,4-дихлорфенил)-4-(4-фторфенил)-5-оксоморфолин-2-ил]этил]-4-(3,4-дифторфенил)пиперидин-4-ил]ацетамид;
1'-[2-[2-(3,4-дихлорфенил)-4-(4-фторфенил)-5-оксоморфолин-2-ил]этил]-N,N-диметил-1,4'-бипиперидин-4'-карбоксамид;
N-[1-[2-[2-(3,4-дихлорфенил)-4-(3,4-дифторфенил)-5-оксоморфолин-2-ил]этил]-4-фенилпиперидин-4-ил]ацетамид;
в форме основания или соли присоединения кислоты, а также в форме гидрата или сольвата.
4. Соединение по п.1 формулы (I), которое является N-[1-[2-[2-(3,4-дихлорфенил)-5-оксофенилморфолин-2-ил]этил]-4-(3-фторфенил)пиперидин-4-ил]ацетамидом, правовращающим изомером; в форме основания или соли присоединения кислоты, а также в форме гидрата или сольвата.
5. Способ получения соединения формулы (I) по любому из пп.1-4, отличающищёя тем, что
вводят во взаимодействие соединение формулы
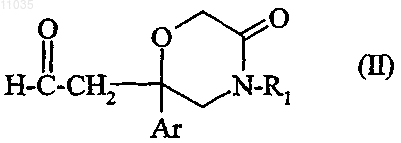
в которой Ar и R1 такие, как определены в отношении соединения формулы (I) в п.1,
и соединение формулы
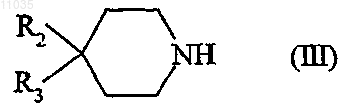
в которой R2 и R3 такие, как определены в отношении соединения формулы (I) в п.1,
в присутствии кислоты в растворителе, затем восстанавливают соль иминия, являющуюся промежуточным продуктом, с помощью восстановителя.
6. Соединение формулы
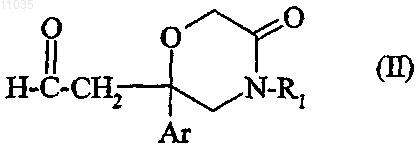
в которой Ar обозначает фенил, двузамещенный атомом галогена;
R1 обозначает фенил, не замещенный или замещенный один или два раза атомом галогена.
7. Соединение формулы
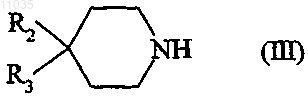
в которой R2 обозначает пиридил; фенил, не замещенный или замещенный один или два раза одним или двумя заместителями, независимо выбранными из атома галогена, (C1-C4)алкила, (С1-С4)алкокси, трифторметильной группы, группы трифторметокси;
R3 обозначает группу (11) -(CH2)q-NR7COOR9;
q равно 0;
R7 и R9 вместе обозначают группу -(CH2)n-;
n равно 2 или 3;
в форме основания или соли присоединения кислоты.
8. Лекарственное средство, отличающееся тем, что содержит соединение формулы (I) по любому из пп.1-4, или соль присоединения этого соединения и фармацевтически приемлемой кислоты, или гидрат, или сольват соединения формулы (I).
9. Фармацевтическая композиция, отличающаяся тем, что содержит соединение формулы (I) по любому из пп.1-4 или фармацевтически приемлемую соль, гидрат или сольват этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
10. Применение соединения формулы (I) по любому изпп.1-4 для получения лекарственного средства, предназначенного для лечения или профилактики синдрома раздражения толстой кишки (IBS); фибромиалгии; невропатических болей; синдрома хронической усталости; мигрени; атипичных болей лица; болезни Крона; язвенных колитов; запоров; диареи; желудочно-пищеводного рефлюкса, гастрита; панкреатита; депрессии; страха, такого как страх вообще, страх, вызванный социальными причинами, фобия и паника; компульсивных навязчивых состояний; тиков; мании; биполярных нарушений; шизофрении; шизоаффективных нарушений; нарушений личности; психотических нарушений, связанных с дефицитом внимания или гиперактивностью; нарушений, связанных с применением препаратов, вызывающих привыкание; гипертрофии простаты.
Текст
011035 Настоящее изобретение относится к новым производным 4-арилморфолин-3-она, их получению и их применению в терапии. Соединения согласно настоящему изобретению обладают очень большим сродством с человеческими рецепторами NK2 нейрокинина А. Нейрокинин A (NRA) относится к группе нейропептидов, называемых тахикининами или нейрокининами, которая включает в себя вещество Р (SP) и нейрокинин В (NKB). Биологическое действие нейрокинина А, также, как других тахикининов, опосредовано специфическими рецепторами семейства рецепторов, содержащих семь трансмембранных доменов, связанных с белками G, которые называют NK1,NK2 и NK3. Рецептор NK2 тахикининов связывает нейрокинин А, тогда как рецепторы NK1 и NK3 связывают соответственно вещество Р и нейрокинин В (Pennefather J.N. et al., Life Sci., 2004, 74, 1445-1463). Рецепторы NK2 тахикининов широко представлены в периферической нервной системе, где они опосредуют разнообразное действие нейрокинина А, специфически и без ограничения в дыхательной системе(бронхостеноз, кашель, воспаление, гиперактивность бронхов.) (Joos G.F., Handb. Exp. Pharm., 2004, 164,491-510, Advenier С. et al., Eur. Respir.J., 1997, 10, 1892-1906), в желудочно-кишечном тракте (воспаление,инфекция, двигательная функция, боль) (Holzer P., Handb Exp. Pharm., 2004, 164, 511-558) и в мочеполовой системе (гиперактивность мочевого пузыря, воспаление, инфекция.) (Kiss S. et al. Neurosci Lett.,2001, 313, 57-60; Warner F.J. et al., Eur. J.Pharmacol., 2002, 438, 171-177). Рецептор NK2 тахикининов также представлен в головном мозге (Hagan R.M. et al., Regul. Pept., 1993, 46, 9-19; Steinberg R. et al., Eur. J.et al., Brain Res., 1990, 506, 59-266), где он опосредует центральное (централизованное) действие нейрокинина А. В качестве примеров многочисленные экспериментальные данные показывают, что блокировка рецептора NK2 тахикининов антагонистом может лечить депрессию (Emonds-Alt, Handb Exp. Pharm., 2004,219-244), а также функциональные нарушения и боли в желудочно-кишечном тракте, такие как синдром раздражения толстой кишки (IBS) (Emonds-Alt, Handb Exp. Pharm., 2004, 219-244; Lecci A. et al., Br. J.Pharmacol., 2004, 141, 1249-1263). Во многих патентах и патентных заявках описаны соединения, обладающие активностью в отношении рецепторов тахикининов. Так международная заявка WO 96/23787 касается соединений формулы в которой, в частности, А может обозначать двухвалентный радикал -O-CH2-CO-;Am, m, Ar1 и Т имеют разные значения. Соединения (А) обладают сродством, главным образом, с рецепторами NK1, NK2 или NK3 тахикининов. Заявка на патент ЕР-А-0776893 относится к соединениям формулы в которой, в частности, D-E может обозначать двухвалентный радикал -O-CH2-CH2-;L, G, Е, А, В, Ra и Rb имеют разные значения. Соединения (В) являются антагонистами одновременно в отношении рецепторов NK1 и рецепторовNK2 тахикининов. Заявка WO 00/34274 касается производных циклогексилпиперидина, которые одновременно являются антагонистами в отношении рецепторов NK1 вещества Р и рецепторов NK2 нейрокинина А. Заявка WO 02/094821 касается производных морфолина, которые одновременно являются антагонистами в отношении человеческих рецепторов NK1 и человеческих рецепторов NK3 тахикининов. В настоящее время обнаружили новые соединения, которые обладают очень высоким сродством с человеческими рецепторами NK2 нейрокинина А и которые являются антагонистами этих рецепторов. Кроме того, соединения согласно настоящему изобретению обладают высокой биодоступностью при пероральном введении и проходят через гематоэнцефалический барьер. Объектом настоящего изобретения являются соединения формулы (I) в которой R7 обозначает атом водорода или (С 1-С 4)алкил;R8 обозначает атом водорода; (C1-C4)алкил; винил; фенил; бензил; пиридил; (С 3-С 7)циклоалкил, не замещенный или замещенный одним или несколькими метилами; фурил; тиенил; пирролил; имидазолил;-1 011035 или R7 и R8 вместе обозначают группу -(CH2)p-;R9 обозначает (C1-C4)алкил или фенил; или R7 и R8 вместе обозначают группу -(CH2)n-;n равно 2 или 3; каждый R11 и R12 независимо обозначает водород или (C1-С 4)алкил; кроме того, R12 может обозначать (С 3-С 7)циклоалкил, (С 3-С 7)циклоалкилметил, гидрокси, (C1-C4)алкокси, бензил или фенил; или R11 иR12 вместе с атомом азота, с которым они связаны, образуют гетероцикл, выбранный из азетидина, пирролидина, пиперидина, морфолина, тиоморфолина или пергидроазепина. Соединения формулы (I) могут содержать один или несколько асимметричных атомов углерода. Таким образом, они могут иметь форму энантиомеров или диастериоизомеров. Эти энантиомеры, диастериоизомеры, а также их смеси, включая рацемические смеси, относятся к изобретению. Соединения формулы (I) могут быть в виде оснований или солей присоединения кислот. Такие соли присоединения относятся к изобретению. Эти соли преимущественно получают с использованием фармацевтически приемлемых кислот, но соли других кислот, пригодных для очистки или выделения соединений формулы (I), также относятся к изобретению. Соединения формулы (I) могут также быть в форме гидратов или сольватов, а именно в виде ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты или сольваты также относятся к изобретению. Под атомом галогена понимают атом брома, хлора, фтора или йода. Под (С 1-С 4)алкилом понимают линейный или разветвленный алкильный радикал, содержащий от одного до четырех атомов углерода, такой как радикал метил, этил, пропил, изопропил, бутил, изобутил,втор-бутил, трет-бутил. Под (C1-C4)алкокси понимают линейный или разветвленный алкоксирадикал, содержащий от одного до четырех атомов углерода, такой как радикал метокси, этокси, пропокси, изопропокси, бутокси,изобутокси, втор-бутокси, трет-бутокси. Под (С 3-С 7)циклоалкилом понимают циклическую алкильную группу, содержащую от трех до семи атомов углерода, такую как циклопропильная, циклобутильная, циклопентильная, циклогексильная или циклогептильная. Из соединений формулы (I), являющихся объектами изобретения, первая группа соединений состоит из соединений, в которыхAr обозначает фенил, дважды замещенный атомом галогена; и/или R1 обозначает фенил, не замещенный или замещенный один или два раза атомом галогена; и/или R2 обозначает пиридил; фенил, не замещенный или замещенный один или два раза одним или двумя заместителями, независимо выбранными из атома галогена, (C1-C4)алкила, (C1-C4)алкокси, трифторметильной группы, трифторметокси группы; кроме того, R2 может обозначать гетероциклический радикал, выбранный из азетидина, пирролидина, пиперидина, морфолина, тиоморфолина или пергидроазетидина, если R3 обозначает группуR7 обозначает атом водорода или (С 1-С 4)алкил;R8 обозначает атом водорода; (C1-C4)алкил; винил; фенил; бензил; пиридил; (С 3-С 7)циклоалкил, не замещенный или замещенный одним или несколькими метилами; фурил; тиенил; пирролил; имидазолил; или R7 и R8 вместе обозначают группу -(CH2)p-;R9 обозначает (С 1-С 4)алкил или фенил; или R7 и R8 вместе обозначают группу -(CH2)n-;n равно 2 или 3; каждый R11 и R12 независимо обозначает водород или (C1-С 4)алкил; кроме того, R12 может обозначать (С 3-С 7)циклоалкил, (С 3-С 7)циклоалкилметил, гидрокси, (C1-C4)алкокси, бензил или фенил; или R11 иR12 вместе с атомом азота, с которым они связаны, образуют гетероцикл, выбранный из азетидина, пирролидина, пиперидина, морфолина, тиоморфолина или пергидроазепина; в форме основания или соли присоединения кислоты, а также в форме гидрата или сольвата. Из соединений этой последней группы можно назвать соединения формулы (I), в которыхAr обозначает фенил, дважды замещенный атомом галогена;R1 обозначает фенил, не замещенный или замещенный один или два раза атомом галогена;R2 обозначает пиридил; фенил, не замещенный или замещенный один или два раза одним или дву-2 011035 мя заместителями, независимо выбранными из атома галогена, (C1-C4)алкила, (C1-C4)алкокси, трифторметильной группы, трифторметоксигруппы; кроме того, R2 может обозначать гетероциклический радикал, выбранный из азетидина, пирролидина, пиперидина, морфолина, тиоморфолина или пергидроазетидина, если R3 обозначает группу(18) -CONR11R12; причем R7, R8, R9, R11 и R12 такие, как определены в отношении соединения формулы (I); в форме основания или соли присоединения кислоты, а также в форме гидрата или сольвата. Из этих последних соединений можно назвать соединения формулы (I), в которых в форме основания или соли присоединения кислоты, а также в форме гидрата или сольвата. Из соединений формулы (I), являющихся объектами изобретения, можно, в частности, назвать следующие соединения: 6-(3,4-дихлорфенил)-6-[2-[4-гидрокси-4-[3-(трифторметил)фенил]пиперидин-1-ил]этил]-4 фенилморфолин-3-он, правовращающий изомер;N-[1-[2-[2-(3,4-дихлорфенил)-4-(3,4-дифторфенил)-5-оксо-морфолин-2-ил]этил]-4 фенилпиперидин-4-ил]ацетамид; в форме основания или соли присоединения кислоты, а также в форме гидрата или сольвата. Следующее соединение: N-[1-[2-[2-(3,4-дихлорфенил)-5-оксо-фенилморфолин-2-ил]этил]-4-(3 фторфенил)пиперидин-4-ил]ацетамид, правовращающий изомер; в виде основания или соли присоединения кислоты, а также в форме гидрата или сольвата является предпочтительным. Далее в тексте под защитной группой Pg подразумевают группу, которая, с одной стороны, обеспечивает защиту реакционноспособной функциональной группы, такой как гидроксигруппа или аминогруппа, в процессе синтеза, а с другой стороны, позволяет регенерировать реакционноспособную функциональную группу в конце синтеза. Примеры защитных групп, а также методы защиты и снятия защиты приведены в "Protective Group in Organic Synthesis", Green et al., 2nd Edition (John WileySons, Inc., NewYork), 1991. Под удаляемой группой далее в тексте понимают группу, которую можно легко отделить от молекулы путем гетеролитического разрыва связи с отделением электронной пары. Эту группу можно также легко заменить другой группой, например, в процессе реакции замещения. Такими удаляемыми группами являются, например, галогены или активированная гидроксигруппа, такая как метансульфонат, бензолсульфонат, р-толуолсульфонат, трифталат, ацетат и т.д. Примеры удаляемых групп, а также информация об их получении приведены в "Advanced in Organic Chemistry" J.March, 3nd Edition, Wiley Interscience, 1985, p.310-316. В соответствии с изобретением можно получать соединения формулы (I) способом, который отличается следующим: вводят во взаимодействие соединение формулы-4 011035 в которой Ar и R1 такие, как определены в отношении соединения формулы (I),и соединение формулы в которой R2 и R3 такие, как определены в отношении соединения формулы (I),в присутствии кислоты в растворителе, затем восстанавливают соль иминия, являющуюся промежуточным продуктом, с помощью восстановителя. Возможно, превращают соединение формулы (I) в одну из его солей присоединения кислоты. Реакцию проводят в присутствии кислоты, такой как уксусная кислота, в растворителе, таком как метанол или дихлорметан, при температуре от комнатной температуры до температуры кипения растворителя и получают in situ промежуточный имин, который восстанавливают химическим путем, используя, например, цианоборгидрат натрия или триацетоксиборгидрат натрия, или каталитическим способом,используя водород и катализатор, такой как палладий на угле или никель Ренея. Возможно, превращают соединение формулы (I) в одну из его солей присоединения кислоты. Реакцию проводят в присутствии растворителя, такого как N,N-диметилформамид, ацетонитрил,дихлорметан, толуол или пропан-2-ол и в присутствии или в отсутствие основания. Если используют основание, его выбирают из органических оснований, таких как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, или из карбонатов или бикарбонатов щелочного металла, таких как карбонат калия, карбонат натрия или бикарбонат натрия. Если основание не используют, реакцию проводят с использованием избыточного количества соединения формулы (III) и в присутствии йодида щелочного металла, такого как йодид калия или йодид натрия. Реакцию проводят при температуре от комнатной температуры до 100 С. Полученные соединения формулы (I) можно впоследствии отделить от реакционной среды и очистить известными способами, например кристаллизацией или хроматографией. Соединения формулы (II) получают путем окисления соединений формулы в которой Ar и R1 такие, как определены в отношении соединения формулы (I). Реакцию окисления проводят с использованием, например, оксалилхлорида, диметилсульфоксида и триэтиламина в растворителе, таком как дихлорметан и при температуре от -78 С до комнатной температуры. Соединения формулы (V) получают путем снятия защиты с соединений формулы в которой Ar и R1 такие, как определены в отношении соединения формулы (I), и Pg1 обозначает известную О-защитную группу, такую, например, как тетрагидропиран-2-ил, бензоил или (С 1-С 4)алкилкарбонил. Снятие защиты проводят традиционными способами, хорошо известными специалисту. Например,если Pg1 обозначает тетрагидропиран-2-ильную группу, снятие защиты осуществляют путем кислотного гидролиза с использованием соляной кислоты в растворителе, таком как простой эфир, метанол или смесь этих растворителей, или с использованием п-толуолсульфоната пиридиния в растворителе, таком как метанол, или с использованием смолы Amberlyst в растворителе, таком как метанол. Реакцию проводят при температуре от комнатной температуры до температуры кипения растворителя. Если Pg1 обозначает бензоильную группу или (C1-C4)алкилкарбонильную группу, снятие защиты осуществляют путем гидролиза в щелочной среде с использованием, например, гидроксида щелочного металла, такого как гидроксид натрия, гидроксид калия или гидроксид лития, в растворителе, таком как вода, метанол, этанол, диоксан или смесь этих растворителей при температуре от 0 С до температуры кипения растворителя. Соединения формулы (VI) получают путем циклизации соединений формулы в которой Ar и R1 такие, как определены в отношении соединения формулы (I), Pg1 такой, как определен в отношении соединения формулы (VI) и Hal обозначает атом галогена, предпочтительно хлора или брома. Реакцию циклизации проводят в присутствии основания, такого как трет-бутила калия, в растворителе, таком как тетрагидрофуран, и при температуре от -60 С до температуры окружающей среды.-5 011035 Соединения формулы (VII) получают путем взаимодействия соединения формулы в которой Ar и R1 такие, как определены в отношении соединения формулы (I), и Pg1 такой, как определен в отношении соединения формулы (VI), с соединением формулы Hal'-CO-CH2-Hal, в которой Hal иHal' обозначают атом галогена, предпочтительно хлора или брома, в присутствии основания, такого как триэтиламин, N-метилморфолин или пиридин. Реакцию проводят в растворителе, таком как дихлорметан, 1,2-дихлорэтан, тетрагидрофуран, диоксан или N,N-диметилформамид при температуре от -70 С до температуры окружающей среды. Соединения формулы (VIII) получают путем взаимодействия соединений формулы в которой Ar и R1 такие, как определены в отношении соединения формулы (I), и Pg1 такой, как определен в отношении соединения формулы (VI),с соединением формулы в которой R1 такой, как определен в отношении соединения формулы (I),в присутствии дипивалоата меди (II) в соответствии со способами арилирования, описанными в Tetrahedron, 1997, 53, (12), 4137-4144; Tetrahedron Letters, 1996, 37 (19), 3295-3298; Tetrahedron 1998, 54, 43134318. Соединения формулы (IX) известны и их получают способами, описанными в WO 96/23787 или вWO 00/58292. Соединения формулы (X) получают из триарилвисмутана формулы в которой R1 такой, как определен в отношении соединения формулы (I),известными способами, такими как описаны в Synthetic Communications, 1996, 26, (24), 4569-4575 или в источниках, указанных выше в отношении арилирования. Соединения формулы (XI) являются коммерческими или их получают способами, описанными вSynthetic Communications, 1996, 26(24), 4569-4575. Соединения формулы (III) являются известными или их получают известными способами, описанными в ЕР-0428434, ЕР-0512901, ЕР-0515240, WO 96/23787, WO 02/094821 и WO 03/104225. Соединения формулы (III) обычно получают в защищенной форме на атоме азота пиперидина; после стадии снятия защиты получают целевые соединения формулы (III). В частном случае получают соединения формулы (III), в которой R3 обозначает группу -(CH2)qNR7COR8, в которой R7 и R8 вместе обозначают группу -(CH2)p- в соответствии с нижеследующей схемойI, на которой Pg2 обозначает N-защитную группу, такую как бензил, бензилокарбонил или третбутилоксикарбонил, Hal обозначает атом галогена, предпочтительно хлора и R2, причем q и p являются такими, как определены в отношении соединения формулы (I). На стадии а 1 схемы I вводят во взаимодействие соединение формулы (XII) и соединение формулы(XIV) в присутствии основания, такого как триэтиламин, в растворителе, таком как ацетонитрил или дихлорметан, и при температуре от 0 С до комнатной температуры для получения соединения формулы(XVI). Соединение формулы (XVI) можно также путем взаимодействия получить на стадии b1 соединения формулы (XIII) и соединения формулы (XV) в присутствии сильной кислоты, такой как серная кислота, в растворителе и при температуре от 0 до 5 С. На стадии с 1 циклизацию соединения формулы (XVI) до получения соединения формулы (XVII) проводят в присутствии основания, такого как гидрат натрия в растворителе, таком как N,Nдиметилформамид, и при температуре от комнатной температуры до 60 С. Защиту с соединения формулы (XVII) снимают известными способами на стадии d1 для получения целевых соединений формулы (III). Получают соединения формулы (III), в которой R3 обозначает группу -(CH2)q-NR7COR9, в которойR7 и R9 вместе обозначают группу -(CH2)n- в соответствии с нижеследующей схемой II, на которой Pg2 обозначает N-защитную группу, такую как определена выше, Hal обозначает атом галогена, предпочтительно хлора, причем R2, q и n являются такими, как определены в отношении соединения формулы (I). На стадии а 2 схемы II вводят во взаимодействие соединение формулы (XVIII) и соединение формулы (XX) в присутствии основания, такого как триэтиламин, в растворителе, таком как дихлорметан или 1,2-дихлорэтан, и при температуре от 0 С до комнатной температуры для получения соединения формулы (XXII). Соединение формулы (XXII) можно также получить на стадии b2 путем взаимодействия соединения формулы (XIX) и соединения формулы (XXI) в растворителе, таком как 1,2-дихлорэтан, и при температуре кипения растворителя. Соединение формулы (XIX) получают путем воздействия азида натрия на хлорид соответствующей кислоты методом, описанным в Organic Syntheses, 51, 48-52. На стадии с 2 циклизацию соединения формулы (XXII) до получения соединения формулы (XXIII) проводят в присутствии основания, такого как гидрид натрия в растворителе, таком как N,Nдиметилформамид, и при температуре от комнатной температуры до 60 С. Защиту с соединения формулы (XXIII) снимают известными способами на стадии d2 для получения целевого соединения формулы (III). Получают соединения формулы (III), в которой R3 обозначает группу -(CH2)q-NR7CONR11R12, в которой R7 и R12 вместе обозначают группу -(CH2)m- в соответствии с нижеследующей схемой III, на которой Pg2 обозначает N-защитную группу, такую как определена выше, Hal обозначает атом галогена,предпочтительно хлора, причем R2, q и m являются такими, как определены в отношении соединения формулы (I). Схема III-8 011035 На стадии a3 схемы III вводят во взаимодействие соединение формулы (XIX) и соединение формулы (XXIV) в растворителе, таком как 1,2-дихлорэтан, и при температуре от комнатной температуры до температуры кипения растворителя. На стадии b3 циклизацию соединения формулы (XXV) до получения соединения формулы (XXVI) проводят в присутствии основания, такого как гидрид натрия в растворителе, таком как N,Nдиметилформамид, и при температуре от комнатной температуры до 60 С. Защиту с соединения формулы (XXVI) снимают на стадии с 3 известными способами на стадии с 3 для получения целевых соединений формулы (III). Соединения формулы (IV) получают путем взаимодействия соединения формулы (V) и соединения формулы в которой Y обозначает метильную, фенильную, толуольную или трифторметильную группу в присутствии основания, такого как триэтиламин, N,N-диизопропилэтиламин или пиридин в растворителе, таком как дихлорметан или толуол, и при температуре от -20 С до температуры кипения растворителя. В соответствии с другим аспектом объектом изобретения также являются соединения формул (II) и некоторые соединения формулы (III). Эти соединения используют в качестве промежуточных продуктов при синтезе соединений формулы (I). Таким образом, объектом изобретения являются соединения формулы в которой Ar обозначает фенил, двузамещенный атомом галогена; R1 обозначает фенил, не замещенный или замещенный один или два раза атомом галогена. Объектом изобретения также являются соединения формулы в которой R2 обозначает пиридил; фенил, не замещенный или замещенный один или два раза одним или двумя заместителями, независимо выбранными из атома галогена, (С 1-С 4)алкила, (С 1-С 4)алкокси, трифторметильной группы, группы трифторметокси;R7 и R8 вместе обозначают группу -(CH2)n-;n равно 2 или 3; в форме основания или соли присоединения кислоты. Разложение рацемических смесей соединений формулы (I) позволяет выделять энантиомеры. Тем не менее предпочтительно проводить разделение рацемических смесей соединений формулы(IX) методами, описанными в WO 96/23787 и в WO 00/58292. Следующие примеры описывают получение ряда соединений согласно изобретению. Эти примеры не имеют ограничительного характера и просто иллюстрируют изобретение. Номера соединений, приведенных в примерах, соответствуют номерам в нижеследующей таблице, которая иллюстрирует химические структуры и физические свойства ряда соединений согласно изобретению. В приготовлениях и примерах используют следующие сокращения. Простой эфир: простой диэтиловый эфир Простой изоэфир: простой диизопропиловый эфирEb: температура кипения ВЭЖХ: высокоэффективная жидкостная хроматография Двуоксид кремния Н: гель двуоксида кремния 60 Н, выпускаемый фирмой Merck (DARMSTAD). Буферный раствор pH 2: раствор 16,66 г KHSO4 и 32,32 г K2SO4 в 1 л воды. Спектры ядерного магнитного резонанса протона (ЯМР 1 Н) зарегистрированы при 200 МГц вDMSO-d6. Химические сдвигивыражены в миллионных долях (м.д.). Для интерпретации спектров используют следующие аббревиатуры: с - синглет, д - дублет, т - триплет, к - квадриплет, м - массив, мт мультиплет, с.уш. - уширенный синглет, ддр - развязанный дублет. Соединения согласно изобретению анализируют комбинированным методом ЖХ/УФ/МС (жидкостная хроматография/УФ-детекция/масс-спектрометрия). Измеряют молекулярный пик (МН+) и время удерживания (tr) в минутах. Используют колонку Symmetry C18, 2,150 мм, 3,5 мкм, при 30 С, расход 0,4 мл/мин. Элюент имеет следующий состав: Растворитель А: 0,005% трифторуксусной кислоты (TFA) в воде, pH 3,15; Растворитель В: 0,005% TFA в ацетонитриле. Градиент: УФ-детекцию проводят при =210 нМ и масс-детекцию в режиме положительной химической ионизации ESI. Приготовления 1. Приготовление соединений формулы (X). Приготовление 1.1. бис-(Ацетато)трифенилвисмут. В раствор 100 г трифенилвисмутана в 720 мл смеси DCM/THF (70/30 об./об.) вводят по каплям при КТ 56,6 мл 32%-го раствора перуксусной кислоты в уксусной кислоте и перемешивают в течение 2 ч при ТА. В реакционную среду вводят 200 мл простого эфира, образовавшийся осадок отжимают и промывают простым эфиром. Получают 72,2 г целевого продукта. Приготовление 1.2. бис-(Ацетато)три(4-хлорфенил)висмут. А) Три(4-хлорфенил)висмутан. В смесь 2,54 г магнезия, покрытого THF, вводят по каплям и при ТА раствор 20 г 1-бром-4 хлорбензола в 150 мл THF и нагревают с обратным холодильником в течение 1 ч. Реакционную смесь охлаждают до 0 С, вводят по каплям раствор 9,9 г BiCl3 в 50 мл THF, нагревают с обратным холодильником в течение 1 ч и перемешивают в течение ночи при КТ. Реакционную смесь выливают в 10%-ный водный раствор NH4Cl, насыщенный NaCl, фильтруют через Celite, экстрагируют с помощью DCM,сушат органическую фазу над MgSO4 и выпаривают растворитель в вакууме. Получают 15,5 г целевого продукта. В) бис-(Ацетато)три(4-хлорфенил)висмут. В смесь 13 г соединения, полученного на предыдущей стадии, в 250 мл уксусной кислоты вводят при ТА 7,1 г пербората натрия моногидрата и перемешивают в течение 1 ч при ТА. Реакционную смесь выливают в 500 мл воды, экстрагируют DCM, промывают органическую фазу водой, сушат органическую фазу над MgSO4 и выпаривают растворитель в вакууме. Получают 15,5 г целевого продукта. Приготовление 1.3. бис-(Ацето)три(4-фторфенил)висмут.A) Три(4-фторфенил)висмутан. В смесь 5,6 г магнезия, покрытого THF, вводят по каплям и при ТА раствор 40 г 1-бром-4 фторбензола в 250 мл THF и нагревают с обратным холодильником в течение 1 ч. Реакционную смесь охлаждают до 0 С, вводят по каплям раствор 21,6 г BiCl3 в 100 мл THF, нагревают с обратным холодильником в течение 1 ч и перемешивают в течение ночи при ТА. Реакционную смесь выливают в 10%-ный водный раствор NH4Cl, насыщенный NaCl, фильтруют через Celite, экстрагируют с помощью DCM,сушат органическую фазу над MgSO4 и выпаривают растворитель в вакууме. Получают 29,75 г целевого продукта.B) бис-(Ацетато)три(4-фторфенил)висмут. В смесь 25 г соединения, полученного на предыдущей стадии, в 100 мл уксусной кислоты вводят 2,3 г пербората натрия тетрагидрата и перемешивают в течение 1 ч при ТА. Реакционную смесь выливают на 1 л воды, экстрагируют DCM, промывают органическую фазу водой, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 27,34 г целевого продукта. Приготовление 1.4. бис-(Ацето)три(3,4-дифторфенил)висмут.A) Три(3,4-дифторфенил)висмутан. В смесь 2,5 г магния, покрытого THF, вводят по каплям и при ТА раствор 20 г 1-бром-3,4 дифторбензола в 150 мл THF и нагревают с обратным холодильником в течение 1 ч. Реакционную смесь охлаждают до 0 С, вводят по каплям раствор 9,8 г BiCl3 в 50 мл THF, нагревают с обратным холодильником в течение 1 ч и перемешивают в течение ночи при КТ. Реакционную смесь выливают в 10%-ный водный раствор NH4Cl, насыщенный NaCl, фильтруют через Celite, экстрагируют с помощью DCM,сушат органическую фазу над MgSO4 и выпаривают растворитель в вакууме. Получают 15,75 г целевого продукта.B) бис-(Ацетато)три(3,4-дифторфенил)висмут. В смесь 13,5 г соединения, полученного на предыдущей стадии, в 250 мл уксусной кислоты вводят 7,4 г пербората натрия моногидрата и перемешивают в течение 1 ч при КТ. Реакционную смесь выливают в 500 мл воды, экстрагируют DCM, промывают органическую фазу водой, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 15,5 г целевого продукта. 2. Приготовление соединений формулы (IX). Приготовление 2.1. 4-Амино-3-(3,4-дихлорфенил)-3-гидроксибутилбензоат, левовращающий изомер. Это соединение получают в соответствии с методикой, описанной на стадиях А, В, С, D, Е и F приготовления 1.1 в WO 00/58292. Приготовление 2.2. 4-Амино-3-(3,4-дифторфенил)-3-гидроксибутилбензоат, левовращающий изомер. Это соединение получают в соответствии с методикой, описанной на стадии А приготовления 1.1 в Это соединение получают в соответствии с методикой, описанной на стадиях А, В, С, D и Е приготовления 1.1 в WO 00/58292. 3. Приготовление соединений формулы (VIII). Приготовление 3.1. 4-Анилино-3-(3,4-дихлорфенил)-3-гидроксибутилбензоат, индивидуальный изомер. А) Дипивалоат меди II. В суспензию 13,6 г CuCO3Cu(OH)2 в 50 мл воды вводят по каплям раствор 18,6 г пивалевой кислоты в 100 мл горячей воды и перемешивают до окончания выделения газа. Реакционную смесь отжимают и осадок промывают четыре раза водой. Осадок обрабатывают 300 мл THF, нерастворившееся вещество отфильтровывают и концентрируют фильтрат в вакууме. После высушивания в вакууме получают 7,2 г- 11011035 целевого продукта. В) 4-Анилино-3-(3,4-дихлорфенил)-3-гидроксибутилбензоат, индивидуальный изомер. Смесь 17,7 г соединения, полученного при приготовлении 2.1, 30,7 г соединения, полученного при приготовлении 1.1, и 1,25 г соединения, полученного на предыдущей стадии, в 960 мл DCM, перешивают в течение одной ночи при КТ. Реакционную смесь концентрируют досуха, остаток обрабатывают простым эфиром, нерастворившееся вещество отфильтровывают и фильтрат концентрируют в вакууме. Остаток подвергают хроматографии на силикагеле Н, элюируя DCM. Получают 18,6 г целевого продукта. Приготовление 3.2. 4-Анилино-3-(3,4-дифторфенил)-3-гидроксибутилбензоат, индивидуальный изомер. В смесь 0,5 г соединения, полученного при приготовлении 2.2, и 0,04 г соединения, полученного на стадии А приготовления 3.1, в 40 мл DCM вводят при КТ 0,95 г соединения, полученного при приготовлении 1.1, и перемешивают при КТ в течение 1 ч. Реакционную смесь подкисляют добавлением буфера,имеющего pH 2, нейтрализуют до pH 7 10%-ным раствором Na2CO3, нерастворившееся вещество отфильтровывают, декантируют фильтрат, промывают органическую фазу водой. Сушат над Na2CO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле, элюируя DCM. Получают 0,3 г целевого продукта. Приготовление 3.3. 4-[(4-Хлорфенил)амино]-3-(3,4-дихлорфенил)-3-гидроксибутилбензоат. Смесь 15,5 г соединения, полученного при приготовлении 1.2, 8,3 г соединения, полученного при приготовлении 2.3, и 0,62 г соединения, полученного на стадии А приготовления 3.1, в 750 мл DCM, перешивают в течение 18 ч при КТ. Реакционную смесь концентрируют в вакууме, остаток обрабатываютDCM, нерастворившееся вещество отфильтровывают и фильтрат подвергают хроматографии на силикагеле, элюируя DCM. Получают 4,62 г целевого продукта. Приготовление 3.4. 3-(3,4-Дихлорфенил)-4-[(4-фторфенил)амино]-3-гидроксибутилбензоат. Смесь 10 г соединения, полученного при приготовлении 1.3, 5,78 г соединения, полученного при приготовлении 2.3, и 0,43 г соединения, полученного на стадии А приготовления 3.1, в 500 мл DCM, перешивают в течение 18 ч при КТ. Реакционную смесь концентрируют в вакууме, остаток обрабатываютDCM, нерастворившееся вещество отфильтровывают и фильтрат подвергают хроматографии на силикагеле, элюируя DCM. Получают 5,84 г целевого продукта. Приготовление 3.5. 3-(3,4-Дихлорфенил)-4-[(3,4-дифторфенил)амино]-3-гидроксибутилбензоат. Смесь 15,5 г соединения, полученного при приготовлении 1.4, 8,2 г соединения, полученного при приготовлении 2.3, и 0,62 г соединения, полученного на стадии А приготовления 3.1, в 750 мл DCM, перешивают в течение 18 ч при КТ. Концентрируют в вакууме, остаток обрабатывают DCM, нерастворившееся вещество отфильтровывают и фильтрат подвергают хроматографии на силикагеле, элюируя DCM. Получают 5,42 г целевого продукта. 4. Приготовление соединений формулы (VII). Приготовление 4.1. 4-[(Хлорацетил)(фенил)амино]-3-(3,4-дихлорфенил)-3-гидроксибутилбензоат, левовращающий изомер. В раствор 7,2 г соединения, полученного при приготовлении 3.1, и 1,7 г триэтиламина в 100 млDCM вводят при КТ 1,9 г хлорацетилхлорида и перемешивают при КТ в течение 1 ч. Добавляют 0,19 г хлорацетилхлорида и перемешивают при КТ в течение 1 ч. Реакционную смесь концентрируют в вакууме, остаток экстрагируют при помощи AcOEt, промывают органическую фазу буферным раствором,имеющим pH 2, водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Получают 6,42 г целевого продукта. 20D=-119,9 (с=1; MeOH). Приготовление 4.2. 4-[(Хлорацетил)(фенил)амино]-3-(3,4-дифторфенил)-3-гидроксибутилбензоат,индивидуальный изомер. Охлаждают до 0 С смесь 3,1 г соединения, полученного при приготовлении 3.2, и 0,79 г триэтиламина в 60 мл DCM, вводят по каплям раствор 0,88 г хлорацетилхлорида в 10 мл DCM и перемешивают в течение 2 ч. Реакционную смесь концентрируют в вакууме, остаток экстрагируют при помощи AcOEt,промывают органическую фазу буферным раствором, имеющим pH 2, водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Получают 3,5 г целевого продукта. Приготовление 4.3. 4-[(Хлорацетил)(4-хлорфенил)амино]-3-(3,4-дихлорфенил)-3-гидроксибутилбензоат. В раствор 4,6 г соединения, полученного при приготовлении 3.3, и 1 г триэтиламина в 150 мл DCM вводят 1,34 г хлорацетилхлорида и перемешивают при КТ в течение ночи. Реакционную смесь концентрируют в вакууме, остаток экстрагируют при помощи AcOEt, промывают органическую фазу буферным раствором, имеющим pH 2, водой, насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 5,25 г целевого продукта. Приготовление 4.4. 4-[(Хлорацетил)(4-хлорфенил)(4-фторфенил)амино]-3-(3,4-дихлорфенил)-3-гидроксибутилбензоат. В смесь 8,5 г соединения, полученного при приготовлении 3.4, и 2,64 мл триэтиламина в 150 млDCM вводят 2,6 г хлорацетилхлорида и перемешивают при КТ в течение ночи. Реакционную смесь концентрируют в вакууме, остаток экстрагируют при помощи AcOEt, промывают органическую фазу буферным раствором, имеющим pH 2, водой, насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 9,5 г целевого продукта. Приготовление 4.5. 4-[(Хлорацетил)(3,4-хлордифторфенил)амино]-3-(3,4-дихлорфенил)-3-гидроксибутилбензоат. В смесь 5,4 г соединения, полученного при приготовлении 3.5, и 1,17 мл триэтиламина в 150 млDCM вводят 1,57 г хлорацетилхлорида и перемешивают при КТ в течение ночи. Концентрируют в вакууме, остаток экстрагируют при помощи AcOEt, промывают органическую фазу буферным раствором,имеющим pH 2, водой, насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 6,23 г целевого продукта. 5. Приготовление соединений формулы (VI). Приготовление 5.1. 2-[2-(3,4-Дихлорфенил)-5-оксо-4-фенилморфолин-2-ил]этилбензоат, индивидуальный изомер. Охлаждают до -60 С раствор 16 г соединения, полученного при приготовлении 4.1 в 750 мл THF,вводят 3,54 г трет-бутилата калия, перемешивают при возврате температуры до -30 С, затем перемешивают в течение 30 мин при -30 С. Реакционную смесь выливают в предварительно охлажденный буферный раствор с pH 2, экстрагируют при помощи AcOEt, промывают органическую фазу водой, сушат над Охлаждают до -60 С раствор 3,5 г соединения, полученного при приготовлении 4.2, в 120 мл THF,вводят 1,75 г трет-бутилата калия и перемешивают в течение 1 ч. Реакционную смесь выливают в буферный раствор с pH 2, экстрагируют при помощи AcOEt, промывают органическую фазу водой, сушат надNa2SO4 и выпаривают растворитель в вакууме. Получают целевой продукт, который используют как таковой при приготовлении 6.2. Приготовление 5.3. 2-[4-(4-Хлорфенил)-2-(3,4-дихлорфенил)-5-оксоморфолин-2-ил]этилбензоат. Охлаждают до -60 С раствор 1,28 г трет-бутилата калия в 250 мл THF, затем вводят по каплям раствор 6,2 г соединения, полученного при приготовлении 4.3, в 40 мл THF, перемешивают при возврате температуры до -30 С, затем перемешивают в течение 1 ч при -30 С. Реакционную смесь выливают в предварительно охлажденный буферный раствор с pH 2, экстрагируют при помощи AcOEt, промывают органическую фазу водой, затем насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 5,8 г целевого продукта. Приготовление 5.4. 2-[2-(3,4-Дихлорфенил)-4-(4-фторфенил)-5-оксоморфолин-2-ил]этилбензоат. Охлаждают до -60 С раствор 2 г трет-бутилата калия в 450 мл THF, затем вводят по каплям раствор 9,5 г соединения, полученного при приготовлении 4.4 в 40 мл THF, перемешивают, оставляя температуру подниматься до -30 С, затем перемешивают в течение 1 ч при -30 С. Реакционную смесь выливают в предварительно охлажденный буферный раствор с pH 2, экстрагируют при помощи AcOEt, промывают органическую фазу водой, затем насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 8,4 г целевого продукта. Приготовление 5.5. 2-[2-(3,4-Дихлорфенил)-4-(3,4-дифторфенил)-5-оксоморфолин-2-ил]этил. Охлаждают до -60 С раствор 1,08 г трет-бутилата в 250 мл THF, затем вводят по каплям раствор соединения, полученного при приготовлении 4.5 в 40 мл THF, перемешивают, позволяя температуре подниматься до -30 С, затем перемешивают в течение 1 ч при -30 С. Реакционную смесь выливают в предварительно охлажденный буферный раствор с pH 2, экстрагируют при помощи AcOEt, промывают органическую фазу водой, затем насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 4,78 г целевого продукта. 6. Приготовление соединений формулы (V). Приготовление 6.1. 6-(3,4-Дихлорфенил)-6-(2-гидроксиэтил)-4-фенилморфолин-3-он, правовращающий изомер. В раствор 14,5 г соединения, полученного при приготовлении 5.1, в 100 мл MeOH вводят при КТ 0,74 г гидроксида лития моногидрата и перемешивают при КТ в течение 1 ч. Реакционную среду концентрируют в вакууме, остаток обрабатывают водой, экстрагируют простым эфиром, промывают органическую фазу водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле Н, элюируя DCM, затем градиентом смеси DCM/MeOH до (98,5/1,5; об./об.). Получают 9 г целевого продукта. 20D=+96,6 (c=1; MeOH). Приготовление 6.2. 6-(3,4-Дифторфенил)-6-(2-гидроксиэтил)-4-фенилморфолин-3-он, индивидуальный изомер. В раствор соединения, полученного при приготовлении 5.2, в 30 мл MeOH вводят при КТ 3 мл концентрированного раствора NaOH и перемешивают при КТ в течение 1 ч. Концентрируют в вакууме, остаток обрабатывают водой, экстрагируют AcOEt, промывают органическую фазу водой, сушат надNa2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле Н,элюируя смесью DCM/MeOH (100/1; об./об.). Получают 1,3 г целевого продукта. Приготовление 6.3. 6-(4-Хлорфенил)-6-(3,4-дихлорфенил)-6-(2-гидроксиэтил)морфолин-3-он. В раствор 5,8 г соединения, полученного при приготовлении 5.3, в 75 мл MeOH вводят при КТ 0,48 г гидроксида лития моногидрата и 2 мл воды, затем перемешивают при КТ в течение 3 ч. Реакционную смесь концентрируют в вакууме, остаток обрабатывают водой, экстрагируют эфиром, промывают органическую фазу водой, затем насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 4,7 г целевого продукта. Приготовление 6.4. 6-(3,4-Дихлорфенил)-4-(4-фторфенил)-6-(2-гидроксиэтил)морфолин-3-он. В раствор 8,4 г соединения, полученного при приготовлении 5.4, в 75 мл MeOH вводят 0,72 г гидроксида лития моногидрата и 2 мл воды и перемешивают при КТ в течение 3 ч. Реакционную смесь концентрируют в вакууме, остаток обрабатывают водой, экстрагируют эфиром, промывают органическую фазу водой, затем насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 6,06 г целевого продукта. Приготовление 6.5. 6-(3,4-Дихлорфенил)-4-(3,4-дифторфенил)-6-(2-гидроксиэтил)морфолин-3-он. В раствор 4,75 г соединения, полученного при приготовлении 5.5, в 75 мл MeOH вводят 0,4 г гидроксида лития моногидрата и 2 мл воды, затем перемешивают при КТ в течение 3 ч. Концентрируют в вакууме, остаток обрабатывают водой, экстрагируют эфиром, промывают органическую фазу водой, затем насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 3,8 г целевого продукта. 7. Приготовление соединений формулы (II). Приготовление 7.1. Охлаждают до -60 С раствор 1,6 г соединения, полученного при приготовлении 6.1 и 1,86 мл DMSO в 40 мл DCM, вводят по каплям раствор 1,1 г оксалилхлорида в 20 мл DCM и перемешивают в течение 2 ч при -60 С. Затем вводят 1,4 г триэтиламина и перемешивают при подъеме температуры до КТ. Реакционную смесь промывают раствором HCl 1N, водой, сушат органическую фазу над Na2SO4 и выпаривают растворитель в вакууме. Получают 1,6 г целевого продукта. Приготовление 7.2. Охлаждают до -70 С раствор 1,14 г оксалилхлорида в 20 мл DCM, добавляют по каплям раствор 1,5 г соединения, полученного при приготовлении 6.1, и 2,1 мл DMSO в 40 мл DCM, и перемешивают в течение 3 ч при -70 С. Затем вводят 6,5 г триэтиламина и перемешивают при подъеме температуры до КТ. Реакционную смесь промывают раствором HCl 2N, водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Получают 1,4 г целевого продукта. Приготовление 7.3. Охлаждают до -60 С раствор 2,05 г оксалилхлорида в 80 мл DCM, добавляют по каплям раствор 2,5 мл DMSO в 20 мл DCM, затем по каплям вводят раствор 4,7 г соединения, полученного при приготовлении 6.3, и 3,5 мл DMSO в 40 мл DCM, и перемешивают в течение 1 ч при -60 С. Затем вводят 10,1 мл триэтиламина и перемешивают при подъеме температуры до КТ. Реакционную смесь промывают раствором HCl 1N, 10%-ным раствором Na2CO3, насыщенным раствором HCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле, элюируя DCM, затем градиентом смеси DCM/MeOH от (99/1; об./об.) до (95/5; об./об.). Получают 2,58 г целевого продукта. Приготовление 7.4. Охлаждают до -60 С смесь 2,72 мл оксалилхлорида в 80 мл DCM, добавляют по каплям раствор 3,32 мл DMSO в 20 мл DCM, затем по каплям вводят раствор 6 г соединения, полученного при приготовлении 6.4 и 4,65 мл DMSO в 40 мл DCM, и перемешивают в течение 1 ч на холоде. Затем вводят 13,5 мл триэтиламина и перемешивают при подъеме температуры до КТ. Реакционную смесь промывают раствором HCl 1N, 10%-ным раствором Na2CO3, насыщенным раствором HCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле, элюируя DCM, затем градиентом смеси DCM/MeOH от (99/1; об./об.) до (95/5; об./об.). Получают 3,68 г целевого продукта. Приготовление 7.5. Охлаждают до -60 С раствор 1,65 мл оксалилхлорида в 80 мл DCM, добавляют по каплям раствор 2 мл DMSO в 20 мл DCM, затем по каплям вводят раствор 3,8 г соединения, полученного при приготовлении 6.5, и 2,8 мл DMSO в 40 мл DCM, и перемешивают в течение 1 ч на холоде. Затем вводят 8,15 мл триэтиламина и перемешивают при подъеме температуры до КТ. Реакционную смесь промывают раствором HCl 1N, 10%-ным раствором Na2CO3, насыщенным раствором HCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле, элюируя градиентом смеси DCM /MeOH от (99/1; об./об.) до (95/5; об./об.). Получают 3 г целевого продукта.- 16011035 8. Приготовление соединений формулы (III). Приготовление 8.1. Это соединение получают методом, описанным в ЕР 474561. Приготовление 8.2.A) 1-Бензил-4-(3-фторфенил)пиперидин-4-ол. В суспензию 5,86 г магнезия в 25 мл THF медленно вводят раствор 42,16 г 1-бром-3-фторбензола в 100 мл THF до достижения, затем до поддержания кипения THF и оставляют на 1 ч при кипении и при перемешивании. После охлаждения до КТ вводят по каплям раствор 38 г 1-бензол-4-пиперидинона в 175 мл THF и нагревают с обратным холодильником в течение 1 ч. После охлаждения до КТ реакционную смесь выливают на лед, экстрагируют AcOEt, промывают органическую фазу водой, сушат надNa2SO4 и выпаривают растворитель в вакууме. Получают 38 г целевого продукта после кристаллизации в циклогексане.B) N-[1-Бензил-4-(3-фторфенил)пиперидин-4-ил]ацетамид. В раствор 38 г соединения, полученного на предыдущей стадии, в 152 мл ацетонитрила вводят по каплям и при температуре ниже 30 С 133 мл 95%-го раствора H2SO4, затем перемешивают в течение 3 ч при температуре от 25 до 30 С. Реакционную смесь выливают на лед, подщелачивают добавлением концентрированного раствора NaOH, образовавшийся осадок отжимают и промывают водой. После высушивания получают 42,8 г целевого продукта. С) N-[4-(3-Фторфенил)пиперидин-4-ил]ацетамида формиат. Оставляют на 30 мин при 40 С, затем 1 ч 30 мин при КТ смесь 14 г соединения, полученного на предыдущей стадии, 16,32 г формиата аммония и 2,3 г 10%-го палладия на угле в 100 мл этанола. Катализатор фильтруют и фильтрат концентрируют в вакууме. Получают 12 г целевого продукта. Приготовление 8.3.A) 1-Бензил-4-(3,4-дифторфенил)пиперидин-4-ол. В суспензию 7,55 г магнезия в 50 мл THF вводят по каплям раствор 50 г 1-бром-3,4-дифторбензола в 100 мл THF до достижения, затем до поддержания кипения THF и оставляют на 2 ч при кипячении с обратным холодильником и при перемешивании. После охлаждения до КТ вводят по каплям раствор 49 г 1-бензол-4-пиперидинона в 100 мл THF и перемешивают в течение ночи при КТ. Реакционную смесь выливают в насыщенный раствор NH4Cl, экстрагируют эфиром, органическую фазу сушат над Na2SO4 и выпаривают растворитель в вакууме. Получают 38,3 г целевого продукта после кристаллизации в циклогексане.B) N-[1-Бензил-4-(3,4-дифторфенил)пиперидин-4-ил]ацетамид. В раствор 37 г соединения, полученного на предыдущей стадии, в 140 мл ацетонитрила вводят по каплям и при температуре ниже 30 С 120 мл 95%-го раствора H2SO4, затем перемешивают в течение ночи при КТ. Реакционную смесь выливают на лед, подщелачивают добавлением концентрированного раствора NaOH, экстрагируют DCM, органическую фазу промывают водой, затем концентрированным раствором NaCl, сушат над Na2SO4 и выпаривают растворитель в вакууме. После высушивания получают 42,8 г целевого продукта. С) N-[4-(3,4-Дифторфенил)пиперидин-4-ил]ацетамида формиат. Перемешивают в течение 4 ч при КТ смесь 5 г соединения, полученного на предыдущей стадии,4,65 г формиата аммония и 0,93 г 10%-го палладия на угле в 100 мл EtOH. Катализатор фильтруют и фильтрат концентрируют в вакууме. Получают 4,3 г целевого продукта. Подготовка 8.4.A) 1-Бензил-4-(4-метилфенил)пиперидин-4-ол. Это соединение получают методом, описанным на стадии А) при подготовке 8.3 из 2,6 г магния в 15 мл THF, 15 г 1-бром-4-метилбензола в 100 мл THF и 16,6 г 1-бензилпиперидинона в 100 мл THF. Получают 22,9 целевого продукта.B) N-[1-Бензил-4-(4-метилфенил)пиперидин-4-ил]ацетамид. В раствор 5,4 г соединения, полученного на предыдущей стадии, в 30 мл ацетонитрила вводят по каплям и при температуре ниже 30 С 19 мл 95%-го раствора H2SO4 и перемешивают в течение ночи при КТ. Реакционную смесь выливают на лед, подщелачивают добавлением концентрированного раствораC) N-[4-(4-метилфенил)пиперидин-4-ил]ацетамида формиат. Охлаждают на ледяной бане смесь 3,5 г соединения, полученного на предыдущей стадии и 2 г формиата аммония в 80 мл MeOH, вводят 0,06 г 10%-го палладия на угле и перемешивают в течение ночи при подъеме температуры до КТ. Катализатор фильтруют и фильтрат концентрируют в вакууме. После высушивания получают 1,63 г целевого продукта. Подготовка 8.5.A) 1-Бензил-4-(4-метоксифенил)пиперидин-4-ол. Охлаждают до -78 С раствор 44,8 г 1-бром-4-метоксибензола в 700 мл THF, вводят по каплям 168 мл раствора 1,6 М п-бутиллития в гексане, затем перемешивают в течение 30 мин при -78 С. Затем вводят по каплям раствор 45,3 г 1-бензол-4-пиперидинона в 100 мл THF и перемешивают в течение 2 ч при -78 С. Реакционную смесь выливают в 400 мл насыщенного раствора NH4C1, экстрагируют эфиром,промывают органическую фазу водой, насыщенным раствором NaCl, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 48,6 г целевого продукта после кристаллизации в гексане.B) N-[1-Бензил-4-(4-метоксифенил)пиперидин-4-ил]ацетамид. В раствор 48,6 г соединения, полученного на предыдущей стадии, в 189 мл ацетонитрила вводят по каплям и при температуре ниже 27 С 160 мл 95%-го раствора H2SO4, затем перемешивают в течение 2 ч и оставляют на ночь на холоде. Реакционную смесь выливают на лед, подщелачивают 30%-ным раствором NaOH, образовавшийся осадок отжимают и промывают водой. Получают 49,4 г целевого продукта,который используют как таковой.C) N-[4-(4-Метоксифенил)пиперидин-4-ил]ацетамида формиат. Перемешивают в течение ночи при КТ смесь 2,58 г соединения, полученного на предыдущей стадии, 2,88 г формиата аммония и 1,7 г 10%-го палладия на угле в 60 мл EtOH. Катализатор фильтруют и фильтрат концентрируют в вакууме. Получают 0,7 г целевого продукта. Подготовка 8.6.A) 1-Бензил-4-[4-(трифторметокси)фенил]пиперидин-4-ол. Это соединение получают методом, описанным на стадии А) при подготовке 8.5, из 20 г 1-бром-4(трифторметокси)бензола в 300 мл THF, 89,3 мл раствора 1,6 М n-бутиллития в гексане и 24,1 мл 1 бензил-4-пиперидинона в 500 мл THF. Получают 18,5 г целевого продукта.B) N-[1-Бензил-4-[4-(трифторметокси)фенил]пиперидин-4-ил]ацетамид. В раствор 18,43 г соединения, полученного на предыдущей стадии, в 61 мл ацетонитрила вводят по каплям и при 25 С 120 мл 95%-го раствора H2SO4, затем перемешивают в течение 3 ч. Реакционную смесь выливают на лед, подщелачивают добавлением концентрированного раствора NaOH, экстрагируют при помощи AcOEt, органическую фазу промывают водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Остаток обрабатывают эфиром и образовавшийся осадок отжимают. Получают 9,5 г целевого продукта.C) N-[4-[4-(Трифторметокси)фенил]пиперидин-4-ил]ацетамида формиат. Перемешивают в течение ночи при КТ смесь 2,75 г соединения, полученного на предыдущей стадии, 1,97 г формиата аммония и 1,2 г 10%-го палладия на угле в 50 мл EtOH. Катализатор фильтруют и фильтрат концентрируют в вакууме. Получают 2 г целевого продукта. Приготовление 8.7. 1-[4-(3-Фторфенил)пиперидин-4-ил]пирролидин-2-он. А) 1-Бензил-4-(3-фторфенил)пиперидин-4-амин. Нагревают с обратным холодильником в течение 48 ч смесь 42,5 г соединения, полученного на стадии В подготовки 8.2, и 250 мл раствора HCl 2N. Вводят еще 100 мл раствора HCl 4N и продолжают кипячение с обратным холодильником в течение 72 ч. После охлаждения до КТ реакционную смесь нейтрализуют путем введения концентрированного раствора NaOH, экстрагируют с помощью AcOEt, промывают органическую фазу водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Получают 37 г целевого продукта. В) N-[1-Бензил-4-(3-фторфенил)пиперидин-4-ил]-4-хлорбутанамид. Перемешивают в течение 30 мин при КТ смесь 2,7 г соединения, полученного на предыдущей стадии, и 1,32 г триэтиламина в 100 мл ацетонитрила, затем вводят по каплям 1,34 г 4-хлорбутурилхлорида и перемешивают 2 ч при КТ. Концентрируют в вакууме, остаток обрабатывают водой, экстрагируютAcOEt, сушат органическую фазу над MgSO4 и выпаривают растворитель в вакууме. Получают 3 г целевого продукта. С) 1-[1-Бензил-4-(3-фторфенил)пиперидин-4-ил]пирролидин-2-он. Перемешивают в течение 2 ч при КТ смесь 3 г соединения, полученного на предыдущей стадии, и 0,617 г 60%-го гидрида натрия в масле в 60 мл DMF. В реакционную смесь вводят воду, экстрагируютAcOEt, сушат органическую фазу над Na2SO4 и выпаривают растворитель в вакууме. Получают 2,65 г целевого продукта.D) 1-[4-(3-Фторфенил)пиперидин-4-ил]пирролидин-2-он. Перемешивают в течение ночи при КТ смесь 2,65 г соединения, полученного на предыдущей стадии, 1,43 г формиата аммония и 1,2 г 10%-го палладия на угле в 50 мл EtOH. Катализатор фильтруют и фильтрат концентрируют в вакууме. Остаток обрабатывают 10%-ным раствором Na2CO3, экстрагируютAcOEt, сушат органическую фазу над Na2SO4 и выпаривают растворитель в вакууме. Получают 1,6 г целевого продукта после кристаллизации из эфира. Подготовка 8.8. 1-[4-(3,4-Дифторфенил)пиперидин-4-ил]пирролидин-2-он.A) 1-Бензил-4-(3,4-дифторфенил)пиперидин-4-амин. Кипятят с обратным холодильником в течение 48 ч смесь 14,55 г соединения, полученного на стадии В подготовки 8.3, и 100 мл 8%-го раствора HCl. Реакционную смесь концентрируют в вакууме, остаток обрабатывают простым эфиром и образовавшийся осадок отжимают. Остаток обрабатывают 10%ным раствором Na2CO3, экстрагируют DCM, сушат органическую фазу над Na2SO4 и выпаривают растворитель в вакууме. Получают 10,75 г целевого продукта.B) N-[1-Бензил-4-(3,4-дифторфенил)пиперидин-4-ил]-4-хлорбутанамид. Перемешивают в течение 30 мин при КТ смесь 3,11 г соединения, полученного на предыдущей стадии, и 1,43 г триэтиламина в 50 мл ацетонитрила, затем вводят по каплям 1,16 г 4-хлорбутирилхлорида и перемешивают 5 ч при КТ. Концентрируют в вакууме, остаток экстрагируют AcOEt, органическую фазу промывают водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Получают 3,73 г целевого продукта. С) 1-[1-Бензил-4-(3,4-дифторфенил)пиперидин-4-ил]пирролидин-2-он. Перемешивают в течение 30 мин при КТ смесь 3,73 г соединения, полученного на предыдущей стадии, и 0,73 г 60%-го гидрида натрия в масле в 60 мл DMF. В реакционную смесь вводят воду, экстрагируют AcOEt, сушат органическую фазу над Na2SO4 и выпаривают растворитель в вакууме. Получают 3,7 г целевого продукта в виде масла оранжевого цвета.D) 1-[4-(3,4-Дифторфенил)пиперидин-4-ил]пирролидин-2-он. Перемешивают в течение 4 ч при КТ смесь 3,7 г соединения, полученного на предыдущей стадии,1,9 г формиата аммония и 1,4 г 10%-го палладия на угле в 60 мл MeOH. Катализатор фильтруют, фильтрат концентрируют в вакууме, остаток обрабатывают простым эфиром. Получают 2,5 г целевого продукта. Приготовление 8.9. 1-[4-(4-Метилфенил)пиперидин-4-ил]пирролидин-2-он.A) N-[1-Бензил-4-(4-метилфенил)пиперидин-4-ил]-4-хлорбутанамидхлоргидрат. Охлаждают до 0 С смесь 20 г соединения, полученного на стадии А при подготовке 8.4, и 120,7 мл 4-хлорбутиронитрила, вводят по каплям 50,5 мл 95%-го раствора H2SO4 и перемешивают в течение 2 ч при температуре от 0 до -5 С. Реакционную смесь выливают в воду, подщелачивают до pH 14 добавлением концентрированного раствора NaOH, экстрагируют с помощью DCM, органическую фазу промывают водой, сушат над MgSO4 и частично концентрируют растворитель. Нерастворившееся вещество отфильтровывают, подкисляют фильтрат до pH 1 добавлением раствора 2N-соляной кислоты, перемешивают и отжимают образовавшийся осадок. Получают 9,8 г целевого продукта после высушивания в вакууме.B) 1-[1-Бензил-4-(4-метилфенил)пиперидин-4-ил]пирролидин-2-он. В раствор 1,9 г соединения, полученного на предыдущей стадии (свободное основание), в 60 млDMF вводят при КТ 60%-го 0,396 г гидрида натрия в масле и перемешивают в течение ночи при КТ. В реакционную смесь вводят воду, экстрагируют AcOEt, сушат органическую фазу над Na2SO4 и выпаривают растворитель в вакууме. Получают 1,7 г целевого продукта. С) 1-[4-(4-Метилфенил)пиперидин-4-ил]пирролидин-2-он. Перемешивают в течение 3 ч при КТ смесь 1,7 г соединения, полученного на предыдущей стадии,0,934 г формиата аммония и 0,026 г 10%-го палладия на угле в 100 мл MeOH. Катализатор фильтруют и фильтрат концентрируют в вакууме. Остаток обрабатывают ацетоном, образовавшийся осадок отжимают и промывают его ацетоном. Получают 1,232 г целевого продукта. Приготовление 8.10. 1-[4-(4-Метилфенил)пиперидин-4-ил]пиперидин-2-он.A) N-[1-Бензил-4-(4-метилфенил)пиперидин-4-ил]-5-хлорпентанамидхлоргидрат. Охлаждают до 0 С 6,8 г соединения, полученного на стадии А при приготовлении 8.4, и 50,3 г 5 хлор-п-валеронитрила, быстро вводят 17,16 мл 95%-го раствора H2SO4 и перемешивают в течение 4 ч при температуре от 0 до -5 С. Реакционную смесь выливают в воду, подщелачивают до pH 14 добавлением концентрированного раствора NaOH, экстрагируют с помощью DCM, органическую фазу промывают водой, сушат над MgSO4 и выпаривают растворитель в вакууме. Остаток обрабатывают раствором хлористого водорода в эфире 2N, перемешивают и отжимают образовавшийся осадок. Получают 2 г целевого продукта.B) 1-[1-Бензил-4-(4-метилфенил)пиперидин-4-ил]пиперидин-2-он. В раствор 1 г соединения, полученного на предыдущей стадии (свободное основание), в 30 мл DMF вводят при КТ 0,2 г 60%-го гидрида натрия в масле и перемешивают в течение ночи при КТ. В реакционную смесь вводят воду, экстрагируют с помощью DCM, органическую фазу промывают водой, сушат надNa2SO4 и выпаривают растворитель в вакууме. Остаток обрабатывают простым изоэфиром и образовавшийся осадок отжимают. Получают 0,15 г целевого продукта. С) 1-[4-(4-Метилфенил)пиперидин-4-ил]пиперидин-2-он. Перемешивают в течение ночи при КТ смесь 2 г соединения, полученного на предыдущей стадии,1,04 г формиата аммония и 0,2 9 г 10%-го палладия на угле в 50 мл MeOH. Катализатор фильтруют и фильтрат концентрируют в вакууме. Получают 0,7 г целевого продукта. Приготовление 8.11. 1-[4-(3-Метилфенил)пиперидин-4-ил]пирролидин-2-он. А) 1-Бензил-4-(3-метилфенил)пиперидин-4-ол. Это соединение получают методом, описанным на стадии А при приготовлении 8.3, из 3,4 г магния в 15 мл THF, раствора 20 г 1-бром-3,4-метилбензола в 100 мл THF и раствора 22,13 г 1-бензол-4 пиперидона в 100 мл THF. Получают 26,54 г целевого продукта. В) N-[1-Бензил-4-(3-метилфенил)пиперидин-4-ил]-4-хлорбутанамидхлоргидрат. Это соединение получают методом, описанным на стадии А при приготовлении 8.9, из 24 г соединения, полученного на предыдущей стадии, 14,5 мл 4-хлорбутиронитрила и 60,6 мл 95%-го раствора- 20011035 С) 1-[1-Бензил-4-(3-метилфенил)пиперидин-4-ил]пирролидин-2-он. В раствор 7 г соединения, полученного на предыдущей стадии (свободное основание), в 150 млDMF вводят при КТ 1,56 г 60%-го гидрида натрия в масле и перемешивают в течение ночи при КТ. Реакционную смесь экстрагируют с помощью DCM, органическую фазу промывают водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Получают 6,7 г целевого продукта.D) 1-[4-(3-Метилфенил)пиперидин-4-ил]пирролидин-2-он. Перемешивают в течение ночи при КТ смесь 6,5 г соединения, полученного на предыдущей стадии,3,53 г формиата аммония и 0,1 г 10%-го палладия на угле в 150 мл MeOH. Катализатор фильтруют и фильтрат концентрируют в вакууме, остаток обрабатывают ацетоном и отжимают образовавшийся осадок. Получают 3,5 г целевого продукта. Приготовление 8.12. 3-(4-Фенилпиперидин-4-ил)-1,3-оксазолидин-2-он.A) 1-[(Бензилокси)карбонил]-4-фенилпиперидин-4-карбоновая кислота. Охлаждают до 5 С смесь 151 г р-толуолсульфоната 4-фенилпиперидин-4-карбоновой кислоты и 213 г 30%-го водного раствора NaOH в 500 мл воды. Вводят по каплям раствор 68,2 г бензилхлорформиата в 150 мл ацетона и перемешивают в течение 6 дней при подъеме температуры до КТ. Вводят 150 мл ацетона и выливают реакционную смесь в смесь 200 г концентрированного раствора HCl, 300 мл воды и 300 мл ацетона, предварительно охлажденного на ледяной бане. Отжимают образовавшийся осадок, промывают его водой, потом простым эфиром. Получают 89,7 г целевого продукта.B) Бензил-4-(хлоркарбонил)-4-фенилпиперидин-1-карбоксилат. Нагревают с обратным холодильником до окончания выделения газа смесь 50,89 г соединения, полученного на предыдущей стадии, и 71,4 г тионилхлорида в 400 мл 1,2-дихлорэтана. Реакционную смесь концентрируют в вакууме, остаток обрабатывают ацетоном и выпаривают растворитель в вакууме. Получают 55,3 г целевого продукта в виде масла зеленого цвета. С) Бензол-4-изоцианат-4-фенилпиперидин-1-карбоксилат. Охлаждают до 5 С смесь 55,3 соединения, полученного на предыдущей стадии, в 200 мл ацетона,вводят по каплям раствор 19,5 г азида натрия в 60 мл и перемешивают в течение 2 ч при подъеме температуры до КТ. Концентрируют в вакууме, остаток обрабатывают 5%-ным раствором NaHCO3, экстрагируют толуолом, промывают органическую фазу водой, насыщенным раствором NaCl, сушат над Na2SO4 и концентрируют две трети растворителя в вакууме. Нагревают с обратным холодильником в течение 1 ч остаток толуолового раствора, затем концентрируют в вакууме. Получают 54 г целевого продукта в виде масла оранжевого цвета, которое кристаллизуется.D) Бензил-4-(2-хлорэтокси)карбонил]амино]-4-фенилпиперидин-1-карбоксилат. Нагревают с обратным холодильником в течение 5 ч смесь 3,36 г соединения, полученного на предыдущей стадии, и 8,04 г хлорэтанола в 50 мл 1,2-дихлорэтана и перемешивают в течение ночи при КТ. Концентрируют в вакууме, остаток обрабатывают пентаном, измельчают, отжимают образовавшийся осадок и промывают пентаном. Получают 3,7 г целевого продукта.E) Бензол-4-(2-оксо-1,3-оксазолидин-3-ил)-4-фенилпиперидин-1-карбоксилат. Перемешивают в течение ночи при КТ смесь 3,7 г соединения, полученного на предыдущей стадии,и 0,7 г 60%-го гидрида натрия в масле в 50 мл DMF. Концентрируют в вакууме, остаток обрабатывают буферным раствором с pH 2, экстрагируют AcOEt, органическую фазу промывают водой, сушат надNa2SO4 и выпаривают растворитель в вакууме. Остаток обрабатывают смесью простого изоэфира и пентана, измельчают, отжимают образовавшийся осадок и промывают его простым изоэфиром. Получают 2,7 г целевого продукта.F) 3-(4-Фенилпиперидин-4-ил)-1,3-оксазолидин-2-он. Нагревают до 50 С в течение 1 ч смесь 2,7 г соединения, полученного на предыдущей стадии, 1,34 г формиата аммония и 0,45 г 10%-го палладия на угле в 50 мл EtOH. Катализатор фильтруют и фильтрат концентрируют в вакууме. Получают 1,7 г целевого продукта. Приготовление 8.13. 3-[4-(3-Фторфенил)пиперидин-4-ил]-1,3-оксазолидин-2-онA) 2-Хлорэтил[1-бензил-4-(3-фторфенил)пиперидин-4-ил]карбамат. В раствор 9 г соединения, полученного на стадии А при приготовлении 8.7, и 3,84 г триэтиламина в- 21011035 100 мл 1,2-дихлорэтана вводят при КТ 4,52 г 2-хлорэтилхлорформиата и перемешивают в течение 1 ч при КТ. Концентрируют в вакууме, остаток экстрагируют AcOEt, органическую фазу промывают водой,сушат над Na2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле Н, элюируя смесью DCM/MeOH (100/1; об./об.). Получают 3,2 г целевого продукта.B) 3-[1-Бензил-4-(3-фторфенил)пиперидин-4-ил]-1,3-оксазолидин-2-он. В раствор 3,2 г соединения, полученного на предыдущей стадии, в 30 мл DMF вводят при КТ 0,65 г 60%-го гидрида натрия в масле, перемешивают в течение 1 ч при КТ, затем нагревают в течение 1 ч до 30 С. Концентрируют в вакууме, обрабатывают остаток водой, отжимают образовавшийся осадок и промывают его водой. После высушивания в вакууме получают 2,4 г целевого продукта.C) 3-[4-(3-Фторфенил)пиперидин-4-ил]-1,3-оксазолидин-2-он. Нагревают до 50-60 С в течение 3 ч смесь 2,4 г соединения, полученного на предыдущей стадии,1,28 г формиата аммония и 0,43 г 10%-го палладия на угле в 150 мл EtOH. После охлаждения до ТА катализатор фильтруют и фильтрат концентрируют в вакууме. Получают 1,2 г целевого продукта. Приготовление 18.14. 3-[4-(4-Фторфенил)пиперидин-4-ил]-1,3-оксазолидин-2-он.A) трет-Бутил-бис-(2-хлорэтил)карбамат. В смесь 75 г бис-(2-хлорэтил)аминхлоргидрата и 9,17 г ди-трет-бутилдикарбоната в 1000 мл DCM вводят при КТ и по каплям 61,2 мл триэтиламина и перемешивают в течение ночи при КТ. Концентрируют реакционную смесь в вакууме, остаток экстрагируют эфиром, промывают органическую фазу водой, буферным раствором с pH 2, 5%-ным раствором NaHCO3, насыщенным раствором NaCl, сушат надNa2SO4 и выпаривают растворитель в вакууме. Получают 101 г целевого продукта в виде масла, который используют как таковой.B) трет-Бутил-4-циано-4-(4-фторфенил)пиперидин-1-карбоксилат. В смесь 33,3 г 60%-го гидрида натрия в масле в 200 мл DMSO и 100 мл THF вводят по каплям и при КТ раствор 50 мл 4-фторфенилацетонитрила и 101 г соединения, полученного на предыдущей стадии, в 200 мл THF, перемешивают в течение 2 ч при КТ, потом нагревают с обратным холодильником в течение 1 ч и перемешивают в течение ночи при КТ. Реакционную среду выливают в насыщенный растворNH4Cl, концентрируют THF в вакууме, разбавляют водную фазу водой, экстрагируют эфиром, сушат органическую фазу над Na2SO4 и выпаривают растворитель в вакууме. Полученное масло оранжевого цвета помещают в минимальное количество простого эфира и отжимают образовавшийся кристаллический продукт. Получают 87,6 г целевого продукта.C) 4-(4-Фторфенил)пиперидин-1-карбонитрилхлоргидрат. Нагревают с обратным холодильником в течение 4 ч смесь 87,6 г соединения, полученного на предыдущей стадии, и 33 мл концентрированного раствора HCl в 330 мл MeOH. Концентрируют органическую фазу в вакууме, остаток обрабатывают ацетоном и отжимают образовавшийся кристаллический продукт. Получают 54,71 г целевого продукта.D) 4-(4-Фторфенил)пиперидин-4-карбоновая кислота. Нагревают с обратным холодильником в течение 7 ч смесь 54,71 г соединения, полученного на предыдущей стадии, и 57 г поташа в 360 мл диэтиленгликоля, затем перемешивают в течение ночи при КТ. Объем реакционной смеси доводят до 900 мл добавлением льда, нейтрализуют до pH 7 добавлением концентрированного раствора HCl и перемешивают в течение 2 ч. Остаток отжимают и промывают ацетоном. Получают 31,56 г целевого продукта.E) 1-[(Бензолокси)карбонил]-4-(4-фторфенил)пиперидин-4-карбоновая кислота. В смесь 31,56 г соединения, полученного на предыдущей стадии, и 56,4 г 30%-го раствора NaOH в 320 мл воды вводят 50 мл ацетона, охлаждают на ледяной бане, вводят по каплям 20,12 мл бензилхлорформиата и перемешивают в течение ночи при КТ. Реакционную смесь промывают эфиром, подкисляют водную фазу до pH 1 добавлением концентрированного раствора HCl, экстрагируют AcOEt, органическую фазу промывают водой, насыщенным раствором HCl, сушат над Na2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле Н, элюируя DCM, затем смесьюF) Бензил-4-(хлоркарбонил)-4-(4-фторфенил)пиперидин-1-карбоксилат. В раствор 30,39 г соединения, полученного на предыдущей стадии, в 200 мл 1,2-дихлорэтана вводят 25 мл тионилхлорида, затем нагревают с обратным холодильником в течение 4 ч. Концентрируют в вакууме, остаток обрабатывают DCM и выпаривают растворитель в вакууме. Получают 31,8 г целевого продукта.G) Бензил-4-(4-фторфенил)-4-изоцианатопиперидин-1-карбоксилат. Охлаждают на ледяной бане раствор 31,8 г соединения, полученного на предыдущей стадии, в 200 мл ацетона, вводят по каплям раствор 11,1 г азида натрия в 15 мл воды и перемешивают в течение- 22011035 1 ч при КТ. Концентрируют в вакууме, остаток экстрагируют толуолом, промывают органическую фазу 5%-ным раствором NaHCO3, насыщенным раствором NaCl, сушат над Na2SO4. Нагревают с обратным холодильником в течение 1 ч оставшийся толуольный раствор, затем концентрируют в вакууме. Остаток обрабатывают пентаном и отжимают образовавшийся осадок. Получают 26 г целевого продукта. Н) Бензил-4-(2-хлорэтокси)карбонил]амино]-4-(4-фторфенил)пиперидин-1-карбоксилат. Нагревают с обратным холодильником в течение 4 ч смесь 1,77 г соединения, полученного на предыдущей стадии, и 0,4 г 2-хлорэтанола в 50 мл 1,2-дихлорэтана, затем перемешивают в течение ночи при КТ и концентрируют в вакууме. Получают 2,1 г целевого продукта.I) Бензил-4-(4-фторфенил)-4-(2-оксооксазолидин-3-ил)пиперидин-1-карбоксилат. Перемешивают в течение 2 ч при КТ смесь 2,1 г соединения, полученного на предыдущей стадии, и 0,386 г 60%-го гидрида натрия в масле в 20 мл DMF. Концентрируют в вакууме, остаток обрабатывают буферным раствором с pH 2, экстрагируют AcOEt, органическую фазу промывают водой, сушат надJ) 3-[4-(4-Фторфенил)пиперидин-4-ил]-1,3-оксазолидин-2-он. Перемешивают в течение 1 ч при 40 С смесь 1,5 г соединения, полученного на предыдущей стадии,0,7 г аммония формиата и 0,2 г 10%-го палладия на угле в 20 мл EtOH. Катализатор фильтруют и концентрируют фильтрат в вакууме. Получают 0,9 г целевого продукта. Приготовление 18.15. 3-[4-(3,4-Диметилфенил)пиперидин-4-ил]-1,3-оксазолидин-2-он.A) Бензил[бис-(2-хлорэтил)]амин. На ледяной бане охлаждают смесь 150 г бис-(2-хлорэтил)аминхлоргидрата и 144 г бромида бензила в 1000 мл DMF, вводят по каплям 120 мл триэтиламина, затем перемешивают в течение 5 ч при КТ. Концентрируют в вакууме, остаток обрабатывают водой, экстрагируют простым эфиром, сушат органическую фазу над Na2SO4 и выпаривают растворитель в вакууме. Получают 110 г целевого продукта.B) 1-Бензил-4-(3,4-диметилфенил)пиперидин-4-карбонитрил. В суспензию 5,78 г 60%-го гидрида натрия в масле в 20 мл THF и 10 мл DMSO вводят по каплям раствор 10 г 3,4-диметилфенилацетонитрила в 50 мл DMSO, затем перемешивают в течение 30 мин при КТ. Затем вводят по каплям раствор 14 г соединения, полученного на предыдущей стадии, в 50 млDMSO, перемешивают в течение ночи при КТ. Реакционную среду концентрируют в вакууме, остаток обрабатывают водой, экстрагируют эфиром, сушат органическую фазу над Na2SO4 и выпаривают растворитель в вакууме. Остаток обрабатывают раствором хлористого водорода в эфире (2N), отжимают образовавшийся осадок и промывают его пентаном. Получают 18 г целевого продукта, F=265-267.C) 1-Бензил-4-(3,4-диметилфенил)пиперидин-4-карбоновая кислота. Нагревают с обратным холодильником в течение 24 ч смесь 15 г соединения, полученного на предыдущей стадии, и 11,06 г KOH в таблетках в 100 мл этиленгликоля. После охлаждения до КТ в реакционную смесь вводят воду, промывают водную фазу простым эфиром, нейтрализуют водную фазу до pH 7 добавлением концентрированного раствора HCl и образовавшийся осадок отжимают. Получают 10,6 г целевого продукта.D) 1-Бензил-4-(3,4-диметилфенил)пиперидин-4-карбонилхлорид, хлоргидрат. Нагревают с обратным холодильником в течение 6 ч смесь 10,6 г соединения, полученного на предыдущей стадии, и 8,76 мл тионилхлорида в 100 мл 1,2-дихлорэтана, потом перемешивают в течение ночи при КТ. Концентрируют в вакууме, остаток обрабатывают простым эфиром, образовавшийся осадок отжимают, промывают эфиром и пентаном. Получают 9 г целевого продукта.E) 1-Бензил-4-(3,4-диметилфенил)-4-изоцианатопиперидин. Охлаждают до 0 С раствор 9 г соединения, полученного на предыдущей стадии, и 5,16 мл триэтиламина в 200 мл ацетона, вводят по каплям раствор 3,1 г азида натрия в 15 мл воды и перемешивают при подъеме температуры до КТ. Концентрируют в вакууме, остаток экстрагируют толуолом, промывают органическую фазу водой, сушат над Na2SO4 и нагревают с обратным холодильником в течение 3 ч оставшуюся толуольную фазу. Концентрируют в вакууме и получают 4 г целевого продукта, который используют как таковой.F) 2-Хлорэтил[1-бензил-4-(3,4-диметилфенил)пиперидин-4-ил]карбамат. Нагревают с обратным холодильником в течение 4 ч смесь 4 г соединения, полученного на предыдущей стадии, и 10,05 г 2-хлорэтанола в 50 мл 1,2-дихлорэтана. Концентрируют в вакууме и остаток подвергают хроматографии на силикагеле, элюируя смесью DCM/MeOH (100/5; об./об.). Получают 2 г целевого продукта, который используют как таковой.- 23011035 Перемешивают в течение 2 ч при ТА смесь 2 г соединения, полученного на предыдущей стадии, и 0,4 г 60%-го гидрида натрия в масле в 20 мл DMF. Концентрируют в вакууме, остаток обрабатывают водой, экстрагируют AcOEt, органическую фазу промывают водой, сушат над MgSO4 и выпаривают растворитель в вакууме. Получают 1,4 г целевого продукта. Н) 3-[4-(3,4-Диметилфенил)пиперидин-4-ил]-1,3-оксазолидин-2-он. Перемешивают при 30 С в течение 2 ч смесь 1,4 г соединения, полученного на предыдущей стадии,0,73 г аммония формиата и 0,41 г 10%-го палладия на угле в 30 мл EtOH. Катализатор фильтруют и концентрируют фильтрат в вакууме. Получают 1 г целевого продукта. Приготовление 18.16. 3-(4-Фенилпиперидин-4-ил)-1,3-оксазинан-2-он-формиат.A) Бензил-4-(3-хлорпропокси)карбонил]амино]-4-фенилпиперидин-1-карбоксилат. Нагревают с обратным холодильником в течение 4 ч смесь 4 г соединения, полученного на стадии С при приготовления 8.12, и 5 мл 3-хлор-1-пропанола в 100 мл 1,2-дихлорэтана. Добавляют 5 мл 3-хлор 1-пропанола, затем продолжают кипячение с обратным холодильником в течение 1 ч. Добавляют еще 5 мл 3-хлор-1-пропанола и перемешивают в течение ночи при КТ. Концентрируют в вакууме и получают 4,14 г целевого продукта.B) Бензил-4-(2-оксо-1,3-оксазинан-3-ил)-4-фенилпиперидин-1-карбоксилат. Перемешивают в течение 2 ч при КТ смесь 4,14 г соединения, полученного на предыдущей стадии,и 0,769 г 60%-го гидрида натрия в масле в 50 мл DMF. Концентрируют в вакууме, остаток обрабатывают простым изоэфиром, отжимают образовавшийся осадок. После высушивания в вакууме получают 3,19 г целевого продукта.C) 3-(4-Фенилпиперидин-4-ил)-1,3-оксазинан-2-он-формиат. Перемешивают в течение 3 ч при КТ смесь 3,19 г соединения, полученного на предыдущей стадии,1,53 г аммония формиата и 0,43 г 10%-го палладия на угле в 60 мл EtOH. Катализатор фильтруют и концентрируют фильтрат в вакууме. Получают 1 г целевого продукта. Приготовление 8.17. 3-[4-(4-Фторфенил)пиперидин-4-ил]-1,3-оксазинан-2-он-формиат.G при приготовлении 8.14, и 8 мл 3-хлор-1-пропанола в 20 мл 1,2-дихлорэтана. Реакционную смесь концентрируют в вакууме, остаток обрабатывают пентаном, перемешивают в течение 1 ч и отжимают образовавшийся осадок. Получают 2,5 г целевого продукта после высушивания в вакууме.B) Бензил-(4-фторфенил)-4-(2-оксо-1,3-оксазинан-3-ил)пиперидин-1-карбоксилат. Перемешивают в течение 1 ч при КТ смесь 2,5 г соединения, полученного на предыдущей стадии, и 0,445 г 60%-го гидрида натрия в масле в 20 мл DMF. Концентрируют реакционную смесь в вакууме, остаток обрабатывают буферным раствором с pH 2, экстрагируют AcOEt, органическую фазу промывают водой, сушат над Na2SO4 и растворитель выпаривают в вакууме. Остаток обрабатывают смесью эфира и изопентана, измельчают и отжимают образовавшийся осадок. Получают 1,1 г целевого продукта.C) 3-[4-(4-Фторфенил)пиперидин-4-ил]-1,3-оксазинан-2-он-формиат. Перемешивают в течение 1 ч при КТ смесь 1,1 г соединения, полученного на предыдущей стадии,0,5 г аммония формиата и 0,14 г 10%-го палладия на угле в 20 мл EtOH. Катализатор фильтруют и концентрируют фильтрат в вакууме. Получают 0,7 г целевого продукта. Приготовление 8.18. 3-[4-(3,4-Дифторфенил)пиперидин-4-ил]-1,3-оксазинан-2-он.A) 4-(3,4-Дифторфенил)пиперидин-4-амин. Охлаждают на ледяной бане раствор 33 г соединения, полученного на стадии А при приготовлении 8.8, и 18,42 г формиата аммония в 500 мл MeOH, вводят 0,5 г 10%-го палладия на угле, перемешивают в течение 3 ч при подъеме температуры до КТ, затем нагревают до 40 С в течение 1 ч. Катализатор фильтруют и концентрируют фильтрат в вакууме. Получают 28 г целевого продукта.B) Бензил-4-амино-4-(3,4-дифторфенил)пиперидин-1-карбоксилат. В смесь 27,5 г соединения, полученного на предыдущей стадии, и 57,7 мл триэтиламина в 500 млDCM вводят по каплям и при КТ 22,1 г бензилхлорформиата и перемешивают в течение 1 ч при КТ. Концентрируют реакционную смесь в вакууме, остаток экстрагируют DCM, промывают органическую фазу водой, насыщенным раствором NaCl, сушат над Na2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле, элюируя DCM/MeOH (95/5; об./об.). Получают 11,51 г целевого продукта.C) Бензил-4-(3-хлорпропокси)карбонил]амино]-4-(3,4-дифторфенил)пиперидин-1-карбоксилат. В смесь 5 г соединения, полученного на предыдущей стадии, и 4,42 мл триэтиламина в 100 мл DCM вводят по каплям и при КТ 2,27 г 3-хлорпропилхлорформиата и перемешивают в течение ночи при КТ. Концентрируют реакционную смесь в вакууме, остаток экстрагируют DCM, промывают органическую фазу водой, насыщенным раствором NaCl, сушат над Na2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле Н, элюируя DCM, затем смесью DCM/MeOH (100/2; об./об.). Получают 1,9 г целевого продукта.D) Бензил-(3,4-дифторфенил)-4-(2-оксо-1,3-оксазинан-3-ил)пиперидин-1-карбоксилат. Перемешивают в течение 2 ч при КТ смесь 1,9 г соединения, полученного на предыдущей стадии, и 0,33 г 60%-го гидрида натрия в масле в 30 мл DMF. Концентрируют реакционную смесь в вакууме, остаток обрабатывают эфиром и отжимают образовавшийся осадок. Сушат в вакууме и получают 1,5 г целевого продукта.E) 3-[4-(3,4-Дифторфенил)пиперидин-4-ил]-1,3-оксазинан-2-он. Перемешивают в течение ночи при КТ смесь 1,5 г соединения, полученного на предыдущей стадии,0,66 г аммония формиата и 0,18 г 10%-го палладия на угле в 50 мл EtOH. Катализатор фильтруют и концентрируют фильтрат в вакууме. Получают 0,87 г целевого продукта. Приготовление 8.19. 4-[(4-Фенилпиперидин-4-ил)карбонил]морфолин. Это соединение получают методами, описанными в приготовлении 1.29 в WO 97/10211. Приготовление 8.20. 1,4'-Бипиридин-4'-карбоксамида формиат. А) 1'-Бензил-1,4'-бипиридин-4'-карбоксамид. Это соединение получают методом, описанным на стадии В в приготовлении 3.1 в WO 02/094821. В) 1,4'-Бипиридин-4'-карбоксамида формиат. Выдерживают в течение 4 ч 30 мин смесь 50 г соединения, полученного на предыдущей стадии,31,4 г формиата аммония и 12,5 г 50%-го палладия на угле в 200 мл MeOH. Катализатор фильтруют и концентрируют фильтрат в вакууме. Получают 22,5 г целевого продукта. Приготовление 8.21. 3-[4-(3,4-Дифторфенил)пиперидин-4-ил]-1,3-оксазолидин-2-он.A) Бензил-4-(2-хлорэтокси)карбонил]амино]-4-(3,4-дифторфенил)пиперидин-1-карбоксилат. В раствор 5 г соединения, полученного на стадии В приготовления 8.18, и 4,42 мл триэтиламина в 100 мл DCM вводят по каплям и при КТ 2,06 г 2-хлорэтилхлорформиата и перемешивают в течение ночи при КТ. Концентрируют реакционную смесь в вакууме, остаток экстрагируют DCM, промывают органическую фазу водой, насыщенным раствором NaCl, сушат над Na2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле Н, элюируя DCM, затем смесью DCM/MeOHB) Бензил-4-(3,4-дифторфенил)-4-(2-оксо-1,3-оксазолидин-3-ил)пиперидин-1-карбоксилат. В смесь 1,5 г соединения, полученного на предыдущей стадии, в 50 мл DCM вводят 0,16 г 60%-го гидрида натрия в масле и перемешивают в течение 2 ч при КТ. Концентрируют реакционную смесь в вакууме, остаток обрабатывают эфиром, отжимают образовавшийся осадок и сушат в вакууме. Получают 1,16 г целевого продукта.C) 3-[4-(3,4-Дифторфенил)пиперидин-4-ил]-1,3-оксазолидин-2-он. Перемешивают в течение ночи смесь 1,15 г соединения, полученного на предыдущей стадии, 0,52 г формиата аммония и 0,15 г 10%-го палладия на угле в 60 мл EtOH. Фильтруют катализатор и фильтрат концентрируют в вакууме. Получают 0,73 г целевого продукта.A) 1-Бензил-4-[3-(трифторметил)фенил]пиперидин-4-ол. В смесь 24,5 г 4-гидрокси-4-[3-(трифторметил)фенил]пиперидина (коммерческого) и 27,6 г K2CO3 в 20 мл DMF вводят по каплям и при КТ 17,1 г бромида бензила, затем нагревают до 40 С в течение 2 ч и перемешивают в течение ночи при КТ. Концентрируют реакционную смесь в вакууме, остаток обрабатывают водой, экстрагируют AcOEt, промывают органическую фазу водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Получают 31 г целевого продукта.B) N-[1-Бензил-4-[3-(трифторметил)фенил]пиперидин-4-ил]ацетамида. В раствор 31 г соединения, полученного на предыдущей стадии, в 170 мл ацетонитрила вводят по каплям и при температуре ниже 20 С 88,65 мл 95%-го H2SO4 и перемешивают 6 ч при КТ. Реакционную смесь выливают на лед, нейтрализуют добавлением концентрированного раствора NaOH, отжимают образовавшийся осадок, промывают его водой и сушат его. Получают 17,7 целевого продукта после кристаллизации в пропан-2-оле.C) N-[4-[3-(Трифторметил)фенил]пиперидин-4-ил]ацетамида формиат. Перемешивают в течение ночи при КТ смесь 3 г соединения, полученного на предыдущей стадии,1,5 г формиата аммония и 0,4 г 10%-го палладия на угле в 60 мл MeOH. Фильтруют катализатор и фильтрат концентрируют в вакууме. Получают 3 г целевого продукта. Приготовление 8.23. 4-(Пиридин-2-ил)пиперидин-4-ола формиат.A) 1-Бензил-4-(пиридин-2-ил)пиперидин-4-ол. Охлаждают до -70 С раствор 22,2 г 2-бромпиридина в 100 мл THF, вводят по каплям 87,8 мл nбутиллития и перемешивают 30 мин. Затем вводят по каплям и при -60 С раствор 25,6 г 1-бензил-4 пиперидинона в 100 мл THF и перемешивают в течение ночи при подъеме температуры до КТ. Реакционную смесь выливают в воду, экстрагируют эфиром, промывают органическую фазу водой, сушат надNa2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле Н,элюируя DCM, затем смесью DCM/MeOH от (99/1; об./об.) до (90/10; об./об.). Получают 21,5 г целевого продукта.B) 4-(Пиридин-2-ил)пиперидин-4-ола формиат. Перемешивают в течение ночи при КТ смесь 5 г соединения, полученного на предыдущей стадии,3,5 г формиата аммония и 0,1 г 10%-го палладия на угле в 50 мл MeOH. Фильтруют катализатор и фильтрат концентрируют в вакууме. Получают 3,4 г целевого продукта. Приготовление 8.24. 3-[4-(4-Хлорфенил)пиперидин-4-ил]-1,3-оксазолидин-2-он-хлоргидрат.A) Бензил-4-(4-хлорфенил)пиперидин-1-карбонитрил. В суспензию 9,8 г 60%-го гидрида натрия в масле в 140 мл THF и 60 мл DMSO вводят по каплям и при КТ раствор 11,3 г 4-хлорфенилацетонитрила и 20 г бензил[бис-(2-хлорэтил)]аминобензила в 140 млTHF и 60 мл DMSO, затем нагревают до 70-80 С в течение 2 ч. После охлаждения реакционную смесь выливают на лед, экстрагируют простым эфиром, промывают органическую фазу водой, сушат надNa2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле, элюируя смесью гептана и AcOEt (90/10; об./об.). Получают 19,6 г целевого продукта.B) 1-Бензил-4-(4-хлорфенил)пиперидин-4-карбоновая кислота. Нагревают до 200 С в течение 18 ч смесь 19,6 г соединения, полученного на предыдущей стадии, и 14,15 г KOH в таблетках в 150 мл этиленгликоля. После охлаждения до КТ реакционную смесь выливают на лед, промывают водную фазу простым эфиром, подкисляют водную фазу до pH 6,5 добавлением концентрированного раствора HCl и образовавшийся осадок отжимают, промывают водой, затем ацетоном и сушат его. Получают 19 г целевого продукта. С) 1-Бензил-4-(4-хлорфенил)пиперидин-4-карбонилхлорид, хлоргидрат. Нагревают с обратным холодильником в течение 4 ч смесь 19 г соединения, полученного на предыдущей стадии, и 40,5 мл тионилхлорида, потом перемешивают в течение ночи при КТ. Концентрируют реакционную смесь в вакууме, остаток обрабатывают толуолом и выпаривают растворитель в вакууме.- 26011035 Получают 21 г целевого продукта, который используют как таковой.D) 1-Бензил-4-(4-хлорфенил)-4-изоцианатопиперидин. Охлаждают до 0 С суспензию 20,5 г соединения, полученного на предыдущей стадии, и 13 мл триэтиламина в 200 мл ацетона, вводят по каплям раствор 9,6 г азида натрия в 50 мл воды и перемешивают в течение 30 мин, затем 1 ч при КТ. Концентрируют в вакууме, остаток экстрагируют толуолом, промывают органическую фазу водой, сушат над Na2SO4 и нагревают с обратным холодильником в течение 4 ч толуольную фазу. Перемешивают в течение ночи при КТ, выпаривают растворитель в вакууме и получают 10,5 г целевого продукта, который используют как таковой.E) 2-Хлорэтил[1-бензил-4-(4-хлорфенил)пиперидин-4-ил]карбамат. Нагревают до 80 С в течение 1 ч смесь 10,5 г соединения, полученного на предыдущей стадии, и 20 мл 2-хлорэтанола, затем перемешивают в течение ночи при КТ. Концентрируют в вакууме, экстрагируют остаток AcOEt, промывают органическую фазу водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле, элюируя DCM, затем градиентом смеси DCM/MeOH от (99/1; об./об.) до (90/10; об./об.). Получают 8,3 г целевого продукта.F) 3-[1-Бензил-4-(4-хлорфенил)пиперидин-4-ил]-1,3-оксазолидин-2-он. В раствор 8 г соединения, полученного на предыдущей стадии, в 45 мл DMF вводят порциями и при КТ 1,73 г 60%-го гидрида натрия в масле и нагревают до 50 С в течение 1 ч. Концентрируют в вакууме,остаток обрабатывают водой, экстрагируют AcOEt, органическую фазу промывают водой, сушат надNa2SO4 и выпаривают растворитель в вакууме. Остаток обрабатывают пентаном, измельчают, отжимают образовавшийся осадок и промывают пентаном. Получают 6,2 г целевого продукта.G) 3-[4-(4-Хлорфенил)пиперидин-4-ил]-1,3-оксазолидин-2-она хлоргидрат. Охлаждают до 0 С смесь 6,2 г соединения, полученного на предыдущей стадии, и 2,3 г K2CO3 в 60 мл DCM, вводят по каплям 2,87 г 1-хлорэтилхлорформиата, перемешивают в течение 1 ч на холоде,потом 1 ч при КТ. Фильтруют нерастворившееся вещество и концентрируют фильтрат в вакууме. Остаток обрабатывают 50 мл MeOH и перемешивают в течение ночи при КТ. Концентрируют в вакууме, остаток растворяют в смеси DCM/MeOH, вводят в смесь простого эфира/пентана, образовавшийся осадок фильтруют и промывают простым эфиром. Получают 4,2 г целевого продукта. Приготовление 8.25. Это соединение получают методами, описанными в подготовке 3.1 в WO 02/094821. Пример 1. Соединение 1. 6-(3,4-Дихлорфенил)-6-[2-[4-гидрокси-4-[3-(трифторметил)фенил]пиперидин-4-ил]этил]-4 фенилморфолин-3-он-хлоргидрат, правовращающий изомер. В раствор 0,5 г соединения, полученного при приготовлении 7.1, в 20 мл DCM вводят 0,337 г 4 гидрокси-4-[3-(трифторметил)фенил]пиперидина (коммерческого), затем 0,61 г триацетоксиборогидрида натрия и 0,0085 г уксусной кислоты и перемешивают в течение ночи при КТ. Реакционную смесь подщелачивают 10%-ным раствором Na2CO3, экстрагируют DCM, органическую фазу промывают водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле Н,элюируя DCM, затем градиентом смеси DCM/EtOH до (98/2; об./об.). Полученный продукт обрабатывают хлористым водородом в эфире (2N), концентрируют в вакууме, растворяют остаток в DCM, вводят простой эфир и отжимают образовавшийся осадок. Получают 0,42 г целевого продукта. 20D=+30 (c=0,25; MeOH). Пример 2. Соединение 3. В раствор 0,5 г соединения, полученного при приготовлении 7.1, в 20 мл DCM вводят 0,387 г соединения, полученного при приготовлении 8.2, затем 0,61 г триацетоксиборогидрида натрия и 0,0085 г уксусной кислоты и перемешивают в течение ночи при КТ. Реакционную смесь подщелачивают 10%ным раствором Na2CO3, экстрагируют DCM, органическую фазу промывают водой, сушат над Na2SO4 и- 27011035 выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле Н, элюируяDCM, затем градиентом смеси DCM/MeOH до (97/3; об./об.). Полученный продукт обрабатывают хлористым водородом в эфире (2N), концентрируют в вакууме, растворяют остаток в DCM, вводят простой эфир и отжимают образовавшийся осадок. Получают 0,57 г целевого продукта. 20D=+29,8 (c=0,5; MeOH). 1 Нагревают с обратным холодильником раствор 4,5 г соединения 3 в форме свободного основания в 72 мл ацетонитрила, вводят 0,896 г фумаровой кислоты и продолжают нагревать с обратным холодильником в течение 30 мин. Реакционную смесь охлаждают до КТ и перемешивают в течение 1 ч при КТ. Отжимают образовавшийся кристаллический продукт и сушат в вакууме. Получают 2,3 г целевого продукта в виде фумарата, F=244-245C. 20D=+24,4 (c=0,25; MeOH). Пример 4. Соединение 14. 6-(3,4-Дихлорфенил)-6-[2-[4-(3-фторфенил)-4-(2-оксо-1,3-оксазолидин-3-ил)пиперидин-1-ил]этил]4-фенилморфолин-3-он-хлоргидрат, правовращающий изомер. Перемешивают в течение ночи при КТ смесь 0,5 г соединения, полученного при приготовлении 7.1,0,36 г соединения, полученного при приготовлении 8.13, 0,58 г триацетоксиборогидрида натрия и 0,0085 г уксусной кислоты в 50 мл DCM. Реакционную смесь промывают 10%-ным раствором Na2CO3,органическую фазу промывают водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле Н, элюируя DCM, затем градиентом смеси DCM/MeOH (99/1; об./об.). Полученный продукт растворяют в DCM, добавляют хлористый водород в эфире (2N), отжимают образовавшийся осадок и обрабатывают его эфиром. Получают 0,4 г целевого продукта. 20D=+32,4 (с=0,5; MeOH). 1 Перемешивают в течение ночи при КТ смесь 0,5 г соединения, полученного при приготовлении 7.1,0,36 г соединения, полученного при приготовлении 8.14, 0,61 г триацетоксиборогидрида натрия и 0,0085 г уксусной кислоты в 50 мл DCM. Реакционную смесь промывают 10%-ным раствором Na2CO3,водой, сушат над Na2SO4 и выпаривают растворитель в вакууме. Остаток подвергают хроматографии на силикагеле Н, элюируя DCM, затем смесью DCM/MeOH до (100/3; об./об.). Полученный продукт растворяют в DCM, добавляют хлористый водород в эфире (2N), отжимают образовавшийся осадок и обрабатывают его простым эфиром. Получают 0,56 г целевого продукта. 20D=+31 (c=0,5; MeOH). 1 Н-ЯМР: ДМСО-d6:(ppm): 2,3: мт: 2 Н; 2,4-3,7: м: 12 Н; 4,0-4,75: м: 6 Н; 7,0-7,9: м: 12 Н; 11: се: 1 Н. Нижеследующая таблица иллюстрирует химические структуры и физические свойства нескольких примеров соединений согласно изобретению. В этой таблице в колонке Соль "-" обозначает соединение в форме свободного основания, "HCl" обозначает соединение в форме хлоргидрата и "C4H4O4" обозначает соединение в форме фумарата.
МПК / Метки
МПК: A61P 1/00, C07D 265/10, C07D 413/06, A61P 25/00, A61K 31/537, C07D 413/14
Метки: применение, получение, 4-арилморфолин-3-она, терапии, производные
Код ссылки
<a href="https://eas.patents.su/30-11035-proizvodnye-4-arilmorfolin-3-ona-ih-poluchenie-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 4-арилморфолин-3-она, их получение и их применение в терапии</a>
Предыдущий патент: Соединения карбонилбензоксазина для усиления глутаматергических синаптических ответов
Следующий патент: Фумарат 4-[[4-[[4-(2-цианоэтенил)-2,6-диметилфенил]амино]-2-пиримидинил]амино]бензонитрила
Случайный патент: Горелка с подачей топлива сверху, работающая на твердом топливе, и способ ее применения












