Бициклические арильные аналоги сфингозин 1-фосфата
Номер патента: 24435
Опубликовано: 30.09.2016
Авторы: Лин Эдвард Инь-Шиан, Колдвелл Ричард Д., Гукиан Кевин М., Томас Джермейн, Лю Сяогао, Таверас Артур Г., Кумаравел Гнанасамбандам, Ма Бинь, Чжэн Го Чжу
Формула / Реферат
1. Соединение формул (IIa), (IIIa) или (IIIb)
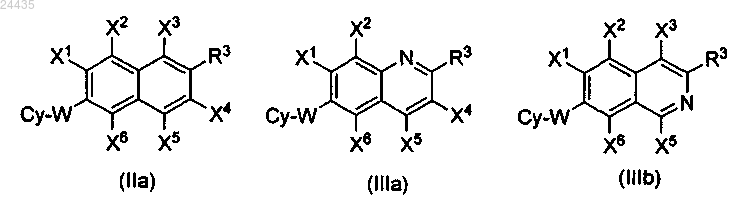
где каждый из X1, X2, X3, X4, X5 и X6, независимо, представляет водород, галоген, C1-C6 алкил, C1-С6 галогеналкил или С3-С6 циклоалкил;
W представляет собой -О-;
Су имеет формулу
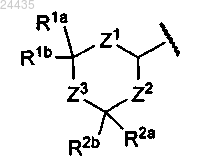
где Z1 представляет собой -СН2-СН2-;
Z2 представляет собой -СН2-;
Z3 представляет собой связь;
один из R1a и R1b представляет собой водород, а другой представляет собой водород, C1-С6 алкил, С1-С4 алкокси, C5-С6 циклоалкил;
или R1a и R1b, взятые вместе, представляют собой С4-С5 алкилен; и
R2a и R2b представляют собой водород;
где R1a или R1b замещен 0-5 заместителями, выбранными из галогена и гидрокси;
R3 представляет собой -L1-J-L2-T1;
L1 представляет собой -C(RfRg)- или связь;
J представляет собой -N(Rf)-[C(RfRg)]n-, где каждый n, независимо, представляет собой целое число от 0 до 5;
или J представляет собой
 где D1 представляет собой
где D1 представляет собой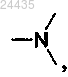 D2 представляет собой
D2 представляет собой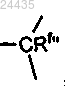 , где Rf" представляет собой водород или C1-С3 алкил;
, где Rf" представляет собой водород или C1-С3 алкил;D2 представляет собой -[(C(Rf'Rg')]k- и
D4 представляет собой -[(C(Rf'Rg')]m-;
где Rf' и Rg', каждый независимо, представляет собой водород или C1-С3 алкил;
k представляет собой 1 или 2 и
m представляет собой 0, 1, 2 или 3;
L2 представляет собой -C(RfRg)- или связь;
Т1 представляет собой -C(O)(ORf), -C(O)N(Rf)S(O)2Rf, тетразолил, -S(O)2ORf, -C(O)NHC(O)-Rf, -N(Rf)S(O)2Rf, -S(O)2NRf, -O-P(O)(ORf)ORf или -P(O)2(ORf);
каждый Rf независимо представляет собой водород, гидрокси, галоген, C1-С6 алкил, C1-С6 галогеналкил, С3-С6 циклоалкил, фенил; где
каждый из циклоалкила и фенила является незамещенным и каждый из алкила необязательно замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена и -ОН;
каждый Rg, независимо, представляет собой водород, гидрокси, галоген, C1-С6 алкил, C1-С6 галогеналкил, С3-С6 циклоалкил, фенил; где каждый из циклоалкила и фенила является незамещенным и каждый из алкила необязательно замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена и -ОН;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, отличающееся тем, что L1 представляет собой -C(RfRg)- и J представляет собой -NRf- или
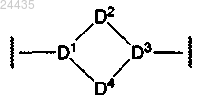 где D3 представляет собой
где D3 представляет собой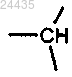 ;
;D2 представляет собой -(СН2)k- и
D4 представляет собой -(СН2)m-;
где k представляет собой 1 или 2 и
m представляет собой 0, 1, 2, или 3;
или его фармацевтически приемлемая соль.
3. Соединение по любому из пп.1, 2, отличающееся тем, что Т1 является -C(O)(ORf), -C(O)N(Rf)S(O2Rf), -O-P(O)(ORf)ORf, -P(O2)(ORf), тетразолилом или -S(O)2ORf, или его фармацевтически приемлемая соль.
4. Соединение по п.1, отличающееся тем, что каждый R1a и R2a представляет собой водород, a R1b представляет собой метил, трифторметил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил, 1,1-диметилпропил, неопентил, циклопентил, н-гексил, циклогексил, метокси, трифторметокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси,
или его фармацевтически приемлемая соль.
5. Соединение, выбранное из группы, состоящей из
1-((6-(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метил)пиперидин-4-карбоновой кислоты;
3-(((6-(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метил)(метил)амино)пропановой кислоты;
1-((6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2-ил)метил)азетидин-3-карбоновой кислоты;
3-((6-(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-N-(фенилсульфонил)пропанамида;
3-((6-(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-2,2-дифторпропановой кислоты;
2,2-дифтор-3-((6-(спиро[5.5]ундекан-3-илокси)нафталин-2-ил)метиламино)пропановой кислоты;
2-{[6-(транс-4-трет-бутилциклогексилокси)-5-трифторметилнафталин-2-илметил]амино}этансульфоновой кислоты;
1-(((6-((транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)метил)циклопропанкарбоновой кислоты;
1-[6-(транс-4-трет-бутилциклогексилокси)хинолин-2-илметил]пирролидин-3-карбоновой кислоты и
1-((6-(4-пропилциклогексилокси)нафталин-2-ил)метил)азетидин-3-карбоновой кислоты;
или его фармацевтически приемлемая соль.
6. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение согласно пп.1-5 или его фармацевтически приемлемую соль.
7. Применение соединения по любому из пп.1-5 или его фармацевтически приемлемой соли для лечения или профилактики патологического состояния, выбранного из группы, состоящей из аутоиммунного заболевания, хронического воспалительного расстройства, ишемически-реперфузионного повреждения, солидной опухоли, метастаз опухолей, заболевания, связанного с ангиогенезом, сосудистого заболевания, болевого состояния, острого вирусного заболевания.
8. Применение по п.7, где болевое состояние представляет собой нейропатическую боль.
9. Применение по п.7, где аутоиммунное заболевание представляет собой увеит, диабет I типа, ревматоидный артрит, воспалительное заболевание кишечника или рассеянный склероз.
10. Применение по п.7, где патологическое состояние представляет собой рассеянный склероз, астму, воспалительную нейропатию, артрит, отторжение при трансплантации, болезнь Крона, язвенный колит, красную волчанку, псориаз, инсулинозависимый или инсулиннезависимый диабет.
11. Применение по п.7, где аутоиммунное заболевание представляет собой рассеянный склероз.
12. Применение по п.7, отличающееся тем, что дополнительно включает использование лекарства, выбранного из группы, состоящей из кортикостероида, бронходилататора, противоастматического средства, противовоспалительного средства, противоревматического средства, иммуносупрессора, антиметаболита, иммуномодулятора, противопсориатического средства и противодиабетического средства.
Текст
БИЦИКЛИЧЕСКИЕ АРИЛЬНЫЕ АНАЛОГИ СФИНГОЗИН 1-ФОСФАТА Представлены соединения формулы (IIа), (IIIа) или (IIIb) где значения X1, X2, X3, X4, X5 и X6, Су, W и R3 указаны в формуле изобретения, которые имеют агонистическую активность при одном или более S1P рецепторах. Соединения являются аналогами сфингозина, которые после фосфорилирования могут вести себя как агонисты на S1P рецепторах.(71)(73) Заявитель и патентовладелец: БАЙОДЖЕН АЙДЕК МА ИНК. (US) Уровень техники Сфингозин 1-фосфат (S1P) является лизофосфолипидным медиатором, который вызывает множество клеточных ответов путем стимулирования пяти членов семейства рецепторов гена эндотелиальной клеточной дифференциации (EDG). Рецепторы EDG являются G-белок сопряженными рецепторами(GPCRs) и после стимуляции распространяют сигналы вторичного мессенджера посредством активации гетеротримерных субъединиц G-белка альфа (G) и бета-гамма (G) димеров. В конечном счете, такаяS1 Р-индуцированная сигнализация приводит к выживанию клеток, повышенной клеточной миграции и,часто, к мутагенезу. Последние разработки агонистов, направленных на S1P рецепторы, обеспечили понимание роли такой сигнальной системы в физиологическом гомеостазе. Например, иммуномодулятор,FTY720 (2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диол), следующий за фосфорилированием, является агонистом при 4 из 5 S1P рецепторов, который, как было выявлено, влияет на S1P рецепторную активность, которая влияет на движение лимфоцитов. Дополнительно, антагонисты рецептора S1P типа 1(S1P1) приводят к протеканию легочного капиллярного эндотелия, что предполагает, что S1P может быть вовлечен в поддержание целостности эндотелиального барьера в некоторых слоях тканей. РецепторыS1P типа 4 (S1P4) экспрессируются, главным образом, в лейкоцитах, и конкретно SIP4 опосредует иммуносупрессорное влияние S1P путем ингибирования пролиферации и секреции эффекторных цитокинов,при усилении секреции супрессорного цитокина IL-10. См., например, Wang, W. et. al., (2005) FASEB J. 19(12): 1731-3, который полностью включен в данную заявку путем ссылки. Рецепторы S1P типа 5 (S1P5) экспрессируются исключительно в олигодендроцитах и олигодендроцитных клетках-предшественниках(ОКП) и являются жизненно важными для клеточной миграции. Стимулирование S1P5 ингибирует миграцию олигодендроцитных клеток-предшественников, которые обычно мигрируют на значительные расстояния во время развития мозга. См., например, Novgorodov A. et al., (2007) FASEB J, 21: 1503-1514,который полностью включен в данную заявку путем ссылки.S1P, как было продемонстрировано, вызывает многие клеточные процессы, включая те из них, которые приводят к агрегации тромбоцитов, клеточной пролиферации, клеточной морфологии, опухолевоклеточной инвазии, хемотаксиса эндотелиальных клеток и ангиогенеза. Из-за этого, S1P рецепторы являются хорошими мишенями для терапевтического применения, такого как заживление ран, ингибирование роста опухолей и аутоиммунные заболевания. Сфингозин-1-фосфат передает сигнал клеткам частично посредством набора G-белок сопряженных рецепторов под названием S1P1, S1P2, S1P3, S1P4, и S1 Р 5 (ранее EDG1, EDG5, EDG3, EDG6 и EDG8).EDG рецепторы являются G-белок сопряженными рецепторами (GPCRs) и после стимуляции распространяют сигналы вторичного мессенджера посредством активации гетеротримерных субъединиц Gбелка альфа (G) и бета-гамма (G) димеров. Данные рецепторы имеют 50-55% идентичность аминокислотных последовательностей и кластер с тремя другими рецепторами (LPA1, LPA2, и LPA3 (ранееEDG2, EDG4 и EDG7) для структурно родственной лизофосфатидной кислоты (LPA). Конформационный сдвиг вызывается G-белок сопряженным рецептором (GPCR), если лиганд связывает данный рецептор, приводя к замещению GDP на GTP на -субъединице связанных G-белков и последующему высвобождению G-белков в цитоплазму. -Субъединица затем диссоциирует из субъединицы и каждая субъединица может затем связываться с эффекторными белками, что активирует вторичные мессенджеры, приводя к клеточному ответу. В конечном счете, GTP на G-белках гидролизует в GDP и субъединицы G-белков повторно ассоциируют друг с другом и затем с рецептором. Амплификация играет главную роль в общем маршруте GPCR. Связывание одного из лигандов с одним рецептором приводит к активации многих G-белков, каждый из которых способен к ассоциации со многими эффекторными белками, что приводит к усиленному клеточному ответу. В общем, соединения могут переключаться от антагонистов к агонистам в зависимости от того, какой из G белков находится ниже рецептора. Если Gq находится ниже, то соединение, направленное на рецептор S1P4, может действовать как антагонист. Возможно, что с другим G-белком (Gj) ниже, соединение-агонист может быть агонистом.S1P рецепторы представляют собой хорошие лекарственные мишени, поскольку индивидуальные рецепторы являются как ткане-, так и ответ-специфичными. Тканеспецифичность S1P рецепторов является желательной, поскольку развитие агониста или антагониста, селективных для одного рецептора,локализует клеточный ответ в тканях, содержащих данный рецептор, ограничивая нежелательные побочные эффекты. Ответ-специфичность S1P рецепторов также является важной, поскольку позволяет развитие агонистов или антагонистов, которые инициируют или подавляют определенные клеточные ответы, не влияя на другие ответы. Например, ответ-специфичность S1P рецепторов может позволить определенную S1P мимикрию, инициирующую агрегацию тромбоцитов, не оказывая влияния на клеточную морфологию. Сфингозин-1-фосфат образуется как метаболит сфингозина в реакции со сфингозин киназой и хранится в избытке в агрегатах тромбоцитов, где присутствуют высокие уровни сфингозин киназы и отсутствует сфингозин лиаза. S1P высвобождается во время агрегации тромбоцитов, накапливается в сыворотке, и также обнаружен в злокачественных асцитах. Обратимый биораспад S1P, наиболее вероятно,происходит посредством гидролиза при помощи эктофосфогидролаз, конкретно сфингозин 1-фосфат фосфогидролазы. Необратимый распад S1P катализируется S1P лиазой, приводя к получению этаноламин фосфата и гексадеканаля. Краткое описание изобретения В настоящее время, существует необходимость в новых, мощных и селективных агентах, которые являются агонистами S1P рецептора, которые имеют повышенную эффективность, селективность и пероральную биодоступность. Дополнительно в данной области существует необходимость в идентификации, а также синтезе и применении таких соединений. В одном аспекте, изобретение относится к соединению формулы (IIa), (IIIa) или (IIIb) где каждый из X1, X2, X3, X4, X5 и X6, независимо, представляет водород, галоген, C1-С 6 алкил, С 1-С 6 галогеналкил или С 3-С 6 циклоалкил;Z3 представляет собой связь; один из R1a и R1b представляет собой водород, а другой представляет собой водород, C1-С 6 алкил,С 1-С 4 алкокси, C5-С 6 циклоалкил; или R1a и R1b, взятые вместе, представляют собой С 4-С 5 алкилен иR2a и R2b представляют собой водород; где R1a или R1b замещен 0-5 заместителями, выбранными из галогена и гидрокси;J представляет собой -N(Rf)-[C(RfR8)]n-, где каждый n, независимо, представляет собой целое число от 0 до 5; или J представляет собой, где Rf представляет собой водород или C1 С 3 алкил,D2 представляет собой -[(C(Rf'Rg')]k- иD4 представляет собой -[(C(Rf'Rg')]m-; где Rf' и Rg', каждый независимо, представляет собой водород или C1-С 3 алкил;N(R )S(O)2Rf, -S(O)2NRf, -O-P(O)(ORf)ORf или -P(O)2(ORf); каждый Rf, независимо, представляет собой водород, гидрокси, галоген, C1-С 6 алкил, C1-С 6 галогеналкил, С 3-С 6 циклоалкил, фенил; где каждый из циклоалкила и фенила является незамещенным и каждый из алкила необязательно замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена и -ОН; каждый Rg, независимо, представляет собой водород, гидрокси, галоген, С 1-С 6 алкил, C1-С 6 галогеналкил, С 3-С 6 циклоалкил, фенил; где каждый из циклоалкила и фенила является незамещенным, и каждый из алкила необязательно замещен 1-5 заместителями, независимо выбранными из группы, состоящей из галогена и -ОН; или его фармацевтически приемлемой соли.m представляет собой 0, 1, 2 или 3. В некоторых условиях Т 1 представляет собой -C(O)(ORf), -C(O)N(Rf)S(O2Rf), -O-P(O)(ORf)ORf,-P(O2)(ORf), тетразолил или -S(O)2ORf. В некоторых условиях каждый R1a и R2a представляет собой водород, a R1b представляет собой метил, трифторметил, этил, пропил, изопропил, н-бутил, изо-бутил, трет-бутил, н-пентил, изопентил, 1,1 диметилпропил, неопентил, циклопентил, н-гексил, циклогексил, метокси, трифторметокси, этокси, нпропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси. Предпочтительными соединениями настоящего изобретения являются соединения, выбранные из группы, состоящей из 1-6-(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метил)пиперидин-4-карбоновой кислоты; 3-6-(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метил)(метил)амино)пропановой кислоты; 1-6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2-ил)метил)азетидин-3 карбоновой кислоты; 3-6-(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-N-(фенилсульфонил)пропанамида; 3-6-(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-2,2-дифторпропановой кислоты; 2,2-дифтор-3-6-(спиро[5.5]ундекан-3-илокси)нафталин-2-ил)метиламино)пропановой кислоты; 2-[6-(транс-4-трет-бутилциклогексилокси)-5-трифторметилнафталин-2-илметил]аминоэтансульфоновой кислоты; 1-6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)метил)циклопропанкарбоновой кислоты; 1-[6-(транс-4-трет-бутилциклогексилокси)хинолин-2-илметил]пирролидин-3-карбоновой кислоты; и 1-6-(4-пропилциклогексилокси)нафталин-2-ил)метил)азетидин-3-карбоновой кислоты; или их фармацевтически приемлемой соли. В другом аспекте фармацевтическая композиция содержит фармацевтически приемлемый носитель и соединение настоящего изобретения, как определено выше. В другом аспекте изобретение касается применения соединения настоящего изобретения, как определено выше, или его фармацевтически приемлемой соли для лечения или профилактики патологического состояния, выбранного из группы, состоящей из аутоиммунного заболевания, хронического воспалительного расстройства, ишемически-реперфузионного повреждения, солидной опухоли, метастаз опухолей, заболевания, связанного с ангиогенезом, сосудистого заболевания, болевого состояния, острого вирусного заболевания. В предпочтительном аспекте болевое состояние представляет собой нейропатическую боль. В еще одном предпочтительном аспекте аутоиммунное заболевание представляет собой увеит, диабет I типа, ревматоидный артрит, воспалительное заболевание кишечника или рассеянный склероз. В следующем предпочтительном аспекте патологическое состояние представляет собой рассеянный склероз, астму, воспалительную нейропатию, артрит, отторжение при трансплантации, болезнь Крона,язвенный колит, красную волчанку, псориаз, инсулинозависимый или инсулиннезависимый диабет. В еще одном предпочтительном аспекте аутоиммунное заболевание представляет собой рассеянный склероз. В другом аспекте применение соединения настоящего изобретения, как определно выше, или его фармацевтически приемлемой соли для лечения или профилактики патологического состояния дополнительно включает использование лекарства, выбранного из группы состоящей из кортикостероида, бронходилататора, противоастматического средства, противовоспалительного средства, противоревматического средства, иммуносупрессора, антиметаболита, иммуномодулятора, противопсориатического средства и противодиабетического средства. Соединения настоящего изобретения проявляют S1P1 агонистическое действие, или S1 Р 1 агонистическое действие и в существенной степени не имеют S1P3 агонистического и антагонистического действия. Соединения настоящего изобретения также проявляют S1P5 антагонистическое действие или S1P5 агонистическое действие. Соединения настоящего изобретения также могут проявлять S1P4 антагонистическое действие илиS1P4 агонистическое действие. Подробное описание одного или более вариантов исполнения изобретения изложено в описании,приведенном ниже. Другие признаки, объекты и преимущества будут очевидны из описания и формулы изобретения. Подробное описание изобретения В данной заявке используют следующие сокращения: S1P, сфингозин-1-фосфат; S1P1-5, S1P рецептор типов 1-5; GPCR, G-белок сопряженный рецептор; ССА, соотношение структура-активность; ГДЭ,ген дифференциации эндотелиальных клеток; ЭАЭ, экспериментальный аутоиммунный энцефаломиелит; ДНО, диабет, не связанный с ожирением; TNF, фактор некроза опухолей альфа; ЛПВ, липопротеин высокой плотности; и RT-ПЦР, ревертазная полимеразная цепная реакция. Значения, перечисленные ниже, для радикалов, заместителей и диапазонов, приведены только для иллюстрации; они не исключают другие определенные значения или другие значения, которые находятся в определенных диапазонах для радикалов и заместителей. Термин "галоген" включает бром, хлор, фтор,и йод. Термин "галоалкил" относится к алкильному радикалу, содержащему как минимум один галогеновый заместитель, неограничивающие примеры включают, не ограничиваясь приведенным, хлорметил,фторэтил, трихлорметил, или трифторметил и т.п. Термин "С 1-С 20 алкил" относится к разветвленной или линейной алкильной группе, имеющей от одного до двадцати атомов углерода. Неограничивающие примеры включают, не ограничиваясь приведенным, метил, этил, н-пропил, изо-пропил, бутил, изо-бутил, втор-бутил, трет-бутил, пентил, гексил, гептил, ороктил и т.п. Термин "(С 1-С 10)алкокси" относится к алкильной группе, присоединенной через атом кислорода. Примерами (С 1-С 10)алкокси могут быть метокси, этокси, пропокси, изопропокси, бутокси, изо-бутокси,втор-бутокси, пентокси, 3-пентокси, или гексилокси и т.п. Термин "(С 3-С 12)циклоалкил" относится к циклической алкильной группе, такой, как, например,циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, или циклооктил и т.п. Термин "фармацевтически приемлемый носитель" включает любой из стандартных фармацевтических носителей, например, фосфатный буферный солевой раствор, гидроксипропил бетациклодекстрины (НО-пропил бета циклодекстрины), воду, эмульсии, такие, как эмульсии типа масло/вода или вода/масло, и различные типы смачивающих агентов. Термин также охватывает любой из агентов, утвержденных регуляторным органом Федерального правительства США или перечисленных в Фармакопее США для применения у животных, включая людей. Термин "фармацевтически приемлемая соль" относится к солям, которые сохраняют биологическую эффективность и свойства описанных соединений и которые не являются биологически или иным образом нежелательными. Во многих случаях, описанные соединения способны образовывать кислотные или основные соли в силу присутствия амино или карбоксильных групп, или групп, аналогичным им. Термин "пролекарство" относится к соединению, которое превращается в физиологических условиях, например, путем сольволиза или метаболически, в соединение, которое является фармацевтически активным. Пролекарство может быть производным соединения настоящего изобретения, которое содержит эфир карбоновой или фосфорной кислоты или амидный фрагмент, которое может быть расщеплено в физиологических условиях. Пролекарство, содержащее такой фрагмент, может быть получено в соответствии с традиционными процедурами, например, путем обработки соединения в соответствии с данным изобретением, содержащим амино, амидо или гидроксильный фрагмент, приемлемым дериватизующим агентом, например галидом карбоновой или фосфорной кислоты, или ангидридом, или путем превращения карбоксильного фрагмента в сложный эфир или амид."Эффективное количество" означает количество, достаточное для получения выбранного эффекта. Например, эффективное количество агониста S1P рецептора представляет собой количество, которое снижает клеточную сигнальную активность S1P рецептора. Описанные соединения могут содержать один или более асимметричных центров в молекуле. В соответствии с данным изобретением любая структура, которая не обозначает стереохимию, должна подразумеваться как охватывающая все различные оптические изомеры (например, диастереомеры и энантиомеры), а также их смеси (такие, как рацемическая смесь). Соединения могут быть изотопно-мечеными соединениями, например соединениями, содержащими различные изотопы водорода, углерода, азота,кислорода, фосфора, фтора, йода или хлора. Описанные соединения могут существовать в таутомерных формах и данное изобретение включает как смеси, так и отдельные индивидуальные таутомеры. Например, следующая структура: подразумевается как представляющая смесь структур"S1P модулирующий агент" относится к соединению или композиции, способным вызывать детектируемые изменения активности S1P рецептора in vivo или in vitro (например, как минимум 10% возрастание или уменьшение S1 Р активности согласно измерениям в данном анализе, таком как биоанализ,описанный в примерах, и известным в данной области. "S1P рецептор" относится ко всем подтипам S1P рецепторов (например, S1P рецепторы S1P1, S1P2, S1P3, S1P4, или S1P5), если не указан конкретный подтип. Специалист в данной области оценит, что описанные соединения, имеющие хиральные центры, могут существовать и быть выделены в необязательно активных и рацемических формах. Должно быть понятно, что описанные соединения охватывают любую рацемическую, необязательно активную или стереоизомерную форму, или их смеси. Из уровня техники известно, каким образом получать такие необязательно активные формы (например, разрешение рацемической формы при помощи методов рекристаллизации, синтез из необязательно-активных исходных материалов, при помощи хирального синтеза, или хроматографического разделения с использованием хиральной неподвижной фазы) и как определять активность в качестве S1P агониста при помощи стандартных тестов, описанных в данной заявке, или при помощи других аналогичных тестов, хорошо известных в данной области. Дополнительно некоторые соединения могут проявлять полиморфизм. Возможное применение агониста S1P рецептора и селективных агонистов рецепторов типа S1P1, в частности, включает, не ограничиваясь приведенным, профилактику или лечение патологического состояния или симптома у млекопитающего. Например, состояние может включать астму, воспалительные нейропатии, артрит, красную волчанку, псориаз, ишемически-реперфузионное повреждение, солидные опухоли, метастазы опухолей, заболевания, связанные с ангиогенезом, сосудистые заболевания, болевые состояния, острые вирусные заболевания, или инсулинозависимый или инсулиннезависимый диабет. Состояние может изменять движение лимфоцитов в качестве способа лечения нейропатической боли,боли, вызванной воспалением (например, если задействованы простагландины) или лечения аутоиммунных патологий, таких как увеит, диабет I типа, ревматоидный артрит, хронические воспалительные расстройства, воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), рассеянный склероз и стенты с лекарственным покрытием. Дополнительное применение может включать лечение дегенеративных заболеваний мозга, заболеваний сердца, раковых заболеваний или гепатита С. См.,например, WO 2005/085295, WO 2004/010987, WO 03/097028, и WO 2006/072562, каждая из которых полностью включена путем ссылки. Класс соединений - агонистов S1P - описан в предварительной заявке США 60/956111, поданной 15 августа 2007 г., и в заявке PCT/US 2008/073378, поданной 15 августа 2008 г., каждая из которых полностью включена путем ссылки. Возможное применение антагониста S1P рецептора и, в частности, селективных антагонистов рецепторов типа S1 Р 5, включает, не ограничиваясь приведенным, профилактику или лечение патологического состояния или симптома у млекопитающего. Например, состояние может включать ингибированную клеточную миграцию олигодендроцитных клеток-предшественников (ОКП). В другом примере селективный антагонист рецептора типа S1P5 может не вызывать лимфопению, таким образом, достигая частичной эффективности без иммуносупрессии. Возможное применение антагониста S1 Р рецептора, и в частности селективных антагонистов рецепторов типа S1P4 включает, не ограничиваясь приведенным, профилактику или лечение патологического состояния или симптома у млекопитающего."Лечение" рассеянного склероза включает лечение различных форм заболевания, включая возвратно-ремиттирующую, хронически прогрессирующую, и агонисты/антагонисты S1P рецептора могут быть применены отдельно или в сочетании с другими агентами для облегчения признаков и симптомов заболевания, а также в качестве профилактики. Дополнительно описанные соединения могут быть применены для изменения движения лимфоцитов в качестве способа пролонгирования аллотрансплантатной выживаемости, например трансплантации, включая трансплантаты твердых органов, лечение заболевания "трансплантат против хозяина",трансплантации костного мозга и т.п. Дополнительно описанные соединения могут быть применены для ингибирования аутотаксина. Аутотаксин, фосфодиэстераза плазмы, как было продемонстрировано, претерпевает ингибирование конечного продукта. Аутотаксин гидролизует несколько субстратов с получением лизофосфатидиновой кислоты и сфингозин 1-фосфат и был задействован в развитии рака и ангиогенеза. Поэтому пролекарства описанных соединений - агонисты S1P рецептора - могут быть применены для ингибирования аутотаксина. Данная активность может сочетаться с агонизмом при S1P рецепторах или может быть независимой от такой активности. Описанные соединения могут быть полезными для ингибирования сфингозин киназы (т.е., сфингозин киназы I, сфингозин киназы II, или обеих). Сфингозин киназа представляет собой внутриклеточный фермент, который катализирует образование S1P из сфингозина и нуклеотидтрифосфата (например,АТФ). Ингибирование сфингозин киназы может уменьшать образование S1P и таким образом уменьшать поставку S1P, доступного для активирования сигнализации при S1P рецепторах. Соответственно, ингибиторы сфингозин киназы могут быть полезными при модулировании функции иммунной системы. Поэтому описанные соединения могут быть применены для ингибирования сфингозин киназы. Такое ингибирование может быть совместным с S1P рецепторной активностью или быть независимым от активности при любом S1P рецепторе. Дополнительно описанные соединения могут быть полезными для ингибирования S1P лиазы. S1P лиаза является внутриклеточным ферментом, который необратимо разлагает S1P. Ингибирование S1P лиазы разрушает движение лимфоцитов с сопутствующей лимфопенией. Соответственно ингибиторыS1P лиазы могут быть полезными при модулировании функции иммунной системы. Поэтому описанные соединения могут быть применены для ингибирования S1P лиазы. Такое ингибирование может быть совместным с S1 Р рецепторной активностью или быть независимым от активности при любом S1P рецепторе. Дополнительно описанные соединения могут быть полезными в качестве антагонистов каннабиноидного CB1 рецептора. СВ 1 антагонизм связан с уменьшением массы тела и улучшением липидных профилей крови. CB1 антагонизм может быть совместным с S1P рецепторной активностью или быть независимым от активности при любом S1P рецепторе. Дополнительно описанные соединения могут быть полезными для ингибирования группы IVA цитозольных PLA2 (cPLA2). cPLA2 катализирует высвобождение эйкозановых кислот (например, арахидоновой кислоты). Эйкозановые кислоты превращаются в провоспалительные эйкозаноиды, такие как простагландины и лейкотриены. Таким образом, описанные соединения могут быть полезными в качестве противовоспалительных агентов. Такое ингибирование может быть совместным с S1P рецепторной активностью или быть независимым от активности при любом S1P рецепторе. Дополнительно описанные соединения могут быть полезными для ингибирования многосубстратной липидной киназы (MuLK). MuLK в высокой степени экспрессируется во многих человеческих опухолевых клетках и поэтому ее ингибирование может замедлять рост или распределение опухолей. Фармацевтические композиции могут содержать соединения настоящего изобретения, как указано выше. Более конкретно, такие соединения могут быть составлены как фармацевтические композиции при помощи стандартных фармацевтически приемлемых носителей, наполнителей, солюбилизирующих агентов и стабилизаторов, известных специалистам в данной области. Например, фармацевтическую композицию, содержащую соединение настоящего изобретения, или его соль, как описано в данной заявке, используют для введения соответствующего соединения субъекту. Соединения настоящего изобретения являются полезными для лечения заболевания или расстройства, включая введение субъекту, нуждающемуся в этом, терапевтически приемлемого количества соединения или фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, и фармацевтически приемлемый носитель. Описанные соединения направлены на аналоги сфингозин 1-фосфата (S1P), которые имеют активность в качестве агонистов рецепторов или антагонистов рецепторов на одном или более S1P рецепторах, конкретно S1P1, S1P4 или S1P5 типах рецепторов. В случаях, когда соединения настоящего изобретения являются достаточно основными или кислотными, образуя стабильные нетоксичные кислые или основные соли, получение и введение соединений в виде фармацевтически приемлемых солей может быть приемлемым. Примеры фармацевтически приемлемых солей представляют собой органические соли присоединения кислот, образованные с кислотами,образующими физиологически приемлемый анион, например тозилат, метансульфонат, ацетат, цитрат,малонат, тартрат, сукцинат, бензоат, аскорбат, -кетоглутарат или -глицерофосфат. Могут быть также образованы неорганические соли, включая гидрохлоридные, сульфатные, нитратные, бикарбонатные и карбонатные соли. Фармацевтически приемлемые соли могут быть получены при помощи стандартных процедур, хорошо известных в данной области, например, путем реакции достаточно основного соединения, такого как амин, с приемлемой кислотой, с получением физиологически приемлемого аниона. Также могут быть получены соли карбоновых кислот щелочных металлов (например, натрия, калия или лития) или щелочно-земельных металлов (например, кальция). Фармацевтически приемлемые основные соли присоединения могут быть получены из неорганических и органических оснований. Соли из неорганических солей, включают, не ограничиваясь приведенным, соли натрия, калия, лития, аммония, кальция или магния. Соли, полученные из органических оснований, включают, не ограничиваясь приведенным, соли первичных, вторичных или третичных аминов,например, алкиламинов, диалкиламинов, триалкиламинов, замещенных алкиламинов, ди(замещенных алкил)аминов, три(замещенных алкил)аминов, алкениламинов, диалкениламинов, триалкениламинов,замещенных алкениламинов, ди(замещенных алкенил)аминов, три(замещенных алкенил)аминов, циклоалкиламинов, ди(циклоалкил)аминов, три(циклоалкил)аминов, замещенных циклоалкиламинов, дизамещенных циклоалкиламинов,тризамещенных циклоалкиламинов,циклоалкениламинов,ди(циклоалкенил)аминов, три(циклоалкенил)аминов, замещенных циклоалкениламинов, дизамещенных циклоалкениламинов, тризамещенных циклоалкениламинов, ариламинов, диариламинов, триариламинов, гетероариламинов, дигетероариламинов, тригетероариламинов, гетероциклических аминов, дигетероциклических аминов, тригетероциклических аминов, или смешанных ди- и триаминов, где как минимум два из заместителей на амине являются различными и являются алкилом, замещенным алкилом,алкенилом, замещенным алкенилом, циклоалкилом, замещенным циклоалкилом, циклоалкенилом, замещенным циклоалкенилом, арилом, гетероарилом, или гетероциклом и т.п. Также включены амины, в которых два или три заместителя вместе с азотом аминогруппы образуют гетероциклическую или гетероарильную группу. Неограничивающие примеры аминов включают изопропиламин, триметиламин, диэтиламин, три(изопропил)амин, три(н-пропил)амин, этаноламин, 2-диметиламиноэтанол, трометамин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, Nалкилглюкамины, теобромин, пурины, пиперазин, пиперидин, морфолин или N-этилпиперидин и т.п. Также должно быть понятно, что полезными могут быть другие производные карбоновых кислот, например амиды карбоновых кислот, включая карбоксамиды, нижние алкил карбоксамиды, или диалкил карбоксамиды и т.п. Соединения настоящего изобретения могут быть составлены как фармацевтические композиции и введены хозяину-млекопитающему, такому как пациент-человек, в виде множества форм, адаптированных для выбранного маршрута введения, например, перорально или парентерально, в виде глазных капель, внутривенными, внутримышечными, местными или подкожными маршрутами. Поэтому данные соединения могут быть введены системно, например перорально, в комбинации с фармацевтически приемлемым носителем, таким как инертный разбавитель или усваиваемый съедобный носитель. Они могут быть заключены в твердые или мягкие желатиновые капсулы, могут быть спрессованы в таблетки или включены в еду диеты пациента. Для перорального терапевтического введения активное соединение может быть скомбинировано с одним или более эксципиентов и применено в виде проглатываемых таблеток, буккальных таблеток, лепешек, капсул, эликсиров, суспензий, сиропов или пластинок и т.п. Такие композиции и препараты должны содержать как минимум приблизительно 0,1% активного соединения. Процентное содержание композиций и препаратов может конечно варьироваться и может традиционно составлять от приблизительно 2 до приблизительно 60 мас.% данной стандартной лекарственной формы. Количество активного соединения в таких терапевтически полезных композициях является таким, что будет получен эффективный уровень дозировок. Таблетки, лепешки, пилюли, капсулы и т.п., могут также содержать следующее: агенты связывания,такие как трагакантовая камедь, гуммиарабик, кукурузный крахмал или желатин; эксципиенты, такие как дикальций фосфат; агент распада, такой как кукурузный крахмал, картофельный крахмал, альгиновая кислота и т.п.; смазывающее вещество, такое как стеарат магния и подсластитель, например сахарозу,фруктозу, лактозу или аспартам, или может быть добавлен ароматизатор, например перечная мята, масло винтергрена, или вишневый ароматизатор. Если стандартной лекарственной формой является капсула,она может содержать дополнительно к веществам указанного выше типа жидкий носитель, такой как растительное масло или полиэтиленгликоль. Различные другие материалы могут присутствовать в виде покрытий или для иной модификации физической формы твердой стандартной лекарственной формы. Например, таблетки, пилюли или капсулы могут быть покрыты желатином, воском, шеллаком или сахаром и т.п. Сироп или эликсир могут содержать активное соединение, сахарозу или фруктозу в качестве подсластителя, метил или пропилпарабены в качестве консервантов, краситель и ароматизатор, такой как вишневый или апельсиновый ароматизатор. Конечно, любое вещество, используемое при получении стандартной лекарственной формы, должно быть фармацевтически приемлемым и существенно нетоксичным в примененных количествах Дополнительно активное соединение может быть включено в препараты и устройства с замедленным высвобождением. Активное соединение может быть также введено внутривенно или интраперитонеально путем инфузии или инъекции. Растворы активного соединения или его соли могут быть получены в воде, необязательно смешаны с нетоксичным поверхностно-активным веществом. Дисперсии могут быть также получены в глицерине, жидких полиэтиленгликолях, триацетине, их смесях и в маслах. В обычных условиях хранения и применения такие препараты содержат консервант для предупреждения роста микроорганизмов. Иллюстративные фармацевтические лекарственные формы для инъекций или инфузий могут содержать стерильные водные растворы или дисперсии или стерильные порошки, содержащие активный ингредиент, адаптированный для препаратов немедленного приема стерильных растворов или дисперсий для инъекций или инфузий, необязательно инкапсулированных в липосомах. Во всех случаях итоговая лекарственная форма должна быть стерильной, текучей и стабильной в условиях производства и хранения. Жидкий носитель или основа могут быть растворителем или жидкой дисперсионной средой, содер-7 024435 жащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкие полиэтиленгликоли и т.п.), растительные масла, или нетоксичные глицериновые эфиры и их смеси. Надлежащая текучесть может быть поддержана, например, путем образования липосом, путем поддержания необходимого размера частиц в случае дисперсий или путем использования поверхностно-активных веществ. Предотвращение действия микроорганизмов может быть произведено при помощи различных антибактериальных и противогрибковых агентов, например парабенов, хлорбутанола, фенола, сорбиновой кислоты или тимеросала и т.п. Во многих случаях будет преимущественным включить изотонические агенты, например сахара, буферы или хлорид натрия. Пролонгированное поглощение композиций для инъекций может быть осуществлено путем применения композиций агентов, замедляющих поглощение, например моностеарата алюминия или желатина. Стерильные растворы для инъекций получают путем включения активного соединения в необходимом количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными выше, по мере необходимости, с последующей стерилизацией фильтрованием. В случае стерильных порошков для получения стерильных растворов для инъекций, преимущественными способами получения являются методы сушки в вакууме и лиофильной очистки, в результате которых получают порошок активного ингредиента плюс любой дополнительный желательный ингредиент, присутствующий в предварительно стерильно-отфильтрованных растворах. Для местного введения данные соединения могут быть нанесены в чистых формах, например, если они являются жидкостями. Однако, в общем будет желательным вводить их в кожу в виде композиций или составов с дерматологически приемлемым носителем, который может быть твердым или жидким. Иллюстративные твердые носители включают тонкодисперсные твердые вещества, такие как тальк,глина, микрокристаллическая целлюлоза, кремнезем, диоксид алюминия и т.п. Полезные жидкие носители включают воду, спирты или гликоли или смеси вода-спирт/гликоль, в которых данные соединения могут быть растворены или диспергированы на эффективных уровнях, необязательно при помощи нетоксичных поверхностно-активных веществ. Для оптимизации свойств для данного применения могут быть добавлены адъюванты, такие как отдушки, и дополнительные антимикробные агенты. Полученные в результате жидкие композиции могут быть нанесены из гигроскопических прокладок, использованы для просачивания бандажей и других повязок, или распылены на пораженный участок при помощи помповых или аэрозольных спреев. Также могут быть использованы загустители, такие как синтетические полимеры, жирные кислоты,соли или эфиры жирных кислот, жирные спирты, модифицированные целлюлозы или модифицированные минеральные вещества с жидкими носителями с образованием распыляемых паст, гелей, мазей, мыл и т.п., для нанесения непосредственно на кожу пользователя. Примеры полезных дерматологических композиций, которые могут быть применены для доставки соединений формулы I в кожу известны из уровня техники; например, см. Jacquet et al. (патент США 4608392), Geria (патент США 4992478), Smith et al. (патент США 4559157) и Wortzman (патент США 4820508), каждый из которых полностью включен путем ссылки. Полезные дозировки соединений настоящего изобретения могут быть определены путем сравнения их активности in vitro, и активности in vivo в животных моделях. Способы экстраполирования эффективных дозировок у мышей, и других животных, для людей, известны в данной области; например, см. патент США 4938949, который полностью включен путем ссылки. В общем, концентрация соединения(ий) настоящего изобретения в жидкой композиции, например лосьоне, будет составлять от приблизительно 0,1 до приблизительно 25 мас.%, преимущественно от приблизительно 0,5-10 мас.%. Концентрация в полутвердой или твердой композиции, такой как гель или порошок, составит приблизительно 0,1-5 мас.%, преимущественно приблизительно 0,5-2,5 мас.%, исходя из общей массы композиции. Количество соединения или его активной соли или производного, необходимого для использования при лечении, будет варьироваться не только в зависимости от конкретной выбранной соли, но также в зависимости от маршрута введения, характера состояния, которое лечат и возраста и состояния пациента,и будет, в конечном счете, принято по усмотрению лечащего врача или клинициста. В общем, однако,доза будет находиться в диапазоне от приблизительно 0,1 до приблизительно 10 мг/кг массы тела в день. Соединение традиционно вводят в стандартной лекарственной форме; например, содержащей 0,0110 мг или 0,05-1 мг активного ингредиента на стандартную лекарственную форму. В некоторых вариантах исполнения приемлемой является доза 5 мг/кг или менее. Идеально активный ингредиент должен быть введен для достижения пиковых концентраций в плазме активного ингредиента от приблизительно 0,5 до приблизительно 75 мкМ, преимущественно приблизительно 1-50 мкМ, наиболее преимущественно, от приблизительно 2 до приблизительно 30 мкМ. Этого можно достигнуть, например, путем внутривенной инъекции 0,05-5% раствора активного ингредиента, необязательно в солевом растворе, или перорального введения в виде болюса, содержащего приблизительно 1-100 мг активного ингредиента. Желательные уровни в крови могут поддерживаться при помощи непрерывной инфузии с обеспечением приблизительно 0,01-5,0 мг/кг/ч или при помощи периодических инфузий, содержащих приблизительно 0,4-15 мг/кг активного ингредиента(ов). Желательная доза может быть традиционно представлена в виде одинарной дозы или в виде разделенных доз, вводимых через соответствующие интервалы, например, как две, три, четыре или более субдоз в день. Субдоза сама по себе может быть дополнительно разделена, например, на ряд дискретных свободным образом разделенных введений; в виде множества ингаляций из инсуффлятора или путем нанесения множества капель в глаз. Описанный способ включает набор, содержащий соединение настоящего изобретения и материал инструкций, описывающий введение соединения или композиции, содержащей соединение, в клетку или субъекту. Это должно быть истолковано как включающее другие варианты исполнения наборов, известных специалистам в данной области, например, набор, содержащий (преимущественно стерильный) растворитель для растворения или супендирования соединения или композиции перед введением соединения или композиции в клетку или субъекту. Преимущественно, субъектом является человек. Соединения могут иметь значения ЕС 50 от 5 нМ до 3 мкМ при действии в качестве агонистов дляS1P1 рецепторов. В то время как ЕС 50 определенных соединений, действующих в качестве агонистовS1P1 и S1P3 рецепторов, может превышать 5000 нМ, такие же соединения могут иметь значения ЕС 50 0,2700 нМ при действии в качестве селективных антагонистов для S1P5 рецепторов и 50 нМ - 3 мкМ при действии в качестве селективных антагонистов для S1P4 рецепторов. В соответствии с описанными соединениями и способами, как описано выше или как обсуждено в примерах ниже, могут быть применены традиционные химические, клеточные, гистохимические, биохимические, молекулярнобиологические, микробиологические и in vivo методы, известные специалисту в данной области. Такие способы полностью объяснены в литературе. Следующие рабочие примеры обеспечены исключительно в целях иллюстрации, и не должны быть истолкованы как каким-либо образом ограничивающие оставшуюся часть описания. Поэтому примеры должны быть истолкованы как охватывающие любые и все вариации, которые станут очевидными в результате доктрин, представленных в данной заявке. Примеры Пример 1: цис-4-трет-бутилциклогексил метансульфонат Цис-4-трет-бутилциклогексанол (6,0 г, 38,5 ммоль, 1,0 экв.) растворяли в дихлорметане (10 мл). К смеси медленно добавляли метансульфоновый ангидрид (8,03 г, 46,2 ммоль, 1,1 экв.) при 0 С. Затем к смеси добавляли триэтиламин (6,4 мл, 46,2 ммоль, 1,5 экв.) и смесь перемешивали при комнатной температуре в течение 3 ч. Смесь экстрагировали дихлорметаном и органический слой концентрировали с получением продукта в виде белого порошка (8,0 г, выход: 90%). Продукт использовали на следующей стадии без дальнейшей очистки. 1 Н ЯМР (400 МГц, CDCl3)4,99-4,98 (m, 1H), 3,02 (s, 3 Н), 2,14-2,12 (m,2 Н), 1,65-1,28 (m, 7 Н), 0,84 (s, 9H). Пример 2: 2-бром-6-(транс-4-трет-бутилциклогексилокси)нафталин 6-бромнафталин-2-ол (CAS 15231-91-1) (3,0 г, 14,8 ммоль, 1,0 экв.) растворяли в смеси третбутанола/2-бутанона (4 мл/2 мл). Затем к смеси добавляли карбонат цезия (12 г, 37,2 ммоль, 2,5 экв.) и смесь перемешивали при 110 С в течение 10 мин. Затем к смеси добавляли транс-4-третбутилциклогексил метансульфонат (3,48 г, 16,2 ммоль, 1,1 экв.). Суспензию перемешивали при 110 С в атмосфере азота в течение 15 ч. Реакционную смесь экстрагировали этилацетатом и органический слой очищали при помощи хроматографии на колонке с силикагелем с использованием петролейного эфира в качестве элюента с получением 2-бром-6-(транс-4-трет-бутилциклогексилокси)нафталина в виде светложелтого твердого вещества (1,7 г, выход: 32%). ESI-MC: 361,0 (М+Н)+. 1 Н ЯМР (400 МГц, CDCl3)7,89 (s, 1H), 7,63 (d, 1H), 7,56 (d, 1 Н), 7,47 (d, 1 Н), 7,15-7,11 (m, 2 Н),4,26-4,24 (m, 1H), 2,27-2,25 (m, 2 Н), 1,89-1,87 (m, 2 Н), 1,45-1,09 (m,5 Н), 0,89 (s, 9H). Пример 3: 6-(транс-4-трет-бутилциклогексилокси)-2-нафтальдегид 2-бром-6-(транс-4-трет-бутилциклогексилокси)нафталин (2,249 г, 6,25 ммоль, 1,0 экв.) растворяли в ТГФ (10 мл) в атмосфере азота. Затем смесь охлаждали до -78 С и раствор н-BuLi в ТГФ (2,5 М, 7,5 мл,18,8 ммоль, 3,0 экв.) добавляли к смеси по каплям. Смесь перемешивали при -78 С в течение 15 мин. Затем к смеси добавляли ДМФ (2,4 мл, 31,2 ммоль, 5,0 экв.) и перемешивали при -78 С в течение 1 ч. После завершения реакции добавляли 1 М HCl для регулирования рН до 6. Смесь экстрагировали EtOAc и органический слой концентрировали и очищали при помощи хроматографии на силикагеле с использованием петролейного эфира/этилацетата (10/1) в качестве элюента с получением 6-(транс-4-третбутилциклогексилокси)-2-нафтальдегида в виде белого твердого вещества (1,16 г, 60%). EDI-MC: 311,1 К раствору 6-бромнафталин-2-ола (100,0 г, 450,1 ммоль), трифенилфосфина (230 г, 877,8 ммоль, 2,0 экв.) и цис-4-трет-бутилциклогексанола (105,4 г, 675,7 ммоль; 1,5 экв.) в толуоле (1,5 л), по каплям добавляли диизопропил азодикарбоксилат (170 г, 850,0 ммоль, 2,0 экв.) при 0 С. Добавление заняло 2 ч и полученную в результате смесь нагревали до 26-30 С. Через 24 ч тонкослойная хроматография показала практически полное израсходование 6-бромнафталин-2-ола. Смесь затем охлаждали до 5 С и перемешивали при данной температуре в течение 2 ч, после чего твердые вещества осаждали и фильтровали. Фильтрат концентрировали практически до сухого остатка с получением масла, которое растворяли в 200 мл метиленхлорида и очищали при помощи хроматографии на силикагеле со 100% петролейным эфиром. После концентрирования 127 г продукта получали в виде белого твердого вещества (выход: 79,1%). EDI-MC: 361,1 (М+Н)+. Пример 5: 6-бром-2-(транс-4-трет-бутилциклогексилокси)-1-йоднафталин Раствор 2-бром-6-(транс-4-трет-бутилциклогексилокси)нафталина (160,0 г, 444,4 ммоль) в метиленхлориде (2,5 л) продували в атмосфере аргона. N-йодсукцинимид (202,1 г, 888,8 ммоль) и тетрахлорид циркония (20,4 г, 88,9 ммоль) добавляли и реакционную смесь перемешивали при комнатной температуре в атмосфере аргона. Реакцию контролировали при помощи 1 Н ЯМР, который показывал полное превращение в продукт через 30 мин. Смесь затем концентрировали при пониженном давлении с получением 250 г неочищенного продукта в виде коричневого твердого вещества Неочищенное вещество очищали при помощи хроматографии на силикагеле с гексаном с получением 200 г целевого продукта в виде коричневого твердого вещества (выход: 92,6%). EDI-MC: 487,1 (М+Н)+. Пример 6: 6-бром-2-(транс-4-трет-бутилциклогексилокси)-1-(трифторметил)нафталин Раствор 6-бром-2-(транс-4-трет-бутилциклогексилокси)-1-йоднафталина (210,0 г, 433 ммоль), гексаметилфосфорамида (386,4 г, 2,16 моль, 5 экв.) B N,N-диметилформамиде (2,0 л) дегазировали путем перемешивания в вакууме и замещения вакуума аргоном (4 раза). К данной смеси добавляли йодид меди(I) (140,0 г, 735 ммоль; 1,7 экв.) и метил фторсульфонилдифторацетат (415 г, 2,16 моль, 5 экв.). Реакционную смесь нагревали до 80 С в атмосфере аргона. После перемешивания в течение 6 часов, тонкослойная хроматография показала полное превращение в продукт. Насыщенный раствор NaHCO3 добавляли для регулирования конечного значения рН до 910 с последующим добавлением EtOAc (3,5 л). Смесь экстрагировали EtOAc (2,5 л 3) и промывали солевым раствором (1,0 л 4), затем высушивали над Na2SO4 (500 г). Растворитель удаляли при пониженном давлении с получением 195 г неочищенного продукта в виде клейкого практически белого твердого вещества с чистотой 90%, которое очищали при помощи хроматографии на силикагеле 0-30% EtOAc в гексане с получением целевого продукта (156 г,84,3%). EDI-MC: 430,0 (М+Н)+. Пример 7: трет-бутил 3-оксо-3-(фенилсульфонамидо)пропилкарбамат 3-(Трет-бутоксикарбониламино)пропаноевую кислоту (4 г, 21,2 ммоль, 1,0 эквив.) растворяли в ДХМ (100 мл). Затем к смеси добавляли фенилсульфонамид (15,1 ммоль, 0,7 эквив.), EDCI (3,45 г, 18,2 ммоль, 0,85 экв.) и диметиламинопиридин (0,37 г, 3 ммоль, 0,15 экв.) и перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь охлаждали до 0 С, добавляли ледяную воду (100 мл). Смесь перемешивали в течение 15 мин, разделяли и водный слой экстрагировали дважды дихлорметаном. Соединенный органический слой промывали 5% HCl, солевым раствором, высушивали над Na2SO4, кон- 10024435 Трет-бутил 3-оксо-3-(фенилсульфонамидо)пропилкарбамат (3,6 г, 15,1 ммоль) растворяли в дихлорметане (60 мл). Затем к смеси добавляли CF3COOH (1,1 мл, 0,3 ммоль, 20 экв.) при 0 С и перемешивали в течение 2 ч при 0 С Реакционную смесь концентрировали и очищали при помощи флешхроматографии с получением 3-амино-N-(фенилсульфонил)пропанамида в виде белого твердого вещества (1,4 г, 40%). EDI-MC: 229,0 (М+Н)+. 1 Н ЯМР (400 МГц, ДМСО-d6) : 7,79-7,71 (m, 2H), 7,70-7,43 (brs, 3 Н), 7,42-7,34 (m, 3 Н), 2,83 (t, 2H),2,24 (t, 2H). Пример 9: 3-6-(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-N-(фенилсульфонил)пропанамид 6-(Транс-4-трет-бутилциклогексилокси)-2-нафтальдегид (300 мг, 0,96 ммоль, 1 экв.) и 3-амино-N(фенилсульфонил)пропанамид (1,19 ммоль, 1,5 экв.) растворяли в безводном этаноле. Смесь перемешивали при 80 С в течение 1 ч. Затем NaBH3CN (110 мг, 1,74 ммоль, 2 экв.) добавляли к смеси и перемешивали при 80 С в течение 16 ч. Органический слой концентрировали и очищали при помощи препаративной тонкослойной хроматографии (подвижной фазой был метанол:дихлорметан 1:10) с получением 3-6(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-N-(фенилсульфонил)пропанамида в виде белого твердого вещества, 284 мг, белое твердое вещество, 62%. ESI-MC: 523,0 (М+Н)+. ВЭЖХ: 99,42%. 1 Н ЯМР (400 МГц, ДМСО-d6) : 7,91 (s, 1 Н), 7,85-7,82 (m, 2 Н), 7,74-7,72 (m, 2 Н), 7,53-7,51(m, 1 Н),7,41-7,35(m, 4 Н), 7,20-7,15 (m, 1 Н), 4,45-4,40 (m, 1H), 4,23 (s, 2H), 2,99 (t, 2H), 2,33 (t, 2H), 2,28-2,16 (m,2 Н), 1,89-1,78 (m, 2 Н), 1,41-1,31 (m, 2 Н), 1,27-1,17 (m, 2 Н), 1,13-1,06 (m, 1H), 0,89 (s, 9H). Пример 10: 3-6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2-ил)метиламино)-N-(фенилсульфонил)пропанамид 6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)-2-нафтальдегид (300 мг, 0,96 ммоль, 1 экв.) и 3-амино-N-(фенилсульфонил)пропанамид (1,19 ммоль, 1,5 экв.) растворяли в безводном этаноле. Смесь перемешивали при 80 С в течение 1 ч. Затем NaBH3CN (110 мг, 1,74 ммоль, 2 экв.) добавляли к смеси и перемешивали при 80 С в течение 16 ч. Органический слой концентрировали и очищали при помощи препаративной тонкослойной хроматографии (подвижной фазой был метанол:дихлорметан 1:10) с получением 3-6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2 -ил)метиламино)N-(фенилсульфонил)пропанамида в виде белого твердого вещества. 120 мг, белое твердое вещество,53%. ESI-MC: 591,0 (М+Н)+. ВЭЖХ: 98,05%. 1 Н ЯМР (400 МГц, ДМСО-d6) : 8,22-8,13 (m, 1H), 8,11-8,04 (m, 2 Н), 7,79-7,63 (m, 4 Н), 7,45-7,30 (m,3 Н), 4,63-4,49 (m, 1H), 4,27 (s, 2H), 2,99 (t, 2H), 2,32 (t, 2H), 2,19-2,07 (m, 2 Н), 1,85-1,74 (m, 2 Н), 1,45-1,30NaBH3CN (60 мг, 1,0 ммоль, 2,0 экв.), полученную в результате смесь кипятили с обратным холодильником в течение 1 ч. Реакционную смесь концентрировали в вакууме и остаток очищали при помощи хроматографии на силикагеле (дихлорметан:метанол 20:1) с получением метил 2-6-(транс-4-третбутилциклогексилокси)нафталин-2-ил)метиламино)пропаноатав виде белого твердого вещества (277 мг,выход: 70%). ESI-MC: 398,1 (М+Н)+. ВЭЖХ: 96,09%. 1 Н ЯМР (400 МГц, CD3OD) : 7,83 (s, 1H), 7,79 (d, 1H), 7,74 (d, 1H), 7,43 (dd, 1H), 7,22 (d, 1 Н), 7,10(100 мг, 0,25 ммоль) в этаноле (10 мл) добавляли водный NaOH (3 мл, 20%, 5,0 экв.) и кипятили с обратным холодильником в течение 1 ч. Затем реакционную смесь охлаждали до 0 С, рН раствора доводили до 6 при помощи 1 М HCl, концентрировали и остаток растворяли в дихлорметане, промывали водой,высушивали и концентрировали с получением 2-6-(транс-4-трет-бутилциклогексилокси)нафталин-2 ил)метиламино)пропаноевой кислоты в виде белого твердого вещества (70 мг, выход: 75%). ESI-MC: 384,1 (М+Н)+. ВЭЖХ: 97,18%. 1 Н ЯМР (400 МГц, CD3OD) : 7,88 (s, 1H), 7,83 (d, 1H), 7,73 (d, 1H), 7,49(CAS5303-65-1)(19 мг, 0,145 ммоль) и уксусную кислоту (17 мг, 0,291 ммоль) растворяли в дихлорэтане (2 мл). Смесь перемешивали при комнатной температуре в течение 10 мин в атмосфере азота. ЗатемNaBH(OAc)3 (41 мг, 0,194 ммоль) добавляли к смеси и смесь перемешивали при комнатной температуре в течение 15 ч. Затем насыщенный раствор NaHCO3 добавляли к смеси для регулирования значения рН до 8. Смесь экстрагировали этилацетатом и органический слой очищали при помощи хроматографии на колонке с силикагелем с использованием дихлорметан:метанол 10:1 с получением продукта этил 3-6(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)бутаноата (40 мг, 88%) в виде светложелтого твердого вещества. ESI-MC: 426,1 (М+Н)+. 1 Н ЯМР (400 МГц, CDCl3)7,70-7,65 (m, 3H), 7,41 (d, 1H), 7,13-7,09 (m, 2 Н), 4,28-4,23 (m, 1 Н), 4,12 Синтез осуществляли так, как описано для 2-6-(-трас-4-трет-бутилциклогексилокси)нафталин-2 ил)метиламино)пропаноевой кислоты. 9 мг, светло-желтое масло, выход: 27%. ESI-MC: 398,1 (М+Н)+. ВЭЖХ: 91,26%. 1 Н ЯМР (400 МГц, CDCl3)7,70-7,61 (m, 3 Н), 7,45 (d, 1 Н), 7,07 (t, 2H), 4,20-4,17 (m, 2H), 3,98-3,95 2-6-(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метил)(ме Смесь 6-(транс-4-трет-бутилциклогексилокси)-2-нафтальдегида (155 мг, 0,5 ммоль) и этил 2(метиламино)ацетата (117 мг, 1,0 ммоль, 2,0 экв.) в безводном этаноле (20 мл) кипятили с обратным холодильником в течение 2 ч и испаряли в вакууме до сухого остатка. Добавляли безводный EtOH и кипятили с обратным холодильником в течение 1 ч и затем смесь охлаждали до 23 С. Добавляли NaBH3CN(60 мг, 1,0 ммоль, 2,0 экв.). Полученную в результате смесь кипятили с обратным холодильником в течение 1 ч. Реакционную смесь концентрировали в вакууме и остаток очищали при помощи хроматографии на силикагеле (дихлорметан:метанол 20:1) с получением продукта этил 2-6-(транс-4-третбутилциклогексилокси)нафталин-2-ил)метил)(метил)амино)ацетата в виде белого твердого вещества (82 мг, выход: 40%). ESI-МС: 411,3 (М+Н)+. ВЭЖХ: 98,93%. 1 Н ЯМР (400 МГц, CDCl3)7,71-7,67 (m, 3H), 7,00 (d, 1H), 7,14-7,13 (m, 2H), 4,30-4,28 (m, 1H), 4,18 Синтез осуществляли так, как описано для 2-6-(транс-4-трет-бутилциклогексилокси)нафталин-2 ил)метиламино)пропаноевой кислоты. 14 мг, серое твердое вещество, выход: 75%. ESI-MC: 383,3 Титульное соединение синтезировали так, как описано для этил 3-6-(транс-4-третбутилциклогексилокси)нафталин-2-ил)метиламино)бутаноата. 730 мг, белое твердое вещество, 40,9%. Синтез осуществляли так, как описано для 2-6-(транс-4-трет-бутилциклогексилокси)нафталин-2 ил)метиламино)пропаноевой кислоты. 593 мг, бежевое твердое вещество, выход: 87,2%. ESI-MC: 384,1 Титульное соединение синтезировали так, как описано для метил 2-6-(транс-4-третбутилциклогексилокси)нафталин-2-ил)метиламино)пропаноата. 100 мг, белое твердое вещество, выход: Синтез осуществляли так, как описано для 2-6-(транс-4-трет-бутилциклогексилокси)нафталин-2 ил)метиламино)пропаноевой кислоты. 70 мг, белое твердое вещество, выход: 75%. ESI-MC: 398,3 Титульное соединение синтезировали так, как описано для метил 2-6-(транс-4-третбутилциклогексилокси)нафталин-2-ил)метиламино)пропаноата. 150 мг, белое твердое вещество, выход: 61%. ESI-MC: 410,3 (М+Н)+. ВЭЖХ: 92,03%. 1 Н ЯМР (400 МГц, CD3OD) : 7,88 (s, 1H), 7,84 (d, 1 Н), 7,82 (d, 1H), 7,44 (dd, 1 Н),7,28 (d, 1 Н), 7,17 Синтез осуществляли так, как описано для 2-6-(транс-4-трет-бутилциклогексилокси)нафталин-2 ил)метиламино)пропаноевой кислоты. 70 мг, белое твердое вещество, выход: 70%. ESI-MC: 396,3 Титульное соединение синтезировали так, как описано для этил 2-6-(транс-4-третбутилциклогексилокси)нафталин-2-ил)метил)(метил)амино)ацетата. 150 мг, белое твердое вещество, выход: 55%. ESI-MC: 423,3 (М+Н)+. ВЭЖХ: 98,59%. 1 Н ЯМР (400 МГц, CDCl3)7,69-7,67 (m, 3 Н), 7,42 (d,1H), 7,12 (t, 2 Н), 4,27-4,25 (m, 1 Н), 3,87 (s, 2 Н), 3,69 (s, 3 Н), 3,12-3,06 (m, 2 Н), 2,88-2,84 (m, 2 Н), 2,73-2,70 Синтез осуществляли так, как описано для 2-6-(транс-4-трет-бутилциклогексилокси)нафталин-2 ил)метиламино)пропаноевой кислоты. Титульное соединение синтезировали так, как описано для этил 2-6-(транс-4-третбутилциклогексилокси)нафталин-2-ил)метил)(метил)амино)ацетата. 100 мг, белое твердое вещество, выход: 46%. ESI-MC: 451,3 (М+Н)+. ВЭЖХ: 92,64%. 1 Н ЯМР (400 МГц, CDCl3)7,75-7,72 (m, 3 Н), 7,48 (dd,1 Н), 7,17 (d, 2H), 4,30-4,28 (m, 1H), 4,16 (q, 2H), 3,96 (s, 2H), 3,09-3,08 (m, 2H), 2,53-2,51 (m, 3H), 2,29-2,26 Синтез осуществляли так, как описано для 2-6-(транс-4-трет-бутилциклогексилокси)нафталин-2 ил)метиламино)пропаноевой кислоты. 70 мг, белое твердое вещество, выход: 87%. ESI-MC: 423,3 К раствору 6-бром-2-(транс-4-трет-бутилциклогексилокси)-1-(трифторметил)нафталина (1 г, 2,3 ммоль) в ТГФ (30 мл) добавляли н-BuLi (2,8 мл, 2,5 М в ТГФ, 3,0 экв.) по каплям при -78 С в течение 30 мин, затем медленно добавляли ДМФ (840 мг, 11,5 ммоль, 5,0 экв.) при -78 С. Реакционную смесь перемешивали при -78 С в течение 1,5 ч. Затем насыщенный раствор NH4Cl добавляли к смеси для того, чтобы погасить реакцию. Смесь экстрагировали EtOAc и очищали при помощи хроматографии на силикагеле (петролейный эфир:этилацетат 10:1) с получением продукта 6-(транс-4-трет-бутилциклогексилокси)5-(трифторметил)-2-нафтальдегида в виде желтого твердого вещества (608 мг, 70%) ESI-MC: 379,2 Смесь 6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)-2-нафтальдегида (300 мг, 0,8 ммоль) и метил азетидин-3-карбоксилата (184 мг, 1,6 ммоль, 2,0 экв.) в безводном этаноле (20 мл) кипятили с обратным холодильником в течение 2 ч. Затем растворитель удаляли в вакууме, добавляли свежий этанол и NaBH3CN (150 мг, 2,4 ммоль, 3,0 экв.), полученную в результате смесь кипятили с обратным холодильником в течение 1 ч. Реакционную смесь концентрировали и остаток очищали при помощи хроматографии на силикагеле (дихлорметан:метанол 20:1) с получением продукта метил 1-6-(транс-4 трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2-ил)метил)азетидин-3-карбоксилата в виде белого твердого вещества (150 мг, выход: 40%). ESI-MC: 477,3 (М+Н)+. ВЭЖХ: 85,67%. 1 Н ЯМР (400 МГц, CD3OD) : 8,09 (dd, 1H), 8,01 (d, 1H), 7,56 (s, 1 Н), 7,46-7,51 (m, 2 Н), 4,42 (m, 1H),3,77 (s, 2H), 3,71 (s, 3H),3,57 (t, 2H), 3,45 (t, 2 Н), 3,35-3,39 (m, 1 Н), 2,18 (d, 2H), 1,88 (d, 2H), 1,43-1,52 (q,2H), 1,09-1,22 (m, 3 Н), 0,89 (s, 9H) К раствору метил 1-6-(транс-4 трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2 ил)метил)азетидин-3-карбоксилата (100 мг, 0,25 ммоль) в этаноле (10 мл) добавляли водный NaOH (3 мл,20%) и кипятили с обратным холодильником в течение 1 ч. Затем реакционную смесь охлаждали до 0 С,рН раствора доводили до 6 при помощи 1 М HCl и концентрировали. Остаток растворяли в дихлорметане, промывали водой, высушивали и концентрировали с получением 1-6-(транс-4-третбутилциклогексилокси)-5-(трифторметил)нафталин-2-ил)метил)азетидин-3-карбоновой кислоты в виде белого твердого вещества (70 мг, выход: 70%). ESI-MC: 464,2 (М+Н)+. ВЭЖХ: 98,64%. 1 Н ЯМР (400 МГц, ДМСО-d6) : 8,19 (d, 2H), 8,08 (d, 2H), 7,72 (d, 1H), 7,67 (d, 1H), 4,60-4,58 (m, 1H),4,51 (s, 2H), 4,21 (d, 4H), 3,55-3,67 (m, 1H), 2,13 (d, 2H), 1,80 (d, 2H), 1,35-1,43 (q, 2H), 1,03-1,22 (m, 3 Н),0,86 (s, 9H). Пример 29: этил 3-6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2 ил)метиламино)пропаноат Синтез осуществляли так, как описано для метил 1-6-(транс-4-трет-бутилциклогексилокси)-5(трифторметил)нафталин-2-ил)метил)азетидин-3-карбоксилата. 50 мг, белое твердое вещество (выход: 20%). ESI-MC: 480,3 (М+Н)+. ВЭЖХ: 89,20%. 1 Н ЯМР (400 МГц, ДМСО-d6) : 8,22 (d, 1H), 8,97 (d, 1H), 7,90 (s, 1H), 7,52 (d, 1H), 7,33 (d, 1H), 4,304,28 (m, 1H), 4,14-4,20 (m, 4 Н), 3,17 (s, 2H), 2,77 (s, 2H), 2,16 (d, 2H), 1,86 (d, 2H), 1,47-1,55 (q, 2H), 1,25 (t,3 Н), 1,09-1,13 (m, 3 Н), 0,87 (s, 9H). Пример 30: 3-6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2-ил)метиламино)пропаноевая кислота Синтез осуществляли так, как описано для 1-6-(транс-4-трет-бутилциклогексилокси)-5(трифторметил)нафталин-2-ил)метил)азетидин-3-карбоновой кислоты. 30 мг, белое твердое вещество Смесь цис-4-трет-бутилциклогексанола (927 мг, 0,00593 моль), метилового эфира 6-гидроксинафталин-2-карбоновой кислоты (1,00 г, 0,00494 моль) и трифенилфосфита (1560 мг, 0,00593 моль) в толуоле (10 мл, 0,1 моль) нагревали до возврата флегмы и по каплям добавляли диизопропил азодикарбоксилат (1,17 мл, 0,00593 моль) и перемешивали и кипятили с обратным холодильником в течение 6 ч. Смесь растворяли в дихлорметане и очищали посредством колоночной хроматографии этилацетатомтексаном (0:100 к 40:60) с получением метил 6-(транс-4-трет-бутилциклогексилокси)-2-нафтоата в виде белого твердого вещества (0,95 г, 56%). 1 Н ЯМР (400 МГц, CDCl3)8,52 (s, 1H), 8,01 (dd, J = 8,7, 1,7 Гц, 1 Н), 7,84 (d, J = 9,6 Гц, 1 Н), 7,73 (d,J = 8,7 Гц, 1 Н), 7,17 (m, 2H), 4,34 (m, 1 Н), 3,97 (s, 3 Н), 2,30 (m, 2 Н), 1,92 (m, 2 Н), 1,52-1,14 (m, 5 Н), 0,91 (s,9H).(8,4 мл, 0,0084 моль) при 0 С. После перемешивания при комнатной температуре в течение 2 ч, добавляли этилацетат и сегнетову соль и смесь затем перемешивали при комнатной температуре в течение 1 ч. После экстракции этилацетатом с последующим концентрированием при пониженном давлении получали продукт (6-транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метанол в виде белого твердого вещества (770 мг, 88%). 1 Н ЯМР (400 МГц, CDCl3)7,71 (m, 2 Н), 7,45 (d, J= 10,1 Гц, 1 Н), 7,15 (m, 3 Н), 4,82 (AB, J = 16,1,16,1 Гц, 2 Н), 4,28 (m, 1H), 2,27-2,31 (m, 2H), 1,89-1,92 (m, 2H), 1,11-1,50 (m, 5H), 0,91 (s, 9H). Пример 33: 6-(транс-4-трет-бутилциклогексилокси)-2-нафтальдегид К (6-транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метанолу (150 мг, 0,480 ммоль) в метиленхлориде (5 мл, 80 ммоль) добавляли перйодинан Десс-Мартина (0,285 г, 0,672 ммоль) и смесь перемешивали при комнатной температуре в течение 1 ч. Неочищенную реакционную смесь затем пропускали через слой силикагеля и фильтрат затем концентрировали при пониженном давлении с получением продукта в виде белого твердого вещества (0,150 г, 100%). 1 Н ЯМР (400 МГц, CDCl3)10,10 (s, 1H), 8,25 (s,1H), 7,92-7,87 (m, 2H), 7,78 (d, J = 8,5 Гц, 1H), 7,23-7,19 (m, 2H), 4,38-4,30 (m, 1H), 2,31-2,29 (m, 2H), 1,941,91 (m, 2H), 1,54-1,11 (m, 5H), 0,92 (s, 9H). Пример 34: 3-6-(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-2,2-дифторпропаноевая кислота Раствор 6-(4-трет-бутил-циклогексилокси)нафталин-2-карбальдегида (150 мг, 0,483 ммоль) и 3 амино-2,2-дифторпропионовой кислоты (60,4 мг, 0,483 ммоль) в этаноле (0,7 мл, 10 ммоль) нагревали до возврата флегмы в течение 2 ч. Желтый раствор затем охлаждали до комнатной температуры и к перемешивающемуся раствору добавляли натрий цианоборогидрид (36,4 мг, 0,580 ммоль). Полученную в результате смесь нагревали до возврата флегмы в течение 1 ч. После охлаждения до комнатной температуры добавляли лимонную кислоту и растворитель удаляли в вакууме. Полученное в результате твердое вещество суспендировали в воде и собирали посредством фильтрования. Фильтрат тщательно промывали водой (4), простым эфиром (3) и гексаном (3). Полученное в результате твердое вещество высушивали на фильтре с получением титульного соединения в виде белого твердого вещества (128,8 мг,64%). 1 Н ЯМР (400 МГц, CDCl3) : 7,92 (s, 1H), 7,87 (d, J = 8,5 Гц, 1 Н), 7,82 (d, J = 9,1 Гц, 1 Н), 7,52 (dd, J = 8,4, 1,8 Гц, 1H), 7,30 (d, J = 2,2 Гц, 1 Н), 7,19 (dd, J = 9,0, 2,4 Гц, 1 Н), 4,45 (s, 2H), 4,40 (m, 1 Н), 3,61 (t, J = 13,8 Гц, 2 Н), 2,28-2,31 (m, 2 Н), 1,92-1,95 (m, 2 Н), 1,49-1,14 (m, 5H), 0,94 (s,9H). Пример 35: метил 6-(спиро[5.5]ундекан-3-илокси)-2-нафтоат Смесь спиро[5.5]ундекан-3-ола (0,999 г, 0,00593 моль), метилового эфира 6-гидрокси-нафталин-2 карбоновой кислоты (1,00 г, 0,00494 моль) и трифенилфосфина (1,56 г, 0,00593 моль) в толуоле (10 мл,0,1 моль) нагревали до возврата флегмы. Диизопропил азодикарбоксилат (1,17 мл, 0,00593 моль) затем добавляли по каплям и полученную в результате смесь кипятили с обратным холодильником в течение 6 ч. Смесь затем разбавляли дихлорметаном и подвергали хроматографической очистке этилацетатом:гексаном (0:100 к 40:60) с получением метил 6-(спиро[5.5]ундекан-3-илокси)-2-нафтоата в виде белого твердого вещества. (1,09 г, 62%). 1 Н ЯМР (400 МГц, CDCl3)8,52 (s, 1 Н), 8,01 (dd, J = 8,7, 1,7 Гц, 1 Н), 7,84 (d, J = 9,6 Гц, 1H), 7,72 (d,J = 8,7 Гц, 1 Н), 7,17 (m, 2 Н), 4,45 (m, 1 Н), 3,97 (s, 3 Н), 1,93-1,28 (m, 18 Н). К раствору метилового эфира 6-(спиро[5.5]ундек-3-илокси)нафталин-2-карбоновой кислоты (0,374 г, 0,00106 моль) в тетрагидрофуране (10 мл, 0,1 моль) добавляли 1,0 М литий тетрагидроалюминат в тетрагидрофуране (3,18 мл, 0,00318 моль) при 0 С. Реакционной смеси затем позволяли нагреваться до комнатной температуры при перемешивании в течение 2 ч, затем добавляли сегнетову соль и перемешивали полученную в результате смесь при комнатной температуре в течение 1 ч. После экстракции этилацетатом и удаления растворителя в вакууме (6-(спиро[5.5]ундекан-3-илокси)нафталин-2-ил)метанол получали в виде белого твердого вещества (0,28 г, 83%). ESI-MC: 307,5 (М+Н)+, 100%). 1 Н ЯМР (400 МГц, CDCl3)7,74-7,70 (m, 3 Н), 7,44 (d, J= 10,0 Гц, 1H), 7,16 (m, 2 Н), 4,81 (s, 2 Н), 4,40 К [6-(спиро[5.5]ундек-3-илокси)нафталин-2-ил]метанолу (150 мг, 0,46 ммоль) в метиленхлориде (5 мл, 80 ммоль) добавляли перйодинан Десса-Мартина (0,274 г, 0,647 ммоль) и полученный в результате раствор перемешивали при комнатной температуре в течение 1 ч. Неочищенную реакционную смесь затем пропускали через слой силикагеля, фильтрат удаляли в вакууме с получением 6-(спиро[5.5]ундекан 3-илокси)-2-нафтальдегида в виде бесцветного твердого вещества. (0,150 г, 100%). 1 Н ЯМР (400 МГц, CDCl3)10,09 (s, 1H), 8,25 (s, 1H), 7,92-7,89 (m, 2 Н), 7,78 (d, J = 8,7 Гц, 1H), 7,247,19 (m, 2 Н), 4,48 (m, 1H), 1,96-1,29 (m, 18 Н). Пример 38: 2,2-дифтор-3-6-(спиро[5.5]ундекан-3-илокси)нафталин-2-ил)метиламино)пропаноевая кислота Раствор 6-(спиро[5.5]ундек-3-илокси)-нафталин-2-карбальдегида (150 мг, 0,46 ммоль) и 3-амино 2,2-дифторпропионовой кислоты (58,2 мг, 0,465 ммоль) в этаноле (0,7 мл, 10 ммоль) нагревали до возврата флегмы в течение 2 ч. Желтый раствор затем охлаждали до комнатной температуры и порциями добавляли натрий цианоборогидрид (35,1 мг, 0,558 ммоль). Полученную в результате смесь нагревали до возврата флегмы в течение 1 ч. Реакционную смесь затем охлаждали до комнатной температуры и добавляли лимонную кислоту. Раствор перемешивали в течение нескольких минут и растворитель удаляли в вакууме. Полученное в результате твердое вещество суспендировали в воде и фильтровали, и собранное твердое вещество тщательно промывали водой (4), простым эфиром (5) и гексаном (5) с получением (82,1 мг, 41%) 2,2-дифтор-3-6-(спиро[5.5]ундекан-3-илокси)нафталин-2-ил)метиламино)пропаноевой кислоты. 1 Н ЯМР (400 МГц, CDCl3) : 7,93 (s, 1 Н), 7,86 (d, J = 8,5 Гц, 1 Н), 7,83 (d, J = 9,1 Гц, 1 Н), 7,52 (dd, J = 8,4, 1,8 Гц, 1 Н), 7,30 (d, J = 2,2 Гц, 1H), 7,22 (dd, J = 9,0, 2,4 Гц, 1 Н), 4,52 (m, 1 Н), 4,45 (s, 2 Н), 3,60 (t, J = 15,9 Гц, 2 Н), 1,76-1,35 (m, 18 Н). Пример 39: (R)-этил 1-6-(транс-4-трет-бутилциклогексилокси)нафталин-2-ил)метил)пиперидин-3 карбоксилат 6-(4-Трет-бутилциклогексилокси)нафталин-2-карбальдегид (500 мг, 2 ммоль) соединяли с этиловым эфиром (R)-пиперидин-3-карбоновой кислоты (0,51 г, 3,2 ммоль) в метаноле (10 мл, 200 ммоль) и уксусной кислоте (9,2 мкл, 0,16 ммоль). Затем добавляли натрий цианоборогидрид (0,25 г, 4,0 ммоль) и реакционную смесь перемешивали всю ночь при комнатной температуре. Реакцию затем гасили водой и трижды экстрагировали этилацетатом. Органические слои соединяли и высушивали над MgSO4. Твердые вещества удаляли посредством фильтрования и добавляли 10 г силикагеля. Затем удаляли весь растворитель и полученный в результате силикагель загружали в колонку на 24 грамма и продукт элюировали с использованием градиента 0-60% этилацетат/гексан и затем высушивали в вакууме с получением титульного соединения в виде бесцветного масла. EDI-MC: 438,1 (М+Н)+.(R)-1-[6-(4-трет-бутилциклогексилокси)нафталин-2-илметил]пиперидин-3 карбоновой кислоты (363,4 мг, 0,8046 ммоль) растворяли в этаноле (5 мл, 80 ммоль), затем обрабатывали 1 М водным гидроксидом натрия (5 мл, 5 ммоль). Смесь энергично перемешивали в течение 18 ч. Значение рН доводили до 3-4 при помощи 3N HCl и реакционную смесь затем трижды экстрагировали этилацетатом. Органические слои соединяли и затем высушивали над MgSO4, фильтровали и концентрировали до сухого остатка при пониженном давлении. Затем добавляли этиловый эфир и белый осадок, образованный на нем, удаляли посредством фильтрования с получением белого твердого вещества, имеющего чистоту 86% по данным ВЭЖХ. Процесс повторяли еще два раза с получением титульного соединения в виде белого твердого вещества (156 мг, 44 %). EDI-MC: 424,2 (М+Н)+. 1 Н ЯМР (400 МГц, MeOD)= 7,82 (s, 1 Н), 7,74-7,62 (m, 2 Н), 7,42 (d, J = 2,3, 1 Н), 7,19 (d, J = 2,3 Гц, 1 6-(4-трет-бутилциклогексилокси)нафталин-2-карбальдегид (503,27 мг, 1,6212 ммоль) соединяли в метаноле (10 мл, 200 ммоль) с уксусной кислотой (9,2 мкл, 0,16 ммоль). Затем добавляли натрий цианоборогидрид (252,76 мг, 4,0221 ммоль) и реакционную смесь перемешивали всю ночь при комнатной температуре. Затем реакцию гасили водой и трижды экстрагировали этилацетатом. Органические слои соединяли и высушивали над MgSO4. Твердые вещества удаляли посредством фильтрования и добавляли 7 грамм силикагеля. Весь растворитель затем удаляли и полученный в результате кремнезем загружали в колонку на 24 г и продукт элюировали с использованием градиента 0-60% этилацетат/гексан и затем высушивали в вакууме с получением титульного соединения в виде бесцветного масла (366 мг, 45%).(S)-1-[6-(4-трет-бутилциклогексилокси)нафталин-2-илметил]пиперидин-3 карбоновой кислоты (151,23 мг, 0,33484 ммоль) растворяли в этаноле (5 мл, 80 ммоль) и затем обрабатывали 1 М гидроксидом натрия в воде (5 мл, 5 ммоль). Смесь энергично перемешивали в течение 18 ч. рН доводили до 3-4 при помощи 3 N HCl и реакционную смесь затем трижды экстрагировали этилацетатом. Органические слои соединяли и затем высушивали над MgSO4, фильтровали и концентрировали до сухого остатка при пониженном давлении. Затем добавляли диэтиловый эфир и белый осадок, образованный на нем, удаляли посредством фильтрования с получением титульного соединения в виде белого твердого вещества (21 мг, 13%). EDI-MC: 424,1 (М+Н)+. 1 Н ЯМР (400 МГц, MeOD)= 7,82 (s, 1 Н), 7,74-7,62 (m, 2 Н), 7,44 (d,J= 2,3, 1 Н), 7,19 (d, J= 2,3 Гц,1 Н), 7,08 (d, J = 2,5, 1 Н), 4,43-4,34 (m, 1 Н), 4,33-4,22 (m, 2 Н), 2,71 (br. s., 1 H), 2,16 (d, J= 2,0 Гц, 2 H), 1,88167 (m, 4 H), 1,40-1,25 (m, 3 H), 1,24-1,11 (m, 4 H), 1,11-0,94 (m, 5H), 0,80 (s, 9 H). Пример 43: трет-бутиловый эфир 4-[6-(транс-4-трет-бутилциклогексилокси)нафталин-2 илметил]аминомасляной кислоты Раствор 6-(4-трет-бутилциклогексилокси)нафталин-2-карбальдегида (45 мг, 0,15 ммоль, HCl соли трет-бутилового эфира 4-аминомасляной кислоты (115 мг, 0,59 ммоль) и триэтиламина (81 мкл, 0,58 ммоль) в 1,2-дихлорэтане (1,5 мл) обрабатывали натрий триацетоксиборогидридом (65 мг, 0,29 ммоль). После перемешивания при комнатной температуре в течение ночи смесь разбавляли дихлорметаном и промывали водным бикарбонатом натрия. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали и остаток очищали на колонке с силикагелем с элюированием этилацетатом в гексане от 0 до 100% с получением бесцветного масла (33 мг, выход: 50%). ESI-MC: 454,4 (М+Н)+; Раствор трет-бутилового эфира 4-[6-(4-трет-бутилциклогексилокси)нафталин-2 илметил]аминомасляной кислоты (33 мг, 0,073 ммоль) в 4 М HCl в диоксане (1,50 мл) перемешивали при комнатной температуре всю ночь с образованием белого осадка. Осадок фильтровали и промывали простым эфиром с получением продукта в виде HCl соли (20 мг, выход: 63%). ESI-MC: 398,1 (М+Н)+; Раствор 6-(4-трет-бутилциклогексилокси)нафталин-2-карбальдегида (90 мг, 0,29 ммоль), гидрохлорида глицинового этилового эфира (162 мг, 1,16 ммоль), и триэтиламина (0,16 мл, 1,16 ммоль) в 1,2 дихлорэтане (2 мл) обрабатывали натрий триацетоксиборогидридом (129 мг, 0,58 ммоль). Смесь перемешивали при комнатной температуре всю ночь. Раствор разбавляли дихлорметаном и промывали водным бикарбонатом натрия. Органическую фазу высушивали над MgSO4 и концентрировали. Остаток очищали на колонке с силикагелем с элюированием этилацетатом в гексане от 0 до 100% с получением продукта (64 мг, выход: 55%). ESI-MC: 420,30 (М+23)+; 1 Н ЯМР (400 МГц, CDCl3)= 7,66-7,70 (m, 3 Н), 7,41 (dd, 1H), 7,11-7,14 (m, 2H), 4,26 (m, 1H), 4,19 К раствору этилового эфира [6-(4-трет-бутилциклогексилокси)нафталин-2-илметил]аминоуксусной кислоты (60 мг, 0,15 ммоль) в метаноле (1 мл) добавляли водный гидроксид лития (4,2 М,0,5 мл, 2 ммоль) с образованием белого осадка. Смесь в виде суспензии перемешивали при комнатной температуре в течение 3 ч и затем при 50 С в течение 2 ч. Суспензию нейтрализовали 1 N HCl до рН 6 и белый осадок фильтровали и высушивали в вакууме с получением белого осадка (48 мг, выход: 86%). К раствору оксалатной соли диэтилового эфира (2-аминоэтил)фосфиновой кислоты (200 мг, 0,74 ммоль) в 1,2-дихлорэтане (3 мл) добавляли 6-(4-трет-бутилциклогексилокси)нафталин-2-карбальдегид(343 мг, 1,1 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч, затем добавляли натрий триацетоксиборогидрид (329 мг, 1,5 ммоль). После перемешивания при комнатной температуре всю ночь реакцию гасили водой, перемешивали при комнатной температуре в течение 30 мин, затем разбавляли этилацетатом и промывали водным NaHCO3. Органический слой высушивали над MgSO4 и очищали на колонке с силикагелем с элюированием этилацетатом (100%), с последующим элюированием метанолом в дихлорметане от 0 до 15% с получением вязкого масла (130 мг, выход: 25%). ESI-MC: 476,3(2-[6-(4-трет-бутилциклогексилокси)нафталин-2 илметил]аминоэтил)фосфиновой кислоты (65,00 мг, 0,14 ммоль) в ацетонитриле (1 мл) добавляли бромтриметилсилан (1 мл, 7,58 ммоль). Реакционную смесь затем перемешивали при 50 С всю ночь. После того, как растворитель концентрировали, остаток очищали при помощи ВЭЖХ (ацетонитрил-вода, 1585%) с получением белого осадка (33 мг, выход: 58). ESI-MC: 420,2 (М+Н)+; 1 Н ЯМР (400 МГц, ДМСО)= 7,81-7,91 (m, 3 Н), 7,51 (dd, 1H), 7,41 (d, 1H), 7,19 (dd, 1 Н), 4,40 (m,1H), 4,31 (s, 2 Н), 3,12 (m, 2 Н), 2,21 (d, 2 Н), 1,97 (m, 2 Н), 1,82 (d, 2 Н), 1,36 (q, 2 Н), 1,22 (q, 2 Н), 1,08 (m,1H), 0,88 (s, 9H). Пример 49: трет-бутиловый эфир 5-гидрокси-2,3-дигидроиндол-1-карбоновой кислоты Смесь 2,3-дигидро-1H-индол-5-ола (1,0 г, 7,8 ммоль), ди-трет-бутилдикарбоната (4,0 г, 18 ммоль),хлороформа (20 мл) и насыщенного водного раствора бикарбоната натрия (8 мл) перемешивали при комнатной температуре в течение ночи. Органическую фазу отделяли и дважды промывали водой, высушивали над MgSO4, фильтровали и концентрировали с получением неочищенного продукта. Неочищенное вещество обрабатывали простым эфиром и фильтровали с получением продукта (1,1 г, выход: 60%). ESIMC: 258,10 (М+23)+, 1 Н ЯМР (400 МГц, ДМСО)9,00 (s, 1H), 7,48 (ws, 1H), 6,61 (d, 1 Н), 6,51 (dd, 1H),3,84 (t, 2H), 2,96 (t, 2H), 1,48 (s, 9H). Пример 50: трет-бутиловый эфир 5-(транс-4-трет-бутилциклогексилокси)-2,3-дигидроиндол-1 карбоновой кислоты К смеси трет-бутилового эфира 5-гидрокси-2,3-дигидроиндол-1-карбоновой кислоты (0,6 г, 2,6 ммоль) в трет-бутиловом спирте (8 мл) и 2-бутаноне (4 мл) добавляли карбонат цезия (2,5 г, 7,7 ммоль) с последующим добавлением 4-трет-бутилциклогексилового эфира метансульфоновой кислоты (1,9 г, 7,7 ммоль). Смесь нагревали в герметично закрытой виале при 100 С в течение ночи с образованием осадка. Смесь обрабатывали дихлорметаном и осадок отфильтровывали и растворитель концентрировали. Остаток очищали на колонке с силикагелем с элюированием этилацетатом в гексане от 0 до 30% с получением осадка (0,96 г, выход: 100%). ESI-MC: 373,30 (М)+. Пример 51: 5-(транс-4-трет-бутилциклогексилокси)-2,3-дигидро-1H-индол К раствору трет-бутилового эфира 5-(4-трет-бутилциклогексилокси)-2,3-дигидроиндол-1 карбоновой кислоты (0,92 г, 2,5 ммоль) в ТГФ (10 мл) добавляли 4 М HCl в диоксане (6 мл, 25 ммоль). Смесь перемешивали при комнатной температуре в течение 48 ч с образованием белого осадка. Данную смесь разделяли на фракции между дихлорметаном и водным раствором бикарбоната натрия, и органическую фазу высушивали над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали на колонке с силикагелем с элюированием метанолом в дихлорметане от 0 до 8% с получением осадка К раствору 5-(4-трет-бутилциклогексилокси)-2,3-дигидро-1 Н-индола (110 мг, 0,4 ммоль) в диметилформамиде (2 мл) добавляли НОВТ моногидрат (10 мг, 0,1 ммоль), 4-трет-бутиловый эфир 2-третбутоксикарбониламино-янтарной кислоты (230 мг, 0,8 ммоль) и наконец N-(3-диметиламинопропил)-N'этилкарбодиимид гидрохлорид (92 мг, 0,48 ммоль). Реакционную смесь нагревали при 50 С всю ночь. Раствор разбавляли простым эфиром и дважды промывали водой. Органическую фазу высушивали надMgSO4, фильтровали и концентрировали с получением неочищенного продукта (220 мг, выход: 100%). Неочищенный продукт непосредственно использовали в примере 53, ESI-МС: 545,4 (М+Н)+. Пример 53: 3-амино-4-[5-(транс-4-трет-бутилциклогексилокси)-2,3-дигидроиндол-1-ил]-4-оксомасляной кислоты(1 мл) добавляли трифторуксусную кислоту (ТФУК) (0,8 мл, 10 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель концентрировали и осадок очищали при помощи ВЭЖХ с получением белого осадка продукта - соли трифторуксусной кислоты (22 мг, выход: 13%). ESI-MC: 389,3 (М+Н)+; 1 Н ЯМР (400 МГц, ДМСО)7,96 (d, 1 Н), 6,92 (d, 1H), 6,76 (dd, 1H), 4,45 (m, 1 Н), 4,11-4,25 (m, 3 Н), 3,15 (t, 2H), 3,04 К раствору 5-(4-трет-бутил-циклогексилокси)-2,3-дигидро-1 Н-индола (0,55 г, 2 ммоль), триэтиламина (0,56 мл, 4 ммоль) в дихлорметане (8 мл) добавляли хлорацетил хлорид (0,2 мл, 2,6 ммоль) при 0 С. Раствор перемешивали от 0 С до комнатной температуры в течение 4 ч. Раствор разбавляли дихлорметаном и промывали 5% водным раствором лимонной кислоты, водным раствором бикарбоната натрия, и водой, высушивали над MgSO4, и концентрировали. Остаток очищали на колонке с силикагелем с элюированием этилацетатом в гексане с получением продукта (0,37 г, выход: 52%). ESI-MC: 350,2 (М+Н)+. Пример 55: диэтиловый эфир (2-2-[5-(транс-4-трет-бутилциклогексилокси)-2,3-дигидроиндол-1 ил]-2-оксоэтиламиноэтил)фосфиновой кислоты К раствору 1 -[5-(4-трет-бутилциклогексилокси)-2,3-дигидроиндол-1-ил]-2-хлорэтанона (60 мг, 0,2 ммоль) и диэтилового эфира (2-аминоэтил)фосфиновой кислоты, соли щавелевой кислоты (93 мг, 0,34 ммоль) в диметилформамиде (1,5 мл) добавляли бромид лития (18 мг, 0,2 ммоль) и карбонат калия (76 мг, 0,55 ммоль). После перемешивания при 70 С всю ночь смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу промывали 5% водным раствором лимонной кислоты, водным раствором бикарбоната натрия, и водой, высушивали над MgSO4 и концентрировали. Остаток очищали на колонке с силикагелем с получением продукта (20 мг, выход: 25%). ESI-MC: 495,3 (М+Н)+ Пример 56: К перемешиваемому раствору диэтилового эфира (2-2-[5-(4-трет-бутилциклогексилокси)-2,3 дигидроиндол-1-ил]-2-оксоэтиламиноэтил)фосфиновой кислоты (16 мг, 0,03 ммоль) в ацетонитриле (0,5 мл) добавляли при перемешивании бромтриметилсилан (0,5 мл, 4 ммоль). Реакционную смесь переме- 22024435 шивали при 50 С всю ночь. После того, как растворитель концентрировали, остаток очищали при помощи ВЭЖХ (ацетонитрил-вода) с получением белого осадка продукта (7,5 мг, выход: 53%). ESI-MC: 439,2 6-Бром-2-гидроксихинолин обрабатывали цис-4-трет-бутилциклогексанолом в условиях реакции Мицунобу, с получением 6-бром-2-транс)-4-трет-бутилциклогексилокси)хинолина. 6-Бром-2-транс)4-трет-бутилциклогексилокси)хинолин затем подвергали воздействию н-бутиллития и ДМФ, с получением 6-формил-2-транс)-4-трет-бутилциклогексилокси)хинолина. Данный альдегид затем обрабатывали 3-аминопропионовой кислотой и натрий цианоборогидридом с получением титульного соединения, 32-транс)-4-трет-бутилциклогексилокси)хинолин-6-ил)метиламино)пропаноевой кислоты. Пример 58: 3-6-транс)-4-трет-бутилциклогексилокси)хинолин-2-ил)метиламино)пропаноевая кислота 6-Гидрокси-2-метилхинолин обрабатывали цис-4-трет-бутилциклогексанолом в условиях Мицунобу, с получением 6-транс)-4-трет-бутилциклогексилокси)-2-метилхинолина, который в свою очередь окисляли трет-бутилпероксидом водорода и диоксидом селена в диоксане, с получением 6-транс)-4 трет-бутилциклогексилокси)-2-формилхинолина. Данный альдегид затем обрабатывали трет-бутил 3 аминопропионатом и натрий цианоборогидридом в дихлорэтане с получением трет-бутил 3-6-транс)4-трет-бутилциклогексилокси)хинолин-2-ил)метил)амино)пропионата. Обработка гидроксидом лития в метанол/ТГФ приводила к получению титульного соединения,3-6-транс)-4-третбутилциклогексилокси)хинолин-2-ил)метиламино)пропаноевой кислоты. Пример 59: трет-бутил 3-(метилсульфонамидо)-3-оксопропилкарбамат(100 мл). Затем к смеси добавляли метансульфонамид (1,43 г, 15,1 ммоль, 0,7 экв.), диметиламинопропилкарбодиимид (3,45 г, 18,2 ммоль, 0,85 экв.) и диметиламинопиридин (0,37 г, 3 ммоль, 0,15 экв.) и перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь охлаждали до 0 С, добавляли ледяную воду (100 мл). Смесь перемешивали в течение 15 мин, разделяли и водный слой дважды экстрагировали ДХМ. Соединенный органический слой промывали 5% HCl, солевым раствором, высушивали над Na2SO4, концентрировали с получением трет-бутил 3-(метилсульфонамидо)-3-оксопропилкарбамата в виде серого масла (3,6 г, 90%). ESI-MC (М+Н)+: 267,1, 1 Н ЯМР (400 МГц, ДМСО-d6) : 6,91-6,83 (brs,1H), 3,36 (s, 3H), 3,19-3,12 (m, 2H), 2,41 (t, 2H), 1,37 (s, 9H). Пример 60: 3-амино-N-(метилсульфонил)пропанамид(60 мл). Затем к смеси добавляли CF3COOH (1,1 мл, 0,3 ммоль, 20 экв.) при 0 С и перемешивали в течение 2 ч при 0 С. Реакционную смесь концентрировали. Остаток очищали при помощи флешхроматографии с получением 3-амино-N-(метилсульфонил)пропанамида в качестве прозрачного твердого вещества (1,8 г, 80%). (подвижная фаза: СН 3 ОН/Н 2 О = 0-5%). ESI-MC (М+1)+: 167,0, 1 Н ЯМР (400 МГц, CD3OD) : 3,21-3,11 (m, 2H), 3,07 (s, 3 Н), 2,60-2,54 (m, 2H). 6-Транс)-4-трет-бутилциклогексилокси)-2-нафтальдегид (300 мг, 0,96 ммоль, 1 экв.) и 3-амино-N(метилсульфонил)пропанамид (239 мг, 1,19 ммоль, 1,5 экв.) растворяли в безводном EtOH. Смесь перемешивали при 80 С в течение 1 ч. Затем к смеси добавляли NaBH3CN (110 мг, 1,74 ммоль, 2 экв.) и перемешивали при 80 С в течение 16 ч. Органический слой концентрировали и очищали при помощи препаративной ТСХ с получением 3-6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-N(метилсульфонил)пропанамида в виде белого твердого вещества (62 мг, 14%). (подвижная фаза: СН 3 ОН/ДХМ = 1:10). ESI-МС (М+1)+: 461,2, ВЭЖХ: 96,38%. 1 Н ЯМР (400 МГц, ДМСО-d6) : 7,93 (s, 1H), 7,85-7,77 (m, 2 Н), 7,59-7,49 (m, 1H), 7,43-7,35(m, 1 Н),7,20-7,11(m, 1 Н), 4,45-4,33 (m, 1 Н), 4,20 (s, 2 Н), 2,98 (t, 2 Н), 2,77 (s, 3 Н), 2,35 (t, 2 Н), 2,26-2,14 (m, 2 Н),1,86-1,75 (m, 2 Н), 1,41-1,30 (m, 2 Н), 1,27-1,14 (m, 2 Н), 1,13-1,02 (m, 1H), 0,89 (s, 9H). Пример 62: 3-6-транс)-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2-ил)метиламино)-N-(метилсульфонил)пропанамид(15 мг, 0,13 ммоль, 0,1 эквив.) и (Вос)2 О (520 мг, 2,38 ммоль, 2 экв.) добавляли к смеси и перемешивали в течение 18 ч при комнатной температуре. Реакционную смесь промывали 5% HCl, солевым раствором,высушивали над Na2SO4, концентрировали и очищали при помощи препаративной ТСХ с получением этил 3-(трет-бутоксикарбонил 6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метил)амино)пропаноата в виде желтого масла (478 мг, 78%). (подвижная фаза:ЕА/РЕ=1:8). ESI-MC (М+1)+: 512,3,1 Н ЯМР (400 МГц, CDCl3) : 7,71-7,63 (m, 2 Н), 7,61-7,53 (m, 1 Н), 7,38-7,27 (m, 1H), 7,15-7,10 (m, 2 Н), 4,57 К раствору этил 3-(трет-бутоксикарбонил 6-транс)-4-третбутилциклогексилокси)нафталин-2-ил)метил)амино)пропаноата (485 мг, 0,94 ммоль) в EtOH (10 мл) добавляли водный раствор NaOH (2 мл, 20%, 5,0 экв.) и кипятили с обратным холодильником в течение 2 ч. Затем реакционную смесь охлаждали до 0 С, рН раствора доводили до 6 при помощи 1 М HCl, концентрировали и остаток растворяли в ДХМ, промывали водой, высушивали и концентрировали с получением 3-(трет-бутоксикарбонил 6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метил)амино)пропаноевой кислоты в виде серого масла (392 мг, 75%). ESI-MC (М+Н+): 484,3, 1 Н ЯМР (400 МГц, ДМСОd6) : 7,79-7,72 (m, 2 Н), 7,62-7,57 (m, 1H), 7,35-7,26 (m, 2 Н), 7,14-7,08 (m, 1 Н), 4,49 (s, 2 Н), 4,41-4,30 (m,1H), 3,38-3,26 (m, 2 Н), 2,33-2,26 (t, 2H), 2,23-2,15 (m, 2 Н), 1,95-1,84 (m, 2 Н), 1,47-1,28 (m, 11 Н), 1,27-1,15 Использовали процедуру получения трет-бутил 3-(метилсульфонамидо)-3-оксопропилкарбамата с получением трет-бутил (6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метил(3-(циклопропансульфонамидо)-3-оксопропил)карбамата. 435 мг, серое масло, 100%. ESI-MC (М+1)+: 587,3, 1 Н ЯМР (400 МГц, ДМСО-d6) : 7,80-7,73 (m, 2 Н), 7,64-7,59 (m, 1H), 7,36-7,27 (m, 2 Н), 7,15-7,10 (m, 1 Н), 4,50 (s, 2 Н),4,40-4,32 (m, 1H), 3,45-3,45 (m, 2 Н), 2,94-2,86 (m, 1H), 2,56-2,52 (m, 2 Н), 2,24-2,15 (m, 2 Н), 1,85-1,77 (m,2 Н), 1,51-1,27 (m, 11 Н), 1,25-0,99 (m, 7 Н), 0,87 (s, 9H). Пример 66: 3-6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-N-(циклопропилсульфонил)пропанамид Использовали процедуру получения 3-амино-N-(метилсульфонил)пропанамида для получения 36-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-N-(циклопропилсульфонил)пропанамида. 92 мг, белое твердое вещество, 25%. ESI-MC (М+1)+: 487,3, 1 Н ЯМР (400 МГц, ДМСО-d6) : 7,94-7,90 (m, 1 Н), 7,86-7,79 (m, 2 Н), 7,55-7,50 (m, 1H), 7,41-7,38 (m, 1H), 7,20-7,14 (m, 1 Н), 4,44-4,34 (m,1 Н), 4,23 (s, 2H), 3,02 (t, 2 Н), 2,79-2,71 (m, 1 Н), 2,37 (t, 2 Н), 2,25-2,16 (m, 2 Н), 1,86-1,76 (m, 2 Н), 1,41-1,28 Процедуру осуществляли так, как описано в примере 28, с получением 2-6-транс)-4-третбутилциклогексилокси)-5-(трифторметил)нафталин-2-ил)метиламино)уксусной кислоты. 50 мг, очищали при помощи препаративной ВЭЖХ-(0,05% ТФУК/вода: МеОН = 0-95%), белое твердое вещество (выход: 44%). ESI-MC (М+Н+): 438,2 ВЭЖХ: 96,18%. 1 Н ЯМР (400 МГц, CD3OD) : 8,20 (d, 1H), 8,08 (d, 1H), 7,98 Процедуру осуществляли так, как описано в примере 27, с получением этил 4-6-транс)-4-третбутилциклогексилокси)-5-(трифторметил)нафталин-2-ил)метиламино)бутаноата, 160 мг, очищали при помощи препаративной ВЭЖХ (0,05% ТФУК/вода: МеОН = 0-95%), белое твердое вещество (выход: 61%). ESI-MC (М+Н+): 494,3, ВЭЖХ: 95,66%. 1 Н ЯМР (400 МГц, CD3OD) : 8,22 (d, 1H), 8,11 (d, 1H), 8,03 К раствору этил 4-6-транс)-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2 ил)метиламино)бутаноата (150 мг, 0,30 ммоль) в ТГФ (15 мл) добавляли 1 М HCl (3 мл) и кипятили с обратным холодильником в течение 1 ч. Затем реакционную смесь концентрировали с получением 4-6 транс)-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2-ил)метиламино)бутаноевой кислоты в виде белого твердого вещества, очищали при помощи препаративной ВЭЖХ (0,05% ТФУК/вода: МеОН = 0-95%), 50 мг, белое твердое вещество (выход: 34%). ESI-MC (М+Н+): 466,3 ВЭЖХ: 96,13%. 1 Н ЯМР (400 МГц, CD3OD) : 8,20 (d, 1H), 8,10 (d, 1H), 8,01 (d, 1H), 7,65 (dd, 1H), 7,57 (d, 1H), 4,50-4,46 (m,1H), 4,34 (s, 2H), 3,16 (t, 2H), 2,46 (d, 2H), 2,21 (d, 2H), 1,98 (t, 2H), 1,90 (d, 2H), 1,49 (q, 2H), 1,25 (q, 2H),1,14-1,08 (m, 1H), 0,91 (s, 9H). Пример 71: метил 1-6-транс)-4-трет-бутилциклогексилокси)-5-фторнафталин-2-ил)метил)азетидин-3-карбоксилат Смесь соединения метил 1-6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2 ил)метил)азетидин-3-карбоксилата (150 мг, 0,37 ммоль) и N-фторбензолсульфонамида (175 мг, 0,56 ммоль, 1,5 экв.) нагревали до 80 С и перемешивали в течение 4 ч в атмосфере N2. Затем смесь очищали при помощи хроматографии на силикагеле с использованием РЕ/ЕА (6/1) в качестве элюента с получением продукта метил 1-6-(транс-4-трет-бутилциклогексилокси)-5-(трифторметил)нафталин-2 ил)метил)азетидин-3-карбоксилата в виде светло-желтого масла (40 мг, 34%). EDI-MC (М+1)+: 428,1, 1 Н ЯМР (400 МГц, CDCl3)7,97 (d, 1H), 7,65-7,62 (m, 1 Н), 7,52-7,41 (m, 2 Н), 7,25-7,22 (m, 1 Н), 4,22-4,17 (m,1 Н), 3,74 (s, 2H), 3,71 (s, 3 Н), 3,59-3,54 (m, 2 Н), 3,37-3,36 (m, 3 Н), 2,22-2,19 (m, 2 Н), 1,86-1,84 (m, 2 Н),1,54-1,45 (m, 2 Н), 1,19-1,08 (m, 3 Н), 0,86 (s, 9H). Пример 72: этил 1-6-транс)-4-трет-бутилциклогексилокси)-5-хлорнафталин-2-ил)метил)азетидин-3-карбоксилатMeCN (5 мл). Затем к смеси добавляли CF3COOH (12 мг, 0,1 ммоль, 0,3 экв.) при 0 С. Смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Затем рН раствора доводили до 7 при помощи насыщенного раствора Na2CO3, концентрировали и смесь экстрагировали EtOAc. Органический слой концентрировали и очищали при помощи хроматографии на силикагеле с использованием РЕ/ЕА (6/1) с получением продукта метил 1-6-транс)-4-трет-бутилциклогексилокси)-5-хлорнафталин-2 ил)метил)азетидин-3-карбоксилата(65 мг, 43%) в виде светло-желтого масла. EDI-MC (М+1)+: 444,0. 1 Н ЯМР (400 МГц, CDCl3)8,16 (d, 1 Н), 7,69-7,66 (m, 2H), 7,50-7,47 (m, 1H), 7,28-7,27 (m, 1H), 4,25-4,19 (m,1H), 3,77 (s, 2H), 3,72 (s, 3H), 3,59-3,58 (m, 2H), 3,38-3,37 (m, 3H), 2,23-2,20 (m, 2H), 1,88-1,85 (m, 2H),1,61-1,52 (m, 2H), 1,12-1,07 (m, 3H), 0,87 (s, 9H). Пример 73: 1-6-транс)-4-трет-бутилциклогексилокси)-5-фторнафталин-2-ил)метил)азетидин-3 карбоновая кислота тидин-3-карбоксилата 40 мг, 0,09 ммоль) в EtOH (3 мл) добавляли водный раствор NaOH (2 мл, 1%, 5,0 экв.) и кипятили с обратным холодильником в течение 1 ч. Затем реакцию охлаждали до 0 С, рН раствора доводили до 6 при помощи 1 М HCl, концентрировали и остаток промывали при помощи ДХМ и воды,высушивали в вакууме с получением продукта 1-6-транс)-4-трет-бутилциклогексилокси)-5 фторнафталин-2-ил)метил)азетидин-3-карбоновой кислоты (30 мг, 78%) в виде белого твердого вещества. EDI-MC (М+1)+: 414,0. ВЭЖХ: 91,27%. 1 Н ЯМР (400 МГц, CD3OD)8,09-8,01 (m, 2H), 7,74-7,71 (m,1 Н), 7,59-7,58 (m, 1 Н), 7,48 (t, 1 Н), 4,57 (s, 2 Н), 4,38-4,32 (m, 5 Н), 3,76-3,70 (m, 1 Н), 2,21-2,19 (m, 2 Н),1,91-1,88 (m, 2 Н), 1,53-1,44 (m, 2 Н), 1,24-1,10 (m, 3 Н), 0,90 (s, 9 Н). Пример 74: 1-6-транс)-4-трет-бутилциклогексилокси)-5-хлорнафталин-2-ил)метил)азетидин-3 карбоновая кислота Процедуру осуществляли так,как для 1-6-транс)-4-трет-бутилциклогексилокси)-5 фторнафталин-2-ил)метил)азетидин-3-карбоновой кислоты с получением титульного соединения в виде твердого вещества (35 мг, 56%). EDI-MC (М+1)+: 430,0. ВЭЖХ: 91,27%. 1 Н ЯМР (400 МГц, CD3OD)8,29-8,26 (m, 1H), 8,00-7,90 (m, 2 Н), 7,64-7,53 (m, 2 Н), 4,49 (s, 2 Н), 4,45-4,38 (m, 1 Н), 4,22-4,19 (m, 4 Н),3,49-3,42 (m, 1 Н), 2,28-2,24 (m, 2 Н), 1,96-1,92 (m, 2 Н), 1,60-1,51 (m, 2 Н), 1,30-1,16 (m, 3 Н), 0,94 (s, 9H). Пример 75: метил 3-(бензиламино)-2-метилпропаноат Смесь метил метакрилата (7 мл, 0,067 моль, 1,0 экв.), бензиламина (6 мл, 0,055 моль, 0,8 экв.) в метаноле (5 мл) перемешивали при 70 С в течение 2 дней. После испарения летучих веществ неочищенный продукт очищали при помощи флеш-хроматографии (ДХМ: МеОН = 20:1) с получением соединения метил 3-(бензиламино)-2-метилпропаноат 9 г, выход: 65%) в виде желтого масла. 1 Н ЯМР (400 МГц, CDCl3)(87 мг, 1,4 ммоль, 0,1 экв.) в метаноле (30 мл) добавляли Pd/C (10%, 0,3 г). Полученную в результате смесь перемешивали в атмосфере водорода при 25 С в течение 16 ч. Катализатор отфильтровывали и фильтрат концентрировали с получением метил 3-амино-2-метилпропаноата (1,4 г, выход: 83%) в виде желтого масла. 1 Н ЯМР (400 МГц, CDCl3) : 3,72 (s, 3 Н), 3,06-3,01 (m, 1 Н), 2,91-2,86 (m, 1 Н), 2,77-2,72 Получение метил 3-6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-2 метилпропаноата осуществляли так, как описано для примера 27. 110 мг, бледно-желтого твердого вещества, выход: 35%. ESI-MC (М+Н)+: 412,1. ВЭЖХ: 93,41%. 1 Н ЯМР (400 МГц, CDCl3) : 7,70-7,65 (m, 3H),7,34 (d, 1H), 7,10 (dd, 1H), 7,01 (d, 1 Н), 4,16-4,09 (m, 1 Н), 3,96 (s, 2 Н), 3,65 (s, 3 Н), 3,143-3,138 (m, 1H),2,92 (d, 2H), 2,16-2,12 (m, 2 Н), 1,84-1,81 (m, 2 Н), 1,39-1,26 (m, 2 Н), 1,15-1,05 (m, 6 Н), 0,88 (s, 9H). Пример 78: 3-6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-2-метилпропаноевая кислота Получение 3-6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-2-метилпропаноевой кислоты осуществляли так, как описано для примера 77, 100 мг, желтое твердое вещество, выход: 94%. ESI-MC (М+Н)+: 398,1. ВЭЖХ: 97,60%. 1 Н ЯМР (400 МГц, CDCl3) : 7,84 (s, 1H), 7,72-7,68 (m,2H), 7,59 (d, 1H), 7,15-7,10 (m, 2H), 4,33-4,24 (m, 3H), 3,11-2,82 (m, 3H), 2,25-2,21 (m, 2H), 1,89-1,86 (m,2H), 1,48-1,11 (m, 9H), 0,89 (s,9H). Пример 79: этил 2-циано-2-метилпропаноат Раствор этил 2-цианоацетата (3 г, 0,026 моль, 1,0 экв.) в тетрагидрофуране (80 мл) охлаждали на водно-ледяной бане, с последующим добавлением гидрида натрия (2,6 г, 0,104 моль, 4,0 экв.) несколькими порциями. Суспензию перемешивали при комнатной температуре. Затем добавляли йодметан (11 г,0,078 ммоль, 3,0 экв.) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч перед тем, как гасили водой. Смесь экстрагировали этилацетатом и промывали солевым раствором, высушивали над Na2SO4 и концентрировали с получением неочищенного продукта этил 2-циано-2 метилпропаноата (3,2 г, выход: 85%) в виде темно-зеленого масла. 1 Н ЯМР (400 МГц, CDCl3) : 4,27 (q,2H), 1,62 (s, 6H), 1,34 (t, 3 Н). Пример 80: этил 3-амино-2,2-диметилпропаноат К раствору этил 2-циано-2-метилпропаноат (0,6 г, 4,2 ммоль, 1,0 экв.) в 6 мл этанол/гидроксид аммония (10:1) добавляли Ra/Ni (20%, 0,12 г). Полученную в результате смесь перемешивали в атмосфере водорода при комнатной температуре в течение 16 ч. Катализатор отфильтровывали и фильтрат концентрировали с получением этил 3-амино-2,2-диметилпропаноата (0,43 г, выход: 70%) в виде желтого масла. 1 Н ЯМР (400 МГц, CDCl3) : 4,15 (q, 2H), 2,77 (s, 2H), 1,76 (s, 2H), 1,26 (t, 3 Н), 1,18 (s, 6H). Пример 81: этил 3-6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-2,2 диметилпропаноатCuCN (742 мг, 8,34 ммоль, 1,5 экв.) растворяли в ДМСО (5 мл). Затем смесь перемешивали при 125 С в течение 15 ч. Добавляли воду и смесь экстрагировали этилацетатом и органический слой очищали при помощи хроматографии на колонке с силикагелем с использованием РЕ/ЕА (10/1) с получением продукта в виде светло-желтого твердого вещества (1,423 г, 82%). EDI-MC (М+1)+: 308,0 1 Н ЯМР (400 МГц,CDCl3)8,12 (s, 1H), 7,78-7,73 (m, 2 Н), 7,54 (dd, 1H), 7,22 (dd, 1H), 7,14 (s, 1H), 4,33-4,30 (m, 1 Н), 2,292,25 (m, 2 Н), 1,93-1,90 (m, 2 Н), 1,48-1,26 (m, 2 Н), 1,25-1,10 (m, 3 Н), 0,91 (s, 9H). Пример 84: (6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метанаминNH4OH (0,3 мл, 6,65 ммоль, 1,2 экв.) растворяли в МеОН (5 мл). Затем к смеси добавляли Ni Рэнея (64 мг, 1,11 ммоль, 0,2 экв.) и раствор суспензии перемешивали при комнатной температуре в атмосфере водорода в течение 15 ч. Смесь фильтровали и очищали при помощи хроматографии на колонке с силикагелем с использованием ДХМ/МеОН (10/1) в качестве элюента с получением продукта в виде бледного твердого вещества (1,76 г, 63%). ESI-MC (M-NH2)+ 295,1. 1 Н ЯМР (400 МГц, CDCl3)7,71-7,65 (m, 3 Н),7,38 (dd, 1H), 7,15-7,11 (m, 2 Н),4,28-4,24 (m, 1 Н), 3,98 (s, 2 Н), 2,30-2,26 (m, 2 Н), 1,91-1,87 (m, 2 Н), 1,76 (s,2 Н), 1,46-1,40 (m, 2 Н), 1,21-1,12 (m, 3 Н), 0,90 (s, 9H). Пример 85: этил 3-6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-2 гидроксипропаноат(6-Транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метанамин (311 мг, 1,0 ммоль, 1,0 экв.) и этилоксиран-2-карбоксилат (116 мг, 1,0 ммоль, 1,0 экв.) растворяли в EtOH (5 мл). Затем смесь кипятили с обратным холодильником в течение 2 ч. Смесь концентрировали и очищали при помощи хроматографии на колонке с силикагелем с использованием ДХМ/МеОН (10/1) в качестве элюента с получением продукта в виде светло-желтого масла (311 мг, 35%). EDI-MC (М+1)+: 428,1. ВЭЖХ: 92,02%. 1 Н ЯМР Получение 3-6-транс)-4-трет-бутилциклогексилокси)нафталин-2-ил)метиламино)-2-гидроксипропаноевой кислоты осуществляли так, как описано для примера 28. 50 мг, белое твердое вещество,выход: 38%. ESI-MC (М+Н)+: 400,2. ВЭЖХ: 99,87%. 1 Н ЯМР (400 МГц, CD3OD) : 7,46-7,36 (m, 3 Н), 7,24(3,18 г, 22,5 ммоль, 3 экв.) растворяли в ацетоне (6 мл) и смеси перемешивали в течение 16 ч при 80 С. Реакционную смесь фильтровали, концентрировали с получением неочищенного продукта в виде желто- 29
МПК / Метки
МПК: A01N 43/42
Метки: сфингозин, аналоги, 1-фосфата, бициклические, арильные
Код ссылки
<a href="https://eas.patents.su/30-24435-biciklicheskie-arilnye-analogi-sfingozin-1-fosfata.html" rel="bookmark" title="База патентов Евразийского Союза">Бициклические арильные аналоги сфингозин 1-фосфата</a>
Предыдущий патент: Идентификация и аутентификация с использованием маркировки полимерным жидкокристаллическим материалом
Следующий патент: Способ ранней диагностики онкологических заболеваний
Случайный патент: Способ закупоривания отверстия и охлаждающий элемент, изготовленный при использовании этого способа












