Бициклические пиримидины и бициклические 3,4-дигидропиримидины как ингибиторы клеточной пролиферации
Номер патента: 3640
Опубликовано: 28.08.2003
Авторы: Тугуд Питер, Хэмби Джэймс Марино, Трумпп-Каллмейер Сузанн А., Добрасин Эллен Мира, Шовольтер Ховард Дэниель Холлис, Крэмер Джеймс Бернард, Шрёдер Мел Конрад
Формула / Реферат
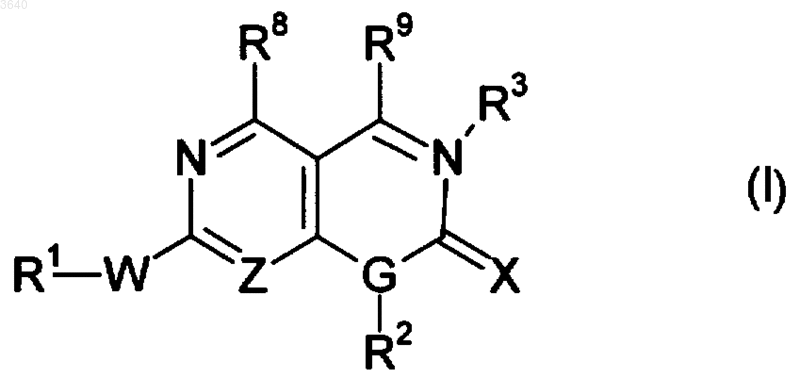
1. Соединения формулы (I)
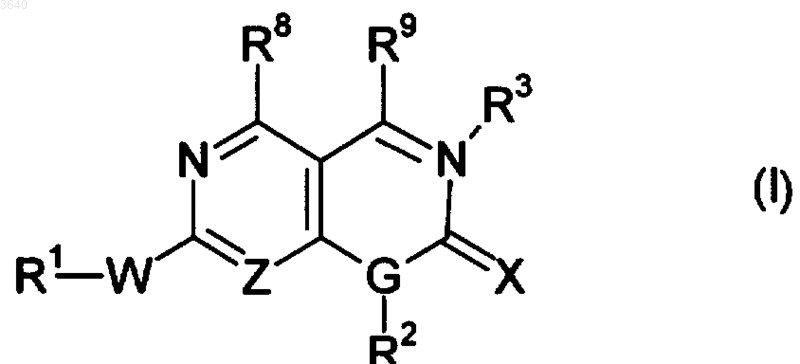
и его фармацевтически приемлемые соли, где
пунктирная линия означает необязательную двойную связь;
Z означает N или CH;
G означает N или CH;
W означает NH, S, SO или SO2;
X означает O, S или NR10;
R1, R2 и R10 независимо выбраны из ряда: H, (CH2)nAr, где Ar означает фенил, 3-хлорфенил, 2,6-дибромфенил, 2,4,6-трибромфенил, 1-нафтил, 4,7-дихлор-2-нафтил и n означает 0, 1, 2 или 3, группа COR4, (CH2)nгетероарил, где гетероарил имеет 4-9 кольцевых атомов, из которых 1-4 атома независимо выбраны из группы, включающей O, S и N, или представляет собой 2-пиридил, 3-метил-2-пиридил, 3-бензотиенил, 4-этил-2-бензотиенил, 2-фуранил, 3,4-диэтил-2-фуранил, пирролил, пиразолил, имидазолил или тиазолил и n имеет вышеуказанное значение, гетероциклил, представляющий собой циклоалкил, имеющий, по меньшей мере, один гетероатом из числа O и S, или пирролидинил, пиперидил и морфолинил, разветвленный или неразветвленный алкил с 1-10 атомами углерода, циклоалкил с 3-10 атомами углерода, алкенил с 2-10 атомами углерода, алкинил с 2-10 атомами углерода, при этом группы (CH2)nAr, (CH2)nгетероарил, алкил, циклоалкил, алкенил и алкинил могут быть замещены 1-5 остатками из группы, включающей NR4R5, N(O)R4R5, NR4R5R6Y, где Y означает галоидный противоион из группы, включающей фтор, хлор, бром и йод, неразветвленный или разветвленный алкил с 1-10 атомами углерода, фенил, незамещенный или замещенный хлором в положении 3, бромом в положениях 2, 6 или 2, 4 и 6, (CH2)nгетероарил, где гетероарил выбран из группы, включающей 2-пиридил, 3-метил-2-пиридил, 3-бензотиенил, 4-этил-2-бензотиенил, 2-фуранил, 3,4-диэтил-2-фуранил, пирролил, пиразолил, имидазолил или тиазолил, и n имеет вышеуказанное значение, гидроксил, неразветвленную или разветвленную алкоксигруппу с 1-10 атомами углерода, группу -O-(CH2)2-O-CH3, фенокси, тиол, тиоалкил, где алкил имеет вышеуказанное значение, фтор, хлор, бром, йод, COR4, CO2R4, CONR4R5, SO2NR4R5, SO3R4, PO3R4, альдегид, нитрил, нитро, гетероарилокси, где гетероарил представляет собой 2-пиридил, 3-метил-2-пиридил, 3-бензотиенил, 4-этил-2-бензотиенил, 2-фуранил, 3,4-диэтил-2-фуранил, пирролил, пиразолил, имидазолил, тиазолил,
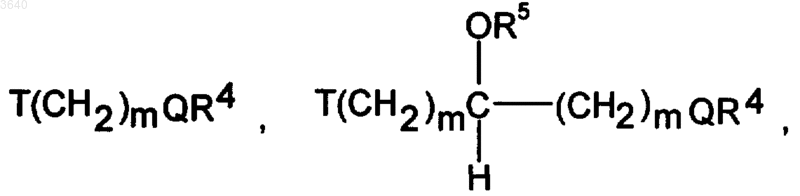
C(O)T(CH2)mQR4 , NHC(O)T(CH2)mQR4, T(CH2)mC(O)NR4NR5, T(CH2)mCO2R4,
где m независимо означает 1-6,
T означает O, S, NR4, N(O)R4, NR4R6Y, где Y имеет вышеуказанное значение, или CR4R5, a Q означает O, S, NR5, N(O)R5 или NR5R6Y, где Y имеет вышеуказанное значение,
когда пунктирная линия присутствует, R3 отсутствует;
или же R3 имеет значения R2, при этом R2 имеет вышеуказанное значение или OH означает, NR4R5, COOR4, OR4, CONR4R5, SO2NR4R5, SO3R4, PO3R4,
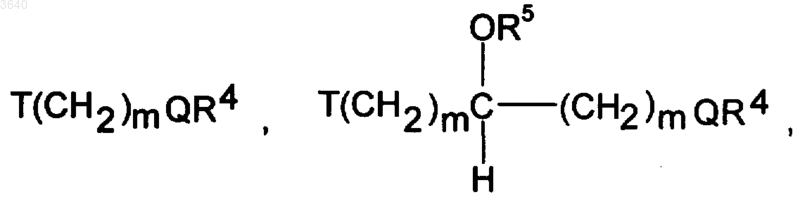
где T и Q имеют вышеуказанное значение,
R4 и R5 независимо выбраны из ряда: водород, алкил с 1-6 атомами углерода, алкенил с 2-6 атомами углерода, алкинил с 2-6 атомами углерода, N(C1-C6алкил)1или2, (CH2)nAr, где Ar имеет вышеуказанное значение, циклоалкил с 3-10 атомами углерода, гетероциклил, имеющий вышеуказанное значение, гетероалил, имеющий вышеуказанное значение, или R4 и R5 вместе с азотом, к которому они присоединены, образуют кольцо, содержащее от 3 до 7 углеродных атомов, при этом указанное кольцо может содержать 1, 2 или 3 гетероатома, выбранных из группы, состоящей из азота, незамещенного или замещенного алкилом с 1-10 атомами углерода или группой (CH2)nPh, где Ph означает фенил и n имеет вышеуказанное значение кислорода и серы и может быть замещено 1-3 группами, выбранными из ряда: OH, OR4, NR4R5, (CH2)mOR4, (CH2)mNR4R5, T-(CH2)mQR4, CO-T-(CH2)mQR4, NH(CO)T(CH2)mQR4, T-(CH2)mCO2R4 и T-(CH2)mCONR4R5, где R4, R5, T, Q и m имеют вышеуказанное значение,
R6 означает алкил, имеющий вышеуказанное значение, R8 и R9 независимо означают H, алкил с 1-3 атомами углерода, NR4R5, N(O)R4R5, NR4R5R6Y, где R4, R5 и Y имеют вышеуказанное значение,гидрокси, алкокси, имеющий вышеуказанное значение, тиол, тиоалкил, имеющий вышеуказанное значение, галоген, имеющий вышеуказанное значение, COR4, CO2R4, CONR4R5, SO2NR4R5, SO3R4, PO3R4, где R4 и R5 имеют вышеуказанное значение, CHO, CN или NO2;
при этом, когда пунктирная линия отсутствует, R9 означает дополнительно =O, =S, =NH или =NOH.
2. Соединения по п.1, где Z и G означают N, W означает NH, a R8 и R9 означают водород.
3. Соединения по п.2, где пунктирная линия представляет двойную связь, a R3 отсутствует и X означает O.
4. Соединения по п.3, где R1 означает фенил или замещенный фенил, пиридил или замещенный пиридил.
5. Соединения по п.4, где R2 означает алкил, замещенный алкил или циклоалкил, незамещенный или замещенный.
6. Соединения по любому из пп.1-5, выбранные из
1-метил-7-[4-(пиразол-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2(1H)-он;
1-метил-7-[4-(4-метилпиперазин-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2(1H)-он;
1-метил-7-[4-(4-гидроксипиперидин-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2(1H)-он;
1-метил-7-{4-[4-(диметиламино)пиперидин-1-ил]фениламино}пиримидо[4,5-d]пиримидин-2(1H)-он;
1-изопропил-7-[4-(пиразол-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2(1H)-он;
1-изопропил-7-[4-(4-метилпиперазин-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2(1H)-он;
1-изопропил-7-[4-(4-гидроксипиперидин-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2(1H)-он;
1-изопропил-7-{4-[4-(диметиламино)пиперидин-1-ил]фениламино}пиримидо[4,5-d]пиримидин-2(1H)-он;
1-бицикло[2.2.1]гепт-2-ил-7-[4-(пиразол-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2(1H)-он(экзо);
1-бицикло[2.2.1]гепт-2-ил-7-[4-(4-метилпиперазин-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2(1H)-он(экзо);
1-бицикло[2.2.1]гепт-2-ил-7-[4-(4-гидроксипиперидин-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2(1H)-он(экзо);
1-бицикло[2.2.1]гепт-2-ил-7-{4-[4-(диметиламино)пиперидин-1-ил]фениламино}пиримидо[4,5-d]пиримидин-2(1H)-он(экзо);
7-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-1-циклопентилпиримидо[4,5-d]пиримидин-2(1H)-он;
7-{4-[4-(2-амино-4-метилпентаноил)пиперазин-1-ил]фениламино}-1-циклопентилпиримидо[4,5-d]пиримидин-2(1H)-он;
1-метил-7-{4-[4-(3-морфолин-4-илпропил)пиперидин-1-ил]фениламино}пиримидо[4,5-d]пиримидин-2(1H)-он;
1-изопропил-7-{4-[4-(3-морфолин-4-илпропил)пиперидин-1-ил]фениламино}пиримидо[4,5-d]пиримидин-2(1H)-он;
1-циклопентил-7-{4-[4-(3-морфолин-4-илпропил)пиперидин-1-ил]фениламино}пиримидо[4,5-d]пиримидин-2(1H)-он;
1-бицикло[2.2.1]гепт-2-ил-7-{4-[4-(3-морфолин-4-илпропил)пиперидин-1-ил]фениламино}пиримидо[4,5-d]пиримидин-2(1H)-он(экзо);
1-циклопентил-7-(4-метансульфонилфениламино)пиримидо[4,5-d]пиримидин-2(1H)-он;
1-циклопентил-7-(4-фтор-3-метилфениламино)пиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(3-аминопирролидин-1-ил)фениламино]-1-циклопентилпиримидо[4,5-d]пиримидин-2(1H)-он;
1-циклопентил-7-(4-пиперазин-1-илфениламино)пиримидо[4,5-d]пиримидин-2(1H)-он;
1-циклопентил-7-[4-(5-метилгексагидропирроло[3,4-c]пиррол-2-ил)фениламино]пиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(4-ацетилпиперазин-1-ил)фениламино]-1-циклогептилпиримидо[4,5-d]пиримидин-2(1H)-он и
1-циклопентил-7-(пиридин-4-иламино)пиримидо[4,5-d]пиримидин-2(1H)-он.
7. Соединения по п.2, где R3 имеет значение, приведенное в п.1, а пунктирная линия отсутствует и X означает O.
8. Соединения по п.7, где R1 означает алкил, пиридил или фенил, каждый из которых необязательно замещен на гидрокси, алкокси, NR4R5 или T(CH2)mQR4.
9. Соединения по пп.7 и 8, выбранные из
1-метил-7-[4-(пиразол-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-метил-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-метил-7-[4-(4-гидроксипиперидин-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-метил-7-{4-[4-(диметиламино)пиперидин-1-ил]фениламино}-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-изопропил-7-[4-(пиразол-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-изопропил-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-изопропил-7-[4-(4-гидроксипиперидин-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-изопропил-7-{4-[4-(диметиламино)пиперидин-1-ил]фениламино}-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-бицикло[2.2.1]гепт-2-ил-7-[4-(пиразол-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он(экзо);
1-бицикло[2.2.1]гепт-2-ил-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он(экзо);
1-бицикло[2.2.1]гепт-2-ил-7-[4-(4-гидроксипиперидин-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он(экзо);
1-бицикло[2.2.1]гепт-2-ил-7-{4-[4-(диметиламино)пиперидин-1-ил]фениламино}-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он(экзо);
7-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-1-циклопентил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-{4-[4-(2-амино-4-метилпентаноил)пиперазин-1-ил]фениламино}-1-циклопентил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-метил-7-{4-[4-(3-морфолин-4-илпропил)пиперидин-1-ил]фениламино}3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-изопропил-7-{4-[4-(3-морфолин-4-илпропил)пиперидин-1-ил]фениламино}-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-циклопентил-7-{4-[4-(3-морфолин-4-илпропил)пиперидин-1-ил]фениламино}-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-бицикло[2.2.1]гепт-2-ил-7-{4-[4-(3-морфолин-4-илпропил)пиперидин-1-ил]фениламино}-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он(экзо);
1-циклопентил-7-(пиридин-4-иламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-циклопентил-7-(4-метансульфонилфениламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-циклопентил-7-(4-фтор-3-метилфениламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(3-аминопирролидин-1-ил)фениламино]-1-циклопентил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(4-ацетилпиперазин-1-ил)фениламино]-1-циклопентил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-циклопентил-7-(4-пиперазин-1-илфениламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
1-циклопентил-7-[4-(5-метилгексагидропирроло[3,4-c]пиррол-2-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-3-(3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-3-(2-хлор-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-3-(2,6-дихлор-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-3-(2-метил-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-3-(2,6-диметил-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(2-диэтиламиноэтокси)фениламино]-3-(3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(2-диэтиламиноэтокси)фениламино]-3-(2-хлор-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(2-диэтиламиноэтокси)фениламино]-3-(2,6-дихлор-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(2-диэтиламиноэтокси)фениламино]-3-(2-метил-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(2-диэтиламиноэтокси)фениламино]-3-(2,6-диметил-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-(4-диэтиламинобутиламино)-3-(3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-(4-диэтиламинобутиламино)-3-(2-хлор-3,5-диметоксифенил)-1-этил-3,4-дигидро-пиримидо[4,5-d]пиримидин-2(1H)-он;
7-(4-диэтиламинобутиламино)-3-(2,6-дихлор-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-(4-диэтиламинобутиламино)-3-(2-метил-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-(4-диэтиламинобутиламино)-3-(2,5-диметил-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-(пиридин-4-иламино)-3-(3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1Н)-он;
7-(пиридин-4-иламино)-3-(2-хлор-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-(пиридин-4-иламино)-3-(2,6-дихлор-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-(пиридин-4-иламино)-3-(2,6-диметил-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-(пиридин-4-иламино)-3-(2-метил-3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-(пиридин-4-иламино)-3-(2,6-дихлор-3,5-диметоксифенил)-1-циклопентил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
3-(2-хлор-3,5-диметоксифенил)-7-(4-диэтиламинобутиламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
3-(2-хлор-3,5-диметоксифенил)-7-[4-(2-диэтиламиноэтокси)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
3-(2-хлор-3,5-диметоксифенил)-7-(пиридин-4-иламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
3-(3,5-диметоксифенил)-7-(пиридин-4-иламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(2-диэтиламиноэтокси)фениламино]-3-(3,5-диметоксифенил)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
3-(2,6-дихлор-3,5-диметоксифенил)-7-(пиридин-4-иламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
3-(2,6-дихлор-3,5-диметоксифенил)-7-[4-(2-диэтиламиноэтокси)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[3-(карбокси)фениламино]-3-(2,6-дихлорофенил)-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[3-(N-диметиламинопропилкарбоксамид)фениламино]-3-(2,6-дихлopфенил)-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[3-(N-диметиламинопропилкарбоксамид)фениламино]-3-(2,6-дихлор-3-гидроксифенил)-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[3-(карбокси)фениламино]-3-(2,6-дихлор-3-гидроксифенил)-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
3-(2,6-дихлорфенил)-7-[4-(2-этиламиноэтокси)фениламино]-1-метил-3,4-дигидропиримидю[4,5-d]пиримидин-2(1H)-он;
3-(2,6-дихлор-3-гидроксифенил)-7-[4-(2-этиламиноэтокси)фениламино]-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(карбоксамид)фениламино]-3-(2,6-дихлорфенил)-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(карбоксамид)фениламино]-3-(2,6-дихлор-3-гидроксифенил)-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
3-(2,6-дихлорфенил)-7-(3-гидроксиметилфениламино)-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
3-(2,6-дихлорфенил)-7-(4-морфолин-4-илфениламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
3-(2,6-дихлор-3-гидроксифенил)-1-метил-7-(4-морфолин-4-илфениламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
3-(2,6-дихлор-3-гидроксифенил)-7-(3-гидроксиметилфениламино)-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(3-карбоксипропил)фениламино]-3-(2,6-дихлорфенил)-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
7-[4-(3-карбоксипропил)фениламино]-3-(2,6-дихлор-3-гидроксифенил)-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он;
3-(2,6-дихлорфенил)-7-[4-(формил)фениламино]-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он и
3-(2,6-дихлор-3-гидроксифенил)-7-[4-(формил)фениламино]-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он.
10. Соединения формулы I'
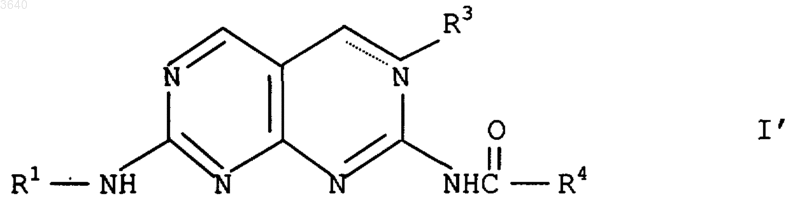
где R1, R3 и R4 имеют значения, указанные в п.1, а пунктирная линия представляет двойную связь, когда R3 отсутствует.
11. Соединения по п.10, выбранные из
1-[7-[4-(2-диэтиламиноэтокси)фениламино]-3-(3,5-диметоксифенил)-3,4-дигидропиримидо[4,5-d]пиримидин-2-ил]-3-этилмочевина;
1-{3-(2-хлор-3,5-диметоксифенил)-7-[4-(2-диэтиламиноэтокси)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2-ил}-3-этилмочевина;
1-трет-бутил-3-[7-[4-(2-диэтиламиноэтокси)фениламино]-3-(3,5-диметоксифенил)-3,4-дигидропиримидо[4,5-d]пиримидин-2-ил]мочевина;
1-трет-бутил-3-{3-(2-хлор-3,5-диметоксифенил)-7-[4-(2-диэтиламиноэтокси)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2-ил}мочевина;
1-трет-бутил-3-[3-(3,5-диметоксифенил)-7-(пиридин-4-иламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2-ил]мочевина;
1-[3-(3,5-диметоксифенил)-7-(пиридин-4-иламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2-ил]-3-этилмочевина;
1-трет-бутил-3-[3-(2-хлор-3,5-диметоксифенил)-7-(пиридин-4-иламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2-ил]мочевина;
1-[3-(2-хлор-3,5-диметоксифенил)-7-(пиридин-4-иламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2-ил]-3-этилмочевина;
1-[3-(2-хлор-3,5-диметоксифенил)-7-(4-диэтиламинобутиламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2-ил]-3-этилмочевина;
3-метил-N-{7-[4-(5-метилгексагидропирроло[3,4-с]пиррол-2-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2-ил}бутирамид;
1-{7-[4-(4-ацетилпиперазин-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2-ил}-3-изопропилмочевина и
1-трет-бутил-3-[3-(2-хлор-3,5-диметоксифенил)-7-(4-диэтиламинобутиламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2-ил]мочевина.
12. Соединения по п.10, где R1 и R4 имеют значения, указанные в п.1, пунктирная линия представляет двойную связь и R3 отсутствует.
13. Соединения по п.12, выбранные из
1-{7-[4-(3-аминометилпирролидин-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2-ил}-3-изопропилмочевина;
1-изопропил-3-[7-(4-пиперазин-1-илфениламино)пиримидо[4,5-d]пиримидин-2-ил]мочевина;
1-[7-(4-фторфениламино)пиримидо[4,5-d]пиримидин-2-ил]-3-метилмочевина;
1-изопропил-3-(7-фениламинопиримидо[4,5-d]пиримидин-2-ил)мочевина;
1-{7-[4-(4-ацетилпиперазин-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2-ил}-3-изопропилмочевина;
N-{7-[4-(3-аминопирролидинил)фениламино]пиримидо[4,5-d]пиримидин-2-ил}-3-метилбутирамид;
N-[7-(4-пиперазин-1-илфениламино)пиримидо[4,5-d]пиримидин-2-ил]изобутирамид;
N-{7-[4-(4-ацетилпиперазин-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2-ил}-3-метилбутирамид;
3-метил-N-[7-(пиридин-4-иламино)пиримидо[4,5-d]пиримидин-2-ил] бутирамид;
1-изопропил-3-[7-(пиридин-4-иламино)пиримидо[4,5-d]пиримидин-2-ил] мочевина и
N-{7-[4-(3-аминометилпирролидин-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2-ил}-3-метилбутирамид.
14. Соединения по п.1, где W означает S, SO или SO2.
15. Соединения по п.1, где R1, R2 и R3 имеют значения, указанные в п.1; W означает NH; Z означает N; G означает N, X означает O; R8 означает водород; R9 означает =O и пунктирная линия отсутствует.
16. Соединения по п.15, выбранные из
1-изопропил-7-[4-(4-метилпиперазин-1-ил)фениламино]-1H-пиримидо[4,5-d]пиримидин-2,4-дион;
7-[4-(2-диэтиламиноэтокси)фениламино]-1-изопропил-1H-пиримидо[4,5-d]пиримидин-2,4-дион;
7-(4-диэтиламинобутиламино)-3-(3,5-диметоксифенил)-1-этил-1H-пиримидо[4,5-d]пиримидин-2,4-дион;
7-[4-(2-диэтиламиноэтокси)фениламино]-3-(3,5-диметоксифенил)-1-этил-1H-пиримидо[4,5-d]пиримидин-2,4-дион и
7-(пиридин-4-иламино)-3-(3,5-диметоксифенил)-1-этил-1H-пиримидо[4,5-d]пиримидин-2,4-дион.
17. Соединения по п.1, где Z означает N, G означает CH, W означает NH, a R8 и R9 означают водород.
18. Соединения по п.17, выбранные из
2-[4-(3-аминопирролидин-1-ил)фениламино]-8-изопропил-8H-пиридо[4,3-d]пиримидин-7-он;
8-циклопентил-2-[4-(гексагидропирроло[3,4-c]пиррол-2-ил)фениламино]-8H-пиридо[4,3-d]пиримидин-7-он;
2-[4-(4-ацетилпиперазин-1-ил)фениламино]-8-циклопентил-8H-пиридо[4,3-d]пиримидин-7-он;
N-{2-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-8-циклопентилпиридо[4,3-d]пиримидин-7-ил}-2,2-диметилпропионамид и
N-(2-{4-[4-(2-амино-4-метилпентаноил)пиперазин-1-ил]фениламино}-8-циклопентилпиридо[4,3-d]пиримидин-7-ил)-2,2-диметилпропионамид.
19. Соединения по п.1, где Z означает CH, G означает N, W означает NH, a R8 и R9 означают водород.
20. Соединения по п.19, где пунктирная линия представляет двойную связь, a R3 отсутствует.
21. Соединения по пп.19 и 20, выбранные из
1-(2-бензилоксиэтил)-7-[4-(4-метилпиперазин-1-ил)фениламино]пиридо[4,3-d]пиримидин-2(1H)-он;
1-(тиофен-2-ил)-7-[4-(4-метилпиперазин-1-ил)фениламино]пиридо [4,3-d]пиримидин-2(1H)-он;
1-(тиофен-2-илметил)-7-[4-(4-метилпиперазин-1-ил)фениламино]пиридо[4,3-d]пиримидин-2(1H)-он;
1-(тетрагидрофуран-2-ил)-7-[4-(4-метилпиперазин-1-ил)фениламино]пиридо[4,3-d]пиримидин-2(1H)-он;
1-(гекса-2,4-диен-1-ил)-7-[4-(4-метилпиперазин-1-ил)фениламино]пиридо[4,3-d]пиримидин-2(1H)-он;
1-(проп-2-ин-1-ил)-7-[4-(4-метилпиперазин-1-ил)фениламино]пиридо[4,3-d]пиримидин-2(1H)-он;
1-[3-(диметиламино)проп-1-ил]-7-[4-(4-метилпиперазин-1-ил)фениламино]пиридо[4,3-d]пиримидин-2(1H)-он;
1-(3-гидроксипроп-1-ил)-7-[4-(4-метилпиперазин-1-ил)фениламино]пиридо[4,3-d]пиримидин-2(1H)-он;
1-(пиридин-4-илметил)-7-[4-(4-метилпиперазин-1-ил)фениламино]пиридо[4,3-d]пиримидин-2(1H)-он;
1-(3,5-диметилгепт-1-ил)-7-[4-(4-метилпиперазин-1-ил)фениламино]пиридо[4,3-d]пиримидин-2(1H)-он;
1-циклопентил-7-(4-пиперазин-1-илфениламин)пиридо[4,3-d]пиримидин-2(1H)-он и
7-[4-(3-аминопирролидин-1-ил)фениламино]-1-циклопентилпиридо[4,3-d]пиримидин-2(1H)-он.
22. Соединения по п.19, где R3 присутствует, а пунктирная линия отсутствует.
23. Соединения по п.22, выбранные из
1-(2-бензилоксиэтил)-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
1-(тиофен-2-ил)-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
1-(тиофен-2-илметил)-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
1-(тетрагидрофуран-2-ил)-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
1-(гекса-2,4-диен-1-ил)-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
1-(проп-2-ин-1-ил)-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
1-[3-(диметиламино)проп-1-ил]-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
1-(3-гидроксипроп-1-ил)-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
1-(пиридин-4-илметил)-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
1-(3,5-диметилгепт-1-ил)-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
3-(3,5-диметоксифенил)-7-(пиридин-4-иламино)-1-этил-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
3-(2-хлор-3,5-диметоксифенил)-7-(пиридин-4-иламино)-1-этил-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
3-(2,6-дихлор-3,5-диметоксифенил)-7-(пиридин-4-иламино)-1-этил-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
3-(2-метил-3,5-диметоксифенил)-7-(пиридин-4-иламино)-1-этил-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
3-(2,6-диметил-3,5-диметоксифенил)-7-(пиридин-4-иламино)-1-этил-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
7-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-3-(3,5-диметоксифенил)-1-этил-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
7-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-3-(2-хлор-3,5-диметоксифенил)-1-этил-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
7-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-3-(2,6-дихлор-3,5-диметоксифенил)-1-этил-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он;
7-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-3-(2-метил-3,5-диметоксифенил)-1-этил-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он и
7-[4-(4-аминоацетилпиперазин-1-ил)фениламино]-3-(2,6-диметил-3,5-диметоксифенил)-1-этил-3,4-дигидропиридо[4,3-d]пиримидин-2(1H)-он.
24. Фармацевтический состав, включающий соединение по п.1 в комбинации с фармацевтически приемлемыми носителем, растворителем или наполнителем.
25. Способ регулирования пролиферативных нарушений, относящихся к группе, включающей рак, псориаз, пролиферацию гладких мышц сосудов, ассоциированную с нарушениями, относящимися к группе, включающей атеросклероз, постхирургический стеноз и рестеноз у млекопитающих, диабетическую ретинопатию и ангиогенез, включающий назначение вышеуказанному млекопитающему терапевтически эффективного количества соединения формулы (I)

и его фармацевтически приемлемые соли, где
пунктирная линия означает необязательную двойную связь;
Z означает N или CH;
G означает N или CH;
W означает NH, S, SO или SO2;
X означает O, S или NR10;
R1, R2 и R10 независимо выбраны из ряда: H, (CH2)nAr, где Ar означает фенил, 3-хлорфенил, 2,6-дибромфенил, 2,4,6-трибромфенил, 1-нафтил, 4,7-дихлор-2-нафтил и n означает 0, 1, 2 или 3, группа COR4, (CH2)nгетероарил, где гетероарил имеет 4-9 кольцевых атомов, из которых 1-4 атома независимо выбраны из группы, включающей O, S и N, или представляет собой 2-пиридил, 3-метил-2-пиридил, 3-бензотиенил, 4-этил-2-бензотиенил, 2-фуранил, 3,4-диэтил-2-фуранил, пирролил, пиразолил, имидазолил или тиазолил, и n имеет вышеуказанное значение, гетероциклил, представляющий собой циклоалкил, имеющий, по меньшей мере, один гетероатом из числа O и S, или пирролидинил, пиперидил и морфолинил, разветвленный или неразветвленный алкил с 1-10 атомами углерода, циклоалкил с 3-10 атомами углерода, алкенил с 2-10 атомами углерода, алкинил с 2-10 атомами углерода, при этом группы (CH2)nAr, (CH2)nгетероарил, алкил, циклоалкил, алкенил и алкинил могут быть замещены 1-5 остатками из группы, включающей NR4R5, N(O)R4R5, NR4R5R6Y, где Y означает галоидный противоион из группы, включающей фтор, хлор, бром и йод, неразветвленный или разветвленный алкил с 1-10 атомами углерода, фенил, незамещенный или замещенный хлором в положении 3, бромом в положениях 2, 6 или 2, 4 и 6, (CH2)nгетероарил, где гетероарил выбран из группы, включающей 2-пиридил, 3-метил-2-пиридил, 3-бензотиенил, 4-этил-2-бензотиенил, 2-фуранил, 3,4-диэтил-2-фуранил, пирролил, пиразолил, имидазолил или тиазолил, и n имеет вышеуказанное значение, гидроксил, неразветвленную или разветвленную алкоксигруппу с 1-10 атомами углерода, группу -O-(CH2)2-O-CH3, фенокси, тиол, тиоалкил, где алкил имеет вышеуказанное значение, фтор, хлор, бром, йод, COR4, CO2R4, CONR4R5, SO2NR4R5, SO3R4, PO3R4, альдегид, нитрил, нитро, гетероарилокси, где гетероарил представляет собой 2-пиридил, 3-метил-2-пиридил, 3-бензотиенил, 4-этил-2-бензотиенил, 2-фуранил, 3,4-диэтил-2-фуранил, пирролил, пиразолил, имидазолил, тиазолил,
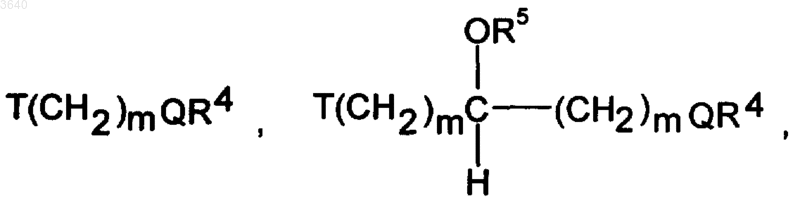
C(O)T(CH2)mQR4, NHC(O)T(CH2)mQR4, T(CH2)mC(O)NR4NR5, T(CH2)mCO2R4, где m независимо означает 1-6, T означает O, S, NR4, N(O)R4, NR4R6Y, где Y имеет вышеуказанное значение, или CR4R5, a Q означает O, S, NR5, N(O)R5 или NR5R6Y, где Y имеет вышеуказанное значение,
когда пунктирная линия присутствует, R3 отсутствует;
или же R3 имеет значения R2, при этом R2 имеет вышеуказанное значение или OH означает NR4R5, COOR4, OR4, CONR4R5, SO2NR4R5, SO3R4, PO3R4,

где T и Q имеют вышеуказанное значение,
R4 и R5 независимо выбраны из ряда: водород, алкил с 1-6 атомами углерода, алкенил с 2-6 атомами углерода, алкинил с 2-6 атомами углерода, N(C1-C6алкил)1или2, (CH2)nAr, где Ar имеет вышеуказанное значение, циклоалкил с 3-10 атомами углерода, гетероциклил, имеющий вышеуказанное значение, гетероалил, имеющий вышеуказанное значение, или R4 и R5 вместе с азотом, к которому они присоединены, образуют кольцо, содержащее от 3 до 7 углеродных атомов, при этом указанное кольцо может содержать 1, 2 или 3 гетероатома, выбранных из группы, состоящей из азота, незамещенного или замещенного алкилом с 1-10 атомами углерода или группой (CH2)nPh, где Ph означает фенил и n имеет вышеуказанное значение, кислорода и серы и может быть замещено 1-3 группами, выбранными из ряда: OH, OR4, NR4R5, (CH2)mOR4, (CH2)mNR4R5, T-(CH2)mQR4, CO-T-(CH2)mQR4, NH(CO)T(CH2)mQR4, T-(CH2)mCO2R4 и T(CH2)mCONR4R5, где R4, R5 T, Q и m имеют вышеуказанное значение,
R6 означает алкил, имеющий вышеуказанное значение,
R8 и R9 независимо означают H, алкил с 1-3 атомами углерода, NR4R5, N(O)R4R5, NR4R5R6Y, где R4, R5 и Y имеют вышеуказанное значение, гидрокси, алкокси, имеющий вышеуказанное значение, тиол, тиоалкил, имеющий вышеуказанное значение, галоген, имеющий вышеуказанное значение, COR4, CO2R4, CONR4R5, SO2NR4R5, SO3R4, PO3R4, где R4 и R5 имеют вышеуказанное значение, CHO, CN или NO2;
при этом, когда пунктирная линия отсутствует, R9 означает дополнительно =O, =S, =NH или =NOH.
26. Способ ингибирования циклинзависимой киназы, или опосредуемой ростовым фактором тирозин киназы, или wee-1 киназы, или нерецепторной тирозин киназы, или серин киназы, включающий взаимодействие упомянутой киназы и соединения формулы (I)
и его фармацевтически приемлемые соли,
где пунктирная линия означает необязательную двойную связь;
Z означает N или CH;
G означает N или CH;
W означает NH, S, SO или SO2;
X означает O, S или NR10;
R1, R2 и R10 независимо выбраны из ряда: H, (CH2)nAr, где Ar означает фенил, 3-хлорфенил, 2,6-дибромфенил, 2,4,6-трибромфенил, 1-нафтил, 4,7-дихлор-2-нафтил и n означает 0, 1, 2 или 3, группа COR4, (CH2)nгетероарил, где гетероарил имеет 4-9 кольцевых атомов, из которых 1-4 атома независимо выбраны из группы, включающей O, S и N, или представляет собой 2-пиридил, 3-метил-2-пиридил, 3-бензотиенил, 4-этил-2-бензотиенил, 2-фуранил, 3,4-диэтил-2-фуранил, пирролил, пиразолил, имидазолил или тиазолил, и n имеет вышеуказанное значение, гетероциклил, представляющий собой циклоалкил, имеющий, по меньшей мере, один гетероатом из числа O и S, или пирролидинил, пиперидил и морфолинил, разветвленный или неразветвленный алкил с 1-10 атомами углерода, циклоалкил с 3-10 атомами углерода, алкенил с 2-10 атомами углерода, алкинил с 2-10 атомами углерода, при этом группы (CH2)nAr, (CH2)nгетероарил, алкил, циклоалкил, алкенил и алкинил могут быть замещены 1-5 остатками из группы, включающей NR4R5, N(O)R4R5, NR4R5R6Y, где Y означает галоидный противоион из группы, включающей фтор, хлор, бром и йод, неразветвленный или разветвленный алкил с 1-10 атомами углерода, фенил, незамещенный или замещенный хлором в положении 3, бромом в положениях 2, 6 или 2, 4 и 6, (CH2)nгетероарил, где гетероарил выбран из группы, включающей 2-пиридил, 3-метил-2-пиридил, 3-бензотиенил, 4-этил-2-бензотиенил, 2-фуранил, 3,4-диэтил-2-фуранил, пирролил, пиразолил, имидазолил или тиазолил, и n имеет вышеуказанное значение, гидроксил, неразветвленную или разветвленную алкоксигруппу с 1-10 атомами углерода, группу -O-(CH2)2-O-CH3, фенокси, тиол, тиоалкил, где алкил имеет вышеуказанное значение, фтор, хлор, бром, йод, COR4, CO2R4, CONR4R5, SO2NR4R5, SO3R4, PO3R4, альдегид, нитрил, нитро, гетероарилокси, где гетероарил представляет собой 2-пиридил, 3-метил-2-пиридил, 3-бензотиенил, 4-этил-2-бензотиенил, 2-фуранил, 3,4-диэтил-2-фуранил, пирролил, пиразолил, имидазолил, тиазолил,
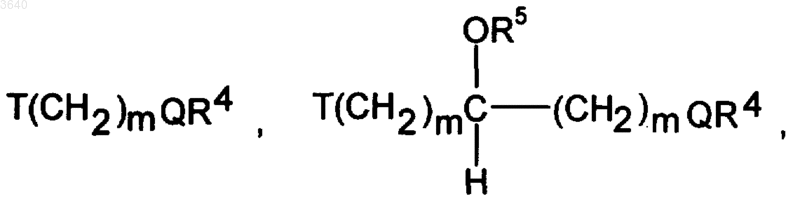
C(O)T(CH2)mQR4, NHC(O)T(CH2)mQR4, T(CH2)mC(O)NR4NR5, T(CH2)mCO2R4, где m независимо означает 1-6, T означает O, S, NR4, N(O)R4, NR4R6Y, где Y имеет вышеуказанное значение, или CR4R5, a Q означает O, S, NR5, N(O)R5 или NR5R6Y, где Y имеет вышеуказанное значение,
когда пунктирная линия присутствует, R3 отсутствует;
или же R3 имеет значения R2, при этом R2 имеет вышеуказанное значение или OH означает NR4R5, COOR4, OR4, CONR4R5, SO2NR4R5, SO3R4, PO3R4,
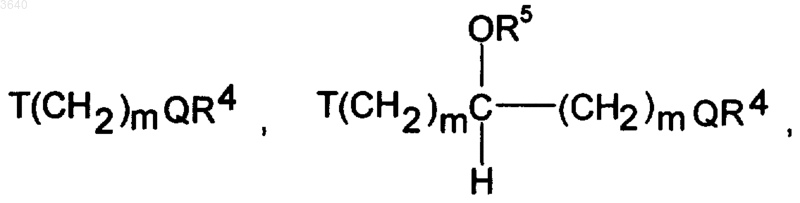
где T и Q имеют вышеуказанное значение,
R4 и R5 независимо выбраны из ряда: водород, алкил с 1-6 атомами углерода, алкенил с 2-6 атомами углерода, алкинил с 2-6 атомами углерода, N(C1-C6алкил)1или2, (CH2)nAr, где Ar имеет вышеуказанное значение, циклоалкил с 3-10 атомами углерода, гетероциклил, имеющий вышеуказанное значение, гетероалил, имеющий вышеуказанное значение, или R4 и R5 вместе с азотом, к которому они присоединены, образуют кольцо, содержащее от 3 до 7 углеродных атомов, при этом указанное кольцо может содержать 1, 2 или 3 гетероатома, выбранных из группы, состоящей из азота, незамещенного или замещенного алкилом с 1-10 атомами углерода или группой (CH2)nPh, где Ph означает фенил и n имеет вышеуказанное значение, кислорода и серы, и может быть замещено 1-3 группами, выбранными из ряда: OH, OR4, NR4R5, (CH2)mOR4, (CH2)mNR4R5, T-(CH2)mQR4, CO-T-(CH2)mQR4, NH(CO)T(CH2)mQR4, T-(CH2)mCO2R4 и T(CH2)mCONR4R5, где R4, R5 T, Q и m имеют вышеуказанное значение,
R6 означает алкил, имеющий вышеуказанное значение,
R8 и R9 независимо означают H, алкил с 1-3 атомами углерода, NR4R5, N(O)R4R5, NR4R5R6Y, где R4, R5 и Y имеют вышеуказанное значение, гидрокси, алкокси, имеющий вышеуказанное значение, тиол, тиоалкил, имеющий вышеуказанное значение, галоген, имеющий вышеуказанное значение, COR4, CO2R4, CONR4R5, SO2NR4R5, SO3R4, PO3R4, где R4 и R5 имеют вышеуказанное значение, CHO, CN или NO2;
при этом, когда пунктирная линия отсутствует, R9 означает дополнительно =O, =S, =NH или =NOH.
27. Способ по п.26, где упомянутая циклинзависимая киназа является cdc2.
28. Способ по п.26, где упомянутая циклинзависимая киназа является cdk2.
29. Способ по п.26, где упомянутая циклинзависимая киназа является cdk4 или cdk6.
30. Способ по п.26, где упомянутая зависимая от ростового фактора тирозин киназа является ростовым фактором тромбоцитов (PDGF).
31. Способ по п.26, где упомянутая зависимая от ростового фактора тирозин киназа является ростовым фактором фибробластов (FGF).
32. Способ по п.26, где упомянутая зависимая от ростового фактора тирозин киназа является фактором роста сосудистого эндотелия (VEGF).
33. Способ по п.26, где упомянутая нерецепторная тирозин киназа является выбранной из семейства, трансформирующего ген ретровируса саркомы Рауша (Src).
34. Способ ингибирования ангиогенеза у млекопитающих, включающий в себя назначение антиангиогенно эффективного количества соединения по п.1.
35. Способ по п.34, где заболевание, вызванное ангиогенезом, выбрано из рака человека, макулярной дегенерации, диабетической ретинопатии, хирургических спаек и псориаза.
36. Способ лечения субъекта, страдающего раком или заболеваниями, вызванными пролиферацией сосудистых гладкомышечных клеток, включающий в себя назначение упомянутому субъекту терапевтически эффективного количества соединения по п.1.
Текст
1 Область техники Настоящее изобретение относится к бициклическим гетероциклам, которые ингибируют ферменты циклинзависимую киназу и тирозинкиназу, вследствие чего являются пригодными для лечения клеточно-пролиферативных нарушений, таких как ангиогенез, атеросклероз,рестеноз и рак. Предпосылки создания изобретения Киназы клеточного цикла являются естественно встречающимися ферментами, вовлеченными в регуляцию клеточного цикла (MeijerL., "Chemical Inhibitors of Cyclin-Dependent Kinases", Progress in Cell Cycle Research, 1995; 1:351-363). Типичные ферменты включают циклинзависимые киназы (cdk): cdk1 (также известная как cdc2), cdk2, cdk4, cdk5, cdk6 и wee-1 киназа. Повышенная активность или временно ненормальная активация этих киназ, как было показано, дает в результате развитие у человека опухолей и других пролиферативных нарушений, таких как рестеноз. Вещества, которые ингибируют cdk, как блокированием взаимодействия циклина с киназой, так и связыванием и инактивацией киназы, вызывают торможение клеточной пролиферации и, таким образом, являются пригодными для лечения опухолей или других ненормально пролиферирующих клеток. Некоторые соединения, которые тормозятcdk, показали противоопухолевую активность как в предклинических, так и в клинических испытаниях. Например, флавоноид флавопиридол, как было показано, является потенциальным ингибитором некоторых типов клеток рака груди и легких (Kaur et al., J. Natl. Cancer Inst.,1992; 84:1736-1740; Int.J.Oncol., 1996; 9:11431168). Это соединение, как было показано, тормозит cdk2 и cdk4. Оломоуцин [2-(гидроксиэтиламин)-6-бензиламин-9-метилпурин] является потенциальным ингибитором cdk2 и cdk5(Vesely, et.al., Eur.J.Biochem., 1994; 224:771-786) и, как было показано, тормозит пролиферацию приблизительно 60 человеческих опухолевых клеточных линий, используемых Национальным институтом рака (NCI) для испытания новых противораковых препаратов (Abraham, et al.,Biology of the Cell, 1995; 83:105-120). Кроме того, тирозинкиназы являются классом ферментов, которые катализируют перенос концевого фосфата аденозинтрифосфата(АТФ) на тирозиновые остатки белковых субстратов. Тирозинкиназы являются неотъемлемой частью рецепторов ростовых факторов и весьма важны для усиления сигнала трансдукции ростового фактора, ведущего к клеточной пролиферации, дифференциации и миграции. Рецепторы ростового фактора также известны как рецепторные тирозинкиназы (RTK). Ненормальная регуляция ростовых факторов или их соответствующих рецепторов играют критическую роль в развитии пролиферативных заболеваний. Например, фактор роста фибробластов(FGF) и фактор роста сосудистого эндотелия(VEGF), как важные медиаторы, вовлечены в ангиогенез, стимулированный опухолью. Твердые опухоли зависят от образования новых кровеносных сосудов из предсуществующих сосудов (ангиогенез), необходимых для питания их роста и обеспечения путей распространения метастазов. Соответственно ингибиторы RTKFGF и VEGF, так же, как и других тирозинкиназ, являются полезными агентами для предотвращения и лечения пролиферативных заболеваний, зависимых от этих ферментов. Несмотря на прогресс, который был сделан, поиск низкомолекулярных соединений орально биодоступных и полезных для лечения самых разнообразных опухолей человека и других пролиферативных нарушений, таких как рестеноз, ангиогенез, диабетическая ретинопатия, псориаз, хирургические спайки макулярная дегенерация и атеросклероз продолжается. Краткое описание изобретения Настоящее изобретение представляет бициклические гетероциклы, которые являются пригодными для лечения пролиферативных нарушений, таких как рак, атеросклероз, рестеноз,ангиогенез, диабетическая ретинопатия, псориаз и эндометриоз. Мы открыли группу бициклических пиримидиновых аналогов, которые являются эффективными ингибиторами циклинзависимых киназ (cdk) и тирозиновых киназ. Соединения являются легко синтезируемыми и могут быть назначены различными путями,включая оральный и парентеральный, и показывают слабую токсичность или ее отсутствие. Заявленные соединения являются членами класса соединений формулы I и его фармацевтически приемлемых солей,где пунктирная линия означает необязательную двойную связь;R1, R2 и R10 независимо выбраны из ряда Н,(CH2)nAr,COR4,(СН 2)nгетероарил,(СН 2)nгетероциклил, C1-С 10 алкил, С 3-С 10 циклоалкил, С 2-С 10 алкенил и С 2-С 10 алкинил, где n равно 0, 1, 2 или 3, а (СН 2)nАr, (СН 2)nгетероарил,алкил, циклоалкил, алкенил и алкинил необязательно замещены не более чем 5 группами, выбранными из ряда NR4R5, N(O)R4R5, NR4R5R6Y,алкил, фенил, замещенный фенил, (СН 2)nгетероарил, гидрокси, алкокси, фенокси, тиол, тиоалкил, галоген, COR4, CO2R4, CONR4R5,SO2NR4R5, SO3R4, PO3R4, альдегид, нитрил, нитро, гетероарилокси, Т (СН 2) mQR4, 3C(O)T(CH2)mQR4,NHC(O)T(CH2)mQR4,4 5 Т(СН 2)mC(O)NR NR или Т(CH2)mCO2R4, где каждая m независимо означает 1-6, Т означает О, S, NR4, N(O)R4, NR4R6Y или CR4R5, a Q означает О, S, NR5, N(O)R5 или NR5R6Y; когда пунктирная линия присутствует, R3 отсутствует; или же R3 имеет значения R2, где R2 - как определено выше, а также ОН, NR4R5, COOR4, OR4,CONR4R5, SO2NR4R5, SO3R4, PO3R4, где Т и Q - как определено выше;R4 и R5 независимо выбраны из ряда водород, C1-С 6 алкил, замещенный алкил, С 2 С 6 алкенил, С 2-С 6 алкинил, N(С 1-С 6 алкил)1 или 2,(СН 2)nАr, С 3-С 10 циклоалкил, гетероциклил, а гетероарил или R4 и R5 вместе с азотом, к которому они присоединены, необязательно образуют кольцо, содержащее от 3 до 7 углеродных атомов, и указанное кольцо необязательно содержит 1, 2 или 3 гетероатома, выбранных из группы, состоящей из азота, замещенного азота,кислорода и серы; когда R4 и R5 вместе с азотом, к которому они присоединены, образуют кольцо, указанное кольцо необязательно замещено 1-3 группами,выбранными из ОН, OR4, NR4R5, (CH2)mOR4,(CH2)mNR4R5, T-(CH2)mQR4, CO-T-(CH2)mQR4,NH(CO)Т(CH2)mQR4,T-(CH2)mCO2R4 или 4 5R8 и R9 независимо означают Н, С 1 С 3 алкил, NR4R5, N(O)R4R5, NR4R5R6Y, гидрокси,алкокси, тиол, тиоалкил, галоген, COR4, CO2R4,CONR4R5, SO2NR4R5, SO3R4, PO3R4, CHO, CN или NO2; когда пунктирная линия отсутствует, R9 означает дополнительно карбонил, тиокарбонил, имин и замещенный имин, оксим и оксимовый эфир, аY означает галогенопротивоион. В предпочтительном случае данное изобретение предусматривает соединения формул где R1, R2, R3, W, R8 и R9 - как определено выше. Кроме того, предпочтительные соединения имеют вышеуказанные формулы, в которых W означает NH. Также предпочтительными являются такие соединения, в которых R1 означает замещенный алкил, фенил или пиридил. Настоящее изобретение также предусматривает фармацевтические составы, включающие в себя соединение формулы I в комбинации с фармацевтически приемлемыми носителем, растворителем или наполнителем. Соединения, рассматриваемые в настоящем изобретении, являются ингибиторами циклинзависимых киназ, таких как cdk2, cdc2 иcdk4. Некоторые из заявленных соединений также ингибируют тирозиновые киназы, зависимые от ростовых факторов, включая такие,как фактор роста тромбоцитов (PDGF), фактор роста фибробластов (FGF) и эпидермальный ростовой фактор (EGF), а также внерецепторные тирозиновые киназы, такие как c-Src. Как ингибиторы циклинзависимых, а также зависимых от ростовых факторов и внерецепторных тирозиновых киназ, заявленные соединения пригодны для регулирования пролиферативных нарушений, таких как рак, псориаз, пролиферация сосудистых гладкомышечных клеток, ассоциированная с атеросклерозом, диабетическая ретинопатия и ангиогенез, постхирургический сосудистый стеноз и рестеноз у млекопитающих. Еще одним предметом настоящего изобретения является способ лечения субъектов, страдающих заболеваниями, вызванными клеточной пролиферацией. Данный способ приводит к ингибированию пролиферации опухолевых клеток эпителиального происхождения и сосудистой гладкой мускулатуры и/или клеточной миграции посредством назначения терапевтически эффективного количества соединения формулыI субъекту, нуждающемуся в лечении. Еще одним предметом настоящего изобретения является способ лечения субъектов, страдающих заболеваниями, вызванными ДНКсодержащими опухолевыми вирусами, такими как вирус герпеса. 5 Подробное описание изобретения Мы открыли новый класс соединений, которые являются эффективными ингибиторами циклинзависимых киназ (cdk) и тирозиновых киназ и которые являются полезными препаратами для лечения субъектов, страдающих заболеваниями, вызванными ненормальной клеточной пролиферацией. Соединения, рассматриваемые в настоящем изобретении, являются ингибиторами циклинзависимых киназ, таких какcdc2, cdk2 и cdk4 и тирозиновых киназ, таких как PDGFr, FGFr и c-Src. Как ингибиторы этих киназ заявленные соединения пригодны для регулирования пролиферативных нарушений,таких как рак, псориаз, пролиферация сосудистых гладкомышечных клеток, ассоциированная с атеросклерозом, постхирургический сосудистый стеноз, ангиогенез, диабетическая ретинопатия и рестеноз у млекопитающих. Заявленные соединения являются членами класса соединений формулы I и его фармацевтически приемлемых солей,где пунктирная линия (- - -) означает необязательную двойную связь;R1, R2 и R10 независимо выбраны из ряда Н,(CH2)nAr,COR4,(СН 2)nгетероарил,(СН 2)nгетероциклил, C1-С 10 алкил, С 3-С 10 циклоалкил, С 2-С 10 алкенил и С 2-С 10 алкинил, где n равно 0, 1, 2 или 3, а (СН 2)nАr, (СН 2)nгетероарил,алкил, циклоалкил, алкенил и алкинил необязательно замещены не более чем 5 группами, выбранными из ряда NR4R5, N(O)R4R5, NR4R5R6Y,алкил,фенил,замещенный фенил,(СН 2)nгетероарил, гидрокси, алкокси, фенокси,тиол, тиоалкил, галоген, COR4, CO2R4,CONR4R5, SO2NR4R5, SO3R4, PO3R4, альдегид,нитрил, нитро, гетероарилокси, T(CH2)mQR4,C(O)T(CH2)mQR4,NHC(O)T(CH2)mQR4,4 5 Т(СН 2)mC(О)NR NR или Т(CH2)mCO2R4, где каждая m независимо означает 1-6, Т означает О, S, NR4, N(O)R4, NR4R6Y или CR4R5, a Q означает О, S, NR5, N(O)R5 или NR5R6Y; когда пунктирная линия присутствует, R3 отсутствует; или же (когда - - - отсутствует) R3 имеет значения R2, где R2 - как определено выше, а также ОН, NR4R5, COOR4, OR4, CONR4R5, SO2NR4R5,SO3R4, PO3R4, 003640R4 и R5 независимо выбраны из ряда водород, С 1-С 6 алкил, замещенный алкил, С 2 С 6 алкенил, С 2-С 6 алкинил, N(С 1-С 6 алкил)1 или 2,(СН 2)nАr, С 3-С 10 циклоалкил, гетероциклил, а гетероарил или R4 и R5 вместе с азотом, к которому они присоединены, необязательно образуют кольцо, содержащее от 3 до 7 углеродных атомов, и указанное кольцо необязательно содержит 1, 2 или 3 гетероатома, выбранных из группы, состоящей из азота, замещенного азота,кислорода и серы; когда R4 и R5 вместе с азотом, к которому они присоединены, образуют кольцо, указанное кольцо необязательно замещено 1-3 группами,выбранными из ОН, OR4, NR4R5, (CH2)mOR4,(CH2)mNR4R5, T-(CH2)mQR4, CO-T-(CH2)mQR4,NH(CO)Т(CH2)mQR4,T-(CH2)mCO2R4 или 4 5R8 и R9 независимо означают Н, C1 С 3 алкил, NR4R5, N(O)R4R5, NR4R5R6Y, гидрокси,алкокси, тиол, тиоалкил, галоген, COR4, CO2R4,CONR4R5, SO2NR4R5, SO3R4, PO3R4, CHO, CN или NO2; когда пунктирная линия отсутствует, R9 означает дополнительно карбонил, тиокарбонил, имин и замещенный имин, оксим и оксимовый эфир, аY означает галогенопротивоион. Особо предпочтительная группа соединений имеет вышеуказанную формулу, где X означает O. Другой предпочтительной группой соединений является группа, в которой W означаетNH. Предпочтительная группа соединений формулы I имеет вышеприведенную формулу, в которой X означает О или NHR10, a R3 означает Н или замещенный арил. Также предпочтительными являются соединения формулы I, в которой R8 и R9 означают водород. Другая предпочтительная группа соединений формулы I имеет вышеприведенную формулу, в которой X означает О, a R2 означает Et,Pr, i-Pr, i-Bu, изопентил или циклоалкил. В особо предпочтительной группе соединений X означает О, a R2 означает циклопентил или этил. В еще одной предпочтительной группе соединений формулы I X означает О, W означаетNH, a R1 означает алкил, замещенный алкил,фенил или замещенный фенил, пиридил или замещенный пиридил. Предпочтительные R1 замещенные фенилогруппы включают 4 пиперидинил (с или без замещения), 4-(2 диэтиламиноэтокси), 4-пиррол, 4-пиразол и 4(4-метилпиперазин-1-ил). В особо предпочтительной группе соединений, X означает О, a R1 7 означает фенил, замещенный гидрокси, алкокси,NR4R5 или T(CH2)mQR4, где R4 и R5, Т, m и Q,как определено выше. В еще более предпочтительной группе соединений X означает О, a R1 означает фенил, замещенный NR4R5 илиT(CH2)mQR4, где R4 и R5, Т, m и Q - как определено выше. Другой предпочтительной группой соединений формулы I является группа, в которой X означает NH. Следующими предпочтительными соединениями являются пиримидо[4,5-d]пиримидины формулы I, где Z означает N. Особо предпочтительные соединения, предусмотренные изобретением, имеют формулы где R1, R2, R3, W, R8 и R9 и X - как определено выше. Кроме того, предпочтительные соединения имеют вышеуказанные формулы, в которых W означает NH. Также предпочтительными являются такие соединения, в которых R1 означает алкил, замещенный фенил или пиридил. Следующие предпочтительные соединения настоящего изобретения имеют формулу V где R2 - как определено выше, а Ar означает фенил, замещенный фенил или гетероалил. В идеале R2 означает алкил, такой как этил, изопропил, пропил, бутил или изопентил, или циклоалкил, такой как норборнил, циклопентил,циклогексил или адамантил. Наиболее предпочтительной Ar-группой является фенил, предпочтительно замещенный 1, 2 или 3 группами, выбранными из ряда фенил, хлор, бром, метил,метокси, гидрокси, гидроксиметил, 2-диэтиламиноэтокси, метоксикарбонилметил, карбокси,карбоксиметил, этоксикарбонил, 2-карбоксиэтил,2-этоксикарбонилэтил,NR4R5 и 4 5 4 5O(СН 2)0-6NR R , где R и R - как определено выше. Другой предпочтительной Ar-группой является пиридил и тиазолил, например, 3 пиридил, 2-тиазолил, каждая из которых необя 003640 8 зательно замещена алкил, галоген, фенил, гидроксифенил или алкоксифенилгруппой. Другие предпочтительные соединения имеют формулу VI где алкил, Ar, арил, гетероарил, R2 и X - как определено выше. Особенно предпочтительными соединениями формулы VI являются те, в которых X означает О или NHCOR4, напримерNHCO алкил и NHCONH алкил. Предпочтительными арильными группами являются фенил и замещенный фенил. Предпочтительными гетероарильными группами являются пиридил и замещенный пиридил. Соединения формулы I, где W означает S,SO или SO2, являются особенно полезными в качестве промежуточных, приводящих к соединениям, в которых W означает NH. Но такие соединения также показывают ингибиторную активность в отношении циклинзависимых и тирозиновых киназ. За исключением специально оговоренных случаев следующие определения применяются на протяжении всего описания. Алкил означает неразветвленный или разветвленный углеводородный радикал, содержащий от 1 до 10 углеродных атомов (кроме оговоренных случаев), и включает, например,метил, этил, н-пропил, изопропил, н-бутил,втор-бутил, изобутил, трет-бутил, н-пентил,изопентил, н-гексил и тому подобные. Галоген включает фтор, хлор, бром и иод. Алкенил означает неразветвленные или разветвленные углеводородные радикалы, содержащие от 2 до 10 углеродных атомов и одну или две двойные связи, и включает этенил, 3 бутен-1-ил, 2-этенилбутил, 3-гексен-1-ил, 3,6 октадиен-1-ил и тому подобные. Алкинил означает неразветвленные или разветвленные углеводородные радикалы, содержащие от 2 до 10 углеродных атомов и одну или две тройные связи, и включает этинил, 3 бутин-1-ил, пропинил, 2-бутин-1-ил, 3-пентин 1-ил, 3,6-октадиен-1-ил и тому подобные. Циклоалкил означает моноциклическую или полициклическую гидрокарбиловую группу, такую как циклопропил, циклогептил, циклооктил, циклодецил, циклобутил, адамантил,норпинанил, декалинил, норборнил, циклогексил и циклопентил. Такие группы могут быть замещены группами, такими как гидрокси, кето и тому подобными. Также включенными являются кольца, в которых от 1 до 3 гетероатомов замещены углеродом. Такие группы имеют название гетероциклил, что означает циклоалкильную группу, также несущую, по крайней мере, один гетероатом, выбранный из О, S илиNR2, образцом которой являются оксиранил,пирролидинил, пиперидил, тетрагидропиран и морфолин. Алкокси означает алкильные группы,упомянутые выше, связанные с кислородом,образцы которых включают метокси, этокси,изопропокси, трет-бутокси и тому подобные. Кроме того, алкокси означает полиэфиры, такие как -О-(СН 2)2-O-СН 3 и тому подобные. Алканоил означает алкильные группы,связанные через карбонил, т.е. C1-C9-C(O)-. Такие группы включают формил, ацетил, пропионил, бутирил и изобутирил. Ацил означает алкильную или арильную(Ar) группу, связанную через карбонильную группу, т.е. R-C(O)-. Например, ацил включаетC1-С 10 алканоил, включая замещенный алканоил,где алкильная часть может быть замещенаNR4R5 или карбоксильной, или гетероциклической группами. Типичные ацильные группы включают ацетил, бензоил и тому подобные. Алкил, алкенил, алкокси и алкинил группы, описанные выше, являются необязательно замещенными, предпочтительно 1-3 группами,выбранными из ряда NR4R5, N(O)NR4R5,NR4R5R6Y, фенил, замещенный фенил, тио C1 С 10 алкил, C1-С 10 алкокси, гидрокси, карбокси,C1-С 10 алкоксикарбонил, галоген, нитрил, циклоалкил и 5-6-членное карбоциклическое кольцо или гетероциклическое кольцо, содержащее 1-2 гетероатома, выбранных из азота, замещенного азота, кислорода и серы.C1-С 10 алкил или (CH2)nPh, где n равно 0, 1, 2 или 3. Пергалогено и полигалогено замещение также включено. Примеры замещенных алкильных групп включают 2-аминоэтил, пентахлорэтил, трифторметил, 2-диэтиламиноэтил, 2-диметиламинопропил, этоксикарбонилметил, 3-фенилбутил,метанилсульфанилметил, метоксиметил, 3 гидроксипентил, 2-карбоксибутил, 4-хлорбутил,3-циклопропилпропил,пентафторэтил,3 морфолинопропил, пиперазинилметил и 2-(4 метилпиперазинил)этил. Примеры замещенных алкинильных групп включают 2-метоксиэтинил, 2-этилсульфаниэтинил,4-(1-пиперазинил)-3-(бутинил),3 фенил-5-гексинил, 3-диэтиламино-3-бутинил, 4 хлор-3-бутинил, 4-циклобутил-4-гексенил и тому подобные. Типичные замещенные алкоксигруппы включают 2-аминоэтокси, трифторметокси, 2 диэтиламиноэтокси, 2-этоксикарбонилэтокси, 3 гидроксипропокси, 6-карбоксгексилокси и тому подобные. Следующие образцы замещенных алкильной, алкенильной и алкинильной групп включают диметиламинометил, карбоксиметил, 4 диметиламино-3-бутен-1-ил, 5-этилметиламино 3-пентин-1-ил, 4-морфолинобутил, 4-тетрагидропиринидилбутил, 3-имидазолидин-1-илпро 003640 10 пил, 4-тетрагидротиазол-3-илбутил, фенилметил, 3-хлорфенилметил и тому подобные. Термины "Ar" и арил означают незамещенные и замещенные ароматические группы. Гетероарильные группы содержат от 4 до 9 атомов в кольце, из которых от 1 до 4 независимо выбраны из ряда, состоящего из О, S и N. Предпочтительные гетероарильные группы содержат 1-2 гетероатома в 5-6-членном ароматическом кольце. Моно и бициклические ароматические кольцевые системы включены в определение арила и гетероарила. Типичные арильные и гетероарильные группы включают фенил, 3 хлорфенил, 2,6-дибромфенил, 2-пиридил, 3 метил-2-пиридил,3-бензотиенил,2,4,6 трибромфенил,4-этил-2-бензотиенил,2 фуранил, 3,4-диэтил-2-фуранил, 1-нафтил, 4,7 дихлор-2-нафтил, пиррол, пиразол, имидазол,тиазол и тому подобные. Особенно предпочтительной гетероарильной группой является пиридил. Предпочтительными Ar группами являются фенил и фенил, замещенный 1, 2 или 3 группами, независимо выбранными из ряда алкил,алкокси,тио,тиоалкил,гидрокси,-COOR7, амино формулы -NR4R5, CONR4R5 иNR5R6Y, где R4 и R5 - как определено выше, a R7 означает Н, алкил или замещенный алкил, например метил, 2-аминоэтил, трихлорэтил, дифенилметил и тому подобные. Алкил и алкоксигруппы могут быть замещены как определено выше. Например, типичными группами являются карбоксиалкил, алкоксикарбонилалкил, гидроксиалкил, гидроксиалкокси и алкоксиалкил. Заявленные соединения будут названы здесь согласно следующему распределению положений Следует принять во внимание, что соединения, определенные вышеприведенной формулой, могут существовать в таутомерных формах. Например, 2-кето соединения могут таутомеризироваться в 2-енол, когда R2 означает водород,следующим образом: 11 Аналогично 2-имино соединения могут таутомеризироваться в 2-амино соединения следующим образом: Все таутомерные формы соединений формул I-IV предполагаются и включены в рамки настоящего изобретения. Заявленные соединения могут существовать как в нерастворимой, так и в растворимой форме, включая гидратированные формы. Вообще растворимые формы, включая гидратированные формы, эквивалентны нерастворимым формам и подразумеваются включенными в рамки настоящего изобретения. Соединения формулы I пригодны для создания в дальнейшем фармацевтически приемлемых составов, содержащих соли, включая, но не ограничиваясь, соли, полученные при добавлении кислот и/или оснований, сольваты и Nоксиды. Данное изобретение также представляет фармацевтические составы, содержащие соединения формулы I вместе с фармацевтически приемлемыми носителем, растворителем или наполнителем. Все эти формы входят в настоящее изобретение. Фармацевтически приемлемые соли, соединений формулы I, полученные при добавлении кислот, включают соли производные неорганических кислот, таких как соляная, азотная,фосфорная, серная, бромисто-водородная, иодисто-водородная, фосфористая и тому подобные,а также соли производные органических кислот,таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты,гидроксиалкановые кислоты, алкандионовые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты и т.д. Такие соли, таким образом, включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, фосфат, двузамещенный фосфат,однозамещенный фосфат, метафосфат, пирофосфат, хлорид, бромид, иодит, ацетат, пропионат, каприлат, изобутират, оксалат, малонат,сукцинат, суберат, себацит, фумарат, малеат,манделат, бензоат, хлорбензоат, метилбензоат,динитробензоат, фталат, бензолсульфонат, толуолсульфонат, фенилацетат, цитрат, лактат,малеат, тартрат, метансульфонат и тому подобные. Также рассмотрены соли аминокислот,такие как аргинат, глюконат, галактуронат и тому подобные (см., например, Berge et al., 003640"Pharmaceutical Salts", J. of Pharmaceutical Science, 1977;66:1-19). Соли основных соединений, полученные при добавлении кислот, получают взаимодействием свободной основной формы с достаточным количеством требуемой кислоты для получения соли традиционным способом. Свободная основная форма может быть регенерирована путем взаимодействия солевой формы с основанием и отделением основания традиционным способом. Свободные основные формы отличны от их соответствующих солевых форм отчасти по некоторым физическим свойствам, таким как растворимость в полярных растворителях, но во всем остальном соли эквивалентны их соответствующим свободным основаниям в рамках целей настоящего изобретения. Фармацевтически приемлемые соли, полученные при добавлении оснований, образованы с металлами или аминами, такими как щелочные и щелочно-земельные металлы гидроксидов или органические амины. Примерами металлов,используемых в качестве катионов, являются натрий, калий, магний, кальций и тому подобные. Примерами соответствующих аминов являются N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, Nметилглюкамин и прокаин; см., например,Berge, et al., как указано ранее. Соли кислых соединений, полученные при добавлении оснований, получают взаимодействием свободной кислой формы с достаточным количеством требуемого основания для того,чтобы получить соль традиционным способом. Свободная кислая форма может быть регенерирована взаимодействием солевой формы с кислотой и отделением свободной кислоты традиционным способом. Свободные кислые формы отличны от их соответствующих солевых форм отчасти по некоторым физическим свойствам,таким как растворимость в полярных растворителях, но во всем остальном соли эквивалентны их соответствующим свободным основаниям в рамках целей настоящего изобретения. Заявленные соединения являются пригодными для лечения рака (например, лейкемии и рака легких, груди, простаты и кожи, такого как меланома) и других пролиферативных заболеваний, включая, но не ограничиваясь, псориаз,HSV, HIV, рестеноз и атеросклероз. Для того чтобы использовать соединение настоящего изобретения для лечения рака, больному раком,назначают терапевтически эффективное количество фармацевтически приемлемого состава,содержащего заявленное соединение. Еще одним предметом данного изобретения является способ лечения субъектов, страдающих заболеваниями, вызванными пролиферацией сосудистых гладкомышечных клеток. Соединения в рамках настоящего изобретения эффективно ингибируют пролиферацию и миграцию сосудистых гладкомышечных клеток. 13 Данный способ приводит к ингибированию пролиферации и/или миграции сосудистых гладкомышечных клеток путем назначения эффективной дозы соединения формулы I субъекту, нуждающемуся в лечении. Заявленные соединения могут быть включены в фармацевтические составы и назначены в самых разнообразных оральных и парентеральных дозовых формах, включая накожное и ректальное применение. Необходимо иметь ввиду, что последующие дозовые формы могут содержать в качестве активного компонента соединение формулы I или соответствующую фармацевтически приемлемую соль или ее сольват. Еще одним воплощением данного изобретения является рецептура фармацевтического состава, включающая соединение формулы I вместе с фармацевтически приемлемыми носителем, растворителем или наполнителем. Для приготовления фармацевтических составов с соединениями настоящего изобретения могут быть использованы как твердые, так и жидкие фармацевтически приемлемые носители. Твердые формы препаратов включают порошки,таблетки, пилюли, капсулы, облатки, свечи и приготовляемые по рецепту гранулы. Твердый носитель может быть одно или более компонентным, каждый из которых может также действовать как растворитель, вкусовой агент, связующее вещество, консервант, дезинтегрирующий агент или инкапсулирующий материал. В порошках носитель представляет собой хорошо размельченное твердое вещество, такое как тальк или крахмал, которые находятся в смеси с хорошо размельченным активным компонентом. В таблетках активный компонент смешан с носителем, имеющим необходимые связывающие свойства, в соответствующих пропорциях, и спрессован в требуемую форму требуемого размера. Фармацевтические составы согласно данному изобретению предпочтительно содержат приблизительно 5-70% или более активного соединения. Пригодные носители включают карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлозу, натрий карбоксиметилцеллюлозу, низкоплавкий воск, масло какао и тому подобные. Предпочтительной формой для орального применения являются капсулы,которые обеспечивают активное соединение с инкапсулирующим материалом в качестве носителя, внутри которых активный компонент в присутствии или отсутствии другого носителя окружен носителем, который, таким образом,связан с ним. Аналогично включены облатки и лепешки. Таблетки, порошки, капсулы, пилюли,облатки и лепешки могут быть использованы в качестве твердых дозовых форм, пригодных для орального назначения. 14 Для приготовления свечей, прежде всего,расплавляют низкоплавкий воск, такой как смесь глицеридов жирных кислот или какао масло, и равномерно распределяют в нем активный компонент посредством перемешивания. Расплавленную гомогенную смесь затем разливают в формы подходящего размера, оставляют охлаждаться и тем самым отвердевать. Жидкие формы препаратов включают растворы, суспензии и эмульсии, такие как вода или растворы вода/пропиленгликоль. Для парентеральной инъекции жидкие препараты могут быть прописаны в водном растворе полиэтиленгликоля, изотоническом солевом растворе, 5% водном растворе глюкозы и тому подобных. Водные растворы, пригодные для орального применения, могут быть приготовлены растворением активного компонента в воде и добавлением подходящих красителей, вкусовых добавок, стабилизирующих и фиксирующих агентов при необходимости. Водные суспензии,пригодные для орального применения, могут быть приготовлены путем диспергирования хорошо размельченного активного компонента в воде или перемешивания с вязкими материалами, такими как натуральные или синтетические камеди, смолы, метилцеллюлоза, натриевая карбоксиметилцеллюлоза или другие хорошо известные суспендирующие агенты. Также включенными являются формы препаратов, которые, как предполагается, переводят незадолго до применения в жидкие формы препаратов, пригодные для орального назначения. Такие жидкие формы включают растворы, суспензии и эмульсии. Эти препараты могут содержать кроме активного компонента красители, вкусовые добавки, стабилизаторы,буферы, искусственные и естественные подсластители, диспергаторы, загустители, солюбилизирующие агенты и тому подобные. Воски, полимеры, микрочастицы и тому подобные могут быть использованы для приготовления длительно высвобождаемых дозовых форм. Также осмотические насосы могут быть применены для распространения активного соединения постоянно в течение длительного периода времени. Фармацевтические препараты данного изобретения предпочтительно являются разовой дозовой формой. В такой форме препарат подразделяют на разовые дозы, содержащие соответствующие количества активного компонента. Разовая дозовая форма может представлять из себя упакованный препарат, содержащий дискретные количества препарата, такой как пакетированные таблетки, капсулы и порошки в пузырьках или ампулах. Также разовая дозовая форма может быть представлена капсулой, таблеткой, облаткой или лепешкой сама по себе,или может быть представлена соответствующим числом любых из них в пакетированном виде. Терапевтически эффективная доза соединения формулы I и/или формулы II как правило 15 будет составлять около 1-100 мг/кг веса тела в день. Типичные дозы для взрослых будут составлять около 50-800 мг в день. Количество активного компонента в разовой дозе препарата можно варьировать или подбирать в интервале приблизительно от 0,1 до 500 мг, предпочтительно приблизительно от 0,5 до 100 мг в соответствии с частным случаем применения и эффективностью активного компонента. Состав может при необходимости также содержать другие совместимые терапевтические препараты. Субъекту, нуждающемуся в лечении соединением формулы I и/или II, назначают препарат в дозе приблизительно 1-500 мг в день как разово, так и несколькими дозами в течение 24 ч. Заявленные соединения способны связывать и ингибировать активность белков, обладающих способностью фосфорилировать другие белки, такие как cdk, PDGFr, FGFr, c-Src иEGFr-FL. Cdk образуют комплексы с циклинами, и эти комплексы фосфорилируют ключевые белки, позволяющие клетке проходить через клеточный цикл (Meijer L., Progress in Cell CycleResearch, 1995;1:351-363) . Заявленные соединения ингибируют это фосфорилирование и тем самым могут быть использованы как антипролиферативные препараты для лечения рака и/или рестеноза и других пролиферативных заболеваний. Вследствие их ингибиторной активности в отношении cdk и других киназ заявленные соединения являются также полезными исследовательскими инструментами для изучения механизма действия таких киназ как in vitro, так иin vivo. Хотя формы данного изобретения, представленные здесь, составляют в настоящее время предпочтительные варианты, многие другие варианты являются возможными. Нет необходимости упоминать здесь все возможные эквивалентные формы или ответвления данного изобретения. Понятно, что термины, используемые здесь, являются скорее описательными, а не ограничивающими, и поэтому следует иметь ввиду, что различные изменения могут быть сделаны без отклонения от сущности или рамок настоящего изобретения. Следующие соединения иллюстрируют специфические примеры, включенные в настоящее изобретение, и соединения, перечисленные ниже, относятся к предпочтительным вариантам. 1-метил-7-[4-(пиразол-1-ил)фениламино]3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)он; 1-метил-7-[4-(4-метилпиперазин-1-ил) фениламино]-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-он; 1-метил-7-[4-(4-гидроксипиперидин-1-ил) фениламино]-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-он;[4,5-d]пиримидин-2,4-дион и 7-(пиридин-4-иламино)-3-(3,5-диметоксифенил)-1-этил-1 Н-пиримидо[4,5-d]пиримидин 2,4-дион. Соединения формулы I, где Z означает N или СН, могут быть получены согласно схеме синтеза, представленной на схемах 1-3. Хотя эти схемы часто показывают точные структуры,необходимо иметь в виду, что эти методы широко применимы к аналогичным соединениям формулы I, давая соответствующее представление о защите и снятии защиты с реактивных функциональных групп с помощью стандартных методов органической химии. Например,для предотвращения нежелательных побочных 24 реакций, гидроксигруппы необходимо перевести в эфиры или сложные эфиры в ходе химических реакций в других частях молекулы. Для восстановления свободной гидроксигруппы защиту легко удаляют. Аминогруппы и карбоксильные кислые группы сходным образом модифицируют для защиты от нежелательных побочных реакций. Типичные защитные группы и способы их присоединения и расщепления полностью описаны Green и Wuts в ProtectiveYork, 1973. Схема 1 описывает типичный способ получения бициклических пиримидинов и бициклических 3,4-дигидропиримидинов данного изобретения. Синтез начинают с 4-хлор-2(метилтио)-5-пиримидинкарбонитрила или с 4 хлор-6-(метилтио)-3-пиридинкарбонитрила,которые легко получают из обычных реагентов. Замещение 4-хлорогруппы на амин в растворителе, таком как тетрагидрофуран (ТГФ), в присутствии или отсутствии третичного амина, такого как триэтиламин, приводит к образованию соответствующих 4-амино-2-(метилтио)-5 пиримидинкарбонитрила или 4-амино-6(метилтио)-3-пиридинкарбонитрила. Используемый амин может быть безводным или присутствовать в водном растворе в виде метилированного или этилированного амина или циклопентиламина. Использование водного гидроксида аммония приводит к образованию первичного амина в положении 4. Восстановление цианогруппы обычными восстанавливающими агентами, такими как ЛАГ, приводит к образованию соответствующего аминометильного аналога. Циклизацию выполняют с помощью реакции с агентом,таким как 1,1'карбонилдиимидазол (КДИ). Окисление метилтиогруппы оксидантом, таким как оксазиридин,в растворителе, таком как хлороформ, при комнатной температуре приводит к образованию метилсульфоксидного производного. Замещение сульфоксида на амин (HaNR1) дает в результате образование соответствующего 7 амино-3,4-дигидробициклического пиримидина. Температура, требуемая для замещения, зависит от используемого амина. Ароматические, вторичные и третичные амины обычно требуют более высокой температуры, чем первичные алифатические или бензиловые амины. Когда используют ароматические амины, такие как анилин, реакция обычно протекает с амином,как растворителем, при высокой температуре(например, 80-150 С). Бициклические 3,4-дигидропиримидины легко окисляют с помощью реакции с оксидантами, такими как трет-бутоксид калия и кислород, приводящей к образованию соответствующих бициклических пиримидинов, представленных в настоящем изобретении. Схема 1 а отображает типичный способ получения бициклических пиримидинов формулыI, где R2 означает Н, а X означает NHR10. На соответствующим образом замещенный 2 метилтио-5-аминометил-4-аминопиримидин сначала воздействуют цианистым бромом для циклизации в дигидропиримидопиримидин. Метилтиогруппу окисляют до сульфоксида с помощью реакции с оксидантом, таким как оксазиридин или пербензойная кислота. Метилсульфоксидный остаток легко замещают с помощью реакции с амином (R1NH2) для получения 7-амино-3,4-дигидробициклического пиримидина, имеющего аминогруппу во 2-м положении. Эти дигидропиримидины легко преобразуют в соответствующие ароматические пиримидины с помощью окисления обычными оксидантами, такими как трет-бутоксид калия или кислород. 2-аминодигидропиримидины и 2 аминопиримидины являются подходящими биологическими агентами, а также полезны в качестве промежуточных соединений, в которых 2-аминогруппу модифицируют стандартными методами, например, алкилированием или ацилированием, для получения соединений формулы I, где X означает NHR10, например, 003640 26 Схемы 1b и 1 с отображают основные процессы получения бициклических пиримидинов формулы I, где G означает С. На схеме 1b 2 метилтио-4-галоген-5-цианпиримидин взаимодействует с алкилмалонатом в присутствии основания, такого как гидрид натрия, что приводит к образованию производного пиримидилмалоната. R2 группы, такие как алкил и циклоалкил, могут быть вставлены с помощью реакции промежуточного соединения пиримидилмалоната с алкилом или циклоалкилгалидом в присутствии основания, такого как карбонат натрия или триэтиламин. 5-Цианогруппа промежуточного соединения пиримидилмалоната легко реагирует с восстанавливающим агентом,что приводит к восстановлению ее в аминометильную группу, амин которой затем замещает одну из алкоксигрупп малонатного остатка, что приводит к закрытию кольца и образованию соответствующего дигидропиримидина. Декарбоксилирование оставшейся малонаткарбоксильной группы легко осуществляют с помощью реакции с основанием, таким как щелочной гидроксид, соответственно получая 2 метилтио-5,6-дигидропиридопиримидин. Метилтиогруппу окисляют до сульфоксида, который затем легко замещают с помощью реакции с (R1NH2), что дает 2-амино-5,6-дигидропиридопиримидин. Дальнейшее окисление с помощью реакции с алкоксидом щелочного метала и кислородом приводит к образованию полного ароматического 7-гидроксипиридопиримидина, соответствующего формуле Схема 1 с показывает типичное преобразование 7-гидроксипиридопиримидина, полученного как описано выше, в 7-замещенные амино соединения формулы I (X=NHR10). 7-Гидрокси соединение сначала взаимодействует с фосфорным оксигалогенидом, что приводит к образованию соответствующего 7-галогенопиридопиримидина. 7-Галогеногруппу легко замещают с помощью реакции с амином, таким как аммоний, получая в результате 7-аминосоединение,которое может быть получено с помощью стандартных процессов, приводящих к образованию Схема 2 иллюстрирует незначительно отличный процесс получения заявленных соединений, начиная с соответственно замещенных пиридила или пиримидилальдегида с формулой где R2 означает, например, Н или алкил, такой как этил. Все реакции по схеме 2 проводят с помощью хорошо известных процедур. Альдегид конденсируют с N-замещенным амином(H2NR3) для получения имина. Имин восстанавливают до вторичного амина, а восстановленный амин циклизуют и затем переводят в ключевое сульфоксидное промежуточное соединение. Сульфоксидную группу легко замещают с помощью реакции с практически любым первичным амином, что приводит к образованию соединений основной формулы данного изобретения Предпочтительная группа заявленных соединений имеет формулу I, где R3 означает арил, такой как двухзамещенный, трехзамещенный или четырехзамещенный фенил. Их легко получают с помощью любой из вышеупомянутых реакций, например, взаимодействием соответственно замещенного анилина с пиридилом 28 или пиримидиловым альдегидом, как показано на схеме 2. Типичные анилины, которые могут быть использованы в этой реакции имеют формулу где заместители выбирают из ряда фенил, хлор,бром, метил, метокси, гидрокси, гидроксиметил,2-диэтиламиноэтокси, метоксикарбонилметил,карбокси, карбоксиметил, этоксикарбонил, 2 карбоксиэтил, 2-этоксикарбонилэтил, NR4R5 иO(CH2)0-6NR4R5, где R4 и R5, как указано выше. Как указано выше, предпочтительная группа заявленных соединений имеет формулуI, где X означает NR10, а также, где X означает О. Типичные заявленные соединения получают согласно схеме 3, начиная с восстановленного имина, описанного в схеме 2 (где R2=H). Восстановленный имин циклизуют с помощью реакции с бромцианом, а 7-метилтиогруппу окисляют до соответствующего сульфоксида, как описано выше. Метилсульфоксидную группу замещают с помощью реакции с первичным амином (H2NR1), вслед за которой получают производное 2-аминогруппы с помощью реакции с алкилирующими или ацилирующими агентами (например, алкилизоцианатами или ацилгалагенидами), что приводит к образованию заявленных соединений с формулой I, где Все заявленные соединения легко очищают стандартными способами при необходимости. Типичные стадии используемой очистки включают хроматографию на твердых носителях, таких как силикагель или окись алюминия. Элюирование главным образом проводят, используя общепринятые растворители, такие как ацетон, этилацетат, тетрагидрофуран, этанол, 29 триэтиламин и смесь таких растворителей. Другие процессы очистки могут быть использованы подобным образом, включая кристаллизацию из общепринятых растворителей, таких как метанол, этанол, диэтиловый эфир, этилацетат и тому подобных. Иногда такая кристаллизация может давать сольваты, такие как сольват этанола,а также гидраты, и такие сольваты и гидраты включены в описание данного изобретения. Вышеприведенные схемы основной реакции в дальнейшем описаны в следующих детальных примерах, которые представлены только для иллюстративных целей, и не предназначены и ни должны быть истолкованы в качестве ограничения изобретения в любом варианте. Необходимо иметь в виду, что вариации и модификации могут быть сделаны без нарушения сущности или рамок изобретения. Препараты 1-10 и примеры 1-47 представляют характерные примеры схем основных реакций, показанных на схеме 1, приведенной выше. Препарат 1. 4-Гидрокси-2-(метилтио)-5 пиримидинкарбонитрил. К 119 г (703 ммоль) раствора свежеперегнанного этил(этоксиметилен)цианацетата в 800 мл метанола при 5 С добавляют 108 г (599 ммоль) 2-метил-2-тиопсевдомочевины. К этой смеси добавляют раствор метоксида натрия,приготовленного растворением 35,6 г (1,55 М) металлического натрия в 800 мл метанола. Раствор нагревают до комнатной температуры и перемешивают в течение 6 ч. После инкубации в течение ночи растворитель удаляют под пониженным давлением, остаток растворяют в 1,5 л воды при 50 С при перемешивании, а раствор фильтруют горячим. Фильтрат подкисляют до рН 2 концентрированной HCl и выдерживают при комнатной температуре в течение ночи. Осажденный продукт собирают и высушивают,получая 48,3 г (48%) поименованного соединения, которое используют непосредственно в следующей стадии. Препарат 2. 4-Хлор-2-(метилтио)-5-пиримидинкарбонитрил. Смесь 48,3 г (289 ммоль) 4-гидрокси-2(метилтио)-5-пиримидинкарбонитрила и 150 мл оксихлорида фосфора нагревают под тягой в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры, фильтруют и фильтрат концентрируют до сухого состояния. Остаток распределяют между дихлорметаном и ледяной водой. Органическую фазу отмывают водой,высушивают с помощью сульфата магния и концентрируют до остатка, который растворяют в 750 мл гексана. Перемешанную смесь нагревают под тягой и горячий раствор гексана декантируют от нерастворимого материала. При охлаждении до комнатной температуры образуются кристаллы, после сбора которых получают 32 г (60%) поименованного соединения. 30 Препарат 3. 4-(Циклопентиламино)-2(метилтио)-5-пиримидинкарбонитрил. К раствору 10,0 г (53,9 ммоль) 4-хлор-2(метилтио)-5-пиримидинкарбонитрила в 100 мл дихлорметана при 0 С добавляют 9,0 мл (64,6 ммоль) триэтиламина, вслед за которым по каплям добавляют 6,4 мл (64,6 ммоль) циклопентиламина. Реакционную смесь выдерживают при 0-10 С в течение 16 ч, растворяют в 100 мл гексана и фильтруют. Фильтрат хроматографируют на силикагеле, элюируя смесью этилацетат/дихлорметан/гексан в соотношении 1:4:5 и получают 4,6 г (36%) чистого продукта. Задержавшийся на фильтре твердый остаток, содержащий и продукт и триэтиламин гидрохлорид,ресуспендируют в 50 мл дихлорметана и хроматографируют как описано выше, получая 7,2 гC11H14N4S: С - 56,38; Н - 6,02; N - 23,91. Найдено: С - 56,48; Н - 5,99; N - 24,12. Препарат 4. 4-(Изопропиламино)-2(метилтио)-5-пиримидинкарбонитрил. К раствору 20,0 г (107,7 ммоль) 4-хлор-2(метилтио)-5-пиримидинкарбонитрила в 200 мл дихлорметана при 0 С добавляют 18,0 мл (129,3 ммоль) триэтиламина, вслед за которым по каплям добавляют 11,0 мл (129,3 ммоль) изопропиламина. Реакционную смесь перемешивают при 0 С в течение 3 ч, затем в течение 30 мин при комнатной температуре. Образовавшийся в результате осадок триэтиламин гидрохлорида фильтруют. Фильтрат хроматографируют на короткой колонке с силикагелем, элюируя дихлорметаном. Чистые фракции смешивают,концентрируют, суспендируют в гексане и фильтруют, получая 13,7 г (61%) продукта. Неочищенные фракции, содержащие и продукт, и триэтиламин гидрохлорид, растворяют в этилацетате, отмывают дважды водой и один раз солевым раствором. Органическую фазу высушивают над сульфатом магния и концентрируют. Остаток кристаллизуют из смеси, содержащей ацетат/гексан в соотношении 1:9, получая 3,6 г (16%) дополнительного продукта с т.пл. 121,0-122,5 С. Содержание элементов, рассчитанное для(экзо). К раствору 10,0 г (53,9 ммоль) 4-хлор-2(метилтио)-5-пиримидинкарбонитрила в 100 мл дихлорметана при 0 С добавляют 9,0 мл (64,6 ммоль) триэтиламина, вслед за которым по каплям добавляют 7,0 мл (59,3 ммоль) экзо-2 аминонорборнана. Реакционную смесь перемешивают при 0 С в течение 2 ч. Получившийся в 31 результате осадок триэтиламингидрохлорида фильтруют. Фильтрат отмывают 3 раза насыщенным водным раствором бикарбоната натрия. Водную фазу обратно экстрагируют дважды дихлорметаном. Объединенную органическую фазу концентрируют, остаток очищают, фильтруя через короткую колонку с силикагелем,элюируя дихлорметаном, получая 8,9 г (64%) поименованного соединения. Содержание элементов, рассчитанное дляC13H16N4S: С - 59,97; Н - 6,19; N - 21,52. Найдено: С - 59,70; Н - 6,08; N - 21,41. Препарат 6. 4-(Метиламино)-2-(метилтио)5-пиримидинкарбонитрил. Через раствор 14,5 г (78,1 ммоль) 4-хлор-2(метилтио)-5-пиримидинкарбонитрила в 800 мл диэтилового эфира при 5 С пропускают газообразный метиламин в течение 15 мин. Реакционную смесь оставляют нагреваться до комнатной температуры, выдерживают в течение ночи и фильтруют. Твердый осадок отмывают диэтиловым эфиром, затем 50 мл воды и высушивают до получения 12,0 г (81%) поименованного соединения с т. пл. 189-190 С. Содержание элементов, рассчитанное дляC7H8N4S: С - 46,65; Н - 4,47; N - 31,09. Найдено: С - 46,79; Н - 4,60; N - 31,26. Препарат 7. 5-(Аминометил)-4-(циклопентиламино)-2-(метилтио)пиримидин. К перемешиваемой при 0 С суспензии 1,7 г (44,8 ммоль) ЛАГ в 70 мл тетрагидрофурана добавляют по каплям раствор 5,0 г (21,3 ммоль) 4-(циклопентиламино)-2-(метилтио)-5-пиримидинкарбонитрила в 250 мл тетрагидрофурана. Реакционную смесь оставляют нагреваться медленно при комнатной температуре в течение ночи. Смесь повторно охлаждают до 0 С и обрабатывают насыщенным раствором сульфата аммония до тех пор, пока не прекратится выделение пузырьков газа. После перемешивания в течение следующих 15 мин серый твердый осадок фильтруют и отмывают четыре раза горячим этилацетатом. Объединенные органические смывы концентрируют и осадок хроматографируют на силикагеле, элюируя смесью метанол/гексан/хлороформ в соотношении 1:1:8,получая 4,0 г (79%) поименованного соединения с т.пл. 58-60 С. Содержание элементов, рассчитанное дляC11H18N4S: С - 55,43; Н - 7,61; N - 23,51. Найдено: С - 55,45; Н - 7,56; N - 23,49. Препарат 8. 5-(Аминометил)-4-(изопропиламино)-2-(метилтио)пиримидин. К перемешиваемой при 0 С суспензии 5,9 г (156,3 ммоль) ЛАГ в 200 мл тетрагидрофурана добавляют по каплям раствор 15,5 г (74,4 ммоль) 4-(изопропиламино)-2-(метилтио)-5 пиримидинкарбонитрила в 500 мл тетрагидрофурана. Реакционную смесь оставляют медлен 003640 32 но нагреваться до комнатной температуры в течение ночи. Смесь повторно охлаждают до 0 С и обрабатывают насыщенным раствором сульфата аммония до тех пор, пока не прекратится выделение пузырьков газа. После перемешивания в течение следующих 15 мин серый твердый осадок фильтруют и отмывают шесть раза горячим этилацетатом. Объединенные органические смывы концентрируют, и остаток очищают хроматографией двумя порциями на колонке Biotage размером 415 см с силикагелем, элюируя смесью ацетонитрил/дихлорметан/триэтиламин в соотношении 60:38:2, а затем смесью ацетонитрил/дихлорметан/метанол/ триэтиламин в соотношении 60:33:5:2, получая 12,9 г (82%) поименованного соединения в виде желтого масла. Масс-спектр (CI) (m+1)/z 213. Препарат 9. 5-(Аминометил)-4-(бицикло(экзо). К перемешиваемой при 0 С суспензии 2,5 г (65,3 ммоль) ЛАГ в 100 мл тетрагидрофурана добавляют по каплям раствор 8,5 г (32,6 ммоль) 4-(бицикло[2.2.1]гепт-2-иламино)-2-(метилтио)5-пиримидинкарбонитрила в 375 мл тетрагидрофурана. Реакцию оставляют медленно нагреваться до комнатной температуры в течение ночи. Смесь повторно охлаждают до 0 С и обрабатывают насыщенным раствором сульфата аммония до тех пор, пока не прекратится выделение пузырьков газа. После перемешивания в течение следующих 15 мин серый твердый осадок фильтруют и отмывают четыре раза горячим этилацетатом. Объединенные органические смывы концентрируют и остаток очищают хроматографией на силикагеле, элюируя смесью метанол/дихлорметан в соотношении 1:9, а затем в соотношении 2:8, получая 5,8 г (68%) поименованного соединения. Содержание элементов, рассчитанное дляC13H20N4S: С - 59,06; Н - 7,62; N - 21,19. Найдено: С - 58,94; Н - 7,86; N - 21,04. Препарат 10. 5-(Аминометил)-4-(метиламино)-2-(метилтио)пиримидин. К перемешиваемой при 0 С суспензии 17,0 г (448 ммоль) литий алюминий гидрида в 500 мл тетрагидрофурана добавляют по каплям раствор 30,0 г (166 ммоль) 4-(метиламино)-2-(метилтио)-5-пиримидинкарбонитрила в 1,5 л тетрагидрофурана. Реакционную смесь оставляют медленно нагреваться до комнатной температуры в течение ночи. Смесь повторно охлаждают до 0 С и обрабатывают насыщенным раствором сульфата аммония до тех пор, пока не прекратится выделение пузырьков газа (80-100 мл). После перемешивания в течение следующих 15 мин серый твердый осадок фильтруют и отмывают три раза горячим тетрагидрофураном и один раз горячим этилацетатом. Объединенные органические смывы концентрируют, а остаток 33 хроматографируют на силикагеле, элюируя смесью триэтиламин/метанол/хлороформ в соотношении 0,5:25:75, получая 21,6 г (70%) масла,которое загустевает при отстаивании поименованного соединения. Масс-спектр (CI) (m+1)/z 185. Пример 1. 1-Циклопентил-7-метансульфанил-3,4-дигидропиримидо[4,5-d]пиримидин 2(1 Н)-он. К раствору 4,2 г (17,6 ммоль) 5-(аминометил)-4-(циклопентиламино)-2-(метилтио) пиримидина в 100 мл тетрагидрофурана при 0 С добавляют 3,4 г (21,1 ммоль) 1,1'-карбонилдиимидазола. Раствор перемешивают при 0 С в течение 30 мин, затем нагревают под слабой тягой в течение ночи. Смесь концентрируют до твердого остатка, т.е. перемешивают как суспензию в хлороформе в течение 4 ч. Рыхлый твердый осадок собирают и высушивают, получая 2,6 г продукта, загрязненного около 5% имидазола. Фильтрат хроматографируют на силикагеле,элюируя смесью этилацетат/ дихлорметан в соотношении 6:4, получая 1,6 г продукта, загрязненного около 10% имидазола. Небольшую порцию кристаллизуют из хлороформа, получая аналитически чистый образец поименованного соединения с т. пл. 179-182 С. Содержание элементов, рассчитанное дляC12H16N4OS: С - 54,52; Н - 6,10; N - 21,19. Найдено: С - 54,42; Н - 6,11; N - 21,29. Пример 2. 1-Изопропил-7-метансульфанил-3,4-дигидропиримидо[4,5-d]пиримидин 2(1 Н)-он. К раствору 12,0 г (56,5 ммоль) 5(аминометил)-4-(изопропиламино)-2-(метилтио) пиримидина в 300 мл тетрагидрофурана при 0 С добавляют 11,0 г (67,8 ммоль) 1,1'-карбонилдиимидазола. Раствор перемешивают при 0 С в течение 30 мин, затем нагревают под слабой тягой в течение ночи. Смесь концентрируют до твердого остатка, т.е. растворяют в хлороформе,отмывают дважды 1N HCl, водой, насыщенным раствором бикарбоната натрия и рассолом. Органическую фазу высушивают над сульфатом магния и концентрируют. Неочищенный твердый остаток кристаллизуют из смеси хлороформ/гексан, получая 9,7 г (72%) поименованного соединения с т.пл. 175,0-176,5 С. Содержание элементов, рассчитанное дляC10H14N4OS: С - 50,40; Н - 5,92; N - 23,51. Найдено: С - 50,35; Н - 5,90; N - 23,54. Пример 3. 1-Бицикло[2.2.1]гепт-2-ил-7 метансульфанил-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-он(экзо). К раствору 4,6 г (17,6 ммоль) 5-(аминометил)-4-(бицикло[2.2.1]гепт-2-иламино)-2(метилтио)пиримидина в 100 мл тетрагидрофурана при 0 С добавляют 3,7 г (22,7 ммоль) 1,1'карбонилдиимидазола. Раствор перемешивают при 0 С в течение 30 мин, при комнатной тем 003640 34 пературе в течение 2 ч, затем нагревают под слабой тягой в течение 48 ч. Смесь растворяют в рассоле и экстрагируют диэтиловым эфиром. Органическую фазу концентрируют, остаток очищают хроматографией на силикагеле, т.е. элюируют смесью метанол/дихлорметан в соотношении 5:95, затем 10:90, получая 2,2 г (85%) поименованного соединения с т.пл. 133-134 С. Содержание элементов, рассчитанное дляC14H18N4OS: С - 57,91; Н - 6,25; N - 19,29. Найдено: С - 57,61; Н - 6,09; N - 19,12 Пример 4. 7-Метансульфанил-1-метил-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. К раствору 21,2 г (152,2 ммоль) 5(аминометил)-4-(метиламино)-2-(метилтио) пиримидина в 900 мл тетрагидрофурана и 100 мл диметилформамида при 0 С добавляют 3,4 г(21,1 ммоль) 1,1'-карбонилдиимидазола. Раствор перемешивают при 0 С в течение 1 ч, затем нагревают под слабой тягой в течение 10 ч. Смесь охлаждают и твердый осадок собирают, отмывают диэтиловым эфиром и высушивают, получая 18,6 г (78%) поименованного соединения с т. пл. 263-265 С. Содержание элементов, рассчитанное дляC8H10N4OS: С - 45,70; Н - 4,79; N - 26,65; S - 15,25. Найдено: С - 46,15; Н - 4,59; N - 26,62; S 15,51. Пример 5. 1-Циклопентил-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин 2(1 Н)-он. К раствору 3,7 г (14,0 ммоль) 1 циклопентил-7-метансульфанил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она в 40 мл хлороформа при комнатной температуре добавляют 4,4 г (16,8 ммоль) 3-фенил-2(фенилсульфонил)оксазиридина. Реакционную смесь перемешивают в течение 3 ч, фильтруют и отмывают смесью хлороформ/гексан в соотношении 1:1, получая 2,85 г (73%) поименованного соединения с т. пл. 235-236 С (dec). Содержание элементов, рассчитанное дляC12H16N4O2S: С - 51,41; Н - 5,75; N - 19,98. Найдено: С - 50,43; Н - 5,55; N - 19,52. Пример 6. 1-Изопропил-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин 2(1 Н)-он. К раствору 7,0 г (29,4 ммоль) 1-изопропил 7-метансульфанил-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-она в 80 мл хлороформа при комнатной температуре добавляют 9,2 г (35,2 ммоль) 3-фенил-2-(фенилсульфонил)оксазиридина. Реакционную смесь перемешивают в течение ночи, разбавляют 40 мл гексана, фильтруют и отмывают смесью хлороформ/гексан в соотношении 1:1, получая 6,4 г (85%) поименованного соединения с т. пл. 218-219 С (dec). Содержание элементов, рассчитанное для С 10 Н 14N4 О 2S: 35 С - 47,23; Н - 5,55; N - 22,03. Найдено: С - 46,88; Н - 5,40; N - 21,56. Пример 7. 1-Бицикло[2.2.1]гепт-2-ил-7 метансульфинил-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-он(экзо). К раствору 2,0 г (6,9 ммоль) 1 бицикло[2.2.1]гепт-2-ил-7-метансульфанил-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она в 20 мл хлороформа при комнатной температуре добавляют 2,1 г (8,3 ммоль) 3-фенил-2-(фенилсульфонил)оксазиридина. Реакционную смесь перемешивают в течение ночи, добавляют 200 мг (0,76 ммоль) или больше 3-фенил-2(фенилсульфонил)оксазиридина и перемешивают в течение ночи. Продукт выделяют хроматографией на колонке Biotage размером 415 см с силикагелем, нанося реакционную смесь на колонку и проводя градиентное элюирование смесью метанол/хлороформ в соотношениях сначала 2:98, затем 4:96, затем 8:92, получая 1,1 г(51%) поименованного соединения с т.пл. 220222 С (dec). Масс-спектр (CI) (m+1)/z 307 и 264. Пример 8. 7-Метансульфинил-1-метил-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. К раствору 9,0 г (42,8 ммоль) 7-метансульфанил-1-метил-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-она в 100 мл хлороформа при комнатной температуре добавляют 12,5 г (47,8 ммоль) 3-фенил-2-(фенилсульфонил)оксазиридина. Реакционную смесь перемешивают в течение 6 ч, добавляют 3,1 г (11,9 ммоль) или больше 3-фенил-2-(фенилсульфонил)оксазиридина и перемешивают в течение ночи. Реакционную смесь выдерживают в течение ночи при 0 С, фильтруют и высушивают под вакуумом при 75 С до постоянного веса 9,7 г (100%) поименованного соединения с т. пл. 225-228 С(dec). Масс-спектр (CI) (m+1)/z 227. Пример 9. 1-Циклопентил-7-(4-метоксифениламино)-3,4-дигидропиримидо[4,5-d]пиримидин-2 (1 Н)-он. Раствор 300 мг (1,07 ммоль) 1-циклопентил-7-метансульфинил-3,4-дигидpoпиpимидo[4,5-d]пиримидин-2(1 Н)-она, 527 мг (4,28 ммоль) п-анизидина и 1,5 мл диметилсульфоксида нагревают до 130 С в течение 30 ч, затем охлаждают и разбавляют этилацетатом. Смесь отмывают три раза водным раствором хлорида натрия, высушивают над сульфатом магния и концентрируют. Остаточные твердые продукты отмывают смесью хлороформ/этилацетат/ этанол/триэтиламин в соотношении 9:1:0,1:0,1,затем хлороформом и суспендируют в 150 мл смеси хлороформ/метанол в соотношении 7:3. Суспензию разбавляют 20 мл гексана, перемешивают в течение 3 ч и фильтруют, получая 88 мг (24%) поименованного соединения в виде не совсем белого порошка с т. пл. 247-249 (dec). Содержание элементов, рассчитанное для(3,21 ммоль) сульфокамфорной кислоты и 2 мл п-диоксана нагревают до 130 С в течение 1 ч в герметизированной пробирке. Смесь охлаждают и разбавляют хлороформом. Раствор отмывают дважды насыщенным водным раствором бикарбоната натрия и по одному разу водным раствором хлорида натрия и затем рассолом. Органическую фазу высушивают над сульфатом магния и концентрируют до появления темнозеленого остатка, который растворяют в хлороформе и хроматографируют на силикагеле,элюируя смесью этилацетат/этанол/триэтиламин в соотношении 9:1:0,5. Фракции продукта объединяют и концентрируют до получения остатка,который растворяют в хлороформе. Раствор разбавляют этилацетатом, в то время как большая часть хлороформа выкипает. При охлаждении образуются кристаллы, которые затем собирают, получая 101 мг (24%) поименованного соединения с т. пл. 254-277 С (dec). Содержание элементов, рассчитанное для[4,5-d]пиримидин-2(1 Н)-она и 2,7 г (14,3 ммоль) 1-(4-аминофенил)-4-метилпиперазина в 32 мл ацетонитрила добавляют 2,75 мл (35,7 ммоль) трифторуксусной кислоты. Смесь нагревают при 85 С в течение ночи. Охлажденную реакционную смесь разбавляют этилацетатом и отмывают два раза насыщенным водным раствором бикарбоната натрия и один раз рассолом. Объединенную водную фазу обратно экстрагируют дихлорметаном. Объединенную органическую фазу высушивают над сульфатом магния и концентрируют. Темный твердый остаток перемешивают в течение 2 ч в 30 мл смеси дихлорметан/этилацетат, фильтруют, отмывают этилацетатом и высушивают, получая 2,3 г (80%) поименованного соединения с т. пл. 236-239 С 37 Основной способ приготовления других 1 циклопентил-7-(замещенный фениламин)3,4-дигидропиримидо[4,5-d]пиримидин 2(1 Н)-онов К раствору 200 мг (0,71 ммоль) 1 циклопентил-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она и двух эквивалентов замещенного анилина в 3,2 мл ацетонитрила добавляют трифторуксусную кислоту. Смесь нагревают при 85 С в течение ночи,охлаждают до комнатной температуры, разбавляют этилацетатом и отмывают два раза насыщенным водным раствором бикарбоната натрия и один раз рассолом. Органическую фазу высушивают над сульфатом магния и концентрируют до получения остатка, который обрабатывают как описано выше, получая соединение формулы I. Следующие специфические заявленные соединения получают в соответствии с вышеуказанным основным процессом. Пример 12. 1-Циклопентил-7-[4-(пиразол 1-ил)фениламино]-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-он. Получают из 222 мг (1,43 ммоль) 1-(4 аминофенил)-4-(пиразол-1-ил)пиперидина и 165 мкл (2,1 ммоль) трифторуксусной кислоты. После нагревания образуется тяжелый осадок. Охлажденную реакционную смесь разбавляют 4 мл этилацетата и фильтруют. Твердый остаток отмывают этилацетатом и высушивают, получая 275 мг (79%) трифторуксуснокислой соли поименованного соединения с т. пл. 256-258 С(2,1 ммоль) трифторуксусной кислоты. Неочищенный остаток ресуспендируют в смеси этилацетат/дихлорметан и перемешивают в течение нескольких часов. Твердый остаток собирают,отмывают этилацетатом и высушивают, получая 210 мг (67%) трифторуксуснокислой соли поименованного соединения с т. пл. 175-177 С. Содержание элементов, рассчитанное для С 22 Н 34N6O2: С - 65,73; Н - 7,81; N - 19,16. Найдено: С - 65,42; Н - 7,73; N - 19,17. Пример 14. 1-Циклопентил-7-[4-(пиррол-1 ил)фениламино]-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-он. Получают из 226 мг (1,43 ммоль) 1-(4 аминофенил)пиррола и 165 мкл (2,1 ммоль) трифторуксусной кислоты. Неочищенный остаток ресуспендируют в смеси этилацетат/дихлорметан/ацетонитрил и перемешивают(4,3 ммоль) трифторуксусной кислоты. Неочищенный остаток суспендируют в смеси этилацетат/дихлорметан/ацетонитрил и перемешивают несколько часов. Твердый остаток собирают,отмывают этилацетатом и высушивают, получая 140 мг (47%) поименованного соединения с т. пл. 200 С (dec). Содержание элементов, рассчитанное для С 33 Н 28N6 О 20,5 Н 2O: С - 63,29; Н - 7,00; N - 22,13. Найдено: С - 63,27; Н - 6,65; N - 19,99. Пример 16. 1-Циклопентил-7-[4-(3-гидроксипиперидин-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. Получают из 274 мг (1,43 ммоль) 1-(4 аминофенил)-3-гидроксипиперидина и 330 мкл(4,3 ммоль) трифторуксусной кислоты. Неочищенный остаток ресуспендируют в смеси этилацетат/дихлорметан и перемешивают в течение нескольких часов. Твердый остаток собирают,отмывают этилацетатом и высушивают, получая 135 мг (42%) поименованного соединения с т.пл. 200 С (dec). Содержание элементов, рассчитанное дляC22H28N7O20,15 СН 2 Сl2: С - 63,16; Н - 6,77; N - 19,95. Найдено: С - 63,18; Н - 6,66; N - 19,97. Пример 17. 1-Циклопентил-7-4-[4-(диметиламино)пиперидин-1-ил]фениламино-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. Получают из 313 мг (1,43 ммоль) 1-(4 аминофенил)-4-(диметиламино)пиперидина и 275 мкл (3,75 ммоль) трифторуксусной кислоты. Неочищенный остаток суспендируют в смеси этилацетат/дихлорметан и перемешивают в течение нескольких часов. Твердый остаток собирают, отмывают этилацетатом и высушивают,получая 80 мг (24%) поименованного соединения с т. пл. 200 С (dec). Содержание элементов, рассчитанное для С 24H33N7O20,23 СН 2 Сl2: С - 63,95; Н - 7,41; N - 21,54. Найдено: С - 63,99; Н - 7,38; N - 21,28. Пример 18. 1-Циклопентил-7-[4-(3,5-диметилпиперазин-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он.(2,1 ммоль) трифторуксусной кислоты. Неочищенный остаток очищают хроматографией на колонке Biotage размером 1,27 см с силикагелем, т.е. элюируют смесью ацетонитрил/этилацетат/метанол/триэтиламин в соотношении 50:40:5:5. Фракции продукта объединяют и концентрируют для получения остатка, который кристаллизируют из смеси дихлорметан/этилацетат, получая 16 мг (5%) поименованного соединения с т.пл. 200 С(dec). Содержание элементов, рассчитанное для С 23 Н 31 Н 7O0,15 СН 2 Сl20,01 С 4 Н 8 О 2: С - 64,01; Н - 7,27; N - 22,53. Найдено: С - 63,98; Н - 7,06; N - 22,60. Пример 19. 1-Циклопентил-7-[4-(2-гидроксиметилпиперидин-1-ил)фениламино]-3,4 дигидропиримидо[4,5-d]пиримидим-2(1 Н)-он. Получают из 294 мг (1,43 ммоль) 1-(4 аминофенил)-2-гидроксиметилпиперидина и 330 мкл (4,3 ммоль) трифторуксусной кислоты. Неочищенный остаток очищают хроматографией на колонке Biotage размером 1,27 см с силикагелем, т.е. элюируют смесью этилацетат/ дихлорметан в соотношении 3:2. Фракции продукта объединяют и концентрируют, получая 130 мг (43%) поименованного соединения с т.пл. 220-221 С. Содержание элементов, рассчитанное дляC23H30N6O2: С - 65,38; Н - 7,16; N - 19,89. Найдено: С - 65,13; Н - 7,15; N - 19,87. Пример 20. 1-Циклопентил-7-4-[4-(3 гидроксипропил)пиперидин-1-ил]фениламино 3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)он. Получают из 335 мг (1,43 ммоль) 1-(4 аминофенил)-4-(3-гидроксипропил)пиперидина и 330 мкл (4,3 ммоль) трифторуксусной кислоты. Неочищенный остаток ресуспендируют в смеси этилацетат/дихлорметан и перемешивают в течение нескольких часов. Твердый осадок собирают и кристаллизуют из смеси этилацетат/дихлорметан. Неочищенный продукт затем очищают растворением в смеси этилацетат/этанол/триэтиламин в соотношении 9:2:1,затем пропускают через колонку с силикагелем,элюируя тем же самым растворителем, получая 31 мг (10%) поименованного соединения с т.пл. 230 С. Содержание элементов, рассчитанное для С 25 Н 34N6O2: С - 65,67; Н - 7,51; N - 18,31. Найдено: С - 65,50; Н - 7,40; N - 18,30. Пример 21. 1-Циклопентил-7-[4-(2-(морфолин-1-ил)этил)пиперидин-1-ил)фениламино]3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)он. Получают из 500 мг (1,43 ммоль) 1-(4 аминофенил)-4-(2-(1-морфолино)этил)пипери 003640 40 дина и 275 мкл (4,3 ммоль) трифторуксусной кислоты. Неочищенный остаток растворяют в 15 мл дихлорметана и раствор концентрируют до 5 мл, разбавляют 15 мл этилацетата для осаждения твердого осадка. Суспензию перемешивают в течение 2 ч, фильтруют и отмывают этилацетатом. Коричневый порошок растворяют в дихлорметане и фильтруют через короткую колонку с силикагелем, элюируя смесью этанол/хлороформ в соотношении 1:9. Фильтрат концентрируют до появления розового порошка, который растворяют в 20 мл дихлорметана с 3 каплями метанола. Раствор разбавляют 30 мл этилацетата, затем при медленном перемешивании концентрируют в атмосфере азота. Осажденный бледный порошок фильтруют и высушивают, получая 54 мг (11%) поименованного соединения с т.пл. 218-220 С. Содержание элементов, рассчитанное для С 22 Н 28N6O20,1 СН 2 Сl20,1 Н 2O: С - 65,41; Н - 7,70; N - 19,00. Найдено: С - 65,70; Н - 7,74; N - 19,37. Основной способ приготовления других 1 изопропил-7-(замещенный фениламин)-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-онов. К раствору 1-изопропил-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин 2(1 Н)-она и двух эквивалентов замещенного анилина в ацетонитриле добавляют трифторуксусную кислоту. Смесь нагревают при 85 С в течение ночи, охлаждают до комнатной температуры, разбавляют этилацетатом или дихлорметаном и отмывают два раза насыщенным водным раствором бикарбоната натрия и один раз рассолом. Органическую фазу высушивают над сульфатом магния и концентрируют до получения остатка, который обрабатывают, как описано в следующих примерах, получая соединение формулы I. Следующие специфические заявленные соединения были получены в соответствии с вышеуказанным основным процессом. Пример 22. 1-Изопропил-7-[4(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. Получают из 400 мг (1,57 ммоль) 1 изопропил-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она, 600 мг (3,14 ммоль) 1-(4-аминофенил)-4-метилпиперазина и 605 мкл (7,85 ммоль) трифторуксусной кислоты в 6,4 мл ацетонитрила. Реакционную смесь нагревают при 85 С в течение 48 ч. После этого неочищенный остаток растирают в смеси этилацетат/дихлорметан и фильтруют. Твердый остаток повторно растворяют в дихлорметане и растворитель испаряют под потоком азота, тогда как этилацетат добавляют до объема 5 мл. Суспензию фильтруют и твердый осадок отмывают смесью этилацетат/дихлорметан и высушивают, получая 470 мг (78%) поименованного вещества с т.пл. 234-237 С (dec).C20H27N7O0,15 С 4 Н 8O20,05 СН 2 Сl2: С - 62,17; Н - 7,15; N - 24,58. Найдено: С - 62,01; Н - 7,06; N - 24,57. Пример 23. 7-[4-(4-Гидроксипиперидин-1 ил)фениламино]-1-изопропил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. Получают из 200 мг (0,79 ммоль) 1 изопропил-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она, 302 мг (1,57 ммоль) 1-(4-аминофенил)-4-гидроксипиперидина и 182 мкл (2,36 ммоль) трифторуксусной кислоты в 3,2 мл ацетонитрила. После этого неочищенный остаток растирают в смеси этилацетат/дихлорметан и фильтруют. Фильтрат концентрируют затем для получения повторного выхода кристаллов. Их объединяют и высушивают, получая 45 мг (13%) поименованного вещества с т.пл. 120 С (dec). Содержание элементов, рассчитанное дляC20H26N6O20,3 С 4H8 О 20,5 Н 2O: С - 60,93; Н - 7,09; N - 20,11. Найдено: С - 60,95; Н - 6,82; N - 20,35. Пример 24. 7-4-[4-(Диметиламино)пиперидин-1-ил]фениламино-1-изопропил-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он; соединение с трифторуксусной кислотой. Получают из 400 мг (1,57 ммоль) 1 изопропил-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она, 690 мг (3,14 ммоль) 1-(4-аминофенил)-4-(диметиламино) пиперидина и 605 мкл (7,86 ммоль) трифторуксусной кислоты в 5 мл ацетонитрила. После нагревания реакционной смеси в течение ночи образуется тяжелый осадок. Охлажденную реакционную смесь разбавляют 6 мл этилацетата и фильтруют. Твердый осадок отмывают дважды этилацетатом, один раз смесью этилацетат/дихлорметан и высушивают, получая 389 мг(38%) трифторуксусной соли поименованного соединения с т.пл. 215-217 С (dec). Содержание элементов, рассчитанное для(2,36 ммоль) трифторуксусной кислоты в 3,2 мл ацетонитрила. После нагревания реакционной смеси в течение ночи образуется тяжелый осадок. Охлажденную реакционную смесь разбавляют этилацетатом и фильтруют. Твердый осадок отмывают этилацетатом и высушивают,получая 315 мг (86%) трифторуксусной солиC18H19N7OC2HF3O20,1 С 4 Н 8O2: С - 51,84; Н - 4,35; N - 21,16. Найдено: С - 51,94; Н - 4,37; N - 21,02. Пример 26. 1-Изопропил-7-4-[4-(3-(морфолин-1-ил)пропил)пиперидин-1-ил]фениламино-3,4-дигидропиримидо[4,5-d]пиримидин 2(1 Н)-он. Получают из 200 мг (0,79 ммоль) 1 изопропил-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она, 477 мг (1,57 ммоль) 1-(4-аминофенил)-4-(3-(1-морфолино) пропилпиперидина и 303 мкл (3,93 ммоль) трифторуксусной кислоты в 3,2 мл ацетонитрила. После этого неочищенный остаток растирают в смеси этилацетат/дихлорметан и фильтруют. Твердый осадок отмывают этилацетатом и высушивают, получая 140 мг (33%) поименованного соединения с т.пл. 203-205 С (dec). Содержание элементов, рассчитанное для С 27 Н 39N7O20,1C4H8O20,25H2O: С - 64,92; Н - 8,01; N - 19,34. Найдено: С - 65,14; Н - 7,96; N - 19,27. Пример 27. 1-Бицикло[2.2.1]гепт-2-ил-7-[4(4-метилпиперазин-1-ил)фениламино]-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)он(экзо). К суспензии 300 мг (0,98 ммоль) 1 бицикло[2.2.1]гепт-2-ил-7-метансульфинил-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она и 374 мг (1,96 ммоль) 1-(4-аминофенил)-4 метилпиперазина в 4,0 мл ацетонитрила добавляют 377 мкл (4,90 ммоль) трифторуксусной кислоты. Смесь нагревают при 85 С в течение ночи. Охлажденную реакционную смесь разбавляют этилацетатом и отмывают два раза насыщенным водным раствором бикарбоната натрия и один раз рассолом. Органическую фазу высушивают над сульфатом магния и концентрируют. Темный твердый остаток растирают в 4 мл в смеси дихлорметан/этилацетат в соотношении 1:1, фильтруют, отмывают этилацетатом и высушивают, получая 266 мг (63%) поименованного соединения с т.пл. 251-254 С (dec). Содержание элементов, рассчитанное для[4,5-d]пиримидин-2(1 Н)-она и 507 мг (2,65 ммоль) 1-(4-аминофенил)-4-метилпиперазина в 5,0 мл ацетонитрила добавляют 510 мкл (6,6 ммоль) трифторуксусной кислоты. После нагревания реакционной смеси при 85 С в течение 43 ночи образуется тяжелый осадок. Охлажденную реакционную смесь разбавляют 2 мл этилацетата и фильтруют. Твердый осадок отмывают три раза смесью этилацетат/ацетонитрил и высушивают, получая 560 мг (84%) трифторуксуснокислой соли поименованного соединения с т.пл. 234-235 С (dec). Содержание элементов, рассчитанное для С 18 Н 23N7O2,0C2HF3O2: С - 45,44; Н - 4,33; N - 16,77. Найдено: С - 45,49; Н - 4,35; N - 16,77. Пример 29. 7-[4-(4-Гидроксипиперидин-1 ил)фениламино]-1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она и 680 мг (3,53 ммоль) 1-(4-аминофенил)-4-гидроксипиперидина в 6 мл ацетонитрила добавляют 408 мкл (5,3 ммоль) трифторуксусной кислоты. После нагревания реакционной смеси при 85 С в течение ночи образуется тяжелый осадок. Охлажденную реакционную смесь разбавляют 2 мл этилацетата и фильтруют. Твердый осадок отмывают этилацетатом и рекристаллизуют из ацетонитрила, получая 565 мг (51%) трифторуксуснокислой соли поименованного соединения с т.пл. 228-229 С (dec). Содержание элементов, рассчитанное для[4,5-d]пиримидин-2(1 Н)-она и 775 мг (3,53 ммоль) 1-(4-аминофенил)-4-(диметиламино) пиперидина в 6 мл ацетонитрила добавляют 680 мкл (8,8 ммоль) трифторуксусной кислоты. После нагревания реакционной смеси при 85 С в течение ночи образуется тяжелый осадок. Охлажденную реакционную смесь разбавляют 6 мл этилацетата и фильтруют. Твердый осадок отмывают этилацетатом и рекристаллизуют из ацетонитрила, затем из смеси ацетонитрил/дихлорметан/трифторуксусная кислота, получая 202 мг (17%) трифторуксуснокислой соли поименованного соединения с т.пл. 190-191 С[4,5-d]пиримидин-2(1 Н)-она и 281 мг (1,77 ммоль) 1-(4-аминофенил)пиразола в 3,2 мл ацетонитрила добавляют 204 мкл (2,65 ммоль) трифторуксусной кислоты. После нагревания реакционной смеси при 85 С в течение ночи образуется тяжелый осадок. Охлажденную реакционную смесь разбавляют 2 мл этилацетата и фильтруют. Твердый осадок отмывают этилацетатом, получая 356 мг (93%) трифторуксуснокислой соли поименованного соединения с т.пл. 250-251 С (dec). Содержание элементов, рассчитанное дляC16H15N7OC2HF3O2: С - 49,66; Н - 3,70; N - 22,52. Найдено: С - 49,70; Н - 3,60; N - 22,18. Основная процедура окисления 1 алкил-7-[(замещенный)фениламино]-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)онов до 1-алкил-7-[(замещенный)фениламино]пиримидо[4,5-d]пиримидин-2 (1 Н)онов К раствору 1-алкил-7-[(замещенный) фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она в ТГФ или ДМСО при комнатной температуре добавляют четыре эквивалента трет-бутоксида калия. Устанавливают атмосферу кислорода, в которой раствор перемешивают в течение ночи. Смесь разбавляют в этилацетате и отмывают последовательно насыщенным водным раствором бикарбоната натрия, водой и рассолом. Органическую фазу высушивают над сульфатом магния и концентрируют, получая остаток, который растирают в соответствующем растворителе, затем осажденный продукт собирают. Дальнейшая очистка может быть проведена с помощью стандартных процедур для получения соединения формулы I. Пример 32. 1-Циклопентил-7-[4-(4-метилпиперазин-1-ил)фениламино]пиримидо[4,5-d] пиримидин-2 (1 Н)-он. Получают из 150 мг (0,37 ммоль) 1 циклопентил-7-[4-(4-метилпиперазин-1-ил) фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она и 165 мг (1,47 ммоль) третбутоксида калия в 6 мл ТГФ. Темно-оранжевый полутвердый осадок растирают в диэтиловом эфире, собирают желтый порошок и высушивают, получая 100 мг (67%) поименованного соединения с т.пл. 220-225 С (dec). Содержание элементов, рассчитанное дляC22H27N7O: С - 65,16; Н - 6,71; N - 24,18. Найдено: С - 65,22; Н - 6,55; N - 23,78. Пример 33. 1-Циклопентил-7-[4-(4-гидроксипиперидин-1-ил)фениламино]пиримидо[4,5-d] пиримидин-2(1 Н)-он. Получают из 60 мг (0,15 ммоль) 1 циклопентил-7-[4-(4-гидроксипиперидин-1-ил) фениламино]-3,4-дигидропиримидо[4,5-d]пири 45 мидин-2(1H)-она и 66 мг (0,58 ммоль) третбутоксида калия в 1,5 мл ДМСО. Неочищенный полутвердый остаток растирают в 15 мл смеси диэтиловый эфир/гексан в соотношении 2:1 и собирают аморфный оранжевый осадок и высушивают, получая 20 мг (30%) поименованного соединения с т.пл. 185 С (dec).[4,5-d]пиримидин-2 (1 Н)-он. Получают из 70 мг (0,16 ммоль) 1 циклопентил-7-3-метил-4-[2-(диэтиламино) этокси]фениламино-3,4-дигидропиримидо[4,5d]пиримидин-2(1 Н)-она и 72 мг (0,58 ммоль) трет-бутоксида калия в 3,0 мл ДМСО. Неочищенный полутвердый остаток растворяют в смеси трет-бутилметилового эфира и гексана. Раствору позволяют медленно испаряться до объема не более 1 мл, затем разбавляют 2 мл смеси диэтиловый эфир/гексан в соотношении 1:3. Твердый осадок собирают и высушивают,получая 17 мг (24%) поименованного соединения с т.пл. 95 С (dec).MS (CI) (m+1)/z 437 и 232. Пример 35. 1-Циклопентил-7-[4-(3-гидроксипиперидин-1-ил)фениламино]пиримидо[4,5-d] пиримидин-2(1 Н)-он. Получают из 75 мг (0,18 ммоль) 1 циклопентил-7-[4-(3-гидроксипиперидин-1-ил) фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она и 82 мг (0,73 ммоль) третбутоксида калия в 4,0 мл ТГФ. Полутвердый остаток растирают в диэтиловом эфире, собирают оранжевый аморфный осадок и высушивают, получая 35 мг (45%) поименованного соединения с т.пл. 135 С (dec). Содержание элементов, рассчитанное для[4,5-d]пиримидин-2(1 Н)-она и 115 мг (1,02 ммоль) трет-бутоксида калия в 5,0 мл ТГФ. Полутвердый остаток растирают в диэтиловом эфире, собирают оранжевый аморфный осадок и высушивают, получая 31 мг (40%) поименованного соединения с т.пл. 135 С (dec). Содержание элементов, рассчитанное для[4,5-d]пиримидин-2(1 Н)-она и 33 мг (0,29 ммоль) трет-бутоксида калия в 2,0 мл ТГФ. Полутвердый остаток растирают в диэтиловом эфире, собирают оранжевый аморфный осадок и высушивают, получая 11,8 мг (32%) поименованного соединения с т.пл. 140 С (dec).MS(CI) (m+1)/z 504. Пример 40. 1-Изопропил-7-[4-(4-метилпиперазин-1-ил)фениламино]пиримидо[4,5-d] пиримидин-2(1 Н)-он. Получают из 200 мг (0,52 ммоль) 1 изопропил-7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она и 235 мг (2,10 ммоль) третбутоксида калия в 10 мл тетрагидрофурана. Полутвердый остаток растирают в 14 мл смеси диэтиловый эфир/гексан в соотношении 1:1,порошок собирают и высушивают, получая 135 мг (68%) поименованного соединения с т.пл. 228-229 С (dec). Содержание элементов, рассчитанное дляC20H25N7O0,03 С 6 Н 140,5 Н 2O: С - 61,98; Н - 6,81; N - 25,07. Найдено: С - 61,95; Н - 6,73; N - 25,04. Пример 41. 7-4-[4-(Диметиламино)пиперидин-1-ил]фениламино-1-изопропилпиримидо[4,5-d]пиримидин-2(1 Н)-он. Получают из 200 мг (0,31 ммоль) 7-4-[4(диметиламино)пиперидин-1-ил]фениламино 1-изопропил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она, трифторуксусной кислоты и 211 мг (1,88 ммоль) трет-бутоксида калия в 7 мл тетрагидрофурана. Реакционную смесь перемешивают в течение 48 ч и обрабатывают как описано в основной процедуре, затем реакцию повторяют в течение 72 ч. После завершения реакции полутвердый остаток растирают в диэтиловом эфире и порошок собирают и высушивают,получая 24 мг (18%) поименованного соединения с т.пл. 100 С (dec). 47 Содержание элементов, рассчитанное для С 22 Н 29N7OН 2O0,1 СН 2 Сl2: С - 61,16; Н - 7,25; N - 22,59. Найдено: С - 61,11; Н - 6,98; N - 22,49. Пример 42. 1-Изопропил-7-[4-(пиразол-1 ил)фениламино]пиримидо[4,5-d]пиримидин 2(1 Н)-он. Получают из 150 мг (0,32 ммоль) 1 изопропил-7-[4-(пиразол-1-ил)фениламино]-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она,трифторуксусной кислоты и 218 мг (1,94 ммоль) трет-бутоксида калия в 10 мл тетрагидрофурана. Реакционную смесь растирают в течение 48 ч,добавляют 50 мг (0,44 ммоль) трет-бутоксида калия и реакцию продолжают в течение 72 ч. После завершения реакции полутвердый осадок растирают в диэтиловом эфире, порошок собирают и высушивают, получая 86 мг (73%) поименованного соединения с т.пл. 243-247 СC18H17N7O0,75 Н 2 О 0,15 С 4 Н 10 О: С - 60,05; Н - 5,42; N - 26,36. Найдено: С - 60,19; Н - 5,36; N - 26,09. Пример 43. 1-Изопропил-7-4-[4-(3-(морфолин-4-ил)пропил)пиперидин-1-ил]фениламинопиримидо[4,5-d]пиримидин-2(1 Н)-он. Получают из 100 мг (0,20 ммоль) 1 изопропил-7-4-[4-(3-(морфолин-4-ил)пропил) пиперидин-1-ил]фениламино-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она и 88,5 мг (0,79 ммоль) трет-бутоксида калия в 10 мл тетрагидрофурана. Реакционную смесь растирают в течение ночи, добавляют 88,5 мг (0,79 ммоль) трет-бутоксида калия и реакцию продолжают в течение 48 ч. После завершения реакции полутвердый осадок ресуспендируют пять раз в диэтиловом эфире, порошок собирают и высушивают на роторном испарителе, получая 87 мг[4,5-d]пиримидин-2(1 Н)-он,экзо и 207 мг (1,84 ммоль) трет-бутоксида калия в 10 мл тетрагидрофурана. Реакционную смесь растирают в течение 48 ч. После завершения реакции полутвердый осадок растирают в смеси диэтиловый эфир/гексан, порошок собирают и высушивают,получая 140 мг (70%) поименованного соединения с т.пл. 210 С (dec). Содержание элементов, рассчитанное для С 24 Н 29N7O0,5 Н 2 О: 48 С - 65,43; Н - 6,86; N - 22,26. Найдено: С - 65,29; Н - 6,74; N - 21,90. Пример 45. 1-Метил-7-[4-(4-метилпиперазин-1-ил)фениламино]пиримидо[4,5-d]пиримидин-2(1 Н)-он. Получают из 250 мг (0,50 ммоль) 1-метил 7-[4-(4-метилпиперазин-1-ил)фениламино]-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она,трифторуксусной кислоты и 336 мг (2,99 ммоль) трет-бутоксида калия в 12 мл тетрагидрофурана. Реакционную смесь перемешивают в течение 48 ч. После завершения реакции полутвердый осадок растирают в диэтиловом эфире, порошок собирают и высушивают, получая 110 мг (61%) поименованного соединения с т.пл. 259-260 С[4,5-d]пиримидин-2(1 Н)-он. Получают из 170 мг (0,26 ммоль) 7-4-[4(диметиламино)пиперидин-1-ил]фениламино 1-метил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она, трифторуксусной кислоты и 233 мг (2,07 ммоль) трет-бутоксида калия в 20 мл тетрагидрофурана. Реакционную смесь перемешивают в течение 6 дней и завершают реакцию,как описано в основной процедуре, включая обратную экстракцию объединенной водной фазы хлороформом. Объединенную органическую фазу высушивают над сульфатом магния,фильтруют и концентрируют. Полутвердый осадок растирают в смеси диэтиловый эфир/гексан, порошок собирают и высушивают,получая 64 мг (60%) поименованного соединения с т.пл. 198-202 С (dec). Содержание элементов, рассчитанное дляC20H25N7O1,7H2O: С - 58,58; Н - 6,98; N - 23,91. Найдено: С - 58,73; Н - 6,71; N - 23,92. Пример 47. 1-Метил-7-[4-(пиразол-1-ил) фениламино]пиримидо[4,5-d]пиримидин-2(1 Н)он. Получают из 200 мг (0,46 ммоль) 1-метил 7-[4-(пиразол-1-ил)фениламино]-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она, трифторуксусной кислоты и 309 мг (2,76 ммоль) третбутоксида калия в 15 мл тетрагидрофурана. Реакционную смесь перемешивают в течение ночи. После завершения реакции полутвердый осадок растирают в диэтиловом эфире, порошок собирают и высушивают, получая 102 мг (65%) поименованного соединения с т.пл. 290 С 49 Примеры 48-65 являются специфическим воплощением схем основных реакций, показанных на схеме 2. Пример 48. 5-[(3,5-Диметоксифенилимино)метил]-2-метилсульфанилпиримидин-4-иламин. К суспензии 4,36 г (23,7 ммоль) 4-амино-2 метилсульфанилпиримидин-5-карбальдегида(полученного как описано в WO 98/33798) и 3,65 г (23,7 ммоль) 3,5-диметоксианилина в 165 мл воды добавляют 4,5 мл ледяной уксусной кислоты. Реакцию перемешивают при 25 С в течение ночи и фильтруют. Фильтр промывают водой и фильтрат высушивают под вакуумом,получая 7,02 г (96%) поименованного соединения, которое используют в следующей стадии.MS(APCI) (m+1)/z 305,l. Пример 48 а. 5-[(3,5-Диметоксифенилимино)метил]-2-метилсульфанилпиримидин-4-ил этиламин. К перемешиваемой суспензии 4-этиламино-2-метилсульфанилпиримидин-5-карбальдегида (5,0 г, 25,09 ммоль, полученного способом, описанным в J. Med. Chem., 1998; 41(17):3276-3292) и 3,5-диметоксианилина (3,84 г, 25,09 ммоль) в воде (190 мл) добавляют ледяную уксусную кислоту (5 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 24 ч и суспензию фильтруют. Нерастворимый продукт высушивают и фильтруют, получая 7,79 г (92%) поименованного соединения с т.пл. 100-105 С. Масс-спектр (APCI, 80/20 CH3CN/H2O,проба=450 С) (m+1)/z 333,1. Содержание элементов, рассчитанное дляC16H20N4O2S1: С - 57,81; Н - 6,06; N - 16,85. Найдено: С - 57,63; Н - 6,06; N - 16,86. Пример 49. 5-[(3,5-Диметоксифениламино)-метил]-2-метилсульфанилпиримидин-4-иламин. К 18,2 мл (18,2 ммоль) 1 М раствора литий алюминий гидрида (ЛАГ) в тетрагидрофуране(ТГФ), охлажденного до 5 С, добавляют раствор 5,55 г (18,3 ммоль) 5-[(3,5-диметоксифенилимино)метил]-2-метилсульфанилпиримидин-4-иламина в 94 мл сухого ТГФ в течение 20 мин. Реакцию перемешивают в течение 1,5 ч при 5 С, затем реакцию останавливают медленным последовательным добавлением 0,72 мл воды, 3,0 мл 25% NaOH и дополнительно 1,66 мл воды. Реакционную смесь фильтруют через целит и фильтр хорошо отмывают ТГФ. Фильтрат концентрируют до сухого остатка под вакуумом. Остаток растворяют в этилацетате. Этилацетатный раствор отмывают три раза насыщенным раствором хлорида натрия. Высушивают над сульфатом магния и концентрируют под вакуумом, получая 5,10 г (91%) поименованного соединения. Содержание элементов, рассчитанное для(100 мл) при 5 С добавляют по каплям 17,78 мл 1 М раствора ЛАГ в ТГФ течение 20 мин. Реакционную смесь перемешивают в течение 1 ч при 5 С и затем реакцию останавливают следующим образом, добавляя по каплям 0,8 мл воды, 3,2 мл 25% NaOH и 1,8 мл воды. Реакционную смесь распределяют между полунасыщенным рассолом и EtOAc. Органическую фазу отделяют,отмывают водой, высушивают над сульфатом магния, фильтруют и выпаривают. Остаток очищают колоночной хроматографией, элюируя градиентом метанола в дихлорметане от 1 до 3%, получая 5,4 г (91%) поименованного соединения. Масс-спектр (APCI, 80/20 CH3CN/H2O,проба=450 С) (m+1)/z 335,2. Содержание элементов, рассчитанное для(40,8 ммоль) гидрида натрия в виде 60% суспензии минерального масла. Ледяную баню удаляют и реакционную смесь перемешивают в течение 1 ч. К реакции затем добавляют 7,94 г (48,9 ммоль) 1,1'-карбонилдиимидазола. После перемешивания в течение следующих 2,5 ч смесь концентрируют под вакуумом. Остаток распределяют между дихлорметаном и насыщенным раствором хлорида аммония. Слой дихлорметана отмывают насыщенным хлоридом аммония,водой и насыщенным раствором хлорида натрия, дважды каждым. Дихлорметановый раствор высушивают над сульфатом магния и концентрируют под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью хлороформ/метанол (10:0,25 об./об.), получая 3,24 г[4,5-d]пиримидин-2(1 Н)-он. К раствору 5-[4-(3,5-диметоксифениламино)метил]-2-метилсульфанилпиримидин-4 илэтиламина (6,42 г, 19,2 ммоль) и диизопропилэтиламина (4,96 г, 38,39 ммоль) в дихлорметане (120 мл) при 5 С добавляют по каплям 10 51 мл 20% раствора фосгена в толуоле в течение 20 мин. Реакционную смесь оставляют нагреваться до температуры окружающей среды и перемешивают 4 ч. Смесь отмывают полунасыщеннымNaHCO3 и водой, затем высушивают над сульфатом магния и фильтруют. Фильтрат выпаривают под пониженным давлением и остаток очищают колоночной хроматографией, элюируя градиентом метанола в дихлорметане от 1 до 3%, получая 5,96 г (86%) поименованного соединения с т.пл. 134-136 С Масс-спектр (APCI, 80/20 CH3CN/H2O,проба=450 С) (m+1)/z 361,2. Содержание элементов, рассчитанное для С 17 Н 20N4O3S: С - 56,65; Н - 5,59; N - 15,54. Найдено: С - 56,49; Н - 5,54; N - 15,33. Пример 51. 3-(3,5-Диметоксифенил)-7 метансульфинил-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-он. К раствору 2,0 г (6,02 ммоль) 3-(3,5 диметоксифенил)-7-метилсульфанил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она в 450 мл хлороформа добавляют 1,73 г (6,62 ммоль) транс-2-(фенилсульфонил)-3-фенилоксазиридина. Реакцию перемешивают при комнатной температуре в течение ночи, затем концентрируют под вакуумом. Остаток хроматографируют на силикагеле, элюируя сначала хлороформом,затем раствором хлороформ/метанол (10/0,25 об./об.) и, наконец, раствором хлороформ/метанол (9:1 об./об.), получая 1,87 г (85%) поименованного соединения с т.пл. 220-222 С. Содержание элементов, рассчитанное для[4,5-d]пиримидин-2(1 Н)-он. К раствору 3-(3,5-диметоксифенил)-1-этил 7-метилсульфанил-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-она (5,61 г, 15,57 ммоль) в дихлорметане (100 мл) при температуре окружающей среды добавляют 3-фенил-2(фенилсульфонил)оксазиридина (4,88 г, 18,69 ммоль, PD 0191006, Org.Synth., 1987; 66: 203210) порциями. Реакционную смесь перемешивают в течение ночи, затем отмывают рассолом и водой. Органическую фазу высушивают над сульфатом магния, фильтруют и выпаривают под пониженным давлением. Остаток очищают колоночной хроматографией, элюируя смесью 3% метанола в дихлорметане, получая 4,6 г 52 С - 54,24; Н - 5,36; N - 14,88. Найдено: С - 53,95; Н - 5,27; N - 14,51. Пример 52. 7-(4-Диэтиламинобутиламино)-3-(3,5-диметоксифенил)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. Суспензию 0,2261 г (0,65 ммоль) 3-(3,5 диметоксифенил)-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она и 0,103 г (0,71 ммоль) диэтиламинобутиламина в 10 мл сухого диоксана нагревают до 60 С и перемешивают в течение ночи. К реакционной смеси добавляют 0,306 г (2,13 ммоль) диэтиламинобутиламина и 0,1658 г (0,71 ммоль) сульфокамфорной кислоты. Реакционную смесь перемешивают в течение следующих 18 ч при 60 С. Реакционный раствор концентрируют под вакуумом и остаток распределяют между этилацетатом и насыщенным раствором бикарбоната натрия. Этилацетатный слой отмывают насыщенным раствором бикарбоната натрия, затем водой, высушивают над сульфатом магния и концентрируют под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/этанол/триэтиламин (9:2:1 об./об./ об.), получая 0,173 г (62%) поименованного соединения с т.пл. 203-207 С. Содержание элементов, рассчитанное дляC22H32N6O3: С - 61,66; Н - 7,53; N - 19,61. Найдено: С - 61,31; Н - 7,32; N - 19,23. Пример 53. 7-(4-Диэтиламинобутиламино)-3-(3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. Смесь 3-(3,5-диметоксифенил)-1-этил-7 метансульфинил-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-она (0,5 г, 1,33 ммоль), 4 диэтиламинобутиламина (0,38 г, 2,66 ммоль) и трифторуксусной кислоты (0,31 г, 2,66 ммоль) в ацетонитриле (6 мл) нагревают в герметизированной пробирке при 90 С в течение 18 ч. Растворитель удаляют под пониженным давлением и остаток переносят в 1N HCl. Раствор подщелачивают 50% NaOH и экстрагируют дважды дихлорметаном. Объединенные органические слои высушивают над сульфатом магния,фильтруют и выпаривают. Остаток очищают радиальной хроматографией, элюируя смесью растворителей этилацетат/метанол/этил (89:10:1 об./об./об.), получая 0,34 г (56%) поименованного соединения с т.пл. 83-85 С. Масс-спектр (APCI, 80/20 CH3CN/H2O,Проба=450 С) (m+1)/z 458,2. Содержание элементов, рассчитанное для С 24 Н 36N6O3: С - 63,13; Н - 7,95; N - 8,41. Найдено: С - 62,85; Н - 7,84; N - 18,06. Пример 53 а. 7-[4-(2-Диэтиламиноэтокси) фениламино]-3-(3,5-диметоксифенил)-1-этил 3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)он. Смесь 3-(3,5-диметоксифенил)-1-этил-7 метансульфинил-3,4-дигидропиримидо[4,5-d] 53 пиримидин-2(1 Н)-она (0,5 г, 1,33 ммоль), 4-(2 диэтиламиноэтокси)анилина (0,55 г, 2,66 ммоль,Helv. Chim. Acta, 1960; 43:1971-1979) и трифторуксусной кислоты (0,46 г, 3,98 ммоль) в ацетонитриле (6 мл) нагревают в герметизированной пробирке при 100 С в течение 18 ч. Растворитель удаляют под пониженным давлением и остаток растворяют в воде. Раствор подщелачивают 1N NaOH и экстрагируют дважды EtOAc. Объединенные органические слои высушивают над сульфатом магния, фильтруют и выпаривают. Остаток ресуспендируют в эфире (20 мл),триэтиламине (0,27 г, 2,66 ммоль) и добавляют ВОС 2O (0,32 г, 1,46 ммоль), и смесь перемешивают при температуре окружающей среды в течение 4 ч. Реакционную смесь разбавляют гексаном и охлаждают до 0 С. Нерастворимый продукт собирают фильтрацией и отмывают гексаном, получая 0,56 г (81%) поименованного соединения с т.пл. 139-141 С. Масс-спектр (APCI, 80/20 CH3CN/H2O,проба=450 С) (m+1)/z 521,3. Содержание элементов, рассчитанное дляC28H36N6O40,19CF3CO2H: С - 62,86; Н - 6,73; N - 15,50. Найдено: С - 62,85; Н - 6,65; N - 15,56. Экспериментальная основа параллельного синтеза 3-арил-7-(замещенный алкиламин)-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-онов и 3-арил-1-алкил-7-(замещенный алкиламин)3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)онов В Argonaut Technologies' Quest 210 10 мл реактор добавляют 0,100 г (0,287 ммоль) 3-(3,5 диметоксифенил)-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-она в 5 мл сухого диоксана или 0,100 г (0,266 ммоль) 3(3,5-диметоксифенил)-1-этил-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин 2(1 Н)-она в 4 мл сухого диоксана и 0,0753 г(0,3157 ммоль) сульфокамфорной кислоты в 2 мл сухого диоксана. К реакционной смеси добавляют раствор 2,7-3,3 экв. амина (R1NH2) в 1 мл диоксана. Реакционную смесь встряхивают при 65 С в течение 18 ч, затем охлаждают до комнатной температуры. Диоксан выпаривают под потоком азота и остаток распределяют между этилацетатом и насыщенным раствором бикарбоната натрия. Этилацетатный слой отмывают дважды разбавленным раствором бикарбоната натрия, затем один раз водой. Этилацетатный слой высушивают с помощью сульфата магния и концентрируют до сухого остатка, используя поток азота. Остаток хроматографируют на силикагеле, получая поименованное соединение. Пример 54. 3-(3,5-Диметоксифенил)-7-2[(пиридин-4-илметил)амино]этиламино-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. Используя основную процедуру, описанную выше, проводят реакцию между 3-(3,5 диметоксифенил)-7-метансульфинил-3,4-дигид 003640MS(APCI) (m+1)/z 436,2. Пример 54 а. 3-(3,5-Диметоксифенил)-7-[3(4-метилпиперазин-1-ил)пропиламино]-3,4 дигидро-1 Н-пиримидо[4,5-d]пиримидин-2(1 Н)он. Используя основную процедуру, описанную выше, проводят реакцию между 3-(3,5 диметоксифенил)-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-оном и 0,1234 г (0,785 ммоль) 3-(4-метилпиперазин-1 ил)пропиламина. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/ этанол/триэтиламин (9:2:1 об./об./об.), затем смесью этилацетат/этанол/триэтиламин (9:3:2 об./об./об.), получая 0,0443 г (35%) поименованного соединения: HPLC=92% чистоты.MS(APCI)(m+1)/z 442,2. Пример 54b. 3-(3,5-Диметоксифенил)-7- [4(4-метилпиперазин-1-ил)бутиламино]-3,4 дигидропиримидо[4 ,5-d]пиримидин-2(1 Н)-он. Используя основную процедуру, описанную выше, проводят реакцию между 3-(3,5 диметоксифенил)-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-оном и 0,1354 г (0,791 ммоль) 4-(4-метилпиперазин-1 ил)бутиламина. Остаток хроматографируют на силикагеле,элюируя смесью этилацетат/этанол/триэтиламин (9:2:1 об./об./об.), затем смесью этилацетат/этанол/триэтиламин (9:3:2 об./об./об.), получая 0,0401 г (31%) поименованного соединения: HPLC=99% чистоты.MS(APCI) (m+1)/z 456,2. Пример 54 с. 3-(3,5-Диметоксифенил)-7-[5(4-метилпиперазин-1-ил)пентиламино]-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. Используя основную процедуру, описанную выше, проводят реакцию между 3-(3,5 диметоксифенил)-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-оном и 0,1457 г (0,805 ммоль) 5-(4-метилпиперазин-1 ил)пентиламина. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/ этанол/триэтиламин (9:2:1 об./об./об.), затем смесью этилацетат/этанол/триэтиламин (9:3:2 об./об./об.), получая 0,0322 г (24%) поименованного соединения: HPLC=97% чистоты.MS(APCI) (m+1)/z 470,2. Пример 55. 7-(3-Диэтиламинопропиламино)3-(3,5-диметоксифенил)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. Используя основную процедуру, описанную выше, проводят реакцию между 3-(3,5 диметоксифенил)-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-оном иMS(APCI) (m+1)/z 415,2. Пример 56. 3-(3,5-Диметоксифенил)-1 этил-7-2-[(пиридин-4-илметил)амино]этиламино-3,4-дигидропиримидо[4,5-d]пиримидин 2(1 Н)-он. Используя основную процедуру, описанную выше, проводят реакцию между 3-(3,5 диметоксифенил)-1-этил-7-метансульфинил-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-оном и 0,1317 г (0,871 ммоль) N-(4-пикол)этилендиамина. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/этанол/ триэтиламин (9:2:1 об./об./об.), получая 0,0307 гMS(APCI) (m+1)/z 464,2. Пример 57. 3-(3,5-Диметоксифенил)-1 этил-7-[3-(4-метилпиперазин-1-ил)пропиламино]-3,4-дигидропиримидо[4,5-d]пиримидин 2(1 Н)-он. Используя основную процедуру, описанную выше, проводят реакцию между 3-(3,5 диметоксифенил)-1-этил-7-метансульфинил-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-оном и 0,1142 г (0,726 ммоль) 3-(4-метилпиперазин-1 ил)пропиламина. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/этанол/ триэтиламин (9:2:1 об./об./об.), получая 0,0712 гMS(APCI) (m+1)/z 470,2. Пример 58. 3-(3,5-Диметоксифенил)-1 этил-7-[4-(4-метилпиперазин-1-ил)бутиламино]-3,4-дигидропиримидо[4,5-d]пиримидин 2(1 Н)-он. Используя основную процедуру, описанную выше, проводят реакцию между 3-(3,5 диметоксифенил)-1-этил-7-метансульфинил-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-оном и 0,1253 г (0,732 ммоль) 4-(4-метилпиперазин-1 ил)-бутиламина. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/этанол/ триэтиламин (9:2:1 об./об./об.), получая 0,0527 гMS(APCI) (m+1)/z 484,3. Пример 59. 3-(3,5-Диметоксифенил)-1 этил-7-[5-(4-метилпиперазин-1-ил)пентиламино]-3,4-дигидропиримидо[4,5-d]пиримидин 2(1 Н)-он. Используя основную процедуру, описанную выше, проводят реакцию между 3-(3,5 диметоксифенил)-1-этил-7-метансульфинил-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-оном и 0,1365 г (0,745 ммоль) 5-(4-метилпиперазин-1 ил)пентиламина. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/этанол/MS(APCI) (m+1)/z 498,3. Пример 60. 7-(3-Диэтиламинопропиламино)-3-(3,5-диметоксифенил)-1-этил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. Используя основную процедуру, описанную выше, проводят реакцию между 3-(3,5 диметоксифенил)-1-этил-7-метансульфинил-3,4 дигидропиримидо[4,5-d]пиримидин-2(1 Н)-оном и 0,1038 г (0,797 ммоль) диэтиламинопропиламина. Остаток хроматографируют на силикагеле, элюируя смесью ацетонитрил/этанол/ триэтиламин (8:1:0,5 об./об./об.), получая 0,0719 г (61%) поименованного соединения: HPLC= 81% чистоты.E.M.Abraham, Indian Journal of Chemistry, 1973; 11:1099-1104) в 40 мл метанола добавляют 60 мл (60 ммоль) 1N раствора гидроксида калия. После перемешивания в течение ночи при комнатной температуре метанол удаляют под вакуумом и остаток ресуспендируют в 800 мл воды. Водную фазу экстрагируют три раза диэтиловым эфиром и подкисляют концентрированной соляной кислотой до рН 3. Появившийся в результате белый осадок фильтруют, хорошо отмывают водой и высушивают на воздухе, получая 9,82 г (87%) поименованного соединения:MS(APCI) (m+1)/z 217. Препарат 12. (2-Хлор-3,5-диметоксифенил) карбамовая кислота, трет-бутиловый эфир. К раствору 9,57 г (44,18 ммоль) 2-хлор-3,5 диметоксибензойной кислоты и 4,78 г (47,3 ммоль) триэтиламина в 250 мл толуола добавляют 13,57 г (49,3 ммоль) дифенилфосфорного азида. Реакцию проводят в течение 4 ч. К реакции добавляют 3,63 г (49,0 ммоль) третбутанола. Реакционную смесь выдерживают в течение ночи, затем концентрируют под вакуумом. Остаток распределяют между 1N раствором лимонной кислоты и этилацетатом. Этилацетатный слой отмывают дважды каждым из следующих растворов: холодный 1N раствор лимонной кислоты, вода, затем насыщенный раствор бикарбоната натрия. Этилацетатный слой высушивают с помощью сульфата магния и концентрируют под вакуумом. Остаток растворяют в тетрагидрофуране, добавляют силикагель и концентрируют до сухого остатка. Остаток хроматографируют на силикагеле, элюируя смесью гексан/диэтиловый эфир (9:1 об./об.), получая 8,14 г (64%) поименованного соединения с т.пл. 94,5-95,5 С. Содержание элементов, рассчитанное для 57 С - 54,20; Н - 6,31; N - 4,87; Сl - 12,32. Найдено: С - 54,20; Н - 6,17; N - 4,90; Сl 12,08. Препарат 13. 2-Хлор-3,5-диметоксифениламин. К 6,01 г (0,021 ммоль) трет-бутилового эфира (2-хлор-3,5-диметоксифенил)карбамовой кислоты добавляют 15 мл трифторуксусной кислоты. Реакционную смесь перемешивают в течение 3 ч при комнатной температуре, затем концентрируют под вакуумом. Остаток подщелачивают насыщенным раствором бикарбоната натрия, затем экстрагируют три раза дихлорметаном. Объединенные дихлорметановые фазы высушивают сульфатом магния и концентрируют под вакуумом, получая 3,98 г поименованного соединения, которое используют в следующем примере.MS(APCI) (m+1)/z 188. Пример 61. 5-[(2-Хлор-3,5-диметоксифенилимино)метил]-2-метилсульфанилпиримидин-4-илэтиламин. К раствору 3,78 г (20,2 ммоль) 2-хлор-3,5 диметоксифениламина в 110 мл толуола добавляют 3,97 г (20,15 ммоль) 4-этиламино-2 метилсульфанилпиримидин-5-карбальдегида. Реакционный сосуд снабжают Dean-Stark ловушкой, а реакционную смесь нагревают. Спустя 3 ч в реакцию добавляют две капли концентрированной серной кислоты. Реакцию проводят в течение ночи, затем концентрируют под вакуумом, получая 7,36 г (93%) поименованного соединения с т.пл. 196,5-198,5 С, которое используют в следующем примере.MS(APCI) (m+1)/z 367,0. Пример 62. 5-[(2-Хлор-3,5-диметоксифениламино)метил]-2-метилсульфанилпиримидин 4-илэтиламин. К суспензии 6,96 г (18,97 ммоль) 5-[(2 хлор-3,5-диметоксифенилимино)метил]-2-метилсульфанилпиримидин-4-илэтиламина в 200 мл сухого ТГФ, охлажденного до 5 С добавляют 18,97 г (18,97 ммоль) 1 М раствора ЛАГ и ТГФ. После перемешивания в течение 1 ч охлажденную реакцию останавливают последовательным добавлением 0,8 мл воды, 3,0 мл 25NNaOH и 1,7 мл воды. Реакционную смесь фильруют через целит, фильтровальную подложку хорошо отмывают ТГФ и фильтрат концентрируют под вакуумом. Остаток растворяют в дихлорметане, добавляют силикагель, элюируя смесью гексан/этилацетат (2:1 об./об), получая 5,15 г (74%) поименованного соединения с т.пл. 116,5-118,5 С. Содержание элементов, рассчитанное для(6,78 ммоль) гидрида натрия в виде 60% суспензии в минеральном масле. Ледяную баню удаляют и реакционную смесь перемешивают в течение 1 ч. В реакцию затем добавляют 1,32 г(8,13 ммоль) 1,1'-карбонилдиимидазола. После перемешивания в течение следующих 2 ч реакционную смесь концентрируют под вакуумом. Остаток распределяют между дихлорметаном и насыщенным раствором хлорида аммония. Водную фазу отмывают дважды дихлорметаном. Дихлорметановые фазы объединяют, высушивают над сульфатом магния и концентрируют под вакуумом. Остаток растворяют в дихлорметане, добавляют силикагель и концентрируют под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью дихлорметан/этилацетат (9:0,5 об./об), получая 0,7507 г (70%) поименованного соединения с т.пл. 189-191 С. Содержание элементов, рассчитанное дляC17H19N4O3ClS: С - 51,71; Н - 4,85; N - 14,19. Найдено: С - 51,95; Н - 4,81; N - 13,88. Пример 64. 3-(2-Хлор-3,5-диметоксифенил)-1-этил-7-метансульфинил-3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)-он. К раствору 0,7457 г (1,89 ммоль) 3-(2-хлор 3,5-диметоксифенил)-1-этил-7-метилсульфанил 3,4-дигидропиримидо[4,5-d]пиримидин-2(1 Н)она в 7 мл хлороформа добавляют 0,5428 г (2,08 ммоль) транс-2-(фенилсульфонил)-3-фенилоксазиридина. Реакционную смесь перемешивают при комнатной температуре в течение ночи, затем концентрируют под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/этанол (9:1 об./об), получая 0,697 г (90%) поименованного соединения. Содержание элементов, рассчитанное дляC17H19N4ClS0,06CH2Cl2: С - 49,26; Н - 4,63; N - 13,47. Найдено: С - 49,58; Н - 4,69; N - 13,08. Пример 65. 3-(2-Хлор-3,5-диметоксифенил)-7-(4-диэтиламинобутиламино)-1-этил-3,4 дигидропиримидо[4 ,5-d]пиримидин-2(1 Н)-он. Раствор 0,1074 г (0,2614 ммоль) 3-(2-хлор 3,5-диметоксифенил)-7-(4-диэтиламинобутиламино)-1-этил-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-она, 0,113 г (0,784 ммоль) диэтиламинобутиламина и 0,067 г (0,287 ммоль) сульфокамфорной кислоты в 4 мл сухого диоксана нагревают до 60 С. После перемешивания в течение ночи реакционную смесь концентрируют под вакуумом и остаток растворяют в дихлорметане. Дихлорметановый раствор экстрагируют три раза насыщенным раствором бикарбоната натрия, высушивают над сульфатом маг 59 ния и концентрируют под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью этилацетат/этанол/триэтиламин (9:1:0,5 об./об./об.), получая 0,106 г (82%) поименованного соединения.MS(APCI) (m+1)/z 491,1. Примеры 66-67 представлены на схеме 3. Пример 66. 3-(3,5-Диметоксифенил)-7 метилсульфанил-3,4-дигидропиримидо[4,5-d] пиримидин-2(1 Н)-он. К раствору 25,0 г (81,6 ммоль) 5-[(3,5 диметоксифениламино)метил]-2-метилсульфанилпиримидин-4-иламина в 120 мл сухого диметилформамида, охлажденного до 5 С, добавляют порционно раствор 10,1 г (95,5 ммоль) бромциана в 25 мл сухого диметилформамида. После добавления раствора бромциана ледяную баню удаляют и реакционную смесь нагревают до комнатной температуры в течение 30 мин. Реакционную смесь нагревают до 80 С в течение 4 ч, затем добавляют 500 мл 1N NaOH. Водную суспензию экстрагируют дихлорметаном(7150 мл). Дихлорметановые фазы объединяют и концентрируют под вакуумом. Остаток растворяют в дихлорметане, экстрагируют три раза насыщенным раствором хлорида натрия, высушивают над сульфатом магния и концентрируют под вакуумом. Остаток растворяют в тетрагидрофуране, добавляют силикагель и концентрируют под вакуумом. Остаток хроматографируют на силикагеле, элюируя сначала этилацетатом, затем переключают на смесь этилацетат/этанол (9:1 об./об.), получая слегка недоочищенный продукт. Этот продукт рехроматографируют на силикагеле, элюируя сначала хлороформом, затем переключают на смесь хлороформ/метанол (9:0,5 об./об.), получая 7,34 г (24%) поименованного соединения с т.пл. 198204 С. Содержание элементов, рассчитанное дляC15H17N5O2S0,30 СНСl3: С - 50,04; Н - 4,75; N - 19,07; S - 8,73. Найдено: С - 50,11; Н - 4,59; N - 19,18; S 8,91. Пример 67. 3-(3,5-Диметоксифенил)-7 метансульфинил-3,4-дигидропиримидо[4,5-d] пиримидин-2-иламин. К раствору 2,00 г (6,04 ммоль) 3-[(3,5 диметоксифенил)-7-метилсульфанил-3,4-дигидропиримидо[4,5-d]пиримидин-2-иламина в 50 мл хлороформа добавляют раствор 1,73 г (6,64 ммоль) транс-2-(фенилсульфонил)-3-фенилоксазиридина в 20 мл хлороформа. Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем концентрируют под вакуумом. Остаток растворяют в дихлорметане,добавляют силикагель и концентрируют под вакуумом. Остаток хроматографируют на силикагеле, элюируя сначала этилацетатом, затем смесью этилацетат/этанол/триэтиламин (9:2:1C15H17N5O3S0,25EtOAc0,25H2O: С - 51,37; Н - 5,26; N - 18,73. Найдено: С - 51,15; Н - 5,23; N - 18,44. Препарат 14. Этил 4-(изопропиламино)-2(метилтио)пиримидин-5-карбоксилат. К раствору 10 г (43,0 ммоль) этил 4-хлор 2-(метилтио)пиримидин-5-карбоксилата и 1,2 мл (51,6 ммоль) триэтиламина в 100 мл дихлорметана добавляют 4,4 мл (51,6 ммоль) изопропиламина. Реакционный раствор перемешивают при 0 С 2 ч, затем оставляют нагреваться до комнатной температуры. Реакционную смесь разбавляют этилацетатом, отмывают дважды водным HCl, дважды водой, один раз насыщенным раствором бикарбоната натрия и рассолом. Органическую фазу высушивают над сульфатом магния, фильтруют и концентрируют, получая 11,1 г (колич.) поименованного соединения в виде масла, которое затвердевает при отстаивании, с т.пл. 159-160 С. Масс-спектр (CI) (m+1)/z 256. Препарат 15. 4-(Изопропиламино)-2(метилтио)пиримидин-5-карбоновая кислота. К раствору 5,0 г (19,6 ммоль) этил 4(изопропиламино)-2-(метилтио)пиримидин-5 карбоксилата в 20 мл этанола добавляют раствор 0,8 г (20,6 ммоль) гидроксида натрия в 30 мл воды. Реакционную смесь ресуспендируют и перемешивают при комнатной температуре в течение ночи. Реакционный раствор разбавляют 100 мл воды и отмывают дважды диэтиловым эфиром. Водную фазу нейтрализуют 20,6 мл 1NHCl. Осадок фильтруют и отмывают дважды водой, высушивают под вакуумом при 70 С,получая 4,0 г (90%) поименованного соединения с т.пл. 202-203 С (dec). Содержание элементов, рассчитанное для С 9 Н 13N3SО 2: С - 47,56; Н - 5,77; N - 18,49. Найдено: С - 47,38; Н - 5,70; N - 18,29. Препарат 16. N-алил-4-(изопропиламино)2-(метилтио)пиримидин-5-карбоксамид. К 3,5 г (15,4 ммоль) этил 4-(изопропиламино)-2-(метилтио)пиримидин-5-карбоновой кислоты добавляют раствор 9 мл (123,2 ммоль) тионилхлорида и реакционную смесь нагревают до 50 С 1 ч, охлаждают до комнатной температуры и концентрируют. Остаток дважды ресуспендируют в ангидриде толуола и концентрируют, получая бесцветный твердый осадок хлорида 4(изопропиламино)-2-(метилтио)пиримидин-5 карбоновой кислоты. К суспензии хлорида 4-(изопропиламино)2-(метилтио)пиримидин-5-карбоновой кислоты в 10 мл тетрагидрофурана при 0 С добавляют 3,5 мл (46,2 ммоль) алиламина и 20 мл тетрагидрофурана. Реакционную суспенизию оставляют ненадолго нагреться до комнатной темпе
МПК / Метки
МПК: C07D 487/04, A61P 9/10, A61K 31/505, C07D 471/04
Метки: пролиферации, пиримидины, ингибиторы, бициклические, клеточной, 3,4-дигидропиримидины
Код ссылки
<a href="https://eas.patents.su/30-3640-biciklicheskie-pirimidiny-i-biciklicheskie-34-digidropirimidiny-kak-ingibitory-kletochnojj-proliferacii.html" rel="bookmark" title="База патентов Евразийского Союза">Бициклические пиримидины и бициклические 3,4-дигидропиримидины как ингибиторы клеточной пролиферации</a>
Предыдущий патент: Композиции валдекоксиба
Следующий патент: Диарильные производные, способы их получения, применение, фармацевтическая композиция и способ лечения
Случайный патент: N-связанные сульфонамиды гетероциклических тиоэфиров












