Новые соли и полиморфные формы афатиниба
Номер патента: 24026
Опубликовано: 31.08.2016
Авторы: Хирематх Чаннавирайя, Ядав Манодж Далсингар, Альбрехт Вольфганг, Гидвани Рамеш Матиорам, Фишер Дирк
Формула / Реферат
1. Кристаллическая соль афатиниба дифумарата.
2. Кристаллическая соль афатиниба дифумарата в форме А, характеризующаяся данными, выбранными из дифрактограммы XRPD с характерными пиками при 4,6±0,2, 24,8±0,2 и 26,1±0,2° 2-тета, дифрактограммы XRPD, представленной на фиг. 20; и их комбинации.
3. Применение кристаллической соли афатиниба дифумарата по п.1 или 2 для получения афатиниба в форме свободного основания.
4. Применение кристаллической соли афатиниба дифумарата по п.1 или 2 для получения солей афатиниба.
5. Применение по п.4 для приготовления афатиниба дималеата или его кристалличекой формы.
6. Фармацевтическая композиция для лечения рака, содержащая кристаллическую соль афатиниба дифумарата по п.1 или 2 и по меньшей мере один фармацевтически приемлемый наполнитель.
7. Применение кристаллической соли афатиниба дифумарата по п.1 или 2 для лечения рака.
8. Применение по п.7, где рак представляет собой солидную опухоль, выбранную из NSCLC, рака молочной железы, головы и шеи.
9. Способ лечения рака, включающий введение терапевтически эффективного количества кристаллической соли афатиниба дифумарата по п.1 или 2 или фармацевтической композиции по п.6 пациенту, страдающему раком.
10. Способ по п.9, где рак представляет собой солидную опухоль, выбранную из NSCLC, рака молочной железы, головы и шеи.
Текст
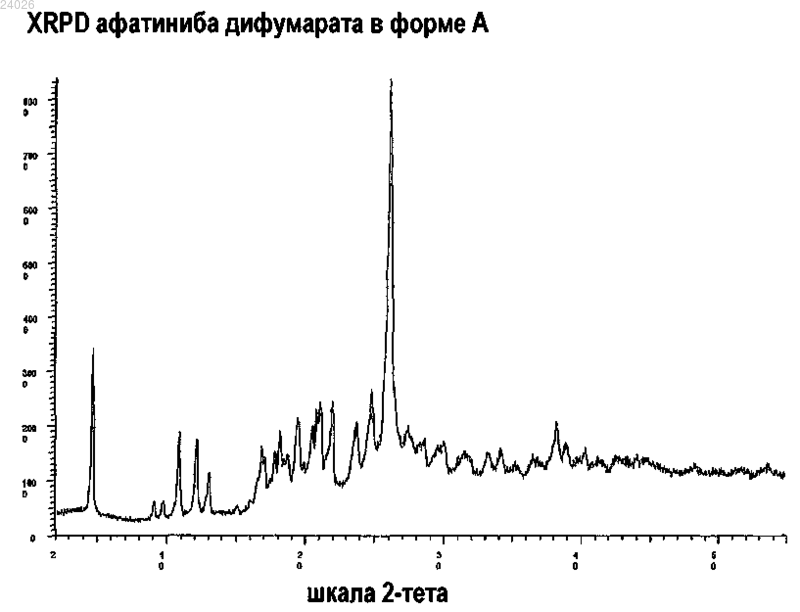
В патенте описаны соли афатиниба и их кристаллические формы, а также процессы их получения. Также в настоящем изобретении описаны кристаллические формы афатиниба и процессы их получения. Настоящее изобретение также включает фармацевтические композиции этих солей афатиниба и их кристаллических форм или кристаллических форм афатиниба, способы их получения и их использование при терапии пациентов, нуждающихся в такой терапии. Гидвани Рамеш Матиорам, Хирематх Чаннавирайя, Ядав Манодж Далсингар (IN), Альбрехт Вольфганг,Фишер Дирк (DE) Медведев В.Н. (RU) Область техники Изобретение относится к новым солям афатиниба, их кристаллическим формам, кристаллическим формам афатиниба и афатиниба дималеата и фармацевтической композиции, содержащей указанные соли или их кристаллические формы; и способам получения указанной соли афатиниба или ее кристаллической формы и указанной фармацевтической композиции. Предпосылки изобретения Соединение (Е)-4-диметиламинобут-2-еноевая кислота 4-(3-хлор-4-фторфениламино)-7-[(S)(тетрагидрофуран-3-ил)окси]хиназолин-6-иламид, известное как афатиниб и имеющее следующую структуру представляет собой экспериментальный необратимый ингибитор тирозинкиназ рецептора эпидермального фактора роста (EGFR) и человеческого эпидермального рецептора 2 (HER2) для перорального введения. Афатиниб находится на стадии разработки для терапии некоторых солидных опухолей, включая немелкоклеточный рак легкого (NSCLC), рак молочной железы, головы и шеи и различные другие виды рака. Производные хиназолина, такие как афатиниб, описаны в документе WO 2002050043. В этом документе также описаны некоторые полезные фармацевтические свойства этого соединения. Соль дималеат и ее кристаллическая форма описаны в документе WO 2005037824. Некоторые молекулы и молекулярные комплексы могут образовывать различные кристаллические формы, т.е. обладать свойством полиморфизма. Одна и та же молекула может образовывать различные полиморфы с различной структурой кристаллов и физическими свойствами, такими как температура плавления, температурные характеристики (измеряемые, например, с помощью термогравиметрического анализа - "TGA" или дифференциальной сканирующей калориметрии - "DSC"), порошковая рентгеновская дифракция (XRPD или порошковая XRD), характерный спектр инфракрасного поглощения и спектр ядерного магнитного резонанса (NMR) твердого вещества. Для дифференцировки различных полиморфных форм соединения можно применять одну или более вышеперечисленных техник. Обнаружение новых полиморфных форм и сольватов фармацевтического продукта может привести к получению материалов с желаемыми технологическими свойствами, такими как легкость в обращении,легкость обработки, стабильность при хранении и легкость очистки, или материалов, представляющих собой желаемые промежуточные кристаллические формы, облегчающие переход в другие полиморфные формы. Новые полиморфные формы и сольваты фармацевтически пригодного соединения или его солей,возможно, будут обладать улучшенными рабочими характеристиками по сравнению с исходным фармацевтическим продуктом. Новые полиморфные формы и сольваты расширяют спектр материалов, доступных специалисту-технологу для оптимизации рецептуры, например, за счет появления продуктов с другими свойствами, например, улучшенными свойствами обращения или обработки, улучшенным профилем растворимости или улучшенным сроком хранения. По меньшей мере в силу этих причин существует потребность в дополнительных твердотельных формах афатиниба в виде свободного основания и его солей. Сущность изобретения В настоящем изобретении представлены кристаллические формы афатиниба в виде свободного основания, афатиниба дималеата, способы их получения и содержащие их фармацевтические композиции. В настоящем изобретении также представлены афатиниба дибензолсульфонат, афатиниба монофумарат,афатиниба дифумарат, афатиниба дисульфат, афатиниба дигидрохлорид, афатиниба диоксалат, афатиниба димезилат, афатиниба дифосфат, афатиниба ди-L-малат, афатиниба дисукцинат, афатиниба цитрат и афатиниба L-аспартат. Далее в настоящем изобретении представлены кристаллические формы афатиниба дибензолсульфоната, афатиниба монофумарата, афатиниба дифумарата, афатиниба дисульфата, афатиниба дигидрохлорида, афатиниба диоксалата, афатиниба димезилата, афатиниба дифосфата, афатиниба дисукцината и афатиниба L-аспартата, способы их получения и содержащие их фармацевтические композиции. Далее в настоящем изобретении представлено использование вышеописанных солей и кристаллических форм для получения афатиниба в виде свободного основания, афатиниба дималеата, других солей афатиниба и их твердотельных форм. В настоящем изобретении далее представлена фармацевтическая композиция, содержащая любую из вышеперечисленных солей и кристаллических форм или их комбинацию и по меньшей мере один фармацевтически приемлемый наполнитель. В настоящем изобретении далее представлено применение любой из вышеперечисленных солей и кристаллических форм, описанных в настоящей заявке, для терапии рака, в особенности для терапии солидных опухолей, включая немелкоклеточный рак легкого (NSCLC), рак молочной железы, головы и шеи и различные другие виды рака. В настоящем изобретении также представлен способ терапии рака, включающий введение терапевтически эффективного количества по меньшей мере одной кристаллической формы афатиниба или афатиниба дималеата согласно настоящему изобретению, или по меньшей мере одной вышеупомянутой фармацевтической композиции, субъекту, страдающему раком, в особенности субъекту, страдающему солидными опухолями, включая, но без ограничения, NSCLC, рак молочной железы, головы и шеи, и различные другие виды рака. Краткое описание чертежей На фиг. 1 приведен результат порошковой рентгеновской дифракции (дифрактограмма "PXRD") кристаллического афатиниба в виде свободного основания, обозначенного формой А. На фиг. 2 приведена дифрактограмма PXRD кристаллического афатиниба в виде свободного основания, обозначенного формой В. На фиг. 3 приведена дифрактограмма PXRD кристаллического афатиниба в виде свободного основания, обозначенного формой С. На фиг. 4 приведена дифрактограмма PXRD кристаллического афатиниба в виде свободного основания, обозначенного формой D. На фиг. 5 приведена дифрактограмма PXRD формы кристаллического афатиниба дималеата, обозначенной формой В афатиниба дималеата. На фиг. 6 приведена дифрактограмма PXRD формы кристаллического афатиниба дибензолсульфоната, обозначенной формой А афатиниба дибензолсульфоната. На фиг. 7 приведена дифрактограмма PXRD кристаллического афатиниба фумарата, обозначенного формой А афатиниба фумарата. На фиг. 8 приведена дифрактограмма PXRD кристаллического афатиниба дисульфата, обозначенного формой А афатиниба дисульфата. На фиг. 9 приведена дифрактограмма PXRD кристаллического афатиниба дисульфата, обозначенного формой В афатиниба дисульфата. На фиг. 10 приведена дифрактограмма PXRD кристаллического афатиниба дигидрохлорида, обозначенного формой А афатиниба дигидрохлорида. На фиг. 11 приведена дифрактограмма PXRD кристаллического афатиниба диоксалата, обозначенного формой А афатиниба диоксалата. На фиг. 12 приведена дифрактограмма PXRD кристаллического афатиниба димезилата, обозначенного формой А афатиниба димезилата. На фиг. 13 приведена дифрактограмма PXRD кристаллического афатиниба димезилата, обозначенного формой В афатиниба димезилата. На фиг. 14 приведена дифрактограмма PXRD аморфного афатиниба дифосфата. На фиг. 15 приведена дифрактограмма PXRD кристаллического афатиниба дифосфата, обозначенного формой А афатиниба дифосфата. На фиг. 16 приведена дифрактограмма PXRD аморфного афатиниба ди-L-малата. На фиг. 17 приведена дифрактограмма PXRD аморфного афатиниба цитрата. На фиг. 18 приведена дифрактограмма PXRD кристаллического афатиниба дисукцината, обозначенного формой А афатиниба дисукцината. На фиг. 19 приведена дифрактограмма PXRD кристаллического афатиниба L-аспартата, обозначенного формой А афатиниба L-аспартата. На фиг. 20 приведена дифрактограмма PXRD кристаллического афатиниба дифумарата, обозначенного формой А афатиниба дифумарата. Подробное описание изобретения Настоящее изобретение относится к новым солям афатиниба, их кристаллическим формам, кристаллическим формам афатиниба и афатиниба дималеата и содержащей его или его указанную кристаллическую форму фармацевтической композиции; а также к способам получения указанной соли афатиниба или ее указанной кристаллической формы и указанной фармацевтической композиции. В настоящей заявке твердое состояние может быть описано графическими данными в целом "как показано" на фигуре. Такие данные включают, например, дифрактограммы PXRD, спектры FTIR и NMRспектры твердых тел. Специалисту в области техники очевидно, что для таких графических данных могут быть характерны небольшие вариации, например, в относительных интенсивностях пиков и положениях пиков, обусловленные вариациями реакции приборов и вариациями концентрации и чистоты образцов, что хорошо известно специалисту в области техники. Тем не менее, специалист в области техники способен сравнить графические данные, приведенные на фигурах в настоящей заявке, с графическими данными, полученными для неизвестной кристаллической формы, и определить, соответствуют ли эти два набора графических данных одной и той же кристаллической форме или двум разным кристаллическим формам. Кристаллическая форма афатиниба или соли афатиниба в настоящей заявке может описываться графическими данными "как показано" на фигуре. Следует понимать, что это описание включает любые кристаллические формы афатиниба или соли афатиниба, описываемые графическими данными с вышеописанными небольшими отклонениями от фигуры, что хорошо известно специалисту в области техники. В настоящей заявке твердое состояние может называться полиморфно чистым или практически не содержащим любых других кристаллических (или полиморфных) форм афатиниба или соли афатиниба согласно изобретению. При употреблении в таком контексте выражение "практически не содержащий" означает, что кристаллическая форма содержит не более 20%, не более 10%, не более 5%, не более 2% или не более 1% любой другой формы искомого соединения, например, по данным PXRD. Таким образом, следует понимать, что массовая доля искомой полиморфной формы афатиниба или соли афатиниба в полиморфах афатиниба или соли афатиниба, практически не содержащих любых других полиморфических форм, описанных в настоящем описании, составляет более 80%, более 90%, более 95%, более 98% или более 99%. Соответственно, в некоторых вариантах осуществления изобретения массовая доля одной или более других кристаллических форм афатиниба или соли афатиниба в описанных полиморфах афатиниба или соли афатиниба может составлять от 1 до 20%, от 5 до 20%, от 5 до 10%, от 5 до 1% или от 2 до 1%, предпочтительно не более 1%. В научной литературе, упоминающей технику анализа порошковой рентгеновской дифракции, используются взаимозаменяемые термины "XRPD" и "PXRD". В настоящем изобретении не делается различий между этими выражениями и сокращениями. Если не указано иначе, в настоящем описании при измерении XRPD используется K. Длины волны излучения меди = 1,5406 . В настоящем описании вещество, например реакционная смесь, может находиться или достигать"комнатной температуры, часто сокращаемой до RT". Это означает, что температура предмета близка или равна температуре окружающего пространства, например, комнаты или газоуловителя, где находится предмет. Как правило, комнатная температура находится в пределах от примерно 20 С до примерно 30 С, или от примерно 22 С до примерно 27 С, или примерно 25 С. В настоящем описании процесс или стадия может проходить "в течение ночи". Это означает что процесс или стадия проходит в течение интервала времени, включающего ночь, в течение которого процесс или стадия могут не находиться под активным наблюдением. Этот интервал времени обычно составляет примерно 8-20 ч или примерно 10-18 ч, обычно около 16 ч. Используемый в настоящем описании термин "пониженное давление" означает давление от примерно 10 мбар до примерно 50 мбар. Используемый в настоящем описании термин "выделенный", относящийся к любому из афатиниба,или соли афатиниба, или их полиморфов согласно настоящему изобретению, означает указанный полиморф афатиниба или соли афатиниба, физически отделенный от реакционной смеси, где он был образован. В настоящем изобретении представлены новые кристаллические формы афатиниба или соли афатиниба, обладающие улучшенными свойствами по сравнению с другими твердыми формами афатиниба или солей афатиниба, выбираемыми из по меньшей мере одного из химической чистоты, текучести, растворимости, скорости растворения, морфологии или формы кристалла, устойчивости, такой как термическая и механическая устойчивости к полиморфной конверсии, устойчивость к дегидратации и/или стабильность при хранении, низкое содержание остаточного растворителя, пониженная гигроскопичность,текучесть и улучшенные характеристики обращения и обработки, такие как сжимаемость и объемная плотность. Таким образом, целью настоящего изобретения является получение новых полиморфных форм афатиниба в виде свободного основания, а также новых фармацевтически приемлемых солей афатиниба и их полиморфных форм. Далее представлены фармацевтические композиции, которые содержат эти новые формы и не сталкиваются с вышеупомянутыми проблемами. В частности, представленные новые формы афатиниба обладают по меньшей мере одним из следующих преимуществ по сравнению с другими формами афатиниба и соли афатиниба, известными из уровня техники: повышенная биодоступность, сниженная вариативность от пациента к пациенту, повышенная общая терапевтическая эффективность, хорошая механическая, полиморфная и/или химическая стабильность, превосходные свойства текучести,хорошая сжимаемость и улучшенные профили растворения. Новые формы предпочтительно негигроскопичны и/или не аккумулируют электростатический заряд. Было обнаружено, что формы афатиниба и солей афатиниба согласно настоящему изобретению обладают по меньшей мере одной улучшенной характеристикой из перечисленных выше. Таким образом, настоящее изобретение относится к активным фармацевтическим ингредиентам(далее также называемым "API"), выбираемым из афатиниба в виде свободного основания в полиморфной форме А, афатиниба в виде свободного основания в полиморфной форме В, афатиниба в виде сво-3 024026 бодного основания в полиморфной форме С, афатиниба в виде свободного основания в полиморфной форме D, и солей, образованных афатинибом в виде свободного основания и одним или более кислотных компонентов, имеющих формулу HmX, где Н означает диссоциирующий атом водорода, а X означает фармацевтически приемлемый остаток (т.е. анион фармацевтически приемлемой кислоты), a m - натуральное число. В формуле HmX предпочтительно X не является тартратом. Кроме того, если X обозначает малеат или фумарат, то соли афатиниба присутствуют в виде афатиниба дималеата формы В или афатиниба фумарата формы А, как описано ниже. Настоящее изобретение в частности относится к полиморфным формам А, В, С и D афатиниба в виде свободного основания, а также к форме В афатиниба дималеата и форме А афатиниба фумарата. Далее оно относится к новым солям афатиниба бензолсульфонату, сульфату, гидрохлориду, оксалату,мезилату, фосфату и малату. Далее настоящее изобретение относится к фармацевтическим композициям,содержащим активный фармацевтический ингредиент согласно настоящему изобретению, необязательно вместе с еще по меньшей мере одним активным ингредиентом.API, в частности соли согласно настоящему изобретению, содержат индивидуальные оптические изомеры, смеси индивидуальных энантиомеров или рацематы афатиниба. Кроме того, в настоящее изобретение включены новые соли в любой полиморфной форме, включая гидраты и/или сольваты и в любой стехиометрии. В вышеприведенной формуле HmX солей афатиниба согласно изобретению m предпочтительно представляет собой число от 1 до 8, более предпочтительно 1, 2, 3 или 4, более предпочтительно m=1 или 2. Список кислот, предпочтительных для образования солей, и соответствующие значения pKa приведены в табл.А. Таблица А В дальнейшем аспекте изобретения изобретение относится к соли афатиниба, где кислотный компонент представляет собой органическую кислоту, содержащую от 1 до 13 атомов углерода. Органическая кислота предпочтительно содержит от 2 до 8 атомов углерода, предпочтительно от 3 до 5 и более предпочтительно 4 атома углерода.API согласно настоящему изобретению, предпочтительно соли согласно настоящему изобретению,обычно обладают пониженной гигроскопичностью. Они обладают преимуществами при составлении галеновых препаратов, поскольку притягивают воду слабее, чем сравнимые соли, известные из уровня техники. В частности, сочетание вышеописанных факторов дает возможность усовершенствовать стандартный процесс производства таблеток. Стабильное содержание воды обеспечивает более однородную дозировку и более длительный срок хранения препаратов. Пригодные соли можно получить с использованием следующих кислот: муравьиная кислота, дихлоруксусная кислота, глиоксиловая кислота, щавелевая кислота, уксусная кислота, гликолевая кислота, малоновая кислота, пропановая кислота, молочная кислота, малеиновая кислота, янтарная кислота, яблочная кислота, L-винная кислота, L-аспарагиновая кислота, бутановая кислота, глутаровая кислота, 2-оксоглутаровая кислота, L-глутаминовая кислота, гиппуровая кислота, 2 метилбутановая кислота, 3-метилбутановая кислота, пентановая кислота, пиколиновая кислота, 3 пиридинкарбоновая кислота, 4-пиридинкарбоновая кислота, бензолсульфоновая кислота, L-аскорбиновая кислота, лимонная кислота, адипиновая кислота, 3-метилглутаровая кислота, бензойная кислота, 4 ацетамидобензойная кислота, гидроксибензойная кислота, дигидроксибензойная кислота, дигидроксияблочная кислота, галловая кислота, 2,4,6-тригидроксибензойная кислота, аминобензойная кислота, гептановая кислота, D- или L-миндальная кислота, октановая кислота, коричная кислота, метилкоричная ки-4 024026 слота, камфорсульфоновая кислота, камфор-10-сульфоновая кислота, цикламиновая кислота, додецилсерная кислота, 2-гидроксиэтансульфоновая кислота, L-глутаминовая кислота, -оксоглутаровая кислота, бромистоводородная кислота, нафтален-2-сульфоновая кислота, 1-гидрокси-2-нафтойная кислота,азотная кислота, памовая кислота, фосфорная кислота. Соль согласно изобретению более предпочтительно содержит кислотный компонент, который представляет собой один или более выбираемых из следующего списка: малеиновая кислота, муравьиная кислота, бензолсульфоновая кислота, серная кислота, щавелевая кислота, соляная кислота, метансульфоновая кислота, фосфорная кислота, L-яблочная кислота, лимонная кислота, янтарная кислота и/или L-аспарагиновая кислота. Предпочтительно соль не является солью винной кислоты, которая может претерпевать полиморфные переходы, что приводит к образованию нежелательных фармацевтических препаратов. В дальнейшем аспекте изобретения, как правило, соотношение кислотного компонента к афатинибу в виде свободного основания в соли составляет от 1:3 до 3:1, предпочтительно соотношение составляет от 1:2 до 2:1, более предпочтительно от 1:1,5 до 1,5:1, в особенности от 1:1 до 2:1. В альтернативных вариантах воплощения изобретение относится к гидратным и/или сольватным формам API согласно изобретению, в особенности солей согласно изобретению. Соли согласно изобретению, их гидраты и/или сольваты, как правило, обладают улучшенными свойствами. Предпочтительно API согласно изобретению, в особенности соли согласно изобретению, находятся в кристаллической форме, или по меньшей мере в частично кристаллической форме. Более стабильные соли афатиниба обладают более высокой степенью кристаллизации. Кроме того, для этих солей характерна улучшенная текучесть и технологичность препаратов. Более высоко кристаллические соли менее липкие, что позволяет добиться однородного распределения действующего вещества при таблетировании. Высокая степень кристаллизации видна из измерений XRD и графиков DCS. Предпочтительно массовая доля кристаллизированной соли составляет не менее 40%. Также предпочтительно, чтобы массовая доля воды в API согласно настоящему изобретению, в частности солей согласно настоящему изобретению, составляла от менее 0,1 до 8%, более предпочтительно от 0,5 до 5%, еще более предпочтительно от 0,8 до 3,5%. Содержание воды определялось, как описано ниже в разделе экспериментов. API, в особенности соли согласно настоящему изобретению, характеризуются высокой чистотой и низким содержанием остаточного растворителя. В случае растворителя, отличного от воды, как правило, содержание растворителя находится в пределах от 1 м.д. до 3500 м.д.,предпочтительно менее 1500 м.д., более предпочтительно менее 500 м.д., в особенности менее 200 м.д. Сольваты, а также гидраты, API и/или солей согласно изобретению, могут представлять собой теми-, моно-, ди-, три-, тетра-, пента-, гексасольваты или гидраты, соответственно. Растворители, используемые для кристаллизации, такие как ацетонитрил, спирты, в особенности метанол, этанол, альдегиды,кетоны, в особенности ацетон, сложные эфиры, например, этилацетат, или алканы, в особенности пентан,гексан, гептан или циклогексан, могут быть встроены в кристаллическую решетку.API и/или соли согласно изобретению предпочтительно находятся в выделенной и практически чистой форме, например, со степенью чистоты 95%, предпочтительно 98%, более предпочтительно 99 мас.%. Энантиомерная чистота солей согласно изобретению составляет 98 мас.%, предпочтительно 99 мас. %. Как правило, фармацевтически приемлемые API согласно настоящему изобретению, в частности соли афатиниба, получают в кристаллической форме. Однако в зависимости от кислотного компонента фармацевтически приемлемые соли афатиниба могут быть получены в виде различных полиморфных форм. Полиморфизмом называется существование различных кристаллических решеток в твердых кристаллических веществах, идентичных по химическому составу. При анализе API и/или солей с помощью дифференциальной сканирующей калориметрии (DSC),эндотермические пики указывают на молекулярные перестройки или трансформации. Кроме того, ни один из пиков на фигурах, приведенных ниже, не соответствует остаточным растворителям или другим примесям. Таким образом, изобретение также относится к полиморфным формам API и/или солей. В зависимости от соответствующей соли полиморфные формы различаются по свойствам, например, по текучести и стабильности при хранении.API афатиниба согласно изобретению, в особенности соли афатиниба согласно изобретению, предпочтительно находятся в форме частиц. Как правило, средний размер частиц (D50) составляет от 1 до 250 мкм, предпочтительно от 2 до 200 мкм, более предпочтительно от 5 до 150 мкм, еще более предпочтительно от 10 до 120 мкм, наиболее предпочтительно от 15 до 90 мкм. Средний размер частиц определяют, как описано ниже в разделе экспериментов. Соотношение Хауснера для солей афатиниба согласно изобретению предпочтительно находится в пределах от 1,01 до 1,5 или от 1,05 до 1,4, предпочтительно от 1,06 до 1,3, более предпочтительно от 1,08 до 1,25. Соотношением Хауснера называется отношение плотности после утряски к насыпной плотности. Плотность после утряски и насыпную плотность предпочтительно определяют по Ph. Eur. 6,0, 2.2.42. В альтернативном предпочтительном варианте воплощения изобретения соли согласно изобрете-5 024026 нию получают в аморфном состоянии или форме. В настоящей заявке термин "аморфный" обычно относится к состоянию твердого вещества, в котором его составляющие (атомы, ионы или молекулы) не упорядочены периодично на большом расстоянии(отсутствует дальний порядок). Однако составляющие аморфного вещества обычно не полностью неподвижны и размещение их не случайно. Расстояние и ориентация их относительно ближних соседей(ближний порядок) подчиняется определенным закономерностям и напоминает кристаллическое состояние. Таким образом, в аморфных веществах наблюдается ближний, но не дальний порядок. В отличие от анизотропных кристаллов, твердые аморфные вещества изотропны. У них обычно нет выраженной температуры плавления; в жидкое состояние они переходят путем постепенного размягчения. Аморфные вещества можно отличить от кристаллических веществ с помощью рентгеноструктурного анализа. У аморфных веществ обычно наблюдается неопределенная интерференция при малых углах дифракции. При использовании солей в качестве фармацевтически активных веществ и при производстве, хранении и применении галеновых препаратов большую роль играют улучшенные физико-химические свойства солей. Большее постоянство физических параметров гарантирует лучшее качество препаратов. Далее подробно описаны предпочтительные варианты осуществления активных фармацевтических ингредиентов согласно настоящему изобретению. В одном варианте осуществления изобретение относится к кристаллическому афатинибу в виде свободного основания в форме А, на дифрактограмме XRPD которого видны характерные пики при 5,1,24,3 и 24,60,2 2-тета. Афатиниб в виде свободного основания в форме А может далее описываться дифрактограммойXRPD с характерными пиками при 3,9, 7,8, 18,7 и 20,60,2 2-тета. Афатиниб в виде свободного основания в форме А может альтернативно описываться дифрактограммой XRPD, приведенной на фиг. 1. Афатиниб в виде свободного основания в форме А может также описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в левой колонке табл.1 ниже. Форма А может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.1 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 1. Список пиков XRPD для афатиниба в виде свободного основания в форме А В одном варианте осуществления изобретение относится к кристаллическому афатинибу в виде свободного основания в форме В, на дифрактограмме XRPD которого видны характерные пики при 3,9,7,8 и 24,30,2 2-тета. Афатиниб в виде свободного основания в форме В может далее описываться дифрактограммойXRPD с характерными пиками при 20,6 и 24,60,2 2-тета. Афатиниб в виде свободного основания в форме В может альтернативно описываться дифрактограммой XRPD, приведенной на фиг. 2. Афатиниб в виде свободного основания в форме В может также описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в левой колонке табл.2 ниже. Форма В может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.2 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 2. Список пиков XRPD для афатиниба в виде свободного основания в форме В В одном варианте осуществления изобретение относится к кристаллическому афатинибу в виде свободного основания в форме С, на дифрактограмме XRPD которого видны характерные пики при 5,10,2, 12,10,2 и 24,60,2 2-тета. Афатиниб в виде свободного основания в форме С может далее описываться дифрактограммойXRPD с характерными пиками при 10,9, 17,0 и 21,00,2 2-тета. Афатиниб в виде свободного основания в форме С может альтернативно описываться дифрактограммой XRPD, приведенной на фиг. 3. Афатиниб в виде свободного основания в форме С может также описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в левой колонке табл.3 ниже. Форма С может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.3 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 3. Список пиков XRPD для афатиниба в виде свободного основания в форме С В одном варианте осуществления изобретение относится к кристаллическому афатинибу в виде свободного основания в форме D, на дифрактограмме XRPD которого видны характерные пики при 5,20,2, 6,00,2 и 18,70,2 2-тета. Афатиниб в виде свободного основания в форме D может далее описываться дифрактограммойXRPD с характерными пиками при 21,1 и 23,50,2 2-тета. Афатиниб в виде свободного основания в форме D может альтернативно описываться дифрактограммой XRPD, приведенной на фиг. 4. Афатиниб в виде свободного основания в форме D может также описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в левой колонке табл.4 ниже. Форма D может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.4 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 4. Список пиков XRPD для афатиниба в виде свободного основания в форме D В одном варианте осуществления изобретение относится к кристаллической форме В соли афатиниба дималеата, на дифрактограмме XRPD которой видны характерные пики при 19,30,2, 22,10,2 и 25,60,2 2-тета. Форма В афатиниба дималеата соли афатиниба дималеата может далее описываться дифрактограммой XRPD с характерными пиками при 18,80,2, 21,50,2, 25,1 и 29,10,2 2-тета. Форма В афатиниба дималеата может альтернативно описываться дифрактограммой XRPD, приведенной на фиг. 5. Форма В афатиниба дималеата может также описываться пиками XRPD в градусах угла 2-тета[0,2], приведенными в левой колонке табл.5 ниже. Форма В может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.5 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 5. Список пиков XRPD для формы В афатиниба дималеата В одном варианте осуществления изобретение относится к соли афатиниба дибензолсульфонату. Предпочтительно дибензолсульфонатная соль обладает преимущественно признаками аморфного вещества; на ее дифрактограмме XRPD не видно характерных пиков. Соль афатиниба дибензолсульфонат может альтернативно описываться дифрактограммой XRPD,приведенной на фиг. 6. В одном варианте осуществления изобретение относится к соли афатиниба монофумарату. В предпочтительном варианте осуществления соль монофумарат представляет собой кристаллическое вещество. В дальнейшем предпочтительном варианте осуществления на дифрактограмме XRPD кристаллического афатиниба монофумарата видны характерные пики при 11,90,2, 19,40,2 и 24,70,2 2-тета. Эту форму можно назвать формой А афатиниба монофумарата. Форма А афатиниба монофумарата может далее описываться дифрактограммой XRPD с характерными пиками при 7,0 и 21,30,2 2-тета. Альтернативно форма А афатиниба монофумарата может описываться дифрактограммой XRPD, приведенной на фиг. 7. Форма А афатиниба монофумарата может также описываться пиками XRPD в градусах угла 2-тета[0,2], приведенными в левой колонке табл.7 ниже. Форма А может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.7 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 7. Список пиков XRPD для соли афатиниба монофумарата В одном варианте осуществления изобретение относится к соли афатиниба дисульфату. В предпочтительном варианте осуществления соль афатиниба дисульфат представляет собой кристаллическое вещество. В дальнейшем предпочтительном варианте осуществления на дифрактограмме XRPD соли афатиниба дисульфата видны характерные пики при 20,40,2 и 25,60,2 2-тета. Эту форму можно назвать формой А афатиниба дисульфата. Форма А афатиниба дисульфата может далее описываться дифрактограммой XRPD с характерными пиками при 21,3 и 22,30,2 2-тета. Альтернативно форма А афатиниба дисульфата может описываться дифрактограммой XRPD, приведенной на фиг. 8. Форма А афатиниба дисульфата может также описываться пиками XRPD в градусах угла 2-тета[0,2], приведенными в левой колонке табл.8 ниже. Форма А может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.8 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 8. Список пиков XRPD для формы А афатиниба дисульфата В одном варианте осуществления изобретение относится к сульфатной соли афатиниба в форме дисульфата формы В. В предпочтительном варианте осуществления на дифрактограмме XRPD формы В афатиниба дисульфата видны характерные пики при 6,10,2, 18,60,2 и 25,50,2 2-тета. Форма В афатиниба дисульфата может далее описываться дифрактограммой XRPD с характерными пиками на 11,60,2, 14,30,2 и 22,80,2 2-тета. Альтернативно форма В афатиниба дисульфата может описываться дифрактограммой XRPD, приведенной на фиг. 9. Форма В афатиниба дисульфата может также описываться пиками XRPD в градусах угла 2-тета[0,2], приведенными в левой колонке табл.9 ниже. Форма В может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.9 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 9. Список пиков XRPD для формы В афатиниба дисульфата В одном варианте осуществления изобретение относится к соли афатиниба дигидрохлориду. В предпочтительном варианте осуществления соль афатиниба дигидрохлорид представляет собой кристаллическое вещество. В дальнейшем предпочтительном варианте осуществления на дифрактограмме XRPD кристаллической соли афатиниба дигидрохлорида видны характерные пики при 5,80,2, 6,40,2 и 25,80,2 2-тета. Эту форму можно назвать формой А афатиниба дигидрохлорида. Форма А афатиниба дигидрохлорида может далее описываться дифрактограммой XRPD с характерными пиками при 19,50,2, 20,60,2, 25,00,2 и 27,10,2 2-тета. Альтернативно форма А афатиниба дигидрохлорида может описываться дифрактограммой XRPD, приведенной на фиг. 10. Форма А афатиниба дигидрохлорида может также описываться пиками XRPD в градусах угла 2 тета [0,2], приведенными в левой колонке табл.10 ниже. Форма А может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.10 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 10. Список пиков XRPD для формы А афатиниба дигидрохлорида В одном варианте осуществления изобретение относится к соли афатиниба диоксалату. В предпочтительном варианте осуществления соль афатиниба диоксалат представляет собой кристаллическое вещество. В дальнейшем предпочтительном варианте осуществления на дифрактограмме XRPD кристаллической соли афатиниба диоксалата видны характерные пики при 5,60,2, 23,50,2 и 25,30,2 2-тета. Эту форму можно назвать формой А соли афатиниба диоксалата. Форма А афатиниба диоксалата может далее описываться дифрактограммой XRPD с характерными пиками при 8,40,2, 17,40,2, 21,50,2, 29,90,2 и/или 32,10,2 2-тета. Альтернативно форма А афатиниба диоксалата может описываться дифрактограммой XRPD, приведенной на фиг. 11. Форма А афатиниба диоксалата может также описываться пиками XRPD в градусах угла 2-тета[0,2], приведенными в левой колонке табл.10b ниже. Форма А может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.10b ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 10b. Список пиков XRPD для формы А афатиниба диоксалата В одном варианте осуществления изобретение относится к соли афатиниба димезилату. В предпочтительном варианте осуществления соль афатиниба димезилат представляет собой кристаллическое вещество. В дальнейшем предпочтительном варианте осуществления на дифрактограмме XRPD кристаллической соли афатиниба димезилата видны характерные пики при 19,50,2, 25,30,2 и 25,70,2 2-тета. Эту форму можно назвать формой А соли афатиниба димезилата. Форма А афатиниба димезилата может далее описываться дифрактограммой XRPD с характерными пиками при 5,70,2, 9,10,2 и 26,10,2 2-тета. Альтернативно форма А афатиниба димезилата может описываться дифрактограммой XRPD, приведенной на фиг. 12. Форма А афатиниба димезилата может также описываться пиками XRPD в градусах угла 2-тета[0,2], приведенными в левой колонке табл.12 ниже. Форма А может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.12 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 12 Список пиков XRPD для формы А афатиниба димезилата В одном варианте осуществления изобретение относится к кристаллической соли афатиниба димезилату в форме В. В предпочтительном варианте осуществления на дифрактограмме XRPD формы В соли афатиниба димезилата видны характерные пики при 15,00,2, 21,00,2 и 26,70,2 2-тета. Форма В афатиниба димезилата может далее описываться дифрактограммой XRPD с характерными пиками при 4,10,2, 16,70,2 и 18,80,2 2-тета.Альтернативно форма В афатиниба димезилата может описываться дифрактограммой XRPD, приведенной на фиг. 13. Форма В афатиниба димезилата может также описываться пиками XRPD в градусах угла 2-тета[0,2], приведенными в левой колонке табл.13 ниже. Форма В может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.13 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 13. Список пиков XRPD для формы В афатиниба димезилата В одном варианте осуществления изобретение относится к соли афатиниба дифосфату. В предпочтительном варианте осуществления соль афатиниба дифосфат представляет собой аморфное вещество. Дифрактограмма XRPD соли афатиниба дифосфата в виде аморфного вещества представлена на фиг. 14. В другом предпочтительном варианте осуществления соль афатиниба дифосфат представляет собой кристаллическое вещество. В дальнейшем предпочтительном варианте осуществления на дифрактограмме XRPD кристаллической соли афатиниба дифосфата видны характерные пики при 10,70,2, 19,20,2 и 25,10,2 2-тета. Эту форму можно назвать формой А афатиниба дифосфата. Форма А афатиниба дифосфата может далее описываться дифрактограммой XRPD с характерными пиками при 12,40,2, 13,40,2, 22,10,2 и 24,30,2 2-тета. Альтернативно форма А афатиниба дифосфата может описываться дифрактограммой XRPD, приведенной на фиг. 15. Форма А афатиниба дифосфата может также описываться пиками XRPD в градусах угла 2-тета[0,2], приведенными в левой колонке табл.15 ниже. Форма А может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.15 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 15. Список пиков XRPD для формы А афатиниба дифосфата В одном варианте осуществления изобретение относится к соли афатиниба ди-L-малату. В предпочтительном варианте осуществления соль афатиниба ди-L-малат представляет собой аморфное вещество. Дифрактограмма XRPD соли афатиниба ди-L-малата в виде аморфного вещества представлена на фиг. 16. В одном варианте осуществления изобретение относится к соли афатиниба цитрату. В предпочтительном варианте осуществления соль афатиниба цитрат представляет собой аморфное вещество. Дифрактограмма XRPD соли афатиниба цитрата в виде аморфного вещества представлена на фиг. 17. В одном варианте осуществления изобретение относится к соли афатиниба дисукцинату. В предпочтительном варианте осуществления изобретения соль афатиниба дисукцинат представляет собой кристаллическое вещество. В предпочтительном варианте осуществления на дифрактограмме XRPD кристаллической соли афатиниба дисукцината видны характерные пики при 6,20,2, 20,30,2 и 24,70,2 2 тета. Эту форму можно назвать формой А афатиниба дисукцината. Форма А афатиниба дисукцината может далее описываться дифрактограммой XRPD с характерными пиками при 21,40,2, 23,80,2 и 31,30,2 2-тета. Альтернативно форма А афатиниба дисукцината может описываться дифрактограммой XRPD, приведенной на фиг. 18. Форма А афатиниба дисукцината может также описываться пиками XRPD в градусах угла 2-тета[0,2], приведенными в левой колонке табл.18 ниже. Форма А может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.18 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 18. Список пиков XRPD для формы А афатиниба дисукцината В одном варианте осуществления изобретение относится к соли афатиниба L-аспартату. В предпочтительном варианте осуществления изобретения соль афатиниба L-аспартат представляет собой кристаллическое вещество. В дальнейшем предпочтительном варианте осуществления на дифрактограмме XRPD кристаллической соли афатиниба L-аспартата видны характерные пики при 21,60,2, 31,00,2 и 37,20,2 2-тета. Эту форму можно назвать формой А афатиниба L-аспартата. Форма А афатиниба L-аспартата может далее описываться дифрактограммой XRPD с характерными пиками при 24,60,2, 28,10,2 и 39,40,2 2-тета. Альтернативно форма А афатиниба L-аспартата может описываться дифрактограммой XRPD, приведенной на фиг. 19. Форма А афатиниба L-аспартата может также описываться пиками XRPD в градусах угла 2-тета[0,2], приведенными в левой колонке табл.19 ниже. Форма А может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.19 ниже, в сочетании с соответствующими значениями относительной интенсивности. Таблица 19. Список пиков XRPD для формы А афатиниба L-аспартата В одном варианте осуществления изобретение относится к соли афатиниба дифумарату. В предпочтительном варианте осуществления изобретения соль афатиниба дифумарат представляет собой кристаллическое вещество. В дальнейшем предпочтительном варианте осуществления на дифрактограммеXRPD кристаллической соли афатиниба дифумарата видны характерные пики при 4,60,2, 24,80,2 и 26,10,2 2-тета. Эту форму можно назвать формой А афатиниба дифумарата. Форма А афатиниба дифумарата может далее описываться дифрактограммой XRPD с характерными пиками при 10,80,2 и 19,50,2 2-тета. Альтернативно форма А афатиниба дифумарата может описываться дифрактограммой XRPD, приведенной на фиг. 20. Форма А афатиниба дифумарата может также описываться пиками XRPD в градусах угла 2-тета[0,2], приведенными в левой колонке табл.20 ниже. Форма А может далее необязательно описываться пиками XRPD в градусах угла 2-тета [0,2], приведенными в табл.20 ниже, в сочетании с соответствующими значениями относительной интенсивности. Далее, целью настоящего изобретения является разработка улучшенного процесса производства афатиниба в виде различных фармацевтически приемлемых солей с неизменным профилем растворимости до и после хранения. В настоящем изобретении представлен процесс производства соли согласно изобретению, как описано выше в по меньшей мере частично кристаллической форме, описываемый следующим образом:(i) свободное основание и/или соответствующую кислоту растворяют в органическом растворителе,(ii) раствор или растворы согласно (i) смешивают друг с другом или альтернативно со свободным основанием или кислотой, не растворяемыми на стадии (i),(iii) раствор по (ii) необязательно перемешивают, предпочтительно в течение по меньшей мере 5 минут,(iv) раствор помещают без перемешивания в условия, приемлемые для кристаллизации соли, такие как RTP, с нагреванием, охлаждением, пониженным давлением и/или вакуумом или без них, предпочтительно в течение по меньшей мере 1 часа, более предпочтительно в течение по меньшей мере 1 дня.(v) соль отделяют и высушивают, например, путем декантации супернатанта или фильтрации с последующим высушиванием, необязательно под вакуумом. Термин "RTP" означает температуру и давление окружающей среды и предпочтительно относится к температуре примерно 23 С и давлению примерно 1013 мбар. В процессе растворения (i) используемый органический растворитель предпочтительно представляет собой спирт, такой как этанол или изопропанол, или алкилнитрил, в особенности ацетонитрил, и/или воду. Растворитель можно подогревать до температуры выше комнатной, например, до 25-60 С, более предпочтительно до 30-50 С, наиболее предпочтительно до 40-45 С. Следует избегать растворителей, обладающими нежелательными токсическими свойствами. На стадии (ii) процесса массовая доля кислоты в используемом водном растворе предпочтительно составляет от 10 до 30%, более предпочтительно от 15 до 25%, например 20% раствор кислоты. Стадия перемешивания может длиться от 5 до 60 мин, более предпочтительно от 7 до 15 мин. На стадии (iv) процесса предпочтительно раствор оставляют в покое для медленного испарения растворителя. Это достигается предпочтительно с помощью охлаждения до комнатной температуры или ниже, более предпочтительно от -10 до +25 С, еще более предпочтительно от -5 до +10 С, наиболее предпочтительно от 0 до 5 С. Концентрирование раствора может также осуществляться путем подогрева до температуры выше комнатной, например от выше 25 до 100 С, более предпочтительно до 30-70 С. На стадии (v) процесса сушка предпочтительно производится при повышенной температуре, более предпочтительно при 20-50 С, наиболее предпочтительно при 30-42 С. Эту стадию предпочтительно проводят под вакуумом. Термин "вакуум" обычно означает давление, предпочтительно выбираемое из 1100 мбар, предпочтительно 10-50 мбар, более предпочтительно 20-40 мбар, такое как 30 мбар. Сушку обычно прекращают по достижении постоянной массы. В зависимости от условий сушки она может занимать от 1 до 48 ч, предпочтительно от 1,5 до 24 ч, например от 2 до 10 ч. В предпочтительном варианте осуществления кристаллизацию можно оптимизировать, например ускорить, путем добавления по меньшей мере одного затравочного кристалла. Изобретение также относится, в частности, к фармацевтической композиции, в особенности в виде твердой лекарственной формы, содержащей API согласно изобретению, в частности, содержащей соль афатиниба согласно изобретению, описанную выше, предпочтительно для перорального введения, необязательно в комбинации с одним или более фармацевтически приемлемыми наполнителями и/или добавками. В настоящем изобретении далее представлено использование вышеописанных солей и кристаллических форм для получения афатиниба в виде свободного основания, афатиниба дималеата, других солей афатиниба и их твердых форм, например, путем превращения вышеописанных солей и кристаллических форм в афатиниб в виде свободного основания, афатиниба дималеат, другие соли афатиниба и их твердые формы, и необязательно дальнейшего получения фармацевтического препарата на основе полученного афатиниба в виде свободного основания, афатиниба дималеата, другой соли афатиниба и их твердых форм. В настоящем изобретении далее представлена фармацевтическая композиция, включающая любую из вышеописанных солей и кристаллических форм или их комбинацию, и по меньшей мере один фармацевтически приемлемый наполнитель. В настоящем изобретении далее представлено использование любой из вышеописанных солей и кристаллических форм, раскрытых в настоящем описании, для терапии рака, в особенности для терапии солидных опухолей, включая NSCLC, рак молочной железы, головы и шеи и различные другие виды рака. В настоящем изобретении также представлен способ терапии рака, включающий введение терапевтически эффективного количества по меньшей мере одной кристаллической формы афатиниба или афатиниба дималеата согласно настоящему изобретению или по меньшей мере одной из вышеописанных фармацевтических композиций, пациенту, страдающему раком, в особенности пациенту, страдающему солидной опухолью, включая, но без ограничения, NSCLC, рак молочной железы, головы и шеи и раз- 22024026 личные другие виды рака. Дальнейший аспект настоящего изобретения относится к фармацевтической композиции, включающей API согласно настоящему изобретению, в частности, соль афатиниба согласно настоящему изобретению, и по меньшей мере еще один активный фармацевтический ингредиент. Предпочтительно еще один активный фармацевтический ингредиент выбирается, например, из паклитаксела, цисплатина, пеметрекседа, винорелбина, симвастатина, летрозола, интеданиба, бевацизумаба, темозоломида, рапамицина, герцептина и цетуксимаба и их фармацевтически приемлемых солей. У такой композиции неожиданно обнаружились улучшенные свойства. Фармацевтическая композиция, включающая API согласно настоящему изобретению , в частности, соль афатиниба согласно настоящему изобретению, и по меньшей мере еще один активный фармацевтический ингредиентобладает улучшенными фармакологическими свойствами. В частности, сочетание компонентовидает неожиданный аддитивный или даже синергический эффект. Сочетание компонентовидает неожиданный усиленный эффект в особенности при терапии рака, иммунных заболеваний, респираторных заболеваний и/или заболеваний желудочно-кишечного тракта. Конкретные опухоли и иммунные заболевания включают, но без ограничения, опухоли на поздней стадии, амилоидоз, нейробластому, менингиому, гемангиоперицитому, множественные метастазы в мозг,мультиформную глиобластому, глиобластому, глиому ствола мозга, злокачественную опухоль мозга с плохим прогнозом, злокачественную глиому, рецидивирующую злокачественную глиому, анапластическую астроцитому, анапластическую олигодендроглиому, нейроэндокринную опухоль, аденокарциному прямой кишки, колоректальный рак С и D по Дьюксу, нерезектабельную колоректальную карциному,метастазирующую гепатоцеллюлярную карциному, саркому Капоши, каротипную острую миелобластную лейкемию, лимфому Ходжкина, неходжкинскую лимфому, кожную Т-клеточную лимфому, кожную В-клеточную лимфому, диффузную крупноклеточную В-клеточную лимфому, фолликулярную лимфому низкой степени злокачественности, злокачественную меланому, злокачественную мезотелиому, злокачественную мезотелиому с плевральным выпотом, карциному брюшной полости, папиллярную серозную карциному, гинекологическую саркому, саркому мягких тканей, склеродерму, кожный васкулит, гистиоцитоз из клеток Лангерганса, лейомиосаркому, прогрессирующую оссифицирующую фибродисплазию,гормон-устойчивый рак простаты, резецированную саркому мягких тканей с высоким риском, нерезектабельную гепатоцеллюлярную карциному, макроглобулинемию Вальденстрема, тлеющую миелому,вялотекущую миелому, рак фаллопиевой трубы, андроген-независимый рак простаты, андрогензависимый неметастазирующий рак простаты IV стадии, гормон-независимый рак простаты, рак простаты, нечувствительный к химиотерапии, папиллярную карциному щитовидной железы, фолликулярную карциному щитовидной железы, медуллярную карциному щитовидной железы, лейомиому, устойчивую и трудноизлечимую множественную миелому, миелофиброз, серповидноклеточную анемию и миелодиспластический синдром. Введение API согласно настоящему изобретению , в частности соли афатиниба согласно настоящему изобретению, и по меньшей мере еще одного активного фармацевтического ингредиентапациенту можно проводить одновременно или последовательно одним и тем же или разными путями введения. Вещества можно вводить перорально, внутривенно, подкожно и/или внутримышечно. Предпочтительно вводить API согласно настоящему изобретению , в частности соль афатиниба согласно настоящему изобретению, и по меньшей мере еще один активный фармацевтический ингредиентперорально. Предпочтительно API согласно настоящему изобретению , в частности соль афатиниба согласно настоящему изобретению, и по меньшей мере еще один активный фармацевтический ингредиент вводят одновременно, более предпочтительно в одной лекарственной форме, еще более предпочтительно в одной твердой лекарственной форме для перорального введения, например, в таблетке или капсуле, предпочтительно в таблетке. В одном варианте осуществления изобретения API согласно настоящему изобретению , в частности соль афатиниба согласно настоящему изобретению, можно вводить ежедневно в количестве от примерно 10 до примерно 150 мг, предпочтительно от примерно 20 до примерно 60 мг, более предпочтительно от примерно 20 до примерно 50 мг и наиболее предпочтительно в количестве 40 мг, в то время как другой активный фармацевтический ингредиентможно вводить в количестве от примерно 0,01 до примерно 350 мг, предпочтительно от примерно 0,1 до примерно 250 мг, более предпочтительно от примерно 0,5 до примерно 150 мг и наиболее предпочтительно в количестве от 1,0 до 100 мг. В другом предпочтительном варианте осуществления изобретения API согласно настоящему изобретению , в частности соль афатиниба согласно настоящему изобретению, и по меньшей мере еще один активный фармацевтический ингредиентможно вводить в виде одной ежедневной дозы или в виде дробных доз от двух до шести раз в день. В некоторых вариантах осуществления изобретения API согласно настоящему изобретению , в частности соль афатиниба согласно настоящему изобретению, и по меньшей мере еще один активный фармацевтический ингредиентможно вводить реже, чем один раз в день, например, на каждый второй, третий, четвертый, пятый, шестой или седьмой день. Фармацевтическую композицию, включающую API согласно настоящему изобретению , в частности соль афа- 23024026 тиниба согласно настоящему изобретению, и по меньшей мере еще один активный фармацевтический ингредиентпредпочтительно вводят ежедневно, еженедельно, два раза в неделю или три раза в неделю. В некоторых вариантах осуществления изобретения API согласно настоящему изобретению , в частности соль афатиниба согласно настоящему изобретению, и по меньшей мере еще один активный фармацевтический ингредиентвводят пациенту циклично. Циклическая терапия включает введение активного вещества в течение определенного периода времени, затем перерыва в течение определенного периода времени, после чего цикл введения повторяется. Циклическая терапия помогает замедлить развитие резистентности к одной или более терапий, избежать или ослабить побочные эффекты одной терапии и/или повысить эффективность лечения. Таким образом, в одном конкретном варианте осуществления изобретения API согласно настоящему изобретению , в частности соль афатиниба согласно настоящему изобретению, и по меньшей мере еще один активный фармацевтический ингредиентвводят 3-6-недельным циклом, включающим перерыв 1-2 недели, предпочтительно 3-недельным циклом, включающим недельный перерыв. Далее в изобретении можно повышать частоту, количество и длину циклов дозировки. В одном варианте осуществления изобретения API согласно настоящему изобретению , в частности соль афатиниба согласно настоящему изобретению, и по меньшей мере еще один фармацевтически активный ингредиентвводят ежедневно непрерывно в течение 3-4 недель, с последующим перерывом 1-2 недели. Далее изобретение поясняется следующими неограничивающими примерами. При рассмотрении настоящего описания со ссылками на определенные предпочтительные варианты осуществления специалисту в области техники будут очевидны другие варианты осуществления изобретения. Далее изобретение определяется путем ссылки на следующие примеры, в которых подробно описывается получение композиции и способы использования изобретения. Специалисту в области техники очевидно, что материалы и способы можно модифицировать разными способами без выхода за пределы объема изобретения. Примеры Список оборудования.XRD: образцы анализировали на дифрактометре Bruker AXS D8 Advance powder X-ray difractometer при следующих условиях измерения: Содержание остаточной воды: определяли по способу Карла Фишера, как описано в Ph. Eur. 6 изд. 2008, раздел 2.5.12. Определение проводили с использованием титратора по Карлу Фишеру Mettler Toledo DL31. Как правило, анализировали 50-100 мг соли.DSC: Mettler Toledo модель DSC 822; интервал нагрева образцов 30-300 С; скорость нагрева = 10 С/мин; продувочный газ = азот 50 мл/мин; тигель алюминий 40 микрон. Температура плавления: прибор для интервала плавления Lab India Visual; размер частиц: средний размер частиц (D50) определяли способом рассеяния света с использованием прибора Mastersizer 2000 производства Malvern Instruments (мокрое измерение, 2000 об/мин, ультразвуковые волны в течение 60 с,интерпретация данных по способу Фраунхофера). Определение остаточного растворителя. а) Условия газовой хроматографииc) Приготовление стандартного раствора. Аккуратно взвешивали соответствующий стандарт в мерной колбе объемом 100 мл, содержащей 50 мл N,N-диметилформамида и разводили до риски N,N-диметилформамидом.d) Тест пригодности системы. Пригодность системы тестировали путем расчета процента относительного стандартного отклонения (% RSD) для каждой области пика растворителя и времени удерживания для 6 копий стандартного раствора.e) Спецификация: % RSD площади для каждого растворителя: не более 10,0%.f) Приготовление анализируемого раствора аккуратно взвешивали примерно 100 мг образца в виале для парофазного анализа объемом 10 мл. Добавляли 1 мл N,N-диметилформамида.g) Процедура. Делали одну инъекцию растворителя, т.е. N,N-диметилформамида. Делали шесть инъекций стандартных растворов и проверяли параметр пригодности системы, как указано в тесте пригодности системы. При соответствии системы параметрам пригодности делали инъекцию анализируемого раствора. Пример 1. Афатиниб в виде свободного основания в форме А. 5,0 мл (46,9 ммоль) концентрированной HCl и 5,0 мл воды добавляли в круглодонную колбу объемом 50 мл с магнитной иглой и азотным баллоном и перемешивали при 30 С. Через 15 мин добавляли 5,3 мл (27,1 ммоль) (диметиламино)ацетальдегид-диэтилацеталя в течение 5 мин при 30 С. Смесь перемешивали в течение ночи при комнатной температуре в инертной атмосфере. Полученный таким образом раствор называли реагентом "А". 6,0 г (10,85 ммоль) диэтил (4-3-хлор-4-фторфениламино)-7-(S)-(тетрагидрофуран-3-илокси)хиназолин-6-илкарбамоил)метил)фосфоната, 0,47 г (10,85 ммоль) безводного хлорида лития и 25 мл ТГФ добавляли в круглодонную двугорлую колбу объемом 250 мл с магнитной иглой, термометром и азотным баллоном. Смесь охлаждали до -8 С на льдосоляной бане и в течение 15 мин добавляли холодный раствор гидроксида калия (4,7 г, 82,7 ммоль растворяли в 24 мл воды и хранили при -18 С). К реакционной смеси по каплям добавляли реагент "А" в течение 30 мин при температуре -7 С. Реакционную смесь перемешивали в течение 1 ч при той же температуре. Реакция медленно нагревалась до 20 С, после чего при этой температуре ее перемешивали в течение 45 мин. Добавляли 20 мл воды и экстрагировали смесь 350 мл этилацетата. Комбинированный экстракт высушивали на сульфате натрия, испаряли и получившийся осадок высушивали при 45 С под вакуумом, в результате чего получали твердое вещество желтого цвета. К твердому веществу прибавляли 200 мл воды, смесь перемешивали в течение 1 ч, фильтровали, промывали 200 мл воды, сушили на роторном испарителе при 45 С в течение 2 ч, в результате чего получали 5,1 г (97,7%, 10,6 ммоль) твердого вещества грязно-белого цвета. На DSC видны два эндотермических пика при 95,9 С и 138,6 С.IR (см-1): 3547,4, 2980,2, 2947,8, 2865,7, 2774, 1673,1, 1626,9, 1575,8, 1536,1, 1500,1, 1455,7, 1430,5,1397,0, 1233,4, 1147,1, 981,9, 852,1, 778,5 и 660,9. Пример 2. Афатиниб в виде свободного основания в форме В. 1,0 г афатиниба в виде свободного основания растворяли в 3 мл бутилацетата и медленно добавляли 15 мл метилциклогексана. Осадок отфильтровывали и высушивали при 45 С под вакуумом в течение 2 ч,в результате чего получали 0, 92 г свободного основания. Ha DSC видна широкая эндотерма при 98,2 С.IR (см-1): 3551,1, 3117,7, 2978,0, 2947,6, 2863,7, 2821,3, 2777,1, 1735,3, 1672,0, 1630,2, 1575,5, 1534,4,1456,4, 1432,1, 1397,4, 1234,4, 1211,4, 1146,2, 884,1, 779,8, 692,8 и 661,2. Пример 3. Афатиниб в виде свободного основания в форме С. 5,3 мл (51,0 ммоль) концентрированной соляной кислоты и 5,7 мл воды добавляли в круглодонную колбу объемом 25 мл с магнитной иглой и азотным баллоном и перемешивали при 30 С. Через 7 мин добавляли 5,75 мл (29,4 ммоль) (диметиламино)ацетальдегид-диэтилацеталя в течение 5 мин при 30 С. Во время добавления выделялся газ; смесь превратилась в прозрачный бесцветный раствор. Раствор перемешивали в течение ночи при комнатной температуре. Полученный таким образом раствор называли реагентом "А". 6,5 г (11,75 ммоль) диэтил (4-(3-хлор-4-фторфениламино)-7-(S)-(тетрагидрофуран-3-илокси)хиназолин-6-илкарбамоил)метил)фосфоната, 0,51 г (11,75 ммоль) безводного хлорида лития и 30 мл ТГФ добавляли в круглодонную двугорлую колбу объемом 250 мл с магнитной иглой, термометром и азотным баллоном. Получали прозрачный раствор. Смесь охлаждали до -6 С на льдосоляной бане и в течение 15 минут добавляли холодный раствор гидроксида калия (5,1 г, 90 ммоль гранул КОН растворяли в 26 мл воды и держали при -18 С в течение 1 ч). К реакционной смеси по каплям добавляли реагент "А" в течение 1 ч при температуре -7 С, и затем реакционную смесь перемешивали в течение 1 ч при той же температуре. Льдосоляную баню заменяли на баню с холодной водой, в которой реакционная смесь постепенно нагревалась до 20 С в течение 30 мин. К реакционной смеси добавляли 25 мл воды. Смесь экстрагировали 360 мл этилацетата, высушивали на сульфате натрия и испаряли при 40 С под вакуумом, в результате чего получали твердое вещество. К этому твердому веществу прибавляли 200 мл воды, смесь перемешивали в течение 1,5 ч. Осадок отфильтровывали, промывали 200 мл воды и сушили на роторном испарителе при 40 С под вакуумом, в результате чего получали 6,9 г твердого вещества. 6,35 г этого неочищенного продукта очищали с помощью колоночной хроматографии на оксиде кремния с использованием градиента от хлороформа до 4% МеОН в хлороформе. К 388 мг полученного таким образом свободного основания добавляли 5 мл метилциклогексана и смесь перемешивали на масляной бане при 130 С в течение 20 мин. Далее добавляли еще 5 мл метилциклогексана и 4 мл н-бутилацетата. После горячей фильтрации фильтрат остывал до комнатной температуры, после чего его перемешивали в течение 2,5 ч. Преципитированный осадок отфильтровывали и высушивали на роторном испарителе при 40 С в течение 3 ч, в результате чего получали 258 мг продукта грязно-белого цвета. На DSC видны два широких перекрывающихся эндотермических пика при 95,1 С и 100,7 С.IR (см-1): 3545,2, 3340,5, 2980,1, 2946,7, 2775,2, 1736,1, 1672,0, 1632,2, 1575,1, 1536,6, 1500,1, 1458,1,1400,4, 1340,7, 1243,1, 1212,0, 1149,4, 1084,2, 970,1, 883,1, 852,3, 780,6, 692,6, 661,3 и 540,2. Пример 4. Афатиниб в виде свободного основания в форме D. 0,7 мл (7,6 ммоль) концентрированной соляной кислоты и 0,7 мл воды добавляли в круглодонную колбу объемом 5 мл с магнитной иглой и азотным баллоном и перемешивали при 30 С. Через 10 мин добавляли 0,7 мл (3,4 ммоль) (диметиламино)ацетальдегид-диэтилацеталя в течение 20 мин при 30 С. Во время добавления выделялся газ; смесь превратилась в прозрачный бесцветный раствор. Смесь перемешивали в течение 3,5 ч при 35 С. Полученный таким образом раствор называли реагентом "А". 0,8 г (1,4 ммоль) диэтил (4- (3-хлор-4-фторфениламино)-7-(S)-(тетрагидрофуран-3-илокси) хиназолин-6-илкарбамоил)метил)фосфоната, 0,06 г (1,4 ммоль) безводного хлорида лития и 4 мл ТГФ добавляли в круглодонную двугорлую колбу объемом 50 мл с магнитной иглой и азотным баллоном. Реакционную смесь перемешивали при комнатной температуре в течение 5 мин, а затем охлаждали до -5 С в течение 15 мин на льдосоляной бане. Добавляли холодный раствор гидроксида калия (0,63 г гранул KOH растворяли в 3,2 мл воды и держали при -18 С в течение 1 ч). К реакционной смеси добавляли реагент"А" при температуре -7 С в течение 3 мин; полученную реакционную смесь перемешивали при -5 С в течение 1 ч. Льдосоляную баню заменяли на баню с холодной водой при 17 С. Реакционную смесь охлаждали до 2 С и добавляли 29 мл воды в течение 30 мин. Осадок отфильтровывали, промывали 20 мл воды и высушивали на воронке Бюхнера. Далее осадок высушивали при комнатной температуре под вакуумом в течение 16 ч, в результате чего получали 0,62 г (90%, 1,3 ммоль) твердого вещества грязнобелого цвета. К 0,45 г полученного таким образом свободного основания добавляли 3 мл н-бутилацетата; смесь перемешивали при 140 С в течение 20 мин, в результате чего получали прозрачный раствор. Раствор остывал до комнатной температуры в течение 30 мин. Добавляли смесь н-бутилацетата и метилциклогексана (4 мл, 1:3), и перемешивали смесь в течение 15 мин. Образовавшийся осадок отфильтровывали, промывали 8 мл метилциклогексана и высушивали на роторном испарителе при 50 С под вакуумом в течение 3,3 ч, в результате чего получали 415 мг твердого вещества грязно-белого цвета. На DSC видна эндотерма при 98,2 С.IR (см-1): 3551,1, 3117,7, 2978,0, 2947,6, 2863,7, 2821,3, 2777,1, 1735,3, 1672,0, 1630,2, 1575,5, 1534,4,1456,4, 1432,1, 1397,4, 1234,4, 1211,4, 1146,2, 884,1, 779,8, 692,8 и 661,2. Пример 5. Афатиниба дималеат форма В. К 200 мг (0,41 ммоль) афатиниба в форме свободного основания добавляли 0,5 мл ТГФ и смесь перемешивали при комнатной температуре до получения раствора светло-желтого цвета. В течение 2 мин добавляли раствор 100 мг (0,8 ммоль) яблочной кислоты в 0,5 мл ТГФ. Далее добавляли еще 4 мл ТГФ и перемешивали смесь в течение 1 ч. Осадки отфильтровывали, промывали 2 мл ТГФ и высушивали на роторном испарителе при 48 С/3 мбар в течение 6 ч, в результате чего получали 0,245 г (выход 83%) твердого вещества белого цвета. На DSC видна экзотерма при 129,5 С и далее второстепенная эндотерма при 156,8 С и главная эндотерма при 17 3,9 С. Данные XRPD подтверждают кристаллическую природу вещества.IR (см-1): 3321,2, 3034,0, 1687,6, 1643,6, 1498, 1456,6, 1353,4, 1268,4, 1067,5, 869,0, 780, 654,7 и 576,4. Остаточный растворитель: ТГФ=3390 м.д. Пример 6. Афатиниба дибензолсульфонат. К 200 мг (0,41 ммоль) афатиниба в виде свободного основания добавляли 2 мл этанола и раствор перемешивали при 70 С в течение 15 мин. В течение 2 мин при 70 С добавляли раствор 130 мг (0,8 ммоль) бензолсульфоновой кислоты в 1 мл этанола, далее раствор перемешивали в течение 10 мин. После выключения нагрева раствор остывал до комнатной температуры в течение 2,5 ч. Добавляли 2,5 мл диэтилового эфира и раствор концентрировали до сухости. Добавляли 3 мл этилацетата и отфильтровывали осадок. После сушки при 50 С и 5 мбар в течение 5 ч получали 0,21 г (63,6%, 0,3 ммоль) твердого вещества светло-желтого цвета.IR (см-1): 3050,7, 1691,1, 1637,3, 1577, 1523,9, 1498,3, 1448,2, 1219,4, 1124,0, 1068,8, 1034,4, 1016,7,997, 728,2, 694,8, 612,3 и 565,7. Остаточный растворитель: этилацетат = 0,74%. Пример 7. Афатиниба фумарат форма А. К 200 мг (0,41 ммоль) афатиниба в виде свободного основания добавляли 2 мл этанола и раствор перемешивали при 70 С до получения светло-желтого раствора. В течение 2 мин при 70 С добавляли раствор 100 мг (0,8 ммоль) фумаровой кислоты в 2,5 мл этанола и раствор перемешивали в течение 10 мин. Прекращали нагрев и давали смеси остыть до комнатной температуры. Добавляли 2,5 мл диэтилового эфира, в результате чего получали мутный раствор. Реакционную смесь перемешивали в течение 1 ч, в результате чего получали осадок. Осадок отфильтровывали, просушивали при 48 С и 5 мбар, и получали 0,2 г (67,7%, 0,3 ммоль) твердого вещества грязно-белого цвета. На DSC видны два широких эндотермических пика при 67,3 С и 126,8 С и широкий экзотермический пик при 169,0 С.IR (см-1): 2982,5, 1679,7, 1530,5, 1499,8, 1428,4, 1214,1, 1144,5, 980,0, 672,8 и 540,2. Остаточный растворитель: этанол = 3,26%, диэтиловый эфир = 547 м.д. 1 Н NMR указывает на присутствие монофумарата. Пример 8. Афатиниба дисульфат форма А. К 200 мг (0,41 ммоль) афатиниба в форме свободного основания добавляли этилацетат (2 мл) и смесь перемешивали при комнатной температуре, в результате чего получали раствор светло-желтого цвета. Добавляли раствор 0,09 мл (1,6 ммоль) серной кислоты в 1 мл этилацетата при комнатной температуре в течение 2 мин. Сразу после добавления кислоты наблюдали выпадение осадка. Наблюдали вяз- 27024026 кое твердое вещество. Добавляли 3 мл этилацетата и перемешивали в течение 2,5 ч. Осадок отфильтровывали и высушивали на роторном испарителе при 50 С/3 мбар в течение 3 ч, в результате чего получали 263 мг (94%) твердого вещества светло-желтого цвета. На DSC виден узкий эндотермический пик при 127,2 С.IR (см-1): 3029,6, 1636,3, 1572,7, 1497,8, 1231,9, 1055,3, 882,4 и 581. Остаточный растворитель: этанол = 1,13%, этилацетат = 1,27%. Пример 9. Афатиниба дисульфат форма В. К 200 мг (0,4 ммоль) афатиниба в виде свободного основания добавляли 1,5 мл смеси этанола с водой (99:1) и перемешивали светло-желтый раствор при 50 С в течение 15 мин. В течение 2 мин добавляли раствор 85 мг (0,8 ммоль) H2SO4 в 0,5 мл смеси этанола с водой (99:1). После добавления кислоты выпадал осадок. Добавляли еще 0,5 мл смеси этанола с водой (99:1) и перемешивали смесь при 85 С в течение 5 мин до получения прозрачного раствора. Через 15 мин выключали нагрев и смесь остывала до комнатной температуры. Через 1 ч реакционную смесь разводили 1 мл смеси этанола с водой (99:1), осадок отфильтровывали, высушивали на роторном испарителе при 5 мбар в течение 5,5 ч, в результате чего получали 200 мг (72%) твердого вещества грязно-белого цвета.IR (см-1): 3295,9, 1695,5, 1637,8, 1573,2, 1497,1, 1449,6, 1268,7, 1216,9, 1197,8, 1050,8, 874,1, 776,4 и 583,1. Остаточный растворитель: этанол - не обнаружено. Пример 10. Афатиниба дигидрохлорид форма А. К 200 мг (0,41 ммоль) афатиниба в виде свободного основания добавляли 2 мл изопропилового спирта и перемешивали светло-желтый раствор в течение 5 мин при комнатной температуре. В течение 4 мин добавляли 1,5 мл раствора HCl в изопропиловом спирте. Наблюдали выпадение осадка, разводили смесь 1 мл изопропилового спирта и перемешивали при комнатной температуре в течение 1,25 ч. Реакционную смесь далее разводили 3 мл изопропилового спирта, осадок отфильтровывали и высушивали на роторном испарителе при 50 С/3 мбар в течение 7 ч, в результате чего получали 184 мг (80%) твердого вещества желтого цвета.IR (см-1): 2961,6, 1680,8, 1633,5, 1572,7, 1523,4, 1499, 1477,8, 1266,0, 1067,2, 887,4 и 778,3. Остаточный растворитель: изопропиловый спирт = 1,87%; этилацетат = 729 м.д. Пример 11. Афатиниба диоксалат форма А. К 200 мг (0,41 ммоль) афатиниба в виде свободного основания добавляли 3 мл этанола и смесь нагревали до 40 С до получения светло-желтого раствора. Добавляли раствор 70 мг (0,8 ммоль) щавелевой кислоты в 1 мл этанола при 40 С и нагревали реакционную смесь в условиях оттока в течение 50 мин. После остывания реакционной смеси до температуры окружающей среды добавляли 3 мл этанола. Осадок отфильтровывали и высушивали при 60 С/3 мбар в течение 5,5 ч, в результате чего получали 215 мг(78%) твердого вещества грязно-белого цвета. На DSC видна узкая эндотерма при 185,4 С и экзотерма при 190,7 С.IR (см-1): 3041,5, 2867, 1776,2, 1702, 1640,3, 1522,9, 1500,1, 1454, 1402,6, 1329,1. Пример 12. Афатиниба димезилат форма А. К 200 мг (0,41 ммоль) афатиниба в виде свободного основания добавляли 2 мл этилацетата и перемешивали светло-желтый раствор при комнатной температуре. Добавляли раствор 80 мг (0,8 ммоль) метансульфоновой кислоты в 1 мл этилацетата при комнатной температуре в течение 2 мин. Наблюдали выпадение осадка и добавляли еще 4 мл этилацетата. После перемешивания в течение 40 мин при комнатной температуре осадок отфильтровывали, промывали 3 мл этилацетата и высушивали при 48 С/3 мбар в течение 4,5 ч, в результате чего получали 257 мг (92%) твердого вещества светло-желтого цвета. Температура плавления=180-188 С.IR (см-1): 3018,1, 1692,8, 1638,5, 1498,5, 1455, 1367,2, 1271,4, 1207,8, 1194,4, 1058,9, 783,9 и 554,7. Остаточный растворитель: этилацетат = 46,3 м.д. Пример 13. Афатиниба димезилат форма В. К 200 мг (0,41 ммоль) афатиниба в виде свободного основания добавляли 1,5 мл смеси этанола с водой (99:1) и перемешивали светло-желтый раствор при 70 С в течение 5 мин. Добавляли раствор 80 мг(0,8 ммоль) метансульфоновой кислоты в 0,5 мл смеси этанола с водой (99:1) в течение 2 мин. Далее добавляли еще 0,5 мл смеси этанола с водой (99:1) и продолжали перемешивать в течение 15 мин. Нагрев выключали, и смесь остывала до комнатной температуры. Смесь перемешивали в течение 15 часов до получения плотного твердого вещества. Реакционную смесь разводили 4 мл смеси этанола с водой (99:1),осадок отфильтровывали и высушивали на роторном испарителе при 3 мбар в течение 4,5 ч, в результате чего получали 190 мг (68%) твердого вещества грязно-белого цвета. На DSC наблюдается широкий эндотермический пик при 106,1 С и эндотермический пик при 182,5 С и 191,5 С.IR (см-1): 3018,1, 1692,8, 1638,5, 1498,5, 1455, 1367,2, 1271,4, 1207,8, 1194,4, 1058,9, 783,9 и 554,7. IR отличается от 043/190. Остаточный растворитель: этанол = 779 м.д. Пример 14. Афатиниба дифосфат аморфный. К 200 мг (0,41 ммоль) афатиниба в виде свободного основания добавляли 2 мл этилацетата и пере- 28024026 мешивали светло-желтый раствор при комнатной температуре. Добавляли раствор 80 мг (0,8 ммоль) фосфорной кислоты в 1 мл этилацетата в течение 2 мин при комнатной температуре. Наблюдали выпадение осадка, добавляли еще 5 мл этилацетата и продолжали перемешивать при комнатной температуре в течение 50 мин. Осадок отфильтровывали, промывали 3 мл этилацетата и высушивали при 48 С/3 мбар в течение 5 ч, в результате чего получали 289 мг (93%) твердого вещества светло-желтого цвета.IR (см-1): 2879,6, 1741,1, 1684,6, 1639,4, 1574,8, 1498,0, 1455,3, 1265,1, 965,6 и 778,2. Остаточный растворитель: этилацетат = 4,91%. Пример 15. Афатиниба дифосфат форма А. К 200 мг (0,41 ммоль) афатиниба в виде свободного основания добавляли 1,5 мл смеси этанола с водой (99:1) и перемешивали светло-желтый раствор при 80 С в течение 10 мин. В течение 2 мин при 80 С добавляли раствор 80 мг (0,8 ммоль) фосфорной кислоты в 0,5 мл смеси этанола с водой (99:1). Далее добавляли еще 1,5 мл смеси этанола с водой (99:1) и продолжали перемешивать в течение 25 мин. После остывания реакционной смеси до комнатной температуры ее разводили 3 мл смеси этанола с водой (99:1). Через 1,5 ч осадок отфильтровывали и высушивали на роторном испарителе при 3 мбар/52 С в течение 5 ч, в результате чего получали 250 мг (85%) твердого вещества грязно-белого цвета. На DSC наблюдается второстепенный эндотермический пик при 109,3 С, небольшой экзотермический пик при 145,3 С и эндотермический пик при 166,1 С и экзотермический пик при 178,3 С.IR (см-1): 3018,1, 1692,8, 1638,5, 1498,5, 1455, 1367,2, 1271,4, 1207,8, 1194,4, 1058,9, 783,9 и 554,7. Остаточный растворитель: этанол 5000 м.д. Пример 16. Афатиниба ди-L-малат аморфный. К 200 мг (0,41 ммоль) афатиниба в виде свободного основания добавляли 2 мл этилацетата и перемешивали светло-желтый раствор при комнатной температуре. В течение 2 мин при комнатной температуре добавляли раствор 110 мг (0,8 ммоль) L-яблочной кислоты в 3 мл этилацетата. После выпадения осадка добавляли 5 мл этилацетата. Смесь перемешивали при комнатной температуре в течение 1 ч. Осадок отфильтровывали, промывали 2 мл этилацетата и высушивали при 48 С/3 мбар в течение 6 ч, в результате чего получали 251 мг (80,7%) твердого вещества светло-желтого цвета.IR (см-1): 2983,9, 1719,3, 1535,8, 1498,4, 1263,8, 879,4 и 778,2. Остаточный растворитель: этилацетат = 5,37%. Пример 17. Афатиниба цитрат аморфный. К 100 мг (0,205 ммоль) афатиниба в виде свободного основания добавляли 2 мл этанола и перемешивали светло-желтый раствор при комнатной температуре. В течение 2 мин добавляли раствор 39,4 мг(0,205 ммоль) лимонной кислоты в 0,5 мл этанола. Далее добавляли еще 0,5 мл этанола. Наблюдали выпадение осадка и перемешивали смесь в течение 15 мин. Осадок отфильтровывали, промывали 0,5 мл этанола и высушивали на роторном испарителе при 50 С в течение 2 ч, в результате чего получали 80 мг(57%) твердого вещества светло-желтого цвета. На DSC отчетливых пиков не наблюдалось.IR (см-1): 2972,8, 1717,1, 1625,3, 1576,2, 1535,5, 1498,6, 1213,1, 879,3 и 778,9. Пример 18. Афатиниба дисукцинат форма А. К 200 мг (0,41 ммоль) афатиниба в виде свободного основания добавляли 2 мл этилацетата и перемешивали светло-желтый раствор при комнатной температуре. В течение 2 мин добавляли раствор 100 мг (0,8 ммоль) янтарной кислоты в 2 мл этанола. Смесь перемешивали в течение 6,5 ч и концентрировали до 1 мл. К этому осадку добавляли 3 мл этилацетата и полученную смесь перемешивали при комнатной температуре в течение 1,5 ч. Осадок отфильтровывали, промывали 2 мл этилацетата и высушивали при 50 С/4 мбар в течение 5 ч, в результате чего получали 225 мг (75,7%) твердого вещества грязно-белого цвета. На DSC видны два эндотермических пика при 97,1 С и 103,7 С и широкий экзотермический пик при 157,3 С.IR (см-1): 3002,7, 1934,7, 1738,7, 1709,0, 1626, 1581,3, 1532,6, 1494,6, 1428,2, 1210,3, 979,1, 797,8,654,0 и 532. Остаточный растворитель: этилацетат = 4,22%, этанол = 0,43%. Пример 19. Афатиниба ди-L-аспартат форма А. К 110 мг (0,8 ммоль) L-аспарагиновой кислоты добавляли 4 мл воды и перемешивали смесь при 110 С. Добавляли раствор 200 мг (0,41 ммоль) афатиниба в виде свободного основания в 1 мл ТГФ. Смесь перемешивали в течение 30 мин. Нагрев выключали, и смесь остывала до комнатной температуры. Добавляли еще 2 мл ТГФ и продолжали перемешивать при комнатной температуре. Через неделю смесь концентрировали на роторном испарителе, в результате чего получали 0,3 г (выход 97%) твердого вещества светло-желтого цвета.Ha DSC видны эндотермические пики при 134,8 С, 158,8 С, 167,5 С, 222,1 С и 255,3 С.IR (см-1): 3411,4, 2986,7, 1688, 1625,5, 1534,4, 1498,2, 1425,9, 1208,6, 1054, 899,9, 659,3 и 552,1. Остаточный растворитель: ТГФ = не обнаружено. Пример 20. Афатиниба дифумарат. К 200 мг (0,41 ммоль) афатиниба в виде свободного основания добавляли 1 мл смеси этанола с во- 29
МПК / Метки
МПК: C07D 405/12, A61K 31/517, A61P 35/00
Метки: соли, полиморфные, новые, афатиниба, формы
Код ссылки
<a href="https://eas.patents.su/30-24026-novye-soli-i-polimorfnye-formy-afatiniba.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соли и полиморфные формы афатиниба</a>
Предыдущий патент: Паропроницаемый ботинок с водонепроницаемой и паропроницаемой подошвой
Следующий патент: Устройство и способ поперечной резки непрерывно движущейся ленты
Случайный патент: Каталитическая конверсия диоксида углерода в смесь синтез-газа












