Производное аминоалкилзамещенного n-тиенилбензамида
Номер патента: 23955
Опубликовано: 29.07.2016
Авторы: Сато Иппеи, Кага Дайсуке, Терада Йох, Миура Масанори, Исомура Маи, Ватануки Сусуму, Хатия Сунитиро, Окуда Такао, Тераи Казухиро
Формула / Реферат
1. Соединение формулы (I) или его соль, или его гидрат
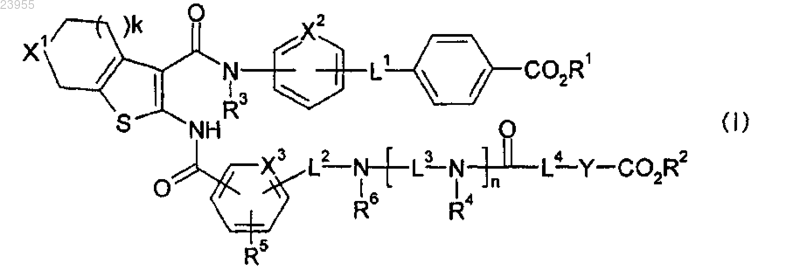
где X1 представляет собой СН2 или О,
k равно 1, 2 или 3,
R3 представляет собой Н или C1-6алкил,
X2 представляет собой СН или N,
L1 представляет собой C1-6алкилен,
R1 представляет собой Н или C1-6алкил,
X3 представляет собой СН или N,
L2 представляет собой C1-6алкилен,
R5 представляет собой Н или C1-6алкил,
R6 представляет собой C1-6 алкил или С3-10 циклоалкил,
R0 представляет собой Н или С1-6 алкил,
L3 представляет собой C1-6алкилен,
n равно 0 или 1,
R4 представляет собой Н, C1-6алкил или С1-6 алкилен-OR0,
L4 представляет собой связь, О или -NR0-,
Y представляет собой C1-6 алкилен, который может быть замещен гидроксильной группой, и
R2 представляет собой Н или С1-6 алкил.
2. Соединение или его соль, или его гидрат по п.1, где в формуле (I) n равно 1.
3. Соединение или его соль, или его гидрат по п.2, где в формуле (I) X1 представляет собой СН2 и k равно 1.
4. Соединение или его соль, или его гидрат по п.3, где в формуле (I) оба X2 и X3 представляют собой СН.
5. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из
4-(2-{4-[({2-[(3-{[{2-[(3-карбоксипропаноил)(метил)амино]этил}(пентан-3-ил)амино]метил}бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил}карбонил)амино]фенил}этил)бензойной кислоты,
4-(2-{4-[({2-[(3-{[(2-{[(карбоксиметокси)карбонил](метил)амино}этил)(пентан-3-ил)амино]метил}бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил}карбонил)амино]фенил}этил)бензойной кислоты,
4-(2-{4-[({2-[(3-{[{2-[(4-карбокси-4-метилпентаноил)(метил)амино]этил}(пентан-3-ил)амино]метил}бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил}карбонил)амино]фенил}этил)бензойной кислоты,
4-(2-{4-[({2-[(3-{[{3-[(3-карбоксипропаноил)(метил)амино]пропил}(пентан-3-ил)амино]метил}бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил}карбонил)амино]фенил}этил)бензойной кислоты,
4-(2-{4-[({2-[(3-{[{2-[(3-карбоксипропаноил)(2-метоксиэтил)амино]этил}(пентан-3-ил)амино]метил}бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил}карбонил)амино]фенил}этил)бензойной кислоты,
4-(2-{4-[({2-[(3-{[(4-карбокси-4-метилпентаноил)(пентан-3-ил)амино]метил}бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил}карбонил)амино]фенил}этил)бензойной кислоты и
4-(2-{4-[({2-[(3-{[(4-карбокси-3,3-диметилбутаноил)(пентан-3-ил)амино]метил}бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил}карбонил)амино]фенил}этил)бензойной кислоты,
или его соль, или его гидрат.
6. Фармацевтическая композиция, содержащая соединение или его соль, или его гидрат по п.5 и фармацевтически приемлемый эксципиент.
7. Фармацевтическая композиция по п.6, которая предназначена для лечения или предупреждения гиперфосфатемии.
8. Применение соединения по п.5 или его соли, или его гидрата для получения фармацевтической композиции для лечения или предупреждения гиперфосфатемии.
9. Применение соединения по п.5 или его соли, или его гидрата для предупреждения или лечения гиперфосфатемии.
10. Способ предупреждения или лечения гиперфосфатемии, включающий введение эффективного количества соединения или его соли, или его гидрата по п.5 субъекту.
11. Соединение по п.5, где указанное соединение является 4-(2-{4-[({2-[(3-{[{2-[(3-карбоксипропаноил)(метил)амино]этил}(пентан-3-ил)амино]метил}бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил}карбонил)амино]фенил}этил)бензойной кислотой или ее солью, или ее гидратом.
12. Соединение по п.5, где указанное соединение является 4-(2-{4-[({2-[(3-{[{2-[(3-карбоксилатопропаноил)(метил)амино]этил}(пентан-3-ил)амино]метил}бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил}карбонил)амино]фенил}этил)бензоатом магния или его гидратом.
13. Соединение по п.5, где указанное соединение является 4-(2-{4-[({2-[(3-{[(2-{[(карбоксиметокси)карбонил](метил)амино}этил)(пентан-3-ил)амино]метил}бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил}карбонил)амино]фенил}этил)бензойной кислотой или ее солью, или ее гидратом.
14. Соединение по п.5, где указанное соединение является 4-(2-{4-[({2-[(3-{[{2-[(3-карбоксипропаноил)(2-метоксиэтил)амино]этил}(пентан-3-ил)амино]метил}бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил}карбонил)амино]фенил}этил)бензойной кислотой или ее солью, или ее гидратом.
15. Соединение по п.5, где указанное соединение является 4-(2-{4-[({2-[(3-{[(2-{[(карбоксилатометокси)карбонил](метил)амино}этил)(пентан-3-ил)амино]метил}бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил}карбонил)амино]фенил}этил)бензоатом магния или его гидратом.
Текст
Предлагается соединение, которое обладает действием по ингибированию переносчика кишечного фосфата (NPT-IIb) и является применимым в качестве активного ингредиента агента для лечения и/или предупреждения гиперфосфатемии. Авторы настоящего изобретения провели исследования в отношении соединения, которое обладает ингибирующим NPT-IIb действием и является применимым в качестве активного ингредиента агента для лечения и/или предупреждения гиперфосфатемии. В результате они разработали производное аминоалкилзамещенного Nтиенилбензамида формулы (I) в которой все заместители имеют значения, раскрытые в формуле изобретения, которое обладает ингибирующим NPT-IIb действием, тем самым завершив настоящее изобретение. Производное аминоалкилзамещенного N-тиенилбензамида настоящего изобретения обладает ингибирующимNPT-IIb действием, и его можно применять в качестве агента для предупреждения или лечения гиперфосфатемии. Область техники, к которой относится изобретение Изобретение относится к производному аминоалкилзамещенного N-тиенилбензамида, применимому в качестве активного ингредиента фармацевтической композиции, например фармацевтической композиции для лечения гиперфосфатемии. Уровень техники Фосфор является важным элементом в поддержании жизни и играет очень важную роль в различных физиологических функциях. Фосфор поглощается в форме фосфата через желудочно-кишечный тракт из пищи, и наибольшая часть фосфора экскретируется путем включения в мочу, тем самым поддерживается и регулируется его общее количество в живом организме. Известно, что в процессе образования мочи значительная часть фосфата фильтруется у почечных клубочков, и только его необходимое количество реабсорбируется в канальцах. Соответственно, если способность к фильтрации почечных клубочков уменьшается, когда почечная недостаточность прогрессирует, экскреция фосфора становится недостаточной, и это вызывает аномальное повышение уровня фосфора в сыворотке крови, то есть вызывает гиперфосфатемию. Поэтому считается, что гиперфосфатемия, которая индуцирует различные осложнения при почечной недостаточности, является показателем снижения QOL (качества жизни) у пациента с почечной недостаточностью из-за переломов и боли в костях или фактором смерти пациента с почечной недостаточностью вследствие сердечно-сосудистых заболеваний, являющихся результатом сердечно-сосудистой кальцификации. Следовательно, гиперфосфатемия является очень важной проблемой в клинической практике ("KDIGO Clinical Guideline for the Diagnosis, Evaluation, Prevention, andTreatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD", Kidney International, 76,Supplement 113 (2009. В настоящее время для лечения гиперфосфатемии применяют агенты связывания фосфата, например различные препараты солей кальция, представленные осажденным карбонатом кальция, полимеры,представленные гидрохлоридом севеламера, или препараты солей металлов, таких как. карбонат лантана,гидроксид алюминия, и препараты железа. Однако эти лекарственные средства имеют различные проблемы, такие как соблюдение указаний по правилам приема малых доз вследствие потребности в приеме нескольких граммов в день, желудочно-кишечные симптомы, такие как запор и диарея, повышение уровней кальция в сыворотке крови и аккумуляция различных металлов. Поэтому требуется разработка нового агента для лечения гиперфосфатемии, который улучшает указанные выше факторы (там же). Считается, что агенты переноса фосфора, присутствующие в мембране каемчатого эпителия желудочно-кишечного тракта и почечных канальцах, принимают участие в абсорбции и экскреции фосфора. До настоящего времени описано большое число агентов переноса фосфата. Среди них NPT-IIb играет основную роль в абсорбции фосфата в желудочно-кишечном тракте, и NPT-IIa играет основную роль в реабсорбции фосфата в почках. Кроме того, описано, что эти молекулы являются агентами переноса натрия и фосфата. В этом отношении указывалось, что, если функция NPT-IIb ингибируется, абсорбция фосфора из желудочно-кишечного тракта может подавляться (Journal of the American Society of Nephrology, 20: p 2348-2358 (2009. Проводят исследование лекарственного средства для лечения гиперфосфатемии, основанного на этом механизме действия, и описано, что, например, соединение, представленное нижеследующей общей формулой, является соединением, обладающим ингибирующим NPT-IIb действием (патентный документ 1).(В формуле А представляет собой 5-9-членную ненасыщенную карбоциклическую часть или ненасыщенную гетероциклическую часть, когда карбоциклическая часть или гетероциклическая часть, представленная А, замещена двумя C1-6 акильными группами или С 2-6 алкенильными группами, эти алкильные группы или алкенильные группы могут образовывать 5-7-членный ненасыщенный карбоцикл в комбинации с атомами углерода, с которыми эти группы связаны; R5 представляет собой арильную группу или т.п., которая может быть замещена; R101 и R102 в комбинации представляют собой =O, R103 и R104 представляют собой водород или т.п., и Z представляет собой следующую группу (А), (В) или (С), в которойR6 и R7 могут быть одинаковыми или отличными друг от друга и представляют собой атом водорода,арильную группу или т.п., и R17 представляет собой атом водорода. Что касается других символов в формуле, см. соответствующее официальное издание). Кроме этого, в качестве соединений, которые обладают ингибирующим NPT-IIb действием и которые применяют для предотвращения или лечения гиперфосфатемии, описаны производное триазола (патентный документ 2) и производное хиназолона (патентный документ 3). Кроме того, описано производное тетрагидротиофена, которое имеет карбониламиногруппу в 2 положении и карбамоильную группу в 3-положении. Например, описано, что производное тетрагидробензотиофена, представленное следующей общей формулой, обладает антивирусной активностью (патентный документ 4). В формуле X представляет собой N(R') или атом кислорода, R1 и R2 образуют кольцо в сочетании со связанными с ними атомами, у равно 0-3, R3 представляет собой замещенный карбоцикл или гетероцикл или т.п., R4 представляет собой N(R')-С(О)-R7 или т.п., R7 представляет собой замещенный карбоцикл или гетероцикл или т.п., и R' представляет собой атом водорода или низший алкил. Что касается других символов в формуле, см. соответствующее официальное издание). Описано, что производное тетрагидробензотиофена, представленное следующей общей формулой,обладает антивирусным действием (патентный документ 5).(в формуле Ra представляет собой атом водорода, алкильную группу или т.п., которая может быть замещена, Rb представляет собой -C(O)-Rb1 или т.п., которая может быть замещена, Rb1 представляет собой амино, аминоалкил, карбоцикл, гетероцикл или т.п., который может быть замещен, Rc представляет собой -С(O)-Rb1 или т.п., который может быть замещен, и Rd и Re представляют собой карбоцикл, гетероцикл, образованный их сочетанием с атомами, связанными с ними, или т.п., который может быть замещен. Что касается других символов в формуле, см. соответствующее официальное издание). Описано, что производное тетрагидробензотиофена, представленное следующей формулой, обладает противоопухолевым действием (патентный документ 6).(в формуле W представляет собой атом углерода или атом азота, А представляет собой 5-14 членный циклоалкил, гетероарил или т.п., который может быть замещен, Y представляет собой -NR1R2 или т.п., X представляет собой -C(O)NR5R6 или т.п., R1 представляет собой атом водорода или низший алкил, R2 представляет собой -C(O)R10 или т.п., R10 представляет собой арил, гетероарил или т.п., который может быть замещен, R5 представляет собой арил, гетероарил или т.п., который может быть замещен, и R6 представляет собой атом водорода или т.п. Что касается других символоз в формуле, см. соответствующее официальное издание). Однако, ни в одном из патентных документов 4-6 не описано или не предложено, что эти соединения обладают ингибирующей NPT-IIb активностью или их можно применять для предотвращения или лечения гиперфосфатемии. Родственная область техники Патентные документы[Патентный документ 1] Проспект международной публикации WO2004/085382.[Патентный документ 2] Проспект международной публикации WO2003/048134.[Патентный документ 4] Проспект международной публикации WO2006/026619.[Патентный документ 5] Проспект международной публикации WO2006/093518.[Патентный документ 6] Проспект международной публикации WO2006/044826. Описание изобретения Проблемы, которые решает изобретение Настоящее изобретение относится к производному аминоалкилзамещенного N-тиенилбензамида,применяемому в качестве активного ингредиента фармацевтической композиции, например фармацевтической композиции для лечения гиперфосфатемии. Способы решения проблем Авторы настоящего изобретения провели полное исследование с целью разработки соединения, обладающего ингибирующим NPT-IIb действием. В результате ими обнаружено, что соединение Nтиенилбензамида, имеющее характеристический заместитель у ароматического кольца бензамида, обладает ингибирующим NPT-IIb действием и действием ингибирования абсорбции фосфора из кишечного тракта, тем самым завершив настоящее изобретение. То есть настоящее изобретение относится к соединению формулы (I) или его соли и фармацевтической композиции, содержащей соединение формулы (I) или его соль и эксципиент. [Хим. формула 6]X1 представляет собой СН 2 или О,k равно 1, 2 или 3,R3 представляет собой Н или C1-6 алкил,X2 представляет собой СН или N,L1 представляет собой C1-6 алкилен,R1 представляет собой Н или C1-6 алкил,X3 представляет собой СН или N,L2 представляет собой C1-6 алкилен,R5 представляет собой Н или C1-6 алкил,R6 представляет собой Н, C1-6 алкил -С 3-10 циклоалкила, где гетероцикл, фенил и циклоалкил могут быть замещены одним или двумя низшими алкилами или С(О)-низшим алкилом, и -R30 может быть замещен одним -OR0,R0 представляет собой Н или C1-6 алкил,L3 представляет собой низший алкилен,n равно 0 или 1,R4 представляет собой Н, C1-6 алкил, -C1-6 алкилен-OR0,L4 представляет собой связь, О или -NR0-,Y представляет собой C1-6 алкилен, который может быть замещен гидроксильной группой, иR2 представляет собой Н или C1-6 алкил). Кроме того, если не указано иное, когда символы в некоторой химической формуле в настоящем описании изобретения используют также в другой химической формуле, одинаковые символы имеют одинаковые значения. Настоящее изобретение относится также к фармацевтической композиции, содержащей соединение формулы (I) или его соль, конкретно, фармацевтической композиции для лечения или предотвращения гиперфосфатемии. Кроме того, фармацевтическая композиция включает агент для лечения гиперфосфатемии, содержащий соединение формулы (I) или его соль. Кроме того, настоящее изобретение относится к применению соединения формулы (I) или его соли для получения фармацевтической композиции для лечения или предотвращения гиперфосфатемии, применению соединения формулы (I) или его соли для лечения или предотвращения гиперфосфатемии, соединению формулы (I) или его соли для лечения или предотвращения гиперфосфатемии и способу лечения гиперфосфатемии, включающему введение эффективного количества соединения формулы (I) или его соли субъекту. Кроме того, термин "субъект" относится к человеку или другим животным, для которых требуется лечение или предотвращение гиперфосфатемии, и в качестве определенного варианта осуществления термин "субъект" относится к человеку, для которого требуется предотвращение или лечение гиперфосфатемии. Эффекты изобретения Соединение формулы (I) или его соль обладает ингибирующим NPT-IIb действием, и его можно применять в качестве агента для предупреждения и/или лечения гиперфосфатемии, почечной недостаточности и аномальности костного метаболизма, вызванной почечной недостаточностью. Варианты осуществления для выполнения изобретения Далее настоящее изобретение будет описано подробно. В настоящем описании изобретения термин "C1-6 алкил" относится к неразветвленному или разветвленному алкилу, имеющему 1-6 атомов углерода (ниже в настоящем описании сокращенный до обозначения C1-6), например, метилу, этилу, н-пропилу, изопропилу, н-бутилу, изобутилу, втор-бутилу, третбутилу, н-пентилу, 1-этилпропилу, н-гексилу и т.д. В качестве другого варианта осуществления алкил представляет собой метил, этил, н-пропил, изопропил, трет-бутил или 1-этилпропил, и в качестве еще одного варианта осуществления алкил представляет собой метил или 1-этилпропил."C1-6 алкилен" относится к неразветвленному или разветвленному С 1-6 алкилену, например, метилену, этилену, триметилену, тетраметилену, пентаметилену, гексаметилену, пропилену, метилметилену,этилэтилену, 1,2-диметилэтилену, 1,1,2,2-тетраметилэтилену и т.д. В качестве другого варианта осуществления низший алкилен представляет собой метилен, этилен, триметилен, тетраметилен или пентаметилен, и еще в одном варианте осуществления низший алкилен представляет собой метилен, этилен или триметилен."Циклоалкил" относится к группе насыщенного С 3-10 углеводородного кольца, которое может иметь мостик(-и), например, циклопропилу, циклобутилу, циклопентилу, циклогексилу, циклогептилу, циклооктилу, адамантилу и т.д. В качестве другого варианта осуществления циклоалкил представляет собой циклопропил, циклобутил, циклопентил или циклогексил."Гетероциклическая" группа относится к 3-15-членной, или в качестве другого варианта осуществления, 5-10-членной моно-, би- или трициклической гетероциклической группе, содержащей 1-4 гетероатома, выбранные из кислорода, серы и азота. Гетероциклическая группа включает насыщенное кольцо, ароматическое кольцо и частично гидрированное ароматическое кольцо. Атом серы или азота в качестве атома кольца могут быть окислены с образованием оксида или диоксида. Гетероциклическая группа представляет собой, в частности, моноциклический гетероарил, такой как пиридил, пирролил, пиразинил, пиримидинил, пиридазинил, имидазолил, триазолил, триазинил, тетразолил, тиазолил, пиразолил, изотиазолил, оксазолил, изоксазолил,тиадизолил, оксадиазолил, тиенил или фурил; бициклический гетероарил, такой как индолил, изоиндолил, бензимидазолил, индазолил, хинолил, изохинолил, хиназолинил, хиноксалинил, фталазинил, бензотиазолил, бензизотиазолил, бензотиадиазолил, бензоксазолил, бензизоксазолил, бензофуранил или бензотиенил; трициклический гетероарил, такой как карбазолил, дибензо[b,d]фуранил или дибензо[b,d]тиенил; неароматический моноциклический гетерсцикл, такой как азетидинил, пирролидинил, пиперидил,пиперазинил, азепанил, диазепанил, морфолинил, тиоморфолинил, тетрагидропиридинил, оксетанил,тетрагидрофуранил, тетрагидропиранил, диоксоланил, диоксанил или тетрагидротиопиранил; неароматический бициклический гетероцикл, такой как индолинил, тетрагидрохинолил, тетрагидроизохинолил,дигидробензимидазолил, тетрагидробензимидазолил, тетрагидрохиноксалинил, дигидрохиноксалинил,дигидробензоксазолил, дигидробензоксазинил, дигидробензофурил, хроманил, хроменил, метилендиоксифенил или этилендиоксифенил, или мостиковый гетероцикл, такой как хинуклидинил. В качестве другого варианта осуществления гетероциклическая группа представляет собой пиридил, тиазолил, пиразинил, пиримидинил, пиразолил, оксадиазолил, тиадиазолил, фурил, тиенил, тетрагидропиранил, тетрагидрофуранил, пирролидинил, пиперидил, пиперазинил, морфолинил или хинуклидинил. В качестве еще одного варианта осуществления гетероциклическая группа представляет собой пиридил, тетрагидрофуранил, тетрагидропиранил или пиперазинил. В настоящем описании для удобства двухвалентную или многовалентную циклическую группу, которая является группой, которая имеет множество заместителей, представляют также как одновалентную группу, такую как арил, циклоалкил или гетероцикл. Некоторые варианты осуществления настоящего изобретения содержат соединения формулы (I),описанные ниже, или их соли:(1) соединение формулы (I), в котором X1 представляет собой СН 2, в качестве другого варианта осуществления соединение, в котором X1 представляет собой О,(2) соединение формулы (I), в котором k равно 1, и в качестве другого варианта осуществления k равно 2 или 3,(3) соединение формулы (I), в котором R3 представляет собой Н,(4) соединение формулы (I), в котором X2 представляет собой СН,(5) соединение формулы (I), в котором L1 представляет собой этилен или триметилен, и в качестве другого варианта осуществления L1 представляет собой этилен,(6) соединение формулы (I), в котором R1 представляет собой Н,(7) соединение формулы (I), в котором X3 представляет собой СН,(8) соединение формулы (I), в котором R5 представляет собой Н,-4 023955(9) соединение формулы (I), в котором L2 представляет собой метилен,(10) соединение формулы (I), в котором R6 представляет собой Н, C1-6 алкил,(11) соединение формулы (I), в котором L3 представляет собой этилен или триметилен,(12) соединение формулы (I), в котором R4 представляет собой Н, C1-6 алкил или C1-6 алкилен-OR0,(13) соединение формулы (I), в котором n равно 0; в качестве другого варианта осуществления соединение, в котором n равно 1,(14) соединение формулы (I), в котором L4 представляет собой связь или О,(15) соединение формулы (I), в котором Y представляет собой C1-6 алкилен, который может быть замещен гидроксильной группой,(16) соединение формулы (I), в котором R2 представляет собой Н,(17) соединение, которое имеет одну из групп согласно указанным выше вариантам осуществления от (1) до (16) или которое является комбинацией двух или более таких групп. Что касается указанного выше варианта осуществления (17), некоторые варианты осуществления настоящего изобретения, относящиеся к формуле (I), приведены в качестве примера ниже:(18) соединение формулы (I), в котором R6 представляет собой C1-6 алкил или С 3-10 циклоалкил,(19) соединение согласно варианту осуществления (18), в котором n равно 1, и R4 представляет собой Н, C1-6 алкил или C1-6 алкилен-OR0,(20) соединение согласно варианту осуществления (19), в котором Y представляет собой C1-6 алкилен, который может быть замещен гидроксильной группой,(21) соединение согласно варианту осуществления (20), в котором X1 представляет собой СН 2, и k равно 1,(22) соединение согласно варианту осуществления (21), в котором оба из X2 и X3 представляют собой СН,(23) соединение согласно варианту осуществления (18), в котором n равно 0. Конкретные примеры соединений, включенных в настоящее изобретение, приведены в качестве примера ниже. 4-(2-4-[(2-[(3-[2-[(3-карбоксипропаноил)(метил)амино]этил(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензойная кислота,4-(2-4-[(2-[(3-[2-[(карбоксиметокси)карбонил](метил)аминоэтил)(пентан-3-ил)амино]метил бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензойная кислота,4-(2-4-[(2-[(3-[2-[(4-карбокси-4-метилпентаноил)(метил)амино]этил(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензойная кислота,4-(2-4-[(2-[(3-[3-[(3-карбоксипропаноил)(метил)амино]пропил(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензойная кислота,4-(2-4-[(2-[(3-[2-[(3-карбоксипропаноил)(2-метоксиэтил)амино]этил(пентан-3-ил)амино]метилбензоил]амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензойная кислота,4-(2-4-[(2-[(3-[(4-карбокси-4-метилпентаноил)(пентан-3-ил)амино]метилбензоил)амино]4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензойная кислота,4-(2-4-[(2-[(3-[(4-карбокси-3,3-диметилбутаноил)(пентан-3-ил)амино]метилбензоил)амино]4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензойная кислота или их соли. Соединение формулы (I) имеет таутомер или региоизомер (изомер положения), в зависимости от типа заместителей. В настоящем описание изобретения, когда соединение формулы (I) описано только в одной форме его изомеров, настоящее изобретение включает другие изомеры, выделенную форму этих изомеров или их смеси. Кроме того, соединение формулы (I) имеет асимметричные атомы углерода или хиральность оси в некоторых случаях, и на основе этих хиральностей в описании могут быть оптические изомеры. Настоящее изобретение включает выделенные оптические изомеры соединения формулы (I) или их смеси. Соль соединения формулы (I) относится к фармацевтически приемлемой соли соединения формулы(I), и в зависимости от типа заместителей образуется кислотно-аддитивная соли или соль с основанием. Конкретные примеры соли включают кислотно-аддитивные соли с неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислста, иодисто-водородная кислота, серная кислота, азотная кислота или фосфорная кислота, или с органической кислотой, такой как муравьиная кислота,уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, миндальная кислота, винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-тоуолсульфоновая кислота, аспарагиновая кислота или глутаминовая кислота, неорганические соли с металлом, таким как литий, натрий, калий,магний, кальций или алюминий, или соли с органическим основанием, таким как метиламин, этиламин,этаноламин, лизин, аргинин, гистидин, меглумин, трометамин или орнитин, соли с различными амино-5 023955 кислотами и производными аминокислот, такими как ацетиллейцин, аммониевые соли и тому подобное. Настоящее изобретение включают также различные гидраты или сольваты и полиморфные вещества соединения формулы (I) или его соли. Кроме того, настоящее изобретение включает соединения, меченные различными радиоизотопами или нерадиоактивными изотопами. Способы получения Соединение формулы (I) или его соль можно получить при помощи различных известных способов синтеза с применением характеристик, основанных на их основной структуре или типе заместителей. В то же время, в зависимости от типа функциональных групп, в некоторых случаях эффективной является защита функциональной группы подходящей защитной группой (группой, которую можно легко превратить в первоначальную функциональную группу) на некоторой стадии между исходным соединением и конечным промежуточным соединением. Примеры защитной группы включают группы, описанные в публикации Wuts (P. G. M. Wuts) and Greene (T. W. Greene), "Greene's Protective Groups in Organic Synthesis (4th edition, 2006) и т.д. Защитную группу можно выбрать подходящим образом и использовать согласно реакционным условиям целевой реакции. После введения защитной группы, как описано выше,проводят реакцию, и затем защитную группу удаляют подходящим образом, в результате чего можно получить требуемое соединение. Кроме того, пролекарство соединения формулы (I) можно получить введением конкретной группы на некоторой стадии между исходным веществом и промежуточным соединением таким же способом,как описано для указанной выше защитной группы, или введением такой группы в полученное соединение формулы II). Реакцию можно проводить с применением способов, известных специалисту в данной области техники, таких как способы этерификации, амидирования и дегидратации. Далее в настоящем описании будет описан типичный способ получения соединения формулы (I). Каждый способ получения можно проводить на основе литературных источников, цитированных в соответствующем описании. Кроме того, способ получения по изобретению не ограничивается следующими примерами. Способ получения 1. На следующей схеме реакций соединение (I) описано просто как (I). Соединение (I) настоящего изобретения можно получить реакцией между соединением (1) и соединением (2). В этой реакции оба соединения (1) и (2) применяют в эквимолярных количествах, или одно из соединений применяют в избыточном количестве относительно другого. Смесь этих соединений обычно перемешивают в течение от 0,1 ч до 5 дней в условиях от охлаждения до нагревания, предпочтительно при температуре от -20 до 60 С в растворителе, неактивном для реакции, в присутствии агента конденсации. Хотя не имеется конкретных ограничений, примеры применяемого здесь растворителя включают ароматические углеводороды, такие как бензол, толуол и ксилол, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТГФ), диоксан и диметоксиэтан, N,N-диметилформамид, диметилсульооксид, этилацетат, ацетонитрил, вода и их смеси. Примеры агента конденсации включают 1-(3-диметиламинопропил)-3 этилкарбодиимид (WSC), диииклогексилкарбодиимид, 1,1'-карбонилдиимидазол, дифенилфосфорилазид и оксихлорид фосфора, но настоящее изобретение не ограничивается ими. В некоторых случаях для реакции предпочтительным является применение добавки (например, 1-гидроксибензотриазола (HOBt. Благоприятным является проведение реакции в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, или неорганического основания, такого как карбонат калия, карбонат натрия или гидроксид калия, для того чтобы реакция протекала гладко. Кроме того, можно также применять способ превращения карбоновой кислоты (2) в реакционноспособное производное и затем проводить реакцию с амином (1). Примеры реакционноспособного про-6 023955 изводного карбоновой кислоты включают галогенангидриды кислот, получаемые, когда карбоновая кислота реагирует с галогенирующим агентом, таким как оксихлорид фосфора или тионилхлорид, смешанные ангидриды кислот, получаемые, когда карбоновая кислота реагирует с изобутилхлорформиатом или подобным соединением, и активные сложные эфиры, получаемые, когда карбоновую кислоту конденсируют с 1-гидроксибензотриазолом или подобным соединением. Реакцию между этими реакционноспособными производными и соединением (1) можно проводить в растворителе, неактивном для реакции,таком как галогенированные углеводороды, ароматические углеводороды или простые эфиры, при охлаждении или при нагревании, предпочтительно при температуре от -20 до 60 С.The Chemical Society of Japan., "Jikken Kagaku Koza (Courses in Experimental Chemistry) (5th edition)",Vol. 16, (2005) (MARUZEN Co., Ltd.). Соединение формулы (I), имеющее связь у L4, можно получить аналогичной реакцией амидирования с применением соответствующей карбоновой кислоты и аминовых соединений в качестве исходных веществ. Способ получения 2.(В формуле LG1 представляет собой уходящую группу). Соединение (I) настоящего изобретения можно получить реакцией между соединением (3) и соединением (4). В данном контексте примеры уходящей группы включают галоген, метансульфонилоксигруппу, п-толуолсульфонилоксигруппу и тому подобное. В данной реакции оба соединения (3) и (4) применяют в эквимолярных количествах, или одно из соединений применяют в избыточном количестве относительно другого. Смесь этих соединений обычно перемешивают в течение от 0,1 ч до 5 дней в условиях от охлаждения до нагревания при кипячении с обратным холодильником, предпочтительно при температуре от 0 до 80 С, в растворителе, неактивном для реакции, или без применения растворителя. Хотя не имеется конкретных ограничений, примеры применяемого здесь растворителя включают ароматические углеводороды, простые эфиры, галогенированные углеводороды, N,N-диметилформамид, диметилсульфоксид, этилацетат, ацетонитрил, воду и их смеси. Подходящим является проведение реакции в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, или неорганического основания, такого как карбонат калия, карбонат натрия или гидроксид калия, для того, чтобы реакция протекала гладко. Соединение (I) настоящего изобретения можно получить реакцией между соединением (5) и соединением (6). В данной реакции оба соединения (5) и (6) применяют в эквимолярных количествах, или одно из соединений применяют в избыточном количестве относительно другого. Смесь этих соединений обычно перемешивают в течение от 0,1 ч до 5 дней в условиях от охлаждения до нагревания при кипячении с обратным холодильником, предпочтительно при температуре от -78 до 50 С в растворителе, неактивном для реакции, или без применения растворителя, в присутствии основания. Хотя не имеется конкретных ограничений, примеры применяемого здесь растворителя включают ароматические углеводороды, простые эфиры и их смеси. В качестве основания можно применять бутиллитий, диизопропиламид лития,гексаметилдисилазид лития, гексаметилдисилазид калия, гексаметилдисилазид натрия, диизобутилалюминийгидрид или пиридин. Способ получения 4.(В формуле L3A представляет собой низший алкилен, который является группой, образующей L3 формулы (I) вместе с соседней метиленовой группой в формуле (Ia. Соединение (Ia), в котором п равно 1, и L3 представляет собой -CH2-L3A в соединении (I) настоящего изобретения, можно получить реакцией между соединением (7) и соединением (8). В данной реакции оба соединения (7) и (8) применяют в эквимолярных количествах, или одно из соединений применяют в избыточном количестве относительно другого. Смесь этих соединений обычно перемешивают в течение от 0,1 ч до 5 дней в условиях от -45 С до нагревания при кипячении с обратным холодильником, предпочтительно при температуре от 0 С до комнатной температуре, в растворителе,неактивном для реакции, в присутствии восстанавливающего агента. Хотя не имеется конкретных ограничений, примеры применяемого здесь растворителя включают спирты, простые эфиры, галогенированные углеводороды и их смеси. Примеры восстанавливающего агента включают цианоборогидрид натрия,триацетоксиборогидрид натрия, борогидрид натрия и тому подобное. Реакцию в некоторых случаях предпочтительно проводят в присутствии дегидратирующего агента, такого как молекулярные сита, или кислоты, такой как уксусная кислота, хлористоводородная кислота и комплекса изопропоксид титана(IV). В зависимости от реакции, в некоторых случаях имин образуется конденсацией соединений (7) и(8), и его можно выделить в виде стабильного промежуточного продукта. В этом случае соединение (Ia) можно получить реакцией восстановления промежуточного соединения имина. Кроме того, вместо обработки соединений восстанавливающим агентом, можно проводить редакцию в растворителе, таком как метанол, этанол или этилацетат, в присутствии или в отсутствие кислоты, такой как уксусная кислота или хлористоводородная кислота, с применением катализатора восстановления (например, палладия на угле или никеля Ренея). В этом случае реакцию предпочтительно проводят в атмосфере водорода при давлении от нормального до 50 атм, в условиях от охлаждения до нагревания.(В формуле LG2 представляет собой уходящую группу).-8 023955 Соединение (Ib), в котором n равно 1, и L4 представляет собой 0 в соединении (I) настоящего изобретения, можно получить превращением соединения (10) в производное карбонатного эфира (11) и затем его реакцией с аминовым соединением (9). Примеры уходящей группы включают С 1, имидазолил,феноксигруплу и 4-нитрофеноксигруппу. Первую стадию проводят реакцией соединения (10) с карбонилирующим реагентом в равном количестве или с карбонилирующим реагентом, который применяют в избыточном количестве относительно соединения (10), обычно в течение приблизительно от 0,1 ч до 1 дня в условиях от охлаждения до нагревания, предпочтительно при температуре от -20 до 80 С, в растворителе, неактивном для реакции, в присутствии основания. На следующей стадии без гашения реакционной смеси первой стадии, к реакционной смеси добавляют эквимолярное количество или избыточное количество аминового соединения (9), и эту смесь перемешивают в течение приблизительно от 0,1 ч до 1 дня в условиях от охлаждения до нагревания, предпочтительно при температуре от -20 до 80 С. Хотя не имеется конкретных ограничений, примеры применяемого здесь растворителя включают галогенированные углеводороды, ароматические углеводороды, простые эфиры, N,N-диметилформамид, диметилсульфоксид, этилацетат, ацетонитрил и их смеси. Примеры карбонилирующего реагента включают дифосген, трифосген, 1,1'-карбонилдиимидазол,4-нитрофенилхлорформиат и фенилхлорформиат. В случае, когда фенилкарбонатный промежуточный продукт является стабильным, его можно сначала выделить, и затем можно проводить следующую реакцию.Inc. 1991. Соединение формулы (I), в котором n равно 1, и L4 представляет собой -NR0-, можно также получить реакцией получения уреата с применением соединения (9) и соединения (HNR0-Y-CO2R2) , соответствующего соединению (10), в качестве исходных веществ в условиях, сходных с условиями, описанными выше. Способ получения 6. Соединение (I) настоящего изобретения, имеющее карбоксильную группу в молекуле, может быть получено путем приготовления предшественника, в котором карбоксил был защищен, способом, описанным выше, с последующим удалением защитной группы предшественника. Эту реакцию можно проводить согласно Greene and Wuts, "Protective Groups in Organic Synthesis" 3rd edition, John WileySons Inc,1999. Способ получения исходного соединения.(В формуле LG3 представляет собой галоген). Исходные соединения (1) и (3) в способах получения 1 и 2 можно получить указанной выше реакцией. В приведенном выше описании амидирование 1 можно, в частности, проводить способом с применением агента конденсации в условиях способа получения 1. Амидирование 2 можно проводить с применением условий, сходных в некоторых случаях со способом получения 1, в котором карбоновую кислоту превращают в реакционноспособное производное, и затем производное подвергают реакции с аминовым соединением. Реакцию Гевалда можно проводить согласно ссылке K. Gewald, "Chem. Ber., 98(1965), 3571". Исходные соединения указанных выше способов получения 4-6 можно также получить указанным выше способом получения, иначе, в некоторых случаях, сочетанием способов получения 1 и 2. Например, исходное соединение (7) способа получения 4 можно получить с применением исходного вещества(3) и R6NH2 в условиях, сходных со способом получения 2.(В формуле R10 представляет собой защитную группу карбоксильной группы). Исходное соединение (5) в способе получения 3 можно получить указанной выше реакцией. На указанной выше схеме амидирование 3 можно проводить, применяя условия способа получения 1. Удаление защитной группы можно проводить согласно ссылке Greene and Wuts, "Protective Groups in Organic Synthesis", 3rd edition, John WileySons Inc, 1999. Циклизацию можно проводить согласно ссылке I. A.Kharizomenova, "Chemistry of Heterocyclic Compounds, 1980, vol. 16, 36". Соединение формулы (I) выделяют и очищают в виде свободного соединения, его соли, гидрата,сольвата или полиморфного вещества. Соль соединения формулы (I) может быть получена реакцией получения соли с применением стандартного способа. Выделение и очистку проводят при помощи стандартных химических операций, таких как экстракция, фракционная кристаллизация и различные типы фракционной хроматографии. Различные изомеры можно получить выбором подходящих исходных соединений или их можно разделить с применением различий в физико-химических характеристиках изомеров. Например, оптический изомер получают обычным разделением рацемата (например, фракционной кристаллизацией диастереомерной соли с хиральным основанием или хиральной кислотой или же хроматографией с применением хиральной колонки) или можно получить из подходящего исходного соединения, которое является оптически активным. Фармакологическую активность соединения формулы (I) можно подтвердить следующим тестом. Пример теста 1. Ингибирующее действие против поглощения 33 Р-фосфата в крысиных клетках экспрессии NPT-IIb.(1) Получение крысиных клеток экспрессии NPT-IIb. Библиотеку комплементарной ДНК крысиной тонкой кишки применяли в качестве матрицы, и ORFNPT-IIb крысы клонировали в p3FLAG-CMV-10 посредством ПЦР в соответствии с рекомендованным способом. Затем 293 клеток трансфицировали клонированной крысиной плазмидой экспрессии NPT-IIb,получая тем самым крысиную клеточную линию стабильной экспрессии NPT-IIb с применением G418.(2) Система оценки ингибирования поглощения фосфата в крысиных клетках экспрессии NPT-Iib. Крысиные клетки экспрессии NPT-IIb высевали в 96-луночном планшете с последующим инкубированием в течение ночи. После этого культуральную среду удаляли, планшет промывали буфером А(137 мМ N-метил-D-глюкамин, 5,4 мМ KCl, 2,8 мМ CaCl2, 1,2 мМ MgCl2 v. 10 мМ HEPES (рН регулировали до 7,4 при помощи HCl)] и затем добавляли буфер В (137 мМ NaCl, 5,4 мМ КС 1, 2,8 мМ CaCl2, 1,2 мМ MgCl2, 0,1 мМ KH2PO4 к 10 мМ HEPES (рН регулировали до 7,4 при помощи KOH. Затем получали соединение с концентрацией в 10 раз выше концентрации оценки путем разведения буфером В и добавляли к смеси. После инкубирования полученной смеси в CO2-инкубаторе в нее добавляли буфер В с добавленным 50 мкКи/мл 33 Р, и затем полученную смесь снова инкубировали в CO2-инкубаторе. После реакции буфер удаляли, планшет промывали буфером С (137 мМ NaCl, 10 мМ Tris/HCl, рН 7.2). После этого добавляли MicroScint-20, и поглощение Р 33 измеряли при помощи TopCount. Степень ингибирования вычисляли следующей формулой: Степень ингибирования (%) = (1-(поглощение 33 Р в лунке, обработанной химикатом) / (поглощение 33 Р в лунке, обработанной ДМСО 100.- 10023955 В табл. 1 иллюстрируются примеры степени ингибирования (Int. 1) поглощения 33 Р-фосфата в NPTIIb крыс для некоторых соединений настоящего изобретения при концентрации лекарственного средства 1 мкМ, достаточной для оценки эффективности. В тексте Ex. представляет собой номера соединений примеров, описанных ниже (такие же значения будут использоваться в контексте ниже). Таблица 1 Пример теста 2. Действие по повышению ингибирования радиоактивности в крови у крыс, которым перорально вводили 32 Р-фосфат (действие по ингибированию абсорбции фосфата). Самцов крыс Wistar (возраст 6-7 недель) выдерживали в состоянии голода в течение 24 ч и затем применяли в качестве экспериментальных животных. Соединение суспендировали или растворяли в растворителе и применяли при концентрации 0,6 мг/мл. Соединения принудительно перорально вводили при дозе 3 мг/кг животным группы введения соединения. Животным контрольной группы вводили растворитель, не содержащий соединение, при дозе 5 мл/кг. Спустя 5 минут после введения соединения или растворителя животным перорально вводили раствор 32 Р-содержащего фосфата (8,3 мМ NaH2PO4) при дозе 7,2 мл/кг. Спустя 15 мин и 30 мин отбирали кровь из венозного орбитального сплетения и собирали сыворотку. Радиоактивность в 0,1 мл сыворотки измеряли жидкостным сцинтилляционным счетчиком. Величину AUC0-30 мин; вычисленную из измеренных значений, считали количеством абсорбированного фосфата. Степень ингибирования абсорбции фосфата определяли из величины AUC0-30 мин по следующей формуле: Степень ингибирования абсорбции фосфата (%) = (1-величина абсорбции фосфата группы введения соединения / величина абсорбции фосфата группы стандарта)100. В табл. 2 иллюстрируются примеры степени ингибирования (Int. 2) абсорбции фосфата для некоторых соединений формулы (I). Таблица 2 Как описано выше, было обнаружено, что соединение настоящего изобретения обладает действием ингибирования NPT-IIb-опосредуемого поглощение фосфата и проявляет действие ингибирования абсорбции фосфата из кишечного тракта даже in vivo. Следовательно, соединение формулы (I) можно применять для лечения и профилактики гилерфосфатемии и т.п. Фармацевтическую композицию, содержащую один или два или более типов соединения формулы(I) или его соли в качестве активного ингредиента, можно получить с применением эксципиентов, обычно применяемых в родственной области техники, то есть с применением эксципиентов или носителей для лекарственных средств, обычно применяемыми способами. Композицию можно вводить в любых формах, таких как формы для перорального введение, например, таблетки, пилюли, капсулы, гранулы, порошок или жидкость, и парентерального введения, например, препарата для инъекции, такого как препарат для внутрисуставной инъекции, внутривенной инъекции и внутримышечной инъекции, суппозитория, глазных капель, глазной мази, чрескожной жидкости,мази, чрескожного пластыря, жидкости для введения через слизистую оболочку, пластыря для введения через слизистую оболочку или препарата для ингаляции. В качестве твердой композиция для перорального введения применяют таблетку, порошок, гранулы и тому подобное. В такой твердой композиции один или два или более типов активных ингредиентов смешивают по меньшей мере с одним типом неактивного эксципиента. Композиция может содержать неактивные добавки, например, смазывающее вещество, дезинтегрирующий агент, стабилизатор и вспомогательное средство для растворения, согласно обычным способам. Таблетка или пилюля может быть необязательно покрыта сахаром или пленкой желудочно- или энтеросолюбильного вещества. Жидкая композиция для перорального введения включает фармацевтически приемлемую эмульсию, раствор, суспензию, сироп, эликсир или тому подобное и содержит обычно применяемый неактивный разбавитель, например, очищенную воду или этанол. Жидкая композиция может содержать вспомогательный агент, такой как солюбилизатор, увлажнитель или суспензию, подслащивающее вещество,вкусо-ароматическое вещество, ароматизирующее вещество и консервант, помимо неактивного разбавителя. Инъекционный препарат для парентерального введения содержит стерильный водный или неводный раствор, суспензию или эмульсию. Примеры водного раствора включают дистиллированную воду для инъекции и физиологический солевой раствор. Прим:еры неводного раствора включают спирты, такие как этанол. Эти композиции могут дополнительно содержать агент, регулирующий тоничность, консервант, увлажнитель, эмульгатор, диспергирующий агент, стабилизатор или солюбилизатор. Их стерилизуют, например, фильтрованием через фильтр, удерживающий бактерии, смешиванием с гермицидом или облучением. Кроме того, их можно получать в виде стерильной твердой композиции, и растворять или суспендировать в стерильной воде или стерильном наполнителе для инъекции перед применением. Примеры агентов для наружного применения включают мазь, пластырь, крем, желе, припарки,спрей, лосьон, глазные капли, глазную мазь и тому подобное. Агент для наружного применения содержит обычно применяемые субстраты мазей и лосьонов, водный или неводный жидкий состав, суспензию, эмульсию и тому подобное. Агенты для введения через слизистую оболочку, такие как агент для ингаляции и агент для введения через нос, применяют в твердой, жидкой или полутвердой форме, их можно получить согласно способам, известным в родственной области техники. Например, к ним можно подходящим образом добавить известный эксципиент, регулятор рН, консервант, поверхностно-активное вещество, смазывающее вещество, стабилизатор, загуститель или тому подобное. Для введения можно применять подходящие устройства для ингаляции или инсуффляции. Например, при помощи известного устройства, такого как ингалятор с подачей отмеренной дозы или пульверизатор, соединение можно вводить отдельно или можно вводить в виде порошка составленной смеси или в виде раствора или суспензии, которая является комбинацией соединения с фармацевтически приемлемым носителем. Ингалятор с сухим порошком и т.п. может быть предназначено для одного введения или множества введений, можно применять сухой порошок или капсулы, содержащие порошок. Альтернативно, соединение можно вводить в форме находящегося под давлением аэрозольного спрея, используя подходящий агент выталкивания, например,подходящий газ, такой как хлорфторалкан или диоксид углерода. В случае перорального введения, подходящая суточная доза обычно составляет приблизительно от 0,001 до 100 мг/кг массы тела, предпочтительно от 0,1 до 30 мг/кг и более предпочтительно от 0,1 до 10 мг/кг, такую дозу вводят один или два-четыре раза в виде раздельных доз. В случае внутривенного введения подходящая суточная доза составляет приблизительно от 0,0001 до 10 мг/кг массы тела, которую вводят один или несколько раз в виде раздельных доз. Кроме того, агент для введения через слизистую оболочку вводят един раз в день или много раз в день в виде раздельных доз, в дозе приблизительно от 0,001 до 100 мг/кг массы тела. Дозу подходящим образом определяют от случая к случаю, принимая во внимание симптомы, возраст, пол и тому подобное. Фармацевтическая композиция настоящего изобретения содержит один или несколько типов соединения формулы (I) и ее соли в качестве активного ингредиента в количестве от 0,01 до 100 мас.% и от 0,01 до 50 мас.% в качестве варианта осуществления, но хотя количество изменяется в зависимости от пути введения, лекарственных форм, места введения и типа зксципиента или добавки. Соединение формулы (I) можно применять совместно с агентом для лечения или предотвращения различных заболеваний, которые считаются заболеваниями, для которых эффективным является соединение формулы (I). При совместном применении соединение и такой агент можно вводить одновременно, можно вводить последовательно друг за другом или можно вводить с требуемым интервалом времени. Препарат для одновременного введения может представлять собой комбинацию лекарственных средств или отдельный препарат. Примеры Далее в контексте будет подробно описан способ получения соединения формулы (I), основанный на примерах, но настоящее изобретение не ограничивается соединениями, описанными в следующих примерах. Кроме того, в примерах получения соответственно будет показан способ получения исходных соединений. Способ получения соединения формулы (I) не ограничивается способами получения конкретных соединений, показанных ниже. Соединение формулы (I) можно получить комбинацией этих способов получения или способом, который хорошо известен специалисту Е данной области техники. Кроме того, в примерах, примерах получения и таблицах, приведенных ниже, в некоторых случаях будут применяться следующие аббревиатуры: Pr: номер примера получения, Ех: номер примера, Str: структурная формула (в структурной формуле соединение, к которому присоединено обозначение ,является хиральным соединением, в котором соответствующий атом углерода является хиральным центром; в структурной формуле, если некоторая связь соединения представлена двумя поперечными линиями, связь является двойной связью, и соединение является смесью Е-изомера и Z-изомера), Syn: способ получения (номер означает, что соединение соответствующего примера получают способом получения, аналогичным способу получения соединения с номером примера), PSy: способ получения (номер означает, что соединение соответствующего примера получения получают способом получения, сходным со способом получения соединения с номером примера получения; кроме того, в случае, когда соединения имеют более чем. один номер примера получения, которые разделяют знаком ",", это означает,что соединение получают последовательными способами получения, сходными с указанными примерам получения, начинающимися слева), Dat: физико-химические данные, ESI+: величина m/z в массспектрометрии (ионизация ESI, (М+Н)+, если не указано иное, ESI-: величина m/z в массспектрометрии (ионизация ESI, (М-Н)-, если не указано иное, EI: величина m/z в масс-спектрометрии(ионизация EI, (М)+, если не указано иное), FAB+: величина m/z в масс-спектрометрии (ионизация FAB,(М+Н)+, если не указано иное), FAB-: величина m/z в масс-спектрометрии (ионизация FAB, (М-Н)-, если не указано иное), APCI/ESI+: величина m/z в масс-спектрометрии (ионизацию APCI и ESI проводят в то же самое время, (М+Н)+, если не указано иное), CI+: величина m/z в масс-спектрометрии (ионизация CI,(М+Н)+, если не указано иное), ЯМР:(м.д.) характеристических пиков спектров 1 Н ЯМР, измеренных в ДМСО-d6. 1H ЯМР-спектр соединения примера 60 измеряли при 80 С.HCl в структурной формуле означает, что соединение выделено в виде гидрохлорида. Кроме того,концентрацию моль/л представляют посредством М для удобства. Например, 1 М водный раствор гидроксида натрия означает 1 моль/л водного раствора гидроксида натрия. Пример получения 1. К смеси 6,2 мл 2-(метиламино) этанола, (5,48 г гидрокарбоната натрия, 60 мл ТГФ и 30 мл воды добавляли по каплям 10 мл этилсукцинилхлорида на протяжении 30 мин при охлаждении льдом с последующим перемешиванием в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:4), получая при этом 12,0 г этил-4-[(2-гидроксиэтил)(метил)амино]-4-оксобутаноата. Пример получения 2. К смеси 11,9 г этил-4-[(2-гидроксиэтил)(метил)амино]-4-оксобутаноата и 120 мл метиленхлорида медленно добавляли 26,0 г периодинана Десс-Мартина при охлаждении льдом, и смеси давали возможность нагреться до комнатной температуры на протяжении 3 ч. К реакционной смеси добавляли водный раствор гидрокарбоната натрия и водный раствор тиосульфата с последующим перемешиванием в течение 30 мин при комнатной температуре. Водный слой экстрагировали метиленхлоридом, органические слои объединяли и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном,давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:4), получая при этом 4,48 г этил-4-[метил-(2-оксоэтил)амино]-4-оксобутаноата. Пример получения 3. С применением 2,55 г гидробромида (циклспропиламино)этанола и 3,54 г гидрокарбоната натрия,0,60 г этил-4-[циклопропил-(2-гидроксиэтил)амино]-4-оксобутаноата получали способом, сходным со способом примера получения 1. Способ получения 4. К смеси 1,0 г N'-(2,2-диметоксиэтил)-N,N-диэтилэтан-1,2-диамина, 0,84 мл N-этил-N-изопропилпропан-2-амина и 10 мл метиленхлорида добавляли 0,70 мл этилсукцинилхлорида при охлаждении льдом с последующим перемешиванием в течение 1 ч при охлаждении льдом. Реакционную смесь концентрировали при пониженном давлении, добавляли этилацетат и воду, и смесь экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным раствором соли и супили над безводным сульфатом натрия с последующим концентрированием при пониженном давлении, получая при этом 1,2 г маслянистого продукта. Смесь 1,2 г полученного маслянистого продукта, 12 мл метиленхлорида и 12 мл трифторуксусной кислоты (TFA) перемешивали в течение 4 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, и к ней добавляли водный раствор гидрокарбоната натрия и этилацетат и экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным раствором соли и сушили над безводным сульфатом натрия с последующим концентрированием при пониженном давлении, получая при этом 0,78 г этил 4-[2(диэтиламино)этил](2-оксоэтил)амино-4-оксобутаноата. Пример получения 5. К смеси 50,1 г метил-4-[(3)-2-(4-нитрофенил)винил]бензоата, 600 мл ТГФ и 200 мл N,N-диметилформамида (ДМФА) добавляли 10,3 г 10% палладия на угле (увлажненного 55% H2O) с последующим перемешиванием в течение 8 ч при комнатной температуре в атмосфере водорода (1 атм). Содержимое реакционного сосуда продували аргоном и затем нерастворимое вещество удаляли фильтрованием с применением целита. Фильтрат концентрировали при пониженном давлении, и к остатку добавляли 1000 мл воды с последующим перемешиванием в течение 30 мин при комнатной температуре. Осадок собирали фильтрованием, получая при этом 44,0 г метил-4-[2-(4-аминофенил)этил]бензоата. Пример получения 6. К смеси 43,9 г метил-4-[2-(4-аминофенил)этил]бензоата, 22,3 г цианоуксусной кислоты и 150 мл ДМФА добавляли 49,5 г WSC гидрохлорида при охлаждении льдом. После перемешивания реакционной смеси в течение 24 ч при комнатной температуре к ней добавляли 450 мл воды при комнатной температуре с последующим, перемешиванием в течение 30 мин при комнатной температуре. После этого осадок собирали фильтрованием, получая при этом 54,2 г метил-4-(2-(4-[(цианоацетил)амино]фенилэтил)бензоата. Пример получения 7. К смеси 54,0 г метил-4-(2-4-[(цианоацетил)амино]фенилэтил)бензоата, 50,0 мл циклогексанона и 300 мл толуола по каплям добавляли 15,0 мл морфолина при комнатной температуре. К реактору присоединяли трубку Дина-Старка для дегидратации, и реакционную смесь перемешивали в течение 3 ч с нагреванием на масляной бане при 120 С. После этого реакционную смесь нагревали для кипячения с обратным холодильником и далее перемешивали в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры с последующим концентрированием при пониженном давлении. Затем к полученному добавляли 200 мл диизопропилового простого эфира с последующим перемешиванием в течение 14 ч. Осажденное твердое вещество собирали фильтрованием, получая при этом 53,2 г метил-4-[2-(4[циано(циклогексилиден)ацетил]аминофенил)этил]бензоата. К смеси этого твердого вещества, 4,5 г серы и 80 мл ДМФА по каплям добавляли. 12,0 мл морфолина при комнатной температуре, и реакционную смесь перемешивали в течение 1 ч при 50 С. К реакционной смеси добавляли насыщенный раствор соли с последующей экстракцией этилацетатом, и затем органический слой промывали водой и насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия с последующим фильтрованием и затем, растворитель удаляли при пониженном давлении. К полученному таким образом остатку добавляли изопропанол, и осажденное твердое вещество собирали фильтрованиеми, получая при этом 43,1 г метил-4-[2-(4-[(2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил) этил]бензоата. Пример получения 8. К смеси 6,9 г метил-4-[2-(4-[(2-амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]амино фенил)этил]бензоата, 1,5 мл пиридина и 69 мл метиленхлоркда добавляли по каплям 3,27 г 3-(хлорметил) бензоилхлорида с последующим перемешиванием в течение 1 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, к смеси добавляли этанол, и осажденное твердое вещество собирали фильтрованием, получая при этом 9,27 г метил-4-[2-(4-(2-[3-(хлорметил)бензоил] амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата. Пример получения 9. Смесь 8,00 г метил-4-[2-(4-[(2-[3-(хлорметил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен 3-ил)карбонил]аминофенил)этил]бензоата, 4,8 мл пентан-3-амина, 3,5 мл N-этил-N-изопропилпропан-2 амина и 80 мл ДМФА перемешивали в течение 13 ч при 80 С. К реакционной смеси добавляли этилаиетат и воду с последующей экстракцией этилацетатом. Органический слой промывали последовательно водой и насыщенным раствором соли и сушили над безводным сульфатом натрия с последующим концентрированием при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (2% метанол/хлороформ), получая при этом 6,57 г метил-4-2-[4-([2-(3-[(пентан-3-иламино)метил] бензоиламино)-4,5,6,7-тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]этилбензоата. Пример получения 10. С применением 250 мг метил-4-[2-(4-[(2-[3-(хлорметил)бензоил]амино-4,5,6,7-тетрагидро-1 бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата и 0,25 мл N,N'-диизопропилэтилендиамина в качестве исходных веществ проводили реакцию, сходную с реакцией примера получения 9, получая при этом 220 мг метил-4-[2-(4-[(2-[3-(изопропил-[2-(изопропиламино)этил]аминометил)бензоил]амино 4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата. Пример получения 11. С применением 1,0 г трет-бутил-(2-бромэтил)карбамата, 2,5 мл пентан-3-амина и 10 мл ацетонитрила в качестве исходных веществ проводили реакцию, сходную с реакцией примера получения 9, получая при этом 890 мг трет-бутил-[2-(пентан-3-иламино)этил]карбамата. Пример получения 12. К смеси 240 мг метил-4-(2-4-[(2-[(3-[2-[(трет-бутоксикарбонил)амино]зтил(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата и 5,0 мл метиленхлорида добавляли 3,0 мл TFA при охлаждении льдом с последующим перемешиванием в течение 1 ч при такой же температуре и затем перемешиванием в течение 5 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, к ней добавляли хлороформ и насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией хлороформом. Орга- 14023955 нический слой сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении, получая при этом 210 мг метил-4-(2-4-[(2-[(3-[(2-аминоэтил)(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата. Пример получения 13. К смеси 210 мг метил-4-(2-4-[ (2-[(3-[(2-аминоэтил)(пентан-3-ил)амино]метилбензоил)амино]4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата, 0,10 мл триэтиламина и 10 мл метиленхлорида добавляли 70 мг этилсукцинилхлорида при охлаждении льдом, и затем смесь перемешивали в течение 1 ч при такой же температуре и затем перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, к реакционной смеси добавляли хлороформ и воду с последующей экстракцией хлороформом. Органический слой сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (10% метанол/хлороформ), получая при этом 170 мг метил-4-(2(4-[(2-[(3-[2-[(4-этокси-4-оксобутаноил)амино]этил(пентан-3-ил)амино]метилбензоил)амино]4,5,6,7-тетрагидро-1-бензстиофен-3-илкарбонил)амино]фенилэтил)бензоата. Пример получения 14. К смеси 800 мг метил-4-2-[4-([2-(3-[(пентан-3-иламино)метил]бензоиламино)-4,5,6,7-тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]этилбензоата, 257 мг трет-бутилметил-(2-оксоэтил)карбамата, 7,5 мг уксусной кислоты и 16 мл дихлорэтана добавляли 372 мг триацетоксиборогидрида натрия с последующим перемешиванием смеси в течение 15 ч при комнатной температуре. К реакционной смеси добавляли водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом. Органический слой сушили над безводным сульфатом натрия с последующим концентрированием при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан : этилацетат = 2:1), получая при этом 908 мг метил-4-(2-4-[(2-[(3-[2-[(трет-бутоксикарбонил)(метил)амино]этил(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетранидро-1-бензотиофен-3-илкарбонил)амино] фенилэтил)бензоата. Пример получения 15. К смеси 250 мг метил-4-[2-(4-[(2-[3-([2-(метиламино)этил](пентан-3-ил)аминометил)бензоил] амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминефенил)этил]бензоата, 0,20 мл N-этил-Nизопропилпропан-2-амина и 10 мл ТГФ при охлаждении льдом добавляли 70 мг метил-(S)-(-)-2 изоцианатопропионата с последующим перемешиванием в течение 1 ч при такой же температуре и затем в течение 2 ч при комнатной температуре. К реакционной смеси добавляли этилацетат и водный раствор гидрокарбоната натрия с последующей экстракцией смеси этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (10% метанол/ хлороформ), получая при этом 290 мг метил-4-2-[4-([2-(3-[(4S)-4,7-диметил-3,6-диоксо-10-(пентан-3-ил)2-окса-5,7,10-триазаундекан-11-ил]бензоиламино)-4,5,6,7-тетрагидро-1-бензотиофен-3-ил]карбонил амино)фенил]этилбензоата. Пример получения 16. К смеси 100 мг (2R)-4-метокси-2-метил-4-оксобутановой кислоты и 10 мл метиленхлорида добавляли 0,10 мл оксалилхлорида и 0,020 мл ДМФА в указанном порядке при охлаждении льдом. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре и затем концентрировали при пониженном давлении. К. смеси 200 мг метил-4-[2-(4-[(2-[3-([2-(метиламино)этил]пентан-3-ил)аминометил) бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата, 0,10 мл триэтиламина и 5,0 мл метиленхлорида при охлаждении льдом добавляли 5,0 мл раствора метиленхлорида с последующим перемешиванием в течение 1 ч, при такой же температуре и затем в течение 4 дней при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, добавляли к ней хлороформ и воду с последующей экстракцией хлороформом. Органический слой сушили над безводным сульфатом натрия с последующим концентрированием при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (10% метанол/хлороформ), получая при этом 230 мг метил 4-(2-4-[(2-[(3-[(2-[(2R)-4-метокси-2-метил-4-оксобутаноил](метил)аминоэтил)(пентан-3-ил) амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата. Пример получения 17. К смеси 220 мг метил-4-[2-(4-[(2-[3-([2-(метиламино)этил](пентан-3-ил)аминометил)бензоил] амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил] бензоата, 0,20 мл N-этил-Nизопропилпропан-2-амина и 5,0 мл метиленхлорида добавляли 100 мг 2,2-диметилглутарового ангидрида при охлаждении льдом с последующим перемешиванием в течение 1 ч при такой же температуре и затем в течение дня при комнатной температуре, и реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли 200 мг карбоната калия и 10 мл ДМФА, затем при охлаждении льдом добавляли 150 мг метилиодида, и реакционную смесь перемешивали в течение 1 ч при охлаждении льдом и затем в течение дня при комнатной температуре. К реакционной смеси добавляли этилацетат и воду с последующей экстракцией смеси этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия с последующим концентрированием при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (5% метанол/хлороформ), получая при этом 260 мг метил-4-(2-4-[(2-[(3-[2-[(5-метокси-4,4-диметил-5 оксопентаноил)(метил)амино]этил(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата. Пример получения 18. К смеси 1,0 г 3-(метиламино)пропан-1-ола и 10 мл метанола добавляли 3,0 г ди-третбутилдикарбоната при охлаждении льдом с последующим перемешиванием в течение 5 дней при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (гексан: этилацетат=3:7), получая при этом 2,05 г третбутил-(3-гидроксипропил)метилкарбамата. Пример получения 19. К смеси 1,5 г 2-(3-бромфенил)этанола, 1,0 г имидазола и 15 мл ДМФА добавляли 2,8 г трет-бутил(хлор)дифенилсилана при охлаждении льдом с последующим перемешиванием в течение 1 ч при такой же температуре, затем в течение дня при комнатной температуре. К реакционной смеси добавляли диэтиловый простой эфир и воду с последующей экстракцией диэтиловым простым эфиром. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия с последующим концентрированием при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан : этилацетат = 7:3), получая при этом 3,27 г [2-(3-бромфенил)этокси](трет-бутил) дифенилсилана. Пример получения 20. К смеси 3,27 г [2-(3-бромфенил)этокси](трет-бутил)дифенилсилана и 50 мл ТГФ медленно добавляли 5,5 мл бутиллития (1,62 М раствор в гексане) при -78 С с последующим перемешиванием в течение 30 мин при -78 С. Кроме того, через реакционную смесь продували диоксид углерода при -78 С, и ее температуру медленно повышали до комнатной температуры с последующим перемешиванием з течение 1 ч при комнатной температуре. К реакционной смеси добавляли воду, и смесь нейтрализовали 9,0 мл 1,0 М хлористоводородной кислотой. К смеси добавляли этилацетат для отделения органического слоя, органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, и затем растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:6), получая при этом 1,45 г 3-(2-[трет-бутил(дифенил)силил]окси этил)бензойной кислоты. Пример получения 21. К смеси 480 мг 3-(2-[трет-бутил(дифенил)силил]оксиэтил)бензойной кислоты и 10 мл метиленхлорида добавляли 160 мг 1-хлор-N,N,2-триметилпропениламин при охлаждении льдом с последующим перемешиванием в течение 1 ч при комнатной температуре. К реакционной смеси при охлаждении льдом добавляли 10 мл раствора метиленхлорида, содержащего 450 мг метил-4- [2-(4-[(2-амино-4,5,6,7 тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата, и 0,20 мл пиридина с последующим перемешиванием в течение 1 ч при охлаждении льдом и затем в течение 4 дней при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, к ней добавляли этилацетат и воду, и органический слой отделяли. Органический слой промывали 5% водным раствором лимонной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли в этом порядке и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:1) , получая при этом 830 мг метил-4-[2-(4-[(2-[3-(2-[трет-бутил(дифенил)силил]оксиэтил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата. Пример получения 22. К смеси 830 мг метил-4-[2-(4-[(2-[3-(2-[трет-бутил(дифенил)силил]оксиэтил)бензоил]амино 4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата и 10 мл ТГФ добавляли при охлаждении льдом 1,5 мл фторида тетрабутиламмония (TBAF) (1,0 М раствср в ТГФ) с последующим перемешиванием в течение 4 ч при комнатной температуре и затем в течение ночи при 50 С. Реакционную смесь концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (10% метанол/хлороформ), получая при этом 540 мг метил-4- [2-(4-[(2-[3-(2 гидроксиэтил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата. Пример получения 23. С применением 250 мг метил-4-[2-(4-[(2-[3-(2-гидроксиэтил)бензоил]амино-4,5,6,7-тетрагидро 1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата и 450 мг периодинана Десс-Мартина проводили реакцию, сходную с реакцией примера получения 2, и реакцию, сходную с реакцией примера получения 14, получая при этом 260 мг метил-4-2-[4-([2-(3-[2-(пентан-3-иламино)этил]бензоиламино)4,5,6,7-тетрагидро-1-бензстиофен-3-ил]карбониламино)фенил]этилбензоата. Пример получения 24. Смесь 640 мг метилгликолята, 0,60 мл пиридина и 10 мл метиленхлорида добавляли к 10 мл раство- 16023955 ра метиленхлорида, содержащего 1,44 г 4-нитрофенилхлорформиата, при комнатной температуре с последующим перемешиванием в течение 2 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, и к остатку добавляли диэтиловый простой эфир и воду, и органический слой отделяли. Органический слой последовательно промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия с последующим концентрированием при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (с применением только хлороформа), получая при этом 320 мг метил-[(4-нитрофенокси)карбонил]оксиацетата. Пример получения 25. К смеси 16,5 г 1-(4-нитрофенил)этанона, 16,4 г метил-4-формилбензоата и 100 мл этанола по каплям добавляли 4,0 мл пиперидина при комнатной температуре с последующим нагреванием при кипячении с обратным холодильником в течение 8 ч. Осадок собирали фильтрованием, получая при этом 24,6 г сырого продукта. Сырой продукт суспендировали в 100 мл этанола с последующим нагреванием при кипячении с обратным холодильником в течение 6 ч. Осадок собирали фильтрованием, получая при этом 24,0 г метил-4-[3-(4-нитрофенил)-3-оксопроп-1-ен-1-ил]бензоата. Пример получения 26. К смеси 5,0 г метил-4-[3-(4-нитрофенил)-3-оксопроп-1-ен-1-ил]бензоата и 150 мл метанола добавляли по каплям 5,0 мл концентрированной серной кислоты при охлаждении льдом. В атмосфере аргона 500 мг 10% палладия на угле добавляли к реакционной смеси. После проведения продувания водородом(3 атм) при комнатной температуре смесь перемешивали в течение 24 ч. Нерастворимое вещество удаляли фильтрованием с применением целита, и затем фильтрат концентрировали при пониженном давлении. К остатку при охлаждении льдом добавляли насыщенный водный раствор гидрокарбсната натрия для нейтрализации остатка и затем проводили экстракцию с применением этилацетата. Органический слой промывали водой и насыщенным раствором соли и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ), получая при этом 2,9 г метил-4-[3-(4-аминофенил)пропил]бензоата. Пример получения 27. Смесь 194 мг метил-4-[2-(4-[(2-[3-(циклопропил-[2-(метиламино)этил]аминометил)бензоил] амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата, 0,050 мл (2-метоксиэтокси)уксусной кислоты, 84 мг WSCгидрохлорида и 5,0 мл ДМФА перемешивали в течение 15 ч при комнатной температуре. К реакционной смеси добавляли воду с последующей экстракцией смеси этилацетатом. Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (5% метанол/хлороформ), получая при этом 200 мг метил-4-[2-(4[(2-[3-(11-циклопропил-8-метил-7-оксо-2,5-диокса-8,11-диазадодекан-12-ил)бензоил]амино-4,5,6,7 тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата. Пример получения 28. С применением 1,4 мл (2-метоксиэтокси)уксусной кислоты и 1,0 г 3-(метиламино)пропан-1-ола в качестве исходных веществ проводили реакцию, сходную с реакцией примера получения 16, получая при этом 2,19 г N-(3-гидроксипропил)-2-(2-метоксиэтокси)-N-метилацетамида. Пример получения 29. С применением 2,0 г метил-4-[2-(4-[(2-[3-(хлорметил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата, 1,0 г трет-бутил-[2-(циклопропиламино)этил] карбамата, 0,76 г карбоната калия и 40 мл ДМФА получали 2,5 г метил-4-(2-4-[(2-[(3-[2-[(третбутоксикарбонил)амино]этил(циклопропил)амино]метилбензоил)-амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата способом, сходным со способом получения примера 9. Пример получения 30. Смесь 1,0 г метил-4-(2-4-[(2-[(3-[(2-аминоэтил)(циклопропил)амино]метилбензоил)амино]4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата, 0,20 мл этилбромацетата,212 мг карбоната калия и 20 мл ДМФА перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, получая при этом 140 мг метил-4-2-[4-([2-(3-[(циклопропил-2-[(2-этокси-2-оксоэтил)амино]этиламино) метил]бензоиламино)-4,5,6,7-тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]этилбензоата. Пример получения 31. С применением 200 мг трет-бутил-(2S)-2-(гидроксиметил)пирролидин-1-карбоксилата и 421 мг периодинана Десс-Мартина проводили реакцию способом, сходным со способом примера получения 2. После этого продукт реакции подвергали реакции с 300 мг метил-4-2-[4-([2-(3-[(пентан-3-иламино) метил]бензоиламино)-4,5,6,7-тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]этилбензоата способом, сходным со способом примера получения 14, получая при этом 350 мг трет-бутил-(2S)-2-([3(3-[(4-2-[4-(метоксикарбонил)фенил]этилфенил)карбамоил]-4,5,6,7-тетрагидро-1-бензотиофен-2- 17023955 илкарбамоил)бензил](пентан-3-ил)аминометил)пирролидин-1-карбоксилата. Пример получения 32. К смеси 200 мг метил-4-[2-(4-[(2-[3-([2-(метиламино)этил](пентан-3-ил)аминометил)бензоил] амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата, 48 мг N-этил-Nизопропилпропан-2-амина и 4 мл диоксана добавляли 44 мг 3,3-диметилдигидрофуран-2,5-диона с последующим перемешиванием в течение ночи при 65 С. Реакционную смесь концентрировали при пониженном давлении, к остатку добавляли этилацетат и воду с последующей экстракцией этилацетатом. Органический слой сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикателе, получая при этом 200 мг 4-[(2[3-(3-[(4-2-[4-(метоксикарбонил)фенил]этилфенил)карбамоил]-4,5,6,7-тетрагидро-1-бензотиофен-2 илкарбамоил)бензил](пентан-3-ил)аминоэтил)(метил)амино]-2,2-диметил-4-оксобутановой кислоты. Пример получения 33. С применением 200 мг метил-4-[2-(4-[(2-[3-([2-(метиламино)этил](пентан-3-ил)аминометил) бензоил]амине-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата, 60 мг моноэтиладипата и 0,10 мл N-этил-N-изопропилпропан-2-амина в качестве исходных веществ и с применением 142 мг гексафторфосфата О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) в качестве агента конденсации проводят реакцию, сходную с реакцией примера получения 27, получая при этом 200 мг метил-4-(2-4-[(2-[(3-[2-[(6-этокси-6-оксогексаноил)(метил)амино]этил(пентан-3-ил) амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата. Пример получения 34. С применением 220 мг метил-4-(2-4-[(2-[(3-[2-[(хлорацетил)(метил)амино]этил(пентан-3-ил) амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата, 60 мг гидрохлорида этилового эфира саркозина и 120 мг карбоната калия, 200 мг метил-4-2-[4([2-(3-[5,8-диметил-6,10-диоксо-2-(пентан-3-ил)-11-окса-2,5,8-триазатридец-1-ил]бензоиламино)4,5,6,7-тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]этилбензоата получали способом, сходным со способом примера получения 9. Пример получения 35. К 4,8 г трет-бутилэтил-2,2'-пиперазин-1,4-диилдиацетата добавляли 20 мл 4 М раствора хлорид водорода/этилацетат с последующим перемешиванием в течение 2 ч при комнатной температуре. Образованное нерастворимое вещество собирали фильтрованием, получая при этом 4,0 г дигидрохлорида [4-(2 этокси-2-оксоэтил)пиперазин-1-ил]уксусной кислоты. Пример получения 36. С применением 200 мг метил-4-[2-(4-[(2-[3-([2-(метиламино)этил](пентан-3-ил)аминометил) бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата и 79 мг метил-3-(бромметил)бензоата проводили реакцию, сходную с реакцией примера получения 30, получая при этом 220 мг метил-3-[(2-[3-(3-[(4-2-[4-(метоксикарбонил)фенил]этилфенил)карбамоил]-4,5,6,7 тетрагидро-1-бензотиоден-2-илкарбамоил)бензил](пентан-3-ил)аминоэтил)(метил)амино]метилбензоата. Пример получения 37. К 1,0 г этил-2-(гидроксиметил)изоникотината добавляли 3,0 мл тионилхлорида с последующим перемешиванием смеси в течение ночи. Реакционную смесь концентрировали при пониженном давлении, и к полученному остатку добавляли 4,0 мл пентан-3-амина и 20 мл ДМФА с последующим перемешиванием в течение ночи при 70 С. К реакционной смеси добавляли воду с последующей экстракцией смеси этилацетатом. Органический слой сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, получая при этом 1,3 г этил-2-[(пентан-3-иламино)метил]изоникотината. Пример получения 38. Смесь 1,9 г этил-2-[2-[(4-трет-бутокси-4-оксобутаноил)(метил)амино]этил(пентан-3-ил)амино] метилизоникотината, 8,2 мл 1,0 М водного раствора гидроксила натрия, 8,0 мл метанола и 16 мл ТГФ перемешивали в течение ночи при комнатной температуре. Смесь нейтрализовали с применением 1,0 М хлористоводородной кислоты, и к ней добавляли воду с последующей экстракцией смесью хлороформметанол. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении, получая при этом 1,5 г 2-[2-[(4-третбутокси-4-оксобутаноил)(метил)амино]этил(пентан-3-ил)амино]метилизоникотиновой кислоты. Пример получения 39. К 20 мл раствора в диоксане, содержащего 2,0 г 2-бром-5-нитропиридина, добавляли 1,58 г метил-4 этинилбензоата, 4,1 мл N-изопропилпропан-2-амина и 281 мг иодида меди(I), и затем к раствору добавляли 504 мг бис(три-трет-бутилфосфин)палладия(0) в атмосфере аргона, с последующим перемешиванием в течение 1 часа при комнатной температуре. К реакционной смеси добавляли 50 мл этилацетата,осажденное нерастворимое вещество собирали фильтрованием, получая при этом 2,45 г метил-4-[(5 нитропиридин-2-ил)этинил]бензоата. Пример получения 40. С применением 120 мг 2-(3-[(циклопропиламино)метил]бензоиламино)-N-[4-(пиридин-4-илметил)фенил]-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида и 120 мг этил-5-хлор-5-оксопентаноата проводили реакцию, сходную с реакцией примера получения 13, получая при этом 105 мг этил-5-(циклопропил 3-[(3-[4-(пиридин-4-илметил)фенил]карбамоил-4,5,6,7-тетрагидро-1-бензотиофен-2-ил)карбамоил]бензиламино)-5-оксопентаноата. Пример получения 41. С применением 300 мг метил-4-2-[4-([2-3-[(циклопропиламино)метил]бензоиламино)-4,5,6,7 тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]этилбензоата, 198 мг 5-циклопропил[3-(3-[(42-[4-(метоксикарбонил)фенил]этилфенил)карбамоил]-4,5,6,7-тетрагидро-1-бензотиофен-2-илкарбамоил)бензил]амино-3,3 -диметил-5-оксопентановой кислоты получали способом, сходным со способом примера получения 32. Пример получения 42. К смеси 150 мг метил-4-3-[4-([2-(3-[(изопропиламино)метил]бензоиламино)-4,5,6,7-тетрагидро 1-бензотиофен-3-ил]карбониламино)фенил]пропилбензоата и 3,5 мл ТГФ добавляли 0,045 мл триэтиламина и 28 мг трифосгена при охлаждении льдом с последующим перемешиванием в течение 3 ч при комнатной температуре. После этого к реакционной смеси добавляли 0,080 мл этилизонипеколята с последующим перемешиванием в течение 18 ч при комнатной температуре. К реакционной смеси добавляли водный раствор гидрокарбоната натрия с последующим перемешиванием в течение 1 ч при комнатной температуре и затем проводили экстрагирование с применением хлороформа. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на основном силикагеле (NH-силикагель, изготовленный FUJI SILYSIA CHEMICAL LTD. (силикагель аминотипа (обработанный аминопролилом, (гексан:этилацетат=1:1, получая при этом 178 мг этил-1-изопропил-[3-(3[(4-3-[4-(метоксикарбонил)фенил]пропилфенил)карбамоил]-4,5,6,7-тетрагидро-1-бензотиофен-2-ил карбамоил)бензил]карбамоилпиперидин-4-карбоксилата. Пример получения 43. С применением 116 мг метил-4-3-[4-([2-(3-[(изопропиламино)метил]бензоиламино)-4,5,6,7 тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]пропилбензоата и 50 мг 6-(метоксикарбонил) пиридин-2-карбоновой кислоты в качестве исходных веществ проводили реакцию, сходную с реакцией примера получения 33, получая при этом 115 мг метил-6-изопропил-[3-(3-[(4-3-[4-(метоксикарбонил) фенил]пропилфенил)карбамоил]-4,5,6,7-тетрагидро-1-бензотиофен-2-илкарбамоил)бензил]карбамоил пиридин-2-карбоксилата. Пример получения 44. С применением 550 мг метил-4-2-[4-([2-(3-[(изопропиламино)метил]бензоиламино)-4,5,6,7 тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]этилбензоата и 200 мг 4-(диэтоксифосфорил) бутановой кислоты в качестве исходных веществ проводили реакцию, сходную с реакцией примера получения 27, получая при этом 600 мг метил-4-[2-(4-[(2-[3-([4-(диэтоксифосфорил)бутаноил](изопропил)аминометил)бензоиламино-4,5,6,7-тетрагидро-1-бензотиофен-3 ил)карбонил]аминофенил)этил]бензоата. Пример получения 45. С применением 1,0 г метил-4-[2-(4-[(2-[3-(хлорметил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата и 1,8 мл 28% водного аммиака, 900 мг метил-4-[2-(4[(2-[3-(аминометил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил) этил]бензоата получали способом, сходным со способом примера получения 9. Пример получения 46. С применением 370 мг метил-4-(2-4-[(2-[(3-[(хлорацетил)(пентан-3-ил)амино]метилбензоил) амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата и 400 мг этилизонипеколята проводили реакцию, сходную с реакцией примера получения 30, получая при этом 380 мг зтил-1-(2-[3-(3-[(4-2-[4-(метоксикарбонил)фенил]этилфенил)карбамоил]-4,5,6,7-тетрагидро-1 бензотиофен-2-илкарбамоил)бензил](пентан-3-ил)амино-2-оксоэтил)пиперидин-4-карбоксилата. Пример получения 47. К смеси 3,0 г 3-формилбензойной кислоты и 30 мл метиленхлорида добавляли 1,7 мл оксалилхлорида и 0,020 мл ДМФА в указанном порядке при охлаждении льдом. Реакционную смесь перемешивали в течение 5 ч при комнатной температуре и концентрировали при пониженном давлении. Полученную смесь и 30 мл метиленхлорида добавляли к см:еси 2,8 мл 2-(триметилсилил)этанола, 1,6 мл пиридина и 30 мл метиленхлорида с последующим перемешиванием в течение 2 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, к ней добавляли воду с последующей экстракцией этилацетатом. Органический слой сушили над безводным сульфатом натрия, растворитель удаляли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (гексан: этилацетат=4:1), получая при этом 3,5 г 2-(триметилсилил)этил-3-формилбензоата. Пример получения 48. С применением 500 мг 2-(триметилсилил)этил-3-формилбензоата и 188 мг 3-аминопиридина проводили реакцию, сходную с реакцией примера получения 14, получая при этом 505 мг 2-(триметилсилил) этил 3-[(пиридин-3-иламино)метил]бензоата. Пример получения 49. С применением 375 мг 2-(триметилсилил)этил-3-[(5-этокси-5-оксопентаноил)(пиридин-3-ил)амино]метилбензоата и 1,0 мл 1,0 М TEAF (раствор в ТГФ) , 160 мг 3-[(5-этокси-5-оксопентаноил)(пиридин-3-ил)амино]метилбензойной кислоты получали способом, сходным со способом примера получения 22. Пример получения 50. К смеси 8,99 г трет-бутил-2-(3-[(пентан-3-иламине)метил]бензоиламино)-4,5,6,7-тетрагидро-1 бензотиофен-3-карбоксилата и 100 мл метиленхлорида добавляли 30 мл TFA с последующим перемешиванием в течение 15 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, и проводили азеотропную перегонку концентрата с применением толуола. К остатку добавляли 4,3 мл тионилхлорида и 50 мл толуола, и по каплям добавляли 0,10 мл ДМФА с последующим перемешиванием смеси в течение 1 ч при 60 С. Реакционную смесь концентрировали при пониженном давлении, к ней добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:2), получая при этом 7,05 г 2-3-[(пентан-3 иламино)метил]фенил-5,6,7,8-тетрагидро-4 Н-[1]бензотиено[2,3-d][1,3]оксазин-4-она. Пример получения 51. К смеси 4,81 г 2,2-диметил-5-оксо-5-[3-(4-оксо-5,6,7,8-тетрагидро-4 Н-[1]бензотиено[2,3-d][1,3]оксазин-2-ил)бензил](пентан-3-ил)аминопентановой кислоты и 50 мл ДМФА добавляли 2,59 г метилиодида и 3,16 г карбоната калия с последующим перемешиванием в течение 1 ч при комнатной температуре. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и затем сушили над безводным: сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток перекристаллизовывали из этанола, получая при этом 3,24 г метил-2,2-диметил-5-оксо-5-[3-(4-оксо-5,6,7,8-тетрагидро-4 Н-[1]бензотиено[2,3-d][1,3]оксазин-2 ил)бензил](пентан-3-ил)аминопентаноата в виде желтовато-белого твердого вещества. Пример получения 52. 1,1 мл гексаметилдисилазида лития (1,0 М в ТГФ) добавляли по каплям к смеси 200 мг метил-2,2 диметил-5-оксо-5-[3-(4-оксо-5,6,7,8-тетрагидро-4 Н-[1]бензотиено[2,3-d][1,3]оксазин-2-ил)бензил] (пентан-3-ил)аминопентаноата, 90 мг 4-[2-(морфолин-4-ил)зтил]анилина и 5,0 мл ТГФ при охлаждении льдом с последующим перемешиванием в течение 30 мин при такой же температуре. К реакционной смеси добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:1), получая при этом 164 мг метил-2,2-диметил-5-[(3-[3-(4-[2-(морфолин-4-ил)этил]фенилкарбамоил)-4,5,6,7-тетрагидро-1-бензотиофен-2-ил]карбамоилбензил)(пентан-3 ил)амино]-5-оксопентаноата. Пример получения 53. 23 мл комплекса боран-ТГФ (1,08 М раствор в ТГФ) добавляли по каплям к смеси 3,02 г третбутил-4-[3-(4-нитрофенил)пропаноил]пиперазин-1-карбоксилата и 40 мл ТГФ при охлаждении льдом в атмосфере аргона с последующим перемешиванием в течение 10 мин при комнатной температуре, и затем нагреванием при кипячении с обратным холодильником проводили в течение 2 ч. Реакционную смесь охлаждали льдом и к ней по каплям добавляли 30 мл метанола с последующим перемешиванием в течение 3 ч при 50 С. Реакционную смесь концентрировали при пониженном давлении, к остатку добавляли воду и этилацетат с последующей экстракцией смеси этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (5% метанол/хлороформ), получая при этом 2,73 г трет-бутил-4-[3-(4-нитрофенил)пропил]пиперазин-1 карбоксилата. Пример получения 54. С применением 180 мг метил-2,2-диметил-5-оксо-5-[пентан-3-ил-(3-[3-(4- [3-(пиперазин-1-ил) пропил]фенилкарбамоил)-4,5,6,7-тетрагидро-1-бензотиофен-2-ил]карбамоилбензил)амино]пентаноата и 0,06 мл 37% водного раствора формалина проводят реакцию, сходную с реакцией примера получения 14, получая при этом 152 мг метил-2,2-диметил-5-[(3-[3-(4-[3-(4-метилпиперазин-1-ил)пропил]фенил карбамоил)-4,5,6,7-тетрагидро-1-бензотиофен-2-ил]карбамоилбензил)(пентан-3-ил)амино]-5-оксопентаноата. Пример получения 55. К смеси 680 мг трет-бутил-(5-нитропиридин-2-ил)ацетата и 10 мл ДМФА добавляли 373 мг гидрида натрия (55%, дисперсия в жидком парафине) при охлаждении льдом в атмосфере аргона с последующим перемешиванием в течение 30 мин при комнатной температуре. Кроме того, к смеси по каплям добавляли 0,62 мл метилиодида при охлаждении льдом с последующим перемешиванием в течение 5 ч при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:1), получая при этом 582 мг трет-бутил-2-метил-2-(5-нитропиридин-2-ил)пропаноата. Пример получения 56. К смеси 200 мг N-[4-(бензилокси)фенил]-2-[3-(морфолин-4-илметил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида и 6,0 мл TFA добавляли 255 мг 1,2,3,4,5-пентаметилбензола с последующим перемешиванием в течение ночи при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, и к ней добавляли этилацетат и насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (3% метансл/хлороформ), получая при этом 169 мг N-(4-гидроксифенил)-2-[3-(морфолин-4-илметил)бензоил]амино-4,5,6,7 тетрагидро-1-бензотиофен-3-карбоксамида. Пример получения 57. С применением 169 мг N-(4-гидроксифенил)-2-[3-(морфолин-4-илметил)бензоил]амино-4,5,6,7 тетрагидро-1-бензотиофен-3-карбоксамида и 95 мг метил-4-(бромметил)бензоата, 193 мг метил-4-[(4[(2-[3-(морфолин-4-илметил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]амино фенокси)метил]бензоата получали способом, аналогичным способу примера получения 30. Пример получения 58. С применением 610 мг метил-4-(2-4-[(2-[(3-[1-[N-(трет-бутоксикарбонил)-N-метилглицил]пиперидин-4-ил(циклопропил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата и 5,0 мл TFA в качестве исходных веществ проводили реакцию удаления защиты, сходную с реакцией примера получения 12, и реакцию амидирования, сходную с реакцией примера получения 32, проводили последовательно, получая при этом 240 мг 4-[2-(4-циклопропил[3-(3-[(4-2-[4-(метоксикарбонил)фенил]этилфенил)карбамоил]-4,5,6,7-тетрагидро-1-бензотиофен-2 илкарбамоил)бензил]аминопиперидин-1-ил)-2-оксоэтил](метил)амино-4-оксобутановой кислоты. Пример получения 59. С применением 250 мг метил-4-2-[4-([2-(3-[(циклопропиламино)метил]бензоиламино)-4,5,6,7 тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]этилбензоата и 153 мг этил-2-хлорпиримидин 5-карбоксилата в качестве исходных веществ проводили реакцию, сходную с реакцией примера получения 30, получая при этом 307 мг этил-2-циклопропил-[3-(3-[(4-2-[4-(метоксикарбонил)фенил]этил фенил)карбамоил-4,5,6,7-тетрагидро-1-бензотиофен-2-илкарбамоил)бензил]аминопиримидин-5 карбоксилата. Пример получения 60. Смесь 22,2 г 2-[3-(морфолин-4-илметил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3 карбоновой кислоты и 230 мл толуола нагревали при 60 С, и к смеси добавляли 20 мл тионилхлорида с последующим перемешиванием в течение 1 ч при 60 С. Нерастворимое вещество собирали фильтрованием и промывали толуолом. К веществу, собранному фильтрованием, добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат с последующей экстракцией этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток промывали этанолом, получая при этом 18,9 г 2-[3-(морфолин-4-илметил)фенил]-5,6,7,8-тетрагидро-4 Н-[1]бензотиено[2,3-d][1,3]оксазин-4 она. Пример получения 61. С применением 300 мг метил-4-2-[4-([2-(3-[(циклопропиламино)метил]бензоиламино)-4,5,6,7 тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]этилбензоата и 289 мг этил-4-бромбутирата проводили реакцию, сходную с реакцией примера получения 30, получая при этом 201 мг метил-4-(2-4[(2-[(3-[циклопропил(4-этокси-4-оксобутил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1 бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата. Пример получения 62. К смеси 5,27 г бензил-5-метилтиофен-2-карбоксилата и 100 мл тетрахлорида углерода добавляли 4,18 г N-бромсукциниммда (NBS) и 142 мг азобисизобутиронитрила (AIBN) с последующим перемешиванием в течение ночи при 80 С. Реакционную смесь концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=7:3), получая при этом 4,44 г бензил-5-(бромметил)тиофен-2-карбоксилата. Пример получения 63. К смеси 2,18 г бензил-5-(бромметил)тиофен-2-карбоксилата и 26 мл толуола добавляли 1,86 г трифенилфосфина с последующим перемешиванием в течение ночи при 80 С. Нерастворимое вещество со- 21023955 бирали фильтрованием, получая при этом 2,89 г бромида (5-[(бензилокси)карбонил]-2-тиенилметил)(трифенил)фосфония. Пример получения 64. Смесь 3,01 г метил-5-(морфолин-4-илметил)тиофен-2-карбоксилата и 30 мл 6,0 М хлористоводородной кислоты подвергали нагреванию при кипячении с обратным холодильником в течение ночи при 100 С. Реакционную смесь концентрировали при пониженном давлении, и остаток промывали ацетонитрилом, получая при этом 3,05 г гидрохлорида 5-(морфолик-4-илметил)тиофен-2-карбоновой кислоты. Пример получения 65. С применением 3,42 г метил-6-метилпиразин-2-карбоксилата и 4,40 г NBS реакцию бромирования проводили способом, сходным со способом примера получения 62. После этого, с применением 10 мл морфолина в качестве амина проводили реакцию, сходную с реакцией примера получения 9, получая при этом 987 мг метил-6-(морфолин-4-илметил)пиразин-2-карбоксилата. Пример получения 66. С применением 1,2 г трет-бутил-4-(4-этокси-4-оксобутаноил)пиперазин-1-карбоксилата и 1,0 мл 4,0 М раствора хлорида водорода в этилацетате проводили реакцию, сходную с реакцией примера получения 35, получая при этом 900 мг гидрохлорида этил-4-оксо-4-(пиперазин-1-ил)бутаноата. Пример получения 67. К смеси 306 мг гидрохлорида N-циклопропил-N-[3-(3-[(4-2-[4-(метоксикарбонил)фенил]этил фенил)карбамоил]-4,5,6,7-тетрагидро-1-бензотиофен-2-илкарбамоил)бензил]глицина и 5,0 мл дихлорметана добавляли 0,182 мл триэтиламина, 91 мг гидрохлорида метил-N-метилглицината, 125 мгWSCгидрохлорида и 88 мг HOBt с последующим перемешиванием в течение 15 ч при комнатной температуре. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, получая при этом 152 мг метил-N-циклолропил-N-[3-(3-[(4-2-[4-(метоксикарбонил)фенил]этил фенил)карбамоил]-4,5,6,7-тетрагидро-1-бензотиофен-2-илкарбамоил)бензил]глицил-N-метилглицината. Пример получения 68. Способом, сходным со способом примера получения 37, 197 мг метил-4-(2-4-[(2-[(3-[(2 гидроксиэтил)(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензстиофен-3-илкарбонил)амино]фенилэтил)бензоата подвергали реакции с 0,10 мл тионилхлорида, и затем полученный продукт подвергали реакции с 32 5 мг этилизонипеколята, получая при этом 206 мг этил-1-(2-[3-(3-[(4-2[4-(метоксикарбонил)фенил]этилфенил)карбамоил]-4,5,6,7-тетрагидро-1-бензотиофен-2-илкарбамоил) бензил](пентан-3-ил)аминоэтил)пиперидин-4-карбоксилата. Пример получения 69. К смеси 2,88 г бромида (5-[(бензилокси)карбонил]-2-тиенилметил)(трифенил)фосфония, 823 мг 4 нитробензальдегида и 30 мл ТГФ по каплям добавляли 1,0 мл 5,0 М раствора метоксида натрия в метаноле с последующим перемешиванием в течение ночи при комнатной температуре. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали последовательно 1,0 М хлористо-водородной кислотой, насыщенным водным, раствором гидрокарбоната натрия и насыщенным раствором соли и затем сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан : этилацетат = 4:6). К полученному остатку добавляли 10 мл метанола и 10 мл ТГФ, и к смеси в потоке аргона добавляли 98 мг 10% палладия на угле с последующим перемешиванием в течение ночи при комнатной температуре в атмосфере водорода. Реакционную смесь фильтровали с применением целита, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле(гексан : этилацетат = 1:1), получая при этом 765 мг метил-5-[2-(4-аминофенил)этил]тиофен-2-карбоксилата. Соединения примеров получения 70-315, показанные в нижеследующей таблице, получали способом, сходным со способами примеров получения 1-69. В нижеследующей таблице показаны структура,физико-химические данные и способ получения соединений примеров получения. Пример 1. К смеси 1,00 г метил-4-2-[4-([2-(3-[(пентан-3-иламино)метил]бензоиламино)-4,5,6,7-тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]этилбензоата, 1,00 г триацетоксиборогидрида натрия,0,50 мл уксусной кислоты и 20 мл метиленхлорида добавляли 473 мг этил-4-[метил-(2-оксоэтил)амино]4-оксобутаноата с последующим перемешиванием в течение 1 ч при комнатной температуре. К реакционной смеси добавляли 498 мг триацетоксиборогидрида натрия и 237 мг этил-4-[метил-(2-оксоэтил) амино]-4-оксобутаноата с последующим перемешиванием в течение 2 ч при комнатной температуре. К реакционной смеси добавляли водный раствор гидрокарбоната натрия с последующей экстракцией метиленхлоридом. Органический слой сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на основном силикагеле (этилацетат), тем самым получая 1,19 г метил-4-(2-4-[(2-[(3-[2-[(4-этокси-4-оксобутаноил)(метил)амино] этил(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата. Пример 2. Смесь 1,18 г метил-4-(2-4-[(2-[(3-[2-[(4-этокси-4-оксобутаноил)(метил)амино]этил(пентан-3 ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил) бензоата, 5,0 мл 1,0 M водного раствора гидроксида натрия и 24 мл этанола подвергали нагреванию при кипячении с обратным холодильником в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении и к ней добавляли 4 мл 1,0 М хлористо-водородной кислоты. Затем к смеси добавляли 600 мг лактобионовой кислоты для нейтрализации смеси, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (10% метанол/хлороформ), получая при этом 1,10 г продукта. 3,0 мл ацетонитрила и 0,40 мл 1,0 М хлористо-водородной кислоты добавляли к 300 мг этого продукта, и реакционную смесь очищали колоночной хроматографией ODS (50% ацетонитрил/0,01 М хлористоводородная кислота) с последующей лиофилизацией, получая при этом 253 мг гидрохлорида 4-(2-4-[(2-[(3-[2-[(3-карбоксипропаноил)(метил)амино]этил(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензойной кислоты. Пример 2 А. К смеси 100 мг 4-(2-4-[(2-[(3-[2-[(3-карбоксипропаноил)(метил)амино]этил(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофэн-3-илкарбонил)амино]фенил этил)бензойной кислоты, которую получали хроматографической очисткой, как описано в примере 2, 3,0 мл этанола, 1,5 мл воды и 0,26 мл 1,0 М водного раствора гидроксида натрия по каплям добавляли 1,3 мл 0,1 М водного раствора хлорида магния. Реакционную смесь перемешивали в течение ночи с нагреванием при кипячении с обратным холодильником, и затем осажденное твердое вещество собирали фильтрованием, получая при этом 89 мг гидрата 4-(2-4-[(2-[(3-[2-[(3-карбоксилатопропаноил)(метил)амино]этил(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил) амино]фенилэтил)бензоата магния в виде кристаллов. ESI+:781. Пример 3. Смесь 100 мг метил-[(4-нитрофенокси)карбонил]оксиацетата и 5,0 мл ТГФ добавляли к смеси 180 мг метил-4-[2-(4-[(2-[3-([2-(метиламино)этил](пентан-3-ил)аминометил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата, 0,15 мл N-этил-N-изопропилпропан 2-амина и 5,0 мл ТГФ при охлаждении льдом с последующим перемешиванием в течение 3 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, и к остатку добавляли этилацетат и насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом. Органический слой промывали последовательно насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным раствором соли и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на основном силикагеле (гексан:хлороформ=4:6), получая при этом 204 мг метил-4-2-[4-([2-(3-[7-метил 3,6-диоксо-10-(пентан-3-ил)-2,5-диокса-7,10-диазаундекан-11-ил]бензоиламино)-4,5,6,7-тетрагидро-1 бензотиофен-3-ил]карбониламино)фенил]этилбензоата. Пример 4. К смеси 203 мг метил-4-2-[4-([2-(3-[7-метил-3,6-диоксо-10-(пентан-3-ил)-2,5-диокса-7,10-диазаундекан-11-ил]бензоиламино)-4,5,6,7-тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]этилбензоата,4,0 мл метанола и 4,0 мл ТГФ добавляли 1,5 мл 1,0 М водного раствора гидроксида натрия при комнатной температуре с последующим перемешиванием в течение 14 ч при 60 С. К реакционной смеси при охлаждении льдом добавляли 1,5 мл 1,0 М хлористо-водородной кислоты с последующим концентрированием при пониженном давлении. К остатку добавляли смешанный растворитель (метанол/хлороформ=15/85), нерастворимое вещество отфильтровывали, и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (15% метанол/хлороформ). К полученному продукту добавляли смешанный растворитель (ацетонитрил/вода=90/10), к смеси при охлаждении льдом добавляли 0,5 мл 1,0 М хлористо-водородной кислоты, и растворитель удаляли при пониженном давлении. Остаток подвергали лиофилизации, получая при этом 18 6 мг гидрохлорида 4-(24-[(2-[(3-[(2-[(карбоксиметокси)карбонил](метил)аминоэтил)(пентан-3-ил)амино]метилбензоил) амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензойной кислоты. Пример 4 А. К смеси 100 мг 4-(2-4-[(2-[(3-[(2-[(карбоксиметокси) карбонил](метил)аминоэтил)(пентан-3 ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил) бензойной кислоты, которую получали хроматографической счисткой, как описано в примере 4, и 0,5 мл этанола добавляли 0,26 мл 1,0 М водного раствора гидроксида натрия при комнатной температуре с последующим перемешиванием в течение 15 мин при 80 С. К реакционной смеси по каплям добавляли 1,3 мл 0,1 М водного раствора хлорида магния, и реакционную смесь перемешивали в течение 30 мин с нагреванием при кипячении с обратным холодильником. К реакционной смеси добавляли 0,49 мл воды с последующим нагреванием при кипячении с обратным холодильником в течение дополнительного 1 ч. К реакционной смеси добавляли 1,5 мл этанола с последующим перемешиванием в течение дополнитель- 23023955 ного 1 ч с нагреванием при кипячении с обратным холодильником, и затем смесь охлаждали до комнатной температуры. Осажденное твердое вещество собирали фильтрованием, получая при этом 105 мг гидрата 4-(2-4-[(2-[(3-[(2-[(карбоксилатометокси)карбонил](метил)аминоэтил)(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата магния в виде кристаллов. ESI+: 783. Пример 5. Смесь 195 мг метил-4-[2-(4-[(2-[3-(11-циклопропил-8-метил-7-оксо-2,5-диокса-8,11-диазадодекан 12-ил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата, 1,0 мл 1,0 М водного раствора гидроксида натрия и 5,0 мл метанола перемешивали в течение 15 ч при 60 С. Реакционную смесь концентрировали при пониженном давлении, к остатку добавляли 1,0 мл 1,0 М хлористо-водородной кислоты и проводили экстрагирование с применением хлороформа. Органический слой сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (10% метанол/хлороформ). Полученное подобное пене вещество растворяли в 5,0 мл этилацетата, и к полученному при охлаждении льдом добавляли 0,13 мл 4,0 М раствора хлорида водорода в этилацетате с последующим перемешиванием в течение 2 ч при комнатной температуре. Осажденное твердое вещество собирали фильтрованием и промывали этилацетатом с последующей сушкой при пониженном давлении, получая при этом 108 мг гидрохлорида 4-[2-(4-[(2-[3-(11-циклопропил-8-метил-7-оксо-2,5-диокса-8,11-диазадодекан-12-ил)бензоил] амино 4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензойной кислоты. Пример 6. Смесь 140 мг метил-4-2-[4-([2-(3-[(циклопропил-2-[(2-этокси-2-оксоэтил)амино]этиламино) метил]бензоиламино)-4,5,6,7-тетрагидро-1-бензотиофен-3-ил]карбониламино)фенил]этилбензоата,1,0 мл 1,0 водного раствора гидроксида натрия, 1,0 мл метанола и 2,0 мл ТГФ перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли 1,0 мл 1,0 М хлористо-водородной кислоты. Осажденное твердое вещество собирали фильтрованием, получая при этом 113 мг 4-(2-4-[(2[(3-[2-[(карбоксиметил)амино]этил(циклопропил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1 бензотиофен-3-илкарбонил)амино]фенилэтил)бензойной кислоты. Пример 7. С применением 160 мг метил-4-[2-(4-[(2-[3-(циклопропил-[2-(метиламино)этил]аминометил) бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата и 70 мг метил-3-(бромметил) бензоата в качестве исходных веществ последовательно проводили алкилирование,сходное с алкилированием примера получения 30, и гидролиз, сходный с гидролизом примера 2, получая при этом 69 мг дигидрохлорида 3-[2-[(3-[3-(4-[2-(4-карбоксифенил)этил]фенилкарбамоил)-4,5,6,7 тетрагидро-1-бензотиофен-2-ил]карбамоилбензил)(циклопропил)амино]этил(метил)амино]метилбензойной кислоты. Пример 8. С применением 320 мг метил-4-(2-5-[(2-[(2-[2-[(4-трет-бутокси-4-оксобутаноил)(метил)амино] этил(пентан-3-ил)амино]метилизоникотиноил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]пиридин-2-илэтил)бензоата в качестве исходного вещества проводили удаление третбутильной группы при помощи 3,0 мл TFA в условиях, сходных с условиями примера 10, как описано ниже, и гидролиз, сходный с гидролизом примера 2, получая при этом 279 мг тригидрохлорида 4-(2-5[(2-[(2-[2-[(3-карбоксипропаноил)(метил)амино]этил(пентан-3-ил)амино]метилизоникотиноил) амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]пиридин-2-илэтил)бензойной кислоты. Пример 9. Смесь 180 мг 4-[2-(4-[(2-[3-([4-(диэтоксифосфорил)бутаноил](изопропил)аминометил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-ил)карбонил]аминофенил)этил]бензойной кислоты,0,040 мл бромтриметилсилана и 3,6 мл хлороформа перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду с последующей экстракцией хлороформом. Органический слой сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, получая при этом 42 мг 4-(2-4-[(2-[(3-[4[этокси(гидрокси)фосфорил]бутаноил(изопропил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1 бензотиофен-3-илкарбонил)амино]фенилэтил)бензойной кислоты. Пример 10. Смесь 675 мг метил-5-[3-[(3-[6-(1-трет-бутокси-2-метил-1-оксопропан-2-ил)пиридин-3-ил]карбамоил-4,5,6,7-тетрагидро-1-бензотиофен-2-ил)карбамоил]бензил(пентан-3-ил)амино]-2,2-диметил-5 оксопентаноата, 10 мл метиленхлорида и 1,3 мл TFA перемешивали 15 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, и к остатку добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией с применением этилацетата. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном, давлении. Остаток очищали колоночной хроматографией на силикагеле (10% метанол/хлороформ), получая при этом 550 мг 2-5-[(2-[(3-[(5-метокси-4,4-диметил-5 оксопентаноил)(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3- 24023955 илкарбонил)амино]пиридин-2-ил-2-метилпропановой кислоты. Пример 11. К смеси 410 мг 2-5-[(2-[(3-[(5-метокси-4,4-диметил-5-оксопентаноил)(пентан-3-ил)амино]метил бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]пиридин-2-ил-2 метилпропановой кислоты, 75 мг 4-метилморфолина и 10 мл ТГФ добавляли 0,089 мл изобутилхлорформиата при охлаждении льдом с последующим перемешиванием в течение 10 мин при комнатной температуре. Реакционную смесь фильтровали, и затем фильтрат охлаждали льдом. К нему добавляли 65 мг борогидрида натрия и 1,0 мл воды с последующим перемешиванием в течение 10 мин при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:2), получая при этом 155 мг метил-5-[3-[(3-[6-(1-гидрокси-2-метилпропан-2-ил)пиридин-3-ил]карбамоил-4,5,6,7-тетрагидро-1 бензотиофен-2-ил)карбамоил]бензил(пентан-3-ил)амино]-2,2-диметил-5-оксопентаноата. Пример 12. Смесь 150 мг 4-[(2-[3-(мороолин-4-илметил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3 ил)карбонил]аминобензойной кислоты, 57 мг N,N-диэтил-п-фенилендиамина, 61 мг WSCгидрохлорида,42 мг HOBt и 1,5 мл метиленхлорида перемешивали в течение 3 ч при комнатной температуре. К реакционной смеси добавляли воду с последующей экстракцией метиленхлоридом. Органический слой сушили над безводным сульфатом натрия, и растворитель удаля:ли при пониженном давлении. Остаток очищали колоночной хроматографией на основном силикагеле (2% метанол/хлороформ), получая при этом маслянистое вещество. К этому веществу добавляли метанол и 4,0 М раствор хлорида водорода в этилацетате,и раствор концентрировали при пониженном давлении. Остаток обрабатывали этилацетатом, получая при этом 85 мг дигидрохлорида N-(4-[4-(диэтиламино)фенил]карбамоилфенил)-2-[3-(морфолин-4 илметил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида. Пример 13. С применением 340 мг 2-[(3-[циклопропил(пиперидин-4-ил)амино]метилбензоил)амино]-N-[4(диэтиламино)фенил]-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида и 99 мг этилбромацетата, реакцию проводили в условиях, сходных с условиями примера получения 30, получая при этом 310 мг этил[4-(циклопропил 3-[(3-[4-(диэтиламино)фенил]карбамоил-4,5,6,7-тетрагидро-1-бензотиофен-2-ил) карбамоил]бензиламино)пиперидин-1-ил]ацетата. Пример 14. С применением 1,71 г трет-бутил-3-(гидроксиметил)-4-[3-(3-[(4-2-[4-(метоксикарбонил)фенил] этилфенил)карбамоил]-4,5,6,7-тетрагидро-1-бензотиофен-2-илкарбамоил)бензил]пиперазин-1-карбоксилата и 17 мл TFA реакцию проводили в условиях, аналогичных условиям примера получения 12, получая при этом 1,38 г метил-4-(2-4-[(2-[(3-[2-(гидроксиметил)пиперазин-1-ил]метилбензоил)амино]4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата. Пример 15. К смеси 200 мг 2-[3-(хлорметил)бензоил]амино-N-[4-(диэтиламино)фенил]-4,5,6,7-тетрагидро-1 бензотиофен-3-карбоксамида и 8 мл ДМФА добавляли 1,0 мл морфолина с последующим перемешиванием в течение 3 дней при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (хлороформ : метанол : водный раствор аммиака = 50:1:0,1). Полученный остаток растворяли в смешанном растворителе этилацетата и этанола (4:1), и в раствор дополнительно добавляли 1,0 мл 4,0 М раствора хлорида водорода в этилацетате. Осажденное твердое вещество собирали фильтрованием, получая при этом 183 мг дигидрохлоридаN-[4-(диэтиламино)фенил]-2-[3-(морфолин-4-илметил)бензоил]амино-4,5,6,7-тетрагидро-1 бензотиофен-3-карбоксамида. Пример 16. С применением 400 мг 2-[3-(хлорметил)бензоил]амино-N-[4-(пиридин-4-илметил)фенил]-4,5,6,7 тетрагидро-1-бензотиофен-3-карбоксамида и 819 мг этил-4-(циклопропиламино)циклогексанкарбоксилата проводят алкилирование, сходное с алкилированием примера получения 30, и затем проводят гидролиз в условиях, сходных с условиями примера 5, получая при этом 261 мг дигидрохлорида 4(циклопропил-3-[(3-[4-(пиридин-4-илметил)фенил]карбамоил-4,5,6,7-тетрагидро-1-бензотиофен-2 ил)карбамоил]бензиламино)циклогексанкарбоновой кислоты. Пример 17. К смеси 350 мг 2-[3-(морфолин-4-илметил)фенил]-5,6,7,8-тетрагидро-4 Н-[1]бензотиено[2,3-d][1,3] оксазин-4-она, 150 мг N2,N2-диэтилпиримидин-2,5-диамина и 5,0 мл ТГФ добавляли по каплям 1,0 мл гексаметилдисилазида лития (1,0 М в ТГФ) при охлаждении льдом с последующим перемешиванием в течение 1 ч при такой же температуре. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией смеси этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (метанол/хлороформ). К остатку последовательно добавляли этилацетат и 0,5 мл 4,0 М раствора хлорида водорода в этилацетате с последующим перемешиванием в течение 30 минут при комнатной температуре. Нерастворимое вещество собирали фильтрованием, получая при этом 174 мг дигидрохлорида N-[2(диэтиламино)пиримидин-5-ил]-2-[3-(морфолин-4-илметил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида. Пример 18. С применением 250 мг метил-4-(2-4-[(2-[(3-[цис-4-[(бензилокси)карбонил]циклогексил(изопропил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенил этил)бензоата и 10 мг 10% палладия на угле проводили каталитическое восстановление водородом в условиях, сходных с условиями примера получения 5, получая при этом 88 мг цис-4-(изопропил-[3-(3-[(42-[4-(метоксикарбонил)фенил]этилфенил)карбамоил]-4,5,6,7-тетрагидро-1-бензотиофен-2-илкарбамоил)бензил]аминоциклогексанкарбоновой кислоты. Пример 19. С применением 5,34 г 2-[3-(хлорметил)бензоил]амино]-N-[4-(диэтиламино)фенил]-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида и 13,1 г 1-[4-(циклопропиламино)пиперидин-1-ил]этанона в качестве исходных веществ проводили реакцию в условиях, сходных с условиями примера получения 2 9,получая при этом 5,37 г 2-[(3-[(1-ацетилпиперидин-4-ил)(циклолропил)амино]метилбензоил)амино]-N[4-(диэтиламино)фенил]-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида. Пример 20. С применением 23 мг метил-4-[2-(4-[(2-[3-(хлорметил)бензоил]амино-4,5,6,7-тетрагидро-1 бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата и 19 мг метил-[(1-этилпропил)амино]ацетата в качестве исходных веществ проводили алкилированием в условиях, сходных с условиями примера получения 30, и затем проводили гидролиз в условиях, сходных с условиями примера 6, получая при этом 6,7 мг 4-(2-4-[(2-[(3-[(карбоксиметил)(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1 бензотиофен-3-илкарбонил)амино]фенилэтил)бензойной кислоты. Пример 21. С применением 250 мг 2-амино-N-[4-(пиридин-4-илметил)фенил]-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида и 244 мг 5-(морфолин-4-илметил)-2-фуранкарбоновой кислоты в качестве исходных веществ проводили реакцию конденсации в условиях, сходных с условиями примера получения 16, получая при этом 307 мг дигидрохлорида 2 -[5-(морфолин-4-илметил)-2-фуроил]амино-N-[4-(пиридин-4 илметил)фенил]-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида. Пример 22. Смесь 0,07 мл гексаметилдисилазида лития (1,0 М в ТГФ) и 0,2 мл ТГФ добавляли к смеси 11,5 мг 2-[3-(морфолин-4-илметил)фенил]-5,6,7,8-тетрагидро-4 Н-[1]бензотиено[2,3-d][1,3]оксазин-4-она, 4,9 мг 5-циклопропил-1,3,4-тиадиазол-2-амина и 0,8 мл ТГФ с последующим перемешиванием в течение ночи при комнатной температуре. К реакционной смеси добавляли хлороформ и насыщенный водный раствор хлорида аммония, и органический слой отделяли. После удаления растворителя при пониженном давлении полученный остаток очищали, получая при этом 11,4 мг N-(5-циклопропил-1,3,4-тиадиазол-2-ил)-2[3-(морфолин-4-илметил)бензоил]амино-4,5,6,7-тетрагидро-1-бензотиофен-3-карбоксамида. Пример 67 А. К смеси 90 мг гидрохлорида 4-(2-4-[(2-[(3-[2-[(4-карбокси-4-метилпентаноил)(метил)амино] этил(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензойной кислоты и 0,5 мл этанола добавляли 0,32 мл 1,0 М водного раствора гицроксида натрия при комнатной температуре с последующим перемешиванием в течение 5 мин при комнатной температуре. К реакционной смеси при 80 С по каплям добавляли 1,1 мл 0,1 М водного раствора хлорида магния и затем 0,38 мл воды с последующим перемешиванием снова в течение 30 мин при 80 С. К реакционной смеси добавляли 0,4 мл EtOH с последующим перемешиванием снова в течение 14 ч при 80 С. К реакционной смеси добавляли 0,9 мл воды с последующим перемешиванием в течение дополнительного 1 ч при 80 С. К реакционной смеси добавляли 1,8 мл воды с последующим перемешиванием снова в течение 2 ч при 80 С. После охлаждения реакционной смеси до комнатной температуры осадок собирали фильтрованием, получая при этом 86 мг гидрата 4-(2-(4-[(2-[(3-[2-[(4-карбоксилато-4 метилпентаноил)(метил)амино]этил(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1 бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата магния в виде кристаллов. ESI+:823. Пример 109 А. К смеси 80 мг 4-(2-4-[(2-[(3-[(4-карбокси-4-метилпентаноил)(пентан-3-ил)амино]метилбензоил) амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензойной кислоты и 0,4 мл этанола добавляли 0,21 мл 1,0 М водного раствора гидроксида натрия при комнатной температуре с последующим перемешиванием в течение: 5 мин при комнатной температуре. К реакционной смеси по каплям добавляли при 80 С 1,0 мл 0,1 М водного раствора хлорида магния и затем к реакционной смеси добавляли 0,39 мл воды с последующим перемешиванием снова в течение 30 мин при 80 С. К реакционной смеси добавляли 0,4 мл этанола с последующим перемешиванием снова в течение 30 мин при 80 С. К реакционной смеси добавляли 0,8 мл воды с последующим перемешиванием в течение 14 ч при 80 С и затем добавляли еще 0,8 мл воды с последующим перемешиванием снова в течение 2 ч при 80 С. После охлаждения реакционной смеси до комнатной температуры осадок собирали фильтрованием, получая при этом 74 мг гидрата 4-(2-4-[(2-[(3-[(4-карбоксилато-4-метилпентаноил)(пентан-3-ил)амино]метил бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата магния в виде кристаллов. ESI-:764. Пример 121 А. К смеси 80 мг 4-(2-4-[(2-[(3-[(4-карбокси-3,3-диметилбутаноил)(пентан-3-ил)амино]метил бензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензойной кислоты и 0,4 мл этанола добавляли 0,21 мл 1,0 М водного раствора гидроксида натрия при комнатной температуре с последующим перемешиванием в течение 5 мин при комнатной температуре. К реакционной смеси при 80 С по каплям добавляли 1,0 мл 0,1 М водного раствора хлорида магния и затем к ней добавляли 0,39 мл воды с последующим перемешиванием снова в течение 30 мин при 80 С. К реакционной смеси добавляли 0,4 мл этанола с последующим перемешиванием в течение 30 мин при 80 С. К реакционной см:еси добавляли 0,8 мл воды с последующим перемешиванием в течение 14 ч при 80 С и затем к ней дополнительно добавляли 0,8 мл воды с последующим перемешиванием снова в течение 2 ч при 80 С. После охлаждения реакционной смеси до комнатной температуры осадок собирали фильтрованием, получая при этом 77 мг гидрата 4-(2-4-[(2-[(3-[(4-карбоксилато-3,3-диметилбутаноил)(пентан-3-ил)амино]метилбензоил)амино]-4,5,6,7-тетрагидро-1-бензотиофен-3-илкарбонил)амино]фенилэтил)бензоата магния в виде кристаллов. ESI-:764. Пример 148. С применением 29 мг метил-4-[2-(4-[(2-[3-(хлорметил)бензоил]амино-4,5,6,7-тетрагидро-1 бензотиофен-3-ил)карбонил]аминофенил)этил]бензоата и 30 мг гидрохлорида метил-3-(аминометил) бензоата в качестве исходных веществ проводили аминирование в условиях, сходных с условиями примера получения 30, после этого проводили алкилирование МР-триацетоксиборогидридом (Biotage) в условиях, сходных с условиями примера 1, и затем проводили гидролиз в условиях, сходных с условиями примера 6, получая при этом 15 мг 3-[3-[3-(4-[2-(4-карбоксифенил)этил]фенилкарбамоил)-4,5,6,7 тетрагидро-1-бензотиофен-2-ил]карбамоилбензил)(изопропил)амино]метилбензойной кислоты. Соединения примеров 23-246, показанные в нижеследующей таблице, получали способами, сходными со способами примеров 1-22. В следующей таблице показана структура, физико-химические данные и способ получения соединений примеров. В табл. 50-90 Сравнительные примеры обозначены звездочкой . Таблица 3
МПК / Метки
МПК: A61P 43/00, C07D 333/80, A61K 31/5377, C07D 495/04, A61P 13/12, C07D 453/02, C07D 333/68, A61P 7/00, C07D 413/12, A61P 19/00, A61K 31/4436, A61K 31/444, A61K 31/506, C07D 417/12, C07D 333/78, A61K 31/4535, C07D 409/14, A61K 31/496, A61K 31/381, C07D 409/12, A61K 31/439
Метки: n-тиенилбензамида, производное, аминоалкилзамещенного
Код ссылки
<a href="https://eas.patents.su/30-23955-proizvodnoe-aminoalkilzameshhennogo-n-tienilbenzamida.html" rel="bookmark" title="База патентов Евразийского Союза">Производное аминоалкилзамещенного n-тиенилбензамида</a>
Предыдущий патент: Терапия 3-гидроксиантраниловой кислотой (3-haa) для профилактики и лечения гиперлипидемии и ее сердечно-сосудистых осложнений
Следующий патент: Полимерные микросферы в качестве разлагаемых добавок для снижения водоотдачи для нефтепромыслового применения
Случайный патент: Способ производства железорудных агломератов с использованием связующего, содержащего силикат натрия












