Производное пиразолохинолина
Номер патента: 23493
Опубликовано: 30.06.2016
Авторы: Сугита Мари, Камидзо Кадзунори, Ямамото Хирофуми, Сео Рюси, Ямамото Сатоси, Укай Ацуси, Каизава Хироюки
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
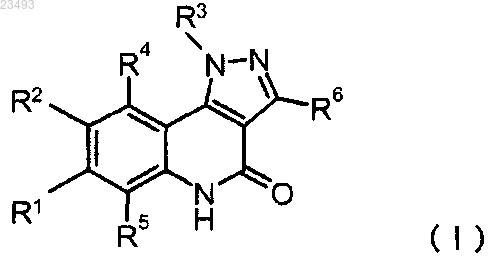
в которой
R1 представляет собой метил;
R2 представляет собой группу формулы (II)

R3 представляет собой (3S)-тетрагидрофуран-3-ил или тетрагидро-2Н-пиран-4-ил;
R4, R5 и R6 представляют собой водород и
Ra и Rb вместе с соседним атомом азота образуют 4-(2,2,2-трифторэтил)пиперазин-1-ил или 4-(3,3,3-трифторпропил)пиперазин-1-ил.
2. Соединение или его фармацевтически приемлемая соль, выбранное из группы, состоящей из
8-[(4-{[(2S)-2-фторпропил]окси}пиперидин-1-ил)карбонил]-7-метил-1-(тетрагидро-2Н-пиран-4-ил)-1,5-дигидро-4Н-пиразоло[4,3-с]хинолин-4-она,
7-метил-1-(тетрагидро-2Н-пиран-4-ил)-8-{[4-(3,3,3-трифторпропил)пиперазин-1-ил]карбонил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она,
8-[(4-{[(2R)-2-фторпропил]окси}пиперидин-1-ил)карбонил]-7-метил-1-(тетрагидро-2Н-пиран-4-ил)-1,5-дигидро-4Н-пиразоло[4,3-с]хинолин-4-она,
7-метил-1-[(3S)-тетрагидрофуран-3-ил]-8-{[4-(3,3,3-трифторпропил)пиперазин-1-ил]карбонил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она,
8-{[4-(2-метоксиэтил)пиперидин-1-ил]карбонил}-7-метил-1-[(3S)-тетрагидрофуран-3-ил]-1,5-дигидро-4Н-пиразоло[4,3-с]хинолин-4-она,
7-метил-1-[(3S)-тетрагидрофуран-3-ил]-8-{[4-(2,2,2-трифторэтил)пиперазин-1-ил]карбонил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-она.
3. Соединение или его фармацевтически приемлемая соль по п.2, которое представляет собой 8-[(4-{[(2S)-2-фторпропил]окси}пиперидин-1-ил)карбонил]-7-метил-1-(тетрагидро-2Н-пиран-4-ил)-1,5-дигидро-4Н-пиразоло[4,3-с]хинолин-4-он.
4. Соединение или его фармацевтически приемлемая соль по п.2, которое представляет собой 7-метил-1-(тетрагидро-2Н-пиран-4-ил)-8-{[4-(3,3,3-трифторпропил)пиперазин-1-ил]карбонил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он.
5. Соединение или его фармацевтически приемлемая соль по п.2, которое представляет собой 8-[(4-{[(2R)-2-фторпропил]окси}пиперидин-1-ил)карбонил]-7-метил-1-(тетрагидро-2Н-пиран-4-ил)-1,5-дигидро-4Н-пиразоло[4,3-с]хинолин-4-он.
6. Соединение или его фармацевтически приемлемая соль по п.2, которое представляет собой 7-метил-1-[(3S)-тетрагидрофуран-3-ил]-8-{[4-(3,3,3-трифторпропил)пиперазин-1-ил]карбонил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он.
7. Соединение или его фармацевтически приемлемая соль по п.2, которое представляет собой 8-{[4-(2-метоксиэтил)пиперидин-1-ил]карбонил}-7-метил-1-[(3S)-тетрагидрофуран-3-ил]-1,5-дигидро-4Н-пиразоло[4,3-с]хинолин-4-он.
8. Соединение или его фармацевтически приемлемая соль по п.2, которое представляет собой 7-метил-1-[(3S)-тетрагидрофуран-3-ил]-8-{[4-(2,2,2-трифторэтил)пиперазин-1-ил]карбонил}-1,5-дигидро-4Н-пиразоло[4,3-c]хинолин-4-он.
9. Фармацевтическая композиция, ингибирующая PDE9 (фосфодиэстераза 9) активность, содержащая соединение или его фармацевтически приемлемую соль по п.1 или 2 для предотвращения или лечения гипоактивного мочевого пузыря, нарушения мочеиспускания при гипоактивном мочевом пузыре, нарушения мочеиспускания, сопровождающего гиперплазию предстательной железы, и фармацевтически приемлемый эксципиент.
Текст
Предложено соединение общей формулы (I) или его фармацевтически приемлемая соль, которое обладает PDE9-ингибирующей активностью и является применимым в качестве активного ингредиента средства для лечения и/или предотвращения нарушения накопительной функции мочевого пузыря, нарушения мочеиспускания, заболеваний мочевого пузыря/уретральных заболеваний и тому подобного. Авторы настоящего изобретения исследовали соединение,которое обладает PDE9-ингибирующим действием и является применимым в качестве активного ингредиента средства для лечения и/или предотвращения нарушения накопительной функции мочевого пузыря, нарушения мочеиспускания, заболеваний мочевого пузыря/уретральных заболеваний и тому подобного, и таким образом обнаружили, что производное пиразолохинолина обладает PDE9-ингибирующим действием, тем самым завершив настоящее изобретение. Производное пиразолохинолина настоящего изобретения обладает PDE9-ингибирующим действием и его можно применять в качестве агента для предотвращения и/или лечения нарушения накопительной функции мочевого пузыря, нарушения мочеиспускания, заболеваний мочевого пузыря/уретральных заболеваний и тому подобного. Настоящее изобретение также относится к фармацевтической композиции, ингибирующей PDE9 активность, включающей соединение формулы (I), и фармацевтически приемлемый эксципиент где радикалы определены в формуле изобретения. Область техники, к которой относится изобретение Настоящее изобретение относится к производному пиразолохинолина, которое является применимым в качестве активного ингредиента фармацевтической композиции, в частности фармацевтической композиции для лечения нарушения накопительной функции мочевого пузыря, нарушения мочеиспускания, заболеваний мочевого пузыря/уретральных заболеваний. Уровень техники Важные роли в нарушении накопительной функции мочевого пузыря играют накопление мочи и мочеиспускание, которые регулируются координированным действием мочевого пузыря и мочеиспускательного канала. То есть, во время накопления мочи гладкая мышца мочевого пузыря релаксирует и сфинктер мочеиспускательного канала сокращается, в результате чего поддерживается состояние, при котором уретральная резистентность является высокой, и поддерживается также удержание мочи. С другой стороны, во время мочеиспускания гладкая мышца мочевого пузыря сокращается, тогда как гладкая мышца мочеиспускательного канала релаксируется и сокращение наружного уретрального сфинктера также ингибируется. Примеры нарушения мочеиспускания включают нарушение накопительной функции мочевого пузыря, такое как гиперактивный мочевой пузырь и тому подобное, при которой моча не может удерживаться во время накопления мочи, и нарушение мочеиспускания, при котором моча не может достаточно отводиться вследствие повышения уретральной резистентности и уменьшения сократительной способности мочевого пузыря. Эти два нарушения могут проявляться одновременно. При лечении нарушения накопительной функции мочевого пузыря, такого как гиперактивный мочевой пузырь и тому подобное, часто применяли антихолинергические агенты. Однако эти агенты не могут обеспечить достаточное терапевтическое действие и, кроме того, проявляют побочные действия,основанные на антихолинергическом действии (сухой рот, желудочно-кишечные симптомы, глазные симптомы, аритмии или тому подобное) и, соответственно, введение таких агентов может часто прерываться. Кроме того, антихолинергические агенты снижают сократительную способность мочевого пузыря и поэтому противопоказаны для лечения учащения мочеиспускания/недержания мочи, сопровождающих непроходимость мочеиспускательного канала, такую как гиперплазия предстательной хелезы и тому подобное. Нарушение мочеиспускания вызывается повышением уретральной резистентности по время мочеиспускания или понижением сократительной способности мочевого пузыря. В качестве заболевания,вызывающего повышение уретральной резистентности, хорошо известным является нарушение мочеиспускания, сопровождающееся гиперплазией предстательной железы, которое характеризуется непроходимостью мочеиспускательного канала вследствие узелковой гипертрофии тканей простаты. Антагонист рецептора 1 теперь применяют с целью лечения нарушения мочеиспускания, сопровождающегося гиперплазией предстательной железы (см, например, непатентный документ 1). Другие причины повышения уретральной резистентности включают функциональные обструкции, такие как недостаточность уретральной релаксации во время мочеиспускания или диссинергия детрузора - наружного уретрального сфинктера и тому подобное, вследствие неврологических нарушений, таких как диабет, старение, повреждение костного мозга, операции на тазовых органах и тому подобное. У пациентов с этими заболеваниями имеется много случаев, в которых антагонист 1 является неэффективным. С другой стороны,уменьшение в сократительной способности мочевого пузыря во время мочеиспускания, называемое недостаточно активным мочевым пузырем, несокращающимся пузырем, нестабильным мочевым пузырем или тому подобным, также вызывает нарушение мочеиспускания. Известные факторы уменьшения сократительной способности мочевого пузыря включают старение, неврологические заболевания, такие как диабет, болезнь Паркинсона, рассеянный склероз и тому подобное, повреждение костного мозга и неврологические нарушения вследствие операции на тазовых органах. Примеры агента для лечения уменьшения сократительной способности мочевого пузыря во время мочеиспускания включают хлорид бетанхола, который является агонистом мускаринового рецептора, и бромид дистигмина, который является ингибитором холинэстеразы. Оба этих лекарственных средства имеют побочные действия, и поэтому удовлетворенность ими является низкой (см., например, непатентные документы 2 и 3). При нарушении мочеиспускания, вызванного увеличением уретральной резистентности или уменьшением сократительной способности мочевого пузыря, как описано выше, наблюдают остаточную мочу после мочеиспускания. Увеличенная остаточная моча может вызвать уменьшение эффективной способности мочевого пузыря и тем самым вызывать симптомы гиперактивного мочевого пузыря, такие как частое повторение мочеиспускания и тому подобное, или в некоторых случаях тяжелые симптомы, такие как гидронефроз, и с учетом этого имеется потребность в терапевтическом агенте, который является более эффективным, чем современный терапевтический агент. Известно, что система релаксации вследствие того, что оксид азота (NO) присутствует в гладкой мышце и NO, продуцированный в нервных окончаниях, локально активирует растворимую гунилатциклазу, присутствующую в клетках гладких мышц. Активированная гуанилатциклаза повышает содержание циклического монофосфата гуанозина (цГМФ) в клетках. С другой стороны, цГМФ разрушается с образованием 5'-ГМФ под действием фосфодиэстеразы (PDE), которая является ферментом, разрушаю-1 023493 щим цГМФ. Считается, что повышение концентрации внутриклеточного цГМФ значительно способствует релаксации гладких мышц. Поэтому уменьшение системы NO-цГМФ вызывает недостаточность релаксации гладкой мышцы. Описано, что, например, у пациентов, проявляющих непроходимость мочеиспускательного канала при гиперплазии предстательной железы или находящихся в пожилом возрасте,как описано выше, продуцирование NO значительно уменьшается (непатентные документы 4 и 5). В качестве подтипа PDE, который специфически разрушает цГМФ, известны PDE5, PDE6 и PDE9,и среди них PDE9 обладает более высокой субстратной аффинностью, чем PDE5 и PDE6 (непатентный документ 6). Кроме того, с той точки зрения, что при распределении экспрессии в различных тканяхPDE9 наблюдают при его самой высокой экспрессии в простате человека (непатентный документ 7), он играет важную роль в релаксации гладкой мышцы в более низкой части мочеиспускательного канала, и ингибитор PDE9 повышает релаксацию мочеиспускательного канала посредством цГМФ в ткани. Поэтому считается, что ингибитор PDE9 проявляет действие против нарушения мочеиспускания вследствие повышения уретральной резистентности. Поскольку ингибитор PDE9 уменьшает уретральную резистентность, можно предполагать его действие против нарушения мочеиспускания, при котором сократительная способность мочевого пузыря уменьшается. Кроме того, уменьшение остаточной мочи вследствие улучшения при нарушении мочеиспускания может привести к улучшению симптомов гиперактивного мочевого пузыря, таких как учащение мочеиспускания и тому подобное, или предотвращению почечных нарушений. Поэтому считается, что ингибитор PDE9 является применимым в качестве агента для предотвращения и/или лечения нарушения накопительной функции мочевого пузыря, нарушения мочеиспускания и заболеваний мочевого пузыря/уретральных заболеваний. Например, в качестве соединения, обладающего PDE5- и/или PDЕ 9-ингибирующим действием, в патентных документах 1 и 2 описаны производные хиноксалина, представленные нижеследующими формулами (А) и (В), соответственно. Далее, в патентных документах 3 и 4 описаны производное тиенопиримидина и производное хиназолина в качестве соединений, обладающих PDE5-и/или PDЕ 9 ингибирующим действием, соответственно. Кроме того, в патентных документах 5-12 описано производное пиразолопиридина, которое обладает PDE9-ингибирующим действием. Кроме того, в патентных документах 13-17 описаны соединения, представленные нижеследующими формулами (С)-(G), но не имеется конкретного описания соединений настоящего изобретения. Кроме того, не имеется описания, что соединение обладает PDЕ 9-ингибирующим действием и его можно применять для лечения нарушений в функции мочеиспускания. Химическая формула 1(Значения символов в формулах относятся к значениям каждой из соответствующих патентных публикаций). Предшествующий уровень техники Патентный документ[Патентный документ 17]: публикация Европейского патента 476544. Непатентный документ Сущность изобретения Проблемы, которые решаются изобретением Авторы настоящего изобретения предоставляет соединение, которое обладает PDE9 ингибирующим действием и является применимым в качестве активного ингредиента фармацевтической композиции для предотвращения и лечения нарушения накопительной функции мочевого пузыря, нарушения мочеиспускания, заболеваний мочевого пузыря/уретральных заболеваний и тому подобное. Способ решения проблем Авторы настоящего изобретения провели интенсивное исследование соединения, которое обладаетPDE9-ингибирующим действием, и в результате обнаружили, что соединение формулы (I) является применимым в качестве соединения, обладающего PDE9-ингибирующим действием, тем самым завершив настоящее изобретение. То есть, настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой солиR1 представляет собой метил, a R2 представляет собой группу формулы (II)Ra и Rb вместе с соседним атомом азота образуют 4-(2,2,2-трифторэтил)пиперазин-1-ил или 4-(3,3,3 трифторпропил)пиперазин-1-ил. Кроме того, настоящее изобретение относится к соединению или его фармацевтически приемлемой соли, выбранного из группы, состоящей из 8-[(4-[(2S)-2-фторпропил]оксипиперидин-1-ил)карбонил]-7-метил-1-(тетрагидро-2 Н-пиран-4-ил)1,5-дигидро-4 Н-пиразоло[4,3-с]хинолин-4-она,7-метил-1-(тетрагидро-2 Н-пиран-4-ил)-8- [4- (3,3,3-трифторпропил)пиперазин-1-ил]карбонил-1,5 дигидро-4 Н-пиразоло[4,3-c]хинолин-4-она,8-[(4-[(2R)-2-фторпропил]оксипиперидин-1-ил)карбонил]-7-метил-1-(тетрагидро-2 Н-пиран-4-ил)1,5-дигидро-4 Н-пиразоло[4,3-с]хинолин-4-она,7-метил-1-[(3S)-тетрагидрофуран-3-ил]-8-[4-(3,3,3-трифторпропил)пиперазин-1-ил]карбонил-1,5 дигидро-4 Н-пиразоло[4,3-c]хинолин-4-она,8-[4-(2-метоксиэтил)пиперидин-1-ил]карбонил-7-метил-1-[(3S)-тетрагидрофуран-3-ил]-1,5-дигидро-4 Н-пиразоло[4,3-с]хинолин-4-она,7-метил-1-[(3S)-тетрагидрофуран-3-ил]-8-[4-(2,2,2-трифторэтил)пиперазин-1-ил]карбонил-1,5 дигидро-4 Н-пиразоло[4,3-c]хинолин-4-она. Кроме того, настоящее изобретение к соединению или его фармацевтически приемлемой соли, которое представляет собой 8-[(4-[(2S)-2-фторпропил]оксипиперидин-1-ил)карбонил]-7-метил-1(тетрагидро-2 Н-пиран-4-ил)-1,5-дигидро-4 Н-пиразоло[4,3-с]хинолин-4-он. В другом воплощении изобретение относится к 7-метил-1-(тетрагидро-2 Н-пиран-4-ил)-8-[4-(3,3,3 трифторпропил)пиперазин-1-ил]карбонил-1,5-дигидро-4 Н-пиразоло[4,3-c]хинолин-4-ону или его фармацевтически приемлемой соли. Также настоящее изобретение относится к 8-[(4-[(2R)-2-фторпропил]оксипиперидин-1 ил)карбонил]-7-метил-1-(тетрагидро-2 Н-пиран-4-ил)-1,5-дигидро-4 Н-пиразоло[4,3-c]хинолин-4-ону или его фармацевтически приемлемой соли. В следующем воплощении изобретение относится к 7-метил-1-[(3S)-тетрагидрофуран-3-ил]-8-[4(3,3,3-трифторпропил)-пиперазин-1-ил]карбонил-1,5-дигидро-4 Н-пиразоло[4,3-c]хинолин-4-ону или его фармацевтически приемлемой соли. 8-[4-(2-Метоксиэтил)пиперидин-1-ил]карбонил-7-метил-1-[(3S)-тетрагидрофуран-3-ил]-1,5 дигидро-4 Н-пиразоло[4,3-с]хинолин-4-он или его фармацевтически приемлемая соль также являются предметом настоящего изобретения. Настоящее изобретение обеспечивает также 7-метил-1-[(3S) -тетрагидрофуран-3-ил]-8-[4-(2,2,2 трифторэтил)пиперазин-1-ил]карбонил-1,5-дигидро-4 Н-пиразоло[4,3-c]хинолин-4-он или его фармацев-4 023493 тически приемлемую соль. Помимо этого настоящее изобретение относится к фармацевтической композиции, ингибирующейPDE9 (фосфодиэстераза 9) активность, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, для предотвращения или лечения гипоактивного мочевого пузыря, нарушения мочеиспускания при гипоактивном мочевом пузыре, нарушения мочеиспускания, сопровождающего гиперплазию предстательной железы, и его фармацевтически приемлемый эксципиент. Далее, фармацевтическая композиция может включать агент для предотвращения или лечения нарушения накопительной функции мочевого пузыря, нарушения мочеиспускания и заболеваний мочевого пузыря/уретральных заболеваний и тому подобного, который включает соединение формулы (I) или его фармацевтически приемлемую соль. Далее "субъектом" является человек или другое животное, нуждающееся в таком предотвращении или лечении, и, в определенном варианте осуществления, человек, нуждающийся в таком предотвращении или лечении. В настоящем описании "нарушение накопительной функции мочевого пузыря" относится к нарушению функции накопления мочи (нарушению накопительной функции мочевого пузыря)" из-за которого моча не может удерживаться во время накопления, и "нарушение мочеиспускания" относится к "нарушению функции мочеиспускания (нарушение мочеиспускания)", из-за которого моча не может в достаточном количестве вытекать во время мочеиспускания вследствие повышенной уретральной резистентности и пониженной сократительной способности мочевого пузыря (Neurourol Urodynam, 21:pp.167-178 (2002. Применяемый в настоящем описании изобретения термин "заболевания мочевого пузыря/уретральные заболевания" включает "нарушение функции нижних мочевых путей" и "симптомы нижних мочевых путей (LUTS)" (Neurourol Urodynam, 21: pp. 167-178 (2002, которые являются симптомами, являющимися результатом нарушения функции нижних мочевых путей. Согласно этому, термины заболевания мочевого пузыря/уретральные заболевания, применяемые в контексте, включают "нарушения накопительной функции мочевого пузыря" и "нарушение мочеиспускания". В настоящем изобретении примеры заболеваний мочевого пузыря/уретральные заболевания включают в определенном варианте осуществления гипоактивный мочевой пузырь, гипотонический мочевой пузырь, несокращающийся мочевой пузырь, гипоактивность детрузора, нестабильный мочевой пузырь,недостаточность релаксации мочеиспускательного канала или диссинергию действия детрузоравнешнего уретрального сфинктера, гиперактивный мочевой пузырь и их симптомы нижних мочевых путей, интерстициальный цистит, хронический простатит, мочекислые инкременты мочеиспускательного канала и сопровождающие их симптомы нижних мочевых путей и тому подобное. В другом варианте осуществления примеры заболеваний мочевого пузыря/уретральных заболеваний включают гипоактивный мочевой пузырь, гипотонический мочевой пузырь, несокращающийся мочевой пузырь, гипоактивность детрузора, нестабильный мочевой пузырь, недостаточность релаксации мочеиспускательного канала или диссинергию действия детрузора-внешнего уретрального сфинктера и их симптомы нижних мочевых путей, интерстициальный цистит, хронический простатит, мочекислые инкременты мочеиспускательного канала и сопровождающие их симптомы нижних мочевых путей и тому подобное. В следующем варианте осуществления примеры заболеваний мочевого пузыря/уретральных заболеваний включают гипоактивный мочевой пузырь, гипотонический мочевой пузырь, несокращающийся мочевой пузырь, гипоактивность детрузора, нестабильный мочевой пузырь, недостаточность релаксации мочеиспускательного канала или диссинергию действия детрузора-внешнего уретрального сфинктера и их симптомы в нижних мочевых путях, и тому подобное. В еще следующем варианте осуществления примеры заболеваний мочевого пузыря/уретральных заболеваний включают гипоактивный мочевой пузырь, гипотонический мочевой пузырь, несокращающийся мочевой пузырь, гипоактивность детрузора, недостаточность релаксации мочеиспускательного канала или диссинергию действия детрузора-внешнего уретрального сфинктера, их симптомы в нижних мочевых путях и тому подобное. В настоящем изобретении конкретные примеры нарушения накопительной функции мочевого пузыря включают гиперактивный мочевой пузырь и симптомы гиперактивного мочевого пузыря, такие как сильная потребность в мочеиспускании, частота мочеиспускания, императивное недержание, ноктурию и тому подобное. В настоящем изобретении примеры нарушения мочеиспускания включают нарушение мочеиспускания вследствие повышения уретральной резистентности и нарушения мочеиспускания вследствие уменьшения сократительной способности мочевого пузыря. В конкретном варианте осуществления конкретные примеры его включают нарушение мочеиспускания при гипоактивном мочевом пузыре, нарушение мочеиспускания при гипотоническом мочевом пузыре, нарушение мочеиспускания при несокращающемся мочевом пузыре, нарушение мочеиспускания при нестабильном мочевом пузыре, нарушение мочеиспускания при гипоактивности детрузора, нарушение мочеиспускания при недостаточности релаксации мочеиспускательного канала или диссинергии действия детрузора-внешнего уретрального сфинк-5 023493 тера, нарушение мочеиспускания, нарушение мочеиспускания, сопровождающее хронический простатит,нарушение мочеиспускания, сопровождающее мочекислые инкременты мочеиспускательного канала,нарушение мочеиспускания, сопровождающее интерстициальный цистит, нарушение мочеиспускания,сопровождающее гипоактивность детрузора, и тому подобное. В следующем варианте осуществления примеры нарушения мочеиспускания включают нарушение мочеиспускания при гипоактивном мочевом пузыре, нарушение мочеиспускания при гипотоническом мочевом пузыре, нарушение мочеиспускания при несокращающемся мочевом пузыре, нарушение мочеиспускания при гипоактивности детрузора, нарушение мочеиспускания при нарушении релаксации мочеиспускательного канала или диссинергии действия детрузора-внешнего уретрального сфинктера, нарушение мочеиспускания, и тому подобное. Действие патента Соединение формулы (I) или его фармацевтически приемлемая соль обладает PDE9-ингибирующим действием и его можно применять в качестве агента для предотвращения и/или лечения заболеваний,связанных с деградацией цГМФ под действием PDE9, например, нарушения накопительной функции мочевого пузыря, нарушения мочеиспускания и заболеваний мочевого пузыря/уретральных заболеваний,в другом варианте осуществления таких заболеваний, как гипоактивный мочевой пузырь, гипотонический мочевой пузырь, несокращающийся мочевой пузырь, гипоактивность детрузора, нестабильный мочевой пузырь, недостаточность релаксации мочеиспускательного канала или диссинергия действия детрузора-внешнего уретрального сфинктера, гиперактивный мочевой пузырь и их симптомы нижних мочевых путей и интерстициальный цистит, хронический простатит, мочекислые инкременты мочеиспускательного канала и сопровождающие их симптомы нижних мочевых путей и тому подобное, и в следующем варианте осуществления такие заболевания, как гипоактивный мочевой пузырь, гипотонический мочевой пузырь, несокращающийся мочевой пузырь, нестабильный мочевой пузырь, гипоактивность детрузора, гиперактивный мочевой пузырь, учащение мочеиспускания, ноктурия, инконтиненция, симптомы нижних мочевых путей, нарушение мочеиспускания, сопровождающееся недостаточностью релаксации мочеиспускательного канала или диссинергия действия детрузора-внешнего уретрального сфинктера, интерстициальный цистит, хронический простатит, мочекислые инкременты мочеиспускательного канала и тому подобное. Соединение формулы (I) может существовать в форме таутомеров или геометрических изомеров, в зависимости от типа заместителей. В данном описании изобретения соединение формулы (I) будет описано только в одной форме изомера, однако соединения настоящего изобретения могут включать другие изомеры, выделенные формы изомеров или их смеси. Кроме того, соединение формулы (I) в некоторых случаях может иметь асимметричные атомы углерода или аксиальную асимметрию, и соответственно оно может существовать в форме оптических изомеров. Более того, соль соединения формулы (I) является фармацевтически приемлемой солью соединения формулы (I) и может быть кислотно-аддитивной солью или солью с основанием, в зависимости от типа заместителей. Конкретные примеры их включают кислотно-аддитивные соли с неорганическими кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота, йодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобная кислота, и с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, миндальная кислота, винная кислота, дибензоилвинная кислота, дитолилвинная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, аспарагиновая кислота, глутаминовая кислота и тому подобное, и соли с неорганическими основаниями, такими как основания натрия, калия, магния, кальция,алюминия и тому подобное, или с органическими основаниями, такими как метиламин, этиламин, этаноламин, лизин, аргинин, трометамин, орнитин и тому подобное, соли с различными аминокислотами или производными аминокислот, такими как ацетиллейцин и тому подобное, соли аммония и т.д. Помимо этого, настоящее изобретение включает также различные гидраты или сольваты и полиморфные кристаллические вещества соединения формулы (I) или его соли. Кроме того, настоящее изобретение включает также соединения, меченные различными радиоактивными или нерадиоактивными изотопами. Способы получения Соединение формулы (I) или его фармацевтически приемлемая соль можно получить с учетом его характеристик, основанных на основной структуре или типе заместителя, и применением различных известных способов синтеза. Во время получения замена соответствующей функциональной группы подходящей защитной группой (группой, которую можно легко превратить в подходящую функциональную группу) на стадии от исходного вещества до промежуточного продукта в некоторых случаях может быть эффективной, в зависимости от типа функциональной группы при технологии получения. Защитная группа для такой функциональной группы может включать, например, защитные группы, описанные в"Greene's Protective Groups in Organic Synthesis (4th edition, 2006), P.G.M. Wuts and T.W. Greene, и только одну из них нужно выбрать и применять, как необходимо, в зависимости от условий реакции. При при-6 023493 менении этого типа способа нужное соединение можно получить введением защитной группы, проведением реакции и удалением защитной группы, как необходимо. В контексте ниже будут описаны репрезентативные способы получения для соединений формулы(I). Каждый из способов получения можно также проводить способами ссылок, добавленных к настоящему описанию. Кроме того, способы получения настоящего изобретения не ограничиваются примерами, показанными ниже. Способ получения 1. Химическая формула 12 где Ra, Rb, R2, R3, R4, R5 и R6 имеют такие же значения, как и указанные выше. R представляет собой низший алкил. Такие же значения будут применяться в контексте ниже. Соединение (I) настоящего изобретения можно получить реакцией соединения (1 а) с соединением(1b). В этой реакции применяют соединение (1 а) и соединение (1b) в эквимолярных количествах или любое из них в избыточном количестве, и смесь их перемешивают при любых температурных условиях от охлаждения до нагревания, предпочтительно при температуре от -20 до 120 С, обычно в течение от 0,1 ч до 5 дней, в растворителе, который является инертным в условиях реакции, в присутствии агента конденсации. Растворитель, указываемый в контексте, конкретно не ограничивают, но примеры его включают ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан, хлороформ и тому подобное; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, диметоксиэтан и тому подобное, N,Nдиметилформамид (ДМФА), N-метилпирролидон, диметилсульфоксид, этилацетат, ацетонитрил или воду и их смеси. Примеры агента конденсации включают 1-(3-диметиламинопропил)-3-этилкарбодиимид,1,3-дициклогексилкарбодиимид, гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), тетрафторборат О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU), гексафторфосфат бром(трипирролидин-1-ил)фосфония, 1,1'-карбонилдиимидазол (CDI), дифенилфосфорилазид и фосфорилхлорид, но не ограничиваются ими. Кроме того, можно также применять агент конденсации,нанесенный на полистирольную смолу, например, PS-карбодиимид (Biotage AB, Sweden). В некоторых случаях для реакции может быть предпочтительным применение добавки (например, 1 гидроксибензотриазола). В некоторых случаях для ровного прогрессирования реакции может быть благоприятно проведение реакции в присутствии органического основания, такого как триэтиламин, N,Nдиизопропилэтиламин (DIPEA), N-метилморфолин и тому подобное, или неорганического основания,такого как карбонат калия, карбонат натрия, гидроксид калия и тому подобное. Кроме того, в некоторых случаях применение микроволнового реактора (Biotage AB) может позволить проводить реакцию с ровным прогрессированием. В зависимости от конкретного случая можно также применять осажденный на полистирольную смолу изоцианат, например, PS-изоцианат (Biotage AB, Sweden) и тому подобное, для удаления избыточного количества амина после завершения реакции и можно также применять осажденную на полистирольную смолу соль четвертичного аммония, например, МР-карбонат (Biotage AB, Sweden) и тому подобное, для удаления избыточного количества добавок после завершения реакции. Кроме того, можно также применять способ, в котором карбоновую кислоту (1 а) превращают в ее реакционноспособное производное и затем подвергают реакции с амином (1b). Примеры реакционноспособного производного карбоновой кислоты включают галогенангидриды кислот, которые можно получить реакцией галогенирующего агента, такого как фосфорилхлорид, тионилхлорид и тому подобное,смешанные ангидриды кислот, которые можно получить реакцией изобутирилхлорформиата или подобного реагента, активные сложные эфиры, полученные конденсацией 1-гидроксибензотриазола или подобного реагента и т.д. Реакцию реакционноспособного производного и соединения (1b) можно проводить при любом температурном условии от охлаждения до нагревания, предпочтительно при температуре от -20 до 60 С, в растворителе, который является инертным в условиях реакции, таком как галогенированные углеводороды, ароматические углеводороды, простые эфиры и тому подобное. Кроме того, можно также применять способ, в котором подвергают реакции реагент амид алюминия, полученный реакцией сложного эфира (1 с) с триметилалюминием и с амином (1b). Для проведения этих стадий можно обратиться к ссылке на способы, описанные в публикации "Organic Functional Group Preparations", S.R. Sandier and W. Karo, 2nd edition, vol. 1, Academic Press Inc, 1991,и "Courses in Experimental Chemistry (5th edition)", The Chemical Society of Japan, Vol. 16 (2005) (Maruzen). Кроме того, некоторые из соединений, представленных формулой (I), можно также получить из со-7 023493 единения настоящего изобретения, полученного, как описано выше, подходящим сочетанием способов,обычно применяемых специалистами в данной области, такими как известные способы алкилирования,ацилирования, замещения, окисления, восстановления, гидролиза, удаления защитной группы, галогенирования и тому подобное (см., например, "Courses in Experimental Chemistry" (5th edition), The ChemicalSociety of Japan (2005) (Maruzen. Помимо этого для получения промежуточных продуктов можно также применять способ, который обычно применяют специалисты в данной области. Синтез 1 исходных веществ. Химическая формула 13 Стадией, представленной как стадия 1-1, является получение соединения (2b) реакцией соединения(2 а) с (диметоксиметил)диметиламином или его эквивалентной формой. В данной реакции соединение(2 а) и (диметоксиметил)диметиламин или его эквивалентную форму применяют в эквивалентных количествах или любое из них применяют в избыточном количестве, и смесь их перемешивают при любых температурных условиях от охлаждения до нагревания, предпочтительно при температуре от 20 до 200 С, обычно в течение от 0,1 ч до 5 дней, в растворителе, который является инертным в условиях реакции, или без растворителя. В качестве примеров эквивалентной формы, применяемой в контексте, известными являются метоксибис(диметиламино)метан, (бисэтилсульфанилметил)диметиламин, перхлорид бис(диметиламино)монометиния, диэтилацеталь N,N-диметилформамида, хлорид 3-(диметиламино)2-азапроп-2-ен-1-илидендиметиламмония, 2-аза-1,3-бис(диметиламино)-3-метокси-1-пропен и тому подобное. Применяемый в контексте растворитель конкретно не ограничивают, но примеры его включают ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, диметоксиэтан и тому подобное, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан, хлороформ и тому подобное, N,Nдиметилформамид, N,N-диметилацетамид, диметилсульфоксид, этилацетат, ацетонитрил, N-этилпирролидон и их смеси. Для проведения такой стадии можно обратиться к ссылке на способы, описанные в публикацияхBredereck, H. et al., Chemische Berichte, 97, 3397 (1964), Ivanova, I.A. et al., Bulletin of the Academy of Sciences of the USSR, Division of Chemical Science, 1965, 2143, Arnold, Z., Zemlicka, J., Collection of Czechoslovak Chemical Communications, 25, 1302 (1960), Meerwein, H. et al., Justus Liebigs Annalen der Chemie,641, 1 (1961), Lin, Yang-i, Lang, Stanley, A., Journal of Organic Chemistry, 45(24), 4857 (1980), Cherif, Souheir El, Rene, Loic, Synthesis, (1988) 2, 138, Gupton, John Т., Colon, Cesar et al., Journal of Organic Chemistry, 45(22), 4522 (1980), Kantlehner, Willi, Hauber, Michael, Bulletin des Societes Chimiques Beiges, 103(12),697 (1994), Gorobets, Nikolay Yu. et al., Tetrahedron, 60(39), 8633 (2004) и тому подобное. Стадия 1-2 является стадией получения соединения (2 с) с применением соединения (2b) и алкилгидразина или его соли. Смесь их перемешивают при любых температурных условиях от охлаждения до нагревания, предпочтительно от 20 до 120 С, обычно в течение от 0,1 ч до 5 дней, в растворителе, который является инертным в условиях реакции. Данную реакцию можно проводить при любом условии из кислотного условия, нейтрального условия и основного условия. Растворитель, применяемый в контексте, конкретно не ограничивается, но примеры его включают ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран,1,4-диоксан, диметоксиэтан и тому подобное, галогенированные углеводороды, такие как дихлорметан,1,2-дихлорэтан, хлороформ и тому подобное, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, уксусную кислоту, этилацетат, ацетонитрил, N-этилпирролидон и их смеси. Хотя и не всегда ясно, в некоторых случаях во время синтеза в реакционной смеси образуются изомеры положения. Однако такую смесь изомеров положения можно разделить, например, препаративной ВЭЖХ, колоночной хроматографией на силикагеле, перекристаллизацией или подобным способом. Для проведения этой стадии можно обратиться к ссылке на способы, описанные в публикациях Tanaka, Akira et al., Journal of(2010), Adams, Nicholas D. et al., Journal of Medicinal Chemistry, 53(10), 3973 (2010), Speake, Jason D. et al.,Bioorganic Medicinal Chemistry Letters, 13(6), 1183 (2006) и т.д. Стадия, представленная стадией 1-3, является стадией получения соединения (2d) реакцией восстановления соединения (2 с). В этой реакции соединение (2 с) перемешивают в присутствии металлического катализатора, обычно в течение от 1 часа до 5 дней, в растворителе, который является инертным в условиях реакции. В качестве металла подходящим образом применяют железо, цинк, олово или подобный металл. Данную реакцию проводят при любых температурных условиях от охлаждения до нагревания,предпочтительно при температуре от 40 до 100 С. Эту реакции обычно проводят в кислотных условиях,но реакцию можно также проводить в нейтральных или основных условиях в случае применения цинковой пыли. Эту реакцию можно также проводить с применением моногидрата гидразина в эквивалентом количестве или в избыточном количестве относительно соединения (2 с). В данной реакции перемешивание проводят в присутствии железного катализатора, такого как активированный уголь/хлорид железа(III) и тому подобное, обычно в течение от 0,5 ч до 5 дней, в растворителе, инертном в условиях реакции. Растворитель данного контекста конкретно не ограничивается, но примеры его включают спирты,такие как метанол, этанол, 2-пропанол и тому подобное, простые эфиры, такие как диэтиловый эфир,тетрагидрофуран, 1,4-диоксан, диметоксиэтан и тому подобное, воду, уксусную кислоту, этилацетат,N,N-диметилформамид, диметилсульфоксид и их смеси. Для проведения этих стадий можно обратиться к ссылке на способы, описанные в публикации "Courses in Experimental Chemistry" (4th edition), TheChemical Society of Japan, Vol. 20 (1992) (Maruzen) и т.д. Стадия 1-4 является стадией получения соединения (2 е) реакцией циклизации соединения (2d) с 1,1'-карбонилдиимидазолом или трифосгеном. Смесь их перемешивают в присутствии амина или основания при любом температурном условии от охлаждения до нагревания, предпочтительно при температуре от 80 до 200 С, в растворителе, который является инертным в условиях реакции, обычно в течение от 0,1 ч до 5 дней, более предпочтительно с применением микроволнового реактора. Кроме того, данную реакцию можно также проводить в отсутствие амина или основания. Примеры амина или основания данного контекста включают триэтиламин, диизопропилэтиламин, трибутиламин,1,8-диазабицикло[5.4.0]ундецен, 1,5-диазабицикло[4.3.0]нон-5-ен, имидазол и тому подобное. Растворитель данного контекста конкретно не ограничивают, но примеры его включают ароматические углеводороды, такие как бензол, толуол, ксилол, 1,2-дихлорбензол и тому подобное, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, диметоксиэтан и тому подобное, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан, хлороформ и тому подобное, N,Nдиметилформамид, N,N-диметилацетамид, N-метилпирролидон, N-этилпирролидон, диметилсульфоксид,сульфолан, уксусную кислоту, этилацетат, ацетонитрил и их смеси. Для проведения этой стадии можно обратиться к ссылке на способ, описанный в J. Med. Chem., (9), 2671 (1991). Стадия, представленная стадией 1-5, является стадией получения соединения (2f) реакцией соединения (2 е) с монооксидом углерода и спиртом в присутствии палладиевого катализатора. Для проведения этой стадии можно обратиться к ссылке на способ, описанный в публикациях Nicolaou, K.C. et al.,Angew. Chem. Int. Ed., 44, 4442 (2005), "Topics in Organometallic Chemistry, Vol. 14, Palladium in OrganicSynthesis (2005)". Стадия, представленная стадией 1-6, является стадией получения соединения (2g) реакцией гидролиза соединения (2f). В данной стадии реакцию гидролиза проводят согласно ссылке на способ, описанный в "Green's Protective Groups in Organic Synthesis (4th edition, 2006)". Синтез 2 исходных веществ. Химическая формула 14 где по меньшей мере один из Р 1 и Р 2 представляет собой защитную группу. Стадия, представленная стадией 2-1, является реакцией для получения соединения (3b) введением защитной группы в аминогруппу соединения (3 а). В качестве защитной группы, применяемой для защиты аминогруппы, можно применять карбамат, мочевину, амид, сульфонамид или тому подобное, предпочтительно применяют ацетил, метансульфонил или п-толуолсульфонил. Данную реакцию можно проводить согласно способу, описанному в "Green's Protective Groups in Organic Synthesis (4th edition, 2006)". Стадия, представленная стадией 2-2, является стадией для получения соединения (3 с) реакцией со-9 023493 единения (3b) с (диметоксиметил)диметиламином или его эквивалентной формой. Для этой стадии можно применять способ, применяемый на стадии 1-1 (синтеза 1 исходных веществ). Стадия, представленная стадией 2-3, является стадией получения соединения (3d) реакцией циклизации с применением соединения (3 с) и алкилгидразина или его соли. Для этой стадии можно применять способ, применяемый на стадии 1-2 (синтеза 1 исходных веществ). Стадия, представленная стадией 2-4, является стадией получения соединения (2d) реакцией удаления защитной группы у соединения (3d). Эту реакцию можно проводить согласно способу, описанному в где R' представляет собой низший алкил. Стадия 3-1 является стадией получения соединения (4b) конденсацией соединения (4 а) с соединением (4 е). В данной реакции соединение (4 а) и соединение (4 е) перемешивают в присутствии металла или соли металла и эквивалентного количества или избыточного количества амина или основания в растворителе, который является инертным в условиях реакции, обычно в течение от 1 ч до 5 дней, в атмосфере азота. Эту реакцию проводят при любом температурном условии от охлаждения до нагревания, предпочтительно при температуре от 20 С до комнатной температуры. Металл или соль металла в данном контексте конкретно не ограничивают, но примеры их включают магний, этоксид магния, хлорид магния,хлорид самария и тому подобное. Амин или основание металла данного контекста конкретно не ограничивают, но примеры их включают триэтиламин, N-этил-N-изопропилпропан-2-амин, трибутиламин, 1,8 диазабицикло[5.4.0]ундецен, 1,5-диазабицикло[4.3.0]нон-5-ен, имидазол, пиридин, 2,6-лутидин, хинолин,N,N-диметиланилин, гидрид натрия, гидроксид натрия, гидроксид калия, метоксид натрия, этоксид натрия, трет-бутоксид калия, карбонат натрия, карбонат калия, карбонат цезия и тому подобное. Растворитель данного контекста конкретно не ограничивают, но примеры его включают спирты, такие как метанол, этанол, 2-пропанол и тому подобное, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран,1,4-диоксан, диметоксиэтан и тому подобное, бензол, толуол, дихлорметан, хлороформ, дихлорэтан, тетрахлоид углерода и их смеси. Для проведения этой стадии можно дать ссылку на способы, описанные в публикациях Arnould, J.C. et al., Journal of Medicinal Chemistry, 35(14), 2631 (1992), Sato, Masayuki et al.,Chemical Pharmaceutical Bulletin, 31(6), 1896 (1983). Стадия 3-2 является стадией получения соединения (4 с) декарбоксилированием соединения (4b). В этой реакции соединения перемешивают с применением кислоты в количестве, составляющем от каталитического количества до избыточного количества, обычно в течение от 1 часа до 5 дней, в растворителе,который является инертным в условиях реакции, в атмосфере азота. Данную реакцию обычно проводят при любом температурном условии от охлаждения до нагревания. Кислоту в данном контексте конкретно не ограничивают, но примеры ее включают хлористо-водородную кислоту, бромисто-водородную кислоту, серную кислоту, метансульфоновую кислоту, 4-толуолсульфоновую кислоту, Dкамфорсульфоновую кислоту, трифторуксусную кислоту и тому подобное. Растворитель в данном контексте конкретно не ограничивают, но примеры его включают спирты, такие как метанол, этанол, 2 пропанол и тому подобное, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,4-диоксан,диметоксиэтан и тому подобное, бензол, толуол, дихлорметан, хлороформ, дихлорэтан, ацетонитрил,воду, уксусную кислоту и их смеси. Кроме того, соединение (4 с) можно также получить из соединения(4b) способом с применением хлорида натрия в диметилсульфоксиде. Такую стадию можно проводить согласно способу, описанному в WO 2004/63197 A1, Cegne-Laage, Emmanuelle et al., Chemistry-A European Journal, 10(6), 1445 (2004). Стадия 3-3 является стадией получения соединения (4d) реакцией соединения (4 с) с алкилгидразином или его солью. Для этой стадии можно применять способ, применяемый в стадии 1-2 (синтеза 1 исходных веществ). Соединения формулы (I) можно выделить и очистить в виде свободных соединений, их солей, гидратов, сольватов или полиморфных кристаллических веществ. Соли соединения формулы (I) можно также получить проведением общепринятой реакции образования соли. Выделение и очистку проводят обычными химическими операциями, такими как экстракция, фракционная кристаллизация, различные типы фракционной хроматографии и тому подобное. Различные изомеры можно получать выбором подходящего исходного соединения или разделением изомеров с применением различия в их физико-химических свойствах изомеров. Например, оптические изомеры можно получить при помощи обычного способа разделения рацемических продуктов на оптические изомеры (например, фракционной кристаллизацией полученных диастереомерных солей с оптически активными основаниями или кислотами, хроматографией с применением хиральной колонки или подобным способом или т.д. и др.) и, кроме того, изомеры можно также получить из подходящего оптически активного исходного вещества. Фармакологическую активность соединения формулы (I) подтверждали описанными ниже испытаниями. Пример испытания 1. PDE9-ингибирующая активность(2) Оценка PDE9-ингибирующей активности PDE9-ингибирующую активность измеряли следующим способом. То есть, к буферному раствору, содержащему трис(гидроксиметил)аминометан-хлористоводородную кислоту (40 мМ, рН 8,0), хлорид магния (5 мМ) и 2-меркаптоэтанол (4 мМ) добавляли цГМФ (1 мкМ) и 3 Н-цГМФ (0,33 мкКи/мл), получая при этом буферный раствор субстрата. К нему добавляли раствор испытуемого вещества и раствор фермента, который регулировали до оптимальной концентрации, для проведения реакции при 30 С. Ферментативную реакцию останавливали добавлением гранул для анализа с использованием близости сцинтилляции (SPA) (Perkin Elmer, USA),содержащих 5 мМ 3-изобутил-1-метилксантин (IBMX). Для определения активности фермента количество 5'-ГМФ, который является продуктом реакции деградации, связанным с гранулами SPA, измерялиTopCount микропланшет-ридером (Hewlett Packard, USA). Степень ингибирования вычисляли определением радиоактивности контроля, не содержащего испытуемое соединение, как (А), определением радиоактивности слепого опыта, не содержащего фермент,как (В) и определением радиоактивности испытуемого вещества как (С) и с применением следующего уравнения: Степень ингибирования = 100-(С)-(В)/(А)-(В)100(%) Кроме того, величину IC50 вычисляли как концентрацию соединения, которая ингибирует 50% активности фермента, методом логистической регрессии.(3) Другие оценки PDЕ 9-ингибирующей активности Рекомбинантный фермент PDE1 был купленet al. (Nemoz G., et al., FEBS Lett., 384: pp. 97-102 (1996. PDE3, PDE5 и PDE6 выделяли из миокарда кроликов, простаты кроликов и сетчатки крыс. То есть, нужные ткани отбирали у каждого из животных и измельчали в буферном растворе,содержащем бис-(2-гидроксиэтил)иминотрис(гидроксиметил)аминометан (20 мМ), дитиотреит (5 мМ), простой эфир гликоля-диаминтетрауксусную кислоту (2 мМ) и ацетат натрия (50 мМ). Затем клетки разрушали с применением гомогенизатора Poritoron. Каждый из гомогенатов тканей ультрацентрифугировали (100000g, 4 С, 60 мин) и затем супернатант добавляли в колонку сефарозы Q. С применением градиента концентрации буферного раствора, содержащего 0,05-1,2 М ацетат натрия, хлорид натрия (140 мМ), хлорид калия (5 мМ), глюкозу (5 мМ) и 2-[4(2-гидроксиэтил)-1-пиперазинил]этансульфоновую кислоту (10 мМ), элюирование проводили ионообменом, получая при этом фракцию в качестве источника ферментов. Для каждой из элюированных фракций подтипы PDE идентифицировали посредством ферментативных свойств и селективной восприимчивостью к ингибитору. Для определения ферментативной активности PDE способность к деградации для цАМФ или цГМФ измеряли количеством 5'-АМФ или 5'-ГМФ, который является продуктом реакции деградации, связанным с гранулами SPA, способом, описанным выше для PDE9. Для соединения формулы (I), а также для сравнительных соединений, приведенных в качестве иллюстративных соединений, действие в отношении PDE9-ингибирующей активности подтверждали указанным выше способом испытания. Действия в отношении PDE9-ингибирующей активности (величиныIC50, нМ) некоторых соединений показаны в табл. 1, в которой Ex означаетпримера, как описано ниже(такое же значение будут применять далее). Кроме того, было подтверждено, что соединения формулы (I) обладают селективной PDE9 ингибирующей активностью. Селективная PDE9-ингибирующая активность относится к более сильнодействующей ингибирующей активности, чем ингибирующая активность, в частности в отношенииPDE1, PDE3 и PDE6, и имеется, например, случай, когда величина IC50 (нМ) составляет 1/10 или меньше по сравнению с такой величиной для любой из PDE1, PDE3 и PDE6, предпочтительно случай, когда величина IC50 (нМ) составляет 1/50 или меньше по сравнению с такой величиной 1, 2 или всех из PDE1,PDE3 и PDE6, и более предпочтительно случай, когда величина IC50 (нМ) составляет 1/100 или меньше по сравнению с такой величиной 1, 2 или всех из PDE1, PDE3 и PDE6. Пример испытания 2. Оценка PDE9-ингибирующей активности в клетках Ген CRE-luc, у которого ген люциферазы (luc) связан с геном PDE9 и геном элемента ответной реакции на циклический АМФ (CRE) в клетке HEK293, транзиторно вводили для получения клетки, совместно экспрэссирующей PDE9 и CRE-luc. На следующий день к клеткам добавляли раствор 0,5 мМ IBMX и испытуемого вещества и клетки культивировали при 37 С в течение 6 час и затем супернатант культуры удаляли. К клеткам добавляли фосфатный буферный, содержащий 0,2% тритона Х-100, для разрушения клеток. PDE9-ингибирующую активность в клетках оценивали добавлением жидкости субстрата люциферина к раствору клеток, полученному разрушением клеток, и измерением активности люциферазы в планшет-ридере по флуоресценции/люминесценции. В результате этого было подтверждено, что среди соединений формулы (I) имеются несколько соединений, проявляющих эффективную активность. Другие соединенияпредставляют собой сравнительные соединения и приведены в качестве иллюстративных соединений. Пример испытания 3. Одновременное измерение на модели ответных реакций: сокращение мочевого пузыря/релаксация мочеиспускательного канала крысы Одновременное измерение ответных реакций: сокращение мочевого пузыря/релаксация мочеиспускательного канала у крысы проводили частично модифицированным методом Wibberley et al. (Wibberley,A., et al., Br. J. Pharmacol., 136: pp. 399-414 (2002. To есть, самку крысы Spague-Dawley (SD) (CharlesRiver Laboratories Japan, Inc.) анестезировали уретаном и мочевой пузырь подвергали рассечению по средней линии в нижней части брюшной полости. Канюлю с двойным просветом (канюлю, имеющую двойную структуру для РЕ 190 и РЕ 50) со дна мочевого пузыря вводили в мочевой пузырь и дно мочевого пузыря и канюлю фиксировали наложением швов у места, где наконечник достигал проксимального отдела мочеиспускательного канала. При инфузии физиологического солевого раствора в мочеиспускательный канал при помощи наружной канюли внутреннее давление мочеиспускательного канала измеряли датчиком давления при помощи внутренней канюли с солевым раствором, инфузированным в мочеиспускательный канал посредством наружной канюли. С другой стороны, одну канюлю (РЕ 50) вводили в мочевой пузырь со дна мочевого пузыря и устанавливали в нем. Внутреннее давление мочевого пузыря измеряли при помощи этой канюли. После периода послеоперационной стабилизации физиологический солевой раствор инфузировали в мочевой пузырь посредством канюли со дна мочевого пузыря, вызывая этим реакцию сокращения мочевого пузыря и тем самым вызывая реакцию релаксации мочеиспускательного канала, сопровождающую рефлекс сокращения мочевого пузыря. Испытуемое соединение вводили внутривенно или интрадуоденально. В результате этого было подтверждено, что среди соединений формулы (I) имеются некоторые соединения, проявляющие эффективную активность. Для некоторых соединений формулы (I) отношение с повышенным временем релаксации мочеиспускательного канала во время его опорожнения при введении 1 мг/кг (повышение относительно группы введения растворителя (по сравнению с наполнителем и сравнительными соединениями) (% показано в табл. 2. Таблица 2 Пример испытания 4. Действие соединения на индуцированное лекарственным средством нарушение мочеиспускания у крысиной модели Самца крысы SD (Japan SLC, Inc.) подвергали анестезии изофлураном для помещения канюли в мочевой пузырь и яремную вену и позднее активизировали в клетке для животных Ballman. После периода послеоперационной стабилизации физиологический солевой раствор инфузировали в мочевой пузырь,чтобы вызвать мочеиспускание. Инфузию физиологического солевого раствора останавливали сразу после опорожнения мочевого пузыря и количество собранной мочи измеряли с применением сосуда с весами, помещенного под клетку Ballman. После периода завершения мочеиспускания остаточную мочу собирали самотеком через канюлю, помещенную в мочевой пузырь, и измеряли ее массу. Далее, внутреннее давление мочевого пузыря измеряли трансдуктором давления посредством канюли в мочевом пузыре. Дисфункцию мочеиспускания вызывали внутривенным введением одного антихолинергического агента или комбинации антихолинергических агентов, агониста 1-рецептора и ингибитора продуцирования NO, и динамику мочеиспускания наблюдали после введения лекарственного средства. Испытуемое вещество вводили внутривенно, перорально или в желудок. В результате этого было подтверждено, что среди соединений формулы (I) имеются некоторые соединения, проявляющие эффективную активность. В результате описанного выше испытания было подтверждено, что некоторые соединения формулы(I) обладают PDE9-ингибирующим действием и было также подтверждено, что некоторые соединения формулы (I) вызывают релаксирующее действие у мочеиспускательного канала во время опорожнения мочевого пузыря у животных моделей. Согласно этому соединение формулы (I) можно применять для предотвращения или лечения заболеваний, связанных с деградацией цГМФ под действием PDE9, например, таких заболеваний, как нарушение накопительной функции мочевого пузыря, нарушение мочеиспускания, заболевания мочевого пузыря/уретральные заболевания, в другом варианте осуществления гипоактивный мочевой пузырь, гипотонический мочевой пузырь, несокращающийся мочевой пузырь,гипоактивность детрузора, нестабильный мочевой пузырь, недостаточность релаксации мочеиспускательного канала или диссинергия действия детрузора-внешнего уретрального сфинктера, гиперактивный мочевой пузырь и их симптомы в нижних мочевых путях и интерстициальный цистит, хронический простатит, мочекислые инкременты мочеиспускательного канала и сопровождающие их симптомы нижних мочевых путей и тому подобное, и в следующем варианте осуществления гипоактивный мочевой пузырь,гипотонический мочевой пузырь, несокращающийся мочевой пузырь, нестабильный мочевой пузырь,гипоактивность детрузора, гиперактивный мочевой пузырь, частое мочеиспускание, ноктурия, недержание мочи, гиперплазия предстательной железы, симптомы в нижних мочевых путях, нарушение мочеиспускания, сопровождающее недостаточность релаксации мочеиспускательного канала или диссинергия действия детрузора-внешнего уретрального сфинктера, интерстициальный цистит, хронический простатит, мочекислые инкременты мочеиспускательного канала и тому подобное. Кроме того, некоторые соединения формулы (I) обладают селективной PDE9-ингибирующей активностью и в результате этого можно избежать побочных действий, вызванных действием других подтипов PDE, в результате этого соединения могут быть превосходными терапевтическими агентами, имеющими более высокую безопасность. Например, можно избежать риска сердечнососудистого заболевания, вызванного PDE3-ингибирующим действием, или риска слепсты, вызванной PDE3-ингибирующим действием (A.M. Laties Drug Safety 2009; 32, 1-18/J.B. Shipley et al., Am. J. Med. Sci., 1996; 311, 286291/T.M. Vinogradova et al., Circ. Res., 2008; 102, 761-769). Фармацевтическую композицию, содержащую один или два или более типов соединения формулы(I) или ее фармацевтически приемлемую соль в качестве активного ингредиента, можно получить с применением эксципиентов, которые обычно применяют в данной области, то есть эксципиентов для фармацевтического препарата, носителей для фармацевтического препарата и тому подобного согласно обычно применяемым способам. Введение можно выполнить либо пероральным введением посредством таблеток, пилюль, капсул,гранул, порошков, растворов и тому подобного или парентеральным введением инъекций, таких как внутрисуставные, внутривенные или внутримышечные инъекции и тому подобное, суппозиториев, офтальмических растворов, глазных мазей, чрескожных жидких препаратов, мазей, чрескожных пластырей,жидких препаратов для введения через слизистую оболочку, пластырей для введения через слизистую оболочку, ингаляторов и тому подобного. Твердую композицию для применения при пероральном введении согласно настоящему изобретению применяют в форме таблеток, порошков, гранул или тому подобного. В такой твердой композиции один или два или более активных ингредиентов смешивают по меньшей мере с одним неактивным эксципиентом. В общепринятом способе композиция может содержать неактивные добавки, такие как смазывающее вещество, дезинтегрирующий агент, стабилизатор или агент, способствующий растворению. Если необходимо, таблетки или пилюли можно покрыть сахаром или пленкой желудочно- или энтеросолюбильного вещества для нанесения покрытия. Жидкая композиция для перорального введения содержит фармацевтически приемлемые эмульсии,растворы, суспензии, сиропы, эликсиры или тому подобное и содержит также обычно применяемые инертные разбавители, например, очищенную воду или этанол. Помимо инертного разбавителя жидкая композиция может содержать также вспомогательные агенты, такие как агент, способствующий растворению, увлажняющий агент и суспендирующий агент, подслащивающие средства, корригенты, ароматизаторы и антисептики. Инъекции для парентерального введения включают стерильные водные или неводные препараты в виде растворов, суспензий и эмульсий. Водный раствор включает, например, дистиллированную воду для инъекции и физиологический солевой раствор. Примеры неводного растворителя включают пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, спирты, такие как этанол, полисорбат 80 (Japanese Pharmacopeia) и тому подобное. Такая композиция может дополнительно содержать агент тоничности, антисептик, увлажняющий агент, эмульгирующий агент, диспергирующий агент, стабилизирующий агент или агент, способствующий растворению. Эти композиции стерилизуют,например, фильтрованием через удерживающий бактерии фильтр, смешиванием с бактерицидом или облучением. Кроме того, их можно также применять приготовлением стерильной твердой композиции и растворением или суспендированием ее в стерильной воде или стерильном растворителе для инъекции перед ее применением. Средство для наружного применения включает мази, пластыри, кремы, желе, наклейки, спреи,лосьоны, глазные капли, глазные мази и тому подобное. Такие средства содержат обычно применяемые основы мазей, основы лосьонов, водные или неводные жидкие препараты, суспензии, эмульсии и тому подобное. В качестве средств для введения через слизистую оболочку, таких как ингалятор, средство для введения через нос и тому подобное применяют в твердой, жидкой или полутвердой форме, их можно получить согласно общепринятому известному способу. Например, к нему можно подходящим образом добавить известный эксципиент, а также рН регулирующий агент, антисептик, поверхностно-активное вещество, смазывающее вещество, стабилизирующее средство, загущающее средство или тому подобное. Для их введения можно применять подходящее устройство для ингаляции или продувания. Соединение можно вводить, например, как таковое или в виде порошка приготовленной смеси, или в виде раствора или суспензии в комбинации с фармацевтически приемлемым носителем с применением общепринятого известного устройства или распылителя, такого как устройство для ингаляции с введением дозированного количества и тому подобное. Ингалятор с сухим порошком или тому подобное может быть предназначен для одного или многих введений, и можно применять сухой порошок или капсулу, содержащую порошок. Или же он может быть в форме аэрозольного спрея, находящегося под давлением, с применением подходящего средства для подачи спрея, например, подходящий газ, такой как хлорфторалкан, диоксид углерода и тому подобное, или в других формах. При пероральном введении суточная доза обычно составляет от приблизительно 0,001 до 100 мг/кг,предпочтительно от 0,1 до 30 мг/кг и более предпочтительно от 0,1 до 10 мг/кг массы тела, причем такую дозу вводят в виде одной порции или 2-4 разделенных порций. В случае внутривенного введения суточную дозу подходящим образом вводят в количестве от приблизительно 0,0001 до 10 мг/кг массы тела,один раз в день или два или более раз в день. Кроме того, средство для введения через слизистую оболочку вводят при дозе от приблизительно 0,001 до 100 мг/кг массы тела один раз в день или два или более раз в день. Дозу подходящим образом выбирают в каждом отдельном случае, принимая во внимание симптомы, возраст и пол и тому подобное. Фармацевтическая композиция настоящего изобретения содержит от 0,01 до 100 мас.% и в некоторых вариантах осуществления 0,01-50 мас.% одного или нескольких типов соединения формулы (I) или его соли, которое является активным ингредиентом, хотя вводимое количество изменяется в зависимости от путей введения, лекарственных форм, места введения или типов эксципиентов и добавок. Соединение формулы (I) можно применять в комбинации с различными агентами для лечения или предотвращения заболеваний, для которых, как считается, соединение формулы (I) является эффективным. Комбинированные препараты можно вводить одновременно или по отдельности и непрерывно или с требуемыми интервалами времени. Препараты, которые вводят совместно, могут быть смесью или их можно получать по отдельности. Примеры Ниже в контексте способы получения соединения формулы (I), а также соединения сравнения,представленные в таблицах, будут описаны более подробно посредством примеров. Однако настоящее изобретение не ограничивается соединениями, описанными ниже в примерах. Кроме того, в примерах получения будет описан каждый из способов получения исходных соединений. Кроме того, способы получения соединения формулы (I) не ограничиваются способами получения описанных ниже конкретных примеров, соединение формулы (I) можно получить любой комбинацией способов получения или способами, которые известны специалисту в данной области. Кроме того, при проведении реакций получения солей, которые известны специалисту в данной области, имеются случаи добавления или исключения определенных способов получения примеров или примеров получения. Далее имеются случаи, когда температуру реакции варьируют в диапазоне, очевидном для специалиста в данной области, принимающего во внимание скорость реакции соединения,образование побочных продуктов и тому подобное. В указанных ниже примерах, примерах получения и таблицах в некоторых случаях можно применять следующие аббревиатуры, трет: третичный, Pr:примера получения, Ex:примера, :соединения, структура: структурная формула, Syn: способ получения (номер показывает, что соединение примера получали таким же способом, как соединение, имеющее свой номер, какпримера), данные: физико-химические данные, ESI+: величины m/z масс-спектрометрии (представляющие собой (М+Н)+ при ионизации ESI, если не указано иначе), ESI-: величины m/z масс-спектрометрии (представляющие собой(М-Н)- при ионизации ESI, если не указано иначе), EI+: величины m/z масс-спектрометрии (представляющие собой (М)+ при ионизации EI, если не указано иначе), FAB+: величины m/z масс-спектрометрии(представляющие собой (М+Н)+ при ионизации FAB, если не указано иначе), FAB-: величины m/z массспектрометрии (представляющие собой (М-Н)-при ионизации FAB, если не указано иначе), APCI+: величины m/z масс-спектрометрии (представляющие собой (М+Н)+ при ионизации APCI, если не указано иначе), APCI/ESI+: величины m/z масс-спектрометрии (представляющие собой (М+Н)+, если не указано иначе, при одновременно проводимой ионизации APCI и ESI), APCI/ESI-: величины m/z массспектрометрии (представляющие собой (М-Н)-, если не указано иначе, при одновременно проводимой ионизации APCI и ESI), т. пл.: точка плавления, разл.: разложение, ЯМР:(м.д.) пика в спектре 1 Н ЯМР,с: синглет (спектра), д: дублет (спектра), т: триплет (спектра), кв.: квартет (спектра) и ушир.: уширенная линия (спектра) (пример: ушир. с). Далее, HCl в структурной формуле представляет собой гидрохлорид[моль/л]. Случай, когда имеется характеристика "хиральный" в структурной формуле, означает, что соединение примера находится в оптически активной форме, но имеются некоторые случаи, когда стереохимию не определяли. Случай, когда не имеется характеристики "хиральный" в структурной формуле,означает, что соединение примера является смесью геометрических изомеров или рацематом. Соответственно этому, случай, когда имеется описание стереохимии, но не имеется характеристики "хиральный",означает рацемическую смесь диастереомеров, имеющих относительные конфигурации, и случай, когда не имеется ни описания стереохимии, ни характеристики "хиральный", означает смесь геометрических изомеров или смесь оптических изомеров. Пример получения 1. К смеси жидкостей 980 мг 5-(4-бром-2-нитрофенил)-1-циклопентил-1 Н-пиразола в 9,8 г тетрагидрофурана, 19,6 мл этанола и 2,9 мл воды добавляли 102 мг хлорида аммония с последующим нагреванием смеси при 70 С. К смеси добавляли 1,03 г восстановленного железа с последующим нагреванием при температуре кипения с обратным холодильником в течение 4 ч и охлаждением до комнатной температуры. Нерастворимое вещество отделяли фильтрованием на целите, фильтрат концентрировали и к концентрату добавляли смесь жидкостей хлороформ/вода. Водный слой отделяли и затем органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (нгексан/этилацетат), получая при этом 815 мг 5-бром-2-(1-циклопентил-1 Н-пиразол-5-ил)анилина. Пример получения 2. В атмосфере азота к раствору 1,15 г (2 Е)-1-(4-бром-2-нитрофенил)-3-(диметиламино)проп-2-ен-1 она в 9,2 мл уксусной кислоты добавляли 1,05 г гидрохлорида циклопентилгидразина с последующим перемешиванием при комнатной температуре в течение 60 ч. Реакционную жидкость выливали в смесь жидкостей вода/этилацетат с последующим регулированием рН до 10 6 М водным раствором гидроксида натрия. Водный слой отделяли и затем органический слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и затем остаток очищали колоночной хроматографией на силикагеле (н-гексан/этилацетат), получая при этом 940 мг 5-(4-бром-2-нитрофенил)-1-циклопентил-1 Н-пиразола. Пример получения 3. К раствору 100 мг 5-бром-2-(1-циклопентил-1 Н-пиразол-5-ил)анилина в 2,5 мл Nметилпирролидона добавляли 105 мг CDI с последующим перемешиванием в течение 2 ч с применением микроволнового реактора и охлаждением до комнатной температуры. Осажденное твердое вещество собирали фильтрованием, промывали этилацетатом и затем сушили при пониженном давлении, получая при этом 73 мг 7-бром-1-циклопентил-1,5-дигидро-4 Н-пиразоло[4,3-c]хинолин-4-он. Пример получения 4. В атмосфере азота смесь 3,62 г 1-(4-бром-2-нитрофенил)этанона и 5,3 г (диметоксиметил)диметиламина перемешивали в течение 4 ч при 90 С. Реакционную смесь охлаждали до комнатной температуры и осажденное твердое вещество собирали фильтрованием. Полученное твердое вещество промывали диизопропиловым эфиром и сушили при пониженном давлении, получая при этом 3,93 г(2 Е)-1-(4-бром-2-нитрофенил)-3-(диметиламино)проп-2-ен-1-она. Пример получения 5. К раствору 735 мг 7-бром-1-циклопентил-1,5-дигидро-4 Н-пиразоло[4,3-c]хинолин-4-она в 6 мл диметилсульфоксида последовательно добавляли 49 мг ацетата палладия, 91 мг 1,3-бис(дифенилфосфино)пропана, 0,62 мл триэтиламина и 3 мл метанола и атмосферу в реакционном контейнере заменяли монооксидом углерода. Смесь перемешивали при 70 С в течение 7 ч, охлаждали до комнатной температуры и затем выливали в смесь жидкостей воды и этилацетата. Водный слой отделяли, органический слой промывали разбавленной хлористо-водородной кислотой и насыщенным раствором соли и затем сушили над безводным сульфатом магния и растворитель выпаривали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол), получая при этом 551 мг метил-1-циклопентил-4-оксо-4,5-дигидро-1 Н-пиразоло[4,3-c]хинолин-7-карбоксилата. Пример получения 6. В атмосфере азота к раствору 6,95 г 1-(2-амино-5-бром-4-метилфенил)этанона и 8,5 мл триэтиламина в 104 мл тетрагидрофурана медленно добавляли 3,25 мл ацетилхлорида. После перемешивания при комнатной температуре в течение 2 дней реакционную жидкость выливали в смесь жидкостей вода/этилацетат с последующим перемешиванием в течение 30 мин и регулированием рН до 3 при помощи 6 М хлористо-водородной кислоты и водный слой отделяли. Органический слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и затем остаток очищали колоночной хроматографией на силикагеле (нгексан/этилацетат), получая при этом 6,33 г N-(2-ацетил-4-бром-5-метилфенил)ацетамида. Пример получения 7. В атмосфере азота 6,33 г N-(2-ацетил-4-бром-5-метилфенил)ацетамида добавляли к жидкой смеси 3,3 г (диметоксиметил)диметиламина и 19 мл толуола с последующим перемешиванием при 120 С в течение 16 ч. Смесь охлаждали до комнатной температуры, затем раствор концентрировали и к концентрату добавляли диизопропиловый простой эфир и смесь растирали. Порошок собирали фильтрованием,промывали диизопропиловым эфиром и затем сушили при пониженном давлении, получая при этом 6,92 г N-4-бром-2-[(2 Е)-3-(диметиламино)проп-2-еноил]-5-метилфенилацетамида. Пример получения 8. К раствору 3,37 г гидрохлорида тетрагидро-2 Н-пиран-4-илгидразина в 120 мл этанола добавляли 3,82 г порошкообразного карбоната калия с последующим перемешиванием при комнатной температуре в течение 30 мин. К смеси добавляли 6 г N-4-бром-2-[(2 Е)-3-(диметиламино)проп-2-еноил]-5 метилфенилацетамида с последующим перемешиванием при 80 С в течение 16 ч и охлаждением до комнатной температуры. Смесь выливали в смесь жидкостей вода/этилацетат и водный слой отделяли. Органический слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (н-гексан/этилацетат), получая при этом 3,96 г N-4-бром-5-метил-2-[1(тетрагидро-2 Н-пиран-4-ил)-1 Н-пиразол-5-ил]фенилацетамида. Пример получения 9. 3,96 г N-4-бром-5-метил-2-[1-(тетрагидро-2 Н-пиран-4-ил)-1 Н-пиразол-5-ил]фенилацетамида суспендировали в 18 мл 12 М хлористо-водородной кислоты с последующим перемешиванием при 120 С в течение 40 мин. Реакционную жидкость охлаждали до комнатной температуры, затем выливали в смесь жидкостей насыщенный водный раствор гидрокарбоната натрия/этилацетат и рН смеси регулировали до рН 10 при помощи 6 М водного раствора гидроксида натрия. Водный слой отделяли и затем органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и затем остаток очищали колоночной хроматографией на силикагеле (н-гексан/этилацетат), получая при этом 3,36 г 4-бром-5-метил-2-[1-(тетрагидро-2 Н-пиран-4 ил)-1 Н-пиразол-5-ил]анилина. Пример получения 10. К смеси 2,63 г метил-7-метил-4-оксо-1-(тетрагидро-2 Н-пиран-4-ил)-4,5-дигидро-1 Н-пиразоло[4,3c]хинолин-8-карбоксилата в 52 мл метанола добавляли 10,2 мл 3 М водного раствора гидроксида натрия с последующим перемешиванием при 60 С в течение 20 ч. Нерастворимое вещество отделяли фильтрованием и рН фильтрата регулировали до рН 2 концентрированной хлористо-водородной кислотой и перемешивали в течение 1 ч. Осажденный порошок собирали фильтрованием и сушили при пониженном давлении, получая при этом 2,49 г 7-метил-4-оксо-1-(тетрагидро-2 Н-пиран-4-ил)-4,5-дигидро-1 Нпиразоло[4,3-c]карбоновой кислоты в виде порошка. Пример получения 11. В атмосфере азота к раствору 1,0 г 1-(4-бром-2-нитрофенил)бутан-1,3-диона в 10 мл уксусной кислоты добавляли 501 мг гидрохлорида циклопентилгидразина с последующим перемешиванием при 100 С в течение 1 ч и 30 мин. Реакционную жидкость концентрировали и к полученному остатку добавляли этилацетат. Раствор промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и затем остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол), получая при этом 770 мг 5-(4-бром-2-нитрофенил)-1-циклопентил-3-метил-1 Н-пиразола. Пример получения 12. В атмосфере азота к раствору 4,95 г трет-бутил 2-(4-бром-2-нитробензоил)-3-оксобутаноата в 30 мл дихлорметана добавляли 20 мл трифторуксусной кислоты при охлаждении льдом. Смесь нагревали до комнатной температуры и перемешивали в течение 2,5 ч и затем растворитель выпаривали при пониженном давлении. К остатку добавляли этилацетат и раствор промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (н-гексан/этилацетат), получая при этом 2,7 г 1-(4-бром-2-нитрофенил)бутан-1,3-диона. Пример получения 13. В атмосфере азота к суспензии 2,28 г хлорида магния в 50 мл тетрагидрофурана добавляли 3,80 г трет-бутил 3-оксобутаноата при комнатной температуре. Смесь охлаждали до -8 С и к ней добавляли 3,9 мл пиридина с последующим перемешиванием при такой же температуре в течение 30 мин, нагреванием до комнатной температуры и дальнейшим перемешиванием в течение 30 мин. Смесь охлаждали до -8 С и к ней добавляли раствор 5,3 г 4-бром-2-нитробензоилхлорида в 20 мл тетрагидрофурана с последующим перемешиванием при такой же температуре в течение 1 ч, нагреванием до комнатной температуры и дальнейшим перемешиванием в течение 1,5 ч. Смесь выливали в смесь жидкостей воды и этилацетата и рН регулировали до 3 концентрированной хлористо-водородной кислотой. Водный слой отделяли и затем органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении, получая при этом 4,95 г трет-бутил 2-(4-бром-2-нитробензоил)-3-оксобутаноата. Пример получения 14. К смеси 1,60 г 1-(бензилпирролидин-3-ил)-8-бром-7-метил-1,5-дигидро-4 Н-пиразоло[4,3-c]хинолин 4-она в 80 мл диметилсульфоксида добавляли 1,27 г тетракис(трифенилфосфин)палладия(0), 2,04 мл триэтиламина и 3 мл метанола. Атмосферу в реакционном контейнере заменяли монооксидом углерода с последующим перемешиванием при 70 С в течение 10 ч. Реакционную смесь оставляли для охлаждения и затем к ней добавляли воду с последующей экстракцией смесью хлороформ/метанол. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении и полученное твердое вещество нагревали и промывали этилацетатом и затем перемешивали при комнатной температуре в течение 10 мин. Твердое вещество собирали фильтрованием и сушили при пониженном давлении, получая при этом 1,33 г метил 1-(1 бензилпирролидин-3-ил)-7-метил-4-оксо-4,5-дигидро-1 Н-пиразоло[4,3-c]хинолин-8-карбоксилата. Пример получения 15. 4,3 г трет-бутил 4-(гидроксиметил)пиперидин-1-карбоксилата, 66 мг 4,7-дифенил-1,10 фенантролина и 45 мг ацетата палладия добавляли к 50 мл бутилвинилового простого эфира с последующим перемешиванием при комнатной температуре в течение 15 мин и перемешиванием при 75 С в течение 2 дней. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (н-гексан/этилацетат),получая при этом 4,4 г трет-бутил-4-[(винилокси)метил]пиперидин-1-карбоксилата. Пример получения 16. К смеси 3,23 г 4-бром-2-[1-(тетрагидро-2 Н-пиран-4-ил)-1 Н-пиразол-5-ил]-5-(трифторметил)анилина в 32 мл N-метилпирролидона добавляли 2,6 мл DIPEA и 1,8 г CDI с последующим перемешиванием при 150 С в течение 1,5 ч. После охлаждения льдом к смеси добавляли смесь диизопропиловый эфир/этилацетат (4/1) и лед с последующим перемешиванием. Осажденное твердое вещество собирали фильтрованием и промывали водой и смесью диизопропиловый эфир/этилацетат (4/1). Полученное твердое вещество нагревали и промывали смесью диизопропиловый эфир/этилацетат (4/1) с последующим перемешиванием при комнатной температуре в течение 10 мин и твердое вещество собирали фильтрованием, промывали диэтиловым простым эфиром и затем сушили при пониженном давлении, получая при этом 2,95 г 8-бром-1-(тетрагидро-2 Н-пиран-4-ил)-7-(трифторметил)-1,5-дигидро-4 Н-пиразоло[4,3c]хинолин-4-она. Пример получения 17. К смеси 11,6 г 1-[2-амино-4-(трифторметил)фенил]этанона, 60 мл ацетонитрила и 230 мл диэтилового простого эфира добавляли 2,85 г амберлиста 15 (зарегистрированный товарный знак) и порциями к ней три раза добавляли 10,1 г N-бромсукцинимида при охлаждении на ледяной бане. После перемешивания в течение 30 мин на ледяной бане смесь перемешивали при комнатной температуре на протяжении ночи. Нерастворимое вещество отделяли фильтрованием и промывали этилацетатом. Фильтрат разделяли добавлением воды и этилацетата. Органический слой промывали 10% водным раствором тиосульфата натрия и насыщенным раствором соли и сушили над безводным сульфатом магния и затем растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (н-гексан/этилацетат), получая при этом 10,36 г 1-[2-амино-5-бром-4-(трифторметил)фенил]этанона. Пример получения 18. К смеси 6,0 г дигидрохлорида тетрагидро-2 Н-пиран-4-илгидразина в 175 мл N-метилпирролидона добавляли 11 мл DIPEA с последующим перемешиванием при комнатной температуре в течение 20 мин. К реакционной смеси добавляли 8,86 г N-4-бром-2-[(2E)-3-(диметиламино)проп-2-еноил]-5(трифторметил)фенил-2,2,2-трифторацетамида с последующим перемешиванием при 110 С в течение 1 ч. К реакционной жидкости добавляли воду с последующей экстракцией смеси изопропилацетатом и органический слой промывали насыщенным раствором соли. Растворитель выпаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол). Полученное маслянистое вещество растирали со смесью диэтиловый эфир/н-гексан, получая при этом 4,19 г N4-бром-2-[1-(тетрагидро-2 Н-пиран-4-ил)-1 Н-пиразол-5-ил]-5-(трифторметил)фенил-2,2,2-трифторацетамида. Пример получения 19. В атмосфере азота к раствору 330 мг трет-бутил (3S)-3-фенилпиперазин-1-карбоксилата в 3,5 мл ДМФА добавляли 75,4 мг гидрида натрия (включающего 40% минерального масла) при охлаждении льдом с последующим перемешиванием в течение 30 мин. К смеси добавляли 0,27 мл 2 бромэтилметилового простого эфира с последующим перемешиванием при комнатной температуре в течение 16 ч. К смеси добавляли 75,4 мг гидрида натрия (включающего 40% минерального масла) и 0,6 мл 2-бромэтилметилового простого эфира с последующим дополнительным перемешиванием в течение 8 ч. Смесь выливали в смесь жидкостей воды и этилацетата и водный слой отделяли. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле(хлороформ/метанол), получая при этом 330 мг трет-бутил (3S)-4-(2-метоксиэтил)-3-фенилпиперазин-1 карбоксилата. Пример получения 20. Смесь 3 г 4-этоксибутил п-толуолсульфоната, 2,65 г трет-бутил (3R)-3-метилпиперазин-1 карбоксилата, 3,07 г триэтиламина и 30 мл ацетонитрила перемешивали при 90 С в течение 3 ч. Реакционную жидкость выливали в насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией смеси этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол), получая при этом 3,1 г третбутил (3R)-4-(4-этоксибутил)-3-метилпиперазин-1-карбоксилата. Способ получения 21. К раствору 420 мг трет-бутил 4-[3-(пиридин-3-ил)пропил]пиперазин-1-карбоксилата в 6 мл метанола добавляли 2 мл раствора 4 М хлорида водорода-диоксана с последующим перемешиванием при ком- 20023493 натной температуре в течение 16 ч. Растворитель выпаривали при пониженном давлении, получая при этом 395 мг тригидрохлорида 1[3-(пиридин-3-ил) пропил]пиперазина. Способ получения 22. К раствору 2,0 г трет-бутил 4-[(циклопропилокси)метил]пиперидин-1-карбоксилата в 20 мл дихлорметана добавляли 3,0 мл трифторуксусной кислоты с последующим перемешиванием при комнатной температуре в течение 2 ч. Реакционную жидкость концентрировали при пониженном давлении и к остатку добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат. Органический слой отделяли, затем промывали насыщенным раствором соли и сушили над безводным сульфатом магния и растворитель выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на основном силикагеле (хлороформ/метанол), получая при этом 756 мг 4-[(циклопропилокси)метил]пиперидина. Пример получения 23. В атмосфере азота к смеси 693 мг литийалюминийгидрида и 30 мл тетрагидрофурана по каплям добавляли раствор 1,0 г 1-(пиперидин-1-ил)циклобутанкарбонитрила в 18 мл тетрагидрофурана при охлаждении льдом. Реакционную жидкость перемешивали при комнатной температуре в течение 3 ч. При охлаждении льдом к ней добавляли по каплям 1,5 мл воды и 1,5 мл 15% водного раствора гидроксида натрия. Смесь разбавляли этилацетатом и реакционную жидкость фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол), получая при этом 932 мг 1-[1-(пиперидин-1-ил)циклобутил]метанамина. Пример получения 24. В атмосфере азота при охлаждении льдом к раствору 1,5 г трет-бутил 4-[3-(пиридин-3 ил)пропаноил]пиперазин-1-карбоксилата в 25 мл тетрагидрофурана добавляли 7 мл раствора 1 М боран/тетрагидрофуран. Смесь нагревали для кипячения с обратным холодильником в течение 6 ч и затем охлаждали до комнатной температуры и к ней добавляли 10 мл метанола с последующим дополнительным нагреванием для кипячения с обратным холодильником в течение 16 ч. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении и к ней добавляли смесь жидкостей насыщенного водного раствора гидрокарбоната натрия и этилацетата. Водный слой отделяли и затем органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол), получая при этом 1,43 г трет-бутил 4-[3-(пиридин-3 ил)пропил]пиперазин-1-карбоксилата. Пример получения 25. К 3,9 г (4,4-дифторциклогексил)метанола добавляли 40 мл толуола. К смеси при комнатной температуре добавляли 10,2 г трифенилфосфина с последующим перемешиванием в течение некоторого времени. Смесь охлаждали льдом и к ней порциями добавляли 7,2 г ди-трет-бутил азодикарбоксилата при поддержании внутренней температуры приблизительно от 10 до 15 С. Реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Растворитель выпаривали и остаток очищали колоночной хроматографией на силикагеле (н-гексан/этилацетат), получая при этом 10,7 г ди-трет-бутил 1-[(4,4 дифторциклогексил)метил]гидразин-1,2-дикарбоксилата. Пример получения 26. Раствор 1,5 г 4-гидроксипиридина, 7,6 г цианометилентрибутилфосфорана и 1,4 г (2S)-2-фтор-1 пропанола в 20 мл толуола перемешивали при 105 С на протяжении ночи. К остатку добавляли 1 М хлористоводородную кислоту и этилацетат и водный слой отделяли. рН водного слоя регулировали до 11 добавлением 1 М водного раствора гидроксида натрия и органический слой отделяли добавлением этилацетата. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния и растворитель выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол), получая при этом 2,2 г 4-[(2S)-2-фторпропил]оксипиридина. Пример получения 27. К смеси (3R)-1-метилпирролидин-3-ола в 35 мл тетрагидрофурана добавляли 18,2 трифенилфосфина и к полученной смеси при охлаждении льдом добавляли по каплям раствор 13,2 г ди-третбутилазодикарбоксилата в 10 мл тетрагидрофурана с последующим перемешиванием в течение 1 ч и дополнительным перемешиванием при комнатной температуре в течение 1 ч. К реакционной смеси добавляли 40 мл 6 М хлористо-водородной кислоты с последующим перемешиванием при комнатной температуре на протяжении ночи. К реакционной жидкости добавляли 40 мл воды, тетрагидрофуран выпаривали при пониженном давлении и затем к остатку добавляли 20 мл дихлорметана для проведения разделения жидкости. К полученному водному слою добавляли 20 мл дихлорметана для проведения дважды разделения жидкости и водный слой отделяли. Из водного слоя воду выпаривали при пониженном давлении и затем совместно выпаривали с изопропанолом. Полученное твердое вещество собирали фильтрованием и сушили при пониженном давлении, получая при этом 7,92 г дигидрохлорида (3S)-3-гидразино-1- 21023493 метилпирролидина. Пример получения 28. К раствору 357 мг метил 2,2-дифтор-3-метоксипропионата в 7 мл тетрагидрофурана добавляли 2,7 мл 1 М водного раствора гидроксида натрия с последующим перемешиванием при комнатной температуре в течение 3 ч. Реакционную жидкость подкисляли добавлением 3,0 мл 1 М хлористо-водородной кислоты и затем экстрагировали этилацетатом, органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния и растворитель выпаривали при пониженном давлении. К остатку добавляли 7 мл 1,2-дихлорэтана и 25 мкл ДМФА и 219 мкл оксалилхлорида при охлаждении льдом с последующим перемешиванием при комнатной температуре в течение 1 ч. Реакционную жидкость охлаждали льдом и добавляли 1,9 мл триэтиламина и 560 мг трет-бутил пиперазин-1-карбоксилата с последующим перемешиванием при комнатной температуре на протяжении ночи. К реакционной смеси добавляли хлороформ и воду с последующей экстракцией хлороформом. Смесь промывали насыщенным раствором соли и сушили над безводным сульфатом магния и растворитель выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (н-гексан/этилацетат), получая при этом 500 мг трет-бутил 4-(2,2-дифтор-3-метоксипропаноил)пиперазин-1-карбоксилата. Пример получения 29. В атмосфере азота 63 мл диэтилцинка (1,0 М раствор в гексане) добавляли к 92 мл 1,2-дихлорэтана при -40 С и затем к смеси добавляли раствор 2,5 г трет-бутил 4-[(винилокси)метил]пиперидин-1 карбоксилата в 134 мл 1,2-дихлорэтана с последующим перемешиванием смеси при -40 С в течение 30 мин. К ней добавляли 7,5 мл хлорйодметана с последующим перемешиванием в течение 4 ч при повышении температуры от -40 до -15 С. К реакционной смеси добавляли порциями насыщенный водный раствор хлорида аммония с последующей экстракцией смеси хлороформом. Органический слой промывали насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (нгексан/этилацетат), получая при этом 2,0 г трет-бутил 4-[(циклопропилокси)метил]пиперидин-1 карбоксилата. Пример получения 30. 2,2 г 4-[(2S)-2-фторпропил]оксипиридина добавляли к раствору 22 мл уксусной кислоты в 22 мл метанола и к смеси в атмосфере аргона добавляли 500 мг 10% палладия-на-угле (влажного типа). Реакционную жидкость перемешивали при комнатной температуре на протяжении ночи в атмосфере водорода при 303975 Па (3 атм). Реакционную жидкость фильтровали через целит и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на основном силикагеле (хлороформ/метанол), получая при этом 988 мг 4-[(2S)-2-фторпропил]оксипиперидина. Пример получения 31. К смеси 500 мг 6-бром-3-фтор-2-метилпиридина, 580 мг трет-бутил (3R)-3-метилпиперазин-1 карбоксилата, 506 мг трет-бутоксида натрия и 61 мг 4,5-бис(дифенилфосфино)-9,9-диметилксантена в толуоле добавляли 48 мг трис (дибензилиденацетон)дипалладия(0) с последующим перемешиванием при 110 С в течение 3 ч. После охлаждения до комнатной температуры реакционную жидкость выливали в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (н-гексан/этилацетат), получая при этом 780 мг трет-бутил (3R)-4-(5-фтор-6-метилпиридин-2-ил)-3-метилпиперазин-1-карбоксилата. Пример получения 32. К смеси 500 мг 3-(циклопропилокси)пропанола в 5 мл дихлорметана добавляли 1,2 мл триэтиламина и 1,3 г хлорангидрида п-толуолсульфоновой кислоты при охлаждении льдом с последующим перемешиванием в течение 4 ч. Реакционную жидкость разбавляли хлороформом, промывали 1 М хлористоводородной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (н-гексан/этилацетат), получая при этом 522 мг 3-(циклопропилокси)пропил п-толуолсульфоната. Пример получения 33. К раствору 12,8 г 1-[2-амино-5-бром-4- (трифторметил)фенил]этанона в 190 мл дихлорметана добавляли 8,82 мл триэтиламина и к смеси по каплям на протяжении 10 мин при охлаждении льдом добавляли раствор 7,66 мл трифторуксусного ангидрида с последующим перемешиванием в течение 30 мин. Далее к смеси при охлаждении льдом по каплям добавляли 2,65 мл триэтиламина в 2,3 мл трифторуксусного ангидрида с последующим перемешиванием в течение 30 мин. К реакционной жидкости добавляли воду с последующей экстракцией хлороформом и органический слой промывали смесью насыщенный водный раствор гидрокарбоната натрия/лед (1/1) и насыщенным раствором соли и сушили над безводным сульфатом магния. Нерастворимое вещество отделяли фильтрованием и затем растворитель выпаривали при пониженном давлении, получая при этом 18 г N-[2-ацетил-4-бром-5-(трифторметил)фенил]2,2,2-трифторацетамида. Таким же способом, как способ примера получения 1, получали соединения примеров получения 11 и 1-2; таким же способом, как способ примера получения 2, получали соединение примера получения 2-1; таким же способом, как способ примера получения 3, получали соединения примеров получения от 3-1 до 3-13; таким же способом, как способ примера получения 5, получали соединения примеров получения от 5-1 до 5-19; таким же способом, как способ примера получения 6, получали соединения примеров получения от 6-1 до 6-2; таким же способом, как способ примера получения 7, получали соединения примеров получения от 7-1 до 7-3; таким же способом, как способ примера получения 8, получали соединения примеров получения от 8-1 до 8-18; таким же способом, как способ примера получения 9, получали соединения примеров получения от 9-1 до 9-17; таким же способом, как способ примера получения 10, получали соединения примеров получения от 10-1 до 10-21; таким же способом, как способ примера получения 14, получали соединения примеров получения от 14-1 до 14-2; таким же способом, как способ примера получения 16, получали соединения примеров получения от 16-1 до 16-8; таким же способом, как способ примера получения 17, получали соединения примеров получения от 17-1 до 17-2; таким же способом, как способ примера получения 19, получали соединения примеров получения от 19-1 до 19-16; таким же способом, как способ примера получения 20, получали соединения примеров получения от 20-1 до 20-3; таким же способом, как способ примера получения 21, получали соединения примеров получения от 21-1 до 21-39; таким же способом, как способ примера получения 24, получали соединения примеров получения от 24-1 до 24-2; таким же способом, как способ примера получения 25, получали соединения примеров получения от 25-1 до 25-4; таким же способом, как способ примера получения 26, получали соединения примеров получения от 26-1 до 26-2; таким же способом, как способ примера получения 28, получали соединение примера получения 28-1; таким же способом, как способ примера получения 30, получали соединения примеров получения 30-1 и 30-2; таким же способом, как способ примера получения 31, получали соединения примеров получения 31-1 и 31-2; таким же способом,как способ указанного ниже примера 7, получали соединения примеров получения от 34-1 до 34-14; таким же способом, как способ указанного ниже примера 4, получали соединения примеров получения от 35-1 до 35-6; таким же способом, как способ указанного ниже примера 2, получали соединение примера получения 36; и таким же способом, как способ указанного ниже примера 5, получали соединения примеров получения от 37-1 до 37-2, причем для каждого соединения применяли соответствующие исходные вещества. Структуры соединений примеров получения показаны ниже в таблицах 3-26 и физико-химические данные соединений примеров получения показаны в табл. 27-34. Пример 1. В атмосфере азота к раствору 148 мг 5-хлориндолина в 1 мл толуола добавляли 0,54 мл 1,8 М раствора триметилалюминия в толуоле при 0 С с последующим перемешиванием при комнатной температуре в течение 2 ч (раствор А). В атмосфере азота к смеси 100 мг метил-1-циклопентил-4-оксо-4,5 дигидро-1 Н-пиразоло[4,3-c]хинолин-7-карбоксилата в 3 мл толуола добавляли раствор А с последующим перемешиванием при 70 С в течение 8 ч. После охлаждения до комнатной температуры к реакционной смеси добавляли разбавленную хлористо-водородную кислоту и смесь выливали в смесь жидкостей воды и этилацетата. рН регулировали до 10 при помощи 28% водного аммиака. Нерастворимое вещество отделяли фильтрованием. Водный слой отделяли, органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом магния и растворитель выпаривали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = 100/0-92/8), получая при этом 65 мг 7-[(5-хлор-2,3-дигидро-1 Н-индол-1-ил)карбонил]-1 циклопентил-1,5-дигидро-4 Н-пиразоло[4,3-с]хинолин-4-она в виде белого порошка. Пример 2. К смеси 120 мг 7-метил-4-оксо-1-(тетрагидро-2 Н-пиран-4-ил)-4,5-дигидро-1 Н-пиразоло[4,3c]хинолин-8-карбоновой кислоты в 2,4 мл ДМФА добавляли 130 мг 1-(пиридин-3-илметил)пиперазина,0,19 мл DIPEA и 177 мг TBTU с последующим перемешиванием при комнатной температуре на протяжении ночи. Реакционную жидкость охлаждали льдом и выливали в насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = 100/0-92/8), получая при этом белый порошок. Порошок суспендировали в 1 мл метанола и к суспензии добавляли 0,37 мл раствора 4 М хлорид водорода-этилацетат с последующим перемешиванием смеси в течение 30 мин. Полученный порошок собирали фильтрованием, промывали метанолом и затем сушили при пониженном давлении, получая при этом 82 мг дигидрохлорида 7-метил-8-[4-(пиридин-3 илметил)пиперазин-1-ил]карбонил-1-(тетрагидро-2 Н-пиран-4-ил)-1,5-дигидро-4 Н-пиразоло[4,3-c]хинолин-4-она в виде белого твердого вещества. Пример 3. К смеси 8,2 г 7-метил-4-оксо-1-(тетрагидро-2 Н-пиран-4-ил)-4,5-дигидро-1 Н-пиразоло[4,3c]хинолин-8-карбоновой кислоты, 3,8 мг 1-(2-аминоэтил) пиперидина, 13,1 мкл DIPEA и 0,4 мл ДМФА добавляли смесь 9,8 мг HATU и 0,1 мл ДМФА с последующим перемешиванием при комнатной темпе- 23023493 ратуре на протяжении ночи. Реакционную жидкость очищали препаративной ВЭЖХ (метанол/0,1% водный раствор муравьиной кислоты), получая при этом 3,6 мг 7-метил-4-оксо-N-[2-(пиперидин-1-ил)этил]1-(тетрагидро-2 Н-пиран-4-ил)-4,5-дигидро-1 Н-пиразоло[4,3-c]хинолин-8-карбоксамида. Пример 4. К смеси 224 мг гидрохлорида (1-бензилпирролидин-3-ил)-8-[4-(этоксиметил)пиперидин-1 ил]карбонил-7-метил-1,5-дигидро-4 Н-пиразоло[4,3-c]хинолин-4-она в метаноле добавляли 23 мг 10% гидроксида палладия/порошок угля с последующим перемешиванием при комнатной температуре в течение 20 ч в атмосфере водорода при 303975 Па (3 атм). После возвращения к нормальному давлению и замены водорода аргоном нерастворимое вещество удаляли фильтрованием и растворитель выпаривали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния с обращенной фазой (ацетонитрил/вода = 0/100-35/65). Полученное соединение растворяли в 4 мл метанола и к раствору добавляли раствор 4 М хлорид водорода-этилацетат с последующим перемешиванием в течение 1 ч. Затем растворитель выпаривали при пониженном давлении и твердое вещество собирали фильтрованием, промывали диэтиловым эфиром и затем сушили при пониженном давлении, получая при этом 180 мг гидрохлорида 8-[4-(этоксиметил)пиперидин-1-ил]карбонил-7-метил-1-пирролидин-3-ил)-1,5 дигидро-4 Н-пиразоло[4,3-c]хинолин-4-она в виде белого твердого вещества. Пример 5. К смеси 110 мг 1-циклопентил-7-метил-4-оксо-4,5-дигидро-1 Н-пиразоло[4,3-c]хинолин-8 карбоновой кислоты в 4,4 мл ДМФА добавляли 73 мг 1-(2-изопропоксиэтил)пиперазина, 121 мкл DIPEA и 202 мг HATU с последующим перемешиванием при комнатной температуре на протяжении ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и воду с последующей экстракцией смеси этилацетатом. Органический слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния и затем растворитель выпаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = 100/0-95/5). К полученному маслянистому веществу добавляли 2 мл метанола и 265 мкл раствора 4 М хлорид водорода-этилацетат с последующим перемешиванием смеси при комнатной температуре в течение 30 мин. Растворитель выпаривали при пониженном давлении и к остатку добавляли 0,5 мл метанола и 3 мл диэтилового эфира с последующим перемешиванием смеси при комнатной температуре, получая при этом порошок, который собирали фильтрованием и сушили при пониженном давлении, получая при этом 140 мг гидрохлорида 1 циклопентил-8-[4-(2-изопропоксиэтил)пиперазин-1-ил]карбонил-7-метил-1,5-дигидро-4 Н-пиразоло[4,3-c]хинолин-4-она в виде белого порошка. Пример 6. К 95 мг этил (3R)-1-[7-метил-4-оксо-1-(тетрагидро-2 Н-пиран-4-ил)-4,5-дигидро-1 Н-пиразоло[4,3c]хинолин-8-ил]карбонилпиперидин-3-карбоксилата добавляли 5 мл этанола и 200 мкл 3 М водного раствора гидроксида натрия с последующим перемешиванием при 70 С в течение 9 ч. Реакционную смесь оставляли для охлаждения и к ней добавляли воду и этилацетат для проведения разделения жидкости. рН водного слоя регулировали до приблизительно рН 41 мл 1 М хлористо-водородной кислоты, затем раствор упаривали совместно с толуолом и осажденный порошок собирали фильтрованием. Полученный порошок сушили при пониженном давлении, получая при этом 71 мг (3R)-1-[7-метил-4-оксо-1(тетрагидро-2 Н-пиран-4-ил)-4,5-дигидро-1 Н-пиразоло[4,3-c]хинолин-8-ил]карбонилпиперидин-3-карбоновой кислоты в виде белого порошка. Пример 7. К смеси 33 мг гидрохлорида 8-[4-(этоксиметил)пиперидин-1-ил]карбонил-7-метил-1-пирролидин 3-ил)-1,5-дигидро-4 Н-пиразоло[4,3-c]хинолин-4-она в 0,66 мл 1,2-дихлорэтана и 0,26 мл уксусной кислоты добавляли 210 мкл 37% водного раствора формальдегида и 44 мг триацетоксиборгидрида натрия с последующим перемешиванием смеси при комнатной температуре в течение 2 ч. Реакционную жидкость выливали в 1 М водный раствор гидроксида натрия с последующей экстракцией смеси хлороформом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол = 100/0-90/10). Полученное соединение растворяли в 1 мл дихлорметана и к раствору добавляли 20 мкл раствора 4 М хлорид водорода-этилацетат с последующим перемешиванием в течение 15 мин. Затем растворитель выпаривали при пониженном давлении и твердое вещество собирали фильтрованием, промывали диэтиловым эфиром и затем сушили при пониженном давлении, получая при этом 24 мг гидрохлорида 8-[4-(этоксиметил)пиперидин-1-ил]карбонил-7-метил-1(1-метилпирролидин-3-ил)-1,5-дигидро-4 Н-пиразоло[4,3-с]хинолин-4-она в виде белого твердого вещества. Пример 8. К смеси 8,2 мг 7-метил-4-оксо-1-(тетрагидро-2 Н-пиран-4-ил)-4,5-дигидро-1 Н-пиразоло[4,3c]хинолин-8-карбоновой кислоты, моногидрохлорида 7,7 мг метил 3-пиперидин-4-илбензоата, 3,4 мг 1 гидроксибензотриазола, 7,0 мкл триэтиламина и 1,0 мл ДМФА добавляли 100 мг PS-карбодиимида (Biotage) с последующим перемешиванием при комнатной температуре на протяжении ночи. К реакционной смеси добавляли 75 мг МР-карбоната (Biotage), 50 мг PS-изоцианата (Biotage) и 0,5 мл ДМФА при ком- 24023493 натной температуре с последующим перемешиванием в течение 2 ч. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли 0,5 мл метанола, 0,5 мл тетрагидрофурана и 0,5 мл 1 М водного раствора гидроксида натрия с последующим перемешиванием при комнатной температуре на протяжении ночи. К реакционной жидкости добавляли 0,5 мл 1 М хлористоводородной кислоты и растворитель выпаривали при пониженном давлении. Полученный остаток очищали сочетанием препаративной ЖХ-МС (метанол/0,1% водный раствор муравьиной кислоты), получая при этом 5,8 мг 3-(1-[7-метил-4-оксо-1-(тетрагидро-2 Н-пиран-4-ил)-4,5-дигидро-1 Нпиразоло[4,3-с]хинолин-8-ил]карбонилпиперидин-4-ил)бензойной кислоты. Пример 9. К смеси 11,9 мг 7-метил-8-(пиперазин-1-илкарбонил)-1-(тетрагидро-2 Н-пиран-4-ил)-1,5 дигидро-4 Н-пиразоло[4,3-с]хинолин-4-она, 15,9 мг 6-(1-пирролидинил)никотинальдегида, 0,3 мл 1,2 дихлорэтана и 30 мкл уксусной кислоты добавляли 19,1 мг триацетоксиборгидрида натрия с последующим перемешиванием при комнатной температуре на протяжении ночи. К реакционной жидкости добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией смеси хлороформом. Растворитель органического слоя выпаривали при пониженном давлении. Полученный остаток очищали препаративной ВЭЖХ (метанол/0,1% водный раствор муравьиной кислоты), получая при этом 9,7 мг 7-метил-8-[(4-[6-(пирролидин-1-ил)пиридин-3-ил]метилпиперазин-1-ил)карбонил]-1(тетрагидро-2 Н-пиран-4-ил)-1,5-дигидро-4 Н-пиразоло[4,3-c] хинолин-4-она. Пример 10. К смеси 6,0 мг трет-бутил (3S)-3-метилпиперазин-1-карбоксилата, 17,3 мг 6-морфолинопиридин-2 карбальдегида, 0,3 мл 1,2-дихлорэтана и 5,2 мкл уксусной кислоты добавляли 19,1 мг триацетоксиборгидрида натрия с последующим перемешиванием при комнатной температуре на протяжении ночи. К реакционной жидкости добавляли насыщенный водный раствор гидрокарбоната натрия с последующей экстракцией хлороформом. Растворитель органического слоя выпаривали при пониженном давлении. К полученному остатку добавляли 300 мкл метанола и 100 мкл раствора 4 М хлорид водорода-этилацетат с последующим перемешиванием при комнатной температуре на протяжении ночи. Растворитель выпаривали при пониженном давлении и к полученному остатку добавляли 8,2 мг 7-метил-4-оксо-1(тетрагидро-2 Н-пиран-4-ил)-4,5-дигидро-1 Н-пиразоло[4,3-c]хинолин-8-карбоновой кислоты, 26,1 мклDIPEA и 0,4 мл ДМФА. Затем к полученной смеси добавляли смесь 9,5 мг HATU и 0,1 мл ДМФА с последующим перемешиванием при комнатной температуре на протяжении ночи. Реакционную жидкость очищали препаративной ВЭЖХ (метанол/0,1% водный раствор муравьиной кислоты), получая при этом 11 мг 7-метил-8-[(3S)-3-метил-4-[6-(морфолин-4-ил)пиридин-2-ил]метилпиперазин-1-ил]карбонил-1(тетрагидро-2 Н-пиран-4-ил)-1,5-дигидро-4 Н-пиразоло[4,3-c]хинолин-4-она. Таким же способом, как способы примеров 1-10, получали соединения примеров 11-677, показанных ниже в таблицах. Структуры соединений примеров показаны в табл. 35-104 и способы получения и физико-химические данные соединений примеров показаны в табл. 105-142. Кроме того, структуры других соединений формулы (I) показаны в табл. 143-146. Их можно легко получить любым из указанных выше способов получения, способов, описанных в примерах, способов,известных специалистам в данной области, или их модифицированными способами.
МПК / Метки
МПК: A61K 31/4738, C07D 471/04, A61K 31/496, A61K 31/4985, C07D 519/00, A61P 13/00, A61K 31/5377, A61P 13/02
Метки: пиразолохинолина, производное
Код ссылки
<a href="https://eas.patents.su/30-23493-proizvodnoe-pirazolohinolina.html" rel="bookmark" title="База патентов Евразийского Союза">Производное пиразолохинолина</a>
Предыдущий патент: Связывание диоксида углерода, включающее термолитические процессы на основе двух солей
Следующий патент: Способы и композиции, содержащие жасмонаты или родственные соединения, для усиления биозащитной активности в растениях
Случайный патент: Три(цикло)замещённые амидные соединения












