Замещенные соли 2,3-дигидроимидазо[1,2-c]хиназолина
Номер патента: 23646
Опубликовано: 30.06.2016
Авторы: Милитцер Ханс-Кристиан, Петерс Ян Георг, Мюллер Хартвиг
Формула / Реферат
1. Дигидрохлоридная соль 2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо-[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамида формулы (II)
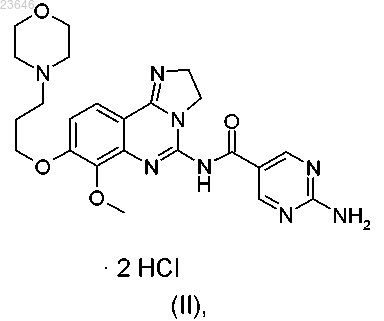
или ее сольват, гидрат или таутомер.
2. Дигидрохлоридная соль формулы (II) по п.1, которая находится в кристаллической форме и характеризуется данным по ИК-спектроскопии и Раман-спектроскопии:

3. Способ получения дигидрохлоридной соли по п.1 или 2, при этом указанный способ включает добавление соляной кислоты к соединению формулы (I)
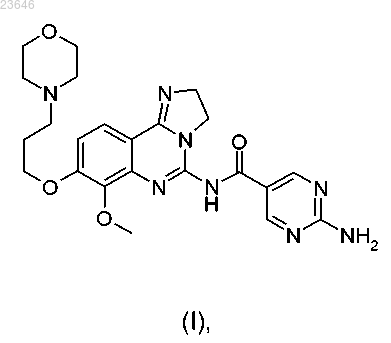
с образованием при этом указанной дигидрохлоридной соли формулы (II)
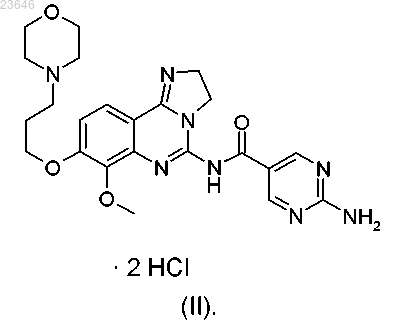
4. Способ по п.3, при этом соединение формулы (I) используют в виде суспензии.
5. Способ по п.4, при этом указанный способ включает:
a) добавление соляной кислоты к суспензии указанного соединения формулы (I) в среде при температуре от точки замерзания смеси до точки кипения смеси до достижения уровня рН от 3 до 4;
b) перемешивание полученной смеси при температуре от точки замерзания смеси до точки кипения смеси, и, при необходимости,
c) отфильтровывание полученного твердого вещества и промывку фильтровального осадка с последующим регулированием уровня рН фильтрата до рН от 1.8 до 2.0 с использованием соляной кислоты, и, при необходимости,
d) перемешивание смеси при температуре от точки замерзания до точки кипения смеси с добавлением этанола с последующим перемешиванием в течение периода времени, и, при необходимости,
е) добавление затравочных кристаллов, при необходимости, с последующим добавлением этанола, и, при необходимости,
f) отфильтровывание полученного дигидрохлорида формулы (II), при необходимости, с промывкой смесью вода-этанол и, при необходимости, с высушиванием с получением при этом дигидрохлоридной соли по п.1 или 2.
6. Способ по п.5, при этом
на стадии а) используют соляную кислоту в виде водного раствора соляной кислоты (32%) и/или используют суспензию соединения формулы (I) в воде и стадию осуществляют при температуре 20°С±2°),
стадию b) осуществляют при комнатной температуре и в течение периода времени более 10 мин,
на стадии с) отфильтровывание проводят водой и соляную кислоту используют в виде водного раствора соляной кислоты (32%),
на стадии d) перемешивание смеси осуществляют в течение периода времени 10 мин при комнатной температуре и последующее перемешивание осуществляют в течение периода времени 10 мин,
на стадии е) последующее добавление этанола осуществляют в течение периода времени 5 ч,
и на стадии f) высушивание осуществляют в виде высушивания в вакууме.
7. Способ по п.3 или 4, при этом указанный способ включает:
а) добавление указанной соляной кислоты к указанному соединению формулы (I) и затем, при необходимости,
b) перемешивание смеси при температуре от точки кипения до точки замерзания смеси, затем, при необходимости,
c) дальнейшее перемешивание при температуре от точки кипения до точки замерзания смеси, при необходимости, с перемешиванием указанной суспензии при температуре от точки кипения до точки замерзания смеси в течение периода времени до 4 ч, и, при необходимости,
d) отфильтровывание, при необходимости, промывку и высушивание с получением при этом дигидрохлоридной соли по п.1 или 2.
8. Способ по п.7, при этом
на стадии а) добавляют соляную кислоту к соединению формулы (I) в ацетон/воду или этанол/воду,
на стадии b) перемешивание осуществляют при температуре от 40 до 60°С, предпочтительно при 50°С, в течение периода времени от 0,2 до 2 ч, предпочтительно в течение 0,5 ч,
на стадии с) дальнейшее перемешивание осуществляют при температуре от 30 до 40°С, предпочтительно при 35°С в течение периода времени от 1 до 4 ч,
на стадии с) перемешивание суспензии осуществляют при температуре от 10 до 45°С, предпочтительно при 35°С, в течение периода времени от 12 до 72 ч, предпочтительно 72 ч,
на стадии с) дальнейшее перемешивание суспензии осуществляют при комнатной температуре в течение периода времени 2 ч.
9. Способ по п.3 или 7, отличающийся тем, что указанная соляная кислота является концентрированным водным раствором соляной кислоты (36% HCl), и ее добавляют к указанному соединению формулы (I) в смесь ацетон/вода (8:2 об/об), с последующим нагреванием при температуре 50°С в течение периода времени 0,5 ч, с дальнейшим нагреванием при температуре 35°С в течение периода времени 72 ч, с последующим перемешиванием указанной суспензии при комнатной температуре в течение периода времени 2 ч, с последующей фильтрацией, промывкой смесью ацетон/вода и высушиванием в вакуумной печи, с получением при этом указанной дигидрохлоридной соли по п.1 или 2.
10. Способ по п.9, отличающийся тем, что высушивание в вакуумной печи осуществляют при температуре 40°С, давлением 100 мбар, в течение периода времени 16 ч.
11. Применение соединения формулы (I)
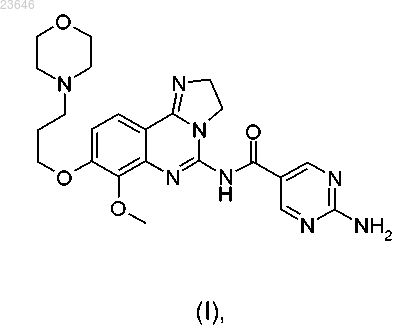
для получения дигидрохлоридной соли формулы (II)
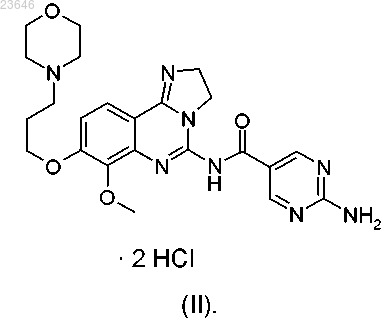
12. Применение дигидрохлоридной соли по п.1 или 2 для получения лекарственного средства для лечения и/или профилактики заболевания, выбранного из гиперпролиферативного заболевания и/или нарушения ангиогенеза.
13. Применение по п.12, причем лекарственное средство представляет собой лекарственное средство для лечения или профилактики рака, предпочтительно рака легких, немелкоклеточного рака легких, рака толстой и прямой кишки, меланомы, рака поджелудочной железы, гепатоцитного рака или рака молочной железы.
14. Применение дигидрохлоридной соли по п.1 или 2 для лечения и/или профилактики заболевания, выбранного из гиперпролиферативного заболевания и/или нарушения ангиогенеза.
15. Применение по п.14, причем заболевание выбрано из рака, предпочтительно из рака легких, немелкоклеточного рака легких, рака толстой и прямой кишки, меланомы, рака поджелудочной железы, гепатоцитного рака или рака молочной железы.
16. Применение по п.15, причем рак представляет собой лимфому.
17. Применение по п.16, причем лимфома выбрана из лимфомы, связанной со СПИДом, неходжкинской лимфомы, кожной Т-клеточной лимфомы, лимфомы Беркитта, болезни Ходжкина или лимфомы центральной нервной системы.
18. Применение по п.16 или 17, причем лимфома представляет собой неходжкинскую лимфому.
19. Фармацевтическая композиция, обладающая свойствами ингибитора фосфатидилинозитол-3-киназы класса I, содержащая дигидрохлоридную соль по п.1 или 2.
20. Способ лечения и/или профилактики заболевания, выбранного из гиперпролиферативного заболевания и/или нарушения ангиогенеза, у субъекта, включающий введение указанному субъекту терапевтически эффективного количества дигидрохлоридной соли по п.1 или 2.
21. Способ по п.20, причем заболевание выбирают из рака, предпочтительно из рака легких, немелкоклеточного рака легких, рака толстой и прямой кишки, меланомы, рака поджелудочной железы, гепатоцитного рака или рака молочной железы.
Текст
Настоящее изобретение касается 2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3 дигидроимидазо-[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамид дигидрохлоридной соли формулы (II) или ее таутомера, сольвата или гидрата; способов получения указанной дигидрохлоридной соли; указанной дигидрохлоридной соли для лечения и/или профилактики заболевания; применения указанной дигидрохлоридной соли для получения лекарственного средства для лечения и/или профилактики заболевания, в частности гиперпролиферативного заболевания и/или ангиогенеза,в частности, для лечения или профилактики рака, особенно рака лгких, в частности немелкоклеточного рака лгких, рака толстой и прямой кишки, меланомы, рака поджелудочной железы, гепатоцитного рака или рака молочной железы; фармацевтической композиции,содержащей указанную дигидрохлоридную соль; и фармацевтической комбинации, содержащей указанную дигидрохлоридную соль в комбинации с одним или более фармацевтическими веществами.(71)(73) Заявитель и патентовладелец: БАЙЕР ИНТЕЛЛЕКТУЭЛЬ ПРОПЕРТИ ГМБХ (DE) Настоящее изобретение касается 2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3 дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамид дигидрохлоридной соли формулы (II) или ее таутомера, сольвата или гидрата, (которую в дальнейшем именуют "солью согласно настоящему изобретению" или "дигидрохлоридной солью"); способов получения указанной соли согласно настоящему изобретению; указанной соли согласно настоящему изобретению для лечения и/или профилактики заболевания; применения указанной соли согласно настоящему изобретению для получения лекарственного средства для лечения и/или профилактики заболевания, в частности, гиперпролиферативного заболевания и/или ангиогенеза, в частности для лечения или профилактики рака, особенно рака лгких, в частности немелкоклеточного рака лгких, рака толстой и прямой кишки, меланомы, рака поджелудочной железы, гепатоцитного рака или рака молочной железы; фармацевтической композиции, содержащей указанную соль согласно настоящему изобретению; и фармацевтической комбинации, содержащей указанную соль согласно настоящему изобретению в комбинации с одним или более фармацевтическими веществами. Предпосылки создания изобретения Соединение формулы (I)(которое в дальнейшем именуют "соединением формулы (I)" или "свободным основанием") представляет собой запатентованный раковый агент с новым механизмом действия, ингибирующим фосфатидилинозитол-3-киназы Класса I (PI3Ks). Данный класс киназ является важной целью, так как PI3Ks играют основную роль в трансдукции клеточных сигналов с поверхностных рецепторов для выживания и пролиферации. Соединение формулы (I) проявляет широкий спектр воздействия на опухоли различных гистологических типов, как in vitro, так и in vivo. Указанное соединение формулы (I) может быть синтезировано в соответствии со способами, представленными в международной заявке на патент РСТ/ЕР 2003/010377, опубликованной как WO 04/029055 А 1 08 апреля 2004 г., (которая включена в данный документ полностью посредством ссылки),на стр. 26 и далее. Более того, указанное соединение формулы (I) опубликовано в международной заявке на патентPCT/US 2007/024985, опубликованной как WO 2008/070150 А 1 12 июня 2008 г., (которая включена в данный документ полностью посредством ссылки), в качестве соединения примера 13: 2-амино-N-[7 метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пирими-дин-5-карбоксамида. Кроме того, указанное соединение формулы (I) описано в WO 2008/070150 на стр. 9 и далее и может быть синтезировано в соответствии со способами, приведенными в указанном документе на стр. 42 и далее. Данные биологического теста для указанного соединения формулы (I) приведены в указанном документе на стр. 101-107. Указанное соединение формулы (I) может существовать в одной или более таутомерных формах: таутомеры, которые иногда называют таутомерами протонного сдвига, представляют собой два или более соединений, которые связаны миграцией атома водорода вместе с миграцией одной или более одинарных связей и одной или более кумулированных двойных связей. Соединение формулы (I) может, например, существовать в таутомерной форме (Ia), таутомерной форме (Ib) или таутомерной форме (Ic), либо может существовать в виде смеси любых этих форм, как описано выше. Предполагается, что все подобные таутомерные формы включены в объем настоящего изобретения. Указанное соединение формулы (I) может существовать в виде сольвата: сольват для целей настоящего изобретения представляет собой комплекс растворителя и соединения формулы (I) в тврдом состоянии. Примеры сольватов включают, но не ограничиваются ими, комплексы соединения согласно изобретению с этанолом или метанолом. Указанное соединение формулы (I) может существовать в виде гидрата: гидраты являются особой формой сольватов, в которых растворителем выступает вода. Техническая проблема, подлежащая решению В общем, для данного фармацевтически активного соединения желательны фармацевтически приемлемые формы указанного фармацевтически активного соединения с целью увеличения эффективности указанного фармацевтически активного соединения, например улучшения физических и химических характеристик, таких как химическая стабильность, физическая стабильность, растворимость in vivo,улучшенное поглощение фармацевтически активного соединения in vivo и т.д. В дополнение, лекарственное средство хорошо принимает стабильную кристаллическую форму, которая может быть произведена наджным образом. Аморфные или кристаллические формы низшего порядка (например, мезоморфные формы) являются менее привлекательными, так как имеется риск позднего изменения формы и изменений физических свойств. Однако указанное соединение формулы (I) (которое является свободным основанием) может быть получено только в мезоморфной форме, являющейся стабильной в тврдой форме, но нестабильной при 70 С в кислотном водном растворе, а также имеющей вышеописанный риск позднего изменения формы. Образование кристаллической соли из свободного основания (I) может решить вышеуказанную проблему, поскольку свойства данной формы являются предпочтительными по отношению свойств свободного основания (I). Пытаясь получить формы кристаллической соли (I) мы поняли, что получить формы кристаллической соли (I) не так легко, как можно ожидать от соединения с основными центрами. Кроме того, соединение формулы (I) имеет низкую растворимость в воде и большинстве органических растворителей. Растворимость значительно повышается в кислой среде, при наличии двух полных основных центров (табл. I, см. ниже). Следовательно, очищение и конечная обработка соединения формулы (I) является трудной задачей. Следующая структура иллюстрирует соединение формулы (I), где рассчитанные значения рКа указаны в скобках. Таблица I: значения рКа соединения формулы (I): В частности, что касается уникальной химической структуры соединения формулы (I), см. выше,физические свойства соединения формулы (I) являются не только перспективными по отношению к химическому процессу, обращению с лекарственным веществом и производству лекарственных средств, но и дополнительно предлагают значительные перспективы развития стабильного и наджного метода ВЭЖХ. Было бы желательно иметь фармацевтически приемлемую и кристаллическую форму соединения формулы (I), которая позволяет проводить наджное очищение, например, с помощью кристаллизации, с учтом сложных специфических технических проблем и очень низкой водной растворимости, и с которой легко справиться (например, которая является сыпучим твердым веществом). Решение технической проблемы Предпринимались различные попытки получения кристаллических солей соединения формулы (I). Получение форм кристаллической соли оказалось сложным процессом, так как, в общем, не был получен раствор, а в некоторых случая были образованы смолоподобные, липкие материалы. Неожиданно, и это является основой настоящего изобретения, было обнаружено, что дигидрохлоридная соль соединения формулы (I) согласно настоящему изобретению (заявителю не известны конкретные открытия в известном уровне техники) обладает технически полезными свойствами, как указано, в том числе, в экспериментальном разделе и в разделе Заключение данного текста. Таким образом, настоящее изобретение касается-2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо-[1,2-с]хиназолин-5 ил]пиримидин-5-карбоксамид дигидрохлоридной соли формулы (II) или ее таутомера, сольвата или гидрата, (которую в дальнейшем именуют "солью согласно настоящему изобретению" или "дигидрохлоридной солью"); способов получения указанной соли согласно настоящему изобретению; указанной соли согласно настоящему изобретению для лечения и/или профилактики заболевания; применения указанной соли согласно настоящему изобретению для получения лекарственных средств для лечения и/или профилактики заболевания, в частности гиперпролиферативного заболевания и/или ангиогенеза, в частности для лечения или профилактики рака, особенно немелкоклеточного рака лгких, рака толстой и прямой кишки, меланомы, рака поджелудочной железы, гепатоцитного рака или рака молочной железы; фармацевтической композиции, содержащей указанную соль согласно настоящему изобретению; и фармацевтической комбинации, содержащей указанную соль согласно настоящему изобретению в комбинации с одним или более фармацевтическими веществами. Способы получения соли согласно настоящему изобретению Настоящее изобретение также касается способа получения дигидрохлоридной соли формулы (II) согласно настоящему изобретению, который включает добавление соляной кислоты к соединению формулы (I), или наоборот, добавление соединения формулы (I) к соляной кислоте. В соответствии с вариантом осуществления настоящего изобретения указанный способ получения дигидрохлоридной соли формулы (II) согласно настоящему изобретению включает добавление соляной предпочтительно, в суспензии, с получением при этом указанной дигидрохлоридной соли формулы В соответствии с вариантом осуществления настоящего изобретения указанный способ получения дигидрохлоридной соли формулы (II) согласно настоящему изобретению включает:a) добавление соляной кислоты, такой как, например, водный раствор соляной кислоты (32%) к суспензии указанного соединения формулы (I) в среде, такой как, например, вода, при температуре от точки замерзания смеси до точки кипения смеси, такой как температура 20 С (+-2), до достижения уровня рН от 3 до 4;b) перемешивание полученной смеси при температуре от точки замерзания смеси до точки кипения смеси, такой как, например, комнатная температура, в течение периода времени, такого как, например,более 10 мин; и, при необходимости,c) отфильтровывание полученного твердого вещества и промывку фильтровального осадка, например, водой, с последующим регулированием уровня рН фильтрата до рН от 1.8 до 2.0 с использованием соляной кислоты, такой как, например, водный раствор соляной кислоты (32%); и, при необходимости,d) перемешивание смеси в течение периода времени, такого как, например, 10 мин, при температуре от точки замерзания до точки кипения смеси, такой как, например, комнатная температура, с добавлением этанола, с последующим перемешиванием в течение периода времени, такого как, например, 10 мин; и, при необходимости,e) добавление затравочных кристаллов, при необходимости, с последующим добавлением этанола в течение периода времени, такого как, например, 5 ч; и, при необходимости,f) отфильтровывание полученного дигидрохлорида формулы (II), при необходимости, с промывкой смесью вода-этанол и, при необходимости, с высушиванием, таким как, например, высушивание в вакууме с получением при этом дигидрохлоридной соли формулы (II) согласно настоящему изобретению. В соответствии с вариантом осуществления настоящего изобретения указанный способ получения дигидрохлоридной соли формулы (II) согласно настоящему изобретению включает:a) добавление указанной соляной кислоты к указанному соединению формулы (I), например, в ацетон/воду или этанол/воду; и затем, при необходимости,b) нагревание при температуре от точки кипения до точки замерзания смеси, такой как, например,от 40 до 60 С, такой как, например, 50 С, в течение периода времени, например, предпочтительно от 0,2 до 2 ч, такого как, например, в течение 0,5 ч; затем, при необходимости,c) дальнейшее нагревание при температуре от точки кипения до точки замерзания смеси, такой как,например, от 30 до 40 С, такой как, например, 35 С, в течение периода времени, такого как, например, от 1 до 4 ч, при необходимости, с перемешиванием указанной суспензии при температуре от точки кипения до точки замерзания смеси, такой как, например, от 10 до 45 С, такой как, например, 35 С, в течение периода времени, например, предпочтительно от 12 до 72 ч, такого как, например, 72 ч, при необходимости, с дальнейшим перемешиванием указанной суспензии при температуре от точки замерзания смеси до точки кипения смеси, такой как, например, комнатная температура, в течение периода времени от 0 до 4 ч, такого как, например, 2 ч; и, при необходимости, d) отфильтровывание, при необходимости, промывка и высушивание с получением при этом дигидрохлоридной соли формулы (II) согласно настоящему изобретению. В соответствии с вариантом осуществления указанный способ получения дигидрохлоридной соли формулы (II) согласно настоящему изобретению заключается в следующем: Указанная соляная кислота является концентрированным водным раствором соляной кислоты (1,33 г, 36% HCl) и ее добавляют к указанному соединению формулы (I) в смесь ацетон/вода (50 мл, 8:2 об/об),-4 023646 с последующим нагреванием при температуре 50 С, в течение периода времени 0,5 ч, с дальнейшим нагреванием при температуре 35 С в течение периода времени 72 ч, с последующим перемешиванием указанной суспензии при комнатной температуре в течение периода времени 2 ч, с последующей фильтрацией, промывкой смесью ацетон/вода и высушиванием в вакуумной печи (40 С, 100 мбар, 16 ч), с получением при этом указанной дигидрохлоридной соли формулы (II) согласно настоящему изобретению. Экспериментальный раздел В данном тексте используют следующие термины и сокращения: которое является соединением примера 13 WO 2008/070150 А 1, как указано выше."дигидрохлоридная соль формулы (II)" или "соль формулы (II)" означает 2-амино-N-[7-метокси-8(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамид дигидрохлорид, который является дигидрохлоридной солью формулы (II):"XRPD" означает "порошковую рентгеновскую дифрактографию": аппарат, используемый для следующих измерений:"IC" означает "Ионную хроматографию": Аппарат: Ионный хроматограф Мерка с системой супрессора Определение: Детектор проводимости, Fa. Metrohm"TGA" означает "Термогравиметрический анализ": Аппарат: Термогравиметрический анализатор TGA 7 или TGA 850 е Производитель: Perkin Elmer или Mettler-Toledo Тепловой режим: 10 Кмин" или 5 К/мин Газ для продувки (Spiilgas): азот, 20-30 мл/мин. Тигель (Tiegel): открытый платиновый тигель (offener Platin-Tiegel) Подготовка образцов: отсутствует Аппарат: дифференциальный сканирующий калориметр DSC 7 или Pyris-1 или DSC 821 е Производитель: Perkin Elmer или Mettler-Toledo Тепловой режим: 2 и 20 К/мин. или 5 K/мин. Газ для продувки (Spiilgas): азот Тигель (Tiegel): негазовый непроницаемый алюминиевый тигель Подготовка образцов: отсутствует"DVS" означает "динамическую сорбцию паров": Аппарат: Анализатор динамической сорбции паров IGA Sorp, произведнный фирмой Hiden Analytical. Температурный режим работы 25 С. Подготовка образцов: отсутствует"преим." или "преимущ." означает "преимущественно". Общая ХП: (субъективное) суждение касательно общей химической проявляемости. Пример 1. Дигидрохлоридная соль формулы (II) В суспензию соединения формулы I (3 г) в смеси ацетон/вода (50 мл, 8:2 об/об) добавили концентрированный водный раствор соляной кислоты (1,33 г, 36% HCl), что не привело к заметным изменениям. Полученную смесь перемешивали при 50 С в течение 0,5 ч, затем при 35 С в течение 3 дней, затем при комнатной температуре в течение 2 ч. Полученный тврдый материал изолировали с помощью фильтрации, промывали в смеси ацетон /вода (8:2 об/об) и высушивали в вакуумной печи (40 С, 100 мбар, 16 ч) с получением необходимого материала (3,2 г, 93% продукта). Примечание: тврдые материалы имели подходящие фильтрационные характеристики. Характеристика: Результаты XRPD соответствуют образованным кристаллическим тврдым материалам. Результаты IC соответствуют образованию дигидрохлорида. Результаты TGA соответствуют тврдым материалам, содержащим 13-14% растворителя и/или воды. Аналитическая ВЭЖХ мас.% DS соответствует дигидрохлоридным тврдым веществам, содержащим 13-14% растворителя и/или воды. ВЭЖХ скопление показало 2,2% примесей. Устойчивость в качестве тврдого вещества: Дигидрохлорид формулы (II) (100 мг из примера 4) хранили при 90 С в течение 1 недели, затем исследовали с помощью ВЭЖХ. Растворимость в воде: Гидрохлорид формулы (II) (500 мг из примера 4) перемешивали при 25 С в течение 20 ч в воде (5 мл). Полученную суспензию профильтровали на мембранном фильтре, измерили уровень рН в полученном растворе и с помощью ВЭЖХ определили растворимость. Тврдый материал, оставшийся на фильтре, исследовали с помощью XRPD и TGA. Дополнительные данные о растворимости: Дигидрохлорид формулы (II) перемешивали в 20 мл различных растворителей в течение 20 ч при 25 С. Во всех водосодержащих растворителях полностью растворилось приблизительно 2 г дигидрохлорида формулы (II). Устойчивость в растворе Гидролитическая устойчивость Различные водные растворы (0,05 % свободного основания формулы (I); после добавления 50% 2 пропанол, [буферный раствор фильтровали с 0.5 мкм на мембранном фильтре]) хранили при 25 и 70 С в течение 24 ч и одной недели. Назначение характеристических полос Таблица. Назначение характеристики активных вибраций к спектру, гдевалентные вибрации;изгибные вибрации;вне плоскости; валентные вибрации;изгибные вибрации; о.о.р.вне плоскости ИК-спектр приведен на фиг. 1. Спектр Рамана приведен на фиг. 2. Спектроскопия в видимой и инфракрасной области Аппарат и условия измерения. Спектр УФ/видимого света указан на фиг. 3. ЯМР-спектроскопия 1 Структурная формула назначенных сигналов ЯМРa) Нумерация относится к структурной формуле для назначения ЯМР-сигналов.a) Нумерация относится к структурной формуле для назначения ЯМР-сигналов. Масс-спектр дигидрохлорида формулы (II) указан на фиг. 7. Обращайтесь к спектру за относительной пиковой интенсивностью. Элементный анализ Элементный анализ был проведн компанией Bayer Industry Services, Леверкузен, Германия. Результаты: Элементный анализ соответствует дигидрохлоридной соли формулы II с 7% воды. Пример 2. Ещ один способ получения дигидрохлоридной соли формулы (II) В 366 г суспензии соединения формулы (I) в 1015 г воды добавили 183 г водного раствора соляной кислоты (32%) при температуре 20 С (+-2) до достижения уровня рН от 3 до 4. Полученную смесь перемешали при комнатной температуре более 10 мин, фильтровали, осадок на фильтре удалили путм добавления 82 г воды. Фильтрат довели до уровня рН от 1,8 до 2,0 с помощью водного раствора соляной кислоты (32%). Смесь перемешивали в течение 10 мин при комнатной температуре, добавили 146 г этанола (100%) и перемешивали ещ 10 мин. Добавили 1 г затравочных кристаллов, затем 1592 г этанола не позднее чем через 5 ч. Полученное вещество удалили с помощью фильтрации, промыли смесью водаэтанол и высушили в вакууме с получением 410 г (97%) дигидрохлорида формулы (II) чистотой 99% согласно ВЭЖХ. Сравнительный пример 1: моногидрохлорид соединения формулы (I) В суспензию соединения формулы (I) (0,5 г, 1,04 ммоль) в смеси ацетон/вода (9 мл, 8:2 об/об) добавили концентрированный раствор соляной кислоты (89 мкл, 1,07 ммоль, 1,0 экв, 36% HCl). В смеси произошли значительные изменения, однако чистый раствор получен не был. Смесь нагревали и перемешивали при 50 С в течение 0,5 ч, затем при 35 С в течение 3 дней, затем при комнатной температуре в течение 2 ч. Оставшиеся тврдые частицы удалили путм фильтрации, промыли ацетоном/водой, (8:2 об/об) и высушили (40 С, 100 мбар, 16 ч) с получением необходимого продукта (0,5 г). Результаты указывают на то, что кристаллический моногидрохлорид образован не был. Несмотря на то, что в результате эксперимента чистота улучшилась, дальнейшие исследования не проводили, так как материал был преимущественно аморфным. Сравнительный пример 2: Бис (водород сульфат) соль соединения формулы (I) В суспензию соединения формулы (I) (0,5 г, 0,103 ммоль) в смесь ацетон / вода (9 мл, 9:1 об/об) добавили концентрированный раствор серной кислоты (213 мг, 96 % H2SO4, 2 экв.). В смеси произошли значительные изменения, однако чистый раствор получен не был. Смесь нагревали и перемешивали при 50 С в течение 0,5 ч, затем при 35 С в течение 3 дней, затем при комнатной температуре в течение 2 ч. Оставшиеся суспендированные твердые частицы отделили путм фильтрации, промыли (ацетон/вода, 9:1 об/об), высушили (40 С, 100 мбар, 16 ч) с получением приблизительно 30 мг необходимого продукта. Сравнительный пример 3: соль лимонной кислоты соединения формулы (I) В суспензию соединения формулы (I) (3,0 г, 6,24 ммоль) в смеси этанол/вода (50 мл, 1:2 об/об) добавили лимонную кислоту (2,4 г, 10,2 ммоль, 1,6 экв). Смесь нагревали при перемешивании до 35 С, добавили 25 мл воды и 100 мл этанола и перемешивали при 35 С в течение 2 ч. Полученный чистый раствор охладили при комнатной температуре, перемешивание продолжали в течение 3 дней. Полученные тврдые частицы отделили путм фильтрации, промыли в 10 мл этанола и высушили (40 С, 100 мбар, 24 ч) с получением необходимого продукта (3,8 г, 90% продукта). Примечание: процесс фильтрации данного материала был очень медленным. Характеристика: Все результаты указывают на то, что однородная настоящая соль не была образована, а была получена смесь лимонной соли, свободного основания и/или лимонной кислоты. Устойчивость в качестве тврдого вещества Лимонную кислоту соединения формулы (I) (100 мг из сравнительного примера 3) хранили при 90 С в течение 1 недели. Растворимость в воде Лимонную кислоту соединения формулы (I) (500 мг из сравнительного примера 3) перемешивали при 25 С в течение 20 ч в воде (5 мл). Полученную суспензию профильтровали на мембранном фильтре,измерили уровень рН раствора и определили растворимость с помощью ВЭЖХ. Тврдые вещества, оставленные на фильтре, исследовали с помощью XRPD и TGA. Сравнительный пример 4: соль янтарной кислоты соединения формулы (I) В суспензию соединения формулы (I) (3,0 г, 6,24 ммоль) в смеси ацетон/вода (50 мл, 8:2 об/об) добавили янтарную кислоту (1,48 г, 12,5 ммоль, 2 экв.) для образования белой суспензии. Смесь нагревали и перемешивали при 50 С в течение 0,5 ч, затем при 35 С в течение 3 дней, затем при комнатной температуре в течение 2 ч. За данный период внешний вид смеси значительно не изменился. Полученные тврдые частицы удалили путм фильтрации, промыли в нескольких мл смеси ацетон/вода (8:2 об/об) и высушили (40 С, 100 мбар,16 ч) с получением необходимого продукта (3,4 г, 91%). Характеристика: Характеристика предполагает, что однородная стехиометрическая соль не была образована, а была получена смесь сукцината и свободного основания. Устойчивость в качестве тврдого вещества Соль янтарной кислоты соединения формулы (I) (100 мг из сравнительного примера 4) хранили при 90 С в течение 1 недели. Растворимость в воде Соль янтарной кислоты соединения формулы (I) (500 мг из сравнительного примера 4) перемешивали в воде (5 мл) при 25 С в течение 20 ч. Полученную суспензию фильтровали на мембранном фильтре, измерили уровень рН раствора и определили растворимость с помощью ВЭЖХ. Оставшиеся тврдые частицы исследовали с помощью XRPD и TGA. Сравнительный пример 5: малеиновая кислота соединения формулы (I) В суспензию соединения формулы (I) (3,0 г, 6,24 ммоль) в смеси ацетон/вода (50 мл, 8:2 об/об) добавили малеиновую кислоту (1,45 г, 12,5 ммоль, 2,0 экв.) с получением почти чистого раствора, который через 5 мин. стал суспензией. Смесь нагревали при 50 С в течение 0,5 ч, затем при 35 С в течение 3 дней,затем при комнатной температуре в течение 2 ч. Полученные тврдые частицы отделили с помощью фильтрации, промыли в смеси ацетон/вода (8:2 об/об) и высушили (40 С, 100 мбар, 16 ч) с получением необходимого продукта (4,0 г, 90%). Примечание: процесс фильтрации данного материала прошл хорошо. Характеристика: Результаты указывают на образование кристаллической кислой соли. В данном случае с образованием соли чистота основания не улучшилась. Устойчивость в качестве тврдого вещества Малеиновую кислоту соединения формулы (I) (100 мг из сравнительного примера 5) хранили при 90 С в течение 1 недели. Растворимость в воде Соль малеиновой кислоты соединения формулы (I) (500 мг из сравнительного примера 5) перемешивали в воде (5 мл) при 25 С в течение 20 ч. Полученную суспензию фильтровали на мембранном фильтре, измерили уровень рН раствора и определили растворимость с помощью ВЭЖХ. Оставшиеся тврдые частицы исследовали с помощью XRPD и TGA. Сравнительный пример 6: соль метансульфокислоты соединения формулы (I) К суспензии соединения формулы (I) (3,0 г, 6,24 ммоль) в смеси ацетон/вода (50 мл, 9:1 об/об) добавили метансульфокислоту (1,2 г, 12,5 ммоль, 2 экв.) с получением липкого материала. Смесь нагревали и перемешивали при 50 С в течение 0,5 ч, затем при 35 С в течение 3 дней. За данный период внешний вид смеси значительно не изменился. В смесь добавили дополнительный ацетон (50 мл), перемешивание продолжали при комнатной температуре в течение ещ 5 дней, в результате чего образовалась поддающаяся фильтрации суспензия и липкий материал. Суспензию удалили путм фильтрации, промыли ацетоном и высушили (40 С, 100 мбар, 16 ч) с получением необходимого продукта (3,5 г, 83,3%). Характеристика: Все результаты указывают на возможность образования кристаллической кислой соли. Очевидно,что оптимальные условия кристаллизации не были найдены и/или кислое вещество является очень чувствительным к условиям образования, так как материал был частично аморфным. Полиморфная форма,образованная к настоящему времени, кажется, может впитывать растворители/воду. Устойчивость в качестве тврдого вещества Соль метансульфокислоты соединения формулы (I) (100 мг из сравнительного примера 6) хранили при 90 С в течение 1 недели. Растворимость в воде Соль метансульфокислоты соединения формулы (I) (500 мг из сравнительного примера 6) перемешивали при 25 С в течение 20 ч в воде (5 мл). Образец был практически полностью растворен. Полученную смесь фильтровали на мембранном фильтре, измерили уровень рН раствора и определили растворимость с помощью ВЭЖХ. Однако после фильтрации не осталось достаточно твердого материала для дальнейшего анализа. Заключения С физико-химической точки зрения дигидрохлоридная соль формулы (II) (пример 4) согласно настоящему изобретению проявляет на удивление технические результаты, как видно в примерах и сравнительных примерах выше, как изложено в табл. 5 ниже. Таблица 5 Во-первых, как видно из сравнительного примера 1, неожиданно результаты указывают на то, что кристаллический моногидрохлорид соединения формулы (I) не был образован: он был преимущественно аморфным. Напротив, как видно из примера 1 дигидрохлоридная соль формулы (II) может образовывать кристаллическую устойчивую дигидрохлоридную соль. Кристаллическая дигидрохлоридная соль является устойчивой по отношению к обратному процессу в воде до свободного основания. Более того, дигидрохлоридная соль согласно настоящему изобретению имеет преимущественную устойчивость в воде по сравнению с другими указанными солями. Это означает, что соль не возвращается в воду до свободного основания в тестируемых условиях, т.е. выпадение свободного основания не произошло. Кристалличность дигидрохлоридной соли согласно настоящему изобретению была преимущественной по сравнению с моногидрохлоридной солью (при порошковой рентгеновской дифракции было установлено, что она является преимущественно аморфной). Во-вторых, как видно из сравнительного примера 5 (таблица характеристик), согласно результатам порошковой рентгеновской дифракции комментарии говорят о том, что разница в малеате соединения формулы (I) сравнительного примера 5, как указано, данная разница предположительно получена благодаря интеграции растворителя. Более того, согласно сравнительному примеру 5 чистота основания не была улучшена при образовании малеата. Напротив, как видно из примера 1 (дигидрохлоридная соль согласно настоящему изобретению), чистота свободного основания была улучшена при образовании дигидрохлоридной соли. Более того, качество лекарственного средства улучшилось при образовании дигидрохлоридной соли. Более того, дополнительно технически преимущественное свойство дигидрохлоридной соли (II) согласно настоящему изобретению состоит в том, что кристаллическая форма соли отлично подойдт для улучшения процесса очищения и конечной обработки: она устойчива как тврдое вещество и в растворе,а также вписывается в галеновскую стратегию (например, соль согласно настоящему изобретению растворяется быстрее, чем соединение формулы (I) (свободное основание), что является чистым техническим преимуществом. В общем, как указано в табл. 5, см. выше, дигидрохлорид является преимуществом, что касается чистоты, устойчивости соли, кристалличности и растворимости в воде. Более того, что очень важно, как видно из биохимических образцов PI3K и PI3KP: как свободное основание, так и дигидрохлоридная соль проявили одинаковую активность в обоих биохимических образцах PI3K и PI3K. Немного большая эффективность дигидрохлоридной соли возможна благодаря улучшенной растворимости. Это является большим преимуществом. Фармацевтические композиции соли согласно настоящему изобретению Как указано выше, соль согласно настоящему изобретению может быть в форме фармацевтической препаративной формы, готовой для одновременного, параллельного, отдельного или последовательного использования. Компоненты могут приниматься по-отдельности орально, внутривенно, местно, локально, внутрибрюшным или назальным способом. Указанные композиции могут быть использованы для достижения нужного фармакологического эффекта путем их введения пациенту, нуждающемуся в таком лечении. Для целей предлагаемого изобретения термин "пациент" означает млекопитающих, включая человека, которые нуждаются в лечении определенной болезни или состояния. Таким образом, настоящее изобретение включает соль согласно настоящему изобретению, которая может быть в форме фармацевтической композиции препартивной формы, состоящей из фармацевтически приемлемого носителя и фармацевтически эффективного количества указанной соли. Фармацевтически приемлемый носитель представляет собой предпочтительно носитель,который является относительно нетоксичным и безвредным для пациента при концентрации, необходимой для эффективной активности активного ингредиента, таким образом, чтобы любые побочные действия, вызванные носителем, не влияли на положительное действие компонента и/или комбинации. Фармацевтически эффективное количество комбинации представляет собой предпочтительно такое количество, при применении которого достигается положительный результат, или при применении которого оказывается воздействие на определенное патологическое состояние, которое подвергается лечению. Соли согласно настоящему изобретению могут применяться вместе с фармацевтически приемлемыми носителями, хорошо известными специалистам, с использованием любых обычных эффективных форм единиц дозирования, включая формы с немедленным, замедленным и пролонгированным высвобождением лекарственного вещества. Лекарственные средства могут вводиться местно, перорально, парентерально, назально, через глаза, сублингвально, ректально, вагинально и т.д. Для перорального введения соли могут быть изготовлены в виде твердых или жидких препаратов,таких как капсулы, пилюли, таблетки, пастилки, лекарственные леденцы, порошки, растворы, суспензии или эмульсии, обычными способами изготовления фармацевтических составов, известными специалистам. Твердыми формами единиц дозирования могут быть обычные желатиновые капсулы с твердой или мягкой оболочкой, которые будут содержать, например, ПАВ, скользящие вещества и инертные наполнители, такие как лактоза, сахароза, фосфат кальция и кукурузный крахмал. В еще одном варианте осуществления изобретения, соли согласно настоящему изобретению могут быть изготовлены в форме таблеток с использованием обычных веществ основы таблеток, таких как лактоза, сахароза и кукурузный крахмал, в комбинации со связывающими веществами, такими как аравийская камедь, кукурузный крахмал или желатин, с распадающимися веществами, которые предназначены для улучшения распадаемости и растворения таблеток после принятия таблетки, такими как картофельный крахмал, альгиновая кислота, кукурузный крахмал и гуаровая камедь, трагакантовая камедь, аравийская камедь, со скользящими веществами, которые предназначены для улучшения процесса грануляции таблеток и для предотвращения прилипания материала таблетки к пресс-формам и пуансонам для изготовления таблеток, например, тальк, стеариновая кислота или стеарат магния, кальция или цинка, с красителями, красящими веществами и ароматизаторами, такими как мята перечная, гаультериевое масло или вишневый ароматизатор, которые предназначены для улучшения эстетических качеств таблеток и для того, чтобы сделать их прием более комфортным для пациента. В число подходящих вспомогательных веществ, которые могут быть использованы при приготовлении жидких лекарственных форм для перорального введения, входят дикальцийфосфат и разбавители, такие как вода и спирты, например, этанол, бензиловый спирт и полиэтиловый спирт, как с добавлением, так и без добавления фармацевтически приемлемых ПАВ, суспендирующих веществ или эмульгирующих добавок. Другие различные материалы могут быть представлены в форме покрытий или для изменения каким-либо другим образом физической формы единицы дозирования. Например, таблетки, пилюли или капсулы могут быть покрыты шеллаком, сахаром или и тем и другим. Для получения водной суспензии пригодны диспергируемые порошки и гранулы. Они обеспечивают активный ингредиент в примеси с диспергирующим или увлажняющим агентом, суспендирующим и одним или более консервирующими веществами. Подходящие диспергирущие и суспендирующие агенты являются примерами указанных выше агентов. Также могут присутствовать дополнительные вспомогательные вещества, например, вкусовые добавки, ароматизаторы и красящие вещества, описанные выше. Фармацевтические композиции согласно настоящему изобретению могут быть в форме эмульсий типа масло в воде. Масляной фазой может являться растительное масло, такое как, например, парафиновое масло или смесь растительных масел. Подходящими эмульгирующими добавками могут быть: (1) природные камеди, такие как аравийская камедь и трагакантовая камедь, (2) природные фосфатиды, такие как соевый лецитин, (3) сложные эфиры или неполные эфиры, образованные жирными кислотами и ангидридами гекситов, например сорбитанмоноолеат, (4) продукты конденсации указанных неполных эфиров с этиленоксидом, например, полиоксиэтиленсорбитанмоноолеат. Эмульсии также могут содержать подсластители и ароматизаторы. Масляные суспензии могут быть получены путем суспендирования активного ингредиента в растительном масле, таком, например, как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загустители, такие как, например, пчелиный воск, твердый парафин или цетиловый спирт. Суспензии также могут содержать один или более консервантов, например этил или н-пропил п-гидроксибензоат,один или более красителей; одно или более ароматических веществ; и один или более подсластителей,таких как сахароза или сахарин. При приготовлении сиропов и эликсиров могут использоваться подсластители, такие как, например,глицерин, пропиленгликоль, сорбитол или сахароза. Подобные составы могут также содержать смягчитель и консерванты, такие как метил и пропилпарабены, а также ароматизаторы и красители. Соль согласно настоящему изобретению может также вводиться парентерально, то есть, подкожно,внутривенно, интраокулярно, внутрисуставно, внутримышечно или внутрибрюшинно, в виде инъекционных доз соединения, предпочтительно в физиологически приемлемом разбавителе вместе с фармацевтическим носителем, которым может быть стерильная жидкость или смесь жидкостей, таких как вода,соляной раствор, водный раствор декстрозы и соответствующие сахарные растворы, спирты, такие как этанол, изопропанол или гексадециловый спирт, гликоли, такие как пропиленгликоль или полиэтиленгликоль, кетали, полученные из глицерина, такие как 2,2-диметил-1,1-диоксолан-4-метанол, простые эфи- 18023646 ры, такие как поли(этиленгликоль) 400, масло, жирные кислоты, сложные эфиры жирных кислот, глицериды жирных кислот или ацетилированные глицериды жирных кислот, с добавлением или без добавления фармацевтически применимого ПАВ, такого как мыло или моющее средство, суспендирующего средства, такого как пектин, карбомеры, метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза или эмульгирующих добавок и других фармацевтических вспомогательных лекарственных средств. Примерами масел, которые могут применяться в парентеральных составах по настоящему изобретению, являются масла нефтяного, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло, кунжутное масло, хлопковое масло, кукурузное масло, оливковое масло, петролатум и минеральное масло. Подходящие жирные кислоты включают олеиновую кислоту, стеариновую кислоту, изостеариновую и миристиновую кислоту. Подходящие сложные эфиры жирных кислот, например, этилолеат и изопропил миристат. Подходящие мыла включают соли щелочных металлов жирных кислот, аммониевые соли и соли триэтаноламина, а подходящие детергенты включают катионные детергенты, например, диметилдиалкиламмоний галогениды, алкилпиридин галогениды и алкиламинацетаты; анионные детергенты, например, алкил-, арил- и олефинсульфонаты, алкил-, олефин, моноглицеридсульфаты и сульфаты простых эфиров и сульфосукцинаты; неионогенные детергенты,например, жирные аминоксиды, алканоламиды жирной кислоты и поли(оксиэтиленоксипропилен)ы или сополимеры этиленоксида или пропиленоксида; и детергенты амфотерного типа, например алкил-бетааминопропионаты и четвертичные аммониевые соли 2-алкилимидазолина, а также смеси этих соединений. Парентеральные композиции согласно настоящему изобретению обычно содержат от приблизительно 0,5 до приблизительно 25 мас.% активного ингредиента в растворе. Также предпочтительно могут использоваться консерванты и буферы. Для того, чтобы избежать или снизить раздражение в месте инъекции, такие составы могут содержать неионогенное поверхностно-активное вещество со значением гидрофильно-липофильного баланса (HLB), предпочтительно, приблизительно 12-17. Количество ПАВ в такой препаративной форме предпочтительно находится в пределах от приблизительно 5 до приблизительно 15 мас.%. ПАВ может быть отдельным компонентом, который имеет значение HLB, указанное выше, или может являться смесью двух или более компонентов с необходимым значением HLB. Примерами ПАВ, используемых в парентеральных композициях, являются вещества класса сложных эфиров жирных кислот полиэтиленсорбитана, например, сорбитанмоноолеат и высокомолекулярные аддукты этиленоксида с гидрофобным основанием, образующиеся путем конденсации пропиленоксида с пропиленгликолем. Фармацевтические композиции могут быть в форме стерильных инъекционных водных суспензий. Такие суспензии могут быть составлены известными способами с использованием подходящих диспергирующих веществ или смачивающих добавок и суспендирующих средств, таких как, например, карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметилцеллю-лоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь; диспергирующих веществ или смачивающих добавок, таких как природный фосфатид, например, лецитин, продукт конденсации алкиленоксида с жирной кислотой, например, полиоксиэтиленстеарат, продукт конденсации этиленоксида с длинноцепочечным алифатическим спиртом, например, гептадекаэтиленоксицетанол, продукт конденсации этиленоксида с неполным сложным эфиром, полученным из жирной кислоты, и гекситола, такой как полиоксиэтиленсорбитолмоноолеат, или продукт конденсации этиленоксида с неполным сложным эфиром, полученным из жирной кислоты и гекситолангидрида, например, полиоксиэтиленсорбитанмоноолеат. Стерильным инъекционным препаратом может также быть стерильный инъекционный раствор или суспензия в нетоксичном разбавителе или растворителе, подходящем для парентерального введения. Разбавителями и растворителями могут быть, например, вода, раствор Рингера, изотонические растворы хлористого натрия и изотонические растворы глюкозы. Кроме того, в качестве растворителей или суспендирующих веществ традиционно используют стерильные нелетучие масла. Для этого можно использовать любое нейтральное нелетучее масло, включая синтетические моно- или диглицериды. В дополнение, для изготовления инъекционных лекарственных средств могут использоваться жирные кислоты,такие как олеиновая кислота. Композиция согласно настоящему изобретению может также применяться в форме суппозиториев для ректального введения лекарственного вещества. Эти композиции можно получать смешиванием лекарственного вещества со вспомогательным веществом противораздражающего действия, твердым при обычных температурах и жидким при ректальной температуре, которое будет размягчаться в прямой кишке и высвобождать лекарственное средство. Такие материалы, например, масло какао и полиэтиленгликоль. Для другой препаративной формы, используемой в способах согласно настоящему изобретению,предполагается применение средств для трансдермального введения препарата (трансдермальные пластыри). Такие трансдермальные пластыри могут использоваться для того, чтобы обеспечить непрерывную или периодически возобновляемую инфузию соединений по настоящему изобретению в регулируемых количествах. Устройство и применение трансдермальных пластырей для введения фармацевтиче- 19023646 ских препаратов хорошо известны специалистам (см., например, патент США 19530-10536, дата выдачи 11.07.1991 г., который включен в настоящую заявку посредством ссылки). Такие пластыри могут иметь устройство, позволяющее производить непрерывное или периодическое введение фармацевтического препарата или осуществлять введение фармацевтического препарата по мере возникновения необходимости. Препаративные формы с контролируемым высвобождением для парентерального применения включают липосомальные соединения, соединения в виде полимерных микросфер и полимерных гелей,которые известны специалистам. Возможно, что введение фармацевтической композиции будет необходимо или желательно производить с использованием механического устройства для введения фармацевтических препаратов. Устройство и применение механических устройств для введения фармацевтических препаратов хорошо известны специалистам. При техниках прямого введения препаратов, например, непосредственно в мозг обыкновенно задействуется катетер для доставки лекарственного средства в желудочковую систему больного для преодоления гематоэнцефалитического барьера. Одна из таких имплантируемых систем доставки лекарственных средств, используемых для перенесения лекарственных веществ в определенные анатомические области организма, описана в патенте США 5011472, дата выдачи 30.04.1991 г. При необходимости или по желанию композиции согласно настоящему изобретению могут также содержать другие обыкновенно использующиеся фармацевтически приемлемые ингредиенты, обычно называемые носители или растворители. Для приготовления таких композиций в соответствующих формах дозирования могут использоваться стандартные процедуры. Такие ингредиенты и процедуры включают ингредиенты и процедуры, описанные в следующих источниках, каждый из которых включен в настоящий документ посредством ссылки: Powell M.F. et al., "Справочник вспомогательных веществ для парентеральных препаратов" PDA Журнал фармацевтической науки и технологии 1998, 52(5), 238-311;Strickley, R.G "Парентеральные составы синтетических препаратов на рынке США (1999)-Часть-1" PDA Журнал фармацевтической науки и технологии 1999, 53(6), 324-349; и Nema S. et al., "Вспомогательные вещества и их инъекционные продукты" PDA Журнал фармацевтической науки и технологии 1997, 51(4),166-171. Обычно используемые фармацевтические ингредиенты, которые могут, при необходимости, быть использованы для приготовления композиции в соответствии с предполагаемым способом введения,включают: подкисляющие вещества (примеры включают, но не ограничиваются ими, уксусную кислоту, лимонную кислоту, фумаровую кислоту, соляную кислоту, азотную кислоту); подщелачивающие вещества (примеры включают, но не ограничиваются ими, аммиачный раствор,карбонат аммония, диэтаноламин, моноэтаноламин, гидроксид калия, борат натрия, карбонат натрия,гидроксид натрия, триэтаноламин, троламин); адсорбенты (примеры включают, но не ограничиваются ими, порошкообразную целлюлозу и активированный уголь); аэрозольные пропелленты (примеры включают, но не ограничиваются ими, углекислый газ, CCl2F2,F2ClC-CClF2 и CClF3) вещества-вытеснители воздуха (примеры включают, но не ограничиваются ими, азот и аргон); противогрибковые консерванты (примеры включают, но не ограничиваются ими, бензойную кислоту, бутилпарабен, этилпарабен, метилпарабен, пропилпарабен, бензоат натрия); противомикробные консерванты (примеры включают, но не ограничиваются ими, бензалкония хлорид, бензетония хлорид, бензиловый спирт, цетилпиридиний хлорид, хлорбутанол, фенол, фенилэтиловый спирт, нитрат фенилртути и тимеросал); противоокислители (примеры включают, но не ограничиваются ими, аскорбиновую кислоту, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, фосфорноватистую кислоту, тиоглицерин, пропилгаллат, аскорбат натрия, бисульфит натрия, формальдегидсульфоксилат натрия, метабисульфит натрия); связующие материалы (примеры включают, но не ограничиваются ими, блок-полимеры, натуральный и синтетический каучук, полиакрилаты, полиуретаны, силиконы, полисилоксаны и сополимеры бутадиена и стирола); буферные вещества (примеры включают, но не ограничиваются ими, метафосфат калия, дикалийфосфат, ацетат натрия, цитрат натрия безводный и дигидрат цитрата натрия); носители (примеры включают, но не ограничиваются ими, сироп из аравийской камеди, ароматический сироп, ароматический эликсир, вишневый сироп, сироп какао, апельсиновый сироп, глюкозу, кукурузное масло, минеральное масло, арахисовое масло, кунжутное масло, бактериостатический физиологический раствор для инъекций и бактериостатическую воду для инъекций); хелатирующие агенты (примеры включают, но не ограничиваются ими, динатрия эдетат и эдетовую кислоту); красители (примеры включают, но не ограничиваются ими, FDC красный 3, FDC красный 20, FDC желтый 6, FDC синий 2, DC зеленый 5, DC оранжевый 5, DC красный 8,- 20023646 карамель и оксид железа красный); осветлители (примеры включают, но не ограничиваются ими, бентонит); эмульгирующие добавки (примеры включают, но не ограничиваются ими, аравийскую камедь, цетомакрогол, цетиловый спирт, глицерилмоностеарат, лецитин, сорбитанмоноолеат, полиоксиэтилен 50 моностеарат); вещества для инкапсулирования (примеры включают, но не ограничиваются ими, желатин и ацетатфталат целлюлозы); ароматизаторы (примеры включают, но не ограничиваются ими, анисовое масло, коричное масло,какао, ментол, апельсиновое масло, масло мяты перечной и ванилин); красители (примеры включают, но не ограничиваются ими глицерин, пропилен гликоль и сорбитол); отмучивающие вещества (примеры включают, но не ограничиваются ими, минеральное масло и глицерин); масла (примеры включают, но не ограничиваются ими, арахисовое масло, минеральное масло,оливковое масло, ореховое масло, кунжутное масло и растительное масло); мазевые основы (примеры включают, но не ограничиваются ими, ланолин, мазь-эмульсию, полиэтиленгликолевую мазь, петролатум, гидрофильный петролатум, белую мазь, желтую мазь и мазь на розовой воде); вещества, способствующие проникновению (трансдермальное введение) (примеры включают, но не ограничиваются ими, одноатомные или многоатомные спирты, одно- или поливалентные спирты, насыщенные или ненасыщенные жирные спирты, насыщенные или ненасыщенные сложные жирные эфиры,насыщенные или ненасыщенные дикарбоновые кислоты, эфирные масла, производные фосфатидила,цефалин, терпены, амиды, простые эфиры, кетоны и мочевины); пластификаторы (примеры включают, но не ограничиваются ими, диэтилфталат и глицерин); растворители (примеры включают, но не ограничиваются ими, этанол, кукурузное масло, хлопковое масло, глицерин, изопропанол, минеральное масло, олеиновую кислоту, ореховое масло, дистиллированную воду, воду для инъекций, стерильную воду для инъекций и стерильную воду для промываний); загустители (примеры включают, но не ограничиваются ими, цетиловый спирт, воск сложных цетиловых эфиров, микрокристаллический воск, парафин, стеариловый спирт, белый воск и желтый воск); основы для суппозиториев (примеры включают, но не ограничиваются ими, масло какао и полиэтиленгликоли (смеси; ПАВ (примеры включают, но не ограничиваются ими, хлорид бензалкония, ноноксинол 10, октоксинол 9, полисорбат 80, лаурилсульфат натрия и сорбитанмонопальмитат); суспендирующие вещества (примеры включают, но не ограничиваются ими, агар, бентонит, карбомеры, натрий-карбоксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, каолин, метилцеллюлоза, трагакант и вигум); подсластители (примеры включают, но не ограничиваются ими, аспартам, декстрозу, глицерин,маннитол, пропиленгликоль, сахарин натрия, сорбит и сахарозу); антиадгезивные вещества, использующиеся при изготовлении таблеток (примеры включают, но не ограничиваются ими, стеарат магния и тальк); связующие вещества для таблеток (примеры включают, но не ограничиваются ими, аравийскую камедь, альгиновую кислоту,карбоксиметилцеллюлозу натрия, прессуемый сахар, этилцеллюлозу, желатин, жидкую глюкозу,метилцеллюлозу, несшитый поливинилпирролидон и предварительно клейстеризованный крахмал); разбавители для таблеток и капсул (примеры включают, но не ограничиваются ими, двузамещенный фосфат кальция, каолин, лактозу, маннитол, микроскристаллическую целлюлозу, целлюлозу в порошке, осажденный карбонат кальция, карбонат натрия, фосфат натрия, сорбит и крахмал); вещества для покрытия таблеток (примеры включают, но не ограничиваются ими, глюкозный сироп, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу, этилцеллюлозу, фталат ацетата целлюлозы и шеллак); вспомогательные вещества для прямого прессования таблеток (примеры включают, но не ограничиваются ими, двузамещенный фосфат кальция); вещества, расщепляющие таблетки (примеры включают, но не ограничиваются ими, альгиновую кислоту, кальций-карбокиметилцеллюлозу, микрокристаллическую целлюлозу, полакрилин калия, сшитый поливинилпирролидон, альгинат натрия, натрия крахмала гликолат и крахмал); скользящие вещества таблеток (примеры включают, но не ограничиваются ими, коллоидную окись кремния, кукурузный крахмал и тальк); скользящие вещества для таблеток (примеры включают, но не ограничиваются ими, стеарат кальция, стеарат магния, минеральное масло, стеариновую кислоту и стеарат цинка); вещества, делающие таблетки/капсулы светонепроницаемыми (примеры включают, но не ограничиваются ими, диоксид титана); полирующие компоненты таблеток (примеры включают, но не ограничиваются ими, карнаубский воск и белый воск); загустители (примеры включают, но не ограничиваются ими, пчелиный воск, цетиловый спирт и парафин); вещества, регулирующие тоничность (примеры включают, но не ограничиваются ими, декстрозу и хлорид натрия); вещества, повышающие вязкость (примеры включают, но не ограничиваются ими, альгиновую кислоту, бентонит, карбомеры, карбоксиметилцеллюлозу натрия, метилцеллюлозу, поливинилпирролидон,альгинат натрия и трагакант); и смачивающие вещества (примеры включают, но не ограничиваются ими, гептадекаэтиленоксицетанол, лецитины, сорбитолмоноолеат, полиоксиэтилен-сорбитолмоноолеат и полиоксиэтиленстеарат). Фармацевтические композиции согласно настоящему изобретению могут быть проиллюстрированы следующим образом: Стерильный раствор IV. С использованием стерильной воды для инъекций, получают раствор (5 мг/мл) требуемого соединения, описываемого в изобретении, и, при необходимости, регулируют рН. Для введения раствор разбавляют до 1-2 мг/мл стерильной 5% декстрозой и вводят в виде инфузии IV для внутривенного вливания в течение 60 мин. Лиофилизированный порошок для IV приготовления раствора для внутривенного вливания: Стерильный препарат можно приготовить из: (i) 100-1000 мг требуемого соединения по настоящему изобретению, в виде лиофилизированного порошка, (ii) 32-327 мг/мл цитрата натрия и (iii) 300-3000 мг декстарана 40. Препаративную форму ресуспендируют при помощи стерильного солевого раствора для инъекций или 5% декстрозы до концентрации 10-20 мг/мл, затем далее разводят солевым раствором или 5% декстрозой до концентрации 0,2-0,4 мг/мл и вводят либо как болюс IV, либо как IV инфузия в течение 15-60 мин. Суспензия для внутримышечного введения: Для внутримышечного введения может быть приготовлен следующий раствор или суспензия: 50 мг/мл требуемого соединения согласно настоящему изобретению, не растворимого в воде; 5 мг/мл карбоксиметилцеллюлозы натрия 4 мг/мл TWEEN 80 9 мг/мл хлорида натрия 9 мг/мл бензилового спирта Твердые капсулы: Большое количество капсул получают путем наполнения каждой стандартной твердой желатиновой капсулы, состоящей из двух частей, 100 мг порошкообразного активного ингредиента, 150 мг лактозы, 50 мг целлюлозы и 6 мг стеарата магния. Мягкие желатиновые капсулы: Приготавливают смесь активного ингредиента в легкоусваиваемом масле, таком как соевое, хлопковое или оливковое масло, и вводят ее при помощи вытеснительного насоса в жидкий желатин для образования мягких желатиновых капсул, содержащих 100 мг активного ингредиента. Капсулы промывают и высушивают. Активный ингредиент можно растворять в смеси политэтиленгликоля, глицерина и сорбита для получения смешиваемой с водой медицинской смеси. Таблетки: Большое количество таблеток получают с использованием традиционной технологии, так что каждая единица дозирования содержит 100 мг активного ингредиента, 0,2 мг коллоидного диоксида кремния, 5 мг стеарата магния, 275 мг микрокристаллической целлюлозы, 11 мг крахмала и 98,8 мг лактозы. Для улучшения вкусовых качеств, внешнего вида и стабильности или отложенного поглощения могут применяться подходящие водные или неводные покрытия. Таблетки/капсулы с немедленным высвобождением: Это твердые лекарственные формы для перорального применения, полученные посредством стандартных и новых технологий. Эти лекарственные формы принимают перорально без воды для мгновенного растворения и доставки лекарственного средства. Активный ингредиент смешивают с жидкостью,содержащей такой ингредиент, как сахар, желатин, пектин и подсластители. Эти жидкости отвердевают и превращают в твердые таблетки или капсуловидные таблетки с использованием технологии лиофильной сушки и твердофазной экстракции. Лекарственные соединения могут подвергаться сжатию с вязкоэластичными и термоэластичными сахарами и полимерами или шипучими компонентами для получения пористых матриц, предназначенных для немедленного высвобождения без использования воды. Способ лечения рака Термин рак, в контексте настоящего изобретения, включает, но не ограничивается ими, рак молочной железы, легких, мозга, репродуктивных органов, пищеварительного тракта, мочевых путей, глаза,печени, кожи, головы и шеи, щитовидной железы, паращитовидной железы и их отдаленные метастазы. Такие заболевания включают также многочисленные миеломы, лимфомы, саркомы и лейкемии. Примеры опухоли молочной железы включают, но не ограничиваются ими, инвазивную проточную раковую опухоль, инвазивную лобулярную раковую опухоль, проточный преинвазитивный рак и лобулярный преинвазитивный рак в месте образования. Примеры опухоли дыхательных путей включают, но не ограничиваются ими, мелкоклеточную и немелкоклеточную раковую опухоль легких, а также бронхиальную аденому и плевролегочную бластому. Опухоли мозга включают, но не ограничиваются ими, глиому стволовой части мозга и гипофталмическую глиома, мозжечковую или мозговую астроцитому, медуллобластому, эпендиному, а также нейроэктодермальную и пинеальную опухоль. Опухоли мужских репродуктивных органов включают, но не ограничиваются ими, рак простаты и тестикулярный рак. Опухоли женских репродуктивных органов включают, но не ограничиваются ими,внутриматочный, шейный, яичниковый, вагинальный и относящийся к женским наружным половым органам рак, а также рак матки. Опухоли пищеварительного тракта включают, но не ограничиваются ими, рак анальный, толстой кишки, колоректальный, пищеводный, желчного пузыря, желудка, ректальный, тонкой кишки и слюнной железы. Опухоли мочевых путей включают, но не ограничиваются ими, рак мочевого пузыря, полового члена, почки, почечной лоханки, мочеточника, уретральный рак и папиллярный рак почки человека. Рак глаза включает, но не ограничивается ими, внутриглазную меланому и ретинобластому. Опухоли печени включают, но не ограничиваются ими, рак гепатоцеллюлярный (рак клеток печени с фиброламеллярным вариантом или без него), холангиоцеллюлярный (внутрипеченочный рак желчного протока) и смешанный гепатоцеллюлярный холангитный. Рак кожи включает, но не ограничивается ими, плоскоклеточнуюкарциному, саркому Капоши, злокачественную меланому, рак клеток Меркеля и немеланоцитарный рак кожи. Рак головы и шеи включает, но не ограничивается ими, рак гортанный, гипофарингеальный, носоглоточный, орофарингеальный и рак губ и ротовой полости. Лимфомы включают, но не ограничиваются ими, лимфомы, связанные со СПИДом, не относящаяся к лимфоме Ходжкина, кожная Т-клеточная лимфома, лимфома Беркитта, болезнь Ходжкина и лимфома центральной нервной системы. Саркома включает, но не ограничивается ими, саркому мягкий тканей, остеогенную саркому, злокачественную фиброзную гистиоцитому, лимфосаркому и рабдомиосаркому. Лейкемия включает, но не ограничивается ими, лейкому острую миелоидную, острую лимфобластическую, хроническую лимфицитическую, хроническую миелогенную и лейкому клеток волос. Настоящее изобретение касается способа применения соли согласно настоящему изобретению для лечения рака, как описано ниже, в частности, НМРЛ у млекопитающих, CRC, меланомы, рака поджелудочной железы, гепатоцита или рака молочной железы. Соль согласно настоящему изобретению может быть использована для подавления, блокировки, снижения, уменьшения и т.д. пролиферации клеток и/или деления клеток и/или для стимуляции апоптоза в лечении или профилактике рака, в частности,НМРЛ, CRC, меланомы, рака поджелудочной железы, гепатоцита или рака молочной железы. Этот способ включает введение нуждающемуся в таком лечении млекопитающему, включая человека, некоторого количества соединения согласно настоящему изобретению или фармацевтически приемлемой соли, изомера, полиморфа, метаболита, гидрата, сольвата или сложного эфира этого соединения и т.д., которое является эффективным для лечения или профилактики рака, в частности, НМРЛ, CRC, меланомы, рака поджелудочной железы, гепатоцита или рака молочной железы. Термин "лечение" или "терапия" используется по тексту настоящего документа в обычном значении, то есть означает помощь или уход за человеком с целью смягчения, снятия симптомов, облегчения,улучшения патологического состояния, борьбы с патологическим состоянием и т.д., вызванным заболеванием или расстройством, таким как, например, карцинома. Доза и способ введения Эффективная доза соединений согласно настоящему изобретению, необходимая для лечения каждого из указанных показаний, может быть без труда определена на основе стандартных лабораторных методов для оценки соединений, использующихся для лечения или профилактики рака, в частности,НМРЛ, CRC, меланомы, рака поджелудочной железы, карциноме печени или рака молочной железы,стандартных испытаний на токсичность и стандартных фармакологических анализов для определения лечения вышеуказанных патологических состояний у млекопитающих, а также на основе сравнения результатов этих испытаний и анализов с результатами действия известных лекарственных средств, используемых для лечения таких патологических состояний. Количество активного ингредиента, которое необходимо ввести при лечении одного из этих заболеваний, может варьироваться в широких пределах в зависимости от конкретного соединения и употребляемой единицы дозирования, способа введения, периода лечения, возраста и пола пациента, а также природы и степени патологического состояния. Общее количество активного ингредиента, которое необходимо принять, будет в основном варьироваться от приблизительно 0,001 мг/кг до приблизительно 200 мг/кг массы тела в день, предпочтительно от приблизительно 0,01 мг/кг до приблизительно 20 мг/кг массы тела в день. Клинически применимые схемы введения препарата могут варьироваться от приема 1-3 раза в день до приема раз в четыре недели. Кроме того, для того, чтобы обеспечить улучшенный общий баланс между фармакологическим эффектом препарата и переносимостью пациента, может быть полезно предусмотреть период "лекарственных каникул", то есть определенный период, когда введение препарата пациенту временно прекращается. Единица дозирования может содержать от приблизительно 0,5 до приблизительно 1,500 мг активного ингредиента и может приниматься один или более раз в день или реже, чем один раз в день. Дневная доза для введения в виде инъекций, включая внутривенные, внутримышечные, подкожные и парентеральные инъекции, а также использование методов инфузионной терапии, в среднем, предпочтительно составит 0,01-200 мг/кг общей массы тела. Дневная доза при ректальном введении, в среднем предпочтительно составит 0,01-200 мг/кг общей массы тела. Дневная доза при вагинальном введении в среднем предпочтительно составит 0,01-200 мг/кг общей массы тела. Дневная доза при местном применении, в среднем предпочтительно составит 0,1-200 мг от одного до четырех раз в день. Концентрация при трансдермальном введении предпочтительно должна быть такова, чтобы дневная доза оставалась в пределах 0,01200 мг/кг. Дневная доза при ингаляторном введении в среднем предпочтительно составит 0,01-100 мг/кг общей массы тела. Конкретные схемы приема лекарственных средств в начале и в ходе лечения для каждого пациента будут варьироваться в зависимости от природы и тяжести патологического состояния, которые устанавливает лечащий врач, ставящий диагноз, а также в зависимости от активности конкретного используемого соединения, возраста и общего состояния пациента, времени приема, способа применения, скорости выведения лекарственного средства из организма, солей лекарственных средств и других подобных факторов. Нужный способ лечения и количество доз соединения по настоящему изобретению, или его фармацевтически приемлемой соли или сложного эфира или состава, содержащего такие соединения, могут быть установлены специалистами в данной области посредством стандартных медицинских тестов. Терапии, использующие соль согласно настоящему изобретению: один или более фармацевтических агентов. Соль согласно настоящему изобретению можно применять в виде отдельного фармацевтического препарата или в комбинации с одним или более дополнительными фармацевтическими препаратами, при этом полученное сочетание соли согласно настоящему изобретению и дополнительный фармацевтический препарат не приводит к появлению негативных эффектов. Например, соль согласно настоящему изобретению можно сочетать с компонентом С, т.е. одним или более фармацевтическими препаратами,такими как известные антиангиогенезные, антигиперпролиферативные, противовоспалительными, болеутоляющими,иммунорегуляторными,диуретическими,антиаритмическими,антигиперхолестеринемическими, антидислипидемическими, антидиабетическими или антивирусными препаратами и им подобными, а также с их примесями и солями. Компонентом С может быть один или более фармацевтических агентов, таких как алдеслейкин,алендроновая кислота, альфаферон, алитретиноин, аллопуринол, алоприм, алокси, алтретамин, аминоглютетимид, амифостин, амрубицин, амсакрин, анастрозол, анзмет, аранесп, арглабин, триоксид мышьяка, аромазин, 5-азацитидин, азатиоприн, бацилла Кальметте-Герена (БЦЖ, BCG), бестатин, бетаметазон ацетат, бетаметазон натрий фосфат, бексаротен, блеомицин сульфат, броксуридин, бортезомиб, бусульфан, кальцитонин, кампат, капецитабин, карбоплатин, касодекс, цефезон, целмолейкин, церубидин, хлорамбуцил, цисплатин, кладрибин, кладрибин, клодроновая кислота, циклофосфамид, цитарабин, дакарбазин, дактиномицин, дауноксом, декадрон, декадрон фосфат, делестроген, денилейкин дифтитокс, депомедрол, деслорелин, дексразоксан, диэтилстилбестрол, дифлюкан, доцетаксел, доксифлуридин, доксорубицин, дронабинол, DW-166HC, элигард, элитек, элленс, эменд, эпирубицин, эпоэтин альфа, эпоген, эптаплатин, эргамизол, эстрэйс, эстрадиол, эстрамустин фосфат натрия, этинилэстрадиол, этиол, этидроновая кислота, этопофоз, этопофос, фадрозол, фарстон, филграстим, финастерид, флиграстим, флоксуридин, флуконазол, флударабин, 5-фтордезоксиуридин монофосфат, 5-фторурацил (5-FU), флюоксиместерон, флутамид, форместан, фостеабин, фотемустин, фулвестрант, гаммагард, гемцитабин, гемтузумаб,гливек, глиадел, госерелин, гранисетрон HCl, гистрелин, гикамтин, гидрокортон, эритрогидроксинониладенин, гидроксимочевина, ибритумомаб тиуксетан, идарубицин, ифосфамид, интерферон-альфа, интерферон-альфа 2, интерферон-альфа-2 А, интерферон-альфа-2 В, интерферон-альфа-n1,интерферон-альфа-пЗ, интерферон бета, интерферон гамма-1 а, интерлейкин-2, интрон А, пресса, иринотекан, китрил, лапатиниб, лентинана сульфат, летрозол, лейковорин, лейпролид, лейпролида ацетат, левамизол, кальциевая соль левофолиниевой кислоты, левотроид, левоксил, ломустин, лонидамин, маринол, мехлорэтамин, мекобаламин, медроксипрогестерон ацетат, мегестрола ацетат, мелфалан, менест, 6 меркаптопурин, месна, метотрексат, метвикс, милтефозин, миноциклин, митомицин С, митотан, митоксантрон, модренал, миоцет, недаплатин, невласта, ньюмега, нейпоген, нилутамид, нолвадекс, NSC631570, ОСТ-43, октреотид, ондансетрон HCl, орапред, оксалиплатин, паклитаксел, педиапред, пегаспаргаза, пегасис, пентостатин, пицибанил, пилокарпин HCl, пирарубицин, пликамицин, порфимер натрия,преднимустин, преднизолон, преднизон, премарин, прокарбазин, прокрит, ралтитрексед, RDEA 119, ребиф, рениум-186 этидронат, ритуксимаб, роферон-А, ромуртид, саладжен, сандостатин, сарграмостим,семустин, сизофиран, собузоксан, солу-медрол, спарфозовая кислота, терапия стволовыми клетками,- 24023646 стрептозоцин, хлорид стронция-89, сунитиниб, синтроид, тамоксифен, тамсулозин, тазонермин, тестолактон, таксотер, тецелейкин, темозоломид, тенипозид, тестостерона пропионат, тестред, тиогуанин,тиотепа, тиротропин, тилудроновая кислота, топотекан, торемифен, тозитумомаб, трастузумаб, треосульфан, третиноин, трексалл, триметилмеламин, триметрексат, трипторелина ацетат, трипторелин памоат, УФТ (UFT), уридин, вальрубицин, веснаринон, винбластин, винкристин, виндезин, винорельбин,вирулизин, зинекард, зиностатин стималамер, зофран, ABI-007, аколбифен, актиммун, аффинитак, аминоптерин, арзоксифен, азоприснил, атаместан, атрасентан, сорафениб (BAY 43-9006), авастин, CCI-779,CDC-501, целебрекс, цетуксимаб, криснатол, ципротерона ацетат, децитабин, DN-101, доксорубицинМТС, dSLIM, дутастерид, эдотекарин, эфлорнитин, экзатекан, фенретинид, гистамина дигидрохлорид,гидрогелевый имплантат гистрелина, гольмий-166 DOTMP, ибандроновая кислота, интерферон гамма,интрон-пег (intron-PEG), иксабепилон, гемоцианин фиссуреллы, L-651582, ланреотид, лазофоксифен,либра, лонафарниб, мипроксифен, минодронат, MS-209, липосомный МТР-РЕ, МХ-6, нафарелин, неморубицин, неовастат, нолатрексед, облимерсен, онко-TCS, озидем, паклитаксела полиглютамат, памидронат динатрия, PN-401, QS-21, квазепам, R-1549, ралоксифен, ранпирназа, 13-цис-ретиноевая кислота,сатраплатин, сеокальцитол, Т-138067, тарцева, таксопрексин, тимозин альфа 1, тиазофурин, типифарниб,тирапазамин, TLK-286, торемифен, TransMID-107R, валсподар, вапреотид, ваталаниб, вертепорфин,винфлунин, Z-100, золедроновая кислота или комбинации этих веществ. В одном из вариантов осуществления изобретения компонентом С может быть один или более следующих: 1311-chTNT, абареликс, абиратерон, акларубицин, альдеслейкин, алемтузумаб, алитретиноин,алтретамин, аминоглутетимид, амрубицин, амсакрин, анастрозол, арглабин, триоксид мышьяка, аспарагиназ, азацитидин, базиликсимаб, BAY 80-6946, BAY 1000394, BAY 86-9766 (RDEA 119), белотекан,бендамустин, бевацизумаб, бексаротен, бикалутамид, бизантрен, блеомицин, бортезомиб, бусерелин,бусульфан, кабазитаксел, кальций фолинат, кальций левофолинат, капецитабин, карбрплатин, кармофур,кармустин, катумаксомаб, целекоксиб, цельмолейкин, цетуксимаб, хлорамбуцил, хлормадинон, хлорметин, цисплатин, кладрибин, клодроновая кислота, клофарабин, кризантаспас, циклофосфамид, ципротерон, цитарабие, дакарбазин, дактиномицин, дарбэпоэтин альфа, дазатиниб, даунорубицин, децитабин,дегареликс, денилейкин дифтитокс, деносумаб, деслорелин, диброспидий хлорид, доцетаксел, доксифлуридин, доксорубицин, доксорубицин + эстрон, экулизумаб, эдреколомаб, эллептиний ацетат, элтромбопаг, эндостатин, эноцитабин, эпирубицин, эпитиостанол, эпоэтин альфа, эпоэтин бета, эптаплатин, эрибулин, эрлотиниб, эстрадиод, эстрамустин, этопосид, эверолимус, эксеместан, фадрозол, филграстим,флударабин, флуороурацил, флутамид, форместан, фотемустин, фулвестрант, нитрат галлия, ганиреликс,гефитиниб, гемцитабин, гемтузумаб, глутоксим, гозерелин, гистамин дигидрохлорид, гистрелин, гидроксикарбамид, семена I-125, ибандроновая кислота, ибритумомаб тиуксетан, идарубицин, ифосфамид,имтатиниб, имиквимод, импросульфан, интерферон альфа, интерферон бета, интерферон гамма, ипилимумаб, иринотецан, иксабепилон, ланреотид, лапатиниб, леналидомид, ленограстим, лентинан, летрозол,лейпрорелин, левамизол, лизурид, лобаплатин, ломустин, лонидамин, мазопросол, метоксипрогестерон,мегестрол, мелфалан, мепитиостан, меркаптопурин, метотрексат, метоксален, метил аминолевулинат,метилтестостерон, мифамуртид, милтефосин, мириплатин, митобронитол, митогуазон, митолактол, митомицин, митотан, митоксантрон, недаплатин, неларабин, нидотиниб, нилутамид, нимотузумаб, нимустин, нитракрин, офатумумаб, омепразол, опрелвекин, оксалиплатин, генная терапия, паклитаксел, палифермин, семя палладий-103, памидроновая кислота, панитумумаб, пазопаниб, пэгаспаргазп, PEG-эпоэтин бета (метокси PEG-эпоэтин бета), пэнфилграстим, пегинтерферон альфа-2b, пеметрексед, пентазоцин,пентостатин, пепломицин, перфосфамид, пицибанил, пирарубицин, плериксафор, пликамицин, полиглузам, эстрадурин, полисахарид-К, порфимер натрия, пралатрексат, преднимустин, прокарбазин, хинаголид, ралоксифен, ралтитрексед, ранимустин, разоксан, регорафениб, ризедроновая кислота, ритуксимаб,ромидепсин, помиплостим, сарграмостим, сипулейцел-Т, сизофиран, собузоксан, натрий глицидидазол,сорафениб, стрепрозоцин, сунитиниб, талапорфин, тамибаротен, тамоксифен, тазонермин, тецелейкин,тегафур, тегафур + гимерацил + отерацил, темопорфин, темозоломид, темсиролимус, тенипосид, тестостерон, тетрофосмин, талидомид, тиотепа, тималфасин, тиогуанин, тоцилизумаб, топотекан, торемифен,тоситумомаб, трабектидин, трастузумаб, треосульфан, третиноин, трилостан, трипрорелин, трофосфамид, триптофан, убенимекс, валрубицин, вандетаниб, вапреотидин, вемурафениб, винбластин, винкристин, виндесин, винфлюнин, винорелбин, вориностат, ворозол, иттрий-90 стеклянный микрошар, циностатин, циностатин стималамер, золедроновая кислота, зорубицин. В качестве альтернативы, указанный компонент С может быть одним или более фармацевтическими веществами, выбранными из гемцитабина, паклитаксела (когда компонент В сам по себе не является паклитакселом), цисплатина, карбоплатина, маслянокислого натрия, 5-FU, доксирубицина, тамоксифена,этопозида, трастумазаба, гефтиниба, интрона А, рапамицина, 17-AAG, U0126, инсулина, производного инсулина, лиганда PPAR, препарата сульфонилмочевины, а-ингибитора глюкозидазы, бигуанида, ингибитора DPP-IV, ингибитора 11-бета-HSD, GLP-1, производного GLP-1, GIP, производного GIP, РАСАР,производного РАСАР, секретина или производного секретина. Альтернативно, указанный компонентом С может быть одним или более фармацевтическими агентами, выбранными из следующих веществ: таксан, такой как доцетаксел, паклитаксел или таксол; эпоти- 25023646 лон, такой как иксабепилон, патупилон или сагопилон; митоксантрон; преднисолон; дексаметазон; эстрамустин; винбластин; винкристин; доксорубицин; адриамицин; идарубицин; даунорубицин; блеомицин; этопозид; циклофосфамид; ифосфамид; прокарбазин; мелфалан; 5-фторурацил; капецитабин; флударабин; цитарабин; Ара-С; 2-хлор-2'-дезоксиаденозин; тиогуанин; антиандроген, такой как флутамид, ципротерон ацетат или бикалутамид; бортезомиб; производное платины, такое как цисплатин или карбоплатин; хлорамбуцил; метотрексат и ритуксимаб. Дополнительные антигиперпролиферативные препараты, которые могут быть добавлены в виде компонента С к комбинации соли согласно настоящему изобретению, включают, но не ограничиваются ими, вещества, перечисленные в справочнике Мерк (11 ое издание, 1996), в схемах химиотерапии, применяемых для лечения рака, которые включены в настоящий документ посредством ссылки, аспарагиназа, блеомицин, карбоплатин, кармустин, хлорамбуцил, цисплатин, коласпаза, циклофосфамид, цитарабин, дакарбазин, дактиномицин, даунорубицин, доксорубицин (адриамицин), эпирубицин, эпотилон и его производные, этопозид, 5-фторурацил, гексаметилмеламин, гидроксимочевина, ифосфамид, иринотекан, лейковорин, ломустин, мехлорэтамин, 6-меркаптопурин, месна, метотрексат, митомицин С, митоксантрон, преднизолон, преднизон, прокарбазин, ралоксифен, стрептозоцин, тамоксифен, тиогуанин, топотекан, винбластин, винкристин и виндезин. Другие антигиперпролиферативные препараты, пригодные для использования в виде компонента С с комбинацией соли согласно настоящему изобретению, включают, но не ограничиваются ими, соединения, о возможности использования которых для лечения неопластических заболеваний указано в девятом издании "Клинической фармакологии по Гудману и Гилману", под редакцией Molinoff et al., издательство McGraw-Hill, стр. 1225-1287, (1996) (Goodman and Gilman's The Pharmacological Basis of Therapeutics(Ninth Edition), editor Molinoff et al., publ. by McGraw-Hill, стр. 1225-1287, (1996, которая включена в настоящую заявку посредством ссылки, такие как аминоглутетимид, L-аспарагиназа, азатиоприн, 5 азацитидин кладрибин, бусульфан, диэтилстильбэстрол, 2',2'-дифтордезоксицитидин, доцетаксел, эритрогидроксинонил аденин, этинилэстрадиол, 5-фтордезоксиуридин, 5-фтордезоксиуридин монофосфат,флударабина фосфат, флуоксиместерон, флутамид, гидроксипрогестерона капроат, идарубицин, интерферон, медроксипрогестерона ацетат, мегестрола ацетат, мелфалан, митотан, паклитаксел (когда компонет В сам по себе не является паклитакселом), пентостатин, N-фосфоноацетил-L-аспартат (PALA), пликамицин, семустин, тенипозид, тестостерона пропионат, тиотепа, триметилмеламин, уридин и винорелбин. Другие антигиперпролиферативные препараты, пригодные для использования в виде компонента С с комбинацией соли согласно настоящему изобретению включают, но не ограничиваются ими, другие антираковые вещества, такие как эпотилон и его производные, иринотекан, ралоксифен и топотекан. Как правило, применение цитотоксических и/или цитостатических средств в комбинации с компонентом С или солью согласно настоящему изобретению послужит, чтобы:(1) обеспечить более высокую эффективность снижения роста опухоли или даже уничтожение опухоли по сравнению с приемом каждого вещества в отдельности,(2) позволить принимать меньшие количества химиотерапевтических средств,(3) позволить назначать химиотерапевтическое лечение, хорошо переносимое пациентом и имеющее меньшее количество вредных лекарственных осложнений, наблюдаемых при химиотерапии одним веществом и некоторых других комбинированных видах терапии,(4) позволить лечить более широкий спектр различных типов рака у млекопитающих, особенно у человека,(5) повысить скорость ответной реакции у прошедших лечение пациентов,(6) увеличить время выживания среди прошедших лечение пациентов по сравнению со стандартными химиотерапиями,(7) продлить время развития опухоли и/или(8) обеспечить эффективность и переносимость, по крайней мере, на том же уровне, что и вещества,используемые отдельно, по сравнению с известными случаями, когда другие противораковые соли вызывают противодействующий эффект. Биологический разделP110 биохимический анализ представляет собой анализ, измеряющий инкорпорацию 33 Р в субстрат р 110, фосфатидилинсоитол (PI). Данный анализ является модификацией анализа, разработанногоRCK (Fuchikami et al., 2002). Помеченные His- N-терминальные укороченные (AN 1-108) p110 и такие же укороченные p110 (AN 1-108) белки, у которых отсутствует связывающий домен-р 85, были выражены в клетках Sf9, очищенных до 50%. Для получения кривых IC50, реакцию проводили в формате 384 с использованием пластинок MaxiSorp в следующих условиях. Пластинки были покрыты 2 g/well молярного отношения 1:1 фосфатидилиноситола (PI: Avanti 840042C) и фосфатидилсерина (PS: Avanti 840032C), растворнного в хлороформе. Органическому растворителю позволили испариться путм хранения пластинок в газоотводе в течение ночи. Пластинки были скреплены приспособлениями для заклеивания планшетов майлар и хранились до месяца при 4 С в течение необходимого периода. 7.5 нг укороченного очищенного белкар 110 добавили к каждому источнику, содержащему 9 мкл рабочего буферного раствора (50 мМ MOPSO рН 7.0, 100 мМ NaCl, 4 мМ MgCl2, 0.1% (мас./об) BSA) за исключением отрицательного контроля источников, которые получили только рабочий буферный раствор. Один микролитр каждого пробного соединения в ДМСО перенесли из разбавленных растворов для получения реакции восьмиточечной дозы (0,0, 0,003, 0,01 0,03, 0,1, 0,3, 1,0, 3,0 и 10 мкМ конечная концентрация соединения BAY). Реакцию начинали путм добавления 5 мкл 40 мкМ раствора АТФ, содержащего 20Ci/ml [- 33 Р]-АТФ и продолжали в течение двух часов при комнатной температуре с лгким перемешиванием. Реакцию завершали путм добавления 5 мкл 25 мМ исходного раствора EDTA. Планшеты были промыты в 384-машиной для отмывки планшетов в буфере без детергента и 25 мкл сцинтиляционного коктейля было добавлено в каждый источник. Радиоактивность, инкорпорированная в неподвижный субстрат PI, была определена с использованием жидкостного сцинтилляционного счтчика BetaPlate. Ингибирование было рассчитано с использованием следующего уравнения: Значения IC50 для свободного основания и дигидрохоридной соли в биологических анализах р 110 и р 110 собраны в табл. А. Два соединения проявили одинаковую активность в биологических анализахPI3K и PI3K. Немного большая эффективность дигидрохлоридной соли возможна благодаря улучшенной растворимости. Таблица А. Активность свободного основания и дигидрохлоридной соли в анализах PI3K и P13K Анализы на пролиферацию Пролиферацию клеток определяют путм использования прибора для определения люминесцентной жизнеспособности клетки Cell Titer-Glo компании Promega (Кат. G7573) после 72-часового воздействия препаратов. Кратко, клетки поместили на 500-1000 клеток/источниках 384-луночных планшетов в 25 мкл в среде для выращивания. Для каждой изученной клеточной линии, клетки помещали на отдельный планшет для определения люминесценции при t = 0 и t = 72 моментах времени. После ночной инкубации при 37 С, люминесцентные значения для образцов t = 0 определяли путм добавления 25 мкл клеточного раствора Titer-Glo в один источник, переводя планшеты в круговую качалку на 10 мин при комнатной температуре, затем планшеты исследовали в детекторе Wallac Victor2 1420 Multilabel HTS с помощью люминометрического окна (максимальное детектирование света производят при 428 нМ). Планшеты доз для момента времени t = 72 ч обрабатывали соединениями, растворнными в среде для выращивания в конечном объме 30 мкл. Затем клетки инкубировали в течение 72 ч при 37 С. Люминесцентные значения для t = 72 часовых образцов определяли путм добавления 30 мкл раствора PromegaCellTiter-Glo, затем клетки поместили в шейкер на 10 мин при комнатной температуре, изучая затем люминесценцию в люминометре Victor. Для обработки данных из значений, определнных для t = 72 часовых временных моментов, были выделены значения t = 0, как для обработанных, так и не обработанных образцов. Для определения процентного ингибирования роста использовали процентные различия люминесценции между обработанными препаратом и контрольными образцами. На панели 16 опухолевых клеточных линий, покрывающих 6 раковых симптомов, как свободное основание, так и дигидрохлоридная соль проявили сильную антипролиферативную активность, и различие в значениях IC50 составило менее чем три раза, во всех исследованных опухолевых клеточных линиях. Данная информация чтко указывает на то, что дигидрохлоридная соль сохраняет противоопухолевую активность свободного основания. Таблица В. Антипролиферативная активность свободного основания и дигидрохлорида в анализах пролиферации опухолевой клеточной линииFuchikami K., Togame H., Sagara A., Satoh T., Gantner F., Bacon KB., Reinemer P. J. Biomol Screen. 7(5): 441-50 (2002). Универсальный экран с высокой пропускной способностью для ингибиторов активности липидкиназы: развитие анализа неподвижного фосфолипидного планшета для фосфоинозитида 3 киназы гамма. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Дигидрохлоридная соль 2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3 дигидроимидазо-[1,2-с]хиназолин-5-ил]пиримидин-5-карбоксамида формулы (II) или ее сольват, гидрат или таутомер. 2. Дигидрохлоридная соль формулы (II) по п.1, которая находится в кристаллической форме и характеризуется данным по ИК-спектроскопии и Раман-спектроскопии: 3. Способ получения дигидрохлоридной соли по п.1 или 2, при этом указанный способ включает добавление соляной кислоты к соединению формулы (I) с образованием при этом указанной дигидрохлоридной соли формулы (II) 4. Способ по п.3, при этом соединение формулы (I) используют в виде суспензии. 5. Способ по п.4, при этом указанный способ включает:a) добавление соляной кислоты к суспензии указанного соединения формулы (I) в среде при температуре от точки замерзания смеси до точки кипения смеси до достижения уровня рН от 3 до 4;b) перемешивание полученной смеси при температуре от точки замерзания смеси до точки кипения смеси, и, при необходимости,c) отфильтровывание полученного твердого вещества и промывку фильтровального осадка с последующим регулированием уровня рН фильтрата до рН от 1.8 до 2.0 с использованием соляной кислоты, и,при необходимости,d) перемешивание смеси при температуре от точки замерзания до точки кипения смеси с добавлением этанола с последующим перемешиванием в течение периода времени, и, при необходимости,е) добавление затравочных кристаллов, при необходимости, с последующим добавлением этанола,и, при необходимости,f) отфильтровывание полученного дигидрохлорида формулы (II), при необходимости, с промывкой смесью вода-этанол и, при необходимости, с высушиванием с получением при этом дигидрохлоридной соли по п.1 или 2. 6. Способ по п.5, при этом на стадии а) используют соляную кислоту в виде водного раствора соляной кислоты (32%) и/или используют суспензию соединения формулы (I) в воде и стадию осуществляют при температуре 202 С,стадию b) осуществляют при комнатной температуре и в течение периода времени более 10 мин,на стадии с) отфильтровывание проводят водой и соляную кислоту используют в виде водного раствора соляной кислоты (32%),на стадии d) перемешивание смеси осуществляют в течение периода времени 10 мин при комнатной температуре и последующее перемешивание осуществляют в течение периода времени 10 мин,на стадии е) последующее добавление этанола осуществляют в течение периода времени 5 ч,ина стадии f) высушивание осуществляют в виде высушивания в вакууме. 7. Способ по п.3 или 4, при этом указанный способ включает: а) добавление указанной соляной кислоты к указанному соединению формулы (I) и затем, при необходимости,b) перемешивание смеси при температуре от точки кипения до точки замерзания смеси, затем, при необходимости,c) дальнейшее перемешивание при температуре от точки кипения до точки замерзания смеси, при необходимости, с перемешиванием указанной суспензии при температуре от точки кипения до точки замерзания смеси в течение периода времени до 4 ч и, при необходимости,d) отфильтровывание, при необходимости, промывку и высушивание с получением при этом дигидрохлоридной соли по п.1 или 2. 8. Способ по п.7, при этом на стадии а) добавляют соляную кислоту к соединению формулы (I) в ацетон/воду или этанол/воду,на стадии b) перемешивание осуществляют при температуре от 40 до 60 С, предпочтительно при 50 С, в течение периода времени от 0,2 до 2 ч, предпочтительно в течение 0,5 ч,на стадии с) дальнейшее перемешивание осуществляют при температуре от 30 до 40 С, предпочти- 29
МПК / Метки
МПК: C07D 487/04, A61K 31/519, A61P 35/00
Метки: соли, 2,3-дигидроимидазо[1,2-c]хиназолина, замещенные
Код ссылки
<a href="https://eas.patents.su/30-23646-zameshhennye-soli-23-digidroimidazo12-chinazolina.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные соли 2,3-дигидроимидазо[1,2-c]хиназолина</a>
Предыдущий патент: Анод для электролитического выделения хлора
Следующий патент: Альтернативная установка газодиффузионного электрода в электрохимической ячейке с перколяторной технологией












