Соли и кристаллические формы 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила
Номер патента: 15677
Опубликовано: 31.10.2011
Авторы: Штовассер Франк, Бэнцигер Маркус, Гарад Судхакар Девидасрао
Формула / Реферат
1. Кристаллическая форма соединения формулы I
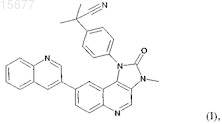
или гидрата или сольвата соединения формулы I, или соли соединения формулы I, или гидрата или сольвата соли соединения формулы I.
2. Соединение I по п.1 в кристаллической форме A.
3. Соединение по п.2, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 8,4±0,3°.
4. Соединение I по п.1 в кристаллической форме B.
5. Соединение по п.3, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 6,9±0,3°.
6. Соединение I по п.1 в кристаллической форме C.
7. Соединение по п.6, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 14,7±0,3°.
8. Соединение I по п.1 в кристаллической форме D.
9. Соединение по п.8, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 23,9±0,3°.
10. Моногидрат соединения I по п.1 в кристаллической форме HA.
11. Соединение по п.10, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 17,6±0,3°.
12. Монотозилат соединения I по п.1 в кристаллической форме.
13. Монотозилат соединения I по п.12 в кристаллической форме A.
14. Соединение по п.12 или 13, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 5,7±0,3°.
15. Соединение по пп.12, 13 или 14, на рентгенограмме которого содержатся пики при углах дифракции 2-тэта, равных 5,4±0,3°; 5,7±0,3° и 17,2±0,3°.
16. Соединение по п.12 или 13, которое обладает рентгенограммой, в основном такой, как представленная на фиг. 6.
17. Монотозилат соединения I по п.12 в кристаллической форме B.
18. Соединение по п.12 или 17, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 5,8±0,3°.
19. Соединение по пп.12, 17 или 18, на рентгенограмме которого содержатся пики при углах дифракции 2-тэта, равных 5,8±0,3°; 17,8±0,3° и 18,7±0,3°.
20. Моногидрат монотозилата соединения I по п.1 в кристаллической форме HA.
21. Соединение по п.20, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 6,5±0,3°.
22. Дигидрат монотозилата соединения I по п.1 в кристаллической форме HB.
23. Соединение по п.22, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 6,9±0,3°.
24. Сольват с 2 молекулами муравьиной кислоты монотозилата соединения I по п.1 в кристаллической форме SA.
25. Соединение по п.24, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 5,8±0,3°.
26. Дитозилат соединения I по п.1 в кристаллической форме.
27. Дитозилат соединения I по п.26 в кристаллической форме A.
28. Соединение по п.26 или 27, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 22,4±0,3°.
29. Тригидрат дитозилата соединения I по п.1 в кристаллической форме HA.
30. Соединение по п.29, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 4,7±0,3°.
31. Аморфный монотозилат соединения I по п.1.
32. Моногидрат сольвата с 2 молекулами муравьиной кислоты монотозилата соединения I по п.1 в кристаллической форме SC.
33. Соединение по п.32, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 5,6±0,3°.
34. Сольват с 2 молекулами уксусной кислоты монотозилата соединения I по п.1 в кристаллической форме SB.
35. Соединение по п.34, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 5,7±0,3°.
36. Фармацевтическая композиция, включающая твердую форму соединения формулы I, его гидраты или сольваты, его соли и гидраты или сольваты его солей по любому из пп.1-35 и необязательно по меньшей мере один фармацевтически приемлемый носитель.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента В изобретении описаны особые кристаллические формы 2-метил-2-[4-(3-метил-2-оксо-8 хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила, его гидратов и сольватов, его солей и гидратов и сольватов его солей, некоторые способы их получения,фармацевтические композиции, содержащие эти кристаллические формы, и их применение в диагностических методиках или предпочтительно для лекарственного лечения теплокровных животных, предпочтительно людей, и их применение в качестве промежуточного продукта или для приготовления фармацевтических препаратов, предназначенных для применения в диагностических методиках или предпочтительно для лекарственного лечения теплокровных животных, предпочтительно людей. Штовассер Франк (DE), Бэнцигер Маркус (CH), Гарад Судхакар Девидасрао (US) Веселицкая И.А., Пивницкая Н.Н.,Кузенкова Н.В., Веселицкий М.Б.,Каксис Р.А., Комарова О.М., Белоусов Ю.В. (RU) 015677 Настоящее изобретение относится к особым твердым, предпочтительно кристаллическим или аморфным, более предпочтительно кристаллическим формам 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3 ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила (соединение I, см. ниже), к его гидратам и сольватам, его солям и гидратам и сольватам его солей, некоторым способам их получения, фармацевтическим композициям, содержащим эти твердые формы, и к их применению в диагностических методиках или предпочтительно для лекарственного лечения теплокровных животных, предпочтительно людей, и к их применению в качестве промежуточного продукта или для приготовления фармацевтических препаратов, предназначенных для применения в диагностических методиках или предпочтительно для лекарственного лечения теплокровных животных, предпочтительно людей. Уровень техники 2-Метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрил, ингибирование им активности липидкиназ, таких как PI3-киназа и/или представители семейства протеинкиназ, родственных PI3-киназе (также называющиеся PIKK и включающие DNA-PK,ATM, ATR, hSMG-1 и mTOR), таких как ДНК-протеинкиназа, его получение и его применение, в особенности в качестве противоопухолевого средства, описаны в WO 2006/122806. В этой публикации соединения приведены в качестве примера в свободной форме (см., например, пример 7) и в виде соли с 4-толуолсульфоновой кислотой в стехиометрическом соотношении 1:1. Синтез 2-метил-2-[4-(3-метил-2 оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила также описан в экспериментальной части в примере 1. Согласно изобретению неожиданно было установлено, что при некоторых условиях можно обнаружить новые особые кристаллические формы 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила, его гидратов и сольватов, его солей и гидратов или сольватов его солей, которые описаны ниже в настоящем изобретении и которые являются полезными для применения в разных случаях и обладают полезными характеристиками. Они обладают новыми физическими характеристиками, которые могут привести к значительным различиям в некоторых фармацевтических характеристиках и которые можно использовать для лекарственного вещества и приготовления лекарственного продукта, например, для растворения лекарственных веществ и/или облегчения путей приготовления/очистки. Подробное описание изобретения Настоящее изобретение более подробно описано ниже с использованием чертежей и других средств. Настоящее изобретение предпочтительно относится к в основном чистым кристаллическим формам 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила формулы I (соединение I) гидрата или сольвата соединения формулы I, или соли соединения формулы I, или гидрата или сольвата соли соединения формулы I. Описание чертежей На рентгенограммах, рассмотренных ниже, углы дифракции 2-тэта отложены по горизонтальной оси (оси X) и интенсивности (количества импульсов) - по вертикальной оси (оси Y). Фиг. 1. Форма A 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин 1-ил)фенил]пропионитрила. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 8,4, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 7,9 и 10,5. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 7,9; 8,4; 10,5; 10,9; 13,3; 17,9; 22,0. Данные порошковой рентгенограммы получены на приборе Scintag с использованием источника излучения Cu K-альфа; шаг 0,020, диапазон 2,00-40,00,постоянная скорость сканирования 0,50/мин (все значения 2-тэта 0,3). Фиг. 2. Форма B 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин 1-ил)фенил]пропионитрила. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 6,9, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 14,2 и 17,7. При пол-1 015677 ном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 6,9; 8,7; 10,1; 14,2; 17,7; 20,5; 21,1. Данные порошковой рентгенограммы получены на приборе Scintag с использованием источника излучения Cu K-альфа; шаг 0,020, диапазон 2,00-40,00,постоянная скорость сканирования 0,50/мин (все значения 2-тэта 0,3). Фиг. 3. Модельная порошковая рентгенограмма формы C 2-метил-2-[4-(3-метил-2-оксо-8-хинолин 3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 14,7, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 11,4 и 18,6. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 6,6; 11,4; 14,7; 15,6; 18,3; 18,6; 19,8; 22,7; 24,5 (все значения 2-тэта 0,3). Фиг. 4. Форма D 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин 1-ил)фенил]пропионитрила. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 23,9, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 20,6 и 22,1. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 8,5; 19,9; 20,2; 20,6; 22,1; 23,9; 26,1; 27,2. Данные порошковой рентгенограммы получены на приборе STOE Stadi P Combi с использованием источника излучения Cu K-альфа-1; щель 4 мм/2 мм; с образцом, помещенным в каптоновую пленку; Монохроматор: срез кристалла германия в направлении (111), излучение 1,54060 , генератор: 50 кВ, 30 мА, детектор: линейный ФЗД (фазочувствительный детектор)/регулируемый/на постоянной частоте; диапазон 1: 2-тэта (начало, конец,шаг)=2,000, 39,980, 0,020; 390,00 с/шаг (все значения 2-тэта 0,3). Фиг. 5. ФормаHA моногидрата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 17,6, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 18,8 и 22,5. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 5,6; 6,9; 8,5; 9,2; 13,8; 17,6; 18,8; 22,5; 24,0. Данные порошковой рентгенограммы получены на приборе Bruker D8 Discover GADDS в режиме отражения (все значения 2-тэта 0,3). Фиг. 6. ФормаA монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 5,7, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 5,4 и 17,2. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 5,4; 5,7; 16,4; 17,2; 18,3; 19,0; 22,0; 23,1; 23,4; 27,5. Данные порошковой рентгенограммы получены на приборе Scintag с использованием источника излучения Cu K-альфа; шаг 0,020,диапазон 2,00-40,00, постоянная скорость сканирования 0,50/мин (все значения 2-тэта 0,3). Фиг. 7. ФормаB монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 5,8, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 17,8 и 18,7. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 5,8; 16,4; 17,2; 17,8; 18,4; 18,7; 22,1; 22,7; 23,7. Данные порошковой рентгенограммы получены на приборе STOE Stadi P Combi с использованием источника излучения Cu K-альфа-1; щель 4 мм/2 мм; с образцом, помещенным в каптоновую пленку; монохроматор: срез кристалла германия в направлении (111), излучение 1,54060 , генератор: 50 кВ, 30 мА, детектор: линейный ФЗД/регулируемый/на постоянной частоте; диапазон 1: 2-тэта (начало, конец, шаг)=2,000; 39,980; 0,020; 390,00 с/шаг (все значения 2-тэта 0,3). Фиг. 8. Модельная порошковая рентгенограмма формы HA моногидрата монотозилата 2-метил-2-[4(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила (рассчитана по соответствующей монокристаллической структуре).-2 015677 Кристаллографические характеристики моногидрата монотозилата соединения I. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 6,5, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 4 линии, обладающие относительными интенсивностями, равными более 50%, расположенные при 7,8; 19,6; 23,1 и 26,2. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 6,5; 7,8; 9,0; 11,4; 14,9; 19,3; 19,6; 23,1; 26,2 (все значения 2-тэта 0,3). Фиг. 9. Модельная порошковая рентгенограмма формы HB дигидрата монотозилата 2-метил-2-[4-(3 метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила (рассчитана по соответствующей монокристаллической структуре). Кристаллографические характеристики дигидрата монотозилата соединения I. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 6,9, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 19,5 и 26,6. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 6,9; 10,2; 13,4; 13,8; 16,4; 16,9; 19,5; 21,1; 26,6 (все значения 2-тэта 0,3). Фиг. 10. Модельная порошковая рентгенограмма формы SA сольвата с 2 молекулами муравьиной кислоты монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин 1-ил)фенил]пропионитрила (рассчитана по соответствующей монокристаллической структуре). Кристаллографические характеристики сольвата с муравьиной кислотой монотозилата соединения I. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 5,8, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 7,6 и 20,9. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 5,8; 7,9; 11,7; 13,1; 13,6; 14,5; 17,3; 20,9; 22,6; 24,5 (все значения 2-тэта 0,3).-3 015677 Фиг. 11. Форма A дитозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Кристаллографические характеристики дитозилата соединения I. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 22,4, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 21,5 и 25,0. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 5,6; 7,7; 15,8; 16,8; 18,6; 19,1; 21,5; 22,4; 25,0. Данные порошковой рентгенограммы получены на приборе Bruker D8 Advance с использованием источника излучения Cu K-альфа; шаг 0,017, время счета 0,3 с, диапазон 2,00-40,00, щель с переменным отклонением 12 мм, детектор ФЗД VANTEC (все значения 2-тэта 0,3). Фиг. 12. Модельная порошковая рентгенограмма формы HA тригидрата дитозилата 2-метил-2-[4-(3 метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила (рассчитана по соответствующей монокристаллической структуре). Кристаллографические характеристики соединения I дитозилата тригидрата. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 4,7, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 9,4 и 12,6. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 4,7; 7,4; 8,4; 9,4; 12,6; 13,7; 14,7; 18,3; 20,8; 24,1 (все значения 2-тэта 0,3). Фиг. 13. Аморфная форма монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Данные порошковой рентгенограммы получены на приборе Bruker D8 Advance с использованием источника излучения Cu K-альфа; шаг 0,017, время счета 0,3 с, диапазон 2,00-40,00, щель с переменным отклонением 12 мм, детектор ФЗД VANTEC. Фиг. 14. Спектры комбинационного рассеяния аморфной формы монотозилата 2-метил-2-[4-(3 метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Спектр комбинационного рассеяния образца снят на дисперсионном спектрометре комбинационного рассеяния с лазерным источником возбуждения при 1064 нм (Bruker RFS 100). Существенные полосы в спектрах охарактеризованы обратными значениями волновых чисел (см-1). Фиг. 15. ИК Фурье-спектры аморфной формы монотозилата 2-метил-2-[4-(3-метил-2-оксо-8 хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Инфракрасный спектр поглощения образца получен с использованием инфракрасного Фурьемикроскопа (Bruker Vertex 70). Существенные полосы в спектрах охарактеризованы обратными значениями волновых чисел (см-1).-4 015677 Фиг. 16. Модельная порошковая рентгенограмма формы SC сольвата с 2 молекулами муравьиной кислоты моногидрата монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила (рассчитана по соответствующей монокристаллической структуре). Кристаллографические характеристики сольвата с муравьиной кислотой моногидрата монотозилата соединения I. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 5,6, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 20,7 и 22,2. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 5,6; 7,6; 12,9; 13,3; 14,3; 20,7; 22,2; 24,5; 25,2; 26,2; 29,3 (все значения 2-тэта 0,3). Фиг. 17 Модельная порошковая рентгенограмма формы SB сольвата с 2 молекулами уксусной кислоты монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1 ил)фенил]пропионитрила (рассчитана по соответствующей монокристаллической структуре). Кристаллографические характеристики сольвата с уксусной кислотой соединения монотозилата I. Наиболее интенсивная линия наблюдается на рентгенограмме при угле дифракции 2-тэта, равном 5,7, и она обладает относительной интенсивностью, равной 100%. Обнаружены еще 2 линии, обладающие относительными интенсивностями, равными более 10%, расположенные при 7,7 и 22,3. При полном описании эта форма характеризуется дифракционными пиками, расположенными при углах дифракции 2-тэта, равных 5,7; 7,7; 12,7; 13,4; 14,3; 14,6; 20,1; 20,5; 20,7; 22,3; 23,7; 24,0; 24,2; 24,9; 26,0(все значения 2-тэта 0,3). Термин "в основном чистая" в контексте настоящего изобретения означает, что не менее 90, предпочтительно не менее 95 и наиболее предпочтительно не менее 99 мас.% кристаллов соединения формулы I, его гидратов или сольватов, его солей или гидратов или сольватов его солей находятся в указанной кристаллической форме, предлагаемой в настоящем изобретении. Термин "твердая форма" в контексте настоящего изобретения включает кристаллические формы и аморфные формы. Предпочтительными твердыми формами являются кристаллические формы. В контексте утверждения о том, что кристаллическая форма соединения формулы I, его гидратов или сольватов, его солей или его гидратов или сольватов его солей обладает рентгенограммой, в основном такой, как приведенная на одном из чертежей, термин "в основном" означает, что на диаграмме,приведенной на указанном чертеже, содержатся по меньшей мере главные линии, т.е. обладающие относительной интенсивностью, равной более 20%, предпочтительно более 30% по сравнению с наиболее интенсивной линией этой диаграммы.-5 015677 В одном предпочтительном варианте осуществления кристаллическая форма соединения формулыI, его гидратов или сольватов, его солей или его гидратов или сольватов его солей обладает рентгенограммой, в основном такой, как приведенная на одном из чертежей. Особенно высокое предпочтение отдается твердой, предпочтительно кристаллической форме соединения формулы I, его гидратов и сольватов, его солей и гидратов или сольватов его солей, которые можно получить, как это описано в примерах. Одним из преимущества возможности использования разных кристаллических форм соединения формулы I, его гидратов или сольватов, его солей или гидратов или сольватов его солей является то, что для разных кристаллических форм при кристаллизации характерно включение разных примесей, т.е. примесь, которая включается в кристаллическую форму AA, необязательно включается в кристаллическую форму BB или в кристаллическую форму CC. Другими словами, последовательное получение разных кристаллических форм одного и того же вещества приводит к улучшению чистоты конечного полученного вещества. Кроме того, разные кристаллические формы обладают разными физическими характеристиками, такими как температуры плавления, гигроскопичность, растворимость, сыпучесть или термодинамическая стабильность, поэтому наличие разных кристаллических форм позволяет выбрать форму, наиболее подходящую для конкретного применения или объекта, например, для применения в качестве промежуточного продукта в методике приготовления лекарственного средства или для применения в разных вводимых формах, таких как таблетки, капсулы, мази или растворы. Твердые, предпочтительно кристаллические формы соединения формулы I, его гидратов или сольватов, его солей и гидратов или сольватов его солей обладают ценными фармакологическими характеристиками и могут, например, применяться для лечения патологических состояний, которые опосредуются активацией ферментов PI3 киназ, таких как пролиферативные, воспалительные или аллергические патологические состояния или нарушения, обычно возникающие в связи с трансплантацией. Твердые, аморфные или кристаллические, предпочтительно кристаллические формы соединения формулы I, его гидратов или сольватов, его солей и гидратов или сольватов его солей предпочтительно можно использовать для лечения пролиферативного заболевания, выбранного из группы, включающей доброкачественную или злокачественную опухоль, карциному головного мозга, почек, печени, надпочечников, мочевого пузыря, молочной железы, желудка, опухоли желудка, яичников, ободочной кишки,прямой кишки, предстательной железы, поджелудочной железы, легких, влагалища или щитовидной железы, саркомы, глиобластомы, множественную миелому или рак желудочно-кишечного тракта, в особенности карциному прямой кишки или колоректальную аденому или опухоль головы и шеи, гиперпролиферацию эпидермиса, псориаз, гиперплазию предстательной железы, неоплазию, неоплазию эпителиального характера, лимфомы, карциномы молочной железы или лейкоз. Другие заболевания включают синдром Коудена, болезнь Лермитта-Дудоса и синдром Баннаяна-Зонана и заболевания, при которых аберрантно активирован путь PI3K/PKB. Настоящее изобретение предпочтительно относится к форме A монотозилата 2-метил-2-[4-(3 метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила,предназначенной для лечения одного из указанных заболеваний, отмеченных в настоящем изобретении, или для приготовления фармакологического средства, предназначенного для его лечения. Настоящее изобретение также относится к способу лечения теплокровных животных, страдающих от указанных заболеваний, в котором количество твердой, предпочтительно кристаллической формы соединения формулы I, его гидратов или сольватов, его солей или гидратов или сольватов его солей, которое эффективно для борьбы с соответствующим заболеванием, предпочтительно количество, обладающее антипролиферативной эффективностью, вводят теплокровным животным, нуждающимся в таком лечении. Кроме того, настоящее изобретение относится к применению твердых, предпочтительно кристаллических форм соединения формулы I, его гидратов или сольватов, его солей и гидратов или сольватов его солей для приготовления фармацевтических композиций, предназначенных для применения с целью лечения организма человека или животного, предпочтительно для лечения пролиферативного заболевания, такого как доброкачественная или злокачественная опухоль, карцинома головного мозга,почек, печени, надпочечников, мочевого пузыря, молочной железы, желудка, опухоли желудка, яичников, ободочной кишки, прямой кишки, предстательной железы, поджелудочной железы, легких, влагалища или щитовидной железы, саркомы, глиобластомы, множественная миелома или рак желудочнокишечного тракта, в особенности карцинома прямой кишки или колоректальная аденома или опухоль головы и шеи, гиперпролиферация эпидермиса, псориаз, гиперплазия предстательной железы, неоплазия,неоплазия эпителиального характера, лимфомы, карцинома молочной железы или лейкоз. Твердые, предпочтительно кристаллические формы соединения формулы I, его гидратов или сольватов, его солей или гидратов или сольватов его солей, описанные в настоящем изобретении, можно использовать для приготовления стабильных фармацевтических дозированных форм. Следовательно, настоящее изобретение также относится к фармацевтическим препаратам, которые содержат количество,предпочтительно терапевтически эффективное для предупреждения или лечения одного из заболеваний,указанных в настоящем изобретении, количество твердой, предпочтительно кристаллической формы соединения формулы I, его гидратов или сольватов, его солей или гидратов или сольватов его солей, со-6 015677 вместно с фармацевтически приемлемыми носителями, которые пригодны для местного, энтерального,например перорального или ректального, или парентерального введения и которые могут быть неорганическими или органическими и твердыми или жидкими. Фармацевтические препараты, предлагаемые в настоящем изобретении, которые при необходимости могут содержать дополнительные фармакологически активные вещества, готовят по известным технологиям, например с помощью обычных технологий перемешивания, гранулирования, нанесения покрытий, растворения или лиофилизации, и они содержат примерно от 1 до 100%, предпочтительно от примерно 1 до примерно 20% активного вещества или веществ. Настоящее изобретение также относится к способу приготовления фармацевтической композиции,который включает смешивание твердой, предпочтительно кристаллической формы соединения формулыI, его гидратов или сольватов, его солей или гидратов или сольватов его солей, предлагаемых в настоящем изобретении, по меньшей мере с одним фармацевтически приемлемым носителем или разбавителем. Термин "фармацевтическая композиция" означает продукт, включающий активный ингредиент (ингредиенты), фармацевтически приемлемые инертные наполнители, которые образуют носитель, а также любой продукт, который прямо или косвенно образуется путем комбинирования, комплексообразования или агрегации любых двух или большего количества ингредиентов или путем диссоциации одного или большего количества ингредиентов или вследствие других типов реакций или взаимодействий одного или большего количества ингредиентов. В соответствии с этим фармацевтические композиции, предлагаемые в настоящем изобретении, включают любую композицию, полученную смешиванием активного ингредиента, дополнительного активного ингредиента (ингредиентов) и фармацевтически приемлемых инертных наполнителей. Термин "инертный наполнитель" означает компонент фармацевтического продукта, который не является активным ингредиентом, такой как наполнитель, разбавитель или носитель. Инертные наполнители, которые применимы для приготовления фармацевтической композиции, предпочтительно обычно являются безопасными, нетоксичными и не являются биологически или в другом отношении нежелательными и являются приемлемыми для применения в ветеринарии, а также в фармацевтике. "Фармацевтически приемлемый инертный наполнитель" при использовании в настоящем описании и формуле изобретения включает один или более чем один такой инертный наполнитель."Терапевтически эффективное количество" означает количество соединения, которое при введении для лечения или предупреждения заболевания достаточно для такого лечения или предупреждения заболевания. "Терапевтически эффективное количество" будет меняться в зависимости от соединения, заболевания и его тяжести и возраста, массы и т.п. подвергающегося лечению пациента. Настоящее изобретение также относится к способу приготовления твердых, предпочтительно кристаллических форм соединения формулы I, его гидратов или сольватов, его солей и гидратов или сольватов его солей. Теперь можно определить точные условия, при которых образуются кристаллы, и на практике существует целый ряд подходящих методик, включая условия кристаллизации, описанные в примерах 3-17. Условия, вызывающие кристаллизацию, обычно включают использование соответствующего вызывающего кристаллизацию растворителя, такого как трет-бутилметиловый эфир (ТБМЭ), метанол, этанол,изопропанол, или вода, или их смеси. Обычно аморфное соединение растворяют в растворителе при температуре не ниже 10C. Раствор можно получить растворением в растворителе любого одного или большего количества аморфных форм соединения и его сольватов, таких как гидраты, метаноляты, этаноляты, изопропаноляты или формиаты. Затем кристаллы можно получить из раствора, кристаллизация происходит при температуре примерно от 0C и до температуры кипения растворителя. Растворение и кристаллизацию можно провести по различным обычным методикам. Например, аморфное соединение можно растворить в растворителе или смеси растворителей, в которой оно легко растворимо при повышенной температуре, но в которой оно лишь умеренно растворимо при более низких температурах. После растворения при повышенной температуре проводят охлаждение, во время которого искомые кристаллы выкристаллизовываются из раствора. Стадию охлаждения и нагревания можно проводить несколько раз, например по меньшей мере один раз, по меньшей мере 2 раза, по меньшей мере 3 раза, по меньшей мере 5 раз. Температуры охлаждения и нагревания равны, например, не ниже 5, не ниже 10 или не ниже 15C. Низкая температура циклов охлаждение/нагревание может, например, быть ниже 15, ниже 10, ниже 5 или ниже 0C, тогда как высокая температура может, например, быть не ниже 15, не ниже 20,не ниже 25 или не ниже 30C. Также можно использовать смешанные растворители, включающие хороший растворитель, в котором соединение легко растворимо предпочтительно в количествах, составляющих не менее 1 мас.% при 30C, и плохой растворитель, в котором оно умеренно растворимо предпочтительно в количествах, составляющих не более примерно 0,01 мас.% при 30C, при условии, что при пониженной температуре,обычно не ниже примерно 0C, возможна кристаллизация из смеси выбранных растворителей. Альтернативно, можно использовать различие в растворимости кристаллов в разных растворителях. Например, аморфное соединение можно растворить в хорошем растворителе, в котором оно хорошо рас-7 015677 творимо, таком как в котором оно растворимо в количествах, составляющих не менее 1 мас.% примерно при 30C и затем раствор смешать с плохим растворителем, в котором оно хуже растворимо, таким как в котором оно растворимо в количествах, составляющих не более примерно 0,01 мас.% примерно при 30C. Таким образом, раствор соединения в хорошем растворителе можно прибавить к плохому растворителю, обычно при поддержании температуры выше примерно 0C, или плохой растворитель можно прибавить к раствору соединения в хорошем растворителе, также обычно при поддержании температуры выше примерно 0C. Примеры хороших растворителей могут включать низшие спирты, такие как метанол, этанол и изопропанол, муравьиную кислоту, уксусную кислоту или ацетон. Примером плохого растворителя является, например, вода. Кристаллизацию предпочтительно проводить при температуре в диапазоне от примерно 0 до примерно 40C. В альтернативном варианте осуществления способа, предлагаемого в настоящем изобретении,твердое аморфное соединение суспендируют при температуре обычно не ниже примерно 0C в растворителе, в котором оно не полностью растворимо, предпочтительно в котором оно лишь умеренно растворимо при этой температуре. Образуется суспензия, в которой диспергированы частицы твердого вещества, и они остаются не полностью растворенными в растворителе. Предпочтительно, если твердые вещества поддерживаются в состоянии суспензии путем смешивания, например путем встряхивания или перемешивания. Температуру суспензии обычно поддерживают равной примерно 0C или выше, чтобы обеспечить превращение исходных твердых веществ в кристаллы. Аморфное твердое соединение, суспендированное в подходящем растворителе, может представлять собой сольват, например гидрат, метанолят, этанолят, ацетат или формиат. Путем сушки сольвата можно получить аморфный порошок. Для стимулирования кристаллизации к раствору предпочтительно прибавить "затравку" кристаллического вещества. В предпочтительном варианте осуществления настоящего изобретения кристаллические формы формулы I, его гидраты или сольваты, его соли и гидраты или сольваты его солей обладают высокой кристалличностью. Кристаллическая форма определяется в настоящем изобретении как обладающая"высокой кристалличностью" или являющаяся "кристаллографически чистой", когда она содержит самое большее примерно 0,5% (мас./мас), например самое большее примерно 0,1% (мас./мас.), другой формы. Так, например, "кристаллографически чистая форма AA" содержит примерно 0,5% (мас./мас.) или менее,например примерно 0,1% (мас./мас.) или менее формы, BB и/или другой кристаллической формы. Что касается содержания аморфной формы, то "кристаллографически чистая" форма содержит менее примерно 5% аморфной формы или количество аморфной формы, меньшее предела обнаружения (т.е. не содержит обнаруживаемое количество) аморфной формы. Приведенные ниже примеры иллюстрируют настоящее изобретение, не ограничивая его объем. Температуры приведены в градусах Цельсия (C). Примеры Пример 1. 2-Метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1 ил)фенил]пропионитрил В подходящий стеклянный лабораторный реактор помещают 45,0 г исходный 2-[4-(8-бром-3-метил 2-оксо-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]-2-метилпропионитрил вместе с 2,25 г бистрифенилфосфинпалладийдихлорида в 445 мл N,N-диметилформамида (ДМФ). Эту смесь нагревают до 95C и затем прибавляют раствор 22,2 г 3-хинолинбороновой кислоты в смеси 225 мл ДМФ, 300 мл H2O и 60 гKHCO3. Эту смесь нагревают в течение 2 ч при 95C. Затем прибавляют 1080 мл H2O. Осаждается продукт,2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрил. Смесь охлаждают в течение 1,5 ч до 0-5C. После перемешивания при этой температуре в течение 2 ч неочищенный продукт отфильтровывают и промывают с помощью 300 мл H2O. Этот продукт сушат в вакууме при 60C в течение 18 ч и получают неочищенный продукт. 40 г этого неочищенного продукта растворяют в 200 мл муравьиной кислоты при 60C. Прибавляют 8 г активированного угля и Smopex 234. Смесь перемешивают при 60C в течение 1 ч, уголь отфильтровывают, остаток промывают с помощью 80 мл муравьиной кислоты и затем 175 мл муравьиной кислоты отгоняют в вакууме. Затем прибавляют 320 мл метанола и смесь кипятят с обратным холодильником в течение 3 ч. Очищенный продукт осаждается из реакционной смеси. Смесь охлаждают до 0-5C в течение 1 ч, затем перемешивают 2 ч при этой температуре и в заключение отфильтровывают и промывают с-8 015677 помощью 80 мл холодного метанола. Эту процедуру перекристаллизации повторяют еще раз. В заключение дважды перекристаллизованное вещество сушат в вакууме при 60C и получают очищенный 2-метил 2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрил. Пример 1a. 5-Бром-2-(2-нитровиниламино)бензойная кислота Суспензию 25 г (16 ммоль) 2-амино-5-бромбензойной кислоты (Fluka, Buchs, Switzerland) в H2OHCl (37%) (10:1) перемешивают в течение 8 ч и затем фильтруют (раствор A). 8,17 г (255 ммоль) нитрометана (Fluka, Buchs, Switzerland) прибавляют в течение 10 мин к охлаждаемой в бане со льдом смеси 35 г льда и 15,3 г (382 ммоль) NaOH. После перемешивания в течение 1 ч при 0C и 1 ч при КТ (комнатная температура) раствор при 0C прибавляют к 28 г льда и 42 мл HCl (37%) (раствор B). Растворы A и B объединяют и реакционную смесь перемешивают в течение 18 ч при КТ. Желтый осадок отфильтровывают, промывают с помощью H2O и сушат в вакууме при 40C и получают искомое соединение. ЭР-МС (масс-спектроскопия с ионизацией элктрораспылением): 287, 289 (M+H)+, Br. 1 29 г (101 ммоль) 5-бром-2-(2-нитровиниламино)бензойной кислоты (пример 1a) и 11,9 г (121 ммоль) ацетата калия в 129 мл (152 ммоль) уксусного ангидрида перемешивают в течение 1,5 ч при 120C. Осадок отфильтровывают и промывают уксусной кислотой, пока фильтрат не станет бесцветным, затем промывают с помощью H2O, сушат в вакууме и получают искомое соединение. ЭР-МС: 269, 271 (M+H)+, Br; аналитическая ВЭЖХ (высокоэффективная жидкостная хроматография): tret=2,70 мин (градиентный режим 1). Пример 1c. 6-Бром-4-хлор-3-нитрохинолин 20 г (74,3 ммоль) 6-бром-3-нитрохинолин-4-ола (пример 1b) в 150 мл (1,63 моль) POCl3 перемешивают в течение 45 мин при 120C. Смесь охлаждают до КТ и медленно выливают в смесь воды со льдом. Осадок отфильтровывают, промывают охлажденной льдом водой и растворяют в CH2Cl2. Органическую фазу промывают холодным рассолом и водную фазу отбрасывают. После сушки над MgSO4 органический растворитель выпаривают досуха и получают искомое соединение. 1 К 15 г (92,5 ммоль) (4-нитрофенил)ацетонитрила (Fluka, Buchs, Switzerland), 1,64 мг (5,09 ммоль) тетрабутиламмонийбромида (Fluka, Buchs, Switzerland) и 43,3 г (305 ммоль) йодметана в 125 мл CH2Cl2 прибавляют 10 г (250 ммоль) NaOH в 125 мл воды. Реакционную смесь перемешивают в течение 20 ч при КТ. Затем органический слой отделяют, сушат над MgSO4 и выпаривают досуха. Остаток растворяют в диэтиловом эфире и обрабатывают древесным углем в течение 30 мин, фильтруют через целит, выпаривают в вакууме и получают искомое соединение в виде бледно-желтого твердого вещества. Аналитическая ВЭЖХ: tret=3,60 мин (градиентный режим 1). 16 г (84,1 ммоль) 2-метил-2-(4-нитрофенил)пропионитрила (пример 1d) и 4,16 г Ni Ренея встряхивают в 160 мл смеси ТГФ (тетрагидрофуран)-MeOH (1:1) при давлении H2, равном 1,1 бар, в течение 12 ч при КТ. После завершения реакции катализатор отфильтровывают и фильтрат выпаривают досуха. Остаток очищают с помощью флэш-хроматографии на силикагеле (гексан-EtOAc от 3:1 до 1:2) и получают искомое соединение в виде масла. ЭР-МС: 161 (M+H)+; аналитическая ВЭЖХ: tret=2,13 мин (градиентный режим 1). Пример 1f. 2-[4-(6-Бром-3-нитрохинолин-4-иламино)фенил]-2-метилпропионитрил 18 г (62,6 ммоль) 6-бром-4-хлор-3-нитрохинолина (пример 1c) и 11 г (68,9 ммоль) 2-(4 аминофенил)-2-метилпропионитрила (пример 1e) растворяют в 350 мл уксусной кислоты и перемешивают в течение 2 ч. Затем прибавляют воду и желтый осадок отфильтровывают и промывают с помощьюH2O. Твердой вещество растворяют в смеси EtOAc-ТГФ (1:1), промывают насыщенным водным раствором NaHCO3 и сушат над MgSO4. Органическую фазу выпаривают досуха и получают искомое соединение в виде желтого твердого вещества. ЭР-МС: 411, 413(M+H)+, Br; аналитическая ВЭЖХ: tret=3,69 мин (градиентный режим 1). Пример 1g. 2-[4-(3-Амино-6-бромхинолин-4-иламино)фенил]-2-метилпропионитрилNi Ренея в течение 1 ч. После завершения реакции катализатор отфильтровывают и фильтрат выпаривают досуха и получают искомое соединение в виде желтого вспененного вещества. ЭР-МС: 381, 383 (M+H)+, Br; аналитическая ВЭЖХ: tret=3,21 мин (градиентный режим 1). Пример 1h. 2-[4-(8-Бром-2-оксо-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]-2-метилпропионитрил(пример 1g) и 1,59 г (15,7 ммоль) триэтиламина в 120 мл CH2Cl2 при 0C в бане со льдом в течение 40 мин прибавляют к раствору 2,85 г (14,4 ммоль) трихлорметилхлорформиата (Fluka, Buchs, Switzerland) в 80 мл CH2Cl2. Реакционную смесь перемешивают в течение 20 мин при этой температуре, затем реакцию останавливают насыщенным водным раствором Na2SO4, перемешивают в течение 5 мин и экстрагируют с помощью CH2Cl2. Органический слой сушат над Na2SO4, фильтруют и выпаривают в вакууме и получают неочищенное искомое соединение в виде коричневатого твердого вещества.(0,847 ммоль) тетрабутиламмонийбромида (Fluka, Buchs, Switzerland) в 170 мл CH2Cl2 прибавляют раствор 508 мг (12,7 ммоль) NaOH (Fluka, Buchs, Switzerland) в 85 мл H2O. Реакционную смесь перемешивают в течение 2 дней и прибавляют 900 мг (6,35 ммоль) йодметана и 254 мг (6,35 ммоль) NaOH в 5 млH2O. Реакционную смесь перемешивают в течение 1 дня при КТ. Затем реакцию останавливают с помощью H2O и экстрагируют с помощью CH2Cl2 (2). Органический слой промывают рассолом, сушат надNa2SO4, фильтруют и выпаривают в вакууме и получают искомое соединение в виде бежевого твердого вещества. ЭР-МС: 421, 423 (M+H)+, Br; аналитическая ВЭЖХ: tret=3,15 мин (градиентный режим 1). Пример 2. 2-Метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрил-п-толуолсульфонат. 26,5 г 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрил вместе с 55 мл муравьиной кислоты помещают в стеклянный реактор. Эту смесь нагревают до 60C и получают прозрачный раствор. Этот раствор фильтруют до получения прозрачного раствора и промывают с помощью 36 мл муравьиной кислоты. Затем муравьиную кислоту отгоняют, пока объем оставшегося раствора не станет равным 55 мл. Затем при 50C прибавляют раствор 11,3 г птолуолсульфоновой кислоты в 228 мл ацетона, а затем в течение 30 мин дополнительно прибавляют 822 мл ацетона. Из реакционной смеси осаждается соль. Смесь охлаждают до 0C в течение 2 ч, перемешивают при этой температуре в течение 3 ч, затем отфильтровывают и промывают с помощью 84 мл ацетона. Продукт сушат при 60C в вакууме в течение 18 ч и получают 29,8 г (82,4%) 2-метил-2-[4-(3 метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрил-птолуолсульфоната (кристаллическая форма A). Кристаллические формы, предлагаемые в настоящем изобретении, синтезируют в соответствии с приведенными ниже примерами, которые являются иллюстративными и не ограничивают объем настоящего изобретения. Пример 3. Получение формы A 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5c]хинолин-1-ил)фенил]пропионитрила. Форму A соединения I можно получить следующим образом: 241 г свободного основания растворяют в 2,4 л уксусной кислоты при 50C. Раствор фильтруют до получения прозрачного раствора, промывают с помощью 250 мл уксусной кислоты и затем при 50C прибавляют 7,2 л воды. Начинает осаждаться свободное основание. Смесь охлаждают в течение 1 ч до 25C, затем фильтруют и промывают с помощью 10 л H2O. Затем свободное основание сушат в вакууме при 50C в течение ночи и получают 204 г свободного основания. Пример 4. Получение формы B 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5c]хинолин-1-ил)фенил]пропионитрила. 0,47 г свободного основания (соединение I) помещают в реактор вместе с 2 мл муравьиной кислоты. Смесь нагревают до 60C и получают прозрачный раствор. Затем прибавляют 5,2 мл метанола. Смесь нагревают при 65C в течение 2 ч. Соединение I начинает осаждаться (при этих условиях муравьиная кислота этерифицируется в соответствующий метиловый эфир). Смесь охлаждают до комнатной температуры и перемешивают при комнатной температуре в течение еще 2 ч. Затем осадок отфильтровывают,промывают с помощью 2 мл метанола и сушат в вакууме при 60C в течение 17 ч и получают форму B соединения I.- 11015677 Пример 5. Получение формы C 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5c]хинолин-1-ил)фенил]пропионитрила. Соединение I переходит в другую полиморфную форму после приведения в равновесие в различных растворителях (эксперимент по диспергированию с использованием примерно 20 мг образца и 0,5 мл растворителя и приведением в равновесие при 25C в течение 24 ч (с перемешиванием. В метаноле, смеси метанол/вода, ДМФ, этаноле, этилацетате и ТГФ можно обнаружить эту новую форму C. Соединение I (0,94 г) прибавляют к 14 мл этанола и нагревают до 62C. Затем прибавляют 3 мл муравьиной кислоты и получают прозрачный раствор. Смесь перемешивают 2 ч при 62C, при этом начинает осаждаться свободное основание. Смесь охлаждают до комнатной температуры, перемешивают при комнатной температуре в течение 2,5 ч и затем отфильтровывают. Затем осадок на фильтре промывают с помощью 5 мл охлажденного льдом этанола и после этого сушат в вакууме при 60C в течение ночи и получают форму C соединения I. Альтернативно, соединение I растворяют в муравьиной кислоте при 60C, фильтруют до получения прозрачного раствора и затем метанол прибавляют. После перемешивания в течение 2 ч при 65C смесь охлаждают до комнатной температуры, соль отфильтровывают и промывают охлажденным льдом метанолом и получают форму C соединения I. Пример 6. Получение формы D 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5c]хинолин-1-ил)фенил]пропионитрила. Соединение I переходит в другую полиморфную форму после приведения в равновесие в различных растворителях (эксперимент по диспергированию с использованием примерно 20 мг образца и 0,5 мл растворителя и приведением в равновесие при 25C в течение 24 ч (с перемешиванием. В изопропаноле в качестве растворителя можно обнаружить эту новую форму D. Пример 7. моногидрата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 Получение формыHA дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Это соединение получают после кристаллизации путем медленного выпаривания растворителя из раствора в ДМФ при комнатной температуре. Пример 8. Получение формыA монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. 2-Метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрил (соединение формулы I) растворяют в муравьиной кислоте при 56C и полученный раствор фильтруют до получения прозрачного раствора. Затем фильтрат концентрируют и в течение 30 мин прибавляют раствор п-толуолсульфоновой кислоты (1,05 экв.) в ацетоне. После прибавления 25% и 50% объема в смесь вносят затравку для стимулирования кристаллизации. Прибавляют дополнительное количество ацетона и суспензию охлаждают до 0C. Закристаллизовавшийся продукт (форма A соединения I монотозилат) собирают центрифугированием и сушат при 60C в вакууме. Пример 9. Получение формыB монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Фазовое превращение формы A, полученной в соответствии с примером 8, в другую кристаллическую форму, далее называемую формой B, можно наблюдать при температуре выше 70C (ее также можно обнаружить при проведении соответствующей ДСК (дифференциальная сканирующая калориметрия. По данным экспериментов с помощью ДСК это превращение обратимо. Форма A и форма B являются энантиомерами. Пример 10. Получение формы HA моногидрата монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Насыщенный раствор соединения I дитозилата в смеси этанол/ацетон (1:1) можно использовать в эксперименте с медленным выпариванием растворителя при 25C. Обнаружено образование монокристаллов моногидрата монотозилата соединения 1 (форма HA) и можно рассчитать структуру монокристалла. Пример 11. Получение формы HB дигидрата монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Путем проведения эксперимента по приведению в равновесие дитозилата соединения I в воде (через 3 дня) при 25C можно наблюдать образование монокристаллов. Можно определить и рассчитанная структура кристалла показала, что он представляет собой дигидрат монотозилата соединения I (форма- 12015677 Пример 12. Получение формы SA сольвата с 2 молекулами муравьиной кислоты монотозилата 2-метил-2-[4-(3 метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Структуру монокристалла соединения I монотозилат сольвата с 2 молекулами муравьиной кислоты определяли с помощью рентгенографии (модификация SA). Подходящие монокристаллы получали путем приведения в равновесие соединения I монотозилат в смеси растворителей ацетон/муравьиная кислота(1:1 (об./об. при 50C после охлаждения до комнатной температуры. Установлено, что эта соль обладает составом 1:1,7 (п-толуолсульфонат соединения I/муравьиная кислота). Хотя установлено, что эта соль обладает составом 1:1,7, поскольку одна молекула сольвата находится в неупорядоченном состоянии,вероятна стехиометрия 1:2. Составы, содержащие меньше 2 молекул муравьиной кислоты, обнаружены по той причине, что молекулы муравьиной кислоты могут выходить из структуры. Пример 13. Получение формыA дитозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Если раствор соединения I в муравьиной кислоте обработать ацетоновым раствором птолуолсульфоновой кислоты (1,25 экв.), то после отфильтровывания монотозилата при кристаллизации маточного раствора в качестве второй порции можно выделить дитозилат соединения I. Дитозилат соединения I характеризуется начальными потерями при сушке, равными 0,4% (при нагревании до 140C). С помощью ДСК обнаруживается плавление примерно при 262C с энтальпией плавления, равной примерно 93 Дж/г. Пример 14. Получение формы HA тригидрата дитозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. В насыщенном растворе дитозилата соединения I в смеси дихлорметан/метанол (1:1 (об./об. можно было обнаружить тригидрат дитозилата соединения I (модификация HA) и обнаружены монокристаллы. Пример 15. Получение аморфного монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Аморфное вещество получали путем распылительной сушки монотозилата соединения I. По данным ДСК температура стеклования, Tg, равна примерно 128C. После перекристаллизации примерно при 175C вещество плавилось примерно при 279C с энтальпией плавления, равной примерно 65 Дж/г. Пример 16. Получение формы SC сольвата с 2 молекулами муравьиной кислоты моногидрата монотозилата 2 метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Структуру монокристалла сольвата с 2 молекулами муравьиной кислоты моногидрата монотозилата соединения I определяли с помощью рентгенографии (модификация SC). Подходящие монокристаллы получали путем приведения в равновесие монотозилата соединения I в смеси растворителей метилизобутилкетон/муравьиная кислота (1:1 (об./об. при 50C после охлаждения до комнатной температуры. Пример 17. Получение формы SB сольвата с 2 молекулами уксусной кислоты монотозилата 2-метил-2-[4-(3 метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила. Структуру монокристалла сольвата с 2 молекулами уксусной кислоты монотозилата соединения I определяли с помощью рентгенографии (модификация SC). Подходящие монокристаллы получали путем приведения в равновесие монотозилата соединения I в смеси растворителей метилизобутилкетон/уксусная кислота (1:1 (об./об. при 50C после охлаждения до комнатной температуры. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма соединения формулы I или гидрата или сольвата соединения формулы I, или соли соединения формулы I, или гидрата или сольвата соли соединения формулы I. 2. Соединение I по п.1 в кристаллической форме A.- 13015677 3. Соединение по п.2, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 8,40,3. 4. Соединение I по п.1 в кристаллической форме B. 5. Соединение по п.3, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 6,90,3. 6. Соединение I по п.1 в кристаллической форме C. 7. Соединение по п.6, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 14,70,3. 8. Соединение I по п.1 в кристаллической форме D. 9. Соединение по п.8, на рентгенограмме которого содержится пик при угле дифракции 2-тэта, равном 23,90,3. 10. Моногидрат соединения I по п.1 в кристаллической форме HA. 11. Соединение по п.10, на рентгенограмме которого содержится пик при угле дифракции 2-тэта,равном 17,60,3. 12. Монотозилат соединения I по п.1 в кристаллической форме. 13. Монотозилат соединения I по п.12 в кристаллической форме A. 14. Соединение по п.12 или 13, на рентгенограмме которого содержится пик при угле дифракции 2 тэта, равном 5,70,3. 15. Соединение по пп.12, 13 или 14, на рентгенограмме которого содержатся пики при углах дифракции 2-тэта, равных 5,40,3; 5,70,3 и 17,20,3. 16. Соединение по п.12 или 13, которое обладает рентгенограммой, в основном такой, как представленная на фиг. 6. 17. Монотозилат соединения I по п.12 в кристаллической форме B. 18. Соединение по п.12 или 17, на рентгенограмме которого содержится пик при угле дифракции 2 тэта, равном 5,80,3. 19. Соединение по пп.12, 17 или 18, на рентгенограмме которого содержатся пики при углах дифракции 2-тэта, равных 5,80,3; 17,80,3 и 18,70,3. 20. Моногидрат монотозилата соединения I по п.1 в кристаллической форме HA. 21. Соединение по п.20, на рентгенограмме которого содержится пик при угле дифракции 2-тэта,равном 6,50,3. 22. Дигидрат монотозилата соединения I по п.1 в кристаллической форме HB. 23. Соединение по п.22, на рентгенограмме которого содержится пик при угле дифракции 2-тэта,равном 6,90,3. 24. Сольват с 2 молекулами муравьиной кислоты монотозилата соединения I по п.1 в кристаллической форме SA. 25. Соединение по п.24, на рентгенограмме которого содержится пик при угле дифракции 2-тэта,равном 5,80,3. 26. Дитозилат соединения I по п.1 в кристаллической форме. 27. Дитозилат соединения I по п.26 в кристаллической форме A. 28. Соединение по п.26 или 27, на рентгенограмме которого содержится пик при угле дифракции 2 тэта, равном 22,40,3. 29. Тригидрат дитозилата соединения I по п.1 в кристаллической форме HA. 30. Соединение по п.29, на рентгенограмме которого содержится пик при угле дифракции 2-тэта,равном 4,70,3. 31. Аморфный монотозилат соединения I по п.1. 32. Моногидрат сольвата с 2 молекулами муравьиной кислоты монотозилата соединения I по п.1 в кристаллической форме SC. 33. Соединение по п.32, на рентгенограмме которого содержится пик при угле дифракции 2-тэта,равном 5,60,3. 34. Сольват с 2 молекулами уксусной кислоты монотозилата соединения I по п.1 в кристаллической форме SB. 35. Соединение по п.34, на рентгенограмме которого содержится пик при угле дифракции 2-тэта,равном 5,70,3. 36. Фармацевтическая композиция, включающая твердую форму соединения формулы I, его гидраты или сольваты, его соли и гидраты или сольваты его солей по любому из пп.1-35 и необязательно по меньшей мере один фармацевтически приемлемый носитель. Фиг. 9 Форма SA сольвата с 2 молекулами муравьиной кислоты монотозилата 2-метил-2-[4-(3-метил-2-оксо-8 хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила- 19015677 Аморфная форма монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5c]хинолин-1-ил)фенил]пропионитрила Фиг. 13 Спектры комбинационного рассеяния аморфной формы монотозилата 2-метил-2-[4-(3-метил-2-оксо-8 хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила Фиг. 14 ИК Фурье-спектры аморфной формы монотозилата 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3 дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила- 20015677 Форма SC сольвата с 2 молекулами муравьиной кислоты моногидрата монотозилата 2-метил-2-[4-(3 метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила Фиг. 16 Форма SB сольвата с 2 молекулами уксусной кислоты монотозилата 2-метил-2-[4-(3-метил-2-оксо-8 хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила
МПК / Метки
МПК: C07D 471/04, A61P 35/00, A61K 31/4745
Метки: кристаллические, формы, 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила, соли
Код ссылки
<a href="https://eas.patents.su/22-15677-soli-i-kristallicheskie-formy-2-metil-2-4-3-metil-2-okso-8-hinolin-3-il-23-digidroimidazo45-chinolin-1-ilfenilpropionitrila.html" rel="bookmark" title="База патентов Евразийского Союза">Соли и кристаллические формы 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]пропионитрила</a>
Предыдущий патент: Композиции и способы ингибирования экспрессии гена pcsk9
Следующий патент: Упругий элемент (варианты), упругодемпфирующий узел
Случайный патент: Способ сгущения и устройство для сгущения жидкости












