Производные пиридина и пиразина в качестве модуляторов протеинкиназы, лекарственное средство и композиция, содержащая их
Номер патента: 23561
Опубликовано: 30.06.2016
Авторы: Куцейко Роберт, Зендцик Мартин, Саттон Джеймс, Линь Сяодун, Пфистер Кейт Б., Сюй Чэн, Цзинь Джефф, Барсанти Пол А., Вань Лифэн, Пань Ю, Киз Роберт
Формула / Реферат
1. Соединение формулы (I)
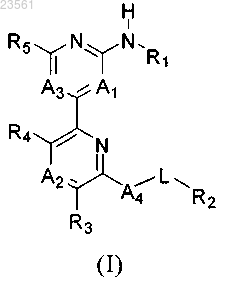
или его фармацевтически приемлемая соль,
в которой A1 обозначает CR6;
А2 обозначает CR7;
А3 обозначает CR8;
А4 обозначает NR9 или О;
L обозначает С1-С4-алкил;
R1 обозначает X-R16;
X обозначает связь или C1-С2-алкил;
R16 выбран из группы, состоящей из С1-С2-алкила, циклопентила, циклогексила, пиперидина, пиперазина, морфолина, пиридина, пирролидина, циклогексенила и тетрагидро-2Н-пирана;
где R16 замещен одной-тремя группами, выбранными из аминогруппы, гидроксигруппы, NHCH2-фенила, СН2-аминогруппы, СОО-трет-бутила, Н, метоксигруппы, NH-SO2-этила, СН2-NHSO2-этила, SO2-этила, метила, СН2-СООН, CO-NHCH3, CON(CH3)2, NHC(CH3)-CH2-SO2-CH3, NH-СОО-СН2-фенила, гидроксиметила, CH2-NH-CH3, СН2-NH-этила, NH-СН2-СН2-метоксигруппы, СН2-NH-CO-CH3, NH-CH2-CH2OH, NH-CO-CH2-N(CH3)2, NH-CO-метилпирролидина, NH-СН2-2-метил-1,3-диоксолана, NH-CO-пиридила, NH-этила, пирролидина, СН2-NH-CO-пиридила, NH-тетрагидропирана, СОСН2-N(СН3)2, NH-СН2-2,2-диметил-1,3-диоксолана, тетрагидропирана, СО-метилпирролидина, СН2-метилпиперидина, NH-CO-СН3, NH-SO2-CH3, NH-СН2-тетрагидрофурана, NH-СН2-оксетана, NH-CH2-диоксана, N(CH3)-CH2CH2-OCH3, СН(ОН)-СН2-аминогруппы, NH-CH2CH2-OCF3, NH-CH2-CH(CF3)-OCH3, F, NH-оксетана, СН2-СН2-ОСН3, СН2-ОСН3, СН2-тетрагидропирана, СН2-метилпиперазина, NH2-CH2-CH(OH)-CF3, пиперидина, СН2-пирролидина, NH-CH(CH3)CH2OCH3, NH-тетрагидрофурана, (CH2)3-NH2, гидроксиэтила, пропила, СН2-пиридила, СН2-пиперидина, морфолина, NH-хлорпиримидина, NH-СН2СН2-SO2-метила, пиперазина,
и СН2-морфолина;
R2 выбран из группы, состоящей из С3-С7-циклоалкила, 5-7-членного гетероциклоалкила, содержащего вплоть до двух гетероатомов, выбранных из N, О и S, и пиридила, где каждая указанная группа R2 содержит 1, 2 или 3 заместителя, независимо выбранных из водорода, цианогруппы, CO-NH2, галогена, метоксигруппы, дигалогенметоксигруппы, тригалогенметоксигруппы, тригалогеналкила, C1-С3-алкила и гидроксигруппы;
R9 обозначает метил, водород или этил;
R4, R5 и R6 все обозначают водород;
R3 и R7 все независимо выбраны из группы, состоящей из водорода и цианогруппы;
R8 выбран из Cl, F и метила;
или соединение, выбранное из группы, состоящей из
транс-N1-бензил-N4-(4-(6-(3-фторбензиламино)пиразин-2-ил)пиридин-2-ил)циклогексан-1,4-диамина,
этил-2-(транс-4-(5'-хлор-6-(3-фторбензиламино)-2,4'-бипиридин-2'-иламино)циклогексиламино)оксазол-4-карбоксилата,
5'-хлор-N2'-(транс-4-(6-хлорпиримидин-4-иламино)циклогексил)-N6-(3-фторбензил)-2,4'-бипиридин-2',6-диамина,
3,5'-дихлор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-N2'-(транс-4-((R)-тетрагидрофуран-2-ил)метил)аминоциклогексил)-2,4'-бипиридин-2',6-диамина,
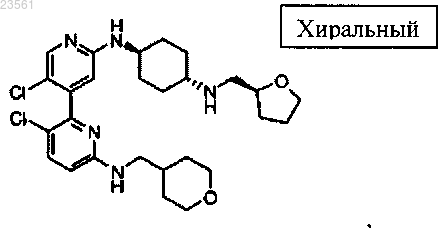
5'-хлор-N6-(дидейтеро-(тетрагидро-2Н-пиран-4-ил)метил)-N2'-(транс-4-(((S)-тетрагидрофуран-2-ил)метил)аминоциклогексил)-2,4'-бипиридин-2',6-диамина,
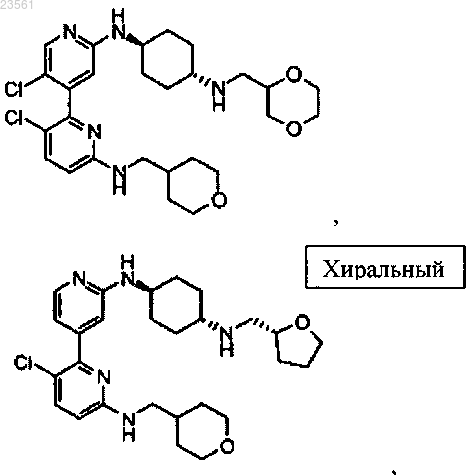
3,5'-дихлор-N2'-(транс-4-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)аминоциклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамина,
5'-хлор-5-фтор-N2'-(транс-4-(оксетан-2-илметиламино)циклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамина,
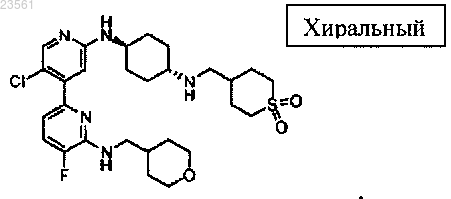
5'-хлор-5-фтор-N2'-(транс-4-((2-метил-1,3-диоксолан-2-ил)метил)аминоциклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамина,
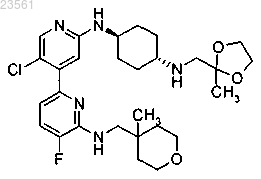
или

2. Соединение по п.1, в котором R8 обозначает Cl.
3. Соединение по п.1 или 2, в котором А4 обозначает NR9.
4. Соединение по пп.1, 2 или 3, в котором А4 обозначает NR9 и R9 обозначает метил, водород или этил.
5. Соединение по п.1, в котором R16 обозначает циклогексил;
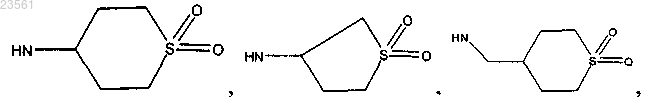
где R16 замещен одной-тремя группами, независимо выбранными из группы, включающей аминогруппу, гидроксигруппу, NHCH2-фенил, СН2-аминогруппу, СОО-трет-бутил, Н, метоксигруппу, NH-SO2-этил, СН2-NHSO2-этил, SO2-этил, метил, СН2-СООН, CO-NHCH3, CON(CH3)2, NHCH2-CH2-SO2-CH3, NH-COO-CH2-фенил, гидроксиметил, CH2-NH-CH3, СН2-NH-этил, NH-СН2-СН2-метоксигруппу, CH2-NH-CO-CH3, NH-CH2-CH2OH, NH-CO-CH2-N(CH3)2, NH-CO-метилпирролидин, NH-CO-пиридил, NH-этил, пирролидин, СН2-NH-СО-пиридил, COCH2-N(CH3)2, тетрагидропиран, СО-метилпирролидин, СН2-метилпиперидин, NH-CO-CH3, NH-SO2-CH3, NH-СН2-тетрагидрофуран, NH-СН2-диоксан, N(CH3)-CH2CH2-OCH3, СН(ОН)-СН2-аминогруппу, NH-CH2CH2-OCF3, NH(CH3)-CH2-OCH3, NH-CH2-CH(CF3)-OCH3, F, NH-оксетан, CH2-CH2-OCH3, CH2-OCH3, СН2-тетрагидропиран, СН2-метилпиперазин, NH2-CH2-CH(OH)-CF3, пиперидин, СН2-пирролидин, NH-CH(CH3)CH2OCH3, NH-тетрагидрофуран, (CH2)3-NH2, гидроксиэтил, пропил, СН2-пиридил, СН2-пиперидин, морфолин, NH-хлорпиримидин, NH-СН2СН2-SO2-метил, пиперазин, СН2-морфолин, NH-СН2-2-метил-1,3-диоксолан, NH-тетрагидропиран, NH-СН2-2,2-диметил-1,3-диоксолан, NH-СН2-оксетан, N(CH3)-CH2CH2-OCH3,
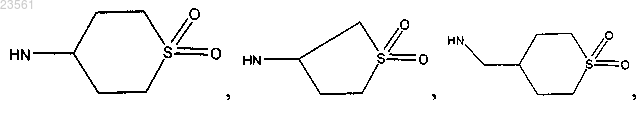
и NH-CH(CH3)-CH2-OH;
R8 обозначает Cl и
R9 выбран из группы, включающей Н, этил и метил.
6. Соединение по п.1, выбранное из группы, включающей
N2'-(транс-4-аминоциклогексил)-5'-хлор-3,5-дифтор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
3,5'-дихлор-N2'-(транс-4-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)аминоциклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
5'-хлор-N6-((тетрагидро-2Н-пиран-4-ил)дидейтерометил)-N2'-(транс-4-(((S)-тетрагидрофуран-2-ил)метил)аминоциклогексил)-2,4'-бипиридин-2',6-диамин;
5'-хлор-5-фтор-N2'-(транс-4-(2-(метилсульфонил)этиламино)циклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
3,5'-дихлор-N2'-(транс-4-((R)-1-метоксипропан-2-иламино)циклогексил)-N6-(((S)-тетрагидро-2Н-пиран-3-ил)метил)-2,4'-бипиридин-2',6-диамин;
3,5'-дихлор-N2'-(транс-4-((R)-1-метоксипропан-2-иламино)циклогексил)-N6-(((R)-тетрагидро-2Н-пиран-3-ил)метил)-2,4'-бипиридин-2',6-диамин;
4-((5'-хлор-2'-(транс-4-((R)-1-метоксипропан-2-иламино)циклогексиламино)-2,4'-бипиридин-6-иламино)метил)тетрагидро-2Н-пиран-4-карбонитрил;
N2'-(транс-4-аминоциклогексил)-3-хлор-5'-фтор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
5'-хлор-N6-(3-фторбензил)-N2'-((1R,3S)-3-((метиламино)метил)циклопентил)-2,4'-бипиридин-2',6-диамин;
3,5'-дихлор-N2'-(транс-4-((R)-1-метоксипропан-2-иламино)циклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
5'-хлор-3-фтор-N2'-(транс-4-((R)-1-метоксипропан-2-иламино)циклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
5'-хлор-5-фтор-N2'-(транс-4-((R)-1-метоксипропан-2-иламино)циклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
5'-хлор-N6-((2,2-диметилтетрагидро-2Н-пиран-4-ил)метил)-N2'-(транс-4-((R)-1-метоксипропан-2-иламино)циклогексил)-2,4'-бипиридин-2',6-диамин;
5'-хлор-N6-(((S)-2,2-диметилтетрагидро-2Н-пиран-4-ил)метил)-N2'-(транс-4-((R)-1-метоксипропан-2-иламино)циклогексил)-2,4'-бипиридин-2',6-диамин;
5'-хлор-5-фтор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-N2'-(транс-4-((1,1-диоксотетрагидро-2Н-тиопиран-4-ил)метил)аминоциклогексил)-2,4'-бипиридин-2',6-диамин;
5'-хлор-5-фтор-N2'-(транс-4-(2-метоксиэтиламино)циклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-5'-хлор-N6-((5-фторпиридин-3-ил)метил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-3,5'-дихлор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-3,5'-дихлор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
3,5'-дихлор-N2'-(транс-4-(2-метоксиэтиламино)циклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
2-(транс-4-(3,5'-дихлор-6-((тетрагидро-2Н-пиран-4-ил)метил)амино-2,4'-бипиридин-2'-иламино)циклогексиламино)этанол;
транс-N1-(5-хлор-4-(6-(((R)-тетрагидро-2Н-пиран-3-ил)метил)аминопиразин-2-ил)пиридин-2-ил)циклогексан-1,4-диамин;
3,5'-дихлор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-N2'-(транс-4-(((R)-тетрагидрофуран-2-ил)метил)аминоциклогексил)-2,4'-бипиридин-2',6-диамин;
3,5'-дихлор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-N2'-(транс-4-(((S)-тетрагидрофуран-2-ил)метил)аминоциклогексил)-2,4'-бипиридин-2',6-диамин;
3,5'-дихлор-N2'-(транс-4-((2-метоксиэтил)(метил)амино)циклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
5'-хлор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-N2'-(транс-4-(((R)-тетрагидрофуран-2-ил)метил)аминоциклогексил)-2,4'-бипиридин-2',6-диамин;
5'-хлор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-N2'-(транс-4-(((S)-тетрагидрофуран-2-ил)метил)аминоциклогексил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-5'-хлор-3-фтор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
5'-хлор-3-фтор-N2'-(транс-4-(2-метоксиэтиламино)циклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-3-бром-5'-хлор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
3-бром-5'-хлор-N2'-(транс-4-(2-метоксиэтиламино)циклогексил)-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
транс-4-(3,5'-дихлор-6-((2,2-диметилтетрагидро-2Н-пиран-4-ил)метил)амино-2,4'-бипиридин-2'-иламино)циклогексанол;
(2S)-3-(транс-4-(3,5'-дихлор-6-((2,2-диметилтетрагидро-2Н-пиран-4-ил)метил)амино-2,4'-бипиридин-2'-иламино)циклогексиламино)-1,1,1-трифторпропан-2-ол;
(2R)-3-(транс-4-(3,5'-дихлор-6-((2,2-диметилтетрагидро-2Н-пиран-4-ил)метил)амино-2,4'-бипиридин-2'-иламино)циклогексиламино)-1,1,1-трифторпропан-2-ол;
3,5'-дихлор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-N2'-(транс-4-(2-(трифторметокси)этиламино)циклогексил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-5'-хлор-N6-(((R)-2,2-диметилтетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-5'-хлор-N6-(((S)-2,2-диметилтетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-3,5,5'-трихлор-N6-((тетрагидро-2H-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-5'-хлор-5-фтор-N6-((тетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-5'-хлор-N6-((4-метилтетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-5'-хлор-5-фтор-N6-((4-метилтетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-5'-хлор-N6-((4-фтортетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
N2'-(транс-4-аминоциклогексил)-5'-хлор-N6-(((2R,6S)-2,6-диметилтетрагидро-2Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6-диамин;
((5'-хлор-5-фтор-2'-(транс-4-(2-метоксиэтиламино)циклогексиламино)-2,4'-бипиридин-6-иламино)метил)тетрагидро-2Н-пиран-4-карбонитрил;
((2'-(транс-4-аминоциклогексиламино)-5'-хлор-5-фтор-2,4'-бипиридин-6-иламино)метил)тетрагидро-2Н-пиран-4-карбонитрил;
((5'-хлор-5-фтор-2'-(транс-4-(пропиламино)циклогексиламино)-2,4'-бипиридин-6-иламино)метил)тетрагидро-2Н-пиран-4-карбонитрил;
((5'-хлор-2'-(транс-4-(дипропиламино)циклогексиламино)-5-фтор-2,4'-бипиридин-6-иламино)метил)тетрагидро-2Н-пиран-4-карбонитрил;
((5'-хлор-5-фтор-2'-(транс-4-((R)-1-метоксипропан-2-иламино)циклогексиламино)-2,4'-бипиридин-6-иламино)метил)тетрагидро-2Н-пиран-4-карбонитрил;
((5'-хлор-2'-(транс-4-((2-метил-1,3-диоксолан-2-ил)метил)аминоциклогексиламино)-2,4'-бипиридин-6-иламино)метил)тетрагидро-2Н-пиран-4-карбонитрил;
(4-((5'-хлор-2'-(транс-4-((R)-1-метоксипропан-2-иламино)циклогексиламино)-2,4'-бипиридин-6-иламино)метил)тетрагидро-2Н-пиран-4-ил)метанол и
5'-хлор-5-фтор-N1-((4-метилтетрагидро-2Н-пиран-4-ил)метил)-N2'-(транс-4-(1,1-диоксотетрагидротиофен-3-иламино)циклогексил)-2,4'-бипиридин-2',6-диамин.
7. Соединение по п.1, выбранное из группы, включающей
транс-N1-(4-(3-хлор-6-((тетрагидро-2Н-пиран-4-ил)метил)аминопиразин-2-ил)пиридин-2-ил)циклогексан-1,4-диамин;
транс-N1-(5-хлор-4-(3-хлор-6-((тетрагидро-2Н-пиран-4-ил)метил)аминопиразин-2-ил)пиридин-2-ил)циклогексан-1,4-диамин;
транс-4-(5-хлор-4-(5-хлор-6-((тетрагидро-2Н-пиран-4-ил)метил)аминопиразин-2-ил)пиридин-2-иламино)циклогексанол;
транс-N1-(5-хлор-4-(5-хлор-6-((тетрагидро-2Н-пиран-4-ил)метил)аминопиразин-2-ил)пиридин-2-ил)циклогексан-1,4-диамин;
транс-4-(5-хлор-4-(6-(((S)-тетрагидро-2Н-пиран-3-ил)метил)аминопиразин-2-ил)пиридин-2-иламино)циклогексанол;
транс-4-(5-хлор-4-(6-(((R)-тетрагидро-2Н-пиран-3-ил)метил)аминопиразин-2-ил)пиридин-2-иламино)циклогексанол;
транс-N1-(5-хлор-4-(6-(((S)-тетрагидро-2Н-пиран-3-ил)метил)аминопиразин-2-ил)пиридин-2-ил)циклогексан-1,4-диамин;
транс-N1-(5-хлор-4-(6-(((R)-тетрагидро-2Н-пиран-3-ил)метил)аминопиразин-2-ил)пиридин-2-ил)циклогексан-1,4-диамин;
транс-N1-(5-хлор-4-(6-(метил((тетрагидро-2Н-пиран-4-ил)метил)амино)пиразин-2-ил)пиридин-2-ил)циклогексан-1,4-диамин;
транс-N1-(5-хлор-4-(6-((тетрагидро-2Н-пиран-4-ил)метил)аминопиразин-2-ил)пиридин-2-ил)-N4-(2-метоксиэтил)циклогексан-1,4-диамин;
транс-4-(5-хлор-4-(6-((тетрагидро-2Н-пиран-3-ил)метил)аминопиразин-2-ил)пиридин-2-иламино)циклогексанол и
транс-4-(5-хлор-4-(6-((тетрагидро-2Н-пиран-4-ил)метил)аминопиразин-2-ил)пиридин-2-иламино)циклогексанол.
8. Лекарственное средство для лечения рака, гипертрофии сердца, ВИЧ или воспалительного заболевания у субъекта, содержащее соединение по любому из пп.1, 6 или 7 или его фармацевтически приемлемую соль или сольват.
9. Фармацевтическая композиция для лечения заболевания или патологического состояния, опосредуемого с помощью CDK9, содержащая соединение по любому из пп.1, 6 или 7 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, разбавитель или инертный наполнитель.
10. Соединение по п.1, выбранное из группы, состоящей из
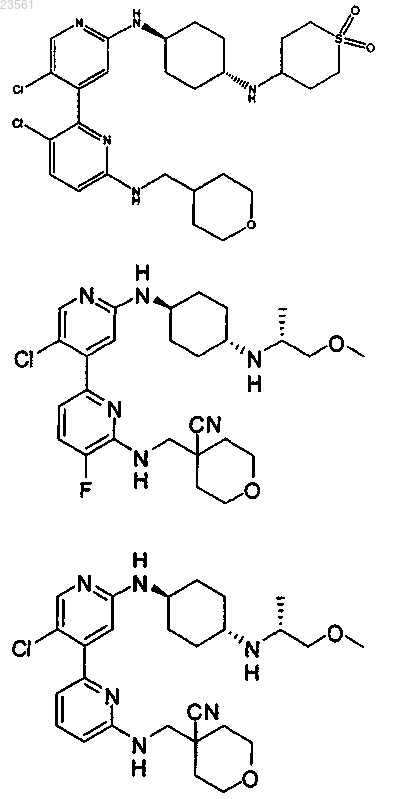
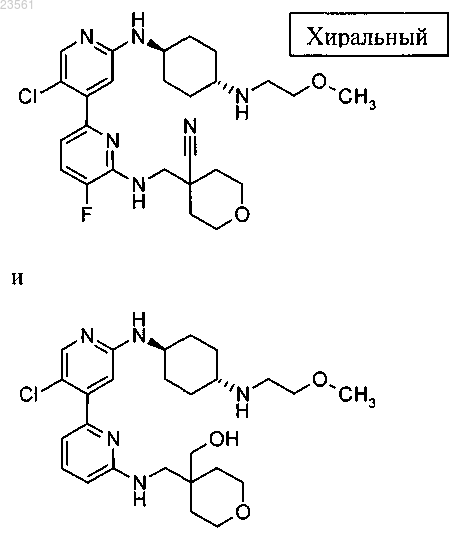
или его фармацевтически приемлемой соли.
Текст
В изобретении описаны соединение формулы (I) и его фармацевтически приемлемые соли, где все заместители раскрыты в формуле изобретения. В изобретении также описано лекарственное средство и фармацевтическая композиция для лечения заболевания или патологического состояния, опосредуемого с помощью CDK9. Уровень техники По настоящей заявке испрашивается приоритет по предварительной заявке U.S.61/273154, поданной 30 июля 2009 г., и по предварительной заявке U.S.61/357720, поданной 23 июня 2010 г., содержание которых во всей их полноте включено в настоящее изобретение в качестве ссылки. В последние годы поиску новых терапевтических средств значительно способствовало лучшее изучение структуры ферментов и других биомолекул, связанных с заболеваниями. Одним важным классом ферментов, оказавшимся объектом многочисленных исследований, являются протеинкиназы. Протеинкиназы представляют собой большую группу структурно родственных ферментов, которые обеспечивают регулирование различных процессов передачи сигналов в клетке (Hardie, G. and Hanks, S.The Protein Kinase Facts Book, I and II, Academic Press, San Diego, Calif. 1995). Ввиду сохранения их структуры и каталитического действия предполагается, что протеинкиназы образовались из общего анцестрального гена. Почти все киназы включают сходный, содержащий 250-300 аминокислот каталитический домен. Киназы можно разделить на группы в соответствии с субстратами, которых они фосфорилируют (например, протенитирозин, протеинсерин/треонин, липиды и т.п.). Идентифицированы группы последовательностей, которые обычно соответствуют каждой из этих групп киназ (см., например, Hanks,S.K., Hunter, Т., FASEB J. 1995, 9, 576-596; Knighton et al., Science 1991, 253, 407-414; Hiles et al., Cell 1992, 70, 419-429; Kunz et al., Cell 1993, 73, 585-596; Garcia-Bustos et al., EMBO J. 1994, 13, 2352-2361). Многие заболевания связаны с аномальными ответами клеток, вызванными опосредуемыми протеинкиназой проявлениями, описанными выше. Эти заболевания включают, но не ограничиваются только ими, аутоиммунные заболевания, воспалительные заболевания, заболевания кости, метаболические заболевания, неврологические и нейродегенеративные заболевания, рак, сердечно-сосудистые заболевания,аллергии и астму, болезнь Альцгеймера и связанные с гормонами заболевания. В связи с этим в медицинской химии предпринимались значительные усилия по поиску ингибиторов протеинкиназы, которые эффективны в качестве лекарственных средств. Комплексы циклин-зависимой киназы (CDK) являются классом киназ, представляющим интерес. Эти комплексы включают, по меньшей мере, каталитическую (сама CDK) и регуляторную (циклин) субъединицы. Некоторые из комплексов, наиболее важных для регуляции клеточного цикла, включают циклин A (CDK1, также обозначаемый, как cdc2 и CDK2), циклин В 1-В 3 (CDK1) и циклин D1-D3(CDK2, CDK4, CDK5, CDK6), циклин Е (CDK2). Каждый из этих комплексов участвует в конкретной фазе клеточного цикла. Кроме того, CDK 7, 8 и 9 участвуют в регуляции транскрипции. Активность CDK регулируется после трансляции с помощью временных ассоциаций с другими белками и с помощью изменения их положения в клетке. Развитие опухоли тесно связано с генетическим изменением и нарушением регуляции CDK и их регуляторов и это показывает, что ингибиторы CDK могут быть полезными противораковыми лекарственными средствами. И действительно, полученные ранее результаты показывают, что изменившиеся и нормальные клетки различаются по их потребности, например, в циклине A/CDK2, и что можно разработать новые противоопухолевые средства, не проявляющие обычной токсичности по отношению к реципиенту, наблюдающейся у обычных цитотоксичных и цитостатических лекарственных средств. Хотя ингибирование связанных с клеточным циклом CDK прямо относится, например, к применению в онкологии, ингибирование CDK, регулирующих РНКполимеразу, также может относиться к раку. Показано, что CDK участвуют в протекании клеточного цикла и клеточной транскрипции и прекращение регулирования роста связано с аномальной пролиферацией клеток при заболевании (см., например, Malumbres and Barbacid, Nat. Rev. Cancer 2001, 1:222). Показано, что повышенная активность или временная аномальная активация циклин-зависимых киназ приводит к развитию опухолей у людей(Sherr С.J., Science 1996, 274: 1672-1677). И действительно, развитие опухолей у людей обычно связывают с изменениями или самих белков CDK, или их регуляторов (Cordon-Cardo С., Am. J. Pat 1/701. 1995; 147: 545-560; Karp J.E. and Broder S., Nat. Med. 1995; 1: 309-320; Hall M. et al., Adv. Cancer Res. 1996; 68: 67-108). Природные белки, являющиеся ингибиторами CDK, такие как р 16 и р 27, подавляют рост линий клеток рака легких in vitro (Kamb A., Curr. Top. Microbiol. Immunol. 1998; 227: 139-148).CDK 7 и 9, видимо, играют ключевую роль в инициировании транскрипции и элонгации соответственно (см., например, Peterlin and Price. Cell 23: 297-305, 2006, Shapiro. J. Clin. Oncol. 24: 1770-83, 2006). Ингибирование CDK9 было связано с прямым индуцированием апоптоза опухолевых клеток гематопоэтической группы путем понижающей регуляции транскрипции антиапоптических белков, таких какet al. Cancer Res. 2005; 65:5399 и Alvi et al. Blood 2005; 105: 4484). Для клеток солидных опухолей ингибирование транскрипции путем понижающей регуляцииактивности CDK9 обнаруживает синергизм с ингибированием клеточного цикла посредством CDK, например CDK1 и 2, и индуцирует апоптоз (Cai,D.-P., Cancer Res 2006, 66: 9270. Ингибирование транскрипции с помощью CDK9 или CDK7 может привести к селективной уничтожающей активности в типах опухолевых клеток, которые зависят от транскрипции мРНК при небольших временах полужизни, например, циклина D1 при лимфоме клеток ман-1 023561 тии. Некоторые факторы транскрипции, такие как Мус и NF-kB, осуществляют селективный рекрутингCDK9 к их промоторам, и опухоли, зависимые от активации этих путей передачи сигнала, могут быть чувствительны к ингибированию CDK9. Малые молекулы-ингибиторы CDK также можно использовать для лечения сердечно-сосудистых нарушений, таких как рестеноз и атеросклероз, и других сосудистых нарушений, которые обусловлены аберрантной пролиферацией клеток. Пролиферация гладких мышц сосудов и гиперплазия интимы после баллонной ангиопластики подавляются путем сверхэкспрессирования белка - ингибитора циклинзависимой киназы. Кроме того, пуриновый ингибитор CDK2 - CVT-313 (Ki=95 нМ) приводит к превышающему 80% подавлению образования неоинтимы у крыс. Ингибиторы CDK можно использовать для лечения заболеваний, вызванных различными возбудителями инфекции, включая грибы, простейшие паразиты, такие как Plasmodium falciparum, и ДНК и РНК вирусы. Например, циклин-зависимые киназы необходимы для репликации вирусов после инфицирования вирусом простого герпеса (ВПГ) (Schang L.M. et al., J. Virol. 1998; 72: 5626) и известно, что гомологиCDK играют важную роль в дрожжевых грибках. Ингибирование функции CDK9/циклин Т недавно было связано с предупреждением репликации ВИЧ (вирус иммунодефицита человека) и обнаружение новых биологических характеристик CDK продолжает способствовать появлению новых терапевтических показаний для ингибиторов CDK (Sausville,E.A. Trends Molec. Med. 2002, 8, S32-S37).CDK важны для опосредуемого нейтрофилами воспаления и по данным экспериментальных моделей на животных ингибиторы CDK способствуют устранению воспаления (Rossi, A.G. et al., Nature Med. 2006, 12: 1056). Таким образом, ингибиторы CDK, включая ингибиторы CDK9, могут действовать, как противовоспалительные средства. Селективные ингибиторы CDK можно использовать для облегчения различных аутоиммунных нарушений. Хроническое воспалительное заболевание - ревматоидный артрит - характеризуется гиперплазией синовиальной ткани; подавление пролиферации синовиальной ткани должно свести воспаление к минимуму и предупредить разрушение сустава. По данным исследования артрита с помощью модели на крысах опухание сустава было в значительной степени подавлено путем лечения аденовирусом, экспрессирующим ингибитор CDK - белок р 16. Ингибиторы CDK эффективны для борьбы с другими нарушениями пролиферации клеток, включая псориаз (характеризующийся гиперпролиферацией кератоцитов),гломерулонефрит, хроническое воспаление и обыкновенную волчанку. Некоторые ингибиторы CDK применимы в качестве защитных химиотерапевтических средств вследствие их способности подавлять прогрессирование клеточного цикла нормальных не подвергшихся изменениям клеток (Chen, et al. J. Natl. Cancer Institute, 2000; 92: 1999-2008). Предварительное лечение пациента, страдающего раком, с помощью ингибитора CDK до использования цитотоксических средств может ослабить побочные эффекты, обычно связанные с химиотерапией. Нормально пролиферирующие ткани защищают от цитотоксических воздействий с помощью селективного ингибитора CDK. В соответствии с этим необходимы новые ингибиторы протеинкиназ, таких как CDK1, CDK2,CDK4, CDK5, CDK6, CDK7, CDK8 и CDK9, а также их комбинаций. Краткое изложение сущности изобретения Необходимы новые средства и методики лечения нарушений, связанных с протеинкиназой. Также необходимы новые соединения, применимые для устранения, предупреждения или облегчения одного или большего количества симптомов рака, воспаления, гипертрофии сердца и ВИЧ. Кроме того, необходимы способы модулирования активности протеинкиназ, таких как CDK1, CDK2, CDK3, CDK4, CDK5,CDK6, CDK7, CDK8 и CDK9 и их комбинации, с использованием соединений, предлагаемых в настоящем изобретении. Одним объектом настоящего изобретения является соединение формулы (I) или его фармацевтически приемлемая соль,в которой A1 обозначает CR6; А 2 обозначает CR7; А 3 обозначает CR8; А 4 обозначает NR9 или О;X обозначает связь или С 1-С 2-алкил;R2 выбран из группы, состоящей из С 3-С 7-циклоалкила, 5-7-членного гетероциклоалкила, содержащего вплоть до двух гетероатомов, выбранных из N, О и S, и пиридила, где каждая указанная группа R2 содержит 1, 2 или 3 заместителя, независимо выбранных из водорода, цианогруппы, CO-NH2, галогена,метоксигруппы, дигалогенметоксигруппы, тригалогенметоксигруппы, тригалогеналкила, C1-С 3-алкила и гидроксигруппы;R3 и R7 все независимо выбраны из группы, состоящей из водорода и цианогруппы; Особенно предпочтительный вариант осуществления настоящего изобретения относится к соединению формулы (I), выбранному из группы, включающей Еще один предпочтительный вариант осуществления настоящего изобретения относится к соединению формулы I, выбранному из группы, включающей Другим объектом настоящего изобретения является соединение формулы (I) или его фармацевтически приемлемая соль или сольват, предназначенное для применения в способе лечения заболевания или патологического состояния, опосредуемого CDK9. Еще одним объектом настоящего изобретения является способ лечения заболевания или патологического состояния, опосредуемого CDK9, включающий введение нуждающемуся в нем субъекту соединения формулы (I) или его фармацевтически приемлемой соли в терапевтически эффективном количестве. Еще одним объектом настоящего изобретения является соединение формулы (I), предназначенное для применения в способе лечения заболевания или патологического состояния, опосредуемого CDK9, выбранного из группы, включающей рак, гипертрофию сердца, ВИЧ и воспалительные заболевания. Другим объектом настоящего изобретения является способ лечения рака, выбранного из группы,включающей рак мочевого пузыря, головы и шеи, молочной железы, желудка, яичников, толстой кишки,легких, головного мозга, гортани, лимфатической системы, гематопоэтической системы, мочеполового тракта, желудочно-кишечного тракта, яичников, предстательной железы, желудка, кости, мелкоклеточный рак легких, глиому, колоректальный рак и рак поджелудочной железы. Еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, разбавитель или инертный наполнитель. Другим объектом настоящего изобретения является способ регулирования, модулирования или ингибирования активности протеинкиназы, который включает взаимодействие протеинкиназы с соединением, предлагаемым в настоящем изобретении. В одном варианте осуществления протеинкиназа выбрана из группы, включающей CDK1, CDK2, CDK3, CDK4, CDK5, CDK6, CDK7, CDK8 и CDK9 и любую их комбинацию. В другом варианте осуществления протеинкиназа выбрана из группы, включающей CDK1,CDK2 и CDK9 и любую их комбинацию. В еще одном варианте осуществления протеинкиназа находится в культуре клеток. В еще одном варианте осуществления протеинкиназа находится в млекопитающем. Другим объектом настоящего изобретения является способ лечения нарушения, связанного с протеинкиназой, включающий введение нуждающемуся в нем субъекту соединения, предлагаемого в настоящем изобретении, в фармацевтически приемлемом количестве, так что подвергается лечению нарушение, связанное с протеинкиназой. В одном варианте осуществления протеинкиназа выбрана из группы, включающей CDK1, CDK2, CDK3, CDK4, CDK5, CDK6, CDK7, CDK8 и CDK9. В одном варианте осуществления нарушение, связанное с протеинкиназой, представляет собой рак. В еще одном варианте осуществления рак выбран из группы, включающей рак мочевого пузыря, головы и шеи, молочной железы, желудка, яичников, толстой кишки, легких, головного мозга, гортани, лимфатической системы, гематопоэтической системы, мочеполового тракта, желудочно-кишечного тракта,яичников, предстательной железы, желудка, кости, мелкоклеточный рак легких, глиому, колоректальный рак и рак поджелудочной железы. В одном варианте осуществления нарушение, связанное с протеинкиназой, представляет собой воспаление. В другом варианте осуществления воспаление связано с ревматоидным артритом, обыкновенной волчанкой, диабетом типа 1, диабетической нефропатией, рассеянным склерозом, гломерулонефритом, хроническим воспалением и отторжениями трансплантатов органов. В другом варианте осуществления нарушение, связанное с протеинкиназой, представляет собой вирусную инфекцию. В одном варианте осуществления вирусная инфекция связана с вирусом ВИЧ, вирусом папилломы человека, вирусом герпеса, поксвирусом, вирусом Эпштейн-Барра, вирусом Sindbis или аденовирусом. В еще одном варианте осуществления нарушение, связанное с протеинкиназой, представляет собой гипертрофию сердца. Другим объектом настоящего изобретения является способ лечения рака, который включает введение нуждающемуся в нем субъекту соединения, предлагаемого в настоящем изобретении, в фармацевтически приемлемом количестве, так что подвергается лечению рак. В одном варианте осуществления рак выбран из группы, включающей рак мочевого пузыря, головы и шеи, молочной железы, желудка, яичников, толстой кишки, легких, головного мозга, гортани, лимфатической системы, гематопоэтической системы, мочеполового тракта, желудочно-кишечного тракта, яичников, предстательной железы, желудка,кости, мелкоклеточный рак легких, глиому, колоректальный рак и рак поджелудочной железы. Другим объектом настоящего изобретения является способ лечения воспаления, включающий введение нуждающемуся в нем субъекту соединения в фармацевтически приемлемом количестве, так что воспаление подвергается лечению, в котором соединением является соединение, предлагаемое в настоящем изобретении. В одном варианте осуществления воспаление связано с ревматоидным артритом,обыкновенной волчанкой, диабетом типа 1, диабетической нефропатией, рассеянным склерозом, гломерулонефритом, хроническим воспалением или отторжениями трансплантатов органов. Другим объектом настоящего изобретения является способ лечения гипертрофии сердца, включающий введение нуждающемуся в нем субъекту соединения в фармацевтически приемлемом количестве, так что гипертрофия сердца подвергается лечению, в котором соединением является соединение,предлагаемое в настоящем изобретении. Другим объектом настоящего изобретения является способ лечения вирусной инфекции, включающий введение нуждающемуся в нем субъекту соединения в фармацевтически приемлемом количестве,так что вирусная инфекция подвергается лечению, в котором соединением является соединение, предлагаемое в настоящем изобретении. В одном варианте осуществления вирусная инфекция связана с вирусом ВИЧ, вирусом папилломы человека, вирусом герпеса, поксвирусом, вирусом Эпштейна-Барра, вирусом Sindbis или аденовирусом. В одном варианте осуществления субъектом, подвергающимся лечению соединениями, предлагаемыми в настоящем изобретении, является млекопитающее. В другом варианте осуществления млекопитающим является человек. В другом объекте настоящего изобретения соединения, предлагаемые в настоящем изобретении,вводят одновременно или последовательно с противовоспалительным, антипролиферативным, химиотерапевтическим средством, иммунодепрессантом, противораковым, цитотоксическим средством или ингибитором киназы или его солью. В одном варианте осуществления соединение или его соль вводят одновременно или последовательно с одним или большим количеством следующих средств: ингибиторPTK, циклоспорин А, CTLA4-Ig, антитела, выбранные из группы, включающей антитела к ICAM-3, к рецептору IL-2, к CD45RB, к CD2, к CD3, к CD4, к CD80, к CD86 и моноклональные антитела OKT3,CVT-313, средства, блокирующие взаимодействие между CD40 и gp39, белки слияния, образованные изCD40 и gp39, ингибиторы NF-каппа В функции, нестероидные противовоспалительные лекарственные средства, стероиды, соединения золота, FK506, микофенолят мотефил, цитотоксические лекарственные средства, ингибиторы TNF-, антитела к TNF или растворимому рецептору TNF, рапамицин, лефлунимид, ингибиторы циклооксигеназы-2, паклитаксел, цисплатин, карбоплатин, доксорубицин, карминомицин, даунорубицин, аминоптерин, метотрексат, метоптерин, митомицин С, эктеинасцидин 743, порфиромицин, 5-фторурацил, 6-меркаптопурин, гемцитабин, цитозинарабинозид, подофиллотоксин, этопозид,этопозидфосфат, тенипозид, мелфалан, винбластин, винкристин, лейрозидин, эпотилон, виндезин, лейро-9 023561 зин или их производные. Другим объектом настоящего изобретения является упакованное средство для лечения нарушения,связанного с протеинкиназой, включающее модулирующее протеинкиназу соединения формулы (I) или формулы II, упакованное вместе с инструкциями по применению эффективного количества модулирующего протеинкиназу соединения, предназначенного для лечения нарушения, связанного с протеинкиназой. В некоторых вариантах осуществления соединение, предлагаемое в настоящем изобретении, также характеризуется как модулятор протеинкиназы, включая, но не ограничиваясь только ими, протеинкиназы, выбранные из группы, включающей abl, ATK, Bcr-abl, Blk, Brk, Btk, c-fms, e-kit, c-met, c-src, CDK,cRafl, CSFIR, CSK, EGFR, ErbB2, ErbB3, ErbB4, ERK, Fak, fes, FGFRI, FGFR2, FGFR3, FGFR4, FGFR5,Fgr, FLK-4, flt-1, Fps, Frk, Fyn, GSK, Gst-Flkl, Hck, Her-2, Her-4, IGF-1R, INS-R, Jak, JNK, KDR, Lck, Lyn,MEK, p38, panHER, PDGFR, PLK, PKC, PYK2, Raf, Rho, ros, SRC, TRK, TYK2, UL97, VEGFR, Yes,Zap70, Aurora-A, GSK3-альфа, HIPK1, HIPK2, HIP3, IRAKI, JNK1, JNK2, JNK3, TRKB, CAMKII, CK1,CK2, RAF, GSK3Beta, MAPK1, MKK4, MKK7, MST2, NEK2, AAK1, PKCalpha, PKD, RIPK2 и ROCK-II (я полагаю, что следует расмотреть, стоит ли включать такой большой перечень. Может быть, ограничиться теми, которые выявлены при расширенном исследовании клеток с использованием планшетов). В предпочтительном варианте осуществления протеинкиназа выбрана из группы, включающейCDK1, CDK2, CDK3, CDK4, CDK5, CDK6, CDK7, CDK8 и CDK9 и любую их комбинацию, а также любую другую CDK, а также любую пока еще не идентифицированную CDK. В особенно предпочтительном варианте осуществления протеинкиназа выбрана из группы, включающей CDK1, CDK2 и CDK9. В особенно предпочтительном варианте осуществления протеинкиназа представляет собой CDK9. В предпочтительном варианте осуществления представляющие интерес комбинации CDK включают CDK4 и CDK9; CDK1, CDK2 и CDK9; CDK9 и CDK7; CDK9 и CDK1; CDK9 и CDK2; CDK4, CDK6 иCDK9; CDK1, CDK2, CDK3, CDK4, CDK6 и CDK9. В других вариантах осуществления соединения, предлагаемые в настоящем изобретении, применяют для лечения нарушений, связанных с протеинкиназой. При использовании в настоящем изобретении,термин "нарушение, связанное с протеинкиназой" включает нарушения и состояния (например, патологические состояние), которые связаны с активностью протеинкиназы, например, CDK4, например CDK1,CDK2 и/или CDK9. Неограничивающие примеры нарушений, связанных с протеинкиназой, включают аномальную пролиферацию клеток (включая связанный с протеинкиназой рак), вирусные инфекции, аутоиммунные заболевания и нейродегенеративные нарушения. Неограничивающие примеры нарушений, связанных с протеинкиназой, включают пролиферативные заболевания, такие как вирусные инфекции, аутоиммунные заболевания, грибковое заболевание,рак, псориаз, пролиферация клеток гладких мышц сосудов, связанная с атеросклерозом, фиброз легких,артрит, гломерулонефрит, хроническое воспаление, нейродегенеративные нарушения, такие как болезнь Альцгеймера, и послеоперационный стеноз и рестеноз. Связанные с протеинкиназой заболевания также включают заболевания, связанные с аномальной пролиферацией клеток, включая, но не ограничиваясь только ими, раковые заболевания молочной железы, яичников, шейки матки, предстательной железы,яичка, пищевода, желудка, кожи, легких, кости, ободочной кишки, поджелудочной железы, щитовидной железы, желчных протоков, полости рта и глотки (рта), губы, языка, рта, глотки, тонкой кишки, ободочной кишки-прямой кишки, толстой кишки, прямой кишки, головного мозга и центральной нервной системы, глиобластому, нейрообластому, кератоакантому, эпидермоидную карциному, крупноклеточную карциному, аденокарциному, аденокарциному, аденому, аденокарциному, фолликулярную карциному,недифференцированную карциному, папиллярную карциному, семиному, меланому, саркому, карциному мочевого пузыря, карциному печени, карциному почки, миелоидные нарушения, лимфоидные нарушения, ходжкинскую лимфому, волосатоклеточную лимфому и лейкоз. Дополнительные неограничивающие примеры связанных с протеинкиназой типов рака включают карциномы, гематопоэтические опухоли лимфоидного происхождения, гематопоэтические опухоли миелоидного происхождения, опухоли мезенхимального происхождения, опухоли центральной и периферической нервной системы, меланому, семиному, тератокарциному, остеосаркому, пигментную ксеродерму, кератоакантому, фолликулярный рак щитовидной железы и саркому Капоши. Связанные с протеинкиназой нарушения включают заболевания, связанные с апоптозом, включая,но не ограничиваясь только ими, рак, вирусные инфекции, аутоиммунные заболевания и нейродегенеративные нарушения. Неограничивающие примеры нарушений, связанных с протеинкиназой, включают вирусные инфекции, включая, но не ограничиваясь только ими, ВИЧ, вирус папилломы человека, вирус герпеса, поксвирус, вирус Эпштейна-Барра, вирус Sindbis и аденовирус. Неограничивающие примеры нарушений, связанных с протеинкиназой, включают ангиогенез и метастазирование опухоли. Неограничивающие примеры нарушений, связанных с протеинкиназой, также включают пролиферацию клеток гладких мышц сосудов, связанную с атеросклерозом, послеоперационный стеноз сосудов и рестеноз и эндометриоз. Другие неограничивающие примеры нарушений, связанных с протеинкиназой, включают связан- 10023561Plasitiodium falciparum, и ДНК и РНК вирусы. В другом варианте осуществления соединение, предлагаемое в настоящем изобретении, дополнительно характеризуется как модулятор комбинации протеинкиназ, например киназ CDK, напримерCDK1, CDK2 и/или CDK9. В некоторых вариантах осуществления соединение, предлагаемое в настоящем изобретении, применяют для связанных с протеинкиназой заболеваний и/или в качестве ингибитора любой одной или большего количества протеинкиназ. Подразумевается, что применением может быть лечение с целью ингибирования одной или большего количества изоформ протеинкиназ. Соединения, предлагаемые в настоящем изобретении, являются ингибиторами ферментов циклинзависимых киназ. Если не ограничиваться теоретическими соображениями, то можно полагать, что ингибирование комплекса CDK-4/циклин D1 блокирует фосфорилирование комплекса Rb/неактивный E2F и тем самым предотвращает высвобождение активированного E2F и в конечном счете блокирование транскрипции Е 2F-зависимой ДНК. Это влияет на остановку цикла клеток G1. В частности, показано, что путь CDK4 характеризуется опухолеспецифической дерегуляцией и цитотоксическими эффектами. В соответствии с этим, возможность ингибировать активность комбинаций CDK важна для использования при лечении. Кроме того, способность клеток воспринимать и переносить воздействие химиотерапевтических средств может зависеть от быстрых изменений в транскрипции или от активации путей, которые весьма чувствительны к активности CDK9/циклин T1 (PTEF-b). Ингибирование CDK9 может сенсибилизировать клетки по отношению к стимулированию посредством TNF-альфа или TRAIL путем ингибированияNF-kB или может блокировать рост клеток путем уменьшения экспрессирования myc-зависимого гена. Ингибирование CDK9 также может сенсибилизировать клетки по отношению к генотоксичным химиотерапевтическим средствам, ингибированию HDAC или по отношению к другим средствам лечения, связанным с передачей сигналов. Сами по себе соединения, предлагаемые в настоящем изобретении, могут привести к снижению содержания антиапоптических белков, которые могут прямо индуцировать апоптоз или сенсибилизировать по отношению к другим апоптическим воздействиям, таким как подавление клеточного цикла, повреждение ДНК или микротрубочек или подавление передачи сигнала. Снижение содержания антиапоптических белков соединениями, предлагаемыми в настоящем изобретении, может прямо вызвать апоптоз или сенсибилизировать по отношению к другим апоптическим воздействиям, таким как подавление клеточного цикла, повреждение ДНК или микротрубочек или подавление передачи сигнала. Соединения, предлагаемые в настоящем изобретении, могут быть эффективными в сочетании с химиотерапией, средствами, останавливающими повреждение ДНК, или другими средствами, останавливающими клеточный цикл. Соединения, предлагаемые в настоящем изобретении, также могут быть эффективными для воздействия на резистентные по отношению к химиотерапии клетки. Настоящее изобретение относится к устранению одного или большего количества симптомов рака,воспаления, гипертрофии сердца и инфицирования посредством ВИЧ, а также к лечению связанных с протеинкиназой нарушений, описанных выше, но настоящее изобретение не ограничивается тем, каким образом обеспечивается воздействие соединения при лечении заболевания. Настоящее изобретение относится к лечению заболеваний, описанных в настоящем изобретении, любым образом, который обеспечивает лечение, например, рака, воспаления, гипертрофии сердца и инфицирования посредством ВИЧ. В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции любого из соединений, предлагаемых в настоящем изобретении. В родственном варианте осуществления настоящее изобретение относится к фармацевтической композиции любого из соединений,предлагаемых в настоящем изобретении, и включающей фармацевтически приемлемый носитель или инертный наполнитель для любого из этих соединений. В некоторых вариантах осуществления настоящее изобретение относится к соединениям, как к новым химическим объектам. В одном варианте осуществления настоящее изобретение относится к упакованному средству,предназначенному для лечения нарушения, связанного с протеинкиназой. Упакованное средство включает соединение, предлагаемое в настоящем изобретении, упакованное вместе с инструкциями для применения по назначению эффективного количества соединения, предлагаемого в настоящем изобретении. Соединения, предлагаемые в настоящем изобретении, пригодны для применения в качестве активных средств в фармацевтических композициях, которые эффективны преимущественно для лечения нарушений, связанных с протеинкиназой, например рака, воспаления, гипертрофии сердца и инфицирования посредством ВИЧ. Фармацевтическая композиция в различных вариантах осуществления содержит фармацевтически эффективное количество активного средства, предлагаемого в настоящем изобретении,вместе с другими фармацевтически приемлемыми инертными наполнителями, носителями, наполнителями, разбавителями и т.п. Выражение "фармацевтически эффективное количество" при использовании в настоящем изобретении указывает количество, которое необходимо вводить реципиенту, в клетку, ткань или орган реципиента для обеспечения терапевтического результата, предпочтительно для регулирования, модулирования или ингибирования активности протеинкиназы, например ингибирования активности протеинкиназы или лечения рака, воспаления, гипертрофии сердца и инфицирования посредством ВИЧ. В других вариантах осуществления настоящее изобретение относится к способу ингибирования активности протеинкиназы. Способ включает взаимодействие клетки с любым из соединений, предлагаемых в настоящем изобретении. В родственном варианте осуществления способ дополнительно включает соединение, содержащееся в количестве, эффективном для селективного ингибирования активности протеинкиназы. В других вариантах осуществления настоящее изобретение относится к применению любого из соединений, предлагаемых в настоящем изобретении, для приготовления лекарственного средства, предназначенного для лечения у субъекта рака, воспаления, гипертрофии сердца и инфицирования посредством ВИЧ. В других вариантах осуществления настоящее изобретение относится к способу приготовления лекарственного средства, включающему приготовление препарата любого из соединений, предлагаемых в настоящем изобретении, предназначенного для лечения субъекта. Подробное описание некоторых вариантов осуществления Термин "лечение", "лечить" включает уменьшение проявления или ослабление по меньшей мере одного симптома, связанного с подвергающимся лечению патологическим состоянием, нарушением или заболеванием или вызванным им. В некоторых вариантах осуществления лечение включает вызывание нарушения, связанного с протеинкиназой, с последующей активацией соединения, предлагаемого в настоящем изобретении, которое, в свою очередь, уменьшает проявление или ослабляет по меньшей мере один симптом, связанный с подвергающимся лечению нарушением, связанным с протеинкиназой, или вызванный им. Например, лечение может ослабить один или несколько симптомов нарушения или привести к полному устранению нарушения. Термин "применение" включает любой один или большее количество следующих вариантов осуществления настоящего изобретения соответственно: применение для лечения связанных с протеинкиназой нарушений; применение для приготовления фармацевтических композиций, предназначенных для применения для лечения этих заболеваний, например для приготовления лекарственного средства; способы применения соединений, предлагаемых в настоящем изобретении, для лечения этих заболеваний; фармацевтическим препараты, содержащие соединения, предлагаемые в настоящем изобретении, предназначенные для лечения этих заболеваний; и соединения, предлагаемые в настоящем изобретении, предназначенные для применения для лечения этих заболеваний; если это является целесообразным и подходящим, если не указано иное. В частности, подвергающиеся лечению заболевания и таким образом являющиеся предпочтительными для применения соединения, предлагаемого в настоящем изобретении, выбраны из группы, включающей рак, воспаление, гипертрофию сердца и инфицирование посредством ВИЧ, а также заболевания, которые зависят от активности протеинкиназ. Термин "применение" также включает варианты осуществления композиций, предлагаемых в настоящем изобретении, которые эффективно связывают протеинкиназу, так что они могут выступать в качестве маркировки или метки, так что при связывании с флуоресцентной или обычной меткой или при приобретении радиоактивности их можно использовать в качестве реагента для научных исследований или в качестве диагностирующего или визуализирующего реагента. Термин "субъект" включает организмы, например прокариоты и эукариоты, которые способны страдать от заболевания, нарушения или патологического состояния, связанного с активностью протеинкиназы, или которых оно может поражать. Примеры субъектов включают млекопитающих, например людей, собак, крупный рогатый скот, лошадей, свиней, овец, коз, кошек, кроликов, крыс и трансгенных животных, не являющихся людьми. В некоторых вариантах осуществления субъектом является человек,например человек, страдающий или подвергающийся опасности страдать, или который может страдать от рака, воспаления, гипертрофии сердца и инфицирования посредством ВИЧ и других заболеваний или патологических состояний, описанных в настоящем изобретении (например, нарушением, связанным с протеинкиназой). В другом варианте осуществления субъектом является клетка. Выражение "соединение, модулирующее протеинкиназу", "модулятор протеинкиназы" или "ингибитор протеинкиназы" означает соединения, которые модулируют, например ингибируют или иным образом изменяют активность протеинкиназы. Примеры соединений, модулирующих протеинкиназу,включают соединения, предлагаемые в настоящем изобретении, т.е. формулы (I) и формулы II, а также соединения, приведенные в табл. А, В и С (включая их фармацевтически приемлемые соли, а также энантиомеры, стереоизомеры, поворотные изомеры, таутомеры, диастереоизомеры, атропоизомеры или рацематы). Коме того, способ, предлагаемый в настоящем изобретении, включает введение субъекту соединения, модулирующего протеинкиназу, предлагаемого в настоящем изобретении, в эффективном количестве, например соединения, модулирующего протеинкиназу, формулы (I) и формулы II, а также приведенные в табл. А, В и С (включая их фармацевтически приемлемые соли, а также энантиомеры, стереоизомеры, поворотные изомеры, таутомеры, диастереоизомеры, атропоизомеры или рацематы). Если в настоящем изобретении связывающие группы заданы своей обычной химической формулой,записанной слева направо, они также включают химически идентичные заместители, которые получатся при записи структуры справа налево, например -СН 2 О- включает -ОСН 2-, но только для этой цели. Термин "алкил" сам по себе или в качестве части другого заместителя означает, если не указано иное, полностью насыщенную линейную (неразветвленную) или разветвленную цепь или их комбинацию, содержащую указанное количество атомов углерода, если оно указано (т.е. C1-С 10-означает от 1 до 10 атомов углерода). Примеры включают, но не ограничиваются только ими, такие группы, как метил,этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, гомологи и изомеры, например, нпентила, н-гексила, н-гептила, н-октила и т.п. Если размер не указан, то алкильные группы, указанные в настоящем изобретении содержат 1-10 атомов углерода, обычно 1-8 атомов углерода и часто 1-6 или 1-4 атома углерода и предпочтительно 1-2 атома углерода. Если алкильная группа представляет собой разветвленную алкильную группу и количество атомов углерода не указано, то разветвленная алкильная группа содержит 3-8 атомов углерода, обычно примерно 3-6 атомов углерода и предпочтительно 3-4 атома углерода. Термин "алкенил" означает ненасыщенные алифатические группы, включая линейные (неразветвленные) или разветвленные группы и их комбинации, содержащие указанное количество атомов углерода, если оно указано, которые содержат по меньшей мере одну двойную связь (-С=С-). Все двойные связи могут независимо находиться в (Е)- или (Z)-конфигурации, а также в виде их комбинаций. Примеры алкенильных групп включают, но не ограничиваются только ими, -СН 2-СН=СН-СН 3; -СН=СН-СН=СН 2 и-СН 2-СН=СН-СН(СН 3)-СН 2-СН 3. Если размер не указан, то алкенильные группы, обсужденные в настоящем изобретении, содержат 2-6 атомов углерода. Термин "алкинил" означает ненасыщенные алифатические группы, включая линейные (неразветвленные) или разветвленные группы и их комбинации, содержащие указанное количество атомов углерода, если оно указано, которые содержат по меньшей мере одну тройную углерод-углеродную связь(-С=С-). Примеры алкинильных групп включают, но не ограничиваются только ими, -СН 2-СС-СН 3;-ОС-ОСН и -СН 2-С=С-СН(СН 3)-СН 2-СН 3. Если размер не указан, то алкинильные группы, обсужденные в настоящем изобретении, содержат 2-6 атомов углерода. Алкинильные и алкенильные группы могут содержать более одной кратной связи или комбинацию двойных и тройных связей и могут быть замещены, как это описано для алкильных групп. Термины "алкоксигруппа", "алкенилоксигруппа" и "алкинилоксигруппа" означают -О-алкил, -Оалкенил и -О-алкинил соответственно. Термин "циклоалкил" по отдельности или в комбинации с другими терминами означает, если не указано иное, циклические варианты алкила, алкенила или алкинила или их комбинации. Кроме того,циклоалкил может содержать конденсированные кольца, но исключены конденсированные арильные и гетероарильные группы, и циклоалкильные группы могут быть замещены, если они специально не описаны, как незамещенные. Примеры циклоалкила включают, но не ограничиваются только ими, циклопропил, циклобутил, циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил, норборнил и т.п. Если размер кольца не указан, то циклоалкильные группы, описанные в настоящем изобретении, содержат 3-8 элементов кольца или 3-6 элементов кольца. Термин "гетероцикл" или "гетероциклил" по отдельности или в комбинации с другими терминами означает циклоалкильный радикал, содержащий по меньшей мере один кольцевой атом углерода и по меньшей мере один кольцевой гетероатом, выбранный из группы, включающей О, N, P, Si и S, предпочтительно из группы, включающей N, О и S, где кольцо не является ароматическим, но может содержать кратные связи. Атомы азота и кислорода в гетероциклической группы необязательно могут быть окислены и атом азота необязательно может быть кватернизован. Во многих вариантах осуществления кольцевые гетероатомы выбраны из группы, включающей N, О и S. Гетероциклические группы, описанные в настоящем изобретении, если не указано иное, содержат 3-10 элементов кольца и по меньшей мере одним элементом кольца является гетероатом, выбранный из группы, включающей N, О и S; обычно в гетероциклическую группу включены не более 3 таких гетероатомов и в одном кольце гетероциклической группы содержится не более 2 из этих гетероатомов. Гетероциклическая группа может быть сконденсирована с дополнительным карбоциклическим, гетероциклическим или арильным кольцом. Гетероциклическая группа может быть присоединена к остальной части молекулы с помощью кольцевого атома углерода или кольцевого гетероатома и гетероциклические группы могут быть замещены, как это описано для алкильных групп. Кроме того, гетероциклическая группа может содержать конденсированные кольца, но исключены конденсированные системы, содержащие гетероарильную группу в качестве части конденсированной кольцевой системы. Примеры гетероциклических групп включают, но не ограничиваются только ими, 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4 морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, 1,2,3,4-тетрагидропиридил, дигидроиндол (индолин), тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил, 1-пиперазинил, 2-пиперазинил и т.п. Как и в случае других фрагментов, описанных в настоящем изобретении, гетероциклоалкильные фрагменты могут быть незамещенными или содержать различные заместители, известные в данной области техники, например гидроксигруппу, галоген, оксогруппу (С=О), алкилиминогруппу (RN=, где R обозначает низш. алкил или низш. алкоксигруппу), аминогруппу, алкиламиногруппу, диалкиламино- 13023561 группу, ациламиноалкил, алкоксигруппу, тиоалкоксигруппу, полиалкоксигруппу, низш. алкил, циклоалкил или галогеналкил. Неограничивающие примеры замещенных гетероциклоалкильных групп включают следующие, где каждый фрагмент может быть присоединен к основной молекуле любым возможным образом. В число гетероциклов также включены пиперидин, морфолин, тиоморфолин, пиперазин, пирролидин, тетрагидрофуран, оксетан, оксепан, оксиран, тетрагидротиофуран, тиепан, тииран и необязательно замещенные варианты каждого из них. Термины "циклоалкилоксигруппа" и "гетероциклоалкилоксигруппа" означают -О-циклоалкильную и -О-гетероциклоалкильную группы соответственно (например, циклопропоксигруппу, 2 пиперидинилоксигруппу и т.п.). Термин "арил" означает, если не указано иное, ароматическую углеводородную группу, которая может представлять собой одно кольцо или несколько колец (например, от 1 до 3 колец), которые сконденсированы друг с другом. Арил может содержать конденсированные кольца, где одно или большее количество конец необязательно представляют собой циклоалкил, но не включены гетероциклические или гетероароматические кольца; конденсированная система, содержащая по меньшей мере одно гетероароматическое кольцо, описана, как гетероарильная группа, и фенильное кольцо, сконденсированное с гетероциклическим кольцом, описано в настоящем изобретении, как гетероциклическая группа. Арильная группа включает конденсированную кольцевую систему, в которой фенильное кольцо сконденсировано с циклоалкильным кольцом. Примеры арильных групп включают, но не ограничиваются только ими, фенил, 1-нафтил, тетрагидронафталин, дигидро-1 Н-инден, 2-нафтил, тетрагидронафтил и т.п. Термин "гетероарил" при использовании в настоящем изобретении означает группы, содержащие одно кольцо или 2 или 3 конденсированных кольца, где по меньшей мере одно из колец является ароматическим кольцом, которое содержит от 1 до 4 гетероатомов, выбранных из группы, включающей N, О иS в качестве элементов колец (т.е. он содержит по меньшей мере одно гетероароматическое кольцо), где атомы азота и серы необязательно окислены и атом(ы) азота необязательно кватернизован. Гетероарильная группа может быть присоединена к остальной части молекулы с помощью кольцевого атома углерода или кольцевого гетероатома и она может быть присоединена через любое кольцо гетероарильного фрагмента, если этот фрагмент является бициклическим или трициклическим. Гетероарил может содержать конденсированные кольца, где одно или большее количество колец необязательно представляет собой циклоалкил или гетероциклоалкил или арил, при условии, что по меньшей мере одно из колец представляет собой гетероароматическое кольцо. Неограничивающими примерами гетероарильных групп являются 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5 изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3- 14023561 пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, 5 индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил и 6-хинолил. Заместители каждой из указанных выше арильных и гетероарильных кольцевых систем выбраны из группы приемлемых заместителей, описанных ниже. Арильные или гетероарильные группы обычно содержат до 4 заместителей в одном кольце (0-4), и иногда содержат 0-3 или 0-2 заместителя. Термины "арилоксигруппа" и "гетероарилоксигруппа" означают арильные и гетероарильные группы соответственно, присоединенные к остальной части молекулы через кислородный мостик (-О-). Термин "арилалкил" или "аралкил" означают связанную с алкилом арильную группу, в которой алкильный фрагмент присоединен к основной структуре и арил присоединен к алкильной части арилалкильного фрагмента. Примерами являются бензил, фенетил и т.п. "Гетероарилалкил" или "гетероаралкил" означают гетероарильный фрагмент, присоединенный к основной структуре через алкильный остаток. Примеры включают фуранилметил, пиридинилметил, пиримидинилэтил и т.п. Арилалкил и гетероарилалкил также содержат заместители, в которых в алкильной группе содержится по меньшей мере один атом углерода и второй атом углерода алкильной группы заменен, например, на атом кислорода (например, феноксиметил, 2-пиридилметоксигруппу, 3-(1-нафтилокси)пропил и т.п.). Термин "галоген" сам по себе или в качестве части другого заместителя означает, если не указано иное, атом фтора, хлора, брома или йода. Кроме того, такие термины, как "галогеналкил", включают моногалогеналкил и пергалогеналкил. Например, термин "галоген(С 1-С 4)алкил" включает, но не ограничивается только ими, трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и т.п. Приставка "пергалоген" означает соответствующую группу, в которой все доступные положения заняты галогенидными группами. Например, "пергалогеналкил" включает -CCl3, -CF3, -CCl2CF3 и т.п. Термины "перфторалкил" и "перхлоралкил" описывают подмножества пергалогеналкилов, в которых все доступные положения заняты фторидными и хлоридными группами соответственно. Неограничивающие примеры перфторалкила включают -CF3 и -CF2CF3. Неограничивающие примеры перхлоралкила включают -CCl3 и"Аминогруппа" в настоящем изобретении означает группу -NH2 или -NRR', где R и R' все независимо обозначают водород или алкил (например, низш. алкил). Термин "ариламиногруппа" в настоящем изобретении означает группу -NRR', в которой R обозначает арил и R' обозначает водород, алкил или арил. Термин "арилалкиламиногруппа" в настоящем изобретении означает группу -NRR', в которой R обозначает арилалкил и R' обозначает водород, алкил, арил или арилалкил. "Замещенная аминогруппа" означает аминогруппу, в которой по меньшей мере один из R и R' не обозначает Н, т.е. аминогруппа по меньшей мере одну замещающую группу. Термин "алкиламиногруппа" означает -алкил-NRR', где R и R' все независимо выбраны из группы, включающей водород или алкил (например, низш. алкил). Термин "аминокарбонил" в настоящем изобретении означает группу -С(О)-NH2, т.е. она присоединена к основной структуре через карбонильный атом углерода. "Замещенный аминокарбонил" в настоящем изобретении означает группу -C(O)-NRR' где R обозначает алкил и R' обозначает водород или алкил. Термин "ариламинокарбонил" в настоящем изобретении означает группу -C(O)-NRR', в которой R обозначает арил и R' обозначает водород, алкил или арил. "Арилалкиламинокарбонил" в настоящем изобретении означает группу -С(О)-NRR', в которой R обозначает арилалкил и R' обозначает водород, алкил, арил или арилалкил."Аминосульфонил" в настоящем изобретении означает группу -S(O)2-NH2-"Замещенный аминосульфонил" в настоящем изобретении означает группу -S(O)2-NRR', в которой R обозначает алкил и R' обозначает водород или алкил. Термин "арилалкиламиносульфониларил" в настоящем изобретении означает группу -арил-S(О)2-NH-арилалкил."Карбонил" означает двухвалентную группу -С(О)-. Термин "сульфонил" в настоящем изобретении означает группу -SO2-. "Алкилсульфонил" означает замещенную сульфонильную структуру -SO2R, в которой R обозначает алкил. Алкилсульфонильные группы, использующиеся в соединениях, предлагаемых в настоящем изобретении, обычно представляет собой низш. алкилсульфонильные группы, содержащие в R от 1 до 6 атомов углерода. Так, типичные алкилсульфонильные группы, использующиеся в соединениях, предлагаемых в настоящем изобретении,включают, например, метилсульфонил (т.е. где R обозначает метил), этилсульфонил (т.е. где R обозначает этил), пропилсульфонил (т.е. где R обозначает пропил) и т.п. Термин "арилсульфонил" в настоящем изобретении означает группу -SO2-арил. Термин "арилалкилсульфонил" в настоящем изобретении означает группу -SO2-арилалкил. Термин "сульфонамидная группа" в настоящем изобретении означает SO2NH2 или -SO2NRR' в случае, если она замещена. Если не указано иное, каждый радикал/фрагмент, описанный в настоящем изобретении (например,"алкил", "циклоалкил", "гетероциклоалкил", "арил", "гетероарил", "алкоксигруппа" и т.п.) включают замещенные и незамещенные формы."Необязательно замещенный" при использовании в настоящем изобретении означает, что конкретная описанная группа или группы могут содержать заместители, не являющиеся атомами водорода (т.е. она может быть незамещенной), или группа или группы могут содержать один или большее количество заместителей, не являющихся атомами водорода. Если не указано иное, то полное количество таких заместителей, которые могут содержаться, равно количеству атомов Н, содержащихся в незамещенной форме описанной группы. Обычно группа содержит от 1 до 3 (0-3) заместителей. Если необязательный заместитель присоединен с помощью двойной связи, такой как карбонильный атом кислорода (=O), то заместитель занимает 2 доступных положения замещаемой группы, так что полное количество заместителей, которые можно ввести, уменьшается в соответствии с количеством доступных положений. Подходящие замещающие группы включают, например, гидроксигруппу, нитрогруппу, аминогруппу, иминогруппу, цианогруппу, галоген, тиогруппу, сульфонил, тиоамидную группу, амидиновую группу, имидиновую группу, оксогруппу, оксамидиновую группу, метоксамидиновую группу, имидиновую группу,гуанидиновую группу, сульфонамидную группу, карбоксигруппу, формил, низш. алкил, низш. алкоксигруппу, низш. алкоксиалкил, алкилкарбонил, аминокарбонил, арилкарбонил, арилалкилкарбонил, карбониламиногруппу, гетероарилкарбонил, гетероарилалкилкарбонил, алкилтиогруппу, аминоалкил, цианоалкил, арил и т.п. Дейтерий, если он введен в соединение в количествах, по меньшей мере в 5 раз превышающих естественное содержание, для описания соединений в настоящем изобретении также можно считать заместителем. Отметим, что, поскольку дейтерий является изотопом водорода, который не приводит к значительному изменению формы молекулы, на дейтерий не распространяются численные ограничения, налагающиеся на количество заместителей: дейтерий (D) можно включать вместо водорода (Н) в дополнение к другим заместителям и его не следует учитывать в численных ограничениях, налагающихся на количество других заместителей. Замещающая группа сама может быть замещена теми же группами, которые описаны в настоящем изобретении для структуры соответствующего типа. Группа, замещающая замещающую группу, может представлять собой карбоксигруппу, галоген, нитрогруппу, аминогруппу, цианогруппу, гидроксигруппу,низш. алкил, низш. алкенил, низш. алкинил, низш. алкоксигруппу, аминокарбонил, -SR, тиоамидную группу, -SO3H, -SO2R, N-метилпирролидинил, пиперидинил, пиперазинил, N-метилпиперазинил, 4 хлорпиримидинил, пиридинил, тетрагидропиранил (или гетероциклоалкил, гетероарил) или циклоалкил,где R обычно обозначает водород или низш. алкил. Если замещенный заместитель включает группу, обладающую линейной цепью, то заместитель может находиться в цепи (например, 2-гидроксипропил, 2-аминобутил и т.п.) или на конце цепи (например, 2-гидроксиэтил, 3-цианопропил и т.п.). Замещенные заместители могут представлять собой обладающие линейной цепью, разветвленные или циклические группировки ковалентно связанных атомов углерода или гетероатомов (N, О или S). Термин "циклоалкил" можно использовать в настоящем изобретении для описания карбоциклической неароматической группы, которая присоединена через кольцевой атом углерода, и "циклоалкилалкил" можно использовать для описания карбоциклической неароматической группы, которая присоединена к молекуле через алкильный мостик. Аналогичным образом, "гетероциклил" можно использовать для описания неароматической циклической группы, которая содержит по меньшей мере один гетероатом в качестве элемента кольца и которая присоединена к молекуле через кольцевой атом, которым может быть С или N; и "гетероциклилалкил" можно использовать для описания такой группы, которая присоединена к другой молекуле через мостик. Размеры и заместители, которые пригодны для циклоалкильных, циклоалкилалкильных, гетероциклильных, и гетероциклилалкильных групп, являются такими же,как описанные выше для алкильных групп. При использовании в настоящем изобретении эти термины также включают кольца, которые содержат двойную связь или две двойных связи, если кольцо не является ароматическим. При использовании в настоящем изобретении "изомер" включает все стереоизомеры соединений,указанных в формулах в настоящем изобретении, включая энантиомеры, диастереоизомеры, а также все конформеры, поворотные изомеры и таутомеры, если не указано иное. В объем настоящего изобретения входят все энантиомеры любого раскрытого хирального соединения в основном в чистой левовращающей или правовращающей форме или в виде рацемической смеси, или при любом соотношении энантиомеров. Для соединений, раскрытых, как (R)-энантиомер, в объем настоящего изобретения также входит (S)-энантиомер; для соединений, раскрытых, как (S)-энантиомер, в объем настоящего изобретения также входит (R)-энантиомер. В объем настоящего изобретения входят любые диастереоизомеры соединений, указанных в приведенных выше формулах, в диастереоизомерно чистой форме и в форме смесей в любых соотношениях. Если стереохимическая конфигурация явно не указана в химической структуре или в химическом названии, то подразумевается, что химическая структура или химическое название включает все возможные стереоизомеры, конформеры, поворотные изомеры и таутомеры изображенных соединений. Например, подразумевается, что соединение, содержащее хиральный атом углерода, включает и(R)-энантиомер, и (S)-энантиомер, а также смеси энантиомеров, включая рацемические смеси; и подразумевается, что соединение, содержащее 2 хиральных атома углерода, включает все энантиомеры и диастереоизомеры (включая (R,R)-, (S,S)-, (R,S)- и (R,S)-изомеры). Во всех случаях применения соединений формул, раскрытых в настоящем изобретении, в объем настоящего изобретения также входит применение фармацевтически приемлемых солей описанных соеди- 16023561 нений. Термин "гетероатом" включает атомы любого элемента кроме углерода и водорода. Предпочтительными гетероатомами являются азот, кислород, сера и фосфор. Кроме того, выражение "любая их комбинация" означает, что любое количество указанных функциональных групп и молекул можно объединить с образованием более крупной молекулярной системы. Например, термины "фенил," "карбонил" (или "=О"), "-О-," "-ОН," и С 1-С 6 (т.е. -СН 3 и -СН 2 СН 2 СН 2-) можно объединить с образованием 3-метокси-4-пропоксибензокарбонильного заместителя. Следует понимать, что при объединении функциональных групп и молекул с образованием более крупной молекулярной системы можно удалять или присоединять атомы водорода в соответствии с валентностью каждого атома. Описание настоящего изобретения следует понимать в соответствии с законами и положениями,относящимися к химической связи. Например, может потребоваться удаление атома водорода для введения заместителя в данное положение. Кроме того, следует понимать, что определения переменных (т.е. групп R), а также положения связей в родовых формулах, предлагаемых в настоящем изобретении (например, формулах (I) или II), должно быть согласовано с правилами образования химических связей,известными в данной области техники. Также следует понимать, что все соединения, предлагаемые в настоящем изобретении, описанные выше, дополнительно включают связи между соседними атомами и/или с атомами водорода в соответствии с валентностью каждого атома. Это означает, что связи и/или атомы водорода прибавляют, чтобы для каждого из указанных ниже типов атомов образовывалось следующее количество связей: углерод - четыре связи, азот - три связи, кислород - две связи и сера - двешесть связей. Во всех случаях применения соединений формул, раскрытых в настоящем изобретении, в объем настоящего изобретения также входит применение фармацевтически приемлемых солей описанных соединений. В объем настоящего изобретения входят все фармацевтически приемлемые соли соединений, описанных в настоящем изобретении, а также способы применения таких солей. В объем настоящего изобретения также входят все несолевые формы любой соли соединения, указанного в настоящем изобретении, а также другие соли любой соли соединения, указанного в настоящем изобретении. "Фармацевтически приемлемые соли" являются такими солями, которые сохраняют биологическую активность свободных соединений и которые можно вводить людям и/или животным в виде лекарственных средств или фармацевтических препаратов. Искомую соль соединения, содержащего основную функциональную группу, можно получить по методикам, известным специалистам в данной области техники, путем обработки соединения кислотой. Примеры неорганических кислот включают, но не ограничиваются только ими, хлористоводородную кислоту, бромисто-водородную кислоту, серную кислоту, азотную кислоту и фосфорную кислоту. Примеры органических кислот включают, но не ограничиваются только ими, муравьиную кислоту, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, гиппуровую кислоту,пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, сульфоновые кислоты и салициловую кислоту. Искомую соль соединения,содержащего кислую функциональную группу, можно получить по методикам, известным специалистам в данной области техники, путем обработки соединения основанием. Примеры неорганических солей кислых соединений включают, но не ограничиваются только ими, соли щелочных металлов и соли щелочноземельных металлов, такие как соли натрия, соли калия, соли магния и соли кальция; соли аммония и соли алюминия. Примеры органических солей кислых соединений включают, но не ограничиваются только ими, соли прокаина, дибензиламина, N-этилпиперидина, N,N'-дибензилэтилендиамина и триэтиламина. В основном чистое соединение означает, что в пересчете на полное количество соединения в соединении содержится не более 15, или не более 10, или не более 5, или не более 3, или не более 1% примеси и/или соединения в другой форме. Например, в основном чистая S,S-форма соединения означает, что в ней суммарно содержится всего не более 15, или не более 10, или не более 5, или не более 3, или не более 1% форм R,R-, S,R- и R,S-форм. При использовании в настоящем изобретении "терапевтически эффективное количество" указывает количество, которое приводит к необходимому фармакологическому и/или физиологическому эффекту при патологическом состоянии. Эффект может быть профилактическим, т.е. обеспечивающим полное или частичное предупреждение патологического состояния или его симптома, и/или может быть терапевтическим, т.е. обеспечивающим частичное или полное излечивание патологического состояния и/или неблагоприятного эффекта, приписываемого этому патологическому состоянию. Терапевтически эффективные количества соединений, предлагаемых в настоящем изобретении, обычно включают любое количество, достаточное для обнаруживаемого ингибирования активности Raf по данным исследований, описанных в настоящем изобретении, других исследований активности киназы Raf, известных специалистам с общей подготовкой в данной области техники, или по обнаружению подавления или облегчения симптомов рака. При использовании в настоящем изобретении термин "фармацевтически приемлемый носитель" и родственные термины означает вспомогательные вещества, связующие, разбавители и т.п., известные специалисту в данной области техники, которые пригодны для введения индивидууму (например, млекопитающему или не млекопитающему). В объем настоящего изобретения также входят комбинации двух или большего количества носителей. Фармацевтически приемлемый носитель (носители) и любые дополнительные компоненты, описанные в настоящем изобретении, должны быть совместимыми для применения конкретной дозированной формы по предполагающемуся пути введения (например, пероральному, парентеральному). Специалист в данной области техники должен легко установить такую применимость, в особенности с учетом данных, приведенных в настоящем изобретении. Фармацевтические композиции, описанные в настоящем изобретении, включают по меньшей мере один фармацевтически приемлемый носитель или инертный наполнитель; предпочтительно, если такая композиция включает по меньшей мере один носитель или инертный наполнитель, не являющийся водой, или включает его в дополнение к воде. При использовании в способах лечения/предупреждения и применения соединений и композиций,описанных в настоящем изобретении, индивидуумом, "нуждающимся в нем", может быть индивидуум, у которого было диагностировано патологическое состояние или которого раньше лечили от подвергающегося лечению патологического состояния. В случае предупреждения индивидуумом, нуждающимся в нем, также может быть индивидуум, для которого существует опасность возникновения патологического состояния (например, в семейном анамнезе имеется патологическое состояние, факторы образа жизни указывают на опасность возникновения патологического состояния и т.п.). Обычно, когда в настоящем изобретении раскрывают стадию введения соединения, предлагаемого в настоящем изобретении, настоящее изобретение также включает стадию выявления индивидуума или субъекта, нуждающегося во введении конкретного средства или страдающего от конкретного подлежащего лечению патологического состояния. В некоторых вариантах осуществления индивидуумом является млекопитающее, включая, но не ограничиваясь только ими, крупный рогатый скот, лошадей, кошек, кроликов, собак, грызунов или приматов. В некоторых вариантах осуществления млекопитающим является примат. В некоторых вариантах осуществления приматом является человек. В некоторых вариантах осуществления индивидуумом является человек, включая взрослых, детей и недоношенных детей. В некоторых вариантах осуществления индивидуумом является не млекопитающее. В некоторых вариантах осуществления приматом является примат, не являющийся человеком, такой как шимпанзе и другие виды человекообразных обезьян и мартышек. В некоторых вариантах осуществления млекопитающим является сельскохозяйственное животное, такое как крупный рогатый скот, лошади, овцы, козы и свиньи; домашние животные, такие как кролики, собаки и кошки; лабораторные животные, включая грызунов, такие как крысы, мыши и морские свинки и т.п. Примеры не млекопитающих включают, но не ограничиваются только ими, птиц и т.п. Термин "индивидуум" не указывает на конкретный возраст илипол. В некоторых вариантах осуществления индивидуум был выявлен, как страдающий от одного или большего количества патологических состояний, описанных в настоящем изобретении. Идентификация патологических состояний, описанных в настоящем изобретении, опытным врачом является стандартной процедурой, использующейся в данной области техники (например, с помощью анализов крови, рентгеноскопии, компьютерной томографии, эндоскопии, биопсии и т.п.), и о наличии заболевания может подозревать индивидуум или другие, например, вследствие роста опухоли, кровотечения, кровотечения,образования язв, боли, увеличения лимфатических узлов, кашля, желтухи, образования отеков, потери массы тела, кахексии, потоотделения, анемии, паранеопластических проявлений, тромбоза и т.п. В некоторых вариантах осуществления индивидуум дополнительно был выявлен, как страдающий от рака, при котором экспрессируется мутантная Raf, такая как мутантная B-Raf. В некоторых вариантах осуществления индивидуум был выявлен, как восприимчивый к одному или большему количеству патологических состояний, описанных в настоящем изобретении. Восприимчивость индивидуума может быть основана на любом одном или большем количестве факторов риска и/или методик диагностики, известных специалисту в данной области техники, включая, но не ограничиваясь только ими, исследование генетического профиля, семейного анамнеза, истории болезни (например, наличие родственных патологических состояний), образа жизни или внешнего вида. При использовании в настоящем изобретении и прилагаемой формуле изобретения термины в единственном числе включают и термины во множественном числе, если из контекста явно не следует иное. Если не даны иные определения или из контекста явно не следует иное, все технические и научные термины, использующиеся в настоящем изобретении, обладают такими же значениями, которые известны специалисту с общей подготовкой в области техники, к которой относится настоящее изобретение. Общие методики синтеза Соединения, раскрытые в настоящем изобретении, можно получить из легкодоступных исходных веществ по описанным ниже общим методикам и процедурам. Следует понимать, что, если указаны типичные или предпочтительные условия выполнения методики (т.е. температура, длительность проведе- 18023561 ния реакции, молярные отношения реагентов, растворители, давления и т.п.), то также можно использовать другие условия, если не указано иное. Оптимальные условия проведения реакций могут меняться в зависимости от конкретных использующихся реагентов и растворителей, и такие условия может определить специалист в данной области техники с помощью стандартных методик оптимизации. Кроме того, как должно быть очевидно специалистам в данной области техники, для того, чтобы некоторые функциональные группы не вступали в нежелательные реакции, может потребоваться использование обычных защитных групп. Защитные группы, подходящие для различных функциональных групп, хорошо известны в данной области техники. Например, многочисленные защитные группы описаны в публикации Т.W. Greene and G.M. Wuts, Protecting Groups in Organic Synthesis, Third Edition,Wiley, New York, 1999, и в цитированной в ней литературе. Кроме того, соединения, раскрытые в настоящем изобретении, могут содержать один или большее количество хиральных центров. Поэтому при необходимости такие соединения можно получить или выделить в виде чистых стереоизомеров, т.е. в виде отдельных энантиомеров, или диастереоизомеров, или в виде смесей, обогащенных стереоизомером. Все такие стереоизомеры (и обогащенные смеси) включены в объем настоящего изобретения, если не указано иное. Чистые стереоизомеры (или обогащенные смеси) можно получить с использованием, например, оптически активных исходных веществ или стереоселективных реагентов, хорошо известных в данной области техники. Альтернативно, рацемические смеси таких соединений можно разделить с помощью, например, хиральной колоночной хроматографии, хиральных разделительных реагентов и т.п. Исходные вещества для указанных ниже реакций обычно являются известными соединениями или их можно получить по известным методикам или их очевидным модификациям. Например, многие из исходных веществ продают такие фирмы, как Aldrich Chemical Co (Milwaukee, Wisconsin, USA), Bachem(Torrance, California, USA), Emka-Chemce или Sigma (St. Louis, Missouri, USA). Другие можно получить по методикам или их очевидным модификациям, описанным в стандартных пособиях, таких как FieserEdition) и Larock's Comprehensive Organic Transformations (VCH Publishers Inc., 1989). Различные исходные вещества, промежуточные продукты и соединения, предлагаемые в предпочтительных вариантах осуществления, можно выделить и очистить, если это возможно, по обычным методикам, таким как осаждение, фильтрование, кристаллизация, выпаривание, перегонка и хроматография. Изучение характеристик этих соединений можно провести по обычным методикам, таким как определение температуры плавления, масс-спектроскопия, ядерный магнитный резонанс и другие методики спектроскопического анализа. Соединения, предлагаемые в вариантах осуществления, можно получить по целому ряду методик,известных специалисту в данной области техники, и обычно можно получить по приведенным ниже схемам реакций 1 и 2, которые подробно описаны в приведенных ниже примерах. Примеры В приведенных ниже примерах соединения, предлагаемые в вариантах осуществления, синтезировали по методикам, описанным в настоящем изобретении, или по другим методикам, которые известны в данной области техники. Соединения и/или промежуточные продукты характеризовали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием хроматографической системы Waters Millenium с модулем разделения 2695 (Milford, MA). Использовали аналитические колонки с обращенной фазой Phenomenex Luna C185 мкм, 4,650 мм, выпускающиеся фирмой Alltech (Deerfield, IL). Использовали элюирование в градиентном режиме (скорость потока 2,5 мл/мин), обычно начиная от смеси 5% ацетонитрил/95% вода и заканчивая 100% ацетонитрилом, в течение 10 мин. Все растворители содержали 0,1% трифторуксусной кислоты (ТФК). Соединения детектировали по поглощению в ультрафиолетовой (УФ) области спектра при длине волны 220 или 254 нм. Использовали растворители для ВЭЖХ, выпускающиеся фирмами Burdick and Jackson (Muskegan, MI) или Fisher Scientific (Pittsburgh, PA). В некоторых случаях чистоту определяли с помощью тонкослойной хроматографии (ТСХ) с использованием стеклянных или пластмассовых пластин, покрытых силикагелем, таких как, например,гибкие пластины Baker-Flex Silica Gel 1B2-F. Данные ТСХ легко получали путем визуального детектирования при ультрафиолетовом освещении или путем использования хорошо известной методики окрашивания парами йода или различных других методик окрашивания. Масс-спектрометрические исследования проводили на приборах для ЖХМС: Waters System (AcuityUPLC и Micromass ZQ масс-спектрометр; колонка: Acuity HSS C18 1,8 мкм, 2,150 мм; градиентный режим: 5-95% ацетонитрил в воде с добавлением 0,05% ТФК в течение 1,8 мин; скорость потока 1,2 мл/мин; диапазон молекулярных масс 200-1500; разность потенциалов на конусе 20 В; температура колонки 50 С). Все приведенные массы относятся к протонированным исходным ионам. Исследования с помощью ГХ (газовая хроматография)/МС (масс-спектрометрия) проводили на приборе Hewlett Packard (HP6890 Series газовый хроматограф с селективным по массе детектором 5973; инжектируемый объем: 1 мкл; начальная температура колонки: 50 С; конечная температура колонки: 250 С; время линейного повышения: 20 мин; скорость потока газа: 1 мл/мин; колонка: 5% фенилметилсилоксан, Model No. HP 190915-443, размеры: 30,0250,25 м). Исследования с помощью ядерного магнитного резонанса (ЯМР) проводили для некоторых соединений на приборе Varian 300 МГц ЯМР (Palo Alto, CA). В качестве стандарта использовали триметилсилан или известный химический сдвиг растворителя. Некоторые образцы соединений исследовали при повышенных температурах (например, 75 С), чтобы повысить растворимость образца. Чистоту некоторых соединений исследовали с помощью элементного анализа (Desert Analytics,Tucson, AZ). Температуры плавления определяли на приборе Laboratory Devices Mel-Temp apparatus (Holliston,MA). Препаративные разделения проводили с помощью системы Combiflash Rf (Teledyne Isco, Lincoln,NE) с использованием картриджей RediSep с силикагелем (Teledyne Isco, Lincoln, NE) или картриджей с силикагелем SiliaSep (Silicycle Inc., Quebec City, Canada) или с помощью колоночной флэшхроматографии с использованием силикагеля (230-400 меш), или с помощью ВЭЖХ с использованиемWaters 2767 Sample Manager, С-18 колонки с обращенной фазой, 3050 мм, скорость потока 75 мл/мин. Типичными растворителями, использованными для системы Combiflash Rf и колоночной флэшхроматографии, являлись дихлорметан, метанол, этилацетат, гексан, гептан, ацетон, водный раствор аммиака (или гидроксид аммония) и триэтиламин. Типичными растворителями, использованными для ВЭЖХ с обращенной фазой, являлись ацетонитрил в разных концентрациях и вода с добавлением 0,1% трифторуксусной кислоты. В примерах, приведенных ниже, а также во всей настоящей заявке приведенные ниже аббревиатуры обладают указанными значениями. Термины, для которых не приведены определения, обладают общепринятыми значениями. Аббревиатуры. АЦН - ацетонитрил,БИНАФ - 2,2'-бис-(дифенилфосфино)-1,1'-бинафтил,ДХМ - дихлорметан,ДИЭА - диизопропилэтиламин,ДИПЭА - N,N-диизопропилэтиламин,ДМЭ -1,2-диметоксиэтан,ДМФ - N,N-диметилформамид,ДМСО - диметилсульфоксид,ДФФФ -1,1'-бис-(дифенилфосфино)ферроцен,экв. - эквивалент,EtOAc - этилацетат,EtOH - этанол,HATU - 2-(7-аза-1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийгексафторфосфат,ВЭЖХ - высокоэффективная жидкостная хроматография,МХПБК - мета-хлорпербензойная кислота,МеОН - метанол,NBS - N-бромсукцинимид,NMP - N-метил-2-пирролидон,Rt - время удерживания,ТГФ - тетрагидрофуран. Примеры синтеза Соединения, предлагаемые в настоящем изобретении, можно синтезировать по описанным схемам. Схема 1 а Как показано на схеме 1 а, синтез можно начать с содержащего функциональные группы пиридина или пиримидина I, в котором LG обозначает отщепляющуюся группу, такую как F, Cl, OTf и т.п. X может обозначать функциональную группу, такую как Cl, Br, I или OTf. Соединение I можно превратить в бороновую кислоту или эфир бороновой кислоты II следующим образом: 1) аддукт PdCl2(dppf) с ДХМ,ацетат калия, бис-(пинаколято)дибор нагревают при температуре 30-120 С в растворителях, таких как ТГФ, ДМФ, ДМЭ, ДМА толуол и диоксан; и 2) в растворителе, таком как ТГФ или диэтиловый эфир,проводят обмен аниона галогена путем добавления nBuLi или ДАЛ с последующей нейтрализацией аниона триизопропилборатом. Посредством гидролиза можно получить бороновую кислоту. Затем реакция перекрестного сочетания Судзуки между соединением II и пиридином или пиразином III дает бигетероарил, промежуточный продукт IV. Затем реакция SNAR между IV и содержащим функциональные группы амином NH2R1' в щелочной среде (ДИЭА, ТЭА (триэтиламин), лутидин, пиридин) в растворителе, таком как ДМФ, ТГФ, ДМСО, NMP, диоксан при нагревании (30-130 С) может дать соединение V. Если R1' совпадает с R1, то для получения VI необходимы операции с функциональными группами. Если R1' совпадает с R1, то соединение V будет таким же, как соединение VI. Альтернативно, VI можно получить по приведенной ниже схеме 1b. В этом случае стадию перекрестного сочетания Судзуки проводят между I иVII. Бороновую кислоту или ее эфир VII синтезируют из III таким же образом, как описано выше. Схема 1b Другой альтернативный путь представлен на схеме 2. Как показано на схеме 1 а, бороновую кислоту или ее эфир, X, можно получить из аминопиридина или аминопиримидина IX. Затем реакция перекрестного сочетания Судзуки между соединением X и пиридином или пиразином XI может дать бигетероарил,промежуточный продукт XII. Реакция SNAR между XII и содержащим функциональные группы аминомHA4LR2 в щелочной среде (ДИЭА, ТЭА, лутидин, пиридин) в растворителе, таком как ДМФ, ТГФ,ДМСО, NMP, диоксан при нагревании (30-130 С) может дать соединение V. Если R1' совпадает с R1, то Соединения, предлагаемые в настоящем изобретении, перечисленные в табл. I, получали по описанным ниже конкретным методикам. Методики включают синтез промежуточных продуктов и использование этих промежуточных продуктов для получения соединений формулы (I). Синтез промежуточных продуктов. Синтез 6-бром-N-(3-фторбензил)пиридин-2-амина (промежуточный продукт А) Раствор 2,6-дибромпиридина (7,1 г, 30,0 ммоль) в NMP (16 мл) смешивали со смесью (3 фторфенил)метанамина (4,13 г, 33,0 ммоль) и основания Хюнига (5,76 мл, 33,0 ммоль). Полученную смесь перемешивали в атмосфере аргона при 115-120 С в течение примерно 168 ч. Затем смесь охлаждали до температуры окружающей среды и разбавляли с помощью EtOAc (250 мл). Органический слой отделяли, промывали насыщенным водным раствором бикарбоната натрия (2), водой (2), рассолом (1),сушили над сульфатом натрия, фильтровали и концентрировали в вакууме и получали неочищенное вещество. Неочищенное вещество очищали с помощью колоночной хроматографии [SiO2, 120 г,EtOAc/гексан=от 0/100 до 20/80] и получали 6-бром-N-(3-фторбензил)пиридин-2-амин (7,11 г) в виде почти белого твердого вещества. ЖХМС (m/z): 281,1/283,1 [М+Н]+; время удерживания=1,03 мин. Синтез 5'-хлор-2'-фтор-N-(3-фторбензил)-2,4'-бипиридин-6-амина (промежуточный продукт В) Смесь 6-бром-N-(3-фторбензил)пиридин-2-амина (А, 2,0 г, 7,11 ммоль), 5-хлор-2-фторпиридин-4 илбороновой кислоты (2,0 г, 11,4 ммоль), аддукта PdCl2(dppf)CH2Cl2 (0,465 г, 0,569 ммоль), ДМЭ (27 мл) и 2 М водного раствора Na2CO2 (9,25 мл, 18,50 ммоль) перемешивали примерно при 100 С в течение 3 ч. После охлаждения до температуры окружающей среды смесь разбавляли с помощью EtOAc (25 мл) и МеОН (20 мл), фильтровали, концентрировали в вакууме и получали неочищенное вещество. Неочищенное вещество очищали с помощью колоночной хроматографии [силикагель, 120 г, EtOAc/гексан=от 0/100 до 20/80] и получали 5'-хлор-2'-фтор-N-(3-фторбензил)-2,4'-бипиридин-6-амин (1,26 г) в виде почти белого твердого вещества. ЖХМС (m/z): 332,2 [М+Н]+; время удерживания=0,92 мин. Синтез 6-бром-N-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амина (промежуточный продукт С) Смесь 2-бром-6-фторпиридина (750 мг, 4,26 ммоль) в ДМСО (3 мл) смешивали с (тетрагидро-2 Нпиран-4-ил)метанамингидрохлоридом (775 мг, 5,11 ммоль) и NEt3 (1,426 мл, 10,23 ммоль). Полученную смесь нагревали примерно при 110 С в течение 18 ч. Смесь охлаждали до температуры окружающей среды и разбавляли с помощью EtOAc. Органический слой отделяли, промывали насыщенным водным раствором бикарбоната натрия, водой и рассолом, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме и получали остаток. Полученный остаток очищали с помощью колоночной хроматографии [SiO2, 40 г, EtOAc/гептан=от 0/100 до 30/70]. Чистые фракции объединяли и концентрировали в вакууме и получали 6-бром-N-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амин (В 1, 940 мг) в виде белого твердого вещества. ЖХМС (m/z): 271,0/272,9 [М+Н]+; время удерживания=0,81 мин. Синтез 5'-хлор-2'-фтор-N-тетрагидро-2 Н-пиран-4-ил)метил)-2,4'-бипиридин-6-амина (промежуточный продукт D) Смесь 6-бром-N-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амина (С, 271 мг, 1 ммоль), 5-хлор 2-фторпиридин-4-илбороновой кислоты (351 мг, 2,000 ммоль), аддукта PdCl2(dppf)CH2Cl2 (82 мг, 0,100 ммоль) в ДМЭ (4,5 мл) и 2 М Na2CO3 (318 мг, 3,00 ммоль) нагревали в герметизированной пробирке примерно при 103 С в течение примерно 2 ч. Затем смесь охлаждали до температуры окружающей среды, разбавляли с помощью EtOAc (25 мл) и МеОН (5 мл), фильтровали, концентрировали в вакууме и получали остаток. Полученный остаток очищали с помощью колоночной хроматографии [SiO2, 12 г,EtOAc/гептан=от 10/90 до 50/50]. Фракции объединяли и концентрировали в вакууме и получали 5'-хлор 2'-фтор-N-тетрагидро-2 Н-пиран-4-ил)метил)-2,4'-бипиридин-6-амин (260 мг) в виде вязкого желтого масла. ЖХМС (m/z): 322,1/323,9 [М+Н]+; время удерживания=0,60 мин. Синтез 6-бром-5-хлор-N-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амина (Е) и 6-бром-3-хлорN-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амина (промежуточный продукт F) Раствор 6-бром-N-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амина (С, 1000 мг, 3,69 ммоль) в хлороформе (15 мл) разбавляли 1-хлорпирролидин-2,5-дионом (NCS, 492 мг, 3,69 ммоль). Затем смесь нагревали в герметизированной пробирке примерно при 33 С в течение примерно 16 ч, затем реакционную смесь нагревали в течение примерно 24 ч примерно при 37 С и затем в течение еще 5 дней примерно при 43 С. Затем реакционную смесь охлаждали до температуры окружающей среды, разбавляли 1 н. водным раствором гидроксида натрия и ДХМ. Органический слой отделяли, промывали рассолом, сушили над сульфатом натрия, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии [ISCO, SiO2, 80 г, EtOAc/гептан=5/95 2 мин, от 5/95 до 30/70 2-15 мин, до 35/65 15-18 мин, затем 35%]. Фракции объединяли и концентрировали в вакууме и получали 6 бром-3-хлор-N-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амин (F, 453 мг), и 6-бром-5-хлор-Nтетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амин (Е, 500 мг) (F): ЖХМС (m/z): 305,0 [М+Н]+; время удерживания=1,01 мин (Е): ЖХМС (m/z): 305,0 [М+Н]+; время удерживания=0,96 мин. Синтез 3,5'-дихлор-2'-фтор-N-тетрагидро-2 Н-пиран-4-ил)метил)-2,4'-бипиридин-6-амина (промежуточный продукт G)PdCl2(dppf)CH2Cl2 (80 мг, 0,098 ммоль) в ДМЭ (4,5 мл) и 2 М водного раствора карбоната натрия (4,5 мл,4,50 ммоль) нагревали в герметизированной пробирке примерно при 103 С в течение примерно 16 ч. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли с помощью EtOAc (100 мл) и насыщенным водным раствором карбоната натрия. Органический слой отделяли, промывали насыщенным водным раствором карбоната натрия (2), сушили над сульфатом натрия, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографииPdCl2(dppf)CH2Cl2 (53,4 мг, 0,065 ммоль) в ДМЭ (3 мл) и 2 М водного раствора карбоната натрия (3 мл,6,00 ммоль) нагревали в герметизированной пробирке примерно при 103 С в течение 16 ч. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли с помощью EtOAc (100 мл) и насыщенным водным раствором бикарбоната натрия. Органический слой отделяли, промывали насыщенным водным раствором бикарбоната натрия (2), сушили над сульфатом натрия, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии [ISCO, SiO2,25 г, EtOAc/гептан - от 0/100 до 30/70]. Фракции объединяли и концентрировали в вакууме и получали 5,5'-дихлор-2'-фтор-N-тетрагидро-2 Н-пиран-4-ил)метил)-2,4'-бипиридин-6-амин (130 мг) в виде почти бесцветной жидкости. ЖХМС (m/z): 356,1 [М+Н]+; время удерживания=1,10 мин. Синтез 5'-хлор-2',5-дифтор-N-тетрагидро-2 Н-пиран-4-ил)метил)-2,4'-бипиридин-6-амина (промежуточный продукт I) Стадия 1. Получение 3,6-дифтор-N-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амина. Смесь 2,3,6-трифторпиридина (3 г, 22,54 ммоль), (тетрагидро-2 Н-пиран-4-ил)метанамина (3,89 г,33,8 ммоль) и триэтиламина (7,86 мл, 56,4 ммоль) в NMP (60 мл) нагревали примерно при 70 С в течение примерно 1 ч. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли с помощью EtOAc (100 мл), рассолом (50 мл) и водой (50 мл). Отделенный органический слой промывали рассолом (1), 0,3 н. водным раствором HCl (2), насыщенным водным раствором NaHCO3 (1), рассолом (1), сушили над Na2SO4, отфильтровывали и концентрировали в вакууме и получали неочищенный 3,6-дифтор-N-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амин, который сразу использовали в следующей реакции без дополнительной очистки. Выход: 3,5 г. ЖХМС (m/z): 229,1 [М+Н]+; время удерживания=0,79 мин. Стадия 2. Получение 3-фтор-6-метокси-N-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амина. К раствору 3,6-дифтор-N-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амина (5 г, 21,91 ммоль) в МеОН (35 мл) добавляли метоксид натрия (25 мас.% в МеОН, 15,03 мл, 65,7 ммоль). Полученную смесь нагревали в стальном автоклаве примерно при 135 С в течение 18 ч. Затем смесь охлаждали до температуры окружающей среды и концентрировали в вакууме. Полученный остаток переносили в воду (250 мл) и получали осадок, который собирали фильтрованием и затем промывали водой. Затем твердое вещество растворяли в смеси толуол (10 мл)/ДХМ (10 мл), декантировали с темно-коричневатой пленки и концентрировали в вакууме. Полученный остаток сушили в высоком вакууме и получали неочищенный 3-фтор-6-метокси-N-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амин в виде почти бесцветного масла,которое сразу использовали в следующей реакции без дополнительной очистки. Выход: 4,96 г. ЖХМС(m/z): 241,1 [М+Н]+; время удерживания=0,87 мин. Стадия 3. Получение 5-фтор-6-тетрагидро-2 Н-пиран-4-ил)метил)аминопиридин-2-ола. К раствору 3-фтор-6-метокси-N-тетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амина (4,6 г, 19,14 ммоль) в ацетонитриле (50 мл) добавляли йодид натрия (20,09 г, 134 ммоль) и TMS-хлорид (17,13 мл, 134 ммоль). Полученную смесь перемешивали примерно при 95 С в течение 20 ч. Реакционную смесь охлаждали до температуры окружающей среды и затем разбавляли с помощью EtOAc (80 мл) и водой (40 мл). Разбавленную смесь энергично перемешивали в течение примерно 30 мин. Органический слой отделяли и промывали 0,1 н. водным раствором HCl. Объединенные водные слои осторожно нейтрализовывали(рН 7) раствором NaHCO3 и экстрагировали с помощью EtOAc (1100 мл) и ДХМ (250 мл). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 и рассолом, сушили надNa2SO4, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии [SiO2, 80 г, EtOAc/гептан=10/90 в течение 2 мин, EtOAc/гептан=от 10/90 до 100/0 за 23 мин, затем EtOAc/гептан=100/0] и получали 5-фтор-6-тетрагидро-2 Н-пиран-4 ил)метил)аминопиридин-2-ол в виде высоковязкого масла, которое при выдерживании при комнатной температуре становилось пурпурным. Выход: 780 мг. ЖХМС (m/z): 227,1 [М+Н]+; время удерживания=0,42 мин. Стадия 4. Получение 5-фтор-6-тетрагидро-2 Н-пиран-4-ил)метил)аминопиридин-2 илтрифторметансульфоната. Раствор 5-фтор-6-тетрагидро-2 Н-пиран-4-ил)метил)аминопиридин-2-ола (500 мг, 2,210 ммоль) и триэтиламина (0,462 мл, 3,31 ммоль) в ДХМ (20 мл) постепенно разбавляли примерно при 0 С ангидридом трифторметансульфоновой кислоты (1,120 мл, 6,63 ммоль). Полученную смесь перемешивали в течение примерно 2 ч при 0 С и осторожно смешивали с охлажденным льдом насыщенным водным раствором NaHCO3. Водный слой отделяли и экстрагировали с помощью ДХМ (2). Объединенные органические слои сушили над Na2SO4, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии [SiO2, 40 г, 30 мин, EtOAc/гептан=от 5/95 до 40/60] и получали 5-фтор-6-тетрагидро-2 Н-пиран-4-ил)метил)аминопиридин-2-илтрифторметансульфонат в виде бесцветного масла. Выход: 743 m г. ЖХМС (m/z): 359,0 [М+Н]+; время удерживания=1,02 мин. Стадия 5. Получение 5'-хлор-2',5-дифтор-N-тетрагидро-2 Н-пиран-4-ил)метил)-2,4'-бипиридин-6 амина. Смесь 5-фтор-6-тетрагидро-2 Н-пиран-4-ил)метил)аминопиридин-2-илтрифторметансульфонатаPdCl2(dppf)CH2Cl2 (162 мг, 0,199 ммоль) в ДМЭ (8 мл) и 2 М водного раствора Na2CO3 (2,6 мл, 1,987 ммоль) в герметизированной пробирке нагревали при 95 С в течение 3 ч. Смеси давали охладиться до температуры окружающей среды и разбавляли с помощью EtOAc (100 мл) и насыщенным водным раствором NaHCO3. Отделенный органический слой промывали насыщенным водным раствором NaHCO3(2), сушили над Na2SO4, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии [SiO2, 40 г, EtOAc/гептан=от 0/100 до 25/75 за 20 мин] и получали 5'-хлор-2',5-дифтор-N-тетрагидро-2 Н-пиран-4-ил)метил)-2,4'-бипиридин-6-амин в виде белого твердого вещества. Выход: 570 m г. ЖХМС (m/z): 340,1 [М+Н]+; время удерживания=0,99 мин. Синтез (R/S)-5'-хлор-N-2,2-диметилтетрагидро-2 Н-пиран-4-ил)метил)-2'-фтор-2,4'-бипиридин-6 амина (промежуточный продукт J) Стадия 1. Получение трет-бутил-6-бромпиридин-2-илкарбамата. К раствору 6-бромпиридин-2-амина (3 г, 17,34 ммоль), триэтиламина (3,14 мл, 22,54 ммоль) и ДМАП (диметиламинопиридин) (0,424 г, 3,47 ммоль) в ДХМ (24 мл) медленно добавляли раствор ВОСангидрида (4,83 мл, 20,81 ммоль) в ДХМ (6 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 24 ч. Смесь разбавляли водой, рассолом и EtOAc. Отделенный водный слой экстрагировали с помощью EtOAc. Объединенные органические слои сушили над сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии и получали трет-бутил-6-бромпиридин-2-илкарбамат в виде белого твердого вещества. Выход: 1,67 г. ЖХМС (m/z): 274,9 [М+Н]+; время удерживания=0,95 мин. Стадия 2. Получение(R/S)-(2,2-диметилтетрагидро-2 Н-пиран-4-ил)метил-4 метилбензолсульфоната. К раствору (2,2-диметилтетрагидро-2 Н-пиран-4-ил)метанола (1 г, 6,93 ммоль) в ДХМ (5 мл) и пиридин (5 мл, 61,8 ммоль) добавляли паратолуолсульфонилхлорид (1,586 г, 8,32 ммоль) и ДМАП (0,042 г,0,347 ммоль). Смесь перемешивали в течение 18 ч при температуре окружающей среды. Реакционную смесь концентрировали в вакууме и полученный остаток разбавляли водой и ДХМ. Отделенный органический слой промывали 0,2 н. водным раствором HCl (1), 1 н. водным раствором HCl (2), рассолом,сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии [SiO2, 40 г, EtOAc/гексан=от 0/100 до 50/50; 25 мин] и получали (R/S)-(2,2-диметилтетрагидро-2 Н-пиран-4-ил)метил-4-метилбензолсульфонат в виде бесцветного масла. Выход: 2,05 г. ЖХМС (m/z): 299,1 [М+Н]+; время удерживания=0,96 мин. Стадия 3. Получение (R/S)-трет-бутил-6-бромпиридин-2-ил 2,2-диметилтетрагидро-2 Н-пиран-4 ил)метил)карбамата. К смеси трет-бутил-6-бромпиридин-2-илкарбамата (686 мг, 2,51 ммоль), K2CO3 (347 мг, 2,51 ммоль), (2,2-диметилтетрагидро-2 Н-пиран-4-ил)метил-4-метилбензолсульфоната (750 мг, 2,51 ммоль) в ДМФ (10 мл) осторожно добавляли NaH (60 мас.%, 141 мг, 3,52 ммоль) порциями [Внимание: выделение газа]. Полученную смесь перемешивали примерно при 45 С в течение 4 ч. Смесь нагревали до температуры окружающей среды и разбавляли с помощью EtOAc (50 мл) и насыщенным водным растворомNaHCO3. Органический слой отделяли, промывали насыщенным водным раствором NaHCO3 (1), сушили над Na2SO4, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии [SiO2, 40 г, 25 мин, EtOAc/гептан=от 0/100 до 25/75 за 25 мин] и получали (R/S)-трет-бутил-6-бромпиридин-2-ил 2,2-диметилтетрагидро-2 Н-пиран-4-ил)метил)карбамат в виде высоковязкого бесцветного масла. Выход: 723 мг. ЖХМС (m/z): 344,9 потеря трет-Вигруппы/(399,0).[М+Н]+; время удерживания=1,22 мин. Стадия 4. Получение (R/S)-трет-бутил-5'-хлор-2'-фтор-2,4'-бипиридин-6-ил 2,2-диметилтетрагидро 2 Н-пиран-4-ил)метил)карбамата. Смесь трет-бутил-6-бромпиридин-2-ил 2,2-диметилтетрагидро-2 Н-пиран-4-ил)метил)карбамата(710 мг, 1,778 ммоль), 5-хлор-2-фторпиридин-4-илбороновой кислоты, аддукта PdCl2(dppf)CH2Cl2 (145 мг, 0,178 ммоль) в ДМЭ (7 мл) и 2 М водного раствора Na2CO3 (2,3 мл, 1,778 ммоль) нагревали в герметизированной пробирке примерно при 98 С в течение 2 ч. Смесь охлаждали до температуры окружающей среды и разбавляли с помощью EtOAc (100 мл) и насыщенным водным раствором NaHCO3. Отделенный органический слой промывали насыщенным водным раствором NaHCO3 (2), сушили надNa2SO4, отфильтровывали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии [SiO2, 40 г, 25 мин, EtOAc/гептан=от 0/100 до 25/75 за 25 мин] и получали(R/S)-трет-бутил-5'-хлор-2'-фтор-2,4'-бипиридин-6-ил 2,2-диметилтетрагидро-2 Н-пиран-4-ил)метил)карбамат в виде высоковязкого бесцветного масла. Выход: 605 мг. ЖХМС (m/z): 394,1 потеря трет-Buгруппы/450,2 [М+Н]+; время удерживания=1,24 мин. Стадия 5. Получение (R/S)-5'-хлор-N-2,2-диметилтетрагидро-2 Н-пиран-4-ил)метил)-2'-фтор-2,4'бипиридин-6-амина. К раствору трет-бутил-5'-хлор-2'-фтор-2,4'-бипиридин-6-ил 2,2-диметилтетрагидро-2 Н-пиран-4 ил)метил)карбамата (950 мг, 2,111 ммоль) в метаноле (5 мл) добавляли 4 М HCl/диоксан (15 мл, 494 ммоль). Полученную смесь перемешивали в течение 45 мин при температуре окружающей среды. Затем смесь концентрировали в вакууме и полученный остаток растворяли в EtOAc (50 мл) и насыщенном водном растворе NaHCO3 (50 мл). Отделенный органический слой промывали насыщенным водным раствором NaHCO3 (1), рассолом (1), сушили над Na2SO4, отфильтровывали и концентрировали в вакууме и получали неочищенный (R/S)-5'-хлор-N-2,2-диметилтетрагидро-2 Н-пиран-4-ил)метил)-2'-фтор 2,4'-бипиридин-6-амин в виде бесцветного масла, которое сразу использовали в следующей реакции без дополнительной очистки. Выход: 740 мг. ЖХМС (m/z): 350,1 [М+Н]+; время удерживания=0,69 мин. Синтез 5'-хлор-2',3,6-трифтор-2,4'-бипиридина (промежуточный продукт K) Стадия 1. Получение 3,6-дифтор-2-метоксипиридина. 2,3,6-Трифторпиридин (17,91 мл, 188 ммоль) растворяли в безводном МеОН (300 мл) и полученную смесь помещали в атмосферу аргона. Затем эту смесь обрабатывали 25 мас.% метанольным раствором метоксида натрия (43,0 мл, 188 ммоль). Затем полученную смесь нагревали примерно при 65 С в течение 2 ч. Реакционную смесь охлаждали до температуры окружающей среды и концентрировали в вакууме и получали остаток, который затем смешивали с рассолом (200 мл) и экстрагировали с помощью Et2O(3200 мл). Объединенные экстракты сушили (Na2SO4), фильтровали и концентрировали в вакууме и получали 21,5 г (выход 79%) неочищенного 3,6-дифтор-2-метоксипиридина в виде белого твердого вещества, которое использовали на следующей стадии без очистки. Стадия 2. Получение 3,6-дифтор-2-гидроксипиридина. К 3,6-дифтор-2-метоксипиридину (21,5 г, 148 ммоль) в ацетонитриле (250 мл) добавляли йодид натрия (66,6 г, 445 ммоль) и хлортриметилсилан (56,8 мл, 445 ммоль). Полученную смесь нагревали при 80-85 С в течение 2,5 ч. Смесь охлаждали до температуры окружающей среды и разбавляли с помощьюEtOAc (300 мл) и водой (300 мл) и энергично перемешивали в течение еще 1 ч. Слои разделяли и водную фазу экстрагировали с помощью дополнительного количества этилацетата (200 мл). Объединенные органические слои последовательно промывали 0,6 н. водным раствором HCl (250 мл) и рассолом (250 мл) и концентрировали в вакууме и получали взвесь. Взвесь фильтровали и трижды промывали холодным ацетонитрилом и получали 10,8 г искомого продукта в виде белого твердого вещества. Фильтрат концентрировали и очищали с помощью флэш-хроматографии на силикагеле (гептанькэтилацетат в градиентном режиме) и получали еще 4,2 г (суммарный выход 77%) 3,6-дифтор-2-гидроксипиридина в виде белого твердого вещества. ЖХМС (m/z): 132,0 [М+Н]+; время удерживания=0,47 мин. Стадия 3. Получение 3,6-дифторпиридин-2-илтрифторметансульфоната. Охлажденный в бане из воды со льдом раствор 3,6-дифтор-2-гидроксипиридина (10,75 г, 82 ммоль) и триэтиламина (22,86 мл, 164 ммоль) в ДХМ (550 мл) в течение 20 мин перемешивали с раствором ангидрида трифторметансульфоновой кислоты (16,63 мл, 98 ммоль) в ДХМ (100 мл). Затем полученную смесь перемешивали в течение 2 ч при 0 С и за протеканием реакции следили с помощью ТСХ (тонкослойная хроматография) (2:1 гептаны:этилацетат). Реакцию останавливали насыщенным водным раствором NaHCO3 (200 мл). Отделенный водный слой экстрагировали с помощью ДХМ (2). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (EtOAc/гептан в градиентном режиме) и получали 16,3 г (выход 76%) 3,6-дифторпиридин-2-илтрифторметансульфоната в виде желтого масла. Стадия 4. Получение 5'-хлор-2',3,6-трифтор-2,4'-бипиридина. Смесь 3,6-дифторпиридин-2-илтрифторметансульфоната (3,50 г, 13,30 ммоль) и 5-хлор-2 фторпиридин-4-бороновой кислоты (3,27 г, 18,62 ммоль) в ТГФ (27 мл) дегазировали путем пропускания аргона в течение 10 мин. Добавляли водный раствор карбоната натрия (13,30 мл, 26,6 ммоль) и аддуктPdCl2(dppf)CH2Cl2 (0,652 г, 0,798 ммоль) и смесь дегазировали в течение еще 5 мин. Полученную реакционную смесь перемешивали примерно при 100 С в течение 2 ч в герметичном сосуде. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли с помощью EtOAc и водой. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (гептаны/этилацетат в градиентном режиме) и получали 2,78 г (выход 85%) 5'-хлор-2',3,6-трифтор-2,4'-бипиридина в виде кристаллического твердого вещества. ЖХМС (m/z): 244,9 [М+Н]+; время удерживания=0,86 мин. Синтез 5'-хлор-N-2R,6S)-2,6-диметилтетрагидро-2 Н-пиран-4-ил)метил)-2'-фтор-2,4'-бипиридин-6 амина (промежуточный продукт L) Стадия 1. Получение (2R,6S)-2,6-диметилдигидро-2 Н-пиран-4(3 Н)-она. Раствор 2,6-диметил-4 Н-пиран-4-она (2 г, 16,1 ммоль) в 20 мл этанола перемешивали над 10% Pd/C(0,2 г) в атмосфере водорода (15 фунт-сила/дюйм 2) в течение 16 ч при температуре окружающей среды. На хроматограмме ТСХ обнаруживалось 2 пятна; первое соответствовало искомому продукту и второе соответствовало побочному продукту в соотношении 1:1. ГХМС М+ 128 для продукта и М+ 130 для побочного продукта. Суспензию фильтровали и фильтрат концентрировали для удаления растворителя и получали 2,3 г неочищенного продукта, который содержал 30% побочного продукта. Полученный маслообразный остаток обрабатывали с помощью 2,3 г перйодинана Десса-Мартина в 15 мл ДХМ при температуре окружающей среды в течение 16 ч. ГХМС показывала, что окисление завершилось, образование искомого продукта подтверждала ГХМС с М+ 128. К суспензии добавляли 3 мл NaS2CO3 и полученную смесь перемешивали в течение 1 ч при температуре окружающей среды, затем добавляли 20 мл насыщенного водного раствора бикарбоната натрия и новую смесь перемешивали в течение еще 1 ч. Органическую фазу отделяли, промывали водой, рассолом, сушили и фильтровали через целит. Фильтрат концентрировали и полученный остаток очищали с помощью ISCO при элюировании с помощью 10% этилацетата в гептане и получали 600 мг искомого продукта. ГХМС: М=128. Н ЯМР: 1,5 част./млн (6 Н),2,3 част./млн (4 Н), 3,75 част./млн (2 Н). Стадия 2. Получение (2R,6S,Е)-4-(метоксиметилен)-2,6-диметилтетрагидро-2 Н-пирана. К суспензии (метоксиметил)трифенилфосфинхлорида (1,5 г, 4,45 ммоль) в 8 мл ТГФ при -10 С по каплям добавляли 4,45 мл 1,0 М раствора бис-(триметилсилил)амида натрия в ТГФ. Полученную реакционную смесь перемешивали в течение 1 ч, затем добавляли раствор (2R,6S)-2,6-диметилдигидро-2 Нпиран-4(3 Н)-она (380 мг, 2,96 ммоль) в 2 мл ТГФ. Полученную смесь нагревали до температуры окружающей среды и перемешивали в течение еще 3 ч. ГХМС указывала на образование искомого продукта с М+156 в качестве главного компонента. Реакцию останавливали с помощью 15 мл воды и экстрагировали диэтиловым эфиром (230 мл). Объединенную органическую фазу промывали рассолом, сушили и концентрировали. Полученный остаток очищали с помощью ISCO при элюировании с помощью 10% этилацетата в гептане и получали 240 мг искомого продукта в виде бесцветного масла, ГХМС показывала наличие М=156. Н ЯМР: 5,9 част./млн (1 Н), 3,45 част./млн (3 Н), 3,25 част./млн (2 Н), 2,45 част./млн муравьиной кислоты (1,5 мл, 34,4 ммоль) в воде нагревали на масляной бане в атмосфере аргона примерно при 90 С в течение 1 ч. ГХМС указывала на завершение реакции при этих условиях. Реакционную смесь охлаждали в бане со льдом, нейтрализовывали с помощью 6 н. NaOH до рН 6 и экстрагировали диэтиловым эфиром. Органическую фазу сушили и концентрировали досуха и получали 120 мг искомого продукта в виде желтого масла. ГХМС М=142. Н ЯМР показывал наличие пика при 9,51 част./млн (s, 1H,СНО). Стадия 4. Получение 6-бром-N-2R,6S)-2,6-диметилтетрагидро-2 Н-пиран-4-ил)метил)пиридин-2 амина. Смесь (2R,6S)-2,6-диметилтетрагидро-2 Н-пиран-4-карбальдегида (120 мг, 0,84 ммоль) и 6-бром-2 аминопиридина (219 мг, 1,26 ммоль) в 5 мл ДХМ перемешивали при температуре окружающей среды в течение примерно 40 мин. К этому раствору добавляли триацетоксиборогидрид натрия (268 мг, 1,26 ммоль), затем добавляли 0,01 мл уксусной кислоты. Полученный раствор перемешивали при температуре окружающей среды в течение примерно 40 ч. Реакционную смесь концентрировали в вакууме и полученный остаток разбавляли этилацетатом, промывали бикарбонатом натрия, рассолом, сушили, концентрировали. Полученный остаток очищали с помощью ISCO при элюировании с помощью от 10 до 20% этилацетата в гептане и получали 110 мг искомого продукта в виде бесцветного масла. ЖХМС (m/z): 299/301 (МН+); время удерживания=1,01 мин. Стадия 5. Получение 5'-хлор-N-2R,6S)-2,6-диметилтетрагидро-2 Н-пиран-4-ил)метил)-2'-фтор-2,4'бипиридин-6-амина. Смесь 6-бром-N-2R,6S)-2,6-диметилтетрагидро-2 Н-пиран-4-ил)метил)пиридин-2-амина (110 мг,0,36 ммоль), 5-хлор-2-фторпиридин-4-бороновой кислоты (193 мг, 1,10 ммоль), 0,55 мл 2,0 М насыщенного водного раствора карбоната натрия в 2 мл ДМЭ продували аргоном в течение 3 мин, добавлялиPdCl2(dppf)CH2Cl2 (30 мг, 0,037 ммоль). Полученную смесь нагревали примерно при 95 С на масляной бане в течение 3,5 ч. Образование искомого продукта подтверждалось с помощью ЖХМС: МН+ 350, 0,70 мин. Полученную выше реакционную смесь разбавляли этилацетатом, промывали водой, рассолом, сушили над сульфатом натрия и концентрировали. Полученный остаток очищали с помощью ISCO при элюировании с помощью 10% этилацетата в гептане и получали 90 мг искомого продукта в виде бесцветного масла. ЖХМС (m/z): 350 (МН+); время удерживания=0,70 мин. Синтез 5'-хлор-N6-2R,6S)-2,6-диметилтетрагидро-2 Н-пиран-4-ил)метил)-2,4'-бипиридин-2',6 диамина (промежуточный продукт M) Смесь 5'-хлор-N-2R,6S)-2,6-диметилтетрагидро-2 Н-пиран-4-ил)метил)-2'-фтор-2,4'-бипиридин-6 амина (60 мг, 0,17 ммоль) и 3,0 мл 28% водного раствора гидроксида аммония нагревали примерно при 130 С на масляной бане в течение 17 ч. Образование соединения М подтверждалось по данным ЖХМС/ЖХ. Реакционную смесь разбавляли этилацетатом, промывали водой, насыщенным раствором бикарбоната натрия и рассолом, сушили над сульфатом натрия и концентрировали и получали 50 мг искомого продукта. ЖХМС (m/z): 347 (МН+); время удерживания=0,53 мин. Синтез 3-бром-5'-хлор-2'-фтор-N-тетрагидро-2 Н-пиран-4-ил)метил)-2,4'-бипиридин-6-амина (промежуточный продукт N) Смесь 5'-хлор-2'-фтор-N-тетрагидро-2 Н-пиран-4-ил)метил)-2,4'-бипиридин-6-амина (516 мг, 1,60 ммоль) и N-бромсукцинимида (286 мг, 1,60 ммоль) в ацетонитриле (12 мл) перемешивали при 90 С в течение 3 ч в герметичном сосуде. Летучие вещества удаляли при пониженном давлении. Полученный остаток растворяли в этилацетате и последовательно промывали насыщенным водным раствором бикарбоната натрия и рассолом. Органическую фазу сушили (Na2SO4), фильтровали и концентрировали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (гептаны/этилацетат в градиентном режиме) и получали 608 мг искомого продукта. ЖХМС (m/z): 402,0 Синтез промежуточного продукта метилбензолсульфоната (промежуточный продукт О)(4-метокситетрагидро-2 Н-пиран-4-ил)метил-4 Стадия 1. Синтез 1,6-диоксаспиро[2.5]октана. К прозрачному раствору триметилсульфониййодида (3,27 г, 16 ммоль) в 20 мл ДМСО при перемешивании добавляли дигидро-2 Н-пиран-4(3 Н)-он (1,0 г, 10 ммоль). Затем к этой смеси в атмосфере азота медленно добавляли KOtBu (1,68 г, 15 ммоль) в 15 мл ДМСО. Затем полученный раствор перемешивали в течение ночи при температуре окружающей среды. К смеси медленно добавляли воду (50 мл) и полученную смесь экстрагировали диэтиловым эфиром (320 мл). Эфирные слои объединяли, сушили и концентрировали в вакууме и получали 650 мг неочищенного продукта. 1 Н ЯМР (300 МГц, хлороформ-d)част./млн 1,44-1,62 (m, 2 Н), 1,76-1,98 (m, 2H), 2,70 (s, 2 Н), 3,70-3,98 (m, 4 Н). Стадия 2. Синтез (4-метокситетрагидро-2 Н-пиран-4-ил)метанола. К раствору 1,6-диоксаспиро[2.5]октана (600 мг, 5,26 ммоль) в метаноле (10 мл) при 0 С (вода со льдом) в атмосфере азота добавляли камфорсульфоновую кислоту (50 мг, 0,21 ммоль) и полученную смесь перемешивали примерно при 0 С в течение 2 ч. Смесь концентрировали в вакууме и неочищенный остаток использовали на следующей стадии без очистки. Искомый продукт получали в виде светложелтого масла (707 мг). Стадия 3. К раствору (4-метокситетрагидро-2 Н-пиран-4-ил)метанола (300 мг, 2,05 ммоль) в пиридине (4 мл) при температуре окружающей среды добавляли толуолсульфонилхлорид (430 мг, 2,25 ммоль) и полученную смесь перемешивали в течение ночи примерно при 25 С. Смесь при перемешивании концентрировали и твердый остаток растворяли в ДХМ и очищали с помощью хроматографии на колонке с 12 г силикагеля при элюировании с помощью 0-30% этилацетата в гептане и получали искомое соединение "О" в виде светло-желтого твердого вещества (360 мг). 1 Н ЯМР (300 МГц, хлороформ-d)част./млн 1,45-1,63 (m, 2 Н), 1,61-1,79 (m, 2H), 2,46 (s, 3 Н), 3,16 (s, 3 Н) 3,53-3,75 (m, 4 Н), 3,93 (s, 2 Н), 7,36 (d,J=8,20 Гц, 2 Н), 7,81 (d, J=8,20 Гц, 2 Н). Синтез трет-бутил-6-бром-5-хлорпиридин-2-ил 4-метокситетрагидро-2 Н-пиран-4-ил)метил)карбамата (промежуточный продукт Р) При перемешивании к раствору трет-бутил-6-бром-5-хлорпиридин-2-илкарбамата (140 мг, 0,455 ммоль) в ДМФ (2 мл) в атмосфере азота добавляли NaH (60%, 30 мг, 0,774 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 1 ч. Затем к полученной выше смеси добавляли раствор (4-метокситетрагидро-2 Н-пиран-4-ил)метил-4-метилбензолсульфоната (промежуточный продукт О, 164 мг, 0,546 ммоль) в ДМФ (1,5 мл). Затем полученную смесь перемешивали в течение ночи примерно при 85 С. Смесь при перемешивании разбавляли с помощью 30 мл этилацетата, промывали водой (20 мл 3) и сушили. После концентрирования полученный остаток очищали с помощью хроматографии на колонке с 12 г силикагеля при элюировании с помощью 5-20% этилацетата в гексане и получали искомое соединение "Р" в виде вязкого масла (92 мг), которое затвердевало при выдерживании в течение ночи. ЖХМС (m/z): 437,0 [М+Н]+; время удерживания=1,158 мин. Синтез (1-метоксициклогексил)метил-4-метилбензолсульфоната (промежуточный продукт Q) Это соединение синтезировали из циклогексанона по методике, описанной для (4 метокситетрагидро-2 Н-пиран-4-ил)метил-4-метилбензолсульфоната (промежуточный продукт О). ЖХМС (m/z): 299,2 [М+Н]+; время удерживания=1,055 мин. Синтез 4-(аминометил)тетрагидро-2 Н-пиран-4-карбонитрила (промежуточный продукт R)DBU (4,97 мл, 33,0 ммоль) в ДМФ (6 мл) нагревали примерно при 85 С в течение 3 ч, и затем охлаждали
МПК / Метки
МПК: C07D 401/04, C07D 401/12, A61K 31/506, C07D 213/74, A61P 35/00, A61P 29/00
Метки: производные, средство, протеинкиназы, качестве, модуляторов, пиридина, лекарственное, пиразина, композиция, содержащая
Код ссылки
<a href="https://eas.patents.su/30-23561-proizvodnye-piridina-i-pirazina-v-kachestve-modulyatorov-proteinkinazy-lekarstvennoe-sredstvo-i-kompoziciya-soderzhashhaya-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиридина и пиразина в качестве модуляторов протеинкиназы, лекарственное средство и композиция, содержащая их</a>
Предыдущий патент: Сепаратор для трубчатых проточных устройств
Следующий патент: Способ стереоселективного синтеза бициклических гетероциклов












