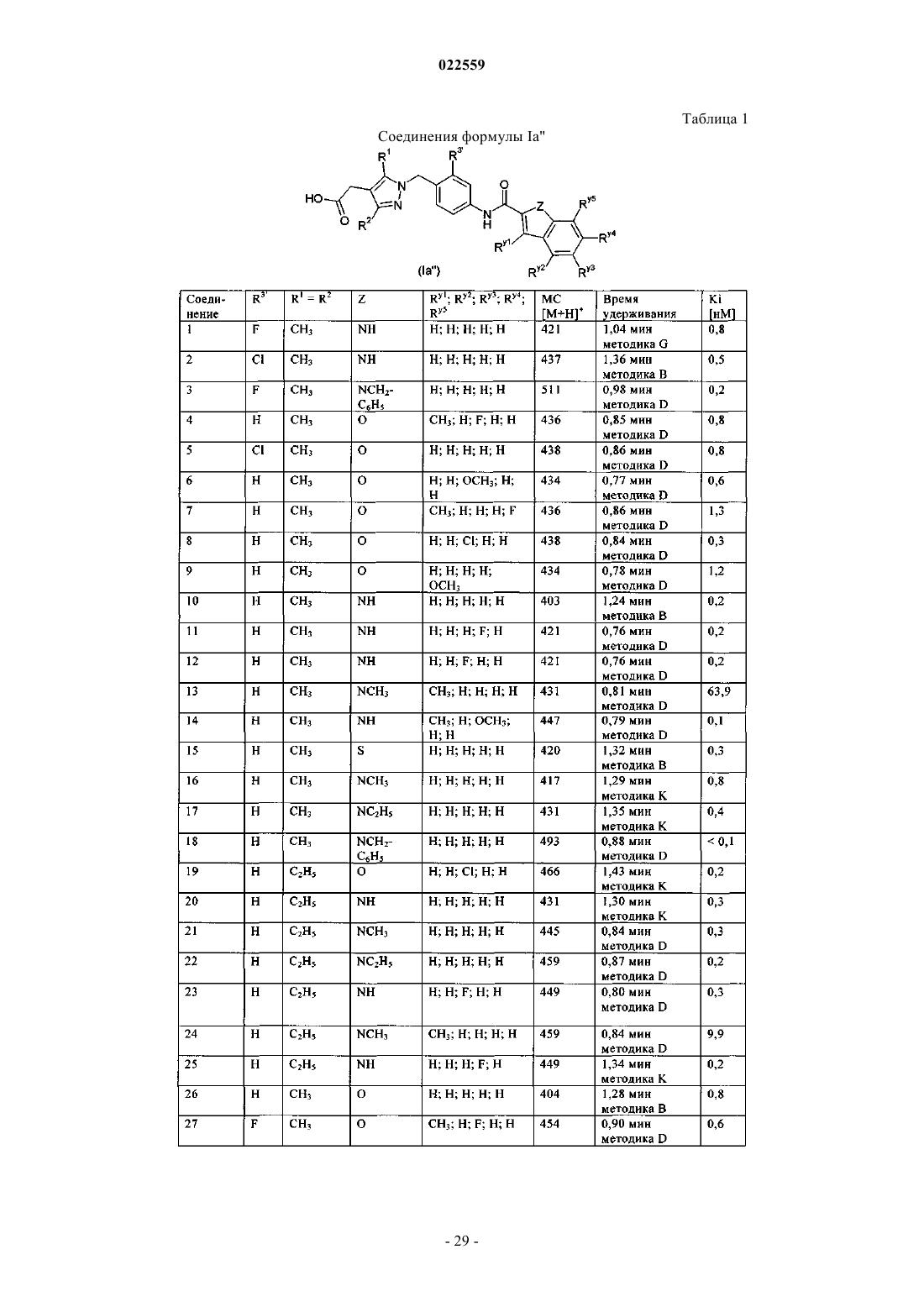
Пиразолы в качестве антагонистов crth2
Номер патента: 22559
Опубликовано: 29.01.2016
Авторы: Рист Вольфганг, Зайтер Петер, Мартирес Домник, Андерскевитц Ральф, Ост Торстен
Формула / Реферат
1. Пиразолы формулы (Ia') или (Ib') и их фармацевтически приемлемые соли:
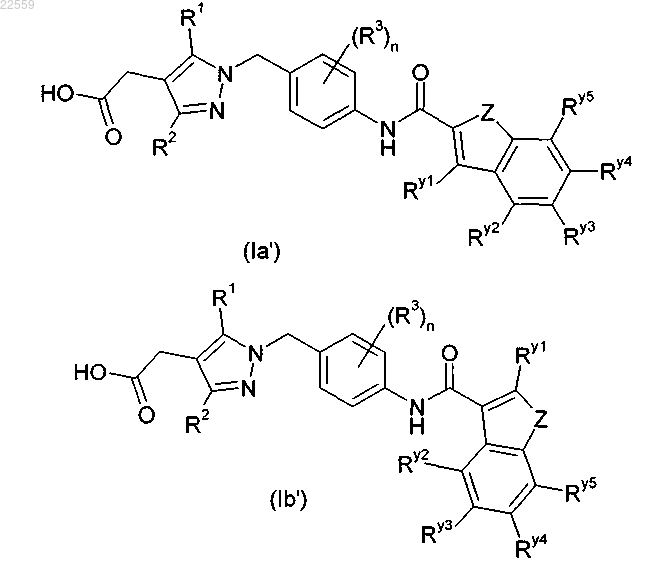
в которых Ry1, Ry2, Ry3, Ry4 и Ry5 независимо выбраны из группы, включающей Н, гидроксигруппу, галоген, цианогруппу, нитрогруппу, SF5, C(O)NRfRg, C1-C6-алкил, гидрокси-C1-C6-алкил, C1-C6-алкокси-C1-C6-алкил, C3-C8-циклоалкил, C1-C6-галогеналкил, C1-C6-алкоксигруппу, C1-C6-алкокси-C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу, C3-C8-циклоалкоксигруппу, C1-C6-алкиламиногруппу, ди-C1-C6-алкиламиногруппу, C1-C6-алкилсульфонил, фенил, феноксигруппу, 5- или 6-членный гетероциклил и 5- или 6-членную гетероциклилоксигруппу, где Rf и Rg независимо друг от друга выбраны из группы, включающей Н, C1-C6-алкил, C1-C6-галогеналкил, C3-C8-циклоалкил, C3-C8-циклоалкенил и 5- или 6-членный гетероциклил, или Rf и Rg вместе с атомом азота, к которому они присоединены, образуют циклический амин, который может содержать в качестве элемента кольца дополнительный гетероатом, выбранный из О, N и S;
Z выбран из О, S и NRz, где Rz обозначает Н, C1-C6-алкил или бензил;
R1 и R2 независимо друг от друга выбраны из группы, включающей Н, галоген, C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, C1-C6-алкоксигруппу, C1-C6-алкилтиогруппу, -NRfRg, C3-C8-циклоалкил, C3-C8-циклоалкил-C1-C6-алкил, C3-C8-циклоалкил-C2-C6-алкенил, C3-C8-циклоалкенил, C3-C8-циклоалкенил-C1-C6-алкил, C3-C8-циклоалкенил-C2-C6-алкенил, фенил, фенил-C1-C6-алкил, фенил-C2-C6-алкенил, нафтил, нафтил-C1-C6-алкил, нафтил-C2-C6-алкенил, гетероциклил, гетероциклил-C1-C6-алкил и гетероциклил-C2-C6-алкенил, где
C1-C6-алкильные, C2-C6-алкенильные и C2-C6-алкинильные фрагменты, содержащиеся в указанных выше радикалах R1 и R2, являются незамещенными или содержат по меньшей мере один заместитель, выбранный из группы, включающей гидроксигруппу, галоген, цианогруппу, нитрогруппу, C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу, C1-C6-алкиламиногруппу, ди-C1-C6-алкиламиногруппу и C1-C6-алкилсульфонил; и/или
два радикала, связанные с одним и тем же атомом углерода указанных C1-C6-алкильных, C2-C6-алкенильных и C2-C6-алкинильных фрагментов в указанных выше радикалах R1 и R2, вместе с указанным атомом углерода могут образовать карбонильную группу;
C3-C8-циклоалкильные, циклоалкенильные, фенильные, нафтильные и гетероциклильные фрагменты в указанных выше радикалах R1 и R2 являются незамещенными или содержат по меньшей мере один заместитель, выбранный из группы, включающей гидроксигруппу, галоген, цианогруппу, нитрогруппу, C1-C6-алкил, C3-C8-циклоалкил, C1-C6-галогеналкил, C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу, C1-C6-алкиламиногруппу, ди-C1-C6-алкиламиногруппу, C1-C6-алкилсульфонил, фенил и 5- или 6-членный гетероарил; и/или
два радикала, связанные с одним и тем же атомом углерода указанных C3-C8-циклоалкильных, C3-C8-циклоалкенильных и гетероциклильных фрагментов в радикалах R1 и R2, вместе с указанным атомом углерода могут образовать карбонильную группу;
Rf и Rg независимо друг от друга выбраны из группы, включающей Н, C1-C6-алкил, C1-C6-галогеналкил, C3-C8-циклоалкил, C3-C8-циклоалкенил и гетероциклил; или
Rf и Rg вместе с атомом азота, к которому они присоединены, образуют циклический амин, который может содержать в качестве элемента кольца дополнительный гетероатом, выбранный из О, N и S;
n обозначает целое число, выбранное из 0 или 1; и
R3, если присутствуют, независимо друг от друга выбран из группы, включающей галоген, C1-C6-алкоксигруппу и C1-C6-галогеналкоксигруппу.
2. Пиразолы формулы (Ia') или (Ib') по п.1, в которых Ry1 выбран из группы, включающей Н, C1-C6-алкил, C1-C6-алкокси-C1-C6-алкил и C1-C6-галогеналкил.
3. Пиразолы формулы (Ia') или (Ib') по п.1 или 2, в которых Ry2, Ry3, Ry4 и Ry5 независимо выбраны из группы, включающей Н, галоген, C1-C6-алкоксигруппу, C1-C6-алкокси-C1-C6-алкоксигруппу и C1-C6-галогеналкоксигруппу.
4. Пиразолы формулы (Ia') или (Ib') по любому из предшествующих пунктов, в которых Z обозначает О.
5. Пиразолы формулы (Ia') или (Ib') по любому из пп.1-3, в которых Z обозначает S.
6. Пиразолы формулы (Ia') или (Ib') по любому из пп.1-3, в которых Z обозначает NRz.
7. Пиразолы формулы (Ia') или (Ib') по любому из предшествующих пунктов, в которых R1 и R2 независимо друг от друга выбраны из группы, включающей Н, C1-C6-алкил, C3-C8-циклоалкил, фенил и нафтил.
8. Пиразолы формулы (Ia') или (Ib') по п.7, в которых R1 и R2 независимо друг от друга выбраны из группы, включающей Н, C1-C4-алкил, C3-C6-циклоалкил и фенил.
9. Пиразолы формулы (Ia') или (Ib') по п.8, в которых R1 и R2 выбраны из C1-C4-алкила.
10. Пиразолы формулы (Ia') или (Ib') по любому из предшествующих пунктов, в которых R3, если присутствуют, независимо выбраны из галогена.
11. Пиразольные соединения по любому из предшествующих пунктов, которые выбраны из соединений формулы (Ia').
12. Пиразольные соединения по любому из пп.1-10, которые выбраны из соединений общей формулы (Ib').
13. Применение пиразолов формулы (Ia') или (Ib') по любому из предшествующих пунктов для приготовления лекарственного средства, предназначенного для лечения заболеваний, связанных с активностью CRTH2.
14. Применение пиразолов формулы (Ia') или (Ib') по любому из пп.1-12 для приготовления лекарственного средства, предназначенного для предупреждения и/или лечения воспалительных, инфекционных и иммунорегуляторных нарушений, заболеваний или патологических состояний дыхательных путей или желудочно-кишечного тракта, воспалительных заболеваний суставов и аллергических заболеваний носоглотки, глаз и кожи.
15. Фармацевтические составы, обладающие антагонистической активностью CRTH2, содержащие один или более пиразолов формулы (Ia') и/или (Ib') по любому из пп.1-12.
16. Фармацевтические составы, содержащие один или более пиразолов формулы (Ia') и/или (Ib') по любому из пп.1-12 в комбинации с одним или несколькими активными веществами, выбранными из группы, включающей бета-миметики, антихолинергетики, кортикостероиды, ингибиторы PDE4, антагонисты LTD4, ингибиторы EGFR, антагонисты CCR3, антагонисты CCR5, антагонисты CCR9, ингибиторы 5-LO, антагонисты гистаминового рецептора, ингибиторы SYK и сульфонамиды.
Текст
Изобретение относится к пиразолам формулы (Ia) или (Ib) и их фармацевтически приемлемым солям, в которых Ra, Rb, Rc, Rd, Y1, Y2, Y3, Y4, Y5, Z, R1, R2, R3 и n имеют одно из значений,приведенных в описании и формуле изобретения, к их применению в качестве лекарственных средств, к фармацевтическому составу, содержащему указанные соединения, и к фармацевтическим составам, содержащим указанные соединения в комбинации с одним или несколькими активными веществами. Эти соединения обладают антагонистической активностью по отношению к CRTH2.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Настоящее изобретение относится к пиразолам формулы (Ia) или (Ib) и их фармацевтически приемлемым солям, обладающим антагонистической активностью по отношению к CRTH2 в которых Ra, Rb, Rc, Rd, Y1, Y2, Y3, Y4, Y5, Z, R1, R2, R3 и n имеют одно из значений, приведенных в описании и формуле изобретения,к применению указанных соединений в качестве лекарственных средств, к фармацевтическим составам,содержащим указанные соединения, и к фармацевтическим составам, содержащим указанные соединения в комбинации с одним или несколькими активными веществами. Уровень техники Простагландин D2 (PGD2) представляет собой эйкозаноид, образующийся в результате метаболизма арахидоновых кислот при стимуляции воспалительных клеток аллергенами, воспалительными факторами или при повреждении тканей. PGD2 в первую очередь высвобождается мастоцитами с клеткамиTh2, дендритными клетками, и его вторичным источником являются макрофаги. PGD2 является главным метаболитом арахидоновой кислоты, продуцирующимся мастоцитами при стимуляции аллергеномImmunol., 1991, 87540-548). Продуцирование PGD2 усиливается также у пациентов, страдающих системным мастоцитозом (Roberts N. Engl. J. Med. 1980, 303, 1400-1404; Butterfield et al., Int. Arch. AllergyImmunol., 1988, 82:869-877), уртикарной сыпью (Heavy et al., J. Allergy Clin. Immunol., 1986, 78:458-461),хроническим риносинуситом (Yoshimura et al., Allergol. Int., 2008, 57:429-436), хроническим обструктивным заболеванием легких (Csanky et al., Electrophoresis, 2009, 30:1228-1234) и во время анафилаксии(Ono et al., Clin. Exp. Allergy, 2009, 39:72-80). Введение PGD2 в дыхательные пути может вызвать реакцию, характерную для астматического ответа, включая бронхостеноз (Hardy et al., 1984, N Engl. J. Med. 311:209-213; Sampson et al., 1997, Thorax 52:513-518) и накопление эозинофилов (Emery et al., 1989, J. Applied Physiol. 67:959-962). СпособностьPGD2 инициировать воспалительные ответы подтверждена сверхэкспрессированием PGD2 синтазы человека у мышей, приводящим к усилению эозинофильного воспаления легких и продуцированию цитокинов Th2 в ответ на аллерген (Fujitani et al, 2002 J. Immunol. 168:443-449).PGD2 является агонистом двух типов содержащих 7 трансмембранных спиралей сшитых с белкомG рецепторов, рецептора PGD2 DPI (Boie et al., J. Biol. Chem., 1995, 270:18910-6) и недавно идентифицированного рецептора CRTH2 (хемотаксический рецептор-гомологическая молекула, экспрессирующийся в клетках Th2) (также называющийся рецептором DP2) (Nagata et al., J. Immunol., 1999, 162:1278-86).CRTH2 инициирует клеточные процессы, что приводит к рекрутменту и активации воспалительных клеток (Spik et al., J. Immunol., 2005; 174:3703-8; Shiraishi, J. Pharmacol. Exp. Ther., 2005, 312:954-60;CRTH2 было установлено, что можно ослабить воспалительные ответы и патофизиологические изменения в экспериментальных моделях на животных таких заболеваний, как астма, аллергический ринит,атопический дерматит и ХОЗЛ (хроническое обструктивное заболевание легких) (Uller et al., Respir Res. 2007, 8:16; Lukacs et al., Am. J. Physiol. Lung Cell Mol. Physiol. 2008, 295:L767-79; Stearns, Bioorg. MedChem. Lett. 2009, 19:4647-51; Nomiya, J. Immunol., 2008, 180:5680-5688; Boehme et al., Int. Immunol., 2009,21:1-17; Boehme et al., Int. Immunol., 2009, 21:81-93; Takeshita et al., Int. Immunol., 2004, 16:947-59; Stebbins et al., J. Pharmacol. Exp. Ther. 2009). Кроме того, генетическая делеция CRTH2 у мышей ослабляет воспалительные ответы в экспериментальных моделях на животных аллергии (Shiraishi et al., J.Immunol. 2008; 180:541-549; Oiwa, Clin. Exp. Allergy, 2008, 38:1357-66; Satoh et al., J. Immunol., 2006,177:2621-9). В отличие от этого, селективный по отношению к DP1 агонист BW245C не содействует воспалительным ответам, таким как миграция или активация лимфоцитов Th2, базофилов или эозинофиловGervais et al., J. Allergy Clin. Immunol., 2001, 108:982-8). Поэтому средства, которые противодействуют влиянию PGD2 на рецептор CRTH2, должны быть пригодны для лечения патологических состояний дыхательных путей или желудочно-кишечного тракта, а также воспалительных заболеваний суставов и аллергических заболеваний носоглотки, глаз и кожи. В WO 2004/096777 описаны производные пиримидина формулы (а) и их соли: в которой R6 обозначает карбоксигруппу, карбоксамид, нитрил или тетразолил,указанные производные обладают антагонистической активностью по отношению к CRTH2 и их можно использовать для профилактики и лечения заболеваний, связанных с активностью CRTH2. В WO 2009/042138 заявлены замещенные алкилтиогруппой пиримидины формулы (b) указанные соединения обладают антагонистической активностью по отношению к CRTH2. В WO 2009/042139 заявлены 2-S-бензилпиримидины формулы (с) указанные соединения обладают антагонистической активностью по отношению к CRTH2. В ЕР 0480659 заявлены соединения общей формулы (d) в которой Z2, в частности, может обозначать карбокси-C1-C10-алкил-С= и Y может обозначать замещенный бензил,указанные соединения могут быть пригодны для лечения гиперурикемии. В WO 2005/040128 заявлены соединения общей формулы (е) указанные соединения могут быть пригодны для лечения патологических состояний, таких как боль, или воспалительных, иммунологических, нарушений костей, нейродегенеративных или почечных нарушений. В WO 01/38325 заявлены соединения общей формулы (f) в которой А обозначает ароматическое кольцо и В обозначает азотсодержащее 5-членное гетероциклическое кольцо, которое может быть дополнительно замещено,указанные соединения обладают гипогликемической и гиполипидемической активностью. Задачей настоящего изобретения является получение дополнительных соединений, обладающих антагонистической активностью по отношению к CRTH2. Предпочтительные соединения, предлагаемые в настоящем изобретении, по данным исследования с использованием целых клеток обладают улучшенной химической стабильностью, улучшенными фармакокинетическими характеристиками (PK) и/или улучшенной активностью. Подробное описание изобретения Настоящее изобретение относится к пиразолам формулы (Ia) или (Ib) и их фармацевтически приемлемым солям: в которых Ra и Rb независимо выбраны из группы, включающей водород, гидроксигруппу, галоген,C1-C6-алкил, C1-C6 галогеналкил, C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу и C3-C8-циклоалкил,или Ra и Rb вместе с атомом углерода, к которому они присоединены, могут образовать карбонильную группу, или Ra и Rb вместе с атомом углерода, к которому они присоединены, образуют 3-8-членное кольцо, где указанное кольцо может содержать в качестве элементов кольца 1 или 2 гетероатома, выбранных из О, N и S, и где элементы указанного кольца необязательно могут быть независимо замещены гидроксигруппой,галогеном,C1-C6-алкилом,C1-C6-галогеналкилом,C1-C6-алкоксигруппой,C1-C6-галогеналкоксигруппой и C3-C8-циклоалкилом;Rc и Rd независимо выбраны из группы, включающей водород, гидроксигруппу, галоген,C1-C6-алкил, C1-C6-галогеналкил, C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу и C3-C8-циклоалкил,или Rc и Rd вместе с атомом углерода, к которому они присоединены, могут образовать карбонильную группу, или Rc и Rd вместе с атомом углерода, к которому они присоединены, образуют 3-8-членное кольцо, где указанное кольцо может содержать в качестве элементов кольца 1 или 2 гетероатома, выбранных из О, N и S, и где элементы указанного кольца необязательно могут быть независимо замещены гидроксигруппой,галогеном,C1-C6-алкилом,C1-C6-галогеналкилом,C1-C6-алкоксигруппой,C1-C6-галогеналкоксигруппой и C3-C8-циклоалкилом;Y1, Y2, Y3, Y4 и Y5 независимо выбраны из N и CRy, где каждый Ry независимо выбран из группы,включающей Н, гидроксигруппу, галоген, цианогруппу, нитрогруппу, SF5, C(O)NRfRg, C1-C6-алкил, гидрокси-C1-C6-алкил, C1-C6-алкокси-C1-C6-алкил, C3-C8-циклоалкил, C1-C6-галогеналкил, C1-C6-алкоксигруппу, C1-C6-алкокси-C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу, C3-C8-циклоалкоксигруппу,C1-C6-алкиламиногруппу, ди-C1-C6-алкиламиногруппу, C1-C6-алкилсульфонил, фенил, феноксигруппу,5- или 6-членный гетероциклил и 5- или 6-членную гетероциклилоксигруппу, где Rf и Rg независимо друг от друга выбраны из группы, включающей Н, C1-C6-алкил, C1-C6-галогеналкил, C3-C8-циклоалкил,C3-C8-циклоалкенил и 5- или 6-членный гетероциклил, или Rf и Rg вместе с атомом азота, к которому они присоединены, образуют циклический амин, который может содержать в качестве элемента кольца дополнительный гетероатом, выбранный из О, N и S;R1 и R2 независимо друг от друга выбраны из группы, включающей Н, галоген, C1-C6-алкил,C2-C6-алкенил, C2-C6-алкинил, C1-C6-алкоксигруппу, C1-C6-алкилтиогруппу, -NRfRg, C3-C8-циклоалкил,C3-C8-циклоалкил-C1-C6-алкил, C3-C8-циклоалкил-C2-C6-алкенил, C3-C8-циклоалкенил, C3-C8-циклоалкенил-C1-C6-алкил, C3-C8-циклоалкенил-C2-C6-алкенил, фенил, фенил-C1-C6-алкил, фенил-C2-C6 алкенил, нафтил, нафтил-C1-C6-алкил, нафтил-C2-C6-алкенил, гетероциклил, гетероциклил-C1-C6-алкил иC1-C6-алкильные, C2-C6-алкенильные и C2-C6-алкинильные фрагменты, содержащиеся в указанных выше радикалах R1 и R2, являются незамещенными или содержат по меньшей мере один заместитель,выбранный из группы, включающей гидроксигруппу, галоген, цианогруппу, нитрогруппу,C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу, C1-C6-алкиламиногруппу, ди-C1-C6-алкиламиногруппу и C1-C6-алкилсульфонил; и/или два радикала, связанные с одним и тем же атомом углерода указанных C1-C6-алкильных,C2-C6-алкенильных и C2-C6-алкинильных фрагментов в указанных выше радикалах R1 и R2, вместе с указанным атомом углерода могут образовать карбонильную группу; иC3-C8-циклоалкильные, циклоалкенильные, фенильные, нафтильные и гетероциклильные фрагменты в указанных выше радикалах R1 и R2 являются незамещенными или содержат по меньшей мере один заместитель, выбранный из группы, включающей гидроксигруппу, галоген, цианогруппу, нитрогруппу,C1-C6-алкил, C3-C8-циклоалкил, C1-C6-галогеналкил, C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу,C1-C6-алкиламиногруппу, ди-C1-C6-алкиламиногруппу, C1-C6-алкилсульфонил, фенил и 5- или 6-членный гетероарил; и/или два радикала, связанные с одним и тем же атомом углерода указанных C3-C8-циклоалкильных,C3-C8-циклоалкенильных и гетероциклильных фрагментов в радикалах R1 и R2 вместе с указанным атомом углерода могут образовать карбонильную группу;Rf и Rg независимо друг от друга выбраны из группы, включающей Н, C1-C6-алкил,C1-C6-галогеналкил, C3-C8-циклоалкил, C3-C8-циклоалкенил и гетероциклил; илиRf и Rg вместе с атомом азота, к которому они присоединены, образуют циклический амин, который может содержать в качестве элемента кольца дополнительный гетероатом, выбранный из О, N и S;R3, если присутствуют, независимо друг от друга выбраны из группы, включающей галоген,C1-C6-алкил, C1-C6-галогеналкил, C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу и C3-C8-циклоалкил. Согласно изобретению неожиданно было установлено, что соединения формулы (Ia) или (Ib), предлагаемые в настоящем изобретении, обладают значительной антагонистической активностью по отношению к CRTH2. Кроме того, согласно изобретению было установлено, что по данным исследования с использованием целых клеток указанные соединения обычно обладают улучшенной химической стабильностью, улучшенными фармакокинетическими характеристиками (PK) и/или улучшенной активностью. Таким образом, пиразолы формулы (Ia) или (Ib), предлагаемые в настоящем изобретении, являются подходящими для предупреждения и/или лечения заболеваний, связанных с активностью CRTH2. В соответствии с этим настоящее изобретение также относится к применению пиразолов формулы(Ia) или (Ib), предлагаемых в настоящем изобретении, в качестве лекарственных средств. Кроме того, настоящее изобретение относится к применению соединений формулы (Ia) или (Ib) для приготовления лекарственного средства, предназначенного для лечения заболеваний, связанных с активностью CRTH2. Точнее, настоящее изобретение относится к применению пиразолов формулы (Ia) или(Ib) для приготовления лекарственного средства, предназначенного для предупреждения и/или лечения воспалительных, инфекционных и иммунорегуляторных нарушений, заболеваний или патологических состояний дыхательных путей или желудочно-кишечного тракта, воспалительных заболеваний суставов и аллергических заболеваний носоглотки, глаз и кожи. Настоящее изобретение также относится к соединениям формулы (Ia) или (Ib), предлагаемым в настоящем изобретении, предназначенным для лечения и/или предупреждения заболеваний, связанных с активностью CRTH2. Точнее, настоящее изобретение относится к соединениям формулы (Ia) или (Ib),предназначенным для применения в качестве лекарственного средства для лечения заболеваний, связанных с активностью CRTH2. Точнее, настоящее изобретение относится к пиразолам формулы (Ia) или (Ib),предназначенным для применения в качестве лекарственного средства для предупреждения и/или лечения воспалительных, инфекционных и иммунорегуляторных нарушений, заболеваний или патологических состояний дыхательных путей или желудочно-кишечного тракта, воспалительных заболеваний суставов и аллергических заболеваний носоглотки, глаз и кожи. Кроме того, настоящее изобретение относится к фармацевтическим составам, содержащим один или более пиразолов формулы (Ia) или (Ib), предлагаемых в настоящем изобретении, в качестве единственного активного вещества или в комбинации с одним или несколькими активными веществами, выбранными из группы, включающей бета-миметики, антихолинергетики, кортикостероиды, ингибиторыCCR9, ингибиторы 5-LO, антагонисты гистаминового рецептора, ингибиторы SYK и сульфонамиды. Активность соединений, предлагаемых в настоящем изобретении, в исследовании изменения формы цельных клеток эозинофилов можно определить, например, по методикам, описанным в следующих публикациях:(устойчивость к гидролизу в кислой среде); (ii) инкубация в буферном растворе, обладающем рН 4,0, при 60 С в течение 3 дней (устойчивость к гидролизу в слабокислой среде); (iii) инкубация в буферном растворе, обладающем рН 7,4, при 60 С в течение 3 дней (устойчивость к гидролизу в среде, обладающей физиологическим значением рН); (iv) инкубация в 0,3% растворе пероксида водорода при 20 С в течение 3 дней (устойчивость к воздействию окислительных реагентов); (v) инкубация в воде при обработке УФ-излучением (ультрафиолетовое излучение) (=300-800 нм, Р=250 Вт/м 2) в течение 24 ч (устойчивость к воздействию света). Кинетику разложения можно исследовать, например, с использованием анализа с помощью ВЭЖХ (высокоэффективная жидкостная хроматография). Фармакокинетические характеристики (PK) соединений, предлагаемых в настоящем изобретении,можно определить с использованием доклинических исследований видов животных, например мышей,крыс, собак, морских свинок, мини-свиней, макак-крабоедов, макак-резусов. Фармакокинетические характеристики соединения можно описать, например, с помощью следующих параметров: среднее время удерживания, период полувыведения, объем распределения, AUC (площадь под кривой), клиренс, биологическая доступность после перорального введения. Использующиеся термины и определения Терминам, специально не определенным в настоящем изобретении, следует придавать значения,которые им придал бы специалист в данной области техники с учетом описания и контекста. Однако,если не указано иное, при использовании в описании приведенные ниже термины обладают указанными значениями и используются указанные ниже обозначения. В определенных ниже группах, радикалах или фрагментах перед группой часто указано количество атомов углерода. Например, "C1-C6-алкил" означает алкильную группу или алкильный радикал, содержащий от 1 до 6 атомов углерода. Обычно в группах, состоящих из двух или большего количества подгрупп, последняя названная группа является положением присоединения радикала. Если не указано иное, то для всех формул и групп предполагаются обычные значения терминов и обычные валентности стабильных атомов. Обычно в объем настоящего изобретения входят все таутомерные формы и изомерные формы и смеси, а именно отдельные геометрические изомеры или оптические изомеры, или рацемические или нерацемические смеси изомеров химической структуры, или соединения, если в названии или структуре соединения не указанная конкретная стереохимическая конфигураций или изомерная форма. Термин "замещенный" при использовании в настоящем изобретении означает, что у указанного атома, фрагмента или радикала любой один или большее количество атомов водорода замещены элементом из указанной группы радикалов при условии, что не превышена нормальная валентность указанного атома и что замещение приводит к стабильному соединению. Соединения, раскрытые в настоящем изобретении, могут существовать в виде фармацевтически приемлемых солей. В объем настоящего изобретения входят соединения в виде солей, включая соли присоединения с кислотами. Подходящие соли включают образованные и с органическими, и с неорганическими кислотами. Такие соли присоединения с кислотами обычно являются фармацевтически приемлемыми. Однако соли с фармацевтически неприемлемыми кислотами можно использовать для приготовления и очистки используемого соединения. Также можно получить соли присоединения с основаниями, и они являются фармацевтически приемлемыми. Более полное обсуждение получения и выбора солей приведено в публикации Pharmaceutical Salts: Properties, Selection, and Use (Stahl, P. Heinrich. Wiley-VCH,Zurich, Switzerland, 2002). Термин "фармацевтически приемлемая соль" при использовании в настоящем изобретении означает соли или цвиттерионные формы соединений, раскрытых в настоящем изобретении, которые растворяются или диспергируются в воде или масле и являются фармацевтически приемлемыми, как это определено в настоящем изобретении. Соли можно получить при окончательном выделении и очистке соединений или отдельно по реакции соответствующего соединения в форме свободного основания с подходящей кислотой. Типичные соли присоединения с кислотами включают ацетат, адипат, альгинат, L-аскорбат,аспартат, бензоат, бензолсульфонат (безилат), бисульфат, бутират, камфорат, камфорсульфонат, цитрат,диглюконат, формиат, фумарат, гентизат, глутарат, глицерофосфат, гликолят, гемисульфат, гептаноат,гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2- гидроксиэтансульфонат (изетионат),лактат, малеат, малонат, DL-манделат, мезитиленсульфонат, метансульфонат, нафтиленсульфонат, никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфонат, пи-5 022559 крат, пивалат, пропионат, пироглутамат, сукцинат, сульфонат, тартрат, L-тартрат, трихлорацетат, трифторацетат, фосфат, глутамат, бикарбонат, паратолуолсульфонат (п-тозилат) и ундеканоат. Кроме того,основные группы в соединениях, раскрытых в настоящем изобретении, можно кватернизировать метил-,этил-, пропил- и бутилхлоридами, -бромидами и -йодидами; диметил-, диэтил-, дибутил- и диамилсульфатами; децил-, лаурил-, миристил- и стерилхлоридами, -бромидами и -йодидами и бензил- и фенетилбромидами. Примеры кислот, которые можно использовать для получения терапевтически приемлемых солей присоединения, включают неорганические кислоты, такие как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота и фосфорная кислота, и органические кислоты, такие как щавелевая кислота, малеиновая кислота, янтарная кислота и лимонная кислота. Соли также можно получить путем координации соединений с ионом щелочного или щелочно-земельного металла. Таким образом, в объем настоящего изобретения входят соли натрия, калия, магния и кальция соединений, раскрытых в настоящем изобретении, и т.п. Соли присоединения с основаниями можно получить при окончательном выделении и очистке соединений по реакции карбоксигруппы с подходящим основанием, таким как гидроксид, карбонат или бикарбонат катиона металла, или с аммиаком, или с органическим первичным, вторичным или третичным амином. Катионы фармацевтически приемлемых солей включают катионы лития, натрия, калия,кальция, магния и алюминия, а также катионы нетоксичных четвертичных аминов, такие как аммоний,тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин,диэтиламин,этиламин,трибутиламин,пиридин,N,N-диметиланилин,N-метилпиперидин,N-метилморфолин, дихлоргексиламин, прокаин, дибензиламин, N,N-дибензилфенетиламин, 1-эфенамин и N,N'-дибензилэтилендиамин. Другие типичные органические амины, применимые для получения солей присоединения с основаниями, включают этилендиамин, этаноламин, диэтаноламин, пиперидин и пиперазин. Хотя соединения, предлагаемые в настоящем изобретении, можно вводить в виде чистого вещества,их также можно использовать в виде фармацевтического препарата. В соответствии с этим настоящее изобретение относится к фармацевтическим составам, которые содержат одно или большее количество некоторых соединений, раскрытых в настоящем изобретении, или одну или большее количество их фармацевтически приемлемых солей, сложных эфиров, пролекарств, амидов или сольватов вместе с одним или большим количеством фармацевтически приемлемых носителей и необязательно одним или большим количеством других терапевтических ингредиентов. Носитель (носители) должен быть "приемлемым" в том смысле, что он должен быть совместим с другими ингредиентами препарата и не оказывать вредного воздействия на его реципиента. То, какой препарат используется, зависит от выбранного пути введения. Можно использовать любые из хорошо известных подходящих методик, носителей и инертных наполнителей, известных в данной области техники; например, описанных в публикации Remington'sPharmaceutical Sciences. Фармацевтические композиции, раскрытые в настоящем изобретении, можно приготовить по любой методике, известной в данной области техники, например с помощью обычных методик смешивания, растворения, гранулирования, приготовления драже, растирания в порошок,эмульгирования, капсулирования, включения или прессования. Термин "галоген" при использовании в настоящем изобретении означает галогенидный заместитель, выбранный из группы, включающей фтор, хлор, бром или йод. Термин "C1-C6-алкил" при использовании в настоящем изобретении (включая алкильные фрагменты C1-C6-алкоксигруппы, C1-C6-алкиламиногруппы, ди-C1-C6-алкиламиногруппы, C1-C6-алкилтиогруппы и т.п.) означает разветвленные и неразветвленные алкильные фрагменты, содержащие от 1 до 6 атомов углерода, присоединенных к оставшейся части молекулы соединения в любом положении алкильной цепи. Термин "C1-C4-алкил" соответственно означает разветвленный или неразветвленный алкильный фрагмент, содержащий от 1 до 4 атомов углерода. "C1-C4-Алкил" обычно является предпочтительным. Примеры "C1-C6-алкила" включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил,трет-бутил, н-пентил, изопентил, неопентил или гексил. Если не указано иное, то определения пропила,бутила, пентила и гексила включают все возможные изомерные формы указанных групп. Так, например,пропил включает н-пропил и изопропил, бутил включает изобутил, втор-бутил и трет-бутил и т.п. Термин "C1-C6-галогеналкил" при использовании в настоящем изобретении (включая алкильные фрагменты C1-C6-галогеналкоксигруппы, C1-C6-галогеналкиламиногруппы, ди-C1-C6-галогеналкиламиногруппы, C1-C6-галогеналкилтиогруппы и т.п) означает разветвленные и неразветвленные алкильные фрагменты, содержащие от 1 до 6 атомов углерода, в которых один или большее количество атомов водорода заменены атомом галогена, выбранным из группы, включающей фтор, хлор или бром, предпочтительно фтор и хлор, особенно предпочтительно фтор. Термин "C1-C4-галогеналкил" соответственно означает разветвленные и неразветвленные алкильные фрагменты, содержащие от 1 до 4 атомов углерода, в которых один или большее количество атомов водорода заменены аналогично тому, как указано выше. C1-C4-Галогеналкил обычно является предпочтительным. Предпочтительные примеры включают CH2F, CHF2, CF3. Термин "C2-C6-алкенил" при использовании в настоящем изобретении (включая алкенильные фрагменты других радикалов) означает разветвленные и неразветвленные алкенильные группы, содержащие от 2 до 6 атомов углерода, присоединенных к оставшейся части молекулы соединения в любом положении алкенильной цепи, и содержащие по меньшей мере одну двойную связь. Термин "C2-C4-алкенил" соответственно означает разветвленные и неразветвленные алкенильные фрагменты, содержащие от 2 до 4 атомов углерода. Предпочтительными являются алкенильные фрагменты, содержащие от 2 до 4 атомов углерода. Примеры этенил или винил, пропенил, бутенил, пентенил или гексенил. Если не указано иное, то определения пропенила, бутенила, пентенила и гексенила включают все возможные изомерные формы указанных фрагментов. Так, например, пропенил включает 1-пропенил и 2-пропенил, бутенил включает 1-, 2- и 3-бутенил, 1-метил-1-пропенил, 1-метил-2-пропенил и т.п. Термин "C2-C6-алкинил" при использовании в настоящем изобретении (включая алкинильные фрагменты других радикалов) означает разветвленные и неразветвленные алкинильные группы, содержащие от 2 до 6 атомов углерода, присоединенных к оставшейся части молекулы соединения в любом положении алкенильной цепи, и содержащие по меньшей мере одну тройную связь. Термин "C2-C4-алкинил" соответственно означает разветвленные и неразветвленные алкинильные фрагменты, содержащие от 2 до 4 атомов углерода. Алкинильные фрагменты, содержащие от 2 до 4 атомов углерода, являются предпочтительными. Примеры включают этинил, пропинил, бутинил, пентинил или гексинил. Если не указано иное, то определения пропинила, бутинила, пентинила и гексинила включают все возможные изомерные формы соответствующих фрагментов. Так, например, пропинил включает 1-пропинил и 2-пропинил, бутинил включает 1-, 2- и 3-бутинил, 1-метил-1-пропинил,1-метил-2-пропинил и т.п. Термин "C3-C8-циклоалкил" при использовании в настоящем изобретении (включая циклоалкильные фрагменты других радикалов) означает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Предпочтительными являются циклические алкильные группы, содержащие от 3 до 6 атомов углерода, такие как циклопропил, циклопентил и циклогексил. Термин "C3-C8-циклоалкенил" при использовании в настоящем изобретении (включая циклоалкенильные фрагменты других радикалов) означает карбоциклические радикалы, содержащие от 3 до 8 атомов углерода и содержащие по меньшей мере одну, предпочтительно одну или две, несопряженные двойные связи. Примерами являются циклопентенил, циклопентадиенил, циклогексенил и циклогексадиенил. Термин "гетероциклил" при использовании в настоящем изобретении (включая гетероциклильные фрагменты других радикалов) означает 5-7-членные гетероциклические радикалы и 5-10-членные бициклические гетероциклические радикалы, содержащие в качестве элементов кольца 1, 2 или 3 гетероатома,выбранных из О, N и S. Гетероциклил может быть связан с молекулой через атом углерода или, если он имеется, через атом азота. Термин "гетероциклил" при использовании в настоящем изобретении включает насыщенный или частично ненасыщенный гетероциклил, а также гетероарил. Термин "насыщенный или частично ненасыщенный гетероциклил" при использовании в настоящем изобретении (включая гетероциклильные фрагменты других радикалов) означает 5-7-членные моноциклические гетероциклические радикалы, определенные выше, содержащие такое количество двойных связей, что не образуется ароматическая система, а также 5-10-членные бициклические гетероциклические радикалы, определенные выше, содержащие такое количество двойных связей, что по меньшей мере в одном из циклов не образуется ароматическая система. Примеры моноциклических насыщенных или частично ненасыщенных гетероциклилов включают пирролидин, тетрагидрофуран, тетрагидротиофен, тиазолидин, диоксолан, пиперидин, тетрагидропиран,тетрагидротиопиран, пиперазин, морфолин, тиоморфолин, оксазепан и т.п. Примеры бициклических насыщенных или частично ненасыщенных гетероциклилов включают дигидропирролизин, пирролизин, тетрагидрохинолин, тетрагидроизохинолин, тетрагидроимидазопиридин,тетрагидропиразолопиридин, бензопиран, бензодиазепин и т.п. Термин "гетероарил" при использовании в настоящем изобретении (включая гетероциклильные фрагменты других радикалов) означает 5-7-членные моноциклические гетероциклические радикалы, определенные выше, содержащие такое количество двойных связей, что образуется ароматическая система,а также 5-10-членные бициклические гетероциклические радикалы, определенные выше, содержащие такое количество двойных связей, что в обоих циклах образуется ароматическая система. Примеры моноциклических ароматических гетероциклилов включают фуран, тиазол, пиррол, тиофен, пиразол, имидазол, тиадиазол, 1,2,3-триазол, 1,2,4-триазол, тетразол, оксазол, оксадиазол, пиридин,пиридазин, пиримидин, пиразин и т.п. Примеры бициклических ароматических гетероциклилов включают пирролизин, индол, индолизин,изоиндол, индазол, пурин, хинолин, изохинолин, бензимидазол, бензофуран, бензотиазол, бензоизотиазол, пиридопиримидин, птеридин, пиримидопиримидин, имидазопиридин, пиразолопиридин и т.п. Термин "конденсированный карбоциклический или гетероциклический фрагмент" при использовании в настоящем изобретении означает C3-C8-циклоалкильные, C3-C8-циклоалкенильные, бензольные и гетероциклильные фрагменты, определенные выше, где указанные фрагменты содержат по меньшей мере одну общую связь с циклическим фрагментом, с которым они связаны. Например, бензол, сконденсированный с бензолом, означает нафталин. Предпочтительными являются конденсированные циклические фрагменты, содержащие одну общую связь с циклическим фрагментом, с которым они сконденсированы. Другим предпочтительным конденсированным фрагментом является бензол. Термин "3-8-членное кольцо, образованное двумя радикалами вместе с атомом углерода, к которому они присоединены, где указанное кольцо может содержать в качестве элементов кольца 1 или 2 гетероатома, выбранных из О, N и S" при использовании в настоящем изобретении означаетC3-C8-циклоалкильные, C3-C8-циклоалкенильные и гетероциклильные фрагменты, определенные выше. Термин "циклический амин, образованный двумя радикалами вместе с атомом азота, к которому они присоединены, где указанное кольцо может содержать в качестве элемента кольца дополнительный гетероатом, выбранный из О, N и S" при использовании в настоящем изобретении означает циклические амины, содержащие от 3 до 8, предпочтительно 5 или 6 элементов кольца. Примерами таких образовавшихся аминов являются пирролидин, пиперидин, пиперазин, морфолин, пиррол, имидазол и т.п. Термины "гетероциклил-C1-C6-алкил", "C3-C8-циклоалкил-C1-C6-алкил", "фенил-C1-C6-алкил" и"нафтил-C1-C6-алкил" при использовании в настоящем изобретении означают алкильные фрагменты,определенные выше, содержащие от 1 до 6 атомов углерода, в которых любой из атомов водорода заменен циклическим фрагментом, определенным выше. В этих терминах алкильный фрагмент предпочтительно содержит от 1 до 4 атомов углерода (C1-C4-алкил). Более предпочтительным алкильным фрагментом является метил или этил, и наиболее предпочтительным является метил. Предпочтительными примерами фенил-C1-C6-алкила являются бензил или фенетил. Термины "гетероциклил-C2-C6-алкенил", "C3-C8-циклоалкил-C2-C6-алкенил", "фенил-C2-C6-алкенил" и "нафтил-C2-C6-алкенил" при использовании в настоящем изобретении означают алкенильные фрагменты, определенные выше, содержащие от 2 до 6 атомов углерода, в которых любой из атомов водорода заменен циклическим фрагментом, определенным выше. В этих терминах алкенильный фрагмент предпочтительно содержит от 2 до 4 атомов углерода (C2-C4-алкенил). Более предпочтительным алкенильным фрагментом является этенил. Предпочтительным примером фенил-C2-C6-алкенила является фенетинил. Конкретные и предпочтительные определения, приведенные ниже в настоящем изобретении для отдельных радикалов и фрагментов Ra, Rb, Rc, Rd, Y1, Y2, Y3, Y4, Y5, Z, R1, R2, n и R3, используются по отдельности, а также в комбинации. Следует понимать, что предпочтительными являются соединения формулы (Ia) или (Ib), в которых один или большее количество отдельных радикалов и фрагментов Ra,Rb, Rc, Rd, Y1, Y2, Y3, Y4, Y5, Z, R1, R2, n и R3 обладают одним из значений, указанных ниже в настоящем изобретении в качестве предпочтительных, и в которой остальные радикалы и фрагменты являются такими, как указано выше в настоящем изобретении. Наиболее предпочтительными являются соединения формулы (Ia) или (Ib), в которых все отдельные радикалы и фрагменты Ra, Rb, Rc, Rd, Y1, Y2, Y3, Y4, Y5, Z,R1, R2, n и R3 обладают одним из значений, указанных ниже в настоящем изобретении в качестве предпочтительных. В одном предпочтительном варианте осуществления настоящее изобретение относится к пиразолам формулы (Ia), в которой отдельные фрагменты обладают одним из значений, приведенных в описании. Предпочтительными являются соединения формулы (Ia), в которой отдельные фрагменты обладают одним из предпочтительных значений, приведенных в описании. В другом предпочтительном варианте осуществления настоящее изобретение относится к пиразолам формулы (Ib), в которой отдельные фрагменты обладают одним из значений, приведенных в описании. Предпочтительными являются соединения формулы (Ib), в которых отдельные фрагменты обладают одним из предпочтительных значений, приведенных в описании. Предпочтительными являются пиразолы формулы (Ia) или (Ib), в которых Ra и Rb независимо выбраны из группы, включающей водород, C1-C6-алкил, C1-C6-галогеналкил и C3-C8-циклоалкил. Особенно предпочтительными являются пиразолы формулы (Ia) или (Ib), в которых Ra и Rb, оба,обозначают водород. Предпочтительными также являются пиразолы формулы (Ia) или (Ib), в которых Rc и Rd независимо выбраны из группы, включающей водород, C1-C6-алкил, C1-C6-галогеналкил и C3-C8-циклоалкил. Особенно предпочтительными являются пиразолы формулы (Ia) или (Ib), в которых Rc и Rd, оба,обозначают водород. Предпочтительными также являются пиразолы формулы (Ia) или (Ib), в которых Y1 обозначает CRy1 или N, в которых Ry1 имеет одно из значений, указанных для Ry. Более предпочтительными являются пиразолы формулы (Ia) или (Ib), в которых Y1 обозначает CRy1,предпочтительно в которых Ry1 выбран из группы, включающей Н, C1-C6-алкил, C1-C6-алкокси-C1-C6 алкил и C1-C6-галогеналкил. Предпочтительными также являются пиразолы формулы (Ia) или (Ib), в которых Y2 обозначает-8 022559 друг от друга имеют одно из значений, указанных для Ry. Более предпочтительными являются пиразолы формулы (Ia) или (Ib), в которых Y2 обозначает CRy2,3Y обозначает CRy3, Y4 обозначает CRy4 и Y5 обозначает CRy5, где Ry2, Ry3, Ry4 и Ry5 независимо друг от друга имеют одно из значений, указанных для Ry, предпочтительно в которых Ry2, Ry3, Ry4 и Ry5 независимо выбраны из группы, включающей Н, галоген, C1-C6-алкоксигруппу, C1-C6-алкокси-C1-C6 алкоксигруппу и C1-C6-галогеналкоксигруппу. В одном предпочтительном варианте осуществления настоящее изобретение относится к пиразолам формулы (Ia) или (Ib), в которых Z обозначает O и остальные фрагменты имеют одно из значений, приведенных в описании, предпочтительно одним из предпочтительных значений, приведенных в описании. В другом предпочтительном варианте осуществления настоящее изобретение относится к пиразолам формулы (Ia) или (Ib), в которых Z обозначает S и остальные фрагменты имеют одно из значений,приведенных в описании, предпочтительно одним из предпочтительных значений, приведенных в описании. В другом предпочтительном варианте осуществления настоящее изобретение относится к пиразолам формулы (Ia) или (Ib), в которых Z обозначает NRz, где Rz обозначает Н, C1-C6-алкил или бензил, и остальные фрагменты имеют одно из значений, приведенных в описании, предпочтительно одним из предпочтительных значений, приведенных в описании. Предпочтительными также являются пиразолы формулы (Ia) или (Ib), в которых R1 и R2 независимо друг от друга выбраны из группы, включающей Н, C1-C6-алкил, C3-C8-циклоалкил, фенил и нафтил. Более предпочтительными являются пиразолы формулы (Ia) или (Ib), в которых R1 и R2 независимо друг от друга выбраны из группы, включающей Н, C1-C4-алкил, C3-C6-циклоалкил и фенил. Особенно предпочтительными являются пиразолы формулы (Ia) или (Ib), в которых R1 и R2 выбраны из C1-C4-алкила. Предпочтительными также являются пиразолы формулы (Ia) или (Ib), в которых n равно 0, 1, 2 или 3, предпочтительно в которых n равно 0 или 1. Предпочтительными также являются пиразолы формулы (Ia) или (Ib), в которых R3, если присутствуют, независимо выбраны из группы, включающей галоген, C1-C6-алкоксигруппу иC1-C6-галогеналкоксигруппу. Более предпочтительными являются пиразолы формулы (Ia) или (Ib), в которых R3, если присутствуют, независимо выбраны из галогена, предпочтительно из F, Cl и Br. В одном предпочтительном варианте осуществления настоящее изобретение относится к пиразолам, выбранным из соединений формулы (Ia') в которой Z, R1, R2, R3, Ry1, Ry2, Ry3, Ry4 и Ry5 имеют одно из приведенных выше значений и n равно 0 или 1. Более предпочтительными являются пиразолы (Ia'), в которых один из фрагментов Z, R1, R2, R3, Ry1,y2R , Ry3, Ry4 и Ry5 обладает приведенными выше предпочтительными значениями. В другом предпочтительном варианте осуществления настоящее изобретение относится к пиразолам, выбранным из соединений формулы (Ib') в которой Z, R1, R2, R3, Ry1, Ry2, Ry3, Ry4 и Ry5 имеют одно из приведенных выше значений. Более предпочтительными являются пиразолы (Ib'), в которых один из фрагментов Z, R1, R2, R3, Ry1,y2R , Ry3, Ry4 и Ry5 обладает приведенными выше предпочтительными значениями. В другом варианте осуществления настоящее изобретение относится к соединениям формулы (Ia) или (Ib), и эти соединения формулы (Ia) или (Ib) содержатся в виде отдельных оптических изомеров,смесей отдельных энантиомеров или рацематов, предпочтительно в виде энантиомерно чистых соединений. В другом варианте осуществления настоящее изобретение относится к соединениям формулы (Ia) или (Ib), и эти соединения формулы (Ia) или (Ib) содержатся в виде солей присоединения с фармакологически приемлемыми кислотами, а также необязательно в виде сольватов и/или гидратов. Получение Соединения, предлагаемые в настоящем изобретении, можно получить по методикам синтеза, которые известны специалисту в данной области техники и описаны в литературе по органическому синтезу. Эти соединения предпочтительно получают по методикам, аналогичным методикам получения, более подробно описанным ниже в настоящем изобретении, предпочтительно описанным в экспериментальном разделе. Соединения формулы (Ia), предлагаемые в настоящем изобретении, можно получить в соответствии со схемой 1. Схема 1 В соответствии со схемой 1 соединения предлагаемые в настоящем изобретении, можно получить с использованием в качестве исходных веществ I производных (1H-пиразол-4-ил)уксусной кислоты, которые содержат в качестве заместителей Ra, Rb, R1, R2, а также содержат защитную группу карбоксигруппыPG. В некоторых случаях эти соединения можно приобрести у поставщиков или их можно получить по методикам, описанным в литературе, например в WO 2007/141267. Подходящие защитные группы описаны в публикации Т.W. Greene, Protective Groups in Organic Synthesis, Wiley, 3rd edition, 1999. Предпочтительными защитными группами PG являются метил, этил, трет-бутил. Промежуточный продукт I можно получить алкилированием исходного вещества I подходящими,содержащими 4-нитробензильную группу соединениями, использующимися в качестве исходного вещества II, в которых LG обозначает подходящую отщепляющуюся группу, такую как галоген, предпочтительно Br, или мезилат, в присутствии основания. Подходящими основаниями являются неорганические основания, такие как карбонаты, предпочтительно карбонат калия. Реакцию предпочтительно проводят в органическом растворителе, таком как диметилформамид, диметилсульфоксид, ацетонитрил, тетрагидрофуран, дихлорметан, или в смеси растворителей. Реакцию обычно проводят в течение от 1 до 48 ч. Предпочтительная температура проведения реакции составляет от 0 С до температуры кипения реакционной смеси. Если R1 отличается от R2, то реакция алкилирования может привести к получению смеси региоизомеров. Отдельные изомеры можно выделить по методикам, которые известны специалисту в данной области техники, например с помощью хроматографии на силикагеле с использованием подходящего растворителя или смеси растворителей или препаративной хроматографии с обращенной фазой с использованием подходящих растворителей в градиентном режиме, или растиранием или кристаллизацией из подходящих растворителей или смеси растворителей. Промежуточный амин II можно получить из промежуточного продукта I восстановлением нитрогруппы, например путем гидрогенолиза в присутствии катализатора, такого как палладий на угле или никель Ренея. Реакцию предпочтительно проводят в инертном органическом растворителе, таком как метанол, этанол, уксусная кислота, этилацетат, или в смеси растворителей. Реакцию обычно проводят в течение от 1 до 48 ч. Предпочтительная температура проведения реакции составляет от 0 до 50 С. Предпочтительное давление, при котором проводят реакцию, находится в диапазоне от атмосферного давления до 100 бар. Восстановление нитрогруппы промежуточного продукта I также можно провести по альтернативным методикам, описанным в публикации J. March, Advanced Organic Chemistry, Wiley, 4th edition, 1992, p. 1216-1217. Промежуточный амид III можно получить из промежуточного амина II по реакции сочетания с карбоновой кислотой (исходное вещество III) в присутствии реагента сочетания, такого как 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийтетрафторборат (TBTU), и основания, такого как диизопропилэтиламин. Реакцию предпочтительно проводят в инертном органическом растворителе, таком как диметилформамид, тетрагидрофуран, дихлорметан, или в смеси растворителей. Реакцию обычно проводят в течение от 1 до 48 ч. Предпочтительная температура проведения реакции составляет от 0 до 30 С. Реакцию сочетания карбоновой кислоты с содержащим аминогруппу промежуточным продуктом II также можно провести по альтернативным методикам, описанным в публикации J. March, AdvancedOrganic Chemistry, Wiley, 4th edition, 1992, p. 419-421. Альтернативно, вместо карбоновой кислоты (исходное вещество III) и реагента сочетания можно использовать соответствующий ацилхлорид или ангидрид кислоты. Соединения формулы (Ia) можно получить из промежуточного продукта III путем удаления защитной группы PG. В случае, если гидроксикарбонильная группа защищена с помощью CH3 или C2H5, это превращение можно провести в водной среде в присутствии неорганического основания, такого какNaOH или LiOH. Реакцию предпочтительно проводят в воде или в смеси воды и CH3OH, C2H5OH, тетрагидрофурана или диоксана. Реакцию обычно проводят в течение от 1 до 48 ч. Предпочтительная температура проведения реакции составляет от 0 С до температуры кипения реакционной смеси. В случае,если PG представляет собой трет-бутил, удаление защитной группы можно провести в кислой среде, например с использованием трифторуксусной кислоты, хлористо-водородной кислоты или монтмориллонита. В случае использования трифторуксусной кислоты реакцию можно провести в неразбавленной трифторуксусной кислоте или в инертном растворителе, таком как дихлорметан. Реакцию обычно проводят в течение от 1 до 48 ч. Предпочтительная температура проведения реакции составляет от 0 до 30 С. Отщепление защитной группы PG также можно провести по альтернативным методикам, описанным в публикации J. March, Advanced Organic Chemistry, Wiley, 4th edition, 1992, p. 378-383 или в публикации Т.W. Greene, Protective Groups in Organic Synthesis, Wiley, 3rd edition, 1999. Соединения формулы (Ib) можно получить по методике, описанной на схеме I, с использованием вместо исходного вещества III исходного вещества формулы III', в которойY1, Y2, Y3, Y4, Y5 и Z обладают одним из указанных выше значений. Показания Соединения формулы (Ia) или (Ib), предлагаемые в настоящем изобретении, являются особенно подходящими для приготовления лекарственного средства, предназначенного для предупреждения и/или лечения заболеваний, при которых играет роль активность рецептора CRTH2. Один вариант осуществления настоящего изобретения относится к приготовлению лекарственного средства, предназначенного для предупреждения и/или лечения самых различных воспалительных, инфекционных и иммунорегуляторных нарушений, заболеваний или патологических состояний дыхательных путей или желудочно-кишечного тракта, воспалительных заболеваний суставов и аллергических заболеваний носоглотки, глаз и кожи. Такие нарушения, заболевания и патологические состояния включают астму и аллергические заболевания, эозинофильные заболевания, хроническое обструктивное заболевание легких, инфицирование патогенными микробами (которые по определению включают вирусы), а также аутоиммунные патологии, такие как ревматоидный артрит и атеросклероз. Предпочтительным является приготовление лекарственного средства, предназначенного для предупреждения и/или лечения воспалительных или аллергических заболеваний и патологических состояний,включая аллергический или неаллергический ринит или синусит, хронический синусит или ринит, назальный полипоз, хронический риносинусит, острый риносинусит, астму, астму у детей, аллергический бронхит, альвеолит, болезнь фермера, гиперреактивность дыхательных путей, аллергический конъюнктивит, бронхит или пневмонит, вызванный инфекцией, например бактериями или вирусами, или гель- 11022559 минтами, или грибками, или простейшими, или другими патогенными микроорганизмами, бронхоэктаз,респираторный дистресс-синдром у взрослых, отек бронхов и легких, бронхит или пневмонит, или интерстициальный пневмонит различной этиологии, например, вызванный аспирацией, вдыханием токсичных газов, паров, бронхит или пневмонит, или интерстициальный пневмонит, вызванный сердечной недостаточностью, рентгеновским излучением, радиоактивным излучением, химиотерапией, бронхит или пневмонит, или интерстициальный пневмонит, связанный с коллагенозом, например, красную волчанку,системную склеродермию, фиброз легких, идиопатический фиброз легких (IPF), интерстициальные заболевания легких или интерстициальный пневмонит различной этиологии, включая асбестоз, силикоз, болезнь Бека или саркоидоз, гранулематоз, кистозный фиброз или муковисцидоз, или 1-антитрипсиновую недостаточность, эозинофильный целлюлит (например, синдром Велла), эозинофильные пневмонии (например, синдром Леффлера, хроническая эозинофильная пневмония), атонический фасциит (например,синдром Шульмана), гиперчувствительность замедленного типа, неаллергическую астму; вызванный физической нагрузкой бронхостеноз; хроническое обструктивное заболевание легких (ХОЗЛ), острый бронхит, хронический бронхит, кашель, эмфизему легких; общую анафилактическую реакцию или реакции гиперчувствительности, лекарственные аллергии (например, на пенициллин, цефалоспорин), эозинофильную миалгию, вызванную потреблением загрязненного триптофана, аллергические реакции на укус насекомого; аутоиммунные заболевания, такие как ревматоидный артрит, псориатический артрит,рассеянный склероз, системная красная волчанка, злокачественная миастения, иммунная тромбоцитопения (ITP взрослых, тромбоцитопения новорожденных, ITP у детей), иммунная гемолитическая анемия(аутоиммунная и вызванная лекарственным средством), синдром Эванса (тромбоцитарная и эритроцитарная иммунные цитопении), гемолитическая анемия новорожденных с Rhg-фенотипом, синдром Гудпасчера (отложение антител к базальной мембране клубочков почек), заболевания брюшной полости,аутоиммунная кардиомиопатия, юношеский диабет; гломерулонефрит, аутоиммунный тиреоидит, болезнь Бехчета; отторжение трансплантата (например, при трансплантации), включая отторжение аллотрансплантата или реакцию "трансплантант против хозяина"; воспалительные заболевания кишечника,такие как болезнь Крона и язвенный колит; спондилоартропатию; склеродермию; псориаз (включая опосредуемый Т-клетками псориаз) и воспалительные дерматозы, такие как дерматит, экзема, атопический дерматит, аллергический контактный дерматит, уртикария; васкулит (например, некротический, кожный и аллергический васкулит); нодозную эритему; эозинофильный миозит, атонический фасциит, раковые заболевания с инфильтрацией лейкоцитов в кожу или органы. Способ лечения Соответственно, соединения формулы (Ia) или (Ib), предлагаемые в настоящем изобретении, применимы для предупреждения и/или лечения самых различных воспалительных, инфекционных и иммунорегуляторных нарушений и заболеваний. Такие нарушения и заболевания включают, но не ограничиваются только ими, астму и аллергические заболевания, хроническое обструктивное заболевание легких,инфицирование патогенными микробами (которые по определению включают инфицирование патогенными микробами (которые по определению включают вирусы), аутоиммунные патологии, такие как ревматоидный артрит и атеросклероз. Например, соединение формулы (Ia) или (Ib), предлагаемое в настоящем изобретении, которое ингибирует одну или большее количество функций рецептора CRTH2 млекопитающих (например, рецептора CRTH2 человека), можно вводить для ингибирования (т.е. ослабления или предупреждения) воспаления и бронхостеноза. В результате подавляется один или большее количество воспалительных процессов, таких как эмиграция лейкоцитов, адгезия, хемотаксис, экзоцитоз (например, ферментов, факторов роста, гистамина, цитотоксических белков), высвобождение воспалительного медиатора, выживание или пролиферация экспрессирующих CRTH2 клеток. Например, способом, предлагаемым в настоящем изобретении, можно подавить активацию или рекрутмент клеток Th2, мастоцитов, базофилов и эозинофилов в центрах воспаления (например, при астме или аллергическом рините). В частности, по данным указанных выше исследований соединения, указанные в приведенных ниже примерах, обладают активностью, обеспечивающей блокирование активации и миграции клеток, экспрессирующих рецептор CRTH2 с использованием соответствующих агонистов CRTH2. Заболевания и патологические состояния у людей, которые можно лечить с помощью ингибиторов функции рецептора CRTH2, включают, но не ограничиваются только ими, воспалительные или аллергические заболевания и патологические состояния, включая аллергический или неаллергический ринит или синусит, хронический синусит или ринит, назальный полипоз, хронический риносинусит, острый риносинусит, астму, астму у детей, аллергический бронхит, альвеолит, болезнь фермера, гиперреактивность дыхательных путей, аллергический конъюнктивит, бронхит или пневмонит, вызванный инфекцией, например бактериями или вирусами, или гельминтами, или грибками, или простейшими, или другими патогенными микроорганизмами, бронхоэктаз, респираторный дистресс-синдром у взрослых, отек бронхов и легких, бронхит или пневмонит, или интерстициальный пневмонит различной этиологии, например,вызванный аспирацией, вдыханием токсичных газов, паров, бронхит или пневмонит, или интерстициальный пневмонит, вызванный сердечной недостаточностью, рентгеновским излучением, радиоактивным излучением, химиотерапией, бронхит или пневмонит, или интерстициальный пневмонит, связанный с коллагенозом, например, красную волчанку, системную склеродермию, фиброз легких, идиопатический фиброз легких (IPF), интерстициальные заболевания легких или интерстициальный пневмонит различной этиологии, включая асбестоз, силикоз, болезнь Бека или саркоидоз, гранулематоз, кистозный фиброз или муковисцидоз, или 1-антитрипсиновую недостаточность, эозинофильный целлюлит (например, синдром Велла), эозинофильные пневмонии (например, синдром Леффлера, хроническая эозинофильная пневмония), атонический фасциит (например, синдром Шульмана), гиперчувствительность замедленного типа, неаллергическую астму; вызванный физической нагрузкой бронхостеноз; хроническое обструктивное заболевание легких (ХОЗЛ), острый бронхит, хронический бронхит, кашель, эмфизему легких; общую анафилактическую реакцию или реакции гиперчувствительности, лекарственные аллергии (например, на пенициллин, цефалоспорин), эозинофильную миалгию, вызванную потреблением загрязненного триптофана, аллергические реакции на укус насекомого; аутоиммунные заболевания, такие как ревматоидный артрит, псориатический артрит, рассеянный склероз, системная красная волчанка,злокачественная миастения, иммунная тромбоцитопения (ITP взрослых, тромбоцитопения новорожденных, ITP у детей), иммунная гемолитическая анемия (аутоиммунная и вызванная лекарственным средством), синдром Эванса (тромбоцитарная и эритроцитарная иммунные цитопении), гемолитическая анемия новорожденных с Rhg-фенотипом, синдром Гудпасчера (отложение антител к базальной мембране клубочков почек), заболевания брюшной полости, аутоиммунная кардиомиопатия, юношеский диабет; гломерулонефрит, аутоиммунный тиреоидит, болезнь Бехчета; отторжение трансплантата (например, при трансплантации), включая отторжение аллотрансплантата или реакцию "трансплантант против хозяина"; воспалительные заболевания кишечника, такие как болезнь Крона и язвенный колит; спондилоартропатию; склеродермию; псориаз (включая опосредуемый Т-клетками псориаз) и воспалительные дерматозы,такие как дерматит, экзема, атопический дерматит, аллергический контактный дерматит, уртикария; васкулит (например, некротический, кожный и аллергический васкулит); нодозную эритему; эозинофильный миозит, атонический фасциит, раковые заболевания с инфильтрацией лейкоцитов в кожу или органы. Комбинации Соединения формулы (Ia) или (Ib), предлагаемые в настоящем изобретении, можно использовать по отдельности или в комбинации с другими соединениями формулы (Ia) или (Ib). Соединения формулы (Ia) или (Ib) также необязательно можно объединять с другими фармакологически активными веществами. Такие фармакологически активные вещества, использующиеся в фармацевтической композиции,содержащей соединения формулы (Ia) или (Ib), предлагаемые в настоящем изобретении, могут быть выбраны из классов, включающих, но не ограничивающихся только ими, агонисты 2-адренорецептора(бета-миметики кратковременного и длительного действия), антихолинергетики (кратковременного и длительного действия), противовоспалительные стероиды (кортикостероиды для перорального и местного введения), диссоциированные глюкокортикоидмиметики, ингибиторы PDE3, ингибиторы PDE4, ингибиторы PDE7, антагонисты LTD4, ингибиторы EGFR, антагонисты PAF, производные липоксина А 4,модуляторы FPRL1, антагонисты рецептора LTB4 (BLT1, BLT2), антагонисты гистаминового рецептора,ингибиторы киназы PI3, ингибиторы нерецепторных тирозинкиназ, таких как, например, LYN, LCK,SYK, ZAP-70, FYN, BTK или ITK, ингибиторы киназ MAP, таких как, например, р 38, ERK1, ERK2,JNK1, JNK2, JNK3 или SAP, ингибиторы сигнального пути NF-В, такие как, например, ингибиторы киназы IKK2, ингибиторы iNOS, ингибиторы MRP4, ингибиторы биосинтеза лейкотриена, такие как, например, ингибиторы 5-липоксигеназы (5-LO), ингибиторы cPLA2, ингибиторы лейкотриен-А 4 гидролазы или ингибиторы FLAP, нестероидные противовоспалительные средства (НСПВС), модуляторы рецептора DPI, антагонисты тромбоксанового рецептора, антагонисты CCR1, антагонисты CCR2, антагонисты CCR3, антагонисты CCR4, антагонисты CCR5, антагонисты CCR6, антагонисты CCR7, антагонисты CCR8, антагонисты CCR9, антагонисты CCR10, антагонисты CXCR1, антагонисты CXCR2, антагонисты CXCR3, антагонисты CXCR4, антагонисты CXCR5, антагонисты CXCR6, антагонистыCX3CR1, антагонисты нейрокинина (NK1, NK2), модуляторы сфингозин-1-фосфатного рецептора, ингибиторы сфингозин-1-фосфатлиазы, модуляторы аденозинового рецептора, такие как, например, агонисты А 2 а, модуляторы пуринергических рецепторов, такие как, например, ингибиторы Р 2 Х 7, активаторы гистондезацетилазы (HDAC), антагонисты брадикинина (BK1, BK2), ингибиторы ТАСЕ, модуляторы PPARгамма, ингибиторы киназы Rho, ингибиторы интерлейкин 1-бета-конвертирующего фермента (ICE), модуляторы Toll-подобного рецептора (TLR), ингибиторы HMG-CoA редуктазы, антагонисты VLA-4, ингибиторы ICAM-1, агонисты SHIP, антагонист рецептора GABAa, ингибиторы ENaC, модуляторы меланокортинового рецептора (MC1R, MC2R, MC3R, MC4R, MC5R), антагонисты CGRP, антагонисты эндотелина, мукорегуляторы, иммунотерапевтические средства, соединения, препятствующие отеку дыхательных путей, противокашлевые соединения, агонисты СВ 2, ретиноиды, иммуносупрессивные средства, стабилизаторы мастоцитов, метилксантин, агонисты опиоидного рецептора, слабительные средства,противовспенивающие агенты, противоспазматические средства, агонисты 5-НТ 4, а также комбинации двух или трех активных веществ. Предпочтительными являются комбинации двух или трех активных веществ, т.е. антагонистыCCR3 или антагонистами LTD4; антагонисты CRTH2 с антихолинергетиками и бета-миметиками, кортикостероидами, ингибиторами PDE4, антагонистами CCR3 или антагонистами LTD4; антагонисты CRTH2 с кортикостероидами и ингибиторами PDE4, антагонистами CCR3 или антагонистами LTD4; антагонисты CRTH2 с ингибиторами PDE4 и антагонистами CCR3 или антагонистами LTD4. В фармацевтических композициях, предлагаемых в настоящем изобретении, в зависимости от конкретного соединения антагонисты CRTH2 формулы (Ia) или (Ib) могут содержаться в форме, выбранной из группы, включающей таутомеры, оптические изомеры, энантиомеры, рацематы, диастереоизомеры,фармакологически приемлемые соли присоединения с кислотами, сольваты или гидраты, если такие формы существуют. Фармацевтические композиции, включающие одно или большее количество, предпочтительно одно соединение 1 в форме в основном чистого энантиомера, являются предпочтительными. В фармацевтических композициях, предлагаемых в настоящем изобретении, может содержаться более одного антагониста CRTH2 формулы (Ia) или (Ib) и более одного дополнительного фармакологически активного соединения. Фармацевтические формы Препараты, подходящие для введения соединений формулы (Ia) или (Ib), включают, например, таблетки, капсулы, суппозитории, растворы и порошки и т.п. Содержание фармацевтически активного соединения (соединений) должно находиться в диапазоне от 0,05 до 90 мас.%, предпочтительно от 0,1 до 50 мас.% в пересчете на композицию в целом. Подходящие таблетки можно изготовить, например, путем смешивания активного вещества (веществ) с известными инертными наполнителями, например инертными разбавителями, такими как карбонат кальция, фосфат кальция или лактоза, разрыхлителями, такими как кукурузный крахмал или альгиновая кислота, связующими, такими как крахмал или желатин, смазывающими веществами, такими как стеарат магния или тальк, и/или агентами для замедления высвобождения, такими как карбоксиметилцеллюлоза, ацетат-фталат целлюлозы или поливинилацетат. Таблетки также могут содержать несколько слоев. Таблетки с покрытием можно изготовить путем нанесения на ядра, полученные аналогично таблеткам, покрытия из веществ, обычно использующихся для нанесения на таблетки, например, коллидона или шеллака, гуммиарабика, талька, диоксида титана или сахара. Для обеспечения замедленного высвобождения или предупреждения несовместимости ядро также может состоять из нескольких слоев. Аналогичным образом, покрытие таблетки также может состоять из ряда слоев, обеспечивающих замедленное высвобождение, возможно, с включением инертных наполнителей, указанных выше для таблеток. Сиропы или эликсиры, содержащие активные вещества или их комбинации, предлагаемые в настоящем изобретении, могут дополнительно содержать подсластитель, такой как сахарин, цикламат, глицерин или сахар, и усилитель вкуса, например ароматизатор, такой как ванилин или апельсиновый экстракт. Они также могут содержать суспендирующие вспомогательные вещества или загустители, такие как натриевая соль карбоксиметилцеллюлозы, смачивающие агенты, такие как, например, продукты конденсации жирных спиртов с этиленоксидом, или консерванты, такие как п-гидроксибензоаты. Растворы готовят обычным образом, например путем добавления изотонических агентов, консервантов, таких как п-гидроксибензоаты, или стабилизаторов, таких как соли щелочных металлов этилендиаминтетрауксусной кислоты, необязательно с использованием эмульгаторов и/или диспергирующих агентов и при использовании воды в качестве разбавителя, например, органические растворители необязательно можно использовать в качестве солюбилизаторов или средств, способствующих растворению, и растворы можно помещать во флаконы или ампулы для инъекций или в бутыли для вливания. Капсулы, содержащие одно или большее количество активных веществ или комбинации активных веществ, можно изготовить, например, путем смешивания активных веществ с инертными носителями,такими как лактоза или сорбит, и их помещения в капсулы из желатина. Подходящие суппозитории можно изготовить, например, путем смешивания с носителями, предназначенным для этой цели, такими как нейтральные жиры или полиэтиленгликоль или его производные. Инертные наполнители, которые можно использовать, включают, но не ограничиваются только ими, воду, фармацевтически приемлемые органические растворители, такие как парафины (например,фракции нефти), растительные масла (например, арахисовое или кунжутное масло), одно- или многоатомные спирты (например, этанол или глицерин), носители, такие как, например, порошкообразные природные минералы (например, каолины, глины, тальк, мел), порошкообразные синтетические минералы (например, высокодисперсная кремниевая кислота и силикаты), сахара (например, тростниковый са- 14022559 хар, лактоза и глюкоза), эмульгаторы (например, лигнин, отработанные сульфитные щелоки, метилцеллюлоза, крахмал и поливинилпирролидон) и смазывающие вещества (например, стеарат магния, тальк,стеариновая кислота и лаурилсульфат натрия). Разумеется, в случае перорального введения наряду с указанными выше носителями таблетки могут содержать добавки, такие как цитрат натрия, карбонат кальция и дикальцийфосфат совместно с различными добавками, такими как крахмал, предпочтительно картофельный крахмал, желатин и т.п. Кроме того, для изготовления таблеток одновременно можно использовать смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. В случае водных суспензий в дополнение к указанным выше инертным наполнителям активные вещества можно объединять с различными усилителями вкуса и красителями. Соединения формулы (Ia) или (Ib) также можно вводить в качестве препаратов или фармацевтических композиций, пригодных для ингаляции. Препараты для ингаляции включают порошки для ингаляции, содержащие пропеллент дозирующие аэрозоли или растворы для ингаляции без пропеллента. В объеме настоящего изобретения термин "растворы для ингаляции без пропеллента" также включает концентраты или стерильные, готовые к применению растворы для ингаляции. Препараты, которые можно использовать в контексте настоящего изобретения, более подробно описаны в последующей части изобретения. Порошки для ингаляции, которые можно использовать в контексте настоящего изобретения, могут содержать соединение формулы (Ia) или (Ib) в чистом виде или в смеси с подходящими физиологически приемлемыми инертными наполнителями. Если активные соединения (Ia) или (Ib) содержатся в смеси с физиологически приемлемыми инертными наполнителями, то для приготовления порошков для ингаляции, предлагаемых в настоящем изобретении, можно использовать следующие физиологически приемлемые инертные наполнители: моносахариды (например, глюкоза или арабиноза), дисахариды (например, лактоза, сахароза, мальтоза),олиго- и полисахариды (например, декстраны), многоатомные спирты (например, сорбит, маннит,ксилит), соли (например, хлорид натрия, карбонат кальция) или смеси этих инертных наполнителей. Предпочтительно использовать моно- или дисахариды, но особенно предпочтительно использовать лактозу или глюкозу, предпочтительно, но не исключительно, в виде их гидратов. Для задач настоящего изобретения особенно предпочтительным инертным наполнителем является лактоза и моногидрат лактозы является наиболее предпочтительным. В порошках для ингаляции, предлагаемых в настоящем изобретении, инертные наполнители обладают частицами с максимальным размером до 250 мкм, предпочтительно от 10 до 150 мкм, наиболее предпочтительно от 15 до 80 мкм. Иногда может оказаться целесообразным добавлять к указанному выше инертному наполнителю более мелкодисперсные фракции инертного наполнителя, обладающие частицами со средним размером от 1 до 9 мкм. Эти более мелкодисперсные инертные наполнители также выбраны из группы возможных инертных наполнителей, перечисленных выше в настоящем изобретении. Кроме того, для приготовления порошков для ингаляции, предлагаемых в настоящем изобретении, к смеси инертных наполнителей добавляют микронизированное активное вещество 1, предпочтительно обладающее частицами со средним размером от 0,5 до 10 мм, более предпочтительно от 1 до 5 мм. Методики приготовления порошков для ингаляции, предлагаемых в настоящем изобретении, путем размола и микронизации с заключительным смешиванием ингредиентов известны из предшествующего уровня техники. Порошки для ингаляции, предлагаемые в настоящем изобретении, можно вводить с помощью ингаляторов, известных из предшествующего уровня техники. Аэрозоли для ингаляции, содержащие газообразный пропеллент, предлагаемые в настоящем изобретении, могут содержать соединения формулы (Ia) или (Ib), растворенные в газообразном пропелленте или в диспергированной форме. Соединения формулы (Ia) или (Ib) могут содержаться в отдельных препаратах или в общем препарате, в котором соединения формулы (Ia) или (Ib) оба растворены, оба диспергированы или в каждом случае только один компонент растворен и другой диспергирован. Газообразные пропелленты, которые можно использовать для приготовления аэрозолей для ингаляции, известны из предшествующего уровня техники. Подходящие газообразные пропелленты выбраны из группы,включающей углеводороды, такие как н-пропан, н-бутан или изобутан, и галогенированные углеводороды, такие как фторированные производные метана, этана, пропана, бутана, циклопропана или циклобутана. Указанные выше газообразные пропелленты можно использовать в чистом виде или в смесях друг с другом. Особенно предпочтительными газообразными пропеллентами являются галогенированные производные алканов, выбранные из группы, включающей TG134a и TG227 и их смеси. Приводимые в действие пропеллентом аэрозоли для ингаляции также могут содержать другие ингредиенты, такие как сорастворители, стабилизаторы, поверхностно-активные вещества, антиоксиданты,смазывающие вещества и регуляторы рН. Все эти ингредиенты известны в данной области техники. Приводимые в действие пропеллентом аэрозоли для ингаляции, предлагаемые в настоящем изобретении, указанные выше, можно вводить с использованием ингаляторов, известных в данной области техники (МДИ = мерные дозирующие ингаляторы). Кроме того, активные соединения формулы (Ia) или (Ib), предлагаемые в настоящем изобретении,можно вводить в форме растворов и суспензий для ингаляции без пропеллента. Использующийся растворитель может быть водным или спиртовым, предпочтительно использовать этанольный раствор. Растворителем может быть чистая вода или смесь воды и этанола. Относительное содержание этанола по сравнению с содержанием воды не ограничивается, но максимальное предпочтительно составляет до 70 об.%, более предпочтительно до 60 об.% и еще более предпочтительно до 30 об.%. Остальной объем составляет вода. Значение рН растворов или суспензий, содержащих соединение формулы (I), доводят до равного от 2 до 7, предпочтительно от 2 до 5 с помощью подходящих кислот. Значение рН можно установить с использованием кислот, выбранных из числа неорганических или органических кислот. Примеры особенно подходящих неорганических кислот включают хлористо-водородную кислоту, бромистоводородную кислоту, азотную кислоту, серную кислоту и/или фосфорную кислоту. Примеры особенно подходящих органических кислот включают аскорбиновую кислоту, лимонную кислоту, яблочную кислоту, винную кислоту, малеиновую кислоту, янтарную кислоту, фумаровую кислоту, уксусную кислоту,муравьиную кислоту и/или припионовую кислоту и т.п. Предпочтительными неорганическими кислотами являются хлористо-водородная и серная кислоты. Также можно использовать кислоты, которые уже образовали соль присоединения с кислотой одного из активных веществ. Из органических кислот предпочтительными являются аскорбиновая кислота, фумаровая кислота и лимонная кислота. При необходимости можно использовать смеси указанных выше кислот, в особенности в случае кислот, которые в дополнение к способности подкислять обладают другими характеристиками, например являются вкусовыми добавками, антиоксидантами или комплексообразующими реагентами, такие как, например, лимонная кислота или аскорбиновая кислота. В контексте настоящего изобретения для регулирования рН особенно предпочтительно использовать хлористо-водородную кислоту. При необходимости для этих препаратов можно исключить добавление этилендиаминтетрауксусной кислоты (ЭДТК) или одной из ее известных солей, этилендиаминтетраацетата натрия в качестве стабилизатора или комплексообразующего реагента. Другие варианты осуществления могут содержать это соединение или эти соединения. В предпочтительном варианте осуществления содержание в пересчете на этилендиаминтетраацетат натрия составляет менее 100 мг/100 мл, предпочтительно менее 50 мг/100 мл, более предпочтительно менее 20 мг/100 мл. Обычно растворы для ингаляции, в которых содержание этилендиаминтетраацетата натрия составляет от 0 до 10 мг/100 мл, являются предпочтительными. В растворы для ингаляции без пропеллента можно добавить сорастворители и/или другие инертные наполнители. Предпочтительными сорастворителями являются такие, которые содержат гидроксигруппы или другие полярные группы, например спирты, предпочтительно изопропиловый спирт, гликоли, предпочтительно пропиленгликоль, полиэтиленгликоль, полипропиленгликоль, простой эфир гликоля, глицерин, полиоксиэтиленовые спирты и полиоксиэтиленовые эфиры жирных кислот. Термины "инертные наполнители" и "добавки" в этом контексте означают любое фармакологически приемлемое вещество,которое не является активным веществом, но которое можно приготовить вместе с активным веществом или веществами в физиологически приемлемом растворителе для улучшения качественных характеристик композиции активного вещества. Предпочтительно, если эти вещества не оказывают фармакологического воздействия или в связи с необходимым лечением не оказывают существенного или, по меньшей мере, нежелательного фармакологического воздействия. Инертные наполнители и добавки включают,например, поверхностно-активные вещества, такие как лецитин сои, олеиновую кислоту, сложные эфиры сорбита, такие как полисорбаты, поливинилпирролидон, другие стабилизаторы, комплексообразующие реагенты, антиоксиданты и/или консерванты, которые обеспечивают или увеличивают срок годности готового фармацевтического препарата, вкусовые добавки, витамины и/или другие добавки, известные в данной области техники. Добавки также включают фармакологически приемлемые соли, такие как хлорид натрия, в качестве изотонических реагентов. Предпочтительные инертные наполнители включают антиоксиданты, такие как аскорбиновая кислота, например, при условии, что ее уже не использовали для регулирования значения рН, витамин А,витамин Е, токоферолы и аналогичные витамины и провитамины, содержащиеся в организме человека. Консерванты можно использовать для защиты композиции от заражения патогенами. Подходящими консервантами являются известные в данной области техники, в частности, цетилпиридинийхлорид, бензалконийхлорид или бензойная кислота или бензоаты, такие как бензоат натрия в концентрации, известной из предшествующего уровня техники. Указанные выше консерванты предпочтительно содержатся в концентрациях, составляющих до 50 мг/100 мл, более предпочтительно от 5 до 20 мг/100 мл. Доза соединений, предлагаемых в настоящем изобретении, разумеется, сильно зависит от методики введения и подвергающегося лечению заболевания. При введении путем ингаляции соединения формулы(Ia) или (Ib) характеризуются высокой активностью даже при дозах, находящихся в микрограммовом диапазоне. Соединения формулы (Ia) или (Ib) также можно эффективно использовать в количествах, превышающих находящиеся в микрограммовом диапазоне. Кроме того, доза может находиться, например, в граммовом диапазоне. Другим объектом настоящего изобретения являются указанные выше фармацевтические препараты сами по себе, которые характеризуются тем, что они содержат соединение формулы (Ia) или (Ib), предпочтительно указанные выше фармацевтические препараты, которые можно вводить путем ингаляции. Приведенные ниже примеры препаратов иллюстрируют настоящее изобретение, не ограничивая его объем. Примеры фармацевтических препаратов. Смешивают тонкоизмельченное активное вещество, лактозу и часть кукурузного крахмала. Смесь просеивают, затем увлажняют раствором поливинилпирролидона в воде, замешивают, подвергают влажной грануляции и сушат. Гранулы, оставшийся кукурузный крахмал и стеарат магния просеивают и смешивают. Смесь прессуют в таблетки подходящей формы и размера. Смешивают тонкоизмельченное активное вещество, часть кукурузного крахмала, лактозу, микрокристаллическую целлюлозу и поливинилпирролидон, смесь просеивают и обрабатывают оставшимся кукурузным крахмалом и водой с получением гранулята, который сушат и просеивают. Добавляют натриевую соль карбоксиметилкрахмала и стеарат магния и смешивают и смесь прессуют в таблетки подходящего размера. Активное вещество растворяют в воде при его собственном рН или необязательно при рН от 5,5 до 6,5 и добавляют хлорид натрия для получения изотонического раствора. Полученный раствор фильтруют для удаления пирогенов и фильтрат в асептических условиях переносят в ампулы, которые затем стерилизуют и термически герметизируют. Ампулы содержат 5, 25 и 50 мг активного вещества. Суспензию переносят в обычный контейнер для аэрозоля с дозирующим клапаном. Предпочтительно, чтобы при каждом включении подавалось 50 мкл суспензии. Активное вещество, при желании, также можно подавать в более значительных дозах (например, 0,02 мас.%). Этот раствор можно приготовить обычным образом. Порошок для ингаляции готовят обычным образом путем смешивания отдельных ингредиентов. Приведенные ниже примеры предназначены для дополнительной иллюстрации настоящего изобретения, без ограничения его объема. ПримерыI. Методики ВЭЖХ. Методика А: ВЭЖХ-МС (высокоэффективная жидкостная хроматография - масс-спектрометрия): Agilent 1100. Подвижная фаза: А: вода с добавлением 0,032% NH4OH,В: метанол, Колонка: XBridge С 18, 3,5 мкм, 4,650 мм (температура колонки: постоянная, 40 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-500 нм. Методика В: ВЭЖХ-МС: МС: Waters ZQ, ВЭЖХ: Alliance 2790/2695, детектор с диодной матрицей 2996. Подвижная фаза: А: вода с добавлением 0,1% ТФК (трифторуксусная кислота),В: метанол Колонка: Waters XBridge C18, 4,620 мм, 3,5 мкм (температура колонки: постоянная, 40 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-400 нм. Методика С: ВЭЖХ: Waters Acquity с детектором ДМ (диодная матрица) и МС. Подвижная фаза: А: вода с добавлением 0,1% ТФК,В: метанол, Колонка: Waters XBridge ВЕН С 18, 2,130 мм, 1,7 мкм (температура колонки: постоянная, 60 С). Детектирование с помощью детектора с диодной матрицей при длине волны, равной 210-400 нм. Методика D: ВЭЖХ: Waters Acquity с детектором ДМ и МС. Подвижная фаза: А: вода с добавлением 0,13% ТФК,В: метанол с добавлением 0,05% ТФК, Колонка: Waters XBridge ВЕН С 18, 2,130 мм, 1,7 мкм (температура колонки: постоянная, 60 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-400 нм. Методика Е: ВЭЖХ: Waters Acquity с детектором ДМ и МС. Подвижная фаза: А: вода с добавлением 0,1% ТФК,В: метанол, Колонка: Waters XBridge C18, 2,130 мм, 2,5 мкм (температура колонки: постоянная, 60 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-400 нм. Методика F: ВЭЖХ: Agilent 1200 с детектором ДМ и МС. Подвижная фаза: А: вода с добавлением 0,1% ТФК,В: метанол, Колонка: Waters XBridge С 18, 330 мм, 2,5 мкм (температура колонки: постоянная, 60 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-400 нм. Методика G: ВЭЖХ-МС: Waters Alliance с детектором ДМ и МС. Подвижная фаза: А: вода с добавлением 0,1% NH3,В: метанол с добавлением 0,1% NH3, Колонка: Waters XBridge C18, 4,630 мм, 3,5 мкм (температура колонки: постоянная, 60 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-400 нм. Методика Н: ВЭЖХ-МС: Waters Alliance с детектором ДМ и МС. Подвижная фаза: А: вода с добавлением 0,1% ТФК,В: метанол,- 19022559 Колонка: Waters SunFire C18, 4,630 мм, 3,5 мкм (температура колонки: постоянная, 60 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-400 нм. Методика J: ВЭЖХ: Waters Acquity с детектором ДМ и МС. Подвижная фаза: А: вода с добавлением 0,13% ТФК,В: метанол с добавлением 0,05% ТФК, Колонка: Waters Sunfire С 18, 2,130 мм, 2,5 мкм (температура колонки: постоянная, 60 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-400 нм. Методика K: ВЭЖХ-МС: Waters Alliance с детектором ДМ и МС. Подвижная фаза: А: вода с добавлением 0,1% ТФК,В: метанол с добавлением 0,1% ТФК, Колонка: Waters XBridge С 18, 4,630 мм, 3,5 мкм (температура колонки: постоянная, 60 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-400 нм. Методика L: ВЭЖХ-МС: Waters Alliance с детектором ДМ и МС. Подвижная фаза: А: вода с добавлением 0,1% ТФК,В: метанол, Колонка: Waters XBridge C18, 4,630 мм, 3,5 мкм (температура колонки: постоянная, 60 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-400 нм. Методика М: ВЭЖХ-МС: ВЭЖХ: Waters 2695,МС: ZQ, детектор с диодной матрицей 2996, автоматический пробоотборник 2695. Подвижная фаза: А: вода с добавлением 0,1% NH3,В: метанол с добавлением 0,1% NH3,Колонка: Waters XBridge C18, 4,630 мм, 3,5 мкм (температура колонки: постоянная, 60 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-400 нм. Методика N: ВЭЖХ: Waters Acquity с детектором ДМ и МС. Подвижная фаза: А: вода с добавлением 0,13% ТФК,В: метанол с добавлением 0,08% ТФК, Колонка: Waters XBridge ВЕН С 18, 2,130 мм, 1,7 мкм (температура колонки: постоянная, 60 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-400 нм. Методика О: ВЭЖХ: Agilent 1200 с детектором ДМ и МС. Подвижная фаза: А: вода с добавлением 0,1% ТФК,В: метанол, Колонка: Waters XBridge C18,330 мм, 2,5 мкм (температура колонки: постоянная, 60 С). Детектирование с помощью детектора с диодной матрицей при длине волны 210-400 нм.a) К раствору метилового эфира (3,5-диметил-1 Н-пиразол-4-ил)уксусной кислоты (3,90 г, 23 ммоль) и 4-нитробензилбромида (4,60 г, 20,7 ммоль) в ацетонитриле добавляют K2CO3 (2,76 г, 19,9 ммоль) и смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь выливают в воду и дважды экстрагируют этилацетатом. Органическую фазу сушат над MgSO4 и выпаривают при пониженном давлении. Получают 7,50 г метилового эфира [3,5-диметил-1-(4-нитробензил)-1 Н-пиразол-4 ил]уксусной кислоты (масс-спектр ИЭР (ионизация электрораспылением): [М+Н]+=304).b) К раствору метилового эфира [3,5-диметил-1-(4-нитробензил)-1 Н-пиразол-4-ил]уксусной кислоты (3,90 г, 10,3 ммоль) в метаноле (10 мл) добавляют 10% палладий на древесном угле (500 мг) и смесь гидрируют. Катализатор отфильтровывают и фильтрат концентрируют при пониженном давлении. Смесь очищают с помощью препаративной ВЭЖХ с обращенной фазой (градиентный режим, метанол в воде + 0,1% NH3) и получают 1,18 г искомого соединения (масс-спектр ИЭР: [М+Н]+=274; время удерживания ВЭЖХ: 2,13 мин (методика А. 2) Этиловый эфир [1-(4-амино-2-хлорбензил)-3,5-диметил-1 Н-пиразол-4-ил]уксусной кислоты. а) К раствору этилового эфира (3,5-диметил-1H-пиразол-4-ил)уксусной кислоты (1,40 г, 7,7 ммоль) и 2-хлор-4-нитробензилбромида (4,60 г, 20,7 ммоль) в 20 мл ацетонитрила добавляют K2CO3 (1,59 г,11,5 ммоль) и смесь перемешивают при комнатной температуре в течение 48 ч. Растворитель удаляют выпариванием и остаток растворяют в смеси дихлорметан/вода. После экстракции дихлорметаном органический слой сушат над Na2SO4 и выпаривают при пониженном давлении и получают 2,79 г этилового эфира [3,5-диметил-1-(2-хлор-4-нитробензил)-1 Н-пиразол-4-ил]уксусной кислоты (масс-спектр ИЭР:b) К раствору этилового эфира [3,5-диметил-1-(2-хлор-4-нитробензил)-1H-пиразол-4-ил]уксусной кислоты (2,39 г, 6,8 ммоль) в метаноле (40 мл) добавляют никель Ренея (250 мг) и смесь гидрируют. Катализатор отфильтровывают, фильтрат концентрируют при пониженном давлении и получают 1,18 г искомого соединения (масс-спектр ИЭР: [М+Н]+=322; время удерживания ВЭЖХ: 1,76 мин (методика А. 3) Этиловый эфир [1-(4-аминобензил)-3,5-диэтил-1 Н-пиразол-4-ил]уксусной кислоты.a) К раствору этилового эфира (3,5-диэтил-1 Н-пиразол-4-ил)уксусной кислоты (10,95 г, 52,1 ммоль) и 4-нитробензилбромида (14,625 г, 68 ммолей) в ацетонитриле (110 мл) добавляют K2CO3 (10,80 г,78,1 ммоль) и смесь перемешивают при комнатной температуре в течение 48 ч. Реакционную смесь выливают в воду и дважды экстрагируют этилацетатом. Органическую фазу сушат над MgSO4 и выпаривают при пониженном давлении. Остаток очищают с помощью ЖХСР (жидкостная хроматография среднего давления) с использованием смеси этилацетат/циклогексан и получают 12,50 г этилового эфираb) К раствору этилового эфира [3,5-диэтил-1-(4-нитробензил)-1 Н-пиразол-4-ил]уксусной кислоты(6,66 г, 19,3 ммоль) в метаноле (500 мл) добавляют никель Ренея (500 мг) и смесь гидрируют при комнатной температуре и давлении 50 фунт-сила/дюйм 2. Катализатор отфильтровывают, фильтрат концентрируют при пониженном давлении и получают 4,38 г искомого соединения (масс-спектр ИЭР:a) К раствору метилового эфира (3,5-диметил-1 Н-пиразол-4-ил)уксусной кислоты (10 г, 48,9 ммоль) и 2-фтор-4-нитробензилбромида (11,5 г, 49,1 ммоль) в ацетонитриле (150 мл) добавляют K2CO3 (10,1 г,73,3 ммоль) и смесь перемешивают при 60 С в течение 48 ч. Растворитель удаляют выпариванием и остаток растворяют в смеси дихлорметан/вода. После экстракции дихлорметаном органический слой сушат над Na2SO4 и выпаривают при пониженном давлении. Остаток очищают с помощью ЖХСР (циклогексан/диэтиловый эфир 7:3) и получают 13 г метилового эфира [3,5-диметил-1-(2-фтор-4-нитробензил)-1 Нпиразол-4-ил]уксусной кислоты (масс-спектр ИЭР: [М+Н]+=322; время удерживания ВЭЖХ: 0,85 минb) К раствору метилового эфира [3,5-диметил-1-(2-фтор-4-нитробензил)-1 Н-пиразол-4-ил]уксусной кислоты (13 г, 40,4 ммоль) в метаноле (250 мл) добавляют никель Ренея (6 г) и смесь гидрируют при 50 С и давлении 50 фунт-сила/дюйм 2. Катализатор отфильтровывают и фильтрат концентрируют при пониженном давлении. Смесь очищают путем кристаллизации из диизопропилового эфира и получают 12,8 г искомого соединения (масс-спектр ИЭР: [М+Н]+=292; время удерживания ВЭЖХ: 0,61 мин (методика С. 5) трет-Бутиловый эфир [1-(4-амино-2-хлорбензил)-3,5-диметил-1 Н-пиразол-4-ил]уксусной кислоты.K2CO3 (2,575 г, 18,6 ммоль) и смесь перемешивают при комнатной температуре в течение 48 ч и затем при 60 С в течение 2 ч. Твердое вещество отфильтровывают и растворитель удаляют выпариванием. Остаток растворяют в смеси дихлорметан/вода. После экстракции дихлорметаном органический слой сушат над MgSO4 и выпаривают при пониженном давлении и получают 4,4 г трет-бутилового эфираb) К раствору трет-бутилового эфира [3,5-диметил-1-(2-хлор-4-нитробензил)-1 Н-пиразол-4 ил]уксусной кислоты (4,40 г, 11,6 ммоль) в метаноле (80 мл) добавляют никель Ренея (440 мг) и смесь гидрируют при комнатной температуре и давлении 50 фунт-сила/дюйм 2 в течение 12 ч. Катализатор отфильтровывают, фильтрат концентрируют при пониженном давлении и получают 2,4 г искомого соединения (масс-спектр ИЭР: [М+Н]+=350; время удерживания ВЭЖХ: 0,76 мин (методика D. 6) трет-Бутиловый эфир [1-(4-аминобензил)-3,5-диметил-1 Н-пиразол-4-ил]уксусной кислоты. Искомое соединение (масс-спектр ИЭР: [М+Н]+= 316; время удерживания ВЭЖХ: 0,65 мин (методика Е синтезируют по аналогии с методикой II.A.5 с использованием 4-нитробензилбромида вместо 2-фтор-4-нитробензилбромида. 7) трет-Бутиловый эфир [1-(4-амино-2-фторбензил)-3,5-диметил-1 Н-пиразол-4-ил]уксусной кислоты.a) К раствору трет-бутилового эфира (3,5-диметил-1 Н-пиразол-4-ил)уксусной кислоты (10 г,47,6 ммоль, получают в соответствии с WO 2007/141267 с использованием 2,4-пентандиона вместо 3,5-гептандиона) и 2-фтор-4-нитробензилбромида (11,2 г, 47,9 ммоль) в ацетонитриле (150 мл), добавляют K2CO3 (6,615 г, 47,9 ммоль) и смесь перемешивают при комнатной температуре в течение 24 ч. Твердое вещество отфильтровывают и растворитель удаляют выпариванием. Остаток растворяют в смеси дихлорметан/вода. После экстракции дихлорметаном органический слой сушат над MgSO4 и выпаривают при пониженном давлении. Остаток очищают с помощью ЖХСР (циклогексан/этилацетат 7:3, силикагель 60) и получают 13,6 г трет-бутилового эфира [3,5-диметил-1-(2-фтор-4-нитробензил)-1 Н-пиразол-4 ил]уксусной кислоты (масс-спектр ИЭР: [М+Н]+=364 ТСХ (тонкослойная хроматография): Rf=0,23 (цик- 22022559b) К раствору трет-бутилового эфира [3,5-диметил-1-(2-фтор-4-нитробензил)-1 Н-пиразол-4 ил]уксусной кислоты (13,6 г, 37,4 ммоль) в метаноле (250 мл) добавляют никель Ренея (6 г) и смесь гидрируют при 50 С и давлении 50 фунт-сила/дюйм 2 в течение 12 ч. Катализатор отфильтровывают и фильтрат концентрируют при пониженном давлении и получают 11,6 г искомого соединения (масс-спектр ИЭР: [М+Н]+=334; ТСХ: Rf=0,53 (дихлорметан/метанол 95:5, силикагель 60 F254. В) Синтез карбоновых кислот. 1) 1-Этил-5-фтор-1 Н-индол-2-карбоновая кислота.a) К раствору 5-фториндол-2-этилового эфира (200 мг, 0,965 ммоль) в диметилсульфоксиде (6 мл) добавляют трет-бутилат калия (108 мг, 0,965 ммоль) и смесь перемешивают при 50 С в течение 30 мин. После охлаждения до комнатной температуры добавляют бромэтан (0,081 мл, 1,06 ммоль) и смесь перемешивают при комнатной температуре в течение 2,5 ч. При охлаждении добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным водным раствором NaCl,сушат над MgSO4, растворитель выпаривают в вакууме и получают 200 мг этилового эфира 1-этил-5-фтор-1 Н-индол-2-карбоновой кислоты (масс-спектр ИЭР: [М+Н]+=236).b) К раствору этилового эфира 1-этил-5-фтор-1H-индол-2-карбоновой кислоты (200 мг, 0,85 ммоль) в диоксане (2 мл) добавляют водный раствор NaOH (1 М, 1,7 мл) и смесь перемешивают при 60 С в течение 1 ч. После выпаривания растворителя остаток суспендируют в небольшом количестве воды и нейтрализуют уксусной кислотой (2 М раствор). Осадок отфильтровывают, промывают водой и сушат и получают 140 мг искомого соединения (масс-спектр ИЭР: [М+Н]+=208; время удерживания ВЭЖХ: 1,21 мин (методика F. Следующие индолкарбоновые кислоты также получают по аналогии с этой методикой: 1-бензил-1 Н-индол-2-карбоновая кислота (масс-спектр ИЭР: [М+Н]+=252; время удерживания ВЭЖХ: 0,84 мин (методика Е; 1-бутил-1 Н-индол-2-карбоновая кислота (масс-спектр ИЭР: [М+Н]+=218); 5-фтор-1-пропил-1 Н-индол-2-карбоновая кислота (масс-спектр ИЭР: [М+Н]+=222); 1-бутил-5-фтор-1H-индол-2-карбоновая кислота (масс-спектр ИЭР: [М+Н]+=236); 1-пропил-1 Н-индол-2-карбоновая кислота (масс-спектр ИЭР: [М+Н]+=204); 1-этил-4-фтор-1H-индол-2-карбоновая кислота (масс-спектр ИЭР: [М+Н]+=208; время удерживания ВЭЖХ: 0,80 мин (методика Е; 1-этил-6-фтор-1H-индол-2-карбоновая кислота (масс-спектр ИЭР: [М+Н]-=206; время удерживания ВЭЖХ: 0,71 мин (методика Е; 6-фтор-1-пропил-1 Н-индол-2-карбоновая кислота (масс-спектр ИЭР: [М-Н]-=220; время удерживания ВЭЖХ: 0,77 мин (методика Е. 2) 3-Этил-5-фторбензофуран-2-карбоновая кислота.a) К раствору 5-фтор-2-гидроксипропиофенона (0,9 г, 5,2 ммоль) и трет-бутилбромацетата (0,9 мл,6,1 ммоль) в ацетонитриле (15 мл) добавляют K2CO3 (1,08 г, 7,8 ммоль) и смесь кипятят с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры смесь выливают в воду и экстрагируют этилацетатом. Органический слой дважды промывают водой, сушат над MgSO4, растворитель выпаривают в вакууме и получают 1,47 г трет-бутилового эфира (4-фтор-2-пропионилфенокси)уксусной кислоты (масс-спектр ИЭР: [М+Н]+=283; время удерживания ВЭЖХ: 0,88 мин (методика D.b) К раствору трет-бутилового эфира (4-фтор-2-пропионилфенокси)уксусной кислоты (1,47 г,5,2 ммоль) в сухом этаноле (20 мл) добавляют раствор метанолята натрия в метаноле (5,4 М, 20 мл) и смесь перемешивают при 80 С в течение 12 ч. После охлаждения до комнатной температуры и выпаривания растворителя остаток растворяют в воде и подкисляют хлористо-водородной кислотой (1 М раствор). Осадок отфильтровывают, промывают водой и сушат и получают 440 мг искомого соединения(масс-спектр ИЭР: [М-Н]-=207; время удерживания ВЭЖХ: 0,87 мин (методика G. Следующие бензофуранкарбоновые кислоты также получают по аналогии с этой методикой: 7-хлор-3-метилбензофуран-2-карбоновая кислота (масс-спектр ИЭР: [М-Н]-=209; время удерживания ВЭЖХ: 1,28 мин (методика Н; 5-фтор-3-пропилбензофуран-2-карбоновая кислота (масс-спектр ИЭР: [М-Н]-=221; время удерживания ВЭЖХ: 1,01 мин (методика G; 3-этил-7-фторбензофуран-2-карбоновая кислота (масс-спектр ИЭР: [М-Н]-=207; время удерживания ВЭЖХ: 0,77 мин (методика Е; 3-этил-5,7-дифторбензофуран-2-карбоновая кислота (масс-спектр ИЭР: [М-Н]-=225; время удерживания ВЭЖХ: 1,32 мин (методика L; 6-хлорбензофуран-2-карбоновая кислота (масс-спектр ИЭР: [М-Н]-=195; время удерживания ВЭЖХ: 1,72 мин (методика Н.a) К раствору индол-2-карбоновой кислоты (80 мг, 0,50 ммоль) в N,N-диметилформамиде (1,5 мл) добавляют TBTU (139 мг, 0,43 ммоль) и N,N-диизопропиламин (0,126 мл, 0,74 ммоль). Затем добавляют метиловый эфир [1-(4-амино-2-фторбензил)-3,5-диметил-1 Н-пиразол-4-ил]уксусной кислоты (120 мг,0,41 ммоль). Смесь перемешивают при комнатной температуре в течение 12 ч. Затем добавляют водный раствор K2CO3 (2 М, 0,5 мл). Полученную смесь пропускают через Al2O3 с использованием смеси дихлорметан/метанол (9:1, 10 мл). Растворитель удаляют в вакууме и получают 82,3 мг метилового эфираNaOH (4 M, 0,3 мл) и смесь перемешивают при комнатной температуре в течение 2 ч. Полученную смесь разбавляют смесью метанол/вода, твердое вещество отфильтровывают и после выпаривания остаток очищают с помощью ВЭЖХ (Gilson, XRS Pursuit, метанол/H2O + 0,1% концентрированного NH3). Фракции, содержащие искомое соединение, концентрируют, лиофилизируют и получают 15 мг искомого соединения (масс-спектр ИЭР: [М+Н]+=421; время удерживания ВЭЖХ: 1,04 мин (методика G. 1 Н-ЯМР (400 МГц, ДМСО-d6, (ДМСО = диметилсульфоксид:[част./млн] = 2,03 (s, 3H), 2,14 (s,3H), 2,52 (s, 3H), 3,21 (s, 2H), 5,16 (s, 2H), 6,99 (t, 1H), 7,08 (t, 1 Н), 7,23 (t, 1 Н), 7,39 (s, 1 Н), 7,48 (m, 2 Н),7,66 (d, 1H), 7,79 (d, 1H), 10,45 (s, 1 Н), 11,79 (br., 1H). Соединения 2 и 3, приведенные в табл. 1, также получают по аналогии с методикой сочетания С 1 с использованием подходящих исходных аминов и карбоновых кислот. Соединение 4. (1-4-[(5-Фтор-3-метилбензофуран-2-карбонил)амино]бензил-3,5-диметил-1 Нпиразол-4-ил)уксусная кислота (методика сочетания С 2).a) К раствору метилового эфира [1-(4-аминобензил)-3,5-диметил-1 Н-пиразол-4-ил]уксусной кислоты (400 мг, 1,46 ммоль) в 5 мл дихлорметана добавляют диизопропилэтиламин (1,5 мл, 8,8 ммоль) и 5-фтор-3-метил-1-бензофуран-2-карбоновую кислоту (369 мг, 1,9 ммоль). После перемешивания при комнатной температуре в течение 10 мин при охлаждении добавляют 50% раствор циклического ангидрида 1-пропилфосфоновой кислоты в этилацетате (1,725 мл, 2,93 ммоль) и смесь перемешивают при комнатной температуре в течение 12 ч. Растворитель выпаривают в вакууме и остаток очищают с помощью ЖХСР (дихлорметан/метанол 98:2) и получают 410 мг метилового эфира (1-4-[(5-фтор-3 метилбензофуран-2-карбонил)амино]бензил-3,5-диметил-1 Н-пиразол-4-ил)уксусной кислоты (массспектр ИЭР: [М+Н]+=450; ТСХ: Rf=0,56 (дихлорметан/метанол 95:5, силикагель 60 F254.b) К раствору метилового эфира (1-4-[(5-фтор-3-метилбензофуран-2-карбонил)амино]бензил-3,5 диметил-1 Н-пиразол-4-ил)уксусной кислоты (410 мг, 0,91 ммоль) в смеси диоксан/вода (10 мл/10 мл) добавляют 1 М раствор NaOH (2,3 мл) и смесь перемешивают при комнатной температуре в течение 24 ч. Смесь разбавляют водой и подкисляют хлористо-водородной кислотой (1 М раствор, 3,25 мл). Осадок отфильтровывают, промывают водой, сушат и получают 338 мг искомого соединения (масс-спектр ИЭР:(s, 2H), 7,10 (d, 2H), 7,37 (t, 1H), 7,66 (m, 2H), 7,75 (d, 2 Н), 10,40 (s, 1 Н), 12,05 (dr., 1H). Соединения 5-26 и 57-59, приведенные в табл. 1 и 2, также получают по аналогии с методикой сочетания С 2 с использованием подходящих исходных аминов и карбоновых кислот. Соединение 27. (1-2-Фтор-4-[(5-фтор-3-метилбензофуран-2-карбонил)амино]бензил-3,5-диметил 1 Н-пиразол-4-ил)уксусная кислота (методика сочетания С 3).a) К раствору 5-фтор-3-метил-1-бензофуран-2-карбоновой кислоты (194 мг, 1 ммоль) в 5 мл диметилформамида добавляют диизопропилэтиламин (0,516 мл, 3 ммоль) и ГАТУ (О-(7-азабензотриазол-1 ил)-N,N,N',N'-тетраметилуронийгексафторфосфат) (399 мг, 1,05 ммоль). После перемешивания при комнатной температуре в течение 25 мин добавляют диметилформамид (1 мл) и затем промежуточный метиловый эфир [1-(4-амино-2-фторбензил)-3,5-диметил-1 Н-пиразол-4-ил]уксусной кислоты (291 мг,1 ммоль). Затем добавляют диизопропилэтиламин (0,344 мл, 2 ммоль) и диметилформамид (2 мл) и смесь перемешивают при комнатной температуре в течение 48 ч. Затем добавляют этилацетат и воду и осадок отфильтровывают. Органический слой дважды экстрагируют уксусной кислотой (1 н. раствор), один раз водным раствором NaHCO3 (5 мас.%) и дважды водой, сушат над MgSO4. Растворитель удаляют выпариванием в вакууме. Остаток очищают с помощью ЖХСР (дихлорметан/метанол 96:4) и получают 120 мг метилового эфира (1-(2-фтор-4-[(5-фтор-3-метилбензофуран-2-карбонил)амино]-бензил)-3,5-диметил-1 Нпиразол-4-ил)уксусной кислоты (масс-спектр ИЭР: [М+Н]+=468; ТСХ: Rf=0,72 (дихлорметан/метанол 9:1, силикагель 60 F254.(1-(2-фтор-4-[(5-фтор-3-метилбензофуран-2 карбонил)амино]бензил)-3,5-диметил-1 Н-пиразол-4-ил)уксусной кислоты (119 мг, 0,26 ммоль) в смеси диоксан/вода (7 мл/7 мл) добавляют водный раствор NaOH (1 M, 2,3 мл) и смесь перемешивают при комнатной температуре в течение 12 ч и при 60 С в течение 2 ч. Смесь разбавляют водой, подкисляют хлористо-водородной кислотой (1 М раствор, 1 мл) и экстрагируют этилацетатом. Органический слой сушат над MgSO4, растворитель выпаривают в вакууме, остаток кристаллизуют из диизопропилового эфира и осадок выделяют фильтрованием и получают 69 мг искомого соединения (масс-спектр ИЭР:(s, 2 Н), 6,96 (t, 1 Н), 7,37 (t, 1 Н), 7,54 (d, 1 Н), 7,66 (m, 2 Н), 7,79 (d, 1H), 10,60 (s, 1H), 12,07 (br., 1H). Соединения 28-31, приведенные в табл. 1, также получают по аналогии с методикой сочетания С 3 с использованием подходящих исходных аминов и карбоновых кислот. Соединение 32. (1-(4-[(1-Этил-5-фтор-1 Н-индол-2-карбонил)амино]-2-фторбензил)-3,5-диметил-1 Нпиразол-4-ил)уксусная кислота (методика сочетания С 4).a) К раствору 1-этил-5-фтор-1 Н-индол-2-карбоновой кислоты (140 мг, 0,68 ммоль) в 6 мл дихлорметана добавляют оксалилхлорид (0,094 мл, 0,68 ммоль) и каплю диметилформамида. После перемешивания при комнатной температуре в течение 1 ч растворитель удаляют выпариванием в вакууме. Остаток растворяют в дихлорметане (5 мл) и по каплям добавляют к раствору метилового эфира[1-(4-амино-2-фторбензил)-3,5-диметил-1 Н-пиразол-4-ил]уксусной кислоты (177 мг, 0,61 ммоль) и диизопропилэтиламина (0,23 мл, 1,35 ммоль) в дихлорметане (5 мл). После добавления 4-диметиламинопиридина (8,255 мг, 0,069 ммоль) раствор перемешивают при комнатной температуре в течение 12 ч. Раствор дважды экстрагируют хлористо-водородной кислотой (1 М раствор), дважды водой, дважды водным раствором NaOH (1 M) и дважды водой. Органический слой сушат над MgSO4,фильтруют и растворитель выпаривают в вакууме. Остаток очищают с помощью ЖХСР (дихлорметан/метанол 95:5) и получают 160 мг метилового эфира (1-(4-[(1-этил-5-фтор-1 Н-индол-2 карбонил)амино]-2-фторбензил)-3,5-диметил-1H-пиразол-4-ил)уксусной кислоты (масс-спектр ИЭР:b) К раствору метилового эфира (1-(4-[(1-этил-5-фтор-1 Н-индол-2-карбонил)амино]-2-фторбензил)3,5-диметил-1 Н-пиразол-4-ил)уксусной кислоты (160 мг, 0,33 ммоль) в диоксане (2 мл) добавляют водный раствор NaOH (1 M, 0,66 мл) и смесь перемешивают при 60 С в течение 1 ч. Растворитель выпаривают в вакууме и остаток суспендируют в воде и обрабатывают уксусной кислотой (2 М раствор). Осадок сушат вымораживанием, растворяют в метаноле и небольшом количестве диметилформамида и продукт,осадившийся при добавлении небольшого количества воды, фильтруют и сушат и получают 137 мг искомого соединения (масс-спектр ИЭР: [М+Н]+=467; время удерживания ВЭЖХ: 0,89 мин (методика D. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част./млн] = 1,30 (t, 6H), 2,04 (s, 3H), 2,13 (s, 3H), 3,25 (s, 2H), 4,55a) К раствору 7-хлор-3-метилбензофуран-2-карбоновой кислоты (185 мг, 0,88 ммоль) в 6 мл дихлорметана добавляют оксалилхлорид (0,123 мл, 1,14 ммоль) и каплю диметилформамида. После перемешивания при комнатной температуре в течение 1 ч растворитель удаляют выпариванием в вакууме. Остаток растворяют в дихлорметане (5 мл) и по каплям добавляют к раствору трет-бутилового эфира[1-(4-аминобензил)-3,5-диметил-1 Н-пиразол-4-ил]уксусной кислоты (428 мг, 1 ммоль) в виде его толуолсульфоната и диизопропилэтиламина (0,39 мл, 2,27 ммоль) в дихлорметане (5 мл). После добавления 4-диметиламинопиридина (11 мг, 0,09 ммоль) раствор перемешивают при комнатной температуре в течение 12 ч. Раствор дважды экстрагируют хлористо-водородной кислотой (1 М раствор), дважды водой,дважды водным раствором NaOH (1 M) и дважды водой. Органический слой сушат над MgSO4, фильтруют и растворитель выпаривают в вакууме и получают 426 мг трет-бутилового эфираb) К раствору трет-бутилового эфира (1-(4-[(7-хлор-3-метилбензофуран-2-карбонил)амино]бензил)3,5-диметил-1 Н-пиразол-4-ил)уксусной кислоты (426 мг, 0,84 ммоль) в дихлорметане (10 мл) добавляют трифторуксусную кислоту (400 мл, 5,2 ммоль) и смесь перемешивают при комнатной температуре в течение 3 дней. Растворитель выпаривают в вакууме и остаток суспендируют в воде и обрабатывают диэтиловым эфиром, осадившийся продукт отфильтровывают и получают 174 мг искомого соединенияa) К раствору 3-этил-5-фторбензофуран-2-карбоновой кислоты (450 мг, 2,16 ммоль) в 10 мл дихлорметана добавляют оксалилхлорид (0,335 мл, 3,1 ммоль) и каплю диметилформамида. После перемешивания при комнатной температуре в течение 1 ч растворитель удаляют выпариванием в вакууме. Остаток растворяют в дихлорметане (10 мл) и по каплям добавляют к раствору трет-бутилового эфира [1(4-аминобензил)-3,5-диметил-1 Н-пиразол-4-ил]уксусной кислоты (1,054 г, 2,16 ммоль) в виде его 4-толуолсульфоната и диизопропилэтиламина (1,3 мл, 7,57 ммоль) в дихлорметане (5 мл). После добавления 4-диметиламинопиридина (26,4 мг, 0,216 ммоль) раствор перемешивают при комнатной температуре в течение 12 ч. Растворитель выпаривают в вакууме, растворяют в 100 мл этилацетата и раствор дважды экстрагируют водой, один раз хлористо-водородной кислотой (0,5 М раствор), один раз водой,один раз водным раствором NaHCO3 (5 мас.%) и один раз водой. Органический слой сушат над MgSO4,фильтруют и растворитель выпаривают в вакууме. Остаток очищают с помощью ЖХСР (дихлорметан/метанол 98:2) и получают 150 мг трет-бутилового эфира 1-(4-[(3-этил-5-фторбензофуран-2 карбонил)амино]бензил)-3,5-диметил-1 Н-пиразол-4-ил)уксусной кислотыb) К раствору трет-бутилового эфира 1-(4-[(3-этил-5-фторбензофуран-2-карбонил)амино]бензил)3,5-диметил-1 Н-пиразол-4-ил)уксусной кислоты (150 мг, 0,30 ммоль) в ацетонитриле (25 мл) добавляют монтмориллонит KSF (300 мг) и смесь кипятят с обратным холодильником в течение 6 ч. Смесь разбавляют ацетонитрилом до объема, равного 400 мл, кипятят с обратным холодильником в течение 5 мин и фильтруют. Растворитель выпаривают в вакууме и остаток промывают диметилформамидом (300 мл). После фильтрования растворитель удаляют выпариванием и остаток обрабатывают ацетоном (200 мл). После растирания осадок отфильтровывают и промывают ацетоном и получают 112 мг искомого соединения (масс-спектр ИЭР: [М+Н]+=450; время удерживания ВЭЖХ: 0,85 мин (методика Е. 1 Н-ЯМР (400 МГц, ДМСО-d6):[част./млн] = 1,21 (t, 6H), 2,04 (s, 3H), 2,11 (s, 3 Н), 3,09 (q, 4 Н), 3,27(s, 2 Н), 5,16 (s, 2 Н), 7,09 (d, 2 Н), 7,33 (t, 1H), 7,67 (m, 2 Н), 7,76 (d, 2H), 10,39 (s, 1H). Соединения 34-47 и 49-56, приведенные в табл. 1, также получают по аналогии с методикой сочетания С 4 с использованием подходящих исходных аминов и карбоновых кислот.IV) Биологические исследования. Соединения формулы (Ia) и (Ib), предлагаемые в настоящем изобретении, исследовали с использованием приведенных ниже биологических методик для определения их способности вытеснять PGD2 из рецептора CRTH2 и их способности противодействовать функциональному влиянию PGD2 в рецептореCRTH2 во всей системе. Приготовление мембран рецептора CRTH2 человека и анализ связывания радиолиганда. Связывание антагонистов CRTH2 определяют с помощью мембран, приготовленных из клеток яичника китайского хомячка (клетки CHO-K1), трансфицированных рецептором CRTH2 человека (клеткиCHO-K1-hCRTH2, Perkin Elmer, Cat No. ES-561-C). Для приготовления клеточных мембран клеткиCHO-K1-hCRTH2 выращивают в суспензии в среде CHO SFMII с добавлением 400 мкг/мл G418. Клетки собирают центрифугированием при 300g, при комнатной температуре в течение 10 мин. Таблетку клеток повторно суспендируют в забуференном фосфатом физиологическом растворе (ЗФФ), содержащем смесь ингибиторов протеазы (Complete, Roche) и обеспечивают концентрацию, равную 10 Е 7 клеток/мл. Клетки CHO-K1-hCRTH2 разрушают путем разложения азотом и получают препарат мембран. Остатки клеток удаляют центрифугированием (при 500g при 4 С, 30 мин) и надосадочную жидкость переносят в чистые пробирки и второй раз центрифугируют при 40000g, при 4 С в течение 1 ч для осаждения мембран. Мембраны суспендируют в инкубационном буфере для ПСА (проксимальный сцинтилляционный анализ) (50 мМ Tris-HCl (Tris - трис-(гидроксиметиламинометан, 10 мМ MgCl2, 150 мМ NaCl, 1 мМ ЭДТК (этилендиаминтетрауксусная кислота), рН 7,4), не содержащем бычий сывороточный альбумин,гомогенизируют путем пропускания через одноразовую иглу (Terumo, 23G1") и хранят в виде аликвот при -80 С. Исследование связывания рецептора CRTH2 проводят по методике проксимального сцинтилляционного анализа (ПСА) с радиолигандом [3H]-PGD2 (Perkin Elmer, NET616000MC). Мембраны клетокCHO-K1-hCRTH2 повторно гомогенизируют путем пропускания через одноразовую иглу (Terumo,23G1") и разводят в инкубационном буфере для ПСА до подходящих концентраций (0,5-10 мкг белка/лунка). Исследование с помощью ПСА проводят в 96-луночных микропланшетах для титрования(Perkin Elmer, Cat No. 6005040) в инкубационном буфере для ПСА при конечном объеме 200 мкл и конечной концентрации, составляющей 50 мМ Tris-HCl, 10 мМ MgCl2, 150 мМ NaCl, 1 мМ ЭДТК, рН 7,4,0,1% бычьего сывороточного альбумина. Смесь для исследования с помощью ПСА содержит 60 мкл суспензии мембран, 80 мкл гранул поливинилтолуола, на которые нанесен агглютинин из зародышей пшеницы (GE Healthcare, RPNQ-0001, 0,3 мг/лунка), 40 мкл [3H]-PGD2, разведенного в буфере для ПСА до конечной концентрации, равной 1 нМ (50000 распадов/мин), и 20 мкл исследуемого соединения (растворенного в диметилсульфоксиде). Смесь для исследования с помощью ПСА инкубируют при комнатной температуре в течение 3 ч. Радиоактивность связанного вещества определяют сцинтилляционным счетчиком (Micro Beta Trilux, Wallac). Связывание [3H]-PGD2 с клеточными мембранами CHO-K1-hCRTH2 определяют при отсутствии(полное связывание, ПС) и в присутствии (неспецифическое связывание, НСС) немеченого PGD2 (1 мкМ,Cayman Chemical, Cat No. 12010) или контрольного антагониста CRTH2 (10 мкМ CAY10471, CaymanChemical, Cat No. 10006735). Сродство исследуемого соединения рассчитывают, вычитая значение для неспецифического связывания (НСС) из значения для полного связывания (ПС) или связывания в присутствии исследуемого соединения (В) при данной концентрации соединения. Значение НСС соответствует ингибированию на 100%. Значение ПС-НСС соответствует ингибированию на 0%. Выраженные в процентах значения ингибирования получают при определенной концентрации соединения, например при 1 мкМ, выраженные в процентах значения ингибирования для исследуемого соединения рассчитывают по формуле 100-В-НСС)100/(ПС-НСС. Значения ингибирования, превышающие 100%, получены вследствие изменчивости анализа. Константу диссоциации Ki рассчитывают путем итеративной аппроксимации экспериментальных данных, полученных при нескольких концентрациях соединения в диапазоне доз от 0,1 до 30000 нМ с помощью программы "easy sys", которая основана на законе действия масс (Schittkowski, Num Math 68,129-142 (1994. Методика функционального исследования связывания CRTH2 с cAMP. Исследование проводят с использованием клеток CHO-K1-hCRTH2. Внутриклеточный cAMP (циклический аденозинмонофосфат) генерируют путем стимуляции клеток с помощью 10 мкМ форсколина,активатора аденилатциклазы. Для активации рецептора CRTH2 добавляют PGD2, что приводит к уменьшению индуцированной форсколином выработки сАМР. Анализируют способность исследуемых соединений ингибировать опосредуемое с помощью PGD2 уменьшение индуцированной форсколином выработки сАМР в клетках CHO-K1-hCRTH2. Клетки CHO-K1-hCRTH2 выращивают во вращающихся флаконах в среде CHO SFMII с добавлением 400 мкг/мл G418. Клетки собирают центрифугированием при 300g, при комнатной температуре в течение 10 мин. Таблетку клеток промывают и суспендируют в ЗФФ. Конечную концентрацию клеток устанавливают равной 410 Е 6 клеток/мл. Исследуемые соединения разводят в диметилсульфоксиде и исследуют при нескольких концентрациях соединений, находящихся в диапазоне от 0,1 до 3000 нМ. Содержание сАМР определяют с помощью набора для исследования сАМР AlphaScreen (PerkinElmer Cat No. 6760625M) в 384-луночных планшетах Optiplates (PerkinElmer, Cat No. 6007290) при полном объеме при исследовании, равном 50 мкл. 10 мкл клеток (40000 клеток/лунка) инкубируют при 37 С в течение 30 мин с 10 мкл смеси для стимулирования, содержащей при конечной концентрации 10 мкМ форсколина, 30 нМ PGD2, 0,5 мМ ИБМК (изобутилметилксантин), 5 мМ HEPES (4-(2-гидроксиэтил)-1 пиперазинэтансульфоновая кислота), 1 буфера CCPX (сбалансированный солевой раствор Хенкса),0,1% БСА (бычий сывороточный альбумин), обладающей значением рН, доведенным до 7,4, и исследуемым соединением при различных концентрациях. Затем добавляют 30 мкл буфера для лизиса и смеси для детектирования, содержащей донорные гранулы SA, биотинилированную сАМР, акцепторные гранулы анти-сАМР, 0,3% Tween-20, 5 мМ HEPES, 0,1% БСА, обладающей значением рН, доведенным до 7,4. После инкубации в течение 2 ч сигнал AlphaScreen считывают с помощью устройстваAlphaQuest-HTS. Значения IC50 рассчитывают с помощью программного обеспечения Prism. Другие методики функционального исследования CRTH2. Способность исследуемых соединений противодействовать функциональному воздействию PGD2 на рецептор CRTH2 также можно продемонстрировать с помощью методик, известных в данной области техники, таких как исследование связывания целых клеток, исследование GTPgS, исследование BRET,исследование накапливания инозитфосфата, исследование экспрессирования CRTH2 поверхностью клеток, исследование притока Са 2+, исследование фосфорилирования ERK, исследование миграции клеток,исследование изменения формы эозинофилов, исследование дегрануляции клеток Th2 или исследование активации базофилов, описанных в публикациях Mathiesen et al., Mol. Pharmacol. 2005, 68:393-402;Sugimoto et al., Pharmacol. Exp. Ther., 2003, 305:347-52; Monneret et al., J. Pharmacol. Exp. Ther., 2005,312:627-34; Xue et al., J. Immunol., 2005, 175:6531-6. Линии клеток, экспрессирующие рецептор CRTH2, включают те, которые сами экспрессируют рецептор CRTH2, такие как клетки AML14.3D10 и NCI-Н 292 (Sawyer et al., Br. J. Pharmacol., 2002,137:1163-72; Chiba et al., Int. Arch. Allergy Immunol., 2007, 143 Suppl 1:23-7), те, в которых экспрессия рецептора CRTH2 индуцируется путем добавления химических реагентов, такие как клетки HL-60 или 137:1163-72), или линии клеток, которым с помощью генной инженерии придана способность экспрессировать рекомбинантный рецептор CRTH2, такие как клетки L1.2, CHO, HEK-293, K562 или CEM (Liu etHata et al., Mol. Pharmacol., 2005, 67:640-7; Nagata et al., FEBS Lett., 1999, 459:195-9). Кроме того, в таких исследованиях можно использовать клетки крови или тканей, например эозинофилы периферической крови человека, выделенные по методикам, описанным в публикации Hansel etal., J. Immunol. Methods, 1991, 145, 105-110, или клетки Th2 человека, выделенные и обработанные так,как описано в публикации Xue et al., J. Immunol., 2005, 175:6531-6, базофилы человека, выделенные и охарактеризованные так, как описано в публикации Monneret et al., J. Pharmacol. Exp. Ther., 2005,312:627-34. В частности, по данным описанных выше исследований, соединения предлагаемые в настоящем изобретении, обладают активностью при связывании с рецептором CRTH2 и ингибируют активациюCRTH2 лигандами CRTH2. При использовании в настоящем изобретении "активное" означает соединение, по данным описанных выше исследований приводящее к ингибированию на 50% при концентрации 1 мкМ или выше или характеризующееся значением Ki1 мкМ. Такой результат указывает на собственную активность соединений, как ингибиторов активности рецептора CRTH2. Антагонистические активности некоторых соединений приведены в табл. 1 и 2.
МПК / Метки
МПК: C07D 403/12, A61P 29/00, A61K 31/4155, C07D 407/12, C07D 409/12
Метки: crth2, антагонистов, качестве, пиразолы
Код ссылки
<a href="https://eas.patents.su/30-22559-pirazoly-v-kachestve-antagonistov-crth2.html" rel="bookmark" title="База патентов Евразийского Союза">Пиразолы в качестве антагонистов crth2</a>