(пиридин-4-ил)бензиламиды как аллостерические модуляторы альфа 7 nachr
Номер патента: 22164
Опубликовано: 30.11.2015
Авторы: Макдональд Грегор Джеймс, Де Бук Бенуа Кристиан Альберт Гилейн, Ромбу Герт, Ленартс Йозеф Элизабет
Формула / Реферат
1. Соединение, характеризующееся формулой (I)
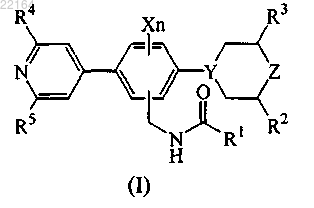
или его стереоизомер, где
n равняется 0, 1 или 2;
X представляет собой фтор или хлор;
Y представляет собой N или СН;
Z представляет собой О или СН2;
R1 представляет собой C1-6алкил; С1-4алкил, замещенный 3 атомами галогена; С3-6циклоалкил; (С3-6циклоалкил)С1-2алкил; метоксиметил; метоксиэтил; тетрагидропиранил; фенил, замещенный 1 или 2 заместителями, выбранными из галогена и С1-6алкила; изоксазолил, замещенный 1 или 2 заместителями, выбранными из С1-4алкила; или пиридинил, замещенный 1 или 2 заместителями, выбранными из галогена;
R2 и R3 независимо представляют собой Н или С1-4алкил;
R4 и R5 независимо представляют собой Н или С1-4алкил;
или его кислотно-аддитивная соль или их сольват.
2. Соединение по п.1, где R1 представляет собой С1-6алкил; С1-4алкил, замещенный 3 фторными заместителями; С3-6циклоалкил; (С3-6циклоалкил)С1-2алкил; метоксиметил; метоксиэтил; тетрагидропиранил; фенил, замещенный 1 или 2 заместителями, выбранными из фтора, хлора и метила; изоксазолил, замещенный 1 или 2 заместителями, выбранными из метила, этила, пропила, изопропила, бутила, изобутила и трет-бутила; или пиридинил, замещенный 1 или 2 заместителями, выбранными из галогена.
3. Соединение по п.1, где R2 представляет собой водород или метил.
4. Соединение по п.1, где R3 представляет собой водород или метил.
5. Соединение по п.1, где R4 представляет собой водород или метил.
6. Соединение по п.1, где R5 представляет собой водород или метил.
7. Соединение по п.1, где R1 представляет собой метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, 2,2,2-трифторэтил, 3,3,3-трифторпропил, 2-метоксиэтил, циклопропил, циклобутил, циклопентил, 1-(циклопропил)этил, (циклопропил)метил, (циклобутил)метил, 4-фтор-2-метилфенил, 3-метилизоксазол-5-ил, 3-метилизоксазол-4-ил, 5-метилизоксазол-3-ил.
8. Соединение по п.1, где R2 и R3 представляют собой метил и характеризуются цис-конфигурацией.
9. Соединение по п.1, где R4 и R5 представляют собой метил.
10. Соединение по п.1, представляющее собой N-[[5-[(2R,6S)-2,6-диметил-4-морфолинил]-2-(2,6-диметил-4-пиридинил)фенил]метил]-2-метилпропанамид.
11. Фармацевтическая композиция, модулирующая активность никотиновых ацетилхолиновых рецепторов, содержащая в качестве активного ингредиента соединение по любому из пп.1-10.
12. Применение соединения по любому из пп.1-10 для лечения в качестве лекарственного препарата, модулирующего активность никотиновых ацетилхолиновых рецепторов.
13. Применение соединения по любому из пп.1-10 для лечения болезни Альцгеймера, деменции, развивающейся при болезни диффузных телец Леви, синдрома гиперактивности с дефицитом внимания, тревоги, шизофрении, мании, биполярной депрессии, болезни Паркинсона, болезни Гентингтона, синдрома Туретта, травмы головного мозга, синдрома смены часовых поясов, пристрастия к никотину, боли; эндотоксикоза, эндотоксинового шока, сепсиса, ревматоидного артрита, астмы, рассеянного склероза, псориаза, уртикарии, воспалительного заболевания кишечника, воспалительного заболевания желчных протоков, болезни Крона, язвенного колита, послеоперационного илеуса, панкреатита, сердечной недостаточности, острого повреждения легких или отторжения аллотрансплантата; когнитивного нарушения при шизофрении, когнитивного нарушения при болезни Альцгеймера, умеренного когнитивного нарушения, болезни Паркинсона, синдрома гиперактивности с дефицитом внимания, язвенного колита, панкреатита, артрита, сепсиса, послеоперационного илеуса или острого повреждения легких.
14. Способ получения фармацевтической композиции по п.11, предусматривающий этап, на котором тщательно смешивают фармацевтически приемлемый носитель с терапевтически эффективным количеством соединения по любому из пп.1-10.
Текст
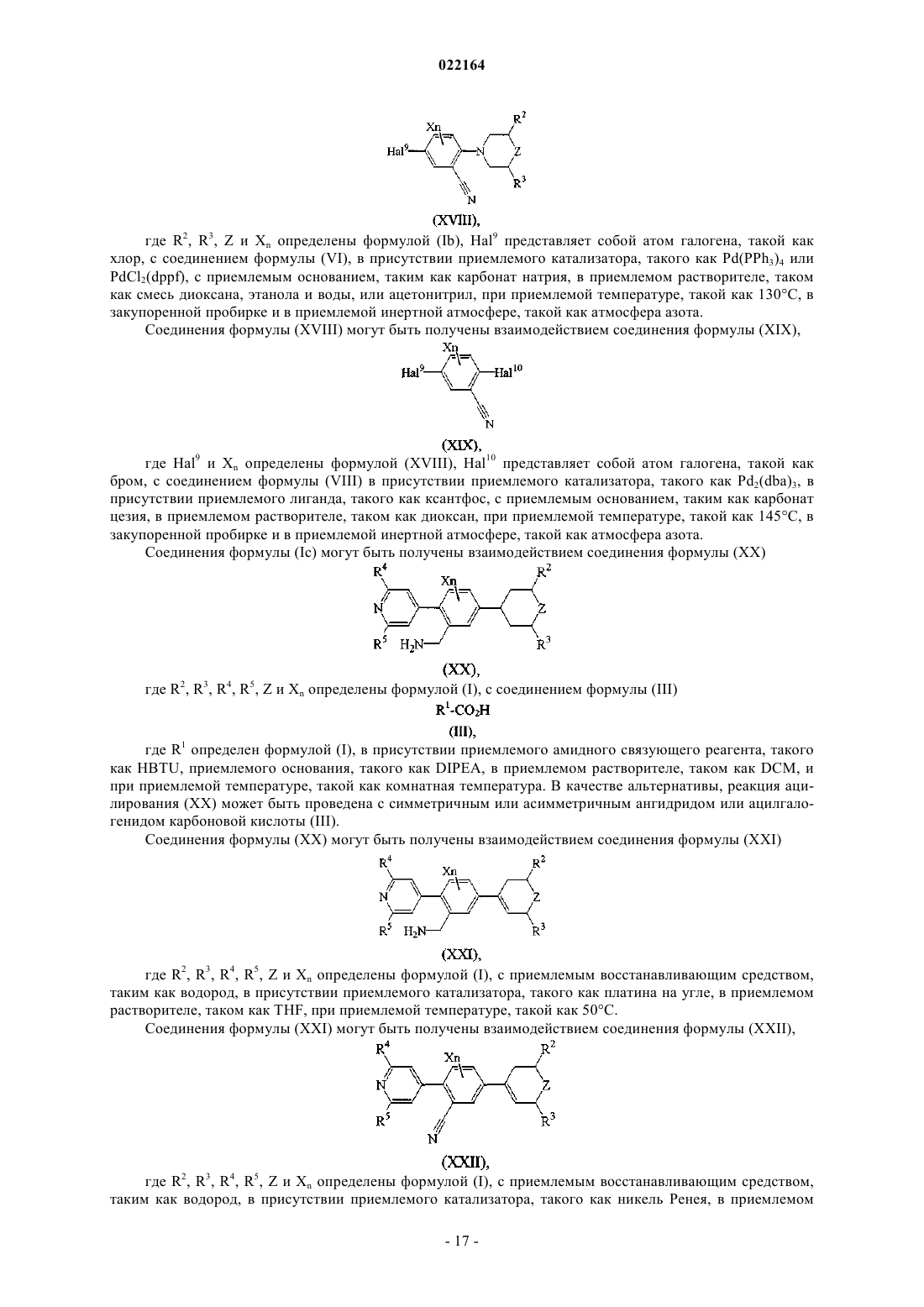
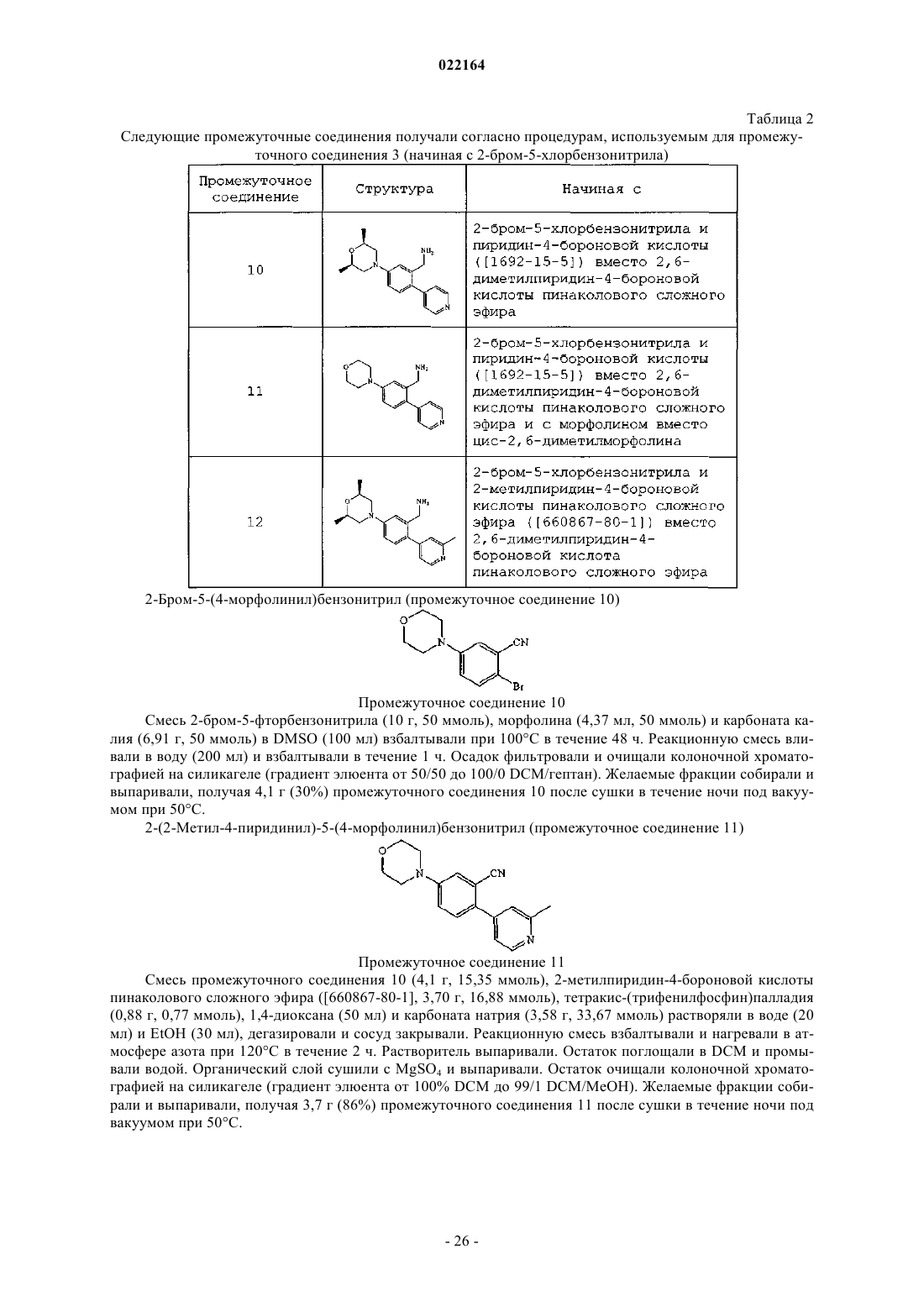
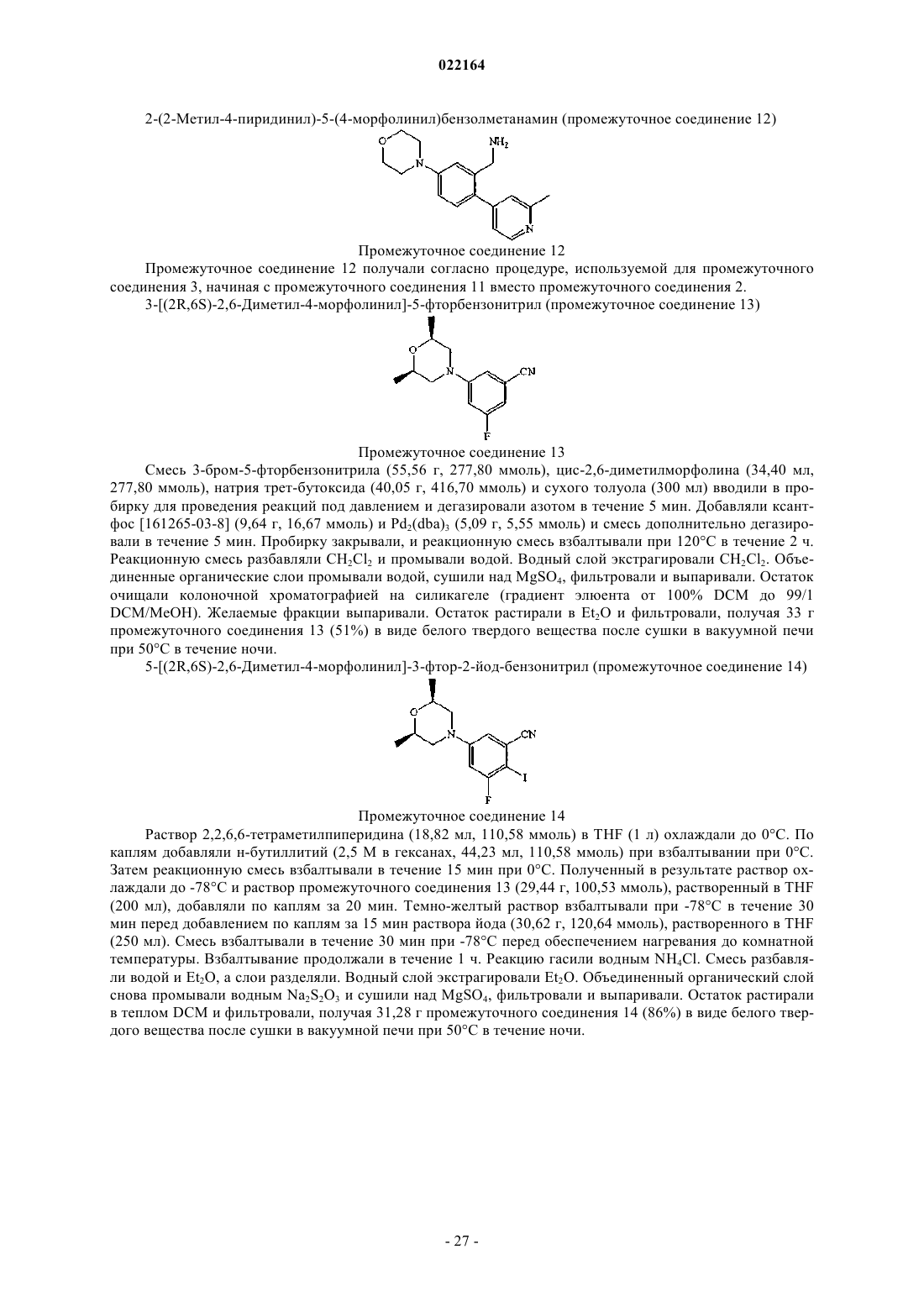
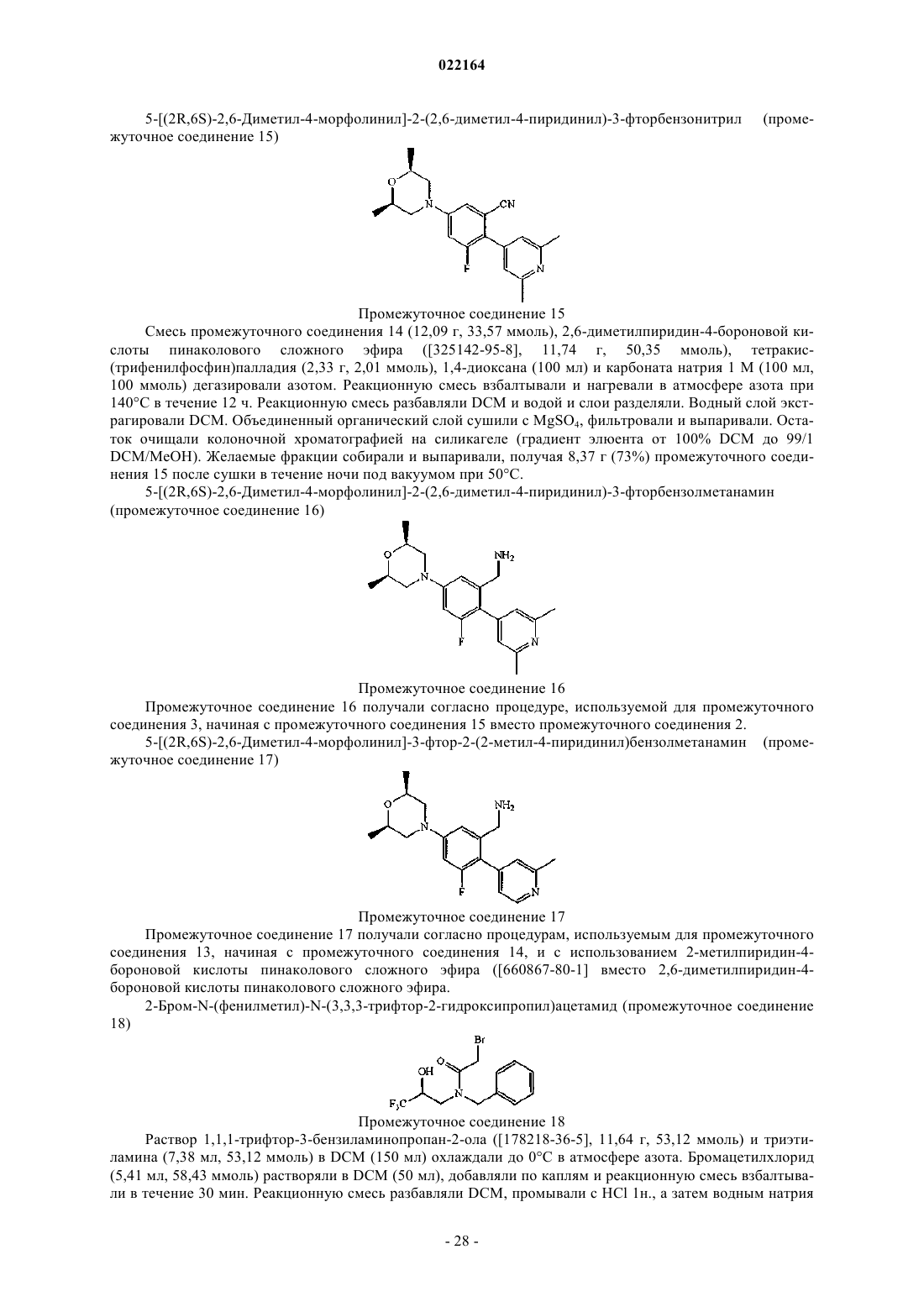
Настоящее изобретение относится к (пиридин-4-ил)бензиламидным производным и их фармацевтически приемлемым солям, способам их получения, фармацевтическим композициям,содержащим их, и к их применению в терапии. Настоящее изобретение, в частности, относится к позитивным аллостерическим модуляторам никотиновых ацетилхолиновых рецепторов, причем такие позитивные аллостерические модуляторы обладают способностью повышать эффективность агонистов никотиновых рецепторов. Де Бук Бенуа Кристиан Альберт Гилейн, Ромбу Герт, Ленартс Йозеф Элизабет, Макдональд Грегор Джеймс(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE)(ПИРИДИН-4-ИЛ)БЕНЗИЛАМИДЫ КАК АЛЛОСТЕРИЧЕСКИЕ МОДУЛЯТОРЫ АЛЬФА 7 nAChR Область изобретения Настоящее изобретение относится к (пиридин-4-ил)бензиламидам и их фармацевтически приемлемым солям, способам их получения, фармацевтическим композициям, содержащим их, и к их применению в терапии. Настоящее изобретение, в частности, относится к аллостерическим модуляторам никотиновых ацетилхолиновых рецепторов, такие аллостерические модуляторы обладают способностью повышать эффективность агонистов никотиновых рецепторов. Известный уровень техники Аллостерические модуляторы никотиновых ацетилхолиновых альфа 7 рецепторов были раскрыты вWO 2009/135944. В WO 2006/096358 раскрываются азабициклоалкановые производные как агонисты никотиновых ацетилхолиновых рецепторов. Предпосылки изобретения Холинергические рецепторы в норме связывают эндогенный нейротрансмиттер ацетилхолин (ACh),тем самым запуская открывание ионных каналов. Рецепторы ACh в центральной нервной системе млекопитающих могут быть разделены на мускариновые (mAChR) и никотиновые (nAChR) подтипы на основе агонистических активностей по отношению к мускарину и никотину соответственно. Никотиновые ацетилхолиновые рецепторы представляют управляемые лигандом ионные каналы, содержащие пять субъединиц. Представители семейства генов субъединицы nAChR были разделены на две группы на основе их аминокислотных последовательностей; при этом одна группа содержит так называемые альфа субъединицы, а вторая группа содержит бета субъединицы. Было показано, что три вида альфа субъединиц, альфа 7, альфа 8 и альфа 9, образуют функциональные рецепторы, если экспрессированы отдельно,и предполагается, что, таким образом, образуют гомоолигомерные пентамерные рецепторы. Была разработана модель аллостерического переходного состояния nAChR, которая предусматривает, по меньшей мере, состояние покоя, активированное состояние и десенситизированное состояние закрытого канала, процесс, благодаря которому рецепторы становятся нечувствительными к агонисту. Различные лиганды nAChR могут стабилизировать конформационное состояние рецептора, с которым они предпочтительно связываются. Например, агонисты ACh и (-)-никотина стабилизируют, соответственно, активные и десенситизированные состояния. Изменения активности никотиновых рецепторов были отмечены в ряде заболеваний. Некоторые из них, например миастения гравис и аутосомно-доминантная ночная лобная эпилепсия (ADNFLE), ассоциированы со снижениями активности никотиновой передачи либо вследствие уменьшения числа рецепторов, либо вследствие повышения десенситизации. Предполагается, что снижение числа никотиновых рецепторов опосредует когнитивные расстройства, наблюдаемые при заболеваниях, таких как болезнь Альцгеймера и шизофрения. Эффекты никотина из табака также опосредуются никотиновыми рецепторами, и поскольку действие никотина заключается в стабилизации рецепторов в десенситизированном состоянии, повышенная активность никотиновых рецепторов может ослабить желание курить. Соединения, связывающиеся с nAChR, были предложены для лечения ряда заболеваний, связанных со снижением холинергической функции, таких как дефицит обучаемости, дефицит когнитивных функций, дефицит внимания и потеря памяти. Модуляция активности 7-никотиновых рецепторов, как полагают, окажет благоприятное воздействие в ряде заболеваний, включающих болезнь Альцгеймера, деменцию, развивающуюся при болезни диффузных телец Леви, синдром гиперактивности с дефицитом внимания, тревогу, шизофрению, манию, биполярное эффективное расстройство, болезнь Паркинсона, болезнь Гентингтона, синдром Туретта, травму головного мозга или другие неврологические, дегенеративные и психиатрические расстройства, при которых происходит потеря холинергических синапсов, включающие синдром смены часовых поясов, пристрастие к никотину, боль. Однако лечение агонистами никотиновых рецепторов, которые оказывают воздействие на том же участке, что и ACh, является проблематичным, поскольку ACh не только активирует, но и блокирует активность рецепторов посредством процессов, включающих десенситизацию и неконкурентную блокировку. Кроме того, продолжительная активация, по-видимому, вызывает длительную инактивацию. Поэтому можно предположить, что агонисты ACh теряют эффективность при постоянном введении. В целом у никотиновых рецепторов и особенно у альфа 7 никотинового рецептора десенситизация ограничивает продолжительность действия используемого агониста. Описание изобретения Было обнаружено, что некоторые новые (пиридин-4-ил)бензиламиды могут увеличивать эффективность агонистов у никотиновых ацетилхолиновых рецепторов (nAChR). Соединения, обладающие указанным типом действия (далее называемые "позитивными аллостерическими модуляторами"), вероятно,пригодны для лечения состояний, ассоциированных со снижениями никотиновой передачи. При терапевтическом назначении такие соединения могут восстанавливать межнейронную связь без воздействия на временный профиль активации. Кроме того, позитивные аллостерические модуляторы, как полагают, не производят продолжительной инактивации рецепторов, как можно увидеть после повторного или про-1 022164 лонгированного применения агонистов. Позитивные модуляторы nAChR согласно настоящему изобретению пригодны для лечения и профилактики психических расстройств, умственных расстройств и заболеваний, воспалительных заболеваний и состояний, при которых модуляция альфа 7 никотинового рецептора оказывает благоприятное воздействие. Настоящее изобретение относится к (пиридин-4-ил)бензиламидам, проявляющим свойства позитивных аллостерических модуляторов, в частности, увеличивающим эффективность агонистов у альфа 7 никотинового рецептора. Настоящее изобретение также относится к способам их получения и фармацевтическим композициям, содержащим их. Настоящее изобретение также относится к применению этих производных для производства лекарственного препарата для лечения и профилактики психических расстройств, умственных расстройств и заболеваний, воспалительных заболеваний и состояний, при которых модуляция альфа 7 никотинового рецептора оказывает благоприятное воздействие. Настоящее изобретение, кроме того, относится к этим производным для применения при лечении и профилактике психических расстройств, умственных расстройств и заболеваний, воспалительных заболеваний и состояний, при которых модуляция альфа 7 никотинового рецептора оказывает благоприятное воздействие. В первом аспекте настоящее изобретение относится к соединению, характеризующемуся формулойX представляет собой фтор или хлор;R1 представляет собой C1-8 алкил; С 1-8 алкил, замещенный 1, 2 или 3 галогеновыми заместителями; С 3-6 циклоалкил; (С 3-6 циклоалкил)С 1-6 алкил; (C1-6 алкилокси)С 1-6 алкил; (тригалоген-С 1-4 алкилокси)С 1-6 алкил; тетрагидрофурил; тетрагидропиранил; фенил; фенил, замещенный 1, 2 или 3 заместителями, выбранными из галогена, трифторметила, трифторметокси, циано, С 1-6 алкила и С 1-4 алкилокси; или моноциклический ароматический гетероциклический радикал, содержащий по меньшей мере один гетероатом, выбранный из N, О и S, необязательно замещенный 1, 2 или, если возможно, 3 заместителями, выбранными из галогена, С 1-4 алкила, С 1-4 алкилокси, С 3-6 циклоалкила и трифторметила;R2 и R3 независимо представляют собой Н, С 1-4 алкил или трифторметил; или R2 и R3 взяты вместе с образованием 1,2-этандиила или 1,3-пропандиила;R4 и R5 независимо представляют собой Н, С 1-4 алкил, трифторметил, С 3-6 циклоалкил или С 1-4 алкилокси; или его кислотно-аддитивной соли или их сольвату. В одном варианте осуществления R1 представляет собой C1-6 алкил; С 3-6 циклоалкил; циклопропил,замещенный 1, 2, 3 или 4 метильными группами; (С 3-6 циклоалкил)C1-2 алкил; метоксиметил; фенил, замещенный 1, 2 или 3 заместителями, выбранными из фтора, хлора, метила, метокси, трифторметила,трифторметокси, циано и аминосульфонила; или фуранил, оксазолил, изоксазолил, оксадиазолил, пирролил, пиразолил, имидазолил, пиридинил, пиридиминил, пиразинил, пиридазинил или бензизоксазолил,каждый из которых незамещен или замещен 1, 2 или, если возможно, 3 заместителями, выбранными из метила, этила, пропила, изопропила, бутила, изобутила, трет-бутила, циклопропила, метокси и трифторметила. В другом варианте осуществления R1 представляет собой С 1-6 алкил; C1-4 алкил, замещенный 3 заместителями фторами; С 3-6 циклоалкил; (С 3-6 циклоалкил)C1-2 алкил; метоксиметил; метоксиэтил, (2,2,2 трифторэтокси)метил; тетрагидропиранил; фенил или фенил, замещенный 1, 2 или 3 заместителями, выбранными из фтора, хлора, трифторметила, трифторметокси, циано, метила и метокси; или фуранил, оксазолил, изоксазолил, оксадиазолил, пирролил, пиразолил, имидазолил, пиридинил, пиридиминил, пиразинил, пиридазинил, тиенил, 1,2,3-тиадиазолил, тиазолил или бензизоксазолил, каждый из которых незамещен или замещен 1, 2 или, если возможно, 3 заместителями, выбранными из метила, этила, пропила,изопропила, н-бутила, изобутила, втор-бутила, трет-бутила, циклопропила, метокси и трифторметила. В другом варианте осуществления R1 представляет собой фуранил, оксазолил, изоксазолил, пиразолил, пиридинил, пиразинил, тиенил, 1,2,3-тиадиазолил, тиазолил или бензизоксазолил, каждый из которых незамещен или замещен 1, 2 или, если возможно, 3 заместителями, выбранными из метила, изопропила, трет-бутила, циклопропила, метокси и трифторметила.-2 022164 В другом варианте осуществления R2 представляет собой водород, метил или трифторметил. В другом варианте осуществления R3 представляет собой водород, метил или трифторметил. В другом варианте осуществления R4 представляет собой водород или метил. В другом варианте осуществления R5 представляет собой водород или метил. В другом варианте осуществления R1 представляет собой метил, этил, н-пропил, изопропил, нбутил, изобутил, втор-бутил, трет-бутил, циклопропил, циклобутил, циклопентил, (циклопропил)этил,(циклопропил)метил,(циклобутил)метил,(циклогексил)метил,3-метилизоксазол-5-ил,3 метилизоксазол-4-ил, 5-метилизоксазол-3-ил, 2-метил-5-трифторметилоксазол-4-ил или 2-метилоксазол 4-ил. В другом варианте осуществления R1 представляет собой метил, этил, н-пропил, изопропил, нбутил, изобутил, втор-бутил, трет-бутил, 2,2,2-трифторэтил, 3,3,3-трифторпропил, 2-метоксиэтил, циклопропил, циклобутил, циклопентил, 1-(циклопропил)этил, (циклопропил)метил, (циклобутил)метил, 4 фтор-2-метилфенил, 3-метилизоксазол-5-ил, 3-метилизоксазол-4-ил, 5-метилизоксазол-3-ил, 2-метил-5 трифторметилоксазол-4-ил или 2-метилоксазол-4-ил. В другом варианте осуществления R1 представляет собой изопропил, циклопропил (циклопропил)метил, (циклобутил)метил, 3-метил-4-изоксазолил или 5-метилизоксазол-3-ил. В другом варианте осуществления R2 и R3 представляют собой метил или трифторметил и характеризуются цис-конфигурацией. В другом варианте осуществления R2 и R3 представляют собой метил и характеризуются трансконфигурацией. В предпочтительном варианте осуществления соединение выбрано из Конкретным соединением является N-5-[(2R,6S)-2,6-диметил-4-морфолинил]-2-(2,6-диметил-4 пиридинил)фенил]метил]-2-метилпропанамид. Предполагается, что все возможные комбинации вышеупомянутых представляющих интерес вариантов осуществления попадают в объем настоящего изобретения. При описании соединений согласно настоящему изобретению используемые термины объясняются- 11022164 согласно следующим определениям, если в контексте не указывается иное. Термин "галоген" как группа или часть группы является общим для фтора, хлора, брома, йода, если в контексте явно не указано иное. Термин "C1-8 алкил" как группа или часть группы означает гидрокарбильный радикал формулыCnH2n+1, где n является числом, варьирующим от 1 до 8. C1-8 алкильные группы содержат от 1 до 8 атомов углерода, предпочтительно от 1 до 6 атомов углерода, более предпочтительно от 1 до 4 атомов углерода,еще более предпочтительно 1-2 атомов углерода. Алкильные группы могут быть линейными или разветвленными и могут быть замещенными, как указано в настоящем документе. Если в настоящем документе после атома углерода используется нижний индекс, то нижний индекс означает число атомов углерода, которое упомянутая группа может содержать. Таким образом, например, C1-8 алкил включает все линейные или разветвленные алкильные группы с 1-8 атомами углерода и, таким образом, включает,например, метил, этил, н-пропил, изопропил, бутил и его изомеры (например, н-бутил, изобутил и третбутил), пентил, гексил, гептил, октил и их изомеры. Термин "С 1-4 алкил" как группа или часть группы означает гидрокарбильный радикал формулыCnH2n+1, где n является числом, варьирующим от 1 до 4. С 1-4 алкильные группы содержат от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода, более предпочтительно 1-2 атома углерода. С 1-4 алкил включает все линейные или разветвленные алкильные группы с 1-4 атомами углерода и, таким образом, включает, например, метил, этил, н-пропил, изопропил, бутил и его изомеры, например, нбутил, изобутил, втор-бутил и трет-бутил. Термин "C1-6 алкилокси" как группа или часть группы означает радикал, характеризующийся формулой -ORa, где Ra представляет собой C1-6 алкил. Неограничивающие примеры приемлемых алкилокси включают метилокси, этилокси, пропилокси, изопропилокси, бутилокси, изобутилокси, втор-бутилокси,трет-бутилокси, пентилокси и гексилокси. Термин "С 1-4 алкилокси" как группа или часть группы означает радикал, характеризующийся формулой -ORb, где Rb представляет собой С 1-4 алкил. Неограничивающие примеры приемлемыхC1-4 алкилокси включают метилокси (также метокси), этилокси (также этокси), пропилокси, изопропилокси, бутилокси, изобутилокси, втор-бутилокси и трет-бутилокси. Термин "галоген-С 1-4 алкилокси" как группа или часть группы означает радикал С 1-4 алкилокси, где указанный радикал C1-4 алкилокси далее замещен 1, 2 или 3 атомами галогена. Неограничивающие примеры приемлемых радикалов галоген-С 1-4 алкилокси включают трифторметилокси, трифторэтилокси,трифторпропилокси и трифторбутилокси. Термин "С 3-6 циклоалкил" отдельно или в комбинации означает циклический насыщенный углеводородный радикал с 3-6 атомами углерода. Неограничивающие примеры приемлемого цикло-С 3-6 алкила включают циклопропил, циклобутил, циклопентил и циклогексил. Выше и ниже термин "соединение формулы (I)" подразумевает включение его аддитивных солей,сольватов и стереоизомеров. Термины "стереоизомеры" или "стереохимически изомерные формы" выше или ниже применяются взаимозаменяемо. Настоящее изобретение включает все стереоизомеры соединения формулы (I) либо в виде чистого стереоизомера, либо в виде смеси двух или более стереоизомеров. Энантиомеры являются стереоизомерами, которые являются несовпадающими при наложении зеркальными отображениями друг друга. Смесь 1:1 пары энантиомеров представляет собой рацемат или рацемическую смесь. Диастереомеры (или диастереоизомеры) представляют собой стереоизомеры, которые не являются энантиомерами, т.е. они не являются зеркальными отображениями друг друга. Если соединение содержит двойную связь, заместители могут быть в Е- или Z-конфигурации. Если соединение содержит дизамещенную циклоалкильную группу, заместители могут быть в цис- или трансконфигурации. Поэтому настоящее изобретение включает энантиомеры, диастереомеры, рацематы, Еизомеры, Z-изомеры, цис-изомеры, транс-изомеры и их смеси. Абсолютная конфигурация определяется согласно системе Кана-Ингольда-Прелога. Конфигурация при ассимметричном атоме определяется либо как R, либо как S. Анализируемые соединения, абсолютная конфигурация которых неизвестна, могут быть обозначены как (+) или (-) в зависимости от направления, в котором они вращают плоскость поляризованного света. Если идентифицируется определенный стереоизомер, это означает, что указанный стереоизомер практически не содержит, т.е. связан с менее 50%, предпочтительно менее 20%, более предпочтительно менее 10%, еще более предпочтительно менее 5%, в частности менее 2% и наиболее предпочтительно менее 1% других изомеров. Таким образом, если соединение формулы (I) определяется,например, как (R), это означает, что соединение практически не содержит (S) изомер; если соединение формулы (I) определяется, например, как Е, это означает, что соединение практически не содержит Zизомер; если соединение формулы (I) определяется, например, как цис, это означает, что соединение практически не содержит транс-изомер. Солями соединений формулы (I) для терапевтического применения являются те, у которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, в получении или очистке фармацевтически приемлемого соединения. Все соли, либо являющие- 12022164 ся, либо не являющиеся фармацевтически приемлемыми, включены в объем настоящего изобретения. Вышеупомянутые и нижеупомянутые фармацевтически приемлемые кислотно- и основноаддитивные соли содержат терапевтически активные нетоксические формы кислотно- и основноаддитивных солей, которые могут образовывать соединения формулы (I). Фармацевтически приемлемые кислотно-аддитивные соли можно легко получить обработкой формы основания этой соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например хлористо-водородная или бромисто-водородная кислота, серная, азотная,фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая,гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая,памоевая и подобные кислоты. В свою очередь, формы указанных солей могут быть превращены обработкой соответствующим основанием в форму свободного основания. Термин "сольваты" означает гидраты и алкоголяты, которые могут образовывать соединения формулы (I), а также их соли. Химические названия соединений согласно настоящему изобретению были получены согласно правилам номенклатуры, принятыми Химической реферативной службой с использованием номенклатурного программного обеспечения Advanced Chemical Development, Inc. (ACD/Name версия продукта 10.01;Build 15494, 1 Dec 2006). Некоторые из соединений формулы (I) также могут существовать в своей таутомерной форме. Такие формы, хотя четко не указаны в вышеприведенной формуле, предназначены для включения в объем настоящего изобретения. Получение соединений. В зависимости от положения ациламинометиленовой группы на фенильном фрагменте, и от того,представляет ли Y N или СН, могут быть выделены три подгруппы формул (Ia), (Ib) и (Ic), для синтеза каждой из которых имеется собственная методика. Соединения формулы (Ia) могут быть получены взаимодействием соединения формулы (II) где R2, R3, R4, R5, Z и Xn определены формулой (I), с соединением формулы R1-CO2H (III), где R1 определен формулой (I), в присутствии приемлемого амидного связующего реагента, такого как HBTU,приемлемого основания, такого как DIPEA, в приемлемом растворителе, таком как DCM, и при приемлемой температуре, такой как комнатная температура. В качестве альтернативы, реакция ацилирования(II) может быть проведена с симметричным или асимметричным ангидридом или ацилгалогенидом кар- 13022164 боновой кислоты (III). Соединения формулы (II) могут быть получены взаимодействием соединения формулы (IV) где R2, R3, R4, R5, Z и Xn определены формулой (I), с приемлемым восстанавливающим средством,таким как водород, в присутствии приемлемого катализатора, такого как никель Ренея, в приемлемом растворителе, таком как 7 М аммиака в метаноле, при приемлемой температуре, такой как комнатная температура. Соединения формулы (IV) могут быть получены взаимодействием соединения формулы (V) где R2, R3, Z и Xn определены формулой (I), Hal1 представляет собой атом галогена, такого как йод,бром или хлор, с соединением формулы (VI)Pd(PPh3)4, с приемлемым основанием, таким как карбонат натрия, в приемлемом растворителе, таком как 1,4-диоксан и этанол/вода (1:1), и при приемлемой температуре, такой как 120 С в закупоренной пробирке, в приемлемой инертной атмосфере, такой как атмосфера азота. Соединения формулы (V) могут быть получены взаимодействием соединения формулы (VII) где Hal1 и Xn определены формулой (V), a Hal2 представляет собой атом галогена, такой как фтор, с соединением формулы (VIII) где R2, R3 и Z определены формулой (I), в присутствии приемлемого основания, такого как карбонат калия, в приемлемом растворителе, таком как DMSO, при приемлемой температуре, такой как 100 С. В качестве альтернативы, соединения формулы (V) могут быть получены взаимодействием соединения формулы (IX) где R2, R3, Z и Xn определены формулой (V), с приемлемым основанием, таким как тетраметилпиперидид лития, и галогеном (Hal1)2, таким как йод, в приемлемом растворителе, таком как THF, при приемлемой температуре, такой как -78 С, и в приемлемой инертной атмосфере, такой как атмосфера азота. Соединения формулы (IX) могут быть получены взаимодействием соединения формулы (X) где Xn определен формулой (IX), Hal3 представляет собой атом галогена, такой как бром, с соединением формулы (VIII) в присутствии приемлемого катализатора, такого как Pd2(dba)3 или катализатор Nolan [478980-01-7], приемлемого лиганда, такого как ксантфос, и приемлемого основания, такого как третбутанолат натрия, в приемлемом растворителе, таком как толуол или моноглим, при приемлемой температуре, такой как 120 С, в закупоренной пробирке и в приемлемой инертной атмосфере, такой как атмосфера азота. В качестве альтернативы, соединения формулы (IV) могут быть получены взаимодействием соединения формулы (XI) где R4, R5 и Xn определены формулой (I), Hal4 представляет собой атом галогена, такой как хлор или бром, с соединением формулы (VIII) в присутствии приемлемого катализатора, такого как Pd2(dba)3 или катализатор Nolan [478980-01-7], приемлемого лиганда, такого как ксантфос, и приемлемого основания,такого как трет-бутанолат натрия, в приемлемом растворителе, таком как толуол или моноглим, при приемлемой температуре, такой как 120 С, в закупоренной пробирке и в приемлемой инертной атмосфере,такой как атмосфера азота. Соединения формулы (XI) могут быть получены взаимодействием соединения формулы (XII) где Hal4 и Xn определены формулой (XI), Hal5 представляет собой атом галогена, такой как бром или йод, с соединением формулы (VI) в присутствии приемлемого катализатора, такого как Pd(PPh3)4, с приемлемым основанием, таким как карбонат натрия или карбонат калия, в приемлемом растворителе,таком как 1,4-диоксан или диметоксиэтан и вода, и при приемлемой температуре, такой как 100 С, в закупоренной пробирке и в приемлемой инертной атмосфере, такой как атмосфера азота. В качестве альтернативы, соединения формулы (IV) могут быть получены взаимодействием соединения формулы (XIII) где R2, R3, R4, R5, Z и Xn определены формулой (I), Hal6 представляет собой атом галогена, такой как- 15022164 бром, с приемлемой цианидной солью, такой как цианид цинка, в присутствии приемлемого катализатора, такого как Pd(PPh3)4, и в присутствии приемлемого лиганда, такого как трифенилфосфин, в приемлемом растворителе, таком как ацетонитрил, и при приемлемой температуре, такой как 150 С, в закупоренной пробирке и в приемлемой инертной атмосфере, такой как атмосфера азота. Соединения формулы (XIII) могут быть получены взаимодействием соединения формулы (XIV) где R4, R5, Xn и Hal6 определены формулой (XIII), Hal7 представляет собой атом галогена, такой как бром, с соединением формулы (VIII) в присутствии приемлемого катализатора, такого как Pd2(dba)3, приемлемого лиганда, такого как ксантфос, и приемлемого основания, такого как трет-бутанолат натрия, в приемлемом растворителе, таком как толуол, при приемлемой температуре, такой как 120 С, в закупоренной пробирке и в приемлемой инертной атмосфере, такой как атмосфера азота. Соединения формулы (XIV) могут быть получены взаимодействием соединения формулы (XV) где Xn, Hal6 и Hal7 определены формулой (XIV), Hal8 представляет собой атом галогена, такой как йод, с соединением формулы (VI) в присутствии приемлемого катализатора, такого как Pd(PPh3)4, в присутствии приемлемого основания, такого как карбонат калия, в приемлемом растворителе, таком как диметоксиэтан, и при приемлемой температуре, такой как 100 С, в закупоренной пробирке и в приемлемой инертной атмосфере, такой как атмосфера азота. Соединения формулы (Ib) могут быть получены взаимодействием соединения формулы (XVI) где R2, R3, R4, R5, Z и Xn определены формулой (Ib), с соединением формулы (III) в присутствии приемлемого амидного связующего реагента, такого как HBTU, приемлемого основания, такого как DIPEA, в приемлемом растворителе, таком как DCM, и при приемлемой температуре, такой как комнатная температура. В качестве альтернативы, реакция ацилирования (XVI) может быть проведена с симметричным или асимметричным ангидридом или ацилгалогенидом карбоновой кислоты (III). Соединения формулы (XVI) могут быть получены взаимодействием соединения формулы (XVII) где R2, R3, R4, R5, Z и Xn определены формулой (Ib), с приемлемым восстанавливающим средством,таким как водород, в присутствии приемлемого катализатора, такого как никель Ренея, в приемлемом растворителе, таком как 7 М аммиака в метаноле, при приемлемой температуре, такой как комнатная температура. Соединения формулы (XVII) могут быть получены взаимодействием соединения формулы (XVIII) где R2, R3, Z и Xn определены формулой (Ib), Hal9 представляет собой атом галогена, такой как хлор, с соединением формулы (VI), в присутствии приемлемого катализатора, такого как Pd(PPh3)4 илиPdCl2(dppf), с приемлемым основанием, таким как карбонат натрия, в приемлемом растворителе, таком как смесь диоксана, этанола и воды, или ацетонитрил, при приемлемой температуре, такой как 130 С, в закупоренной пробирке и в приемлемой инертной атмосфере, такой как атмосфера азота. Соединения формулы (XVIII) могут быть получены взаимодействием соединения формулы (XIX), где Hal9 и Xn определены формулой (XVIII), Hal10 представляет собой атом галогена, такой как бром, с соединением формулы (VIII) в присутствии приемлемого катализатора, такого как Pd2(dba)3, в присутствии приемлемого лиганда, такого как ксантфос, с приемлемым основанием, таким как карбонат цезия, в приемлемом растворителе, таком как диоксан, при приемлемой температуре, такой как 145 С, в закупоренной пробирке и в приемлемой инертной атмосфере, такой как атмосфера азота. Соединения формулы (Ic) могут быть получены взаимодействием соединения формулы (XX) где R1 определен формулой (I), в присутствии приемлемого амидного связующего реагента, такого как HBTU, приемлемого основания, такого как DIPEA, в приемлемом растворителе, таком как DCM, и при приемлемой температуре, такой как комнатная температура. В качестве альтернативы, реакция ацилирования (XX) может быть проведена с симметричным или асимметричным ангидридом или ацилгалогенидом карбоновой кислоты (III). Соединения формулы (XX) могут быть получены взаимодействием соединения формулы (XXI) где R2, R3, R4, R5, Z и Xn определены формулой (I), с приемлемым восстанавливающим средством,таким как водород, в присутствии приемлемого катализатора, такого как платина на угле, в приемлемом растворителе, таком как THF, при приемлемой температуре, такой как 50 С. Соединения формулы (XXI) могут быть получены взаимодействием соединения формулы (XXII), где R2, R3, R4, R5, Z и Xn определены формулой (I), с приемлемым восстанавливающим средством,таким как водород, в присутствии приемлемого катализатора, такого как никель Ренея, в приемлемом- 17022164 растворителе, таком как 7 М аммиака в метаноле, при приемлемой температуре, такой как комнатная температура. Соединения формулы (XXII) могут быть получены взаимодействием соединения формулы (XXIII) где R2, R3 и Z определены формулой (I), R6 представляет собой C1-6 алкил или оба R6 вместе образуют С 2-8 алкандиил, с соединением формулы (XI) в присутствии приемлемого катализатора, такого какPd(PPh3)4, с приемлемым основанием, таким как карбонат калия, в приемлемом растворителе, таком как диметоксиэтан, при приемлемой температуре, такой как 100 С, в приемлемой инертной атмосфере, такой как атмосфера азота. Соединения формулы (XXIII) могут быть получены взаимодействием соединения формулы (XXIV) где R2, R3 и Z определены формулой (I), с приемлемым производным бора, таким как бис(пинаколато)дибор, в присутствии приемлемого катализатора, такого как PdCl2(dppf), в присутствии приемлемого лиганда, такого как dppf, с приемлемым основанием, таким как ацетат калия, в приемлемом растворителе, таком как диметоксиэтан, при приемлемой температуре, такой как 80 С, в приемлемой инертной атмосфере, такой как атмосфера азота. Соединения формулы (XXIV) могут быть получены взаимодействием соединения формулы (XXV) где R2, R3 и Z определены формулой (I), с приемлемым основанием, таким как LDA, и с приемлемым сульфонилирующим средством, таким как перфторбутансульфонилфторид, в приемлемом растворителе, таком как THF, при приемлемой температуре, такой как -78 С, в приемлемой инертной атмосфере, такой как атмосфера азота. Фармакология. Было выявлено, что соединения согласно настоящему изобретению являются позитивными аллостерическими модуляторами альфа 7 никотинового рецептора. Альфа 7 никотиновый рецептор (альфа 7nAChR) принадлежит надсемейству цис-петельных, ионотропных управляемых лигандом ионных каналов, которые включают семейства рецепторов 5-НТ 3, GABAA и семейство глицинового рецептора. Он активируется ацетилхолином и его продуктом деградации холином, и главной особенностью альфа 7nAChR является его быстрая десенсибилизация в постоянном присутствии агониста. Он является вторым наиболее обширным подтипом никотиновых рецепторов в головном мозге, а также является важным регулятором высвобождения многих нейротрансмиттеров. Он характеризуется дискретным распределением в некоторых структурах головного мозга, имеющих отношение к процессам внимания и когнитивным процессам, таких как гиппокамп и префронтальная кора, и вовлекается в ряд психиатрических и неврологических расстройств у людей. Он также вовлекается в холинергический воспалительный путь. Генетическое доказательство его связи с шизофренией проявляется в форме прочной связи между маркером шизофрении (дефицит фильтрации сенсорной информации) и локусом альфа 7 на 15q13-14 и полиморфизмов в коровой промоторной области гена альфа 7. Патологические данные указывают на потерю альфа 7 иммунореактивности и связывание бунгаротоксина (Btx) в гиппокампе, лобной и передней поясной коре головного мозга больных шизофренией, при болезни Паркинсона и болезни Альцгеймера, а также в паравентрикулярном ядре и в nucleusreuniens при аутизме. Фармакологические данные, такие как отмеченная привычка к курению больных шизофренией по сравнению с нормой, были интерпретированы как попытка пациентов заниматься самолечением, чтобы компенсировать дефицит альфа 7 никотинергической передачи. Временная нормализация дефектов- 18022164 фильтрации сенсорной информации (преимпульсное ингибирование, PPI) и на животных моделях, и у человека при введении никотина и временное восстановление нормальной фильтрации сенсорной информации у больных шизофренией, когда холинергическая активность переднего мозга низкая (например, 2 этап сна), были интерпретированы как результат временной активация альфа 7 никотинового рецептора с последующей десенсибилизацией. Таким образом, есть основания полагать, что активация альфа 7 nAChR будет оказывать терапевтически благоприятное воздействие на ряд расстройств CNS (психиатрических и неврологических). Как уже упоминалось, альфа 7 nAChR легко десенсибилизирует в постоянном присутствии природного трансмиттерного ацетилхолина, а также экзогенных лигандов, таких как никотин. В десенсибилизированном состоянии рецептор остается связанным с лигандом, но функционально неактивным. Это не является проблемой для природных трансмиттеров, таких как ацетилхолин и холин, поскольку они являются субстратами для очень мощных механизмов разрушения (ацетилхолинэстераза) и клиренса (холиновый транспортер). Эти трансмиттерные механизмы разрушение/клиренс, вероятно, поддерживают баланс между активируемыми и десенсибилизированными альфа 7 nAChR в физиологически приемлемом диапазоне. Однако синтетические агонисты, которые не являются субстратами для природных механизмов разрушения и клиренса, как выявлено, обладают потенциальной способностью как к надстимуляции, так и к смещению популяционного равновесия альфа 7 nAChR в сторону целенаправленно десенсибилизированного состояния, что нежелательно при расстройствах, при которых играет роль недостаток экспрессии или функции альфа 7 nAChR. Агонисты по своей природе должны быть направлены на связывающий ACh "карман", который является высококонсервативным для всех различных подтипов никотиновых рецепторов, что ведет к возможности побочных реакций из-за неспецифичной активации других подтипов никотиновых рецепторов. Поэтому для предотвращения таких потенциальных препятствий существует альтернативная терапевтическая стратегия по отношению к агонизму альфа 7, заключающаяся в усилении реагирования рецепторов на природных агонистов с позитивным аллостерическим модулятором (РАМ). РАМ определяется как средство, которое связывается с участком, отличным от участка связывания агониста, и поэтому предполагается, что оно не обладает агонистическими или десенсибилизирующими свойствами, но усиливает чувствительность альфа 7 nAChR к природному трансмиттеру. Ценность этой стратегии в том, что для данного количества трансмиттера величина реакции альфа 7nAChR возрастает в присутствии РАМ относительно уровня передачи, возможной в его отсутствие. Кроме того, РАМ также может усиливать эффективность природного трансмиттера. Так для расстройств,при которых наблюдается дефицит белка альфа 7 nAChR, может быть полезным индуцированное РАМ усиление альфа 7 никотинергической передачи. Поскольку РАМ зависит от присутствия природного трансмиттера, возможность надстимуляции ограничивается механизмами разрушения/клиренса для природного трансмиттера. Соединения согласно настоящему изобретению классифицируются на типы 1-4 на основе качественных кинетических свойств, как определено с помощью регистрации фиксации напряжения на целых клетках. Эта классификация основывается на эффекте соединения альфа 7 РАМ, как описано выше, на сигнал, вызванный применением агониста. В частности, указанный агонист представляет собой холин в концентрации 1 мМ. В предпочтительной постановке эксперимента указанное соединение альфа 7 РАМ и холин одновременно применяются к клетке, как описано ниже. Десенсибилизация определяется как закрытие рецептора при активации во время применения агониста при электрофизиологических измерениях фиксации напряжения на целых клетках, что наблюдается как снижение выходящего тока после начальной активации агонистом. Ниже описано определение типов РАМ 1-4. Тип 0. Соединения минимально изменяют величину эффекта тока, вызванного 1 мМ холина. Тип 1. Соединения изменяют величину эффекта тока, вызванного 1 мМ холина, но минимально изменяют кинетические показатели рецептора. В частности, не влияют на скорость и степень десенсибилизации и деактивации рецептора, вызванных агонистом. Модулированная соединением реакция на 1 мМ холина поэтому близка к линейному масштабированию реакции на 1 мМ холина в отсутствие соединения альфа 7 РАМ. Тип 2. Соединения повышают величину эффекта тока, вызванного 1 мМ холина, при этом снижают скорость и/или степень десенсибилизации. Деактивация рецептора, как правило, не затрагивается. Тип 3. Соединения повышают величину эффекта тока, вызванного 1 мМ холина. При тестировании при более высоких концентрациях до 10 мкМ они полностью ингибируют десенсибилизацию, в частности, применение 1 мМ холина за 250 мс. Деактивация рецептора может быть замедлена. Тип 4. Соединения обеспечивают начальную десенсибилизацию рецептора с последующим повторным открытием рецептора во время применения агониста. При низкоэффективных концентрациях соединения альфа 7 РАМ, индуцированная агонистом активация, за которой следует десенсибилизация,может все еще быть отделена от индуцированного соединением повторного открытия как максимум начального входящего тока. При более высоких эффективных концентрациях соединения альфа 7 РАМ,повторное открытие происходит быстрее, чем закрытие из-за десенсибилизации так, что максимум начального тока исчезает.- 19022164 Соединение рассматривали как обладающее представляющей интерес подобной РАМ активностью,если потенциирование пикового тока составляло по меньшей мере 200% по сравнению с реакцией на контрольный холин (=100%). Такие соединения классифицируются как принадлежащие определенному типу РАМ в экспериментальной части. Соединения, которые не отвечают условию, не классифицируются как принадлежащие определенному типу РАМ. Можно подтвердить активность ряда соединений согласно настоящему изобретению с помощью теста потенциала, вызванного слуховым раздражением. Линия инбредных мышей DBA/2, используемая в этом тесте, показала дефицит обработки сенсорной информации, подобный таковому у пациентов с шизофренией, что также коррелирует с уменьшением никотиновых альфа 7 рецепторов в гиппокампе. Подтвердили, что мышь DBA/2 является применяемой моделью подобных таковым при шизофрении дефицитам обработки сенсорной информации. Посредством исследований на человеке эффектов никотина на обработку сенсорной информации прогнозировались результаты, полученные на мыши DBA/2, a исследованиями селективного альфа 7 агониста GTS-21 на мышах DBA/2 прогнозировались эффекты на людях. Поэтому эта модель способности фильтрации сенсорной информации обладает высокой переходной релевантностью. Следовательно, целью настоящего изобретения является обеспечение способов лечения, которые предусматривают либо введение позитивного аллостерического модулятора в качестве единственного активного вещества, что, таким образом, модулирует активность агонистов эндогенного никотинового рецептора, такого как ацетилхолин или холин, либо введение позитивного аллостерического модулятора вместе с агонистом никотинового рецептора. В конкретной форме этого аспекта настоящего изобретения способ лечения предусматривает лечение позитивным аллостерическим модулятором альфа 7 никотинового рецептора, как описано в настоящем документе, и агонистом альфа 7 никотинового рецептора или частичным агонистом. Примеры приемлемых соединений с агонистической активностью по отношению к альфа 7 никотиновому рецептору включают 1,4-диазабицикло[3.2.2]нонан-4-карбоновой кислоты 4-бромфенилового сложного эфира моногидрохлорид (SSR180711A);TC-5619. В частности, примеры приемлемых соединений с агонистической активностью по отношению к 7 никотиновому рецептору включают 1,4-диазабицикло[3.2.2]нонан-4-карбоновой кислоты 4 бромфенилового сложного эфира моногидрохлорид (SSR180711A); (-)-спиро[1-азабицикло[2.2.2.]октан 3,5'-оксазолидин]-2'-он; 3-[(2,4-диметокси)бензилиден]анабазеина дигидрохлорид (GTS-21); [N-[(3R)-1 азабицикло[2.2.2]окт-3-ил]-4-хлорбензамида гидрохлорид] PNU-282987; никотин; варениклин; МЕМ 3454; AZD-0328 и МЕМ 63908. Позитивные модуляторы nAChR согласно настоящему изобретению применимы для лечения или профилактики психических расстройств, умственных расстройств или заболеваний или состояний, при которых полезна модуляция активности альфа 7 никотинового рецептора. Конкретным аспектом способа согласно настоящему изобретению является способ лечения дефицита обучаемости, дефицита когнитивных функций, дефицита внимания или потери памяти, полагают, что модуляция активности альфа 7 никотинового рецептора полезна при ряде заболеваний, в том числе болезни Альцгеймера, деменции, развивающейся при болезни диффузных телец Леви, синдрома гиперактивности с дефицитом внимания,тревоги, шизофрении, мании, биполярной депрессии, болезни Паркинсона, болезни Гентингтона, синдрома Туретта, травмы головного мозга или других неврологических, дегенеративных или психиатрических нарушений, при которых происходит потеря холинергических синапсов, в том числе синдром смены часовых поясов, пристрастие к никотину, боль. Соединения также могут найти терапевтическое применение в качестве противовоспалительных лекарственных препаратов, поскольку субъединица альфа 7 никотинового ацетилхолинового рецептора- 20022164 является необходимой для ингибирования синтеза цитокинов холинергическим воспалительным путем. Примерами показаний, которые можно лечить соединениями, являются эндотоксикоз, эндотоксиновый шок, сепсис, ревматоидный артрит, астма, рассеянный склероз, псориаз, уртикария, воспалительное заболевание кишечника, воспалительное заболевание желчных протоков, болезнь Крона, язвенный колит,послеоперационный илеус, панкреатит, сердечная недостаточность, острое повреждение легких и отторжение аллотрансплантата. Соединения согласно настоящему изобретению могут найти терапевтическое применение при таких показаниях, как когнитивное нарушение при шизофрении, когнитивное нарушение при болезни Альцгеймера, умеренное когнитивное нарушение, болезнь Паркинсона, синдром гиперактивности с дефицитом внимания, язвенный колит, панкреатит, артрит, сепсис, послеоперационный илеус и острое повреждение легких. В свете описанных выше фармакологических свойств соединения формулы (I) или какая-либо их подгруппа, их фармацевтически приемлемые аддитивные соли, сольваты и стереохимически изомерные формы могут быть использованы в качестве лекарственного препарата. В частности, соединения в соответствии с настоящим изобретением могут быть использованы для изготовления лекарственного препарата для лечения или профилактики психических расстройств, умственных расстройств или заболеваний или состояний, при которых полезна модуляция альфа 7 никотинового рецептора. В варианте осуществления настоящее изобретение относится к соединениям формулы (I) для применения в лечении или профилактике, в частности в лечении, психических расстройств, умственных расстройств или заболеваний или состояний, при которых полезна модуляция альфа 7 никотинового рецептора. В варианте осуществления настоящее изобретение относится к соединениям формулы (I) для применения в лечении или профилактике, в частности, в лечении, психических расстройств, умственных расстройств или воспалительных заболеваний. В варианте осуществления настоящее изобретение относится к соединениям формулы (I) для лечения или предупреждения, в частности лечения, указанных заболеваний или состояний. Что касается применимости соединений формулы (I), представлен способ лечения или предупреждения у теплокровных животных, включая людей, страдающих от заболеваний, при которых полезна модуляция альфа 7 никотинового рецептора, таких как шизофрения, мания и биполярная депрессия, тревога, болезнь Альцгеймера, дефицит обучаемости, дефицит когнитивных функций, дефицит внимания,потеря памяти, деменция, развивающаяся при болезни диффузных телец Леви, синдром гиперактивности с дефицитом внимания, болезнь Паркинсона, болезнь Гентингтона, синдром Туретта, травма головного мозга, синдром смены часовых поясов, пристрастие к никотину, боль. Указанные способы предусматривают введение, а именно системное или местное введение, предпочтительно пероральное введение, эффективного количества соединения формулы (I), его стереохимически изомерной формы, фармацевтически приемлемой аддитивной соли или их сольвата теплокровным животным, включая людей. Специалисту в данной области будет понятно, что терапевтически эффективным количеством РАМ согласно настоящему изобретению является количество, достаточное для модуляции активности альфа 7 никотинового рецептора, и что это количество варьирует inter alia в зависимости от типа заболевания,концентрации соединения в терапевтическом составе и состояния пациента. Как правило, количество РАМ, подлежащее введению в качестве терапевтического средства для лечения заболеваний, при которых полезна модуляция альфа 7 никотинового рецептора, таких как шизофрения, мания и биполярная депрессия, тревога, болезнь Альцгеймера, дефицит обучаемости, дефицит когнитивных функций, дефицит внимания, потеря памяти, деменция, развивающаяся при болезни диффузных телец Леви, синдром гиперактивности с дефицитом внимания, болезнь Паркинсона, болезнь Гентингтона, синдром Туретта,травма головного мозга, синдром смены часовых поясов, пристрастие к никотину и боль, будет определяться в каждом конкретном случае лечащим врачом. Как правило, приемлемой дозой является доза, которая дает в результате концентрацию РАМ на участке лечения в диапазоне от 0,5 нМ до 200 мкМ и более типично от 5 нМ до 50 мкМ. Для получения таких терапевтических концентраций пациенту, нуждающемуся в таком лечении, будет введено от 0,01 до 2,50 мг/кг веса тела, в частности от 0,1 до 0,50 мг/кг веса тела. Количество соединения в соответствии с настоящим изобретением, также названного в настоящем документе активным ингредиентом, которое необходимо для достижения терапевтического эффекта, конечно, варьирует в каждом конкретном случае в зависимости от конкретного соединения, пути введения, возраста и состояния реципиента и конкретного расстройства или заболевания, подлежащего лечению. Способ лечения также может предусматривать введение активного ингредиента с режимом от одного до четырех приемов в сутки. В этих способах лечения соединения в соответствии с настоящим изобретением предпочтительно составляются перед приемом. Как описано в настоящем документе ниже, приемлемые фармацевтические составы получают согласно известным процедурам с использованием хорошо известных и легкодоступных ингредиентов.- 21022164 Фармацевтические композиции. Настоящее изобретение также относится к композициям для предупреждения или лечения заболеваний, при которых полезна модуляция альфа 7 никотинового рецептора, таких как шизофрения, мания и биполярная депрессия, тревога, болезнь Альцгеймера, дефицит обучаемости, дефицит когнитивных функций, дефицит внимания, потеря памяти, деменция, развивающаяся при болезни диффузных телец Леви, синдром гиперактивности с дефицитом внимания, болезнь Паркинсона, болезнь Гентингтона, синдром Туретта, травма головного мозга, синдром смены часовых поясов, пристрастие к никотину и боль. Указанные композиции содержат терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемого носителя или разбавителя. Хотя можно активный ингредиент вводить отдельно, предпочтительным является присутствие его в виде фармацевтической композиции. Следовательно, настоящее изобретение, кроме того, относится к фармацевтической композиции, содержащей соединение в соответствии с настоящим изобретением вместе с фармацевтически приемлемым носителем или разбавителем. Носитель или разбавитель должен быть "приемлемым" в смысле совместимости с другими ингредиентами композиции и не должен быть вредным для его реципиентов. Фармацевтические композиции в соответствии с настоящим изобретением могут быть получены любыми способами, хорошо известными в уровне техники фармации, например, с использованием способов, таких как описанные в Gennaro et al. Remington's Pharmaceutical Sciences (18th ed., Mack PublishingCompany, 1990, в особенности см. Part 8: Pharmaceutical preparations and their Manufacture). Терапевтически эффективное количество конкретного соединения в форме основания или в форме аддитивной соли как активного ингредиента комбинируется в однородной смеси с фармацевтически приемлемым носителем, который может принимать формы в широком диапазоне в зависимости от формы препарата, желаемого для введения. Такие фармацевтические композиции желательно находятся в единичной дозированной форме, приемлемой предпочтительно для системного введения, такого как перорального, чрескожного или парентерального введения; или для местного введения, такого как путем ингаляции, назального аэрозоля, глазных капель или путем крема, геля, шампуни или т.п. Например, при получении композиций в пероральной дозированной форме может быть использована любая из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов,таких как суспензии, сиропы, эликсиры и растворы, или твердые носители, такие как крахмалы, сахар,каолин, смазывающие средства, связующие, дезинтегрирующие средства и т.п., в случае порошков, пилюль, капсул и таблеток. Поскольку их легко вводить, таблетки и капсулы представляют наиболее предпочтительную пероральную дозированную единичную форму, в случае которой, конечно, используются твердые фармацевтические носители. Для парентеральных композиций носитель, как правило, будет содержать стерильную воду, по меньшей мере, в значительной степени, хотя могут быть включены другие ингредиенты, например, для растворимости. Могут быть получены, например, инъекционные растворы,в которых носитель включает солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Также могут быть получены инъекционные суспензии, в случае которых могут использоваться соответствующие жидкие носители, суспендирующие средства и т.п. В композициях, приемлемых для чрескожного введения, носитель необязательно содержит усиливающее проницаемость средство и/или приемлемое смачивающее средство, необязательно комбинированное с приемлемыми вспомогательными средствами любой природы в малых количествах, причем вспомогательные средства не оказывают какие-либо значительные пагубные эффекты на кожу. Указанные вспомогательные средства могут облегчать введение на кожу и/или могут использоваться для получения желаемых композиций. Эти композиции могут быть введены различными путями, например, как трансдермальный пластырь, как точечное нанесение или как мазь. Особенно предпочтительно составлять вышеупомянутые фармацевтические композиции в дозированные единичные формы для простоты введения и равномерности дозировки. Дозированная единичная форма, как использовано в описании и формуле изобретения в настоящем документе, означает физически дискретные единицы, приемлемые как единичные дозировки, причем каждая единица содержит определенное количество активного ингредиента, рассчитанного для получения желаемого терапевтического эффекта, вместе с нужным фармацевтическим носителем. Примерами таких дозированных единичных форм являются таблетки (в том числе с насечкой или покрытые таблетки), капсулы, пилюли,пакеты с порошком, облатки, инъекционные растворы или суспензии, полные чайные ложки, полные столовые ложки и т.п., а также их разделенные множественные формы. Точная дозировка и частота введения зависят от конкретного используемого соединения формулы(I), конкретного состояния, подлежащего лечению, тяжести состояния, подлежащего лечению, возраста,веса, пола, степени расстройства и общего физического состояния конкретного пациента, а также от другого медицинского препарата, который индивидуум может принимать, как хорошо известно специалисту в данной области. Кроме того, очевидно, что указанное эффективное суточное количество можно понижать или повышать в зависимости от реакции субъекта, получающего лечение, и/или в зависимости от оценивания назначаемых врачом соединений в соответствии с настоящим изобретением. В зависимости от пути введения фармацевтическая композиция будет содержать от 0,05 до 99- 22022164 вес.%, предпочтительно от 0,1 до 70 вес.%, более предпочтительно от 0,1 до 50 вес.% активного ингредиента и от 1 до 99,95 вес.%, предпочтительно от 30 до 99,9 вес.%, более предпочтительно от 50 до 99,9 вес.% фармацевтически приемлемого носителя, причем все процентные отношения основаны на общем весе композиции. Количество соединения формулы (I), которое может быть объединено с материалом-носителем с получением одиночной дозированной формы, будет варьировать в зависимости от заболевания, которое лечат, видов млекопитающих и конкретного способа введения. Однако, в качестве общего руководства,приемлемые единичные дозы для соединений согласно настоящему изобретению могут, например, предпочтительно составлять от 0,1 до приблизительно 1000 мг активного соединения. Предпочтительная единичная доза составляет от 1 до приблизительно 500 мг. Более предпочтительная единичная доза составляет от 1 до приблизительно 300 мг. Еще более предпочтительная единичная доза составляет от 1 до приблизительно 100 мг. Такие единичные дозы могут вводиться более одного раза в сутки, например 2,3, 4, 5 или 6 раз в сутки, но предпочтительно 1 или 2 раза в сутки, так, что общая дозировка для взрослого весом 70 кг находится в диапазоне от 0,001 до приблизительно 15 мг на 1 кг веса субъекта на введение. Предпочтительная дозировка составляет от 0,01 до приблизительно 1,5 мг на 1 кг веса субъекта на введение, и такая терапия может длиться в течение нескольких недель или месяцев, а в некоторых случаях - лет. Будет понятно, однако, что конкретный уровень дозы для какого-либо конкретного пациента будет зависеть от ряда факторов, в том числе от активности конкретного используемого соединения; возраста, веса тела, общего состояния здоровья, пола и диеты подлежащего лечению индивидуума; времени и пути введения; скорости выведения; других лекарственных средств, которые были введены ранее; и тяжести конкретного подлежащего лечению заболевания, как хорошо известно специалистам в данной области. Типичная дозировка может составлять одну таблетку от 1 до приблизительно 100 мг или от 1 до приблизительно 300 мг, принимаемую один раз в сутки или несколько раз в сутки, или одну капсулу или таблетку пролонгированного действия, принимаемую один раз в сутки и содержащую пропорционально более высокое содержание активного ингредиента. Эффект пролонгированного действия может быть обеспечен материалами капсулы, которые растворяются при различных значениях рН, капсулами, которые медленно высвобождают с помощью осмотического давления, или каким-либо другим известным средством контролируемого высвобождения. Может быть необходимо применение дозировок, выходящих за эти диапазоны в некоторых случаях, как будет очевидно специалистам в данной области. Кроме того, следует отметить, что клиницисту или лечащему врачу хорошо известно, как и когда начать, прервать, отрегулировать или прекратить терапию в зависимости от индивидуальной реакции пациента. Соединения в соответствии с настоящим изобретением могут быть использованы для системного введения, такого как пероральное, чрескожное или парентеральное введение; или для местного введения,такого как путем ингаляции, назального аэрозоля, глазных капель, или с помощью крема, геля, шампуня или т.п. Соединения предпочтительно вводятся перорально. Точная дозировка и частота введения зависит от конкретного используемого соединения формулы (I), конкретного подлежащего лечению состояния, тяжести подлежащего лечению состояния, возраста, веса, пола, степени расстройства и общего физического состояния конкретного пациента, а также другого медицинского препарата, который может принимать индивидуум, как хорошо известно специалистам в данной области. Кроме того, очевидно, что указанное эффективное суточное количество может быть понижено или повышено в зависимости от реакции субъекта, принимающего лечение, и/или в зависимости от оценки врача, прописавшего соединения в соответствии с настоящим изобретением. Соединения формулы (I) также могут быть использованы в комбинации с другими общепринятыми агонистами 7 никотинового рецептора, например, 1,4-диазабицикло-[3.2.2]нонан-4-карбоновой кислоты 4-бромфенилового сложного эфира моногидрохлорид(-)-спиро[1 азабицикло[2.2.2.]октан-3,5'-оксазолидин]-2'-он; 3-[(2,4-диметокси)бензилиден]анабазеина дигидрохлорид (GTS-21); [N-[(3R)-1-азабицикло[2.2.2]окт-3-ил]-4-хлорбензамида гидрохлорид] PNU-282987; никотин; варениклин; МЕМ 3454; AZD-0328; MEM63908; (+)-N-(1-азабицикло[2.2.2]окт-3-ил)бензо[b]фуран 2-карбоксамид; А-582941; AR-R17779; ТС-1698; РНА-709829; трописетрон; WAY-317538; EVP-6124 и ТС-5619. Таким образом, настоящее изобретение также относится к комбинации соединения формулы (I) и агониста альфа 7 никотинового рецептора. Указанная комбинация может быть использована в качестве лекарственного препарата. Настоящее изобретение также относится к продукту, содержащему (а) соединение формулы (I) и (b) агонист альфа 7 никотинового рецептора, как комбинированный препарат для одновременного, раздельного или последовательного применения в лечении заболеваний, при которых полезна модуляция альфа 7 никотинового рецептора. Различные лекарственные средства могут быть комбинированы в единичный препарат вместе с фармацевтически приемлемыми носителями. Экспериментальная часть. Некоторые способы получения соединений в соответствии с настоящим изобретением иллюстрируются в следующих примерах. Если не указано иное, все исходные материалы получали от коммерче- 23022164 ских поставщиков и использовали без дополнительной очистки. Ниже или выше, "мин" означает минуты;"МеОН" означает метанол; "EtOH" означает этанол; "Et2O" означает диэтиловый эфир; "TFA" означает трифторуксусную кислоту, "NH4OAc" означает ацетат аммония, "HBTU" означает О-(бензотриазол-1 ил)-N,N,N',N'-тетраметилурония гексафторфосфат; "DIPEA" означает диизопропилэтиламин; "LDA" означает лития диизопропиламин; "DCM" означает дихлорметан; "VCD" означает колебательный круговой дихроизм. Реакции с помощью микроволн выполняли в однорежимном реакторе: микроволновой реакторInitiator Sixty EXP (Biotage AB), или в многорежимном реакторе: MicroSYNTH Labstation (Milestone,Inc.). Следующие примеры предназначены для иллюстрации, а не для ограничения объема настоящего изобретения. А. Получение промежуточных соединений. 5-Хлор-2-(2,6-диметил-4-пиридинил)бензонитрил (промежуточное соединение 1) Промежуточное соединение 1 Смесь 2-бром-5-хлорбензонитрила (10,03 г, 46,33 ммоль), 2,6-диметилпиридин-4-бороновой кислоты пинаколового сложного эфира ([325142-95-8], 16,20 г, 69,50 ммоль), тетракис(трифенилфосфин)палладия (3,21 г, 2,78 ммоль), 1,4-диоксана (50 мл) и карбоната натрия (14,73 г, 139,00 ммоль) в воде (50 мл) взбалтывали и нагревали в атмосфере азота при 100 С в течение 2 ч. Реакционную смесь разбавляли с помощью CH2Cl2 и воды и слои разделяли. Органический слой сушили с MgSO4,фильтровали и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (градиент элюента от 100% DCM до 98/2 DCM/MeOH). Желаемые фракции собирали и выпаривали, получая 8,73 г(77%) промежуточного соединения 1 после сушки в течение ночи под вакуумом при 50 С. 5-[(2R,6S)-2,6-Диметил-4-морфолинил]-2-(2,6-диметил-4-пиридинил)бензонитрил (промежуточное соединение 2) Промежуточное соединение 2 Смесь промежуточного соединения 1 (2,64 г, 10,88 ммоль), цис-2,6-диметилморфолина (1,35 мл,10,88 ммоль), натрия трет-бутоксида (1,57 г, 16,33 ммоль) и сухого толуола (15 мл) вводили в пробирку для проведения реакций под давлением и дегазировали азотом в течение 5 мин. Добавляли ксантфос[161265-03-8] (378 мг, 0,65 ммоль) и Pd2(dba)3 (199 мг, 0,22 ммоль) и смесь дополнительно дегазировали в течение 5 мин. Пробирку закрывали и реакционную смесь взбалтывали при 120 С в течение 1,5 ч. Реакционную смесь разбавляли CH2Cl2 и промывали водой. Водный слой дважды экстрагировали CH2Cl2. Объединенные органические слои промывали водой, сушили над MgSO4, фильтровали и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (градиент элюента от 100% DCM до 99/1DCM/MeOH), получая 2, 69 г промежуточного соединения 2 (77%) в виде белого твердого вещества после сушки в вакуумной печи при 50 С в течение ночи. 5-[(2R,6S)-2,6-Диметил-4-морфолинил]-2-(2,6-диметил-4-пиридинил)бензолметанамин (промежуточное соединение 3)- 24022164 Промежуточное соединение 2 (3,26 г, 10,14 ммоль) добавляли в суспензию никеля Ренея (1 г) в 7 н. растворе аммиака в МеОН (200 мл). Реакционную смесь взбалтывали при 14 С в атмосфере водорода до абсорбирования 2 экв. водорода. Катализатор удаляли фильтрацией через диатомовую землю. Растворитель выпаривали, получая промежуточное соединение 3 количественно. Промежуточное соединение 3 использовали без дополнительной очистки. 3,5-бис-(Трифторметил)пиперидин (промежуточное соединение 4) Промежуточное соединение 4 3,5-бис-(Трифторметил)пиридин [20857-47-0] (10 г, 46,49 ммоль) и 6 н. HCl в изопропаноле (7,75 мл,46,49 ммоль) добавляли в суспензию Pt на угле 5% (1 г) в EtOH (150 мл). Реакционную смесь взбалтывали при 25 С в атмосфере водорода до абсорбирования 3 экв. водорода. Катализатор удаляли фильтрацией через диатомовую землю. Растворитель выпаривали, получая промежуточное соединение 4 количественно в виде смеси 50:50 цис- и транс-изомеров. Промежуточное соединение 4 использовали без дополнительной очистки. Таблица 1 Следующие промежуточные соединения получали согласно процедурам, используемым для промежуточного соединения 3 (начиная с промежуточного соединения 1 через промежуточное соединение 2)- 25022164 Таблица 2 Следующие промежуточные соединения получали согласно процедурам, используемым для промежуточного соединения 3 (начиная с 2-бром-5-хлорбензонитрила) Промежуточное соединение 10 Смесь 2-бром-5-фторбензонитрила (10 г, 50 ммоль), морфолина (4,37 мл, 50 ммоль) и карбоната калия (6,91 г, 50 ммоль) в DMSO (100 мл) взбалтывали при 100 С в течение 48 ч. Реакционную смесь вливали в воду (200 мл) и взбалтывали в течение 1 ч. Осадок фильтровали и очищали колоночной хроматографией на силикагеле (градиент элюента от 50/50 до 100/0 DCM/гептан). Желаемые фракции собирали и выпаривали, получая 4,1 г (30%) промежуточного соединения 10 после сушки в течение ночи под вакуумом при 50 С. 2-(2-Метил-4-пиридинил)-5-(4-морфолинил)бензонитрил (промежуточное соединение 11) Промежуточное соединение 11 Смесь промежуточного соединения 10 (4,1 г, 15,35 ммоль), 2-метилпиридин-4-бороновой кислоты пинаколового сложного эфира ([660867-80-1], 3,70 г, 16,88 ммоль), тетракис-(трифенилфосфин)палладия(0,88 г, 0,77 ммоль), 1,4-диоксана (50 мл) и карбоната натрия (3,58 г, 33,67 ммоль) растворяли в воде (20 мл) и EtOH (30 мл), дегазировали и сосуд закрывали. Реакционную смесь взбалтывали и нагревали в атмосфере азота при 120 С в течение 2 ч. Растворитель выпаривали. Остаток поглощали в DCM и промывали водой. Органический слой сушили с MgSO4 и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (градиент элюента от 100% DCM до 99/1 DCM/MeOH). Желаемые фракции собирали и выпаривали, получая 3,7 г (86%) промежуточного соединения 11 после сушки в течение ночи под вакуумом при 50 С. Промежуточное соединение 12 Промежуточное соединение 12 получали согласно процедуре, используемой для промежуточного соединения 3, начиная с промежуточного соединения 11 вместо промежуточного соединения 2. 3-[(2R,6S)-2,6-Диметил-4-морфолинил]-5-фторбензонитрил (промежуточное соединение 13) Промежуточное соединение 13 Смесь 3-бром-5-фторбензонитрила (55,56 г, 277,80 ммоль), цис-2,6-диметилморфолина (34,40 мл,277,80 ммоль), натрия трет-бутоксида (40,05 г, 416,70 ммоль) и сухого толуола (300 мл) вводили в пробирку для проведения реакций под давлением и дегазировали азотом в течение 5 мин. Добавляли ксантфос [161265-03-8] (9,64 г, 16,67 ммоль) и Pd2(dba)3 (5,09 г, 5,55 ммоль) и смесь дополнительно дегазировали в течение 5 мин. Пробирку закрывали, и реакционную смесь взбалтывали при 120 С в течение 2 ч. Реакционную смесь разбавляли CH2Cl2 и промывали водой. Водный слой экстрагировали CH2Cl2. Объединенные органические слои промывали водой, сушили над MgSO4, фильтровали и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (градиент элюента от 100% DCM до 99/1DCM/MeOH). Желаемые фракции выпаривали. Остаток растирали в Et2O и фильтровали, получая 33 г промежуточного соединения 13 (51%) в виде белого твердого вещества после сушки в вакуумной печи при 50 С в течение ночи. 5-[(2R,6S)-2,6-Диметил-4-морфолинил]-3-фтор-2-йод-бензонитрил (промежуточное соединение 14) Промежуточное соединение 14 Раствор 2,2,6,6-тетраметилпиперидина (18,82 мл, 110,58 ммоль) в THF (1 л) охлаждали до 0 С. По каплям добавляли н-бутиллитий (2,5 М в гексанах, 44,23 мл, 110,58 ммоль) при взбалтывании при 0 С. Затем реакционную смесь взбалтывали в течение 15 мин при 0 С. Полученный в результате раствор охлаждали до -78 С и раствор промежуточного соединения 13 (29,44 г, 100,53 ммоль), растворенный в THF(200 мл), добавляли по каплям за 20 мин. Темно-желтый раствор взбалтывали при -78 С в течение 30 мин перед добавлением по каплям за 15 мин раствора йода (30,62 г, 120,64 ммоль), растворенного в THF(250 мл). Смесь взбалтывали в течение 30 мин при -78 С перед обеспечением нагревания до комнатной температуры. Взбалтывание продолжали в течение 1 ч. Реакцию гасили водным NH4Cl. Смесь разбавляли водой и Et2O, а слои разделяли. Водный слой экстрагировали Et2O. Объединенный органический слой снова промывали водным Na2S2O3 и сушили над MgSO4, фильтровали и выпаривали. Остаток растирали в теплом DCM и фильтровали, получая 31,28 г промежуточного соединения 14 (86%) в виде белого твердого вещества после сушки в вакуумной печи при 50 С в течение ночи.(проме Промежуточное соединение 15 Смесь промежуточного соединения 14 (12,09 г, 33,57 ммоль), 2,6-диметилпиридин-4-бороновой кислоты пинаколового сложного эфира ([325142-95-8], 11,74 г, 50,35 ммоль), тетракис(трифенилфосфин)палладия (2,33 г, 2,01 ммоль), 1,4-диоксана (100 мл) и карбоната натрия 1 М (100 мл,100 ммоль) дегазировали азотом. Реакционную смесь взбалтывали и нагревали в атмосфере азота при 140 С в течение 12 ч. Реакционную смесь разбавляли DCM и водой и слои разделяли. Водный слой экстрагировали DCM. Объединенный органический слой сушили с MgSO4, фильтровали и выпаривали. Остаток очищали колоночной хроматографией на силикагеле (градиент элюента от 100% DCM до 99/1DCM/MeOH). Желаемые фракции собирали и выпаривали, получая 8,37 г (73%) промежуточного соединения 15 после сушки в течение ночи под вакуумом при 50 С. 5-[(2R,6S)-2,6-Диметил-4-морфолинил]-2-(2,6-диметил-4-пиридинил)-3-фторбензолметанамин Промежуточное соединение 16 Промежуточное соединение 16 получали согласно процедуре, используемой для промежуточного соединения 3, начиная с промежуточного соединения 15 вместо промежуточного соединения 2. 5-[(2R,6S)-2,6-Диметил-4-морфолинил]-3-фтор-2-(2-метил-4-пиридинил)бензолметанамин (промежуточное соединение 17) Промежуточное соединение 17 Промежуточное соединение 17 получали согласно процедурам, используемым для промежуточного соединения 13, начиная с промежуточного соединения 14, и с использованием 2-метилпиридин-4 бороновой кислоты пинаколового сложного эфира ([660867-80-1] вместо 2,6-диметилпиридин-4 бороновой кислоты пинаколового сложного эфира. 2-Бром-N-(фенилметил)-N-(3,3,3-трифтор-2-гидроксипропил)ацетамид (промежуточное соединение 18)(5,41 мл, 58,43 ммоль) растворяли в DCM (50 мл), добавляли по каплям и реакционную смесь взбалтывали в течение 30 мин. Реакционную смесь разбавляли DCM, промывали с HCl 1 н., а затем водным натрия- 28022164 гидрокарбонатом и солевым раствором. Органический слой сушили с MgSO4, фильтровали и выпаривали, получая 18,07 г промежуточного соединения 18 (количественно), которое использовали без дополнительной очистки. 4-(Фенилметил)-6-(трифторметил)-3-морфолинон (промежуточное соединение 19) Промежуточное соединение 19 Промежуточное соединение 18 (123 г, 361,61 ммоль) растворяли в сухом THF (500 мл), добавляли по каплям в суспензию гидрида натрия (60% дисперсия в минеральном масле, 17,35 г, 433,94 ммоль) в сухом THF (500 мл), охлаждали до -5 С в атмосфере азота. После добавления реакционную смесь нагревали до комнатной температуры и взбалтывали в течение 30 мин. Реакцию гасили осторожным добавлением МеОН при 0 С. Затем реакционную смесь вливали в 1 н. HCl (100 мл) и водный слой экстрагировали EtOAc. Органический слой промывали водным гидрокарбонатом и солевым раствором перед сушкой с MgSO4, фильтрацией и выпариванием, получая 90 г промежуточного соединения 19 (96%) в виде масла, которое использовали без дополнительной очистки. 4-(Фенилметил)-2-(трифторметил)-, (2S)-морфолин (промежуточное соединение 20) и 4(фенилметил)-2-(трифторметил)-, (2R)-морфолин (промежуточное соединение 21) Промежуточное соединение 20 Промежуточное соединение 21 Раствор комплекса борана/THF 1 M ([14044-65-6], 868 мл, 868,96 ммоль) добавляли по каплям в раствор промежуточного соединения 19 (90 г, 347,18 ммоль) растворяли в сухом THF (850 мл) при комнатной температуре в атмосфере азота. Смесь взбалтывали в течение 2,5 ч при 70 С (до тех пор, пока газ уже больше не выделялся). Затем по каплям добавляли МеОН (7 0,32 мл, 1735,92 ммоль), а затем HCl (3 М в воде, 578 мл, 1735,92 ммоль), и смесь взбалтывали при 70 С еще 1 ч. Затем реакционную смесь гасили карбонатом калия (239,91 г, 1735,92 ммоль) и растворяли в воде (250 мл). Реакционную смесь экстрагировали диэтиловым эфиром. Органический слой промывали солевым раствором, сушили с MgSO4,фильтровали и выпаривали. Полученное в результате масло очищали колоночной хроматографией на силикагеле (элюент: DCM), получая прозрачное масло, которое затем разделяли на его чистые энантиомеры колоночной хроматографией на Chiralcel OJ 100020 мкм (Daicel) (элюент:гептан/iPrOH 99/1),получая 27 г промежуточного соединения 21 (32%) и 25 г промежуточного соединения 20 (29%), оба в виде прозрачного масла. Определяли абсолютную стереохимию этих двух энантиомеров с помощью Промежуточное соединение 22 Промежуточное соединение 20 (25 г, 101,94 ммоль) добавляли в суспензию Pd на угле 10% (2 г) в МеОН (150 мл). Реакционную смесь взбалтывали при 25 С в атмосфере водорода до абсорбирования 1 экв. водорода. Катализатор удаляли фильтрацией через диатомовую землю. Фильтрат обрабатывали водной HCl 5,5 М (18,5 мл, 101,94 ммоль). Растворитель выпаривали, получая 18,46 г промежуточного соединения 22 (95%) в виде белого твердого вещества. 2-(Трифторметил)-(2R)-морфолина гидрохлорид (промежуточное соединение 23) Промежуточное соединение 23 Промежуточное соединение 21 (27 г, 110,09 ммоль) добавляли в суспензию Pd на угле 10% (2 г) в МеОН (150 мл). Реакционную смесь взбалтывали при 25 С в атмосфере водорода до абсорбирования 1 экв. водорода. Катализатор удаляли фильтрацией через диатомовую землю. Фильтрат обрабатывали водной HCl 5,5 М (20,0 мл, 110,09 ммоль). Растворитель выпаривали, получая 16,4 г промежуточного соединения 23 (78%) в виде белого твердого вещества.
МПК / Метки
МПК: A61P 25/28, C07D 413/14, A61K 31/44, A61P 25/18, C07D 405/12, C07D 401/12, A61P 25/16, A61P 25/14, C07D 213/82, C07D 413/10, A61P 1/00, A61P 25/34, C07D 213/40, C07D 413/12, A61P 17/06
Метки: модуляторы, аллостерические, пиридин-4-ил)бензиламиды, альфа, nachr
Код ссылки
<a href="https://eas.patents.su/30-22164-piridin-4-ilbenzilamidy-kak-allostericheskie-modulyatory-alfa-7-nachr.html" rel="bookmark" title="База патентов Евразийского Союза">(пиридин-4-ил)бензиламиды как аллостерические модуляторы альфа 7 nachr</a>
Предыдущий патент: Двойные ингибиторы pi3 киназы/mtor
Следующий патент: Производное 1,2,3,4-тетрагидрохинолина, подходящее для лечения диабета
Случайный патент: Порошок бария-стронция-алюмосиликата