Производное 1,2,3,4-тетрагидрохинолина, подходящее для лечения диабета
Формула / Реферат
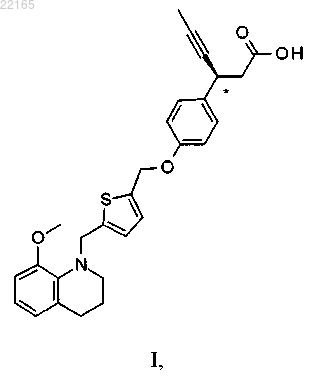
1. Соединение формулы I

или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция, содержащая соединение по п.1 или его фармацевтически приемлемую соль и по меньшей мере один из фармацевтически приемлемого носителя, разбавителя или наполнителя.
3. Применение соединения или его фармацевтически приемлемой соли по п.1 в терапии, связанной с активацией сопряженного с G-белком рецептора 40 (GPR-40).
4. Применение соединения или его фармацевтически приемлемой соли по п.1 для лечения диабета у млекопитающего.
5. Применение соединения или его фармацевтически приемлемой соли по п.1 для получения лекарственного средства для лечения диабета.
6. Соединение формулы II
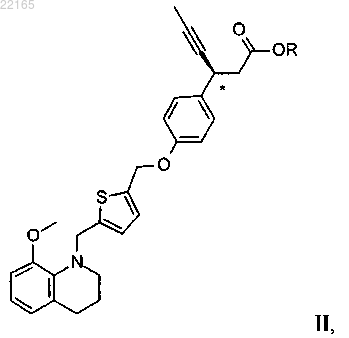
где R выбран из C1-4 алкила, C1-4 галогеналкила, С3-6 циклоалкила, C1-4 алкил-С3-6 циклоалкила, фенила и C1-5 алкилфенила.
7. Способ получения (3S)-3-[4-[[5-[(8-метокси-3,4-дигидро-2Н-хинолин-1-ил)метил]-2-тиенил]метокси]фенил]гекс-4-иновой кислоты формулы I или ее фармацевтически приемлемой соли
при этом указанный способ включает деэтерификацию соединения формулы II

где R выбран из C1-4 алкила, C1-4 галогеналкила, С3-6 циклоалкила, C1-4 алкил-С3-6 циклоалкила, фенила и C1-5 алкилфенила.
Текст
ПРОИЗВОДНОЕ 1,2,3,4-ТЕТРАГИДРОХИНОЛИНА, ПОДХОДЯЩЕЕ ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА Согласно настоящему изобретению предложено соединение формулы I или его фармацевтически приемлемая соль, применение указанного соединения и способ получения указанного соединения.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Диабет представляет собой серьезную проблему в области здравоохранения, стоящую перед развивающимися странами. Было бы желательным обеспечить безопасное и эффективное пероральное лекарственное средство для лечения диабета. Полагают, что некоторые эффективные коммерчески доступные пероральные лекарственные средства для лечения диабета второго типа (T2D) действуют через модуляцию гамма-рецептора, активируемого пролифератором пероксисом (PPAR). Введение указанных лекарственных средств связывают с нежелательными побочными эффектами, иногда включающими гипогликемию, повреждение печени, заболевание желудочно-кишечного тракта, увеличение массы тела или другие нежелательные эффекты, которые могут быть связаны с активностью PPAR-гамма. Необходимы новые варианты лечения, обеспечивающие более желательные характеристики безопасности для контроляT2D, для эффективного лечения или предотвращения диабета у большего числа пациентов. В частности,особенно желательны способы лечения на основе новых механизмов, которые могут свести к минимуму или помочь избежать эффектов, связанных с активацией PPAR-гамма. Сообщалось, что сопряженный с G-белком рецептор 40 (GPR-40), также известный как рецептор свободных жирных кислот 1 (FFA1 или FFAR1), преимущественно экспрессируется на высоких уровнях в бета-клетках поджелудочной железы грызунов, линиях клеток инсулиномы и островках у человека. Данный рецептор активируется средне- и длинноцепочечными жирными кислотами Зависимость секреции инсулина от глюкозы является важным признаком активации GPR-40, что делает данный рецептор отличной мишенью для разработки эффективных видов терапии с желаемыми характеристиками безопасности для применения в лечении T2D. Особенно желательными могут быть соединения, обеспечивающие эффективность и более желательные характеристики безопасности по сравнению с существующими видами терапии, такими как инсулин и сульфонилмочевины. В двух недавно опубликованных заявках на патент, US20110092531 и WO2011066183, описаны соединения, обладающие спиробициклической группой, демонстрирующей активность в отношении GPR40. Согласно настоящему изобретению предложено соединение для лечения диабета, в частности T2D. Указанное соединение согласно настоящему изобретению представляет собой мощный активатор GPR40. Согласно настоящему изобретению предложен желаемый новый вариант лечения, действующий по фармакологическому механизму, который является уникальным по сравнению с коммерчески доступными лекарственными средствами, а также предложено соединение, селективно активирующее GPR-40 по сравнению с PPAR-гамма. Фармакологический профиль соединения согласно настоящему изобретению в качестве селективного активатора GPR-40 может быть особенно желательным для применения в леченииT2D. Кроме того, селективная модуляция GPR-40 может обеспечивать особенно желаемые характеристики безопасности для применения в лечении T2D за счет предотвращения эффектов, связанных с модуляцией PPAR-гамма. Согласно настоящему изобретению предложено соединение формулы I, приведенной ниже или его фармацевтически приемлемая соль. Соединение согласно настоящему изобретению может содержать хиральный атом углерода, обозначенный звездочкойв структуре выше. Предпочтительное соединение имеет конфигурацию, показанную выше, которая по определению известна, как S-конфигурация. Согласно настоящему изобретению также предложена фармацевтическая композиция, содержащая соединение формулы I, описанное выше, или его фармацевтически приемлемую соль совместно с одним или более фармацевтически приемлемыми носителями, разбавителями или наполнителями. Согласно настоящему изобретению предложено соединение в соответствии с формулой I или его фармацевтически приемлемая соль, описанная выше, для применения в терапии. В еще одном варианте реализации настоящего изобретения предложено соединение, описанное выше в соответствии с формулой I, его фармацевтически приемлемая соль или фармацевтическая композиция для применения для лечения диабета у нуждающегося в этом млекопитающего. Предпочтительно указанное применение предназначено для лечения диабета второго типа, и указанное млекопитающее представляет собой человека. Согласно настоящему изобретению предложено применение соединения в соответствии с формулой I или его фармацевтически приемлемой соли для получения лекарственного средства для лечения диабета. Предпочтительно указанное лекарственное средство предназначено для лечения диабета второго типа и для лечения млекопитающего, в частности людей. В еще одном варианте реализации настоящего изобретения предложено промежуточное соединение формулы II где R выбран из С 1-4 алкила, C1-4 галогеналкила, С 3-6 циклоалкила, С 1-4 алкил-С 3-6 циклоалкила, фенила и C1-5 алкилфенила, для получения соединения формулы 1 или его фармацевтически приемлемой соли. Предпочтительные группы R включают C1-2 алкил, -С 1-2 галогеналкил, фенил и C1-2 алкилфенил. Наиболее предпочтительные группы R включают метил, этил, фенил и бензил. Согласно настоящему изобретению также предложен способ получения (3S)-3-[4-5-[(8-метокси 3,4-дигидро-2 Н-хинолин-1-ил)метил]-2-тиенил]метокси]фенил]гекс-4-иновой кислоты, описанной выше для формулы I. Указанный способ включает снятие защитных групп или деэтерификацию промежуточного соединения согласно формуле II с получением соединения формулы 1 или его фармацевтически приемлемой соли. Специалист в данной области техники сможет легко понять и выполнить реакции снятия защитных групп без проведения лишних экспериментов. Специалисту в данной области техники очевидно, что в дополнение к карбоновой кислоте и защищенной карбоновой кислоте можно использовать другие функциональные группы, которые могут быть легко превращены в карбоновую кислоту, вместо карбоновой кислоты или защищенной кислоты. Такие функциональные группы, примеры получения и превращения данных групп в карбоновые кислоты можно найти в "Comprehensive Organic Transformations: A Guide toFunctional Group Preparations" Larock. R.C, Wiley VCH, 1999 и в "March's Advanced Organic Chemistry,Reactions, Mechanisms and Structure" Smith, M.B., and March, I, Wiley-Interscience, 6th Ed. 2007. Соединение согласно настоящему изобретению, (3S)-3-[4-5-[(8-метокси-3,4-дигидро-2 Н-хинолин 1-ил)метил]-2-тиенил]метокси]фенил]гекс-4-иновая кислота, может быть получено в виде фармацевтически приемлемой соли. Термин "фармацевтически приемлемая соль" относится к солям соединения согласно настоящему изобретению, считающимся приемлемыми для клинического применения и/или применения в ветеринарии. Фармацевтически приемлемые соли и общая методика их получения хорошо известны в данной области техники. См., например, P. Stahl, et al, Handbook of Pharmaceutical Salts: Properties, Selection and Use, (VCHA/Wiley-VCH, 2002); S.M. Berge, et al, "Pharmaceutical Salts," Journal ofPharmaceutical Sciences, Vol. 66, No. 1, January 1977. Термин "фармацевтически приемлемый носитель, разбавитель или наполнители" означает, что указанный носитель, разбавитель и наполнители являются фармацевтически совместимыми с другими ингредиентами композиции. На следующих схемах для полной ясности были удалены некоторые заместители, и это никоим образом не ограничивает идею приведенных схем. Кроме того, индивидуальные изомеры, энантиомеры или диастереомеры могут быть выделены в любой удобный момент в синтезе соединения формулы I такими методами, как хиральная хроматография. Кроме того, промежуточные соединения, описанные на следующих схемах и в примерах получения, содержат ряд защитных групп азота, гидроксила и кислоты,таких как сложные эфиры. Меняющаяся защитная группа может быть одинаковой или разной в каждом случае в зависимости от конкретных условий реакции и конкретных проводимых превращений. Условия введения и снятия защитных групп хорошо известны специалисту в данной области техники и описаны в литературе. См., например, Greene and Wuts, Protective Groups in Organic Synthesis, (T Greene and P Wuts,eds, 2d ed 1991). Сокращения, используемые в настоящем описании, определяются в соответствии с Aldnchimica Acta, Vol 17, No 1, 1984. Другие сокращения определяются следующим образом: "ADDP" относится к 1(азодикарбонил)дипиперидину, "BSA" относится к бычьему сывороточному альбумину, "DIBAL-H" относится к диизобутилалюминийгидриду "DIPEA" относится к диизопропилэтиламину, "DMEM" относится к среде Игла, модифицированной по способу Дульбекко, "DTT" относится к дитиотреитолу, "ESI" относится к ионизации электрораспылением, "EtOAc" относится к этилацетату, "EtOH" относится к этиловому спирту или этанолу, "F12" относится к среде Хэма F12, "FBS" относится к фетальной бычьей сыворотке, "НЕК" относится к мезонефросу человека, "IC50" относится к концентрации агента, обеспечивающей 50% от максимально возможного для данного агента ингибирующего ответа, "МеОН" относится к метиловому спирту или метанолу, "NBS" относится к N-бромсукцинимиду, "PPAR" относится к рецептору, активируемому пролифератором пероксисом, "PPRE" относится к элементу ответа пролифератора пероксисом, "RFU" относится к относительной единице флуоресценции, "RPMI" относится к Мемори-2 022165 альному Институту Розуэлла Парка (Roswell Park Memorial Institute), "KT" относится к температуре окружающей среды (комнатной температуре), "ТГФ" относится к тетрагидрофурану, и "ТК" относится к тимидинкиназе В настоящем описании термин "алкил" представляет собой линейный алкил, такой как этил или нпропил, или разветвленный алкил, такой как изопропил или трет-бутил. Термин "С 1-4 галогеналкил" относится к алкильной группе, содержащей 1, 2, 3 или более галогеногрупп, присоединенных к атомам углерода алкильной цепи. Если присутствуют два или более галогенов, указанные галогены не обязательно должны быть присоединены к одному и тому же атому углерода. Данный термин также включает пергалогеналкилы, в которых все атомы водорода алкильной группы замещены галогеном. На схемах ниже все заместители, если не указано иное, являются такими, как определено ранее. Реагенты и исходные вещества в целом легко доступны для специалиста в данной области техники. Другие вещества могут быть получены стандартными методами органической химии и химии гетероциклических соединений, аналогичными синтезу известных сходных по структуре соединений и следующим процедурам, описанным в разделах "Примеры получения" и "Примеры", включая любые новые процедуры. Схема 1 Примеры получения и примеры Следующие примеры получения и примеры дополнительно иллюстрируют настоящее изобретение и представляют собой типичный синтез соединения формулы (I). Соединения названы с помощьюIUPACNAME ACDLABS или Symyx Draw 3.2. Пример получения 1. 8-Метоксихинолин. Гидроксид калия (435 г, 7,76 моль) добавляли к раствору 8-гидроксихинолина (250 г, 1,724 моль) в ТГФ (10 л) при температуре окружающей среды и перемешивали. По каплям добавляли метилиодид (435 г, 2,58 моль) и перемешивали в течение ночи. Реакционную смесь фильтровали, и твердое вещество промывали ТГФ (2 л). Раствор концентрировали досуха добавляли воду; экстрагировали дихлорметаном(23 л); органические фазы объединяли; и промывали солевым раствором. Органические фазы собирали и сушили над сульфатом натрия. Удаляли твердые вещества путем фильтрации. Фильтрат собирали и концентрировали при пониженном давлении с получением красного масла, которое затвердевало при стоянии, с получением титульного соединения (281 г, 102%), которое можно использовать без дополнительной очистки. ESI (m/z) 160(М+Н). Пример получения 2. 8-Метокси-1,2,3,4-тетрагидрохинолин. Цианоборогидрид натрия (505 г, 8,11 моль) в ЕЮН (1 л) добавляли к раствору 8-метоксихинолина(425 г, 2,673 моль) в EtOH (9 л) и перемешивали. Реакционную смесь охлаждали до внутренней температуры 0 С и по каплям добавляли HCl (35%, 1,12 л, 10,962 моль) в течение 60 мин так, чтобы внутренняя температура не поднималась выше 20 С. Реакционной смеси давали нагреться до температуры окружающей среды, а затем нагревали в колбе с обратным холодильником в течение 2,5 ч. Охлаждали до температуры окружающей среды и перемешивали в течение ночи. Добавляли гидроксид аммония (25%, 1 л); разбавляли водой (15 л); и смесь экстрагировали дихлорметаном (310 л). Органические фазы объе-3 022165 диняли и сушили над сульфатом натрия. Твердые вещества удаляли путем фильтрации. Фильтрат собирали и концентрировали при пониженном давлении с получением остатка Указанный остаток очищали путем флэш-хроматографии на силикагеле, элюируя смесью этилацетат:гексан (1:10), с получением титульного соединения (357 г, 82%). ESI (m/z) 164(M+H). Пример получения 3. Метил-5-метилтиофен-2-карбоксилат. По каплям добавляли тионилхлорид (153 мл, 2,1 моль) в течение 20 мин к раствору 5-метилтиофен 2-карбоновой кислоты (100 г, 0,703 моль) в МеОН (1 л) при 0 С и перемешивали. По завершении добавления реакционную смесь нагревали в колбе с обратным холодильником в течение 3,5 ч. Охлаждали и концентрировали в вакууме с получением густого масла. Масло разбавляли EtOAc (500 мл) и последовательно промывали водой (300 мл), а затем солевым раствором (300 мл). Органическую фазу сушили над сульфатом натрия. Твердые вещества удаляли путем фильтрации. Фильтрат собирали и концентрировали при пониженном давлении с получением титульного соединения (106 г, 97%), которое использовали без дополнительной очистки. ESI (m/z) 156(М+Н). Пример получения 4. Метил-5-(бромметил)тиофен-2-карбоксилат. Свежеперекристаллизованный NBS (323,8 г, 1,81 моль) добавляли к раствору метил-5 метилтиофен-2-карбоксилата (258 г. 1.65 моль) в хлороформе (2,6 л) при комнатной температуре и перемешивали. Добавляли пероксид бензоила (3,99 г, 0,016 моль) и реакционную смесь нагревали в колбе с обратным холодильником в течение 7 ч. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали через диатомовую землю. Промывати осадок на фильтре хлороформом (250 мл). Собирали органические фазы и удаляли растворитель с получением титульного соединения (388 г,100%), которое использовали без дополнительной очистки. ESI (m/z) 236(М+Н). Пример получения 5. Метил-5-[(8-метокси-3,4-дигидро-2 Н-хинолин-1-ил)метил]тиофен-2-карбоксилат. Метил-5-(бромэтил)тиофен-2-карбоксилат (432,5 г, 1,84 моль) в EtOH (500 мл) добавляли к раствору 8-метокси-1,2,3,4-тетрагидрохинолина (300 г 1,84 моль) в EtOH (1 л) и перемешивали. По каплям добавляли DIPEA (641 мл. 3,67 моль) и перемешивали при комнатной температуре в течение ночи. После завершения реакции удаляли EtOH в вакууме и добавляли воду (5 л). Водную фазу экстрагировалиEtOAc (33 л), органические фазы объединяли и сушили над сульфатом натрия. Раствор фильтровали и концентрировали при пониженном давлении с получением остатка. Указанный остаток очищали путем флэш-хроматографии на силикагеле, элюируя смесью этилацетат гексан (694), с получением титульного соединения (325 г, 56%) ESI (m/z) 318(M+H). Пример получения 6. [5-[(8-Метокси-3,4-дигидро-2 Н-хинолин-1-ил)метил]-2-тиенил]метанол. Медленно через канюлю добавляли DIBAL-H (1M B толуоле 2,7 л, 2,66 моль) в течение периода времени, составляющего 1,5 ч, к перемешиваемому раствору метил-5-(8-метокси-3,4-дигидрохинолин 1(2 Н)-ил)метил)тиофен-2-карбоксилата (281 г, 0,886 моль) в ТГФ (4 л) при -70 С. Реакцию контролировали путем тонкослойной хроматографии (ТСХ) на предмет завершения. После завершения реакции реакционной смеси давали нагреться до 20 С и добавляли насыщенный раствор хлорида аммония Добавляли раствор тартрата калия-натрия (1,3 кг в 5 л воды) и перемешивали в течение ночи. Отделяли органическую фазу, водную фазу экстрагировали EtOAc (25 л), затем органические фазы объединяли и сушили объединенные органические фазы над сульфатом натрия. Твердые вещества удаляли путем фильтрации. Удаляли растворитель из фильтрата при пониженном давлении с получением титульного соединения в виде белого твердого вещества (252 г, 98%) ESI (m/z) 290(M+H). Пример получения 7. Этил-(3S)-3-[4-5-[(8-метокси-3,4-дигидро-2 Н-хинолин-1-ил)метил]-2-тиенил]метокси]фенил]гекс-4-иноат. Трибутилфосфин (50% раствор в EtOAc, 543 мл, 1,34 моль) добавляли к раствору ADDP (282,5 г,1,5 экв ) в ТГФ (3 л) и смесь охлаждали до внутренней температуры 0 С, а затем перемешивали в течение 15 мин. По каплям добавляли (S)-этил-3-(4-гидроксифенил)гекс-4-иноат (173,5 г, 0,747 моль) в ТГФ (3 л) в течение 15 мин, затем по каплям добавляли 5-8-метокси-3,4-дигидрохинолин-1(2 Н)-ил)метил)тиофен 2-ил)метанол (216 г, 0747 моль) в ТГФ (5 л). Реакционной смеси давали нагреться до температуры окружающей среды и перемешивали в течение ночи. Реакционную смесь фильтровали через диатомовую землю и осадок на фильтре промывали этилацетатом (2 л). Концентрировали органический фильтрат досуха. Добавляли воду (4 л); экстрагировали этилацетатом (35 л); органические фазы объединяли; и сушили объединенные органические фазы над сульфатом натрия. Удаляли твердые вещества путем фильтрации и концентрировали при пониженном давлении с получением масла. Остаток очищали путем флэш-хроматографии на силикагеле, элюируя смесью этилацетат:гексан (6:94), с получением титульного соединения (167 г, 44%). ESI (m/z) 504(М+Н). Пример 1. (3S)-3-[4-5-[(8-Метокси-3,4-дигидро-2 Н-хинолин-1-ил)метил]-2-тиенил]метокси]фенил] гекс-4-иновая кислота Раствор гидроксида калия (49,76 г, 0,88 моль) в воде (372 мл) добавляли к раствору (S)-этил-3-(45-8-метокси-3,4-дигидрохинолин-1(2 Н)-ил)метил)тиофен-2-ил)метокси)фенил)гекс-4-иноата (149 г,0,296 моль) в EtOH (1,49 л) при комнатной температуре и перемешивали в течение ночи. Реакционную смесь концентрировали досуха и добавляли воду (1,3 л). Полученный раствор экстрагировали EtOAc (2300 мл) и разделяли. рН водной фазы доводили до рН 6 с использованием 2 Н НС 1. Собирали полученные твердые вещества. Твердые вещества перекристаллизовывали из горячего МеОН (298 мл, 2 об.) с получением титульного соединения (91 г, 65%). ESI (m/z) 476(М+Н).GPR40. Информация. Результаты исследований с использованием трансгенных мышей со сверхэкспрессией гена GPR40 человека под контролем промотора инсулина II, недавно сообщенные Nagasumi, дополнительно подтверждают, что GPR40 играет важную роль в регуляции зависимой от глюкозы секреции инсулинаacids, Journal Biological Chemistry 278: 11303 -11311, 2003. Данные обнаружения дополнительно подтверждают, что разработка новых соединений, модулирующих GPR40, может быть особенно необходима для применения в лечении T2D. Первичный анализ потока кальция. Соединение из примера 1 тестировали, по существу, как описано ниже, и оно демонстрировало значение ЕС 50 для первичного анализа потока кальция меньше 1 мкМ. Данный анализ использовали для скрининга соединений путем измерения повышения уровней внутриклеточного кальция, происходящего, когда лиганд связывается и активирует GPR40, что таким образом демонстрирует силу и эффективность агонистов GPR40. Для исследования использовали клетки НЕК 293, сверхэкспрессирующие кДНК GPR40 человека, выдерживаемые в среде Игла, модифицированной по способу Дульбекко, со средой F12 в соотношении 3:1 с добавлением 10% FBS и 800 мкг/мл генетицина (geneticin) при 37 С и 5% СО 2. Анализы агонистов проводили с использованием набора для анализа Calcium 4 Dye (Molecular Devices) в присутствии 0,1% BSA, не содержащего жирных кислот, в буфере для анализа (1 х сбалансированный солевой раствор Хэнка (HBSS) и 20 мМ 4-(2-гидроксиэтил)-1 пиперазинэтансульфоновая кислота (HEPES. Активацию рецептора измеряли по увеличению внутриклеточного кальция с использованием флуориметрического планшетного анализатора (FLPR). Максимальное изменение флуоресценции относительно исходной линии использовали для определения ответа агониста. Значение ЕС 50 (эффективная концентрация, при которой достигается половина максимального эффекта) соединения рассчитывали с использованием программного обеспечения Excel Fit (версия 4;IDBS) путем построения графика зависимости концентрации от относительных единиц флуоресценции(RFU). Эффективность в процентах рассчитывали на основе максимального ответа, продемонстрированного соединением по сравнению с природным лигандом, линолевой кислотой. Тестируемое соединение из примера 1 имеет значение ЕС 50 152 +/- 52 нМ с 84 +/- 24% эффективности при исследовании в данном анализе. Данные результаты дополнительно демонстрируют желаемую активность и эффективность данного соединения в качестве агониста GPR40. Анализы зависимой от глюкозы секреции инсулина (GDIS). Поскольку известно, что активация GPR40 приводит к секреции инсулина, которая зависит от высоких концентраций глюкозы, разрабатывали две отдельные системы анализа (линия клеток инсулиномы и первичные островки у грызунов) для дополнительной характеристики соединений, которые, как известно, повышают внутриклеточный кальций в первичном анализе GPR40, рассмотренном выше. Анализы GDIS выполняли с использованием линии клеток инсулиномы мыши Min6. Клетки Min6 выдерживали в среде Игла, модифицированной по способу Дульбекко (DMEM), содержащей заменимые аминокислоты, 10% FBS, 50 мМ 2-меркаптоэтанол и 1% пенициллин, и стрептомицин при 37 С плюс 5% СО 2. В день проведения эксперимента клетки дважды промывали 200 мкл предварительно нагретого буфера Кребса-Рингера, не содержащего глюкозу. Добавление 200 мкл предварительно нагретого буфера Кребса-Рингера, содержащего 2,5 мМ глюкозы, использовали для "голодания" клеток с последующим добавлением соединений в присутствии высокой концентрации глюкозы (25 мМ). Планшет инкубировали при 37 С в течение 2 ч. В конце 2-часовой инкубации надосадочную жидкость осторожно переносили на пластину фильтра Millipore и центрифугировали при 200 g (гравитационная сила) в течение 3 мин. Инсулин анализировали с использованием набора для определения инсулина Mercodia (Insulin estimationkit). Добавление соединения из примера 1 в дозе 0,01, 0,1, 1,0 и 10,0 мкМ плюс 25 мМ глюкоза к клеткамMin6 приводило к дозозависимому увеличению секреции инсулина со статистически значимым (Р 0,01) увеличением (в 2,68 раз по сравнению с полученным в случае 25 мМ глюкозы) в дозе 1,0 мкМ. Анализы GDIS с использованием первичных панкреатических островков Лангерганса грызунов также использовали для характеристики приведенного в качестве примера соединения. Панкреатические островки выделяли у самцов крыс линии Sprague Dawley (SD) путем расщепления коллагеназой и разделения в градиенте плотности Histopaque. Островки культивировали в течение ночи в среде RPMI-1640 сGlutaMAXn (стабилизированная дипептидная форма L-глутамина ( 61870-010 в каталоге Invitrogen для облегчения извлечения в результате процесса выделения. Секрецию инсулина определяли путем инкубации в буфере на основе сбалансированного солевого раствора Эрла (EBSS) в течение 90 мин в 48 луночном планшете. Вкратце, сначала островки предварительно инкубировали в EBSS с 2,8 мМ глюкозой в течение 30 мин, а затем переносили в 48-луночный планшет (четыре островка/лунка), содержащий 150 мкл 2,8 мМ глюкозы, и инкубировали со 150 мкл EBSS с 2,8 или 11,2 мМ глюкозой в присутствии или отсутствии тестируемого соединения в течение 90 мин. В конце инкубации буфер извлекали из лунок и анализировали на предмет уровней инсулина с использованием набора для ELISA-анализа инсулина у крыс (Mercodia). В данной системе анализа инкубация соединения из примера 1 в концентрации 1, 3 и 10 мкМ совместно с островками у крыс и 11,2 мМ глюкозой приводила в статистически значимому(Р 0,05) увеличению инсулина в концентрации 3,0 мкМ (в 2,1 раза) по сравнению с полученным в случае 11,2 мМ глюкозы. Таким образом, соединение из примера 1 индуцирует выработку инсулина в условиях данного анализа. Анализы на определение селективности. Анализы связывания -, - и -рецептора, активируемого пролифератором пероксисом (PPAR), и функциональные анализы. Поскольку известно, что GPR40 активируется лигандами PPAR, приведенное в качестве примера соединение исследовали в анализах связывания PPAR, PPAR и PPAR, и функциональных анализах для определения селективности соединения из примера 1 в отношении GPR40. Соединение из примера 1 тестировали, по существу, как описано ниже для связывания PPAR, и оно демонстрировало значения связывания более 1000 нМ в случае 10 мкМ концентраций тестируемого соединения и, таким образом,считается отрицательным в отношении активности PPAR. Значения аффинности связывания соединения в отношении -, - и -рецепторов PPAR оценивали с использованием технологии сцинтилляционного анализа сближения (SPA). Прямой повтор 2 (DR2) биотинилированного олигонуклеотида использовали для связывания указанных рецепторов со SPAгранулами силиката иттрия, покрытыми стрептавидином. -, -, -PPAR и ретиноидный Х-рецептор(RXR)сверхэкспрессированы в клетках НЕК 293, и клеточные лизаты, содержащие специфические рецепторы, использовали в индивидуальных анализах. DR2 присоединялся к SPA-гранулам в течение 30 минутного периода времени в связывающем буфере, содержащем 10 мМ HEPES рН 7,8, 80 мМ KCl, 0,5 мМ MgCl2, 1 мМ DTT, 0,5% 3[(3-холамидопропил)диметиламмонио]пропансульфоновую кислоту(CHAPS) и 4,4% бычью сыворотку. Клеточные лизаты инкубировали в каждой лунке совместно с одной из 11 концентраций соединения в присутствии меченного радиоактивным изотопом (-0,033,8 мкКи 3 Н) эталонного соединения, представляющего собой двойной агонист PPAR / (бутановая кислота, 2-[4-[2(2,4-дифторфенил)амино]карбонил]гептиламино]этил]фенокси]-2-метил, см. Burris T.P. et al., Molecular Pharmacology 2005, 67, (3) 948-954), для анализов альфа- и дельта-рецепторов, и меченного радиоактивным изотопом (0,037,3 мкКи 3 Н) эталонного соединения, представляющего собой агонист PPAR(пропановая кислота, 2-метил-2-[4-[3-[проопил 5-(2-пиридинил)-2-тиенил]сульфонил]амино]пропил] фенокси], см. Burris T.P. et al., Molecular Pharmacology 2005, 67, (3) 948-954), для анализов гаммарецептора, 110,3 мкг SPA-гранул иттрия, покрытых стрептавидином, 0,126 нМ DR2 HD Oligo и либо 0,3 мкг PPAR с 0,5 мкг RXR, 0,5 мкг PPAR с 0,5 мкг RXR, либо 1,25 мкг PPAR с 3,03 мкг RXR в связывающем буфере, указанном выше, плюс 14% глицерин и 5 мкг деградированной в результате гидродинамического сдвига ДНК из молок лососвых. Неспецифическое связывание определяли в присутствии 10000 нМ немеченого эталонного соединения, представляющего собой двойной агонист PPAR /, для анализов альфа- и дельта-рецепторов, и эталонного соединения, представляющего собой агонист PPAR,для анализа гамма-рецептора. Реакцию связывания (100 мкл на лунку в 96-луночном планшете [Costar 3632]) инкубировали в течение 10 ч и подсчитывали число распадов в минуту (dpm) на Microbeta(Wallac). Аффинность связывания с рецептором (IC50) для соединения определяли путем приведения кривой "концентрация-ответ" с 11 точками в соответствие с логистическим уравнением с 4 параметрами.Ki определяли из IC50 с использованием уравнения Ченга-Прусоффа (Cheng-Prussoff), и Kd определяли по связыванию при насыщении. Для соединения из примера 1 связывание не детектировали ни в одном из трех анализов связывания PPAR в случае концентраций до 10 мкМ. Таким образом, анализы, описанные в настоящем документе, подтверждают, что соединение из примера 1 селективно активирует GPR40 и в то же время позволяет избежать нежелательной активности PPAR. Значения относитатьной IC50 для приведенного в качестве примера соединения при тестировании до 30 мкМ составляют больше 10 мкМ для изоформ PPAR, что подтверждает то, что приведенное в качестве примера соединение позволяет избежать активности PPAR, обеспечивая при этом желаемую активацию GPR40. Функциональные анализы репортерных генов Gal4 PPAR, Gal4 PPAR и PPAR также использовали для контроля селективности приведенного в качестве примера соединения. Клетки CV1, полученные из почечной ткани африканской зеленой мартышки, трансфицировали различными рецепторными и репортерными плазмидами с использованием Fugene. Для анализов Gal4 PPAR и PPAR репортерную плазмиду, содержащую пять тандемных копий элемента ответа белка Gal4 транскрипции дрожжей, клонированных перед геном люциферазы светлячка, регулируемым главным поздним промотором аденовируса, трансфицировали совместно с регулируемой вакуолизирующим обезьяним вирусом 40 (SV40) плазмидой, конститутивно экспрессирующей гибридный белок, содержащий ДНК-связывающий домен(DBD) Gal4 и связывание лиганда либо PPAR, либо PPAR. Для анализа PPAR плазмиды, кодирующиеPPAR и RXR, обе регулируемые промотором цитомегаловируса (CMV), трансфицировали совместно с плазмидой, содержащей кДНК репортерного гена люциферазы, регулируемую промотором ТК, и элемент ответа рецептора (2 Х PPRE). Клетки трансфицировали в колбах для культивирования клеток Т 22 см 2 в средах DMEM с 5% очищенной на активированном угле FBS. После инкубации в течение ночи трансфицированные клетки обрабатывали трипсином, высевали в 96-луночные непрозрачные планшеты(15000 клеток/лунка) в средах DMEM, содержащих 5% очищенную на активированном угле FBS, инкубировали в течение 4 часов, и воздействовали 0,17 мкМ-10 мкМ тестируемого соединения или эталонного соединения в разведениях с кратностью 3,16 (полулогарифмическое разведение, half log dilution). После 24 часов инкубации совместно с соединением клетки лизировали и определяли активность люциферазы по люминесценции в качестве меры активации рецептора. Данные подставляли в логистическую модель с четырьмя параметрами с определением значений ЕС 50. Определяли максимальную стимуляцию в процентах относительно максимальной стимуляции, полученной в случае 10 мкМ соответствующего эталонного соединения, представляющего собой агонист PPAR. Не детектировали функциональную активацию PPAR, PPAR или PPAR в случае соединения из примера 1 при исследовании до 10 мкМ в анализах специфической котрансфекции (CTF) PPAR/функциональных анализах, описанных выше. Таким образом, данный анализ подтверждает, что приведенное в качестве примера соединение позволяет избежать агонистической активности PPAR, что и необходимо. Эффективность in vivo: интраперитонеальный тест на переносимость глюкозы (IPGTT). Для исследования способности приведенного в качестве примера соединения активировать GPR40in-vivo, приводящей к противодиабетической эффективности, т е снижению уровней глюкозы в плазме крови, осуществляли 4-дневное исследование на основе интраперитонеального теста на переносимость глюкозы (lpGTT), и ниже представлены данные для тестируемого соединения. Самцов мышей линии Balb/c (мыши-альбиносы) (8-9 недель) содержали по одному и обеспечивали обычным кормовым рационом питания для грызунов и водой без ограничения. Определяли массу тела животных, рандомизировали по массе тела и ежедневно фиксировали массу тела. Животным перорально вводили дозу один раз в сутки в течение трех дней с использованием состава, содержащего метилцеллюлозу и твин-80 (tween-80). В ночь перед 4 днем животным не давали есть в течение ночи. Утром 4 дня животным перорально вводили соединение или только носитель за 60 мин до проведения теста на переносимость глюкозы (глюкоза 2 г/кг, интраперитонеально). Уровни глюкозы в крови определяли в крови из хвоста, взятой через 0, 3, 7, 15, 30 и 60 мин после сахарной нагрузки. Характеристики колебаний глюкозы в крови от t=0 до t=60 мин использовали для интеграции площади под кривой (ППК) для каждого лечения. Процент снижения глюкозы рассчитывали исходя из данных ППК соединения относительно ППК группы, получавшей носитель. Тестируемое соединение вводили перорально в дозе 0,3, 1,0, 3,0, 10 или 30 мг/кг, а положительный контроль (3-[4-(2-метилбензилокси)фенил]гекс-4-иновую кислоту, смWO 2005086661 ) вводили в дозе 10 мг/кг. Уровни глюкозы были значительно снижены по сравнению с уровнями, полученными в случае контроля носителем в 15-минутные моменты времени с дозами 3, 10 и 30 мг/кг и в 30- и 60-минутные моменты времени с дозами 1,0, 3,0, 10 и 30 мг/кг соединения из примера 1. Уровни глюкозы были снижены в 15-, 30- и 60-минутные моменты времени для положительного контроля ED50 для данного соединения на основе ППК для снижения глюкозы составляла 1,0 мг/кг. Результаты данного исследования показывают, что активация GPR40 соединением из примера 1 приводит к противодиабетической эффективности in-vivo. Приведенное в качестве примера соединение согласно настоящему изобретению может быть легко включено в состав фармацевтических композиций в соответствии с принятой практикой, известной в данной области техники, такой как описана в Remington's "Pharmaceutical Sciences'", Gennaro, Ed., MackPublishing Co. Easton Pa. 1990, таких как таблетки, твердые капсулы или капсулы с гелем, порошки, суспензии или растворы. Композиция также может содержать один или более фармацевтически приемлемых носителей, наполнителей и разбавителей. Неограничивающие примеры фармацевтически приемлемых носителей, наполнителей и разбавителей, подходящих для таких составов, включают следующие вещества: крахмал, сахара, маннит и производные диоксида кремния; связующие агенты, такие как карбоксиметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон; увлажняющие агенты, такие как глицерин; разрыхлители, такие как карбонат кальция и бикарбонат натрия; агенты для замедления растворения, такие как парафин; ускорители ресорбции, такие как соединения четвертичного аммония; поверхностно-активные вещества, такие как цетиловый спирт, моностеарат глицерина, адсорбирующие носители, такие как каолин и бентонит; и смазывающие вещества, такие как тальк, стеарат кальция и магния, и твердые полиэтиленгликоли. Предпочтительные фармацевтические композиции включают композиции, изготовленные в виде таблетки или капсулы для перорального введения. Указанная таблетка или капсула может содержать соединение согласно настоящему изобретению в количестве, эффективном для лечения диабета, в частности диабета второго типа. Фармацевтическую композицию вводят пациенту в количествах, эффективных для лечения диабета,в частности диабета второго типа. Подходящее количество или доза, эффективная для лечения пациента,может быть определена медицинским работником. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I или его фармацевтически приемлемая соль. 2. Фармацевтическая композиция, содержащая соединение по п.1 или его фармацевтически приемлемую соль и по меньшей мере один из фармацевтически приемлемого носителя, разбавителя или наполнителя. 3. Применение соединения или его фармацевтически приемлемой соли по п.1 в терапии, связанной с активацией сопряжнного с G-белком рецептора 40 (GPR-40). 4. Применение соединения или его фармацевтически приемлемой соли по п.1 для лечения диабета у млекопитающего. 5. Применение соединения или его фармацевтически приемлемой соли по п.1 для получения лекарственного средства для лечения диабета. 6. Соединение формулы II где R выбран из C1-4 алкила, C1-4 галогеналкила, С 3-6 циклоалкила, C1-4 алкил-С 3-6 циклоалкила, фенила и C1-5 алкилфенила. 7. Способ получения (3S)-3-[4-5-[(8-метокси-3,4-дигидро-2 Н-хинолин-1-ил)метил]-2-тиенил]метокси]фенил]гекс-4-иновой кислоты формулы I или ее фармацевтически приемлемой соли при этом указанный способ включает деэтерификацию соединения формулы II
МПК / Метки
МПК: A61K 31/4709, A61K 31/381, C07D 409/06
Метки: производное, подходящее, 1,2,3,4-тетрагидрохинолина, диабета, лечения
Код ссылки
<a href="https://eas.patents.su/10-22165-proizvodnoe-1234-tetragidrohinolina-podhodyashhee-dlya-lecheniya-diabeta.html" rel="bookmark" title="База патентов Евразийского Союза">Производное 1,2,3,4-тетрагидрохинолина, подходящее для лечения диабета</a>
Предыдущий патент: (пиридин-4-ил)бензиламиды как аллостерические модуляторы альфа 7 nachr
Следующий патент: Синтетические тритерпеноиды и их применение в лечении заболеваний
Случайный патент: Управляющее приспособление для экранирующего устройства.












