Способ получения (альфа s, бета r)-6-бром-альфа-[2-(диметиламино)этил]-2-метокси-альфа-1-нафталенил-бета-фенил-3-хинолинэтанола
Номер патента: 11770
Опубликовано: 30.06.2009
Авторы: Хорнс Штефан, Порстманн Франк Ральф, Бадер Томас
Формула / Реферат
1. Способ выделения (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола оптическим разделением с хиральным 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксидом или его производным в качестве разделяющего агента.
2. Способ по п.1, в котором хиральный 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид или его производное является хиральным соединением формулы (I)
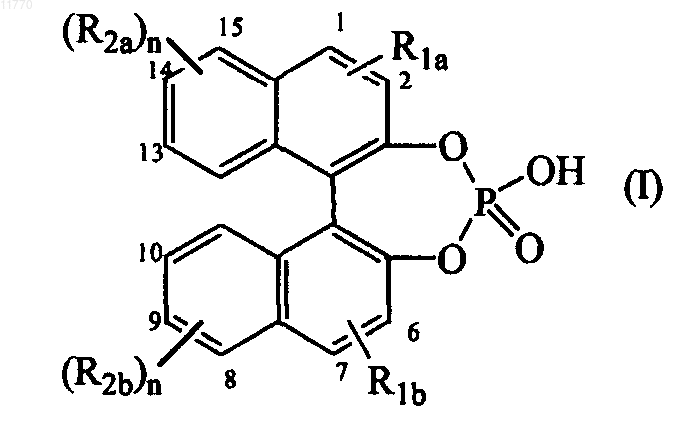
в которой n является целым числом, равным 1 или 2;
R1a и R1b, каждый независимо, обозначает водород; галоген; С1-12алкил, необязательно замещенный арилом; арил; нафтил; Si(фенил)3; С1-6алкилокси; антраценил; С2-6алкинил, необязательно замещенный арилом;
R2a и R2b, каждый независимо, обозначает водород; галоген; С1-12алкил, необязательно замещенный арилом; арил; С2-12алкенил; C1-6алкилокси, необязательно замещенный фенилом; нитро; гидроксил;
R2a в положении 14 и в положении 15 в 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксиде могут также быть взяты для формирования вместе с нафтильным кольцом, к которому присоединены оба заместителя R2a, 13-метил-12,13,14,15,16,17-гексагидро-11H-циклопента[а]фенантрена;
R2b в положении 8 и в положении 9 в 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксиде могут также быть взяты вместе для формирования вместе с нафтильным кольцом, к которому присоединены оба заместителя R2b, 13-метил-12,13,14,15,16,17-гексагидро-11Н-циклопента[а]фенантрена;
арил является фенилом или фенилом, замещенным одним, двумя или тремя заместителями, каждый из которых независимо выбран из C1-6алкила, полигалогенС1-6алкила, С1-6алкилокси, замещенного фенилом, фенилом, необязательно замещенным одним, двумя или тремя заместителями, выбранными из C1-6 алкила или нафтила.
3. Способ по п.1 или 2, в котором соль (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-[3-фенил-3-хинолинэтанола и разделяющего агента кристаллизуется.
4. Способ по п.3, включающий а) взаимодействие смеси стереоизомерных форм 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола с указанным разделяющим агентом в подходящем растворителе; b) отделение образующейся в результате соли (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола и указанного разделяющего агента от реакционной смеси, полученной в а); с) необязательно повторная кристаллизация или суспендирование соли, полученной в b), в подходящем растворителе; d) освобождение (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола от соли, полученной в b) или с).
5. Способ по п.3 или 4, в котором разделяющим агентом является (11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид.
6. Способ по п.4 или 5, в котором подходящим растворителем в а) является кетон, эфир, смесь кетона с апротонным полярным растворителем или смесь эфира с апротонным полярным растворителем.
7. Способ по п.4 или 5, в котором подходящим растворителем в а) является кетон или смесь кетона с апротонным полярным растворителем.
8. Способ по п.7, в котором кетоном является ацетон или метилэтилкетон, и в котором апротонным полярным растворителем является диметилсульфоксид или N,N-диметилформамид.
9. Способ по п.7, в котором подходящим растворителем является ацетон.
10. Способ по п.7, в котором подходящим растворителем является смесь ацетона и диметилсульфоксида.
11. Способ по любому из пп.4-10, в котором в реакционную смесь а) вносится затравка из соли (aS, bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола и разделяющего агента перед добавлением разделяющего агента к реакционной смеси.
12. Способ по любому из пп.4-10, в котором в реакционную смесь а) вносится затравка из соли (aS, bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола и разделяющего агента после добавления разделяющего агента к реакционной смеси.
13. Способ по любому из пп.4-10, в котором в реакционную смесь а) вносится затравка из соли (aS, bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола и разделяющего агента до и после добавления разделяющего агента к реакционной смеси.
14. Способ по любому из пп.4-13, в котором разделяющий агент добавляют к смеси стереоизомерных форм 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола в виде раствора в подходящем растворителе.
15. Способ по п.14, в котором подходящим растворителем является апротонный полярный растворитель.
16. Способ по п.15, в котором апротонным полярным растворителем является диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид или N-метилпирролидон.
17. Способ по п.16, в котором апротонным полярным растворителем является диметилсульфоксид или N,N-диметилформамид.
18. Способ по п.17, в котором апротонным полярным растворителем является диметилсульфоксид.
19. Способ по любому из пп.4-18, в котором стадия повторной кристаллизации или суспендирования в с) выполняют в ацетоне, N,N-диметилформамиде, смеси N,N-диметилформамид/вода, смеси диметилсульфоксид/вода, смеси диметилсульфоксид/ацетон, смеси диметилсульфоксид/спирт или смеси N, N-диметилформамид/спирт.
20. Способ по п.19, в котором повторную кристаллизацию или суспендирование осуществляют в ацетоне.
21. Способ по любому из пп.4-20, в котором освобождение основания от соли в d) осуществляют с помощью взаимодействия соли в подходящем растворителе с подходящим основанием.
22. Способ по п.21, в котором подходящим растворителем является органический растворитель, который является несмешиваемым с водой или водными растворами соли.
23. Способ по п.22, в котором растворителем является толуол или тетрагидрофуран.
24. Способ по п.23, в котором растворителем является толуол.
25. Способ по любому из пп.21-24, в котором основанием является карбонатное основание или фосфатное основание.
26. Способ по п.25, в котором основанием является K2CO3, KHCO3, Na2CO3, NaHCO3, Na3PO4 или Na2HPO4.
27. Способ по п.26, в котором основанием является K2CO3.
28. Способ по любому из яя.4-27, в котором количество разделяющего агента варьирует от 0,5 до 1,5 эквивалентов, вычисленных по сумме стереоизомерных форм 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола, присутствующих в смеси а).
29. Способ по п.28, в котором количество разделяющего агента составляет 1 эквивалент от суммы стереоизомерных форм 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола, присутствующих в смеси а).
30. Способ по любому из пп.3-29, в котором смесь стереизомерных форм 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола является смесью, в которой преимущественно присутствует диастереоизомер А.
31. Способ по п.1 или 2, в котором соль (aR,bS)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола и разделяющего агента кристаллизуется.
32. Способ по п.31, включающий а) взаимодействие смеси стереоизомерных форм 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола с указанным разделяющим агентом в подходящем растворителе; b) отделение образующейся в результате соли (aR,bS)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола и указанного разделяющего агента от реакционной смеси, полученной в а); с) изоляция (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола от остаточной маточной жидкости, полученной после отделения образующейся в результате соли от реакционной смеси.
33. Способ по п.31 или 32, в котором разделяющим агентом является (11bS)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид.
34. Способ по любому из пп.31-33, в котором смесью стереоизомерных форм 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола является диастереоизомер А.
35. Способ выделения (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола по любому из пп.1-29 и 31-33, в котором смесь стереоизомерных форм получают с помощью а) взаимодействия 3-бензил-6-бром-2-метоксихинолина с литийдиизопропиламидом и (3-диметиламино)-1'-пропионафтоном в подходящем растворителе, с последующим добавлением подходящей кислоты.
36. Способ выделения (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола по п.30, в котором смесь стереоизомерных форм получают с помощью а) взаимодействия 3-бензил-6-бром-2-метоксихинолина с литийдиизопропиламидом и (3-диметиламино)-1'-пропионафтоном в подходящем растворителе, с последующим добавлением подходящей кислоты; b) обогащение смеси, полученной в а) рацемической смесью (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола и (aR,bS)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола, с помощью удаления рацемической смеси (aS,bS)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола и (aR,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола из реакционной смеси.
37. Способ по п.36, в котором смесь стереоизомерных форм получают с помощью а) взаимодействия 3-бензил-6-бром-2-метоксихинолина с литийдиизопропиламидом и (3-диметиламино)-1'-пропионафтоном в подходящем растворителе, с последующим добавлением подходящей кислоты; b) обогащение смеси, полученной в а) рацемической смесью (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола и (aR,bS)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола с помощью удаления рацемической смеси (aS,bS)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола и (aR,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола из реакционной смеси; и с) кристаллизации образующихся в результате стереоизомерных форм 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола из реакционной смеси, полученной в b), в подходящем растворителе.
38. Способ по п.37, в котором подходящим растворителем в с) является спирт или смесь эфир/спирт.
39. Способ по п.37, в котором подходящим растворителем в с) является спирт.
40. Способ по п.38 или 39, в котором спиртом является этанол.
41. Способ по любому из пп.35-40, в котором подходящим растворителем в а) является аполярный апротонный растворитель.
42. Способ по п.41, в котором аполярным апротонным растворителем является эфир.
43. Способ по п.42, в котором эфиром является тетрагидрофуран.
44. Способ по любому из пп.35-43, в котором реакцию в а) осуществляют при температуре ниже 0шC.
45. Применение (11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида в качестве разделяющего агента для выделения (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром-a-[2-(диметиламино) этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанола.
46. Соль, имеющая следующую формулу: (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталенил-b-фенил-3-хинолинэтанол*(11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2] 4-оксид диоксафосфепин.
Текст
011770 Настоящее изобретение относится к способу выделения (S,R)-6-бром[2-(диметиламино)этил]2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола оптическим разделением с применением в качестве разделяющего агента хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или его производных. 6-Бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанол и его стереоизомерные формы раскрыты в WO 2004/011436 как противомикробные агенты, применяемые для лечения микобактериальных заболеваний, в частности заболеваний, вызываемых патогенными микобактериями, такими как Mycobacterium (M.) tuberculosis, M. bovis, M. avium и М. marinum. Энантиомер (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанол соответствует соединению 12 (энантиомер A1) в WO 2004/011436 и является предпочтительным соединением для лечения микобактериальных заболеваний, в частности, туберкулеза. В WO 2004/011436 описано его выделение с помощью хиральной хроматографии из диастереоизомера А, который соответствует рацемической смеси (S, R)-6-бром-[]-[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола (энантиомер A1) и (R,S)-6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола (энантиомер А 2). С целью обеспечения поставки (S, R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола для развития и продаж необходим эффективный способ синтеза, который может осуществляться в крупных промышленных масштабах. Вследствие этого целью настоящего изобретения является предоставление способа получения (выделения)(S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола с высоким выходом и большим энантиомерным избытком и который подходит для применения в крупных промышленных масштабах. Настоящее изобретение относится к способу выделения (S,R)-6-бром[2-(диметиламино)этил]2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола оптическим разделением. Несколько хиральных кислот было протестировано как агенты для оптического разделения для выделения(S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенил-фенил-3-хинолинэтанола. Было установлено, что оптическое разделение (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола не является прямым, так как либо не происходит кристаллизации образующейся в результате хиральной соли, либо не наблюдается энантиомерного избытка. Неожиданно было установлено, что при применении хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или его производного в качестве разделяющего агента было успешным оптическое разделение (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3 хинолинэтанола, который является соединением с двумя высокозатрудненными стерическими хиральными центрами, находящимися рядом друг с другом, поскольку происходила кристаллизация хиральной соли, делая возможным выделение или отделение хиральной соли из возможной реакционной смеси, и поскольку мог быть достигнут высокий энантиомерный избыток. Способ настоящего изобретения позволяет выделять желаемый (S,R)энантиомер из смеси, содержащей все 4 энантиомера. Способ также позволяет очистить желаемый (S,R)энантиомер от других примесей способа. Термин энантиомерный избыток (е.е) известен специалистам по стереохимии. Для смеси (+) и (-) энантиомеров с композицией, взятой в молярной или весовой фракциях F(+) и F(-), (где F(+)+F(-)=1),энантиомерный избыток для F(+) определяется как F(+)-F(-), а энантиомерный избыток в процентах определяется как 100[F(+)-F(-)]. Поэтому настоящее изобретение относится к применению хирального 4-гидроксидинафто[2,1d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или его производного в качестве разделяющего агента для выделения (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенил-фенил-3-хинолинэтанола. 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанол является соединением формулы-1 011770 и имеет два хиральных центра, обозначенных в формуле . Соединение существует в 4 стереоизомерных формах, то есть как (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенил-фенил-3-хинолинэтанол, (R,S)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил 3-хинолинэтанол, (R,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанол и (S,S)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанол. 4 стереоизомерных формы могут присутствовать в форме 2 диастереоизомеров, то есть рацемической смеси (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и (R,S)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола, в дальнейшем называемой диастереоизомер А, и рацемической смеси (R,R)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанол и(S,S)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанол, в дальнейшем называемой диастереоизомер В. Таким образом, каждый раз, когда выше или в дальнейшем, применяется ссылка на смесь стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола, она означает смесь 4 возможных стереоизомерных форм, то есть (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола,(R,S)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола, (R,R)-6-бром[2-(диметиламино) этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и (S,S)-6-бром[2-(диметиламино) этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола. Предпочтительно, она означает смесь, в которой диастереоизомер А присутствует в преобладающем количестве, то есть смесь, содержащую более 50%, в частности, 80% или более, в частности, 85% или более, или 90% или более диастереоизомера А, или она означает диастереоизомер А. Диастереоизомер А является рацемической смесью, которая в основном не содержит диастереоизомера В. "В основном не содержит" в этом контексте означает сочетание с менее 5%, предпочтительно менее 2%, более предпочтительно менее 1% другого диастереоизомера или смесь, которая является в основном чистой. Смесь, в которой преимущественно присутствует диастереоизомер А, может быть получена селективной кристаллизацией диастереоизомера В из смеси диастереоизомеров А и В. Это может быть достигнуто с использованием затравки смеси диастереоизомеров А и В диастереоизомером В, таким образом вызывая кристаллизацию диастереоизомера В, который может затем быть удален из смеси, например, фильтрацией, приводя к смеси, в которой преимущественно присутствует диастереоизомер А. Диастереоизомер (в основном не содержащий диастереоизомера В) может быть получен из смеси диастереоизомеров А и В с помощью хроматографии на колонках и кристаллизации (поэтому приведена ссылка на WO 2004/011436, пример В 7). Каждый раз, когда выше или в дальнейшем применяется определение "4-гидроксидинафто[2,1d:1',2'-f][1,3,2]диоксафосфепин 4-оксид" или его производное, он означает хиральный 4 гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид или хиральный 4-гидроксидинафто[2,1d:1',2'-f][1,3,2]диоксафосфепин 4-оксид, в котором одно или оба нафтильных кольца замещены одним или более заместителями. В частности, хиральный 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид или его производное обозначают хиральное соединение формулы (I)R2a в положении 14 и в положении 15 в 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4 оксиде могут также быть взяты вместе для формирования вместе с нафтильным кольцом, к которому присоединены оба заместителя R2a, 13-метил-12,13,14,15,16,17-гексагидро-11 Н-циклопента[а]фенантрена;R2b в положении 8 и в положении 9 в 4-гидроксидинафто[2,1-d: 1',2'-f][1,3,2]диоксафосфепин 4 оксиде могут также быть взяты вместе для формирования вместе с нафтильным кольцом, к которому-2 011770 присоединены оба заместителя R2b, 13-метил-12,13,14,15,16,17-гексагидро-11 Н-циклопента[а]фенантрена; арил является фенилом или фенилом, замещенным одним, двумя или тремя заместителями, каждый из которых выбран из C1-6 алкила, полигалогенС 1-6 алкила, С 1-6 алкилокси, замещенного фенилом, фенилом, необязательно замещенным одним, двумя или тремя заместителями, выбранными из C1-6 алкила или нафтила. Предпочтительными вариантами осуществления соединений формулы (I) являются соединения, к которым применяется одно или по возможности больше, из следующих условий: Предпочтительно заместитель R1a находится в 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксиде в положении 1 или 2. Предпочтительно заместитель R1b находится в 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксиде в положении 6 или 7. Предпочтительно заместитель R2a находится в 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксиде в положении 14 или 15. Предпочтительно заместитель R2b находится в 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксиде в положении 8 или 9. Предпочтительно заместитель R2a находится в 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксиде в положении 13 и 14. Предпочтительно заместитель R2b находится в 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксиде в положении 9 и 10. Хиральный 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид или его производное или хиральные соединения формулы (I) включают:(11bS)-4-гидрокси-1,7,9,14-тетрафенилдинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид; циклический кислый фосфат (4S,14)-(14')-[4,4'-биэстра-1,3,5,7,9-пентаен]-3,3'-диола;(11bS)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид. Предпочтительно разделяющим агентом является (11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид или (11bS)-4-гидроксидинафто[2,1-d: 1',2'-f][1,3,2]диоксафосфепин 4-оксид. Наиболее предпочтительно разделяющим агентом является (11bR)-4-гидроксидинафто [2,1-d: 1',2'-f][1,3,2]диоксафосфепин 4-оксид. Применяемый выше или в дальнейшем C1-6 алкил как группа или часть группы обозначает насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 6 атомов углерода, такие как метил, этил, пропил, 1-метилэтил, бутил, пентил, гексил, 2-метилбутил и подобные; С 1-12 алкил как группа или часть группы обозначает насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 12 атомов углерода, такие как группы, определенные для С 1-6 алкила и гептил, октил, нонил, децил и подобные; С 2-12 алкенил обозначает углеводородные радикалы с прямой или разветвленной цепью, имеющие от 2 до 12 атомов углерода, содержащие двойную связь, такие как этенил, пропенил, бутенил, пентенил, гексенил, метиленоктил и подобные; С 2-6 алкинил обозначает углеводородные радикалы с прямой или разветвленной цепью, имеющие от 2 до 6 атомов углерода, содержащие тройную связь, такие как этинил, пропиинил, бутинил, пентинил, гексинил и подобные. Термин галоген является общим для фтора, хлора, брома и йода. Применяемый выше или в дальнейшем полигалогенС 1-6 алкил как группа или часть группы обозначает моно- или полигалогензамещенный С 1-6 алкил, например, метил с одним или более атомами фтора, например, дифторметил или трифторметил, 1,1-дифторэтил и подобные. В случае, если к алкильной группе присоединен более чем один атом галогена, в пределах определения полигалогенС 1-6 алкил, они могут быть одинаковыми или различными. Соединение формулы (I) может также применяться в форме гидрата или в форме с добавлением растворителя, которую соединение формулы (I) способно образовывать. К примерам таких форм относятся, например, гидраты, алкоголяты и подобные. Настоящий способ выделения (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола оптическим разделением с хиральным 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксидом или его производным в качестве разделяющего агента охватывает два варианта осуществления. В первом варианте осуществления кристаллизуется соль желаемого (S,R) энантиомера и разделяющего агента. Во втором варианте осуществления кристаллизуется соль (S,R) энантиомера и разделяющего агента. Далее эти два варианта осуществления будут описаны более подробно. Первый вариант осуществления Изобретение относится к способу выделения (S,R)-6-бром[2-(диметиламино)этил]-2-метокси-1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола оптическим разделением с хиральным 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксидом или его производным в качестве разделяющего агента, в котором соль (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и разделяющего агента кристаллизуется. Настоящее изобретение далее относится к способу выделения (S,R)-6-бром[2-(диметиламино) этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром-[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола оптическим разделением с хиральным 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксидом или его производным в качестве разделяющего агента, в котором соль (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола и разделяющего агента кристаллизуется, указанный способ включаетa) взаимодействие смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола с указанным разделяющим агентом в подходящем растворителе;b) отделение образующейся в результате соли (S,R)-6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола и указанного разделяющего агента от реакционной смеси, полученной в а);c) необязательно повторная кристаллизация или суспендирование раствора соли, полученного в b),в подходящем растворителе;d) освобождение (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3 хинолинэтанола от соли, полученной в b) или с). Поскольку (11bR)-4-гидроксидинафто[2,1-d:r,2'-f][1,3,2]диоксафосфепин 4-оксид является предпочтительным разделяющим агентом, настоящее изобретение также относится к способу выделения(S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из сме-4 011770 си стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3 хинолинэтанола оптическим разделением с (11bR)-4-гидроксидинафто [2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксидом в качестве разделяющего агента, в котором соль (S,R)-6-бром[2-(диметиламино) этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и разделяющего агента кристаллизуется,указанный способ включает а) взаимодействие смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола с (11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксидом в подходящем растворителе; b) отделение результирующего(11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид из реакционной смеси, полученной в а) ; с) необязательно повторная кристаллизация или суспендирование соли, полученной в b) в подходящем растворителе; d) освобождение (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола от соли, полученной в b) или с). Поскольку в вышеописанных способах соль (S,R)-6-бром[2-(диметиламино)этил]-2-метокси-1-нафталенилфенил-3-хинолинэтанола и разделяющего агента кристаллизуется, она может быть отделена от реакционной смеси, например, фильтрацией. Растворитель в а) может также быть смесью различных растворителей. В предпочтительном варианте осуществления настоящего изобретения подходящим растворителем в а) является кетон, эфир,смесь кетона с апротонным полярным растворителем, или смесью эфира с апротонным полярным растворителем. Предпочтительно кетоном является ацетон или метилэтилкетон. Предпочтительно эфиром является этилацетат или бутилацетат, более предпочтительно бутилацетат. Апротонным полярным растворителем для смеси с кетоном является предпочтительно диметилсульфоксид, N,N-диметилформамид,N,N-диметилацетамид или N-метилпирролидон. Апротонным полярным растворителем для смеси с эфиром, предпочтительно бутилацетатом, является предпочтительно диметилсульфоксид или N,Nдиметилформамид, предпочтительно диметилсульфоксид. Предпочтительно растворителем в а) является кетон или смесь кетона с апротонным полярным растворителем. Более предпочтительно растворителем в а) является ацетон или растворителем в а) является смесь ацетона с диметилсульфоксидом или N,Nдиметилформамидом, в частности смесь ацетона и диметилсульфоксида. В предпочтительном варианте осуществления настоящего изобретения количество хирального Агидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или его производного, в частности (11bR)4-гидроксидинафто [2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида, варьирует от 0,5 до 1,5 эквивалентов,предпочтительно от 0,8 до 1,2 эквивалентов, наиболее предпочтительно равно 1 эквиваленту, вычисленному по сумме диастереоизомеров А и В, присутствующих в смеси в а), то есть вычисленному по сумме стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола, присутствующих в смеси а). В предпочтительном варианте осуществления настоящего изобретения в реакционную смесь а) вводят затравку из кристаллов соли (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4 оксида или их производных, в частности, из кристаллов соли (S,R)-6-бром[2-(диметиламино)этил]2-метокси 1-нафталенилфенил-3-хинолинэтанола(11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2] диоксафосфепин 4-оксида перед добавлением к реакционной смеси хирального 4-гидроксидинафто[2,1d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или его производного, в частности (11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида. В другом предпочтительном варианте осуществления настоящего изобретения в реакционную смесь а) вводят затравку из кристаллов соли (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола и хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или их производных, в частности из кристаллов соли (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола (11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида, после добавления к реакционной смеси хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или его производного, в частности (11bR)-4 гидроксидинафто [2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид. Более предпочтительно в реакционную смесь а) вводят затравку из кристаллов соли (S, R)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола и хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или их производных, в частности, из кристаллов соли (S,R)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола(11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида, до и после добавления к реакционной смеси хирального 4 гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или его производного, в частности (11bR)4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида. При добавлении к реакционной смеси затравки из хиральной соли в а) улучшается энантиомерный избыток и фильтруемость образующейся в результате твердой фазы. Затравка из соли (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-5 011770 хинолинэтанола и хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или их производных, в частности затравка из соли (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола(11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4 оксида, могут быть получены из предварительно осуществленных способов получения (S,R)-6-бром-[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола с помощью хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или его производного, в частности (11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида, в качестве разделяющего агента, таких как способ, являющийся предметом настоящего изобретения. В предпочтительном варианте осуществления настоящего изобретения хиральный 4 гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид или его производное, в частности, (11bR)4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид, добавляют к смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола в виде раствора в подходящем растворителе. Указанным растворителем предпочтительно является апротонный полярный растворитель, такой как, например, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид или N-метилпирролидон, более предпочтительно апротонным полярным растворителем является диметилсульфоксид или N,N-диметилформамид, наиболее предпочтительно - диметилсульфоксид. При добавлении к реакционной смеси а) хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2] диоксафосфепин 4-оксида или его производного в виде раствора, в частности, (11bR)-4-гидроксидинафто[2,1d:1',2'-f][1,3,2]диоксафосфепин 4-оксида, эффективность реакции и обработка реагентов повышаются. В предпочтительном варианте осуществления смесь стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола в а) в вышеописанных способах является смесью, в которой преимущественно присутствует диастереоизомер А. В предпочтительном варианте осуществления настоящего изобретения рекристаллизация и/или суспендирование полученной соли (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4 оксида или их производных, в частности, соль (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола(11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4 оксида, выполняют до высвобождения из хиральной соли желаемого основания для повышения эффективности и химической чистоты. Рекристаллизацию или суспендирование выполняют в подходящем растворителе, таком как, например, ацетон, N,N-диметилформамид, смесь N,N-диметилформамид/вода,смесь диметилсульфоксид/вода, смесь диметилсульфоксид/ацетон, смесь диметилсульфоксид/спирт или смесь N, N-диметилформамид/спирт. Предпочтительно, рекристаллизацию выполняют в ацетоне. В предпочтительном варианте осуществления настоящего изобретения (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанол освобождают от соли (S,R)-6 бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и хирального 4 гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или их производных, в частности, от соли(11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида взаимодействием соли в подходящем растворителе с подходящим основанием. Предпочтительно растворителем является органический растворитель, который является несмешиваемым с водой или водными растворами соли, такой как, например, толуол или тетрагидрофуран. Более предпочтительно, растворителем является толуол. В предпочтительном варианте осуществления настоящего изобретения основанием, применяемым для освобождения (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3 хинолинэтанола из вышеописанной соли является карбонатное основание или фосфатное основание. Предпочтительно, основанием являются K2CO3, KHCO3, Na2CO3, NaHCO3, Na3PO4 или Na2HPO4. Более предпочтительно основанием является K2CO3. Для повышения чистоты, полученный (S,R) энантиомер может быть далее повторно кристаллизован в подходящем растворителе, например, этаноле или толуоле, как описано ниже. Настоящее изобретение также относится к соли (S,R)-6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола и хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2] диоксафосфепин 4-оксида или их производных, в частности к соли (S,R)-6-бром[2-(диметиламино) этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола[1,3,2]диоксафосфепин 4-оксида. Второй вариант осуществления Как уже указано выше, альтернативный способ выделения (S,R)-6-бром[2-(диметиламино) этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром-[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола оптическим разделением-6 011770 с хиральным 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксидом или его производным в качестве разделяющего агента согласно настоящему изобретению является способом, в котором соль(R,S)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и разделяющего агента кристаллизуется. Поэтому настоящее изобретение также относится к способу выделения (S, R)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола оптическим разделением с хиральным 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксидом или его производным в качестве разделяющего агента, в котором соль (R,S)-6-бром[2-(диметиламино) этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и разделяющего агента кристаллизуется,указанный способ включает а) взаимодействие смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола с указанным разделяющим агентом в подходящем растворителе; b) отделение образующейся в результате соли (R,S)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и указанного разделяющего агента от реакционной смеси, полученной в а); с) выделение (S,R)-6-бром[2-(диметиламино) этил] 2-метокси 1-нафталенилфенил-3-хинолинэтанола из остаточной маточной жидкости, полученной после отделения образующейся в результате соли от реакционной смеси. Для этого альтернативного способа (11bS)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид является предпочтительным разделяющим агентом и поэтому настоящее изобретение также относится к способу выделения (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенил-(3 фенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси-1-нафталенилфенил-3-хинолинэтанола оптическим разделением с (11bS)-4-гидроксидинафто[2,1d:1',2'-f][1,3,2]диоксафосфепин 4-оксидом в качестве разделяющего агента, в котором соль (R,S)-6 бром(2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и разделяющего агента кристаллизуется, указанный способ включает а) взаимодействие смеси стереоизомерных форм 6 бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола с указанным разделяющим агентом в подходящем растворителе; b) отделение образующейся в результате соли (R,S)6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и указанного разделяющего агента от реакционной смеси, полученной в а); с) выделение (S,R)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из остаточной маточной жидкости, полученной после отделения образующейся в результате соли от реакционной смеси. В альтернативных способах, описанных выше, предпочтительные варианты осуществления растворителя, применяемого в а), и количество разделяющего агента, в частности, (11bS)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида, сопоставимы описанным выше для первого варианта осуществления. Таким образом, все вышеописанные предпочтительные варианты осуществления растворителя в а) и количество разделяющего агента также подходят для второго варианта осуществления. Также процедура затравки, описанная выше для первого варианта осуществления, подходит для второго варианта осуществления, означая, что предпочтительные варианты осуществления альтернативного способа включают способ, в котором производится затравка реакционной смеси в а) кристаллами соли (R,S)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или их производных, в частности кристаллами соли (R,S)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил 3-хинолинэтанола(11bS)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида. Семена могут быть добавлены до добавления к реакционной смеси разделяющего агента, после добавления к реакционной смеси разделяющего агента или предпочтительно до и после добавления к реакционной смеси разделяющего агента, по аналогии с тем, что описано для первого варианта осуществления. Затравка из соли (R,S) -6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3 хинолинэтанола и хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида или их производных, в частности, затравка из соли (R,S)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола(11bS)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4 оксида, может быть получена в результате предварительно выполненных способов согласно второму варианту осуществления. Для второго варианта осуществления также предпочтительно добавление разделяющего агента к реакционной смеси в виде раствора. Для второго варианта осуществления могут также применяться те же растворители, которые описаны выше для первого варианта осуществления. В предпочтительном варианте осуществления альтернативного способа смесью стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола является диастереоизомер А. Поскольку сформированная соль (R,S)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенил-[3-фенил-3-хинолинэтанола и хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафос-7 011770 фепин 4-оксида или их производных, в частности соль (R,S)-6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола (11bS)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида, кристаллизуется, она может быть отделена от реакционной смеси, например,фильтрацией. При применении диастереоизомера А в качестве смеси стереоизомерных форм 6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола, желательный (S,R)энантиомер может быть выделен из остаточной маточной жидкости, например, экстракцией с подходящим растворителем. Примером подходящего экстракционного растворителя является, например, толуол и водный раствор щелочи, например, водный раствор K2CO3. Остаточное количество разделяющего агента в маточной жидкости будет задерживаться в слое водного раствора щелочи, тогда как желаемый (S, R) энантиомер будет находиться в органическом слое. После отделения органического слоя от водного слоя, применяя технологии, известные специалисту, указанный органический слой может быть концентрирован до сухого состояния, например, в вакууме, приводя к желаемому (S, R) энантиомеру. В альтернативном варианте (S,R) энантиомер может быть выделен из остаточной маточной жидкости с помощью способа первого варианта осуществления. Маточная жидкость фактически является смесью стереоизомерных форм, в которой преимущественно присутствует желаемый (S,R) энантиомер, по сравнению с (R, S) энантиомером. Полученный (S,R) энантиомер может быть далее повторно кристаллизован в подходящем растворителе, например, этаноле или толуоле, как описано ниже. Синтез смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенил-фенил-3-хинолинэтанола. Смесь стереоизомерных форм 6-бром[2-(диметиламино) этил] -2-метокси 1-нафталенил-фенил-3-хинолинэтанола, включая диастереоизомер А, из которой должен быть выделен желательный энантиомер (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанол, может быть изготовлена согласно протоколу, раскрытому в WO 2004/011436, который приведен здесь в качестве ссылки. В альтернативном варианте смесь стереоизомерных форм 6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола может также быть изготовлена взаимодействием 3 бензил-6-бром-2-метоксихинолина с литийдиизопропиламидом и (3-диметиламино)-1'-пропионафтоном в подходящем растворителе, таком как, например, аполярный апротонный растворитель, такой как эфир,предпочтительно тетрагидрофуран, предпочтительно при пониженной температуре, например, температуре ниже 0C, более предпочтительно при температуре от -70 до -80C, с последующим добавлением подходящей кислоты, такой как, например, уксусная кислота. Полученная таким образом смесь стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола может необязательно быть обогащена диастереоизомером А, с помощью внесения в реакционную смесь затравки с диастереоизомером В, полученной в предыдущих способах получения согласно настоящему изобретению, или полученной согласно протоколу, описанному в WO 2004/011436, для стимулирования кристаллизации диастереоизомера В с последующим отфильтровыванием указанного диастереоизомера В. Образующаяся в результате смесь стереоизомерных форм может необязательно далее быть обогащена диастереоизомером А кристаллизацией от подходящего растворителя, такого как, например, этанол. Обогащение (или очистка) реакционной смеси специфичным диастереоизомером или энантиомером означает, что содержание этого специфичного диастереоизомера или энантиомера относительно другого увеличилось. Таким образом, настоящее изобретение также относится к способу получения (S,R)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола, указанный способ включает а) взаимодействие 3-бензил-6-бром-2-метоксихинолина с литийдиизопропиламидом и (3 диметиламино)-1'-пропионафтоном в подходящем растворителе, таком как, например, аполярный апротонный растворитель, такой как эфир, предпочтительно тетрагидрофуран, предпочтительно при пониженной температуре, например, при температуре ниже 0C, с последующим добавлением подходящей кислоты, такой как, например, уксусная кислота; и b) выделение (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6 бром[2-(диметиламино) этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола, полученной в а) с помощью хирального 4-гидроксидинафто[2,1-d:1',2'-f] [1,3,2]диоксафосфепин 4-оксида или его производного, в частности, (11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида, согласно способам, описанным выше, в частности в первом варианте осуществления. Или, другими словами, настоящее изобретение также относится к способу выделения (S,R)-6 бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола согласно вышеописанным способам, в котором смесь стереоизомерных форм получена с помощью а) взаимодействия 3-бензил-6-бром-2-метоксихинолина с литийдиизопропиламидом и (3-диметиламино)-8 011770 1'-пропионафтоном в подходящем растворителе, таком как, например, аполярный апротонный растворитель, такой как эфир, предпочтительно тетрагидрофуран, предпочтительно при пониженной температуре,например, при температуре ниже 0C, с последующим добавлением подходящей кислоты, такой как, например, уксусная кислота. Настоящее изобретение также относится к способу, включающему а) взаимодействие 3-бензил-6 бром-2-метоксихинолина с литийдиизопропиламидом и (3-диметиламино)-1'-пропионафтоном в подходящем растворителе, таком как, например, аполярный апротонный растворитель, такой как эфир, предпочтительно тетрагидрофуран, предпочтительно при пониженной температуре, например при температуре ниже 0C, с последующим добавлением подходящей кислоты, такой как, например, уксусная кислота; b) обогащение (или очищение) реакционой смеси, полученной в а), рацемической смесью (S,R)-6 бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и (R,S)-6 бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола, с помощью удаления рацемической смеси (R,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенил-фенил-3-хинолинэтанола и (S, S)-6-бром[2-(диметиламино) этил] -2-метокси 1-нафталенил-фенил-3-хинолинэтанола из реакционной смеси; с) выделение (S,R)-6-бром[2-(диметиламино) этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром-[2-(диметиламино) этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола, полученной в b) с помощью хирального 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид или его производного, в частности, (11bR)-4-гидроксидинафто [2,1-d:1',2'-f] [1,3,2]диоксафосфепин 4-оксид, согласно способам, описанным выше, в частности, в первом варианте осуществления. Или другими словами, настоящее изобретение также относится к способу выделения (S,R)-6 бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола согласно вышеописанным способам, в котором смесь стереоизомерных форм получена а) взаимодействием 3-бензил-6-бром-2-метоксихинолина с литийдиизопропиламидом и (3-диметиламино)-1'пропионафтоном в подходящем растворителе, таком как, например, аполярный апротонный растворитель, такой как эфир, предпочтительно тетрагидрофуран, предпочтительно при пониженной температуре,например, при температуре ниже 0 С, с последующим добавлением подходящей кислоты, такой как, например, уксусная кислота; b) обогащение (очищение) смеси, полученной в а), рацемической смесью (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и (R,S)6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола, с помощью удаления из реакционной смеси рацемической смеси (S,S)-6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола и (R,R)-6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола. Настоящее изобретение также относится к способу, включающемуa) взаимодействие 3-бензил-6-бром-2-метоксихинолина с литийдиизопропиламидом и (3-диметиламино)-1'-пропионафтоном в подходящем растворителе, таком как, например, аполярный апротонный растворитель, такой как эфир, предпочтительно тетрагидрофуран, предпочтительно при пониженной температуре, например при температуре ниже 0C, с последующим добавлением подходящей кислоты,такой как, например, уксусная кислота;b) обогащение (или очищение) реакционной смеси, полученной в а), рацемической смесью (S,R)6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и (R,S)-6 бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола с помощью удаления из реакционной смеси рацемической смеси (R,R)-6-бром[2-(диметиламино)этил]-2-метокси-1-нафталенилфенил-3-хинолинэтанола и (S,S)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола;c) кристаллизацию результирующих стереоизомерных форм 6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола из реакционной смеси, полученной в b), в подходящем растворителе, таком как, например, спирт или смесь эфир/спирт, предпочтительно спирт, в котором спирт предпочтительно является этанолом, а эфир предпочтительно является тетрагидрофураном;d) выделение (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3 хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола, полученной в с), с помощью хирального 4-гидроксидинафто[2,1d:1', 2'-f][1,3,2]диоксафосфепин 4-оксида или его производного, в частности, (11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида, согласно способам, описанным выше, в частности в первом варианте осуществления. Или другими словами, настоящее изобретение также относится к способу выделения (S,R)-6 бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэта-9 011770 нола согласно вышеописанным способам, в котором смесь стереоизомерных форм получена с помощью а) взаимодействия 3-бензил-6-бром-2-метоксихинолина с литийдиизопропиламидом и (3-диметиламино)1'-пропионафтоном в подходящем растворителе, таком как, например, аполярный апротонный растворитель, такой как эфир, предпочтительно тетрагидрофуран, предпочтительно при пониженной температуре,например, при температуре ниже 0C, с последующим добавлением подходящей кислоты, такой как, например, уксусная кислота; b) обогащения (очищения) смеси, полученной в а), рацемической смесью (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и (R,S)6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола с помощью удаления рацемической смеси (S,S)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенил-фенил-3-хинолинэтанола и (R,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенил-фенил-3-хинолинэтанола из реакционной смеси; и с) кристаллизации результирующих форм стереоизомеров 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из реакционной смеси, полученной в b), в подходящем растворителе. Экспериментальная часть А. Получение смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола. Стадия А. (3-Диметиламино)-1'-пропионафтон-HCl (48,47 г; 183,8 ммоль) растворили в воде (157,5 г) и перемешивали в течение от 5 до 10 мин при комнатной температуре. Добавили гидроксид натрия(51,46 г; 386 ммоль) в виде 30% раствора в воде, и реакционную сесь пермемешивали в течение от 10 до 15 мин. Добавили толуол (105 г), и смесь перемешивали в течение от 10 до 15 мин с последующим разделением слоев. К органическому слою добавили воду (100 г) и перемешивание продолжали в течение от 10 до 15 мин с последующим разделением слоев. Органический слой концентрировали в вакууме при температуре от 50 до 60C, с получением 98,2% (3-диметиламино)-1'-пропионафтона. Стадия В. К тетрагидрофурану (74 г) добавили лития диизопропиламид (92,4 г; 228 ммоль) в виде 25% раствора в тетрагидрофуране, гептане и этилбензоле в атмосфере N2 при температуре от 20 до 25 С. Раствор охладили до температуры от -70 до-80 С и по каплям в течение 90 мин (от 80 до 150 мин) добавляли 3-бензил-6-бром-2-метоксихинолин (57,4 г; 175 ммоль) в тетрагидрофуране (74 г). Реакционную смесь перемешивали в течение 90 мин (80-150 мин) при температуре от -70 до -80C. Раствор (3-диметиламино)-1'-пропионафтона (45,7 г; 175 ммоль; изготовленный, согласно стадии А) в тетрагидрофуране (74 г) по каплям добавляли к реакционной смеси в течение 90 минут (80-150 мин) при температуре от -70 до -80C. Реакционную смесь перемешивали в течение 14 ч (от 8 до 15 ч) при температуре от -70 до -80C. Реакционную смесь, полученную на стадии В, добавили к предварительно охлажденному (-10C) раствору уксусной кислоты (39 г; 438 ммоль) в тетрагидрофуране (39 г) в течение 10-30 мин. Через 15 мин после завершения добавления в смесь ввели затравку из диастереоизомера В (0,05 г; 0,1 ммоль), полученную из предыдущей стадии, и реакционную смесь перемешивали в течение 6 ч (от 5 до 7 ч) при температуре от 0 до 5 С. В течение 5-30 мин по каплям добавили воду (200 г), и реакционную смесь перемешивали в течение 30-40 мин при температуре от 0 до 5 С. Диастереоизомер В отфильтровали и дважды промыли тетрагидрофураном (30 г для каждой стадии промывания). Эти два слоя разделили. Органический маточный слой сконцентрировали в вакууме при температуре от 50 до 55 С. Добавили этанол(250 г), и реакционную смесь далее сконцентрировали в вакууме при температуре от 50 до 60C. Смесь охлаждали в течение 0,5-1,5 ч до 0C (от -5 до 5 С) и перемешивали в течение 1-2 ч при данной температуре с последующей фильтрацией. Остаток от фильтрации дважды промыли этанолом (50 г для каждой стадии промывания), и полученный продукт высушили при 80C (от 75 до 85 С) в вакууме. Выход продукта: 37,48 г твердого вещества, содержащего 82,7% (вес./вес.), диастереоизомера А и 7,7% (вес./вес.) диастереоизомера В. В. Выделение специфического энантиомера (S,R)-(S,R)-6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола из смеси стереоизомерических форм с применением(11bR)-4-гидроксидинафто [2,1-d:1'2'-f][1,3,2]диоксафосфепин 4-оксида. Твердое вещество, полученное на стадии С (30,45 г; 50 ммоль; leq.), суспендировали в ацетоне(193,3 г) при температуре от 20 до 30 С. В эту суспензию внесли затравку из соли (S,R)-6-бром[2(диметиламино)этил] -2-метокси 1-нафталенилфенил-3-хинолинэтанола (11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида (9 мг; 0,016 ммоль), полученную из предыдущих стадий.(11bR)-4-Гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид (17,60 г; 50 ммоль; leq.) растворили в диметилсульфоксиде (38,7 г) при температуре от 40 до 50C и этот раствор добавили через фильтр к вышеупомянутой суспензии в ацетоне в течение интервала времени от 5 до 15 мин. Затем в реакционную смесь снова внесли затравку из соли (S, R)-6-бром[2-(диметиламино)этил]-2-метокси(1-нафтил)-фенил-3-хинолинэтанола(11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида (9 мг; 0,016 ммоль), полученную из предыдущих способов получения. Результирующую суспензию перемешивали в течение 60 мин (от 45 до 75 мин) с последующим на- 10011770 греванием до температуры флегмы. Суспензию перемешивали в течение 60 мин (от 45 до 75 мин) с обратным холодильником, с последующим охлаждением до 25 С (от 20 до 30C) в течение 30-60 мин и перемешиванием в течение 1-2 ч при температуре от 20 до 30C. Результирующее твердое вещество отфильтровали и дважды промыли ацетоном (62,5 г для каждой стадии промывания). Результирующий остаток (59 г) суспендировали в ацетоне (185,4 г), и суспензию нагрели до температуры флегмы и перемешивали с обратным холодильником в течение 2 часов (от 1,5 до 2,5 ч) с последующим охлаждением до 25 С (от 20 до 30C) в течение 30-45 мин и перемешиванием в течение 45-75 мин. Результирующее твердое вещество отфильтровали и промыли ацетоном (47 г) с последующим промыванием толуолом (55 г). Полученное твердое вещество (54,96 г) суспендировали в толуоле (40,3 г) и обработали (1,4 экв. ) 10% раствором карбоната калия (4,23 г K2CO3 в 38,02 г дистиллированной воды). Смесь нагрели до 80-85C и водный слой отделили. К органическому слою добавили раствор карбоната калия (0,4 экв.) (1,23 г K2CO3 в 11,07 г дистиллированной воды). После перемешивания в течение 5-15 мин водный слой отделили, а органический слой промыли дистиллированной водой (11,8 г) при температуре от 80 до 85 С. Органический слой сконцентрировали при 55C (от 50 до 60C) в вакууме. Остаток обработали этанолом (69 г) при температуре 45 до 50C с последующим охлаждением в пределах от 0,5 до 1,5 ч от 0 до 5 С и перемешиванием в течение от 0,5 до 1 ч при данной температуре. Результирующее твердое вещество отфильтровали, дважды промыли этанолом (18 г для каждой стадии промывания) и высушили в вакууме при 70C (от 65 до 75 С). Выход продукта: 39% по весу (или 78% по весу, из расчета на желаемый энантиомер) (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола (чистота HPLC: 99,6%; энантиомерный избыток 99,8%, точка плавления 182-184 С). Чистоту определяли с помощью HPLC, с применением колонки YMC-Pack ODSAQ (150 4,6 мм, 3 мкм), применяемой в качестве подвижной фазы. Подвижная фаза А: вода/ трифторуксусная кислота (1000 мл/мкм); подвижная фаза В; ацетонитрил/трифторуксусная кислота (1000 мл/ 0,8 мл); градиент элюции, начиная с 75% для А и 25% для В 10% для А и 90% для В. Энантиомерный избыток определяли с помощью HPLC с применением колонки Cyclobond I RSP (250 4,6 мм), применяемой в качестве подвижной фазы: МеОН/вода/ацетат аммония (60 мл/40 мл/0,154 г), отрегулированный уксусной кислотой к рН 7. Полученный продукт (19,0 г) суспендировали в толуоле (10,96 г) и нагрели до 90C. Смесь отфильтровали при высокой температуре, и фильтр промыли толуолом (1,5 г). Раствор охладили до 70C и по каплям добавили этанол (22,16 г) . При добавлении этанола продукт начал кристаллизоваться (необязательно, можно добавить несколько мг (S,R)-6-бром[2-(диметиламино)этил]-2-метокси(1 нафтил)фенил-3-хинолинэтанола). Далее по каплям добавляли этанол (32,31 г) при 65C, и суспензию охладили до 0C и перемешивали в течение 1 ч. Остаток отфильтровали и промыли этанолом в 2 частях(52 г) . Результирующий продукт высушили (от 40 до 70C) с получением (S,R)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ выделения (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенил-фенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси-1-нафталенилфенил-3-хинолинэтанола оптическим разделением с хиральным 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксидом или его производным в качестве разделяющего агента. 2. Способ по п.1, в котором хиральный 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4 оксид или его производное является хиральным соединением формулы (I)R2a в положении 14 и в положении 15 в 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4 оксиде могут также быть взяты для формирования вместе с нафтильным кольцом, к которому присоеди- 11011770 нены оба заместителя R2a, 13-метил-12,13,14,15,16,17-гексагидро-11H-циклопента[а]фенантрена;R2b в положении 8 и в положении 9 в 4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4 оксиде могут также быть взяты вместе для формирования вместе с нафтильным кольцом, к которому присоединены оба заместителя R2b, 13-метил-12,13,14,15,16,17-гексагидро-11 Н-циклопента[а]фенантрена; арил является фенилом или фенилом, замещенным одним, двумя или тремя заместителями, каждый из которых независимо выбран из C1-6 алкила, полигалогенС 1-6 алкила, С 1-6 алкилокси, замещенного фенилом, фенилом, необязательно замещенным одним, двумя или тремя заместителями, выбранными из C1-6 алкила или нафтила. 3. Способ по п.1 или 2, в котором соль (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенил-[3-фенил-3-хинолинэтанола и разделяющего агента кристаллизуется. 4. Способ по п.3, включающий а) взаимодействие смеси стереоизомерных форм 6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола с указанным разделяющим агентом в подходящем растворителе; b) отделение образующейся в результате соли (S,R)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и указанного разделяющего агента от реакционной смеси, полученной в а); с) необязательно повторная кристаллизация или суспендирование соли, полученной в b), в подходящем растворителе; d) освобождение (S,R)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола от соли, полученной в b) или с). 5. Способ по п.3 или 4, в котором разделяющим агентом является (11bR)-4-гидроксидинафто[2,1d:1',2'-f][1,3,2]диоксафосфепин 4-оксид. 6. Способ по п.4 или 5, в котором подходящим растворителем в а) является кетон, эфир, смесь кетона с апротонным полярным растворителем или смесь эфира с апротонным полярным растворителем. 7. Способ по п.4 или 5, в котором подходящим растворителем в а) является кетон или смесь кетона с апротонным полярным растворителем. 8. Способ по п.7, в котором кетоном является ацетон или метилэтилкетон, и в котором апротонным полярным растворителем является диметилсульфоксид или N,N-диметилформамид. 9. Способ по п.7, в котором подходящим растворителем является ацетон. 10. Способ по п.7, в котором подходящим растворителем является смесь ацетона и диметилсульфоксида. 11. Способ по любому из пп.4-10, в котором в реакционную смесь а) вносится затравка из соли (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и разделяющего агента перед добавлением разделяющего агента к реакционной смеси. 12. Способ по любому из пп.4-10, в котором в реакционную смесь а) вносится затравка из соли (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и разделяющего агента после добавления разделяющего агента к реакционной смеси. 13. Способ по любому из пп.4-10, в котором в реакционную смесь а) вносится затравка из соли (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и разделяющего агента до и после добавления разделяющего агента к реакционной смеси. 14. Способ по любому из пп.4-13, в котором разделяющий агент добавляют к смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола в виде раствора в подходящем растворителе. 15. Способ по п.14, в котором подходящим растворителем является апротонный полярный растворитель. 16. Способ по п.15, в котором апротонным полярным растворителем является диметилсульфоксид,N,N-диметилформамид, N,N-диметилацетамид или N-метилпирролидон. 17. Способ по п.16, в котором апротонным полярным растворителем является диметилсульфоксид или N,N-диметилформамид. 18. Способ по п.17, в котором апротонным полярным растворителем является диметилсульфоксид. 19. Способ по любому из пп.4-18, в котором стадия повторной кристаллизации или суспендирования в с) выполняют в ацетоне, N,N-диметилформамиде, смеси N,N-диметилформамид/вода, смеси диметилсульфоксид/вода, смеси диметилсульфоксид/ацетон, смеси диметилсульфоксид/спирт или смеси N,N-диметилформамид/спирт. 20. Способ по п.19, в котором повторную кристаллизацию или суспендирование осуществляют в ацетоне. 21. Способ по любому из пп.4-20, в котором освобождение основания от соли в d) осуществляют с помощью взаимодействия соли в подходящем растворителе с подходящим основанием. 22. Способ по п.21, в котором подходящим растворителем является органический растворитель, который является несмешиваемым с водой или водными растворами соли. 23. Способ по п.22, в котором растворителем является толуол или тетрагидрофуран. 24. Способ по п.23, в котором растворителем является толуол.- 12011770 25. Способ по любому из пп.21-24, в котором основанием является карбонатное основание или фосфатное основание. 26. Способ по п.25, в котором основанием является K2CO3, KHCO3, Na2CO3, NaHCO3, Na3PO4 илиNa2HPO4. 27. Способ по п.26, в котором основанием является K2CO3. 28. Способ по любому из пп.4-27, в котором количество разделяющего агента варьирует от 0,5 до 1,5 эквивалентов, вычисленных по сумме стереоизомерных форм 6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола, присутствующих в смеси а). 29. Способ по п.28, в котором количество разделяющего агента составляет 1 эквивалент от суммы стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола, присутствующих в смеси а). 30. Способ по любому из пп.3-29, в котором смесь стереизомерных форм 6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола является смесью, в которой преимущественно присутствует диастереоизомер А. 31. Способ по п.1 или 2, в котором соль (R,S)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола и разделяющего агента кристаллизуется. 32. Способ по п.31, включающий а) взаимодействие смеси стереоизомерных форм 6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола с указанным разделяющим агентом в подходящем растворителе; b) отделение образующейся в результате соли (R,S)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и указанного разделяющего агента от реакционной смеси, полученной в а); с) изоляция (S,R)-6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола от остаточной маточной жидкости, полученной после отделения образующейся в результате соли от реакционной смеси. 33. Способ по п.31 или 32, в котором разделяющим агентом является (11bS)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксид. 34. Способ по любому из пп.31-33, в котором смесью стереоизомерных форм 6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола является диастереоизомер А. 35. Способ выделения (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенил-фенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси-1-нафталенилфенил-3-хинолинэтанола по любому из пп.1-29 и 31-33, в котором смесь стереоизомерных форм получают с помощью а) взаимодействия 3-бензил-6-бром-2-метоксихинолина с литийдиизопропиламидом и (3-диметиламино)-1'-пропионафтоном в подходящем растворителе, с последующим добавлением подходящей кислоты. 36. Способ выделения (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенил-фенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино)этил]-2-метокси-1-нафталенилфенил-3-хинолинэтанола по п.30, в котором смесь стереоизомерных форм получают с помощью а) взаимодействия 3-бензил-6-бром-2-метоксихинолина с литийдиизопропиламидом и (3 диметиламино)-1'-пропионафтоном в подходящем растворителе, с последующим добавлением подходящей кислоты; b) обогащение смеси, полученной в а) рацемической смесью (S,R)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и (R,S)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола, с помощью удаления рацемической смеси (S,S)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и (R,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из реакционной смеси. 37. Способ по п.36, в котором смесь стереоизомерных форм получают с помощью а) взаимодействия 3-бензил-6-бром-2-метоксихинолина с литийдиизопропиламидом и (3-диметиламино)-1'-пропионафтоном в подходящем растворителе, с последующим добавлением подходящей кислоты; b) обогащение смеси, полученной в а) рацемической смесью (S,R)-6-бром[2-(диметиламино)этил]-2-метокси-1-нафталенилфенил-3-хинолинэтанола и (R,S)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола с помощью удаления рацемической смеси (S,S)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола и (R,R)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола из реакционной смеси; и с) кристаллизации образующихся в результате стереоизомерных форм 6-бром[2-(диметиламино)этил]-2 метокси 1-нафталенилфенил-3-хинолинэтанола из реакционной смеси, полученной в b), в подходящем растворителе. 38. Способ по п.37, в котором подходящим растворителем в с) является спирт или смесь эфир/спирт. 39. Способ по п.37, в котором подходящим растворителем в с) является спирт. 40. Способ по п.38 или 39, в котором спиртом является этанол.- 13011770 41. Способ по любому из пп.35-40, в котором подходящим растворителем в а) является аполярный апротонный растворитель. 42. Способ по п.41, в котором аполярным апротонным растворителем является эфир. 43. Способ по п.42, в котором эфиром является тетрагидрофуран. 44. Способ по любому из пп.35-43, в котором реакцию в а) осуществляют при температуре ниже 0C. 45. Применение (11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2]диоксафосфепин 4-оксида в качестве разделяющего агента для выделения (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталенилфенил-3-хинолинэтанола из смеси стереоизомерных форм 6-бром[2-(диметиламино) этил]-2-метокси 1-нафталенилфенил-3-хинолинэтанола. 46. Соль, имеющая следующую формулу: (S,R)-6-бром[2-(диметиламино)этил]-2-метокси-1-нафталенилфенил-3-хинолинэтанол(11bR)-4-гидроксидинафто[2,1-d:1',2'-f][1,3,2] 4-оксид диоксафосфепин.
МПК / Метки
МПК: C07F 9/09, C07D 215/22
Метки: получения, способ, r)-6-бром-альфа-[2-(диметиламино)этил]-2-метокси-альфа-1-нафталенил-бета-фенил-3-хинолинэтанола, beta, альфа
Код ссылки
<a href="https://eas.patents.su/15-11770-sposob-polucheniya-alfa-s-beta-r-6-brom-alfa-2-dimetilaminoetil-2-metoksi-alfa-1-naftalenil-beta-fenil-3-hinolinetanola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения (альфа s, бета r)-6-бром-альфа-[2-(диметиламино)этил]-2-метокси-альфа-1-нафталенил-бета-фенил-3-хинолинэтанола</a>
Предыдущий патент: Способ получения циклогексанола и циклогексанона
Следующий патент: Способ получения оптически чистых ингибиторов протонного насоса
Случайный патент: Способ предотвращения или отсрочки катетерной реваскуляризации












