Производные гексафторизопропил карбамата, их получение и их терапевтическое применение
Номер патента: 22076
Опубликовано: 30.10.2015
Авторы: Марге Франк, Женесс Жан, Хорнарт Кристиан, Барч Режин, Шере Дороте, Эвен Люк
Формула / Реферат
1. Соединение формулы (I)
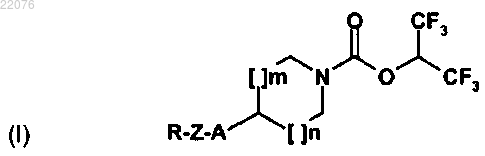
в которой
R обозначает группу R1, возможно замещенную одной или более группами R2 и/или R3;
R1 обозначает арил или гетероарил;
R2 обозначает атом галогена или циано, нитро, оксо, (C1-С6)алкил, (С1-С6)алкокси, гидроксил, (C1-С6)алкилтио, (C1-С6)галогеналкил, (C1-C6)галогеналкокси, (C1-C6)галогеналкилтио, NR4R5, NR4COR5, NR4SO2R5, COR4, CO2R4, CONR4R5, SO2R4, SO2NR4R5, фенилокси или бензилоксигруппу;
R3 обозначает моноциклическую арильную или гетероарильную группу, которая может быть замещена одной или более группами R2, которые являются одинаковыми или отличными друг от друга;
R4 и R5 обозначают независимо друг от друга атом водорода или (С1-С6)алкил или образуют с атомом азота или фрагментом N-CO или N-SO2, который их несет, гетероцикл, возможно замещенный (C1-C6)алкильной или бензильной группой;
Z обозначает связь, (C1-C6)алкиленовую группу, (С2-С6)алкениленовую группу, (С2-С6)алкиниленовую группу, О-(С1-С6)алкиленовую группу или N(RA)-(С1-С6)алкиленовую группу;
А обозначает связь, атом кислорода, атом серы, группу N(RA), N(RA)-(С1-С6)алкиленовую группу, группу CON(RA), CON(RA)-(С1-С6)алкиленовую группу, группу SO2N(RA), SO2N(RA)-(С1-С6)алкиленовую группу, группу OCON(RA), OCON(RA)-(С1-С6)алкиленовую группу, группу N(RB)CON(RA), N(RB)CON(RA)-(С1-С6)алкиленовую группу, группу N(RB)SO2N(RA), N(RB)SO2N(RA)-(C1-C6)алкиленовую группу, O-(C1-C6)алкиленовую группу, группу N(RB)CO2, N(RB)CO2-(С1-С6)алкиленовую группу, S-(C1-С6)алкиленовую группу, группу SO2, SO2-(C1-C6)алкиленовую группу, группу N(RB)SO2, N(RB)SO2-(C1-С6)алкиленовую группу, группу СО, СО-(С1-С6)алкиленовую группу, группу N(RB)CO, N(RB)CO-(C1-C6)алкиленовую группу, группу SO2N(RB)CO, SO2N(RB)CO-(С1-С6)алкиленовую группу, группу SO2N(RB)CON(RA) или SO2N(RB)CON(RA)-(C1-C6)алкиленовую группу;
RA и RB обозначают независимо друг от друга атом водорода или (С1-С6)алкильную группу;
m и n обозначают независимо друг от друга целое число, равное 0 или 1,
причем арильная группа означает ароматическую циклическую группу, включающую от 6 до 10 атомов углерода и гетероарильная группа означает моно- или бициклическую группу, включающую от 5 до 10 атомов, включая от 1 до 5 гетероатомов, выбранных из N, О и S, причем эта группа является ароматической, ненасыщенной или частично ненасыщенной или частично окисленной,
в форме основания или соли присоединения с фармацевтически приемлемой кислотой.
2. Соединение формулы (I) по п.1, отличающееся тем, что
R1 обозначает фенил, нафтил, инданил, бензоксазолил, бензизоксазолил, бензимидазолил, бензотриазолил, оксадиазолил, индазолил, изоксазолил, пиридинил, пиразинил, пиримидинил, тиенил, тиазолил, бензотиофенил, индолил, дигидробензодиоксанил, бензотиадиазолил, пиразолил, дигидробензоксазинил или индолинил;
R2 обозначает одну или более групп, выбранных из атома галогена или метила, трифторметила, метокси, трифторметокси, циано, оксо, CH3NHCO, CH3SO2, NH2CO, NH2SO2 или группы пирролидинил-SO2;
R3 обозначает группу, выбранную из фенила или оксазолила;
или соединение формулы (I) представляет собой 2,2,2-трифтор-1-(трифторметил)этил-4-{[3-(2-метилпиримидин-4-ил)бензолсульфониламино]метил}пиперидин-1-карбоксилат,
в форме основания или соли присоединения с фармацевтически приемлемой кислотой.
3. Соединение формулы (I) по любому из пп.1 и 2, отличающееся тем, что
Z обозначает связь или группу CH2, (CH2)2, CH=CH, СºС, OCH2 или OC(CH3)2,
в форме основания или соли присоединения с фармацевтически приемлемой кислотой.
4. Соединение формулы (I) по любому из пп.1-3, отличающееся тем, что
А обозначает связь, атом кислорода, атом серы, группу OCH2, группу О(CH2)2, группы NH, NHCH2 или NH(CH2)2, группу SO2 или СО, группу CONH, CONHCH2 или CONH(CH2)2, группу SO2NH, SO2NHCH2 или SO2NH(CH2)2, SO2NHCO, SO2NHCONH или SO2NHCONHCH2, группу OCONH, группу NHCONH, группу NHCONHCH2, N(CH3)CONHCH2, NHCONH(CH2)2 или N(CH3)CONH(CH2)2 или SO2N(CH3)CH2,
в форме основания или соли присоединения с фармацевтически приемлемой кислотой.
5. Соединение формулы (I) по любому из пп.1-4, отличающееся тем, что m и n означают 1, в форме основания или соли присоединения с фармацевтически приемлемой кислотой.
6. Соединение формулы (I) по любому из пп.1-4, отличающееся тем, что m означает 1 и n означает 0, в форме основания или соли присоединения с фармацевтически приемлемой кислотой.
7. Соединение формулы (I) по любому из пп.1-4, отличающееся тем, что m и n означают 0, в форме основания или соли присоединения с фармацевтически приемлемой кислотой.
8. Соединение формулы (I) по любому из пп.1-7, отличающееся тем, что
R1 обозначает фенил, нафтил, инданил, бензоксазолил, бензизоксазолил, бензимидазолил, бензотриазолил, оксадиазолил, индазолил, изоксазолил, пиридинил, пиразинил, пиримидинил, тиенил, тиазолил, бензотиофенил, индолил, дигидробензодиоксанил, бензотиадиазолил, пиразолил, дигидробензоксазинил или индолинил;
R2 обозначает одну или более групп, выбранных из атома галогена или метила, трифторметила, метокси, трифторметокси, циано, оксо, CH3NHCO, CH3SO2, NH2CO, NH2SO2 или группы пирролидинил-SO2;
R3 обозначает группу, выбранную из фенила или оксазолила;
Z обозначает связь или CH2, (CH2)2, CH=CH, CºC, OCH2 или OC(CH3)2;
А обозначает связь, атом кислорода, атом серы, группу OCH2, группу O(CH2)2, NH, NHCH2 или NH(CH2)2, группу SO2 или СО, группу CONH, CONHCH2 или CONH(CH2)2, группу SO2NH, SO2NHCH2, SO2NH(CH2)2, SO2NHCO, SO2NHCONH или группу SO2NHCONHCH2, группу OCONH, группу NHCONH, группу NHCONHCH2, N(CH3)CONHCH2, NHCONH(CH2)2 или N(CH3)CONH(CH2)2 или SO2N(CH3)CH2;
m и n означают независимо друг от друга целое число, равное 0 или 1,
в форме основания или соли присоединения с фармацевтически приемлемой кислотой.
9. Способ получения соединения формулы (I) по любому из пп.1-8, отличающийся тем, что соединение формулы (II)
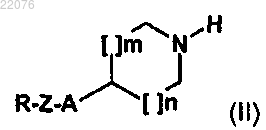
в которой A, Z, R, m и n имеют значения, определенные в общей формуле (I) по п.1, вводят в реакцию с соединением формулы (III)
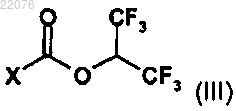
в которой X обозначает уходящую группу.
10. Способ по п.9, в котором уходящая группа представляет собой атом хлора, 4-нитрофеноксигруппу, имидазольную группу, 1,2,4-триазольную группу или N-оксисукцинимидную группу.
11. Способ получения соединения формулы (I) по п.1, в котором А обозначает CON(RA), CON(RA)-(C1-C6)алкилен, SO2N(RA), SO2N(RA)-(С1-С6)алкилен, N(RB)CON(RA), N(RB)CON(RA)-(С1-С6)алкилен, OCON(RA) или OCON(RA)-(С1-С6)алкилен, отличающийся тем, что соединение формулы (IV)
в которой R и Z имеют значения, определенные в общей формуле (I) по п.1, и W обозначает COCl, SO2Cl, NCO, OCOCl или N(RB)COCl функциональную группу, причем RA и RB имеют значения, определенные в формуле (I) по п.1, вводят в реакцию с соединением формулы (V)
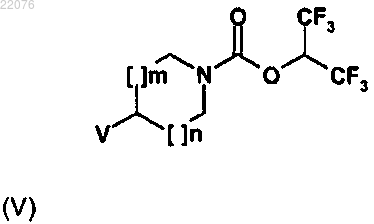
в которой m и n имеют значения, определенные в общей формуле (I) по п.1, и V обозначает аминную группу HN(RA) или HN(RA)-(С1-С6)алкиленовую функциональную группу.
12. Соединение формулы (V)
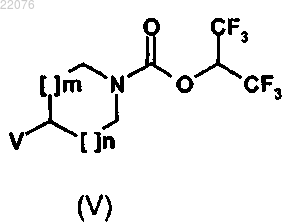
в которой m и n имеют значения, определенные в общей формуле (I) по п.1, и V обозначает аминную группу HN(RA) или HN(RA)-(С1-С6)алкиленовую функциональную группу, причем RA имеет значение, определенное в формуле (I) по п.1.
13. Лекарственное средство, отличающееся тем, что оно включает соединение формулы (I) по любому из пп.1-8 или соль присоединения этого соединения с фармацевтически приемлемой кислотой, для профилактики или лечения острой или хронической боли, головокружения, рвоты, тошноты, расстройств пищевого поведения, метаболического синдрома, дислипидемии, неврологических и психиатрических патологий, острых или хронических нейродегенеративных заболеваний, эпилепсии, нарушений сна, сердечно-сосудистых заболеваний, ишемии почек, рака, нарушений иммунной системы, аллергических заболеваний, паразитарных, вирусных или бактериальных инфекционных болезней, воспалительных заболеваний, остеопороза, глазных состояний, легочных состояний, желудочно-кишечных заболеваний, недержания мочи или воспаления мочевого пузыря.
14. Фармацевтическая композиция, отличающаяся тем, что она включает соединение формулы (I) по любому из пп.1-8 или фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый эксципиент, для профилактики или лечения острой или хронической боли, головокружения, рвоты, тошноты, расстройств пищевого поведения, метаболического синдрома, дислипидемии, неврологических и психиатрических патологий, острых или хронических нейродегенеративных заболеваний, эпилепсии, нарушений сна, сердечно-сосудистых заболеваний, ишемии почек, рака, нарушений иммунной системы, аллергических заболеваний, паразитарных, вирусных или бактериальных инфекционных болезней, воспалительных заболеваний, остеопороза, глазных состояний, легочных состояний, желудочно-кишечных заболеваний, недержания мочи или воспаления мочевого пузыря.
15. Применение соединения формулы (I) по любому из пп.1-8 в получении лекарственного средства, предназначенного для лечения и для профилактики патологии, в которой участвует любой субстрат, метаболизируемый ферментом MGL (моноацилглицеринлипазы).
16. Применение по п.15, отличающееся тем, что субстрат, метаболизируемый ферментом MGL, представляет собой эндогенный 2-арахидоноилглицерин (2-AG) или эндогенный 1(3)-арахидоноилглицерин.
17. Применение соединения формулы (I) по любому из пп.1-8 в форме основания или фармацевтически приемлемой соли в получении лекарственного средства, предназначенного для профилактики или лечения острой или хронической боли, головокружения, рвоты, тошноты, расстройств пищевого поведения, метаболического синдрома, дислипидемии, неврологических и психиатрических патологий, острых или хронических нейродегенеративных заболеваний, эпилепсии, нарушений сна, сердечно-сосудистых заболеваний, ишемии почек, рака, нарушений иммунной системы, аллергических заболеваний, паразитарных, вирусных или бактериальных инфекционных болезней, воспалительных заболеваний, остеопороза, глазных состояний, легочных состояний, желудочно-кишечных заболеваний, недержания мочи или воспаления мочевого пузыря.
Текст
Изобретение относится к производным гексафторизопропил карбамата общей формулы (I) в которой R, Z, А, m и n имеют значения, определенные в описании, в форме основания или соли присоединения с кислотой. Эти соединения могут использоваться в качестве ингибиторов фермента MGL (моноацилглицеринлипазы). Настоящее изобретение относится к производным гексафторизопропил карбамата, к их получению и к их терапевтическому применению. Эти соединения имеют ингибирующую активность в отношении фермента MGL (моноацилглицеринлипазы). В WO 2009141238 и WO 2010009207 раскрыты агонисты рецептора GPR119, которые могут включать гексафторизопропил карбамат. В "Characterization of the Tunable Piperidine and Piperazine carbamates as Inhibitors of EndocannabinoidHydrolases" (J.Z. Long, X. Jin, A. Adibekian, W. Li et al.) описаны ингибиторы фермента MGL, имеющиеN-пиперидиновое кольцо, несущее карбамат. В WO 2009/052319 раскрыты другие типы соединений, которые являются ингибиторами ферментаMGL. Объектом изобретения являются соединения формулы (I)R обозначает группу R1, в случае необходимости замещенную одной или более группами R2 и/илиR1 обозначает арил или гетероарил;R2 обозначает атом галогена или циано, нитро, оксо, (С 1-С 6) алкил, (С 1-С 6) алкокси, гидроксил, (C1 С 6) алкилтио, (С 1-С 6) галогеналкил, (С 1-С 6) галогеналкокси, (С 1-С 6) галогеналкилтио, NR4R5, NR4COR5,NR4SO2R5, COR4, CO2R4, CONR4R5, SO2R4, SO2NR4R5, фенилокси или бензилоксигруппу;R3 обозначает моноциклическую арильную или гетероарильную группу, которая может быть замещена одной или более группами R2, которые являются одинаковыми или отличными друг от друга;R4 и R5 обозначают независимо друг от друга атом водорода или (C1-C6) алкил или образуют с атомом азота или фрагментом N-CO или N-SO2, который их несет, гетероцикл, в случае необходимости замещенный (C1-C6) алкильной или бензильной группой;Z обозначает связь, (С 1-С 6) алкиленовую группу, (С 2-C6) алкениленовую группу, (С 2-С 6) алкиниленовую группу, О-(C1-C6) алкиленовую группу или N(RA)-(C1-C6) алкиленовую группу; А обозначает связь, атом кислорода, атом серы, группу N(RA), N(RA)-(C1-C6) алкиленовую группу,группу CON(RA), CON(RA)-(C1-C6) алкиленовую группу, группу SO2N(RA), SO2N(RA)-(C1-C6) алкиленовую группу, группу OCON(RA), OCON(RA)-(C1-С 6) алкиленовую группу, группу N(RB)CON(RA),N(RB)CON(RA)-(C1-C6) алкиленовую группу, группу N(RB)SO2N(RA), N(RB)SO2N(RA)-(C1-C6) алкиленовую группу, O-(C1-C6) алкиленовую группу, группу N(RB)CO2, N(RB)CO2-(C1-C6) алкиленовую группу, S(C1-C6) алкиленовую группу, группу SO2, SO2-(C1-C6) алкиленовую группу, группу N(RB)SO2, N(RB)SO2(C1-C6) алкиленовую группу, группу СО, СО-(C1-C6) алкиленовую группу, группу N(RB)CO, N(RB)CO(C1-C6) алкиленовую группу, группу SO2N(RB)CO, SO2N(RB)CO-(C1-C6) алкиленовую группу, группуRA и RB обозначают независимо друг от друга атом водорода или (C1-C6) алкильную группу;m и n обозначают независимо друг от друга целое число, равное 0 или 1,в форме основания или соли присоединения с кислотой. Соединения формулы (I) могут включать один или более асимметрических атомов углерода. Они могут, таким образом, существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры,диастереоизомеры и их смеси, включая рацемические смеси, находятся в рамках изобретения. Соединения формулы (I) могут существовать в форме оснований или солей присоединения с кислотами. Такие соли присоединения находятся в рамках изобретения. Эти соли могут быть получены с фармацевтически приемлемыми кислотами, но соли других кислот, например, используемых в очистке или выделении соединений формулы (I), также находятся в рамках изобретения. В контексте настоящего изобретения понимают, чтоCt-Cz, где t и z могут принимать значения от 1 до 7, означает углеродную цепь или кольцо, которое может иметь от t до z атомов углерода; например C1-C3 может характеризовать углеродную цепь, содержащую от 1 до 3 атомов углерода; галоген означает фтор, хлор, бром или йод; алкильная группа означает насыщенную прямую, разветвленную или циклическую алифатическую группу, в случае необходимости замещенную насыщенной прямой, разветвленной или циклической алкильной группой. Можно назвать, например, метил, этил, пропил, изопропил, бутил, изобутил, третбутил, циклопропил, циклобутил, циклопентил, циклогексил, метилциклопропил и циклопропилметил и т.п.; алкиленовая группа означает насыщенную прямую, разветвленную или циклическую двухвалент-1 022076 ную алифатическую группу. Например, (C1-C6) алкиленовая группа означает прямую, разветвленную или циклическую двухвалентную углеродную цепь из 1-6 атомов углерода, такую как метиленил (-CH2-),этиленил (-CH2CH2-), 1-метилэтиленил (-CH(CH3)CH2-), пропиленил (-CH2CH2CH2-), циклопропиленил(-(с-проп и т.п.; алкенильная группа означает моно- или полиненасыщенную прямую или разветвленную алифатическую группу, включающую, например, одну или две этиленовые ненасыщенные связи; алкинильная группа означает моно- или полиненасыщенную прямую или разветвленную алифатическую группу, включающую, например, одну или две этиленовые ненасыщенные связи; алкоксигруппа означает -О-алкильный радикал, где алкильная группа имеет значения, определенные выше; алкилтиогруппа означает -S-алкильный радикал, где алкильная группа имеет значения, определенные выше; галогеналкильная группа означает алкильную группу, один или более атомов водорода которой были заменены одним или более одинаковыми или разными атомами галогена. Можно назвать, например,группы CF3, CH2CF3, CHF2 и CCl3; галоген(C1-C6) алкокси означает -О-алкильный радикал, где алкильная группа имеет значения, определенные выше, и который замещен одним или более одинаковыми или разными атомами галогена. Можно назвать, например, группы -OCF3, -OCHF2 и -OCCl3; арильная группа означает ароматическую циклическую группу, включающую от 6 до 10 атомов углерода; можно назвать в качестве примеров арильных групп фенил или нафтил; эта арильная группа может также существовать в частично ненасыщенной форме; можно назвать, например, инденильную, инданильную или тетралинильную группы; гетероарильная группа означает моно- или бициклическую группу, включающую от 5 до 10 атомов,включая от 1 до 5 гетероатомов, выбранных из N, О и S, причем эта группа является ароматической, ненасыщенной или частично ненасыщенной или частично окисленной. Можно назвать в качестве примеров моноциклических гетероарильных групп пиррол, фуран, тиофен, пиразол, имидазол, триазол, тетразол,оксазол, изоксазол, оксадиазол, тиазол, изотиазол, тиадиазол, пиридин, пиримидин, пиразин, пиридазин или триазин. Можно назвать в качестве примеров бициклических гетероарильных групп фурофуран, тиенотиофен, пирролопиррол, пирролоимидазол, пирролопиразол, пирролотриазол, имидазоимидазол,имидазопиразол, фуропиррол, фуроимидазол, фуропиразол, фуротриазол, пирролооксазол, имидазооксазол, пиразолооксазол, фурооксазол, оксазолооксазол, оксазолоизоксазол, пирролоизоксазол, имидазоизоксазол, пиразолоизоксазол, изоксазолоизоксазол, фуроизоксазол, изоксазолооксадиазол, пирролооксадиазол, фурооксадиазол, изоксазолооксадиазол, тиенопиррол, тиеноимидазол, тиенопиразол, тиенотриазол, пирролотиазол, имидазотиазол, пиразолотиазол, триазолотиазол, фуротиазол, оксазолотиазол, оксазолоизотиазол, пирролоизотиазол, имидазоизотиазол, пиразолоизотиазол, изоксазолоизотиазол, фуроизотиазол, пирролотиадиазол, имидазотиадиазол, фуротиадиазол, изоксазолотиадиазол, оксазолотиадиазол,изотиазолотиадиазол, индол, изоиндол, бензимидазол, индазол, индолизин, бензофуран, изобензофуран,бензотиофен, пирролопиридин, имидазопиридин, пиразолопиридин, триазолопиридин, тетразолопиридин, пирролопиримидин, имидазопиримидин, пиразолопиримидин, пирролопиразин, имидазопиразин,пиразолопиразин, пирролопиридазин, имидазопиридазин, пиразолопиридазин, триазолопиридазин, пирролотриазин, фуропиридин, фуропиримидин, фуропиразин, фуропиридазин, фуротриазин, оксазолопиридин, оксазолопиримидин, оксазолопиразин, оксазолопиридазин, изоксазолопиридин, изоксазолопиримидин, изоксазолопиразин, изоксазолопиридазин, оксадиазолопиридин, бензоксазол, бензизоксазол, бензоксадиазол, бензоксазин, бензодиоксол, бензодиоксин, бензодиоксепин, тиенопиридин, тиенопиримидин, тиенопиразин, тиенопиридазин, тиенотриазин, тиазолопиридин, тиазолопиримидин, тиазолопиразин, тиазолопиридазин, изотиазолопиридин, изотиазолопиримидин, изотиазолопиразин, изотиазолопиридазин, тиадиазолопиридин, тиадиазолопиримидин, бензотиазол, бензизотиазол, бензотиадиазол, хинолин, изохинолин, циннолин, фталазин, хиноксалин, хиназолин, нафтиридин, бензотриазин, пиридопиримидин, пиридопиразин, пиридопиридазин, пиридотриазин, пиримидопиримидин, пиримидопиразин, пиримидопиридазин, пиразинопиразин, пиразинопиридазин, пиразинотриазин или пиридазинопиридазин. Эти группы могут существовать в ненасыщенной или частично ненасыщенной форме; можно назвать, например, дигидробензофуран, дигидробензотиофен, тетрагидрохинолин, тетрагидроизохинолин,индолин, дигидробензоксазин или дигидробензодиоксан; гетероциклическая группа означает насыщенную 3-7-членную циклическую группу, включающую от 1 до 4 гетероатомов, выбранных из N, О и S. Можно назвать, например, пирролидин, пиперидин, морфолин, пиперазин, азиридин, азетидин, азепин, тиоморфолин, N-метилпиперазин, гомопиперазин, азетидин-2-он, 1,2-тиазетидин-1,1-диоксид, пирролидин-2-он, 1,2-изотиазолидин-1,1-диоксид, пиперидин-2 он, 1,2-тиазинан-1,1-диоксид, имидазолидин-2-он, оксазолидин-2-он, 1,2,5-тиадиазолидин-1,1-диоксид,1,2,3-оксатиазолидин-2,2-диоксид, тетрагидропиримидин-2-он, 1,3-оксазинан-2-он, 1,2,6-тиадиазинан 1,1-диоксид, 1,2,3-оксатиазинан-2,2-диоксид, пиперазин-2-он, морфолин-3-он, 1,2,5-тиадиазинан-1,1 диоксид или 1,3,4-оксатиазинан-3,3-диоксид. В контексте настоящего изобретения группы R, Z и А читаются слева направо; левая часть группыZ связана с группой R, и правая часть Z связана с группой А; аналогично, левая часть группы А связана с группой Z, и правая часть А связана с кольцевой системой В различных группах, как определено ниже, группы A, Z, R, RA, RB, R1, R2 или R3, когда они не определены, имеют те же самые определения, как указанные выше. Среди соединений формулы (I), которые являются объектами изобретения, первая группа соединений состоит из соединений, для которыхR2 обозначает одну или более групп, выбранных из атома галогена или метила, трифторметила, метокси, трифторметокси, циано, оксо, CH3NHCO, CH3SO2, NH2CO, NH2SO2 или группы пирролидин-SO2;R3 обозначает группу, выбранную из фенила или оксазола; а также соединения 2,2,2-трифтор-1-(трифторметил)этил-4-[3-(2-метилпиримидин-4-ил)бензолсульфониламино]метилпиперидин-1-карбоксилат. Среди соединений формулы (I), которые являются объектом изобретения, вторая группа соединений состоит из соединений формулы (I), для которыхZ обозначает связь или группу CH2, (CH2)2, CH=CH, СС, OCH2 или OC(CH3)2. Среди соединений формулы (I), которые являются объектом изобретения, третья группа соединений состоит из соединений формулы (I), для которых А обозначает связь, атом кислорода, атом серы, группу OCH2, группу O(CH2)2, группы NH, NHCH2 или NH(CH2)2, группу SO2 или СО, группу CONH, CONHCH2 или CONH(CH2)2, группу SO2NH,SO2NHCH2 или SO2NH(CH2)2, SO2NHCO, SO2NHCONH или SO2NHCONHCH2, группу OCONH, группуSO2N(CH3)CH2. Среди соединений формулы (I), которые являются объектом изобретения, четвертая группа соединений состоит из соединений формулы (I), для которыхm и n означают 1. Среди соединений формулы (I), которые являются объектами изобретения, пятая группа соединений состоит из соединений формулы (I), для которыхm означает 1 и n означает 0. Среди соединений формулы (I), которые являются объектами изобретения, шестая группа соединений состоит из соединений формулы (I), для которыхm и n означают 0. Среди соединений формулы (I), которые являются объектами изобретения, седьмая группа соединений состоит из соединений формулы (I), для которыхR2 обозначает одну или более групп, выбранных из атома галогена или метила, трифторметила, метокси, трифторметокси, циано, оксо, CH3NHCO, CH3SO2, NH2CO, NH2SO2 или группы пирролидин-SO2;R3 обозначает группу, выбранную из фенила или оксазола;Z обозначает связь или CH2, (CH2)2, CH=CH, СС, OCH2 или OC(CH3)2; А обозначает связь, атом кислорода, атом серы, группу OCH2, группу O(CH2)2, NH, NHCH2 илиm и n означают независимо друг от друга целое число, равное 0 или 1,в форме основания или соли присоединения с кислотой. Комбинации групп один-семь, как определено выше, также находятся в рамках изобретения. В частности, среди соединений формулы (I), которые являются объектами изобретения, можно назвать следующие соединения: В последующем описании термин "защитная группа Pg" означает группу, которая позволяет, с одной стороны, защитить реактивную функциональную группу, такую как гидроксил или амин, в течение синтеза и, с другой стороны, регенерировать интактную реактивную функциональную группу в конце синтеза. Примеры защитных групп и способов защиты и снятия защиты приведены в "Protective Groupsin Organic Synthesis", Green et al., 2nd Edition (John WileySons Inc., New York), 1991. Термин "уходящая группа" в последующем описании обозначает группу, которая может быть легко отщеплена от молекулы путем расщепления гетеролитической связи с уходом электронной пары. Эта группа может, таким образом, быть легко заменена другой группой, например, в течение реакции замещения. В соответствии с изобретением соединения общей формулы (I) могут быть получены согласно следующему способу. Общий способ (схема 1) получения соединений согласно изобретению состоит во введении амина общей формулы (II) в форме основания или соли, в которой m, n, A, Z и R имеют значения, определенные выше, в реакцию с производным общей формулы (III), в которой X обозначает уходящую группу,такую как атом хлора, 4-нитрофеноксигруппа, имидазольная группа, 1,2,4-триазольная группа или Nоксисукцинимидная группа. Реакцию осуществляют в растворителе, таком как дихлорметан, ацетонитрил, N-метилпирролидинон, диметилсульфоксид, диметилформамид или смеси этих растворителей, в случае необходимости в присутствии основания, такого как пиридин или диизопропилэтиламин, и катализатора, такого как 4-диметиламинопиридин, при температуре от 0 до 80C. Схема 1 Соединения общей формулы (II) доступны коммерчески, или описаны в литературе, или могут быть получены согласно способам, которые описаны там, или которые известны специалисту в данной области техники, как проиллюстрировано в примерах, которые следуют далее. Соединения общей формулы (III) получают реакцией спирта 1,1,1,3,3,3-гексафтор-2-пропанол с трифосгеном, 4-нитрофенилхлорформиатом, карбонилдиимидазолом, карбонил-ди-(1,2,4-триазолом) или карбонил-ди-(N-оксисукцинимидом), в растворителе, таком как дихлорметан, ацетонитрил или Nметилпирролидинон, в случае необходимости в присутствии основания, такого как пиридин, и катализатора, такого как 4-диметиламинопиридин, при температуре от 0 до 80C. Соединения (III) обычно получают и используют in situ. О некоторых из соединений общей формулы (III) уже сообщалось в литературе (Х=хлор, Synthesis, 1993 (1), 103-106; Х=имидазол, Tetrahedron Letters, 1982, 23 (20), 2113-2116;X=1,2,4-триазол, Chem. Pharm. Bull., 1983, 31 (12), 4578-4581). Альтернативно, соединения общей формулы (Ia), в которой А обозначает CON(RA), CON(RA)-(C1C6) алкилен, SO2N(RA), SO2N(RA)-(C1-C6) алкилен, N(RB)CON(RA), N(RB)CON(RA)-(C1-C6) алкилен,OCON(RA) или OCON(RA)-(C1-C6) алкилен, и R, Z, m и n имеют значения, определенные выше, могут быть получены (схема 2) введением производного общей формулы (IV), в которой W обозначает карбонилхлоридную (COCl), сульфонилхлоридную (SO2Cl), изоцианатную (NCO), карбамоилхлоридную(N(RB)COCl) или хлорформиатную (OCOCl) функциональную группу, в реакцию с производным общей формулы (V), в которой V обозначает аминную HN(RA) или HN(RA)-(C1-C6) функциональную алкиленовую группу. Это производное формулы (V) может представлять собой производное гексафторизопропилпиперидин-1-карбоксилата, когда m и n означают 1; производное гексафторизопропилпирролидин-1-карбоксилата, когда m означает 1 и n означает 0; производное гексафторизопропилазетидин-1-карбоксилата, когда m и n означают 0. Схема 2 Реакцию осуществляют в растворителе, таком как дихлорметан, ацетонитрил или N-метилпирролидинон, в случае необходимости в присутствии основания, такого как пиридин или диизопропилэтиламин, и катализатора, такого как 4-диметиламинопиридин, при температуре от 0 до 80C. Соединения общей формулы (IV) коммерчески доступны, или описаны в литературе, или могут быть получены согласно способам, которые описаны там, или которые известны специалисту в данной области техники. Соединения общей формулы (V) в форме основания или соли являются новыми и находятся в рамках изобретения. Они могут быть использованы в качестве промежуточных соединений в синтезе соединений формулы (Ia) и могут быть получены, как описано в примерах, которые следуют далее. Примеры, которые следуют далее, иллюстрируют получение нескольких соединений по изобретению. Эти примеры не ограничивают объем притязаний и служат только для иллюстрации изобретения. Микроанализы, спектры ИК и ЯМР и/или анализы LC/MS подтверждают структуры и чистоту полученных соединений. Номера соединений в примерах относятся к данным в таблице, приведенной ниже, в которой проиллюстрированы химические структуры и физические свойства нескольких соединений согласно изобретению. Спектры протонного ядерного магнитного резонанса (1 Н ЯМР) регистрировали при 200 или 400 МГц (химические сдвигив м.д.) в d3-хлороформе (CDCl3), d6-(диметилсульфоксиде) (ДМСО) или d4 метаноле (CD3OD). Аббревиатуры, используемые для характеристики сигналов, являются следующими:s=синглет, m=мультиплет, d=дублет, t=триплет, g=квартет, sept.=септет. Примеры способов анализа LC/MS описаны подробно ниже. Времена удерживания (Rt) выражены в минутах. Способ А. ВЭЖХ/ловушка - градиент 5 мМ ацетата аммония/ацетонитрил. Т 0: 100% А - Т 13 - Т 16 мин: 100% В - Т 16,5 - Т 20 мин: 100% А. Путь А: ацетат аммония + 3% ацетонитрила; путь В: ацетонитрил. Объемная скорость потока: 0,5 мл/мин - Т=40C. Колонка: Kromasil C18 (502,1 мм; 3,5 мкм). Способ В. ВЭЖХ/ZQ - градиент вода/ацетонитрил/трифторуксусная кислота. Т 0: 100% А - Т 13 - Т 16 мин: 100% В - Т 16,5 - Т 20 мин: 100% А. Путь А: вода + 0,05% трифторуксусной кислоты + 3% ацетонитрила; путь В: ацетонитрил + 0,035% трифторуксусной кислоты. Объемная скорость потока: 0,5 мл/мин - Т=40C. Колонка: Kromasil C18 (502,1 мм; 3,5 мкм). Способ С. ВЭЖХ/ZQ - градиент 5% ацетата аммония/ацетонитрил. Т 0: 100% А - Т 5,5 - Т 7 мин: 100% В - Т 7,1 - Т 10 мин: 100% А. Раствор 0,604 г (3,6 ммоль) 1,1,1,3,3,3-трифтор-2-пропанола, 0,32 мл (3,96 ммоль) пиридина и 0,014 г (0,12 ммоль) 4-диметиламинопиридина в 9 мл дихлорметана добавляли по каплям под атмосферой аргона к раствору, охлажденному до 0C, 0,356 г (1,2 ммоль) трифосгена в 8 мл дихлорметана. Перемешивание продолжали при температуре окружающей среды в течение 6 ч. Затем добавляли 0,670 г (3,6 ммоль) 4-(пиперидин-4-ил)бензонитрила и 1,31 мл (7,92 ммоль) диизопропилэтиламина. Смесь оставляли для перемешивания в течение ночи. Добавляли 23 мл дихлорметана. Органическую фазу промывали 3 раза 40 мл ледяной воды, высушивали над сульфатом натрия и упаривали досуха. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с 15:85 смесью этилацетата и циклогексана. Кристаллизацию осуществляли из н-гексана, получая 0,32 г (0,84 ммоль) продукта в форме белого порошка. Температура плавления (C): 54-56. Раствор 0,342 г (1,7 ммоль) 4-нитрофенил хлорформиата в 6 мл дихлорметана добавляли по каплям под атмосферой аргона к раствору, охлажденному до 0C, 0,571 г (3,4 ммоль) 1,1,1,3,3,3-трифтор-2 пропанола, 0,28 мл (3,4 ммоль) пиридина и 0,011 г (0,1 ммоль) 4-диметиламинопиридина в 5 мл дихлорметана. Смесь перемешивали при температуре окружающей среды в течение ночи. Затем добавляли 0,374 г (1,7 ммоль) 6-фтор-3-(пиперидин-4-ил)бензол[d]изоксазола и затем 0,74 мл (4,25 ммоль) диизопропилэтиламина. Смесь перемешивали при температуре окружающей среды в течение 5 ч. Добавляли 4 г диоксида кремния и смесь упаривали досуха. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с 10:90 смесью и затем 15:85 смесью этилацетата и циклогексана. Кристаллизацию осуществляли в н-гексане, получая 0,45 г (1,09 ммоль) продукта в форме белых кристаллов. Температура плавления (C): 91-93. 0,328 г (2 ммоль) карбонил-ди(1,2,4-триазола) добавляли к раствору 0,6725 г (4 ммоль) 1,1,1,3,3,3 трифтор-2-пропанола и 0,012 г (0,1 ммоль) 4-диметиламинопиридина в 10 мл дихлорметана. Смесь перемешивали при температуре окружающей среды в течение ночи и затем добавляли 0,503 г (2 ммоль) 5 хлор-1-пиперидин-4-ил-1,3-дигидробензимидазол-2-она. Перемешивание продолжали при температуре окружающей среды в течение 3 ч и дихлорметан выпаривали под вакуумом. Остаток забирали в смеси 50 мл этилацетата и 20 мл 1 н. водного раствора соляной кислоты. Органическую фазу отделяли отстаиванием и затем промывали 2 раза 20 мл воды и затем 20 мл насыщенного водного раствора хлорида натрия. Продукт высушивали над сульфатом натрия и упаривали под вакуумом. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с 30:70, затем 40:60 и 50:50 смесью этилацетата и циклогексана. Перекристаллизацию затем осуществляли в горячих условиях для смеси этилацетата и циклогексана, получая 0,28 г (0,62 ммоль) продукта в форме белого кристаллического порошка. Температура плавления (C): 231-233. 0,512 г (2 ммоль) карбонил-ди-(N-оксисукцинимида) и 0,012 г (0,1 ммоль) 4 диметиламинопиридина добавляли к раствору 0,504 г (3 ммоль) 1,1,1,3,3,3-трифтор-2-пропанола в 7 мл дихлорметана. Смесь перемешивали при температуре окружающей среды в течение 4 ч. Ее охлаждали до 0C и добавляли 0,520 г (2 ммоль) (4-хлорфенил)(пиперидин-4-ил)метанон гидрохлорида и затем 1,04 мл(6 ммоль) диизопропилэтиламина. Смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли 20 мл ледяной воды и 50 мл ледяного дихлорметана. Органическую фазу отделяли отстаиванием. Ее промывали дважды ледяной водой и затем 20 мл насыщенного водного раствора хлорида натрия. Продукт высушивали над сульфатом натрия и упаривали досуха. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с 5:95 и затем 10:90 смесью этилацетата и циклогексана,получая 0,175 г (0,42 ммоль) продукта в форме бесцветного масла. 5.1. 4-(3'-Цианобифенил-3-илокси)пиперидин-1-трет-бутилкарбоксилат. Раствор 1,210 г (5,99 ммоль) диизопропилазодикарбоксилата добавляли по каплям под атмосферой аргона к раствору, охлажденному до 0C, 0,974 г (4,99 ммоль) 3'-гидроксибифенил-3-карбонитрила, 1,205 г (5,99 ммоль) 4-гидроксипиперидин-1-трет-бутилкарбоксилата и 1,570 г (5,99 ммоль) трифенилфосфина в 12 мл тетрагидрофурана. Смесь затем перемешивали при температуре окружающей среды в течение ночи. Добавляли 15 г диоксида кремния и смесь упаривали досуха. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с 10:90 и затем 15:85 смесью этилацетата и циклогексана, получая 1,538 г (4,06 ммоль) продукта в форме бесцветного масла. 5.2. 3'-(Пиперидин-4-илокси)бифенил-3-карбонитрил. 1,508 г (3,98 ммоль) 4-(3'-цианобифенил-3-илокси)пиперидин-1-трет-бутилкарбоксилата, полученного на стадии 5.1, растворяли в 13 мл дихлорметана. Добавляли 3,07 мл (39,84 ммоль) трифторуксусной кислоты и смесь перемешивали при температуре окружающей среды в течение 4 ч. Смесь упаривали досуха и затем совместно упаривали дважды с 12 мл 1,2-дихлорэтана. Остаток забирали в смеси 18 мл дихлорметана и 9 мл 1 н. водного раствора гидроксида натрия. Органическую фазу отделяли отстаиванием и водную фазу экстрагировали 12 мл дихлорметана. Органические фазы промывали 18 мл воды и затем 18 мл насыщенного водного раствора хлорида натрия. Их высушивали над сульфатом натрия и упаривали досуха, получая 1,026 г (3,68 ммоль) продукта в форме оранжевого масла. 5.3. 2,2,2-Трифтор-1-(трифторметил)этил-4-(3'-цианобифенил-3-илокси)пиперидин-1-карбоксилат. Раствор 0,504 г (3 ммоль) 1,1,1,3,3,3-гексафтор-2-пропанола, 0,27 мл (3 ммоль) пиридина и 0,012 г(0,1 ммоль) 4-диметиламинопиридина в 6 мл дихлорметана добавляли по каплям под атмосферой аргона к раствору, охлажденному до 0C, 0,296 г (1 ммоль) трифосгена в 7 мл дихлорметана. Смесь перемешивали при температуре окружающей среды в течение 5 ч. Затем добавляли раствор 0,835 г (3 ммоль) 3'(пиперидин-4-илокси)бифенил-3-карбонитрила, полученного на стадии 5.2, в 4,9 мл дихлорметана и затем 1,09 мл (6,6 ммоль) диизопропилэтиламина. Смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли 11 мл дихлорметана и органическую фазу промывали 3 раза 25 мл ледяной воды. Органическую фазу высушивали над сульфатом натрия и упаривали досуха. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с 10:90 смесью этилацетата и циклогексана. Кристаллизацию затем осуществляли из н-гексана, получая 0,635 г (1,34 ммоль) продукта в форме твердого вещества белого цвета. Температура плавления (C): 80-82. 6.1. трет-Бутил 4-(5-(трифторметил)пиридин-2-иламино)пиперидин-1-карбоксилат. Смесь 0,678 г (3 ммоль) 2-бром-5-(трифторметил)пиридина, 0,901 г (4,5 ммоль) 4-аминопиперидин 1-трет-бутилкарбоксилата и 0,829 г (6 ммоль) карбоната калия в 5 мл диметилсульфоксида нагревали при 100C в течение 20 ч. Смесь охлаждали до температуры окружающей среды и затем добавляли 50 мл этилацетата и 15 мл воды. Органическую фазу отделяли отстаиванием и промывали дважды 15 мл воды и затем 15 мл насыщенного водного раствора хлорида натрия. Ее высушивали над сульфатом натрия и упаривали под вакуумом. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с 20:80 и затем 30:70 смесью этилацетата и циклогексана, получая 0,864 г (2,5 ммоль) продукта в форме твердого вещества белого цвета. Температура плавления (C): 152. 6.2. (Пиперидин-4-ил)(5-(трифторметил)пиридин-2-ил)амин. 0,860 г (2,49 ммоль) 4-(5-(трифторметил)(пиридин-2-иламино)пиперидин-1-трет-бутилкарбоксилата, полученного на стадии 6.1, растворяли в 8,5 мл дихлорметана. Добавляли 1,91 мл трифторуксусной кислоты и смесь перемешивали при температуре окружающей среды в течение 4 ч. Дихлорметан выпаривали и затем остаток совместно упаривали дважды с 10 мл 1,2-дихлорэтана. Остаток забирали в смеси 50 мл этилацетата, 10 мл 1 н. водного раствора гидроксида натрия и 5 мл 33%-го водного раствора гидроксида аммония. Органическую фазу отделяли отстаиванием. Продукт промывали 2 раза 10 мл воды и затем 10 мл насыщенного водного раствора хлорида натрия. Продукт высушивали над сульфатом натрия и упаривали досуха, получая 0,572 г (2,33 ммоль) продукта в форме твердого вещества грязнобелого цвета. Температура плавления (C): 128. 6.3. 2,2,2-Трифтор-1-(трифторметил)этил-4-(5-(трифторметил)(пиридин-2-иламино)пиперидин-1 карбоксилат. Раствор 0,467 г (2,32 ммоль) 4-нитрофенил хлорформиата в 3 мл дихлорметана добавляли по каплям под атмосферой аргона к раствору, охлажденному до 0C, 0,781 г (4,64 ммоль) 1,1,1,3,3,3-гексафтор 2-пропанола, 0,38 мл (4,64 ммоль) пиридина и 0,014 г (0,11 ммоль) 4-диметиламинопиридина в 1,5 мл дихлорметана. Смесь оставляли при температуре окружающей среды в течение ночи и затем добавляли 0,569 г (2,32 ммоль) (пиперидин-4-ил)(5-(трифторметил)пиридин-2-ил)амина, полученного на стадии 6,2,и 1,22 мл (6,96 ммоль) диизопропилэтиламина в 5 мл дихлорметана. Смесь перемешивали в течение 5 ч и затем упаривали. Остаток забирали в смеси 10 мл этилацетата, 50 мл простого диэтилового эфира и 20 мл воды. Органическую фазу отделяли отстаиванием и затем промывали 3 раза 20 мл 1 М водного раствора карбоната калия. Водные фазы повторно экстрагировали 20 мл простого диэтилового эфира. Органические фазы промывали 20 мл воды и затем 20 мл насыщенного водного раствора хлорида натрия. Их вы- 15022076 сушивали над сульфатом натрия и упаривали досуха. Продукт очищали хроматографией на силикагеле,осуществляя элюирование с 15:85 и затем 20:80 смесью этилацетата и циклогексана, получая 0,766 г(1,74 ммоль) продукта в форме твердого вещества белого цвета. 1H ЯМР (CDCl3,м.д., 200 МГц): 8,3 (с, 1H), 7,55 (дд, 1H), 6,25 (д, 1H), 5,75 (септ., 1H), 4,7 (д, 1H),4,1 (м, 3H), 3,15 (м, 2H), 2,15 (м, 2H), 1,45 (м, 2H). 6.4. 2,2,2-Трифтор-1-(трифторметил)этил-4-(5-(трифторметил)(пиридин-2-иламино)пиперидин-1 карбоксилат гидрохлорид (1:1). 0,75 г (1,71 ммоль) 2,2,2-трифтор-1-(трифторметил)этил-4-(5-(трифторметил)пиридин-2-иламино) пиперидин-1-карбоксилата, полученного на стадии 6.3, растворяли в 15 мл простого диизопропилового эфира. Добавляли 0,68 мл 5 н. раствора соляной кислоты в изопропаноле. Смесь упаривали досуха. Остаток перекристаллизовывали в горячих условиях из смеси ацетона и простого диизопропилового эфира,получая 0,616 г (1,30 ммоль) продукта в форме белых кристаллов. Температура плавления (C): 225-235 (разложение). 7.1. 4-[(4-Хлорбензолсульфониламино)метил]пиперидин-1-трет-бутилкарбоксилат. Раствор 0,844 г (4 ммоль) 4-хлорбензолсульфонилхлорида в 5 мл дихлорметана добавляли по каплям к раствору 0,857 г (4 ммоль) 4-(аминометил)пиперидин-1-трет-бутилкарбоксилата, 0,99 мл (6 ммоль) диизопропилэтиламина и 0,024 г (0,2 ммоль) 4-диметиламинопиридина в 9 мл дихлорметана. Смесь перемешивали при температуре окружающей среды в течение ночи. Органическую фазу промывали 10 мл воды и затем 4 мл 1 н. водного раствора соляной кислоты, 2 раза 14 мл воды, 2 раза 14 мл 1 н. водного раствора гидроксида натрия, 3 раза 14 мл воды и 14 мл насыщенного водного раствора хлорида натрия. Ее высушивали над сульфатом натрия и упаривали досуха, получая 1,371 г (3,52 ммоль) продукта в форме оранжевой пасты, используемой в этом виде на следующей стадии. 7.2. 4-Хлор-N-(пиперидин-4-илметил)бензолсульфонамид. 1,364 г (3,51 ммоль) 4-[(4-хлорбензолсульфониламино)метил]пиперидин-1-трет-бутилкарбоксилата,полученного на стадии 7.1, растворяли в 11 мл дихлорметана. Добавляли 2,7 мл (35 ммоль) трифторуксусной кислоты. Смесь перемешивали в течение 4 ч и затем упаривали досуха. Остаток забирали в 11 мл 1 н. водного раствора соляной кислоты. Водную фазу промывали 3 раза 11 мл простого диэтилового эфира и затем добавляли 1,6 мл 33%-го водного раствора гидроксида натрия. Осуществляли 3 раза экстракцию с помощью 11 мл дихлорметана и затем 3 раза 15 мл хлороформа. Органические фазы высушивали над сульфатом натрия и упаривали досуха, получая 0,847 г (2,93 ммоль) продукта в форме твердого вещества белого цвета. 7.3. 2,2,2-Трифтор-1-(трифторметил)этил-4-[(4-хлорбензолсульфониламино)метил]пиперидин-1 карбоксилат. Раствор 0,59 г (2,93 ммоль) 4-нитрофенил хлорформиата в 6 мл дихлорметана добавляли по каплям под атмосферой аргона к раствору, охлажденному до 0C, 0,984 г (5,86 ммоль) 1,1,1,3,3,3-гексафтор-2 пропанола, 0,48 мл (5,86 ммоль) пиридина и 0,015 г (0,17 ммоль) 4-диметиламинопиридина в 6 мл дихлорметана. Смесь оставляли при температуре окружающей среды в течение ночи и затем добавляли смесь 0,846 г (2,93 ммоль) 4-хлор-N-(пиперидин-4-илметил)бензолсульфонамида, полученного на стадии 7.2, и 1,21 мл (7,33 ммоль) диизопропилэтиламина в 9 мл дихлорметана. Смесь перемешивали при температуре окружающей среды в течение 5 ч и затем упаривали досуха. Остаток забирали в смеси 16 мл этилацетата и 56 мл простого диэтилового эфира. Органическую фазу промывали 4 раза 50 мл воды и затем 70 мл 1 М водного раствора карбоната натрия, 70 мл воды и 70 мл насыщенного водного раствора хлорида натрия. Ее высушивали над сульфатом натрия и упаривали досуха. Остаток очищали хроматографией на силикагеле, осуществляя элюирование с 25:75 смесью этилацетата и циклогексана. Кристаллизацию осуществляли из н-гексана, получая 0,849 г (1,75 ммоль) продукта в форме твердого вещества белого цвета. Температура плавления (C): 136-138. 8.1. 2,2,2-Трифтор-1-(трифторметил)этил-4-(трет-бутоксикарбониламино)пиперидин-1-карбоксилат. Раствор 3,02 г (15 ммоль) 4-нитрофенилхлорформиата добавляли по каплям под атмосферой аргона к раствору, охлажденному до 0C, 3,15 мл (30 ммоль) 1,1,1,3,3,3-гексафтор-2-пропанола, 2,42 мл (30 ммоль) пиридина и 0,091 г (0,75 ммоль) 4-диметиламинопиридина в 10 мл дихлорметана. Смесь оставляли для реакции при температуре окружающей среды в течение ночи. Ее охлаждали до 0C и добавляли частями 3,00 г (15 ммоль) (пиперидин-4-ил)трет-бутилкарбамата и затем добавляли по каплям 6,55 мл(37,5 ммоль) диизопропилэтиламина. Смесь перемешивали при температуре окружающей среды в течение 5 ч и упаривали. Остаток забирали в смеси 20 мл этилацетата, 30 мл воды и 60 мл простого диэтилового эфира. Органическую фазу отделяли отстаиванием. Ее промывали 30 мл воды и затем 4 раза 30 мл 1 М водного раствора карбоната натрия, 2 раза 30 мл воды и 30 мл насыщенного водного раствора хлорида натрия. Продукт высушивали над сульфатом натрия и упаривали досуха, получая 5,18 г (13,1 ммоль) продукта в форме твердого вещества грязно-белого цвета. Температура плавления (C): 104-106. ИК (KBr, см-1): 1731, 1678. 1H ЯМР (CDCl3,м.д., 200 МГц): 5,65 (септ., 1H), 4,3 (м, 1H), 4,0 (м, 2H), 3,6 (м, 1H), 2,95 (м, 2H),1,95 (м, 2H), 1,4-1,2 (м+с, 11H). 8.2. 2,2,2-Трифтор-1-(трифторметил)этил-4-аминопиперидин-1-карбоксилат гидрохлорид. 5,10 г (12,93 ммоль) 2,2,2-трифтор-1-(трифторметил)этил-4-(трет-бутоксикарбониламино)пиперидин-1-карбоксилата, полученного на стадии 8.1, растворяли в 18 мл дихлорметана и добавляли при перемешивании 5,2 мл 5 н. раствора соляной кислоты в изопропаноле. Через 3 ч добавляли еще 2,6 мл раствора соляной кислоты. Перемешивание продолжали при температуре окружающей среды в течение ночи. Смесь упаривали досуха. Добавляли 50 мл простого диизопропилового эфира. Перемешивание продолжали в течение 3 ч. Твердое вещество отфильтровывали и затем высушивали под вакуумом в присутствии пентоксида фосфора, получая 4,27 г (12,9 ммоль) продукта в форме грязно-белого порошка. Температура плавления (C): 204-206. ИК (KBr, см-1): 1731. 1H ЯМР (ДМСО,м.д., 200 МГц): 8,2 (м, 3H), 6,6 (септ., 1H), 4,0 (м, 2H), 3,4-2,9 (м, 3H), 2,0 (м, 2H),1,45 (м, 2H). 8.3. 2,2,2-Трифтор-1-(трифторметил)этил-4-[3-(3-хлорфенил)уреидо]пиперидин-1-карбоксилат. 0,30 мл (1,72 ммоль) диизопропилэтиламина и затем 0,230 г (1,5 ммоль) 3-хлорфенилизоцианата в растворе в 3 мл дихлорметана добавляли к суспензии 0,545 г (1,65 ммоль) 2,2,2-трифтор-1(трифторметил)этил-4-аминопиперидин-1-карбоксилат гидрохлорида, полученного на стадии 8.2, в 3 мл дихлорметана. Смесь перемешивали при температуре окружающей среды в течение ночи. Ее упаривали досуха. Остаток забирали в смеси 40 мл этилацетата и 10 мл воды. Органическую фазу отделяли отстаиванием. Ее промывали 10 мл воды и затем 10 мл 1 н. водного раствора соляной кислоты, 10 мл воды и 10 мл насыщенного водного раствора хлорида натрия. Продукт высушивали над сульфатом натрия и упаривали досуха. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с 30:70 и затем 40:60 смесью этилацетата и циклогексана. Перекристаллизацию осуществляли в горячих условиях из смеси этилацетата и н-гексана, получая 0,51 г (1,14 ммоль) продукта в форме белого кристаллического порошка. Температура плавления (C): 204-206. Как описано в предыдущих примерах 2, 6.3 и 7.3, смесь 0,41 мл (3,91 ммоль) 1,1,1,3,3,3-гексафтор 2-пропанола, 0,32 мл (3,91 ммоль) пиридина, 0,023 г (0,19 ммоль) 4-диметиламинопиридина и 0,75 г (3,72 ммоль) 4-нитрофенилхлорформиата в растворе в 13 мл дихлорметана оставляли для реакции при температуре окружающей среды в течение ночи. Добавляли 0,84 г (3,90 ммоль) (пиперидин-4-ил)метил-третбутилкарбамата и 2,1 мл (11,7 ммоль) диизопропилэтиламина. Смесь перемешивали при температуре окружающей среды в течение 4 ч. Органическую фазу промывали 5 раз 25 мл 1 н. водного раствора гидроксида натрия и затем 2 раза 25 мл 1 н. водного раствора соляной кислоты. Ее высушивали над сульфатом магния, получая 1,6 г продукта в форме масла. Продукт забирали в 9,7 мл (39 ммоль) 4 н. раствора соляной кислоты в диоксане. Смесь перемешивали при температуре окружающей среды в течение ночи и затем упаривали досуха. Остаток забирали в простом диэтиловом эфире, и продукт фильтровали и высушивали под вакуумом, получая 0,91 г (2,64 ммоль) продукта в форме грязно-белого порошка. Температура плавления (C): 177-178. ИК (KBr, см-1): 1716. 1H ЯМР (ДМСО,м.д., 200 МГц): 7,95 (м, 3H), 6,55 (септ., 1H), 4,0 (м, 2H), 3,0 (м, 2H), 2,75 (м, 2H),1,85 (м, 3H), 1,15 (м, 2H). 9.2. 2,2,2-Трифтор-1-(трифторметил)этил-4-[2-(4-хлорфенокси)-2-метилпропиониламино]метил пиперидин-1-карбоксилат. 0,10 г (0,29 ммоль) 2,2,2-трифтор-1-(трифторметил)этил-4-(аминометил)пиперидин-1-карбоксилат гидрохлорида, полученного на стадии 9.1, и 0,071 г (0,29 ммоль) 2-(4-хлорфенокси)-2 метилпропионилхлорида растворяли в 1,5 мл дихлорметана. Добавляли 0,13 мл (0,73 ммоль) диизопропилэтиламина. Смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли 1,5 мл дихлорметана. Органическую фазу промывали 2 мл 1 н. водного раствора соляной кислоты, затем фильтровали через гидрофобный картридж и упаривали досуха. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с градиентом от 10:90 до 40:60 этилацетата и циклогексана, в течение 15 мин, получая 0,089 г (0,176 ммоль) продукта в форме белого порошка. Температура плавления (C): 77-78. 10.1. 2,2,2-Трифтор-1-(трифторметил)этил-3-(2-аминоэтил)азетидин-1-карбоксилат гидрохлорид. Как описано в предыдущем примере 9.1, смесь 1,65 мл (15,63 ммоль) 1,1,1,3,3,3-гексафтор-2 пропанола, 1,27 мл (15,63 ммоль) пиридина, 0,090 г (0,74 ммоль) 4-диметиламинопиридина и 3,0 г (14,88 ммоль) 4-нитрофенилхлорформиата в растворе в 50 мл дихлорметана оставляли для реакции при температуре окружающей среды в течение ночи. Половину раствора удаляли. Добавляли 1,853 г (7,83 ммоль)(2-(азетидин-3-ил)этил)трет-бутилкарбамата, 4,19 мл (23,49 ммоль) диизопропилэтиламина и 20 мл дихлорметана. Смесь перемешивали при температуре окружающей среды в течение ночи. Органическую фазу затем промывали 3 раза 50 мл 1 н. водного раствора гидроксида натрия и затем 50 мл 1 н. водного раствора соляной кислоты. Ее высушивали над сульфатом магния и упаривали досуха, получая 3,00 г продукта. Продукт забирали в 19 мл (76 ммоль) 4 н. раствора соляной кислоты в диоксане. Добавляли дополнительные 20 мл диоксана. Смесь перемешивали при температуре окружающей среды в течение 5 ч. Ее упаривали досуха, получая 2,50 г (7,56 ммоль) продукта в форме масла, которое затвердевало. Температура плавления (C): 116-117. ИК (KBr, см-1): 1731. 1H ЯМР (ДМСО,м.д., 200 МГц): 8,0 (м, 3H), 6,5 (септ., 1H), 4,15 (м, 2H), 3,75 (м, 2H), 2,75 (м, 3H),1,9 (м, 2H). 10.2. 2,2,2-Трифтор-1-(трифторметил)этил-3-[2-(3-метил-3-фенилуреидо)этил]азетидин-1 карбоксилат. 0,112 г (0,34 ммоль) 2,2,2-трифтор-1-(трифторметил)этил-3-(2-аминоэтил)азетидин-1-карбоксилат гидрохлорида, полученного на стадии 10.1, растворяли в 2 мл дихлорметана. Добавляли 0,054 г (0,32 ммоль) N-метил-N-фенилкарбамоилхлорида и 0,15 мл (0,85 ммоль) диизопропилэтиламина. Смесь перемешивали при температуре окружающей среды в течение ночи. Органическую фазу промывали 3 раза 2 мл 1 н. водного раствора гидроксида натрия и затем 2 мл 1 н. водного раствора соляной кислоты. Ее вы- 18022076 сушивали фильтрацией через гидрофобный картридж и упаривали досуха. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с градиентом от 15:85 до 45:55 этилацетата и циклогексана, в течение 15 мин, получая 0,06 г (0,14 ммоль) продукта в форме белого порошка. Температура плавления (C): 101-102. 11.1. 2,2,2-Трифтор-1-(трифторметил)этил-3-(аминометил)пирролидин-1-карбоксилат гидрохлорид. Процедура является той же самой, как описано в примере 10.1. Используя 1,56 г (7,83 ммоль) (пирролидин-3-илметил)трет-бутилкарбамата (вместо (2-(азетидин-3-ил)этил)трет-бутилкарбамата), получают 1,51 г (4,56 ммоль) продукта в форме масла, используемого в этой форме на следующей стадии. Твердый образец получают, растирая из этилацетата. Температура плавления (C): 190C (разложение). ИК (KBr, см-1): 1732. 1H ЯМР (ДМСО,м.д., 200 МГц): 7,90 (м, 3H), 6,55 (септ, 1H), 3,65 (м, 1H), 3,55 (м, 1H), 3,40 (м,1H), 3,15 (м, 1H), 2,95 (м, 2H), 2,50 (м, 1H), 2,10 (м, 1H), 1,75 (м, 1H). 11.2. 2,2,2-Трифтор-1-(трифторметил)этил-3-[(нафталин-1-сульфониламино)метил]пирролидин-1 карбоксилат. Процедура является той же самой, как описано в примере 10.2. Используя 0,10 г (0,30 ммоль) 2,2,2 трифтор-1-(трифторметил)этил-3-(аминометил)пирролидин-1-карбоксилат гидрохлорида, полученного на стадии 11.2, 0,066 г (0,29 ммоль) нафталин-1-сульфонилхлорида и 0,13 мл (0,76 ммоль) диизопропилэтиламина, получают после очистки хроматографией на силикагеле, 0,096 г (0,20 ммоль) продукта в форме белого порошка. Температура плавления (C): 135-136. 12.1. 3-(1-Аминоциклопропил)азетидин-1-трет-бутилкарбоксилат. 10,5 мл (35 ммоль) тетраизопропоксида титана (Ti(OiPr)4) и затем по каплям 21 мл (63 ммоль) 3 М раствор этилмагний бромида в простом диэтиловом эфире добавляли, под атмосферой азота, к раствору 4,8 г (26,34 ммоль) 4-цианоазетидин-1-трет-бутилкарбоксилата в 150 мл простого диэтилового эфира. Смесь перемешивали в течение 40 мин и затем добавляли по каплям 9 мл (71 ммоль) комплекса трифторида бора и эфирата (BF3Et2O). Реакционную смесь перемешивали в течение 5 ч. Добавляли 100 мл 2 М водного раствора гидроксида натрия и 150 мл дихлорметана. Смесь фильтровали через целит. Органическую фазу отделяли отстаиванием. Ее высушивали над сульфатом натрия и упаривали досуха. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с 90:10 смесью дихлорметана и метанола, получая 1,91 г (9,0 ммоль) продукта в форме бесцветного масла, которое медленно затвердевало. 1H ЯМР (CDCl3,м.д., 200 МГц): 3,65 (т, 2H), 3,35 (м, 2H), 2,30-2,20 (м, 1H), 1,45 (с, 2H), 1,15 (с,9H), 0,35 (м, 2H), 0,20 (м, 2H). 12.2. 3-[1-(4-Хлорбензолсульфониламино)циклопропил]азетидин-1-трет-бутилкарбоксилат. 0,35 г (1,65 ммоль) 3-(1-аминоциклопропил)азетидин-1-трет-бутилкарбоксилата, полученного на стадии 12,1, 0,6 мл (3,44 ммоль) диизопропилэтиламина и 0,34 г (1,61 ммоль) 4-хлорбензолсульфонил хлорида растворяли в 4 мл дихлорметана. Смесь перемешивали при температуре окружающей среды в течение 20 ч. Добавляли 20 мл дихлорметана и осуществляли промывку с использованием 10 мл 1 н. водного раствора соляной кислоты, затем 10 мл 1 н. водного раствора гидроксида натрия и 10 мл насыщен- 19022076 ного водного раствора хлорида натрия. Органическую фазу фильтровали через гидрофобный картридж и упаривали досуха. Остаток очищали хроматографией на силикагеле, осуществляя элюирование с 95:5 смесью дихлорметана и метанола, получая 0,30 г (0,77 ммоль) продукта в форме твердого вещества белого цвета. 1H ЯМР (CDCl3,м.д., 200 МГц): 7,85 (м, 2H), 7,55 (м, 2H), 5,55 (с, 1H), 3,90 (т, 2H), 3,50 (м, 2H),3,15-3,00 (м, 1H), 1,50 (с, 9H), 0,80 (с, 4H). 12.3. N-(1-(Азетидин-3-ил)циклопропил)-4-хлорбензолсульфонамидгидрохлорид. 0,30 г (0,78 ммоль) 3-[1-(4-хлорбензолсульфониламино)циклопропил]азетидин-1-трет-бутилкарбоксилата, полученного на стадии 12.2, растворяли в 10 мл метанола. Добавляли 0,2 мл (1,58 ммоль) триметилсилилхлорида. Смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли дополнительные 0,2 мл триметилсилил хлорида и перемешивание продолжали в течение 4 ч. Смесь концентрировали под вакуумом и затем остаток забирали в этилацетате и упаривали досуха, получая 0,28 г продукта в форме твердого вещества белого цвета, используемого в этом виде. 12.4. 2,2,2-Трифтор-1-(трифторметил)этил-3-[1-(4-хлорбензолсульфониламино)циклопропил] азетидин-1-карбоксилат. Раствор 2,0 г (9,9 ммоль) 4-нитрофенил хлорформиата в 10 мл дихлорметана добавляли по каплям к раствору 2,50 г (14,9 ммоль) 1,1,1,3,3,3-гексафтор-2-пропанола и 1,90 мл (23,5 ммоль) пиридина в 40 мл дихлорметана. Смесь оставляли для реакции при температуре окружающей среды в течение ночи. 5 мл этого раствора извлекали и добавляли 0,28 г (0,87 ммоль) N-(1-азетидин-3-ил-циклопропил)-4 хлорбензолсульфонамид гидрохлорида, полученного на стадии 12,3, и 1,3 мл (7,46 ммоль) диизопропилэтиламина. Смесь перемешивали в течение 8 ч. Промывку осуществляли 2 раза с использованием 10 мл 0,5 н. водного раствора соляной кислоты и затем 3 раза с использованием 10 мл насыщенного водного раствора карбоната натрия. Органическую фазу фильтровали через гидрофобный картридж и упаривали досуха. Остаток очищали хроматографией на силикагеле, осуществляя элюирование с 95:5 смесью дихлорметана и метанола, получая 0,32 г (0,66 ммоль) продукта в форме белого порошка. Температура плавления (C): 108-109. 13.1. 4-(4-Карбамоилпиразол-1-илметил)пиперидин-1-трет-бутилкарбоксилат. 2,15 г (10 ммоль) 4-(гидроксиметил)пиперидин-1-трет-бутилкарбоксилата, 2,11 мл (15 ммоль) триэтиламина и 0,06 г (0,5 ммоль) 4-диметиламинопиридина растворяли в 15 мл дихлорметана под атмосферой аргона. Раствор охлаждали в ванне со льдом и добавляли по каплям раствор 1,60 г (14 ммоль) метансульфонилхлорида в 5 мл дихлорметана. Смесь перемешивали при температуре ванны со льдом в течение 1 ч и затем при температуре окружающей среды в течение 2 ч. Добавляли 20 мл воды и 20 мл дихлорметана. Органическую фазу отделяли отстаиванием и промывали 20 мл 0,5 н. водного раствора соляной кислоты, затем дважды 20 мл воды и 20 мл насыщенного водного раствора хлорида натрия. Органическую фазу высушивали над сульфатом натрия и упаривали досуха, получая 2,96 г (10 ммоль) мезилата в форме оранжевого масла. 1,76 г (6 ммоль) этого продукта повторно растворяли в 6 мл N,N-диметилформамида. 0,76 г (6,9 ммоль) 1 Н-пиразол-4-карбоксамида и 1,24 г (9 ммоль) карбоната калия добавляли при перемешивании и смесь нагревали при 70C в течение ночи. Добавляли 30 мл этилацетата и твердое вещество отфильтровывали и промывали 6 мл 1:5 смеси N,N-диметилформамида и этилацетата и затем 6 мл этилацетата. Фильтраты упаривали досуха. Остаток забирали в 50 мл 95:5 смесь хлороформа и метанола. Нерастворимый материал отфильтровывали и промывали дважды 95:5 смесью хлороформа и метанола. Фильтраты упаривали досуха и остаток перекристаллизовывали в горячих условиях из этилацетата,получая 0,98 г (3,17 ммоль) продукта в форме белого порошка. Температура плавления (C): 190-192. 1(3,11 ммоль) 4-(4-карбамоилпиразол-1-илметил)пиперидин-1-третбутилкарбоксилата, полученного на стадии 13.1, в 25 мл 5 н. раствора соляной кислоты (124 ммоль) в изопропаноле перемешивали в течение ночи. Ее упаривали досуха и затем совместно упаривали дважды с 25 мл этилацетата. Продукт повторно суспендировали в 25 мл этилацетата. Продукт фильтровали, промывали дважды 10 мл этилацетата и высушивали под вакуумом, получая 0,91 г (3,23 ммоль) продукта в форме белого порошка. 1(уш.т, 2H), 2,10 (м, 1H), 1,60 (уш.д, 2H), 1,45-1,25 (м, 2H). 13.3. 2,2,2-Трифтор-1-(трифторметил)этил-4-(4-карбамоилпиразол-1-илметил)пиперидин-1 карбоксилат. Раствор 0,605 г (3 ммоль) 4-нитрофенил хлорформиата в 5 мл дихлорметана добавляли по каплям к раствору 1,00 г (6 ммоль) 1,1,1,3,3,3-гексафтор-2-пропанола, 0,49 мл (6 ммоль) пиридина и 0,036 г (0,3 ммоль) 4-диметиламинопиридина в 5 мл дихлорметана. Смесь оставляли для реакции при температуре окружающей среды в течение ночи. Этот раствор добавляли по каплям под атмосферой аргона к раствору, охлажденному в ванне со льдом, 0,84 г (3 ммоль) 1-(пиперидин-4-илметил)-1 Н-пиразол-4-карбоксамид гидрохлорида, полученного на стадии 13.2, и 2,2 мл (13 ммоль) диизопропилэтиламина в смеси 15 мл N,N-диметилформамида и 7 мл диметилсульфоксида. Реакционную смесь затем перемешивали при температуре окружающей среды в течение 2 ч и упаривали под вакуумом. Остаток забирали в 50 мл этилацетата и добавляли 2,8 г (20 ммоль) карбоната калия. Смесь перемешивали энергично в течение 2 ч. Твердое вещество отфильтровывали и промывали дважды 25 мл этилацетата. Фильтрат затем промывали дважды 10 мл полунасыщенного водного раствора хлорида натрия и затем дважды 10 мл насыщенного водного раствора хлорида натрия. Фильтрат высушивали над сульфатом натрия и выпаривали досуха. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с 97:3, затем 95:5 и 92:8 смесью дихлорметана и метанола, получая 1,0 г продукта в форме твердого вещества белого цвета, загрязненного приблизительно 3 мол.% 4-нитрофенил-4-(4-карбамоилпиразол-1-илметил)пиперидин-1-карбоксилата. 0,80 г этого продукта повторно растворяли в 15 мл этилацетата. Добавляли 0,2 г 10%-го палладия на угле и смесь перемешивали под атмосферой водорода 2 бар в течение 3 ч. Затем ее фильтровали через целит. Ополаскивание осуществляли 4 раза с использованием 10 мл этилацетата и фильтрат упаривали досуха. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с 97:3, затем 95:5 и затем 92:8 смесью дихлорметана и метанола, получая 0,75 г продукта в форме твердого вещества белого цвета. Перекристаллизацию осуществляли в горячих условиях из смеси этилацетата и простого диизопропилового эфира, получая 0,68 г (1,69 ммоль) продукта в форме белого порошка. Температура плавления (C): 98-118. 14.1. 4-[2-(5-Карбамоилпиразин-2-иламино)этил]пиперидин-1-трет-бутилкарбоксилат. Смесь 1,12 г (7,15 ммоль) 5-хлорпиразин-2-карбоксамида, 1,95 г (8,58 ммоль) 4-(2 аминоэтил)пиперидин-1-трет-бутилкарбоксилата и 1,18 г (8,58 ммоль) карбоната калия в 1,4 мл диметилсульфоксида, нагревали в течение 5 ч при 100C под атмосферой аргона и при перемешивании. После охлаждения до температуры окружающей среды добавляли 25 мл этилацетата и 25 мл воды. Органическую фазу отделяли отстаиванием и промывали 3 раза 25 мл воды и затем 25 мл насыщенного водного раствора хлорида натрия. Ее высушивали над сульфатом натрия и упаривали досуха. Остаток очищали хроматографией на силикагеле, осуществляя элюирование с 97:3, затем 95:5 и 93:7 смесью дихлорметана и метанола, получая 1,99 г (5,69 ммоль) продукта в форме светло-желтой пасты. 1(5,68 ммоль) 4-[2-(5-карбамоилпиразин-2-иламино)этил]пиперидин-1-третбутилкарбоксилата, полученного на стадии 14.1, растворяли в 20 мл дихлорметана. Добавляли 13 мл 5 н. раствора соляной кислоты в изопропаноле и смесь перемешивали в течение ночи. Ее упаривали досуха и затем совместно упаривали дважды с 50 мл этилацетата. Остаток забирали в 17 мл этилацетата и перемешивали в течение 1 ч. Твердое вещество отфильтровывали, промывали 2 раза 5 мл этилацетата и высушивали под вакуумом, получая 1,78 г (5,54 ммоль) продукта в форме твердого вещества желтого цвета. 1(т, 2H), 1,90 (уш.д, 2H), 1,70-1,15 (м, 5H). 14.3. 2,2,2-Трифтор-1-(трифторметил)этил-4-[2-(5-карбамоилпиразин-2-иламино)этил]пиперидин-1 карбоксилат. Раствор 1,01 г (5 ммоль) 4-нитрофенил хлорформиата в 8,5 мл дихлорметана добавляли по каплям к раствору, охлажденному под аргоном в ванне со льдом, 1,69 г (10 ммоль) 1,1,1,3,3,3-гексафтор-2 пропанола, 0,82 мл (10 ммоль) пиридина и 0,030 г (0,25 ммоль) 4-диметиламинопиридина в 8,5 мл дихлорметана. Смесь оставляли для реакции при температуре окружающей среды в течение ночи. Этот раствор добавляли по каплям под атмосферой аргона и при перемешивании к смеси, охлажденной в ванне холодной воды, 1,62 г (5,04 ммоль) 5-(2-(пиперидин-4-ил)этиламино)пиразин-2 карбоксамид дигидрохлорида, полученного на стадии 14.2, и 3,75 мл (22 ммоль) диизопропилэтиламина в 11 мл диметилсульфоксида. Реакционную смесь затем перемешивали при температуре окружающей среды в течение 4 ч и упаривали под вакуумом. Остаток забирали в 110 мл этилацетата и добавляли 4,7 г(34 ммоль) карбоната калия. Смесь перемешивали энергично в течение 4 ч. Твердое вещество отфильтровывали и промывали дважды 30 мл этилацетата. Фильтрат затем промывали 3 раза 16 мл полунасыщенного водного раствора хлорида натрия и затем 3 раза 16 мл насыщенного водного раствора хлорида натрия. Фильтрат высушивали над сульфатом натрия и выпаривали досуха. Продукт очищали хроматографией на силикагеле, осуществляя элюирование с 90:10 смесью этилацетата и циклогексана и затем с этилацетатом, получая 1,6 г продукта. Его повторно растворяли в 90 мл этилацетата и промывали 3 раза 7,5 мл 1 М раствора водного карбоната калия и затем дважды 7,5 мл воды. Органическую фазу высушивали над сульфатом натрия и упаривали, получая 1,57 г продукта. Перекристаллизацию осуществляли в горячих условиях из смеси этилацетата и простого диизопропилового эфира, получая 1,31 г (2,95 ммоль) продукта в форме светло-желтого порошка. Температура плавления (C): 156-158.(уш.с, 1H), 4,70 (уш.с, 1H), 4,15 (уш.т, 2H), 3,50 (уш.с, 2H), 2,90 (м, 2H), 1,80-1,20 (м, 7H). Химические структуры и физические свойства нескольких примеров соединений согласно изобретению проиллюстрированы в следующей табл. 1. В этой таблице: Т.пл. (C) обозначает температуру плавления соединения в градусах Цельсия;(МН+) обозначает молекулярный ион с протонированием; М-H)-) обозначает молекулярный ион с потерей протона;(М+) обозначает молекулярный ион с потерей электрона;(MH+ACN) обозначает молекулярный ион в форме аддукта с ацетонитрилом;(MNH4+) обозначает молекулярный ион в форме аддукта с аммиаком;(МАСО 2-) обозначает молекулярный ион в форме аддукта с ацетатным ионом; в столбцах Z и А "-" означает, что Z и/или А отсутствуют; в столбце Соль "-" обозначает связь в форме свободного основания и "HCl" обозначает связь в форме гидрохлорида; Соединения, описанные в табл. 1, были получены согласно способам, описанным выше. Времена удерживания (Rt) нескольких соединений табл. 1, измеренные анализом LC/MS согласно одному из способов А, В, С, D или Е, описанных выше, проиллюстрированы в табл. 2. Вращения плоскости поляризации ([]D), полученные для энантиомерных соединений 22, 23, 24 и 25 из табл. 1, и условия для измерения []D даны в табл. 3.
МПК / Метки
МПК: C07D 205/04, C07D 409/12, C07D 211/16, C07D 413/12, C07D 211/46, A61K 31/4468, C07D 211/54, C07D 401/12, C07D 207/14, C07D 211/62, C07D 207/12, A61P 25/00, C07D 403/04, C07D 405/12, C07D 211/58
Метки: получение, производные, применение, карбамата, терапевтическое, гексафторизопропил
Код ссылки
<a href="https://eas.patents.su/30-22076-proizvodnye-geksaftorizopropil-karbamata-ih-poluchenie-i-ih-terapevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные гексафторизопропил карбамата, их получение и их терапевтическое применение</a>
Предыдущий патент: Азотсодержащие гетероарильные соединения
Следующий патент: Новый способ синтеза агомелатина
Случайный патент: Способ получения бензилэпоксидов и промежуточные соединения












