Производные пиперазинилацилпиперидина, их получение и их терапевтическое применение
Номер патента: 7501
Опубликовано: 27.10.2006
Авторы: Дос Сантос Виктор, Эрбер Жан-Марк, Бош Мишель, Тоннерр Бернар, Нисато Дино, Боно Франсуаза, Ваньон Жан
Формула / Реферат
1. Соединение формулы (I)
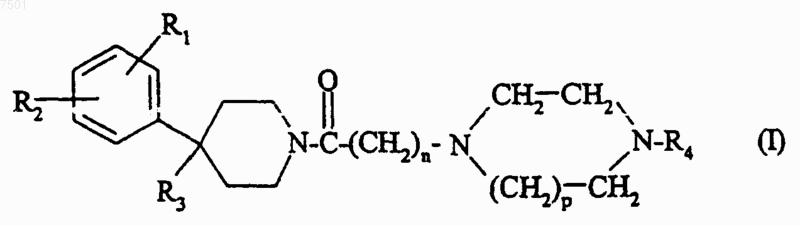
в которой n равно 1 или 2;
р равно 1 или 2;
R1 представляет собой атом галогена; радикал трифторметил; (C1-С4)алкил; (С1-С4)алкокси; радикал трифторметокси;
R2 представляет собой атом водорода или атом галогена;
R3 представляет собой атом водорода; группу -OR5; группу -CH2OR5; группу -NR6R7; группу -NR8COR9; группу -NR8CONR10R11; группу -CH2NR12R13; группу -CH2NR8CONR14R15; (С1-С4)алкоксикарбонил; группу -CONR16R17;
либо R3 образует двойную связь между атомом углерода, к которому он присоединен, и соседним атомом углерода пиперидинового кольца;
R4 представляет собой ароматическую группу, выбранную из
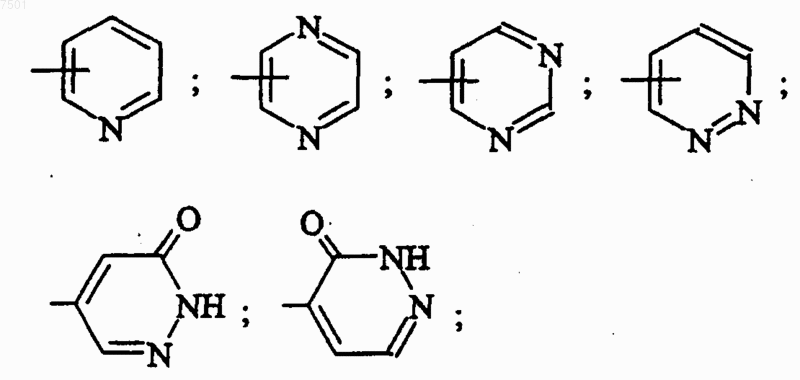
причем указанные ароматические группы являются незамещенными или являются моно- или дизамещенными заместителем, независимо выбранным из атома галогена; (C1-C4)алкила; (C1-C4)алкокси; радикала трифторметил;
R5 представляет собой атом водорода; (С1-С4)алкил; (С1-С4)алкилкарбонил;
R6 и R7, каждый независимо, представляет собой атом водорода или (C1-С4)алкил;
R8 представляет собой атом водорода или (С1-С4)алкил;
R9 представляет собой (С1-С4)алкил или группу -(CH2)m-NR6R7;
m равно 1, 2 или 3;
R10 и R11, каждый независимо, представляет собой атом водорода или (C1-С4)алкил;
R12 и R13, каждый независимо, представляет собой атом водорода или (С1-С6)алкил; R13 также может представлять собой группу -(CH2)q-OH или группу -(CH2)q-S-CH3;
либо R12 и R13 вместе с атомом азота, к которому они присоединены, образуют гетероцикл, выбранный из азиридина, азетидина, пирролидина, пиперидина и морфолина;
q равно 2 или 3;
R14 и R15, каждый независимо, представляет собой атом водорода или (C1-С4)алкил;
R16 и R17, каждый независимо, представляет собой атом водорода или (С1-С4)алкил; R17 также может представлять собой группу -(CH2)q-NR6R7;
либо R16 и R17 вместе с атомом азота, к которому они присоединены, образуют гетероцикл, выбранный из азетидина, пирролидина, пиперидина, морфолина и пиперазина, который является незамещенным или замещенным по 4 положению (С1-С4)алкилом;
в форме основания или соли присоединения кислоты либо в форме гидрата или сольвата.
2. Соединение формулы (I) по п.1, характеризующееся тем, что
R1 находится в 2, 3 или 4 положении фенила и представляет собой радикал трифторметил, атом хлора, радикал метил, метокси или трифторметокси и R2 представляет собой атом водорода; либо R1 находится в 3 положении фенила и представляет собой радикал трифторметил и R2 находится в 4 положении фенила и представляет собой атом хлора;
в форме основания или соли присоединения кислоты либо в форме гидрата или сольвата.
3. Соединение формулы (I) по п.1, характеризующееся тем, что
R3 представляет собой атом водорода, гидроксил, метокси, (ацетилокси)метил, гидроксиметил, диметиламино, ацетиламино, аминометил, (метиламино)метил, (диметиламино)метил, (диэтиламино)метил, (изопропиламино)метил, (N-метилизопропиламино)метил, (изобутиламино)метил, (N-метилизобутиламино)метил, (изопентиламино)метил, (N-метилизопентиламино)метил, аминокарбонил, азетидин-1-илкарбонил; либо R3 образует двойную связь между атомом углерода, к которому он присоединен, и соседним атомом углерода пиперидинового кольца;
в форме основания или соли присоединения кислоты либо в форме гидрата или сольвата.
4. Соединение формулы (I) по п.1, характеризующееся тем, что R4 представляет собой 2-пиридил, 6-метил-2-пиридил, 3-(трифторметил)-2-пиридил, 5-(трифторметил)-2-пиридил, 3-хлор-5-(трифторметил)-2-пиридил, 3-пиридил, 4-пиридил, 3,5-дихлор-4-пиридил, 2-пиразинил, 5-хлор-2-пиразинил, 6-хлор-2-пиразинил, 2-пиримидинил, 4-(трифторметил)-2-пиримидинил, 6-хлор-2-пиримидинил, 4-пиримидинил, 6-хлор-4-пиримидинил, 5-пиримидинил, 3-пиридазинил, 6-хлор-3-пиридазинил, 4-пиридазинил, 3(2Н)-пиридазинон-5-ил или 3(2Н)-пиридазинон-4-ил; в форме основания или соли присоединения кислоты либо в форме гидрата или сольвата.
5. Соединение формулы (I) по п.1, характеризующееся тем, что
n равно 1 или 2;
р равно 1 или 2;
R1 находится в 2, 3 или 4 положении фенила и представляет собой радикал трифторметил, атом хлора, радикал метил, метокси или трифторметокси и R2 представляет собой атом водорода; либо R1 находится в 3 положении фенила и представляет собой радикал трифторметил и R2 находится в 4 положении фенила и представляет собой атом хлора;
R3 представляет собой атом водорода, гидроксил, метокси, (ацетилокси)метил, гидроксиметил, диметиламино, ацетиламино, аминометил, (метиламино)метил, (диметиламино)метил, (диэтиламино)метил, (изопропиламино)метил, (N-метилизопропиламино)метил, (изобутиламино)метил, (N-метилизобутиламино)метил, (изопентиламино)метил, (N-метилизопентиламино)метил, аминокарбонил, азетидин-1-илкарбонил; либо R3 образует двойную связь между атомом углерода, к которому он присоединен, и соседним атомом углерода пиперидинового кольца;
R4 представляет собой 2-пиридил, 6-метил-2-пиридил, 3-(трифторметил)-2-пиридил, 5-(трифторметил)-2-пиридил, 3-хлор-5-(трифторметил)-2-пиридил, 3-пиридил, 4-пиридил, 3,5-дихлор-4-пиридил, 2-пиразинил, 5-хлор-2-пиразинил, 6-хлор-2-пиразинил, 2-пиримидинил, 4-(трифторметил)-2-пиримидинил, 6-хлор-2-пиримидинил, 4-пиримидинил, 6-хлор-4-пиримидинил, 5-пиримидинил, 3-пиридазинил, 6-хлор-3-пиридазинил, 4-пиридазинил, 3(2H)-пиридазинон-5-ил, 3(2Н)-пиридазинон-4-ил;
в форме основания или соли присоединения кислоты либо в форме гидрата или сольвата.
6. Соединение формулы (I) по п.1, характеризующееся тем, что
n равно 1;
р равно 1;
R1 находится в 2, 3 или 4 положении фенила и представляет собой радикал трифторметил, атом хлора, радикал метокси или трифторметокси и R2 представляет собой атом водорода; либо R1 находится в 3 положении фенила и представляет собой радикал трифторметил и R2 находится в 4 положении фенила и представляет собой атом хлора;
R3 представляет собой гидроксил, диметиламино, аминометил, (метиламино)метил, (диметиламино) метил, (диэтиламино)метил, (изопропиламино)метил, (изобутиламино)метил, (изопентиламино)метил, (N-метилизопентиламино)метил или аминокарбонил; либо R3 образует двойную связь между атомом углерода, к которому он присоединен, и соседним атомом углерода пиперидинового кольца;
R4 представляет собой 2-пиразинил, 4-пиримидинил, 3(2Н)-пиридазинон-5-ил или 5-(трифторметил)-2-пиридил;
в форме основания или соли присоединения кислоты либо в форме гидрата или сольвата.
7. Способ получения соединений формулы (I) по п.1, в которой n равно 1, характеризующийся тем, что
а1) соединение формулы
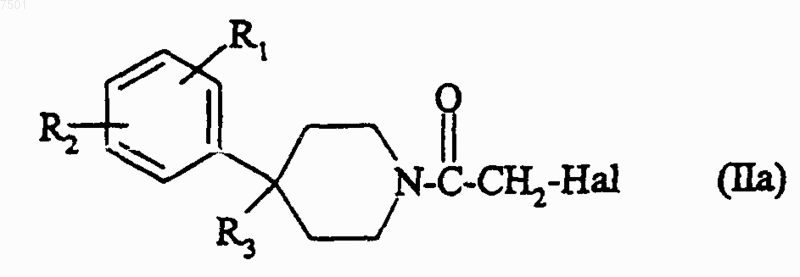
в которой R1, R2 и R3 являются такиьш, как определено для соединения формулы (I) в п.1, и Hal представляет собой атом галогена, предпочтительно хлора или брома, при условии, что когда R3 содержит гидроксильную или аминную функциональную группу, эти функциональные группы могут быть защищены, подвергают взаимодействию с соединением формулы
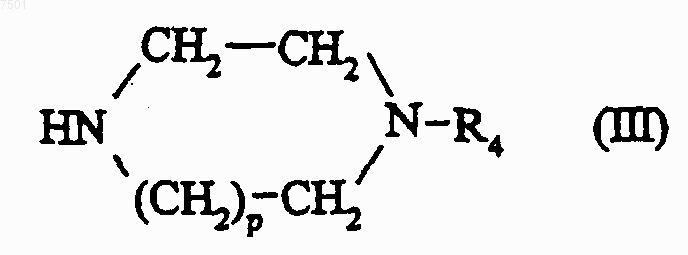
в которой р и R4 являются такими, как определено для соединения формулы (I) в п.1;
б1) и после снятия защиты с гидроксильной или аминной функциональных групп, присутствующих в R3, когда подходит, получают соединение формулы (I).
8. Способ получения соединений формулы (I) по п.1, в которой n равно 2, характеризующийся тем, что
а2) соединение формулы
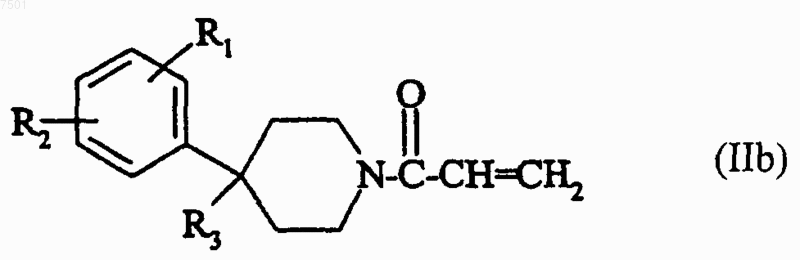
в которой R1, R2 и R3 являются такими, как определено для соединения формулы (I) в п.1, при условии, что, когда R3 содержит гидроксильную или аминную функциональную группу, эти функциональные группы могут быть защищены, подвергают взаимодействию с соединением формулы
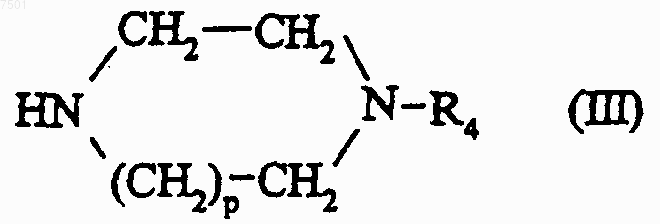
в которой р и R4 являются такими, как определено для соединения формулы (I) в п.1;
б2) и после снятия защиты с гидроксильной или аминной функциональных групп, присутствующих в R3, когда подходит, получают соединение формулы (I).
9. Способ получения соединений формулы (I) по п.1, в которой R3 представляет собой группу -CH2NR12R13, в которой R12 и R13 каждый представляет собой водород, характеризующийся тем, что
а3) соединение формулы
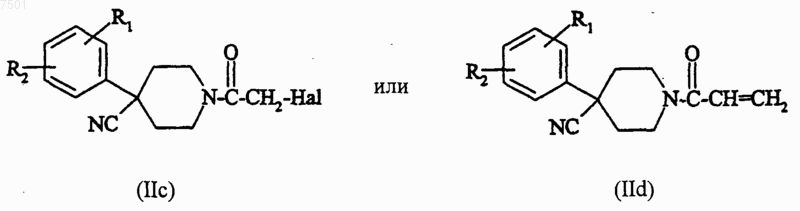
в которой R1 и R2 являются такими, как определено для соединения формулы (I) в п.1, и Hal представляет собой атом галогена, предпочтительно хлора или брома, подвергают взаимодействию с соединением формулы
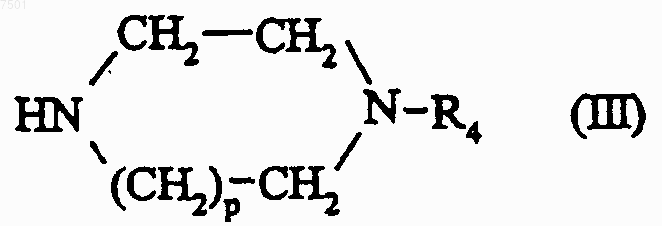
в которой р и R4 являются такими, как определено для соединения формулы (I) в п.1, с образованием соединения формулы
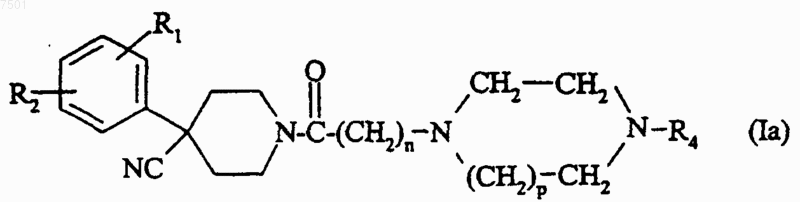
б3) цианогруппу соединения формулы (Iа) восстанавливают с образованием соединения формулы (I) по п.1, в которой R3 представляет собой CH2NH2.
10. Соединение формулы
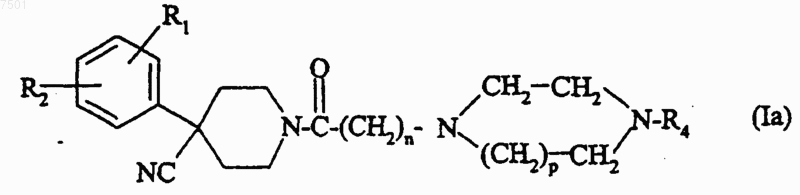
в которой n равно 1 или 2;
р равно 1 или 2;
R1 представляет собой атом галогена; радикал трифторметил; (C1-С4)алкил; (С1-С4)алкокси; радикал трифторметокси;
R2 представляет собой атом водорода или атом галогена;
R4 представляет собой ароматическую группу, выбранную из
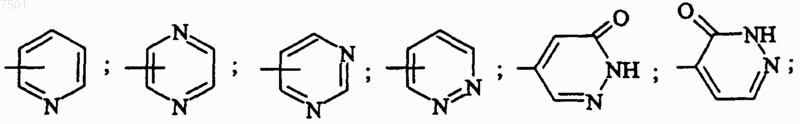
причем указанные ароматические группы являются незамещенными или моно- или дизамещенными заместителем, независимо выбранным из атома галогена, (С1-С4)алкила, (С1-С4)алкокси, радикала трифторметокси;
в форме основания или соли присоединения кислоты либо в форме гидрата или сольвата.
11. Лекарственное средство, отличающееся тем, что включает в себя соединение формулы (I) по любому из пп.1-6, или соль этого соединения, полученную присоединением фармацевтически приемлемой кислоты, либо гидрат или сольват соединения формулы (I).
12. Фармацевтическая композиция, отличающаяся тем, что включает в себя соединение формулы (I) по любому из пп.1-6 или фармацевтически приемлемые соль, гидрат или сольват этого соединения и по меньшей мере один фармацевтически приемлемый эксципиент.
13. Применение соединения формулы (I) по любому из пп.1-6 для изготовления лекарственного средства, предназначенного для профилактики или лечения центральных или периферических нейродегенеративных заболеваний; бокового амиотрофического склероза, рассеянного склероза; сердечно-сосудистых состояний; периферических невропатий; повреждения зрительного нерва и сетчатки; травмы спинного мозга и травмы головы; атеросклероза; стенозов; образования рубца; алопеции; злокачественных новообразований; опухолей; метастазов, лейкемий; хронической невропатической боли и боли при воспалении; аутоиммунных заболеваний; переломов костей; костных заболеваний.
Текст
007501 Настоящее изобретение относится к производным замещенного 1-пиперазинилацилпиперидина, их получению и их терапевтическому применению. Соединения по настоящему изобретению проявляют аффинность в отношении нейротрофинового рецептора p75NTR. Нейротрофины принадлежат к семейству белков, которые обладают сходной структурой и сходными свойствами и включают в себя фактор роста нервной ткани (NGF), нейротрофный фактор головного мозга (Brain Derived Neurotrophic Factor, BDNF), нейротрофин-3 (NT-3), нейротрофин-4/5 (NT-4/5) и нейротрофин-6 (NT-6). Биологические эффекты этих белков (выживание и дифференциация) находятся под влиянием взаимодействия с рецепторами мембраны, имеющими тирозинкиназную активность (trk-A, trkB и trk-C) (H. THOENEN, Science, 1995, 270, 593-598; G.R. LEWIN and YA BARDE, Annu. Rev. Neurosci.,1996, 19, 289-317; M.V. CHAO, J., Neurobiol., 1994, 25, 1373-1385; M. BOTHWELL, Annu. Rev. Neurosci.,1995, 18, 223-253; G. DECHANT and Y.A. BARDE, Curr. Opin. Neurobiol., 1997, 7, 413-418). Однако многочисленные исследования показывают преобладающую роль рецептора p75NTR в активности нейротрофинов. Рецептор p75NTR, являющийся рецептором для всех нейротрофинов, представляет собой трансмембранный гликопротеин семейства рецепторов фактора некроза опухоли (TNF) (W.J. FRIEDMAN and L.A.GREENE, Exp. Cell. Res., 1999, 253, 131-142; J. MELDOSIS et al., Trends Pharmacol. Sci., 2000, 21, 242243). Рецептору p75NTR приписывается ряд биологических функций: с одной стороны, модуляция аффинности нейротрофинов к trk-рецепторам; с другой стороны, в отсутствие trk, индукция сигнала для клеточной гибели путем апоптоза, которая происходит через гомодимеризацию этого рецептора и активацию церамидного пути. Апоптоз или программируемая клеточная гибель является физиологическим механизмом для элиминации клеток во многих тканях. В частности, апоптоз играет преобладающую роль в эмбриогенезе,морфогенезе и обновлении клеток. Апоптоз является генетически контролируемым явлением, которое происходит только при развитой и необратимой стадии повреждения клеток. Многочисленные исследования показывают, что апоптоз происходит при некоторых патологиях центральной нервной системы, таких как боковой амиотрофический склероз, рассеянный склероз, болезнь Альцгеймера, Паркинсона и Хантингтона и прионные заболевания. Более того, нейрональная гибель путем апоптоза также происходит сразу же после ишемии мозга и сердца. Клеточная гибель является также преобладающим явлением при атеросклерозе; действительно, зоны некроза в первичных атеросклеротических повреждениях у людей оцениваются в 80% (M.L. BOCHATON-PIALAT et al., Am. J.Pathol., 1995, 146, 1-6; Н. PERLMAN, Circulation, 1997, 95, 981-987). Апоптоз также вовлечен в механизмы, приводящие к клеточной гибели после ишемии-реперфузии сердца (Н. YAOITA et al., Cardiovasc.p75NTR после ишемии в областях мозга и сердца, в которых отмечали массивный апоптоз. Следовательно,эти результаты предполагают, что p75NTR может играть преобладающую роль в механизмах, приводящих к нейрональной гибели путем апоптоза после ишемии (P.P. ROUX et al., J. Neurosci., 1999, 19, 6887-6896;J.A. PARK et al., J. Neurosci., 2000, 20, 9096-9103). Рецептор p75NTR описывают как клеточную мишень для прионного пептида (V. DELLA-BIANCA etSci. USA, 1994, 91., 10703-10706), который, таким образом, может быть вовлечен в явление апоптоза,индуцируемого этими соединениями. Эти результаты подтверждают гипотезу, в соответствии с которойp75NTR может играть важную роль в нейрональной гибели, индуцированной инфекционным прионным белком (трансмиссивная губчатая энцефалопатия) или бета-амилоидным белком (болезнь Альцгеймера). Недавние исследования предполагают, что р 75NTR-рецептор также может играть важную роль в аксональной регенерации, через их функцию в качестве ко-рецептора для Nogo-рецептора (WONG et al.,Nature Neurosci., 2002, 5, 1302-1308; Kerracher and Winton, Neuron, 2002, 36, 345-348). Действительно,некоторые миелин-ассоциированные белки (миелин-ассоциированный гликопротеин, MAG, Nogo-A и гликопротеин миелина олигодендроцитов OMgp) ингибируют регенерацию нервов на центральном уровне во время медуллярной травмы или травмы головы. Эти белки локализованы в мембране олигодендроцитов, непосредственно примыкая к аксону, и ингибируют рост аксонов нервной клетки путем связывания с высокой аффинностью с Nogo-рецептором, локализованным на аксональной мембране. Рецептор p75NTR ассоциирован с Nogo-рецептором и вовлечен в передачу сигналов ингибиторных эффектов этих миелиновых белков в отношении к аксональному росту. Как результат, рецептор p75NTR играет главную роль в регулировании нейрональной пластичности и взаимодействиях нейрон-нейроглия и представляет собой терапевтическую мишень выбора для стимулирования регенерации нервов.-1 007501 На периферическом уровне, недавние исследования указывают на увеличение в экспрессии p75NTR и нейротрофинов и массивный апоптоз в атеросклеротических повреждениях. Более того, также отмечается про-ангиогенный и сосудорасширяющий эффект NGF. Наконец, была идентифицирована новая форма p75NTR, которая является укороченной во внеклеточной части, а также его главная роль в установленном васкулогенезе (D. VON SHACK et al., Nature Neuroscience, 2001, 4, 977-978). Все эти недавние данные предполагают, что p75NTR в своей целой или укороченной форме также может играть преобладающую роль в сосудистых патологиях. Известно, что ряд соединений взаимодействует с системой trkA/NGF/p75NTR или обладает активностью NGF-типа. Так, в патентной заявке WO 00/59893 описаны производные замещенного пиримидина,которые демонстрируют активность NGF-типа и/или которые увеличивают активность NGF в отношении клеток РС 12. В патентных заявках WO 00/69828 и WO 00/69829 описаны полициклические соединения,которые ингибируют связывание NGF с рецептором p75NTR в клетках, которые не экспрессируют trkAрецептор. В заявке WO 94/11373 описаны производные пиридазинохиназолона, которые связываются с нейротрофиновым рецептором p75NTR. В заявке WO 94/22866 описаны производные пиразолохиназолона, которые специфически связываются с NGF таким образом, чтобы избежать его присоединения к рецептору p75NTR, но позволяя ему взаимодействовать с trk-рецептором. В заявке WO 01/49684 описаны производные замещенного тетрагидропиридина, которые обладают активностью в отношении модулирования TNF-альфа. В настоящее время обнаружены новые производные 1-пиперазинилацилпиперидина, которые проявляют аффинность в отношении рецептора p75NTR. В настоящем изобретении предложены соединения формулы (I):R1 представляет собой атом галогена; радикал трифторметил; (С 1-С 4)алкил; (С 1-С 4)алкокси; радикал трифторметокси;R2 представляет собой атом водорода или атом галогена;R3 представляет собой атом водорода; группу -OR5; группу -CH2OR5; группу -NR6R7; группу-NR8COR9; группу -NR8CONR10R11; группу -CH2NR12R13; группу -CH2NR8CONR14R15; (С 1-С 4)алкоксикарбонил; группу -CONR16R17; либо R3 образует двойную связь между атомом углерода, к которому он присоединен, и соседним атомом углерода пиперидинового кольца;R4 представляет собой ароматическую группу, выбранную из причем указанные ароматические группы являются незамещенными или являются моно- или дизамещенными заместителем, независимо выбранным из атома галогена; (С 1-С 4)алкила; (С 1-С 4)алкокси; радикала трифторметил;R5 представляет собой атом водорода; (С 1-С 4)алкил; (С 1-С 4)алкилкарбонил;R6 и R7, каждый независимо, представляет собой атом водорода или (C1-С 4)алкил;R8 представляет собой атом водорода или (C1-C4)алкил;R10 и R11, каждый независимо, представляет собой атом водорода или (С 1-С 4)алкил;R12 и R13, каждый независимо, представляет собой атом водорода или (С 1-С 5)алкил; R13 также может представлять собой группу -(СН 2)q-ОН или группу -(CH2)q-S-CH3; либо R12 и R13 вместе с атомом азота, к которому они присоединены, образуют гетероцикл, выбранный из азиридина, азетидина, пирролидина, пиперидина и морфолина;R14 и R15, каждый независимо, представляет собой атом водорода или (С 1-С 4)алкил;R16 и R17, каждый независимо, представляет собой атом водорода или (С 1-С 4)алкил; R17 также может представлять собой группу -(CH2)q-NR6R7; либо R16 и R17 вместе с атомом азота, к которому они присоединены, образуют гетероцикл, выбранный из азетидина, пирролидина, пиперидина, морфолина и пиперазина, который является незамещенным или замещенным по 4 положению (С 1-С 4)алкилом. Соединения формулы (I) могут существовать в форме оснований или солей присоединения кислот. Такие соли присоединения являются частью данного изобретения. Эти соли преимущественно получают с фармацевтически приемлемыми кислотами, хотя соли других кислот, полезных для очистки или выделения соединений формулы (I), также являются частью данного изобретения. Соединения формулы (I) также могут существовать в форме гидратов или сольватов, особенно в форме ассоциатов или комбинаций с одной или более чем одной молекулой воды или с растворителем. Такие гидраты и сольваты также являются частью данного изобретения. Атом галогена представляет собой атом брома, хлора, фтора или йода.(С 1-С 4)Алкил или (С 1-С 5)алкил, соответственно, представляют собой линейный или разветвленный алкильный радикал, имеющий от одного до четырех атомов углерода или от одного до пяти атомов углерода, соответственно, такой как радикал метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил,трет-бутил, пентил, изопентил, неопентил или трет-пентил.(С 1-С 4)Алкокси представляет собой линейный или разветвленный алкоксильный радикал, имеющий от одного до четырех атомов углерода, такой как радикал метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси или трет-бутокси. Среди соединений формулы (I), предложенных данным изобретением, могут быть упомянуты предпочтительные соединения, которые определены следующим образом:R1 находится в 2, 3 или 4 положении фенила и представляет собой радикал трифторметил, атом хлора, радикал метил, метокси или трифторметокси, и R2 представляет собой атом водорода; либо R1 находится в 3 положении фенила и представляет собой радикал трифторметил, и R2 находится в 4 положении фенила и представляет собой атом хлора; и/или R3 представляет собой атом водорода, гидроксил, метокси, (ацетилокси)метил, гидроксиметил, диметиламино, ацетиламино, аминометил, (метиламино)метил, (диметиламино)метил, (диэтиламино)метил, (изопропиламино)метил, (N-метилизопропиламино)метил, (изобутиламино)метил, (N-метилизобутиламино)метил, (изопентиламино)метил, (N-метилизопентиламино)метил, аминокарбонил, азетидин-1-илкарбонил; либо R3 образует двойную связь между атомом углерода, к которому он присоединен,и соседним атомом углерода пиперидинового кольца; и/или R4 представляет собой 2-пиридил, 6-метил-2-пиридил, 3-(трифторметил)-2-пиридил, 5(трифторметил)-2-пиридил, 3-хлор-5-(трифторметил)-2-пиридил, 3-пиридил, 4-пиридил, 3,5-дихлор-4 пиридил, 2-пиразинил, 5-хлор-2-пиразинил, 6-хлор-2-пиразинил, 2-пиримидинил, 4-(трифторметил)-2 пиримидинил, 6-хлор-2-пиримидинил, 4-пиримидинил, 6-хлор-4-пиримидинил, 5-пиримидинил, 3 пиридазинил, 6-хлор-3-пиридазинил, 4-пиридазинил, 3(2 Н)-пиридазинон-5-ил или 3(2H)-пиридазинон-4 ил. Особое предпочтение дано соединениям формулы (I), гдеR1 находится в 2, 3 или 4 положении фенила и представляет собой радикал трифторметил, атом хлора, радикал метил, метокси или трифторметокси, и R2 представляет собой атом водорода; либо R1 находится в 3 положении фенила и представляет собой радикал трифторметил, и R2 находится в 4 положении фенила и представляет собой атом хлора;R3 представляет собой атом водорода, гидроксил, метокси, (ацетилокси)метил, гидроксиметил, диметиламино, ацетиламино, аминометил, (метиламино)метил, (диметиламино)метил, (диэтиламино)метил,(изопропиламино)метил, (N-метилизопропиламино)метил, (изобутиламино)метил, (N-метилизобутиламино)метил, (изопентиламино)метил, (N-метилизопентиламино)метил, аминокарбонил, азетидин-1 илкарбонил; либо R3 образует двойную связь между атомом углерода, к которому он присоединен, и соседним атомом углерода пиперидинового кольца;R4 представляет собой 2-пиридил, 6-метил-2-пиридил, 3-(трифторметил)-2-пиридил, 5-(трифторметил)-2-пиридил, 3-хлор-5-(трифторметил)-2-пиридил, 3-пиридил, 4-пиридил, 3,5-дихлор-4-пиридил, 2 пиразинил, 5-хлор-2-пиразинил, 6-хлор-2-пиразинил, 2-пиримидинил, 4-(трифторметил)-2-пиримидинил,6-хлор-2-пиримидинил, 4-пиримидинил, 6-хлор-4-пиримидинил, 5-пиримидинил, 3-пиридазинил, 6-хлор 3-пиридазинил, 4-пиридазинил, 3(2 Н)-пиридазинон-5-ил, 3(2 Н)-пиридазинон-4-ил; в форме основания или соли присоединения кислоты, а также в форме гидрата или сольвата. Большее предпочтение дано соединениям формулы (I), гдеR1 находится в 2, 3 или 4 положении фенила и представляет собой радикал трифторметил, атом хлора, радикал метокси или трифторметокси, и R2 представляет собой атом водорода; либо R1 находится в 3 положении фенила и представляет собой радикал трифторметил, и R2 находится в 4 положении фенила и представляет собой атом хлора;R3 представляет собой гидроксил, диметиламино, аминометил, (метиламино)метил, (диметиламино) метил, (диэтиламино)метил, (изопропиламино)метил, (изобутиламино)метил, (изопентиламино)метил,(N-метилизопентиламино)метил или аминокарбонил; либо R3 образует двойную связь между атомом углерода, к которому он присоединен, и соседним атомом углерода пиперидинового кольца;R4 представляет собой 2-пиразинил, 4-пиримидинил, 3(2H)-пиридазинон-5-ил или 5-(трифторметил)-2-пиридил; в форме основания или соли присоединения кислоты и в форме гидрата или сольвата. Среди соединений формулы (I), предложенных данным изобретением, конкретное упоминание может быть сделано для следующих соединений: 1-[4-(аминометил)-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1 этанон; 5-[4-[2-[4-гидрокси-4-[3-(трифторметил)фенил]-1-пиперидил]-2-оксоэтил]-1-пиперазинил]-3(2 Н)пиридазинон; 1-[4-гидрокси-4-[2-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1 этанон; 2-[4-(4-пиримидинил)-1-пиперазинил]-1-[4-[3-(трифторметил)фенил]-3,6-дигидро-1(2 Н)-пиридил]1-этанон; 2-[4-(2-пиразинил)-1-пиперазинил]-1-[4-[2-(трифторметил)фенил]-3,6-дигидро-1(2 Н)-пиридил]-1 этанон; 1-[2-[4-(2-пиразинил)-1-пиперазинил]ацетил]-4-[3-(трифторметил)фенил]-4-пиперидинкарбоксамид; 1-[4-(диметиламино)-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]1-этанон; 1-[4-гидрокси-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1 этанон; 1-[4-[(диметиламино)метил]-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон; 1-[4-(4-хлорфенил)-3,6-дигидро-1 (2H)-пиридил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон; 1-[4-гидрокси-4-(3-метоксифенил)-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон; 1-[4-[4-хлор-3-(трифторметил)фенил]-3,6-дигидро-1(2 Н)-пиридил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон; 1-[4-[4-хлор-3-(трифторметил)фенил]-3,6-дигидро-1(2 Н)-пиридил]-2-[4-[5-(трифторметил)-2-пиридил]-1-пиперазинил]-1-этанон; 1-[4-[(метиламино)метил]-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон; 1-[4-[(диэтиламино)метил]-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон; 1-[4-[(изопропиламино)метил]-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон; 1-[4-[(изобутиламино)метил]-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1 -этанон; 1-[4-[(изопентиламино)метил]-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон; 1-[4-[(N-метилизопентиламино)метил]-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон; 1-[4-гидрокси-4-[3-(трифторметокси)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1 этанон; в форме основания или соли присоединения кислоты и в форме гидрата или сольвата. В другом аспекте настоящего изобретения предложен способ получения соединений формулы (I), в которой n = 1, характеризующийся тем, что а 1) соединение формулы в которой R1, R2 и R3 являются такими, как определено для соединения формулы (I), и Hal представляет собой атом галогена, предпочтительно хлора или брома, при условии, что когда R3 содержит гидро-4 007501 ксильную или аминную функциональную группу, эти функциональные группы могут быть защищены,подвергают взаимодействию с соединением формулы в которой р и R4 являются такими, как определено для соединения формулы (I); б 1) и, после снятия защиты с гидроксильной или аминной функциональных групп, присутствующих в R3, когда подходит, получают соединение формулы (I). Когда подходит, соединение формулы (I) превращают в одну из его солей присоединения кислоты. В еще одном аспекте настоящего изобретения предложен способ получения соединений формулы в которой R1, R2 и R3 являются такими, как определено для соединения формулы (I), при условии,что когда R3 содержит гидроксильную или аминную функциональную группу, эти функциональные группы могут быть защищены, подвергают взаимодействию с соединением формулы в которой р и R4 являются такими, как определено для соединения формулы (I); б 2) и, после снятия защиты с гидроксильной или аминной функциональных групп, присутствующих в R3, когда подходит, получают соединение формулы (I). Когда подходит, соединение формулы (I) превращают в одну из его солей присоединения кислоты. На стадии а 1) или на стадии а 2), когда соединение формулы (IIа) или (IIb) подвергают взаимодействию с соединением формулы (III), взаимодействие осуществляют в присутствии основания, выбранного из органических оснований, таких как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин,или из карбонатов или бикарбонатов щелочных металлов, таких как карбонат калия, карбонат натрия или бикарбонат натрия, и в отсутствие или в присутствии йодида щелочного металла, такого как йодид калия или йодид натрия. Реакцию осуществляют в растворителе, таком как ацетонитрил, N,N-диметилформамид, толуол или пропан-2-ол, и при температуре между температурой окружающей среды и температурой флегмообразования растворителя. Когда подходит, на стадии б 1) или на стадии б 2) с гидроксильной или аминной функциональных групп, присутствующих в R3, снимают защиту согласно традиционным способам, хорошо известным специалисту в данной области техники. В одном из вариантов способа, и когда R3 представляет собой группу -CH2NR12R13, в которой R12 иR13 каждый представляет собой водород,а 3) соединение формулы в которой R1, R2 и R3 являются такими, как определено для соединения формулы (I), и Hal представляет собой атом галогена, предпочтительно хлора или брома, подвергают взаимодействию с соединением формулы в которой р и R4 являются такими, как определено для соединения формулы (I), с образованием соединения формулы-5 007501 б 3) цианогруппу соединения формулы (Iа) восстанавливают с образованием соединения формулы(I), в которой R3 представляет собой CH2NH2. Когда подходит, соединение формулы (I) превращают в одну из его солей присоединения кислоты. На стадии а 3) взаимодействие между соединением формулы (IIс) или (IId) и соединением формулы(III) осуществляют так, как описано выше для стадии а 1) или а 2) способа по данному изобретению. На стадии б 3) восстановление цианогруппы соединения формулы (Ia) осуществляют традиционными способами. Так, например, восстановление проводят путем гидрирования в присутствии катализатора, такого как никель Ренея или родий на оксиде алюминия, и в присутствии или в отсутствие аммиака в растворителе, таком как метанол, N,N-диметилформамид или тетрагидрофуран, или смеси этих растворителей и при температуре между температурой окружающей среды и 60 С. В другом варианте способа, и когда R3 образует двойную связь между атомом углерода, к которому он присоединен, и соседним атомом углерода пиперидинового кольца, соединение формулы в которой R1, R2, n, p и R4 являются такими, как определено для соединения формулы (I), подвергают дегидратации с образованием соединения формулы Когда подходит, соединение формулы (I) превращают в одну из его солей присоединения кислоты. Дегидратацию осуществляют с использованием, например, смеси уксусная кислота/соляная кислота или смеси уксусная кислота/серная кислота, при температуре между температурой окружающей среды и 140 С. Реакцию также можно проводить с использованием пара-толуолсульфокислоты в растворителе,таком как толуол, и при температуре между температурой окружающей среды и температурой флегмообразования. Соединение формулы (I), в которой R3 представляет собой группу -CH2NR12R13, в которой R12 = Н,и R13 = (С 1-С 5)алкил, также может быть получено взаимодействием соединения формулы (I), в которойR3 = -CH2NH2, с (C1-С 5)алкилгалогенидом в присутствии основания, такого как карбонат щелочного металла, такой как карбонат калия, в растворителе, таком как ацетонитрил, N,N-диметилформамид или тетрагидрофуран, при температуре между температурой окружающей среды и температурой флегмообразования растворителя. Такую же реакцию используют для получения соединений формулы (I), в которойR12 и R13 представляют собой одинаковый или разный (С 1-С 5)алкил. Соединение формулы (I), в которой R3 представляет собой группу -CH2NR12R13, в которой R12 = H или (С 1-С 5)алкил, и R13 = (С 1-С 5)алкил, группа -(CH2)q-OH или группа -(CH2)q-S-CH3, соответственно,также может быть получено взаимодействием соединения формулы (I), в которой R3 = -CH2-NHR12, с формальдегидом или с альдегидом формулы ОНС-(С 1-С 4)алкил, OHC-(CH2)q-1-OH или OHC-(CH2)q-1-SCH3, соответственно, или с соответствующим кетоном, в присутствии восстановителя, такого как борогидрид натрия или триацетоксиборогидрид натрия, и в присутствии кислоты, такой как уксусная кислота, в растворителе, таком как дихлорметан или тетрагидрофуран, при температуре между 0 С и температурой окружающей среды. Соединение формулы (I), в которой R3 представляет собой группу -CH2NR12R13, в которой R12 и R13 вместе с атомом азота, к которому они присоединены, образуют азиридин, также может быть получено путем циклизации соответствующего промежуточного соединения, в котором R3 представляет собой группу -CH2NH-CH2CH2-Cl, в присутствии основания, такого как карбонат щелочного металла, такой как карбонат калия, и в присутствии йодида щелочного металла, такого как йодид калия, в растворителе,таком как ацетонитрил, и при температуре между температурой окружающей среды и температурой флегмообразования растворителя; соответствующее промежуточное соединение получают путем взаимодействия соединения формулы (I), в которой R3 = -CH2NH2, с хлорацетальдегидом согласно способу,описанному выше. Соединение формулы (I), в которой R3 представляет собой группу -CH2NR12R13, в которой R12 и R13 вместе с атомом азота, к которому они присоединены, образуют азетидин, пирролидин, пиперидин или морфолин, соответственно, также может быть получено взаимодействием соединения формулы (I), в которой R3 = -CH2NH2, с соединением формулы Hal-(CH2)3-Hal, Hal-(CH2)4-Hal, Hal-(CH2)5-Hal или HalCH2CH2-O-CH2CH2-Hal, соответственно, в котором Hal представляет собой атом галогена, предпочтительно хлора или брома, в присутствии основания, такого как карбонат щелочного металла, такой как карбонат калия, или в присутствии йодида щелочного металла, такого как йодид калия, в растворителе,-6 007501 таком как ацетонитрил, этиленгликоль или смесь этих растворителей, и при температуре между температурой окружающей среды и температурой флегмообразования растворителя. Соединение формулы (I), в которой R3 представляет собой группу -CH2NR8CONR14R15, в которой R8= R14 = R15 = Н, также может быть получено взаимодействием соединения формулы (I), в которой R3 =-CH2NH2, с триметилсилилизоцианатом в растворителе, таком как дихлорметан, при температуре между температурой окружающей среды и температурой флегмообразования растворителя с последующим гидролизом в кислой среде. Соединение формулы (I), в которой R3 представляет собой группу -CONR16R17 также может быть получено взаимодействием соответствующего промежуточного соединения, в котором R3 представляет собой карбоксил, с соединением формулы HNR16R17 традиционными способами пептидного сочетания; соответствующее промежуточное соединение получают традиционными способами: кислотной или щелочной обработкой соединения формулы (I), в которой R3 представляет собой (С 1-С 4)алкоксикарбонил,или взаимодействием соединения формулы (Ia) с сильным основанием, таким как гидроксид щелочного металла, такой как гидроксид калия, в растворителе, таком как толуол или этиленгликоль, при температуре между температурой окружающей среды и температурой флегмообразования растворителя. Соединение формулы (I), в которой R3 представляет собой группу -NR8COR9, в которой R9=-(CH2)mNR6R7, также может быть получено взаимодействием соответствующего промежуточного соединения, в котором R3 представляет собой группу -NR8CO(CH2)m-Hal, и Hal представляет собой атом галогена,предпочтительно хлора, с избытком соединения формулы HNR6R7 в растворителе, таком как дихлорметан или этанол, при температуре между температурой окружающей среды и температурой флегмообразования растворителя; соответствующее промежуточное соединение получают взаимодействием соединения формулы (I), в которой R3=-NHR8, с соединением формулы Hal-CO-(CH2)m-Hal, в которой Hal представляет собой атом галогена, предпочтительно хлора или брома, в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин, в растворителе, таком как дихлорметан, и при температуре между 0 С и температурой окружающей среды. Соединение формулы (I), в которой R3 представляет собой группу -CH2OR5, в которой R5 представляет собой атом водорода, также может быть получено кислотной или щелочной обработкой соединения формулы (I), в которой R3 представляет собой группу -CH2OR5, в которой R5 представляет собой (С 1 С 4)алкилкарбонил. Полученные таким образом соединения формулы (I) затем могут быть отделены от реакционной среды и очищены традиционными способами, например, кристаллизацией или хроматографией. Полученные таким образом соединения формулы (I) выделяют в форме свободного основания или соли в соответствии с традиционными методиками. Соединения формулы (IIа) получают путем осуществления взаимодействия производного пиперидина формулы в которой R1, R2 и R3 являются такими, как определено для соединения формулы (I), с соединением формулы в которой Hal и Hal' каждый независимо представляет собой атом галогена, предпочтительно хлора или брома. Реакцию проводят в присутствии основания, такого как триэтиламин, N,N'-диизопропилэтиламин или N-метилморфолин, в растворителе, таком как дихлорметан, хлороформ, тетрагидрофуран,диоксан, или смеси этих растворителей и при температуре между 0 С и температурой окружающей среды. Соединения формулы (IIb) получают взаимодействием соединения формулы (IV) с соединением формулы в которой Hal и Hal' являются такими, как определено выше, в рабочих условиях, упомянутых выше. Аналогично, соединения формулы (IIс) или (IId), соответственно, получают взаимодействием соединения формулы в которой R1 и R2 являются такими, как определено для соединения формулы (I), с соединением формулы (V) или (VI), соответственно, в таких же рабочих условиях, как упомянуто выше. Соединения формулы (V) или (VI) имеются в продаже, являются известными, или их получают известными способами. Соединения формулы (III) имеются в продаже, или их получают известными способами, такими как описано в J. Org. Chem., 1953, 18, 1484-1488, J. Med. Chem., 1978, 21 (6), 536-542, Chem. Pharm. Bull.,1991, 39 (9), 2288-2300, Tetrahedron Letters, 1998, 39, 617-620, или в WO 97/28129. Например, соединение формулы (III) получают взаимодействием соединения формулы в которой р является таким, как определено для соединения формулы (I), и W представляет собой водород или N-защитную группу, с соединением формулыHal-R4 в которой R4 является таким, как определено для соединения формулы (I), и Hal представляет собой атом галогена, предпочтительно хлора, брома или йода. Реакцию проводят в присутствии или отсутствие основания, в инертном растворителе, таком как этанол, пропан-2-ол, н-бутанол, ацетонитрил или толуол, при температуре между 0 С и температурой флегмообразования растворителя. Если используют основание, то его выбирают из органических оснований, таких как диизопропилэтиламин, или из карбонатов щелочных металлов, таких как карбонат натрия или калия. В отсутствие основания реакцию проводят с использованием избытка соединения формулы (VII). Также реакцию можно проводить без растворителя, путем нагревания смеси соединений(VII) и (VIII) при температурах порядка от приблизительно 140 С до 180 С. Когда подходит, когда W представляет собой N-защитную группу, ее удаляют традиционными способами, получая ожидаемые соединения формулы (III). Соединения формулы (VII) или формулы (VIII) являются известными, или их получают известными способами. Соединения формулы (IV) имеются в продаже, являются известными, или их получают известными способами, такими как описано в ЕР 0474561, ЕР 0673928 или WO 96/23787. Соединения формулы (IV) обычно получают в форме, в которой атом азота пиперидина защищен; после стадии снятия защиты получают сами соединения формулы (IV). В частности, соединение формулы (IV), в которой R3 представляет собой группу -OR5, в которой R5= H, получают взаимодействием магнийорганического производного формулы в которой R1 и R2 являются такими, как определено для соединения формулы (I), и Hal представляет собой атом галогена, предпочтительно брома, с 1-бензил-4-пиперидиноном в растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре между температурой окружающей среды и температурой флегмообразования растворителя. Магнийорганические производные формулы (IX) получают из соответствующих галогенированных производных традиционными способами, хорошо известными специалисту в данной области техники. Соединения формулы (IV), в которой R3 = -OR5, где R5 представляет собой (С 1-С 4)алкил или (С 1-С 4) алкилкарбонил, соответственно, получают из соединений формулы (IV), в которой R3 = -ОН, путем реакции алкилирования или ацилирования, соответственно, способами, которые известны специалисту в данной области техники. Соединения формулы (IV), в которой R3 = -ОН, и которые несут защитную группу на атоме азота пиперидина, могут быть подвергнуты реакции Риттера путем воздействия ацетонитрила в кислой среде,с получением соединений формулы (IV), в которой R3 = -NHCOCH3, способом, описанным в ЕР 0474561. Затем применяют гидролиз в сильно кислой среде с получением соединений формулы (IV), в которой R3= -NR6R7, где R6 = R7 = H. Способы, описанные в ЕР 0673928 или WO 96/23787 используют для получения соединений формулы (IV), в которой R3 = -NR6R7, где R6 и/или R7 представляет собой (С 1-С 4)алкил. Соединения формулы (IV), в которой R3 = -NReCOR9, где R9 представляет собой (С 1-С 4)алкил, либоR3 = -NR8CONR10R11, либо R3 = -CH2NR12R13, где R12 и R13 каждый независимо представляет собой водо-8 007501 род или (С 1-С 4)алкил, либо R3 = -CH2NR8CONR14R15, либо R3 = (С 1-С 4)алкоксикарбонил, либоR3=-CONR16R17, получают способами, описанными в WO 96/23787. Соединение формулы (IV), в которой R3 = -CH2NR12R13, где R12 = R13 = H, получают из соединения формулы (IVa) способом, описанным выше для соединения формулы (I). Соединение формулы (IV), в которой R3 = -NR8COR9, где R9 = -(CH2)mNR6R7, получают способом,описанным выше для соединения формулы (I). Соединение формулы (IV), в которой R3=-CH2NR12R13, где R12 = Н или (С 1-С 5)алкил, и R13=(С 1 С 5)алкил, группа -(CH2)q-OH или группа -(CH2)q-S-CH3, получают способом, описанным выше для соединения формулы (I). Соединение формулы (IV), в которой R3 = -CH2NR12R13, где R12 = H, и R13 = -СН 3, также может быть получено путем восстановления соответствующего промежуточного соединения, в которомR3=-CH2NHCHO, с использованием восстановителя, такого как алюмогидрид лития, в растворителе, таком как эфир или тетрагидрофуран, при температуре между температурой окружающей среды и температурой флегмообразования растворителя. Соответствующее промежуточное соединение получают взаимодействием соединения формулы (IV), в которой R3=-CH2NH2, с этилформиатом при температуре между температурой окружающей среды и 60 С. Соединение формулы (IV), в которой R3=-CH2NR12R13, где R12 и R13 вместе с атомом азота, к которому они присоединены, образуют азиридин, азетидин, пирролидин, пиперидин или морфолин, получают способами, описанными выше для соединения формулы (I). Соединение формулы (I), в которой R3=-CONR16R17, где R16=R17=H, также может быть получено взаимодействием соединения формулы (IVa), с защищенным атомом азота пиперидина, с пероксидом водорода в присутствии сильного основания, такого как гидроксид щелочного металла, такой как гидроксид натрия, и катализатора фазового переноса, такого как соль замещенного четвертичного аммония,например хлорид триэтиламмония, в растворителе, таком как толуол в смеси с водой, при температуре между температурой окружающей среды и температурой флегмообразования растворителя. Соединения формулы (IVa) получают известными способами, такими как описано в Bioorg. Med.Chem. Lett., 1999, 9, 3273-3276 и в J. Med. Chem., 1999, 42 (23), 4778-4793. Соединения формулы (IV), в которой R3=-CH2OR5, где R5 представляет собой (С 1-С 4)алкил или (С 1 С 4)алкилкарбонил, соответственно, получают из соединений формулы (IV), в которой R3=-CH2OH, путем реакции алкилирования или ацилирования, соответственно, способами, известными специалисту в данной области техники. Соединения формулы (IV), в которой R3=-CH2OR5, где R5 представляет собой атом водорода, получают путем восстановления соединения формулы (IV), в которой R3 представляет собой метоксикарбонил, способами, известными специалисту в данной области техники. Соединения формулы (IV), в которой R3 представляет собой (С 1-С 4)алкоксикарбонил, получают реакцией этерификации соответствующего промежуточного соединения, в котором R3 представляет собой карбоксил, способами, известными специалисту в данной области техники; соответствующее промежуточное соединение получают взаимодействием соединения формулы (VIa) с сильным основанием, таким как гидроксид щелочного металла, такой как гидроксид калия, в растворителе, таком как толуол или этиленгликоль, при температуре между температурой окружающей среды и температурой флегмообразования растворителя. Во время любой стадии получения соединений формулы (I) или промежуточных соединений формулы (Iа), (IIа), (IIb), (IIc), (IId), (III) или (IV) может быть необходимо и/или желательно защитить чувствительные или реакционноспособные функциональные группы, такие как аминные, гидроксильные или карбоксильные группы, которые присутствуют на какой-либо из рассматриваемых молекул. Эту защиту можно проводить с использованием традиционных защитных групп, таких как группы, описанные в Protective Groups in Organic Chemistry, J.F.W. McOmie, Ed., Plenum Press, 1973; в Protective Groups in OrganicP.J., 1994, Georg Thieme Verlag. Защитные группы можно удалять на подходящей последующей стадии с использованием способов, которые известны специалисту в данной области техники и которые не оказывают вредное воздействие на остальную часть рассматриваемой молекулы.N-защитные группы, используемые в подходящих случаях, являются традиционными N-защитными группами, которые хорошо известны специалисту в данной области техники, такими как, например, третбутоксикарбонильная, флуоренилметоксикарбонильная, бензильная, бензгидрилиденовая или бензилоксикарбонильная группа. В другом из аспектов данного изобретения дополнительно предложены соединения формулы (Ia). Эти соединения являются полезными в качестве промежуточных веществ для синтеза соединений формулы (I). Соответственно, в другом из аспектов данного изобретения предложены соединения формулыR1 представляет собой атом галогена; радикал трифторметил; (С 1-С 4)алкил; (С 1-С 4)алкокси; радикал трифторметокси;R2 представляет собой атом водорода или атом галогена;R4 представляет собой ароматическую группу, выбранную из причем указанные ароматические группы являются незамещенными или моно- или дизамещенными заместителем, независимо выбранным из атома галогена, (С 1-С 4)алкила, (C1-C4)алкокси, радикала трифторметил; в форме основания или соли присоединения кислоты, и в форме гидрата или сольвата. Следующие примеры описывают получение некоторых соединений по данному изобретению. Эти примеры не являются ограничивающими и только иллюстрируют настоящее изобретение. Ряд полученных в примерах соединений упоминается в табл. 1 ниже, в которой приведены химические структуры и физические свойства некоторых соединений по данному изобретению. На подготовительных стадиях и в примерах использованы следующие сокращения: эфир: диэтиловый эфир; изоэфир: диизопропиловый эфир; ДМСО: диметилсульфоксид; ДМФА: N,N-диметилформамид; ТГФ: тетрагидрофуран; ДХМ: дихлорметан;AcOEt: этилацетат; ДИПЭА: диизопропилэтиламин; ТФУ: трифторуксусная кислота; ВОР: гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония; РуВОР: гексафторфосфат бензотриазол-1-илокситрипирролидинфосфония; 2 н. хлористо-водородный эфир: 2 н. раствор соляной кислоты в диэтиловом эфире; т.пл.: температура плавления; ТОС: температура окружающей среды; т.кип.: температура кипения; ВЭЖХ: высоко-эффективная жидкостная хроматография;Silica Н: силикагель 60 Н (приобретен у Merck, Darmstadt); Буферный раствор с рН = 2: раствор 16,66 г KHSO4 и 32,32 г K2SO4 в 1 л воды. Спектры протонного магнитного резонанса (1 Н ЯМР) регистрировали при 200 МГц в ДМСО-d6 с использованием пика ДМСО-d6 в качестве контрольного пика. Химические сдвигивыражали в миллионных долях (ppm, млн-1). Наблюдаемые сигналы отображали следующим образом: s: синглет; bs: широкий синглет; d: дублет; sd: расщепленный дублет; t: триплет; st: расщепленный триплет; q: квадруплет;unres. соmр.: неразрешенный комплекс; mt: мультиплет. ЯМР-спектры подтверждают структуры данных соединений. Соединения по данному изобретению анализировали путем сочетания методов ЖХ/УФ/МС (жидкостной хроматографии/детекции в ультрафиолетовой области/масс-спектрометрии). Выполненная проверка показала, что масс-спектры соединений, полученные методом "положительного" электрораспыления (ESI+), согласуются с рассчитанной молекулярной массой. Основным пиком в масс-спектрах соединений по изобретению обычно является молекулярный ион МН+.- 10007501 Подготовительные стадии 1. Получение соединений формул (IV) и (IVa). Подготовительная стадия 1.1 Гидрохлорид 4-[3-(трифторметил)фенил]-4-пиперидинола.(IV), HCl: R1 = 3-CF3; R2 = H; R3 = -ОН. А) Гидрохлорид 1-бензил-4-[3-(трифторметил)фенил]-4-пиперидинола. Смесь 180 г магния в 2670 мл ТГФ нагревают до 30 С и смешивают с 33 мл раствора 1670 г 1-бром 3-(трифторметил)бензола в 1330 мл ТГФ, а затем, медленно, с оставшейся частью раствора, так чтобы привести к флегмообразованию ТГФ, а потом поддерживать этот процесс, и оставляют нагреваться с обратным холодильником и перемешиванием в течение 2 ч. Затем медленно добавляют раствор 1000 г 1 бензил-4-пиперидинона в 3200 мл ТГФ и смесь нагревают с обратным холодильником в течение 2 ч. После охлаждения до ТОС реакционную смесь в течение 30 мин добавляют к раствору 1870 г хлорида аммония в 6700 мл воды и смесь оставляют перемешиваться при 20-25 С в течение 2 ч. После декантации органическую фазу промывают 5330 мл воды и под вакуумом выпаривают растворитель. Остаток переносят в 5330 мл эфира, медленно добавляют раствор 210 г HCl (г) в 800 мл пропан-2-ола, поддерживая температуру ниже 25 С, смесь оставляют перемешиваться в течение 40 мин и образовавшиеся кристаллы отделяют отсасыванием. Кристаллы переносят в 2000 мл эфира и снова отделяют отсасыванием. После перекристаллизации из смеси пропан-2-ол/EtOH (70/30; об./об.) получают 1080 г ожидаемого продукта. Б) Гидрохлорид 4-[3-(трифторметил)фенил]-4-пиперидинола. Смесь 1000 г соединения, полученного на предыдущей стадии, и 83 г 10%-ного палладия на угле(содержание влаги 50%) в 2910 мл EtOН и 2910 мл МеОН гидрируют при 50 С под давлением 200 кПа (2 бар). Катализатор отфильтровывают, дважды промывают 660 мл МеОН и под вакуумом концентрируют фильтрат и промывные воды. Остаток переносят в 3320 мл эфира и оставляют перемешиваться при ТОС в течение 1 ч 30 мин. Образовавшийся осадок отделяют отсасыванием, промывают 280 мл эфира и сушат под вакуумом при 40 С. Получают 726 г ожидаемого продукта. Подготовительная стадия 1.2. 4-Метокси-4-[3-(трифторметил)фенил]пиперидин.(IV): R1= 3-CF3; R2 = H; R3 = -ОСН 3. А) трет-Бутил-4-гидрокси-4-[3-(трифторметил)фенил]-1 -пиперидин-карбоксилат. 20 г соединения, полученного на подготовительной стадии 1.1, в 80 мл ДХМ смешивают при ТОС с 17,92 г триэтиламина, а затем по каплям с раствором 16,3 г ди-трет-бутилдикарбоната в 20 мл ДХМ и смесь оставляют перемешиваться при ТОС в течение 18 ч. К реакционной смеси добавляют воду, затем смесь экстрагируют ДХМ, органическую фазу промывают водой и 5%-ным раствором KHSO4 и сушат над Na2SO4 и под вакуумом выпаривают растворитель. После перекристаллизации из смеси изоэфир/гексан получают 13 ожидаемого продукта. Б) трет-Бутил-4-метокси-4-[3-(трифторметил)фенил]-1-пиперидин-карбоксилат. Раствор 2 г соединения, полученного на предыдущей стадии, в 15 мл ДМФА и 20 мл ТГФ смешивают порциями и при ТОС с 0,277 г гидрида натрия с концентрацией 60% в масле и смесь оставляют перемешиваться в течение 40 мин. Затем добавляют 1,3 г метилйодида и смесь оставляют перемешиваться в течение 2 ч. Реакционную смесь концентрируют под вакуумом, остаток переносят в воду и экстрагируют AcOEt, органическую фазу промывают водой и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 2 г ожидаемого продукта в виде желтого масла. В) 4-Метокси-4-[3-(трифторметил)фенил]пиперидин. Смесь 2 г соединения, полученного на предыдущей стадии, и 5 мл ТФУ в 15 мл ДХМ оставляют перемешиваться при ТОС в течение 1 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ДХМ, органическую фазу промывают 5%-ным раствором Na2CO3 и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 1,7 г ожидаемого продукта в виде масла оранжевого цвета. Подготовительная стадия 1.3.A) 1-Бензил-4-[3-(трифторметил)фенил]-4-пиперидинол. Раствор 20 г соединения, полученного на подготовительной стадии 1.1 (свободного основания), и 11,3 мл триэтиламина в 200 мл ДХМ охлаждают на ледяной бане, по каплям добавляют 11 мл бензилбромида и смесь оставляют перемешиваться при ТОС в течение ночи. Смесь концентрируют под вакуумом, остаток переносят в насыщенный раствор K2 СО 3 и экстрагируют AcOEt, органическую фазу промывают насыщенным раствором K2 СO3 и насыщенным раствором NaCl и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Маслянистый остаток переносят в пентан и образовавшийся осадок отделяют отсасыванием. Получают 17 г ожидаемого продукта. Б) N-[1 -Бензил-4-[3-(трифторметил)фенил]-4-пиперидил]ацетамид.- 11007501 60 мл концентрированной H2SO4 охлаждают на ледяной бане, по каплям добавляют раствор 16 г соединения, полученного на предыдущей стадии, в 120 мл ацетонитрила, поддерживая при этом температуру реакционной среды ниже 30 С, и смесь оставляют перемешиваться в течение ночи, во время которой температура возвращается до ТОС. Реакционную смесь выливают на лед, делают среду щелочной путем добавления концентрированного раствора NaOH и образовавшийся осадок отделяют отсасыванием. Осадок растворяют в ДХМ, органическую фазу промывают водой и сушат над Na2SO4 и под вакуумом выпаривают растворитель. После перекристаллизации из ацетонитрила получают 9,7 г ожидаемого продукта.B) 1-Бензил-4-[3-(трифторметил)фенил]-4-пиперидинамин. Смесь 9,6 г соединения, полученного на предыдущей стадии, 250 мл концентрированного раствораHCl и 250 мл воды нагревают при 150 С в течение ночи. Половину реакционной смеси концентрируют под вакуумом, полученную в результате кислую водную фазу делают щелочной путем добавления концентрированного раствора NaOH и экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 8,1 г ожидаемого продукта, который используют в том виде, как он получен. Г) 1-Бензил-N,N-диметил-4-[3-(трифторметил)фенил]-4-пиперидинамин. Смесь 8,1 г соединения, полученного на предыдущей стадии, 3,5 мл 37%-ного раствора формальдегида в воде и 10 мл уксусной кислоты в 250 мл ТГФ смешивают порциями и при ТОС с 50 г триацетоксиборогидрида натрия и смесь оставляют перемешиваться при ТОС в течение ночи. Добавляют 200 мл МеОН и реакционную смесь нагревают при 70 С в течение 1 ч и концентрируют под вакуумом. Остаток переносят в 1 н. раствор NaOH и экстрагируют ДХМ, органическую фазу промывают водой и сушат надNa2SO4 и под вакуумом выпаривают растворитель. Получают 8,7 г ожидаемого продукта в виде масла,которое затвердевает. Д) N,N-Диметил-4-[3-(трифторметил)фенил]-4-пиперидинамин. Смесь 8,2 г соединения, полученного на предыдущей стадии, 5 г формиата аммония и 2 г 10%-ного палладия на угле в 100 мл МеОН оставляют перемешиваться при ТОС в течение 1 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Остаток переносят в насыщенный раствор К 2 СО 3 и экстрагируют AcOEt, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 4,8 г ожидаемого продукта. Подготовительная стадия 1.4 Гидрохлорид 4-[3-(трифторметил)фенил]-4-пиперидинкарбонитрила.(IVa), HCl: R1 = 3-CF3; R2 = H. А) 2-(2,2-Диэтоксиэтил)-4,4-диэтокси-2-[3-(трифторметил)фенил]бутаннитрил. Смесь 30 г 3-(трифторметил)фенилацетонитрила и 14,4 г амида натрия в 400 мл толуола оставляют перемешиваться при ТОС в течение 5 мин, добавляют 66 мл диэтилацеталя бромацетальдегида, а затем смесь нагревают при 60 С в течение 3 ч. Смесь концентрируют под вакуумом, остаток переносят в воду и экстрагируют эфиром, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле Н, элюируя смесью ДХМ/AcOEt (100/5; об./об.). Получают 26 г ожидаемого продукта. Б) 4-Оксо-2-(2-оксоэтил)-2-[3-(трифторметил)фенил]бутаннитрил. Смесь 23,9 г соединения, полученного на предыдущей стадии, в 90 мл муравьиной кислоты оставляют перемешиваться при 50 С в течение 1 ч. К реакционной смеси добавляют воду, затем смесь экстрагируют AcOEt, органическую фазу промывают водой и 10%-ным раствором NaHCO3 и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 16 г ожидаемого продукта, который непосредственно используют на следующей стадии. В) Гидрохлорид 1-бензил-4-[3-(трифторметил)фенил]-4-пиперидин-карбонитрила. Смесь 16 г соединения, полученного на предыдущей стадии, 6,25 мл бензиламина, 48,6 г триацетоксиборогидрида натрия и 5 капель уксусной кислоты в 150 мл ДХМ оставляют перемешиваться при ТОС в течение ночи. Затем по каплям добавляют 40 мл МеОН и смесь нагревают при 60 С в течение 1 ч. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют AcOEt, органическую фазу промывают 10%-ным раствором NaНСО 3 и водой и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток переносят в насыщенный раствор HCl (г) в эфире и образовавшийся осадок отделяют отсасыванием. Получают 18 г ожидаемого продукта. Г) Гидрохлорид 4-[3-(трифторметил)фенил]-4-пиперидинкарбонитрила. Смесь 2 г соединения, полученного на предыдущей стадии, и 0,2 г 10%-ного палладия на угле в 30 мл МеОН гидрируют при ТОС и атмосферном давлении в течение 3 ч. Катализатор отфильтровывают на целите (Celite) и под вакуумом концентрируют фильтрат. Получают 1,5 г ожидаемого продукта. Это соединение также может быть получено, следуя трем стадиям, указанным ниже: А') трет-Бутил-бис(2-хлорэтил)карбамат. Смесь 106 г гидрохлорида N,N-бис(2-хлорэтил)амина и 130 г ди-трет-бутилдикарбоната в 1500 мл ДХМ по каплям в течение 1 ч 30 мин при ТОС смешивают с 83 мл триэтиламина, затем оставляют перемешиваться при ТОС в течение ночи. Реакционную смесь промывают водой, органическую фазу сушат- 12007501 над Na2SO4 и упаривают под вакуумом. Получают 150 г ожидаемого продукта, который используют в том виде, как он получен. Б') трет-Бутил-4-циано-4-[3-(трифторметил)фенил]-1-пиперидинкарбоксилат. Суспензию 56 г гидрида натрия с концентрацией 60% в масле в 750 мл ДМСО и 250 мл ТГФ смешивают по каплям в атмосфере инертного газа и при ТОС с раствором 120 г 3-(трифторметил)фенилацетонитрила в 250 мл ДМСО, а затем, медленно, с раствором 150 г соединения, полученного на предыдущей стадии, в 250 мл ДМСО и нагревают при 60 С в течение ночи. Реакционную смесь вливают в смесь лед/Н 2 О и экстрагируют эфиром, органическую фазу промывают водой и насыщенным раствором NaCl и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя ДХМ, а затем смесью ДХМ/AcOEt (80/20; об./об.). Получают 191 г ожидаемого продукта, который кристаллизуется; т.пл. = 72-73 С. В') Гидрохлорид 4-[3-(трифторметил)фенил]-4-пиперидинкарбонитрила. Смесь 115 г соединения, полученного на предыдущей стадии, 500 мл 2 н. раствора HCl в эфире и 150 мл МеОН оставляют перемешиваться при ТОС в течение 4 ч. Образовавшийся кристаллический продукт отделяют отсасыванием и сушат. Получают 75 г ожидаемого продукта, т.пл. = 259 С. Подготовительная стадия 1.5. трет-Бутил-[4-[3-(трифторметил)фенил]-4-пиперидил]метилкарбамат.A) [1-Бензил-4-[3-(трифторметил)фенил]-4-пиперидил]метиламин. Смесь 1,5 г соединения, полученного на стадии В подготовительной стадии 1.4, 0,15 г никеля Ренея и 5 мл водного раствора аммиака в 20 мл МеОН гидрируют при ТОС и атмосферном давлении в течение ночи. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Получают 1,45 г ожидаемого продукта. Б) трет-Бутил-[1-бензил-4-[3-(трифторметил)фенил]-4-пиперидил]-метилкарбамат. Смесь 1,45 г соединения, полученного на предыдущей стадии, и 20 мл AcOEt нагревают до 40 С,добавляют 0,9 г ди-трет-бутилдикарбоната, и затем смесь нагревают с обратным холодильником в течение 30 мин. После охлаждения до ТОС ее смешивают с водой и экстрагируют AcOEt, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 1,86 г ожидаемого продукта.B) трет-Бутил-[4-[3-(трифторметил)фенил]-4-пиперидил]метилкарбамат. Смесь 1,8 г соединения, полученного на предыдущей стадии, и 0,18 г 10%-ного палладия на угле в 20 мл МеОН гидрируют при ТОС и атмосферном давлении в течение ночи. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Получают 1,3 г ожидаемого продукта в виде масла. Подготовительная стадия 1.6. 4-[3-(Трифторметил)фенил]-4-пиперидинкарбоксамид.(IV): R1= 3-CF3; R2 = H; R3 = -CONH2. А) 1-Бензил-4-[3-(трифторметил)фенил]-4-пиперидинкарбоксамид. Смесь 5 г соединения, полученного на стадии В подготовительной стадии 1.4, 30 мл толуола, 30 мл 30%-ного раствора Н 2 О 2, 30 мл 30%-ного раствора NaOH и 0,5 г аликвоты 336 (хлорида триоктилметиламмония) нагревают при 100 С в течение 48 ч. Смесь концентрируют под вакуумом, остаток переносят в воду и экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле Н, элюируя смесью ДХМ/МеОН (100/3; об./об.). Получают 2,5 г ожидаемого продукта. Б) 4-[3-(Трифторметил)фенил]-4-пиперидинкарбоксамид. Смесь 2,5 г соединения, полученного на предыдущей стадии, и 0,25 г 10%-ного палладия на угле в 30 мл МеОН гидрируют при ТОС и атмосферном давлении в течение 48 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Получают 1,7 г ожидаемого продукта. Подготовительная стадия 1.7. 4-[2-(Трифторметил)фенил]-4-пиперидинол.(IV): R1 = 2-CF3; R2 = H; R3 = -ОН. А) 1-Бензил-4-[2-(трифторметил)фенил]-4-пиперидинол. Смесь 1,52 г магния в 25 мл ТГФ по каплям в течение 20 мин смешивают с раствором 14,25 г 1 бром-2-(трифторметил)бензола в 15 мл ТГФ и смесь нагревают с обратным холодильником в течение 30 мин. После охлаждения на ледяной бане медленно смешивают с раствором 10 г 1-бензил-4-пиперидинона в 30 мл ТГФ и оставляют перемешиваться при ТОС в течение 3 ч. Реакционную смесь вливают в насыщенный водный раствор хлорида аммония и экстрагируют AcOEt, объединенные органические фазы промывают водой и сушат над Na2SO4 и под вакуумом выпаривают растворители. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/AcOEt (70/30; об./об.). Получают 4,5 г ожидаемого продукта. Б) 4-[2-(Трифторметил)фенил]-4-пиперидинол. Смесь 4,5 г соединения, полученного на предыдущей стадии, и 0,5 г 10%-ного палладия на угле в 100 мл МеОН гидрируют при 35 С и атмосферном давлении в течение ночи. Катализатор отфильтровы- 13007501 вают и под вакуумом концентрируют фильтрат. После перекристаллизации из изоэфира получают 2,7 г ожидаемого продукта. Подготовительная стадия 1.8. Гидрохлорид 4-[2-(трифторметил)фенил]-4-пиперидинкарбонитрила.(IVa), HCl: R1= 2-CF3; R2 = H. А) трет-Бутил-4-циано-4-[2-(трифторметил)фенил]-1-пиперидинкарбоксилат. Суспензию 9 г гидрида натрия с концентрацией 60% в масле в 125 мл ДМСО и 125 мл ТГФ смешивают по каплям и при ТОС с раствором 20 г 2-(трифторметил)фенилацетонитрила в 50 мл ДМСО, а затем, медленно, с раствором 25 г соединения, полученного на стадии А' подготовительной стадии 1.4, в 70 мл ДМСО и смесь нагревают при 60 С в течение 24 ч. Реакционную смесь вливают в 2 л воды и экстрагируют эфиром, органическую фазу промывают водой и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя ДХМ, а затем смесью ДХМ/AcOEt (70/30; об./об.). Получают 16 г ожидаемого продукта. Б) Гидрохлорид 4-[2-(трифторметил)фенил]-4-пиперидинкарбонитрила. Смесь 6 г соединения, полученного на предыдущей стадии, 150 мл 2 н. хлористо-водородного эфира и 20 мл МеОН оставляют перемешиваться при ТОС в течение 2 ч. Смесь концентрируют под вакуумом,остаток переносят в эфир и образовавшийся осадок отделяют отсасыванием. Получают 2,3 г ожидаемого продукта. Подготовительная стадия 1.9. Гидрохлорид метил-4-[3-(трифторметил)фенил]-4-пиперидинкарбоксилата.(IV) HCl: R1 = 3-CF3; R2 = H; R3 = -СООСН 3. А) 1 -Бензил-4-[3-(трифторметил)фенил]-4-пиперидинкарбоновая кислота. Смесь 5 г соединения, полученного на стадии В подготовительной стадии 1.4, и 4,25 г гранулированного KОН в 80 мл этиленгликоля нагревают с обратным холодильником в течение 3 ч. Смесь охлаждают до ТОС и смешивают с 100 мл воды, подкисляют до рН = 6,5 10%-ным раствором HCl и образовавшийся осадок отделяют отсасыванием и сушат под вакуумом. Получают 3,9 г ожидаемого продукта,т.пл. = 243 С. Б) Гидрохлорид метил-1-бензил-4-[3-(трифторметил)фенил]-4-пиперидинкарбоксилата. Смесь 3 г соединения, полученного на предыдущей стадии, и 50 мл тионилхлорида в 100 мл ДХМ нагревают при 60 С в течение 3 ч. Смесь концентрируют под вакуумом, остаток переносят в 100 мл МеОН и нагревают при 60 С в течение ночи. Концентрирование под вакуумом приводит к получению 4 г ожидаемого продукта, т.пл. = 230 С. В) Гидрохлорид метил-4-[3-(трифторметил)фенил]-4-пиперидинкарбоксилата. Смесь 4 г соединения, полученного на предыдущей стадии, и 0,4 г 10%-ного палладия на угле в 200 мл МеОН гидрируют при ТОС и атмосферном давлении в течение ночи. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Получают 2,5 г ожидаемого продукта. Подготовительная стадия 1.10(IV): R1 = 3-CF3; R2 = H; R3 = -CH2-O-CO-CH3. А) 1-(трет-Бутил)-4-метил-4-[3-(трифторметил)фенил]-1,4-пиперидиндикарбоксилат. Смесь 7 г соединения, полученного на подготовительной стадии 1.9, 5,33 г ди-трет-бутилдикарбоната и 3,5 мл триэтиламина в 100 мл ДХМ оставляют перемешиваться при ТОС в течение 2 ч. Смесь концентрируют под вакуумом, остаток переносят в воду и экстрагируют эфиром, органическую фазу промывают водой и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 9,3 г ожидаемого продукта. Б) трет-Бутил-4-(гидроксиметил)-4-[3-(трифторметил)фенил]-1-пиперидинкарбоксилат. Смесь 9,27 г соединения, полученного на предыдущей стадии, в 150 мл эфира охлаждают до 0 С,добавляют 1 г алюмогидрида лития и смесь оставляют перемешиваться при 0 С в течение 4 ч. Реакционную смесь смешивают с насыщенным раствором NH4Cl, неорганические соли отфильтровывают, фильтрат экстрагируют AcOEt, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. После перекристаллизации из эфира получают 5,5 г ожидаемого продукта. В) трет-Бутил-4-[(ацетилокси)метил]-4-[3-(трифторметил)фенил]-1 -пиперидинкарбоксилат. Смесь 5,5 г соединения, полученного на предыдущей стадии, и 2 мл триэтиламина в 50 мл ДХМ охлаждают до -70 С, добавляют 1,1 мл ацетилхлорида и смесь оставляют перемешиваться в течение ночи,во время которой температура возвращается до ТОС. К реакционной смеси добавляют лед, затем смесь экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 6 г ожидаемого продукта. Г) [4-[3-(Трифторметил)фенил]-4-пиперидил]метилацетат. Смесь 6 г соединения, полученного на предыдущей стадии, и 30 мл ТФУ в 50 мл ДХМ оставляют перемешиваться при ТОС в течение 1 ч. Смесь концентрируют под вакуумом, остаток переносят на лед,а затем в 10%-ный раствор NаНСО 3 и экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 4,5 г ожидаемого продукта.(IV): R1 = 4-CF3; R2 = H; R3 = -ОН. А) 1-Бензил-4-[4-(трифторметил)фенил]-4-пиперидинол. Это соединение получают согласно методике, описанной на стадии А подготовительной стадии 1.7,из 1,55 г магния в 25 мл ТГФ, раствора 14,25 г 1-бром-4-(трифторметил)бензола в 15 мл ТГФ и раствора 10 г 1-бензил-4-пиперидинона в 30 мл ТГФ. Получают 7,3 г ожидаемого продукта. Б) 4-[4-(Трифторметил)фенил]-4-пиперидинол. Смесь 4,8 г соединения, полученного на предыдущей стадии, и 2 г 10%-ного палладия на угле в 50 мл МеОН гидрируют при 30 С и атмосферном давлении в течение 2 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. После перекристаллизации из изо-эфира получают 2,4 г ожидаемого продукта. Подготовительная стадия 1.12. Гидрохлорид 4-(4-хлорфенил)-4-пиперидинкарбонитрила.(IVa), HCl: R1 = 4-Cl; R2 = H. А) трет-Бутил-4-(4-хлорфенил)-4-циано-1 -пиперидинкарбоксилат. Суспензию 4,4 г гидрида натрия с концентрацией 60% в масле в 300 мл ТГФ быстро смешивают при ТОС с 7,51 г 4-хлорфенилацетонитрила, а затем с 12 г /трет-бутил-бис(2-хлорэтил)карбамата, нагревают при 40 С в течение 28 ч, а затем оставляют перемешиваться при ТОС в течение ночи. К реакционной смеси добавляют насыщенный раствор хлорида аммония, затем смесь концентрируют под вакуумом для удаления ТГФ, после чего оставшуюся водную фазу экстрагируют эфиром, органическую фазу промывают буферным раствором с рН = 2 и насыщенным раствором NaCl и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 12 г ожидаемого продукта, который используют в том виде,как он получен. Б) Гидрохлорид 4-(4-хлорфенил)-4-пиперидинкарбонитрила. Смесь 18 г соединения, полученного на предыдущей стадии, в 100 мл МеОН и 20 мл концентрированного раствора HCl нагревают при 40-50 С в течение 3 ч. Реакционную смесь концентрируют под вакуумом, остаток дважды переносят в МеОН и каждый раз под вакуумом выпаривают растворитель. После перекристаллизации из ацетона получают 5,85 г ожидаемого продукта. Подготовительная стадия 1.13. 4-(3-Метилфенил)-4-пиперидинол.(IV): R1 = 3-СН 3; R2 = H; R3 = -ОН. А) 1 -Бензил-4-(3-метилфенил)-4-пиперидинол. Это соединение получают согласно методике, описанной на стадии А в подготовительной стадии 1.7, из 1,55 г магния в 25 мл ТГФ, раствора 11 г 3-бромтолуола в 15 мл ТГФ и раствора 10 г 1-бензил-4 пиперидона в 30 мл ТГФ. Полученный продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (97/3; об./об.). Получают 14,5 г ожидаемого продукта. Б) 4-(3-Метилфенил)-4-пиперидинол. Смесь 14,5 г соединения, полученного на предыдущей стадии, и 2 г 10%-ного палладия на угле в 500 мл МеОН гидрируют при 25 С и атмосферном давлении в течение 48 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Получают 8,9 г ожидаемого продукта. Подготовительная стадия 1.14. 4-(3-Метоксифенил)-4-пиперидинол.(IV): R1 = 3-ОСН 3; R2 = H; R3 = -ОН. А) 1-Бензил-4-(3-метоксифенил)-4-пиперидинол. Это соединение получают согласно методике, описанной на стадии А подготовительной стадии 1.7,из 1,55 г магния в 25 мл ТГФ, раствора 12 г 3-броманизола в 15 мл ТГФ и раствора 10 г 1-бензил-4 пиперидона в 30 мл ТГФ. Полученный продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (от 97/3 до 95/5; об./об.). Получают 13,7 г ожидаемого продукта. Б) 4-(3-Метоксифенил)-4-пиперидинол. Смесь 13,7 г соединения, полученного на предыдущей стадии, и 2 г 10%-ного палладия на угле в 500 мл EtOH гидрируют при 25 С и атмосферном давлении в течение 48 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Получают 10,8 г ожидаемого продукта. Подготовительная стадия 1.15. Гидрохлорид N-[4-[4-хлор-3-(трифторметил)фенил]-4-пиперидил]ацетамида.A) 1-Бензил-4-[4-хлор-3-(трифторметил)фенил]-4-пиперидинол. Смесь 15 г 4-[4-хлор-3-(трифторметил)фенил]-4-пиперидинола, 8,3 г K2 СО 3 и 7,18 мл бензилбромида в 80 мл ДМФА оставляют перемешиваться при ТОС в течение 2 дней. Реакционную смесь вливают в воду и экстрагируют AcOEt, нерастворимый продукт отфильтровывают, органическую фазу промывают водой и насыщенным раствором NaCl и сушат над Na2SO4 и под вакуумом выпаривают растворитель.- 15007501 Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (95/5; об./об.). Получают 14,6 г ожидаемого продукта. Б) N-[1-Бензил-4-[4-хлор-3-(трифторметил)фенил]-4-пиперидил]ацетамид. 30 мл концентрированной H2SO4 охлаждают на ледяной бане, по каплям при температуре ниже 15 С добавляют раствор 7,98 г соединения, полученного на предыдущей стадии, в 60 мл ацетонитрила и смесь оставляют перемешиваться при 15 С в течение 2 дней. Реакционную смесь выливают на лед, делают среду щелочной путем добавления гранулированного NaOH, экстрагируют AcOEt, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель с получением неочищенного твердого вещества (7,86 г). Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (от 97/3 до 95/5; об./об.). После перекристаллизации из смеси ДХМ/изо-эфир получают 4,26 г ожидаемого продукта; т.пл. = 198-199 С. В) Гидрохлорид N-[4-[4-хлор-3-(трифторметил)фенил]-4-пиперидил]-ацетамида. Смесь 3,1 г соединения, полученного на предыдущей стадии, и 1,05 г К 2 СО 3 в 25 мл ДХМ оставляют перемешиваться при ТОС в течение 15 мин, затем охлаждают на ледяной бане, смешивают по каплям с раствором 1,2 мл 1-хлорэтилхлорформиата в 5 мл ДХМ и оставляют перемешиваться при 4 С в течение 2 ч. Нерастворимый продукт отфильтровывают, фильтрат концентрируют под вакуумом, остаток переносят в МеОН и под вакуумом выпаривают растворитель. Остаток переносят в 80 мл МеОН, нагревают с обратным холодильником в течение 15 мин и под вакуумом выпаривают растворитель. Получают 2,7 г ожидаемого продукта. Г) трет-Бутил-4-(ацетиламино)-4-[4-хлор-3-(трифторметил)фенил]-1 -пиперидинкарбоксилат. Смесь 2,7 г соединения, полученного на предыдущей стадии, 1,9 мл ДИПЭА и 1,64 г ди-трет-бутилдикарбоната в 20 мл ДХМ оставляют перемешиваться при ТОС в течение 2 ч. Смесь концентрируют под вакуумом и остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (98/2; об./об.). Получают 1,4 г ожидаемого продукта. Д) Гидрохлорид N-[4-[4-хлор-3-(трифторметил)фенил]-4-пиперидил]ацетамида. Суспензию 1,4 г соединения, полученного на предыдущей стадии, в 20 мл диоксана смешивают с 4 мл 2 н. раствора хлористо-водородного эфира и оставляют перемешиваться при ТОС в течение 2 ч. Реакционную смесь концентрируют под вакуумом с образованием ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 1.16. Гидрохлорид 4-[3-(трифторметокси)фенил]-4-пиперидинола.(IV), HCl: R1 = 3-OCF3; R2 = H; R3 = -ОН. А) Гидрохлорид 1-бензил-4-[3-(трифторметокси)фенил]-4-пиперидинола. Это соединение получают согласно методике, описанной на стадии А подготовительной стадии 1.7,из 2 г магния в 25 мл ТГФ, раствора 20 г 1-бром-3-(трифторметокси)бензола в 15 мл ТГФ и раствора 13 г 1-бензил-4-пиперидона в 30 мл ТГФ. В 2 н. растворе хлористо-водородного эфира образуется гидрохлорид получаемого продукта. Получают 24,4 г ожидаемого продукта. Б) Гидрохлорид 4-[3-(трифторметокси)фенил]-4-пиперидинола. Смесь 24 г соединения, полученного на предыдущей стадии, 16 г формиата аммония и 2 г 10%-ного палладия на угле в 500 мл МеОН оставляют перемешиваться при ТОС в течение 4 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Остаток переносят в насыщенный растворK2 СО 3 и экстрагируют эфиром, органическую фазу промывают насыщенным раствором NaCl и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток переносят в 2 н. раствор хлористоводородного эфира и образовавшийся осадок отделяют отсасыванием. Получают 6,2 г ожидаемого продукта, т.пл. = 145-146 С. Подготовительная стадия 1.17. трет-Бутилметил-4-[3-(трифторметил)фенил]пиперидин-4-ил]метил]-карбамат.(IV): R1 = 3-CF3; R2 = H; R3 = -СН 2N(СН 3)-СООС(СН 3)3. А) N,N-Бис(2-хлорэтил)бензиламин. Смесь 150 г гидрохлорида N,N-бис(2-хлорэтил)амина и 100 мл бензилбромида в 1000 мл ДМФА охлаждают на ледяной бане, затем по каплям добавляют 120 мл триэтиламина и смесь оставляют перемешиваться при ТОС в течение ночи. Реакционную смесь концентрируют под вакуумом, остаток переносят в воду и 3 раза экстрагируют эфиром, органические фазы сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 113 г ожидаемого продукта. Б) Гидрохлорид 1-бензил-4-[3-(трифторметил)фенил]-4-пиперидинкарбонитрила. Суспензию 23,24 г гидрида натрия с концентрацией 60% в масле в 100 мл ДМСО и 100 мл ТГФ смешивают по каплям в атмосфере инертного газа и при ТОС с раствором 50 г 3-(трифторметил)фенилацетонитрила в 150 мл ДМСО и смесь оставляют перемешиваться в течение 15 мин. Затем в течение 1 ч добавляют раствор 62,43 г соединения, полученного на предыдущей стадии, в 150 мл ДМСО и смесь оставляют перемешиваться при ТОС в течение ночи. Добавляют смесь лед/вода, эту систему экстрагируют эфиром, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток пере- 16007501 носят в 1000 мл горячего EtOH, систему оставляют перемешиваться при ТОС в течение 48 ч и образовавшийся кристаллический продукт отделяют отсасыванием. Получают 50 г ожидаемого продукта. В) [1-Бензил-4-[3-(трифторметил)фенил]-4-пиперидил]метиламин. 30 г соединения, полученного на предыдущей стадии, растворяют в 10%-ном растворе NaOH и экстрагируют эфиром, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Продукт в форме свободного основания переносят в 500 мл МеОН и 30 мл 20%-ного водного раствора аммиака. Добавляют 3 г никеля Ренея и систему гидрируют при ТОС и атмосферном давлении в течение ночи. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Остаток переносят в воду и экстрагируют AcOEt, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 27 г ожидаемого продукта. Г) 1-Бензил-4-[3-(трифторметил)фенил]-4-пиперидил]метил]формамид. Смесь 27 г соединения, полученного на предыдущей стадии, и 300 мл этилформиата оставляют перемешиваться при ТОС в течение ночи, затем нагревают при 60 С в течение 6 ч и оставляют перемешиваться при ТОС в течение 48 ч. Смесь концентрируют под вакуумом, остаток переносят в 10%-ный раствор HCl, кислую водную фазу промывают эфиром, добавляют лед, смесь делают щелочной путем добавления 10%-ного раствора NaOH и экстрагируют эфиром, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле Н, элюируя ДХМ, а затем смесью ДХМ/МеОН (100/4; об./об.). Получают 20 г ожидаемого продукта. Д) 1-Бензил-4-[3-(трифторметил)фенил]-4-пиперидил]метил]метиламин. Суспензию 4 г алюмогидрида лития в 400 мл эфира смешивают при ТОС с 20 г соединения, полученного на предыдущей стадии, а затем оставляют перемешиваться при ТОС в течение 16 ч. Затем последовательно добавляют 3 мл воды, 3 мл 30%-ного NaOH и 1 мл воды и смесь оставляют перемешиваться. Неорганические соли отфильтровывают на целите, фильтрат декантируют, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 18 г ожидаемого продукта. Е) трет-Бутил-1-бензил-4-[3-(трифторметил)фенил]-4-пиперидил]метил]метилкарбамат. Смесь 18 г соединения, полученного на предыдущей стадии, и 9,6 г ди-трет-бутилдикарбоната в 300 мл ДХМ оставляют перемешиваться при ТОС в течение 1 ч. К реакционной смеси добавляют воду, затем смесь экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле Н, элюируя смесью ДХМ/МеОН (100/2; об./об.). Получают 21 г ожидаемого продукта. Ж) трет-Бутилметил-4-[3-(трифторметил)фенил]пиперидин-4-ил]метил]карбамат. Смесь 21 г соединения, полученного на предыдущей стадии, и 2 г 10%-ного палладия на угле в 300 мл МеОН гидрируют при ТОС и атмосферном давлении в течение 12 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Получают 16 г ожидаемого продукта. Подготовительная стадия 1.18. Гидрохлорид 4-(3-хлорфенил)-4-пиперидинкарбонитрила.(IVa), HCl: R1= 3-Cl; R2 = H. А) трет-Бутил-4-(3-хлорфенил)-4-цианопиперидин-1-карбоксилат. Суспензию 15,8 г гидрида натрия с концентрацией 60% в масле в 400 мл ДМСО смешивают по каплям при ТОС в атмосфере инертного газа с раствором 30 г 3-хлорфенилацетонитрила в 200 мл ТГФ, затем с раствором 45,5 г трет-бутил-бис(2-хлорэтил)карбамата в 200 мл ДМСО и нагревают при 60 С в течение ночи. Реакционную смесь вливают в смесь лед/вода и экстрагируют эфиром, органическую фазу промывают водой и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя ДХМ. Получают 33 г ожидаемого продукта. Б) Гидрохлорид 4-(3-хлорфенил)-4-пиперидинкарбонитрила. Смесь 6,7 г соединения, полученного на предыдущей стадии, 100 мл 2 н. раствора хлористоводородного эфира и 20 мл МеОН оставляют перемешиваться при ТОС в течение 3 ч. Смесь концентрируют под вакуумом, остаток переносят в эфир и образовавшийся осадок отделяют отсасыванием. Получают 4,65 г ожидаемого продукта, т.пл. = 198 С. Подготовительная стадия 1.19 Гидрохлорид 4-(3-метоксифенил)-4-пиперидинкарбонитрила.(IVa), HCl: R1 = 3-OCH3; R2 = H. А) трет-Бутил-4-(3-метоксифенил)-4-цианопиперидин-1-карбоксилат. Это соединение получают согласно методике, описанной на стадии А подготовительной стадии 1.8,из 16,3 г гидрида натрия с концентрацией 60% в масле в 400 мл ДМСО, 30 г 3-метоксифенилацетонитрила в 150 мл ТГФ и 47 г трет-бутил-бис(2-хлорэтил)карбамата в 100 мл ДМСО. Получают 54 г ожидаемого продукта. Б) Гидрохлорид 4-(3-метоксифенил)-4-пиперидинкарбонитрила. Смесь 48 г соединения, полученного на предыдущей стадии, 300 мл 2 н. раствора хлористоводородного эфира и 50 мл МеОН оставляют перемешиваться при ТОС в течение 2 ч. Образовавшийся осадок отделяют отсасыванием с получением 30,5 г ожидаемого продукта, т.пл. = 172 С. А) Гидрохлорид 4-(хлорформил)-4-[3-(трифторметил)фенил]пиперидина. Смесь 1 г соединения, полученного на стадии А подготовительной стадии 1.9, и 10 мл тионилхлорида в 10 мл ДХМ нагревают при 60 С в течение 2 ч. Смесь концентрируют под вакуумом с получением 1,05 г ожидаемого продукта, который используют в том виде, как он получен. Б) 4-(Азетидин-1-илкарбонил)-1-бензил-4-[3-(трифторметил)фенил]пиперидин. Смесь 1,05 г соединения, полученного на предыдущей стадии, 0,283 г азетидина и 1,15 мл триэтиламина в 10 мл ДХМ оставляют перемешиваться при ТОС в течение ночи. К реакционной смеси добавляют насыщенный раствор K2 СO3, которую затем экстрагируют ДХМ, экстракт сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (97/3; об./об.). Получают 0,43 г ожидаемого продукта. В) 4-(Азетидин-1-илкарбонил)-4-[3-(трифторметил)фенил]пиперидин. Смесь 0,43 г соединения, полученного на предыдущей стадии, 1 г 10%-ного палладия на угле и 20 мл МеОН гидрируют при 25 С и атмосферном давлении в течение ночи. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Получают 0,33 г ожидаемого продукта, который используют в том виде, как он получен. 2. Получение соединений формулы (II). Подготовительная стадия 2.1. 2-Хлор-1 -[4-[3-(трифторметил)фенил]-1 -пиперидил]-1-этанон.(IIа): R1 = 3-CF3; R2 = Н; R3 = H; Hal = Cl. Смесь 2,5 г 4-[3-(трифторметил)фенил]пиперидина и 4 мл триэтиламина в 30 мл ДХМ охлаждают на ледяной бане, затем смешивают по каплям с 0,85 мл 2-хлорацетилхлорида и оставляют перемешиваться в течение 3 ч. За это время температура возвращается до ТОС. Смесь концентрируют под вакуумом,остаток переносят в 1 н. водный раствор HCl и экстрагируют AcOEt, органическую фазу промывают насыщенным раствором NaCl и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 3,1 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 2.2. 2-Хлор-1-[4-гидрокси-4-[3-(трифторметил)фенил]-1 -пиперидил]-1-этанон.(IIа): R1= 3-CF3; R2 = H; R3 = -ОН; Hal = Cl. Смесь 5 г соединения, полученного на подготовительной стадии 1.1, и 10 мл ДИПЭА в 40 мл ДХМ смешивают по каплям при ТОС с 1,63 мл 2-хлорацетилхлорида и оставляют перемешиваться в течение 30 мин. Реакционную смесь промывают водой, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (97/3; об./об.). Получают 5,5 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 2.3. 1-[4-Гидрокси-4-[3-(трифторметил)фенил]-1-пиперидил]-2-пропен-1-он.(IIb): R1 = 3-CF3; R2 = H; R3 = -ОН. Смесь 5 г соединения, полученного на подготовительной стадии 1.1, и 8 мл триэтиламина в 50 мл ДХМ охлаждают на ледяной бане, затем смешивают по каплям с 2,07 мл 3-бромпропионилхлорида и оставляют перемешиваться в течение 2 ч, в течение которых температура возвращается до ТОС. Реакционную смесь промывают насыщенным раствором K2 СO3 и водой, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (от 98,5/1,5 до 97/3; об./об.). Получают 4,6 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 2.4. 2-Хлор-1-[4-метокси-4-[3-(трифторметил)фенил]-1-пиперидил]-1-этанон.(IIа): R1 = 3-CF3; R2 = H; R3 = -OCH3; Hal = Cl. Смесь 1 г соединения, полученного на подготовительной стадии 1.2, и 1,4 мл триэтиламина в 20 мл ДХМ смешивают по каплям при ТОС с 0,3 мл 2-хлорацетилхлорида и оставляют перемешиваться при ТОС в течение 3 ч. Смесь концентрируют под вакуумом, остаток переносят в 1 н. водный раствор HCl и экстрагируют AcOEt, органическую фазу промывают раствором NaCl и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 1,2 г ожидаемого продукта, который используют в том виде,как он получен. Подготовительная стадия 2.5. 2-Хлор-1-[4-(диметиламино)-4-[3-(трифторметил)фенил]-1-пиперидил]-1-этанон.- 18007501 Смесь 1 г соединения, полученного на подготовительной стадии 1.3, и 1 мл триэтиламина в 20 мл ДХМ охлаждают на ледяной бане, затем смешивают по каплям с 0,35 мл 2-хлорацетилхлорида и оставляют перемешиваться, во время которого температура возвращается до ТОС. Смесь концентрируют под вакуумом, остаток экстрагируют AcOEt, органическую фазу промывают насыщенным раствором K2 СO3 и сушат над Na2SO4 и смесь упаривают под вакуумом. Получают 1,4 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 2.6. 1-(2-Хлорацетил)-4-[3-(трифторметил)фенил]-4-пиперидинкарбонитрил.(IIc): R1 = 3-CF3; R2 = H; Hal = Cl. Смесь 4,8 г соединения, полученного на подготовительной стадии 1.4 (свободного основания), и 2,7 мл триэтиламина в 50 мл ДХМ смешивают по каплям при ТОС с 1,5 мл 2-хлорацетилхлорида и оставляют перемешиваться при ТОС в течение 1 ч. К реакционной смеси добавляют 10%-ный раствор HCl, затем смесь декантируют, органическую фазу промывают 10%-ным раствором NaOH и сушат над Na2SO4 и под вакуумом выпаривают растворитель. После перекристаллизации из эфира получают 3,42 г ожидаемого продукта; т.пл. = 120C. Подготовительная стадия 2.7. трет-Бутил-[1-(2-хлорацетил)-4-[3-(трифторметил)фенил]-4-пиперидил]-метилкарбамат.(IIa): R1 = 3-CF3; R2 = H; R3 = -CH2NHCOOC(CH3)3; Hal = Cl. Смесь 4,95 г соединения, полученного на подготовительной стадии 1.5, и 6,8 мл триэтиламина в 50 мл ДХМ охлаждают на ледяной бане, затем смешивают по каплям с 1,65 мл 2-хлорацетилхлорида и оставляют перемешиваться, во время которого температура возвращается до ТОС. Смесь концентрируют под вакуумом, остаток переносят в насыщенный раствор K2 СО 3 и экстрагируют AcOEt, органическую фазу промывают насыщенным раствором K2 СО 3, буферным раствором с рН = 2 и насыщенным раствором NaCl и сушат над Na2SO4 и смесь упаривают под вакуумом. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/AcOEt (80/20; об./об.). Получают 1,8 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 2.8. 1-(2-Хлорацетил)-4-[3-(трифторметил)фенил]-4-пиперидинкарбоксамид.(IIа): R1 = 3-CF3; R2 = H; R3 = -CONH2; Hal = Cl. Смесь 0,7 г соединения, полученного на подготовительной стадии 1.6, и 0,37 мл триэтиламина в 10 мл ДХМ и 10 мл диоксана смешивают по каплям при ТОС с 0,21 мл 2-хлорацетилхлорида и оставляют перемешиваться при ТОС в течение 2 ч. Смесь концентрируют под вакуумом, остаток переносят в воду и образовавшийся осадок отделяют отсасыванием и сушат. Получают 0,82 г ожидаемого продукта, т.пл. = 195-198 С. Подготовительная стадия 2.9. 2-Хлор-1-[4-гидрокси-4-[2-(трифторметил)фенил]-1-пиперидил]-1-этанон.(IIа): R1 = 2-CF3; R2 = H; R3 = -ОН; Hal = Cl. Смесь 1,8 г соединения, полученного на подготовительной стадии 1.7, и 1 мл триэтиламина в 20 мл ДХМ охлаждают на ледяной бане, затем смешивают по каплям с 0,65 мл 2-хлорацетилхлорида и оставляют перемешиваться в течение 1 ч, во время которого температура возвращается до ТОС. К реакционной смеси добавляют воду, смесь концентрируют под вакуумом для удаления ДХМ и подвергают экстракции AcOEt, органическую фазу промывают водой и насыщенным раствором NaCl и сушат надNa2SO4 и под вакуумом выпаривают растворитель. Получают 1,8 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 2.10. 1-(2-Хлорацетил)-4-[2-(трифторметил)фенил]-4-пиперидинкарбонитрил.(IIc): R1 = 2-CF3; R2 = H; Hal = Cl. Смесь 2,1 г соединения, полученного на подготовительной стадии 1.8, и 2 мл триэтиламина в 20 мл ДХМ смешивают при ТОС с 0,6 мл 2-хлорацетилхлорида и оставляют перемешиваться в течение 30 мин. Смесь концентрируют под вакуумом, остаток переносят в 10%-ный раствор HCl и экстрагируют AcOEt,органическую фазу промывают водой, насыщенным раствором K2 СО 3 и насыщенным раствором NaCl и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 2,3 г ожидаемого продукта. Подготовительная стадия 2.11.(IIа): R1 = 3-CF3; R2 = H; R3 = -CH2OCOCH3; Hal = Cl. Смесь 1 г соединения, полученного на подготовительной стадии 1.10, и 0,46 мл триэтиламина в 20 мл ДХМ охлаждают до 0 С, добавляют 0,27 мл 2-хлорацетилхлорида и смесь оставляют перемешиваться при 0 С в течение 30 мин. К реакционной смеси добавляют воду, смесь экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 0,9 г ожидаемого продукта. Подготовительная стадия 2.12. 2-Хлор-1-[4-гидрокси-4-[4-(трифторметил)фенил]-1-пиперидил]-1-этанон.(IIa): R1 = 4-CF3; R2 = H; R3 = -ОН; Hal = Cl. Смесь 1,2 г соединения, полученного на подготовительной стадии 1.11, и 1,2 мл триэтиламина в 20 мл ДХМ охлаждают на ледяной бане, затем смешивают по каплям с 0,38 мл 2-хлорацетилхлорида и оставляют перемешиваться в течение 1 ч, во время которого температура возвращается до ТОС. К реакционной смеси добавляют воду, смесь экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 1,36 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 2.13. 2-Хлор-1-[4-(4-хлорфенил)-4-гидрокси-1 -пиперидил]-1-этанон.(IIa): R1 = 4-Cl; R2 = H; R3 = -ОН; Hal = Cl. Это соединение получают согласно методике, описанной в подготовительной стадии 2.12, из 4-(4 хлорфенил)-4-пиперидинола (имеющегося в продаже) и 2-хлорацетилхлорида. Подготовительная стадия 2.14. 1-(2-Хлорацетил)-4-(4-хлорфенил)-4-пиперидинкарбонитрил.(IIc): R1 = 4-Cl; R2 = H; Hal = Cl. Это соединение получают согласно методике, описанной в подготовительной стадии 2.1, из соединения, полученного на подготовительной стадии 1.12, и 2-хлорацетилхлорида. Подготовительная стадия 2.15. 2-Хлор-1-[4-гидрокси-4-(3-метилфенил)-1-пиперидил]-1-этанон.(IIa): R1 = 3-СН 3; R2 = H; R3 = -ОН; Hal = Cl. Это соединение получают согласно методике, описанной в подготовительной стадии 2.1, из соединения, полученного на подготовительной стадии 1.13, и 2-хлорацетилхлорида. Подготовительная стадия 2.16. 2-Хлор-1-[4-гидрокси-4-(3-метоксифенил)-1-пиперидил]-1-этанон.(IIa): R1= 3-ОСН 3; R2 = H; R3 = -ОН; Hal = Cl. Это соединение получают согласно методике, описанной в подготовительной стадии 2.1, из соединения, полученного на подготовительной стадии 1.14, и 2-хлорацетилхлорида. Подготовительная стадия 2.17. 2-Хлор-1-[4-[4-хлор-3-(трифторметил)фенил]-4-гидрокси-1-пиперидил]-1-этанон.(IIa): R1 = 3-CF3; R2 = 4-Cl; R3 = -OH; Hal = Cl. Это соединение получают согласно методике, описанной в подготовительной стадии 2.1, из 4-[4 хлор-3-(трифторметил)фенил]-4-пиперидинола и 2-хлорацетилхлорида. Подготовительная стадия 2.18.(IIа): R1 = 3-CF3; R2 = 4-Cl; R3 = -NHCOCH3; Hal = Cl. Это соединение получают согласно методике, описанной в подготовительной стадии 2.2, из соединения, полученного на подготовительной стадии 1.15, и 2-хлорацетилхлорида. Подготовительная стадия 2.19. 2-Хлор-1-[4-гидрокси-4-[3-(трифторметокси)фенил]-1-пиперидил]-1-этанон.(IIa): R1 = 3-OCF3; R2 = H; R3 = -ОН; Hal = Cl. Это соединение получают согласно методике, описанной в подготовительной стадии 2.1, из соединения, полученного на подготовительной стадии 1.16, и 2-хлорацетилхлорида. Подготовительная стадия 2.20. трет-Бутил-1-(2-хлорацетил)-4-[3-(трифторметил)фенил]-4-пиперидил]метил]метилкарбамат.(IIa): R1 = 3-CF3; R2 = H; R3 = -CH2N(CH3)COOC(CH3)3; Hal = Cl. Раствор 14 г соединения, полученного на подготовительной стадии 1.17, и 5,5 мл триэтиламина в 300 мл ДХМ охлаждают до -40 С, медленно добавляют 3,1 мл 2-хлорацетилхлорида и смесь оставляют перемешиваться, во время которого температура возвращается до ТОС. Смесь концентрируют под вакуумом, остаток переносят в воду и экстрагируют AcOEt, органическую фазу промывают буферным раствором с рН = 2 и водой, сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 15,33 г ожидаемого продукта. Подготовительная стадия 2.21. 1-(2-Хлорацетил)-4-(3-хлорфенил)-4-пиперидинкарбонитрил.(IIc): R1 = 3-Cl; R2 = H; Hal = Cl. Это соединение получают согласно методике, описанной в подготовительной стадии 2.1, из соединения, полученного на подготовительной стадии 1.18, и 2-хлорацетилхлорида. Подготовительная стадия 2.22. 1-(2-Хлорацетил)-4-(3-метоксифенил)-4-пиперидинкарбонитрил.(IIc): R1 = 3-ОСН 3; R2 = H; Hal = Cl. Это соединение получают согласно методике, описанной в подготовительной стадии 2.1, из соединения, полученного на подготовительной стадии 1.19, и 2-хлорацетилхлорида. Подготовительная стадия 2.23.- 20007501 4-(Азетидин-1-илкарбонил)-1-(2-хлорацетил)-4-[3-(трифторметил)фенил]-пиперидин. Это соединение получают согласно методике, описанной в подготовительной стадии 2.1, из соединения, полученного на подготовительной стадии 1.20, и 2-хлорацетилхлорида. 3. Получение соединений формулы (III). Подготовительная стадия 3.1. 1-(2-Пиразинил)пиперазин. Смесь 3 г пиперазина, 1,04 мл 2-хлорпиразина и 1,85 г K2 СО 3 в 100 мл EtOH нагревают с обратным холодильником в течение 48 ч. Реакционную смесь концентрируют под вакуумом, остаток переносят в воду, среду делают щелочной путем добавления 10%-ного NaOH до рН = 10 и подвергают экстракции хлороформом, органическую фазу промывают водой, сушат над Na2SO4 и под вакуумом выпаривают растворитель. После перекристаллизации из гексана получают 1,8 г ожидаемого продукта. Подготовительная стадия 3.2. 1-(3-Пиридил)пиперазин. Это соединение получают согласно методике, описанной в Tetrahedron Letters, 1998, 39, 617-620. Подготовительная стадия 3.3 Тригидрохлорид 3-(1-пиперазинил)пиридазина.A) трет-Бутил-4-(6-хлор-3-пиридазинил)-1-пиперазинкарбоксилат. Смесь 13,52 г трет-бутил-1-пиперазинкарбоксилата, 10,81 г 3,6-дихлорпиридазина и 20 мл триэтиламина в 100 мл н-бутанола нагревают с обратным холодильником в течение 5 ч. Смесь концентрируют под вакуумом и остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/AcOEt (90/10; об./об.). Получают 14 г ожидаемого продукта, который используют в том виде, как он получен. Б) трет-Бутил-4-(3-пиридазинил)-1-пиперазинкарбоксилат. Смесь 10,5 г соединения, полученного на предыдущей стадии, и 2,5 г 10%-ного палладия на угле в 30 мл ДМФА и 250 мл EtOH гидрируют при ТОС и атмосферном давлении в течение ночи. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (от 97/3 до 90/10; об./об.). Получают 9,1 г ожидаемого продукта,который используют в том виде, как он получен.B) Тригидрохлорид 3-(1-пиперазинил)пиридазина. Смесь 3,8 г соединения, полученного на предыдущей стадии, 50 мл 2 н. раствора HCl в эфире и 20 мл МеОН оставляют перемешиваться при ТОС в течение ночи. Смесь концентрируют под вакуумом,остаток переносят в эфир и образовавшийся осадок отделяют отсасыванием. Получают 3 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 3.4. Тригидрохлорид 3-хлор-6-(1 -пиперазинил)пиридазина. Смесь 2,96 г соединения, полученного на стадии А получения 3.3, и 30 мл 6 н. раствора HCl в МеОН оставляют перемешиваться при ТОС в течение ночи. Реакционную смесь концентрируют под вакуумом,остаток переносят в ДХМ несколько раз и каждый раз под вакуумом выпаривают растворитель. Получают 2,6 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 3.5. Дигидрохлорид 4-(1 -пиперазинил)пиримидина.A) трет-Бутил-4-(2-хлор-4-пиримидинил)-1-пиперазинкарбоксилат. Смесь 9,55 г трет-бутил-1-пиперазинкарбоксилата, 7,64 г 2,4-дихлорпиримидина и 8,6 г NaHCO3 в 50 мл EtOH нагревают с обратным холодильником в течение 1 ч. Смесь концентрируют под вакуумом,остаток переносят в воду и экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/AcOEt (от 90/10 до 60/40; об./об.). Разделяют два соединения:- 21007501 менее полярное соединение,соответствующее трет-бутил-4-(4-хлор-4-пиримидинил)-1 пиперазинкарбоксилату, которого получают 1,75 г; более полярное соединение, соответствующее соединению стадии А), которого получают 12,9 г, и которое используют в том виде, как оно получено. Б) Гидрохлорид трет-бутил-4-(4-пиримидинил)-1 -пиперазинкарбоксилата. Смесь 12,9 г соединения, полученного на предыдущей стадии, и 3,2 г 10%-ного палладия на угле в 300 мл МеОН и 100 мл ДМФА гидрируют при ТОС и атмосферном давлении в течение 2 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Получают 13 г ожидаемого продукта, который используют в том виде, как он получен.B) Дигидрохлорид 4-(1-пиперазинил)пиримидина. Смесь 4 г соединения, полученного на предыдущей стадии, 50 мл 2 н. раствора HCl в эфире и 30 мл МеОН оставляют перемешиваться при ТОС в течение 2 ч. Образовавшийся осадок отделяют отсасыванием и промывают эфиром. Получают 3 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 3.6. х Гидрохлорид 5-(1-пиперазинил)пиримидина. А) трет-Бутил-4-(5-пиримидинил)-1 -пиперазинкарбоксилат. В течение 15 мин через смесь 9,3 г трет-бутил-1-пиперазинкарбоксилата, 7,95 г 5-бромпиримидина и 6,5 г трет-бутилата натрия в 250 мл толуола барботируют аргон, которую затем нагревают с обратным холодильником, добавляют 0,277 г ацетата палладия и 1,7 мл три-трет-бутилфосфина, и нагревание с обратным холодильником продолжают в течение 24 ч. Добавляют 0,277 г ацетата палладия и смесь нагревают с обратным холодильником в течение 8 ч. Реакционную смесь охлаждают до ТОС, добавляют воду, смесь подвергают экстракции AcOEt, органическую фазу фильтруют, сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя ДХМ, затем смесью ДХМ/AcOEt (50/50; об./об.) и, наконец, смесью ДХМ/МеОН (95/5; об./об.). После перекристаллизации из смеси ДХМ/гексан/изо-эфир получают 3,95 г ожидаемого продукта. Б) х Гидрохлорид 5-(1-пиперазинил)пиримидина. Смесь 3,5 г соединения, полученного на предыдущей стадии, в 20 мл диоксана смешивают при ТОС с 50 мл 2 н. раствора HCl в эфире, оставляют перемешиваться при ТОС в течение 1 ч и концентрируют под вакуумом. Получают желтое твердое вещество, которое используют в том виде, как оно получено. Подготовительная стадия 3.7. 4-(1-Пиперазинил)пиридазин. А) 5-(4-Бензил-1-пиперазинил)-4-хлор-3(2 Н)-пиридазинон. Смесь 7 г 1-бензилпиперазина, 6,55 г 4,5-дихлор-3(2H)-пиридазинона и 11 г K2 СО 3 в 150 мл ДМФА нагревают при 110 С в течение 4 ч, а затем концентрируют под вакуумом. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (95/5; об./об.). Полученный продукт переносят в изо-эфир, растирают в порошок и образовавшийся осадок отделяют отсасыванием. Получают 7 г ожидаемого продукта, который перекристаллизовывают из изо-эфира; т.пл. = 173-175 С. Б) 5-(4-Бензил-1 -пиперазинил)-3,4-дихлорпиридазин. Смесь 1,7 г соединения, полученного на предыдущей стадии, и 20 мл оксихлорида фосфора нагревают при 85 С в течение 4 ч. После охлаждения до ТОС реакционную смесь выливают на лед, водную фазу делают щелочной путем добавления концентрированного раствора NaOH и экстрагируют ДХМ,органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (от 97/3 до 90/10; об./об.). Получают 1,5 г ожидаемого продукта, который используют в том виде, как он получен. В) 4-(1-Пиперазинил)пиридазин. Смесь 1,3 г соединения, полученного на предыдущей стадии, и 0,13 г 10%-ного палладия на угле в 20 мл МеОН гидрируют при 30 С и атмосферном давлении в течение 3 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Получают 0,85 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 3.8. Гидрохлорид 5-(1 -пиперазинил)-3(2H)-пиридазинона. Смесь 0,8 г соединения, полученного на стадии А получения 3.8, и 0,3 г 10%-ного палладия на угле в 30 мл МеОН гидрируют при 30 С и атмосферном давлении в течение 2 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Получают 0,38 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 3.9. Гидрохлорид 4-(1 -пиперазинил)-3(2 Н)-пиридазинона. А) 4-(4-Бензил-1-пиперазинил)-5-хлор-3(2H)-пиридазинон и 5-(4-бензил-1-пиперазинил)-4-хлор 3(2H)-пиридазинон. Смесь 2,77 г 1-бензилпиперазина, 1,3 г NaHCO3 и 2,6 г 4,5-дихлор-3(2 Н)-пиридазинона в 300 мл диоксана нагревают при 100 С в течение ночи, а затем концентрируют под вакуумом. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (98/2; об./об.). Разделяют два соединения: менее полярное соединение, 4-(4-бензил-1-пиперазинил)-5-хлор-3(2 Н)-пиридазинон, которого получают 0,8 г; более полярное соединение, 5-(4-бензил-1-пиперазинил)-4-хлор-3(2 Н)-пиридазинон, которого получают 1,2 г. Б) Гидрохлорид 4-(1-пиперазинил)-3(2 Н)-пиридазинона. Смесь 0,75 г менее полярного соединения, полученного на предыдущей стадии, и 0,2 г 10%-ного палладия на угле в 20 мл МеОН и 10 мл ДМФА гидрируют при 30 С и атмосферном давлении в течение 3 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Получают 0,46 г ожидаемого продукта, который используют в том виде, как он получен. Подготовительная стадия 3.10. 1-(2-Пиримидинил)-1,4-диазепан. Раствор 3 г 2-хлорпиримидина в 20 мл EtOH охлаждают на ледяной бане, затем смешивают по каплям с раствором 13 г 1,4-диазепана в 50 мл EtOH, оставляют перемешиваться в холоде в течение 30 мин,а затем при ТОС в течение 24 ч. Смесь концентрируют под вакуумом, остаток переносят в 100 мл AcOEt и 100 мл насыщенного раствора K2 СO3, систему декантируют, органическую фазу разбавляют путем добавления 100 мл AcOEt, органическую фазу промывают насыщенным раствором K2 СО 3 и сушат надNa2SO4 и под вакуумом выпаривают растворитель. Получают ожидаемый продукт, который используют в том виде, как он получен. Подготовительная стадия 3.11. Гидрохлорид 2-хлор-6-(1-пиперазинил)пиразина. А) трет-Бутил-4-(6-хлорпиразин-2-ил)-1 -пиперазинкарбоксилат. Смесь 5 г трет-бутил-1-пиперазинкарбоксилата, 4 г 2,6-дихлорпиразина и 9,5 мл ДИПЭА в 40 мл нбутанола нагревают с обратным холодильником в течение 3 ч. Смесь концентрируют под вакуумом, остаток переносят в 100 мл EtOH, систему выдерживают в течение ночи и образовавшийся кристаллический продукт отделяют отсасыванием. Получают 4,7 г ожидаемого продукта, т.пл. = 108 С. Б) Гидрохлорид 2-хлор-6-(1-пиперазинил)пиразина. Смесь 1,5 г соединения, полученного на предыдущей стадии, и 100 мл раствора 2 н. хлористоводородного эфира в 10 мл МеОН оставляют перемешиваться при ТОС в течение ночи. Образовавшийся осадок отделяют отсасыванием и промывают эфиром. Получают 1,2 г ожидаемого продукта. Подготовительная стадия 3.12. х Гидрохлорид 4-хлор-2-(1-пиперазинил)пиримидина. А) трет-Бутил-4-(4-хлорпиримидин-2-ил)-1-пиперазинкарбоксилат и трет-бутил-4-(2-хлорпиримидин-4-ил)-1-пиперазинкарбоксилат. Смесь 9,55 г трет-бутил-1-пиперазинкарбоксилата, 7,64 г 2,6-дихлорпиримидина и 8,6 г NaHCO3 в 90 мл EtOH нагревают при 100 С в течение одного часа. Смесь концентрируют под вакуумом, остаток переносят в воду и экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/AcOEt (от 90/10 до 60/40; об./об.). Разделяют два соединения: менее полярное соединение, трет-бутил-4-(4-хлорпиримидин-2-ил)-1-пиперазинкарбоксилат, которого получают 1,75 г; более полярное соединение, трет-бутил-4-(2-хлорпиримидин-4-ил)-1-пиперазинкарбоксилат, которого получают 12,9 г. Б) х Гидрохлорид 4-хлор-2-(1-пиперазинил)пиримидина. Смесь 1,75 г менее полярного соединения, полученного на предыдущей стадии, и 100 мл раствора 2 н. хлористо-водородного эфира в 10 мл МеОН оставляют перемешиваться при ТОС в течение 18 ч. Смесь концентрируют под вакуумом, остаток переносят в эфир и образовавшийся кристаллический продукт отделяют отсасыванием. Получают 1,6 г ожидаемого продукта. Подготовительная стадия 3.13. Гидрохлорид 6-хлор-4-(1 -пиперазинил)пиримидина. Раствор 14,8 г 4,6-дихлорпиримидина в 100 мл ацетонитрила охлаждают до 0-5 С, в течение 30 мин добавляют раствор 20 г безводного пиперазина в 200 мл ацетонитрила и смесь оставляют перемешиваться при 0-5 С в течение 2 ч. Смесь концентрируют под вакуумом, остаток переносят в 100 мл 2 н. раствораNaOH и экстрагируют эфиром, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Образуется гидрохлорид - 15 г ожидаемого продукта. Пример 1. Соединение 1. Гидрохлорид 2-[4-(2-пиразинил)-1-пиперазинил]-1-[4-[3-(трифторметил)фенил]-1-пиперидил]-1 этанона, 2 Н 2 О. Смесь 0,7 г соединения, полученного на подготовительной стадии 2.1, 0,39 г соединения, полученного на подготовительной стадии 3.1, 0,39 г йодида калия и 0,635 г K2 СО 3 в 30 мл ацетонитрила оставляют перемешиваться при ТОС в течение ночи. К реакционной смеси добавляют воду, смесь подвергают экстракции AcOEt, органическую фазу промывают водой и насыщенным раствором NaCl, сушат надNa2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле,элюируя смесью ДХМ/МеОН (97/3; об./об.). Полученный продукт переносят в 2 н. раствор хлористоводородного эфира, растирают в порошок и образовавшийся осадок отделяют отсасыванием. Получают 0,42 г ожидаемого продукта. Масс-спектр: МН+ = 434.3. Пример 2. Соединение 2. Диоксалат 1-[4-гидрокси-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-[5-(трифторметил)-2-пиридил]-1-пиперазинил]-1-этанона, 2 Н 2 О. Смесь 0,8 г соединения, полученного на подготовительной стадии 2.2, 0,575 г 1-[5-(трифторметил)2-пиридил]пиперазина, 0,413 г йодида калия и 0,688 г К 2 СО 3 в 20 мл ацетонитрила оставляют перемешиваться при ТОС в течение 2 ч. Добавляют насыщенный раствор K2 СО 3, смесь экстрагируют AcOEt, органическую фазу промывают водой и насыщенным раствором NaCl, сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (96/4; об./об.). Полученный продукт переносят в эфир, добавляют 0,384 г щавелевой кислоты, смесь перетирают и образовавшийся осадок отделяют отсасыванием. Получают 1,27 г ожидаемого продукта, т.пл. = 173 С. Смесь 0,5 г соединения, полученного на подготовительной стадии 2.3, 0,660 г соединения, полученного на подготовительной стадии 3.1, 0,4 мл триэтиламина и 0,23 г йодида калия в 10 мл ацетонитрила нагревают при 70 С в течение 60 ч. К реакционной смеси добавляют воду, смесь экстрагируют AcOEt,органическую фазу промывают насыщенным раствором K2 СО 3, водой и насыщенным раствором NaCl,сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (94/6; об./об.). 0,77 г полученного продукта переносят в эфир,добавляют 0,28 г щавелевой кислоты и образовавшийся осадок отделяют отсасыванием. Получают 0,762 г ожидаемого продукта, т.пл. = 113 С. Пример 4. Соединение 4. 1-[4-(Аминометил)-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1 этанон. А) 1-[2-[4-(2-Пиразинил)-1-пиперазинил]ацетил]-4-[3-(трифторметил)фенил]-4-пиперидинкарбонитрил. Смесь 3,42 г соединения, полученного на подготовительной стадии 2.6, 1,7 г соединения, полученного на подготовительной стадии 3.1, 1,7 г йодида калия и 1,42 г K2 СО 3 в 50 мл ацетонитрила оставляют перемешиваться при ТОС в течение 18 ч. Смесь концентрируют под вакуумом, остаток переносят в воду и экстрагируют AcOEt, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток переносят в абсолютный EtOH и образовавшиеся кристаллы отделяют отсасыванием и промывают эфиром. Получают 3,5 г ожидаемого продукта, т.пл. = 138 С. Б) 1-[4-(Аминометил)-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон. Смесь 3 г соединения, полученного на предыдущей стадии, 0,3 г никеля Ренея, 20 мл 20%-ного водного раствора аммиака и 200 мл МеОН гидрируют при ТОС и атмосферном давлении в течение 16 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Остаток переносят в воду и экстрагируют AcOEt, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. После перекристаллизации из AcOEt получают 2,17 г ожидаемого продукта; т.пл. = 155 С. Масс-спектр: МН+ = 463.4. 1 Н ЯМР: ДМСО-d6:(млн-1): 1.0-1.2: m: 2 Н; 1.6-2.2: m: 4 Н; 2.4-4.0: m: 16 Н; 7.4-7.7: m: 4 Н; 7.79: d: 1H; 8.06: dd: 1H; 8.29: d: 1H. Соединение 4 примера 4 также может быть получено, следуя двум стадиям, указанным ниже. А') трет-Бутил-[1-[2-[4-(2-пиразинил)-1-пиперазинил]ацетил]-4-[3-(трифторметил)фенил]-4-пиперидил]метилкарбамат. Смесь 2,8 г соединения, полученного на подготовительной стадии 2.7, 1,25 г соединения, полученного на подготовительной стадии 3.1, 1,1 г йодида калия и 1,8 г K2 СО 3 в 30 мл ацетонитрила оставляют перемешиваться при ТОС в течение 3 ч. Добавляют насыщенный раствор K2 СО 3, смесь экстрагируютAcOEt, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (97/3; об./об.). Получают 1,75 г ожидаемого продукта. Б') 1-[4-(Аминометил)-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон. Смесь 1,7 г соединения, полученного на предыдущей стадии, 50 мл 2 н. раствора HCl в эфире и 30 мл МеОН оставляют перемешиваться при ТОС в течение 4 ч. Смесь концентрируют под вакуумом, остаток переносят в воду, водную фазу промывают AcOEt, водную фазу делают щелочной, добавляя К 2 СO3,смесь подвергают экстракции AcOEt, органическую фазу промывают насыщенным раствором NaCl и сушат над Na2SO4 и под вакуумом выпаривают растворитель. После упаривания в AcOEt продукт кристаллизуется, и образовавшиеся кристаллы отделяют отсасыванием. Получают 1,05 г ожидаемого продукта, т.пл. = 152-153 С. Масс-спектр: МН+ = 463.3. Пример 5. Соединение 5. Тригидрохлорид 1-[4-(аминометил)-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиримидинил)-1-пиперазинил]-1-этанона.A) 1-[2-[4-(2-Пиримидинил)-1-пиперазинил]ацетил]-4-[3-(трифторметил)-фенил]-4-пиперидинкарбонитрил. Смесь 1,28 г соединения, полученного на подготовительной стадии 2.6, 1,1 г 2-(1-пиперазинил)пиримидина, 1,23 г K2 СО 3 и 0,79 г йодида калия в 30 мл ацетонитрила оставляют перемешиваться при ТОС в течение 4 ч. Смесь концентрируют под вакуумом, остаток переносят в воду и экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле Н, элюируя смесью ДХМ/МеОН (100/1; об./об.). Получают 0,9 г ожидаемого продукта. Б) Тригидрохлорид 1-[4-(аминометил)-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиримидинил)-1-пиперазинил]-1 -этанона. Смесь 0,9 г соединения, полученного на предыдущей стадии, 0,1 г никеля Ренея, 10 мл 20%-ного водного раствора аммиака и 50 мл МеОН гидрируют при ТОС и атмосферном давлении в течение 4 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Остаток переносят в воду и экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток переносят в 2 н. раствор HCl в эфире и образовавшийся осадок отделяют отсасыванием. После сушки под вакуумом получают 0,74 г ожидаемого продукта; т.пл. = 198-202 С. Пример 6. Соединение 27. Диоксалат 2-[4-(4-пиримидинил)-1-пиперазинил]-1-[4-[3-(трифторметил)фенил]-3,6-дигидро-1(2 Н)пиридил]-1-этанона. Смесь 0,87 г Соединения 11, 5 мл 35%-ного раствора HCl и 9 мл уксусной кислоты нагревают при 110 С в течение 1 ч. После охлаждения до ТОС добавляют 5%-ный раствор K2 СО 3, смесь экстрагируют AcOEt, органическую фазу промывают насыщенным раствором NaCl, сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (95/5; об./об.). 0,7 г полученного продукта переносят в МеОН, добавляют 0,12 г щавелевой кислоты, смесь оставляют кристаллизоваться и образовавшийся осадок отделяют отсасыванием. Получают 0,502 г ожидаемого продукта, т.пл. = 160 С. Масс-спектр: МН+ = 432.3. Пример 7. Соединение 30. 1,5 Оксалат 1-[4-(аминометил)-4-[2-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанона, 0,5 Н 2 О. А) 1,5 Оксалат 1-[2-[4-(2-пиразинил)-1-пиперазинил]ацетил]-4-[2-(трифторметил)фенил]-4-пиперидинкарбонитрила. Смесь 1 г соединения, полученного на подготовительной стадии 2.10, 0,496 г соединения, полученного на подготовительной стадии 3.1, 0,51 г йодида калия и 0,836 г K2 СО 3 в 20 мл ацетонитрила оставляют перемешиваться при ТОС в течение ночи. Смесь концентрируют под вакуумом, остаток переносят в воду и экстрагируют AcOEt, органическую фазу промывают водой и насыщенным раствором NaCl и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (97/3; об./об.). 0,29 г полученного продукта переносят в МеОН,добавляют 0,057 г щавелевой кислоты и образовавшийся осадок отделяют отсасыванием. Получают 0,081 г ожидаемого продукта, т.пл. = 125-126 С. Б) 1,5 Оксалат 1-[4-(аминометил)-4-[2-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1 пиперазинил]-1-этанона, 0,5 Н 2 О. Смесь 0,8 г соединения, полученного на предыдущей стадии, 0,08 г никеля Ренея, 20 мл 20%-ного водного раствора аммиака и 100 мл МеОН гидрируют при ТОС и атмосферном давлении в течение 36 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Остаток переносят в воду и экстрагируют AcOEt, органическую фазу промывают насыщенным раствором NaCl и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Продукт подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (90/10; об./об.). 0,28 г полученного продукта переносят в AcOEt, добавляют 0,054 г щавелевой кислоты и образовавшийся осадок отделяют отсасыванием. Получают 0,26 г ожидаемого продукта. Смесь 0,6 г соединения 31 и.0,14 г гранулированного КОН в 10 мл МеОН и 5 мл воды нагревают при 70 С в течение 10 мин. После охлаждения до ТОС образовавшийся кристаллический продукт отделяют отсасыванием, промывают водой и сушат. Получают 0,3 г ожидаемого продукта, т.пл. = 223 С. Масс-спектр: МН+ = 464.4. Пример 9. Соединение 33. 1-[4-[(Диметиламино)метил]-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон. Смесь 0,85 г соединения 4, полученного в примере 4, 0,28 мл 37%-ного водного раствора формальдегида, 3,8 г триацетоксиборогидрида натрия и 3 капель уксусной кислоты в 50 мл ТГФ оставляют перемешиваться при ТОС в течение ночи. Реакционную смесь концентрируют под вакуумом, остаток переносят в 100 мл воды и смесь нагревают при 80 С в течение 30 мин. После охлаждения до ТОС реакционную смесь делают щелочной с рН = 9 путем добавления 10%-ного раствора NaOH и экстрагируют ДХМ. Органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. После перекристаллизации из эфира получают 0,55 г ожидаемого продукта, т.пл. = 118 С. Масс-спектр: МН+ = 491.4. 1 Н ЯМР: ДМСО-d6:(млн-1): 1.6-2.3: m: 10 Н; 2.35-2.7: m: 6 Н; 2.8-3.3: m: 4 Н; 3.4-4.0: m: 6 Н; 7.4-8.4: Смесь 0,907 г соединения 35 и 0,913 г пара-толуолсульфокислоты в 20 мл толуола нагревают при 118 С в течение 24 ч. После охлаждения до ТОС добавляют 5%-ный раствор K2 СО 3, смесь экстрагируютAcOEt, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (97/3; об./об.). После перекристаллизации из смеси ДХМ/изо-эфир получают 0,55 г ожидаемого продукта, т.пл. = 139-141 С. Пример 11. Соединение 37. Трифторацетат 1-[4-(аминометил)-4-(4-хлорфенил)-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанона. А) 4-(4-Хлорфенил)-1-[2-[4-(2-пиразинил)-1-пиперазинил]ацетил]-4-пиперидинкарбонитрил. Смесь 1 г соединения, полученного на подготовительной стадии 2.14, 0,56 г соединения, полученного на подготовительной стадии 3.1, 0,56 г йодида калия и 0,47 г K2CO3 в 20 мл ацетонитрила оставляют перемешиваться при ТОС в течение ночи. Смесь концентрируют под вакуумом, остаток переносят в воду и экстрагируют AcOEt, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Получают 1,51 г ожидаемого продукта, который используют в том виде, как он получен. Б) Трифторацетат 1-[4-(аминометил)-4-фенил-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1 этанона и трифторацетат 1-[4-(аминометил)-4-(4-хлорфенил)-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанона. Смесь 1,51 г соединения, полученного на предыдущей стадии, и 0,15 г родия на оксиде алюминия в 100 мл МеОН гидрируют при ТОС и атмосферном давлении в течение 36 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Остаток подвергают хроматографии на силикагеле Н,элюируя смесью ДХМ/МеОН (100/5; об./об.), а затем смесью ДХМ/МеОН/Н 2O (100/5/0,5; об./об./об.). Полученный продукт, в виде смеси двух соединений, переносят в EtOH, добавляют 2 н. раствор хлористо-водородного эфира и образовавшийся осадок отделяют отсасыванием. Осадок растворяют в воде,водную фазу промывают ДХМ, водную фазу делают щелочной путем добавления 10%-ного раствораNaOH и экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают раство- 27007501 ритель. Остаток перекристаллизовывают из AcOEt с образованием 0,14 г смеси двух соединений, содержащей 21,6% одного соединения и 75,5% соединения 37. Для разделения этих двух соединений применяют препаративную ВЭЖХ. Используют прибор Delta Prep 4000 для препаративной ВЭЖХ с колонкой PROCHROM с динамической осевой компрессией с диаметром 500 мм и 380 г KromasilC18 неподвижной фазы, под давлением 7000 кПа (70 бар). Подвижная фаза представляет собой градиент смеси элюента А (Н 2 О + ТФУ 0,1%) и элюента Б (ацетонитрил/Н 2O (90% + 10%) + ТФУ 0,1%), скорость потока составляет 122 мл/мин. УФ-анализ проводят при длине волны 254 нм. После разделения 0,122 г смеси получают следующие продукты: 0,037 г соединения, идентифицированного как трифторацетат 1-[4-(аминометил)-4-фенил-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанона, время удерживания (RT) = 13 мин; масс-спектр МН+ = 395.4; 0,15 г соединения 37: время удерживания (RT) = 15,9 мин; масс-спектр МН+ = 429.4. Пример 12. Соединение 57. 1-[4-[(Метиламино)метил]-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1 пиперазинил]-1-этанон. А) трет-Бутилметил-1-[2-[4-(2-пиразинил)-1-пиперазинил]ацетил]-4-[3-(трифторметил)фенил]-4 пиперидил]метил]карбамат. Смесь 10 г соединения, полученного на подготовительной стадии 2.20, 3,7 г соединения, полученного на подготовительной стадии 3.1, 3,7 г йодида калия и 6,2 г K2CO3 в 200 мл ацетонитрила оставляют перемешиваться при ТОС в течение 5 ч. Смесь концентрируют под вакуумом, остаток переносят в воду и экстрагируют AcOEt, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле Н, элюируя ДХМ, а затем смесью ДХМ/МеОН (100/2; об./об.). Получают 10,7 г ожидаемого продукта. Б) 1-[4-[(Метиламино)метил]-4-[3-(трифторметил)фенил]-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон. Раствор 8 г соединения, полученного на предыдущей стадии, в 100 мл МеОН смешивают с 300 мл 2 н. раствора хлористо-водородного эфира и оставляют перемешиваться при ТОС в течение ночи. Смесь концентрируют под вакуумом, остаток переносят в 10%-ный раствор NaOH и экстрагируют AcOEt, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле Н, элюируя смесью ДХМ/МеОН (100/2; об./об.), а затем смесью ДХМ/МеОН/ вода (100/5/0,5; об./об./об.). После перекристаллизации из изоэфира получают 4,5 г ожидаемого продукта; т.пл. = 137-139 С. Масс-спектр МН+ = 477.4. 1 Н ЯМР: ДМСО-d6:(млн-1): 1.10: s: 10 Н; 1.6-2.3: m: 7 Н; 2.4-3.8: m: 16 Н; 7.4-7.75: m: 4 Н; 7.8: d: 1H; 8.15: dd: 1H; 8.3: d: 1H. Пример 13. Соединение 58. 1-[4-(Изопропиламино)метил]-4-[3-(трифторметил)фенил]-1-пиперидил-2-[4-(2-пиразинил)-1 пиперазинил]-1-этанон. Смесь 1 г соединения 4, 0,16 мл ацетона и 5 капель уксусной кислоты в 10 мл ТГФ смешивают при ТОС с 0,5 г триацетоксиборогидрида натрия и оставляют перемешиваться при ТОС в течение ночи. Затем добавляют 20 мл МеОН и смесь нагревают при 55 С в течение 1 ч. Смесь концентрируют под вакуумом, остаток переносят в 30%-ный раствор NaOH и экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (93/7; об./об.). После перекристаллизации из эфира получают 0,511 г ожидаемого продукта, т.пл. = 140-141 С. Масс-спектр: МН+ = 505.3. Пример 14. Соединение 59. Тригидрохлорид 1 -[4-[(N-метилизопропиламино)метил]-4-[3-(трифторметил)фенил]-1-пиперидил]2-[4-(2-пиразинил)-1-пиперазинил]-1-этанона. Смесь 0,36 г соединения 58, 0,08 мл 37%-ного водного раствора формальдегида и 5 капель уксусной кислоты в 10 мл ТГФ смешивают при ТОС с 0,605 г триацетоксиборогидрида натрия и оставляют перемешиваться при ТОС в течение 4 ч. Затем добавляют 10 мл МеОН и смесь нагревают при 60 С в- 28007501 течение 1 ч. Смесь концентрируют под вакуумом, остаток переносят в 30%-ный раствор NaOH и экстрагируют ДХМ, экстракт сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии с использованием смеси ДХМ/МеОН (96/4; об./об.). Полученный продукт переносят в 2 н. раствор хлористо-водородного эфира и образовавшийся осадок отделяют отсасыванием. Получают 0,233 г ожидаемого продукта, т.пл. = 185-200 С. Масс-спектр: МН+ = 519.3. Пример 15. Соединение 65. 1-[4-(Аминометил)-4-(3-хлорфенил)-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон. А) 4-(3-Хлорфенил)-1-[2-[4-(2-пиразинил)-1-пиперазинил]ацетил]-4-пиперидинкарбонитрил. Смесь 2,3 г соединения, полученного на подготовительной стадии 2.21, 1,3 г соединения, полученного на подготовительной стадии 3.1, 1,3 г йодида калия и 2,2 г K2 СО 3 в 40 мл ацетонитрила оставляют перемешиваться при ТОС в течение ночи. К реакционной смеси добавляют воду, смесь экстрагируютAcOEt, органическую фазу промывают насыщенным раствором K2 СО 3 и водой и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (97/3; об./об.). Получают 2,3 г ожидаемого продукта. Б) 1-[4-(Аминометил)-4-(3-хлорфенил)-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанон. Смесь 0,62 г соединения, полученного на предыдущей стадии, и 0,6 г никеля Ренея в 30 мл МеОН гидрируют при 28 С и атмосферном давлении в течение 8 ч. Катализатор отфильтровывают и под вакуумом концентрируют фильтрат. Остаток подвергают хроматографии на оксиде алюминия, элюируя смесью ДХМ/МеОН (97/3; об./об.). После перекристаллизации из смеси ДХМ/изо-эфир получают 0,121 г ожидаемого продукта; т.пл. = 138-139 С. Масс-спектр: МН+ = 429.3. Пример 16. Соединение 69. Диоксалат 1-[4-(аминометил)-4-(3-метоксифенил)-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанона. А) 4-(3-Метоксифенил)-1-[2-[4-(2-пиразинил)-1-пиперазинил]ацетил]-4-пиперидинкарбонитрил. Смесь 1,2 г соединения, полученного на подготовительной стадии 2.22, 0,675 г соединения, полученного на подготовительной стадии 3.1, 0,68 г йодида калия и 1,2 г K2 СО 3 в 30 мл ацетонитрила оставляют перемешиваться при ТОС в течение 4 ч. Добавляют воду, смесь экстрагируют ДХМ, органическую фазу промывают насыщенным раствором K2 СО 3 и водой и сушат над Na2SO4 и под вакуумом выпаривают растворитель. Остаток подвергают хроматографии на силикагеле, элюируя смесью ДХМ/МеОН (97/3; об./об.). Получают 1,5 г ожидаемого продукта, часть которого перекристаллизовывают из изоэфира; т.пл.= 108 С. Б) Диоксалат 1-[4-(аминометил)-4-(3-метоксифенил)-1-пиперидил]-2-[4-(2-пиразинил)-1-пиперазинил]-1-этанона. Смесь 1,3 г соединения, полученного на предыдущей стадии, 0,2 г никеля Ренея и 10 мл концентрированного водного раствора аммиака в 70 мл МеОН гидрируют при 31 С и атмосферном давлении в течение 30 ч. Катализатор отфильтровывают и под вакуумом упаривают фильтрат. Остаток переносят в 1 н. раствор HCl, водную фазу промывают AcOEt и делают ее щелочной путем добавления 10%-ного раствора NaOH, смесь экстрагируют ДХМ, органическую фазу сушат над Na2SO4 и под вакуумом выпаривают растворитель. 0,2 г полученного продукта переносят в эфир, добавляют 0,042 г щавелевой кислоты,смесь перетирают и образовавшийся осадок отделяют отсасыванием. Получают 0,19 г ожидаемого продукта, т.пл. = 120 С. Масс-спектр: МН+ = 425.4. В таблице, представленной ниже, приведены химические структуры и физические свойства некоторых примеров соединений по данному изобретению. В этой таблице- значение R3 = двойная связь означает, что R3 вместе с соседним атомом углерода пиперидинового кольца образует двойную связь, как показано в примере 6;
МПК / Метки
МПК: C07D 417/14, A61P 25/28, C07D 401/14, A61K 31/497
Метки: производные, терапевтическое, применение, пиперазинилацилпиперидина, получение
Код ссылки
<a href="https://eas.patents.su/30-7501-proizvodnye-piperazinilacilpiperidina-ih-poluchenie-i-ih-terapevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиперазинилацилпиперидина, их получение и их терапевтическое применение</a>
Предыдущий патент: Передатчик энергии для использования в агрегатах для нанесения покрытий и/или в сушильных установках, в частности, для нанесения лакового покрытия
Следующий патент: Производные никотин-или изоникотинбензотиазола
Случайный патент: Способ коррекции веса тела человека












