Новый способ синтеза агомелатина
Формула / Реферат
1. Способ промышленного синтеза соединения формулы (I)
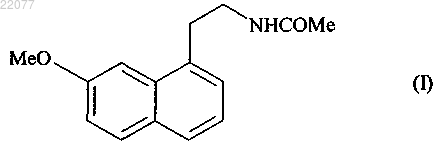
отличающийся тем, что подвергают взаимодействию цианид аллила формулы (II)
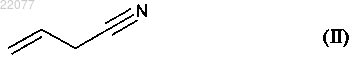
с соединением формулы (III) в присутствии свободнорадикального инициатора
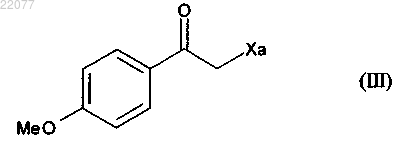
где Ха представляет собой группу -S-C(S)-OR, в которой R представляет собой линейную или разветвленную (C1-C6)алкильную группу,
чтобы получить соединение формулы (IV)
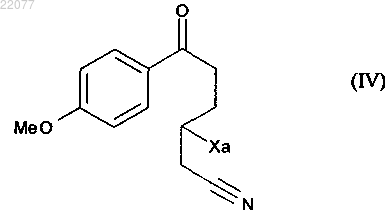
в которой Ха является таким, как определено выше,
это последнее соединение по выбору может быть выделено до того, как его подвергнут реакции циклизации в присутствии свободнорадикального инициатора, чтобы получить соединение формулы (V)
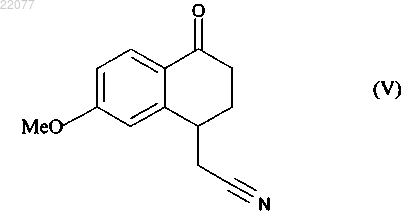
которое также по выбору может быть выделено до того, как его подвергнут реакции восстановления/дегидратации, чтобы получить соединение формулы (VI)
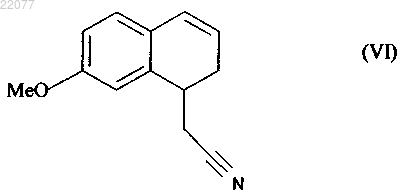
которое затем подвергают реакции ароматизации, чтобы получить соединение формулы (VII)
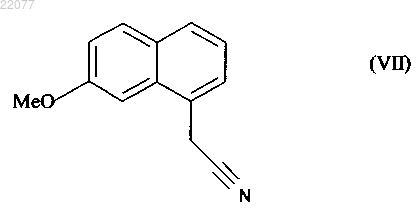
которое подвергают восстановлению водородом в присутствии никеля Ренея в аммиачном этаноле или смеси этанола и воды и реакции с уксусным ангидридом, чтобы получить соединение формулы (I), которое выделяют в виде твердого вещества.
2. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что соединение формулы (VII) затем подвергают восстановлению водородом в присутствии никеля Ренея в среде аммиачного этанола, затем преобразуют в соль с использованием соляной кислоты, чтобы получить соединение формулы (VIII)
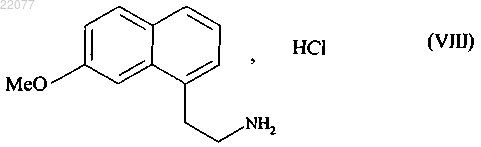
которое последовательно подвергают воздействию ацетата натрия и затем уксусного ангидрида, чтобы получить соединение формулы (I), которое выделяют в виде твердого вещества.
3. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что соединение формулы (VII) подвергают восстановлению водородом в присутствии никеля Ренея в среде, содержащей уксусный ангидрид в аммиачном этаноле или смеси этанола и воды, чтобы получить соединение формулы (I), которое выделяют в виде твердого вещества.
4. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что группа Ха = -S-C(S)-OC2H5.
5. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что свободнорадикальные реакции инициируют термическим способом при температуре, находящейся между 50 и 140°C.
6. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что циклизацию соединения формулы (IV) осуществляют при температуре, находящейся между 130 и 135°C.
7. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что стадию присоединения соединения формулы (II) к соединению формулы (III) и стадию циклизации соединения формулы (IV) инициируют в присутствии пероксида дилауроила.
8. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что стадию присоединения соединения формулы (II) к соединению формулы (III) осуществляют в хлорбензоле.
9. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что стадию циклизации продукта присоединения формулы (IV) до получения соединения формулы (V) осуществляют в этилацетате.
10. Способ синтеза по п.1, отличающийся тем, что превращение соединения формулы (V) в соединение формулы (VI) осуществляют в присутствии изопропоксида алюминия.
11. Способ синтеза по п.1, отличающийся тем, что превращение соединения формулы (V) в соединение формулы (VI) осуществляют в изопропаноле.
12. Способ синтеза по п.1, отличающийся тем, что каталитическое количество п-толуолсульфоновой кислоты добавляют к смеси в конце превращения соединения формулы (V) в соединение формулы (VI).
13. Способ синтеза по п.1, отличающийся тем, что ароматизацию соединения формулы (VI) осуществляют в присутствии хинона.
14. Способ синтеза по п.1, отличающийся тем, что ароматизацию соединения формулы (VI) осуществляют в присутствии тетрахлорбензохинона с нагреванием в колбе с обратным холодильником с толуолом.
15. Соединение формулы (V) по п.1.
16. Применение соединения формулы (V) по п.15 в синтезе агомелатина.
17. Соединение формулы (VI) по п.1.
18. Применение соединения формулы (VI) по п.17 в синтезе агомелатина.
Текст
НОВЫЙ СПОСОБ СИНТЕЗА АГОМЕЛАТИНА Способ промышленного синтеза соединения формулы (I) из цианид аллила формулы (II) и соединения формулы (III), в котором Ха представляет собой группу -S-C(S)-OR, в которой R представляет собой линейную или разветвленную (C1-C6)алкильную группу(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) Настоящее изобретение относится к способу промышленного синтеза агомелатина или N-[2-(7 метокси-1-нафтил)этил]ацетамида формулы (I) Агомелатин или N-[2-(7-метокси-1-нафтил)этил]ацетамид обладает ценными фармакологическими свойствами. В самом деле, он имеет двойственную особенность, с одной стороны, быть агонистом рецепторов мелатонинэргической системы, а с другой стороны, антагонистом 5-НТ 2 С рецептора. Эти свойства придают ему активность в центральной нервной системе и, в частности, при лечении тяжелых депрессий,сезонных депрессий, нарушений сна, патологии сердечно-сосудистой системы, патологии пищеварительной системы, бессонницы и утомления вследствие разницы во времени, нарушений аппетита и ожирения. Агомелатин, его получение и терапевтическое применение описаны в европейских патентах EP 0447285 и EP 1564202. Принимая во внимание фармацевтическую пользу данного соединения, является важным получать его при помощи высокопроизводительного способа промышленного синтеза, который легко переводится в промышленный масштаб, обеспечивает получение агомелатина с высоким выходом и с превосходной чистотой. В патенте EP 0447285 описан способ получения агомелатина, включающий восемь стадий, исходя из 7-метокси-1-тетралона. В патенте EP 1564202 заявитель разработал новый способ синтеза намного более эффективный и промышленно применимый, включающий только четыре стадии, исходя из 7-метокси-1-тетралона, и позволяющий получить агомелатин весьма репродуктивным способом в хорошо определенной кристаллической форме. Тем не менее, поиски новых способов синтеза, в частности исходя из менее дорогостоящих исходных материалов, нежели 7-метокси-1-тетралон, по-прежнему представляют интерес. Заявитель продолжил свои исследования и разработал новый способ синтеза агомелатина исходя из цианида аллила и производного ксантогената; преимущество этих новых исходных веществ состоит в том, что они являются простыми, легкодоступными в больших количествах при небольшой стоимости. Этот способ синтеза основывается на использовании малораспространенных свободнорадикальных реакций и все же очень эффективных. Преобразование этих реакций в промышленный масштаб с использованием реакторов непрерывного действия является многообещающим по мере того, как становится легче контролировать продвижение цепной реакции. Наряду с этим этот новый способ получения агомелатина воспроизводимым способом и без необходимости в лабораторной очистке, с чистотой, совместимой с его применением в качестве фармацевтического действующего вещества. В действительности, таким образом агомелатин может быть синтезирован в 6 стадий, в ходе которых выделяют только два из промежуточных продуктов. В частности, настоящее изобретение относится к способу промышленного синтеза соединения формулы (I) отличающийся тем, что подвергают взаимодействию цианид аллила формулы (II) где Ха представляет собой группу -S-C(S)-OR, в которой R представляет собой линейную или разветвленную (C1-C6)алкильную группу, чтобы получить соединение формулы (IV) в которой Ха является таким, как определено выше, это последнее соединение по выбору может быть выделено до того, как его подвергнут реакции циклизации в присутствии свободнорадикального инициатора, чтобы образовать соединение формулы (V) которое также по выбору может быть выделено до того, как его подвергнут реакции восстановления/дегидратации, чтобы получить соединение формулы (VI) которое затем подвергают реакции ароматизации, чтобы получить соединение формулы (VII) которое подвергают восстановлению водородом в присутствии никеля Ренея в полярной протонной среде и реакции с уксусным ангидридом, чтобы получить соединение формулы (I), которое выделяют в виде твердого вещества. В предпочтительном варианте осуществления изобретения соединение формулы (VII) затем подвергают восстановлению водородом в присутствии никеля Ренея в среде аммиачного этанола, затем преобразуют в соль с использованием соляной кислоты, чтобы получить соединение формулы (VIII) которое последовательно подвергают воздействию ацетата натрия и затем уксусного ангидрида, чтобы получить соединение формулы (I), которое выделяют в виде твердого вещества. Альтернативно, соединение формулы (VII) может быть подвергнуто восстановлению водородом в присутствии никеля Ренея в среде, содержащей уксусный ангидрид в полярной протонной среде, чтобы получить соединение формулы (I), которое выделяют в виде твердого вещества. В предпочтительном соединении формулы (III) Ха представляет собой группу -S-C(S)-OC2H5. В способе согласно изобретению инициирование свободнорадикальных реакций осуществляют термическим способом. Предпочтительно реакционную среду нагревают при температуре, находящейся между 50 и 140C. Еще более предпочтительно циклизацию осуществляют при температуре, находящейся между 130 и 135C. Пероксиды представляют собой свободнорадикальные инициаторы в особенности пригодные для осуществления стадии присоединения соединения формулы (II) к соединению формулы (III), или же для проведения циклизации соединения формулы (IV), чтобы образовать соединение формулы (V). В качестве примеров, в частности, можно перечислить пероксид диизобутирила, пероксинеодеканоат кумила,пероксинеодеканоат трет-амила, пероксидикарбонат ди-(2-этилгексила), пероксинеодеканоат третбутила, пероксидикарбонат дибутила, пероксидикарбонат дицетила, пероксидикарбонат димиристила,пероксинеогептаноат трет-бутила, пероксипивалат трет-амила, пероксид дидеканоила, перокси-2 этилгексаноат трет-амила, пероксиизобутират трет-бутила, 1,4-ди-(трет-бутилперкосикарбо)циклогексан,-2 022077 пероксиацетат трет-бутила, пероксибензоат трет-бутила, пероксид ди-трет-амила, пероксид трет-бутила кумила, бис-(трет-бутил)пероксид, пероксид дикумила, пероксид дилауроила (DLP) или пероксидикарбонат ди-(4-трет-бутилциклогексила). Предпочтительно реакцию инициируют в присутствии пероксида дилауроила. Количество пероксида дилауроила, применяемого при циклизации, предпочтительно составляет от 1 до 2,5 экв. В предпочтительном варианте осуществления изобретения пероксид дилауроила добавляют в среду фракционным способом. Реакции присоединения и/или циклизации осуществляют в растворителе, обычно применяемом в свободнорадикальной химии, таком как 1,2-дихлорэтан, дихлорметан, бензол, толуол, трифторметилбензол, хлорбензол, гексан, циклогексан, гептан, октан, этилацетат, трет-бутиловый спирт и их смеси. Предпочтительно применяют этилацетат в стадии присоединения соединения формулы (II) к соединению формулы (III), тогда как циклизацию соединения формулы (IV) до образования соединения формулы (V) выгодно осуществляют в хлорбензоле, этилацетате или этилбутирате. В этом последнем случае наиболее предпочтительным является хлорбензол. Превращение соединения формулы (V) в соединение формулы (VI) выгодно осуществляют в присутствии кислоты Льюиса, такой как изопропоксид алюминия или изопропоксид самария. К тому же это превращение проводят предпочтительно в спирте (первичном или вторичном) и еще более предпочтительно в изопропаноле. Предпочтительно каталитическое количество n-толуолсульфоновой кислоты добавляют к смеси один раз весь тетралон (V), поглощенный в конце превращения соединения формулы (V) в соединение формулы (VI). Ароматизацию соединения (VI) осуществляют в присутствии хинона, предпочтительно в присутствии 2,3-дихлор-5,6-дициано-1,4-бензохинона (DDQ) или тетрахлорбензохинона (TCQ). Еще более предпочтительно ароматизацию осуществляют в присутствии TCQ с нагреванием в колбе с обратным холодильником с толуолом. Соединение формулы (II) доступно специалисту в данной области техники посредством классических химических реакций и/или описанных в литературных источниках. Этот способ представляет особый интерес по следующим причинам: он позволяет получить соединение формулы (I) в промышленном масштабе с хорошими выходами исходя из простых и не очень дорогостоящих исходных веществ; только промежуточные продукты формулы (VI) и (VII) требуют стадии очистки и выделения. Соединения формулы (V) и (VI), полученные способом согласно изобретению, являются новыми и пригодны в качестве промежуточных продуктов синтеза агомелатина. Приведенные ниже примеры демонстрируют изобретение, но никоим образом не ограничивают его. Для того чтобы обосновать реакционный путь, промежуточные продукты синтеза были систематически выделены и охарактеризованы. Тем не менее, возможно значительно оптимизировать способы,ограничивая число промежуточных продуктов. Таким образом, пример 2, приведенный подробнее ниже,соответствует тому же самому реакционному пути, который приведен в примере 1, но только с той разницей, что был выделен (7-метокси-1,2-дигидро-1-нафталенил)ацетонитрил и (7-метокси-1 нафтил)ацетонитрил. Пример 1. N-[2-(7-Метокси-1-нафтил)этил]ацетамид. Стадия А. Дитиокарбонат S-[1-(цианометил)-4-(4-метоксифенил)-4-аксо 6 утил]-O-этила. Раствор цианида аллила (4,8 мл, 60,0 ммоль) и дитиокарбоната S-[2-(4-метоксифенил)-2-оксоэтил]O-этил [дитиокарбонат S-[2-(4-метоксифенил)-2-оксоэтил]-O-этил, полученный в соответствии с протоколом, описанным в Batanero, В. et al., J. Org. Chem. 2001, 66, 320] (8,1 г, 30,0 ммоль) в этилацетате (30 мл) нагревали в колбе с обратным холодильником в течение 15 мин под атмосферой азота. Во-первых,добавляют количество пероксида дилауроила (10 мол.%) к раствору в колбе с обратным холодильником. Через 1 ч 30 мин равным образом вводили другое количество пероксида дилауроила (5 мол.%). Когда реагенты были полностью израсходованы, смесь охлаждали при температуре окружающей среды и концентрировали под сниженным давлением. Затем сырую смесь очищали колоночной флешхроматографией (петролейный эфир - этилацетат: 95-5 до 80-20), чтобы получить соединение, указанное в заголовке в виде масла с выходом в 98%. Стадия В. (7-Метокси-4-оксо-1,2,3,4-тетрагидро-1-нафталенил)ацетонитрил. Соединение стадии А, используемое в дальнейшем без очистки, растворяли в хлорбензоле (900 мл) и раствор нагревали в колбе с обратным холодильником в течение 15 мин под атмосферой азота. Затем пероксид дилауроила постепенно добавляли к раствору в колбе с обратным холодильником (10 мол.% каждые 10 мин). В конце реакции смесь охлаждали при температуре окружающей среды и концентрировали под сниженным давлением. Затем вводили ацетонитрил, чтобы осадить большую часть производных пероксида дилауроила. После этого смесь отфильтровывали, концентрировали под сниженным давлением и очищали колоночной флеш-хроматографией (петролейный эфир - этилацетат: 60-40), чтобы получить соединение, указанное в заголовке в виде твердого вещества с выходом в 40%. МСВР (EI, m/z) рассчит. для C13H13NO2: 215.0946; обнаружено: 215.0946. Стадия С. (7-Метокси-1,2-дигидро-1-нафталенил)ацетонитрил. Изопропоксид алюминия (2,05 г, 10,0 ммоль) добавляли к раствору соединения, полученного на стадии В (680 мг, 3,15 ммоль) в изопропаноле (15 мл) при температуре окружающей среды. Реакционную смесь нагревали в колбе с обратным холодильником. После того как все исходные вещества были полностью израсходованы, туда добавляли несколько кристаллов моногидрата n-толуолсульфоновой кислоты и аппарат Дина Старка устанавливали на верхушку колбы. Смесь снова нагревали в колбе с обратным холодильником в течение 1 ч, в течение которого изопропанол постепенно заменяли толуолом с помощью аппарата Дина Старка. Затем добавляли раствор 1N HCl и полученные фазы разделяли. Водную фазу экстрагировали этилацетатом, тогда как органические фазы промывали насыщенным растворомNHCO3, насыщенным раствором NaCl, затем высушивали над MgSO4, отфильтровывали и концентрировали под сниженным давлением. Остаток очищали колоночной хроматографией (петролейный эфир этилацетат: 80-20), чтобы получить продукт, указанный в заголовке в виде масла с выходом в 85%. МСВР (EI, m/z) рассчит. для C13H13NO: 199.0997; обнаружено: 199.1001. Стадия D. (7-Метокси-1-нафтил)ацетонитрил. Способ А. К раствору соединения, полученного на стадии С (1,0 г, 5,0 ммоль), в дихлорметане (50 мл) при температуре окружающей среды добавляли DDQ (1,4 г, 6,0 ммоль). Реакционную смесь перемешивали в течение 2 дней, затем очищали с помощью насыщенного раствора NaHCO3. Водную фазу экстрагировали этилацетатом, тогда как органическую фазу промывали насыщенным раствором NaCl, высушивали надMgSO4, отфильтровывали и концентрировали под сниженным давлением. Остаток очищали колоночной хроматографией (петролейный эфир - этилацетат: 80-20), чтобы получить продукт, указанный в заголовке в виде твердого вещества с выходом в 55%. Способ В. К раствору TCQ (615 мг, 2,5 ммоль) в толуоле (1,5 мл), нагретому до 80C, добавляли соединение,полученное на стадии С (462 мг, 2,3 ммоль), растворенное в толуоле (3,5 мл). Затем смесь нагревали в колбе с обратным холодильником в течение 2,5 ч, затем разбавляли с водой и экстрагировали петролейным эфиром. Органическую фазу промывали раствором NaOH (30 мас.%) и водой, затем высушивали над MgSO4, отфильтровывали и концентрировали под сниженным давлением. Остаток очищали колоночной хроматографией (петролейный эфир - этилацетат: 80-20), чтобы получить продукт, указанный в заголовке в виде твердого вещества с выходом в 61%. МСВР (EI, m/z) рассчит. для C13H11NO: 197.0841; обнаружено: 197.0838. Стадия Е. N-[2-(7-Метокси-1-нафтил)этил]ацетамид. Реакцию осуществляли большей партией с целью оптимизировать полученный выход. В 8 л реактор загружали 136 г никеля Ренея, 2,06 л этанола и 0,23 л воды. При перемешивании при 70C и под 30 бар водорода медленно добавляли соединение, полученное в стадии D (0,8 кг), растворенное в уксусном ангидриде (2,4 л). В конце добавления реакционную среду перемешивали 1 ч под водородом при 30 бар, затем реактор декомпрессировали и раствор отфильтровывали. После концентрирования среды остаток кристаллизовали в смеси этанол/вода 35/65, чтобы получить продукт, указанный в заголовке, с выходом в 89% и химической чистотой более чем 99%. Точка плавления: 108C. Пример 2. N-[2-(7-Метокси-1-нафтил)этил]ацетамид. Стадия А. (7-Метокси-1,2-дигидро-1-нафталенил)ацетонитрил. Раствор цианида аллила (6,75 мл, 84,0 ммоль) и дитиокарбоната S-[2-(4-метоксифенил)-2-оксоэтил]O-этил (11,3 г, 42,0 ммоль) в этилацетате (45 мл) нагревали в колбе с обратным холодильником в течение 15 мин под атмосферой азота. В первую очередь добавляют количество пероксида дилауроила (10 мол.%) к раствору в колбе с обратным холодильником. Через 1 ч 30 мин равным образом вводили другое количество пероксида дилауроила (5 мол.%). После того как все исходные вещества были полностью израсходованы, смесь охлаждали при температуре окружающей среды и концентрировали под сниженным давлением. Сырую смесь растворяли в хлорбензоле (640 мл) и раствор нагревали в колбе с обратным холодильником в течение 15 мин под атмосферой азота. Затем пероксид дилауроила постепенно добавляли к раствору в колбе с обратным холодильником (10 мол.% каждые 10 мин). В конце реакции смесь охлаждали при температуре окружающей среды и концентрировали под сниженным давлением. Затем вводили ацетонитрил, чтобы осадить большую часть производных пероксида дилауроила. После этого смесь отфильтровывали, концентрировали под сниженным давлением. Половину сырого масла,полученного таким образом, растворяли в изопропаноле (100 мл) при температуре окружающей среды в присутствии изопропоксида алюминия (13,6 г, 66,6 ммоль). Реакционную смесь нагревали в колбе с обратным холодильником. После того как все исходные вещества были полностью израсходованы, туда добавляли несколько кристаллов моногидратной п-толуолсульфоновой кислоты и аппарат Дина Старка устанавливали на верхушку колбы. Смесь снова нагревали в колбе с обратным холодильником в течение 2 ч, в течение которых изопропанол постепенно заменяли толуолом с помощью аппарата Дина Старка. Затем добавляли раствор 1N HCl и полученные фазы разделяли. Водную фазу экстрагировали этилацетатом, тогда как органические фазы промывали насыщенным раствором NaHO3, насыщенным растворомNaCl, затем высушивали над MgSO4, отфильтровывали и концентрировали под сниженным давлением. Остаток очищали колоночной хроматографией (петролейный эфир - этилацетат: 80-20), чтобы получить продукт, указанный в заголовке в виде масла с выходом в 24%. МСВР (EI, m/z) рассчит. для C13H13NO: 199.0997; обнаружено: 199.1001. Стадия В. (7-Метокси-1-нафтил)ацетонитрил. Осуществляли способом, аналогичным стадии D из примера 1. Стадия С. N-[2-(7-Метокси-1-нафтил)этил]ацетамид. Осуществляли способом, аналогичным стадии Е из примера 1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ промышленного синтеза соединения формулы (I) отличающийся тем, что подвергают взаимодействию цианид аллила формулы (II) где Ха представляет собой группу -S-C(S)-OR, в которой R представляет собой линейную или разветвленную (C1-C6)алкильную группу,чтобы получить соединение формулы (IV) в которой Ха является таким, как определено выше,это последнее соединение по выбору может быть выделено до того, как его подвергнут реакции циклизации в присутствии свободнорадикального инициатора, чтобы получить соединение формулы (V) которое также по выбору может быть выделено до того, как его подвергнут реакции восстановления/дегидратации, чтобы получить соединение формулы (VI) которое затем подвергают реакции ароматизации, чтобы получить соединение формулы (VII) которое подвергают восстановлению водородом в присутствии никеля Ренея в аммиачном этаноле или смеси этанола и воды и реакции с уксусным ангидридом, чтобы получить соединение формулы (I), которое выделяют в виде твердого вещества. 2. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что соединение формулы(VII) затем подвергают восстановлению водородом в присутствии никеля Ренея в среде аммиачного этанола, затем преобразуют в соль с использованием соляной кислоты, чтобы получить соединение формулы (VIII) которое последовательно подвергают воздействию ацетата натрия и затем уксусного ангидрида, чтобы получить соединение формулы (I), которое выделяют в виде твердого вещества. 3. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что соединение формулы(VII) подвергают восстановлению водородом в присутствии никеля Ренея в среде, содержащей уксусный ангидрид в аммиачном этаноле или смеси этанола и воды, чтобы получить соединение формулы (I), которое выделяют в виде твердого вещества. 4. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что группа Ха = -S-C(S)OC2H5. 5. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что свободнорадикальные реакции инициируют термическим способом при температуре, находящейся между 50 и 140C. 6. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что циклизацию соединения формулы (IV) осуществляют при температуре, находящейся между 130 и 135C. 7. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что стадию присоединения соединения формулы (II) к соединению формулы (III) и стадию циклизации соединения формулы (IV) инициируют в присутствии пероксида дилауроила. 8. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что стадию присоединения соединения формулы (II) к соединению формулы (III) осуществляют в хлорбензоле. 9. Способ синтеза соединения формулы (I) по п.1, отличающийся тем, что стадию циклизации продукта присоединения формулы (IV) до получения соединения формулы (V) осуществляют в этилацетате. 10. Способ синтеза по п.1, отличающийся тем, что превращение соединения формулы (V) в соединение формулы (VI) осуществляют в присутствии изопропоксида алюминия. 11. Способ синтеза по п.1, отличающийся тем, что превращение соединения формулы (V) в соединение формулы (VI) осуществляют в изопропаноле. 12. Способ синтеза по п.1, отличающийся тем, что каталитическое количество птолуолсульфоновой кислоты добавляют к смеси в конце превращения соединения формулы (V) в соединение формулы (VI). 13. Способ синтеза по п.1, отличающийся тем, что ароматизацию соединения формулы (VI) осуществляют в присутствии хинона. 14. Способ синтеза по п.1, отличающийся тем, что ароматизацию соединения формулы (VI) осуществляют в присутствии тетрахлорбензохинона с нагреванием в колбе с обратным холодильником с толуолом. 15. Соединение формулы (V) по п.1. 16. Применение соединения формулы (V) по п.15 в синтезе агомелатина. 17. Соединение формулы (VI) по п.1. 18. Применение соединения формулы (VI) по п.17 в синтезе агомелатина. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: C07C 233/18, C07C 231/02, C07C 253/30, C07C 255/40, C07C 255/37
Метки: синтеза, способ, новый, агомелатина
Код ссылки
<a href="https://eas.patents.su/7-22077-novyjj-sposob-sinteza-agomelatina.html" rel="bookmark" title="База патентов Евразийского Союза">Новый способ синтеза агомелатина</a>
Предыдущий патент: Производные гексафторизопропил карбамата, их получение и их терапевтическое применение
Следующий патент: Гетероциклическое соединение и его применение
Случайный патент: Пептидомиметик smac, применимый в качестве ингибитора iap (ингибитор белков апоптоза)











