Хинолины и их аналоги в качестве модуляторов сиртуина
Номер патента: 21938
Опубликовано: 30.10.2015
Авторы: Диш Джереми С., Спрингер Стефани К., Ву Чи Б., Перни Роберт Б., Блум Чарльз А.
Формула / Реферат
1. Соединение формулы (III)
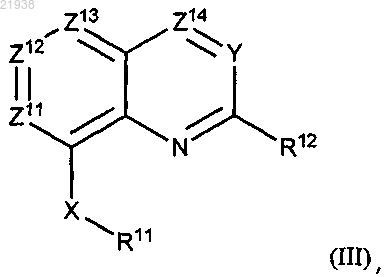
или его соль, где
каждый из Z11, Z13 и Z14 независимо выбран из N и CR, Z12 представляет собой CR, где R выбран из водорода, галогена и C1-С4 алкила;
Y выбран из N и CR13, где R13 выбран из водорода, галогена, -C1-C4 алкила, -О-(C1-C4 алкила) и -О-(C1-C2 фторзамещенного алкила);
не более двух из Z11, Z13, Z14 и Y представляют собой N;
X выбран из ![]() ,
, ![]() ,
,
где ![]() представляет собой положение, в котором X присоединен к R11, и
представляет собой положение, в котором X присоединен к R11, и
R11 выбран из карбоцикла и гетероцикла, где R11 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -CºN, C1-C4 алкила, С3-С7 циклоалкила, С1-С4 фторзамещенного алкила, =O, -O-R14, -S-R14, -(C1-C4 алкил)-N(R14)(R14), -N(R14)(R14), -О-(С2-С4 алкил)-N(R14)(R14), -C(O)-N(R14)(R14), -C(O)-O-R14 и -(С1-С4 алкил)-С(O)-N(R14)(R14), при этом, когда R11 является фенилом, R11 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси, фторзамещенным 3,4-этилендиокси, O-(насыщенным гетероциклом), фторзамещенным -О-(насыщенным гетероциклом) и C1-C4 алкилзамещенным О-(насыщенным гетероциклом), где
каждый R14 независимо выбран из водорода и -С1-С4 алкила; или
два R14, вместе с атомом азота, к которому они присоединены, образуют 4-8-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из N, S, S(=O), S(=O)2 и О, где
когда R14 является алкилом, алкил необязательно замещен одним или более -ОН, -О-(C1-C4 алкилом), фтором, -NH2, -NH(C1-C4 алкилом), -N(C1-C4 алкилом)2, -NH(СН2СН2ОСН3) или -N(СН2СН2ОСН3)2, и
когда два R14, вместе с атомом азота, к которому они присоединены, образуют 4-8-членный насыщенный гетероцикл, причем насыщенный гетероцикл необязательно замещен по атому углерода -ОН, -C1-C4 алкилом, фтором, -NH2, -NH(C1-C4 алкилом), -N(C1-C4 алкилом)2, -NH(СН2СН2ОСН3) или
-N(СН2СН2ОСН3)2; и необязательно замещен по любому замещаемому атому азота -C1-C4 алкилом, фторзамещенным C1-C4 алкилом или -(СН2) 2-О-СН3; и
R12 выбран из карбоцикла и гетероцикла, присоединенного к остальной части соединения через атом углерода кольца, где R12 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -CºN, C1-C4 алкила, С3-С7 циклоалкила, С1-С2 фторзамещенного алкила, -O-R14, -S-R14, -S(O)-R14,
-S(O)2-R14, -(С1-С4 алкил)-N(R14)(R14), -N(R14)(R14), -О-(С2-С4 алкил)-N(R14)(R14), -C(O)-N(R14)(R14), -(C1-C4 алкил)-С(О)-N(R14)(R14), -O-фенила, фенила и второго гетероцикла, при этом, когда R12 является фенилом, R12 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси, фторзамещенным 3,4-этилендиокси или -O-(насыщенным гетероциклом), где любой фенил, насыщенный гетероцикл или второй гетероциклический заместитель в R12 необязательно замещен галогеном, -CºN, C1-C4 алкилом, C1-С2 фторзамещенным алкилом, -О-(C1-C2 фторзамещенным алкилом),
-O-(С1-С4 алкилом), -S-(C1-C4 алкилом), -S-(C1-C2 фторзамещенным алкилом), -NH-(C1-C4 алкилом) и -N-(C1-C4 алкилом)2,
где "карбоцикл" в определениях радикалов R11 и R12 представляет собой 5-7-членное насыщенное, ненасыщенное или ароматическое моноциклическое кольцо;
"гетероцикл" в определениях радикалов R11 и R12 представляет собой 4-7-членное насыщенное, ненасыщенное или ароматическое моноциклическое кольцо, включающее один или более гетероатомов, выбранных из атомов N, О и S.
2. Соединение по п.1, где
R12 выбран из моноциклического карбоцикла и моноциклического гетероцикла, присоединенного к остальной части соединения через атом углерода кольца, где R12 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -CºN, C1-C4 алкила, С3-С7 циклоалкила, C1-C2 фторзамещенного алкила, -O-R14, -S-R14, -S(O)-R14, -S(O)2-R14, -(С1-С4 алкил)-N(R14)(R14), -N(R14)(R14), -О-(С2-С4 алкил)-N(R14)(R14), -C(O)-N(R14)(R14), -(C1-C4 алкил)-C(O)-N(R14)(R14), -O-фенила, фенила и второго гетероцикла, при этом, когда R12 является фенилом, R12 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси, фторзамещенным 3,4-этилендиокси или -O-(насыщенным гетероциклом), где любой фенил, насыщенный гетероцикл или второй гетероциклический заместитель в R12 необязательно замещены галогеном, -CºN, C1-C4 алкилом, C1-C2 фторзамещенным алкилом, -О-(C1-C2 фторзамещенным алкилом), -O-(C1-C4 алкилом), -S-(C1-C4 алкилом), -S-(C1-C2 фторзамещенным алкилом), -NH-(C1-C4 алкилом) и -N-(C1-C4 алкилом)2.
3. Соединение по п.1 или 2, где R12 выбран из арила и гетероарила.
4. Соединение по п.3, где R12 выбран из

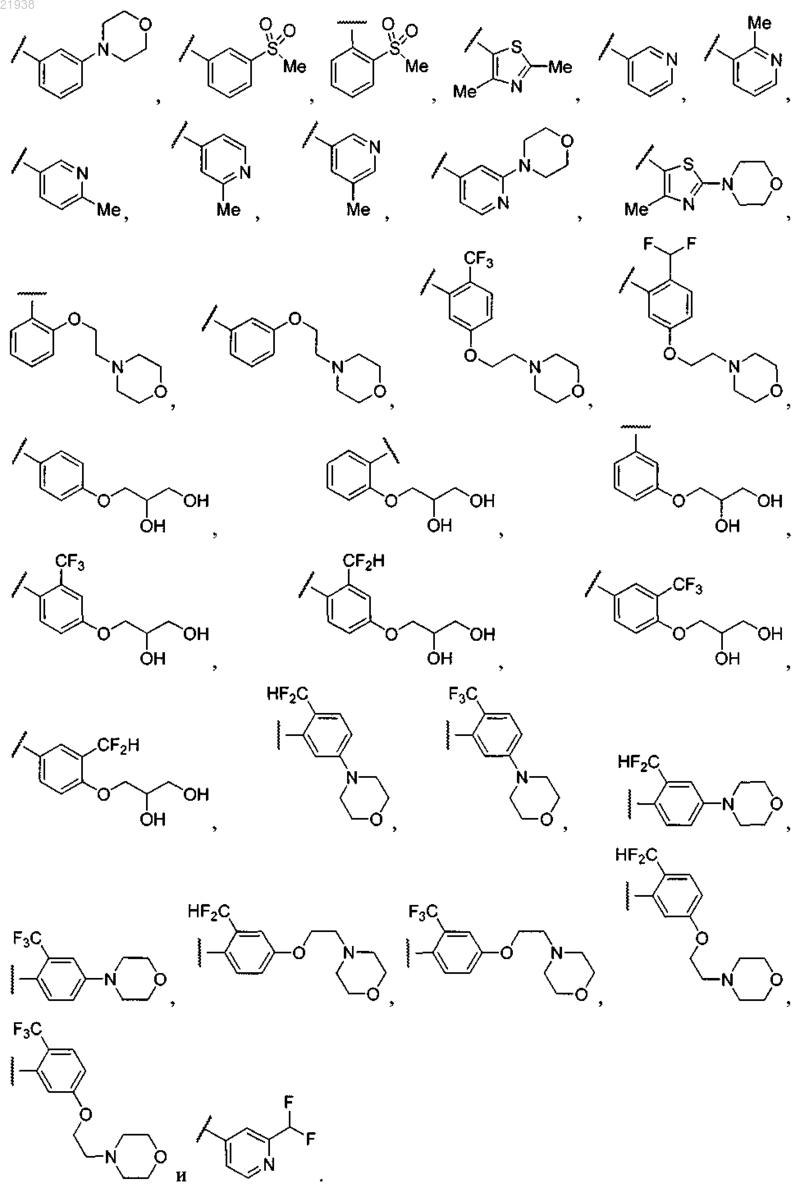
5. Соединение по любому из пп.1-4, выбранное из любого из
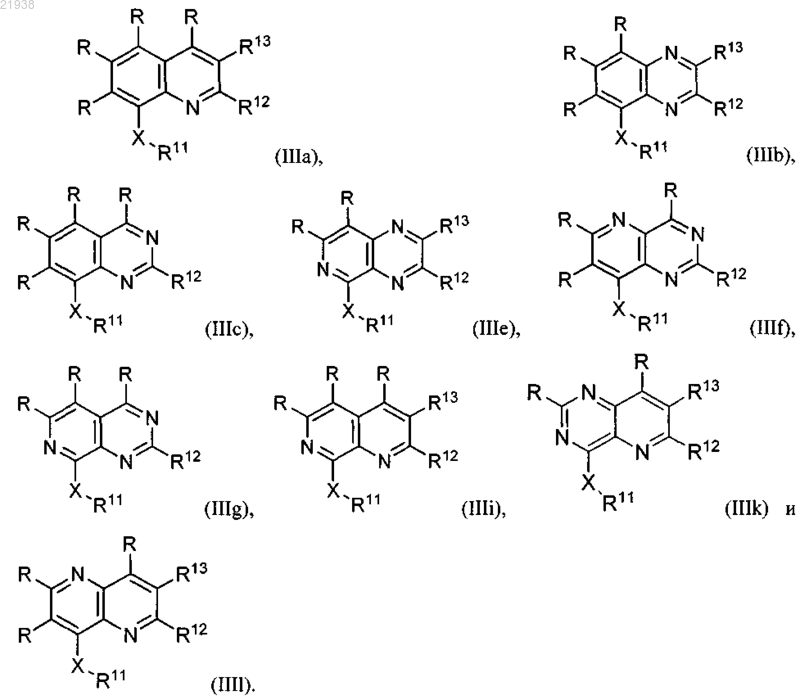
6. Соединение по п.5, где соединение представлено структурными формулами, выбранными из (IIIa), (IIIi), (IIIk) или (IIIl).
7. Соединение по п.6, где соединение представлено структурной формулой (IIIa)

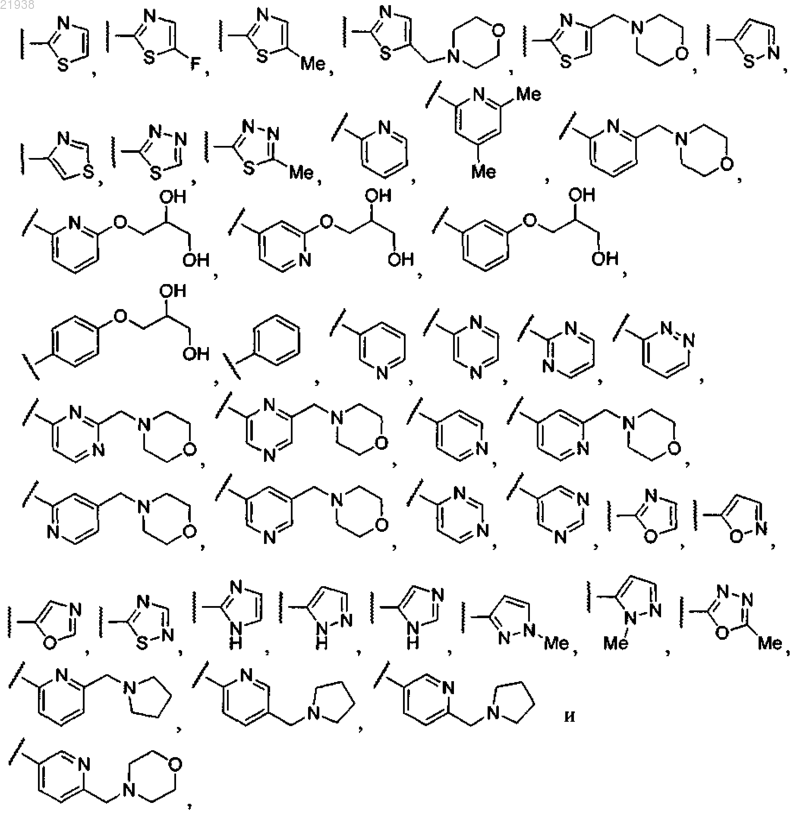
8. Соединение по любому из пп.1-7, где R11 выбран из
9. Соединение по п.1 формулы (IV)
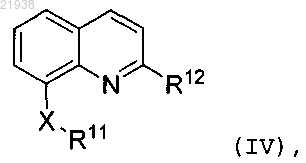
где X выбран из ![]() или
или ![]() ;
;
и R12 выбран из фенила и пиридила, где R12 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, C1-C4 алкила, фторзамещенного C1-C2 алкила, -O-R14, S(O)2-R14, -(С1-С4 алкил)-N(R14)(R14) и -N(R14)(R14), при этом, когда R12 является фенилом, R12 также необязательно замещен 3,4-метилендиокси или О-(насыщенным гетероциклом).
10. Соединение по п.9, где соединение выбрано из следующих соединений:

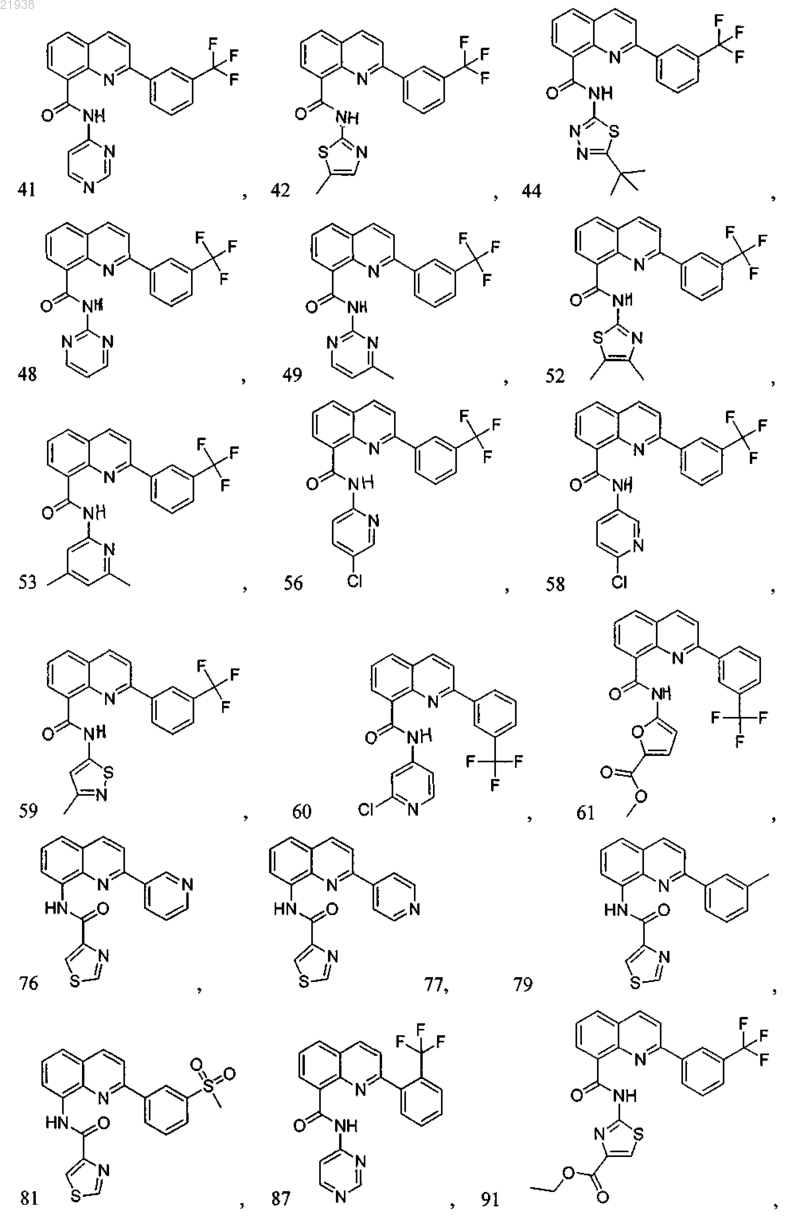
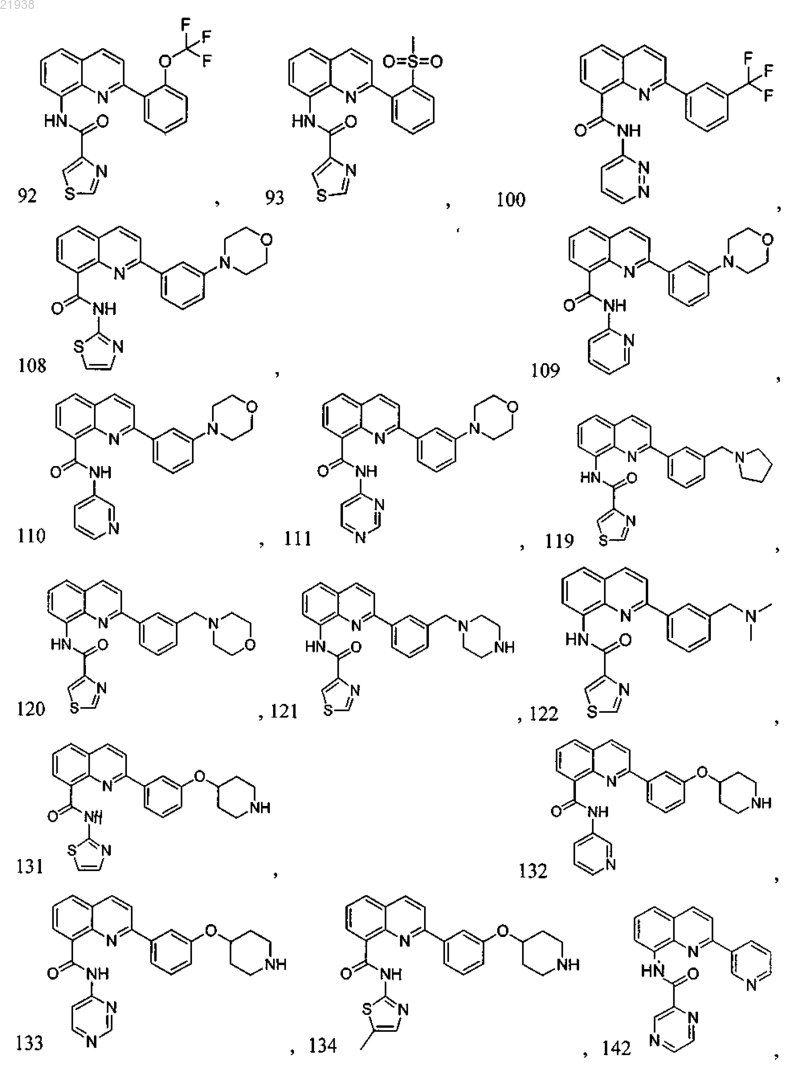
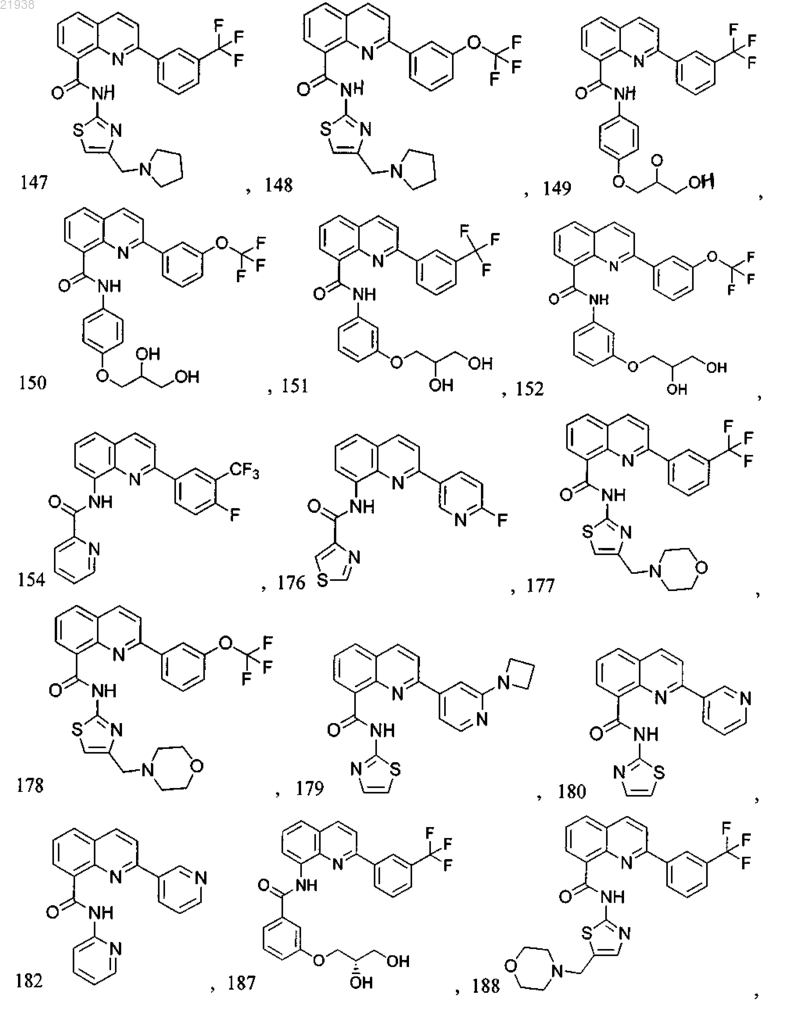
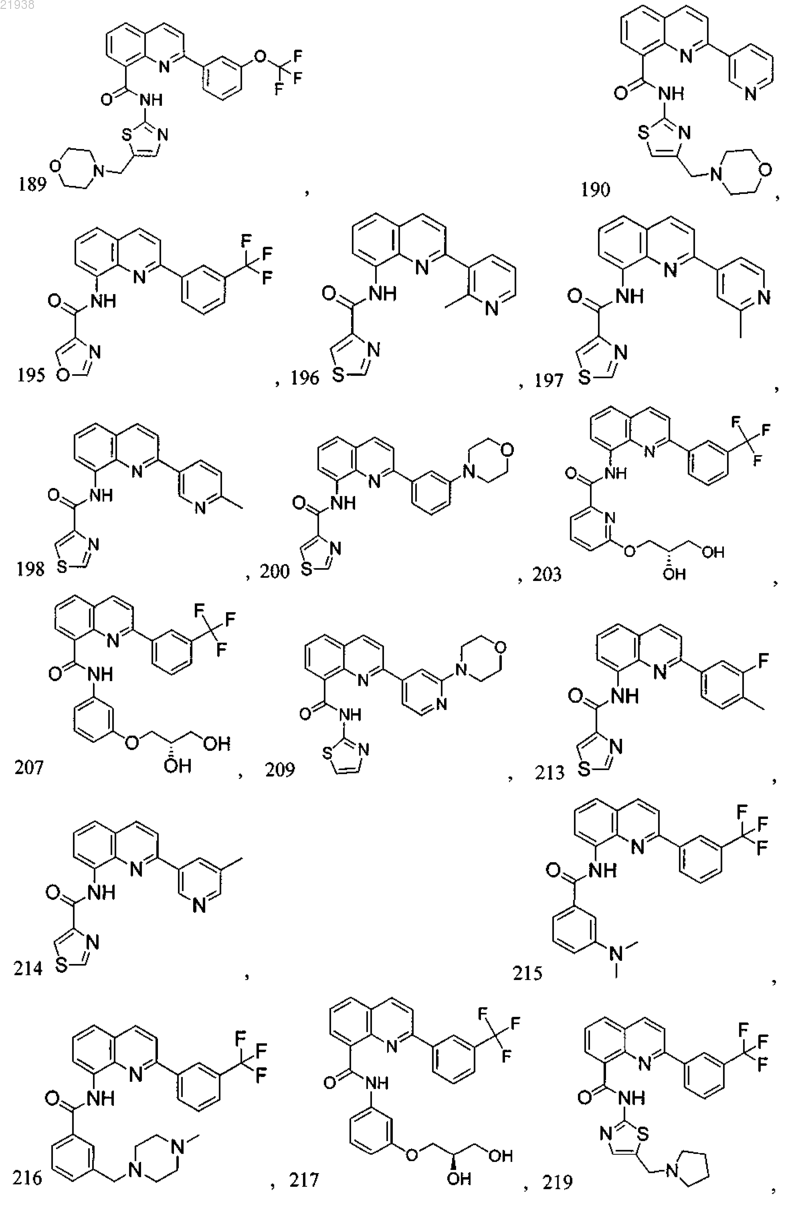
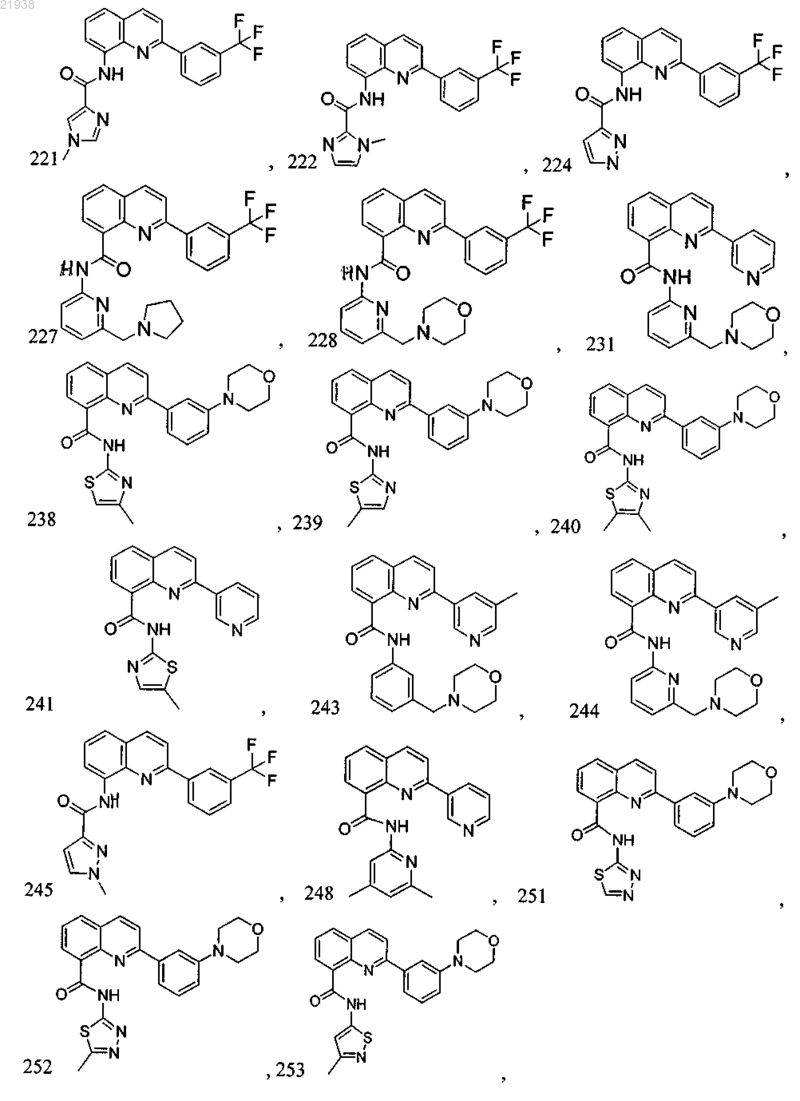
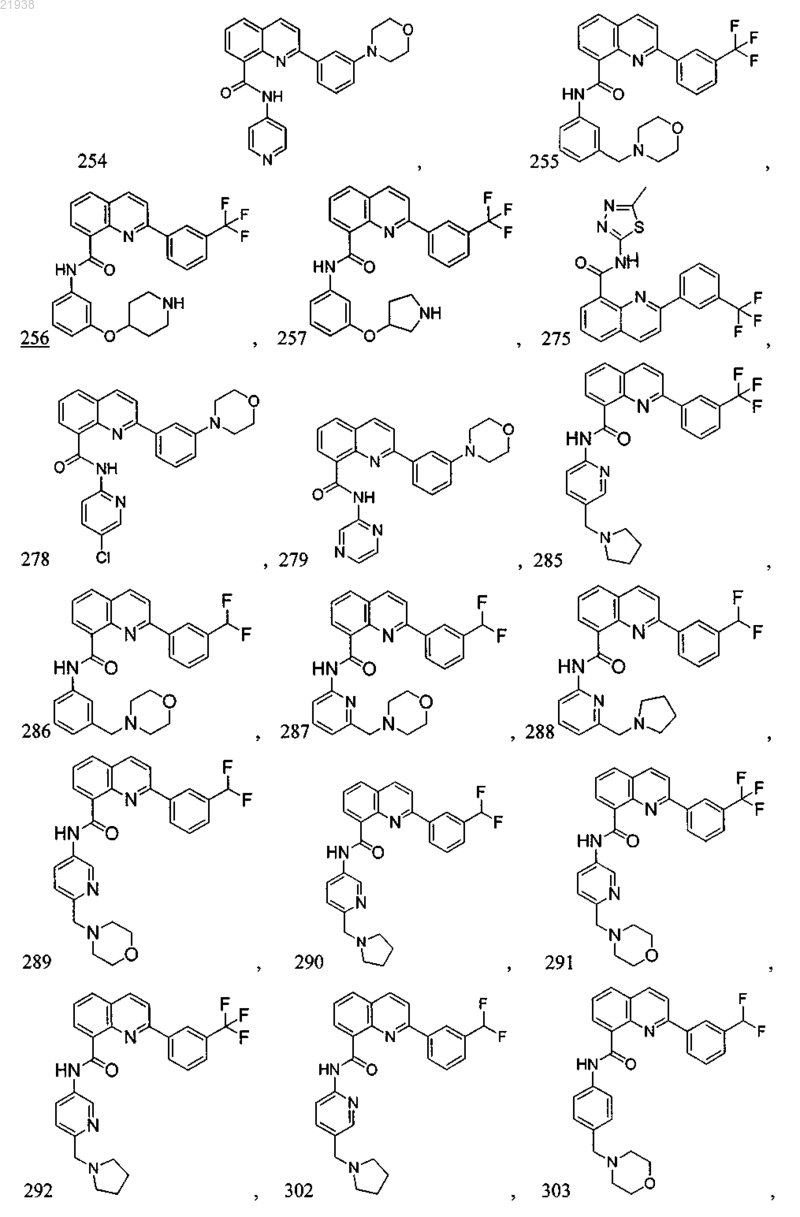
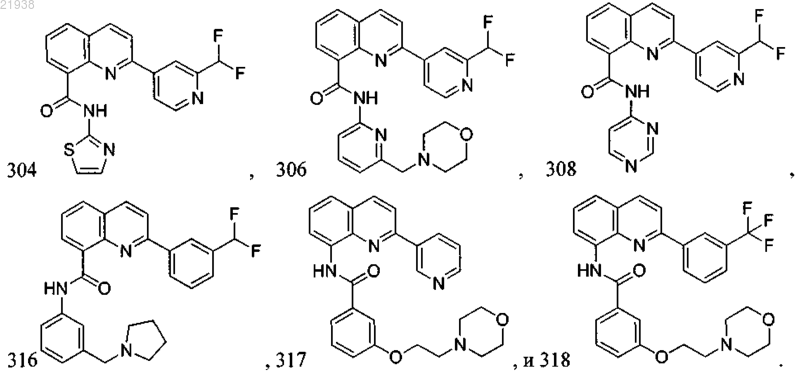
11. Соединение по любому из пп.1-10, где соль является фармацевтически приемлемой солью.
12. Фармацевтическая композиция, включающая соединение по п.11 и фармацевтически приемлемый носитель.
13. Фармацевтическая композиция по п.12, дополнительно включающая дополнительное активное вещество, выбранное из противовоспалительных средств, анальгетиков, противомикробных средств, противогрибковых средств, антибиотиков, витаминов, антиоксидантов и солнцезащитных средств.
14. Способ лечения субъекта, страдающего от или подверженного риску развития резистентности к инсулину, метаболического синдрома, диабета или их осложнений, или повышения чувствительности к инсулину у субъекта, включающий введение субъекту, нуждающемуся в этом, композиции по п.12.
15. Применение соединения по п.11 для лечения заболеваний или нарушений, ассоциированных с лечением резистентности к инсулину, метаболического синдрома, диабета или их осложнений, или для повышения чувствительности к инсулину у субъекта.
16. Применение соединения по п.11 в производстве лекарственного средства для лечения резистентности к инсулину, метаболического синдрома, диабета или их осложнений, или для повышения чувствительности к инсулину у субъекта.
Текст
и способы их применения. Сиртуин-модулирующие соединения могут применяться для увеличения продолжительности жизненного цикла клетки и для лечения и/или профилактики большого ряда заболеваний и нарушений, включающих, например, заболевания или нарушения, связанные со старением или стрессом, диабетом, ожирением, нейродегенеративными заболеваниями,сердечно-сосудистым заболеванием, нарушениями свертываемости крови, воспалением, раком и/или гиперемией, а также заболевания или нарушения, при которых требуется повысить митохондриальную активность. Также предложены композиции, включающие сиртуинмодулирующее соединение в комбинации с другим терапевтическим средством. Семейство генов регуляторов молчащей информации (SIR) представляет собой высоко консервативную группу генов, присутствующих в геномах организмов от архебактерий до высших эукариотов. Белки, кодируемые SIR, участвуют в различных процессах - от регулирования сайленсинга генов, до репарации ДНК. Белки, кодируемые представителями семейства генов SIR, демонстрируют высокую консервативность последовательности в коровом домене размером 250 аминокислот. Хорошо изученнным геномом в данном семействе является SIR2 S. cerevisiae, который участвует в сайленсинге НМ локусов,которые содержат информацию, определяющую тип спаривания у дрожжей, эффекты положения теломеров и старение клетки. Дрожжевой белок Sir2 принадлежит к семейству гистондеацетилаз. ГомологSir2, CobB в Salmonella typhimurium, функционирует как NAD (никотинамидадениндинуклеотид)зависимая АДФ-рибозилтрансфераза. Белок Sir2 представляет собой деацетилазу класса III, которая использует NAD в качестве косубстрата. В отличие от других деацетилаз, многие из которых участвуют в сайленсинге генов, Sir2 нечувствителен к таким ингибиторам гистондеацетилаз класса I и II, как трихостатин A (TSA). Деацетилирование ацетиллизина под действием Sir2 тесно связано с гидролизом NAD, в результате которого образуется никотинамид и новое соединение ацетил-АДФ-рибозы. NAD-зависимая деацетилазная активность Sir2 является существенной для его функций, которые могут связывать его биологическую роль с клеточным метаболизмом в дрожжах. У млекопитающих гомологи Sir2 обладают NADзависимой гистондеацетилазной активностью. Биохимические исследования показали, что Sir2 может быстро деацетилировать N-концевые хвосты гистонов Н 3 и Н 4, приводя к образованию 1-O-ацетил-АДФ-рибозы и никотинамида. Штаммы с дополнительными копиями SIR2 демонстрируют повышенный сайленсинг рДНК и на 30% более длительный жизненный цикл. Недавно было показано, что дополнительные копии гомолога SIR2 из С.elegans, sir-2.1,и ген D. melanogaster dSir2 значительно увеличивают продолжительность жизни данных организмов. Это означает, что SIR2-зависимый путь регуляции старения возник на ранних этапах эволюции и являлся достаточно консервативным. На сегодняшний день считается, что гены Sir2 появились с целью повышения здоровья организма и сопротивления стрессам, чтобы увеличить его шанс на выживание в неблагоприятной ситуации. У людей существует семь Sir2-подобных генов (SIRT1-SRT7), которые имеют общую консервативную каталитическую область Sir2. SIRT1 представляет собой ядерный белок с наиболее высокой степенью гомологии последовательности с Sir2. SIRT1 посредством деацетилирования регулирует множество мишеней в клетке, включая супрессор образования опухолей р 53, фактор клеточной сигнализации NF-В И фактор транскрипции FOXO.SIRT3 является гомологом SIRT1, консервативным у прокариотов и эукариотов. Белок SIRT3 направляется в кристы митохондрий посредством уникального домена, расположенного на N-конце. SIRT3 обладает NAD+-зависимой деацетилазной активностью и экспрессируется повсеместно, особенно в метаболически активных тканях. В процессе транспорта в митохондрии SIRT3, как полагают, расщепляется с образованием меньшей, активной формы под действием митохондриальной матриксной пептидазы процессинга (МРР). Ограничение калорий, как известно, в течение более чем 70 лет улучшало состояние здоровья и увеличивало продолжительность жизни у млекопитающих. Продолжительность жизни дрожжей, как и у многоклеточных, также увеличивается в результате вмешательств, которые напоминают ограничение калорий, например низкое содержание глюкозы. Открытие того, что и дрожжи, и мухи, лишенные генаSIR2, не живут дольше при ограничении калорий, свидетельствует о том, что гены SIR2 опосредуют благопрятное влияние на состояние здоровья при диете с ограничением калорий. Кроме того, мутации, которые снижают активность глюкозо-чувствительного цАМФ (аденозин-3',5'-монофосфат)-зависимого(РКА) пути у дрожжей, увеличивают продолжительность жизни в клетках дикого типа, но не в мутантном sir2 штамме, указывая на то, что SIR2, вероятно, является ключевым регулируемым компонентом пути ограничения калорий. Сущность изобретения В настоящем изобретении предложены новые сиртуин-модулирующие соединения, а также способы их применения. В одном аспекте изобретение предоставляет сиртуин-модулирующие соединения, имеющие структурную формулу (III) подробно описанные ниже. В другом аспекте изобретение предоставляет фармацевтическую композицию, включающую соединение формулы (III) и фармацевтически приемлемый носитель. В следующем аспекте изобретение предоставляет способ лечения субъекта, страдающего от или подверженного риску развития резистентности к инсулину, метаболического синдрома, диабета или их осложнений, или повышения чувствительности к инсулину у субъекта введением субъекту фармацевтической композиции, содержащей соединение формулы (III). В следующем аспекте изобретение относится к применению соединения формулы (III) для лечения заболеваний или нарушений, ассоциированных с лечением резистентности к инсулину, метаболического синдрома, диабета или их осложнений, или для повышения чувствительности к инсулину у субъекта. Кроме того, настоящее изобретение относится к применению соединения формулы (III) в производстве лекарственного средства для лечения резистентности к инсулину, метаболического синдрома, диабета или их осложнений, или для повышения чувствительности к инсулину у субъекта. В некоторых аспектах сиртуин-модулирующие соединения можно вводить отдельно или в комбинации с дополнительным активным веществом, выбранным из противовоспалительных средств, анальгетиков, противомикробных средств, противогрибковых средств, антибиотиков, витаминов, антиоксидантов и солнцезащитных средств. Подробное описание 1. Определения. Ниже сформулированы значения используемых в настоящей заявке следующих терминов и фраз. Если не указано иное, все технические и научные термины, используемые в настоящей заявке, имеют общепринятое значение, известное средним специалистам в данной области. Термин "средство" в настоящей заявке используется для обозначения химического соединения,смеси химических соединений, биологической макромолекулы (например, нуклеиновой кислоты, антитела, белка или его части, например пептида), или экстракта, полученного из биологических материалов,таких как клетки или ткани бактерий, растений, грибов или животных (в особенности млекопитающих). Активность подобных средств может сделать их пригодными в качестве "терапевтического средства",которое является биологически, физиологически или фармакологически активным веществом (или веществами), которое оказывает местное или системное действие в организме субъекта. Термин "биодоступный" в отношении соединения является общепринятым в данной области техники и относится к форме соединения, которая обеспечивает полную или частичную абсорбцию введенного субъекту или пациенту количества соединения, введение в организм субъекта или пациента, или обеспечивает физиологическую доступность иным путем."Биологически активная часть сиртуина" относится к части сиртуинового белка, обладающей биологической активностью, например, способностью к деацетилированию. Биологически активные части сиртуина могут включать коровый домен сиртуинов. Биологически активные части SIRT1, имеющего регистрационный номер в GenBank NP036370, которые включают NAD+-связывающий домен и субстратсвязывающий домен, например, могут без ограничения включать аминокислоты 62-293 из GenBankNP036370, кодируемые нуклеотидами 237-932 из GenBank NM012238. Таким образом, указанная область иногда упоминается как коровый домен. Другие биологически активные части SIRT1, также иногда называемые коровыми доменами, приблизительно включают аминокислоты 261-447 из GenBankNP036370, кодируемые нуклеотидами 834-1394 из GenBank NM012238; приблизительно включают аминокислоты 242-493 из GenBank NP036370, кодируемые нуклеотидами 777-1532 из GenBankNM012238; или приблизительно включают аминокислоты 254-495 из GenBank NP 036370, кодируемые нуклеотидами 813-1538 из GenBank NM012238. Термин "домашние животные" относится к кошкам и собакам. Используемый в настоящей заявке термин "собака(и)" обозначает любого представителя подвида Canis familiaris, который включает большое количество различных пород. Термин "кошка(и)" относится к животному из семейства кошачьих,включая домашних кошек и других представителей семейства Кошачьи, рода Кошки."Диабет" относится к высокому уровню сахара в крови или кетоацидозу, а также к хроническим,общим метаболическим нарушениям, которые являются результатом состояния с длительным сохранением высокого уровня сахара в крови или уменьшения толерантности к глюкозе. "Диабет" включает диабет и I типа, и II типа (инсулиннезависимый сахарный диабет или ИНСД). Факторы риска развития диабета включают следующие факторы: объем талии превышает 40 дюймов (101,6 см) для мужчин или 35 дюймов (88,9 см) для женщин, кровяное давление 130/85 мм рт.ст или выше, уровень триглицеридов превышает 150 мг/дл, уровень глюкозы в крови натощак превышает 100 мг/дл или уровень липопротеинов высокой плотности ниже 40 мг/дл у мужчин или 50 мг/дл у женщин. Термин "ED50" является общепринятым в данной области техники. В некоторых вариантах осуществления ED50 означает дозу препарата, который производит 50% его максимального ответа или эффекта,или альтернативно, дозу, которая производит заданный эффект у 50% тестируемых субъектов или препаратов. Термин "LD50" является общепринятым в данной области техники. В некоторых вариантах осуществления LD50 означает дозу препарата, которая является смертельной для 50% тестируемых субъектов. Термин "терапевтический индекс" является общепринятым термином в данной области техники, который относится к терапевтическому индексу препарата, определяемому как LD50/ED50. Термин "гиперинсулинемия" относится к состоянию у индивида, при котором уровень инсулина в крови превышает нормальный уровень. Термин "резистентность к инсулину" относится к состоянию, при котором нормальное количество инсулина производит сниженный биологический ответ по сравнению с биологическим ответом у субъекта, который не имеет резистентности к инсулину."Инсулинорезистентное нарушение", описываемое в настоящей заявке, относится к любому заболеванию или патологическому состоянию, которое вызвано или возникло вследствие резистентности к инсулину. Примеры включают: диабет, ожирение, метаболический синдром, инсулинорезистентные синдромы, синдром X, резистентность к инсулину, повышенное кровяное давление, гипертензию, высокий уровень холестерина в крови, дислипидемию, гиперлипидемию, атеросклеротическое заболевание,включая удар, болезнь коронарных артерий или инфаркт миокарда, гипергликемию, гиперинсулинемию и/или гиперпроинсулинемию, нарушение толерантности к глюкозе, замедленную секрецию инсулина,диабетические осложнения, включающие ишемическую болезнь сердца, стенокардию, застойную сердечную недостаточность, удар, нарушение когнитивных функций при деменции, ретинопатию, периферическую нейропатию, нефропатию, гломерулонефрит, гломерулосклероз, нефротический синдром, гипертензивный нефросклероз, некоторые типы рака (такие как рак эндометрия, молочной железы, простаты и толстой кишки), осложнения беременности, нарушения женской репродуктивной системы (такие как нерегулярные менструации, бесплодие, нерегулярную овуляцию, синдром поликистозных яичников(СПКЯ, липодистрофию, нарушения, связанные с обменом холестерина, такие как камни в желчном пузыре, холецистит и холелитиаз, подагру, обструктивное апноэ сна и нарушения дыхания, остеоартрит,а также профилактику и лечение потери костной массы, например остеопороза. Термин "сельскохозяйственные животные" относится к одомашненным четвероногим, которые включают животных, выращиваемых для получения мяса и различных субпродуктов, например жвачное животное, включая рогатый скот и других представителей рода Bos (Настоящие быки), свинью, включая домашнюю свинью и других представителей рода Sus (Кабаны), барана, включая овцу и других представителей рода Ovis (Бараны), домашних коз и других представителей рода Capra (Горные козлы); одомашненных четвероногих, выращиваемых в специальных целях, например для использования в качестве вьючного животного, например, лошадь, включая домашних лошадей и других представителей семейства Equidae (Лошадиные), род Equus (Лошади). Термин "млекопитающее" известен в уровне техники и примеры млекопитающих включают людей,приматов, сельскохозяйственных животных (включая крупный рогатый скот, свиней и т.д.), домашних животных (например, собак, кошек и т.д.) и грызунов (например, мышей и крыс). Индивиды с "ожирением" или лица, страдающие ожирением, обычно представляют собой лиц,имеющих индекс массы тела (ИМТ) по меньшей мере 25 или более. Ожирение может быть связано с резистентностью к инсулину или нет. Термины "парентеральное введение" и "вводимый парентерально" являются общепринятыми в данной области техники и относятся к способам введения за исключением энтерального и местного введения, осуществляемым обычно посредством инъекции, и включают, без ограничения, внутривенную,внутримышечную, внутриартериальную, интратекальную, интракапсулярную, внутриглазничную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную,внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную и надчревную инъекцию и инфузию."Пациент", "субъект", "индивид" или "реципиент" относятся либо к человеку, либо к животному за исключением человека. Термин "фармацевтически приемлемый носитель" является общепринятыми в данной области техники и относится к фармацевтически приемлемому материалу, составу или среде, такой как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал, участвующий в переносе или транспортировке любой рассматриваемой композиции или ее компонента. Каждый носитель должен являться "приемлемым" в том смысле, что он должен быть совместим с рассматриваемой композицией и ее компонентами и не должен оказывать нежелательного воздействия на пациента. Некоторые примеры материалов, которые могут служить фармацевтически приемлемыми носителями, включают: (1) сахара, такие как лактозу, глюкозу и сахарозу; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натриевую соль карбоксиметилцеллюлозы, этилцеллюлозу и ацетат целлюлозы; (4) порошковую трагакантовую камедь; (5) солод;(6) желатин; (7) тальк; (8) наполнители, такие как масло какао и воска для суппозиториев; (9) масла, такие как масло арахиса, хлопковое масло, масло сафлора, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные средства, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатные буферные растворы и (21) другие нетоксичные совместимые вещества, применяемые в фармацевтических композициях. Термин "профилактическое" или "терапевтическое" воздействие являются общепринятыми в данной области и относятся к введению лекарственного средства реципиенту. Если лекарственное средство вводят до клинического проявления нежелательного состояния (например, заболевания или другого не-3 021938 желательного состояния животного-реципиента), то тогда подобное воздействие является профилактическим, то есть защищает реципиента от развития нежелательного состояния, а если лекарственное средство вводят после проявления нежелательного состояния, то такое воздействие является терапевтическим(то есть, оно направлено на устранение, улучшение состояния или сдерживание существующего нежелательного состояния или побочных эффектов, развивающихся впоследствии). Термин "апирогенная" в отношении композиции относится к композиции, которая не содержит пироген в количестве, которое бы приводило к возникновению неблагоприятного эффекта (например, раздражению, лихорадке, воспалению, диарее, угнетению дыхания, эндотоксическому шоку и т.д.) у субъекта, которому была введена композиция. Например, подразумевается, что данный термин охватывает композиции, которые не содержат или практически не содержат эндотоксин, такой как, например, липополисахарид (ЛПС)."Репликативный жизненный цикл" клетки относится к количеству дочерних клеток, образовавшихся из индивидуальной "материнской клетки". "Хронологическое старение" или "хронологический жизненный цикл", с другой стороны, относится к отрезку времени, в течение которого популяция неделящихся клеток остается жизнеспособной в отсутствие питательных веществ. "Увеличение жизненного цикла клетки" или "удлинение жизненного цикла клетки", применительно к клеткам или организмам,относится к увеличению количества дочерних клеток, образовавшихся из одной клетки; увеличение способности клеток или организмов справляться со стрессами и бороться с повреждением, например, ДНК,белков; и/или увеличение способности клеток или организмов к выживанию и существованию в живом состоянии в течение более длительного периода при конкретных условиях, например, стрессе (например,при тепловом шоке, осмотическом стрессе, при воздействии излучения высоких энергий, в условиях химически индуцированного стресса, при повреждении ДНК, недостаточном уровне соли, недостаточном уровне азота или недостаточном уровне питательных веществ). Продолжительность жизненного цикла может быть увеличена по меньшей мере приблизительно на 20, 30, 40, 50, 60% или на 20-70, 30-60, 4060% или на большую величину, с применением способов, описанных в настоящей заявке."Сиртуин-активирующее соединение" относится к соединению, которое повышает уровень сиртуинового белка и/или усиливает по меньшей мере одну активность сиртуинового белка. В примере осуществления сиртуин-активирующее соединение может усиливать по меньшей мере одну биологическую активность сиртуинового белка по меньшей мере приблизительно на 10, 25, 50, 75, 100% или больше. Примеры биологической активности сиртуиновых белков включают деацетилирование, например, гистонов и р 53; удлинение продолжительности жизненного цикла; увеличение геномной стабильности; сайленсинг транскрипции и регуляцию сегрегации окисленных белков между материнскими и дочерними клетками."Сиртуиновый белок" относится к представителю семейства обладающих деацетилазной активностью белков сиртуинов, или предпочтительно к семейству sir2, которое включают дрожжевой белок Sir2(номер GenBank NM012238 и NP036370 (или AF083106 и SIRT2 (номер GenBank NM012237,NM030593, NP036369, NP085096 и AF083107). Другие представители семейства включают четыре дополнительных дрожжевых Sir2-подобных гена, называемых "HST гены" (гомологи Sir два) HST1,HST2, HST3 и HST4, а также пять других человеческих гомологов hSIRT3, hSIRT4, hSIRT5, hSIRT6 иhSIRT7 (Brachmann et al. (1995) Genes Dev. 9:2888 and Frye et al. (1999) BBRC 260:273). Предпочтельными сиртуинами являются сиртуины, которые имеют большее сходство с SIRT1, то есть, hSIRTl и/илиSir2, чем с SIRT2, как, например, те представители, которые включают по меньшей мере часть Nконцевой последовательности, присутствующей в SIRT1 и отсутствующей в SIRT2, такие как, например"SIRT1 белок" относится к представителю семейства деацетилаз сиртуинов sir2. В одном варианте осуществления SIRT1 белок включает дрожжевой белок Sir2 (номер GenBank P53685), Sir-2.1 С. elegansAF083106 и человеческий SIRT2 (номер GenBank NM012237, NM030593, NP036369, NP085096,или AF083107), а также их эквиваленты и фрагменты. В другом варианте осуществления SIRT1 белок включает полипептид, включающий последовательность, состоящую или по существу состоящую из аминокислотной последовательности, приведенной в GenBank NP036370, NP501912, NP085096,NP036369 или Р 53685. Белки SIRT1 включают полипептиды, включающие всю или часть аминокислотной последовательности, приведенной в GenBank NP036370, NP501912, NP085096, NP036369 или Р 53685; аминокислотную последовательность, приведенную в GenBank NP036370, NP501912,NP085096, NP036369 или Р 53685, содержащую от 1 до приблизительно 2, 3, 5, 7, 10, 15, 20, 30, 50, 75 или более консервативных аминокислотных замен; аминокислотную последовательность, которая по меньшей мере на 60, 70, 80, 90, 95, 96, 97, 98 или 99% идентична GenBank NP036370, NP501912,NP085096, NP036369 или Р 53685, а также ее функциональные фрагменты. Полипептиды изобретения также включают гомологи (например, ортологи и паралоги), варианты или фрагменты последовательностей GenBank NP036370, NP501912, NP085096, NP036369 или Р 53685."SIRT3 белок" относится к представителю семейства белков деацетилаз сиртуинов и/или к гомологу белка SIRT1. В одном варианте осуществления SIRT3 белок включает человеческий SIRT3 (номер GenBank AAH01042, NP036371, или NP001017524) и мышиный SIRT3 (номер GenBank NP071878), а также их эквиваленты и фрагменты. В другом варианте осуществления SIRT3 белок включает полипептид, включающий последовательность, состоящую или по существу состоящую из аминокислотной последовательности, приведенной в GenBank AAH01042, NP036371, NP001017524 или NP071878. БелкиSIRT3 включают полипептиды, включающие всю или часть аминокислотной последовательности, приведенной в GenBank ААН 01042, NP036371, NP001017524 или NP071878; аминокислотную последовательность, приведенную в GenBank AAH01042, NP036371, NP 001017524 или NP071878, содержащую от 1 до приблизительно 2, 3, 5, 7, 10, 15, 20, 30, 50, 75 или более консервативных аминокислотных замен; аминокислотную последовательность, которая по меньшей мере на 60, 70, 80, 90, 95, 96, 97, 98 или 99% идентична GenBank AAH01042, NP036371, NP001017524, или NP071878, а также ее функциональные фрагменты. Полипептиды изобретения также включают гомологи (например, ортологи и паралоги), варианты или фрагменты последовательностей GenBank AAH01042, NP036371,NP001017524 или NP071878. В одном варианте осуществления SIRT3 белок включает фрагмент белкаSIRT3, который получен в результате расщепления митохондриальной матриксной пептидазой процессинга (МРР) и/или митохондриальной промежуточной пептидазой (MIP). Термины "системное введение", "вводимый системно", "периферическое введение" и "вводимый периферически" являются общепризнанными в данной области и относятся к введению рассматриваемой композиции, терапевтического или другого материала, исключая непосредственного введения в центральную нервную систему, в результате чего он попадает в организм пациента и, таким образом, подвергается метаболизму и другим подобным процессам. Термин "терапевтическое средство" является общепризнанным в данной области и относится к любой химической молекуле, которая является биологически, физиологически или фармакологически активным веществом, которое оказывает местное или системное действие в организме субъекта. Термин также означает любое вещество, предназначенное для применения в диагностике, терапии, ослаблении симптомов, лечении или профилактике заболевания, или в улучшении желаемого физического или умственного развития и/или состояний у животного или человека. Термин "терапевтический эффект" является общепризнанным в данной области и относится к местному или системному эффекту, вызываемому фармакологически активным веществом у животных, в особенности млекопитающих, а более конкретно людей. Фраза "терапевтически-эффективное количество" означает количество такого вещества, которое производит некоторый желаемый местный или системный эффект при разумном соотношении выгоды/риска, применимом к любой терапии. Терапевтически эффективное количество такого вещества изменяется в зависимости от субъекта и подвергаемого лечению патологического состояния, веса и возраста субъекта, тяжести патологического состояния, способа введения и т.п., которые могут быть легко определены средним специалистом в данной области. Например, некоторые композиции, описываемые в настоящей заявке, можно вводить в достаточном количестве, чтобы произвести желаемый эффект с разумным соотношением выгоды/риска, применимым к такой терапии."Лечение" состояния или заболевания относится к лечению, а также к уменьшению интенсивности по меньшей мере одного симптома состояния или заболевания. Термин "ухудшение зрения" относится к снижению остроты зрения, которое часто является лишь частично обратимым или является необратимым при лечении (например, хирургической операции). Особенно тяжелое ухудшение зрения называют "слепотой" или "потерей зрения", которое относится к полной потере зрения, зрению хуже 20/200, которое нельзя улучшить с помощью корригирующих линз, или полю зрения с диаметром менее 20 (радиусом 10). 2. Модуляторы сиртуина. В одном аспекте изобретение предоставляет новые сиртуин-модулирующие соединения для лечения и/или профилактики большого разнообразия заболеваний и нарушений, включая, например, заболевания или нарушения, связанные с лечением резистентности к инсулину, метаболического синдрома,диабета или их осложнений. Новые сиртуин-модулирующие соединения применяются также для повышения чувствительности к инсулину. В одном варианте осуществления сиртуин-модулирующие соединения изобретения представлены структурной формулой III или его солью, где каждый из Z11, Z13 и Z14 независимо выбран из N и CR, Z12 представляет собой CR, где R выбран из водорода, галогена и C1-С 4 алкила;Y выбран из N и CR13, где R13 выбран из водорода, галогена, -C1-C4 алкила, -О-(C1-C4 алкила) и -О(C1-C2 фторзамещенного алкила); не более двух из Z11, Z13, Z14 и Y представляют собой N; где представляет собой положение, в котором X присоединен к R11, и 11R выбран из карбоцикла и гетероцикла, где R11 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -CN, C1-C4 алкила, С 3-С 7 циклоалкила, C1-C4 фторзамещенного алкила, =O, -O-R14, -S-R14, -(C1-C4 алкил)-N(R14)(R14), -N(R14)(R14), -О-(С 2-С 4 алкил)-N(R14)(R14),-C(O)-N(R14)(R14), -C(O)-O-R14 и -(C1-C4 алкил)-C(O)-N(R14)(R14) , при этом, когда R11 является фенилом,R11 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4 этилендиокси, фторзамещенным 3,4-этилендиокси, О-(насыщенным гетероциклом), фторзамещенным-О-(насыщенным гетероциклом) и C1-C4 алкилзамещенным O-(насыщенным гетероциклом), где каждый R14 независимо выбран из водорода и -C1-C4 алкила; или два R14, вместе с атомом азота, к которому они присоединены, образуют 4-8-членный насыщенный гетероцикл, необязательно включающий один дополнительный гетероатом, выбранный из N, S, S(=O),S(=O)2 и О, где когда R14 является алкилом, алкил необязательно замещен одним или более -ОН, -О-(C1-C4 алкилом), фтором, -NH2, -NH(C1-C4 алкилом), -N(C1-C4 алкилом)2, -NH(СН 2 СН 2 ОСН 3) или -N(СН 2 СН 2 ОСН 3)2,и когда два R14 вместе с атомом азота, к которому они присоединены, образуют 4-8-членный насыщенный гетероцикл, причем насыщенный гетероцикл необязательно замещен по атому углерода -ОН,-C1-C4 алкилом, фтором, -NH2, -NH(C1-C4 алкилом), -N(C1-C4 алкилом)2, -NH (СН 2 СН 2 ОСН 3) или-N(СН 2 СН 2 ОСН 3)2; и необязательно замещен по любому замещаемому атому азота -C1-C4 алкилом, фторзамещенным C1-C4 алкилом или -(СН 2)2-О-СН 3; иR12 выбран из карбоцикла и гетероцикла, присоединенного к остальной части соединения через атом углерода кольца, где R12 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -C=N, C1-C4 алкила, С 3-С 7 циклоалкила, C1-C2 фторзамещенного алкила, -O-R14, -S-R14,-S(O)-R14, -S(O)2-R14, -(С 1-С 4 алкил)-N(R14)(R14), -N(R14)(R14), -О-(С 2-С 4 алкил)-N(R14)(R14), -C(O)-N(R14)(R14), - (C1-C4 алкил)-С(О)-N(R14)(R14), -O-фенила, фенила и второго гетероцикла, при этом, когда R12 является фенилом, R12 также необязательно замещен 3,4-метилендиокси, фторзамещенным 3,4 метилендиокси, 3,4-этилендиокси, фторзамещенным 3,4-этилендиокси или -O-(насыщенным гетероциклом), где любой фенил, насыщенный гетероцикл или второй гетероциклический заместитель в R12 необязательно замещен галогеном, -CN, C1-C4 алкилом, C1-C2 фторзамещенным алкилом, -О-(С 1-С 2 фторзамещенным алкилом), -O-(C1-C4 алкилом), -S-(С 1-С 4 алкилом), -S-(C1-C2 фторзамещенньм алкилом), -NH(C1-C4 алкилом) и -N-(C1-C4 алкилом)2, где"карбоцикл" в определениях радикалов R11 и R12 представляет собой 5-7-членное насыщенное, ненасыщенное или ароматическое моноциклическое кольцо;"гетероцикл" в определениях радикалов R11 и R12 представляет собой 4-7-членное насыщенное, ненасыщенное или ароматическое моноциклическое кольцо, включающее один или более гетероатомов,выбранных из атомов N, О и S. В некоторых вариантах осуществления формулы IIIR12 выбран из моноциклического карбоцикла и моноциклического гетероцикла, присоединенного к остальной части соединения через атом углерода кольца, где R12 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, -CN, C1-C4 алкила, С 3-С 7 циклоалкила, C1-C2 фторзамещенного алкила, -O-R14, -S-R14, -S(O)-R14, -S(O)2-R14, -(С 1-С 4 алкил)-N(R14)(R14), -N(R14)(R14), -О(С 2-С 4 алкил)-N(R14)(R14), -C(O)-N(R14)(R14), -(C1-C4 алкил)-C(O)-N(R14)(R14), -O-фенила, фенила и второго гетероцикла, при этом, когда R12 является фенилом, R12 также необязательно замещен 3,4 метилендиокси, фторзамещенным 3,4-метилендиокси, 3,4-этилендиокси, фторзамещенным 3,4 этилендиокси или -O-(насыщенным гетероциклом), где любой фенил, насыщенный гетероцикл или второй гетероциклический заместитель в R12 необязательно замещены галогеном, -CN, C1-C4 алкилом, C1C2 фторзамещенным алкилом, -О-(C1-C2 фторзамещенным алкилом), -O-(C1-C4 алкилом), -S-(С 1-С 4 алкилом), -S-(С 1-С 2 фторзамещенным алкилом), -NH-(C1-C4 алкилом) и -N-(C1-C4 алкилом)2. В еще одном варианте осуществления формулы III R12 выбран из арила и гетероарила. В одном аспекте данного варианта осуществления R12 выбран из следующего: В некоторых вариантах осуществления формулы III, соединение представлено структурными формулами, выбранными из: В более конкретном аспекте данного варианта осуществления соединение представлено структурными формулами, выбранными из из IIIa, IIIi, IIIk или IIIl. В еще более конкретном аспекте данного варианта осуществления, соединение представлено структурной формулой IIIa В еще одном варианте осуществления формулы III R11 выбран из В одном конкретном варианте осуществления формулы III, соединение представлено структурной формулой IVR12 выбран из фенила и пиридила, где R12 необязательно замещен одним-двумя заместителями, независимо выбранными из галогена, C1-C4 алкила, фторзамещенного C1-C2 алкила, -O-R14, S(O)2-R14,-(C1-C4 алкил)-N(R14)(R14) и -N(R14)(R14), при этом, когда R12 является фенилом, R12 также необязательно замещен 3,4-метилендиокси или О-(насыщенным гетероциклом). В одном конкретном варианте осуществления изобретение относится к ряду конкретных соединений формулы III, описанных в примерах. В еще одном варианте осуществления соединений формулы III его соль является фармацевтически приемлемой солью. Сиртуин-модулирующие соединения изобретения предпочтительно модулируют уровень и/или активность сиртуинового белка, в особенности деацетилазную активность сиртуинового белка. Отдельно или в дополнение к вышеуказанным свойствам некоторые сиртуин-модулирующие соединения изобретения практически не обладают одной или более следующими активностями: ингибирование PI3-киназы, ингибирование альдоредуктазы, ингибирование тирозинкиназы, трансактивация EGFR тирозинкиназы, расширение коронарных сосудов или спазмолитическая активность, при концентрациях соединения, которые являются эффективными для модулирования деацетилирующей активности сиртуинового белка (например, такого как белок SIRT1 и/или SIRT3). Термин "карбоциклический" включает 5-7-членное моноциклическое и 8-12-членное бициклическое кольца, где моноциклическое или бициклическое кольца выбраны из насыщенного, ненасыщенного и ароматического. Примеры карбоциклов включают циклопентил, циклогексил, циклогексенил, адамантил, фенил и нафтил. Термин "гетероциклический" включает 4-7-членное моноциклическое и 8-12-членное бициклическое кольца, включающие один или более гетероатомов, выбранных, например, из атомов N, О и S. В некоторых вариантах осуществления, гетероциклическая группа выбрана из насыщенной, ненасыщенной или ароматической. Моноциклические кольца включают 5-7-членный арил или гетероарил, 3-7-членный циклоалкил и 5-7-членный неароматический гетероциклил. Примеры моноциклических групп включают замещенные или незамещенные гетероциклы, такие как тиазолил, оксазолил, оксазинил, тиазинил, дитианил, диоксанил, изоксазолил, изотиазолил, триазолил, фуранил, тетрагидрофуранил, дигидрофуранил, пиранил, тетразолил, пиразолил, пиразинил, пиридазинил, имидазолил, пиридинил, пирролил, дигидропирролил,пирролидинил, тиазинил, оксазинил, пиперидинил, пиперазинил, пиримидинил, морфолинил, тетрагидротиофенил, тиофенил, циклогексил, циклопентил, циклопропил, циклобутил, циклогептанил, азетидинил, оксетанил, тииранил, оксиранил, азиридинил и тиоморфолинил. Ароматические (арильные) группы включают карбоциклические ароматические группы, такие как фенил, нафтил и антрацил, а также гетероарильные группы, такие как имидазолил, тиенил, фурил, пиридил, пиримидил, пиранил, пиразолил, пирроил, пиразинил, тиазолил, оксазолил и тетразолил. Ароматические группы также включают конденсированные полициклические ароматические кольцевые системы,в которых карбоциклическое ароматическое кольцо или гетероарильное кольцо сконденсировано с одним или несколькими другими гетероарильными кольцами. Примеры включают бензотиенил, бензофурил, индолил, хинолинил, бензотиазол, бензоксазол, бензимидазол, хинолинил, изохинолинил и изоиндолил. Термин "фторзамещенный" включает от одного замещающего атома фтора до перфтор-замещения. Примеры фторзамещенного C1-C2 алкила включают -CFH2, CF2H, -CF3, -CH2CH2F, -CH2CHF2, -CHFCH3, CF2CHF2. Перфторзамещенный C1-C2 алкил включает, например, -CF3 и -CF2CF3. Подходящие заместители на группах, обозначенных как замещенные или незамещенные, являются заместителями, которые не оказывают существенного влияния на способность раскрытых соединений обладать одним или более свойствами, раскрытыми в настоящей заявке. Заместитель оказывает существенное влияние на свойства соединения, когда величина соответствующего параметра уменьшается более чем приблизительно на 50% в соединении с заместителем, по сравнению с соединением без заместителя. Комбинации заместителей и переменных, предусматриваемые в соответствии с настоящим изобретением, являются только такими комбинациями, которые приводят к образованию устойчивых соединений. Используемый в настоящей заявке термин "устойчивый" относится к соединениям, которые обладают стабильностью, которая достаточна для их производства, и которая обеспечивает сохранение целостности соединения в течение достаточного периода времени, чтобы соединение можно было применять в целях, подробно описанных в настоящей заявке. Соединения, раскрытые в настоящей заявке, также могут быть частично и полностью дейтерированными. В некоторых случаях один или более атомов дейтерия присутствуют для кинетических исследований. Специалист в данной области техники может выбрать участки, в которых присутствуют такие атомы дейтерия. Также в настоящее изобретение включены соли, в особенности фармацевтически приемлемые соли,сиртуин-модулирующих соединений, описанных в настоящей заявке. Соединения настоящего изобретения, которые обладают достаточно кислыми, достаточно основными, либо и теми, и другими функциональными группами, могут реагировать с любым из многочисленных неорганических оснований, а также неорганических и органических кислот, с образованием соли. В альтернативе, соединения, которые имеют заряженный атом, например соединения с четвертичным атомом азота, могут образовывать соль с соответствующим противоионом (например, галоид, такой как бромид, хлорид или фторид, в особенности бромид). Кислоты, обычно используемые для образования солей присоединения кислот, являются неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, фосфорная кислота и т.п., а также органическими кислотами, такими как п-толуолсульфоновая кислота, метансульфоновая кислота, щавелевая кислота, п-бромфенолсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и т.п. Примеры таких солей включают сульфат, пиросульфат, гидросульфат, сульфит, гидросульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид,ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капроат, гептаноат, пропиолат,оксалат, малонат, сукцинат, суберат, себацинат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат,ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гамма-гидроксибутират,гликолят, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат,манделат и т.п. Соли присоединения оснований включают соли, полученные из неорганических оснований, таких как гидроксиды аммония или щелочных или щелочно-земельных металлов, карбонаты, гидрокарбонаты и т.п. Такие основания, которые могут применяться при получении солей настоящего изобретения, таким образом, включают гидроксид натрия, гидроксид калия, гидроксид аммония, карбонат калия и т.п. Соединения настоящего изобретения могут быть синтезированы с использованием стандартных методов. Предпочтительно, указанные соединения синтезируют из легкодоступных исходных соединений. Преобразования синтетической химии и методики, которые могут применяться в синтезе сиртуинмодулирующих соединений, описанных в настоящей заявке, известны в уровне техники и включают,например, описанные в R. Larock, Comprehensive Organic Transformations (1989); Т. W. Greene and P. G.Reagents for Organic Synthesis (1994); а также L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis (1995). Сиртуин-модулирующее соединение может проходить через цитоплазматическую мембрану клетки. Например, соединение может обладать клеточной проницаемостью по меньшей мере приблизительно 20, 50, 75, 80, 90 или 95%. Сиртуин-модулирующие соединения, описанные в настоящей заявке, могут также обладать одной или более следующими особенностями: соединение может являться практически нетоксичным для клетки или субъекта; сиртуин-модулирующее соединение может являться органической молекулой или небольшой молекулой с массой 2000 а.е.м. или менее, 1000 а.е.м. или менее; соединение может обладать периодом полуразложения при нормальных атмосферных условиях, который составляет по меньшей мере приблизительно 30, 60, 120, 6 месяцев или 1 год; соединение обладать периодом полуразложения в растворе, который составляет по меньшей мере приблизительно 30, 60, 120 дней, 6 месяцев или 1 год; сиртуин-модулирующее соединение может быть более устойчивым в растворе, чем ресвератрол по меньшей мере приблизительно на 50%, в 2 раза, в 5 раз, 10 раз, 30 раз, 50 раз или 100 раз; сиртуинмодулирующее соединение может активировать деацетилирование фактора репарации ДНК Ku70; сиртуин-модулирующее соединение может активировать деацетилирование RelA/p65; соединение может увеличивать общее число оборотов и повышать чувствительность клеток к TNF-индуцированному апоптозу. В некоторых вариантах осуществления сиртуин-модулирующее соединение не обладает какой-либо существенной способностью ингибировать гистондеацетилазу (HDAC) класса I, HDAC класса II, илиHDAC I и II, в концентрациях (например, in vivo), эффективных при модулировании деацетилазной активности сиртуина. Например, в предпочтительных вариантах осуществления сиртуин-модулирующее соединение является сиртуин-активирующим соединением и выбрано таким образом, чтобы оно обладало ЕС 50 для активации сиртуиновой деацетилазной активности, которая по меньшей мере в 5 раз меньше,чем ЕС 50 для ингибирования HDAC I и/или HDAC II, а еще более предпочтительно по меньшей мере в 10 раз, 100 раз или даже в 1000 раз меньше. Способы анализа HDAC I и/или HDAC II активности известны в уровне техники, а наборы для выполнения таких анализов могут быть приобретены коммерчески. См. например, BioVision, Inc. (Mountain View, CA; сайт в Интернет - biovision.com) и Thomas Scientific(Swedesboro, NJ; сайт в Интернет tomassci.com). В некоторых вариантах осуществления сиртуин-модулирующее соединение не обладает какой-либо существенной способностью модулировать гомологи сиртуина. В одном варианте осуществления активатор человеческого сиртуинового белка может не обладать какой-либо существенной способностью активировать сиртуиновый белок из низших эукариотов, в особенности дрожжей или возбудителей заболеваний человека, в концентрациях (например, in vivo), эффективных для активации деацетилазной активности человеческого сиртуина. Например, сиртуин-активирующее соединение может быть выбрано таким образом, чтобы оно обладало ЕС 50 для активации деацетилазной активности человеческого сиртуина, такого как SIRT1 и/или SIRT3, которая, по меньшей мере, в 5 раз меньше, чем ЕС 50 дня активации дрожжевого сиртуина, такого как Sir2 (например, Candida, S. cerevisiae и т.д.), а еще более предпочтительно по меньшей мере в 10 раз, 100 раз или даже в 1000 раз меньше. В другом варианте осуществления ингибитор сиртуинового белка из низших эукариотов, в особенности дрожжей или возбудителей заболеваний человека, не обладает какой-либо существенной способностью ингибировать человеческий сиртуиновый белок при концентрациях (например, in vivo), эффективных при ингибировании деацетилазной активности сиртуинового белка из низшего эукариота. Например, сиртуин-ингибирующее соединение может быть выбрано таким образом, чтобы оно обладало IC50 для ингибирования деацетилазной активности человеческого сиртуина, такого как SIRT1 и/или SIRT3, которая, по меньшей мере, в 5 раз меньше,чем IC50. Для ингибирования дрожжевого сиртуина, такого как Sir2 (например, Candida, S. cerevisiae и т.д.), а еще более предпочтительно по меньшей мере в 10 раз, 100 раз или даже в 1000 раз меньше. В некоторых вариантах осуществления сиртуин-модулирующее соединение может обладать способностью модулировать один или более гомологов сиртуиновых белков, таких как, например, один или более SIRT1, SIRT2, SIRT3, SIRT4, SIRT5, SIRT6 или SIRT7 человека. В одном варианте осуществления сиртуин-модулирующее соединение обладает способностью модулировать и SIRT1, и SIRT3 белок. В других вариантах осуществления модулятор SIRT1 не обладает какой-либо существенной спо- 10021938 собностью модулировать другие гомологи сиртуиновых белков, такие как, например, один или болееSIRT2, SIRT3, SIRT4, SIRT5, SIRT6 или SIRT7 человека, при концентрациях (например, in vivo), эффективных для модулирования деацетилазной активности человеческого SIRT1. Например, сиртуинмодулирующее соединение может быть выбрано таким образом, чтобы оно обладало ED50 для модулирования деацетилазной активности SIRT1 человека, которая, по меньшей мере, в 5 раз меньше, чем ED50 для модулирования одного или более SIRT2, SIRT3, SIRT4, SIRT5, SIRT6 или SIRT7 человека, а еще более предпочтительно, по меньшей мере, в 10 раз, 100 раз или даже в 1000 раз меньше. В одном варианте осуществления модулятор SIRT1 не обладает какой-либо существенной способностью модулироватьSIRT3 белок. В других вариантах осуществления модулятор SIRT3 не обладает какой-либо существенной способностью модулировать другие гомологи сиртуиновых белков, такие как, например, один или болееSIRT1, SIRT2, SIRT4, SIRT5, SIRT6 или SIRT7 человека, при концентрациях (например, in vivo), эффективных для модулирования деацетилазной активности SIRT3 человека. Например, сиртуинмодулирующее соединение может быть выбрано таким образом, чтобы оно обладало ED50 для модулирования деацетилазной активности SIRT3 человека, которая, по меньшей мере, в 5 раз меньше, чем ED50 для модулирования одного или более SIRT1, SIRT2, SIRT4, SIRT5, SIRT6 или SIRT7 человека, а еще более предпочтительно, по меньшей мере, в 10 раз, 100 раз или даже в 1000 раз меньше. В одном варианте осуществления модулятор SIRT3 не обладает какой-либо существенной способностью модулироватьSIRT1 белок. В некоторых вариантах осуществления сиртуин-модулирующее соединение может обладать аффинностью связывания к сиртуиновому белку, которая составляет приблизительно 10-9 М, 10-10 М, 10-11 М, 10-12 М или меньше. Сиртуин-модулирующее соединение может снижать (активатор) или повышать(ингибитор) кажущуюся Km сиртуинового белка по отношению к его субстрату или NAD+ (или другому кофактору), по меньшей мере, приблизительно в 2, 3, 4, 5, 10, 20, 30, 50 или в 100 раз. В некоторых вариантах осуществления значения Km определяют, используя масс-спектрометрический анализ, описанный в настоящей заявке. Предпочтительные активирующие соединения снижают Km сиртуина по отношению к его субстрату или кофактору в большей степени по сравнению с ресвератролом в аналогичной концентрации, или снижают Km сиртуина по отношению к его субстрату или кофактору также как ресвератрол,при более низкой концентрации. Сиртуин-модулирующее соединение может повышать Vmax сиртуинового белка по меньшей мере приблизительно в 2, 3, 4, 5, 10, 20, 30, 50 или в 100 раз. Сиртуинмодулирующее соединение может обладать ED50 для модулирования деацетилазной активности SIRT1 и/или SIRT3 белка, которая составляет менее чем приблизительно 1 нМ, менее чем приблизительно 10 нМ, менее чем приблизительно 100 нМ, менее чем приблизительно 1 мкМ, менее чем приблизительно 10 мкМ, менее чем приблизительно 100 мкМ или от приблизительно 1-10 нМ, от приблизительно 10-100 нМ, от приблизительно 0,1-1 мкМ, от приблизительно 1-10 мкМ или от приблизительно 10-100 мкМ. Сиртуин-модулирующее соединение может модулировать деацетилазаную активность SIRT1 и/илиSIRT3 белка по меньшей мере приблизительно в 5, 10, 20, 30, 50 или в 100 раз, как измерено в клеточном анализе или в анализе на основе клеточной системы. Сиртуин-активирующее соединение может вызывать, по меньшей мере, приблизительно на 10, 30, 50, 80%, в 2 раза, 5 раз, 10 раз, 50 раз или в 100 раз большую индукцию деацетилазной активности сиртуинового белка по сравнению с ресвератролом при такой же концентрации. Сиртуин-модулирующее соединение может обладать ED50 для модулированияSIRT5, которая по меньшей мере приблизительно в 10, 20, 30, 50 раз выше, чем ED50 для модулированияSIRT1 и/или SIRT3. 3. Примеры применения. В настоящем описании раскрываются способы модулирования уровня и/или активности сиртуинового белка и способы их применения. Раскрывается применение сиртуин-модулирующих соединения,где сиртуин-модулирующие соединения активируют сиртуиновый белок, например, повышают уровень и/или активность сиртуинового белка. Сиртуин-модулирующие соединения, которые повышают уровень и/или активность сиртуинового белка, могут применяться в различных терапевтических областях, включая, например, увеличение продолжительности жизненного цикла клетки, повышения чувствительности к инсулину, а также лечение и/или профилактику большого разнообразия заболеваний и нарушений,включая, например, заболевания или нарушения, ассоциированные с лечением резистентности к инсулину, метаболического синдрома, диабета или их осложнений. Способы включают введение субъекту, испытывающему в этом потребность, фармацевтически эффективного количества сиртуин-модулирующего соединения настоящего изобретения. Хотя настоящие заявители не желают быть связанными с какой-либо теорией, предполагается, что активаторы настоящего изобретения могут взаимодействовать с сиртуином в том же положении в сиртуиновом белке (например, активном сайте или сайте, влияющем на Km или Vmax активного сайта). Предполагается, что это служит причиной того, что некоторые классы активаторов и ингибиторов сиртуина могут обладать существенным структурным подобием. В некоторых вариантах осуществления сиртуин-модулирующие соединения, описанные в настоящей заявке, могут быть взяты отдельно или в комбинации с другими соединениями. В одном варианте осуществления смесь двух или более сиртуин-модулирующих соединений может быть введена субъекту,испытывающему в этом потребность. В другом варианте осуществления сиртуин-модулирующее соединение может быть введено с дополнительными активными веществвами, выбранными из противовоспалительных средств, анальгетиков, противомикробных средств, противогрибковых средств, антибиотиков,витаминов, антиоксидантов и солнцезащитных средств. Метаболические нарушения/диабет В другом аспекте сиртуин-модулирующие соединения, которые повышают уровень и/или активность сиртуинового белка, могут применяться для лечения и профилактики метаболического нарушения,такого как разистентность к инсулину, преддиабетическое состояние, диабет II типа и/или их осложнения. Введение сиртуин-модулирующих соединений, которые повышают уровень и/или активность сиртуинового белка, может увеличить чувствительность к инсулину и/или понизить уровни инсулина у субъекта. Субъект, испытывающий потребность в подобной терапии, может являться субъектом с разистентностью к инсулину или у него могут проявляться другие симптомы, предшествующие развитию диабета II типа, он может иметь диабет II типа, или у него может развиться любое из перечисленных состояний. Например, субъект может являться субъектом, имеющим резистентность к инсулину, например,имеющим высокие уровни инсулина в крови и/или ассоциируемые состояния, такие как гиперлипидемию, дислипогенез, гиперхолестеринемию, сниженную толерантность к глюкозе, высокий уровень глюкозы в крови, другие проявления синдрома X, гипертонию, атеросклероз и липодистрофию. В примере осуществления сиртуин-модулирующие соединения, которые повышают уровень и/или активность сиртуинового белка, могут быть введены в виде комбинированной терапии для лечения и профилактики метаболического нарушения. Например, одно или более сиртуин-модулирующих соединений, которые повышают уровень и/или активность сиртуинового белка, могут быть введены в комбинации с одним или более противодиабетическими средствами. 4. Анализы. Другие способы, рассматриваемые в настоящей заявке, включают способы скрининга для идентификации соединений или средств, которые модулируют сиртуины. Средство может являться нуклеиновой кислотой, такой как аптамер. Анализ может быть проведен на основе клеток или в бесклеточном формате. Например, анализ может включать инкубирование (или контакт) сиртуина с тестируемым средством при условиях, в которых сиртуин может подвергаться модуляции средством, которое, как известно, модулирует сиртуин, а также контроль или определение уровня модуляции сиртуина в присутствии тестируемого средства по сравнению с отсутствием тестируемого средства. Уровень модуляции сиртуина может быть определен путем определения его способности деацетилировать субстрат. Примерами субстратов являются ацетилированные пептиды, которые могут быть приобретены у BIOMOL (PlymouthMeeting, PA). Предпочтительные субстраты включают пептиды р 53, например, пептиды, которые включают ацетилированный K382. Наиболее предпочтительным субстратом является Fluor-de-Lys-SIRTl (BIOMOL), то есть, ацетилированный пептид Arg-His-Lys-Lys. Другими субстратами являются пептиды человеческих гистонов Н 3 и Н 4 или ацетилированная аминокислота. Субстраты могут быть флуорогенными. Сиртуин может представлять собой SIRT1, Sir2, SIRT3 или их часть. Например, рекомбинантныйSIRT1 может быть приобретен у BIOMOL. Реакция может проводиться в течение приблизительно 30 мин и может быть остановлена, например, никотинамидом. Набор для анализа HDAC флуоресцентной активности/ поиска новых лекарственных средств (AK-500, BIOMOL Research Laboratories) может использоваться для определения уровня ацетилирования. Подобные анализы описаны в статье Bitterman et al.(2002) J. Biol. Chem. 277:45099. Уровень модуляции сиртуина в анализе может быть сравнен с уровнем модуляции сиртуина в присутствии одного или более (отдельно или одновременно) соединений, описанных в настоящей заявке, которые могут служить в качестве положительного или отрицательного контроля. Сиртуины, применяемые в анализе, могут являться полноразмерными сиртуиновыми белками или их частями. Поскольку в настоящей заявке было показано, что активирующие соединения, по-видимому,взаимодействуют с N-концом SIRT1, белки, применяемые в анализе, включают N-концевые фрагменты сиртуинов, например, аминокислоты приблизительно 1-176 или 1-255 из SIRT1; аминокислоты приблизительно 1-174 или 1-252 из Sir2. В одном варианте осуществления скрининговый анализ включает (i) контакт сиртуина с тестируемым средством и ацетилированным субстратом в условиях, подходящих для деацетилирования субстрата сиртуином в отсутствии тестируемого средства; и (ii) определение уровня ацетилирования субстрата, где более низкий уровень ацетилирования субстрата в присутствии тестируемого средства по сравнению с отсутствием тестируемого средства указывает на то, что тестируемое средство стимулирует деацетилирование сиртуина, тогда как более высокий уровень ацетилирования субстрата в присутствии тестируемого средства по сравнению с отсутствием тестируемого средства указывает на то, что тестируемое средство ингибирует деацетилирование сиртуина. Способы идентификации средства, которое модулирует, например, стимулирует, сиртуины in vivo,может включать (i) контакт клетки с тестируемым средством и субстратом, которое способен проникать в клетку в присутствии ингибитора HDAC класса I и класса II, в условиях, подходящих для деацетилирования субстрата сиртуином в отсутствии тестируемого средства; и (ii) определение уровня ацетилирова- 12021938 ния субстрата, где более низкий уровень ацетилирования субстрата в присутствии тестируемого средства по сравнению с отсутствием тестируемого средства указывает на то, что тестируемое средство стимулирует деацетилирование сиртуина, тогда как более высокий уровень ацетилирования субстрата в присутствии тестируемого средства по сравнению с отсутствием тестируемого средства указывает на то, что тестируемое средство ингибирует деацетилирование сиртуина. Предпочтительным субстратом является ацетилированный пептид, который также предпочтительно является флуорогенным, как описано далее в настоящей заявке. Способ может дополнительно включать лизирование клеток для определения уровня ацетилирования субстрата. Субстраты могут быть добавлены к клеткам при концентрации в диапазоне от приблизительно 1 мкМ до приблизительно 10 мМ, предпочтительно от приблизительно 10 мкМ до 1 мМ,еще более предпочтительно от приблизительно 100 мкМ до 1 мМ, например приблизительно 200 мкМ. Предпочтительным субстратом является ацетилированный лизин, например, -ацетил-лизин (Fluor-deLys, FdL) или Fluor-de-Lys-SIRT1. Предпочтительным ингибитором HDAC класса I и класса II является трихостатин (TSA), который может использоваться при концентрациях в диапазоне от приблизительно 0,01 до 100 мкМ, предпочтительно от приблизительно 0,1 до 10 мкМ, например 1 мкМ. Инкубирование клеток с тестируемым соединением и субстратом может проводиться в течение от приблизительно 10 мин до 5 ч, предпочтительно в течение приблизительно 1-3 ч. Так как TSA ингибирует все HDAC класса I и класса II, а некоторые субстраты, например, Fluor-de-Lys, являются плохим субстратом для SIRT2 и еще более плохим субстратом для SIRT3-7, такой анализ может применяться для идентификации модуляторов SIRT1 in vivo. 5. Фармацевтические композиции. Сиртуин-модулирующие соединения, описанные в настоящей заявке, могут быть включены в композицию обычным путем, используя один или несколько физиологически или фармацевтически приемлемых носителей или эксципиентов. Например, сиртуин-модулирующие соединения, а также их фармацевтически приемлемые соли и сольваты могут быть включены в композицию для введения, например, с помощью инъекции (например, п/к, в/м, в/б), ингаляции или инсуффляции (через рот или нос), или перорального, буккального, подъязычного, трансдермального, назального, парентерального или ректального введения. В одном варианте осуществления сиртуин-модулирующее соединение можно вводить местно,в область, в которой присутствуют целевые клетки, то есть, в определенную ткань, орган или жидкость(например, кровь, спинномозговую жидкость и т.д.). В другом варианте осуществления изобретение обеспечивает фармацевтическую композицию,включающую соединение структурной формулы (III), как определено выше, а также фармацевтически приемлемый носитель. Сиртуин-модулирующие соединения могут быть включены в композицию, предназначенную для различных способов введения, включая системное и местное или локализованное введение. Методики и препаративные формы обычно можно найти в Remington's Pharmaceutical Sciences, Meade Publishing Co.,Easton, PA. Для парентерального введения предпочтительной является инъекция, включая внутримышечную, внутривенную, внутрибрюшинную и подкожную инъекцию. Для инъекции соединения могут быть приготовлены в форме жидких растворов, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнка или раствор Рингера. Кроме того, соединения могут быть приготовлены в виде твердой формы и повторно растворены или суспендированы непосредственно перед применением. Также включены лиофилизированные формы. Для перорального введения фармацевтические композиции могут иметь форму, например, таблеток, пастилок или капсул, приготовленных обычными способами с фармацевтически приемлемыми эксципиентами, такими как связующие средства (например, желатинированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); лубриканты (например, стеарат магния, тальк или кварц); разрыхлители (например, картофельный крахмал или натриевая соль крахмалгликолята); или смачивающие средства (например, лаурилсульфат натрия). На таблетки может быть нанесено покрытие способами, известными в уровне техники. Жидкие препараты для перорального введения могут иметь форму, например, растворов, сиропов или суспензий, либо они могут быть представлены в виде сухого продукта, предназначенного для разведения водой или другой подходящей средой перед применением. Такие жидкие препараты могут быть приготовлены стандартными способами с фармацевтически приемлемыми добавками, такими как суспендирующие средства (например, сироп сорбита, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгирующие средства (например, лецитин или гуммиарабик); неводные носители (например, миндальное масло, сложные эфиры жирных кислот, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Препараты при необходимости также могут содержать буферные соли, ароматизаторы, красители и подсластители. Препараты для перорального введения могут быть приготовлены в виде препаративных форм, обеспечивающих контролируемое высвобождение активного соединения. Для введения посредством ингаляции (например, пульмональной доставки), сиртуинмодулирующие соединения могут доставляться в форме аэрозоля из балона или небулайзера, с использо- 13021938 ванием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, углекислого газа или другого подходящего газа. В случае аэрозоля под давлением единичная доза может быть определена с помощью клапана, выпускающего дозированное количество. Капсулы и картриджи, например желатиновые, предназначенные для использования в ингаляторе или инсуффляторе, могут содержать порошковую смесь соединения и подходящую порошковую основу, такую как лактозу или крахмал. Сиртуин-модулирующие соединения могут быть включены в композицию для парентерального введения с помощью инъекции, например, болюсной инъекции или непрерывной инфузии. Композиции для инъекции могут быть представлены в виде единичной дозированной формы, например, в ампулах или в упаковках многократного применения с добавлением консерванта. Композиции могут иметь форму суспензий, растворов или эмульсий в масляных или водных носителях, и могут содержать вспомогательные средства, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. В альтернативе активный компонент может находиться в порошковой форме для разведения подходящим разбавителем, например стерильной апирогенной водой, перед применением. Сиртуин-модулирующие соединения могут быть также включены в композиции для ректального введения, такие как суппозитории или удерживающие клизмы, например, содержащие стандартные основы для суппозиториев, такие как масло какао или другие глицериды. В дополнение к вышеописанным композициям сиртуин-модулирующие соединения могут быть также включены в депопрепараты. Такие длительно действующие препаративные формы можно вводить посредством вживления (например, подкожного или внутримышечного) или внутримышечной инъекции. Таким образом, например, сиртуин-модулирующие соединения могут быть включены в препаративную форму с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами, или в виде умеренно растворимых производных, например, в виде умеренно растворимых солей. Композиция контролируемого высвобождения также включает пластыри. В некоторых вариантах осуществления соединения, описанные в настоящей заявке, могут быть включены в препаративные формы для доставки в центральную нервную систему (ЦНС) (см. обзор Begley, PharmacologyTherapeutics 104: 29-45 (2004. Стандартные подходы к доставке препарата в ЦНС включают: нейрохирургические стратегии (например, внутримозговую инъекцию или интрацеребровентрикулярную инфузию); молекулярную модификацию средства (например, получение химерного слитого белка, который включает транспортный пептид, обладающий аффинностью к поверхностным молекулам эндотелиальных клеток, в комбинации со средством, которое самостоятельно неспособно проходить через ГЭБ) в попытке воспользоваться одним из эндогенных транспортных путей ГЭБ; фармакологические стратегии, направленные на повышение растворимости средства в липидах (например, конъюгирование водорастворимых средств с липидными или холестериновыми носителями); а также кратковременное нарушение целостности ГЭБ с помощью гиперосмотического прорыва (в результате инфузии раствора маннита в сонную артерию или прменения биологически активного средства, такого как пептид ангиотензин). Липосомы представляют собой другую систему доставки лекарственного средства, которая является легко вводимой. В связи с этим в способе изобретения активные соединения могут быть также введены в форме системы доставки на основе липосом. Липосомы хорошо известны специалисту, квалифицированному в данной области. Липосомы могут быть сформированы из различных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины. Липосомы, которые могут применяться в способе изобретения, охватывают все типы липосом, включая, помимо прочего, малые однослойные везикулы,большие однослойные везикулы и многослойные везикулы. Другой способ приготовления лекарственной формы, в особенности раствора, модулятора сиртуина, такого как ресвератрол или его производное, осуществляется с помощью циклодекстрина. Под циклодекстрином подразумевается -, - или -циклодекстрин. Циклодекстрины подробно описаны в патенте США 4727064 (Pitha et al.), который включен в настоящую заявку путем отсылки. Циклодекстрины представляют собой циклические олигомеры глюкозы, указанные соединения образуют комплексы включения с любым лекарственным соединением, молекула которого может поместиться внутри липофильных полостей молекулы циклодекстрина. Быстро распадающиеся или растворяющиеся дозированные формы пригодны для быстрой абсорбции, в особенности буккальной или подъязычной абсорбции, фармацевтически активных средств. Быстроплавкие дозированные формы удобны для таких пациентов, как пожилые и педиатрические пациенты, которые сталкиваются с затруднениями при глотании обычных твердых дозированных форм, таких как каплеты и таблетки. Кроме того, быстроплавкие дозированные формы преодолевают недостатки,связанные, например, с жевательными дозированными формами, когда промежуток времени, в течение которого активное вещество остается во рту пациента, играет важную роль в определении степени маскирования вкуса и степени, в которой пациент может возражать против раздражения горла активным средством. Фармацевтические композиции (включая косметические препараты) могут включать от приблизи- 14021938 тельно 0,00001 до 100%, например от 0,001 до 10% или от 0,1 до 5 вес.% одного или более сиртуинмодулирующих соединений, описанных в настоящей заявке. В другом варианте осуществления фармацевтическая композиция включает: (i) 0,05-1000 мг соединений изобретения, или их фармацевтически приемлемую соль, и (ii) 0,1-2 г одного или более фармацевтически приемлемых наполнителей. В одном варианте осуществления сиртуин-модулирующее соединение, описанное в настоящей заявке, включено в композицию для местного применения, содержащую носитель для наружного применения, который в целом подходит для местного введения препарата, и включает любой подобный материал, известный в уровне техники. Носитель для наружного применения может быть выбран так, чтобы он обеспечивал получение композиции в требуемой форме, например в виде мази, лосьона, крема, микроэмульсии, геля, масла, раствора и т.п., и может состоять из природного или синтетического материала. Предпочтительно выбранный носитель не оказывает неблагоприятного влияния на активные вещества или другие компоненты композиции для местного применения. Примеры подходящих носителей для наружного применения, используемых в настоящей заявке, включают воду, спирты и другие нетоксичные органические растворители, глицерин, минеральное масло, силикон, вазелиновое масло, ланолин,жирные кислоты, растительные масла, парабены, воска и т.п. Композиции могут являться бесцветными, не имеющими запаха мазями, лосьонами, кремами, микроэмульсиями и гелями. Сиртуин-модулирующие соединения могут быть включены в мази, которые в большинстве случаев являются полутвердыми препаратами, которые обычно приготовлены на основе петролатума или других продуктов нефтепереработки. Конкретная применяемая мазевая основа, как будет очевидно квалифицированным специалистам, является такой основой, которая будет обеспечивать оптимальную доставку лекарственного средства, а также, предпочтительно, и другие требуемые свойства, например умягчение и т.п. Что касается других носителей или сред, мазевая основа должна быть инертной, стабильной, нераздражающей и несенсибилизирующей. Сиртуин-модулирующие соединения могут быть включены в лосьоны, которые в большинстве случаев являются препаратами, наносимыми на поверхность кожи без трения, и обычно представляют собой жидкие или полужидкие препараты, в которых твердые частицы, включая активное вещество, присутствуют в водной или спиртовой основе. Лосьоны обычно являются суспензиями твердых частиц и могут включать жидкую масляную эмульсию типа масло в воде. Сиртуин-модулирующие соединения могут быть включены в кремы, которые в большинстве случаев являются вязкими жидкими или полутвердыми эмульсиями типа масло в воде или вода в масле. Основы для крема являются водносмываемыми и содержат масляную фазу, эмульгатор и водную фазу. Масляная фаза обычно состоит из петролатума и жирного спирта, такого как цетиловый или стеариловый спирт; водная фаза обычно, хотя и не обязательно, превосходит масляную фазу по объему, и обычно содержит увлажняющее вещество. Эмульгатор в кремовой композиции, как описанно в справочнике Remington, см. выше, обычно является неионным, анионным, катионным или амфотерным поверхностноактивным веществом. Сиртуин-модулирующие соединения могут быть включены в микроэмульсии, которые в большинстве случаев являются термодинамически стабильными, изотропно прозрачными дисперсиями двух несмешивающихся жидкостей, таких как масло и вода, стабилизированными межфазной пленкой из молекул поверхностно-активного вещества (Encyclopedia of Pharmaceutical Technology (New York: MarcelDekker, 1992, volume 9). Сиртуин-модулирующие соединения могут быть включены в гелевые композиции, которые в большинстве случаев являются полутвердыми системами, состоящими либо из суспензий, сформированных из маленьких неорганических частиц (двухфазные системы), либо из больших органических молекул, практически однородно распределенных в объеме жидкости-носителя (однофазные гели). Хотя в гелях обычно используют водную жидкость-носитель, также в качестве жидкости-носителя могут использоваться спирты и масла. Также в композиции могут быть включены другие активные средства, например другие противовоспалительные средства, анальгетики, противомикробные средства, противогрибковые средства, антибиотики, витамины, антиоксиданты и солнцезащитные средства, обычно присутствующие в солнцезащитных композициях, включая, помимо прочего, антранилаты, бензофеноны (в особенности бензофенон-3), производные камфоры, циннаматы (например, октилметоксициннамат), дибензоилметаны (например, бутилметоксидибензоилметан), п-аминобензойную кислоту (РАВА) и ее производные, а также эфиры салициловой кислоты (например, октилсалицилат). В некоторых формах для наружного применения активное вещество присутствует в количестве в диапазоне приблизительно от 0,25 до 75 вес.% лекарственной формы, предпочтительно в диапазоне приблизительно от 0,25 до 30 вес.% лекарственной формы, более предпочтительно в диапазоне приблизительно от 0,5 до 15 вес.% лекарственной формы и наиболее предпочтительно в диапазоне от приблизительно 1,0 до 10 вес.% лекарственной формы. Заболевания глаз можно лечить или подвергать профилактике, например, с помощью системной,местной, внутриглазной инъекции сиртуин-модулирующего соединения или посредством введения уст- 15021938 ройства замедленного высвобождения, которое высвобождает сиртуин-модулирующее соединение. Сиртуин-модулирующее соединение, которое повышает уровень и/или активность сиртуинового белка,можно доставлять в фармацевтически приемлемом офтальмическом носителе, который обеспечивает контакт соединения с глазной поверхностью в течение достаточного периода времени, чтобы соединение могло проникнуть через роговую оболочку во внутренние области глаза, как например, в переднюю камеру, заднюю камеру, стекловидное тело, внутриглазную жидкость, жидкость стекловидного тела, роговую оболочку, радужную оболочку/ресничное тело, хрусталик, хориоид/сетчатку и склеру. Фармацевтически-приемлемый офтальмический носитель может, например, являться мазью, растительным маслом или инкапсулирующим материалом. В альтернативном варианте соединения изобретения могут быть введены непосредственно во внутриглазную жидкость и жидкость стекловидного тела. В другом альтернативном варианте соединения могут быть введены системно, например, внутривенной инфузией или инъекцией, для лечения глаза. Сиртуин-модулирующие соединения, описанные в настоящей заявке, могут храниться в бескислородной среде. Например, ресвератрол или его аналог могут быть приготовлены в воздухонепроницаемой капсуле для перорального введения, как например Capsugel (Pfizer, Inc). Клетки, например, обработанные ex vivo сиртуин-модулирующим соединением, можно вводить согласно методам введения трансплантата субъекту, которое может сопровождаться, например, введением иммунодепрессантного препарата, например, циклоспорина А. Относительно информации об общих принципах приготовления лекарственных форм см. Cell Therapy: Stem Cell Transplantation, Gene Therapy,and Cellular Immunotherapy, by G. MorstynW. Sheridan eds, Cambridge University Press, 1996; а такжеHematopoietic Stem Cell Therapy, E. D. Ball, J. ListerP. Law, Churchill Livingstone, 2000. Токсичность и терапевтическая эффективность сиртуин-модулирующих соединений может быть определена в соответствии со стандартными фармацевтическими методиками в культурах клеток или на экспериментальных животных. LD50 является дозой, смертельной для 50% популяции. ED50 является дозой, терапевтически эффективной в 50% популяции. Отношение доз между токсическими и терапевтическими эффектами (LD50/ED50) является терапевтическим индексом. Сиртуин-модулирующие соединения,которые демонстрируют высокие терапевтические индексы, являются предпочтительными. Наряду с тем,что сиртуин-модулирующие соединения, которые проявляют токсические побочные эффекты, могут применяться, следует принять меры по разработке системы доставки, которая направляет подобные соединения в участок пораженной ткани, чтобы минимизировать потенциальное повреждение непораженных клеток и, таким образом, уменьшить побочные эффекты. Данные, полученные от анализов в культурах клеток и тестах на животных, могут использоваться для составления диапазона дозировки для применения на людях. Дозировка таких соединений может находиться в пределах диапазона концентраций в кровотоке, которые включают ED50 с низкой токсичностью или с ее отсутствием. Дозировка может изменяться в пределах данного диапазона в зависимости от применяемой дозированной лекарственной формы и используемого пути введения. Для любого соединения терапевтически эффективная доза может быть первоначально оценена с помощью анализов в культуре клеток. Доза может быть составлена с помощью моделей на животных с достижением диапазона концентрации в циркулирующей плазме, который включает IC50 (то есть, концентрацию тестируемого соединения, которая достигает полумаксимального ингибирования симптомов), как определено в культуре клеток. Такая информация может использоваться для более точного определения эффективных доз на людях. Уровни в плазме могут быть измерены, например, с помощью высокоэффективной жидкостной хроматографии. 6. Наборы. Также в настоящей заявке предложены наборы, например, наборы для терапевтических целей. Набор может включать одно или более сиртуин-модулирующих соединений, например, в отмеренных дозах. Набор необязательно может включать устройства для контакта клеток с соединениями, а также инструкции по применению. Устройства включают шприцы, стенты и другие устройства для введения сиртуин-модулирующего соединения субъекту (например, в кровеносный сосуд субъекта) или для его нанесения на кожу субъекта. В настоящей заявке раскрывается композиция веществ, включающая модулятор сиртуина настоящего изобретения и другое терапевтическое средство (применяемое в комбинированных терапиях и комбинированных композициях), находящиеся в отдельных дозированных лекарственных формах, но связанные друг с другом. Термин "связанный друг с другом", используемый в настоящей заявке, означает,что отдельные дозированные лекарственные формы упакованы вместе или иным образом соединены друг с другом так, что можно легко понять, что отдельные дозированные лекарственные формы предназначены для продажи и введения, как часть одной и той же схемы. Средство и модулятор сиртуина предпочтительно упакованы вместе в блистерной упаковке или другой многоячейковой упаковке, или в виде соединенных, отдельно запечатанных контейнеров (таких как пакеты из фольги и т.п.), которые могут быть отделены пользователем (например, разорваны по линиям отрыва между двумя указанными контейнерами). Набор может включать в отдельных емкостях а) модулятор сиртуина настоящего изобретения/ и b) другое терапевтическое средство, такое как описанное где-либо в настоящем описании. При практическом осуществлении указанных способов, если не указано иное, используются стандартные методы цитобиологии, культивирования клеток, молекулярной биологии, трансгенной биологии, микробиологии, генной инженерии и иммунологии, которые находятся в рамках компетентности в данной области техники. Такие методы полностью описаны в литературе. См., например, Molecular Cloning A Laboratory Manual, 2nd Ed., ed. by Sambrook, Fritsch and Maniatis (Cold Spring Harbor LaboratorySpring Harbor Laboratory Press, Cold Spring Harbor, N. Y., 1986). Примеры Далее изобретение описывается в общих чертах, оно будет с большей легкостью понято посредством обращения к следующим примерам, которые включены исключительно в целях пояснения некоторых аспектов и вариантов осуществления настоящего изобретения, и не должны рассматриваться как какое-либо ограничение изобретения. Получение 8-ниотро-2-(3-(трифторметил)фенил)хинолина: 3-Трифторметилбензальдегид (20,0 г, 0,115 моль) вносили в 500 мл CH3CN вместе с (трифенилфосфоранилиден)ацетальдегидом (35 г, 0,115 моль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Затем смесь упаривали в вакуме. Полученный остаток вносили в 800 мл смеси 1:1 пентан/EtOAc и фильтровали. Фильтрат упаривали в вакуме, получая неочищенный продукт (Е)-3-(3(трифторметил)фенил)акрилальдегид в виде темно-красного масла. Полученный материал вносили в 30 мл CH2Cl2. Полученную смесь медленно добавляли к суспензии 2-нитроанилина (4 г, 0,029 моль) в концентрированной HCl (50 мл) при 90 С в течение 30 мин. Полученную реакционную смесь перемешивали при 90 С в течение еще 1 ч. Реакционную смесь охлаждали до комнатной температуры и промывалиCH2Cl2 (2100 мл). Водный слой нейтрализовали 5%-ным водным раствором NaOH и экстрагировалиCH2Cl2. Объединенные органические слои высушивали (Na2SO4) и упаривали в вакуме. Полученный остаток очищали с помощью хроматографии (пентан/EtOAc), получив 800 мг 8-нитро-2-(3-(трифторметил)фенил) хинолина. МС (ESI) вычисл. для C16H9F3N2O2 (m/z) : 318,06, найдено: 319 [М+1]. Аналогичным способом получали следующее соединение: а. 8-нитро-2-(3-(трифторметокси)фенил)хинолин. Получение N-(2-фенилхинолин-8-ил)пиразин-2-карбоксамида:Chemical Society (1946), vol 68, p. 1589. В стандартном опыте 8-нитро-2-фенилхинолин (510 мг) растворяли в 100 мл МеОН. После добавления 10% Pd на С (50 мг) реакционную смесь тщательно барботировали азотом. Затем смесь энергично перемешивали при комнатной температуре под 1 атм водорода в течение 18 ч. Реакционную смесь фильтровали через слой целлита, а фильтрат упаривали в вакуме, получив 380 мг 2-фенилхинолин-8-амина. МС (ESI) вычисл. для C15H12N2 (m/z): 220,10, найдено: 221 [М+1]. Аналогичным способом получали следующие соединения:b. 2-(3-(трифторметокси)фенил)хинолин-8-амин. Стадия 2. Получение N-(2-фенилхинолин-8-ил)пиразин-2-карбоксамида. 2-Фенилхинолин-8-амин (60 мг, 0,27 ммоль) вносили в 2 мл ДМФА вместе с пиразин-2-карбоновой кислотой (34 мг, 0,27 ммоль), HATU (207 мг, 0,54 ммоль) и ДИЭА (95 мкл, 0,54 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Затем смесь разбавляли EtOAc и промывали водой. Органический слой высушивали (Na2SO4) и упаривали в вакуме. Полученный остаток очищали с помощью препаративной ВЭЖХ (используя водный CH3CN, забуференный 0,1% ТФУ), полу- 17021938 чив 10 мг продукта. МС (ESI) вычисл. для C20H14N4O (m/z): 326,12, найдено: 327 [М+1]. Аналогичным способом получали следующие соединения: Этил-6-гидроксипиколинат (500 мг, 2,7 ммоль), (R)-(2,2-диметил-1,3-диоксолан-4-ил)метанол (1,11 мл, 3,0 экв) и NaH (60%-ая дисперсия в минеральном масле, 385 мг, 3,3 экв) в ТГФ кипятили с обратным холодильником в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры, подкисляли до рН 4, вливали в раствор соли и экстрагировали этилацетатом. Органический слой высушивали, упаривали и перекристаллизовывали из смеси пентана/этилацетата с получением (R)-6-2,2-диметил-1,3 диоксолан-4-ил)метокси)пиколиновой кислоты (500 мг, выход 74%). Получение (R)-3-2,2-диметил-1,3-диоксолан-4-ил)метокси)бензойной кислоты: Стадия 1. Получение (R)-метил-3-2,2-диметил-1,3-диоксолан-4-ил)метокси)бензоата. Смесь метил-3-гидроксибензоата (10.0 г, 65,8 ммоль), (S)-4-(хлорметил)-2,2-диметил-1,3 диоксолана (13,0 г, 98,7 ммоль) и K2CO3 (18,0 г, 132 ммоль) в ДМФА (100 мл) перемешивали в течение 18 ч при 160 С. Смесь разбавляли водой (150 мл) и доводили рН до 6, добавляя 3 Н HCl. Смесь экстрагировали этилацетатом (200 мл 3), высушивали объединенные органические слои (MgSO4) и упаривали в вакуме. Остаток очищали с помощью колоночной хроматографии (10% этилацетата в петролейном эфире), получив (R)-метил-3-2,2-диметил-1,3-диоксолан-4-ил)метокси)бензоат в виде коричневого масла(8,5 г, выход 49%). Стадия 2. Получение (R)-3-2,2-диметил-1,3-диоксолан-4-ил)метокси)бензойной кислоты. К раствору (R)-метил-3-2,2-диметил-1,3-диоксолан-4-ил) метокси) бензоата (8,5 г, 32 ммоль) в ТГФ (80 мл) добавляли раствор LiOH (2,3 г, 96 ммоль) в воде (20 мл). Смесь перемешивали в течение 15 ч при 40 С. Смесь концентрировали и разбавляли насыщенным раствором Na2CO3 (50 мл), промывали этилацетатом (50 мл 2). Значение рН водного слоя доводили до 4, добавляя 3 Н водную HCl. Осадок собирали фильтрацией, после чего осадок на фильтре высушивали в вакууме, получив (R)-3-2,2-диметил 1,3-диоксолан-4-ил)метокси)бензойную кислоту в виде белого твердого вещества (5,8 г, выход 72%). Аналогичным способом получали следующее соединение: 2-Фенилхинолин-8-амин (60 мг, 0,27 ммоль) подвергали той же общей методике амидной конденсации, описанной выше, с использованием 1-(трет-бутоксикарбонил)пиперидин-4-карбоновой кислоты. Полученное промежуточное звено, а именно, трет-бутил-4-(2-фенилхинолин-8-илкарбамоил)пиперидин 1-карбоксилат, далее обрабатывали 2 мл 25%-ой ТФУ в CH2Cl2 в течение 6 ч. Реакционную смесь упаривали в вакуме. Полученный остаток очищали с помощью препаративной ВЭЖХ (используя водный(2003), vol 56, pgs. 39-44. Стадия 1. Получение 2-хлорхинолин-8-амина. Раствор 2-хлор-8-нитрохинолина (1,02 г), порошок железа (2,05 г) и NH4Cl (2,6 г) в смеси EtOH: воды 5:1 (50 мл) кипятили с обратным холодильником в течение 9 ч. По окончании реакции раствор охлаждали до 60 С и фильтровали через целит. Отфильтрованный осадок промывали изопропиловым спиртом, а затем этилацетатом. Фильтрат выпаривали досуха, растворяли в этилацетате и промывали водой,разбавляли водным раствором NaHCO3, раствором соли, после чего высушивали (Na2SO4) и упаривали с получением масла. Целевой продукт кристаллизовали при добавлении пентана в виде коричневого твердого вещества (0,818 г). Стадия 2. Получение N-(2-хлорхинолин-8-ил)тиазол-4-карбоксамида. Раствор 2-хлорхинолин-8-амина (222 мг), тиазол-4-карбоновой кислоты (129 мг, 1 экв), HATU (570 мг, 1,5 экв) и ДИЭА (246 мкл, 2,0 экв) в ДМФА (3 мл) перемешивали при комнатной температуре в течение ночи. Продукт осаждали при добавлении воды (20 мл), собирали фильтрацией и перекристаллизовывали из метанола, получив продукт в виде серого сухого вещества (194 мг). Аналогичным способом получали следующее соединение. а. 2-хлор-N-(пиразин-2-ил)хинолин-8-карбоксамид. Стадия 3. Получение N-(2-(3-фторфенил)хинолин-8-ил)тиазол-4-карбоксамида. Раствор N-(2-хлорхинолин-8-ил)тиазол-4-карбоксамида (29 мг, 0,100 ммоль), 3-фторфенилбороновой кислоты (28 мг, 2 экв.), CsCO3 (65 мг, 2 экв.), Pd(dppf )Cl2 ДХМ (4 мг, 0,05 экв.) в DME (2 мл) нагревали в микроволновом реакторе (140 С 15 мин). Реакционную смесь фильтровали и выпаривали. Остаток растворяли в этилацетате, промывали насыщенным водным раствором NaHCO3; высушивали(Na2SO4) и упаривали. Продукт очищали с помощью колоночной хроматографии (от 0 до 100% EtOAc в пентане), получив 8,6 мг N-(2-(3-фторфенил)хинолин-8-ил)тиазол-4-карбоксамида. МС (ESI) вычисл. дляC19H13FN3OS (ra/z) : 350,08, найдено: 350,1 [М+1]. Аналогичным способом получали следующие соединения: Раствор N-(2-(2-гидроксифенил)хинолин-8-ил)тиазол-4-карбоксамида (0,1 г, 0,287 ммоль), 4-(2 хлорэтил)морфолина (0,129 г, 0,862 ммоль) и карбоната цезия (0,7 г, 2,15 ммоль) в ДМФА (5 мл) нагревали в микроволновом реакторе (200 С 2 ч). Неочищенный материал фильтровали и очищали с помощью хроматографии на силикагеле (в градиенте этилацетата в пентане от 0 до 90%). МС (ESI) вычисл. для C25H24N4O3S (m/z) : 460,16, найдено: 4 61 [М+1]. Получение 1-(тиазол-2-ил)-3-(2-(3-(трифторметокси)фенил)хинолин-8-ил)мочевины: Стадия 1. Получение 8-изоцианато-2-(3-(трифторметокси)фенил)хинолина. К 2-(3-(трифторметокси)фенил)хинолин-8-амину (252 мг, 0,830 ммоль) в толуоле (10 мл) добавляли смесь трифосгена (82 мг, 0,275 ммоль) в толуоле (5 мл). Смесь перемешивали в течение 2 дней, получив 8-изоцианато-2-(3-(трифторметокси)фенил)хинолин, который использовали без выделения. Стадия 2. Получение 1-(тиазол-2-ил)-3-(2-(3-(трифторметокси)фенил)хинолин-8-ил)мочевины: К смеси 8-изоцианато-2-(3-(трифторметокси)фенил)хинолина (0,277 ммоль) в толуоле (5 мл) добавляли 2-аминотиазол (0,553 ммоль, 55 мг). Смесь выпаривали досуха, снова растворяли в пиридине и нагревали в микроволновом реакторе (140 С 10 мин). Реакционную смесь разбавляли СН 2 С 12, промывали насыщенным водным раствором NaHCO3, водой, раствором соли. Органический слой высушивали(Na2SO4) и упаривали в вакуме. В результате очистки с помощью колоночной хроматографии (от 0 до 100% этилацетата в пентане) получали целевой продукт. МС (ESI) вычисл. для C20H13F3N4O2S (m/z): 430,07, найдено: 431 [М+1]. Аналогичным способом получали следующие соединения:NaCNBH3 (88 мг, 1,4 ммоль) при комнатной температуре, затем реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь упаривали в вакууме, остаток вносили в ДХМ,раствор промывали водой (150 мл), обрабатывали активированным углем и Na2SO4, фильтровали через слой силикагеля и промывали осадок на фильтре CH2Cl2. Органические растворы объединяли и упаривали в вакууме, растирали в смеси этилацетата/пентана и фильтровали, получив N-(пиридин-3-илметил)-2(3-(трифторметил)фенил)хинолин-8-амин в виде желтого твердого вещества (220 мг, выход 83%). МС Аналогичным способом получали следующие соединения: Стадия 1. Получение 2-хлор-N-(пиридин-3-илметил)хинолин-8-амина. В смесь 2-хлорхинолин-8-амина (1,75 г, 9,8 ммоль), 3-пиридинкарбальдегида (2,14 г, 20 ммоль) и АсОН (1,2 г, 20 ммоль) в МеОН (10 мл) по частям добавляли NaCNBH3 (1,26 г, 20 ммоль) при комнатной температуре, затем реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь упаривали в вакууме, а остаток вносили в CH2Cl2. Раствор промывали водой (150 мл),высушивали над Na2SO4, концентрировали и очищали на колонке с силикагелем (20:1 пентан/этилацетат), получив 2-хлор-N-(пиридин-3-илметил)хинолин-8-амин в виде желтого масла (2,1 г,выход 80%). Стадия 2. Получение 2-(пиридин-3-ил)-N-(пиридин-3-илметил)хинолин-8-амина. Смесь 2-хлор-N-(пиридин-3-илметил)хинолин-8-амина (160 мг, 0,59 ммоль), 3-пиридилбороновой кислоты (111 мг, 0,9 ммоль), комплекса PdCl2 (dppf)СН 2 С 12 (53 мг, 0,06 ммоль), К 2 СО 3 (248 мг, 1,8 ммоль) и диоксана/Н 20 (5:1, 6 мл) перемешивали при 80 С в течение 3 ч под N2. Реакционную смесь фильтровали, концентрировали и очищали с помощью препаративной ТСХ (4:1 пентан/этилацетат), получив 2-(пиридин-3-ил)-N-(пиридин-3-илметил)хинолин-8-амин в виде желтого твердого вещества (139 мг, выход 75%). МС (ESI) вычисл. для C20H16N4 (m/z) : 312,14, найдено: 313 [М+1]. Аналогичным способом получали следующие соединения: К раствору N-(2-(3-формилфенил)хинолин-8-ил)тиазол-4-карбоксамида (54 мг, 0,150 ммоль) и морфолина (37 мкл, 0,450 ммоль) в смеси ТГФ (4 мл) и этанола (8 мл) добавляли Na(OAc)3BH (95 мг, 0,450 ммоль). Реакционную смесь перемешивали в течение 18 ч, после чего добавляли NaBH4 (17 мг, 3 экв) и уксусную кислоту (500 мкл) и перемешивали реакционную смесь в течение 2 ч. Реакцию останавливали,вливая смесь воды/метанола, выпаривали досуха и растворяли остаток в CH2Cl2. Полученный раствор промывали 1 Н NaOH, водой, раствором соли, высушивали (Na2SO4) и концентрировали. Неочищенный материал очищали с помощью колоночной хроматографии на силикагеле (в градиенте метанола от 0 до 10% в CH2Cl2, модифицированном 0,1% триэтиламина). Продукт лиофилизировали в смеси ацетонитрила/воды, получив N-(2-(3-(морфолинометил)фенил)хинолин-8-ил)тиазол-4-карбоксамид (46 мг, выход 71%). МС (ESI) вычисл. для C24H22N4O2S (m/z) : 430,15, найдено: 431 [М+1]. Аналогичным способом получали следующие соединения: Трет-бутил-4-(3-(8-(тиазол-4-карбоксамидо)хинолин-2-ил)бензил)пиперазин-1-карбоксилат из примера выше обрабатывали смесью 25% ТФУ в CH2Cl2 в течение 18 ч и выпаривали досуха. Остаток суспендировали в CH2Cl2, промытым водным (насыщ.) раствором NaHCO3, высушивали (Na2SO4) и концентрировали. Полученный остаток разводили минимальным количеством диоксана, обрабатывали небольшим избытком HCl в метаноле, а затем диэтиловым эфиром. Полученную соль HCl и N-(2-(3-(пиперазин 1-илметил)фенил)хинолин-8-ил)тиазол-4-карбоксамида собирали с помощью фильтрации (24 мг, выход 32% в двух стадиях). МС (ESI) вычисл. для C24H23N5OS (m/z): 429,16, найдено: 430 [М+1]. Получение N-(2-(3-(трифторметокси)фенил)хинолин-8-ил)-N'-2-тиазолилсульфамида: Раствор 2-(3-(трифторметокси)фенил)хинолин-8-амина (153 мг, 0,500 ммоль) и триэтиламина (104 мкл, 1,5 экв) в безводном CH2Cl2 (10 мл) охлаждали до 0 С. Затем добавляли смесь хлорсульфоновой кислоты (64 мг, 1,1 экв) в CH2Cl2 (3 мл), и перемешивали реакционную смесь при 0 С в течение 30 мин,нагревали до комнатной температуры и перемешивали в течение 1 ч. Добавляли твердый PCl5 (114 мг,1,1 экв), реакционную смесь нагревали и кипятили с обратным холодильником в течение 1 часа, а затем охлаждали до комнатной температуры. Смесь делили на 5 равных по объему частей. К одной части добавляли 2-аминотиазол (200 мг) и DIPEA (0,200 мл). Смесь перемешивали в течение 2,5 ч и добавляли воду. Органический слой промывали водой, раствором соли, высушивали (NaSO4) и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ, а фракции лиофилизировали с получением продукта в виде твердого вещества (10,9 мг, выход 23%). МС (ESI) вычисл. для C19H13F3N4O3S2 (m/z): 466,04,найдено: 467 [М+1]. Аналогичным способом получали следующие соединения: К раствору 2-амино-4-фторбензойной кислоты (2,0 г, 12,9 ммоль) в метаноле (50 мл) добавляли тионилхлорид (1,8 мл, 25,8 ммоль). Смесь оставили нагреваться с обратным холодильником на ночь, после чего выпаривали досуха. Остаток экстрагировали CH2Cl2 (30 мл), промывали водн. NaHCO3 (20 мл), водой и раствором соли, высушивали и выпаривали, получив метил-2-амино-4-фторбензоат в виде твердого желтого вещества (1,4 г). Получение 2-(3-(трифторметокси)фенил)хинолин-8-карбоновой кислоты: Метил 2-(3-(трифторметокси)фенил)хинолин-8-карбоксилат получали согласно методике, описанной Demau.de и др. в Journal of Combinatorial Chemistry (2004), vol 6, р. 768-775. Получение 2-(3-(трифторметокси)фенил)хинолин-8-карбоновой кислоты. К смеси метил-2-(3-(трифторметокси)фенил)хинолин-8-карбоксилата (1,1 г, 3,16 ммоль), растворенного в ТГФ (20 мл), добавляли смесь гидроксида лития (227 мг, 9,5 ммоль) в воде (15 мл). Реакционную смесь перемешивали в течение 70 ч. Затем реакционную смесь выпаривали с целью удаления ТГФ, и доводили рН водного раствора до 1, используя 4 Н HCl (водн.). Твердое вещество собирали с помощью фильтрации, промывали водой и выссушивали в вакууме, получив 2-(3-(трифторметокси)фенил)хинолин-8-карбоновую кислоту в виде твердого коричневого вещества (973 мг, выход 92%). Аналогичным способом получали следующие соединения: К смеси 2-(3-(трифторметокси)фенил)хинолин-8-карбоновой кислоты (1 г, 3,3 ммоль) и HATU (1,71 г, 4,5 ммоль) в ДМФА (30 мл) добавляли 3-аминопиридин (423 мг, 4,5 ммоль), а затем DIPEA (1,03 мл, 6 ммоль). Смесь перемешивали 18 ч, добавляли воду (150 мл), а выпавший в результате осадок собирали с помощью фильтрации. Неочищенный материал очищали с помощью хроматографии (силикагель, в градиенте этилацетата от 0 до 100% в пентане), целевую фракцию выпаривали, а продукт перекристаллизовывали из метанола с получением продукта в виде твердого белого вещества (550 мг, выход 45%). МС(ESI) вычисл. для C22H14F3N3O2 (m/z): 409,10, найдено: 410 [М+1]. Аналогичным способом получали следующие соединения:(40 мл) добавляли трифторид дитиламиносеры (3,7 мл, 28,2 ммоль) в течение 2-минутного периода. Раствор нагревали до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь охлаждали до 0 С, а затем медленно приливали смесь 1:1 водн. NaHCO3 (насыщ.) и 1 М NaOH. Раствор экстрагировали CH2Cl2 (2) и промывали органический слой водой, раствором соли, высушивали (Na2SO4) и упаривали, получив красно-коричневое масло (0,78 г, выход 68%). Продукт использовали в следующей стадии без дополнительной обработки. Получение 2-(3-(дифторметил)фенил)-N-(тиазол-2-ил)хинолин-8-карбоксамида: Стадия 1. Получение 2-(3-(дифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана. К раствору 1-бром-3-(дифторметил)бензола (5,0 г, 24,2 ммоль) в ДМФА (30 мл) добавляли бис(пинаколато)дибор (12,5 г, 50,0 ммоль), KOAc (4,9 г, 50,0 ммоль) и Pd(dppf) Cl2CH2Cl2 (0,5 г, 2,4 ммоль). Реакционную смесь перемешивали в атмосфере азота при 85 С в течение 12 ч, после чего реакционную смесь охлаждали до комнатной температуры и добавляли воду (20 мл). Смесь экстрагировали этилацетатом (330 мл). Объединенные органические слои высушивали над Na2SO4 и упаривали в вакууме, остаток очищали с помощью колоночной хроматографии на силикагеле (петролейный эфир : этилацетат = 150:1), получив 2-(3-(дифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (4,5 г,выход 74%). Аналогичным способом получали следующее соединение: а. 2-(дифторметил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин. Стадия 2. Получение 2-(3-(дифторметил)фенил)хинолин-8-карбоновой кислоты. К раствору 2-хлорхинолин-8-карбоновой кислоты (3,1 г, 15,0 ммоль) в DME (20 мл) и воде (2 мл) добавляли 2-(3-(дифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (4,5 г, 17,7 ммоль), K3PO4(5,2 г, 22,6 ммоль) и Pd(dppf) Cl2CH2Cl2 (0,50 г, 0,63 ммоль). Реакционную смесь перемешивали в атмо- 25021938 сфере азота при 85 С в течение 12 ч, затем реакционную смесь охлаждали до комнатной температуры и добавляли воду (20 мл). Смесь фильтровали, осадок на фильтре промывали водой, после чего полученное твердое вещество высушивали в вакууме с получением 2-(3-(дифторметил)фенил)хинолин-8-карбоновой кислоты (3,6 г, выход 80%). Аналогичным способом получали следующее соединение: а. 2-(2-(дифторметил)пиридин-4-ил)хинолин-8-карбоновую кислоту. Стадия 3. Получение 2-(3-(дифторметил)фенил)-N-(тиазол-2-ил)хинолин-8-карбоксамида. Смесь 2-(3-(дифторметил)фенил)хинолин-8-карбоновой кислоты (250 мг, 0,84 ммоль), тиазол-2 амина (84 мг, 1,2 ммоль), HATU (0,64 г, 1,68 ммоль) и DIPEA (0,22 г, 1,68 ммоль) в ДМФА (25 мл) перемешивали при 40 С в течение 12 ч. Добавляли насыщенный раствор NaHCO3 (5 мл) и фильтровали смесь, остаток промывали метанолом (25 мл) , а затем высушивали в вакууме с получением 2-(3(дифторметил)фенил)-N-(тиазол-2-ил)хинолин-8-карбоксамида в виде сухого вещества (125 мг, выход 39%). МС (ESI) вычисл. для C20H13F2N3OS (m/z) : 381,07, найдено: 382 [М+1]. Аналогичным способом получали следующие соединения: Применяли аналогичную общую методику амидной конденсации, подробно описанную выше, используя трет-бутил-4-аминопиперидин-1-карбоксилат. Защиту с продукта снимали путем обработки 25% ТФУ в CH2Cl2 в течение 72 ч, а затем смесь выпаривали досуха. Остаток растворяли в CH2Cl2, промытом насыщенным водным раствором NaHCO3, высушивали над Na2SO4 и концентрировали. После растирания с пентаном, продукт выделяли в виде светло-коричневого твердого вещества (25 мг, выход 33% за 2 стадии). МС (ESI) вычисл. для C22H20F3N3O (m/z) : 399,16, найдено: 400 [М+1]. Аналогичным способом получали следующие соединения: Стадия 1) Получение трет-бутил-3-(3-нитрофенокси)пирролидин-1-карбоксилата: К смеси 3-нитрофенола (4,0 г, 28,8 ммоль), трет-бутил-3-гидроксипирролидин-1-карбоксилата (5,94 г, 31,7 ммоль), PPh3 (8,3 г, 31,7 ммоль) в ТГФ (40 мл) при 0 С в атмосфере аргона добавляли DEAD (5,52 г, 31,7 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 18 ч. Реакционную смесь выпаривали и очищали с помощью колоночной хроматографии, получив трет-бутил 3-(3-нитрофенокси)пирролидин-1-карбоксилат (8,73 г, выход 98%). Стадия 2. Получение трет-бутил-3-(3-аминофенокси)пирролидин-1-карбоксилата. К раствору трет-бутил-3-(3-нитрофенокси)пирролидин-1-карбоксилата (8,73 г, 28,3 ммоль) в метаноле (50 мл) добавляли никель Рэнея (1,0 г). Раствор перемешивали в атмосфере Н 2 (1 атм) 18 ч. Смесь фильтровали, упаривали и очищали с помощью хроматографии, получив трет-бутил-3-(3-аминофенокси) пирролидин-1-карбоксилат в виде твердого белого вещества (5,47 г, выход 70%). Аналогичным способом получали следующее соединение: а. трет-бутил-4-(3-аминофенокси)пиперидин-1-карбоксилат. Получение 5-(2-(3-(трифторметил)фенил)хинолин-8-карбоксамидо)фуран-2-карбоновой кислоты: Раствор метил-5-(2-(3-(трифторметил)фенил)хинолин-8-карбоксамидо)фуран-2-карбоксилата (12 мг) и NaOH (2 экв) в 50%-ом водном ТГФ (6 мл) перемешивали при комнатной температуре в течение ночи. Смесь упаривали, доводили рН до 1, используя конц. HCl, и собирали выпавший осадок фильтрованием. Очистка с помощью ТСХ дала 5-(2-(3-(трифторметил)фенил)хинолин-8-карбоксамидо)фуран-2 карбоновую кислоту (5 мг). МС (ESI) вычисл. для C22H13F3N2O4 (m/z) : 426,08, найдено: 427 [М+1]. Аналогичным способом получали следующее соединение: а. 2-(2-(3-(трифторметил)фенил)хинолин-8-карбоксамидо)тиазол-4-карбоновую кислоту. Получение (R)-3-2,2-диметил-1,3-диоксолан-4-ил)метокси)анилина: Стадия 1. Получение (R)-2,2-диметил-4-3-нитрофенокси)метил)-1,3-диоксолана. 3-Нитрофенол (2,0 г, 14,37 ммоль) вносили в 20 мл безводного ДМФА вместе с безводным карбонатом калия (4,96 г, 35,93 ммоль) и (R)-4-(хлорметил)-2,2-диметил-1,3-диоксоланом (2,55 мл, 18,68 ммоль). Полученную реакционную смесь нагревали в микроволновом реакторе с перемешиванием при 160 С в течение 4 ч. Неочищенную реакционную смесь промывали водой, фильтровали и экстрагировали дихлорметаном (315 мл). Объединенные органические слои высушивали (Na2SO4) и выпаривали в вакуме. Полученный остаток очищали с помощью хроматографии, используя смесь этилацетата:пентана, получив целевой продукт в виде масла янтарного цвета (52%). Стадия 2. Получение (R)-3-2,2-диметил-1,3-диоксолан-4-ил)метокси)анилина. В атмосфере азота соединяли порошок Fe (2,38 г, 42,54 ммоль) и NH4Cl (2,38 г, 42,54 ммоль) с последующим добавлением (R)-2,2-диметил-4-3-нитрофенокси)метил)-1,3-диоксолана (1,8 г, 7,09 ммоль) и смеси изопропанола: воды 4:1 (30 мл : 10 мл). Реакционную смесь нагревали с обратным холодильником при перемешивании в течение 18 ч. Неочищенный материал фильтровали через целит и упаривали фильтрат в вакуме. Полученный водный слой экстрагировали дихлорметаном (315 мл). Объединенные органические слои высушивали (Na2SO4) и упаривали в вакууме с получением (R)-3-2,2-диметил-1,3 диоксолан-4-ил)метокси)анилина (1,2 г, выход 79%). Материал использовали в следующей стадии без дополнительной очистки. Аналогичным способом получали следующие соединения: К смеси 4-2,2-диметил-1,3-диоксолан-4-ил)метокси)анилина (167 мг, 0,750 ммоль), 2-(3-(трифторметил)фенил)хинолин-8-карбоновой кислоты (159 мг, 0,500 ммоль), HATU (285 мг, 0,75 ммоль) в NMP (5 мл) добавляли DIPEA (17 3 мкл, 1,0 ммоль). Реакционную смесь перемешивали в течение 72 ч при комнатной температуре, добавляли воду (5 мл), собирали выпавший осадок фильтрованием и перекристаллизовывали из этанола. Желтое твердое вещество обрабатывали смесью 1:3 6 Н HCl/диоксана (8 мл) в течение ночи. Смесь выпаривали досуха,растирали с водой, собирали фильтрованием, промывали водой и высушивали с получением N-(4-(2,3 дигидроксипропокси)фенил)-2-(3-(трифторметил)фенил)хинолин-8-карбоксамида (191 мг, выход 79%). МС (ESI) вычисл. для C26H21F3N2O4 (m/z): 482,15, найдено: 483 [М+1]. Аналогичным способом получали следующие соединения: Стадия 1. Получение трет-бутил-4-(3-формилфенокси)пиперидин-1-карбоксилата. К смеси 3-гидроксибензальдегида (1,0 г), трет-бутил-4-гидроксипиперидин-1-карбоксилата (1,67 г,1,1 экв), трифенилфосфина (2,35 г, 1,1 экв) в ТГФ (15 мл) при 0 С по каплям добавляли DEAD (6,74 г,4,75 экв). Смесь нагревали до комнатной температуры и перемешивали в течение 2 дней. К реакционной смеси добавляли насыщенный р-р NaHCO3 (водн.), и экстрагировали водный слой этилацетатом (315 мл), органические слои объединяли, высушивали (Na2SO4) и очищали с помощью колоночной хроматографии на силикагеле (10% этилацетата в пентане), получив целевой продукт в виде светло-желтого масла (900 мг, выход 38%). Аналогичным способом получали следующие соединения:a. (R)-3-(пирролидин-3-илокси)бензальдегид. Стадия 2. Получение 2-(3-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)фенил)хинолин-8-карбоновой кислоты. Для получения 2- (3-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)фенил)хинолин-8-карбоновой кислоты применяли методику, по сути аналогичную описанной при получении 2-(3-(трифторметокси) фенил)хинолин-8-карбоновой кислоты, используя в качестве подходящего реагента трет-бутил-4-(3 формилфенокси)пиперидин-1-карбоксилат. Аналогичным способом получали следующее соединение:a. (R)-2-(3-(пирролидин-3-илокси)фенил)хинолин-8-карбоновую кислоту. Стадия 3. Получение N-циклопентил-2-(3-(пиперидин-4-илокси)фенил)хинолин-8-карбоксамида. Применяли такую же общую методику амидной конденсации, описанную выше, используя 2-(3-(1(трет-бутоксикарбонил)пиперидин-4-илокси)фенил)хинолин-8-карбоновую кислоту и циклопентиламин. После очистки с помощью колоночной хроматографии (1:5 этилацетат/пентан) с последующей обработкой 4 Н HCl/МеОН и выпариванием продукт получали в виде желтого твердого вещества. МС (ESI) вычисл. для C26H29N3O2 (m/z): 415,23, найдено: 416 [М+1]. Аналогичным способом получали следующие соединения: Стадия 1. Получение (2-(3-(трифторметил)фенил)хинолин-8-ил)метанола. К раствору 2-(3-(трифторметил)фенил)хинолин-8-карбоновой кислоты (1,5 г, 4,12 ммоль) в ТГФ (50 мл) порциями добавляли LiAlH4 (0,36 г, 9,46 ммоль) при 0 С. Смесь оставляли перемешиваться при комнатной температуре на ночь, после чего приливали воду и выпаривали досуха. Остаток растворяли в воде и экстрагировали этилацетатом. Объединенные органические слои промывали раствором соли, высушивали над Na2SO4 и упаривали. Очистка с помощью колоночной хроматографии (1:10 этилацетат в пента- 28021938 не) дала продукт в виде желтого масла (0,69 г, выход 48%). Стадия 2. Получение 8-(хлорметил)-2-(3-(трифторметил)фенил)хинолина. К раствору (2-(3-(трифторметил)фенил)хинолин-8-ил)метанола (0,67 г, 2,2 ммоль) в CH2Cl2 (20 мл) по каплям при 0 С добавляли SOCl2 (0,32 мл, 4,4 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч, а затем выпаривали. Остаток очищали с помощью колоночной хроматографии (1:15 этилацетат в пентане), получив продукт в виде белого твердого вещества (0,668 г, выход 94%). Стадия 3. Получение N-2-(3-(трифторметил)фенил)хинолин-8-ил)метил)циклопентанамина. Раствор 8-(хлорметил)-2-(3-(трифторметил)фенил)хинолина (70 мг, 0,22 ммоль), циклопентиламина(0,1 мл, 1,09 ммоль) и DIPEA (0,18 мл, 1,09 ммоль) в ацетонитриле (2 мл) перемешивали при 100 С в микроволновом реакторе в течение 10 мин. Затем смесь упаривали. Очистка с помощью препаративной ТСХ привела к получению белого твердого вещества (74,8 мг, выход 91%). МС (ESI) вычисл. дляC22H21F3N2 (m/z) : 370,17, найдено: 371 [М+1]. Аналогичным способом получали следующие соединения:(75 мл) и воде (4 мл), одной порцией добавляли SeO2 (4,38 г, 39,4 ммоль). Смесь оставляли на ночь нагреваться с обратным холодильником. Затем смесь фильтровали для удаления черного осадка. Фильтрат выпаривали и очищали с помощью колоночной хроматографии (1:5 этилацетат/пентан), получив 2-оксо 2-(3-(трифторметокси)фенил)ацетальдегид в виде желтого масла (5,3 г, выход 98%). Аналогичным способом получали следующее соединение: а. 2-оксо-2-(3-(трифторметил)фенил)ацетальдегид. Стадия 2. Получение 3-(3-(трифторметокси)фенил)хиноксалин-5-карбоновой кислоты. 2-оксо-2-(3-(трифторметокси)фенил)ацетальдегид (1,0 г, 4,58 ммоль) и 2,3-диаминобензойную кислоту (634 мг, 4,17 ммоль) растворяли в EtOH (70 мл) и оставляли перемешиваться при комнатной температуре на ночь. Объем уменьшали до 30 мл, осадок собирали фильтрованием, промывали этанолом и высушивали в вакууме с получением 3-(3-(трифторметокси)фенил)хиноксалин-5-карбоновой кислоты в виде серого твердого вещества (1,0 г, выход: 12%). Аналогичным способом получали следующие соединения:b. 3-(3-(трифторметил)фенил)хиноксалин-5-карбоновую кислоту. Стадия 3. Получение N-(тиазол-2-ил)-3-(3-(трифторметокси)фенил)хиноксалин-5-карбоксамида. Смесь 3-(3-(трифторметокси)фенил)хиноксалин-5-карбоновой кислоты (100 мг, 0,30 ммоль), 2 аминотиазола (30 мг, 0,30 ммоль), HATU (171 мг, 0,4 5 ммоль) и ДИЭА (116 мг, 0,9 ммоль) в ДМФА (10 мл) перемешивали при комнатной температуре в течение 2 ч. Затем добавляли воду (20 мл), собирали выпавший в результате осадок фильтрованием и высушивали в вакууме с получением N-(тиазол-2-ил)-3(3-(трифторметокси)фенил)хиноксалин-5-карбоксамида в виде твердого вещества (115,5 мг, выход 92%). МС (ESI) вычисл. для C19H11F3N4O2S (m/z) : 416,06, найдено: 417 [М+1]. Аналогичным способом получали следующие соединения:
МПК / Метки
МПК: A61K 31/535
Метки: аналоги, хинолины, модуляторов, качестве, сиртуина
Код ссылки
<a href="https://eas.patents.su/30-21938-hinoliny-i-ih-analogi-v-kachestve-modulyatorov-sirtuina.html" rel="bookmark" title="База патентов Евразийского Союза">Хинолины и их аналоги в качестве модуляторов сиртуина</a>
Предыдущий патент: Мембрана из полых волокон
Следующий патент: Гидрогалогенидный комплекс агомелатина и его получение
Случайный патент: Медикаменты для профилактики и лечения бромидроза и для улучшения запаха тела












