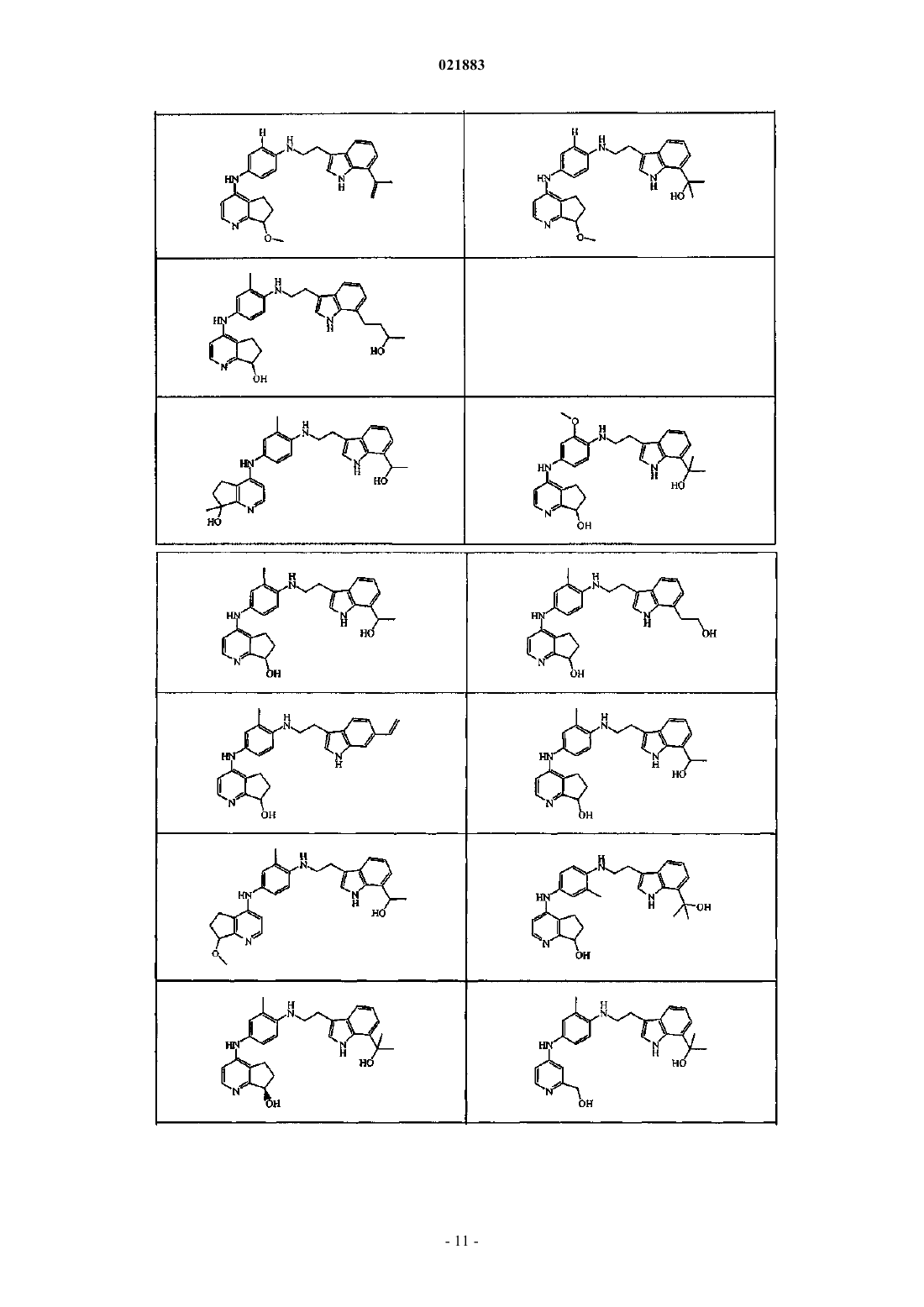
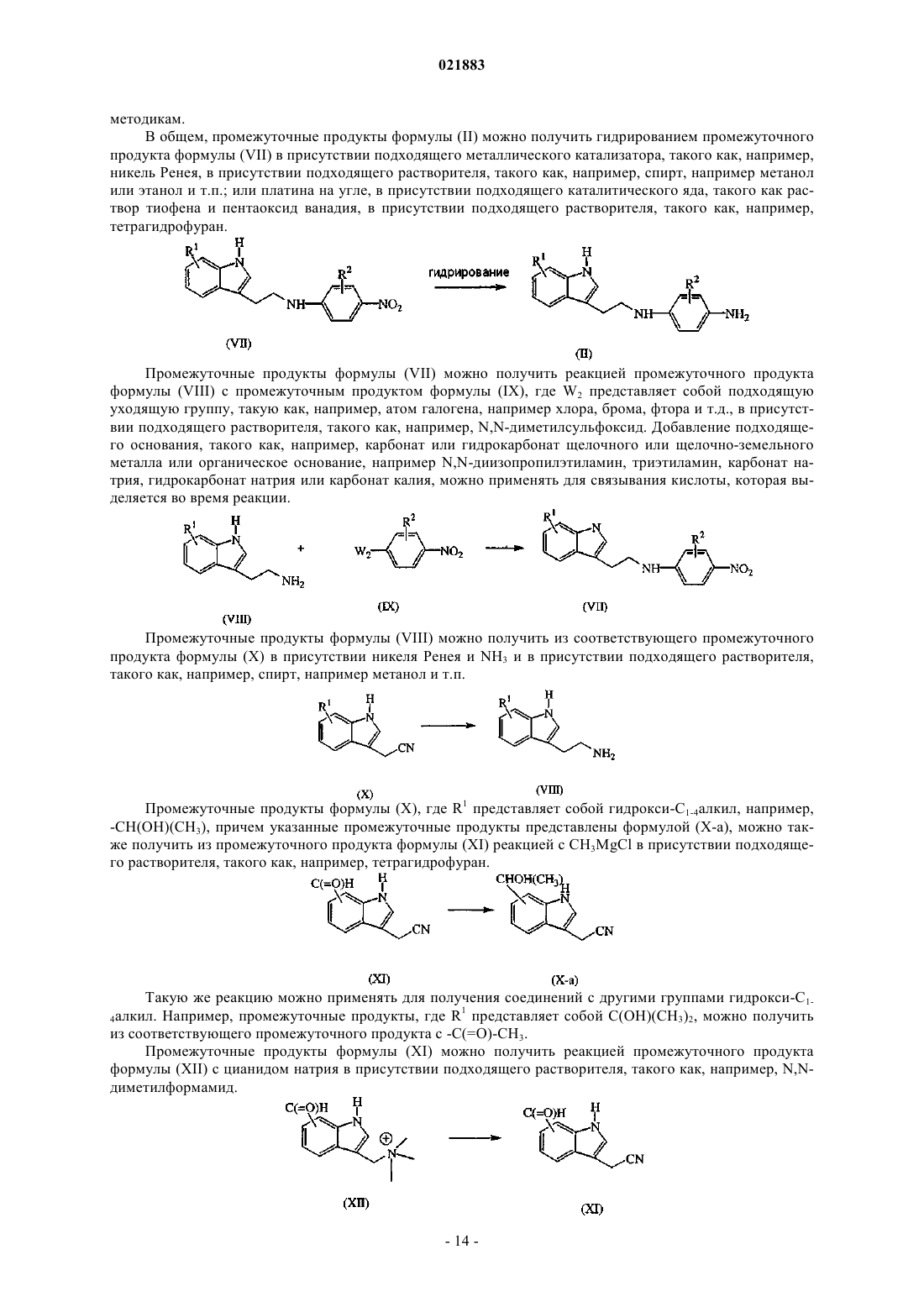
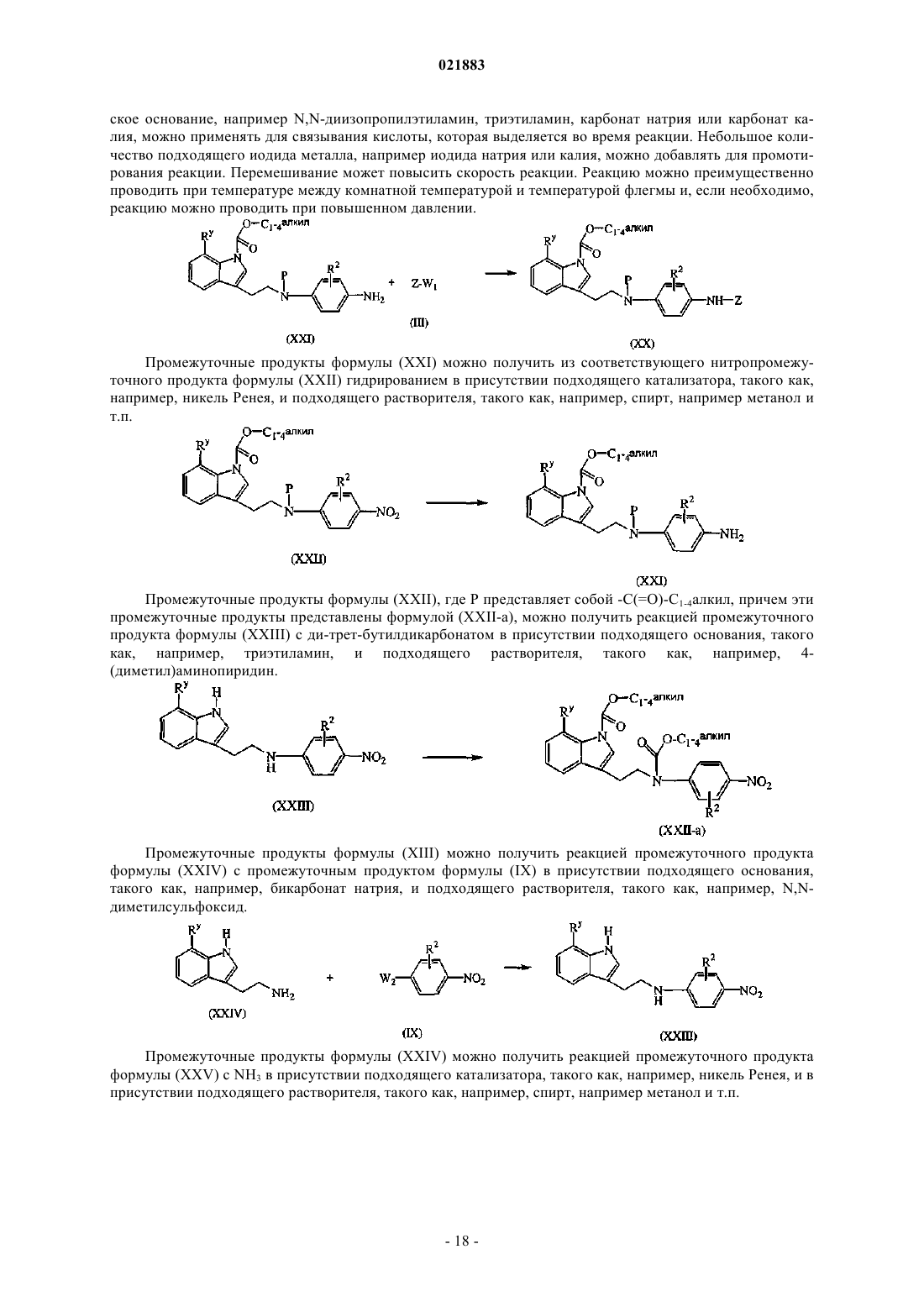
Производные индола в качестве противораковых агентов
Номер патента: 21883
Опубликовано: 30.09.2015
Авторы: Декамп Софи, Амблар Натали Клоди Изабелль, Схунтьес Брюно
Формула / Реферат
1. Соединение формулы (I)
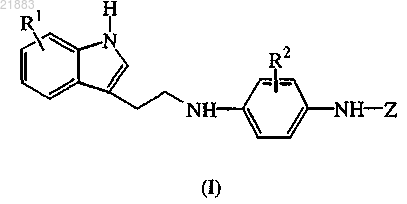
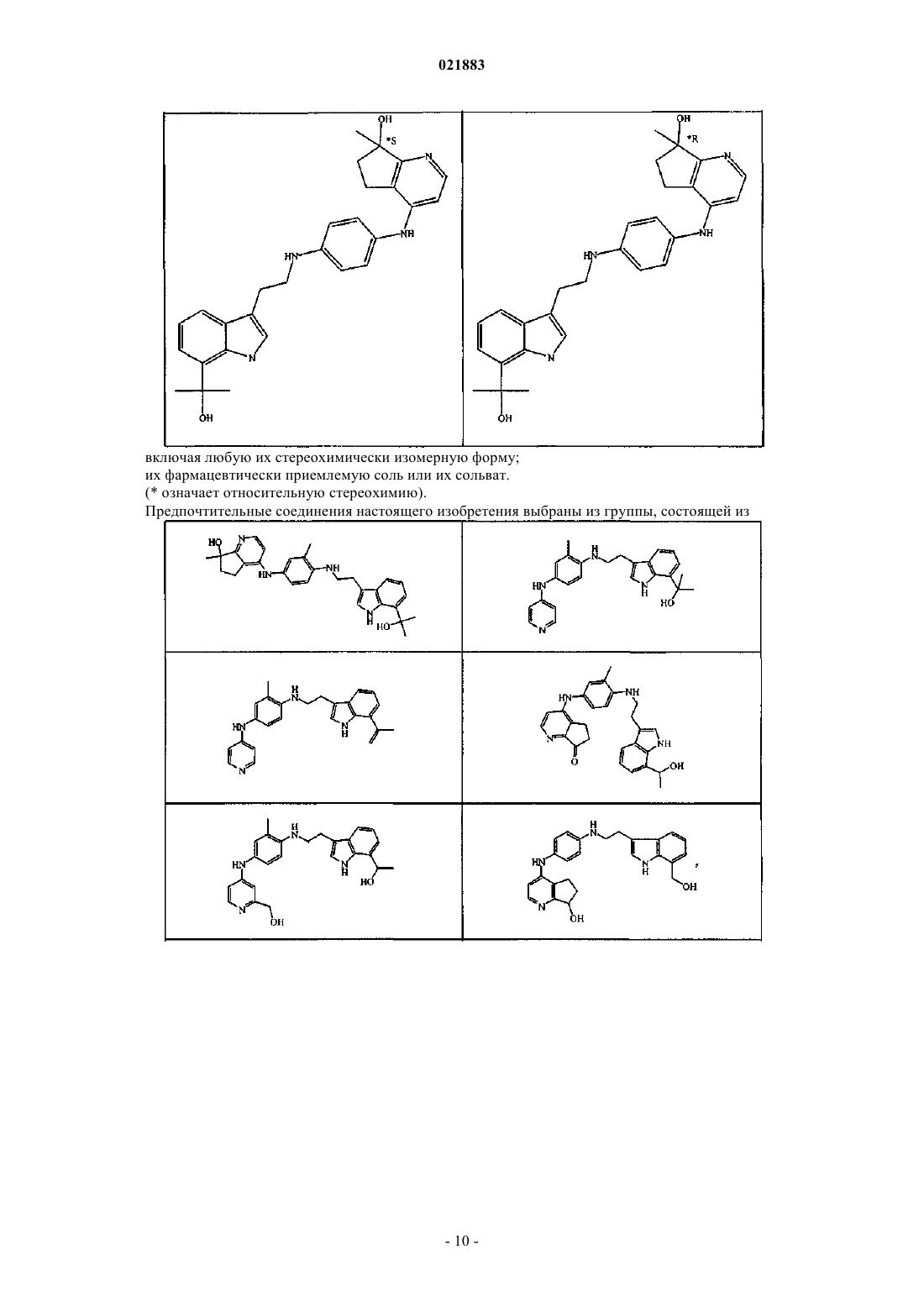
включая любую его стереохимически изомерную форму, где
R1 представляет собой гидрокси-С1-6алкил или С2-6алкенил; при условии, что заместитель R1 находится в положении 6 или 7 индольной части;
R2 представляет собой водород или С1-4алкил;
Z представляет собой радикал, выбранный из
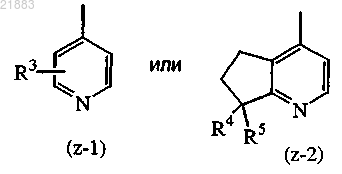
R3 представляет собой водород или гидрокси-С1-4алкил;
R4 представляет собой гидрокси или С1-4алкилокси;
R5 представляет собой водород или С1-4алкил или
R4 и R5, взятые вместе, образуют оксо;
его фармацевтически приемлемая соль или его сольват.
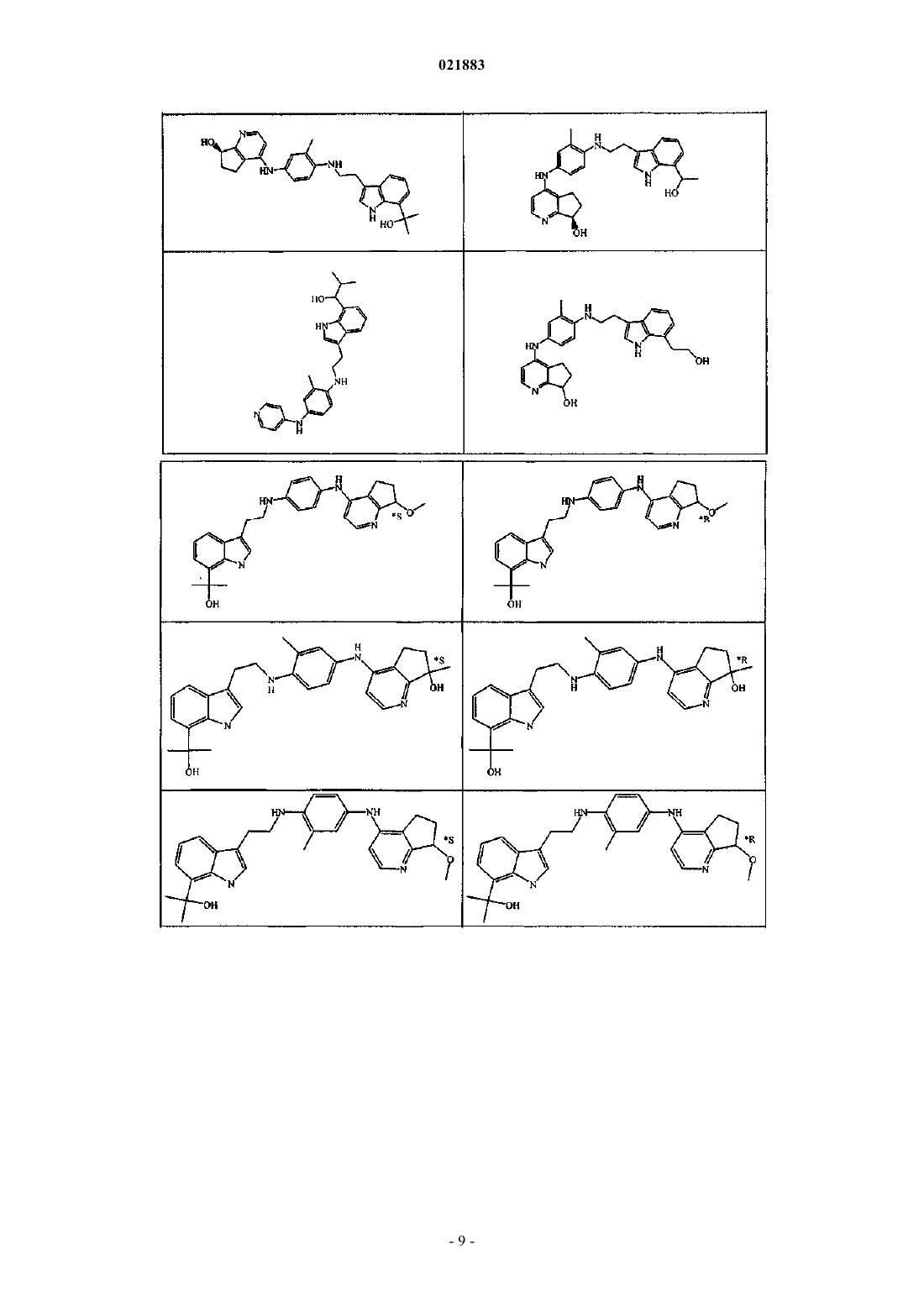
2. Соединение по п.1, имеющее формулу

3. Соединение по п.1 или 2, где R1 представляет собой гидрокси-С1-6алкил.
4. Соединение по любому из пп.1-3, где R2 представляет собой С1-4алкил.
5. Соединение по любому из пп.1-4, где Z представляет собой радикал формулы (z-1).
6. Соединение по любому из пп.1-4, где Z представляет собой радикал формулы (z-2).
7. Соединение по п.6, где R4 представляет собой гидроксил и R5 представляет собой водород.
8. Соединение по п.6, где R4 представляет собой гидроксил и R5 представляет собой С1-4алкил.
9. Соединение по п.1, где соединение является энантиомером формулы

имеющим левое вращение плоскости поляризованного света, измеренное при длине волны D-линии натрия (589 нм) при температуре 20°С и длине пути ячейки 1 дм в хлороформе при концентрации 8,59 мг/мл;
или его фармацевтически приемлемая соль, или его сольват.
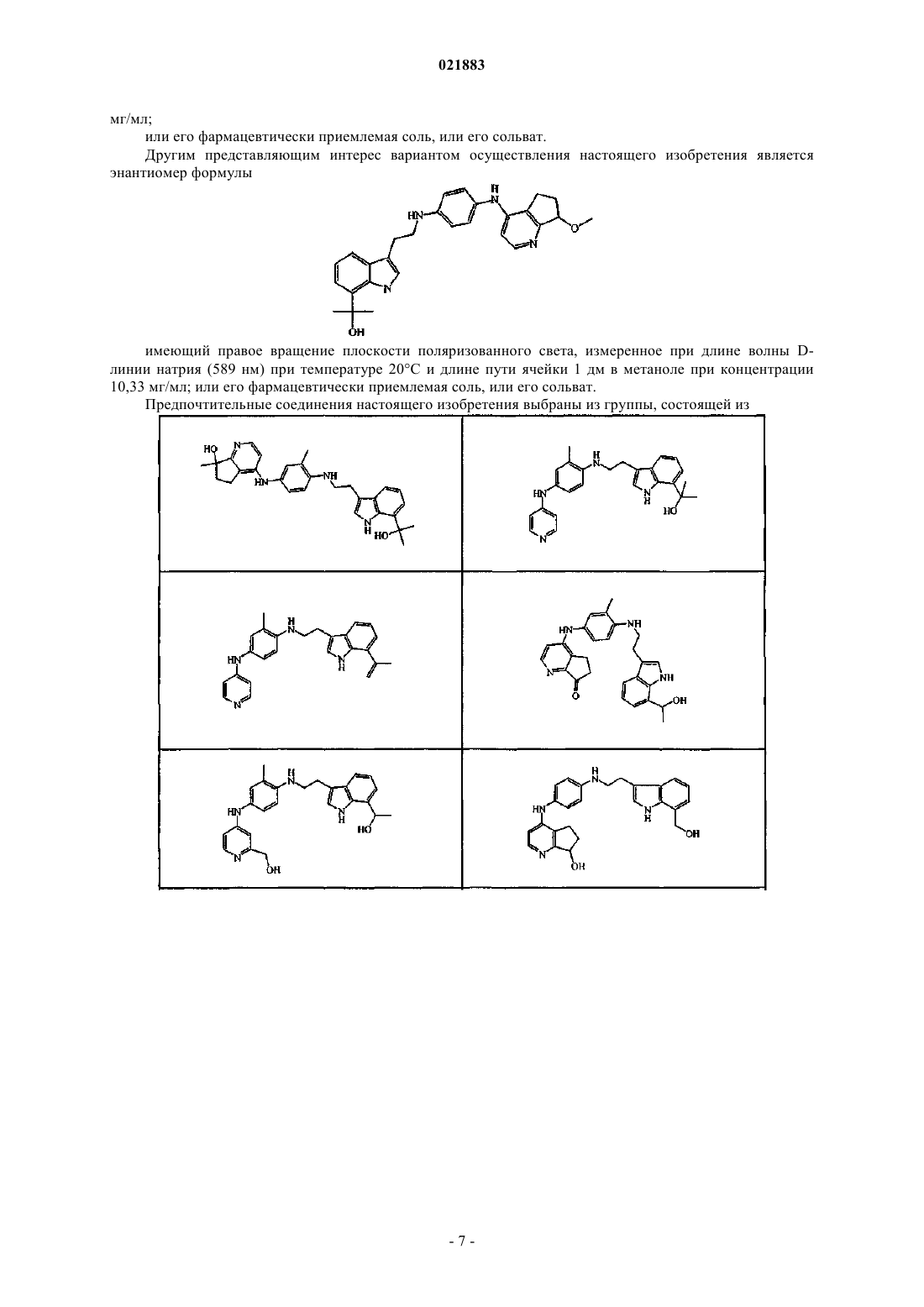
10. Соединение по п.1, где соединение является энантиомером формулы
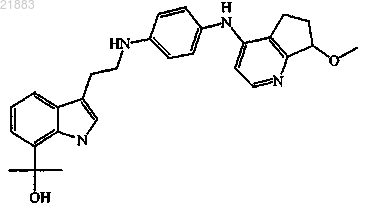
имеющим правое вращение плоскости поляризованного света, измеренное при длине волны D-линии натрия (589 нм) при температуре 20°С и длине пути ячейки 1 дм в метаноле при концентрации 10,33 мг/мл;
или его фармацевтически приемлемая соль, или его сольват.
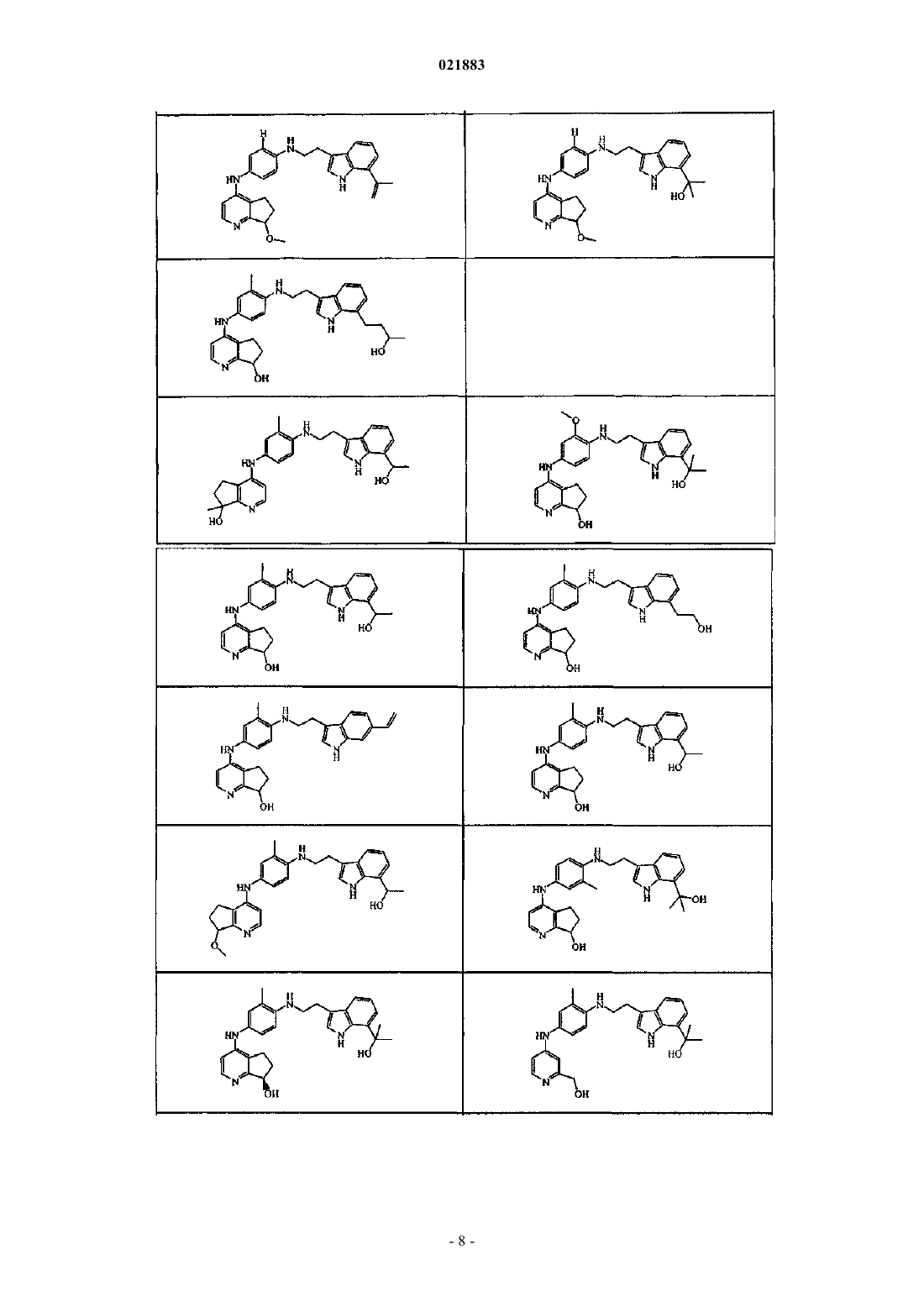
11. Применение соединения по любому из пп.1-10 в качестве лекарственного средства для лечения рака.
12. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-10 в качестве активного ингредиента и фармацевтически приемлемый носитель.
13. Применение соединения по любому из пп.1-10 для изготовления лекарственного средства для лечения рака.
14. Комбинация одного или нескольких противораковых агентов и соединения по любому из пп.1-10.
15. Способ получения соединения по п.1, отличающийся тем, что промежуточный продукт формулы (II) подвергают взаимодействию с промежуточным продуктом формулы (III), где W1 представляет собой подходящую уходящую группу, в инертном в реакционных условиях растворителе, необязательно в присутствии подходящего основания
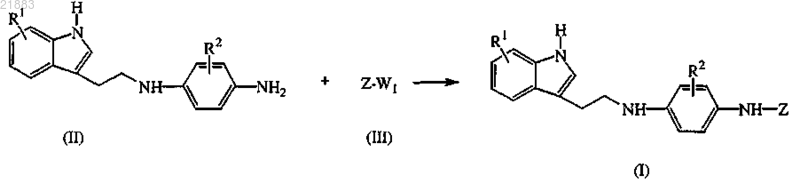
где R1, R2 и Z имеют значения, указанные в п.1,
или, если необходимо, превращают соединения формулы (I) друг в друга по известным в данной области техники превращениям и дополнительно, если необходимо, превращают соединения формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или наоборот, превращают кислотно-аддитивную соль в свободное основание обработкой основанием или превращают основно-аддитивную соль в свободную кислоту обработкой кислотой, или, если необходимо, получают их стереохимически изомерные формы или сольваты.
16. Способ получения соединения по п.1, отличающийся тем, что промежуточный продукт формулы (II) подвергают взаимодействию с промежуточным продуктом формулы (III), где W1 представляет собой подходящую уходящую группу, в присутствии подходящего катализатора, подходящего лиганда, подходящего основания и подходящего растворителя
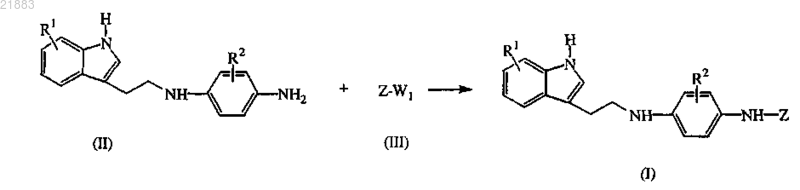
где R1, R2 и Z имеют значения, указанные в п.1,
или, если необходимо, превращают соединения формулы (I) друг в друга по известным в данной области техники превращениям и дополнительно, если необходимо, превращают соединения формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или наоборот, превращают кислотно-аддитивную соль в свободное основание обработкой основанием или превращают основно-аддитивную соль в свободную кислоту обработкой кислотой, или, если необходимо, получают их стереохимически изомерные формы или сольваты.
17. Способ получения соединения по п.1, отличающийся тем, что соответствующее карбонильное соединение формулы (IV) восстанавливают в присутствии подходящего восстанавливающего агента и подходящего растворителя
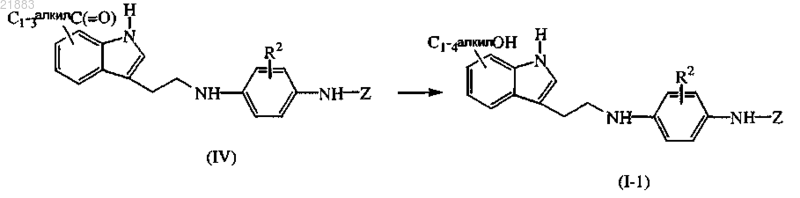
где R2 и Z имеют значения, указанные в п.1,
или, если необходимо, превращают соединения формулы (I) друг в друга по известным в данной области техники превращениям и дополнительно, если необходимо, превращают соединения формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или наоборот, превращают кислотно-аддитивную соль в свободное основание обработкой основанием или превращают основно-аддитивную соль в свободную кислоту обработкой кислотой, или, если необходимо, получают их стереохимически изомерные формы или сольваты.
18. Способ получения соединения по п.1, отличающийся тем, что соответствующее сложноэфирное производное формулы (V), где Rx представляет собой C1-3алкил-С(=O)ОС1-4алкил, восстанавливают в присутствии подходящего восстанавливающего агента и подходящего растворителя

где R2 и Z имеют значения, указанные в п.1,
или, если необходимо, превращают соединения формулы (I) друг в друга по известным в данной области техники превращениям и дополнительно, если необходимо, превращают соединения формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или наоборот, превращают кислотно-аддитивную соль в свободное основание обработкой основанием или превращают основно-аддитивную соль в свободную кислоту обработкой кислотой, или, если необходимо, получают их стереохимически изомерные формы или сольваты.
19. Способ получения соединения по п.1, отличающийся тем, что промежуточный продукт формулы (VI) гидролизуют подходящим основанием в присутствии подходящего растворителя
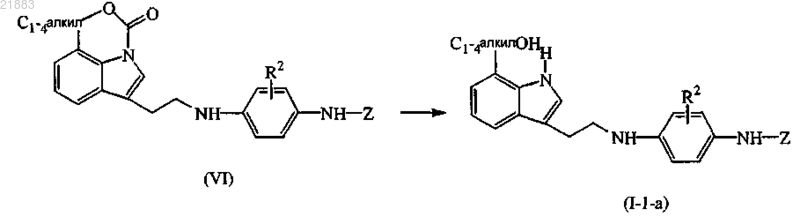
где R2 и Z имеют значения, указанные в п.1,
или, если необходимо, превращают соединения формулы (I) друг в друга по известным в данной области техники превращениям и дополнительно, если необходимо, превращают соединения формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или наоборот, превращают кислотно-аддитивную соль в свободное основание обработкой основанием или превращают основно-аддитивную соль в свободную кислоту обработкой кислотой, или, если необходимо, получают их стереохимически изомерные формы или сольваты.
Текст
Настоящее изобретение относится к соединениям формулы (I), их применению для лечения рака,а также фармацевтическим композициям, содержащим указанные соединения формулы (I) Схунтьес Брюно (BE), Декамп Софи,Амблар Натали Клоди Изабелль (FR) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Область техники, к которой относится изобретение Настоящее изобретение относится к производным индола и композициям, содержащим указанные соединения, действующим в качестве противораковых агентов. Кроме того, настоящее изобретение относится к способам получения описанных соединений, комбинации указанных соединений с одним или несколькими противораковыми агентами, применению указанных соединений, например, в качестве лекарственных средств, в частности, для лечения рака. Без связи с какой-либо теорией в настоящее время считают, что хотя MDM2 и р 53 представляют собой ключевые элементы в биологии опухолевых клеток и играют ключевые роли в клеточной реакции на повреждение или стресс клеток и хотя настоящие соединения увеличивают экспрессию р 53, оказывается, что они могут не представлять собой основные молекулярные мишени, посредством которых настоящие соединения проявляют свою демонстрируемую сильную преклиническую противоопухолевую активность. Первоначальные исследования были направлены на непосредственное или опосредуемое действие на синтез ДНК и/или репликативную, вызванную стрессом, ответную реакцию как основу для наблюдаемой преклинической противоопухолевой активности соединений. Настоящие соединения проявляют также антипролиферативные действия в опухолевых клетках, которые лишены р 53, лишены функционального р 53 или имеют мутант р 53 и, кроме того, они могут делать онкогенные клетки чувствительными к химиотерапии и радиотерапии. р 53 представляет собой белок-супрессор опухолей, который играет основную роль в регуляции баланса между пролиферацией клеток и подавлением роста/апоптозом клеток. При нормальных условиях полупериод существования р 53 является очень коротким и в результате этого уровень р 53 в клетках низкий. Однако в ответ на клеточное повреждение ДНК или клеточный стресс (например, активацию онкогена, эрозию теломера, гипоксию) уровни р 53 увеличиваются. Повышение уровней р 53 приводит к активации транскрипции ряда генов, которая вызывает либо остановку роста, либо процессы апоптоза клеток. Таким образом, важной функцией р 53 является предотвращение нерегулируемой пролиферации поврежденных клеток и, тем самым, защита организма от развития рака. Термин "MDM2" (Murine Double Minute 2) применяют в данном контексте для обозначения белка, получаемого в результате экспрессии генаmdm2. В пределах значения этого термина MDM2 включает в себя все белки, кодируемые mdm2, их мутанты, их альтернативные белки тонкого слоя и их фосфорилированные белки. Кроме того, применяемый в контексте термин "MDM2" включает в себя аналоги MDM2, например MDMX, известный также как MDM4, и гомологи и аналоги MDM2 других животных, например гомолог HDM2 человека или аналог HDMX человека. MDM2 является ключевым негативным регулятором функции р 53. Он образует негативную авторегуляторную петлю связыванием аминоконцевого домена трансактивации р 53, и, таким образом, MDM2 как ингибирует способность р 53 активировать транскрипцию, так и направленно вызывает протеолитическую деградацию р 53. При нормальных условиях эта регуляторная петля является ответственной за поддержание низких уровней р 53. Предшествующий уровень техники изобретения В JP 11130750 среди других соединений описаны замещенные фениламинокарбонилиндолилсоединения в качестве антагонистов рецептора 5-НТ. В ЕР 1129074 описаны амиды антраниловой кислоты в качестве ингибиторов рецепторов эндотелиального фактора роста сосудов (VEGFR) и применимые при лечении ангиогенных нарушений. В WO 01/42224 предложены карбоксиамидопроизводные для лечения болезни Альцгеймера. В ЕР 1317443 описаны трициклические производные третичных аминов, применимые в качестве рецептораCXCR4 хемокина или модуляторов CCR5 для лечения вирусного иммунодефицитного заболевания человека и вирусного иммунодефицитного заболевания кошачьих. В ЕР 1379239 описаны N-(2-арилэтил)бензиламины в качестве антагонистов рецептора 5-НТ 6 рецептора. В WO 00/15357 описаны пиперазин-4-фенилпроизводные в качестве ингибиторов взаимодействия между MDM2 и р 53. В ЕР 1137418 предложены трициклические соединения для восстановления конформационной стабильности белка семейства р 53. В WO 03/040402 предложены соединения, которые ингибируют взаимодействие между белками, такое как взаимодействие между MDM2 и р 53. В ЕР 1443937 описаны замещенные 1,4-бензодиазепины и их применение в качестве ингибиторов взаимодействия MDM2-p53. В ЕР 1458380 предложены цис-2,4,5-трифенилимидазолоны, которые ингибируют взаимодействие белка MDM2 с подобными р 53 пептидами и обладают антипролиферативной активностью. В ЕР 1519932 описаны производные бисарилсульфонамидов, которые связываются с MDM2 и которые можно применять в терапии рака. В WO 2006/032631, WO 2007/107543, WO 2007/107545, WO 2009/019274, WO 2009/037308 и WO 2009/037343 описаны ингибиторы взаимодействия между MDM2 и р 53. Существует потребность в эффективных малых молекулах, которые обладают сильным ингибирующим действием против роста клеток, имеют широкий профиль безопасности и обладают меньшими нежелательными побочными действиями. Соединения настоящего изобретения проявляют превосходную активность in vitro и превосходные противоопухолевые действия in vivo. Они имеют низкую аффинность в отношении ферментов Р 450, ко-1 021883 торые снижают риск нежелательного взаимодействия лекарственное средство-лекарственное средство,обеспечивая тем самым более широкий предел безопасности. Кроме того, соединения настоящего изобретения обладают слабыми, индуцированными лекарственными средствами, неврологическими действиями и имеют улучшенный сердечно-сосудистый профиль, который может благоприятно влиять на ограничивающую дозу токсичность соединений. Описание изобретения Настоящее изобретение относится к соединениям, композициям, комбинациям для лечения рака и их применению для лечения рака. Кроме того, соединения и композиция настоящего изобретения являются применимыми для повышения эффективности химиотерапии и радиотерапии. Изобретение также относится к способам получения соединений настоящего изобретения. Изобретение относится к соединениям формулы (I) включая их любую стереохимически изомерную форму, гдеR2 представляет собой водород или С 1-4 алкил;R3 представляет собой водород или гидрокси-С 1-4 алкил;R4 представляет собой гидрокси или С 1-4 алкилокси;R5 представляет собой водород или С 1-4 алкил илиR4 и R5, взятые вместе, образуют оксо; их фармацевтически приемлемым солям или сольватам. Соединения формулы (I) могут существовать в их таутомерных формах. Предполагается, что такие формы, хотя они определенно не указаны в приведенной выше формуле, включены в объем настоящего изобретения. Настоящее изобретение относится также к применению соединения формулы (I) для изготовления лекарственного средства для лечения рака и применению соединения формулы (I) для лечения рака. Настоящее изобретение относится также к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I) в качестве активного ингредиента и фармацевтически приемлемый носитель; к комбинации одного или нескольких противораковых агентов и соединения формулы (I), способам получения соединений формулы (I). Один способ получения соединения формулы(I) настоящего изобретения заключается в том, что промежуточный продукт формулы (II) подвергают взаимодействию с промежуточным продуктом формулы (III), где W1 представляет собой подходящую уходящую группу, в инертном в реакционных условиях растворителе, необязательно в присутствии подходящего основания где R1, R2 и Z имеют значения, указанные в п.1,или, если необходимо, превращают соединения формулы (I) друг в друга по известным в данной области техники превращениям и дополнительно, если необходимо, превращают соединения формулы(I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или наоборот,превращают кислотно-аддитивную соль в свободное основание обработкой основанием или превращают основно-аддитивную соль в свободную кислоту обработкой кислотой, или, если необходимо, получают их стереохимически изомерные формы или сольваты. Второй способ получения соединения формулы (I) настоящего изобретения заключается в том, что промежуточный продукт формулы (II) подвергают взаимодействию с промежуточным продуктом формулы (III), где W1 представляет собой подходящую уходящую группу, в присутствии подходящего катализатора, подходящего лиганда, подходящего основания и подходящего растворителя где R1, R2 и Z имеют значения, указанные в п.1,или, если необходимо, превращают соединения формулы (I) друг в друга по известным в данной области техники превращениям и дополнительно, если необходимо, превращают соединения формулы(I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или наоборот,превращают кислотно-аддитивную соль в свободное основание обработкой основанием или превращают основно-аддитивную соль в свободную кислоту обработкой кислотой, или, если необходимо, получают их стереохимически изомерные формы или сольваты. Третий способ получения соединения формулы (I) настоящего изобретения заключается в том, что соответствующее карбонильное соединение формулы (IV) восстанавливают в присутствии подходящего восстанавливающего агента и подходящего растворителя где R2 и Z имеют значения, указанные в п.1,или, если необходимо, превращают соединения формулы (I) друг в друга по известным в данной области техники превращениям и дополнительно, если необходимо, превращают соединения формулы(I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или наоборот,превращают кислотно-аддитивную соль в свободное основание обработкой основанием или превращают основно-аддитивную соль в свободную кислоту обработкой кислотой, или, если необходимо, получают их стереохимически изомерные формы или сольваты. Четвертый способ получения соединения формулы (I) настоящего изобретения заключается в том,что соответствующее сложноэфирное производное формулы (V), где Rx представляет собой C1-3 алкилC(=O)OC1-4 алкил, восстанавливают в присутствии подходящего восстанавливающего агента и подходящего растворителя где R2 и Z имеют значения, указанные в п.1,или, если необходимо, превращают соединения формулы (I) друг в друга по известным в данной области техники превращениям и дополнительно, если необходимо, превращают соединения формулы(I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или наоборот,превращают кислотно-аддитивную соль в свободное основание обработкой основанием или превращают основно-аддитивную соль в свободную кислоту обработкой кислотой, или, если необходимо, получают их стереохимически изомерные формы или сольваты. Пятый способ получения соединения формулы (I) настоящего изобретения заключается в том, что промежуточный продукт формулы (VI) гидролизуют подходящим основанием в присутствии подходящего растворителя где R2 и Z имеют значения, указанные в п.1,или, если необходимо, превращают соединения формулы (I) друг в друга по известным в данной области техники превращениям и дополнительно, если необходимо, превращают соединения формулы(I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или наоборот,превращают кислотно-аддитивную соль в свободное основание обработкой основанием или превращают основно-аддитивную соль в свободную кислоту обработкой кислотой, или, если необходимо, получают их стереохимически изомерные формы или сольваты. Ряд терминов, применяемых в предшествующих определениях и далее в контексте, объясняются ниже. Эти термины иногда применяют как таковые (по отдельности) или в составных терминах. С 1-4 алкил, как группа или часть группы, означает насыщенные углеводородные радикалы с неразветвленной или разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как метил, этил, пропил, 1-метилэтил, бутил; С 1-6 алкил, как группа или часть группы, означает насыщенные углеводородные радикалы с неразветвленной или разветвленной цепью, имеющие от 1 до 6 атомов углерода, такие как группы, указанные для С 1-4 алкила, и пентил, гексил, 2-метилбутил и т.п. С 2-6 алкенил означает углеводородные радикалы с неразветвленной или разветвленной цепью, содержащие двойную связь и имеющие от 2 до 6 атомов углерода, такие как, например, этенил, 2-пропенил, 3-бутенил, 2-пентенил, 3-пентенил,3-метил-2-бутенил и т.п. Линии, нарисованные от заместителей к циклическим системам, указывают, что связь может быть присоединена к любому из подходящих атомов цикла. Для терапевтического применения солями соединений формулы (I) являются соли, у которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, могут также найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, независимо от того, являются ли они фармацевтически приемлемыми или не являются, включены в объем настоящего изобретения. Имеется в виду, что фармацевтически приемлемые соли, указываемые в контексте ранее или далее,содержат формы терапевтически активных нетоксичных кислотно-аддитивных солей, которые способны образовывать соединения формулы (I). Последние можно преимущественно получать обработкой формы основания такими подходящими кислотами, как неорганические кислоты, например галогеноводородные кислоты, например хлористо-водородная кислота, бромисто-водородная кислота и т.п.; серная кислота; азотная кислота; фосфорная кислота и т.п.; или органические кислоты, например уксусная, пропановая,гидроксиуксусная, 2-гидроксипропановая, 2-оксопропановая, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, 2-гидрокси-1,2,3-пропантрикарбоновая, метансульфоновая, этансульфоновая,бензолсульфоновая,4-метилбензолсульфоновая,циклогексансульфоновая,2 гидроксибензойная, 4-амино-2-гидроксибензойная и подобные кислоты. Наоборот, форму соли можно превратить обработкой щелочью в форму свободного основания. Соединения формулы (I), содержащие кислые протоны, можно превратить в их терапевтически активные нетоксичные формы аддитивных солей металлов или аминов обработкой подходящими органическими и неорганическими основаниями. Имеется в виду, что фармацевтически приемлемые соли, указываемые в контексте ранее или далее, содержат также формы терапевтически активных нетоксичных солей металлов или аминов (формы основно-аддитивных солей), которые способны образовывать соединения формулы (I). Формы подходящих основно-аддитивных солей включают, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например первичными, вторичными и третичными алифатическими и ароматическими аминами, такие как соли метиламина, этиламина, пропиламина, изопропиламина, четырех изомеров бутиламина, диметиламина, диэтиламина, диэтаноламина, дипропиламина,диизопропиламина, ди-н-бутиламина, пирролидина, пиперидина, морфолина, триметиламина, триэтиламина, трипропиламина, хинуклидина, пиридина, хинолина и изохинолина, соли бензатина, N-метил-D-4 021883 глюкамина, 2-амино-2-(гидроксиметил)-1,3-пропандиола, гидрабамина и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Наоборот, форму соли можно превратить обработкой кислотой в форму свободной кислоты. Термин "соль" включает также четвертичные аммониевые соли (четвертичные амины), которые соединения формулы (I) способны образовывать реакцией между основным атомом азота соединения формулы (I) и подходящим кватернизующим агентом, таким как, например, необязательно замещенный С 1-6 алкилгалогенид, арилгалогенид, С 1-6 алкилкарбонилгалогенид, арилкарбонилгалогенид или арил-С 1-6 алкилгалогенид, например метилиодид или бензилиодид, у которого арил представляет собой незамещенный или замещенный фенил. Можно применять также другие реагенты с легко уходящими группами, такие как, например, С 1-6 алкилтрифторметансульфонаты, С 1-6 алкилметансульфонаты иC1-6 алкил-п-толуолсульфонаты. Четвертичный амин имеет положительно заряженный атом азота. Фармацевтически приемлемые противоионы включают в себя ионы хлора, брома, йода, трифторацетата, ацетата, трифлата, сульфата и сульфоната. Выбранный противоион можно ввести с применением ионообменной смолы. Термин "соль" предпочтительно означает формы фармацевтически приемлемых кислотноаддитивных солей и формы фармацевтически приемлемых аддитивных солей металлов или аминов. Термин "сольват" включает гидраты и формы, образованные присоединением растворителей, которые способны образовывать соединения формулы (I), а также их соли. Примерами таких форм являются,например, гидраты, алкоголяты и т.п. Должно быть понятно, что некоторые из соединений формулы (I) и их соли и сольваты могут содержать один или несколько центров хиральности и могут существовать в виде стереохимически изомерных форм. Термин "стереохимически изомерные формы соединений формулы (I)", применяемый в контексте ранее, означает все возможные соединения, состоящие из одинаковых атомов, связанных одинаковой последовательностью связей, но имеющие разные трехмерные структуры, которые не являются взаимообмениваемыми и которые могут иметь соединения формулы (I) и их фармацевтически приемлемые соли или физиологически функциональные производные. Если не указывается или не обозначается иначе, химическое название соединений означает смесь всех возможных стереохимически изомерных форм, а также каждую из индивидуальных изомерных форм соединений формулы (I) и их солей или сольватов, которая, по существу, не содержит другой изомер(ы), т.е. содержит меньше чем 50%, предпочтительно меньше чем 20%, более предпочтительно меньше чем 10%, еще более предпочтительно меньше чем 5%, еще более предпочтительно меньше чем 2% и наиболее предпочтительно меньше чем 1% другого изомера(ов). Так, например, когда соединение формулы (I) указывается как R-изомер, это означает, что соединение, по существу, не содержит Sизомер. Или, если соединение формулы (I), например, указывается как Е-изомер, это означает, что соединение, по существу, не содержит Z-изомер. В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители у двухвалентных циклических (частично) насыщенных радикалов могут иметь либо цис-, либо транс-конфигурацию. Соединения, содержащие двойные связи, могут иметь Е (заместители находятся на одной стороне относительно двойной связи)- или Z (заместители находятся на противоположных сторонах относительно двойной связи)-стереохимию у этой двойной связи. Термины "цис", "транс", "R", "S", "Е" и "Z" хорошо известны специалисту в данной области. Несомненно имеется в виду, что стереохимически изомерные формы соединений формулы I включены в объем данного изобретения. Особенно интересными являются те соединения формулы (I), которые являются стереохимически чистыми. По условиям CAS-номенклатуры, когда в молекуле присутствуют два стереогенных центра известной абсолютной конфигурации, R- или S-обозначение присваивается (на основании правила последовательности Кана-Ингольца-Прелога) хиральному центру, пронумерованному самым низким числом, центру начала отсчета. Конфигурация второго стереогенного центра указывается с применением относительных обозначений [R,R] или [R,S], где R всегда указывается как центр начала отсчета и [R,R] обозначают центры с одинаковой хиральностью и [R,S] обозначают центры с различной хиральностью. Например, если в молекуле хиральный центр, пронумерованный самым низким числом, имеет Sконфигурацию и второй центр имеет R-конфигурацию, стереообозначение должно быть указано как S[R,S]. Если применяют обозначения и , то положение заместителя с самым высоким приоритетом у асимметричного атома углерода в циклической системе, имеющего самое низкое число в цикле,всегда условно является -положением средней плоскости, определяемой циклической системой. Положение заместителя с самым высоким приоритетом у другого асимметричного атома углерода в циклической системе относительно положения заместителя с самым высоким приоритетом у атома начала отсчета обозначается , если он находится на той же стороне средней плоскости, определяемой циклической системой, или , если он находится на другой стороне средней плоскости, определяемой циклической системой. Термины "цис" и "транс" при применении в контексте соответствуют номенклатуре Chemical Abstracts (J. Org. Chem. 1970, 35 (9), 2849-2867) и относятся к положению заместителей в циклической части. Соединения формулы (I) можно синтезировать в форме рацемических смесей энантиомеров, которые можно отделить друг от друга по известным в данной области методикам разделения. Рацемические соединения формулы (I) можно превратить в соответствующие формы диастереомерных солей реакцией с подходящей хиральной кислотой. Указанные формы диастереомерных солей затем разделяют, например, селективной или фракционированной кристаллизацией, и энантиомеры выделяют из солей обработкой щелочью. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию, в которой применяют хиральную неподвижную фазу. Эти чистые стереохимически изомерные формы можно также получить из соответствующих чистых стереохимически изомерных форм подходящих исходных веществ, при условии, что реакция протекает стереоспецифическим образом. Если желательным является определенный стереоизомер, такое соединение предпочтительно следует синтезировать стереоспецифическими способами получения. В этих способах преимущественно следует применять энантиомерно чистые исходные вещества. Имеется в виду, что настоящее изобретение включает также любые изотопы атомов, присутствующих в соединениях изобретения. Например, изотопы водорода включают тритий и дейтерий и изотопы углерода включают С-13 и С-14. Имеется в виду, что применяемый ниже в контексте термин "соединения формулы (I)" или "соединения настоящего изобретения" всегда включает также фармацевтически приемлемые соли, в частности кислотно- или основно(соль металла или амина)-аддитивные соли, все стереоизомерные формы, сольваты и все полиморфные кристаллические формы или аморфные формы. При применении в контексте выше или ниже такие заместители можно всегда выбрать, каждый независимо, из перечня многочисленных определений заместителей, причем предполагается, что все возможные комбинации их являются химически стабильными. Представляющим интерес вариантом осуществления настоящего изобретения являются те соединения формулы (I), у которых заместитель R1 находится в положении 7 индольной части, т.е. соединения,имеющие следующую формулу: Представляющим интерес вариантом осуществления настоящего изобретения являются те соединения формулы (I) или (I-а), где R1 представляет собой гидрокси-С 1-6 алкил. Другим вариантом осуществления настоящего изобретения являются те соединения формулы (I) или (I-а), где R2 представляет собой С 1-4 алкил. Представляющим интерес вариантом осуществления настоящего изобретения являются те соединения формулы (I) или (I-а), где Z представляет собой радикал формулы (z-1). Представляющим интерес вариантом осуществления настоящего изобретения являются те соединения формулы (I) или (I-а), где Z представляет собой радикал формулы (z-2). Представляющим интерес вариантом осуществления настоящего изобретения являются те соединения формулы (I), (I-а), где Z представляет собой радикал формулы (z-2), у которых R4 представляет собой гидроксил и R5 представляет собой водород; или R4 представляет собой гидроксил и R5 представляет собой C1-4 алкил. Соединения указанных выше, представляющих интерес вариантов осуществления предпочтительно являются стереохимически чистыми. Представляющим интерес вариантом осуществления настоящего изобретения является энантиомер формулы имеющий левое вращение плоскости поляризованного света, измеренное при длине волны D-линии натрия (589 нм) при температуре 20 С и длине пути ячейки 1 дм в хлороформе при концентрации 8,59 мг/мл; или его фармацевтически приемлемая соль, или его сольват. Другим представляющим интерес вариантом осуществления настоящего изобретения является энантиомер формулы имеющий правое вращение плоскости поляризованного света, измеренное при длине волны Dлинии натрия (589 нм) при температуре 20 С и длине пути ячейки 1 дм в метаноле при концентрации 10,33 мг/мл; или его фармацевтически приемлемая соль, или его сольват. Предпочтительные соединения настоящего изобретения выбраны из группы, состоящей из включая любую их стереохимически изомерную форму; их фармацевтически приемлемую соль или их сольват.( означает относительную стереохимию). Предпочтительные соединения настоящего изобретения выбраны из группы, состоящей из включая любую их стереохимически изомерную форму; их фармацевтически приемлемую соль или их сольват. Предпочтительным соединением настоящего изобретения является соединение, имеющее следующую формулу: или его фармацевтически приемлемая соль, или его сольват. Предпочтительным соединением настоящего изобретения является соединение, имеющее следующую формулу: включая любую его стереохимически изомерную форму; его фармацевтически приемлемая соль или его сольват. Соединения формулы (I), их фармацевтически приемлемые соли и их стереохимически изомерные формы можно получить способами настоящего изобретения, раскрытыми выше. Исходные вещества и некоторые из промежуточных продуктов являются известными соединениями и коммерчески доступными или их можно получить согласно общепринятым методикам реакций, обычно известным в данной области. Ссылкой в этом отношении являются также способы синтеза, описанные в WO 2006/032631. Способы получения соединений настоящего изобретения будут описаны ниже в контексте более подробно. Другие способы получения конечных соединений формулы (I) описаны в примерах. В общем, соединения формулы (I) можно получить реакцией промежуточного продукта формулы(II) с промежуточным продуктом формулы (III), где W1 представляет собой подходящую уходящую группу, такую как, например, галоген, например фтор, хлор, бром или йод, или сульфонилоксигруппа,такая как метилсульфонилокси, 4-метилфенилсульфонилокси и т.п. Реакцию можно проводить в инертном в реакционных условиях растворителе, таком как, например, спирт, например метанол, этанол, 2 метоксиэтанол, пропанол, бутанол и т.п.; простой эфир, например 1,4-диоксан, предпочтительно в присутствии подходящей кислоты, такой как, например, HCl, 1,1'-оксибиспропан и т.п.; кетон, например, 4 метил-2-пентанон; или N,N-диметилформамид, нитробензол, ацетонитрил и т.п. Добавление подходящего основания, такого как, например, карбонат или гидрокарбонат щелочного или щелочно-земельного металла или органическое основание, например N,N-диизопропилэтиламин, триэтиламин, карбонат натрия или карбонат калия, можно применять для связывания кислоты, которая выделяется во время реакции. Небольшое количество подходящего иодида металла, например иодида натрия или калия, можно добавлять для промотирования реакции. Перемешивание может повысить скорость реакции. Реакцию преимущественно проводят при температуре между комнатной температурой и температурой флегмы реакционной смеси и, при необходимости, реакцию можно проводить при повышенном давлении. В указанной выше реакции промежуточные продукты формулы (II), где R1 представляет собой-С(ОН)(СН 3)2, могут дать в результате соответствующее конечное соединение формулы (I), где R1 представляет собой -С(СН 3)=СН 2. Указанную выше реакцию промежуточного продукта формулы (III) с промежуточным продуктом формулы (II) можно также проводить в присутствии подходящего катализатора, такого как, например, Pd(dba)2-бис-[(1,2,4,5-)-1,5-дифенил-1,4-пентадиен-3-он]палладий, подходящего лиганда, такого как, например, BINAP (2,2'-бис-(дифенилфосфино)-1,1'-бинафтил), подходящего основания, такого как, например, третичный бутоксид натрия, и подходящего растворителя, такого как, например, толуол. Соединения формулы (I), где R1 представляет собой гидрокси-С 1-4 алкил, причем указанные соединения представлены формулой (I-1), можно также получить восстановлением соответствующего карбонилпроизводного формулы (IV) в присутствии подходящего восстанавливающего агента, такого как, например, NaBH4, и подходящего растворителя, такого как, например, спирт, например метанол и т.п. Соединения формулы (I-1) можно также получить восстановлением соответствующего сложноэфирного производного формулы (V), где Rx представляет собой -С 1-3 алкил-С(=O)ОС 1-4 алкил, в присутствии подходящего восстанавливающего агента, такого как, например, LiAlH4, и подходящего растворителя, такого как, например, тетрагидрофуран. Соединения формулы (I-1), где R1 представляет собой гидрокси-С 1-4 алкил и указанный гидрокси-С 14 алкил находится в положении 7 индольной части, причем указанные соединения представлены формулой (I-1-a), можно также получить гидролизом промежуточного продукта формулы (VI) подходящим основанием, таким как, например, гидроксид натрия, в присутствии подходящего растворителя, такого как, например, тетрагидрофуран или спирт, например этанол и т.п. Соединения формулы (I) можно также превратить друг в друга посредством реакций, известных в данной области техники, или превращениями функциональных групп. Соединения формулы (I) можно также превратить в фармацевтически приемлемую кислотноаддитивную соль реакцией с подходящей кислотой, такой как, например, хлористо-водородная кислота,в подходящем растворителе, таком как, например, спирт, например 2-пропанол, диэтиловый простой эфир, диизопропиловый простой эфир. Некоторые из промежуточных продуктов и исходных веществ являются известными соединениями и могут быть коммерчески доступными или их можно получить согласно известным в данной области методикам. В общем, промежуточные продукты формулы (II) можно получить гидрированием промежуточного продукта формулы (VII) в присутствии подходящего металлического катализатора, такого как, например,никель Ренея, в присутствии подходящего растворителя, такого как, например, спирт, например метанол или этанол и т.п.; или платина на угле, в присутствии подходящего каталитического яда, такого как раствор тиофена и пентаоксид ванадия, в присутствии подходящего растворителя, такого как, например,тетрагидрофуран. Промежуточные продукты формулы (VII) можно получить реакцией промежуточного продукта формулы (VIII) с промежуточным продуктом формулы (IX), где W2 представляет собой подходящую уходящую группу, такую как, например, атом галогена, например хлора, брома, фтора и т.д., в присутствии подходящего растворителя, такого как, например, N,N-диметилсульфоксид. Добавление подходящего основания, такого как, например, карбонат или гидрокарбонат щелочного или щелочно-земельного металла или органическое основание, например N,N-диизопропилэтиламин, триэтиламин, карбонат натрия, гидрокарбонат натрия или карбонат калия, можно применять для связывания кислоты, которая выделяется во время реакции. Промежуточные продукты формулы (VIII) можно получить из соответствующего промежуточного продукта формулы (X) в присутствии никеля Ренея и NH3 и в присутствии подходящего растворителя,такого как, например, спирт, например метанол и т.п. Промежуточные продукты формулы (X), где R1 представляет собой гидрокси-С 1-4 алкил, например,-СН(ОН)(СН 3), причем указанные промежуточные продукты представлены формулой (Х-а), можно также получить из промежуточного продукта формулы (XI) реакцией с CH3MgCl в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. Такую же реакцию можно применять для получения соединений с другими группами гидрокси-С 1 Например, промежуточные продукты, где R1 представляет собой С(ОН)(СН 3)2, можно получить из соответствующего промежуточного продукта с -C(=О)-СН 3. Промежуточные продукты формулы (XI) можно получить реакцией промежуточного продукта формулы (XII) с цианидом натрия в присутствии подходящего растворителя, такого как, например, N,Nдиметилформамид. Альтернативно, промежуточные продукты формулы (XI) можно также получить окислением соответствующего гидроксианалога в присутствии периодинана Десса-Мартина и подходящего растворителя,такого как, например, дихлорметан. Промежуточные продукты формулы (XII) можно получить реакцией промежуточного продукта формулы (XIII) с CH3I в присутствии подходящего растворителя, такого как спирт, например этанол. Промежуточные продукты формулы (XIII) можно получить реакцией промежуточного продукта формулы (XIV) с солью Эшенмозера в присутствии уксусной кислоты. Промежуточные продукты формулы (XIV) можно получить окислением соответствующего гидроксильного аналога в присутствии подходящего окисляющего агента, такого как, например, MnO2, в присутствии подходящего растворителя, такого как, например, дихлорметан. Промежуточные продукты формулы (III), где Z представляет собой радикал формулы (z-2) и R4 представляет собой гидроксил, причем указанные промежуточные продукты представлены формулой(III-а), можно получить восстановлением промежуточного продукта формулы (III-b) подходящим восстанавливающим агентом, таким как, например, NaBH4, в присутствии подходящего растворителя, такого как, например, спирт, например метанол. Промежуточные продукты формулы (III-а) можно превратить в промежуточные продукты формулы(III-с) реакцией с C1-4 алкилиодидом в присутствии подходящего основания, такого как гидрид натрия, и подходящего растворителя, такого как, например, тетрагидрофуран. Промежуточные продукты формулы(III-b) можно получить окислением промежуточного продукта формулы (III-а) реакцией с подходящим окисляющим агентом, таким как, например, MnO2, в присутствии подходящего растворителя, такого как,например, дихлорметан. Промежуточные продукты формулы (III-b) можно превратить в промежуточный продукт формулы (III-d) реакцией с С 1-4 алкил-MgCl в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. Промежуточные продукты формулы (III-а) можно также получить перемешиванием промежуточного продукта формулы (XV) в смеси метанол/NH3. При желании, промежуточный продукт формулы (III-а) можно превратить в промежуточный продукт формулы (XV) перемешиванием в смеси уксусного ангидрида и пиридина.S-энантиомер промежуточного продукта (III-а), называемый в контексте промежуточным продуктом формулы (III-а-1), и R-энантиомер промежуточного продукта (XV), называемый в контексте промежуточным продуктом формулы (XV-b), можно получить добавлением липазы Candida Antartica В к рацемической смеси промежуточного продукта формулы (III-а) в подходящем растворителе, таком как этениловый эфир уксусной кислоты (см. схему 1). При желании, промежуточный продукт формулы (XV-b) можно превратить в R-энантиомер промежуточного продукта (III-а), называемый в контексте промежуточным продуктом формулы (III-а-2), реакцией в смеси MeOH/NH3. Данный способ позволяет превратить один из энантиомеров исходной рацемической смеси в его ацетат с ее (энантиомерный избыток) 99% и выходом 58% и второй изомер выделить с ее 99% и выходом 42%. Термин "энантиомерный избыток (ее)" хорошо известен специалисту в области стереохимии. Для смеси (+)- и (-)-энантиомеров с составом, указанным как молярные или массовые части F(+) и F(-) (гдеF(+)+F(-)=1), энантиомерный избыток для F устанавливают как F(+)-F(-) и процентный энантиомерный избыток как 100[F(+)-F(-)]. Схема 1 Альтернативно, R-энантиомер промежуточного продукта (III-а), называемый в контексте промежуточным продуктом формулы (III-а-2), и S-энантиомер промежуточного продукта (XV), называемый в контексте промежуточным продуктом формулы (XV-a), можно получить добавлением липазы CandidaAntartica В к рацемической смеси промежуточного продукта формулы (XV) в воде (см. схему 2). При желании, промежуточный продукт формулы (XV-а) можно превратить в промежуточный продукт (III-а 1) реакцией в смеси MeOH/NH3. Схема 2 Альтернативно, промежуточный продукт формулы (III-а) можно также разделить на его энантиомеры хиральной колоночной хроматографией. Промежуточные продукты формулы (XV) можно получить перемешиванием промежуточного продукта формулы (XVI) в уксусном ангидриде. Промежуточный продукт формулы (XVI), у которого W1 представляет собой хлор, называемый в контексте промежуточным продуктом формулы (XVI-a), можно получить добавлением хлорида бензилтриэтиламмония и хлорида натрия к раствору промежуточного продукта формулы (XVII) в ацетонитриле с последующим добавлением концентрированной хлористо-водородной кислоты. Промежуточные продукты формулы (XVII) можно получить добавлением дымящей азотной кислоты к серной кислоте с последующим добавлением порциями 1-оксида 6,7-дигидро-5 Нциклопента[b]пиридина. Промежуточные продукты формулы (IV) можно получить согласно указанным выше протоколам реакций для получения промежуточных продуктов формулы (II). Промежуточные продукты формулы (V) можно получить удалением защиты у промежуточного продукта формулы (XVIII), у которого Р представляет собой подходящую защитную группу, такую как,например, -C(=O)-O-C(СН 3)3, в присутствии подходящей кислоты, такой как, например, хлористоводородная кислота, и подходящего растворителя, такого как, например, ацетонитрил. Промежуточные продукты формулы (XVIII) можно получить реакцией промежуточного продукта формулы (XIX) с промежуточным продуктом формулы (III) в присутствии инертного в условиях реакции растворителя, такого как, например, спирт, например метанол, этанол, 2-метоксиэтанол, пропанол, изопропанол, бутанол и т.п.; простой эфир, например 1,4-диоксан, предпочтительно в присутствии подходящей кислоты, такой как, например, HCl, 1,1'-оксибиспропан и т.п.; кетон, например 4-метил-2 пентанон; или N,N-диметилформамид, нитробензол, ацетонитрил и т.п. Добавление подходящего основания, такого как, например, карбонат или гидрокарбонат щелочного или щелочно-земельного металла или органическое основание, например N,N-диизопропилэтиламин, триэтиламин, карбонат натрия или карбонат калия, можно применять для связывания кислоты, которая выделяется во время реакции. Небольшое количество подходящего иодида металла, например иодида натрия или калия, можно добавлять для промотирования реакции. Перемешивание может повысить скорость реакции. Реакцию можно преимущественно проводить при температуре между комнатной температурой и температурой флегмы и,если необходимо, реакцию можно проводить при повышенном давлении. Промежуточные продукты формулы (XIX) можно получить согласно протоколам реакций, описанным выше для промежуточных продуктов формулы (II). Промежуточные продукты формулы (VI) можно получить реакцией промежуточного продукта формулы (XX), в которой Р представляет собой подходящую уходящую группу, которая имеет значения,указанные выше, и Ry представляет собой -С 1-4 алкил-О-Si(СН 3)2-C(СН 3)3, в присутствии подходящей кислоты, такой как, например, трифторуксусная кислота, и подходящего растворителя, такого как, например, дихлорметан. Промежуточные продукты формулы (XX) можно получить реакцией промежуточного продукта формулы (XXI) с промежуточным продуктом формулы (III) в присутствии инертного в реакционных условиях растворителя, такого как, например, спирт, например метанол, этанол, 2-метоксиэтанол, пропанол, изопропанол и т.п.; простой эфир, например 1,4-диоксан, предпочтительно в присутствии подходящей кислоты, такой как, например, HCl, 1,1'-оксибиспропан и т.п.; кетон, например 4-метил-2-пентанон; или N,N-диметилформамид, нитробензол, ацетонитрил и т.п. Добавление подходящего основания, такого как, например, карбонат или гидрокарбонат щелочного или щелочно-земельного металла или органиче- 17021883 ское основание, например N,N-диизопропилэтиламин, триэтиламин, карбонат натрия или карбонат калия, можно применять для связывания кислоты, которая выделяется во время реакции. Небольшое количество подходящего иодида металла, например иодида натрия или калия, можно добавлять для промотирования реакции. Перемешивание может повысить скорость реакции. Реакцию можно преимущественно проводить при температуре между комнатной температурой и температурой флегмы и, если необходимо,реакцию можно проводить при повышенном давлении. Промежуточные продукты формулы (XXI) можно получить из соответствующего нитропромежуточного продукта формулы (XXII) гидрированием в присутствии подходящего катализатора, такого как,например, никель Ренея, и подходящего растворителя, такого как, например, спирт, например метанол и т.п. Промежуточные продукты формулы (XXII), где Р представляет собой -C(=O)-С 1-4 алкил, причем эти промежуточные продукты представлены формулой (XXII-a), можно получить реакцией промежуточного продукта формулы (XXIII) с ди-трет-бутилдикарбонатом в присутствии подходящего основания, такого как, например, триэтиламин, и подходящего растворителя, такого как, например, 4(диметил)аминопиридин. Промежуточные продукты формулы (XIII) можно получить реакцией промежуточного продукта формулы (XXIV) с промежуточным продуктом формулы (IX) в присутствии подходящего основания,такого как, например, бикарбонат натрия, и подходящего растворителя, такого как, например, N,Nдиметилсульфоксид. Промежуточные продукты формулы (XXIV) можно получить реакцией промежуточного продукта формулы (XXV) с NH3 в присутствии подходящего катализатора, такого как, например, никель Ренея, и в присутствии подходящего растворителя, такого как, например, спирт, например метанол и т.п. Промежуточные продукты формулы (XXV) можно получить реакцией промежуточного продукта формулы (XXVI) с трет-бутилдиметилсилилхлоридом в присутствии подходящего основания, такого как,например, имидазол, и подходящего растворителя, такого как, например, тетрагидрофуран. Промежуточные продукты формулы (XXVI) можно получить, как описано выше для промежуточных продуктов формулы (XI). Соединения формулы (I) и некоторые из промежуточных продуктов в настоящем изобретении могут содержать асимметричный атом углерода. Чистые стереохимически изомерные формы этих соединений и этих промежуточных продуктов можно получить посредством применения известных в данной области техники методик. Например, диастереоизомеры можно разделить физическими способами, такими как селективная кристаллизация или хроматографические методики, например, распределение в противоточном потоке, жидкостная хроматография и подобные способы. Энантиомеры можно получить из рацемических смесей сначала превращением указанных рацемических смесей при помощи подходящих разделяющих агентов, таких как, например, хиральные кислоты, в смеси диастереомерных солей или соединений; затем физическим разделением этих смесей диастереомерных солей или соединений,например, селективной кристаллизацией, суперкритической жидкостной хроматографией или хроматографическими способами, например, жидкостной хроматографией, и подобными способами, и, наконец,превращением этих разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Стереохимически чистые изомерные формы можно также получить из стереохимически чистых изомерных форм подходящих промежуточных продуктов и исходных веществ, при условии, что реакции превращения проходят стереоспецифическим образом. Соединения формулы (I), в том числе их стереохимически изомерные формы, их фармацевтически приемлемые соли или их сольваты, обладают ценными фармакологическими свойствами, проявляющимися в том, что они повышают экспрессию р 53, проявляют сильную антипролиферативную активность,проявляют сильную противоопухолевую активность. Как указано выше, соединения изобретения повышают экспрессию р 53 при проведении анализа,описанного в разделе С.1. Это повышение может быть вызвано, но не ограничивается ими, одним или несколькими следующими механизмами действия: взаимодействие с предшествующими или последующими мишенями, например, киназами или ферментами, активности которых принимают участие в убиквитинации или SUMO-модификации,непосредственная или опосредованная стабилизация белка р 53, например, сохранением этого белка в его функциональной структурной форме или предотвращением ошибочного фолдинга (ошибочной укладки); увеличение экспрессии р 53 или экспрессии членов семейства р 53, например р 63 и р 73; повышение активности р 53, например (но без ограничения этим), повышением его транскрипционной активности, и/или повышение экспрессии генов и белков пути передачи сигналов р 53, например (но без ограничения указанным), р 21 wafl, cip1, MIC-1 (GDF-15), PIG-3, Bax, Puma, Noxa и ATF-3. Следовательно, в настоящем изобретении описываются соединения формулы (I) для применения в качестве лекарственных средств, в частности для лечения рака или родственных заболеваний, для ингибирования роста опухолей, для повышения экспрессии р 53. Кроме того, изобретение относится также к применению соединения для изготовления лекарственного средства для лечения нарушения, опосредуемого посредством пониженной экспрессии р 53, в частности, для лечения рака, где упомянутым соединением является соединение формулы (I). Термин "лечение", применяемый в контексте, относится к любому лечению заболевания и/или состояния у животного, особенно человека, и включает в себя (i) предотвращение появления заболевания и/или состояния у субъекта, который может быть предрасположен к такому заболеванию или состоянию,но у которого оно еще не диагностировано; (ii) подавление заболевания и/или состояния, т.е. задержка его развития; (iii) ослабление заболевания и/или состояния, т.е. индуцирование регресса заболевания и/или состояния. Термин "нарушение, опосредуемое посредством пониженной экспрессии р 53" означает любое нежелательное или пагубное состояние, которое можно ингибировать, развитие которого можно задерживать, которое можно ослабить или регресс которого можно вызвать апоптозом, индуцированием гибели клеток или регуляцией клеточного цикла. В настоящем описании раскрывается также способ лечения нарушения, опосредуемого пониженной экспрессией р 53, в частности лечение рака, введением эффективного количества соединения настоящего изобретения субъекту, например, млекопитающему (и более конкретно человеку), нуждающемуся в таком лечении. Соединения изобретения могут обладать антипролиферативными действиями в клетках опухолей,даже если такие клетки лишены функционального белка р 53. Более конкретно, соединения изобретения могут обладать антипролиферативными действиями в опухолях с р 53 дикого типа или мутантным р 53 и/или опухолях, сверхэкспрессирующих MDM2. Соединения могут воздействовать на ангиогенез, миграцию, инвазию и метастаз опухолевых клеток. Таким образом, в данном описании раскрывается ингибирование роста опухолей соединением настоящего изобретения. Примеры опухолей, включающих злокачественные новообразования взрослых людей и детей, которые могут ингибировать соединения настоящего изобретения, включают, но не ограничиваются перечисленным, рак легких, включающий мелкоклеточный рак легких и немелколеточный рак легких (например, аденокарциному), раковые заболевания поджелудочной железы, раковые заболевания толстой кишки (например, колоректальные карциномы, такие как, например, аденокарцинома толстой кишки и аденома толстой кишки), эзофагеальный рак, плоскоклеточный рак полости рта, карциному языка, карциному желудка, рак печени, ринофарингеальный рак, опухоли кроветворных лимфоидных тканей (например, острый лимфобластный лейкоз, В-клеточную лимфому, лимфому Беркитта), неходжкинскую лимфому (например, лимфому клеток головного мозга), лимфому Ходжкина, миелоидные лейкозы (например, острый миелоидный лейкоз (AML) или хронический миелоидный лейкоз (CML, острый лимфобластный лейкоз, хронический лимфобластный лейкоз (CLL), рак фолликул щитовидной железы, синдром миелодисплазии (MDS), опухоли мезенхимального происхождения, саркомы мягких тканей, липосаркомы, саркомы желудочно-кишечной стромы, злокачественные опухоли оболочки периферических нервов (MPNST), саркомы Юинга, лейомиосаркомы, мезенхимальные хондросаркомы, лимфосаркомы,фибросаркомы, рабдомиосаркомы, меланомы, тератокарциномы, нейробластомы, опухоли головного мозга, медуллобластому, глиомы, доброкачественную опухоль кожи (например, кератоакантому), рак молочной железы (например, запущенный рак молочной железы), карциному почек, нефробластому,карциному яичников, цервикальную карциному, рак эндометрия, карциному мочевого пузыря, рак простаты, включающий запущенное заболевание и гормонрезистентный рак простаты, тестикулярные раковые заболевания, остеосаркому, рак головы и шеи, эпидермальную саркому, множественную миелому(например, резистентную множественную миелому), мезотелиому. Конкретными раковыми заболеваниями, которые можно лечить соединениями настоящего изобретения, являются рак молочной железы,колоректальный рак, немелкоклеточный рак легких, острый миелоидный лейкоз (AML). Ввиду полезных фармакологических свойств соединений объектов данного изобретения, их можно изготовить в составе различных фармацевтических форм для целей введения. Для изготовления фармацевтических композиций данного изобретения эффективное количество соединения настоящего изобретения в качестве активного ингредиента объединяют для образования однородной смеси с фармацевтически приемлемым носителем, который может иметь различные формы в зависимости от формы препарата, требуемого для введения. Эти фармацевтические композиции желательны в виде единичной дозированной формы, подходящей предпочтительно для введения перорально, ректально, подкожно или парентеральной инъекцией. Например, при изготовлении композиций в пероральной дозированной форме можно применять любую из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы, или твердые носители, такие как крахмалы, сахара, каолин, лубриканты, связывающие вещества, дезинтегрирующие агенты и т.п., в случае порошков, пилюль, капсул и таблеток. Вследствие легкости их введения, таблетки и капсулы представляют собой наиболее подходящую пероральную единичную дозированную форму, в этом случае, несомненно, применяют твердые фармацевтические носители. Для парентеральных композиций носитель обычно содержит стерильную воду, по меньшей мере, в качестве его большей части, хотя могут быть включены другие ингредиенты, например,для способствования растворимости компонентов. Например, можно изготовить инъецируемые растворы, в которых носитель содержит солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Можно также изготовить инъецируемые суспензии, в этом случае можно применять подходящие жидкие носители, суспендирующие агенты и т.п. В композициях, подходящих для подкожного введения, носитель необязательно содержит агент, повышающий проникновение, и/или подходящий смачивающий агент, необязательно в сочетании с подходящими добавками любой природы в небольших количествах, причем добавки не оказывают значительное вредное воздействие на кожу. Указанные добавки могут облегчить введение в кожу и/или могут быть полезными при изготовлении требуемых композиций. Эти композиции можно вводить различными путями, например, в виде чрескожного пластыря,посредством нанесения пятен, в виде мази. Особенно подходящим является изготовление вышеуказанных фармацевтических композиций в виде единичной дозированной формы вследствие легкости введения и однородности дозы. Единичная дозированная форма, описываемая для применения в контексте описания и формулы изобретения, относится к физически дискретным единицам, подходящим в качестве унифицированных доз, причем каждая единица содержит предварительно определенное количество активного ингредиента, вычисленное для обеспечения требуемого терапевтического действия, в сочетании с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (в том числе таблетки с насечками и таблетки, покрытые оболочками), капсулы, пилюли, пакетики с порошком, облатки, инъецируемые растворы или суспензии, полные чайные ложки, полные столовые ложки и т.п., и их сегрегированные многократные дозы. Особенно благоприятным является изготовление вышеуказанных фармацевтических композиций в виде единичной дозированной формы вследствие легкости введения и однородности дозы. Единичная дозированная форма, описываемая в контексте описания и формулы изобретения, относится к физически дискретным единицам, подходящим в качестве унифицированных доз, причем каждая единица содержит предварительно определенное количество активного ингредиента, вычисленное для обеспечения требуемого терапевтического действия, в сочетании с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (в том числе таблетки с насечками и таблетки,покрытые оболочками), капсулы, пилюли, пакетики с порошком, облатки, инъецируемые растворы или суспензии, полные чайные ложки, полные столовые ложки и т.п., и их сегрегированные многократные дозы. Соединения изобретения вводят в количестве, достаточном для индуцирования апоптоза, индуцирования гибели клеток или регуляции клеточного цикла. Таким образом, соединения изобретения вводят в количестве, достаточном для увеличения экспрессии р 53 или проявления противоопухолевой активности. Специалист в данной области может легко определить эффективное количество на основании результатов испытания, представленных далее в контексте. В общем, предполагается, что терапевтически эффективное количество может быть от 0,005 до 100 мг/кг массы тела и конкретно от 0,005 до 10 мг/кг массы тела. Для введения требуемой дозы может быть подходящим введение одной, двух, трех, четырех или более поддоз через подходящие интервалы времени на протяжении дня. Указанные поддозы можно изготовить в виде единичных дозированных форм, например, содержащих от 0,5 до 500 мг, конкретно от 1 до 500 мг, более конкретно от 10 до 500 мг активного ингредиента на единичную дозированную форму. В зависимости от способа введения., фармацевтическая композиция предпочтительно может содержать от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.%, еще более предпочтительно от 0,1 до 50 мас.% соединения настоящего изобретения и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,9 мас.%, еще более предпочтительно от 50 до 99,9 мас.% фармацевтически приемлемого носителя,причем все проценты вычислены в расчете на общую массу композиции. В качестве другого аспекта настоящего изобретения предложена комбинация соединения настоящего изобретения с другим противораковым агентом, особенно для применения в качестве лекарственного средства, более конкретно, при лечении рака или родственных заболеваний. Для лечения указанных выше состояний соединения изобретения можно преимущественно применять в комбинации с одним или несколькими другими лекарственными средствами, более конкретно с другими противораковыми агентами или адъювантами при терапии рака. Примеры противораковых агентов или адъювантов (агентов, усиливающих действие лекарственных средств в терапии) включают, но не ограничиваются перечисленным: Как указано выше, соединения настоящего изобретения имеют также терапевтические применения для сенсибилизации опухолевых клеток во время радиотерапии и химиотерапии. Поэтому соединения настоящего изобретения можно применять в качестве "радиосенсибилизирующего вещества" и/или "химиосенсибилизирующего вещества" или можно вводить в комбинации с другим "радиосенсибилизирующим веществом" и/или "химиосенсибилизирующим веществом". Применяемый в контексте термин "радиосенсибилизирующее вещество" означает молекулу, предпочтительно молекулу с низкой молекулярной массой, вводимую животным в терапевтически эффективных количествах для повышения чувствительности клеток к ионизирующему излучению и/или для стимуляции лечения заболеваний, которые поддаются излечению ионизирующим излучением. Применяемый в контексте термин "химиосенсибилизирующее вещество" означает молекулу, предпочтительно молекулу с низкой молекулярной массой, вводимую животным в терапевтически эффективных количествах для повышения чувствительности клеток к химиотерапии и/или стимуляции лечения заболеваний, которые поддаются излечению химиотерапией. В литературе предложено несколько механизмов способа действия радиосенсибилизирующих веществ, включающих механизмы, при которых радиосенсибилизирующие гипоксические клетки вещества(например, производные 2-нитроимидазола и производные диоксида бензотриазина) имитируют кислород или действуют альтернативно, подобно биоредуктивным агентам при гипоксии; радиосенсибилизирующие негипоксические клетки вещества (например, галогенированные пиримидины) могут быть аналогами оснований ДНК и предпочтительно включаются в ДНК раковых клеток и тем самым стимулируют индуцированное радиацией разрушение молекул ДНК и/или препятствуют действию механизмов репарации нормальной ДНК; выдвинуты также гипотезы различных других потенциальных механизмов действия радиосенсибилизирующих веществ при лечении заболевания. Во многих протоколах лечения рака в настоящее время применяют радиосенсибилизирующие вещества в сочетании с рентгеновским излучением. Примеры активирующих рентгеновское излучение радиосенсибилизирующих веществ включают, но не ограничиваются перечисленным, следующие вещества: метронидазол, мизонидазол, десметилмизонидазол, пимонидазол, этанидазол, ниморазол, митомицин С, RSU 1069, SR 4233, ЕО 9, RB 6145, никотинамид, 5-бромдеоксиуридин (BUdR), 5-иоддеоксиуридин(IUdR), бромдеоксицитидин, фтордеоксиуридин (FudR), гидроксимочевину, цисплатин и их терапевтически активные аналоги и производные. При фотодинамической терапии (PDT) раковых заболеваний применяют видимый свет в качестве активатора радиации сенсибилизирующего агента. Примеры фотодинамических радиосенсибилизирующих веществ включают, но не ограничиваются указанными веществами, производные гематопорфирина,фотофрин, производные бензопорфирина, этиопорфирин олова, феоборбид-а, бактериохлорофилл-а,нафталоцианины, фталоцианины, фталоцианины цинка и их терапевтически эффективные аналоги и производные. Радиосенсибилизирующие вещества можно вводить в сочетании с терапевтически эффективным количеством одного или нескольких соединений, включающих, но не ограничивающихся перечисленным, соединения, которые стимулируют включение радиосенсибилизирующих веществ в клеткимишени; соединения, которые регулируют поток терапевтических средств, питательных веществ и/или кислорода в клетки-мишени; химиотерапевтические агенты, которые воздействуют на опухоль вместе с дополнительной радиацией или без нее, или другие терапевтически эффективные соединения для лечения рака или другого заболевания. Химиосенсибилизирующие вещества можно вводить в сочетании с терапевтически эффективным количеством одного или нескольких других соединений, включающих, но не ограничивающихся перечисленным, соединения, которые стимулируют включение химиосенсибилизирующих веществ в клеткимишени; соединения, которые регулируют поток терапевтических средств, питательных веществ и/или кислорода в клетки-мишени; химиотерапевтические агенты, которые воздействуют на опухоль, или другие терапевтически эффективные соединения для лечения рака или другого заболевания. Обнаружено,что антагонисты кальция, например, верапамин, являются применимыми в комбинации с противоопухолевыми агентами для создания чувствительности к химиотерапии в опухолевых клетках, устойчивых к переносимым химиотерапевтическим агентам, и для повышения эффективности таких соединений в чувствительных к лекарственным средствам злокачественных образованиях. Ввиду их полезных фармакологических свойств, компоненты комбинаций согласно изобретению,т.е. одно или несколько других противораковых средств и соединение согласно настоящему изобретению можно изготовлять в составе различных фармацевтических форм для целей введения. Компоненты можно изготовлять раздельно в отдельных фармацевтических композициях или в одной фармацевтической композиции, содержащей все компоненты. Одно или несколько других противораковых средств и соединение согласно настоящему изобрете- 24021883 нию можно вводить одновременно (например, в разных композициях или в одной композиции) или последовательно в любом порядке. В последнем случае два или более соединений можно вводить в пределах периода времени и в количестве и способом, которые достаточны для гарантирования того, что достигается полезное или синергическое действие. Должно быть понятно, что предпочтительный способ и порядок введения и соответствующие дозированные количества и схемы приема для каждого компонента комбинации будет зависеть от вводимого конкретного другого лекарственного средства и соединения настоящего изобретения, пути их введения, конкретной подвергаемой лечению опухоли и конкретного хозяина, подвергаемого лечению. Оптимальный способ и порядок введения и дозированные количества и схему приема может легко определить специалист в данной области с применением общепринятых способов и с учетом информации, приведенной в контексте. Массовое отношение соединения согласно настоящему изобретению и одного или нескольких других противораковых агентов при приеме их в комбинации может определить специалист в данной области. Указанное отношение и точная доза и частота введения зависят от конкретного соединения согласно изобретению и другого применяемого противоракового агента(ов), конкретного, подвергаемого лечению состояния, тяжести подвергаемого лечению состояния, возраста, массы, пола, питания, времени введения и общего физического состояния конкретного пациента, способа введения, а также другой лекарственной терапии, которую может принимать индивидуум, что хорошо известно специалисту в данной области. Кроме того, очевидно, что эффективное суточное количество можно уменьшить или увеличить в зависимости от реакции подвергаемого лечению субъекта и/или в зависимости от оценки лечащего врача, прописывающего соединения настоящего изобретения. Конкретное массовое отношение настоящего соединения формулы (I) и другого противоракового агента может составлять от 1/10 до 10/1, более конкретно от 1/5 до 5/1, еще более конкретно от 1/3 до 3/1. Координационное соединение платины преимущественно вводят при дозе 1-500 мг на квадратный метр (мг/м 2) площади поверхности тела, например 50-400 мг/м 2, конкретно для цисплатина доза составляет приблизительно 75 мг/м 2 и для карбоплатина приблизительно 300 мг/м 2 на курс лечения. Таксановое соединение преимущественно вводят при дозе 50-400 мг/м 2 площади поверхности тела,например 75-250 мг/м 2, конкретно паклитаксел вводят при дозе приблизительно 175-250 мг/м 2 и доцетаксел вводят при дозе приблизительно 75-150 мг/м 2 на курс лечения. Камптотециновое соединение преимущественно вводят при дозе 0,1-400 мг/м 2 площади поверхности тела, например 1-300 мг/м 2, конкретно иринотекан вводят при дозе приблизительно 100-350 мг/м 2 и топотекан вводят при дозе приблизительно 1-2 мг/м 2 на курс лечения. Противоопухолевое производное подофиллотоксина преимущественно вводят при дозе 30-300 мг/м 2 площади поверхности тела, например 50-250 мг/м 2, конкретно этопозид вводят при дозе приблизительно 35-100 мг/м 2 и тенипозид вводят при дозе приблизительно 50-250 мг/м 2 на курс лечения. Противоопухолевый винкаалкалоид преимущественно вводят при дозе 2-30 мг/м 2 площади поверхности тела, конкретно винбластин вводят при дозе приблизительно 3-12 мг/м 2, винкристин вводят при дозе приблизительно 1-2 мг/м 2 и винорелбин вводят при дозе приблизительно 10-30 мг/м 2 на курс лечения. Противоопухолевое производное нуклеозида преимущественно вводят при дозе 200-2500 мг/м 2 площади поверхности тела, например 700-1500 мг/м 2, конкретно для 5-FU доза составляет 200-500 мг/м 2,для гемцитабина доза приблизительно составляет 800-1200 мг/м 2 и для капецитабина доза составляет приблизительно 1000-2500 мг/м 2 на курс лечения. Алкилирующие агенты, такие как азотистый аналог горчичного газа или нитрозомочевина, преимущественно вводят при дозе 100-500 мг/м 2 площади поверхности тела, например 120-200 мг/м 2, конкретно циклофосфамид вводят при дозе приблизительно 100-500 мг/м 2, хлорамбуцил вводят при дозе приблизительно 0,1-0,2 мг/м 2, кармустин вводят при дозе приблизительно 150-200 мг/м 2 и ломустин вводят при дозе приблизительно 100-150 мг/м 2 на курс лечения. Противоопухолевое производное антрациклина преимущественно вводят при дозе 10-75 мг/м 2 площади поверхности тела, например 15-60 мг/м 2, конкретно для доксорубицина доза составляет приблизительно 40-75 мг/м 2, для даунорубицина доза составляет приблизительно 25-45 мг/м 2 и для идарубицина доза составляет приблизительно 10-15 мг/м 2 на курс лечения. Антиэстрогенный агент преимущественно вводят при дозе приблизительно 1-100 мг ежедневно в зависимости от конкретного агента и подвергаемого лечению состояния. Тамоксифен преимущественно вводят перорально при дозе 5-50 мг, предпочтительно 10-20 мг дважды в день с продолжением терапии в течение периода времени, достаточного для достижения и поддержания терапевтического действия. Торемифен преимущественно вводят перорально при дозе приблизительно 60 мг один раз в день с продолжением терапии в течение периода времени, достаточного для достижения и поддержания терапевтического действия. Анастрозол преимущественно вводят перорально при дозе приблизительно 1 мг один раз в день. Дролоксифен преимущественно вводят перорально при дозе приблизительно 20-100 мг один раз в день. Ралоксифен преимущественно вводят перорально при дозе приблизительно 60 мг один раз в день. Эксеместан преимущественно вводят перорально при дозе приблизительно 25 мг один раз в день. Антитела преимущественно вводят при дозе приблизительно 1-5 мг/м 2 площади поверхности тела или, как известно в данной области, другое количество. Трастузумаб преимущественно вводят при дозе 1-5 мг/м 2 площади поверхности тела, конкретно 2-4 мг/м 2 на курс лечения. Эти дозы можно вводить, например, один, два или больше раз на курс лечения, который можно повторять, например, каждые 7, 14,21 или 28 дней. Соединения формулы (I), их фармацевтически приемлемые аддитивные соли, в частности фармацевтически приемлемые кислотно-аддитивные соли, и стереоизомерные формы могут обладать полезными диагностическими свойствами, поэтому их можно применять для детектирования или идентификации образования комплекса между меченым соединением и другими молекулами, пептидами, белками,ферментами или рецепторами. В способах детектирования или идентификации можно применять соединения, которые мечены агентами для введения метки, такими как радиоизотопы, ферменты, флуоресцентные вещества, светящиеся вещества и т.д. Примеры радиоизотопов включают 125I, 131I, 3 Н и 14 С. Ферменты обычно делают детектируемыми конъюгированием с подходящим субстратом, который, в свою очередь, катализирует детектируемую реакцию. Примеры их включают, например, бета-галактозидазу, бета-глюкозидазу, щелочную фосфатазу, пероксидазу и малатдегидрогеназу, предпочтительно пероксидазу хрена. Светящиеся вещества включают в себя, например, люминол, производные люминола, люциферин,акворин и люциферазу. В качестве биологических образцов можно указать ткань тела или жидкости тела. Примерами жидкостей тела являются цереброспинальная жидкость, кровь, плазма, сыворотка, моча, мокрота, слюна и т.п. Нижеследующие примеры иллюстрируют настоящее изобретение. Экспериментальная часть. Ниже в контексте "ДМФА" означает N,N-диметилформамид, "DCM" означает дихлорметан, "DIPE" означает диизопропиловый простой эфир, "ДМСО" означает диметилсульфоксид, "EtOAc" означает этилацетат, "EtOH" означает этанол, "МеОН" означает метанол и "ТГФ" означает тетрагидрофуран. А. Получение промежуточных соединений. Пример А 1. а) Получение промежуточного продукта 1 Оксид марганца (33,31 г, 13 экв., 0,3832 моль) добавляли порциями к раствору 4-хлор-6,7-дигидро 5 Н-циклопента[b]пиридин-7-ола (промежуточного продукта 3) [CAS 126053-15-4] (5 г, 1 экв., 0,029 моль) в DCM (50 мл). Смесь перемешивали при комнатной температуре в течение 24 ч и затем фильтровали через целит. Растворитель выпаривали, получая при этом 3,25 г (66%) промежуточного продукта 1.b) Получение промежуточного продукта 2 Метилмагнийхлорид (1,47 мл, 3,2 экв., 0,004 моль) добавляли по каплям к раствору промежуточного продукта 1 (0,220 г, 1 экв., 0,0013 моль) в ТГФ (4 мл) при температуре от -5 до 0 С в потоке N2. Реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч. При 0-10 С добавляли хлорид аммония (10% раствор в воде) и EtOAc. Смесь экстрагировали три раза EtOAc и затем органический слой отделяли, сушили над MgSO4, фильтровали и растворитель выпаривали. Остаток (0,215 г) очищали колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc, 50/50). Чистые фракции собирали и растворитель выпаривали, получая при этом 0,120 г (50%) промежуточного продукта 2. Пример А 2. а) Получение промежуточного продукта 3 Натрийтетрагидроборат (1,92 г, 50,67 ммоль) добавляли порциями при 5 С к раствору промежуточного продукта 1 (7,72 г, 46,06 ммоль) в МеОН (80 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ночи и затем выливали в воду. Смесь экстрагировали три раза EtOAc. Органический слой промывали водой и раствором NaCl, отделяли, сушили над MgSO4, фильтровали и растворитель выпаривали, получая при этом 6,38 г (81,7%) промежуточного продукта 3 (смесь 50/50 RS). Этот продукт применяли без дополнительной очистки в следующей стадии.b) Получение промежуточного продукта 4 При 0 С в атмосфере N2 гидрид натрия (1,06 г, 44,22 ммоль) добавляли порциями к раствору промежуточного продукта 3 (3,00 г, 17,70 ммоль) в ТГФ (безводном, 30 мл). Реакционную смесь перемешивали в течение 15 мин при 0 С. Затем при 0 С к смеси по каплям добавляли иодметан (1,65 мл, 26,53 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ночи. Смесь охлаждали до комнатной температуры и по каплям добавляли холодную воду. Смесь перемешивали в течение 1 ч и затем экстрагировали EtOAc три раза. Органический слой отделяли, сушили над MgSO4, фильтровали и растворитель выпаривали, получая при этом 3,10 г (95,4%) промежуточного продукта 4. Данный продукт применяли без дополнительной очистки в следующей стадии. Пример A3. а) Получение промежуточного продукта 5 Метиловый эфир 1 Н-индол-7-карбоновой кислоты (0,091 моль), соль Эшенмозера (0,1 моль) в уксусной кислоте (300 мл) нагревали при 65 С в течение 2 ч. Осадок отделяли фильтрованием, растворяли в DCM и 10% растворе карбоната калия. Добавляли карбонат калия (твердый) и смесь перемешивали при комнатной температуре в течение 1 ч и затем экстрагировали. Органический слой отделяли, сушили надMgSO4, фильтровали и растворитель выпаривали, получая при этом 10 г промежуточного продукта 5.b) Получение промежуточного продукта 7 Промежуточный продукт 5 (0,043 моль), иодметан (0,047 моль) в EtOH (300 мл) перемешивали при комнатной температуре на протяжении ночи. Осадок отделяли фильтрованием и сушили, получая при этом 8,3 г промежуточного продукта 6. с) Получение промежуточного продукта 7 Промежуточный продукт 6 (0,023 моль) цианид натрия (0,03 моль) в ДМФА (100 мл) нагревали при 110 С в течение 2 ч. Реакционную смесь выливали в ледяную воду, перемешивали в течение 1 ч. Осадок отделяли фильтрованием и растворяли в DCM. Раствор экстрагировали, органический слой отделяли,сушили над MgSO4, фильтровали и упаривали, получая при этом 5,1 г промежуточного продукта 7.d) Получение промежуточного продукта 8 Метилмагнийхлорид (0,058 моль) добавляли по каплям к раствору промежуточного продукта 7(0,018 моль) в ТГФ (50 мл) в потоке N2. Реакционную смесь перемешивали при 5 С в течение 1 ч. При 5 С по каплям добавляли 10% раствор хлорида аммония. Реакционную смесь экстрагировали EtOAc. Органический слой отделяли, сушили над MgSO4, фильтровали и упаривали, получая при этом 4 г промежуточного продукта 8. е) Получение промежуточного продукта 9 Промежуточный продукт 8 (0,019 моль) в смеси MeOH/NH3 (50 мл) гидрировали в присутствии никеля Ренея (4 г) при комнатной температуре и давлении 3105 Па (3 бара) в течение 2 ч. Реакционную смесь фильтровали через целит, промывали DCM и фильтрат упаривали, получая при этом 3,5 г промежуточного продукта 9.f) Получение промежуточного продукта 10 Смесь промежуточного продукта 9 (0,016 моль), 2-фтор-5-нитротолуола (0,018 моль), анион мононатрийкарбоната (0,019 моль) в ДМСО (100 мл) нагревали при 60 С на протяжении ночи. Смесь охлаждали при комнатной температуре. Добавляли ледяную воду, добавляли DCM. Реакционную смесь экстрагировали, органический слой отделяли, сушили над MgSO4, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (элюент: смесь циклогексан/EtOAc, 60/40). Чистые фракции собирали и растворитель выпаривали, получая при этом 2,8 г промежуточного продукта 10.f) Получение промежуточного продукта 11 Промежуточный продукт 10 (0,0079 моль), оксид ванадия (0,05 г), раствор (4%) тиофена в DIPE (1 мл), 5% Pt/C (1,3 г) в ТГФ (50 мл) гидрировали при атмосферном давлении в течение 1 ночи при комнатной температуре. Реакционную смесь фильтровали и растворитель выпаривали, получая при этом промежуточный продукт 11. Этот продукт применяли без дополнительной очистки в следующей стадии. Согласно способу A3 получали следующие промежуточные продукты. Пример А 4. Промежуточный продукт 7 альтернативно получали также следующим образом. а) Получение промежуточного продукта 12 1-(Трифенилфосфоранилиден)-2-пропанон (34,4 ммоль) добавляли порциями при комнатной температуре к раствору 1H-индол-7-карбоксальдегида (34,44 ммоль) в метилбензоле (60 мл). Реакционную смесь нагревали при 100 С в течение 3 ч и затем охлаждали до комнатной температуры и упаривали досуха. Остаток (17,4 г) очищали ВЭЖХ на диоксиде кремния: 20-45 мкм (450 г) (элюент смесьDCM/MeOH, 99,5/0,5). Чистые фракции собирали и растворитель выпаривали, получая при этом 4,3 г промежуточного продукта 12.b) Получение промежуточного продукта 13 Промежуточный продукт 12 (3,4 ммоль) и соль Эшенмозера (3,8 ммоль) в уксусной кислоте (10 мл) нагревали при 65 С в течение 2 ч. Осадок отделяли фильтрованием, растворяли в DCM и 10% растворе карбоната калия. Добавляли карбонат калия (твердый) и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь экстрагировали, органический слой отделяли, сушили над MgSO4,фильтровали и растворитель выпаривали, получая при этом 0,7 г промежуточного продукта 13. с) Получение промежуточного продукта 14 Промежуточный продукт 13 (0,13 моль), иодметан (0,14 моль) в EtOH (300 мл) перемешивали при комнатной температуре в течение 2 дней. Осадок отделяли фильтрованием и сушили, получая при этом 47 г промежуточного продукта 14.d) Получение промежуточного продукта 15 Промежуточный продукт 14 (136,5 ммоль), цианид натрия (177,5 ммоль) в ДМФА (400 мл) перемешивали при комнатной температуре в течение 2 ч. Добавляли воду и реакционную смесь экстрагировалиEtOAc. Органический слой отделяли, сушили над MgSO4, фильтровали и упаривали. Остаток очищали высокоэффективной жидкостной хроматографией (неупорядоченный SiOH, 20-45 мкм, 1000 г,MATREX). Подвижная фаза: смесь 70% циклогексана/30% EtOAc. Чистые фракции собирали и растворитель выпаривали, получая при этом 11,8 г промежуточного продукта 15. е) Получение промежуточного продукта 16 Метилмагнийхлорид (0,07 моль) добавляли по каплям к раствору промежуточного продукта 15(0,022 моль) в ТГФ (50 мл). Добавляли 10% раствор NH4Cl и EtOAc. Реакционную смесь экстрагировали,органический слой отделяли, сушили над MgSO4, фильтровали и растворитель выпаривали. Остаток (2,9 г) очищали высокоэффективной жидкостной хроматографией (неупорядоченный SiOH, 20-45 мкм, 450 гMATREX). Подвижная фаза: смесь 60% циклогексана/40% EtOAc. Чистые фракции собирали и раство- 29
МПК / Метки
МПК: A61P 35/00, A61K 31/435, C07D 401/12, A61K 31/44
Метки: агентов, индола, качестве, производные, противораковых
Код ссылки
<a href="https://eas.patents.su/30-21883-proizvodnye-indola-v-kachestve-protivorakovyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индола в качестве противораковых агентов</a>
Предыдущий патент: Устройство и способ для выработки пара в скважине и повышения нефтеотдачи
Следующий патент: Способ получения медных порошков и нанопорошков из промышленных электролитов, в том числе отработанных промышленных электролитов
Случайный патент: Удаление жидкостей природного газа из газообразного потока природного газа