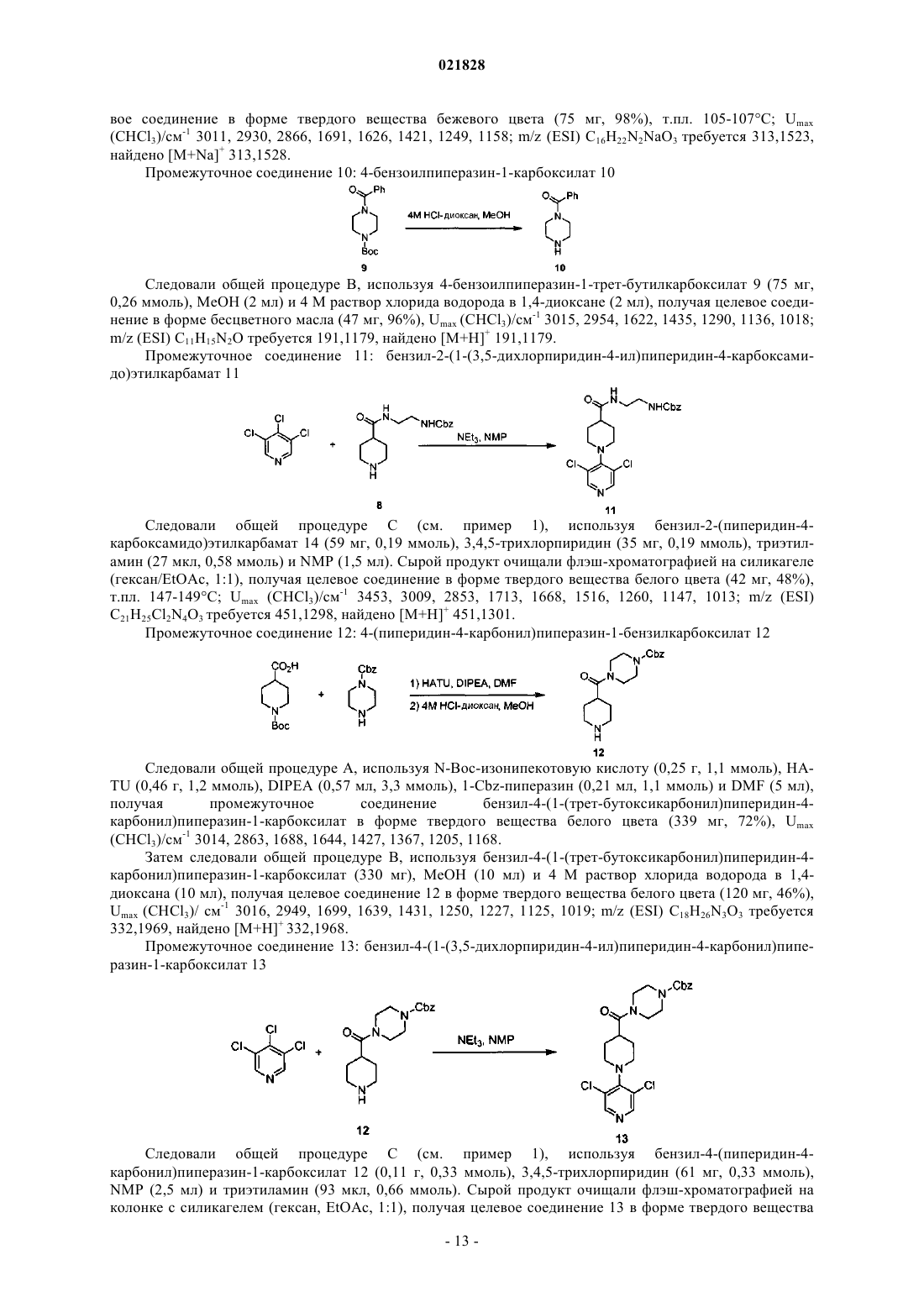
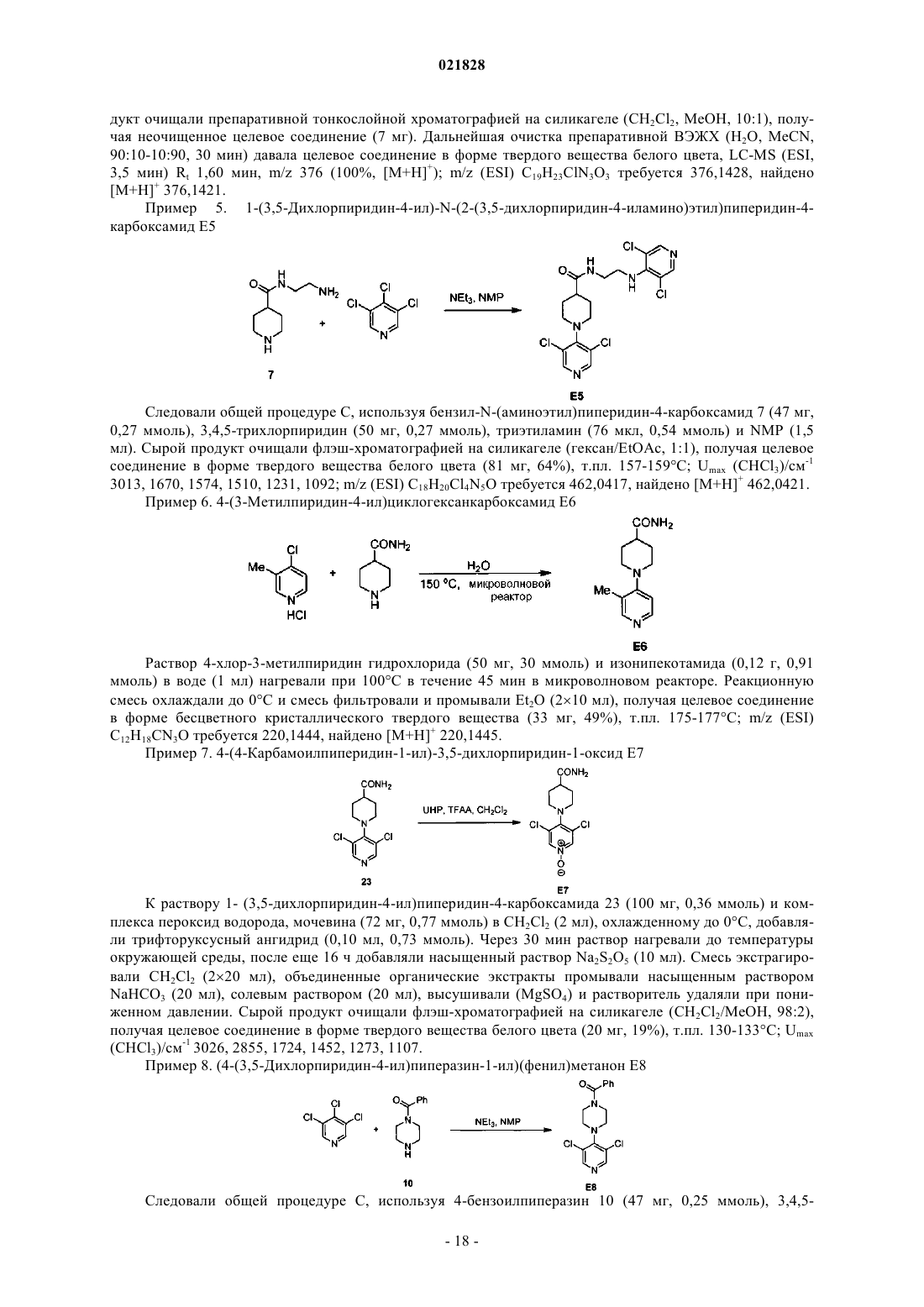
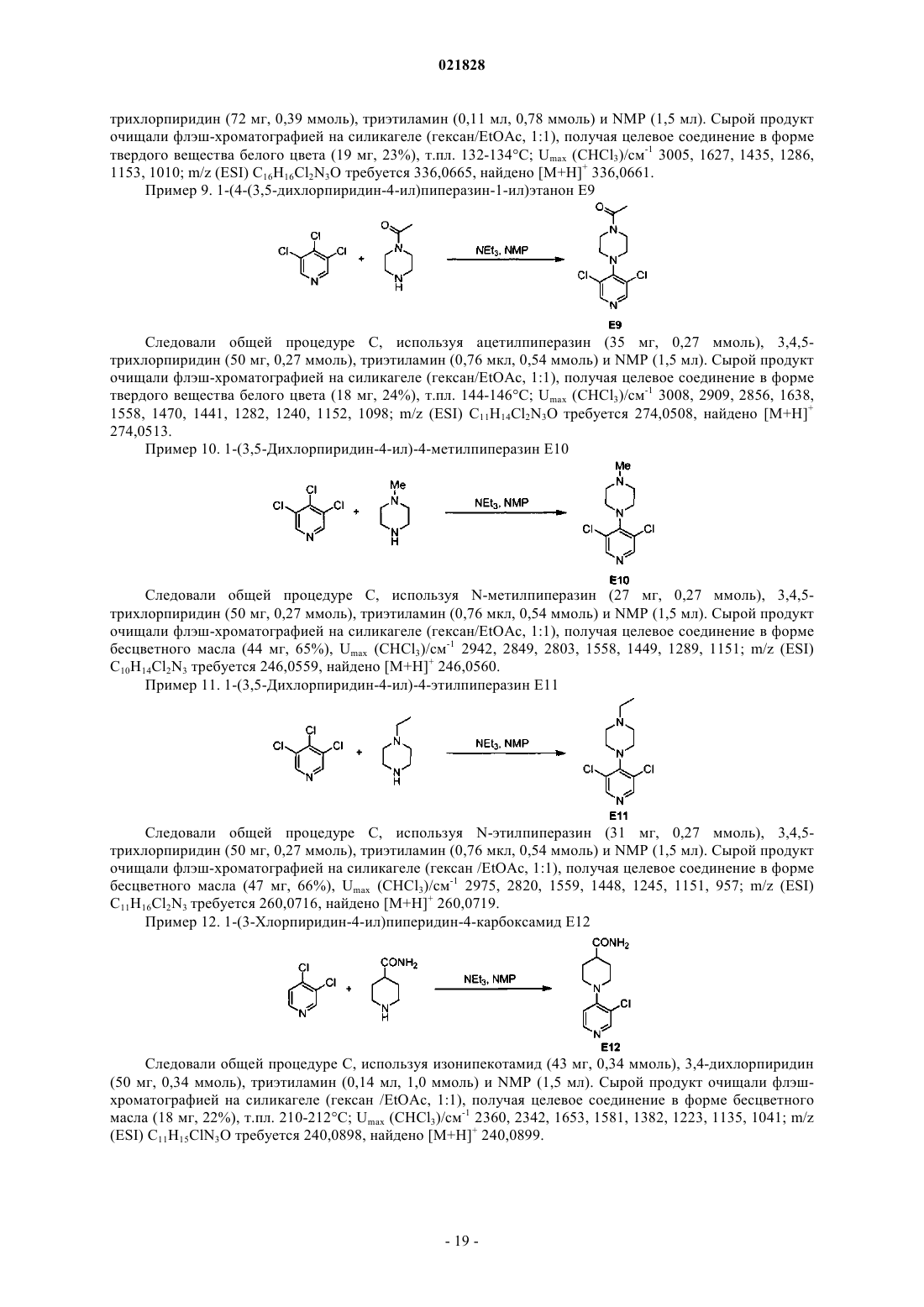
Соединения на основе пиридина и пиримидина в качестве ингибиторов сигнального пути wnт для лечения рака
Номер патента: 21828
Опубликовано: 30.09.2015
Авторы: Пихович Марк, Крамплер Саймон Росс, Благг Джулиан, Макдоналд Эдвард
Формула / Реферат
1. Соединение формулы (I)
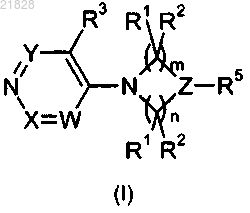
в которой
W обозначает СН, C(R4) или N;
X обозначает СН или CCl;
Y обозначает СН;
Z обозначает C(R6);
R1 и R2 обозначают водород;
R3 и R4 обозначают, каждый независимо, галоген или группу, выбранную из C1-6 алкила, C1-6алкокси, циклоалкила, арила и гетероарила, любой из которых может быть замещен 1, 2 или 3 Ra, причем указанный циклоалкил имеет 3, 4, 5 или 6 кольцевых атомов, указанный арил представляет собой фенил и указанный гетероарил имеет 5 или 6 кольцевых атомов, из которых 1 или 2 являются гетероатомами, выбранными из N, О или S;
R5 и R6 вместе с атомом углерода, к которому они присоединены, могут образовывать 5- или 6-членный гетероцикл, включающий 1 или 2 атома азота в качестве гетероатомов, который может быть замещен 1 или 2 Ra;
каждый Ra независимо выбран из галогена, трифторметила, циано, оксо, нитро, -ORb, -C(O)Rb, -C(O)ORb,
-OC(O)Rb, -S(O)1Rb, -N(Rb)Rc, -N(Rb)C(O)Rc, -C(O)N(Rb)Rc, -S(O)1N(Rb)Rc и Rd;
Rb и Rc обозначают, каждый независимо, водород или Rd;
Rd выбран из C1-6алкила, циклоалкила, арила, циклоалкил-C1-6алкила и гетероарила, каждый из которых может быть замещен 1, 2 или 3 заместителями, независимо выбранными из галогена, циано, амино, гидрокси, C1-6 алкила, C1-6 алкокси, причем
указанный циклоалкил имеет 3, 4, 5 или 6 кольцевых атомов,
указанный арил представляет собой фенил и
указанный гетероарил имеет 5 или 6 кольцевых атомов, из которых 1 или 2 являются гетероатомами, выбранными из N, О или S;
l=0, 1 или 2 и
m=2;
n=1 или 2;
или его фармацевтически приемлемая соль, или N-оксид;
при условии, что указанное соединение не является одним из следующих соединений:
8-(3-фторпиридин-4-ил)-2-(транс-4-гидроксициклогексил)-2,8-диазаспиро[4.5]декан-1-он;
[2-(2,6-диэтилфенил)-4-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6-метилпиримидин-5-илметил]метил-(1S)-(1,2,3,4-тетрагидронафталин-1-ил)амин;
(5R)-7-(3-фторпиридин-4-ил)-2-(транс-4-гидроксициклогексил)-2,7-диазаспиро[4.5]декан-1-он и
7-(3-фторпиридин-4-ил)-2-(4-гидрокси-1-адамантил)-2,7-диазаспиро[4.5]декан-1-он.
2. Соединение по п.1, которое имеет формулу (II)
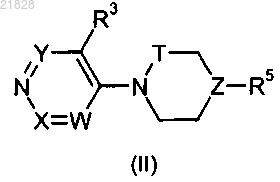
в которой Т обозначает связь или -СН2-.
3. Соединение по п.1 или 2, в котором X и Y, каждый, обозначают СН.
4. Соединение по любому из пп.1-3, в котором W обозначает C(R4) или N.
5. Соединение по п.4, в котором R4 обозначает галоген.
6. Соединение по любому из пп.1-5, в котором R3 обозначает галоген или группу, выбранную из C1-6 алкила, арила или гетероарила, любой из которых может быть замещен 1, 2 или 3 Ra.
7. Соединение по п.6, в котором R3 обозначает галоген или группу, выбранную из C1-6 алкила, фенила, пиразолила, оксазолила, изоксазолила, пиридинила, пиридазинила, пиримидинила и тиофенила, любой из которых может быть замещен 1, 2 или 3 Ra.
8. Соединение по п.1, в котором R5 и R6 вместе с атомом углерода, к которому они присоединены, образуют гетероцикл, содержащий кольцевую амидную группу, причем гетероцикл может быть замещен 1, 2 или 3 Ra.
9. Соединение по п.8, в котором R5 и R6 вместе с атомом углерода, к которому они присоединены, образуют 2-оксопирролидин, который может быть замещен 1, 2 или 3 Ra.
10. Соединение, выбранное из любого из следующих соединений:
8-(3,5-дихлорпиридин-4-ил)-1-фенил-1,3,8-триазаспиро[4.5]декан-4-он;
8-(3,5-дихлорпиридин-4-ил)-2,8-диазаспиро[4.5]декан-1-он;
8-(3-хлор-5-фенилпиридин-4-ил)-2,8-диазаспиро[4.5]декан-1-он;
или его фармацевтически приемлемая соль или N-оксид.
11. Применение соединения по любому из пп.1-10 или его фармацевтически приемлемой соли или N-оксида в лечении и/или профилактике рака.
12. Применение соединения по п.11, причем рак представляет собой рак толстой кишки, молочной железы или печени.
13. Фармацевтический состав, включающий соединение по любому из пп.1-10 или его фармацевтически приемлемую соль или N-оксид и фармацевтически приемлемый носитель или эксципиент.
Текст
СОЕДИНЕНИЯ НА ОСНОВЕ ПИРИДИНА И ПИРИМИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ СИГНАЛЬНОГО ПУТИ WNТ ДЛЯ ЛЕЧЕНИЯ РАКА Настоящее изобретение относится к формулы (I) в которой W обозначает СН, C(R4) или N; X обозначает СН или CCl; Y обозначает СН; Z обозначает C(R6); R1 и R2 обозначают водород; R3 и R4 обозначают, каждый независимо, галоген или группу, выбранную из C1-6 алкила, C1-6 алкокси, циклоалкила,арила и гетероарила, любой из которых может быть замещен 1, 2 или 3 Ra, причем указанный циклоалкил имеет 3, 4, 5 или 6 кольцевых атомов, указанный арил представляет собой фенил и указанный гетероарил имеет 5 или 6 кольцевых атомов, из которых 1 или 2 являются гетероатомами, выбранными из N, О или S; R5 и R6 вместе с атомом углерода, к которому они присоединены, могут образовывать 5- или 6-членный гетероцикл, включающий 1 или 2 атома азота в качестве гетероатомов,который может быть замещен 1 или 2 Ra; каждый Ra независимо выбран из галогена, трифторметила, циано, оксо, нитро, -ORb,-C(O)Rb, -C(O)ORb, -OC(O)Rb, -S(O)1Rb, -N(Rb)Rc, -N(Rb)C(O)Rc, -C(O)N(Rb)Rc, -S(O)1N(Rb)Rc и Rd; Rb и Rc обозначают, каждый независимо, водород или Rd; Rd выбран из C1-6 алкила, циклоалкила, арила, циклоалкил-C1-6 алкила и гетероарила, каждый из которых может быть замещен 1, 2 или 3 заместителями, независимо выбранными из галогена, циано, амино, гидрокси, C1-6 алкила, C1-6 алкокси, причем указанный циклоалкил имеет 3, 4, 5 или 6 кольцевых атомов, указанный арил представляет собой фенил и указанный гетероарил имеет 5 или 6 кольцевых атомов, из которых 1 или 2 являются гетероатомами, выбранными из N, О илиS; l = 0, 1 или 2; и m = 2; n = 1 или 2; или его фармацевтически приемлемая соль, или N-оксид; при условии, что указанное соединение не является одним из следующих соединений: -8-(3-фторпиридин-4-ил)-2-(транс-4-гидроксициклогексил)-2,8 диазаспиро[4.5]декан-1-он; -[2-(2,6-диэтилфенил)-4-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6-метилпиримидин-5-илметил]метил(1S)-(1,2,3,4-тетрагидронафталин-1-ил)амин;-(5R)-7-(3-фторпиридин-4-ил)-2-(транс-4-гидроксициклогексил)-2,7-диазаспиро[4.5]декан-1-он и -7-(3-фторпиридин-4-ил)-2-(4-гидрокси-1-адамантил)-2,7-диазаспиро[4.5]декан-1-он, фармацевтическим композициям, включающим эти соединения, и их потенциальному применению в качестве терапевтических средств для лечения и/или профилактики рака. Макдоналд Эдвард, Благг Джулиан,Пихович Марк, Крамплер Саймон Росс (GB)(71)(73) Заявитель и патентовладелец: КЭНСЭР РЕСЕРЧ ТЕКНОЛОДЖИ ЛИМИТЕД (GB) Область изобретения Это изобретение относится к соединениям и их применению в терапии, в частности, в лечении,профилактике или задержке развития рака. Уровень техники Онкогенная дерегуляция сигнального пути Wnt является причинным фактором инициации рака в различных тканях, включая толстую кишку, молочную железу и печень (см., например, Barker et al.,"Mining the Wnt pathway for cancer therapeutics", Nature Reviews Drug Discovery, Dec. 2006, vol. 5, 997). Сохраняется потребность в эффективных противораковых средствах, в частности, ингибиторах сигнального пути Wnt. В WO 01/27107 раскрыты гетероциклические ингибиторы натрий/протонного обмена, которые могут быть использованы в лечении сердечно-сосудистых нарушений. Включены соединения пиримидина,которые замещены имидазолилпиперидинильной группой. Сущность изобретения Согласно настоящему изобретению заявлено соединение формулы (I)X обозначает СН или CCl;R3 и R4 обозначают, каждый независимо, галоген или группу, выбранную из C1-6 алкила, C1-6 алкокси, циклоалкила, арила и гетероарила, любой из которых может быть замещен 1, 2 или 3 Ra, причем указанный циклоалкил имеет 3, 4, 5 или 6 кольцевых атомов,указанный арил представляет собой фенил и указанный гетероарил имеет 5 или 6 кольцевых атомов, из которых 1 или 2 являются гетероатомами, выбранными из N, О или S;R5 и R6 вместе с атомом углерода, к которому они присоединены, могут образовывать 5- или 6 членный гетероцикл, включающий 1 или 2 атома азота в качестве гетероатомов, который может быть замещен 1 или 2 Ra; каждый Ra независимо выбран из галогена, трифторметила, циано, оксо, нитро, -ORb, -C(O)Rb,-C(O)ORb, -OC(O)Rb, -S(O)lRb, -N(Rb)Rc, -N(Rb)C(O)Rc, -C(O)N(Rb)Rc, -S(O)lN(Rb)Rc и Rd; Rb и Rc обозначают, каждый независимо, водород или Rd;Rd выбран из C1-6 алкила, циклоалкила, арила, циклоалкил-C1-6 алкила и гетероарила, каждый из которых может быть замещен 1, 2 или 3 заместителями, независимо выбранными из галогена, циано, амино, гидрокси, C1-6 алкила, C1-6 алкокси, причем указанный циклоалкил имеет 3, 4, 5 или 6 кольцевых атомов,указанный арил представляет собой фенил, и указанный гетероарил имеет 5 или 6 кольцевых атомов, из которых 1 или 2 являются гетероатомами, выбранными из N, О или S;n = 1 или 2; или его фармацевтически приемлемой соли, или N-оксиду; при условии, что указанное соединение не является одним из следующих соединений:-7-(3-фторпиридин-4-ил)-2-(4-гидрокси-1-адамантил)-2,7-диазаспиро[4.5]декан-1-он. Изобретение также относится к фармацевтическому составу, включающему соединение формулы(I), или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель или эксципиент. В следующем аспекте изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли, для получения лекарственного средства для лечения, профилактики или задержки развития рака. Соединения по изобретению могут существовать в различных формах, таких как, например, свободные кислоты, свободные основания, N-оксиды, соли, и раскрытие включает все различные формы соединений. Следует понимать, что признаки, целые числа, характеристики, соединения, химические звенья или группы, описанные в отношении специфического аспекта, варианта осуществления или примера изобретения, являются применимыми к любому другому аспекту, варианту осуществления или примеру, описанному здесь, если они не являются несовместимыми с ним. Описание различных вариантов осуществления Определения Алкил Термины "алкил" и "C1-6 алкил" в рамках изобретения включают ссылку на алкильную группу с прямой или разветвленной цепью, имеющей 1, 2, 3, 4, 5 или 6 атомов углерода. Этот термин включает ссылку на такие группы как метил, этил, пропил (н-пропил или изопропил), бутил (н-бутил, втор-бутил или трет-бутил), пентил, гексил и т.п. В частности, алкил может иметь 1, 2, 3 или 4 атома углерода. Алкокси Термины "алкокси" и "C1-6 алкокси" в рамках изобретения включают ссылку на -О-алкил, где алкил имеет прямую или разветвленную цепь и включает 1, 2, 3, 4, 5 или 6 атомов углерода. В одном классе вариантов осуществления алкокси имеет 1, 2, 3 или 4 атома углерода. Этот термин включает ссылку на такие группы как метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси, пентокси, гексокси и т.п. Циклоалкил Термин "циклоалкил" в рамках изобретения включает ссылку на алициклическую группу, имеющую 3, 4, 5 или 6 атомов углерода. Группа может быть соединенной мостиковой связью системой или полициклической кольцевой системой. Чаще циклоалкильные группы являются моноциклическими. Этот термин включает ссылку на такие группы как циклопропил, циклобутил, циклопентил, циклогексил, норборнил, бицикло [2.2.2]октил и т.п. Арил Термин "арил" в рамках изобретения представляет собой фенил. Гетероциклил Термин "гетероциклил" в рамках изобретения включает ссылку на насыщенную (например, гетероциклоалкил) или ненасыщенную (например, гетероарил) гетероциклическую кольцевую группу, имеющую 5 или 6 кольцевых атомов, из которых 1 или 2 выбраны из азота, кислорода и серы. Гетероарил Термин "гетероарил" в рамках изобретения включает ссылку на ароматическую гетероциклическую кольцевую систему, имеющую 5 или 6 кольцевых атомов, из которых 1 или 2 выбран из азота, кислорода и серы. Галоген Термин "галоген" в рамках изобретения включает ссылку на F, Cl, Br или I. В частности, галоген может представлять собой F или Cl, из которых F является более часто используемым. Замещенный Термин "замещенный" в рамках изобретения в ссылке на группу означает, что один или больше,более предпочтительно 1, 2 или 3 атомов водорода в указанной группе заменены независимо друг от друга соответствующим числом описанных заместителей. Термин "в случае необходимости замещенный" в рамках изобретения означает замещенный или незамещенный. Конечно, следует понимать, что заместители находятся только в положениях, где они химически возможны, специалист в состоянии определить (экспериментально или теоретически) без дополнительного экспериментирования, возможно ли специфическое замещение. Например, амино- или гидроксильные группы со свободным водородом могут быть нестабильными, если они связаны с атомами углерода ненасыщенными (например, олефиновыми) связями. Дополнительно, конечно, следует понимать, что заместители, описанные здесь, могут сами быть замещены любым заместителем, подчиненным вышеописанному ограничению в отношении соответствующих замещений, как это понятно для специалиста. Фармацевтически приемлемый Термин "фармацевтически приемлемый" в рамках изобретения включает ссылку на такие соединения, материалы, композиции и/или лекарственные формы, которые в рамках нормального медицинского суждения являются подходящими для использования в контакте с тканями человека или животных без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения,соразмерно с приемлемым отношением выгоды/риска. Этот термин включает приемлемость как в медицинских, так и в ветеринарных целях. Независимо Если две или более групп описаны как "каждый независимо" выбранные из списка атомов или групп, это означает, что группы могут быть одинаковыми или разными. Идентичность каждой группы поэтому независима от идентичностей одной или более других групп. Соединения Настоящее изобретение относится к соединениям формулы (I) и к их фармацевтически приемлемым солям и N-оксидам в которой W, X, Y, Z, R1, R2, R3, R5, m и n имеют определенные здесь значения. Различные варианты осуществления изобретения описаны ниже. Следует понимать, что признаки,определенные в каждом варианте осуществления, могут быть скомбинированы с другими указанными признаками для получения других вариантов осуществления. В одном варианте осуществления m и n, каждый, означает 2. В одном варианте осуществления W обозначает C(R4) или N. В другом варианте осуществления W обозначает C(R4). Особо можно назвать соединения, в которых R4 обозначает галоген, например хлор или бром. В одном варианте осуществления гетероарильное кольцо, показанное в формуле (I), содержит по меньшей мере один атом азота в гетероцикле в форме N-оксида. Соответственно, в таких вариантах осуществления в форме N-оксида находится атом азота, расположенный между атомами X и Y. В другом варианте осуществления R3 обозначает галоген (например, хлор или бром) или группу,выбранную из C1-6 алкила, C3-6 циклоалкила, фенила и 5- или 6-членного гетероарила, любой из которых может быть замещен 1, 2 или 3 Ra. В одном варианте осуществления R3 обозначает галоген или группу, выбранную из C1-6 алкила, арила или гетероарила, любой из которых может быть замещен 1, 2 или 3 Ra. В одном варианте осуществления R3 обозначает галоген. В одном варианте осуществления R3 обозначает C1-6 алкокси. В одном варианте осуществления R3 обозначает хлор, бром или фенил. В частном варианте осуществления R3 обозначает хлор или бром. В одном варианте осуществления R4 обозначает галоген (например, хлор или бром) или группу, выбранную из C1-6 алкила, C3-6 циклоалкила, фенила и 5- или 6-членного гетероарила, любой из которых может быть замещен 1, 2 или 3 Ra. В одном варианте осуществления каждая группа Ra независимо выбрана из галогена, трифторметила, циано, оксо, нитро, -ORb, -C(O)Rb, -C(O)ORb, -OC(O)Rb, -S(O)lRb, -N(Rb)Rc, -N(Rb)С(O)Rc,-С(O)N(Rb)Rc, -S(O)lN(Rb)Rc и Rd. В другом варианте осуществления каждая группа Ra независимо выбрана из галогена, трифторметила, оксо, -ORb, -C(O)Rb, -S(O)lRb, -N(Rb)Rc, -N(Rb)C(O)Rc, -C(O)N(Rb)Rc иRd. В другом варианте осуществления Rd выбран из C1-6 алкила, C3-6 циклоалкила, фенила и 5- или 6 членного гетероциклила, каждый из которых может быть замещен 1, 2 или 3 заместителями, независимо выбранными из галогена, циано, амино, гидрокси, C1-4 алкила и C1-4 алкокси. В одном варианте осуществления соединение имеет следующую формулу: в которой Т обозначает связь или -СН 2-. В следующем аспекте настоящее изобретение относится к любому из соединений, перечисленных в сопутствующих примерах. Соединения по изобретению могут быть в форме фармацевтически приемлемых солей. Фармацевтически приемлемые соли согласно настоящему раскрытию могут синтезироваться из родительского соединения, которое содержит основную или кислотую группу, обычными химическими способами. Вообще, такие соли могут быть получены реакцией свободной кислотной или основной формы этих соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе, или в смеси двух; обычно предпочтительными являются неводные среды, такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Списки подходящих солей могут быть найдены в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., US, 1985, p. 1418, раскрытие которого тем самым включено ссылкой; см. также Stahl et al., Eds, "Handbook of Pharmaceutical Salts Properties Selection and Use", Verlag Helvetica Chimica Acta and Wiley-VCH, 2002. Изобретение таким образом включает фармацевтически приемлемые соли раскрытых соединений, в которых родительское соединение модифицируют, получая его соли с кислотой или основанием, например, обычные нетоксичные соли или соли четвертичного аммониевого основания, образованные, например, из неорганических или органических кислот или оснований. Примеры таких солей присоединения с кислотой включают ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират,цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат,никотинат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, роданид, тозилат и ундеканоат. Соли с основанием включают соли аммония, соли щелочного металла, такие как соли натрия и калия, соли щелочно-земельного металла, такие как соли кальция и магния, соли с органическими основаниями, такие как соли дициклогексиламина, N-метил-Dглюкамина, и соли с аминокислотами, такими как аргинин, лизин и т.д. Кроме того, основные азотсодержащие группы могут быть кватернизованы такими агентами, как низшие галогеналкилы, такие как метил, этил, пропил и бутилхлориды, бромиды и йодиды; диалкилсульфаты, такие как диметил, диэтил,дибутил; и диамилсульфаты, галогениды с длинными цепями, такие как децил, лаурил, миристил и стеарил хлориды, бромиды и йодиды, аралкилгалогениды, такие как бензил и фенетилбромиды и другие. Синтез Соединение по изобретению может быть получено согласно способам, описанным здесь. Следует понимать, что эти способы приведены исключительно для иллюстрации изобретения и не должны быть рассмотрены как ограничение. Способ, в котором используют подобные или аналогичные реактивы и/или условия, известные специалисту, может также использоваться для получения соединения по изобретению. Любые смеси конечных продуктов или полученных промежуточных соединений могут быть разделены на основе физико-химических различий компонентов, известным образом, на чистые конечные продукты или промежуточные соединения, например, хроматографией, перегонкой, фракционной кристаллизацией или формированием соли, если это является приемлемым или возможным при этих обстоятельствах. Введение и фармацевтические составы Соединения по изобретению обычно вводят перорально, внутривенно, подкожно, буккально, ректально, кожно, назально, трахеально, бронхиально, любым другим парентеральным путем, таким как пероральный или назальный спрей, или через ингаляцию. Соединения могут вводиться в форме фармацевтических препаратов, включающих пролекарство или активное соединение, или как свободное соединение или, например, фармацевтически приемлемая нетоксичная соль присоединения с органической или неорганической кислотой или основанием, в фармацевтически приемлемой лекарственной форме. В зависимости от нарушения и пациента, подвергаемых лечению, и пути введения композиции могут вводиться в варьирующих дозах. Как правило, поэтому фармацевтические соединения по изобретению могут вводиться перорально или парентерально ("парентерально" в рамках изобретения, относится к способам введения, которые включают внутривенную, внутримышечную, внутрибрюшинную, надчревную, подкожную и внутрисуставную инъекцию и инфузию) хозяину. В случае крупных животных, таких как человек, соединения могут вводиться индивидуально или как композиции в комбинации с фармацевтически приемлемыми разбавителями, эксципиентами или носителями. Фактические уровни дозировки активных ингредиентов в фармацевтических композициях по изобретению могут варьировать, чтобы получить количество активного соединения(й), которое является эффективным для достижения желаемой терапевтической реакции для конкретного пациента, композиций и способа введения. Выбранный уровень дозировки будет зависеть от активности конкретного соединения, пути введения, серьезности состояния, подвергаемого лечению, и состояния и предшествующей медицинской истории получающего лечение пациента. Однако специалисту известно введение с начальными дозами соединения на уровнях ниже необходимых для достижения желаемого терапевтического эффекта и постепенное увеличение дозировки, пока желаемый эффект не будет достигнут. В некоторых вариантах осуществления подходящий уровень дозировки обычно составляет приблизительно от 0,01 до 500 мг на кг массы тела пациента в сутки, который может вводиться в единственной дозе или в виде множества доз. В частном варианте осуществления уровень дозировки составляет от приблизительно 0,1 до приблизительно 250 мг/кг в сутки; более предпочтительно от приблизительно 0,5 до приблизительно 100 мг/кг в сутки. Подходящий уровень дозировки может составлять приблизительно от 0,01 до 250 мг/кг в сутки, приблизительно от 0,05 до 100 мг/кг в сутки или приблизительно от 0,1 до 50 мг/кг в сутки. В пределах этого диапазона дозировка может составлять от 0,05 до 0,5, от 0,5 до 5 или от 5 до 50 мг/кг в сутки. Для перорального введения композиции можно получить в форме таблеток, содержащих от 1,0 до 1000 мг активного ингредиента, в частности 1,0, 5,0, 10,0, 15,0, 20,0, 25,0, 50,0, 75,0,100,0, 150,0, 200,0, 250,0, 300,0, 400,0, 500,0, 600,0, 750,0, 800,0, 900,0 и 1000,0 мг активного ингредиента для симптоматического подбора дозировки для введения пациенту, получающему лечение. Соединения могут вводиться в режиме от 1 до 4 раз в сутки, например, один или два раза в сутки. Режим введения может быть отрегулирован так, чтобы обеспечить оптимальный терапевтический ответ. Согласно другому аспекту изобретение таким образом относится к фармацевтической композиции,включающей соединение по изобретению, в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем. Фармацевтические композиции по изобретению для перентеральной инъекции предпочтительно включают фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления в стерильные растворы или дисперсии для инъекций непосредственно перед использованием. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или основ включают воду, этанол, многоатомные спирты (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.), и подходящие смеси этого, растительные масла (такие как оливковое масло) и подходящие для инъекций органические сложные эфиры, такие как этилолеат. Собственная текучесть может быть поддержана, например, при помощи материалов покрытия, таких как лецитин, путем поддержания необходимой величины частиц в случае дисперсии и при помощи поверхностно-активных веществ. Эти композиции могут также содержать адъюванты, такие как консервант, смачивающие вещества,эмульгаторы и диспергирующие агенты. Профилактика действия микроорганизмов может быть обеспечена включением различных антибактериальных и противогрибковых средств, например парабена, хлорбутанола или фенолсорбиновой кислоты. Может также быть желательно включать изотонические средства, такие как, например, сахара или хлорид натрия. Пролонгированная абсорбция инъецируемой фармацевтической формы может быть обеспечена включением средств (например, алюминий моностеарата и желатина), которые задерживают абсорбцию. В некоторых случаях для пролонгации эффекта лекарственного средства желательно замедлить абсорбцию лекарственного средства из подкожной или внутримышечной инъекции. Это может быть достигнуто при помощи жидкой суспензии кристаллического или аморфного материала с недостаточной водорастворимостью. Скорость абсорбции лекарственного средства тогда зависит от его скорости растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, отсроченную абсорбцию парентерально вводимой формы лекарственного средства обеспечивают, растворяя или суспендируя лекарственное средство в масляном носителе. Инъецируемые формы депо предпочтительно получают, формируя матрицы для микроинкапсуляции лекарственного средства в биоразлагаемых полимерах, например полилактид-полигликолиде. В зависимости от отношения лекарственного средства к полимеру и природы конкретного используемого полимера можно контролировать скорость высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают сложные поли(орто-эфиры) и поли(ангидриды). Инъецируемые составы депо могут также быть получены путем захвата лекарственного средства в липосомах или микроэмульсиях, которые совместимы с тканями организма. Инъецируемые составы могут стерилизоваться,например, фильтрацией через задерживающий бактерии фильтр или включением стерилизующих средств в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерилизованной воде или другой стерильной впрыскиваемой среде непосредственно перед использованием. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли,порошки и гранулы. В таких твердых лекарственных формах активное соединение обычно смешано с по меньшей мере одним инертным фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальций фосфат и/или одним или более: а) наполнителями, такими как крахмалы,лактоза, сахароза, глюкоза, маннит и кремневая кислота; b) связующими, такими как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик; с) увлажнителями, такими как глицерин; d) дезинтеграторами, такими как агар-агар, карбонат кальция, картофельный крахмал или крахмал тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия; е) ингибиторами растворения, такими как парафин; f) ускорителями абсорбции, такими как четвертичные аммониевые соединения; g) смачивающими веществами, такими как цетиловый спирт и моностеарат глицерина; h) абсорбирующими веществами, такими как каолиновая и бентонитовая глина, и i) лубрикантами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль лекарственная форма может также включать буферизующие средства. Твердые композиции подобного типа могут также использоваться как наполнители в желатиновых капсулах с мягким и твердым наполнением с использованием таких эксципиентов как, например, лактоза,или молочный сахар, а также высокомолекулярный полиэтиленгликоль. Предпочтительно составы для перорального введения содержат вспомогательное вещество для растворения. Вспомогательное вещество для растворения не ограничено в том, что касается его идентичности,при условии, что оно является фармацевтически приемлемым. Примеры включают неионогенные поверхностно-активные вещества, такие как сложные эфиры жирной кислоты и сахарозы, сложные эфиры жирной кислоты и глицерина, сложные эфиры жирной кислоты и сорбитана (например, сорбитан триолеат), полиэтиленгликоль, полиоксиэтиленовое гидрированное касторовое масло, полиоксиэтиленовые сложные эфиры жирной кислоты и сорбитана, полиоксиэтиленовые алкиловые эфиры, метоксиполиоксиэтиленовые алкиловые эфиры, полиоксиэтиленовые алкилфениловые эфиры, сложные эфиры жирной кислоты и полиэтиленгликоля, полиоксиэтиленовые алкиламин, полиоксиэтиленовые алкиловые тиоэфиры, сополимеры полиоксиэтилена и полиоксипропилена, полиоксиэтиленовые эфиры жирной кислоты и глицерина, эфиры жирной кислоты и пентаэритрита, эфиры жирной монокислоты и пропиленгликоля, полиоксиэтиленовые эфиры жирной монокислоты и пропиленгликоля, полиоксиэтиленовые эфиры жирной кислоты и сорбита, алкилоламиды жирной кислоты и алкиламиноксиды; желчная кислота и ее соли (например, хенодеоксихолевая кислота, холевая кислота, дезоксихолевая кислота, дигидрохолевая кислота и их соли, и их глициновые или тауриновые конъюгаты); ионные поверхностно-активные вещества, такие как лаурилсульфат натрия, соли жирной кислоты, алкилсульфонаты, алкилфосфаты, фосфаты простых эфиров, соли жирной кислоты и основных аминокислот; соли триэтаноламина и соли четвертичного алкиламмониевого основания; и амфотерные поверхностно-активные вещества, такие как бетаины и соли аминокарбоновых кислот. Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, известные в области фармацевтических составов. Они могут в случае необходимости содержать замутняющие агенты и могут также иметь такой состав, что они высвобождают активный ингредиент(ы) только, или избирательно, в определенной части кишечника, и/или отсроченным образом. Примеры таких композиций включают полимерные вещества и воски. Активные соединения могут также быть в микроинкапсулированной форме, если приемлемо, с одним или более вышеописанных эксципиентов. Активные соединения могут быть в тонкодисперсной форме, например, они могут быть микронизованы. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области,такие как вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этанол,изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль,1,3-бутиленгликоль, диметилформамид, масла (в частности, семени хлопчатника, арахисовое, кукурузное, проростков пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирной кислоты и сорбитана и их смеси. Помимо инертных разбавителей пероральные композиции могут также включать адъюванты, такие как смачивающие вещества, эмульгирующие и суспендирующие агенты, подсластители, вкусовые агенты и отдушки. Суспензии в дополнение к активным соединениям могут содержать суспендирующие агенты, такие как этоксилированные изостеариловые спирты, сложные эфиры полиоксиэтилен сорбита и сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант и их смеси. Композиции для ректального или влагалищного введения представляет собой предпочтительно суппозитории, которые могут быть получены смешиванием соединения по изобретению с подходящими нераздражающими эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при комнатной температуре, но жидкими при температуре тела и поэтому плавятся в прямой кишке или полости влагалища и высвобождают активное соединение. Соединения согласно настоящему изобретению могут также вводиться в форме липосом. Как известно в данной области техники, липосомы обычно получают из фосфолипидов или других липидных веществ. Липосомы формируются моно- или мультиламеллярными гидратированными жидкими кристаллами, которые диспергируют в водной среде. Может использоваться любой нетоксичный, физиологически приемлемый и метаболизируемый липид, способный к образованию липосом. Композиции по изобретению в липосомной форме могут содержать в дополнение к соединению согласно настоящему изобретению стабилизаторы, консерванты, эксципиенты и т.п. Предпочтительными липидами являются фосфолипиды и фосфатидилхолины (лецитины) как натуральные, так и синтетические. Способы получения липосом известны в данной области техники, например Prescott, Ed., Methods inCell Biology, vol. XIV, Academic Press, New York, N.Y. (1976), p 33 et seq. Лекарственные формы для топического введения соединения по изобретению включают порошки,спреи, мази и ингаляторы. Активное соединение смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами, буферами или пропеллентами, которые могут потребоваться. Глазные составы, мази, порошки и растворы для глаз также находятся в рамках этого изобретения. Применение Соединения по изобретению могут быть использованы в терапии различных заболеваний и состояний. Субъект указанной терапии может быть человеком или животным. Соединения по изобретению могут показывать желаемый потенциал, селективность и микросомальную стабильность. В частности, соединения по изобретению могут быть использованы в лечении или профилактике рака, такого как рак толстой кишки, молочной железы или печени. Следующие примеры иллюстрируют изобретение. Общий синтез Соединения, приведенные в качестве примера, были получены согласно следующим реакционным схемам. Процедура с 3 стадиями, состоящая из сочетания N-Boc-изонипекотовой кислоты с рядом аминов с использованием HATU в качестве сочетающего реагента. Удаление защитной группы от полученного пиперидина в кислых условиях с последующим опосредуемым микроволновым облучением сочетанием Реактивы и условия: a) RR'NH, HATU, DIPEA, DMF; b) 4M HCl-диоксан, МеОН 1:1; с) 3,4,5 трихлорпиридин, NEt3, NMP, 220C, 60 мин. Как 4-хлорпиридин, так и 3,4-дихлорпиридин были коммерчески доступными в форме гидрохлоридов. Реакцию осуществляли в воде, используя избыток изонипекотамида, что приводило к превосходному преобразованию в желаемые продукты В и С. Было обнаружено, что эти продукты кристаллизуются после охлаждения реакционной смеси до 0C. Амиды пиперидина сначала синтезировали, затем подвергали сочетанию с фрагментом пиридина. Таким образом осуществляли сочетание 1-Boc-4-аминопиперидина с карбоновыми кислотами, чтобы получить амиды. Удаление N-защиты давало свободные пиперидины, которые переносили сочетание Реактивы и условия: a) RCO2H, HATU, DIPEA, DMF; b) 4M HCl-диоксан, МеОН 1:1; с) 3,4,5 трихлорпиридин, NEt3, NMP, 220C, 60 мин. Промежуточное соединение 4-хлор-3,5-диметилпиридин синтезировали селективным хлорированием 3,5-диметилпиридина, как описано Wurster et al. (J. Med. Chem. 2006, 49, 6351). Промежуточное соединение 4-хлор-3-метилпиридин было коммерчески доступно в форме гидрохлорида. Пиридины затем подвергали сочетанию с изонипекотамидом в водных условиях, получая аналоги Е и F с хорошим выходом. Окисление кольца пиридина может быть осуществлено с использованием условий, разработанныхCaron et al. (Tetrahedron Lett. 2000, 41, 2299) для окисления электрон-дефицитных пиридинов. Высоко реактивное окисляющее средство - пертрифторуксусную кислоту получали in situ из комплекса пероксид водорода-мочевина и трифторуксусного ангидрида.N-Boc-пиперазин был подвергнут сочетанию с бензойной кислотой с получением амида, который затем подвергали удалению защитной группы и сочетанию с 3,4,5-трихлорпиридином, получая Н. Аналогично 3,4,5-трихлорпиридин был подвергнут сочетанию с коммерчески доступными N-ацетил, Nметил и N-этил пиперазинами с получением соединений I, J, K соответственно. Эту схему использовали, чтобы синтезировать аналоги амида, полученные из этилендиамина. Третбутоксикарбонильную защитную группу термически удаляли в ходе реакции сочетания, получая к продукту бис-сочетания L. Карбоксибензильное производное М синтезировали согласно схеме, приведенной ниже, однако удаление защитной группы получали гидрированием, что приводило к гидрированию хлоридных групп с получением N. В этом случае условия опосредуемого кислотой Льюиса расщепления, как описано Stammer et al (J.Chem. Soc, Chem. Comm. 1979, 495), использовали, чтобы селективно отщепить защитную группу, используя триметилсилил йодид, чтобы получить О с хорошим выходом. Соединение О было затем подвергнуто восстановительному аминированию с использованием ряда различных альдегидов с получением других аналогов Р, когда использовали стехиометрические количества альдегида, или Q, когда использовали избыток альдегида. Ряд аналогов первичной функциональной амидной группы синтезировали обычными способами. Таким образом, обработка первичного амида реактивом Лоуссона давала тиоамид R, тогда как обработка виниленкарбонатом давала оксазолон S. Тиоамид R может быть далее преобразован в тиазол Т обработкой хлорацетальдегидом. Сочетание 3,4,5-трихлорпиридина с 4-цианопиперидином приводило к аналогу нитрила U, который подвергали гидролизу в кислых условиях, получая карбоновую кислоту V. 3,4,5-трихлорпиридин и 3,5-дибром-4-хлорпиридин подвергали сочетанию с 3-цианопирролидином,получая нитрильные промежуточные соединения, которые могут быть гидролизованы с получением аналогов амида W. Две энантиомерные формы W могут быть разделены хиральной ВЭЖХ. Аналогично аналоги амида Y на основе этилендиамина могут быть синтезированы путем сочетания промежуточного пирролидина с 3,4,5-тригалогенпиридинами. Был также разработан более производительный путь, в котором промежуточное соединение 2 хлорпиримидин сначала синтезировали и затем подвергали гидрогенолизу. Промежуточный 5 бромпиримидин также подвергали реакции Suzuki с получением аналогов арила АА. Точно так же реакция Suzuki с арил- и гетероарилбороновыми кислотами и 5-бромпиридиновым аналогом давала аналоги арила ВВ с превосходным выходом. Таким же образом, аналоги 3-галоген-5-арилпиридина получали из дихлор- и дибромпиридинов,следя, чтобы избежать двойного сочетания. При использовании избытка бороновых кислот двойная реакция Suzuki с получением только бис-арильных аналогов DD также может быть успешно осуществлена.(4 мл) добавляли DIPEA (0,76 мл, 4,4 ммоль). После перемешивания раствора в течение 5 мин добавляли метиламин гидрохлорид (76 мг, 1,1 ммоль). После перемешивания раствора в течение еще 16 ч его лили в 1 М раствор гидроксида натрия (50 мл) и экстрагировали EtOAc (250 мл). Объединенные органические экстракты промывали водой (50 мл), 1 М соляной кислотой (50 мл), водой (50 мл) и солевым раствором(50 мл). Органическую фазу высушивали (MgSO4) и растворитель выпаривали при пониженном давлении, получая целевое соединение в форме светло-желтого масла (69 мг, 33%), Umax (CHCl3)/см-1 3009,2932, 1677, 1522, 1429, 1279, 1166; m/z (ESI) C12H22N2NaO3 требуется 265,1523, найдено [M+Na]+ 265,1525. Промежуточное соединение 2: трет-бутил-4-(диметилкарбамоил)пиперидин-1-карбоксилат 2 Следовали общей процедуре А, используя N-Boc-изонипекотовую кислоту (0,20 г, 0,86 ммоль),HATU (0,43 г, 1,1 ммоль), DIPEA (0,76 мл, 4,4 ммоль), гидрохлорид диметиламина (92 мг, 1,1 ммоль) иDMF (4 мл), чтобы получить целевое соединение в форме светло-коричневого масла (156 мг, 70%), Umax Следовали общей процедуре А, используя N-Boc-изонипекотовую кислоту (0,20 г, 0,86 ммоль),HATU (0,43 г, 1,1 ммоль), DIPEA (0,76 мл, 4,4 ммоль), N-Boc-этилендиамин (0,18 г, 1,1 ммоль) и DMF (4 мл), получая целевое соединение в форме твердого вещества бежевого цвета (311 мг, 96%), т.пл. 172174C; Umax (CHCl3)/см-1 3022, 2981, 1684, 1671, 1507, 1367, 1241, 1165; m/z (ESI) C18H33N3NaO5 требуется 394,2312, найдено [M+Na]+ 394,2310. Промежуточное соединение 4: трет-бутил-4-(2-(бензилоксикарбониламино)этилкарбамоил)пиперидин-1-карбоксилат 4 Следовали общей процедуре А, используя N-Boc-изонипекотовую кислоту (0,10 г, 0,44 ммоль),HATU (0,22 г, 0,57 ммоль), DIPEA (0,38 мл, 2,2 ммоль), N-Cbz-этилендиамин (0,11 г, 0,57 ммоль) и DMF(2 мл), получая целевое соединение в форме желтого воска (170 мг, 96%), Umax (CHCl3) /см-1 3361, 3024,2943, 1713, 1683, 1519, 1428, 1236, 1166; m/z (ESI) C21H32N3O5 требуется 406,2337, найдено [М+Н]+ 406,2330.(2 мл), охлажденном до 0C, добавляли 4 М раствор хлорида водорода в 1,4-диоксане (2 мл). После перемешивания в течение 15 мин раствору давали нагреться до температуры окружающей среды и после перемешивания в течение дальнейшего периода еще 3 ч растворитель удаляли при пониженном давлении. Сырой продукт очищали хроматографией на картридже SCX-2 (МеОН, затем 0,5 М NH3 в МеОН),получая целевое соединение в форме бесцветного масла (41 мг, 99%), Umax (CHCl3)/см-1 3008, 2948, 1663,1525, 1227, 1199; m/z (ESI) C7H15N2O требуется 143,1179, найдено [М+Н]+ 143,1178. Промежуточное соединение 6: N,N-диметилпиперидин-4-карбоксамид 6 Следовали общей процедуре В, используя трет-бутил-4-(диметилкарбамоил)пиперидин-1 карбоксилат 2 (0,16 г, 0,60 ммоль), МеОН (2,5 мл) и 4 М раствор хлорида водорода в 1,4-диоксане (2,5 мл), получая целевое соединение в форме светло-желтого масла (67 мг, 71%), Umax (CHCl3) /см-1 3003,2947, 1625, 1497, 1401, 1320, 1240, 1137, 1105; m/z (ESI) C8H17N2O требуется 157,1335, найдено [М+Н]+ 157,1338. Промежуточное соединение 7: N-(2-аминоэтил)пиперидин-4-карбоксамид 7 Следовали общей процедуре В,используя трет-бутил-4-(2-(третбутоксикарбониламино)этилкарбамоил)пиперидин-1-карбоксилат 3 (0,31 г, 0,83 ммоль), МеОН (5 мл) и 4 М раствор хлорида водорода в 1,4-диоксане (5 мл), получая целевое соединение в форме бесцветного масла (109 мг, 76%), Umax см-1 3284, 3940, 1647, 1550, 1139, 1035; m/z (ESI) C8H18N3O требуется 172,1444,найдено [М+Н]+ 172,1445. Промежуточное соединение 8: 2-(пиперидин-4-карбоксамидо)этилбензилкарбамат 8 Следовали общей процедуре В, используя трет-бутил-4-(2 (бензилоксикарбониламино)этилкарбамоил)пиперидин-1-карбоксилат 4 (0,19 г, 0,46 ммоль), МеОН (3 мл) и 4 М раствор хлорида водорода в 1,4-диоксане (3 мл), получая целевое соединение в форме бесцветного масла (108 мг, 76%),т.пл. 165-167C; Umax (CHCl3)/см-1 3013, 2946, 1713, 1661, 1519, 1260, 1226, 1140, 1014; m/z (ESI) Следовали общей процедуре А, используя 1-Вос-пиперазин (50 мг, 0,27 ммоль), бензойную кислоту вое соединение в форме твердого вещества бежевого цвета (75 мг, 98%), т.пл. 105-107C; Umax Следовали общей процедуре В, используя 4-бензоилпиперазин-1-трет-бутилкарбоксилат 9 (75 мг,0,26 ммоль), МеОН (2 мл) и 4 М раствор хлорида водорода в 1,4-диоксане (2 мл), получая целевое соединение в форме бесцветного масла (47 мг, 96%), Umax (CHCl3)/см-1 3015, 2954, 1622, 1435, 1290, 1136, 1018; Следовали общей процедуре С (см. пример 1), используя бензил-2-(пиперидин-4 карбоксамидо)этилкарбамат 14 (59 мг, 0,19 ммоль), 3,4,5-трихлорпиридин (35 мг, 0,19 ммоль), триэтиламин (27 мкл, 0,58 ммоль) и NMP (1,5 мл). Сырой продукт очищали флэш-хроматографией на силикагеле(гексан/EtOAc, 1:1), получая целевое соединение в форме твердого вещества белого цвета (42 мг, 48%),т.пл. 147-149C; Umax (CHCl3)/см-1 3453, 3009, 2853, 1713, 1668, 1516, 1260, 1147, 1013; m/z (ESI) Следовали общей процедуре А, используя N-Boc-изонипекотовую кислоту (0,25 г, 1,1 ммоль), HATU (0,46 г, 1,2 ммоль), DIPEA (0,57 мл, 3,3 ммоль), 1-Cbz-пиперазин (0,21 мл, 1,1 ммоль) и DMF (5 мл),получая промежуточное соединение бензил-4-(1-(трет-бутоксикарбонил)пиперидин-4 карбонил)пиперазин-1-карбоксилат в форме твердого вещества белого цвета (339 мг, 72%), Umax(CHCl3)/см-1 3014, 2863, 1688, 1644, 1427, 1367, 1205, 1168. Затем следовали общей процедуре В, используя бензил-4-(1-(трет-бутоксикарбонил)пиперидин-4 карбонил)пиперазин-1-карбоксилат (330 мг), МеОН (10 мл) и 4 М раствор хлорида водорода в 1,4 диоксана (10 мл), получая целевое соединение 12 в форме твердого вещества белого цвета (120 мг, 46%),Umax (CHCl3)/ см-1 3016, 2949, 1699, 1639, 1431, 1250, 1227, 1125, 1019; m/z (ESI) C18H26N3O3 требуется 332,1969, найдено [М+Н]+ 332,1968. Промежуточное соединение 13: бензил-4-(1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбонил)пиперазин-1-карбоксилат 13 Следовали общей процедуре С (см. пример 1), используя бензил-4-(пиперидин-4 карбонил)пиперазин-1-карбоксилат 12 (0,11 г, 0,33 ммоль), 3,4,5-трихлорпиридин (61 мг, 0,33 ммоль),NMP (2,5 мл) и триэтиламин (93 мкл, 0,66 ммоль). Сырой продукт очищали флэш-хроматографией на колонке с силикагелем (гексан, EtOAc, 1:1), получая целевое соединение 13 в форме твердого веществаi) К раствору (R, S)-N-Boc-3-цианопирролидина (0,25 г, 1,3 ммоль) в МеОН (5 мл) добавляли хлорид водород (5 мл 4 М раствора в диоксане), и смесь перемешивали в течение 3 ч, после чего растворитель удаляли при пониженном давлении. Сырой продукт очищали на картридже SCX-2 (МеОН, затем 0,5 М NH3 в МеОН), получая (R,S)-3-цианопирролидин в форме бесцветного масло (136 мг, 100%).ii) К раствору (R,S)-3-цианопирролидин (0,12 г, 1,3 ммоль) и 3,4,5-трихлорпиридин (0,23 г, 1,3 ммоль) в NMP (8 мл) добавляли триэтиламин (0,36 мл, 2,6 ммоль). Смесь нагревали при 220C в течение 60 мин в микроволновом реакторе, вливали в насыщенный раствор бикарбоната натрия (50 мл) и экстрагировали EtOAc (2100 мл). Объединенные органические экстракты промывали водой (50 мл), солевым раствором (50 мл), высушивали (MgSO4) и концентрировали при пониженном давлении. Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, МеОН, 99:1), получая целевое соединение в форме бесцветного масла (155 мг, 50%), Umax (CHCl3)/см-1 3053, 2245, 1558, 1468, 1402; m/z (ESI) К раствору (R,S)-1-Вос-пирролидин-3-карбоновой кислоты (0,22 г, 2,2 ммоль), гидрохлорида N-Zэтилендиамина (0,50 г, 2,2 ммоль) и HATU (0,82 г, 2,2 ммоль) в DMF (15 мл) добавляли DIPEA (1,9 мл,11 ммоль) и раствор перемешивали при температуре окружающей среды в течение 16 ч. Смесь лили в насыщенный раствор бикарбоната натрия (50 мл) и экстрагировали EtOAc (240 мл). Объединенные органические экстракты промывали водой (50 мл), насыщенным раствором лимонной кислоты (50 мл), водой (50 мл) и солевым раствором (50 мл), высушивали (MgSO4) и концентрировали при пониженном давлении, получая целевое соединение 15 в форме бесцветного масла (0,43 г, 100%). Это соединение использовали непосредственно, без дальнейшей очистки. Промежуточное соединение 16: бензиловый эфир 2-[(пирролидин-3-карбонил)амино]этилкарбаминовой кислоты 16(R,S)-3-(2-бензилоксикарбониламино-этилкарбамоил)пирролидин-1-карбоновой кислоты 15 (430 мг, 1,10 ммоль) в МеОН (5 мл) добавляли 4 М раствор хлорида водорода в 1,4-диоксане (5 мл). После перемешивания в течение 2 ч смесь концентрировали при пониженном давлении, и сырой продукт очищали на картридже SCX-2 (МеОН, затем 0,5 М NH3 в МеОН), получая целевое соединение в форме твердого вещества белого цвета (260 мг, 81%), т.пл. 129131C; Umax (CHCl3)/см-1 3451, 3014, 1714, 1663, 1517, 1227; m/z (ESI) C15H22N3O3 требуется 292,1656,найдено [М+Н]+ 292,1654. Промежуточное соединение 17: бензиловый эфир (R,S)-(2-[1-(3,5-дихлорпиридин-4-ил)пирролидин-3-карбонил]аминоэтил)карбаминовой кислоты 17 Следовали общей процедуре С, используя 3,4,5-трихлорпиридин (50 мг, 0,27 ммоль), бензиловый эфир (R,S)-2-[(пирролидин-3-карбонил)амино]этилкарбаминовой кислоты 16 (80 мг, 0,27 ммоль), NMP(3 мл) и триэтиламин (0,11 мл, 0,82 ммоль). Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, МеОН, 99:1), получая целевое соединение в форме твердого вещества белого цвета (61 мг,51%), т.пл. 148-150C; Umax (CHCl3)/см-1 3028, 1716, 1668, 1515, 1464, 1221; m/z (ESI) C20H23Cl2N4O3 требуется 437,1141, найдено [М+Н]+ 437,1142. Промежуточное соединение 18: 3,5-дибром-4-хлорпиридин 18 К раствору 4-(1 Н)-пиридона (0,95 г, 10 ммоль) и гидроксида калия (1,1 г, 20 ммоль) в воде (20 мл),охлажденному до 0C, добавляли бром (3,2 г, 20 ммоль). После перемешивания при этой температуре в течение 75 мин смесь фильтровали, и осадок промывали холодной водой (350 мл) и гексаном (320 мл),получая 3,5-дибром-4-(1 Н)-пиридон в форме твердого вещества белого цвета (2,09 г, 83%). К 3,5-дибром-4-(1 Н)-пиридону (0,25 г, 1,0 ммоль) добавляли POCl3 (2 мл) и смесь нагревали при 100C в течение 2 ч. Смесь лили в смесь лед/вода (25 г) и подщелачивали добавлением насыщенного раствора бикарбоната натрия. Смесь экстрагировали CH2Cl2 (220 мл), объединенные органические экстракты промывали солевым раствором (25 мл), высушивали (MgSO4) и концентрировали при пониженном давлении, получая целевое соединение в форме твердого вещества белого цвета (275 мг, 100%), т.пл. 101-103C; m/z 272 (100%, [М+Н]+). Промежуточное соединение 19: бензиловый эфир (R,S)-(2-[1-(3,5-дибромпиридин-4-ил)пирролидин-3-карбонил]аминоэтил)карбаминовой кислоты 19 Следовали общей процедуре С (см. пример 1), используя 3,5-дибром-4-хлорпиридин 18 (74 мг, 0,27 ммоль), трет-бутиловый эфир (R,S)-3-(2-бензилоксикарбониламиноэтилкарбамоил)пирролидин-1 карбоновой кислоты 16 (80 мг, 0,27 ммоль), NMP (3 мл) и триэтиламин (0,11 мл, 0,82 ммоль). Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, МеОН, 99:1), получая целевое соединение в форме твердого вещества белого цвета (86 мг, 60%), т.пл. 132-134C; Umax (CHCl3)/см-1 3029, 3024,1729, 1665, 1518, 1446, 1249, 1229, 1046, 1016; m/z (ESI) C20H22Br2N4NaO3 требуется 546,9951, найдено Хлор барботировали через раствор 4-пиримидона (1,9 г, 20 ммоль) в ледяной уксусной кислоте (20 мл) в течение 1 ч, и реакционную смесь перемешивали еще в течение 2 ч. Хлор барботировали через раствор в течение еще 15 мин, и смесь перемешивали еще 90 мин. Смесь фильтровали, и осадок промывали гексаном (325 мл), получая целевое соединение в форме твердого вещества белого цвета (2,28 г). Суспензию 5-хлорпиримидон гидрохлорида (1,0 г, 6,0 ммоль) в оксихлориде фосфора (4 мл) нагревали при 90C в течение 90 мин, затем охлаждали до температуры окружающей среды и фильтровали. Сырой продукт очищали возгонкой при пониженном давлении, получая целевое соединение 20 в форме кристаллического твердого вещества белого цвета (273 мг). Это соединение было нестабильным на воздухе, и его использовали немедленно на следующей стадии. Раствор брома (1,0 мл, 20 ммоль) в ледяной уксусной кислоте (10 мл) добавляли за 15 мин через канюлю к раствору 4-пиримидона (1,9 г, 20 ммоль) в ледяной уксусной кислоте (20 мл). После перемешивания в течение 5 ч смесь фильтровали и осадок промывали гексаном (220 мл), получая целевое соединение в форме твердого вещества белого цвета (1,52 г). Суспензию 5-бромпиримидон гидробромида (1,0 г, 3,9 ммоль) в оксихлориде фосфора (4 мл) нагревали при 90C в течение 1 ч, затем охлаждали до 0C. Смесь фильтровали, промывали POCl3 (22 мл),получая целевое соединение в форме твердого вещества кремового цвета (388 мг). Это соединение было нестабильно на воздухе, и его использовали немедленно на следующей стадии. Промежуточное соединение 22: 4-хлор-5-метилпиримидин гидрохлорид 22(3 мл) добавляли суспензию никеля Ренея в воде (20 мл). Смесь нагревали с обратным холодильником в течение 16 ч, затем фильтровали в горячем виде через целит (10 г) и промывали водой (325 мл). Фильтрат упаривали и полученное твердое вещество азеотропно обрабатывали толуолом (250 мл), получая твердое вещество белого цвета (0,75 г, 97%). Смесь 5-метил-3 Н-пиримидин-4-она (0,60 г, 3,6 ммоль) и оксихлорида фосфора (2,0 мл) нагревали при 90C в течение 2,5 ч. Смесь упаривали досуха при пониженном давлении и полученное твердое вещество очищали возгонкой при пониженном давлении, получая целевое соединение в форме твердого вещества белого цвета. Это соединение было нестабильно на воздухе и его использовали немедленно на следующей стадии. Промежуточное соединение 23: 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамид 23 Следовали общей процедуре С (см. пример 1), используя изонипекотамид (380 мг, 3,0 ммоль), 3,4,5 трихлорпиридин (600 мг, 3,3 ммоль), триэтиламин (0,84 мл, 6,0 ммоль) и NMP (18 мл). Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2/EtOH, 95:5-91:9), получая целевое соединение в форме твердого вещества белого цвета (0,676 г, 83%); LC-MS (ESI, 4 мин) R, 1,46 мин, m/z 274 (100%,[М+Н]+); m/z (ESI) C11H13N3OCl2 требуется 273,0436, найдено [М+Н]+ 273,0446. Промежуточное соединение 24: 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карботиоамид 24 К раствору 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамида 23 (40 мг, 0,15 ммоль) в ТГФ (2 мл) добавляли реактив Лоуссона (71 мг, 0,18 ммоль) и смесь нагревали с обратным холодильником в течение 2,5 ч. После охлаждения до температуры окружающей среды смесь лили в насыщенный раствор бикарбоната натрия (20 мл) и экстрагировали EtOAc (220 мл). Объединенные органические экстракты промывали водой (20 мл), солевым раствором (20 мл), высушивали (MgSO4) и концентрировали при пониженном давлении. Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, МеОН,99:1), получая целевое соединение в форме твердого вещества белого цвета (21 мг, 40%), m/z (ESI) Общая процедура С. К раствору N-метилпиперидин-4-карбоксамида 5 (26 мг, 0,18 ммоль) и 3,4,5-трихлорпиридина (33 мг, 0,18 ммоль) в NMP (1,5 мл) добавляли триэтиламин (76 мкл, 0,54 ммоль). Смесь нагревали в микроволновом реакторе при 220C в течение 60 мин, охлаждали до температуры окружающей среды и затем вливали в насыщенный раствор бикарбоната натрия (50 мл). Раствор экстрагировали EtOAc (225 мл),объединенные органические экстракты промывали водой (50 мл), солевым раствором (50 мл), высушивали (MgSO4) и растворитель удаляли при пониженном давлении. Сырой продукт очищали флэшхроматографией на силикагеле (гексан/EtOAc, 1:1), получая целевое соединение в форме твердого вещества белого цвета (46 мг, 88%), т.пл. 175-177C; Umax (CHCl3)/см-1 3462, 3006, 2853, 1665, 1558, 1385,1146, 1096; m/z (ESI) C12H16Cl2N3O требуется 288,0665, найдено [М+Н]+ 288,0664. Пример 2. 1-(3,5-Дихлорпиридин-4-ил)-N,N-диметилпиперидин-4-карбоксамид Е 2 Следовали общей процедуре С, используя N,N-диметилпиперидин-4-карбоксамид 6 (43 мг, 0,27 ммоль), 3,4,5-трихлорпиридин (50 мг, 0,27 ммоль), триэтиламин (76 мкл, 0,54 ммоль) и NMP (1,5 мл). Сырой продукт очищали флэш-хроматографией на силикагеле (гексан/EtOAc, 1:1), получая целевое соединение в форме твердого вещества белого цвета (66 мг, 80%), т.пл. 120-122C; Umax (CHCl3)/см-1 3026,2850, 1631, 1559, 1140, 1092, 934; m/z (ESI) C13H18Cl2N3O требуется 302,0821, найдено [М+Н]+ 302,0823. Пример 3. (1-(3,5-Дихлорпиридин-4-ил)пиперидин-4-ил)(морфолино)метанон Е 3 Следовали общей процедуре С, используя морфолино(пиперидин-4-ил)метанон (21 мг, 0,12 ммоль),3,4,5-трихлорпиридин (23 мг, 0,12 ммоль), триэтиламин (32 мкл, 0,23 ммоль) и NMP (1 мл). Сырой продукт очищали флэш-хроматографией на силикагеле (гексан/EtOAc, 1:1), получая целевое соединение в форме твердого вещества белого цвета (15 мг, 35%), т.пл. 172-174C; Umax (CHCl3)/см-1 3006, 2858, 1632,1559, 1448, 1116, 1020; m/z (ESI) C15H20Cl2N3O2 требуется 344,0927, найдено [М+Н]+ 344,0929. Пример 4. 1-(3-Хлор-5-(3,4-диметоксифенил)пиридин-4-ил)пиперидин-4-карбоксамид Е 4 Общая процедура D. К смеси 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамида 23 (24 мг, 0,088 ммоль), 3,4 диметоксифенилбороновой кислоты (19 мг, 0,11 ммоль) и тетракис(трифенилфосфин)палладия (0) (5 мг,5 мол.%) в ацетонитриле (1 мл) добавляли водный раствор 0,5 М карбоната натрия (0,25 мл, 0,12 ммоль). Смесь нагревали при 150C в микроволновом реакторе в течение 45 мин, затем охлаждали до температуры окружающей среды и очищали на картридже SCX-2 (МеОН, затем NH3 0,5 М в МеОН). Сырой про- 17021828 дукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, МеОН, 10:1), получая неочищенное целевое соединение (7 мг). Дальнейшая очистка препаративной ВЭЖХ (Н 2 О, MeCN,90:10-10:90, 30 мин) давала целевое соединение в форме твердого вещества белого цвета, LC-MS (ESI,3,5 мин) Rt 1,60 мин, m/z 376 (100%, [М+Н]+); m/z (ESI) C19H23ClN3O3 требуется 376,1428, найдено Следовали общей процедуре С, используя бензил-N-(аминоэтил)пиперидин-4-карбоксамид 7 (47 мг,0,27 ммоль), 3,4,5-трихлорпиридин (50 мг, 0,27 ммоль), триэтиламин (76 мкл, 0,54 ммоль) и NMP (1,5 мл). Сырой продукт очищали флэш-хроматографией на силикагеле (гексан/EtOAc, 1:1), получая целевое соединение в форме твердого вещества белого цвета (81 мг, 64%), т.пл. 157-159C; Umax (CHCl3)/см-1 3013, 1670, 1574, 1510, 1231, 1092; m/z (ESI) C18H20Cl4N5O требуется 462,0417, найдено [М+Н]+ 462,0421. Пример 6. 4-(3-Метилпиридин-4-ил)циклогексанкарбоксамид Е 6 Раствор 4-хлор-3-метилпиридин гидрохлорида (50 мг, 30 ммоль) и изонипекотамида (0,12 г, 0,91 ммоль) в воде (1 мл) нагревали при 100C в течение 45 мин в микроволновом реакторе. Реакционную смесь охлаждали до 0C и смесь фильтровали и промывали Et2O (210 мл), получая целевое соединение в форме бесцветного кристаллического твердого вещества (33 мг, 49%), т.пл. 175-177C; m/z (ESI) К раствору 1- (3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамида 23 (100 мг, 0,36 ммоль) и комплекса пероксид водорода, мочевина (72 мг, 0,77 ммоль) в CH2Cl2 (2 мл), охлажденному до 0C, добавляли трифторуксусный ангидрид (0,10 мл, 0,73 ммоль). Через 30 мин раствор нагревали до температуры окружающей среды, после еще 16 ч добавляли насыщенный раствор Na2S2O5 (10 мл). Смесь экстрагировали CH2Cl2 (220 мл), объединенные органические экстракты промывали насыщенным растворомNaHCO3 (20 мл), солевым раствором (20 мл), высушивали (MgSO4) и растворитель удаляли при пониженном давлении. Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2/МеOН, 98:2),получая целевое соединение в форме твердого вещества белого цвета (20 мг, 19%), т.пл. 130-133C; Umax Следовали общей процедуре С, используя 4-бензоилпиперазин 10 (47 мг, 0,25 ммоль), 3,4,5- 18021828 трихлорпиридин (72 мг, 0,39 ммоль), триэтиламин (0,11 мл, 0,78 ммоль) и NMP (1,5 мл). Сырой продукт очищали флэш-хроматографией на силикагеле (гексан/EtOAc, 1:1), получая целевое соединение в форме твердого вещества белого цвета (19 мг, 23%), т.пл. 132-134C; Umax (CHCl3)/см-1 3005, 1627, 1435, 1286,1153, 1010; m/z (ESI) C16H16Cl2N3O требуется 336,0665, найдено [М+Н]+ 336,0661. Пример 9. 1-(4-(3,5-дихлорпиридин-4-ил)пиперазин-1-ил)этанон Е 9 Следовали общей процедуре С, используя ацетилпиперазин (35 мг, 0,27 ммоль), 3,4,5 трихлорпиридин (50 мг, 0,27 ммоль), триэтиламин (0,76 мкл, 0,54 ммоль) и NMP (1,5 мл). Сырой продукт очищали флэш-хроматографией на силикагеле (гексан/EtOAc, 1:1), получая целевое соединение в форме твердого вещества белого цвета (18 мг, 24%), т.пл. 144-146C; Umax (CHCl3)/см-1 3008, 2909, 2856, 1638,1558, 1470, 1441, 1282, 1240, 1152, 1098; m/z (ESI) C11H14Cl2N3O требуется 274,0508, найдено [М+Н]+ 274,0513. Пример 10. 1-(3,5-Дихлорпиридин-4-ил)-4-метилпиперазин Е 10 Следовали общей процедуре С, используя N-метилпиперазин (27 мг, 0,27 ммоль), 3,4,5 трихлорпиридин (50 мг, 0,27 ммоль), триэтиламин (0,76 мкл, 0,54 ммоль) и NMP (1,5 мл). Сырой продукт очищали флэш-хроматографией на силикагеле (гексан/EtOAc, 1:1), получая целевое соединение в форме бесцветного масла (44 мг, 65%), Umax (CHCl3)/см-1 2942, 2849, 2803, 1558, 1449, 1289, 1151; m/z (ESI) Следовали общей процедуре С, используя N-этилпиперазин (31 мг, 0,27 ммоль), 3,4,5 трихлорпиридин (50 мг, 0,27 ммоль), триэтиламин (0,76 мкл, 0,54 ммоль) и NMP (1,5 мл). Сырой продукт очищали флэш-хроматографией на силикагеле (гексан /EtOAc, 1:1), получая целевое соединение в форме бесцветного масла (47 мг, 66%), Umax (CHCl3)/см-1 2975, 2820, 1559, 1448, 1245, 1151, 957; m/z (ESI) Следовали общей процедуре С, используя изонипекотамид (43 мг, 0,34 ммоль), 3,4-дихлорпиридин(50 мг, 0,34 ммоль), триэтиламин (0,14 мл, 1,0 ммоль) и NMP (1,5 мл). Сырой продукт очищали флэшхроматографией на силикагеле (гексан /EtOAc, 1:1), получая целевое соединение в форме бесцветного масла (18 мг, 22%), т.пл. 210-212C; Umax (CHCl3)/см-1 2360, 2342, 1653, 1581, 1382, 1223, 1135, 1041; m/z(0,45 г, 1,0 ммоль) в ацетонитриле и дихлорметане (1:1 смесь, 4 0 мл), охлажденному до 0C, добавляли триметилсилил йодид (0,57 мл, 4,0 ммоль). После перемешивания в течение 60 мин, растворитель удаляли при пониженном давлении, и сырой продукт очищали флэш-хроматографией на силикагеле(CH2Cl2/MeOH, 98:2), получая целевое соединение в форме бесцветного масла (193 мг, 61%), Umax К раствору N-(2-аминоэтил)-1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамида Е 13 (50 мг,0,16 ммоль) в МеОН (5 мл) добавляли бензальдегид (16 мкл, 0,16 ммоль). После перемешивания в течение 2 ч добавляли цианоборгидрид натрия (20 мг, 0,32 ммоль) и смесь перемешивали еще 20 ч. Растворитель удаляли при пониженном давлении, остаток растворяли в EtOAc (20 мл), промывали насыщенным раствором гидрокарбоната натрия (25 мл), солевым раствором (25 мл), высушивали (MgSO4), и растворитель удаляли при пониженном давлении. Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, МеОН, 9:1), получая целевое соединение в форме бесцветного масла К раствору N-(2-аминоэтил)-1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамида Е 13 (50 мг,0,16 ммоль) в МеОН (5 мл) добавляли анизальдегид (19 мкл, 0,16 ммоль). После перемешивания в течение 2 ч добавляли цианоборгидрид натрия (20 мг, 0,32 ммоль) и смесь перемешивали еще 20 ч. Растворитель удаляли при пониженном давлении, остаток растворяли в EtOAc (20 мл), промывали насыщенным раствором гидрокарбоната натрия (25 мл), солевым раствором (25 мл), высушивали(MgSO4) и растворитель удаляли при пониженном давлении. Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, МеОН, 9:1), получая целевое соединение в форме бесцветного масла (13 мг, 19%), Umax (CHCl3)/см-1 3008, 2839, 1660, 1513, 1249, 1174, 1036; m/z (ESI) К раствору N-(2-аминоэтил)-1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамида Е 13 (50 мг,0,16 ммоль) в МеОН (5 мл) добавляли циклогексанкарбальдегид (19 мкл, 0,16 ммоль). После перемешивания в течение 2 ч добавляли цианоборгидрид натрия (20 мг, 0,32 ммоль) и смесь перемешивали еще 16 ч. Растворитель удаляли при пониженном давлении, остаток растворяли в EtOAc (20 мл), промывали насыщенным раствором гидрокарбоната натрия (25 мл), солевым раствором (25 мл), высушивали (MgSO4),и растворитель удаляли при пониженном давлении. Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, МеОН, 9:1), получая целевое соединение в форме твердого вещества белого цвета (15 мг, 23%), т.пл. 174-177C; Umax (CHCl3)/см-1 2932, 2856, 1665, 1558, 1457, 1236,1146, 1037; m/z (ESI) C20H31Cl22N4O требуется 413,1869, найдено [М+Н]+ 413,1875. Пример 17. N-(2-(Дибензиламино)этил)-1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамид Е 17 К раствору N-(2-аминоэтил)-1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамида Е 13 (20 мг,0,060 ммоль) в МеОН (2 мл) добавляли бензальдегид (19 мкл, 0,19 ммоль). После перемешивания в течение 45 мин добавляли цианоборгидрид натрия (12 мг, 0,19 ммоль) и смесь перемешивали еще 16 ч. Растворитель удаляли при пониженном давлении, остаток растворяли в EtOAc (20 мл), промывали насыщенным раствором гидрокарбоната натрия (25 мл), солевым раствором (25 мл), высушивали (MgSO4) и растворитель удаляли при пониженном давлении. Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, МеОН, 9:1), получая целевое соединение в форме твердого вещества белого цвета (14 мг, 54%), т.пл. 147-149C; Umax (CHCl3)/см-1 3007, 2837, 1658, 1558, 1509, 1457,1146; m/z (ESI) C27H31Cl2N4O требуется 497,1869, найдено [М+Н]+ 497,1872. Пример 18. N-(2-(бис(циклогексилметил)амино)этил)-1-(3,5-дихлорпиридин-4-ил)пиперидин-4 карбоксамид Е 18 К раствору N-(2-аминоэтил)-1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамида Е 13 (20 мг,0,060 ммоль) в МеОН (2 мл) добавляли циклогексанкарбальдегид (23 мкл, 0,19 ммоль). После перемешивания в течение 30 мин добавляли цианоборгидрид натрия (12 мг, 0,19 ммоль) и смесь перемешивали еще 16 ч. Растворитель удаляли при пониженном давлении, остаток растворяли в EtOAc (20 мл), промывали насыщенным раствором гидрокарбоната натрия (25 мл), солевым раствором (25 мл), высушивали(MgSO4) и растворитель удаляли при пониженном давлении. Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, MeOH, 9:1), получая целевое соединение в форме твердого вещества белого цвета (28 мг, 87%), т.пл. 236-238C; Umax (CHCl3)/см-1 2926, 2852, 1656, 1510,1384, 1099; m/z (ESI) C27H42Cl2N4O требуется 509,2808, найдено [М+Н]+ 509,2808. Пример 19. N-(2-Бензамидоэтил)-1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамид Е 19DIPEA (82 мкл, 0,47 ммоль). Через 16 ч смесь лили в насыщенный раствор бикарбоната натрия (50 мл) и экстрагировали EtOAc (225 мл). Объединенные органические экстракты промывали водой (50 мл), насыщенным раствором лимонной кислоты (50 мл), водой (50 мл) и солевым раствором (50 мл), высушивали (MgSO4) и концентрировали при пониженном давлении. Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, MeOH, 9:1), получая целевое соединение в форме- 21021828 твердого вещества белого цвета (24 мг, 36%), т.пл. 209-211C; Umax (CHCl3)/см-1 3029, 3006, 1656, 1523,1385, 1228, 1017; m/z (ESI) C20H22Cl2N4NaO2 требуется 443,1012, найдено [M+Na]+ 443,1013. Пример 20. (1-(3,5-Дихлорпиридин-4-ил)пиперидин-4-ил)(пиперазин-1-ил)метанон Е 20 К раствору бензил-4-(1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбонил)пиперазин-1-карбоксилата 13 (40 мг, 0,080 ммоль) в DCM (1 мл), охлажденному до 0C, добавляли триметилсилилйодид (24 мкл,0,16 ммоль) и раствор перемешивали при этой температуре в течение 90 мин, после чего добавляли триметилсилилйодид (48 мкл, 0,32 ммоль) и смесь нагревали до температуры окружающей среды. После перемешивания в течение еще 45 мин раствор концентрировали при пониженном давлении и сырой продукт очищали на картридже SCX-2 (МеОН, затем NH3 0,5 М в МеОН), получая целевое соединение в форме твердого вещества желтого цвета (27 мг, 94%), т.пл. 256-258C; m/z (ESI) C15H20Cl2N4NaO требуется 365,0906, найденный [M+Na]+ 365,0909. Пример 21. 1-(3,5-Дихлорпиридин-4-ил)пирролидин-3-карбоксамид Е 21 Раствор 1-(3,5-дихлорпиридин-4-ил)пирролидин-3-карбонитрила 14 (83 мг, 0,34 ммоль) в серной кислоте (3 мл) перемешивали в течение 90 мин и затем лили на смесь лед/вода (100 г). Смесь подщелачивали добавлением 2 М раствора гидроксида натрия и экстрагировали EtOAc (250 мл). Объединенные органические экстракты промывали водой (50 мл), солевым раствором (50 мл), высушивали (MgSO4) и концентрировали при пониженном давлении, получая целевое соединение в форме твердого вещества белого цвета (65 мг, 73%), т.пл. 161-163C; Umax (CHCl3)/см-1 3053, 2985, 1689, 1558, 1465; m/z (ESI) Следовали общей процедуре С, используя 3,5-дибром-4-хлорпиридин (71 мг, 0,26 ммоль), 3 цианопирролидин (25 мг, 0,26 ммоль), NMP (3 мл) и триэтиламин (72 мкл, 0,52 ммоль). Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, MeOH, 99:1), получая целевое соединение Е 22 в форме твердого вещества белого цвета (9 мг, 10%), т.пл. 159-161C; Umax (CHCl3)/см-1 3022, 3008, 1678,1591, 1446, 1235; m/z (ESI) C10H12Br2N3O требуется 347,9342, найдено [М+Н]+ 347,9339. Также в результате процедуры очистки выделяли 1-(3,5-дибромпиридин-4-ил)пирролидин-3 карбонитрил Е 23 в форме бесцветного масла (13 мг, 15%), Umax (CHCl3) /см-1 3014, 2988, 2246, 1731, 1451,1374, 1248, 1045, 1016; m/z (ESI) C10H10Br2N3 требуется 329,9236, найдено [М+Н]+ 329,9238. Пример 24. (2-Аминоэтил)амид (R,S)-1-(3,5-дихлорпиридин-4-ил)пирролидин-3-карбоновой кислоты Е 24 К раствору бензилового эфира (R,S)-(2-[1-(3,5-дихлорпиридин-4-ил)пирролидин-3-карбонил]аминоэтил)карбаминовой кислоты 17 (50 мг, 0,11 ммоль) в дихлорметане (2 мл), охлажденному до 0C,- 22021828 добавляли йодтриметилсилан (66 мкл, 0,46 ммоль). После перемешивания при этой температуре в течение 2 ч растворитель удаляли при пониженном давлении и сырой продукт очищали на картридже SCX-2(МеОН, затем NH3 0,5 М в МеОН), получая целевое соединение в форме бесцветного масла (16 мг, 46%),Umax (CHCl3)/см-1 3014, 1731, 1664, 1559, 1519, 1465, 1248, 1046; m/z (ESI) C12H16Cl2N4NaO требуется 325,0593, найдено [M+Na]+ 325,0595. Пример 25. (2-Аминоэтил)амид 1-(3,5-дибромпиридин-4-ил)пирролидин-3-карбоновой кислоты Е 25(65 мг, 0,12 ммоль) в дихлорметане (2 мл), охлажденному до 0C, добавляли йодтриметилсилан (70 мкл,0,49 ммоль). После перемешивания при этой температуре в течение 2 ч растворитель удаляли при пониженном давлении и сырой продукт очищали на картридже SCX-2 (МеОН, затем NH3 0,5 М в МеОН), получая целевое соединение в форме бесцветного масла (40 мг, 83%), Umax (CHCl3)/см-1 3022, 2871, 1664,1556, 1450, 1399; m/z (ESI) C12H16Br2N4NaO требуется 412,9583, найдено [М+Н]+ 412,9582. Пример 26. 4-(3,5-Диметилпиридин-4-ил)циклогексанкарбоксамид Е 26 Раствор 4-хлор-3,5-диметилпиридин гидрохлорида (0,10 г, 0,56 ммоль) и изонипекотамида (0,22 мг,1,7 ммоль) в воде (1,5 мл) нагревали при 175C в течение 60 мин в микроволновом реакторе. Смесь лили в насыщенный раствор бикарбоната натрия (20 мл), экстрагировали EtOAc (220 мл). Объединенные органические экстракты высушивали (MgSO4) и концентрировали при пониженном давлении. Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, МеОН, 95:5), получая целевое соединение в форме твердого вещества белого цвета (5 мг, 4%), m/z 234 (100%, [М+Н]+); m/z (ESI) C13H20N3O требуется 234,1601, найдено [М+Н]+ 234,1600. Пример 27. 1-(3,5-Дибромпиридин-4-ил)пиперидин-4-карбоксамид Е 27 Следовали общей процедуре С, используя 3,5-дибром-4-хлорпиридин 18 (50 мг, 0,18 ммоль), изонипекотамид (24 мг, 0,18 ммоль), NMP (2 мл) и триэтиламин (51 мкл, 0,37 ммоль). Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, МеОН, 9:1), получая целевое соединение в форме твердого вещества светло-желтого цвета (29 мг, 43%), т.пл. 158-160C; Umax К раствору 4,5-дихлорпиримидин гидрохлорида 20 (0,20 г, 1,1 ммоль) в DMF (4 мл) добавляли триэтиламин (1,5 мл, 10 ммоль). После перемешивания в течение 30 мин добавляли раствор изонипекотамида (0,42 мг, 3,3 ммоль) в DMF (4 мл) и смесь перемешивали при температуре окружающей среды еще 16 ч. Смесь лили в насыщенный раствор бикарбоната натрия (50 мл) и экстрагировали EtOAc (225 мл). Объединенные органические экстракты промывали водой (25 мл), солевым раствором (25 мл), высушивали (MgSO4) и концентрировали при пониженном давлении. Сырой продукт очищали флэшхроматографией на силикагеле (CH2Cl2, МеОН, градиент 98:2-96:4), получая целевое соединение в форме твердого вещества белого цвета (51 мг, 20%), т.пл. 201-202C; Umax (CHCl3)/см-1 3023, 3014, 1724, 1682,1448, 1360, 1219, 1037; m/z (ESI) C10H14CN4O требуется 241,0851, найдено [М+Н]+ 241,0851. Пример 29. 1-(5-Бромпиримидин-4-ил)пиперидин-4-карбоксамид Е 29 К раствору 5-бром-4-хлорпиримидин гидрохлорида 21 (0,10 г, 0,36 ммоль) в DMF (2 мл) добавляли триэтиламин (0,51 мл, 3,6 ммоль). После перемешивания в течение 30 мин добавляли раствор изонипекотамида (0,14 г, 1,1 ммоль) в DMF (2 мл) и смесь перемешивали при температуре окружающей среды еще 16 ч. Смесь лили в насыщенный раствор бикарбоната натрия (50 мл) и экстрагировали EtOAc (225 мл). Объединенные органические экстракты промывали водой (25 мл), солевым раствором (25 мл), высушивали (MgSO4) и концентрировали при пониженном давлении. Сырой продукт очищали флэшхроматографией на силикагеле (CH2Cl2, МеОН, 98:2), получая целевое соединение в форме твердого вещества белого цвета (60 мг, 58%), т.пл. 188-190C; Umax (CHCl3)/см-1 3012, 2853, 1682, 1566, 1447, 1359,1144, 1017, 950; m/z (ESI) C10H14BrN4O требуется 285,0346, найдено [М+Н]+ 285,0344. Пример 30. 1-(5-Метилпиримидин-4-ил)пиперидин-4-карбоксамид Е 30 К раствору 5-метил-4-хлорпиримидин гидрохлорида 22 (75 мг, 0,45 ммоль) в DMF (2 мл) добавляли триэтиламин (0,63 мл, 4,5 ммоль). После перемешивания в течение 15 мин добавляли раствор изонипекотамида (64 мг, 0,50 ммоль) в DMF (2 мл) и смесь перемешивали при температуре окружающей среды еще 20 ч. Смесь лили в насыщенный раствор бикарбоната натрия (50 мл) и экстрагировали EtOAc (225 мл). Объединенные органические экстракты промывали водой (25 мл), солевым раствором (25 мл), высушивали (MgSO4) и концентрировали при пониженном давлении. Сырой продукт очищали флэшхроматографией на силикагеле (CH2Cl2, МеОН, градиент от 98:2 до 9:1), получая целевое соединение в форме твердого вещества белого цвета (25 мг, 25%), т.пл. 182-184C; Umax (CHCl3)/см-1 3024, 1678, 1581,1439, 1359, 1147, 948; m/z (ESI) C11H17N4O требуется 221,1397, найдено [М+Н]+ 221,1394. Пример 31. 1-(5-Бром-2-хлорпиримидин-4-ил)пиперидин-4-карбоксамид Е 31 К раствору 5-бром-2,4-дихлорпиримидина (0,11 г, 0,50 ммоль) и изонипекотамиде (77 мг, 0,60 ммоль) в DMF (2 мл) добавляли триэтиламин (77 мкл, 0,55 ммоль) и смесь перемешивали при температуре окружающей среды в течение 4,5 ч. Смесь лили в насыщенный раствор бикарбоната натрия (10 мл) и экстрагировали EtOAc (210 мл). Объединенные органические экстракты промывали водой (10 мл), солевым раствором (10 мл), высушивали (MgSO4) и концентрировали при пониженном давлении. Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, МеОН, 98:2), получая целевое соединение в форме твердого вещества белого цвета (174 мг, 95%), m/z (ESI) C10H12BrClN4NaO требуется 340,9775 найдено [M+Na]+ 340,9776. Пример 32. 1-(2-Хлор-5-фенилпиримидин-4-ил)пиперидин-4-карбоксамид Е 32 К раствору 1-(5-бром-2-хлорпиримидин-4-ил)пиперидин-4-карбоксамида Е 31 (0,10 г, 0,31 ммоль),бензолбороновой кислоты (46 мг, 0,38 ммоль) и тетракис (трифенилфосфин)палладия (0) (20 мг, 5 мол.%) в DME (8 мл) добавляли раствор 0,5 М карбоната натрия. Смесь нагревали с обратным холодильником в течение 22 ч, затем охлаждали до температуры окружающей среды и очищали на картридже SCX-2 (МеОН, затем NH3 0,5 М в МеОН). Сырой продукт очищали хроматографией на силикагеле (CH2Cl2, МеОН,98:2), получая целевое соединение в форме твердого вещества белого цвета (58 мг, 59%), m/z 317 (100%,МН+); m/z (ESI) Смесь 1-(2-хлор-5-фенилпиримидин-4-ил)пиперидин-4-карбоксамида Е 32 (35 мг, 0,11 ммоль), ацетата калия (22 мг, 0,22 ммоль) и 10 вес.% палладия на углероде (3,5 мг) в уксусной кислоте (2 мл) перемешивали под атмосферой водорода (1 атм.) в течение 18 ч. Смесь фильтровали через целит, промывали АсОН (210 мл) и концентрировали при пониженном давлении. Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2/MeOH, 10:1), получая целевое соединение в форме твердого вещества белого цвета (9 мг, 29%) m/z 283 (100%, [М+Н]+); m/z (ESI) C16H19N4O требуется 283,1553, найдено [М+Н]+ 283,1549. Пример 35. 2-(1-(3,5-Дихлорпиридин-4-ил)пиперидин-4-ил)тиазол Е 34 К раствору 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карботиоамида 24 (23 мг, 0,079 ммоль) в этаноле (2 мл) добавляли хлорацетальдегид (50 вес.% в Н 2 О) (0,26 мл, 0,16 ммоль) и смесь нагревали с обратным холодильником в течение 17 ч. Смесь концентрировали и к остатку добавляли хлороформ (10 мл). Раствор промывали водой (10 мл) и экстрагировали хлороформом (10 мл). Объединенные органические экстракты промывали солевым раствором (10 мл), высушивали (MgSO4) и концентрировали при пониженном давлении, получая коричневое масло (40 мг). Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, МеОН, 10:1, затем гексан, EtOAc, 1:1), получая целевое соединение в форме твердого вещества светло-коричневого цвета (5 мг, 20%), LC-MS (ESI) Rt 2,79 мин, m/z 314 (100%, М+). Пример 35. 2-(1-(3,5-Дихлорпиридин-4-ил)пиперидин-4-ил)оксазол Е 35 К раствору 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамида 23 (0,10 г, 0,36 ммоль) в полифосфорной кислоте (5 мл) при 80C добавляли виниленкарбонат (35 мг, 0,40 ммоль). Смесь нагревали при 170C в течение 4 ч, охлаждали до температуры окружающей среды и вливали в воду (200 мл). Смесь экстрагировали этилацетатом (350 мл) и объединенные органические экстракты промывали водой (100 мл), насыщенным раствором бикарбоната натрия (50 мл), водой (50 мл), солевым раствором (50 мл), высушивали (MgSO4) и концентрировали при пониженном давлении, получая бесцветное масло (12 мг). Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, МеОН, 10:1, затем гексан, EtOAc, 1:1), получая целевое соединение в форме твердого вещества белого цвета Следовали общей процедуре С, используя 3-бром-4-хлорпиридин (0,10 г, 0,52 ммоль) и изонипекотамид (67 мг, 0,52 ммоль) NMP (2 мл) и триэтиламин (0,14 мл, 1,0 ммоль). Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, МеОН, градиент от 99:1 до 95:5), получая целевое соединение в форме твердого вещества белого цвета (49 мг, 33%), LC-MS (ESI) Rt 0,80 мин, m/z 284 (100%,[М+Н]+); m/z (ESI) C11H15BrN3O требуется 284,0393, найдено [М+Н]+ 284,0392. Пример 37. 1-(3-(4-Метоксифенил)пиридин-4-ил)пиперидин-4-карбоксамид Е 37 Следовали общей процедуре D (см. пример 4), используя 1-(3-бромпиридин-4-ил)пиперидин-4 карбоксамид Е 36 (50 мг, 0,17 ммоль), 4-метоксифенилбороновую кислоту (32 мг, 0,21 ммоль), тетракис(трифенилфосфин)палладий (0) (10 мг, 5 мол.%), ацетонитрил (1,2 мл) и 0,5 М карбоната натрия (0,49 мл, 0,25 ммоль) в течение 50 мин. Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2,МеОН, градиент от 97:3 до 95:5), получая целевое соединение в форме твердого вещества белого цвета Следовали общей процедуре D (см. пример 4), используя 1-(3-бромпиридин-4-ил)пиперидин-4 карбоксамид Е 36 (25 мг, 0,088 ммоль), тиофен-2-бороновую кислоту (13 мг, 0,11 ммоль), тетракис(трифенилфосфин)палладий (0) (5 мг, 5 мол.%), ацетонитрил (1 мл) и 0,5 М карбоната натрия (0,25 мл, 0,12 ммоль) в течение 30 мин. Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, МеОН, 10:1), получая целевое соединение в форме твердого вещества белого цвета (23 мг, 91%), LC-MS (ESI) Rt 1,17 мин, m/z 288 (100%, [М+Н]+); m/z (ESI) C15H18N3OS требуется 288,1165, найдено [М+Н]+ 288,1163. Примеры 39 и 40. 1-(3-Бром-5-фенилпиридин-4-ил)пиперидин-4-карбоксамид Е 39 и 1-(3,5 дифенилпиридин-4-ил)пиперидин-4-карбоксамид Е 40 К раствору 1-(3,5-дибромпиридин-4-ил)пиперидин-4-карбоксамида Е 27 (50 мг, 0,14 ммоль), бензолбороновой кислоты (70 мг, 0,58 ммоль) и фосфата калия (0,20 г, 0,96 ммоль) в толуоле (1,5 мл) добавляли тетракис(трифенилфосфин)палладий (0) (18 мг, 0,014 ммоль). Смесь нагревали при 170C в микроволновом реакторе в течение 45 мин, затем вливали в насыщенный раствор бикарбоната натрия (25 мл). Смесь экстрагировали EtOAc (225 мл) и объединенные органические экстракты промывали водой (25 мл), солевым раствором (25 мл), высушивали (MgSO4), и растворитель удаляли при пониженном давлении. Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, МеОН, 98:2), получая 2:3 смесь продуктов моно- и бис-сочетания. Аналитические образцы затем очищали препаративной ВЭЖХ (MeCN,H2O 5:95): К раствору 1-(3,5-дибромпиридин-4-ил)пиперидин-4-карбоксамида Е 27 (50 мг, 0,14 ммоль), 4 трифторметилбензолбороновой кислоты (0,11 г, 0,56 ммоль) и фосфата калия (0,20 г, 0,96 ммоль) в толуоле (4 мл) добавляли тетракис(трифенилфосфин)палладий (0) (18 мг, 10 мол.%). Смесь нагревали при 170C в микроволновом реакторе в течение 60 мин, затем вливали в насыщенный раствор гидрокарбоната натрия (25 мл). Смесь экстрагировали EtOAc (220 мл) и объединенные органические экстракты промывали водой (25 мл), солевым раствором (25 мл), высушивали (MgSO4) и растворитель удаляли при пониженном давлении. Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, МеОН,98:2) и далее очищали препаративной ВЭЖХ (Н 2 О, MeCN, градиент от 90:10 до 10:90 за 30 мин) (11 мг,9%), m/z (ESI) C18H18BrF3N3O требуется 428,0580, найдено [М+Н]+ 428,0574. Пример 42. 1-(3-Хлор-5-фенилпиридин-4-ил)пиперидин-4-карбоксамид Е 42 Следовали общей процедуре D (см. пример 4), используя 1-(3,5-дихлорпиридин-4-ил)пиперидин-4 карбоксамид 23 (24 мг, 0,088 ммоль), бензолбороновую кислоту (13 мг, 0,11 ммоль), тетракис(трифенилфосфин)палладий (0) (5 мг, 5 мол.%), ацетонитрил (1 мл) и 0,5 М карбоната натрия (0,25 мл, 0,12 ммоль) в течение 30 мин. Сырой продукт очищали препаративной ВЭЖХ (Н 2 О, MeCN, градиент от 90:10 до 10:90 за 30 мин), получая целевое соединение в форме твердого вещества белого цвета (6 мг,22%), LC-MS (ESI) Rt 1,63 мин, m/z 316 (100%, [М+Н]+); m/z (ESI) C17H18ClN3NaO требуется 338,1031,найдено [M+Na]+ 338,1030. Пример 43. 1-(3-Хлор-5-(4-метоксифенил)пиридин-4-ил)пиперидин-4-карбоксамид Е 43 Следовали общей процедуре D (см. пример 4), используя 1-(3,5-дихлорпиридин-4-ил)пиперидин-4 карбоксамид (24 мг, 0,088 ммоль), 4-метоксибензолбороновую кислоту (16 мг, 0,11 ммоль), тетракис(трифенилфосфин)палладий (0) (5 мг, 5 мол.%), ацетонитрил (1 мл) и 0,5 М карбоната натрия (0,25 мл, 0,12 ммоль) в течение 30 мин. Сырой продукт очищали препаративной ВЭЖХ (CH3CN, H2O, 23:77),получая целевое соединение в форме твердого вещества белого цвета (9 мг, 30%), LC-MS (ESI) Rt 1,67 мин, m/z 346 (100%, [М+Н]+); m/z (ESI) C18H21ClN3O2 требуется 346,1317, найдено [М+Н]+ 346,1317. Пример 44. 1-(3-Хлор-5-(1 Н-пиразол-5-ил)пиридин-4-ил)пиперидин-4-карбоксамид Е 44 Следовали общей процедуре D (см. пример 4), используя 1-(3,5-дихлорпиридин-4-ил)пиперидин-4 карбоксамид (24 мг, 0,088 ммоль), пинаколовый эфир 1 Н-пиразол-5-бороновой кислоты (19 мг, 0,11 ммоль), тетракис(трифенилфосфин)палладий (0) (5 мг, 5 мол.%), ацетонитрил (1 мл) и 0,5 М карбоната натрия (0,25 мл, 0,12 ммоль) в течение 30 мин. Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, МеОН, 10:1), получая целевое соединение в форме твердого вещества белого цвета (18 мг, 67%), LC-MS (ESI) Rt 1,06 мин, m/z 306 (100%, [М+Н]+); m/z (ESI) Общая процедура Е. К суспензии 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамида 23 (75 мг, 0,27 ммоль), пинаклового эфира 1,5-диметил-4-пиразолбороновой кислоты (76 мг, 0,34 ммоль) и тетракис(трифенилфосфин)палладия (0) (16 мг, 5 мол.%) в ацетонитриле (3 мл) добавляли раствор 0,5 М карбоната натрия (0,77 мл, 0,38 ммоль). Смесь нагревали в микроволновом реакторе при 150C в течение 45 мин. После охлаждения реакционную смесь концентрировали в вакууме и в сухом виде загружали на силикагель. Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, EtOH, 97:3-80:20,biotage 25 + S), получая целевое соединение в форме прозрачного бесцветного масла (24 мг, 26%), LCMS (ESI, 4 мин) Rt 1,49 мин, m/z 334 (100%, [М+Н]+); m/z (ESI) C16H20N5OCl требуется 333,1356, найдено Следовали общей процедуре Е, используя 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамид(75 мг, 0,27 ммоль), 2-(метилтио)пиримидин-5-бороновую кислоту (58 мг, 0,34 ммоль), тетракис(трифенилфосфин)палладий (0) (16 мг, 5 мол.%), ацетонитрил (3 мл) и 0,5 М карбоната натрия (0,77 мл, 0,38 ммоль). Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, EtOH, 96:482:18, biotage 25+S), получая целевое соединение в форме твердого вещества грязно-белого цвета (11 мг,11%), наряду с рекуперируемым 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамидом в форме твердого вещества белого цвета (41 мг, 55% RSM), LC-MS (ESI, 4 мин) Rt 2,14 мин, m/z 364 (100%, [М+Н]+); Следовали общей процедуре Е, используя 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамид(75 мг, 0,27 ммоль), 1,3-диметил-4-пинаколборонил-1 Н-пиразол (76 мг, 0,34 ммоль), тетракис(трифенилфосфин)палладий (0) (16 мг, 5 мол.%), ацетонитрил (3 мл) и 0,5 М карбоната натрия (0,77 мл, 0,38 ммоль). Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, EtOH, 94:680:20, biotage 25 + S), получая целевое соединение в форме твердого вещества белого цвета (16 мг, 18%),наряду с рекуперируемым 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамидом (30 мг, 40% RSM),LC-MS (ESI, 4 мин) Rt 1,40 мин, m/z 334 (100%, [М+Н]+); m/z (ESI) C16H20N5OCl требуется 333,1356, найдено [М+Н]+ 333,1356. Следовали общей процедуре С, используя 3,4,5-трихлорпиридин (0,50 г, 2,7 ммоль), изонипекотамид (0,30 мг, 2,7 ммоль), NMP (15 мл) и триэтиламин (0,76 мл, 5,5 ммоль). Сырой продукт очищали флэш-хроматографией на силикагеле (CH2Cl2, МеОН, 99:1), получая целевое соединение в форме твердого вещества белого цвета (228 мг, 33%), m/z (ESI) C11H12Cl2N3 требуется 256,0403, найдено [М+Н]+ 256,0409. Пример 49. 1-(3,5-Дихлорпиридин-4-ил)-4-метилпиперидин-4-карбонитрил Е 49(1,5 мл) при -78C добавляли 1 М раствор LDA в ТГФ (0,38 мл, 0,38 ммоль). Смесь перемешивали в течение 30 мин при -78C перед нагреванием до температуры окружающей среды. Через 60 мин добавляли метилйодид (31 мкл, 0,5 ммоль). Смесь перемешивали еще 60 мин при температуре окружающей среды в течение 1 ч, после чего добавляли воду (5 мл). Смесь экстрагировали CH2Cl2 (35 мл), и объединенные органические экстракты высушивали над MgSO4 и концентрировали при пониженном давлении досуха. Сырой продукт очищали флэш-хроматографией на силикагеле (гексан, EtOAc, 100:0-80:20, biotage 25+M), получая целевое соединение в форме твердого вещества белого цвета (34 мг, 36%), наряду с рекуперируемым 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбонитрилом (23 мг, 25%), LC-MS (ESI, 4 мин) Rt 3,09 мин, m/z 270 (100%, m+); m/z (ESI) C12H13Cl2N3 требуется 269,0487, найдено [М+Н]+ 289,0488. Пример 50. 1-(3-Хлор-5-(4-фторфенил)пиридин-4-ил)пиперидин-4-карбоксамид Е 50 Следовали общей процедуре D, используя 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамид(24 мг, 0,088 ммоль), 4-фторбензолбороновую кислоту (15 мг, 0,11 ммоль) и тетракис(трифенилфосфин)палладий (0) (5 мг, 5 мол.%), ацетонитрил (1 мл) и 0,5 М карбоната натрия (0,25 мл, 0,12 ммоль) в течение 30 мин. Сырой продукт очищали препаративной тонкослойной хроматографией на силикагеле (CH2Cl2, МеОН, 10:1), получая неочищенное целевое соединение (19 мг), которое затем очищали препаративной ВЭЖХ (CH3CN, Н 2 О, градиент от 1:9 до 9:1), получая целевое соединение в форме твердого вещества белого цвета, LC-MS (ESI, 3,5 мин) Rt 1,71 мин, m/z 334 (100%, [М+Н]+); m/z Следовали общей процедуре D, используя 1-(3,5-дихлорпиридин-4-ил)пиперидин-4-карбоксамид
МПК / Метки
МПК: C07D 471/10, C07D 401/04, C07D 417/14, C07D 413/14, A61K 31/5377, A61K 31/4545, C07D 401/14, C07D 409/14
Метки: соединения, пиримидина, рака, лечения, качестве, пиридина, ингибиторов, пути, сигнального, основе
Код ссылки
<a href="https://eas.patents.su/30-21828-soedineniya-na-osnove-piridina-i-pirimidina-v-kachestve-ingibitorov-signalnogo-puti-wnt-dlya-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения на основе пиридина и пиримидина в качестве ингибиторов сигнального пути wnт для лечения рака</a>
Предыдущий патент: Способ установки сжимаемого контейнера с напитком в блоке распределения напитка
Следующий патент: Переработка биомассы
Случайный патент: N-бензиламиды, содержащая их фармацевтическая композиция, их применение и способы лечения