Соединения, модулирующие андрогеновые рецепторы
Номер патента: 21170
Опубликовано: 30.04.2015
Авторы: Сало Харри, Весалайнен Анниина, Хеглунд Ииса, Раску Сирпа, Вольфарт Герд, Кнууттила Пиа, Хольм Патрик, Термякангас Олли, Карьялайнен Арья
Формула / Реферат
1. Соединение, представленное формулами (III), (IV) или (V)
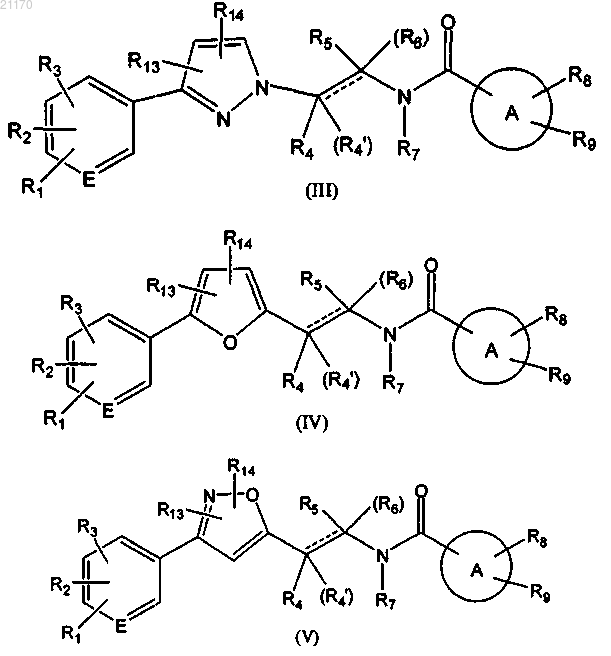
где R1 представляет собой водород, галоген, циано или нитро;
R2 представляет собой водород, галоген, циано, нитро, C1-7алкил, галоген-С1-7алкил, тио-С1-7алкил или С1-7алкокси;
R3 представляет собой водород, галоген или С1-7алкил или
R2 и R3 вместе с атомами углерода, к которым они присоединены, образуют пиридильное кольцо;
где по меньшей мере два из R1, R2 и R3 не представляют собой водород;
R4 представляет собой водород, C1-7алкил или гидрокси-С1-7алкил;
R4', R7 и R14 представляют собой водород;
R5 и R6 независимо представляют собой водород или С1-7алкил;
кольцевой атом Е представляет собой С или N;
пунктирная линия обозначает необязательную двойную связь;
А представляет собой 5-6-членное гетероциклическое кольцо, включающее от 1 до 3 гетероатомов, выбранных из N, О и S;
R8 представляет собой водород, гидрокси, галоген, амино, оксо, С1-7алкил, С1-7алкокси, галоген-С1-7алкил, гидрокси-С1-7алкил, циано-С1-7алкил, амино-С1-7алкил, оксо-С1-7алкил, 2-(диметиламино)ацетоксиэтил, 1-ацетоксиэтил, 2-ацетоксипропил, метоксикарбониламино, С1-7алкокси-С1-7алкил, 1-гидроксициклопентил, 1-пивалоилоксиэтил, метилсульфонамидо-С1-7алкил, оксиран-С1-7алкил, С1-7алкиламино, гидрокси-С1-7алкиламино, С1-7алкокси-С1-7алкиламино, С1-7алкиламино-С1-7алкил, гидрокси-С1-7алкиламино-С1-7алкил, гидроксиимино-С1-7алкил, галоген-С1-7алкилгидрокси-С1-7алкил, -C(O)R10, -NH-C(O)R18 или 5-фуранил, 2-метилфуран-5-ил, пиридинил, пиразолил, 1-бензилимидазолил, тиазолил, имидазолил, имидазол-1-илметил, пирролидин-1-илметил, 2,5-диоксопирролидин-1-илметил, морфолинил, морфолин-4-илметил или пиперидинильное кольцо, необязательно замещенное C1-C7-алкилом или мезилом;
R9 представляет собой водород, С1-7алкил, оксо, оксо-С1-7алкил или фенил или
R8 и R9 вместе с атомами кольца А, к которому они присоединены, образуют 5- или 6-членное насыщенное или ненасыщенное кольцо, которое может включать 1-2 гетероатома, выбранных из О, S и N, которое может быть замещено атомом галогена;
R10 представляет собой гидрокси, С1-7алкил, С1-7алкокси, NR11R12 или пиперазинильное, пиперидинильное, морфолинильное кольцо, необязательно замещенное гидрокси, C1-C7-алкилом, гидрокси-C1-C7-алкилом, оксо-C1-C7-алкилом или морфолинилом;
R11 представляет собой водород, С1-7алкил или гидрокси-С1-7алкил;
R12 представляет собой водород или С1-7алкил;
R13 представляет собой водород, галоген или
R18 представляет собой С1-7алкиламино-С1-7алкил;
и его фармацевтически приемлемые соли.
2. Соединение по п.1, где кольцо А вместе с R8 и R9, образуя конденсированное кольцо, представляет собой одну из следующих групп или их таутомеров:
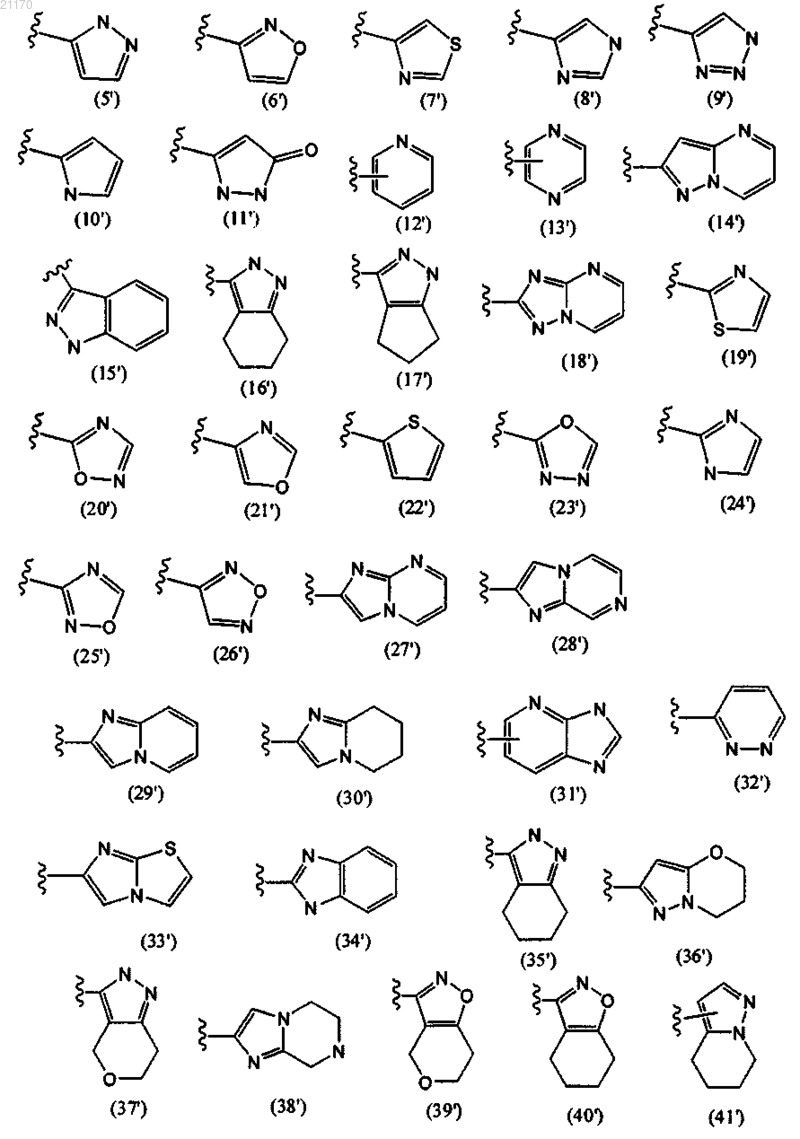
3. Соединение по любому из пп.1 или 2, где
кольцевой атом Е представляет собой С;
R1 представляет собой галоген, С1-7алкил, циано, нитро или галоген-С1-7алкил;
R2 представляет собой циано, галоген или нитро;
R3 представляет собой водород, галоген или С1-7алкил;
А является любой одной из групп (5'), (6'), (7'), (8'), (12'), (20') или (21') или их таутомеров;
R13 и R14 представляют собой водород;
R4 представляет собой водород или метил;
R4' представляет собой водород;
R5 представляет собой водород или С1-7алкил;
R6 (если приемлемо) представляет собой водород;
R8 представляет собой водород, С1-7алкил, гидрокси-С1-7алкил, галоген, гидроксиимино-С1-7алкил или
-C(O)R10, где
R10 представляет собой С1-7алкил;
R9 представляет собой водород или С1-7алкил.
4. Соединение по п.1, представленное формулой (VI)
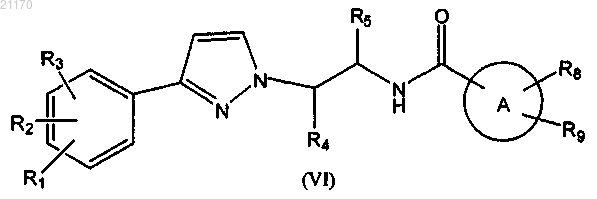
где R1 представляет собой галоген, метил, циано, нитро или трифторметил;
R2 представляет собой циано, галоген или нитро;
R3 представляет собой водород, галоген или метил;
R4 представляет собой водород или метил;
R5 представляет собой водород или C1-3алкил.
5. Соединение по п.4, где
R1 представляет собой галоген;
R2 представляет собой циано;
R3 представляет собой водород, галоген или метил;
R4 представляет собой водород;
R5 представляет собой метил.
6. Соединение по п.1, представляющее собой



7. Фармацевтическая композиция, содержащая соединение по п.1 вместе с фармацевтически приемлемым носителем.
8. Применение соединения по любому из пп.1-6 для получения лекарственного средства для лечения рака простаты.
9. Применение по п.8 для лечения рака простаты, устойчивого к кастрации.
Текст
Описаны соединения формулы (I) где R1-R16, А, В и Е имеют значения, указанные в формуле изобретения, и фармацевтически приемлемые соли и их сложные эфиры. Соединения формулы (I) обладают полезностью в качестве ткань-селективных модуляторов андрогеновых рецепторов (SARM) и, в частности,могут использоваться в качестве лекарственных средств для лечения рака простаты и других связанных с AR состояний и заболеваний, где желательным является антагонизм AR. Область техники Настоящее изобретение относится к фармацевтически активным соединениям и их фармацевтически приемлемым солям и сложным эфирам, используемым для лечения состояний и заболеваний, связанных с ядерными рецепторами, особенно стероидными рецепторами, и, в частности, андрогеновыми рецепторами (AR), и к фармацевтическим композициям, содержащим такие соединения. В частности,изобретение относится к нестероидным соединениям, имеющим структуру карбоксамида и ацетилгидразона, которые могут использоваться в качестве ткань-селективных модуляторов андрогеновых рецепторов (SARM). Соединения по изобретению, которые обладают активностью антагониста AR, можно использовать для лечения пациентов, нуждающихся в терапии с применением антагониста андрогеновых рецепторов. В частности, AR-антагонисты по изобретению используются для лечения или профилактики рака, в частности рака, связанного с AR, такого как рак простаты, и других заболеваний, при которых желателен AR-антагонизм. Уровень техники В последние годы возрос интерес к разработке нестероидных модуляторов стероидных рецепторов для терапевтического применения. Было показано, что нестероидные лиганды могут достигать лучшей рецепторной селективности и лучших физико-химических, фармакокинетических и фармакологических свойств. Что касается андрогеновых рецепторов (AR), то в настоящее время нестероидные антагонисты(антиандрогены) клинически используются для препятствия нежелательному действию избыточного количества андрогенов. Андрогены, действуя через AR, являются весьма важными в процессе инициирования и развития рака простаты. Таким образом, лечение запущенной стадии рака простаты включает андрогенабляционные методы лечения, такие как хирургическая кастрация или гормональное воздействие с использованием агонистов гонадотропин-освобождающего гормона (GnRH), антиандрогенов или того и другого. Хотя такие методы лечения сначала приводят к регрессии заболевания, в конце концов, у всех пациентов развивается поздняя стадия резистентности к кастрации, которая невосприимчива к принятым в настоящее время методам лечения. Резистентный к кастрации рак простаты (CRPC) связан с повышенными уровнями AR. Первое поколение антиандрогенов, таких как бикалутамид, проявляет агонистические свойства в клетках, созданных способами генной инженерии для экспрессии более высоких уровнейAR. Было показано, что in vitro и in vivo повышенная экспрессия AR придавала резистентность клеточным линиям рака простаты к антиандрогенной терапии. Для решения проблемы резистентности для лечения CRPC может быть использовано второе поколение антиандрогенов, которые поддерживают антагонизм в клетках, экспрессирующих избыточное количество AR. Нестероидные антагонисты андрогеновых рецепторов были описаны ранее, например, в патентных публикациях ЕР 100172, ЕР 1790640, США 6087509, США 6673799, США 7271188, WO 03/057669,WO 2004/099188, WO 2006/133567, WO 2008/124000, WO 2009/028543 и WO 2009/055053. Родственные соединения, имеющие структуру карбоксамида, были описаны в WO 2008/062878. Сущность изобретения Было обнаружено, что соединения формул (III), (IV) и (V) являются мощными модуляторами андрогеновых рецепторов (AR), в частности антагонистами AR. Соединения формул (III), (IV) и (V) показывают необыкновенно высокое сродство и высокую антагонистическую активность в отношении андрогеновых рецепторов. Также в клетках, которые сверхэкспрессируют AR ("клетки, сверхэкспрессирующиеAR"), соединения по изобретению обладают антагонизмом AR, от высокой степени до полной, показывая только минимальный агонизм. Соединения по изобретению также эффективно ингибируют пролиферацию линий клеток рака предстательной железы. Кроме того, соединения по изобретению обладают пониженной способностью взаимовлияния лекарственное средство-лекарственное средство, благоприятным набором характеристик безопасности и достаточной водорастворимостью. Таким образом, соединения по изобретению могут быть использованы, в частности, в качестве лекарственных средств при лечении рака простаты и других AR связанных состояний и заболеваний, где необходим AR-антагонизм. Настоящее изобретение относится к новым соединениям карбоксамидной структуры, представленным формулами (III), (IV) или (V)R2 и R3 вместе с атомами углерода, к которым они присоединены, образуют пиридильное кольцо; где по меньшей мере два из R1, R2 и R3 не представляют собой водород;R5 и R6 независимо представляют собой водород или С 1-7 алкил; кольцевой атом Е представляет собой С или N; пунктирная линия обозначает необязательную двойную связь; А представляет собой 5-6-членное гетероциклическое кольцо, включающее от 1 до 3 гетероатомов,выбранных из N, О и S;R9 представляет собой водород, С 1-7 алкил, оксо, оксо-C1-7 алкил или фенил илиR8 и R9 вместе с атомами кольца А, к которому они присоединены, образуют 5- или 6-членное насыщенное или ненасыщенное кольцо, которое может включать 1-2 гетероатома, выбранных из О, S и N,которое может быть замещено атомом галогена;R12 представляет собой водород или С 1-7 алкил;R18 представляет собой С 1-7 алкиламино-С 1-7 алкил; и их фармацевтически приемлемым солям. Другим классом предпочтительных соединений являются соединения формулы (VI)R4 представляет собой водород или метил;R5 представляет собой водород или С 1-3 алкил;A, R8 и R9 имеют значения, указанные выше для соединений формул (III), (IV) и (V). Одним предпочтительным подклассом соединений формулы (VI) являются соединения, где R1 представляет собой галоген; R2 представляет собой циано; R3 представляет собой водород, галоген или метил; R4 представляет собой водород; R5 представляет собой метил и A, R8 и R9 имеют значения, указанные выше для соединений формул (III), (IV) и (V). Другим классом предпочтительных соединений являются соединения формулы (III), (IV), (V), (VI),где А вместе с R8 и R9, образуя конденсированное кольцо, представляет собой одну из следующих групп или их таутомеров: где каждое из вышеуказанных колец замещено R8 и R9, как указано выше. Предпочтительными являются соединения формулы (III), (IV), (V), (VI), где А является любой одной из групп (5'), (6'), (7'), (8'),(12'), (20'), (21'), (27') и (28'), или их таутомеры. Одним подклассом вышеуказанных предпочтительных соединений являются соединения, где R8 представляет собой водород, С 1-7 алкил, гидрокси-С 1-7 алкил,галоген или -C(O)R10, где R10 представляет собой С 1-7 алкил и R9 представляет собой водород или С 1-7 алкил. Предпочтительными соединениями вышеуказанного подкласса являются соединения, где R1 представляет собой галоген, R2 представляет собой циано; R3 представляет собой водород, галоген или метил; R4 представляет собой водород, R5 представляет собой метил. Настоящее изобретение касается далее способа лечения или профилактики состояний, связанных с андрогенными рецепторами (AR), включающего введение субъекту, при необходимости этого, терапевтически эффективного количества соединения формул (III), (IV) или (V). Например, связанное с AR со-3 021170 стояние, которое необходимо подвергнуть лечению, представляет собой рак, в частности связанный с AR рак, такой как рак простаты, легкую простатическую гиперплазию, андрогенную плешивость и акне. В соответствии с одним вариантом осуществления изобретения состояние, связанное с AR, которое необходимо подвергнуть лечению, представляет собой стойкий к кастрации рак простаты (CRPC). Настоящее изобретение относится также к фармацевтической композиции, содержащей соединение формул (III), (IV) или (V) вместе с фармацевтически приемлемым носителем. Подробное описание изобретения Соединения по изобретению могут быть получены путем различных путей синтеза аналогично способам, известным из литературы, используя подходящие исходные продукты. Например, соединения формул (III), (IV) или (V), где R4, R4', R6 и R7 представляют собой водород, и R1, R2, R3, R5, R8, R9, R13,R14, R15, R16, А, В и Е имеют значения, указанные выше для соединений формул (III), (IV) или (V), могут быть получены, например, аналогично или в соответствии с реакционной схемой 1. Некоторые соединения, входящие в формулы (III), (IV) или (V), могут быть получены путем преобразования функциональных групп других соединений формул (III), (IV) или (V), полученных согласно схеме 1, с помощью хорошо известных стадий реакции, таких как окисление, восстановление, гидролиз, ацилирование, алкилирование, амидирование, аминирование и другие. Схема 1NR11R12 или необязательно замещенное 5-12-членное гетероциклическое кольцо, присоединенное к карбонильному углероду через кольцевой атом N, могут быть подходящим образом получены в соответствии со схемой 2 (указанное гетероциклическое кольцо обозначено как "С"). R1, R2, R3, R5, R9, R13, R14, R15,R16, А, В и Е являются такими же, как указано выше для соединений формул (III), (IV) и (V). Соединения формул (III), (IV) или (V), где В представляет собой пиразольное кольцо (3'), могут быть подходящим образом получены, исходя из промежуточного соединения формулы (16), используя способы по схемам 1 или 2. Промежуточное соединение формулы (16) может быть подходящим образом получено в соответствии со схемой 3, где R1, R2, R3, R5, R6 и Е имеют значения, указанные выше для соединений формул (III), (IV) или (V). Схема 3 Оптически активные энантиомеры или диастереомеры соединений формул (III), (IV) или (V) могут быть получены, например, используя подходящие оптически активные исходные продукты. Например,оптически активные энантиомеры соединений формул (III), (IV) или (V) могут быть получены, исходя из оптически активных промежуточных соединений формулы (16 а), используя способы по схемам 1 или 2. Оптически активные промежуточные соединения формулы (16 а) могут быть соответствующим образом получены в соответствии со схемой 4 или 5, где R1, R2, R3, R4, R'4, R5, R6 и Е имеют значения, указанные выше для соединений формул (III), (IV) или (V). Альтернативно, промежуточное соединение формулы (16) может быть получено в соответствии со схемой 6, где R1, R2, R3, R4, R'4, R5, R6 и Е имеют значения, указанные выше для соединений формул (III),(IV) или (V), и Tr представляет собой тритильную (трифенилметильную) группу. Схема 6 Соединения формул (III), (IV) или (V), имеющие необязательную двойную связь, могут быть соответствующим образом получены в соответствии со схемой 7, где R1, R2, R3, R5, R8, R9, R13, R14, R15, R16, А,В и Е имеют значения, указанные выше для соединений формул (III), (IV) или (V). Исходные вещества в вышеуказанных схемах являются коммерчески доступными или могут быть получены в соответствии с известными способами. Фармацевтически приемлемые соли, например соли, полученные добавлением как органических,так и неорганических кислот, хорошо известны в области фармацевтических препаратов. Неограничивающие примеры этих солей включают хлориды, бромиды, сульфаты, нитраты, фосфаты, сульфонаты,форматы, тартраты, малеаты, цитраты, бензоаты, салицилаты и аскорбаты. Фармацевтически приемлемые сложные эфиры, в случае применения, могут быть получены хорошо известными способами, используя фармацевтически приемлемые кислоты, обычно используемые в области фармацевтических препаратов и сохраняющие фармакологические свойства свободной формы. Неограничивающие примеры этих сложных эфиров включают сложные эфиры алифатических или ароматических спиртов, например метиловый, этиловый, пропиловый, изопропиловый, бутиловый, изобутиловый, втор-бутиловый,трет-бутиловый сложные эфиры. Фосфатные и карбонатные эфиры также включены в объем настоящего изобретения. Определение приведенных выше формул (III), (IV) или (V) включает все возможные изотопы и стереоизомеры соединений, включая геометрические изомеры, например Z- и Е-изомеры (цис- и трансизомеры), и оптические изомеры, например диастереомеры и энантиомеры, и все сложные эфиры пролекарств, например, фосфатные и карбонатные эфиры. Кроме того, изобретение включает в свой объем как отдельные изомеры, так любую их смесь, например рацемические смеси. В одном из вариантов осуществления термин "изомер" включает оптические изомеры соединений по изобретению. Специалисту в данной области понятно, что соединения по настоящему изобретению содержат по меньшей мере один хиральный центр. Соответственно, соединения по изобретению могут существовать в виде оптически активных или рацемических форм. Следует учесть, что настоящее изобретение включает любую рацемическую или оптически активную форму или их смеси. В одном из вариантов осуществления соединения по изобретению представляют собой чистые (R)-изомеры. В другом варианте осуществления соединения по изобретению представляют собой чистые (S)-изомеры. В другом варианте осуществления соединения по изобретению представляют собой смесь (R)- и (S)-изомеров. В другом варианте осуществления соединения по изобретению представляют собой рацемическую смесь(R)- и (S)-изомеров в равных количествах. Соединения по изобретению могут содержать два хиральных центра. В этом случае, в соответствии с одним из вариантов осуществления изобретения соединения по изобретению представляют собой чистые диастереомеры. В соответствии с другим вариантом осуществления изобретения соединения по изобретению представляют собой смесь нескольких диастереомеров. Отдельные изомеры могут быть получены, используя соответствующие изомерные формы исходного вещества, или они могут быть разделены после получения конечного соединения в соответствии с обычными способами разделения. Для выделения оптических изомеров, например энантиомеров или диастереомеров, из их смесей могут быть использованы обычные способы выделения, например фракционная кристаллизация. Термины, которые здесь используются, имеют следующие значения. Термин "галоген", как здесь используется, сам по себе или в виде части другой группы относится к хлору, брому, фтору или йоду. Термин "С 1-7 алкил", как здесь используется, сам по себе или в виде части другой группы относится к насыщенному или ненасыщенному прямому, разветвленному или циклическому цепочечному радикалу, имеющему от 1 до 7 атомов углерода. Репрезентативные примеры С 1-7 алкила включают, но этим не ограничиваются, метил, этил, этенил, н-пропил, изопропил, пропенил, н-бутил, изобутил, втор-бутил,трет-бутил, н-пентил, изопентил, неопентил, н-гексил, циклопентил, циклогексил и т.п. Термин "С 1-7 алкиленовый линкер" обозначает насыщенную или ненасыщенную прямую, разветв-7 021170 ленную или циклическую С 1-7 алкильную цепь, которая связывает вместе две группы. ПримерамиC1-7 алкиленового линкера являются метиленовая (-СН 2-) и этиленовая (-СН 2-СН 2-) цепочки. Термин "гидрокси", как здесь используется, сам по себе или в виде части другой группы относится к группе -ОН. Термин "циано", как здесь используется, сам по себе или в виде части другой группы относится к группе -CN. Термин "гидрокси-С 1-7 алкил", как здесь используется, относится по меньшей мере к одной гидрокси группе, как здесь определено, присоединенной к основной части молекулы через С 1-7 алкильную группу,как здесь определено. Репрезентативные примеры гидрокси-С 1-7 алкила включают, но этим не ограничиваются, гидроксиметил, 2,2-дигидроксиэтил, 1-гидроксиэтил, 3-гидроксипропил, 1-гидроксипропил, 1 метил-1-гидроксиэтил, 1-метил-1-гидроксипропил и т.п. Термин "галоген-С 1-7 алкил", как здесь используется, относится по меньшей мере к одному галогену,как здесь определено, присоединенному к основной части молекулы через C1-7 алкильную группу, как здесь определено. Репрезентативные примеры галоген-С 1-7 алкила включают, но этим не ограничиваются,фторметил, дифторметил, трифторметил, 2-хлорэтил, 3-бромпропил и т.п. Термин "С 1-7 алкокси", как здесь используется, сам по себе или в виде части другой группы относится к -O-С 1-7 алкилу, где C1-7 алкил имеет определенные здесь значения. Репрезентативные примеры С 1-7 алкокси включают, но этим не ограничиваются, метокси, этокси, пропокси, бутокси, изобутокси,втор-бутокси, трет-бутокси и т.п. Термин "тио-С 1-7 алкил", как здесь используется, относится к -S-С 1-7 алкилу, где С 1-7 алкил имеет определенные здесь значения. Репрезентативные примеры тио-С 1-7 алкила включают, но этим не ограничиваются, тиометил (-SCH3), тиоэтил и т.п. Термин "оксо" обозначает группу с двойной связью (=O), присоединенную в качестве заместителя. Термин "тиоксо" обозначает группу с двойной связью (=S), присоединенную в качестве заместителя. Термин "амино", как здесь используется, сам по себе или в виде части другой группы относится к-NH2 группе. Термин "C1-7 ацил", как здесь используется, сам по себе или в виде части другой группы относится к С 1-7 алкилкарбонильной группе, и его примеры включают ацетил, пропаноил, изопропаноил, бутаноил,втор-бутаноил, трет-бутаноил и пентаноил. Термин "амино-С 1-7 алкил", как здесь используется, относится по меньшей мере к одной аминогруппе, как здесь определено, присоединенной к основной части молекулы через С 1-7 алкильную группу, как здесь определено. Репрезентативные примеры амино-С 1-7 алкила включают, но этим не ограничиваются,аминометил, 2-аминоэтил, 1-аминоэтил, 2,2-диаминоэтил, 3-аминопропил, 2-аминопропил, 4 аминобутил, 1-метил-1-аминоэтил и т.п. Термин "С 1-7 алкиламино", как здесь используется, сам по себе или в виде части другой группы относится к одной или двум С 1-7 алкил группе(ам), как здесь определено, присоединенной к основной части молекулы через аминогруппу, как здесь определено. Репрезентативные примеры С 1-7 алкиламино включают, но этим не ограничиваются, метиламино, этиламино, пропиламино, бутиламино, диметиламино,диэтиламино, N-этил-N-метиламино и т.п. Термин "С 1-7 алкиламино-С 1-7 алкил", как здесь используется, относится к С 1-7 алкиламиногруппе, как здесь определено, присоединенной к основной части молекулы через C1-7 алкильную группу, как здесь определено. Репрезентативные примеры C1-7 алкиламино-С 1-7 алкила включают, но этим не ограничиваются, N,N-диметиламинометил, N,N-диэтиламинометил, N-метиламиноэтил, N-метиламинопропил, Nэтил-N-метиламинометил и т.п. Термин "гидрокси-С 1-7 алкиламино-С 1-7 алкил", как здесь используется, относится к гидрокси-С 17 алкиламиногруппе, как здесь определено, присоединенной к основной части молекулы через С 17 алкильную группу, как здесь определено. Репрезентативные примеры С 1-7 алкиламино-С 1-7 алкила включают, но этим не ограничиваются, N-гидроксиметиламиноэтил, N-этил-N-гидроксиметиламинометил и т.п. Термин "С 1-7 алкокси-С 1-7 алкил", как здесь используется, относится по меньшей мере к одной С 1-7 алкоксигруппе, как здесь определено, присоединенной к основной части молекулы черезC1-7 алкильную группу, как здесь определено. Репрезентативные примеры С 1-7 алкокси-С 1-7 алкила включают, но этим не ограничиваются, метоксиметил, этоксиметил, 2-метоксиэтил, 2-этоксиэтил, 3,3 диметоксипропил, 2,4-диметоксибутил и т.п. Термин "имино-С 1-7 алкил", как здесь используется, относится по меньшей мере к одной иминогруппе (=NH), присоединенной к основной части молекулы через С 1-7 алкильную группу, как здесь определено. Термин "гидроксиимино-С 1-7 алкил", как здесь используется, относится к =N-OH группе, присоединенной к основной части молекулы через С 1-7 алкильную группу, как здесь определено. Термин "5- или 6-членное гетероциклическое кольцо", как здесь используется, относится к насыщенному, частично насыщенному или ароматическому кольцу с 5 или 6 кольцевыми атомами, из кото-8 021170 рых 1-3 атома представляют собой гетероатомы, выбранные из группы, состоящей из N, О и S. Репрезентативные примеры 5- или 6-членного гетероциклического кольца включают, но этим не ограничиваются,пиразолильное, фуранильное, пиперазинильное, пиперидинильное, пиридинильное кольца и т.п. Термин "5- или 6-членное карбоциклическое кольцо", как здесь используется, относится к насыщенному, частично насыщенному или ароматическому кольцу с 5 или 6 атомами кольца, состоящему только из атомов углерода. Репрезентативные примеры 5- или 6-членного карбоциклического кольца включают, но этим не ограничиваются, фенильное и циклогексильное кольца и т.п. Термин "5-12-членное гетероциклическое кольцо", как здесь используется, относится к моноциклическому или бициклическому насыщенному, частично насыщенному или ароматическому кольцу с 5-12 кольцевыми атомами, из которых 1-4 атома представляют собой гетероатомы, выбранные из группы,содержащей N, О и S. Репрезентативные примеры 5-12-членного гетероциклического кольца включают,но этим не ограничиваются, пиразолильное, фуранильное, пиперазинильное, пиперидинильное, пиридинильное,морфолинильное,пиразинильное,индазолильное,имидазолильное,пиразоло[1,5 а]пиримидинильное, изоксазолильное и тиазолильное кольца и т.п. Термин "5-12-членное карбоциклическое кольцо", как здесь используется, относится к насыщенному, частично насыщенному или ароматическому кольцу с 5-12 кольцевыми атомами, состоящими только из атомов углерода. Репрезентативные примеры 5-12-членного карбоциклического кольца включают, но этим не ограничиваются, фенильное, нафтильное и циклогексильное кольца и т.п. Термин "необязательно замещенный", как здесь используется, в связи с различными остатками, относится к галоген заместителям, таким как фтор, хлор, бром, йод, или заместителям С 1-7 алкил, гидрокси,амино, галоген-С 1-7 алкил, гидрокси-С 1-7 алкил, С 1-7 алкокси, C1-C7-ацил, С 1-7 алкиламино, амино-С 1-7 алкил,метилсульфонил, нитро, циано, тиол или 5- или 6-членное карбоциклическое или гетероциклическое кольцо. Предпочтительными заместителями являются галоген, С 1-7 алкил, гидрокси-С 1-7 алкил, C1-C7-ацил,пиридинил, морфолинил и бензил заместители."Необязательно замещенные" группы могут содержать от 1 до 3, предпочтительно 1 или 2, наиболее предпочтительно 1, вышеуказанных заместителей. Примеры предпочтительных соединений формул (III), (IV) и (V) включают Соединения по изобретению могут быть введены пациенту в терапевтически эффективных количествах, обычно в диапазоне от около 0,1 до около 5000 мг, предпочтительно от около 1 до около 2000 мг в день, в зависимости от возраста, веса, этнической группы, состояния пациента, заболевания, подвергаемого лечению, способа введения и используемого андрогенового (AR) модулятора. Соединения по изобретению могут быть представлены в виде лекарственных форм, используя методы, известные в данной области. Они могут вводиться пациенту в чистом виде или в сочетании с подходящими фармацевтическими наполнителями в форме таблеток, гранул, капсул, свечей, эмульсий, суспензий или растворов. Выбор соответствующих ингредиентов для композиции является обычной работой для рядового специалиста в данной области. Очевидно, что подходящие носители, растворители, образующие гель ингредиенты, образующие дисперсию ингредиенты, антиоксиданты, красители, подсластители, смачивающие вещества и другие ингредиенты, обычно используемые в данной области техники, также могут быть использованы. Композиции, содержащие активное соединение, могут быть введены энтерально или парентерально, но пероральный способ введения является предпочтительным. Содержание активного соединения в композиции составляет от около 0,5 до 100%, предпочтительно от около 1 до около 85% от массы всей композиции. Настоящее изобретение будет описано более подробно с помощью следующих примеров. Примеры приведены только с целью иллюстрации и не ограничивают объем изобретения, определенного в пунктах формулы изобретения. Эксперименты Эксперимент 1. Измеряли сродство AR связывания (Ki) исследуемого соединения.AR-антагонизм исследуемого соединения измеряли в качестве IC50 значения (нМ) для AR человека в клетках hAR/HEK293.AR-агонизм исследуемого соединения в сверхэкспрессирующих AR клетках hAR/HEK293 измеряли в % тестостерон-индуцированной AR активности при концентрации 10 мкМ. Измеряли значение IC50 исследуемого соединения для ингибирования миболерон-индуцированнойVCaP клеточной пролиферации. В качестве контрольного соединения в измерениях использовали бикалутамид. Способы. Исследование связывания андрогенового рецептора. Сродство связывания исследуемых соединений с андрогеновым рецептором (AR) изучали на цитозольных лизатах, полученных из вентральных простат кастрированных крыс, посредством анализа конкурентного связывания (Schilling K. and Liao S., The Prostate, 1984; 5(6): 581-588). Цитозольные препараты и 1 нМ [3 Н]миболерона инкубировали с повышенными концентрациями исследуемых соединений. Для определения неспецифического связывания выполняли параллельные инкубации, используя избыточное количество немеченого тестостерона. После инкубации связанные и свободные стероиды разделяли обработкой суспензией декстран-покрытой угольной пыли. Радиоактивность связывания определяли подсчетом фракции супернатанта в сцинтилляционной жидкости. Радиоактивность измеряли, используя счетчик Microbeta. Все точки данных определяли четырежды. Постоянную диссоциации[3 Н]миболерона для андрогенового рецептора крыс определяли посредством анализа способности поглощающего связывания, проводимого на вентральных простатах кастрированных крыс, по существу,как описано (Isomaa V. et al., Endocrinology, 1982; 111(3): 833-843). Анализ данных. Для анализа способности поглощающего связывания использовали уравнение связывания одного участка (гипербола)X - концентрация радиолиганда. Равновесную постоянной диссоциации (Ki) подсчитывали, используя уравнение Ченга-Прусова:Kd - постоянная диссоциации радиолиганда для рецептора;IC50 - IC50 значение, измеренное в исследовании конкурентного радиолигандного связывания.AR антагонизм. Антагонизм исследуемых соединений относительно AR измеряли с помощью анализа репортерного гена в эмбриональных клетках почки человека (HEK293), стабильно трансфицированных вектором экспрессии, кодирующим полноразмерный AR человека и конструкцию андроген-восприимчивого репортерного гена люциферазы (hAR/HEK293 клетки). Для определения антагонизма относительно hAR клетки обрабатывали одновременно повышенными концентрациями соединения и субмаксимальной концентрацией тестостерона (обычно 0,45 нМ). Конечная концентрация DMSO составляла 1%. Все исследуемые соединения исследовали с трехкратным повтором. Клетки инкубировали в течение 24 ч перед измерением люциферазной активности, используя Luciferase Assay System, Promega Corporation. Агонизм исследуемых соединений в клетках, сверхэкспрессирующих AR, измеряли с помощью анализа репортерного гена в клетках HEK293, стабильно трансфицированных вектором экспрессии, кодирующим полноразмерный AR человека и конструкцию андроген-восприимчивого репортерного гена люциферазы. Для исследования агонизма в клетках, сверхэкспрессирующих AR, выделяли клон, экспрессирующий высокие уровни андрогенового рецептора (в 5 раз выше, чем уровни AR в клетках ARHEK293). Для определения агонизма клетки обрабатывали повышенными концентрациями исследуемого соединения. Конечная концентрация ДМСО составляла 1%. Исследуемые соединения исследовали с трехкратным повтором и люциферазную активность определяли вышеописанным способом. Исследования клеточной пролиферации. Способность исследуемых соединений подавлять рост раковых клеток простаты изучали путем измерения ингибирования клеточной пролиферации, используя линию андроген-восприимчивых клеток рака простаты VCaP. Клетки высеивали при плотности 50000 клеток/лунка в 96-луночный планшет в подходящей культуральной среде (свободная от фенолрота среда RPMI-1640 с добавлением 10% обработанного активированным углем FBS и 4 мМ глутамакса+100 ME пеницилина, 100 ME стрептомицина). Клетки оставляли, чтобы они могли прилипнуть к планшету, на 2-3 дня и затем обрабатывали исследуемыми соединениями в присутствии миболерона (концентрация, способная вызывать субмаксимальное повышение клеточной пролиферации, обычно 0,1 нМ) в течение 4-5 дней. Клеточную пролиферацию измеряли, используя WST-1 Cell Proliferation Assay (Roche). Таблица 1 Сродство связывания AR, AR-антагонизм, AR-агонизм в клетках,сверхэкспрессирующих AR и ингибирование пролиферации клеток VCaP Примеры Целевые продукты в следующих примерах были получены в виде смеси диастереомеров, если не указано другое. Пример 1. 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 5-(пиперазин-1-карбонил)-2 Н-пиразол-3 карбоновой кислоты. а) 2-(3,4-Дихлорфенил)-5-Е)-2-нитровинил)фуран. Перемешиваемый раствор уксусной кислоты (1,4 мл, 1,46 г, 24,3 ммоль) в метаноле (3,5 мл) в атмосфере азота при температуре 0 С обрабатывали по каплям н-пропиламином (2,0 мл, 1,42 г, 24,0 ммоль). Полученный раствор н-пропиламмоний ацетата перемешивали при температуре 0 С в течение 5 мин,затем добавляли по каплям к перемешиваемому раствору 5-(3,4-дихлорфенил)фурфураля (10,04 г, 41,6 ммоль) в нитрометане (6,8 мл, 7,61 г, 124,7 ммоль) при температуре 0 С. Полученную смесь перемешивали при температуре 0 С в течение 30 мин. Затем охлаждающую баню отставляли и перемешивание продолжали при комнатной температуре. Время от времени пять раз добавляли 10 мл ТГФ. После перемешивания в течение ночи ТГФ упаривали и добавляли воду. Твердый продукт фильтровали, промывали водой и гептаном с получением 11,46 г 2-(3,4-дихлорфенил)-5-Е)-2-нитровинил)фурана. 1 Н-ЯМР (400 МГц, ДМСО-d6): 7,38 (1 Н, д), 7,43 (1 Н, д), 7,76 (1 Н, д), 7,95 (1 Н, дд), 8,03 (1 Н, д), 8,19b) Гидрохлорид 2-[5-(3,4-дихлорфенил)фуран-2-ил]этиламина. 2-(3,4-Дихлорфенил)-5-Е)-2-нитровинил)фуран (5,73 г, 20,2 ммоль) растворяли в смеси сухого метанола (90 мл) и сухого этилацетата (70 мл). Затем добавляли 14,3 мл смеси 10 мас.% HCl-метанол и 2,4 г 10% палладия-на-углероде. 2-(3,4-Дихлорфенил)-5-Е)-2-нитровинил)фуран гидрировали при давлении 3 атм при комнатной температуре в течение 4 ч. Катализатор удаляли с помощью фильтрации черезCelite. Удаление растворителя при пониженном давлении давало сырой продукт, который очищали с помощью флэш-хроматографии на силикагеле, используя смесь CH2Cl2/MeOH (98:2-80:20) в качестве градиентного элюента. 1 Н-ЯМР (400 МГц, ДМСО-d6): 3,04 (2 Н, м), 3,14 (2 Н, м), 6,43 (1 Н, д), 7,07 (1 Н, д), 7,67 (2 Н, с), 7,93c) 5-2-[5-(3,4-Дихлорфенил)фуран-2-ил]этилкарбамоил-1 Н-пиразол-3-карбоновая кислота. Моногидрат 3,5-пиразолдикарбоновой кислоты (8,02 г, 46,1 ммоль) растворяли в смеси сухого ДМФА (35 мл), сухого DCM (35 мл) и DIPEA (7,9 мл). При комнатной температуре добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI, 3,37 г, 17,6 ммоль), HOBt (2,28 г, 16,9 ммоль) и DIPEA (3 мл, 2,23 г, 17,3 ммоль). Раствор перемешивали в течение 10 мин. Затем к раствору при комнатной температуре добавляли по каплям гидрохлорид 2-[5-(3,4-дихлорфенил)фуран-2- 14021170 ил]этиламина (3,46 г, 11,8 ммоль), растворенный в смеси сухого DCM (35 мл) и DIPEA (2,0 мл, 1,48 г,11,5 ммоль). После перемешивания в течение ночи добавляли воду. Продукт экстрагировали этилацетатом. Органическую фазу промывали водой, сушили и упаривали. Сырой продукт очищали с помощью флэш-хроматографии, используя DCM в качестве элюента. Продукт растирали с горячим метанолом. 1 Н-ЯМР (400 МГц, ДМСО-d6): 2,95 (2 Н, т), 3,56 (2 Н, м), 6,33 (1 Н, д), 7.01 (1 Н, д), приблизительно 7,03 (1 Н, ушир.с), 7,61 (1 Н, искаженный дд), 7,63 (1 Н, искаженный д), 7,83 (1 Н, д), приблизительно 8,45d) 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 5-(пиперазин-1-карбонил)-2 Н-пиразол-3 карбоновой кислоты. 5-2-[5-(3,4-Дихлорфенил)фуран-2-ил]этилкарбамоил-1 Н-пиразол-3-карбоновую кислоту (0,30 г,0,76 ммоль) растворяли в смеси сухого ДМФА (3 мл) и сухого DCM (3 мл). При комнатной температуре добавляли EDCI (0,22 г, 1,2 ммоль), HOBt (0,16 г, 1,2 ммоль) и DIPEA (0,2 мл, 0,15 г, 1,2 ммоль). После перемешивания в течение 15 мин к раствору при комнатной температуре добавляли по каплям пиперазин(0,10 г, 1,2 ммоль) в сухом DCM (2 мл). Затем раствор перемешивали в течение ночи. Добавляли воду и продукт экстрагировали этилацетатом. Органическую фазу перемешивали с насыщенным солевым раствором и водой, сушили и упаривали. Сырой продукт очищали с помощью флэш-хроматографии, используя CH2Cl2-MeOH в качестве градиентного элюента (95:5-50:50). Затем очищали также с помощью флэш-хроматографии, используя CH2Cl2-MeOH (9:1) в качестве элюента. 1(1 Н, д), 6,58 (1 Н, д), 7,02 (1 Н, с), 7,21 (1 Н, ушир.с), 7,40 (1 Н, искаженный д), 7,43 (1 Н, искаженный дд),7,75 (1 Н, д). Пример 2. 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 5-[4-(2-гидроксиэтил)пиперидин-1 карбонил]-2 Н-пиразол-3-карбоновой кислоты. Указанное в заголовке соединение получали, как в предыдущем примере, исходя из 5-2-[5-(3,4 дихлорфенил)фуран-2-ил]этилкарбамоил-1 Н-пиразол-3-карбоновой кислоты и 4-пиперидин этанола. Сырой продукт очищали с помощью флэш-хроматографии, используя смесь CH2Cl2-MeOH в качестве градиентного элюента (100:0-95:5). 1(1 Н, д), 11,4 (1 Н, ушир.с). Пример 3. 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 5-(4-гидроксипиперидин-1-карбонил)-2 Нпиразол-3-карбоновой кислоты. Указанное в заголовке соединение получали, как в примере 1, исходя из 5-2-[5-(3,4 дихлорфенил)фуран-2-ил]этилкарбамоил-1 Н-пиразол-3-карбоновой кислоты и 4-гидроксипиперидина. Сырой продукт очищали с помощью флэш-хроматографии, используя смесь CH2Cl2-MeOH (95:5) в качестве элюента. 1(2 Н, м), 3,77 (2 Н, кв), приблизительно 4,1 (3 Н, м), 6,20 (1 Н, д), 6,58 (1 Н, д), 7,03 (1 Н, с), приблизительно 7,6 (1 Н, ушир.с), 7,40 (1 Н, искаженный д), 7,43 (1 Н, искаженный дд), 7,74 (1 Н, д), 11,6 (1 Н, ушир.с). Пример 4. 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 5-[4-(2-гидроксиэтил)пиперазин-1 карбонил]-2 Н-пиразол-3-карбоновой кислоты. Указанное в заголовке соединение получали, как в примере 1, исходя из 5-2-[5-(3,4 дихлорфенил)фуран-2-ил]этилкарбамоил-1 Н-пиразол-3-карбоновой кислоты и 1-(2 гидроксиэтил)пиперазина. Сырой продукт очищали с помощью флэш-хроматографии, используя смесьCH2Cl2-MeOH в качестве градиентного элюента (100:0-90:10). 1(1 Н, искаженный дд), 7,63 (1 Н, искаженный д), 7,84 (1 Н, д), приблизительно 8,59 (1 Н, ушир.с), 13,9 (1 Н,ушир.с). Пример 5. 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 5-(4-ацетилпиперазин-1-карбонил)-2 Нпиразол-3-карбоновой кислоты. Указанное в заголовке соединение получали, как в примере 1, исходя из 5-2-[5-(3,4 дихлорфенил)фуран-2-ил]этилкарбамоил-1 Н-пиразол-3-карбоновой кислоты и 1-ацетилпиперазина. Сырой продукт растирали в CH2Cl2 при комнатной температуре с получением целевого продукта. 1 морфолинопиперидина. Сырой продукт очищали с помощью флэш-хроматографии, используя смесьCH2Cl2-MeOH в качестве градиентного элюента (100:0-96:4). 1(5 Н, м), приблизительно 2,78 (1 Н, м), 2,95 (2 Н, т), приблизительно 3,11 (1 Н, м), 3,55-3,57 (6 Н, м), приблизительно 4,45 (1 Н, м), 6,34 (1 Н, д), 7,02 (1 Н, д), приблизительно 7,03 (1 Н, ушир.с), 7,59 (1 Н, искаженный дд), 7,63 (1 Н, искаженный д), 7,84 (1 Н, д), 8,6 (1 Н, ушир.с), 13,9 (1 Н, ушир.с). Пример 7. 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 5-[4-(1-гидроксиэтил)пиперидин-1 карбонил]-2 Н-пиразол-3-карбоновой кислоты карбоновой кислоты. а) 1-(Пиридин-4-ил)этанол. К перемешиваемому раствору 4-ацетилпиридина (2,50 г, 20,6 ммоль) в метаноле (25 мл) добавляли по частям боргидрид натрия (1,56 г, 41,2 ммоль). После перемешивания в течение ночи при комнатной температуре добавляли воду и смесь упаривали досуха в вакууме. Продукт обрабатывали этилацетатом. Растворитель упаривали с получением 2,53 г указанного в заголовке соединения. 1b) 1-(Пиперидин-4-ил)этанол. 1-(Пиридин-4-ил)этанол (2,53 г, 20,5 ммоль) растворяли в уксусной кислоте (20 мл) и гидрировали при комнатной температуре в присутствии оксида платины(IV) (0,19 г) при давлении 1 атм. Катализатор удаляли путем фильтрации через Celite и фильтрат концентрировали в вакууме с получением сырого 1(пиридин-4-ил)этанола в виде ацетатной соли, которую растирали в этилацетате. Водный раствор ацетатной соли подщелачивали (рН 10) гидроксидом натрия и 1-(пиридин-4-ил)этанолом в качестве основания и экстрагировали этилацетатом. Экстракты концентрировали в вакууме. 1c) 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 5-[4-(1-гидроксиэтил)пиперидин-1-карбонил]-2 Нпиразол-3-карбоновой кислоты. Указанное в заголовке соединение получали, как в примере 1, исходя из 5-2-[5-(3,4 дихлорфенил)фуран-2-ил]этилкарбамоил-1 Н-пиразол-3-карбоновой кислоты и 1-(пиперидин-4 ил)этанола. Сырой продукт очищали с помощью флэш-хроматографии, используя смесь CH2Cl2-MeOH в качестве градиентного элюента (100:0-90:10). 1(1 Н, ушир.с). Пример 8. N-(2-(5-(3,4-Дихлорфенил)фуран-2-ил)этил)-3-(морфолин-4-карбонил)-1 Н-пиразол-5 карбоксамид. Указанное в заголовке соединение получали, как в примере 1, исходя из морфолина и 5-2-[5-(3,4 дихлорфенил)фуран-2-ил]этилкарбамоил-1 Н-пиразол-3-карбоновой кислоты. Сырой продукт очищали с помощью хроматографии (CombiFlash, 1-я колонка с диоксидом кремния, элюент: смесь 0-10%N-(2-(5-(3,4-Дихлорфенил)фуран-2-ил)этил)-3-(4-метилпиперазин-1-карбонил)-1 Нпиразол-5-карбоксамид. Указанное в заголовке соединение синтезировали как в примере 1, исходя из 1-метилпиперазина и 5-2-[5-(3,4-дихлорфенил)фуран-2-ил]этилкарбамоил-1 Н-пиразол-3-карбоновой кислоты. Сырой продукт очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент 0-10%MeOH/DCM) и кристаллизовали из смеси DCM/гептан с получением 1,06 г (35%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):2,19 (с, 3 Н), 2,33 (ушир.с, 4 Н), 2,95 (т, 2 Н), 3,56 (кв, 2 Н), 3,62DCM. Гидрохлорид 2-(5-(3,4-дихлорфенил)фуран-2-ил)этанамина (1,0 г; 3,42 ммоль) и DIPEA (0,89 мл; 5,13 ммоль) растворяли в 5 мл DCM и добавляли по каплям к предыдущей смеси. Реакционную смесь перемешивали в течение ночи, после чего добавляли пиразин-2,5-дикарбоновую кислоту (0,58 г; 1,59 ммоль) и DIPEA (0,60 мл; 3,42 ммоль) и смесь опять перемешивали в течение 5 ч. Для доведения реакции до завершения опять добавляли безводный HOBt (0,69 г; 5,13 ммоль), гидрохлорид 1-(3- 16021170 диметиламинопропил)-3-этилкарбодиимида (0,98 г; 5,13 ммоль) и DIPEA (0,89 мл; 5,13 ммоль). После перемешивания в течение ночи смесь разбавляли 20 мл DCM и промывали 310 мл воды. Органическую фазу сушили над Na2SO4, фильтровали и использовали как таковую без дополнительной очистки. Пример 11.N-2-(2-(5-(3,4-Дихлорфенил)фуран-2-ил)этил)-N-5-(2-гидроксиэтил)пиразин-2,5 дикарбоксамид. 5-(2-(5-(3,4-Дихлорфенил)фуран-2-ил)этилкарбамоил)пиразин-2-карбоновую кислоту (0,12 г; 0,30 ммоль), безводный HOBt (0,15 г; 1,1 ммоль), гидрохлорид 1-(3-диметиламинопропил)-3 этилкарбодиимида (0,085 г; 0,44 ммоль) и DIPEA (0,077 мл; 0,44 ммоль) растворяли в 2,5 мл DCM. К этому раствору добавляли 2-аминоэтанол (0,018 мл; 0,3 мл) в 2,5 мл DCM и смесь перемешивали в течение ночи. Смесь разбавляли 10 мл DCM и промывали 35 мл воды. Водные фазы затем экстрагировалиEtOAc, органическую фазу сушили над Na2SO4, фильтровали и упаривали досуха. Продукт очищали с помощью флэш-хроматографии. Объединенные фракции давали 6 мг продукта. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,01 (т, 2 Н), 3,38-3,43 (м, 2 Н), 3,52-3,57 (м, 2 Н), 3,64-3,69 (м, 2 Н),4,81 (т, 1 Н), 6,36 (д, 1 Н), 7,02 (д, 1 Н), 7,58-7,64 (м, 2 Н), 7,80 (д, 1 Н), 8,91-8,94 (т, 1 Н), 9,19 (д, 1 Н), 9,21 (д,1 Н), 9,26-9,29 (т, 1 Н). Пример 12. 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 1,5-диметил-1 Н-пиразол-3-карбоновой кислоты. 1,5-Диметил-1 Н-пиразол-3-карбоновую кислоту (100 мг, 0,71 ммоль) растворяли в сухом ДМФА (2 мл). При комнатной температуре добавляли EDCl (205 мг, 1,1 ммоль), HOBt (145 мг, 1,1 ммоль) и DIPEA(0,19 мл, 141 мг, 1,1 ммоль). Раствор перемешивали в течение 30 мин. Затем к раствору при комнатной температуре добавляли гидрохлорид 2-[5-(3,4-дихлорфенил)фуран-2-ил]этиламина (313 мг, 1,1 ммоль),растворенный в смеси сухого ДМФА (4 мл) и DIPEA (0,19 мл, 141 мг, 1,1 ммоль). После перемешивания в течение ночи добавляли воду. Продукт экстрагировали этилацетатом. Органическую фазу промывали водой, сушили и упаривали. Сырой продукт очищали с помощью флэш-хроматографии, используя смесьCH2Cl2-MeOH в качестве градиентного элюента (100:0-95:5). Дополнительную очистку осуществляли также с помощью флэш-хроматографии, используя смесь CH2Cl2-MeOH в качестве градиентного элюента (100:0-99,7:0,3). Продукт растирали в смеси гептан-CH2Cl2 при комнатной температуре. 1(1 Н, с), 7,01 (1 Н, д), 7,60 (1 Н, искаженный дд), 7,64 (1 Н, искаженный д), 7,83 (1 Н, д), 8,09 (1 Н, т). Пример 13. 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 5-фуран-2-ил-1-фенил-1 Н-пиразол-3 карбоновой кислоты. Указанное в заголовке соединение получали, как в примере 12, исходя из 5-(2-фурил)-1-фенил-1 Нпиразол-3-карбоновой кислоты и гидрохлорида 2-[5-(3,4-дихлорфенил)фуран-2-ил]этиламина. Сырой продукт дважды очищали с помощью флэш-хроматографии, используя сначала смесь CH2Cl2-MeOH в качестве градиентного элюента (100:0-99:1). Затем осуществляли дополнительную очистку с помощью флэш-хроматографии, используя смесь гептан/EtOAc (8:2) в качестве элюента. 1(1 Н, д), 7,07 (1 Н, с), 7,45-7,48 (2 Н, м), 7,54-7,56 (4 Н, м), 7,61 (1 Н, искаженный дд), 7,73 (1 Н, д), 7,84 (1 Н,д), 8,49 (1 Н, т, 3J=5,9 Гц). Пример 14. 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 1-метил-1 Н-индазол-3-карбоновой кислоты. Указанное в заголовке соединение получали, как в примере 12, исходя из N-метилиндазол-3 карбоновой кислоты и гидрохлорида 2-[5-(3,4-дихлорфенил)фуран-2-ил]этиламина. Сырой продукт очищали с помощью флэш-хроматографии, используя смесь гептан/EtOAc в качестве градиентного элюента(1 Н, м), 7,46 (1 Н, м), 7,600 (1 Н, с), 7,602 (1 Н, с), 7,72 (1 Н, д), 7,83 (1 Н, с), 8,16 (1 Н, д), 8,48 (1 Н, т). Пример 15. 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 1 Н-имидазол-4-карбоновой кислоты. Указанное в заголовке соединение получали, как в примере 12, исходя из 4-имидазолкарбоновой кислоты и гидрохлорида 2-[5-(3,4-дихлорфенил)фуран-2-ил]этиламина. Сырой продукт очищали с помощью флэш-хроматографии, используя смесь CH2Cl2/MeOH в качестве градиентного элюента (100:099,6:0,4). Продукт растирали в этилацетате. 1(2 Н, с), 7,71 (1 Н, с), 7,87 (1 Н, с), 8,05 (1 Н, ушир.с), 12,43 (1 Н, ушир.с). Пример 16. Гидрохлорид 2-[5-(3,4-дихлорфенил)фуран-2-ил]этиламида 2-метил-1 Н-имидазол-4 карбоновой кислоты. Указанное в заголовке соединение получали, как в примере 12, исходя из 2-метил-1 Н-имидазол-4 карбоновой кислоты и гидрохлорида 2-[5-(3,4-дихлорфенил)фуран-2-ил]этиламина. Сырой продукт очищали с помощью флэш-хроматографии, используя смесь CH2Cl2/MeOH в качестве градиентного элюента(100:0-97:3). Продукт растворяли в DCM, добавляли этилацетат, насыщенный хлористым водородом и выпавший в осадок продукт фильтровали в виде гидрохлоридной соли. Перекристаллизация из смесиa) (Е)-2-(5-(3,4-дихлорфенил)фуран-2-ил)этенамин. К перемешиваемому раствору 5-(3,4-дихлорфенил)фурфураля (1,18 г, 4,89 ммоль) в уксусной кислоте (30 мл) добавляли нитрометан (0,535 мл, 9,78 ммоль) и ацетат аммония (1,13 г, 14,7 ммоль). Реакционную смесь нагревали при температуре 80 С в течение 4,5 ч. Охлажденную реакционную смесь выливали в ледяную воду (30 мл) и полученный таким образом осадок фильтровали, промывали водой и сушили в вакууме с получением 1,15 г (83%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):7,37 (д, 1 Н), 7,43 (д, 1 Н), 7,76 (д, 1 Н), 7,95 (дд, 1 Н), 8,03 (д, 1 Н),8,19 (д, 1 Н), 8,31 (д, 1 Н).b) 2-(5-(3,4-Дихлорфенил)фуран-2-ил)этанамин. К суспензии литийалюминийгидрида (0,939 г, 24,8 ммоль) в ТГФ (20 мл) в атмосфере азота при температуре 0 С медленно добавляли раствор (Е)-2-(5-(3,4-дихлорфенил)фуран-2-ил)этенамина в ТГФ(20 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. К смеси медленно добавляли немного метанола, затем добавляли воду. Смесь упаривали и твердый остаток экстрагировалиEtOAc (3). Объединенные EtOAc фракции промывали 2 М раствором NaOH и насыщенным солевым раствором. Органическую фазу сушили над Na2SO4, упаривали и очищали с помощью хроматографииc) 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 1 Н-индазол-3-карбоновой кислоты. Индазол-3-карбоновую кислоту (30 мг; 0,182 ммоль), DCC (56 мг, 0,273 ммоль) и DMAP (2 мг) растворяли в смеси DCM:ДМФА (1:1, 4 мл). Добавляли 2-(5-(3,4-дихлорфенил)фуран-2-ил)этанамин (46 мг,0,182 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли DCM (30 мл) и органический слой промывали водой (315 мл). Объединенные органические фазы сушили над Na2SO4, упаривали и очищали с помощью хроматографии (колонка с диоксидом кремния,элюент: смесь 1% MeOH/DCM) с получением 25 мг (34%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,00 (т, 2 Н), 3,63 (кв, 2 Н), 6,37 (д, 1 Н), 7,02 (д, 1 Н), 7,23 (т, 1 Н),7,41 (т, 1 Н), 7,60 (д, 1 Н), 7,61 (д, 2 Н), 7,85 (д, 1 Н), 8,16 (д, 1 Н), 8,54 (д, 1 Н), 13,56 (с, 1 Н). Пример 18. 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 5-трет-бутил-2H-пиразол-3-карбоновой кислоты. Указанное в заголовке соединение синтезировали как в примере 17, исходя из 5-трет-бутил-2 Нпиразол-3-карбоновой кислоты и 2-(5-(3,4-дихлорфенил)фуран-2-ил)этанамина. Сырой продукт очищали с помощью хроматографии (колонка с диоксидом кремния, элюент: смесь 3% MeOH/DCM) с получением 53 мг (33%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,27 (с, 9 Н), 2,97 (т, 2 Н), 3,54 (кв, 2 Н), 6,33 (м, 1 Н), 6,39 (ушир.с,1 Н), 7,02 (д, 1 Н), 7,62 (м, 2 Н), 7,86 (д, 1 Н), 8,20 (с, 1 Н), 12,88 (с, 1 Н). Пример 19. 3-трет-Бутил-N-(1-(5-(3,4-дихлорфенил)фуран-2-ил)пропан-2-ил)-1 Н-пиразол-5 карбоксамид.a) (E)-1-(5-(3,4-дихлорфенил)фуран-2-ил)проп-1-ен-2-амин. К перемешиваемому раствору 5-(3,4-дихлорфенил)фурфураля (1,21 г, 5,0 ммоль) в уксусной кислоте (15 мл) добавляли нитроэтан (0,720 мл, 10,0 ммоль) и ацетат аммония (1,16 г, 15,0 ммоль). Смесь перемешивали при температуре 80 С в течение ночи. Реакционную смесь выливали в ледяную воду. Образовавшийся осадок фильтровали, промывали водой и сушили в вакууме с получением 1,38 г (93%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):2,62 (с, 3 Н), 7,37 (д, 1 Н), 7,46 (д, 1 Н), 7,79 (м, 2 Н), 7,98 (с, 1 Н), 8,09(135 мл), EtOAc (100 мл) и 6,5% HCl (газ) в МеОН (32 мл) добавляли 10% Pd/C (1,09 г). Смесь гидрировали под давлением (3,3 бар, аппарат Парра для гидрирования) в течение 7 ч. Реакционную смесь фильтровали через целит, упаривали и очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент: смесь 5-20% MeOH/DCM) с получением 0,811 г (29%) указанного в заголовке соединения в виде HCl соли. 1DCM:ДМФА (4:1, 5 мл). Добавляли DCC (172 мг; 0,83 ммоль). 1-(5-(3,4-Дихлорфенил)фуран-2 ил)пропан-2-амин (149 мг; 0,55 ммоль) растворяли в 2 мл DCM и TEA (77 мкл, 0,55 ммоль) и полученный раствор добавляли в реакционную смесь. Реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем добавляли DCM (50 мл) и органическую фазу промывали водой (230 мл). Органическую фазу сушили над Na2SO4, упаривали и очищали с помощью хроматографии (CombiFlash, 1-я колонка с диоксидом кремния, элюент: 7,5-100% EtOAc/гептан; 2-я колонка с диоксидом кремния, элюент: смесь 0-5% MeOH/DCM) с получением 35 мг (15%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,19 (д, 3 Н), 1,27 (с, 9 Н), 2,88 (дд, 1 Н), 2,98 (дд, 1 Н), 4,33 (квинтет,1 Н), 6,29 (д, 1 Н), 6,33 (с, 1 Н), 7,00 (д, 1 Н), 7,60 (м, 2 Н), 7,83 (д, 1 Н), 7,89 (д, 1 Н), 12,84 (с, 1 Н). Пример 20.DCM (15 мл) и DIPEA (1,64 мл, 9,42 ммоль). Полученный раствор добавляли в реакционную смесь, перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли DCM и промывали насыщенным водным раствором NaHCO3 и водой. Органическую фазу сушили над Na2SO4, упаривали и очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент 0-15%MeOH/DCM). Продукт, содержащий фракции, собирали, упаривали и кристаллизовали из DCM и перекристаллизовали из смеси 2% MeOH/DCM и гептана. Таким образом, получали 1,18 г (29%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):2,97 (т, 2 Н), 3,59 (кв, 2 Н), 6,35 (д, 1 Н), 7,03 (д, 1 Н), 7,33 (с, 1 Н),7,62 (д, 2 Н), 7,75 (м, 2 Н), 7,84 (т, 1 Н), 8,57 (ушир.с, 1 Н), 8,63 (м, 2 Н), 13,95 (с, 1 Н). Пример 21. 3-трет-Бутил-N-(2-(5-(3,4-дицианофенил)фуран-2-ил)этил)-1 Н-пиразол-5-карбоксамид. К перемешиваемому раствору 2-[5-(3,4-дихлорфенил)фуран-2-ил]этиламида 5-трет-бутил-2 Нпиразол-3-карбоновой кислоты по примеру 18 (128 мг, 0,315 ммоль) в смеси ДМФА/вода (99:1, 1 мл) добавляли цианид цинка (81 мг, 0,693 ммоль), S-Phos (26 мг, 0,063 ммоль) и Pd2(dba)3 (23 мг, 0,025 ммоль). Реакционную смесь нагревали с помощью микроволнового реактора при температуре 150 С в течение 40 мин. Добавляли 1 М раствор NaOH (20 мл) и смесь экстрагировали EtOAc (320 мл). Объединенные органические фазы сушили над Na2SO4, упаривали и очищали с помощью хроматографии (CombiFlash, 1-я колонка с диоксидом кремния: элюент 0-100% EtOAc/гептан; 2-я колонка С-18 RP: элюент 0100% MeCN/вода) с получением 25 мг (20%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,27 (с, 9 Н), 2,96 (т, 2 Н), 3,57 (кв, 2 Н), 6,35 (ушир.с, 1 Н), 6,44 (д,1 Н), 7,31 (д, 1 Н), 8,07 (дд, 1 Н), 8,11 (д, 1 Н), 8,19 (ушир.с, 1 Н), 8,38 (д, 1 Н), 12,87 (ушир.с, 1 Н). Пример 22. N-(2-(5-(3,4-Дихлорфенил)фуран-2-ил)этил)-3-метил-1 Н-пиразол-5-карбоксамид. Указанное в заголовке соединение получали, следуя способу по примеру 20, исходя из 3-метил-1 Нпиразол-5-карбоновой кислоты и гидрохлорида 2-(5-(3,4-дихлорфенил)фуран-2-ил)этанамина. Сырой продукт очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент: смесь 0-100% EtOAc/гептан) с получением 301 мг (28%) указанного в заголовке соединения. 1(д, 1 Н), 7,63 (м, 2 Н), 7,85 (с, 1 Н), 8,16 (т, 1 Н), 13,86 (с, 1 Н). Пример 23. N-(2-(5-(3,4-Дицианофенил)фуран-2-ил)этил)-3-метил-1 Н-пиразол-5-карбоксамид. Указанное в заголовке соединение получали, как в примере 21, но исходя из N-(2-(5-(3,4 дихлорфенил)фуран-2-ил)этил)-3-метил-1 Н-пиразол-5-карбоксамида. Сырой продукт очищали с помощью хроматографии (CombiFlash, 1-я колонка с диоксидом кремния, элюент: смесь 0-10% MeOH/DCM; 2-я колонка С-18 RP, элюент: смесь 0-100% MeCN/вода) с получением 45 мг (16%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):2,24 (с, 3 Н), 2,96 (т, 2 Н), 3,55 (кв, 2 Н), 6,35 (с, 1 Н), 6,43 (д, 1 Н), 7,31(S/R)-N-(1-(5-(3,4-Дихлорфенил)фуран-2-ил)пропан-2-ил)-3-метил-1 Н-пиразол-5 карбоксамид. Указанное в заголовке соединение получали в виде рацемата, следуя способу по примеру 19, но исходя из 3-метил-1 Н-пиразол-5-карбоновой кислоты и гидрохлорида 1-(5-(3,4-дихлорфенил)фуран-2 ил)пропан-2-амина. Таким образом, получали 79 мг (32%) указанного в заголовке соединения. Энантиомеры разделяли с помощью хроматографии (SFC Minigram, Mettler Toledo) с получением 16 мг одного(оптическая чистота 98,8%) (=соединение 24 А) и 16 мг другого (оптическая чистота 98,3%) (=соединение 24 В) энантиомера. Абсолютную конфигурацию разделенных энантиомеров не определяли. Соединение 24 А. 1(S/R)-N-(1-(5-(3,4-Дихлорфенил)фуран-2-ил)пропан-2-ил)-3-(пиридин-4-ил)-1 Нпиразол-5-карбоксамид. Указанное в заголовке соединение получали в виде рацемата, следуя способу по примеру 19, но исходя из 5-пиридин-4-ил-4 Н-пиразол-3-карбоновой кислоты и гидрохлорида 1-(5-(3,4 дихлорфенил)фуран-2-ил)пропан-2-амина. Таким образом, получали 90 мг (31%) указанного в заголовке соединения. Энантиомеры разделяли с помощью хроматографии (SFC Milligram, Mettler Toledo) с получением 16 мг одного (оптическая чистота 100%) (=соединение 25 А) и 11 мг другого (оптическая чистота 100%) (=соединение 25 В) энантиомера. Абсолютную конфигурацию разделенных энантиомеров не определяли. Соединение 25 А. 1(с, 1 Н), 7,58 (с, 2 Н), 7,73 (м, 2 Н), 7,79 (с, 1 Н), 8,33 (ушир.с, 1 Н), 8,63 (д, 2 Н), 13,88 (с, 1 Н). Пример 26. 2-[5-(3,4-Дихлорфенил)фуран-2-ил]этиламид 1-(пиридин-2-ил)-1 Н-имидазол-4 карбоновой кислоты. Указанное в заголовке соединение синтезировали из 2-[5-(3,4-дихлорфенил)фуран-2 ил]этиламида 1 Н-имидазол-4-карбоновой кислоты по примеру 15 и 2-бромпиридина по способу, описанному A.K. Verma et al. Tetrahedron Lett. 48 (2007), 4207. Очистка с помощью флэш-хроматографии,используя смесь CH2Cl2/MeOH в качестве градиентного элюента (100:0-99,9:0,1), давала продукт, который растирали в EtOAc при комнатной температуре с получением желаемого продукта. 1a) 2-(2-(3-(3,4-Дихлорфенил)-1 Н-пиразол-1-ил)этил)изоиндолин-1,3-дион. К охлажденной (0 С) суспензии гидрида натрия (96 мг, 2,4 ммоль) в ДМФА (1,0 мл) добавляли 3(3,4-дихлорфенил)-1 Н-пиразол (0,426 г, 2,0 ммоль) в виде раствора в ДМФА (2,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 45 мин. К охлажденной (0 С) реакционной смеси добавляли N-(2-бромэтил)фталимид (0,610 г, 2,4 ммоль) в виде раствора в ДМФА (1,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду (100 мл) и смесь экстрагировали DCM (350 мл). Объединенные органические фазы сушили над Na2SO4 и очищали с помощью хроматографии (CombiFlash, С-18 RP колонка, элюент: смесь 0-100% MeCN/вода) с получением 0,155 г (20%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,98 (т, 2 Н), 4,26 (т, 2 Н), 6,74 (д, 1 Н), 7,45 (дд, 1 Н), 7,50 (д, 1 Н),7,55 (д, 1 Н), 7,82 (м, 5 Н).b) 2-(3-(3,4-Дихлорфенил)-1 Н-пиразол-1-ил)этанамин. К перемешиваемому раствору 2-(2-(3-(3,4-дихлорфенил)-1 Н-пиразол-1-ил)этил)изоиндолин-1,3 диона (155 мг, 0,40 ммоль) в EtOH (4,0 мл) добавляли гидразингидрат (0,194 мл, 4,0 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 1 ч и оставляли охлаждаться до комнатной температуры. Добавляли воду (20 мл) и смесь экстрагировали DCM (320 мл). Объединенные органические фазы сушили над Na2SO4 и упаривали с получением количественного выхода указанного в заголовке соединения (102 мг, 100%). Продукт использовали на следующей стадии без анализа. с) N-(2-(3-(3,4-Дихлорфенил)-1 Н-пиразол-1-ил)этил)-3-метил-1 Н-пиразол-5-карбоксамид. К перемешиваемому раствору 3-метил-1 Н-пиразол-5-карбоновой кислоты (104 мг, 0,83 ммоль) вDCM (2,0 мл) добавляли DIPEA (0,144 мл, 0,83 ммоль), EDCI (159 мг, 0,83 ммоль) и HOBt (112 мг, 0,83 ммоль). Через 10 мин в реакционную смесь добавляли 2-(3-(3,4-дихлорфенил)-1 Н-пиразол-1-ил)этанамин(102 мг, 0,40 ммоль) в виде раствора в DCM (2,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли DCM и промывали насыщенным водным раствором NaHCO3 и водой. Органическую фазу сушили над Na2SO4, упаривали и очищали с помощью хроматографии (CombiFlash, 1-я колонка с диоксидом кремния, элюент: смесь 0-10% MeOH/DCM; 2-я колонка С-18 RP, элюент: смесь 0-100% MeCN/вода) с получением 65 мг (45%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):2,24 (с, 3 Н), 3,64 (кв, 2 Н), 4,31 (т, 2 Н), 6,36 (с, 1 Н), 6,81 (д, 1 Н), 7,65a) 2-Метил-4-(1 Н-пиразол-3-ил)бензонитрил. Указанное в заголовке соединение синтезировали, следуя способу по примеру 34(b), но исходя из 4 бром-2-метилбензонитрила и 1-(тетрагидро-2 Н-пиран-2-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)-1 Н-пиразола. 1 Н-ЯМР (400 МГц; CDCl3):2,60 (с, 3 Н), 6,69 (д, 1 Н), 7,64 (м, 2 Н), 7,70 (д, 1 Н), 7,78 (с, 1 Н), 10,47b) 4-(1-(2-(1,3-Диоксоизоиндолин-2-ил)этил)-1 Н-пиразол-3-ил)-2-метилбензонитрил. 2-Метил-4-(1 Н-пиразол-3-ил)бензонитрил (0,949 г, 5,2 ммоль) подвергали взаимодействию с N-(2 бромэтил)фталимидом (1,58 г, 6,2 ммоль), следуя способу по примеру 27(а). Сырой продукт очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент: смесь 0-100%c) 4-(1-(2-Аминоэтил)-1 Н-пиразол-3-ил)-2-метилбензонитрил. 4-(1-(2-(1,3-Диоксоизоиндолин-2-ил)этил)-1 Н-пиразол-3-ил)-2-метилбензонитрил (0,590 г, 1,66 ммоль) обрабатывали гидразингидратом, следуя способу по примеру 27(b). Таким образом, получали 362 мг (96%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):2,52 (с, 3 Н), 2,95 (т, 2 Н), 4,13 (т, 2 Н), 6,84 (д, 1 Н), 7,77 (м, 2 Н), 7,82(362 мг, 1,60 ммоль), следуя способу по примеру 34(d). Сырой продукт очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент: смесь 0-20% MeOH/DCM) с получением 44 мгa) (S)-4-(1-(2-(1,3-Диоксоизоиндолин-2-ил)пропил)-1 Н-пиразол-3-ил)-2-метилбензонитрил. 2-Метил-4-(1 Н-пиразол-3-ил)бензонитрил (2,35 г, 12,2 ммоль) подвергали взаимодействию с (S)-2(1-бромпропан-2-ил)изоиндолин-1,3-дионом (3,61 г, 13,5 ммоль), следуя способу по примеру 27(а). Сырой продукт очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент: смесь 0-100% EtOAc/гептан) с получением 1,15 г (25%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; CDCl3):1,59 (д, 3 Н), 2,47 (с, 3 Н), 4,41 (м, 1 Н), 4,83 (м, 2 Н), 6,46 (д, 1 Н), 7,39 (м,2 Н), 7,47 (м, 2 Н), 7,69 (м, 2 Н), 7,78 (м, 2 Н).(S)-4-(1-(2-(1,3-Диоксоизоиндолин-2-ил)пропил)-1 Н-пиразол-3-ил)-2-метилбензонитрил (481 мг, 1,3 ммоль) обрабатывали гидразингидратом, следуя способу по примеру 27(b). Сырой продукт очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент: смесь 0-20% MeOH/DCM) с получением 59 мг (19%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):0,96 (д, 3 Н), 2,52 (с, 3 Н), 3,23 (м, 1 Н), 4,00 (м, 2 Н), 6,85 (д, 1 Н), 7,77(S)-N-(1-(3-(4-Циано-3-метилфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-3-(пиридин-4-ил)-1 Нпиразол-5-карбоксамид. Указанное в заголовке соединение синтезировали, исходя из 5-пиридин-4-ил-4 Н-пиразол-3 карбоновой кислоты (47 мг, 0,25 ммоль) и (S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2 метилбензонитрила (59 мг, 0,25 ммоль), следуя способу по примеру 34(d). Сырой продукт очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент: смесь 0-20% MeOH/DCM) с получением 41 мг (40%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; MeOD):1,24 (д, 3 Н), 2,52 (с, 3 Н), 4,32 (м, 2 Н), 4,53 (м, 1 Н), 6,59 (д, 1 Н), 7,15D-Аланинол (3,90 мл, 50 ммоль) и ангидрид фталевой кислоты (7,41 г, 50 ммоль) нагревали при температуре 160 С в течение 30 мин. В охлажденную реакционную смесь добавляли ледяную воду иDCM. Органическую фазу собирали и водную фазу экстрагировали DCM. Объединенные органические фазы сушили над Na2SO4 и упаривали с получением 8,75 г (85%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,32 (д, 3 Н), 3,54 (м, 1 Н), 3,84 (м, 1 Н), 4,26 (м, 1 Н), 4,91 (м, 1 Н),7,84 (м, 4 Н).(R)-2-(1-Гидроксипропан-2-ил)изоиндолин-1,3-дион (8,75 г, 43 ммоль) и трибромид фосфора (2,73 мл, 29 ммоль) нагревали при температуре 175 С в течение 50 мин. В охлажденную реакционную смесь добавляли лед (50 мл). Полученный таким образом осадок фильтровали, промывали водой и сушили в вакууме с получением 11,1 г (97%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,50 (д, 3 Н), 3,85 (м, 1 Н), 4,01 (м, 1 Н), 4,49 (м, 1 Н), 7,88 (м, 4 Н).c) (R)-4-(1-(2-(1,3-Диоксоизоиндолин-2-ил)пропил)-1 Н-пиразол-3-ил)-2-метилбензонитрил. 2-Метил-4-(1 Н-пиразол-3-ил)бензонитрил (2,23 г, 12,2 ммоль) подвергали взаимодействию с (R)-2(1-бромпропан-2-ил)изоиндолин-1,3-дионом (3,92 г, 14,6 ммоль), следуя способу по примеру 27(а). Сырой продукт очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент: смесь 0-100% EtOAc/гептан) с получением 0,753 г (17%) указанного в заголовке соединения. Продукт использовали на следующей стадии без анализа.(R)-4-(1-(2-(1,3-Диоксоизоиндолин-2-ил)пропил)-1 Н-пиразол-3-ил)-2-метилбензонитрил (753 мг, 2,0 ммоль) обрабатывали гидразингидратом, следуя способу по примеру 27(b). Сырой продукт очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент: смесь 0-20% MeOH/DCM) с получением 82 мг (17%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):0,96 (д, 3 Н), 2,52 (с, 3 Н), 3,22 (м, 1 Н), 3,99 (м, 2 Н), 6,84 (д, 1 Н), 7,77(R)-N-(1-(3-(4-Циано-3-метилфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-3-(пиридин-4-ил)-1 Нпиразол-5-карбоксамид. Указанное в заголовке соединение синтезировали, исходя из 5-пиридин-4-ил-4 Н-пиразол-3 карбоновой кислоты (13 мг, 0,069 ммоль) и (R)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2 метилбензонитрила (17 мг, 0,071 ммоль), следуя способу по примеру 34(d). Сырой продукт очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент: смесь 0-20% MeOH/DCM) с получением 19 мг (67%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,17 (д, 3 Н), 2,48 (с, 3 Н), 4,31 (м, 2 Н), 4,47 (м, 1 Н), 6,82 (д, 1 Н), 7,31N-(2-(3-(4-Циано-3-метилфенил)-1 Н-пиразол-1-ил)этил)-3-метил-1 Н-пиразол-5 карбоксамид. Указанное в заголовке соединение синтезировали, следуя способу по примеру 28(d), исходя из 3 метил-1 Н-пиразол-5-карбоновой кислоты. Сырой продукт очищали с помощью хроматографии (CombiFlash, 1-я колонка с диоксидом кремния, элюент: смесь 0-15% MeOH/DCM; 2-я колонка С-18 RP, элюент: смесь 0-100% MeCN/вода) с получением 39 мг (42%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):2,24 (с, 3 Н), 2,52 (с, 3 Н), 3,65 (кв, 2 Н), 4,33 (т, 2 Н), 6,36 (с, 1 Н), 6,83(д, 1 Н), 7,79 (м, 3 Н), 7,88 (с, 1 Н), 8,24 (ушир.с, 1 Н), 12,85 (ушир.с, 1 Н). Пример 32. (S)-N-(1-(3-(4-Циано-3-метилфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-3-(фуран-2-ил)-1 Нпиразол-5-карбоксамид. Указанное в заголовке соединение синтезировали, следуя способу по примеру 29, но заменяя 5 пиридин-4-ил-4 Н-пиразол-3-карбоновую кислоту на 5-(2-фурил)-4 Н-пиразол-3-карбоновую кислоту. Сырой продукт очищали с помощью хроматографии (CombiFlash, колонка с диоксидом кремния, элюент: смесь 0-100% EtOAc/гептан) с получением 39 мг (75%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,14 (д, 3 Н), 2,49 (с, 3 Н), 4,30 (м, 2 Н), 4,45 (м, 1 Н), 6,61 (м, 1 Н),6,80 (с, 1 Н), 6,82 (д, 1 Н), 6,91 (с, 1 Н), 7,76 (м, 3 Н), 7,80 (д, 1 Н), 7,85 (с, 1 Н), 8,36 (д, 1 Н), 13,69 (с, 1 Н). Пример 33. (R)-N-(1-(3-(4-Циано-3-метилфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-3-(морфолин-4 карбонил)-1 Н-пиразол-5-карбоксамид. Указанное в заголовке соединение синтезировали, следуя способу по примеру 30, но заменяя 5 пиридин-4-ил-4 Н-пиразол-3-карбоновую кислоту на 3,5-пиразолдикарбоновую кислоту. Полученную таким образом(R)-5-(1-(3-(4-циано-3-метилфенил)-1 Н-пиразол-1-ил)пропан-2-илкарбамоил)-1 Нпиразол-3-карбоновую кислоту конденсировали с морфолином согласно способу синтеза 2-[5-(3,4 дихлорфенил)фуран-2-ил]этиламида 5-(пиперазин-1-карбонил)-2 Н-пиразол-3-карбоновой кислоты,пример 1, но заменяя пиперазин на морфолин. Сырой продукт очищали с помощью хроматографии(S)-3-Ацетил-N-(1-(3-(3-хлор-4-цианофенил)-1 Н-пиразол-1-ил)пропан-2-ил)-1 Нпиразол-5-карбоксамид. а) 2-Хлор-4-(1-(тетрагидро-2 Н-пиран-2-ил)-1 Н-пиразол-5-ил)бензонитрил. 1-(Тетрагидро-2 Н-пиран-2-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1 Н-пиразол (6,5 г; 23,28 ммоль) и 4-бром-2-хлорбензонитрил (4 г; 18,48 ммоль) растворяли в ТГФ (65 мл). К этой смеси добавляли хлорид бис-(трифенилфосфин)палладия(II) (0,65 г; 0,92 ммоль), карбонат натрия (4,7 г; 44,3 ммоль) и 18 мл воды и реакционную смесь перемешивали при температуре 35 С в течение 2,5 ч. Растворители отгоняли почти досуха и добавляли воду (48 мл). Спустя 30 мин перемешивания выпавший в осадок продукт фильтровали и к осадку добавляли 32 мл этанола. Суспензию перемешивали в течение 15 мин при комнатной температуре и 30 мин при температуре -10 С, затем фильтровали с получением 3,7 г продукта. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,63-1,54 (м, 3 Н), 1,84-1,80 (м, 1 Н), 1,97-1,94 (м, 1 Н), 2,39-2,35 (м,1 Н), 3,63-3,57 (м, 1 Н), 3,99 (м, 1 Н), 5,32-5,27 (м, 1 Н), 6,72 (д, 1 Н), 7,65 (д, 1 Н), 7,72 (м, 1 Н), 7,92 (д, 1 Н),8,14 (д, 1 Н).b) 2-Хлор-4-(1 Н-пиразол-5-ил)бензонитрил. 2-Хлор-4-(1-(тетрагидро-2 Н-пиран-2-ил)-1 Н-пиразол-5-ил)бензонитрил (3,67 г; 12,75 ммоль) в атмосфере азота добавляли к 8 мл этанола. Медленно добавляли 15,5 мл 10% HCl (газ) в EtOH и температуру повышали до 30 С при перемешивании смеси в течение 1 ч. Температуру затем понижали до -10 С и смесь опять перемешивали в течение 30 мин, после чего продукт выпадал в виде осадка HCl соли,фильтровали и два раза промывали 2 мл этанола. Продукт сушили в вакууме при температуре 40 С. Выход 2,8 г. В смесь 8 мл воды и 14 мл МеОН в атмосфере азота добавляли гидрохлорид 2-хлор-4-(1 Н-пиразол 5-ил)бензонитрила (2,8 г; 11,47 ммоль). К смеси добавляли 50%-й гидроксид натрия (1,5 мл; 28,7 ммоль),поддерживая температуру в процессе добавления ниже 25 С. Смесь перемешивали в течение 2 ч, осадок фильтровали и два раза промывали 3 мл тепловатой воды. Продукт сушили в вакууме при температуре при температуре 40 С. Выход 1,97 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):6,99 (т, 1 Н), 7,89 (м, 1 Н), 7,99 (д, 2 Н), 8,15 (с, 1 Н), 13,27 (с, 1 Н).c) (S)-4-(1-(2-Аминопропил)-1 Н-пиразол-3-ил)-2-хлорбензонитрил. 2-Хлор-4-(1 Н-пиразол-3-ил)бензонитрил (4,00 г; 19,64 ммоль), (S)-трет-бутил-1-гидроксипропан-2 ил карбамат (3,79 г; 21,61 ммоль) и трифенилфосфин растворяли в сухом ТГФ в атмосфере азота и перемешивали. Добавляли по каплям диизопропилазодикарбоксилат (7,74 мл; 39,3 ммоль) и реакционную колбу охлаждали на ледяной бане. Реакционную смесь перемешивали при комнатной температуре в течение ночи (18 ч) и упаривали досуха. Для удаления защитной Вос группы к остатку после упаривания добавляли 200 мл раствора 10% HCl/EtOH, перемешивали в течение 20 ч при комнатной температуре и упаривали досуха. К остатку после упаривания добавляли 100 мл воды и промывали 3120 мл DCM для удаления остатков реагентов. рН водной фазы устанавливали равным 12 путем добавления 2 М раствора NaOH, промывали 380 мл DCM и органическую фазу сушили над Na2SO4. Органическую фазу фильтровали и упаривали с получением 2,605 г указанного в заголовке соединения.(S)-3-Ацетил-N-(1-(3-(3-хлор-4-цианофенил)-1 Н-пиразол-1-ил)пропан-2-ил)-1 Н-пиразол-5 карбоксамид. 3-Ацетил-1 Н-пиразол-5-карбоновую кислоту (0,59 г; 3,84 ммоль) и DIPEA (1,0 мл; 5,75 ммоль) растворяли в 4 мл сухого DCM. Добавляли при комнатной температуре безводный HOBt (0,78 г; 5,75 ммоль) и EDCI (1,10 г; 5,75 ммоль). В 4 мл DCM растворяли (S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2 хлорбензонитрил (1,00 г; 3,84 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли 40 мл DCM и органический слой промывали 315 мл воды. Объединенные водные фазы промывали 220 мл DCM. Обе органические фазы сушили над Na2SO4, фильтровали и упаривали досуха. Обе фракции сырого продукта объединяли и очищали с помощью CombiFlash (2% МеОН вa) 4-(1-(2-Аминоэтил)-1 Н-пиразол-3-ил)-2-хлорбензонитрил. Указанное в заголовке соединение получали, следуя способу по примеру 34(с), исходя из 2,3 г гидрохлорида 2-хлор-4-(1 Н-пиразол-5-ил)бензонитрила, 1,7 мл DIPEA и 1,7 г трет-бутил 2 гидроксиэтилкарбамата, получая 2,08 г продукта. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,56 (с, 2 Н), 2,97 (т, 2 Н), 4,13-4,17 (т, 2 Н), 6,97 (с, 1 Н), 7,87 (д, 1 Н),7,93-8,02 (м, 2 Н), 8,10 (д, 1 Н).b) 5-(2-(3-(3-Хлор-4-цианофенил)-1 Н-пиразол-1-ил)этилкарбамоил)пиразин-2-карбоновая кислота. Пиразин-2,5-дикарбоновую кислоту (0,53 г; 3,18 ммоль), безводный HOBt (0,43 г; 3,18 ммоль), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,61 г; 3,18 ммоль) и DIPEA (0,55 мл; 3,18 ммоль) растворяли в 5 мл сухого DCM. В 5 мл сухого DCM растворяли 4-(1-(2-аминоэтил)-1 Н-пиразол-3 ил)-2-хлорбензонитрил (0,6 г; 2,12 ммоль) и DIPEA (0,55 мл; 3,18 ммоль) и добавляли по каплям к предыдущей смеси. Реакционную смесь перемешивали в течение ночи, после чего добавляли пиразин-2,5 дикарбоновую кислоту (0,27 г; 1,59 ммоль), безводный HOBt (0,52 г; 3,81 ммоль), гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида (0,41 г; 2,12 ммоль) и DIPEA (0,37 мл; 2,12 ммоль) для доведения реакции до завершения. Через 2,5 ч смесь разбавляли 20 мл DCM. После добавления 10 мл воды продукт осаждали в виде осадка и фильтровали, получая 0,42 г сырого продукта, который использовали без дополнительной очистки.(0,11 г; 0,29 ммоль), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,083 г; 0,43 ммоль),безводный HOBt (0,058 г; 0,43 ммоль), DIPEA (0,075 мл; 0,43 ммоль) и морфолин (0,025 г; 0,29 ммоль) растворяли в 5 мл сухого DCM и перемешивали в течение ночи. Раствор разбавляли 10 мл DCM и промывали 35 мл воды. Объединенные водные фазы экстрагировали с помощью 25 мл DCM, объединенные органические фазы сушили над Na2SO4, фильтровали и упаривали досуха. Продукт очищали, используя флэш-хроматографию и смесь DCM/MeOH в качестве градиентного элюента. Выход 0,06 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,45 (т, 2 Н), 3,56 (т, 2 Н), 3,69 (с, 4 Н), 3,76-3,80 (м, 2 Н), 4,42 (т, 2 Н),6,97 (д, 1 Н), 7,87 (д, 1 Н), 7,94-8,01 (м, 2 Н), 8,01 (с, 1 Н), 8,93 (д, 1 Н), 9,13 (с, 1 Н), 9,22-9,25 (т, 1 Н). Пример 36. N-(2-(3-(3-Хлор-4-цианофенил)-1 Н-пиразол-1-ил)этил)-5-оксо-1-фенил-2,5-дигидро-1 Нпиразол-3-карбоксамид.a) Метил 5-оксо-1-фенил-2,5-дигидро-1 Н-пиразол-3-карбоксилат. Фенилгидразин (0,5 г; 4,62 ммоль), диметиловый эфир ацетилендикарбоновой кислоты (0,66 г; 4,62 ммоль) и соль пиридина и 4-толуолсульфоновой кислоты (1,16 г; 4,62 ммоль) растворяли в 7 мл сухого ТГФ в атмосфере азота, раствор перемешивали в течение 2 ч при комнатной температуре, после чего добавляли 7 мл 10% раствора HCl (газ) в EtOAc, смесь нагревали при температуре 67 С в течение 5 ч. Реакционную смесь упаривали досуха и к остатку добавляли 6 мл DCM. Органическую фазу промывали 8 мл воды и объединенные водные фазы экстрагировали с помощью 26 мл DCM. Объединенные органические фазы промывали один раз 12 мл воды, сушили над Na2SO4, фильтровали и упаривали досуха с получением 0,35 г продукта, который использовали как таковой без дополнительной очистки.b) 5-Оксо-1-фенил-2,5-дигидро-1 Н-пиразол-3-карбоновая кислота. Метил 5-оксо-1-фенил-2,5-дигидро-1 Н-пиразол-3-карбоксилат (0,35 г; 1,60 ммоль) в 5 мл 2 М раствора NaOH нагревали при температуре 60 С в течение 2 ч, после чего реакционную смесь подкисляли 1,5 мл концентрированной HCl, что вызывало образование продукта в виде осадка желтого цвета. Фильтрование давало 0,18 г продукта. 1 Н-ЯМР (400 МГц; d6-ДМСО):5,97 (с, 1 Н), 7,33-7,37 (м, 1H), 7,48-7,52 (м, 2H), 7,74 (м, 2 Н). с) N-(2-(3-(3-Хлор-4-цианофенил)-1 Н-пиразол-1-ил)этил)-5-оксо-1-фенил-2,5-дигидро-1 Н-пиразол 3-карбоксамид. 5-Оксо-1-фенил-2,5-дигидро-1 Н-пиразол-3-карбоновую кислоту (0,05 г; 0,24 ммоль), HOBt (0,049 г; 0,37 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,07 г; 0,37 ммоль) добавляли к 2,5 мл DCM. К этой смеси добавляли по каплям 4-(1-(2-аминоэтил)-1 Н-пиразол-3-ил)-2 хлорбензонитрил (0,06 г; 0,24 ммоль) и DIPEA (0,064 мл; 0,37 ммоль) и смесь перемешивали в течение ночи, после чего добавляли 10 мл DCM. Смесь промывали 35 мл воды и объединенные водные фазы экстрагировали с помощью 25 мл DCM. Объединенные органические слои сушили над Na2SO4, фильтровали и упаривали досуха. Продукт очищали с помощью флэш-хроматографии, используя смесьDCM/MeOH в качестве градиентного элюента. Объединенные фракции давали 18 мг продукта. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,23 (с, 1 Н), 3,65-3,70 (м, 2 Н), 4,37 (т, 2 Н), 5,83 (с, 1 Н), 6,97 (д, 1 Н),7,31-7,35 (т, 1 Н), 7,45-7,49 (т, 2 Н), 7,76 (д, 2 Н), 7,85-7,89 (м, 2 Н), 7,94-7,96 (м, 1 Н), 8,09 (д, 1 Н), 8,28 (м,1 Н). Пример 37. 3-Метил-N-(2-(3-(8-нитроизохинолин-5-ил)-1 Н-пиразол-1-ил)этил)-1 Н-пиразол-5 карбоксамид.a) 8-Нитро-5-(1-(тетрагидро-2 Н-пиран-2-ил)-1 Н-пиразол-5-ил)изохинолин. Указанное в заголовке соединение получали, следуя способу по примеру 34(а), исходя из 0,5 г 5 бром-8-нитроизохинолина. Выход 0,49 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,43-1,51 (м, 3 Н), 1,80-1,89 (м, 2 Н), 2,32-2,33 (м, 1 Н), 3,25-3,27 (м,1 Н), 3,76-3,78 (м, 1 Н), 5,06 (д, 1 Н), 6,65 (д, 1 Н), 6,68 (д, 1 Н), 7,78 (д, 1 Н), 8,02 (д, 1 Н), 8,54 (д, 1 Н), 8,72 (д,- 24021170b) 8-Нитро-5-(1 Н-пиразол-5-ил)изохинолин. Указанное в заголовке соединение синтезировали, исходя из 8-нитро-5-(1-(тетрагидро-2 Н-пиран-2 ил)-1 Н-пиразол-5-ил)изохинолина (0,49 г), следуя способу по примеру 34(b). Выход 0,35 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):6,92 (д, 1 Н), 8,00 (ушир.с, 1 Н), 8,18 (д, 1 Н), 8,48 (д, 1 Н), 8,75 (д,1 Н), 8,87 (ушир.с, 1 Н), 9,84 (с, 1 Н), 13,50 (ушир.с, 1 Н).c) 2-(3-(Изохинолин-5-ил)-1 Н-пиразол-1-ил)этанамин. К 0,50 г 8-нитро-5-(1 Н-пиразол-5-ил)изохинолина добавляли 5 мл сухого ДМФА и смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли 0,65 г 2-(третбутоксикарбониламино)этил метансульфоната, разбавленного 1,5 мл сухого ДМФА, и смесь подвергали микроволновому воздействию в течение 30 мин при температуре 160 С. После выливания смеси в воду ее экстрагировали EtOAc. Объединенные органические фазы промывали водой и насыщенным солевым раствором, сушили с помощью Na2SO4 и упаривали. Сырой продукт очищали с помощью CombiFlash(5% МеОН в DCM). Фракции продукта объединяли и упаривали с получением 0,59 г Вос-защищенного продукта. Для удаления защитной Вос группы к остатку после упаривания добавляли 8 мл раствора 10%HCl/EtOH, перемешивали при комнатной температуре до исчезновения исходного продукта согласно данным ТСХ. К смеси добавляли 3 мл диэтилового эфира, осадок фильтровали, промывали диэтиловым эфиром и сушили с получением 0,30 г продукта в виде HCl соли. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,57 (ушир.с, 2 Н), 3,04 (т, 2 Н), 4,25 (т, 2 Н), 6,90 (д, 1 Н), 8,00 (д,1 Н), 8,17 (д, 1 Н), 8,47 (д, 1 Н), 8,75 (д, 1 Н), 8,91 (д, 1 Н), 9,83 (с, 1 Н).d) 3-Метил-N-(2-(3-(8-нитроизохинолин-5-ил)-1 Н-пиразол-1-ил)этил)-1 Н-пиразол-5-карбоксамид. Указанное в заголовке соединение синтезировали, исходя из 2-(3-(изохинолин-5-ил)-1 Н-пиразол-1 ил)этанамина (0,15 г) и 3-метил-1 Н-пиразол-5-карбоновой кислоты (0,080 г), следуя способу по примеру 34(d). Выход 0,15 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):2,25 (с, 3 Н), 3,75 (т, 2 Н), 4,56 (т, 2 Н), 6,35 (с, 1 Н), 6,88 (д, 1 Н), 7,96a) 5-(2-Метокси-4-нитрофенил)-1-(тетрагидро-2 Н-пиран-2-ил)-1 Н-пиразол. Указанное в заголовке соединение получали, следуя способу по примеру 34(а), исходя из 2,46 г 1 йод-2-метокси-4-нитробензола. Выход 1,88 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,41-1,63 (м, 3 Н), 1,80-1,87 (м, 1 Н), 1,90-1,98 (м, 1 Н), 2,26-2,38 (м,1 Н), 3,35-3,42 (м, 1 Н), 3,80-3,85 (м, 1 Н), 3,92 (с, 3 Н), 5,05 (д, 1 Н), 6,44 (д, 1 Н), 7,60 (д, 1 Н), 7,61 (д, 1 Н),7,91 (д, 1 Н), 7,95 (д, 1 Н).b) 5-(2-Метокси-4-нитрофенил)-1 Н-пиразол. Указанное в заголовке соединение синтезировали, исходя из 1,88 г 5-(2-метокси-4-нитрофенил)-1(тетрагидро-2 Н-пиран-2-ил)-1 Н-пиразола, следуя способу по примеру 34(b). Выход 1,32 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):4,02 (с, 3 Н), 6,90 (д, 1 Н), 7,82-7,86 (м, 3 Н), 8,21 (д, 1 Н), 13,2c) 2-(3-(2-Метокси-4-нитрофенил)-1 Н-пиразол-1-ил)этанамин. Указанное в заголовке соединение синтезировали, исходя из 5-(2-метокси-4-нитрофенил)-1 Нпиразола (1,00 г) и 2-(трет-бутоксикарбониламино)этил метансульфоната (1,42 г), следуя способу по примеру 37(с). Выход 0,24 г (в виде HCl соли). 1 Н-ЯМР (400 МГц; d6-ДМСО):3,32 (т, 2 Н), 4,02 (с, 3 Н), 4,47 (т, 2 Н), 6,94 (д, 1 Н), 7,88-7,93 (м, 3 Н),8,12 (ушир.с, 2 Н), 8,22 (д, 1 Н).d) 3-(Фуран-2-ил)-N-(2-(3-(2-метокси-4-нитрофенил)-1 Н-пиразол-1-ил)этил)-1 Н-пиразол-5 карбоксамид. Указанное в заголовке соединение синтезировали, исходя из 2-(3-(2-метокси-4-нитрофенил)-1 Нпиразол-1-ил)этанамина (0,11 г) и 3-(фуран-2-ил)-1 Н-пиразол-5-карбоновой кислоты (0,079 г), следуя способу по примеру 34(d). Выход 0,11 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,71 (т, 2 Н), 4,01 (с, 3 Н), 4,39 (т, 2 Н), 6,57-6,68 (м, 2 Н), 6,85-6,89 (м,2 Н), 7,76-7,93 (м, 4 Н), 8,15-8,22 (м, 1 Н), 8,53 (ушир.с, 1 Н), 13,71 (ушир.с, 1 Н).(3-хлорпиридил)палладий(II) дихлорид) (0,11 г), K2CO3 (2,27 г) в ДМФА (30 мл) и воду (3 мл) перемешивали в атмосфере аргона при температуре 90 С в течение 2,5 ч. После выливания смеси в воду осуществляли экстракцию с помощью EtOAc. Объединенные органические фазы промывали 5% раствором NaHCO3, водой и насыщенным солевым раствором, сушили Na2SO4 и упаривали. Остаток растирали в этаноле. Осадок фильтровали и промывали водой. Выход 1,96 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,50-1,65 (м, 3 Н), 1,83-1,87 (м, 1 Н), 1,95-1,99 (м, 1 Н), 2,33-2,42 (м,1 Н), 3,60-3,67 (м, 1 Н), 3,95-4,00 (м, 1 Н), 5,34 (д, 1 Н), 6,82 (д, 1 Н), 7,68 (д, 1 Н), 8,11 (дд, 1 Н), 8,32 (д, 1 Н),8,54 (д, 1 Н).b) 2-Нитро-5-(1 Н-пиразол-5-ил)бензонитрил. Указанное в заголовке соединение синтезировали, исходя из 1,96 г 2-нитро-5-(1-(тетрагидро-2 Нпиран-2-ил)-1 Н-пиразол-5-ил)бензонитрила, следуя способу по примеру 34(b). Выход 1,40 г. 1c) 5-(1-(2-Аминоэтил)-1 Н-пиразол-3-ил)-2-нитробензонитрил. Указанное в заголовке соединение синтезировали, исходя из 2-нитро-5-(1 Н-пиразол-5 ил)бензонитрила (1,00 г) и 2-(трет-бутоксикарбониламино)этил метансульфоната (1,45 г), следуя способу по примеру 37(с). Выход 0,32 г (в виде HCl соли). 1 Н-ЯМР (400 МГц; d6-ДМСО):3,34 (т, 2 Н), 4,50 (т, 2 Н), 7,15 (д, 1 Н), 7,99 (д, 1 Н), 8,21 (ушир.с,2 Н), 8,39 (дд, 1 Н), 8,45 (д, 1 Н), 8,61 (д, 1 Н).N-(2-(3-(3-Циано-4-нитрофенил)-1 Н-пиразол-1-ил)этил)-3-(пиридин-2-ил)-1 Н-пиразол-5 карбоксамид. Указанное в заголовке соединение синтезировали, исходя из 5-(1-(2-аминоэтил)-1 Н-пиразол-3-ил)2-нитробензонитрила (0,10 г) и 3-(пиридин-2-ил)-1 Н-пиразол-5-карбоновой кислоты (0,077 г), следуя способу по примеру 34(d). Выход 0,21 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,75 (т, 2 Н), 4,41 (т, 2 Н), 7,09 (с, 1 Н), 7,24-7,39 (м, 2 Н), 7,82-7,91 (м,3 Н), 8,37-8,70 (м, 5 Н), 13,84 (ушир.с, 1 Н). Пример 40. N-(2-(3-(3,4-Дицианофенил)-1 Н-пиразол-1-ил)этил)-3-(пиридин-2-ил)-1 Н-пиразол-5 карбоксамид.a) 4-(1-(Тетрагидро-2 Н-пиран-2-ил)-1 Н-пиразол-5-ил)фталонитрил. Указанное в заголовке соединение получали, следуя способу по примеру 34(а), исходя из 2,29 г 4 йодфталонитрила. Выход 2,28 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,50-1,65 (м, 3 Н), 1,82-1,86 (м, 1 Н), 1,94-1,99 (м, 1 Н), 2,32-2,41 (м,1 Н), 3,58-3,64 (м, 1 Н), 3,94-3,97 (м, 1 Н), 5,33 (д, 1 Н), 6,76 (д, 1 Н), 7,67 (д, 1 Н), 8,06 (дд, 1 Н), 8,29 (д, 1 Н),8,31 (д, 1 Н).b) 4-(1 Н-Пиразол-5-ил)фталонитрил. Указанное в заголовке соединение синтезировали, исходя из 2,28 г 4-(1-(тетрагидро-2 Н-пиран-2 ил)-1 Н-пиразол-5-ил)фталонитрила, следуя способу по примеру 34(b). Выход 1,53 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):7,05 (д, 1 Н), 7,91 (ушир.с, 1 Н), 8,16 (д, 1 Н), 8,34 (дд, 1 Н), 8,54 (д,1 Н), 13,36 (ушир.с, 1 Н).(0,38 г) и 2-(трет-бутоксикарбониламино)этил метансульфоната (0,61 г), следуя способу по примеру 37(с). Выход 0,050 г (в виде HCl соли). 1 Н-ЯМР (400 МГц; d4-MeOH):3,50 (т, 2 Н), 4,54 (т, 2 Н), 6,94 (д, 1 Н), 7,81 (д, 1 Н), 7,98 (д, 1 Н), 8,28 бу по примеру 34(d). Выход 0,062 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,72 (т, 2 Н), 4,40 (т, 2 Н), 7,01 (с, 1 Н), 7,27-7,40 (м, 2 Н), 7,88-7,94 (м,3 Н), 8,14 (д, 1 Н), 8,32 (д, 1 Н), 8,35-8,65 (м, 3 Н), 13,9 (ушир.с, 1 Н). Пример 41.EtOH/HCl (50 мл). Смесь перемешивали в течение ночи. Растворитель удаляли путем упаривания. К остатку добавляли воду (20 мл). Эту смесь промывали DCM (220 мл). Добавляли 1 М раствор NaOH до достижения рН 14, затем экстрагировали DCM (320 мл). Органические слои объединяли и упаривали досуха. Флэш-хроматография (градиент DCM:MeOH) давала 97 мг указанного в заголовке соединения. 1 Н-ЯМР (400 МГц; CDCl3):3,19-3,26 (м, 2 Н), 4,04 (с, 3 Н), 4,20-4,28 (м, 2 Н), 6,63 (м, 1 Н), 7,38-7,43b) N-(2-(3-(3-Метокси-4-нитрофенил)-1 Н-пиразол-1-ил)этил)-5-метил-1 Н-пиразол-3-карбоксамид. В стеклянный сосуд отмеривали 3-метилпиразол-5-карбоновую кислоту (70,0 мг, 0,555 ммоль),HOBt (85 мг, 0,629 ммоль) и PS-карбодиимид (672 мг). Добавляли DCM (4 мл) и ДМФА (0,4 мл). Смесь перемешивали в течение 10 мин. Добавляли 2-(3-(3-метокси-4-нитрофенил)-1 Н-пиразол-1-ил)этанаминN-(2-(3-(3-Хлор-4-цианофенил)-1 Н-пиразол-1-ил)этил)-5-(1-метил-1 Н-пиразол-4 ил)изоксазол-3-карбоксамид. В стеклянном сосуде смешивали 5-(1-метил-1 Н-пиразол-4-ил)изоксазол-3-карбоновую кислоту(S)-N-(1-(3-(3-Хлор-4-цианофенил)-1 Н-пиразол-1-ил)пропан-2-ил)-5-(1-метил-1 Нпиразол-4-ил)изоксазол-3-карбоксамид. В стеклянном сосуде смешивали 5-(1-метил-1 Н-пиразол-4-ил)изоксазол-3-карбоновую кислоту(м, 1 Н), 6,63 (д, 1 Н), 6,66 (с, 1 Н), 7,50 (д, 1 Н), 7,69 (д, 1 Н), 7,79-7,94 (м, 4 Н), 8,07 (м, 1 Н). Пример 44. (S)-N-(1-(3-(4-Циано-3-метилфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-5-(1-метил-1 Нпиразол-4-ил)изоксазол-3-карбоксамид. В стеклянном сосуде смешивали 5-(1-метил-1 Н-пиразол-4-ил)изоксазол-3-карбоновую кислотуa) 4-(1-(2-Амино-3-метилбутил)-1 Н-пиразол-3-ил)-2-хлорбензонитрил. Указанное в заголовке соединение получали, следуя способу по примеру 34(с), исходя из 2-хлор-4(1 Н-пиразол-3-ил)бензонитрила (0,2 г; 0,98 ммоль) и трет-бутил 1-гидрокси-3-метилбутан-2-илкарбаматаN-(1-(3-(3-Хлор-4-цианофенил)-1 Н-пиразол-1-ил)-3-метилбутан-2-ил)-3-(пиридин-3-ил)-1 Нпиразол-5-карбоксамид. Указанное в заголовке соединение получали, следуя способу по примеру 34(d), исходя из 4-(1-(2 амино-3-метилбутил)-1 Н-пиразол-3-ил)-2-хлорбензонитрила (0,060 г; 0,21 ммоль) и 5-(пиридин-3-ил)1 Н-пиразол-3-карбоновой кислоты (0,039 г; 0,21 ммоль). Сырой продукт очищали с помощью флэшхроматографии, используя колонку с цианофазой и EtOAc/гептан в качестве элюента. Выход 12%. 1 Н-ЯМР (400 МГц; MeOD):1,14 (м, 6 Н), 1,95 (м, 1 Н), 4,35 (м, 2 Н), 4,55 (м, 1 Н), 6,71 (с, 1 Н), 7,02(м, 1 Н), 7,53 (м, 1 Н), 7,72 (м, 3 Н), 7,95 (с, 1 Н), 8,25 (м, 1 Н), 8,54 (м, 1 Н), 8,88 (м, 1 Н). Пример 46. N-(2-(3-(3-Хлор-4-цианофенил)-1 Н-пиразол-1-ил)этил)пиразоло[1,5-а]пиримидин-2 карбоксамид. Указанное в заголовке соединение получали, следуя способу по примеру 34(d), исходя из пиразоло[1,5-а]пиримидин-2-карбоновой кислоты (0,16 г; 0,97 ммоль) и 4-(1-(2-аминоэтил)-1 Н-пиразол-3-ил)-2 хлорбензонитрила (0,20 г; 0,81 ммоль). Выход 12%. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,75 (кв, 2 Н), 4,41 (т, 2 Н), 6,96 (д, 1 Н), 7,03 (с, 1 Н), 7,19 (м, 1 Н),7,86 (д, 1 Н), 7,97 (м, 2 Н), 8,06 (с, 1 Н), 8,64 (м, 1 Н), 8,71 (м, 1 Н), 9,09 (д, 1 Н). Пример 47. N-(2-(3-(4-Циано-3-нитрофенил)-1 Н-пиразол-1-ил)этил)-3-(пиридин-2-ил)-1 Н-пиразол 5-карбоксамид.a) 2-Нитро-4-(1-(тетрагидро-2 Н-пиран-2-ил)-1 Н-пиразол-5-ил)бензонитрил. Указанное в заголовке соединение синтезировали, исходя из 4-хлор-2-нитробензонитрила (1,50 г) и 1-(тетрагидро-2 Н-пиран-2-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1 Н-пиразола (2,74 г), следуя способу по примеру 39(а). Выход 1,75 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,57 (м, 3 Н), 1,84 (м, 1 Н), 1,97 (м, 1 Н), 2,38-2,47 (м, 1 Н), 3,68-3,75b) 2-Нитро-4-(1 Н-пиразол-5-ил)бензонитрил. Указанное в заголовке соединение синтезировали, исходя из 1,53 г 2-нитро-4-(1-(тетрагидро-2 Нпиран-2-ил)-1 Н-пиразол-5-ил)бензонитрила, следуя способу по примеру 34(b). Выход 1,0 г. 1c) 2-(трет-Бутоксикарбониламино)этил метансульфонат. трет-Бутил N-(2-гидроксиэтил)карбамат (6,0 г), триэтиламин (5,68 мл) растворяли в DCM (50 мл) и в реакционную смесь при температуре 0 С добавляли по каплям метансульфонилхлорид (3,02 мл). Смесь перемешивали в течение 30 мин при температуре 0 С и перемешивание продолжали в течение 2 ч при комнатной температуре. Добавляли воду и смесь экстрагировали DCM. Объединенные органические фазы промывали водой и насыщенным солевым раствором, сушили с помощью Na2SO4 и упаривали. Продукт выдерживали в атмосфере азота. Выход 8,64 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,39 (с, 9 Н), 3,16 (с, 3 Н), 3,23 (кв, 2 Н), 4,16 (т, 2 Н), 7,04 (ушир.с,1 Н).d) трет-Бутил 2-(3-(4-циано-3-нитрофенил)-1 Н-пиразол-1-ил)этилкарбамат. 2-Нитро-4-(1 Н-пиразол-5-ил)бензонитрил (1,0 г), ДМФА (10 мл) и гидрид натрия (60% в масле, 0,24 г) перемешивали в течение 30 мин при комнатной температуре. Добавляли 2-(третбутоксикарбониламино)этил метансульфонат (1,45 г) в ДМФА (3,3 мл) и смесь подвергали микроволновому воздействию в течение 30 мин при температуре 160 С (Biotage Initiator Sixty, работающая в области 2,45 ГГц). После выливания смеси в воду ее экстрагировали EtOAc. Объединенные органические фазы промывали водой и насыщенным солевым раствором, сушили с помощью Na2SO4 и упаривали. Продукт растирали в IPA и фильтровали. Выход 0,92 г. 1 Н-ЯМР (400 МГц; d6-ДМСО):1,35 (с, 9 Н), 3,38 (м, 2 Н), 4,24 (т, 2 Н), 6,92 (м, 1 Н), 7,06 (д, 1 Н), 7,85(3 мл) добавляли раствор смеси 17% HCl-этанол (10 мл) и смесь перемешивали при комнатной температуре до исчезновения исходного продукта. Осадок фильтровали, промывали диэтиловым эфиром и сушили с получением 0,70 г продукта в виде HCl соли. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,31 (м, 2 Н), 4,50 (т, 2 Н), 7,12 (д, 1 Н), 7,99 (д, 1 Н), 8,19 (д, 1 Н),8,27-8,35 (м, 3 Н), 8,37 (дд, 1 Н), 8,73 (д, 1 Н).N-(2-(3-(4-Циано-3-нитрофенил)-1 Н-пиразол-1-ил)этил)-3-(пиридин-2-ил)-1 Н-пиразол-5 карбоксамид. Указанное в заголовке соединение синтезировали, исходя из 4-(1-(2-аминоэтил)-1 Н-пиразол-3-ил)2-нитробензонитрила (300 мг) и 3-(пиридин-2-ил)-1 Н-пиразол-5-карбоновой кислоты (161 мг), следуя способу по примеру 34(d). Выход 166 мг. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,75 (кв, 2 Н), 4,43 (т, 2 Н), 7,09 (д, 1 Н), 7,31 (ушир.с, 1 Н), 7,39 (м,1 Н), 7,88-7,96 (м, 3 Н), 8,20 (д, 1 Н), 8,37 (дд, 1 Н), 8,47-8,57 (м, 1 Н), 8,64 (м, 1 Н), 8,71 (д, 1 Н), 13,90 (м, 1 Н). Пример 48. 3-Ацетил-N-(2-(3-(4-циано-3-нитрофенил)-1 Н-пиразол-1-ил)этил)-1 Н-пиразол-5 карбоксамид. Указанное в заголовке соединение синтезировали, исходя из 4-(1-(2-аминоэтил)-1 Н-пиразол-3-ил)2-нитробензонитрила (150 мг) и 3-ацетил-1 Н-пиразол-5-карбоновой кислоты (94 мг), следуя способу по примеру 34(d). Выход 84 мг. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,30 (с, 3 Н), 3,71 (кв, 2 Н), 4,39 (т, 2 Н), 7,05 (д, 1 Н), 7,27 (ушир.с,1 Н), 7,88 (д, 1 Н), 8,18 (д, 1 Н), 8,33 (д, 1 Н), 8,45-8,75 (м, 1 Н), 8,66 (д, 1 Н), 14,16 (с, 1 Н). Пример 49.N-(2-(3-(4-Циано-3-нитрофенил)-1 Н-пиразол-1-ил)этил)-5-метилизоксазол-3 карбоксамид. Указанное в заголовке соединение синтезировали, исходя из 4-(1-(2-аминоэтил)-1 Н-пиразол-3-ил)2-нитробензонитрила (150 мг) и 5-метилизоксазол-3-карбоновой кислоты (89 мг), следуя способу по примеру 34(d). Выход 9 мг. 1 Н-ЯМР (400 МГц; d6-ДМСО):2,44 (с, 3 Н), 3,70 (кв, 2 Н), 4,40 (т, 2 Н), 6,48 (д, 1 Н), 7,05 (д, 1 Н),7,88 (д, 1 Н), 8,18 (д, 1 Н), 8,32 (дд, 1 Н), 8,67 (д, 1 Н), 8,79 (м, 1 Н). Пример 50. N-(2-(3-(4-Циано-3-нитрофенил)-1 Н-пиразол-1-ил)этил)-5-(пиридин-3-ил)-1 Н-пиразол 3-карбоксамид. Указанное в заголовке соединение синтезировали, исходя из 4-(1-(2-аминоэтил)-1 Н-пиразол-3-ил)2-нитробензонитрила (50 мг) и 3-(пиридин-3-ил)-1 Н-пиразол-5-карбоновой кислоты (44 мг), следуя способу по примеру 34(d). Выход 27 мг. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,74 (м, 2 Н), 4,42 (т, 2 Н), 7,07 (д, 1 Н), 7,17-7,28 (м, 1 Н), 7,50 (м,1 Н), 7,90 (с, 1 Н), 8,05-8,20 (м, 2 Н), 8,31-8,42 (м, 1 Н), 8,52-8,59 (м, 1 Н), 8,69 (д, 1 Н), 8,92-9,04 (м, 1 Н),13,79 (с, 1 Н). Пример 51. 3-Ацетил-N-(2-(3-(3,4-дицианофенил)-1 Н-пиразол-1-ил)этил)-1 Н-пиразол-5 карбоксамид. Указанное в заголовке соединение синтезировали, исходя из 4-(1-(2-аминоэтил)-1 Н-пиразол-3 ил)фталонитрила (50 мг) и 3-ацетил-1 Н-пиразол-5-карбоновой кислоты (34 мг), следуя способу по примеру 34(d). Выход 43 мг. 1 Н-ЯМР (400 МГц; d6-ДМСО):2,49 (с, 3 Н), 3,70 (м, 2 Н), 4,37 (т, 2 Н), 7,00 (д, 1 Н), 7,27 (с, 1 Н), 7,86(д, 1 Н), 8,13 (д, 1 Н), 8,28 (д, 1 Н), 8,45 (д, 1 Н), 8,63 (ушир.с, 1 Н), 14,05 (ушир.с, 1 Н). Пример 52. N-(2-(3-(3,4-Дицианофенил)-1 Н-пиразол-1-ил)этил)-3-(пиридин-3-ил)-1 Н-пиразол-5 карбоксамид. Указанное в заголовке соединение синтезировали, исходя из 4-(1-(2-аминоэтил)-1 Н-пиразол-3 ил)фталонитрила (50 мг) и 3-(пиридин-3-ил)-1 Н-пиразол-5-карбоновой кислоты (42 мг), следуя способу по примеру 34(d). Выход 39 мг. 1 Н-ЯМР (400 МГц; d6-ДМСО):3,73 (кв, 2 Н), 4,40 (т, 2 Н), 7,02 (д, 1 Н), 7,21 (с, 1 Н), 7,49 (м, 1 Н),7,88 (с, 1 Н), 8,11-8,16 (м, 2 Н), 8,30 (дд, 1 Н), 8,40-8,58 (м, 1 Н), 8,48 (д, 1 Н), 8,56 (д, 1 Н), 8,99 (с, 1 Н), 13,78(ушир.с, 1 Н). Пример 53. N-(2-(3-(4-Циано-3-метилфенил)-1H-пиразол-1-ил)этил)-3-(пиридин-3-ил)-1 Н-пиразол 5-карбоксамид. Указанное в заголовке соединение получали, следуя способу по примеру 31, используя в качестве
МПК / Метки
МПК: A61K 31/44, A61K 31/438, A61K 31/416, A61K 31/5377, A61K 31/497, C07D 413/12, C07D 403/12, A61K 31/4523, C07D 401/12, C07D 405/12, C07D 231/14, A61K 31/42, C07D 417/12, A61P 35/00
Метки: андрогеновые, модулирующие, рецепторы, соединения
Код ссылки
<a href="https://eas.patents.su/30-21170-soedineniya-moduliruyushhie-androgenovye-receptory.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, модулирующие андрогеновые рецепторы</a>
Предыдущий патент: Водопроводящий бытовой прибор с дозирующим устройством и устройством ввода
Следующий патент: Способ получения хинолин-3-карбоксамидов
Случайный патент: Водонепроницаемая и паропроницаемая обувная подошва и обувь с такой подошвой