Карбаматные производные алкилгетероциклов, их получение и их применение в терапии
Номер патента: 19742
Опубликовано: 30.05.2014
Авторы: Ваш Жюльен, Саади Мурад, Фэйоль Од, Иэш Филипп, Абуабделла Ахмед, Шерез Натали, Вероник Коринн
Формула / Реферат
1. Соединение, отвечающее формуле (I)

в которой R2 означает атом водорода или фтора либо гидроксил, C1-6-алкил или группу NR8R9;
n означает целое число, равное 1, 2 или 3, и m означает целое число, равное 1 или 2;
А означает ковалентную связь или C1-8-алкиленовую группу;
R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/или R7;
R5 означает группу, выбранную из фенила, пиридинила, пиридазинила, пиримидинила, пиразинила, хинолинила, изохинолинила, фталазинила и хиноксалинила;
R6 означает атом галогена, нитрогруппу, C1-6-алкил, C1-6-алкоксил, C1-6-галогеналкил, C1-6-галогеналкоксил или -О-(C1-3-алкилен)-О-;
R7 означает фенил, который может быть замещен одной или несколькими, одинаковыми или отличными друг от друга, группами R6;
R3 означает трифторметил, C1-6-алкил или атом водорода;
R4 означает группу, выбранную из фуранила, оксазолила, изоксазолила, пиразолила, оксадиазолила, тиадиазолила, имидазолила и триазолила; причем эта группа необязательно замещена одним или несколькими заместителями, выбранными из C1-6-алкила, CO2R8, CONR8R9, CON(R8)(C1-3-алкилен-NR10R11) и фенила; причем фенил может быть замещен одним или несколькими заместителями, выбранными из атома галогена и C1-6-алкоксила;
R8, R9, R10 и R11 означают, независимо друг от друга, атом водорода или C1-6-алкил или с атомом или атомами, с которыми они связаны, образуют в случае NR8R9 пиперазиновый цикл, причем этот цикл необязательно замещен C1-6-алкилом,
в форме основания или аддитивной соли кислоты.
2. Соединение формулы (I) по п.1, отличающееся тем, что n означает целое число, равное 2, и m означает целое число, равное 2, в форме основания или аддитивной соли кислоты.
3. Соединение формулы (I) по п.1 или 2, отличающееся тем, что А означает C1-8-алкиленовую группу, в форме основания или аддитивной соли кислоты.
4. Соединение формулы (I) по любому из пп.1-3, отличающееся тем, что
R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/или R7;
R5 означает фенил, пиридинил, пиридазинил, пиримидинил, пиразинил, хинолинил, фталазинил или хиноксалинил;
R6 означает нитрогруппу, C1-6-алкил, C1-6-алкоксил, C1-6-галогеналкил, C1-6-галогеналкоксил, -О-(C1-3-алкилен)-О- или атом галогена;
R7 означает фенил, который может быть замещен одной или несколькими, одинаковыми или отличными друг от друга, группами R6,
в форме основания или аддитивной соли кислоты.
5. Соединение формулы (I) по любому из пп.1-4, отличающееся тем, что
R4 означает группу, выбранную из оксазолила, изоксазолила, фуранила, имидазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила; причем эта группа необязательно замещена одним или несколькими заместителями, выбранными из С1-6-алкила, COOR8, CON(R8)(С1-3-алкилен-NR10R11), CONR8R9, фенила; причем фенил может быть замещен одним или несколькими заместителями, выбранными из атома галогена или C1-6-алкоксила;
R8 и R9 означают, независимо друг от друга, атом водорода или С1-6-алкил или вместе с атомом, с которым они связаны, образуют пиперазиновый цикл;
R10 и R11 означают, независимо друг от друга, атом водорода или С1-6-алкил,
в форме основания или аддитивной соли кислоты.
6. Соединение формулы (I) по любому из пп.1-5, отличающееся тем, что
R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/или R7;
R5 означает фенил, пиридинил, пиразинил или хинолинил;
R6 означает атом галогена;
R7 означает фенил, который может быть замещен одной или несколькими, одинаковыми или отличными друг от друга, группами R6;
R2 и R3 означают атом водорода;
R4 означает 3-карбамоилизоксазол-5-ил;
n означает целое число, равное 2, и m означает целое число, равное 2;
А означает C1-8-алкиленовую группу,
в форме основания или аддитивной соли кислоты.
7. Способ получения соединения формулы (I) по любому из пп.1-6, включающий реакцию между амином общей формулы (II)
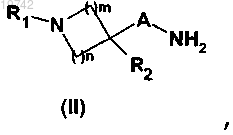
в которой A, R1, R2, m и n имеют значения, указанные в случае общей формулы (I) по п.1,
и карбонатом общей формулы (III)
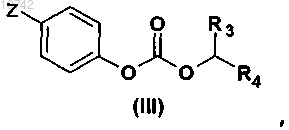
в которой Z означает атом водорода или нитрогруппу;
R3 и R4 имеют значения, указанные в случае общей формулы (I) по п.1,
в присутствии основания, в растворителе, при температуре в диапазоне от комнатной температуры до температуры кипения с обратным холодильником.
8. Способ получения соединения формулы (I) по любому из пп.1-6, включающий реакцию между амином общей формулы (II)
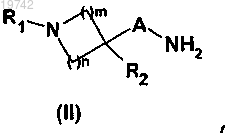
в которой A, R1, R2, m и n имеют значения, указанные в случае общей формулы (I) по п.1,
и фенилхлорформиатом или 4-нитрофенилхлорформиатом,
в присутствии основания, в растворителе, при температуре в диапазоне от 0°С до комнатной температуры,
с получением карбаматного производного общей формулы (IV)
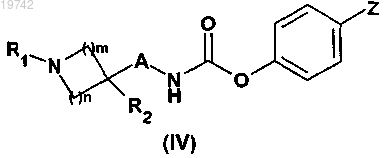
в которой A, R1, R2, m и n имеют значения, указанные в случае общей формулы (I) по п.1, и Z означает атом водорода или нитрогруппу,
с последующим превращением полученного карбаматного производного общей формулы (IV) в соединение общей формулы (I) путем реакции со спиртом общей формулы HOCHR3R4 (IIIa), в которой R3 и R4 имеют значения, указанные в случае общей формулы (I) по п.1,
в присутствии основания, в растворителе, при температуре в диапазоне от комнатной температуры до температуры кипения с обратным холодильником.
9. Способ получения соединения формулы (I) по любому из пп.1-6, в которой R1 означает группу R5, замещенную группой R6 C1-6-алкильного типа или группой R7, такой как указанная в случае общей формулы (I), включающий реакцию Сузуки соединения общей формулы (Ia)
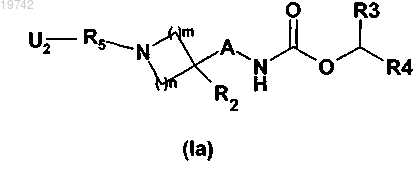
в которой A, R2, R3, R4, R5, n и m имеют значения, указанные в случае общей формулы (I) по п.1, и U2 означает атом хлора, брома, йода или О-трифлатную группу, причем U2 находится в положении, где желают ввести группу R6 или R7,
с C1-6-алкил- или фенилбороновой кислотой, причем указанный фенил может быть замещен одной или несколькими C1-6-алкильными группами, одинаковыми или отличающимися друг от друга, катализируемой переходным металлом.
10. Применение соединения формулы (I) по любому из пп.1-6 в форме основания или аддитивной соли фармацевтически приемлемой кислоты в качестве лекарственного средства для профилактики или лечения патологии, в которой принимают участие эндогенные каннабиноиды и/или ваниллоиды.
11. Фармацевтическая композиция, содержащая по меньшей мере одно соединение формулы (I) по любому из пп.1-6 в форме основания или аддитивной соли фармацевтически приемлемой кислоты и необязательно один или несколько фармацевтически приемлемых эксципиентов для профилактики или лечения патологии, в которой принимают участие эндогенные каннабиноиды и/или ваниллоиды.
12. Применение соединения формулы (I) по любому из пп.1-6 в форме основания или аддитивной соли фармацевтически приемлемой кислоты для получения лекарственного средства, предназначенного для профилактики или лечения патологии, в которой принимают участие эндогенные каннабиноиды и/или ваниллоиды.
13. Применение соединения формулы (I) по любому из пп.1-6 в форме основания или аддитивной соли фармацевтически приемлемой кислоты для получения лекарственного средства, предназначенного для профилактики или лечения острых или хронических болей, головокружений, рвоты, нарушений алиментарного состояния, неврологических и психиатрических патологий, острых или хронических нейродегенеративных заболеваний, эпилепсии, нарушений сна, сердечно-сосудистых заболеваний, ренальной ишемии, раковых заболеваний, нарушений иммунной системы, аллергических заболеваний, паразитарных, вирусных или бактериальных инфекционных заболеваний, воспалительных заболеваний, остеопороза, глазных поражений, пульмонарных поражений, желудочно-кишечных заболеваний или недержания мочи.
Текст
Изобретение относится к соединению, отвечающему общей формуле (I), в которой R2 означает атом водорода или фтора либо гидроксил, C1-6-алкил или группу NR8R9; n означает целое число, равное 1, 2 или 3, и m означает целое число, равное 1 или 2; А означает ковалентную связь или C1-8-алкиленовую группу; R1 означает группуR5, необязательно замещенную одной или несколькими группами R6 и/или R7; R5 означает группу, выбранную из фенила, пиридинила, пиридазинила, пиримидинила, пиразинила, хинолинила, изохинолинила, фталазинила и хиноксалинила; R6 означает атом галогена, нитрогруппу, C1-6-алкил, С 1-6-алкоксил, С 1-6-галогеналкил, C1-6 галогеналкоксил или -О-(C1-3-алкилен)-О-; R7 означает фенил, который может быть замещен одной или несколькими, одинаковыми или отличными друг от друга группами R6; R3 означает трифторметил, C1-6 алкил или атом водорода; R4 означает группу, выбранную из фуранила, оксазолила, изоксазолила, пиразолила,оксадиазолила, тиадиазолила, имидазолила и триазолила; причем эта группа необязательно замещена одним или несколькими заместителями, выбранными из C1-6-алкила, CO2R8, CONR8R9, CON(R8)(С 1-3-алкиленNR10R11) и фенила; причем фенил может быть замещен одним или несколькими заместителями, выбранными из атома галогена и C1-6-алкоксила; R8, R9, R10 и R11 означают, независимо друг от друга, атом водорода илиC1-6-алкил или с атомом или атомами, с которыми они связаны, образуют в случае NR8R9 пиперазиновый цикл,причем этот цикл необязательно замещен C1-6-алкилом; в форме основания или аддитивной соли кислоты; к его применению в терапии. Объектом настоящего изобретения являются карбаматные производные алкилгетероциклов, их получение и их применение в терапии. Всегда существует необходимость нахождения и получения ингибиторов фермента FAAH (гидролаза амида жирной кислоты). Соединения согласно изобретению отвечают этой цели. Эти соединения должны обладать метаболическими, фармакокинетическими и токсикологическими свойствами, позволяющими осуществлять их использование в качестве лекарственных средств. Из этих свойств можно, в частности, назвать ингибирующее воздействие на цитохромы Р 450 и, более конкретно, на изоферментCYP3A4. В документе WO 2004/099176 описаны соединения, обладающие ингибирующей фермент FAAH активностью, имеющие гликольамидную карбаматную группу. Соединения согласно изобретению отвечают общей формуле (I) в которой R2 означает атом водорода или фтора либо гидроксил, С 1-6-алкил или группу NR8R9;n означает целое число, равное 1, 2 или 3, и m означает целое число, равное 1 или 2; А означает ковалентную связь или С 1-8-алкиленовую группу;R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/или R7;R7 означает фенил, который может быть замещен одной или несколькими, одинаковыми или отличными друг от друга, группами R6;R4 означает группу, выбранную из фуранила, оксазолила, изоксазолила, пиразолила, оксадиазолила,тиадиазолила, имидазолила и триазолила; причем эта группа необязательно замещена одним или несколькими заместителями, выбранными из C1-6-алкила, CO2R8, CONR8R9, CON(R8)(С 1-3-алкилен-NR10R11) и фенила; причем фенил может быть замещен одним или несколькими заместителями, выбранными из атома галогена и C1-6-алкоксила;R8, R9, R10 и R11 означают, независимо друг от друга, атом водорода или С 1-6-алкил или с атомом или атомами, с которыми они связаны, образуют в случае NR8R9 пиперазиновый цикл, причем этот цикл необязательно замещен C1-6-алкилом. Среди соединений общей формулы (I) первая подгруппа соединений образована соединениями, в которых n означает целое число, равное 2, и m означает целое число, равное 2. Среди соединений общей формулы (I) вторая подгруппа соединений образована соединениями, в которых А означает C1-8-алкиленовую группу. Среди соединений общей формулы (I) третья подгруппа соединений образована соединениями, в которых R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/илиR7; R5 означает фенил, пиридинил, пиридазинил, пиримидинил, пиразинил, хинолинил, фталазинил или хиноксалинил; R6 означает нитрогруппу, C1-6-алкил, С 1-6-алкоксил, C1-6-галогеналкил, C1-6-галогеналкоксил, -О-(C1-3-алкилен)-О- или атом галогена; R7 означает фенил, который может быть замещен одной или несколькими, одинаковыми или отличными друг от друга, группами R6. Среди соединений общей формулы (I) четвертая подгруппа соединений образована соединениями, в которых R4 означает группу, выбранную из оксазолила, изоксазолила, фуранила, имидазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила; причем эта группа необязательно замещена одним или несколькими заместителями, выбранными из C1-6-алкила, COOR8, CON(R8)(С 1-3-алкилен-NR10R11),CONR8R9, фенила; причем фенил может быть замещен одним или несколькими заместителями, выбранными из атома галогена или C1-6-алкоксила; R8 и R9 означают, независимо друг от друга, атом водорода или C1-6-алкил или вместе с атомом, с которым они связаны, образуют пиперазиновый цикл; R10 и R11 означают, независимо друг от друга, атом водорода или C1-6-алкил. Среди соединений общей формулы (I) пятая подгруппа соединений образована соединениями, в которых R1 означает группу R5, необязательно замещенную одной или несколькими группами R6 и/или R7;R5 означает фенил, пиридинил, пиразинил или хинолинил; R6 означает атом галогена; R7 означает фенил,который может быть замещен одной или несколькими, одинаковыми или отличными друг от друга,группами R6; R2 и R3 означают атом водорода; R4 означает 3-карбамоилизоксазол-5-ил; n означает целое число, равное 2, и m означает целое число, равное 2; А означает C1-8-алкиленовую группу. Из соединений общей формулы (I) могут быть указаны следующие соединения (номенклатура ИЮПАК, получаемая согласно программному обеспечению AutoNom): 1) 3-карбамоилизоксазол-5-илметил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамат; 2) 2-метил-2 Н-[1,2,4]триазол-3-илметил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамат; 3) 3-(4-хлорфенил)изоксазол-5-илметил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамат; 4) 3-(4-хлорфенил)-[1,2,4]оксадиазол-5-илметил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамат; 5) 3-этил-[1,2,4]оксадиазол-5-илметил-2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат; 6) 5-метил-3-фенилизоксазол-4-илметил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамат; 7) 3-изопропил-[1,2,4]оксадиазол-5-илметил-2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат; 8) 1-метил-1 Н-пиразол-3-илметил-2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил]этилкарбамат; 9)(+)-3-метилкарбамоилизоксазол-5-илметил-[1-(4-хлорпиримидин-2-ил)пирролидин-3-илметил]карбамат,в форме основания или аддитивной соли кислоты. Соединения общей формулы (I) могут включать один или несколько асимметрических атомов углерода. Они могут существовать в форме энантиомеров или диастереоизомеров. Соединения общей формулы (I) также могут существовать в форме цис-(Z)- или транс-(Е)-стереоизмеров. Эти стереоизомеры,энантиомеры и диастереоизомеры, а также их смеси, включая рацемические смеси, составляют часть изобретения. Соединения формулы (I) могут существовать в форме оснований или аддитивных солей кислот. Такие аддитивные соли составляют часть изобретения. Эти соли преимущественно получают с фармацевтически приемлемыми кислотами, однако соли других пригодных кислот, например, для очистки или выделения соединений формулы (I) также составляют часть изобретения. В рамках настоящего изобретения под Ct-z, где t и z могут принимать значения от 1 до 8, понимают углеродную цепь, которая может иметь от t до z атомов углерода, как, например, C1-3 углеродная цепь, которая может иметь от 1 до 3 атомов углерода; под алкилом понимают насыщенную, линейную или разветвленную алифатическую группу; например C1-6-алкил представляет собой линейную или разветвленную углеродную цепь из 1-6 атомов углерода, более конкретно метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил; под алкиленом понимают насыщенную, линейную или разветвленную, двухвалентную алкильную группу, например C1-3-алкиленовая группа представляет собой, линейную или разветвленную, двухвалентную углеродную цепь из 1-3 атомов углерода, более конкретно метилен, этилен, 1-метилэтилен,пропилен; под циклоалкилом понимают циклическую алкильную группу, например С 3-7-циклоалкил представляет собой циклическую углеродную группу из 3-7 атомов углерода, более конкретно циклопропил, цик-4 019742 лобутил, циклопентил, циклогексил, циклогептил; под алкоксилом понимают -О-алкильную группу с насыщенной, линейной или разветвленной алифатической цепью; под тиоалкилом понимают -S-алкильную группу с насыщенной, линейной или разветвленной алифатической цепью; под галогеналкилом понимают алкильную группу, один или несколько атомов водорода которой замещены атомом галогена; под галогеналкоксилом понимают алкоксильную группу, один или несколько атомов водорода которой замещены атомом галогена; под галогентиоалкилом понимают тиоалкильную группу, один или несколько атомов водорода которой замещены атомом галогена; под атомом галогена понимают фтор, хлор, бром или йод. Соединения согласно изобретению могут быть получены различными способами, проиллюстрированными на нижеследующих схемах. Так, первый способ (схема 1) состоит во введении во взаимодействие амина общей формулы (II), в которой A, R1, R2, m и n имеют указанные в случае вышеприведенной общей формулы (I) значения, с карбонатом общей формулы (III), в которой Z означает атом водорода или нитрогруппу, R3 и R4 имеют указанные в случае вышеприведенной общей формулы (I) значения, в присутствии основания, такого как триэтиламин, пиридин, N,N-диметиламинопиридин или диизопропилэтиламин, в растворителе, таком как толуол или 1,2-дихлорэтан, при температуре в диапазоне от комнатной температуры до температуры кипения с обратным холодильником растворителя. Схема 1 Один вариант получения соединений общей формулы (I) (схема 1) состоит во введении во взаимодействие амина общей формулы (II), такого как указанный выше, с фенилхлорформиатом или 4 нитрофенилхлорформиатом, в присутствии основания, такого как триэтиламин или диизопропилэтиламин, в растворителе, таком как дихлорметан или тетрагидрофуран, при температуре в диапазоне от 0 С до комнатной температуры, с получением карбаматного производного общей формулы (IV), в которой A,R1, R2, m и n имеют указанные в случае вышеприведенной общей формулы (I) значения и Z означает атом водорода или нитрогруппу. Полученное, таким образом, карбаматное производное общей формулы(IV) затем превращают в соединение общей формулы (I) путем воздействия спирта общей формулыHOCHR3R4 (IIIa), такого как указанный выше, в присутствии основания, такого как триэтиламин, пиридин, N,N-диметиламинопиридин или диизопропилэтиламин, в растворителе, таком как толуол или дихлорэтан, при температуре в диапазоне от комнатной температуры до температуры кипения с обратным холодильником растворителя. Второй способ (схема 2) позволяет получать соединения общей формулы (I), в которой R1 означает группу R5, особенно замещенную группой R6 C1-6-алкильного, С 3-7-циклоалкильного или С 3-7 циклоалкил-С 1-3-алкиленового типа, или группой R7, такой как указанная в случае вышеприведенной общей формулы (I). Схема 2 Так, первая стадия состоит во введении во взаимодействие амина общей формулы (IIa), в которойA, R2, m и n имеют указанные в случае вышеприведенной общей формулы (I) значения и GP означает защитную группу, такую как Boc (трет-бутилоксикарбонил), Cbz (бензилоксикарбонил), бензил или бензгидрил, с производным общей формулы (V), в которой R5 имеет вышеуказанное значение, U1 означает атом галогена или O-трифлатную группу и U2 означает атом хлора, брома, йода или O-трифлатную группу, используя реакции ароматического, гетероароматического нуклеофильного замещения или Nарилирования, N-гетероарилирования по Бухвальду, например, при использовании катализатора на основе палладия или меди, с получением промежуточного продукта общей формулы (IVa), в которой A, R2,-5 019742R5, m, n, U2 и GP имеют вышеуказанные значения. Таким образом, полученное соединение (IVa), вопервых, подвергают реакции удаления защиты, например, в присутствии трифторуксусной кислоты или раствора хлороводорода (5 н.) в изопропаноле или диоксане, затем подвергают реакции конденсации с карбонатом общей формулы (III), такой как указанная выше, при условиях, описанных в случае вышеприведенной схемы 1, с получением карбаматного производного общей формулы (IVb), в которой A, R2,R5, m, n, U2 и Z имеют вышеуказанные значения. Таким образом, полученное соединение общей формулы (IVb) затем превращают в карбаматное производное общей формулы (Ia) путем воздействия спирта общей формулы HOCHR3R4 (IIIa), такой как указанная выше, в присутствии основания, такого как триэтиламин, пиридин, N,N-диметиламинопиридин или N,N-диизопропилэтиламин, в растворителе, таком как толуол или дихлорэтан, при температуре в диапазоне от комнатной температуры до температуры кипения с обратным холодильником растворителя. Последняя стадия состоит в осуществлении реакции сочетания, катализируемой с помощью переходного металла, как палладий(0), промежуточного продукта общей формулы (Ia), в которой A, R2, R3, R4, R5, m, n и U2 имеют вышеуказанные значения, причем U2 находится в положении, где желают ввести группу R6 или R7: либо по реакции типа реакции Сузуки, например, с помощью алкил-, циклоалкил-, арил- или гетероарилбороновой кислоты; либо по реакции типа реакции Стилла, например, используя арильное или гетероарильное производное триалкилолова; либо по реакции типа реакции Негиши, например, используя алкил-, циклоалкил-, арил- или гетероарилгалогенидное производное цинка. Схема 3 Третий способ (схема 3) состоит, во-первых, во введении во взаимодействие амина общей формулы(IIb), в которой A, R2, m и n имеют указанные в случае вышеприведенной общей формулы (I) и PG имеет вышеуказанное значение, с карбонатом общей формулы (III), такой как указанная выше, при условиях,описанных выше в случае реакции амина общей формулы (II) с карбонатом общей формулы (III), затем в осуществлении реакции удаления защиты, например, в присутствии раствора хлороводорода (5 н.) в изопропаноле или в диоксане, с получением промежуточного продукта общей формулы (Ia), в которой A,R2, R3, R4, m и n имеют указанные в случае вышеприведенной общей формулы (I) значения. Один вариант получения промежуточных продуктов общей формулы (Ib) (схема 3, вариант пути А) состоит во введении во взаимодействие амина общей формулы (IIa), такой как указанная выше, с фенилхлорформиатом или 4-нитрофенилхлорформиатом, при условиях, описанных выше, когда соединение формулы (II) вводят во взаимодействие с соединением формулы (IV) (схема 1, вариант), с получением карбаматного производного общей формулы (IVc), в которой A, R2, m и n имеют указанные в случае вышеприведенной общей формулы (I) значения, PG и Z имеют вышеуказанные значения. Таким образом,полученное карбаматное производное общей формулы (IVc) затем превращают в соединение общей формулы (Ia) путем воздействия спирта общей формулы HOCHR3R4 (IIIa) при условиях, описанных выше, когда соединение формулы (IV) вводят во взаимодействие с соединением формулы (IIIa) (схема 1,вариант). Соединение общей формулы (I) затем получают путем введения во взаимодействие соединения общей формулы (Ib) с производным общей формулы (Va), в которой R1 и U1 имеют указанные в случае общей формулы (I) значения, используя условия ароматических или гетероароматических нуклеофильных реакций замещения, например, с помощью основания, такого как триэтиламин, диизопропилэтиламин,пиридин или N,N-диметиламинопиридин, в растворителе, таком как дихлорметан, дихлорэтан, ацетонитрил, N,N-диметилформамид, диоксан или тетрагидрофуран, при температуре в диапазоне от 0 С до температуры кипения с обратным холодильником растворителя. Это превращение может быть также осуществлено, используя условия N-арилирования или N-гетероарилирования по Бухвальду, например, при использовании катализатора на основе палладия или меди. Согласно схеме 3 путь В соединения общей формулы (I), в которой R1 означает группу R5, особенно замещенную группой R6 C1-6-алкильного, С 3-7-циклоалкильного или С 3-7-циклоалкил-С 1-3-алкиленового типа, или группой R7, такой как указанная в случае вышеприведенной общей формулы (I), также могут быть получены по реакции связывания, катализируемой с помощью переходного металла, как, например,-6 019742 палладий(0), осуществляемой при использовании соединения общей формулы (Ia), в которой A, R2, R3,R4, R5, m, n, о и р имеют указанные в случае общей формулы (I) значения и U2 означает атом хлора, брома, йода или трифлатную группу, причем U2 находится в положении, где желают ввести группу R6 илиR7 (схема 3, путь В), согласно реакционным условиям, используемым для превращения соединения формулы (Ia) в соединение формулы (I) (см. схему 2). Промежуточный продукт общей формулы (Ia), такой как приведенная выше, предварительно получают путем введения во взаимодействие амина общей формулы (Ib), такой как указанная выше, с производным общей формулы (Vb), в которой R5, U1 и U2 имеют вышеуказанные значения, согласно условиям,указанным выше на схеме 2, когда соединение формулы (IIa) вводят во взаимодействие с соединением формулы (V), получая соединение формулы (IVa). Один вариант получения промежуточных продуктов общей формулы (Ia) (схема 3, вариант пути В) состоит, во-первых, во введении во взаимодействие амина общей формулы (IIb), в которой A, R5, R2, m иn имеют указанные в случае вышеприведенной общей формулы (I) значения и U2 имеет вышеуказанное значение, с карбонатом общей формулы (III), такой как указанная выше, при условиях, указанных выше в случае реакции амина общей формулы (II) с карбонатом общей формулы (III), с получением промежуточного продукта общей формулы (Ia), в которой A, R5, R2, R3, R4, m и n имеют указанные в случае общей формулы (I) значения и U2 имеет вышеуказанное значение. Другой объект настоящего изобретения относится к следующим промежуточным продуктам формулы (Ib). 3-Метилкарбамоилизоксазол-5-илметилпирролидин-3-илметилкарбаматгидрохлорид,т.пл. (температура плавления) (С): 187-189;(с, 1 Н); 4,90 (с, 2 Н); 3,80 (с, 3 Н); 3,20 (м, 2 Н); 3,00 (м, 2 Н); 2,80 (м, 2 Н); 1,80 (м, 2 Н); 1,50-1,20 (м, 6 Н). 3-Карбамоилизоксазол-5-илметилазепан-4-илкарбамат. Другой объект настоящего изобретения относится к следующим промежуточным продуктам формулы (II):H-ЯМР (CDCl3)(м.д.): 8,50 (д, 1 Н); 6,80 (д, 1 Н); 4,30 (м, 2 Н); 3,90 (м, 2 Н); 2,85 (м, 1 Н); 2,75 (м,2 Н); 1,85 (м, 2 Н); 1,30 (с ушир., 2 Н). Другой объект настоящего изобретения относится к следующим промежуточным продуктам формулы (IIa): трет-бутил-4-(2-аминоэтил)-4-этилпиперидин-1-карбоксилат; трет-бутил-4-(2-аминоэтил)-4-изобутилпиперидин-1-карбоксилат; трет-бутил-3-(2-аминоэтил)-3-диметиламиноазетидин-1-карбоксилат. Другой объект настоящего изобретения относится к следующим промежуточным продуктам формулы (IV): нитрофенил-2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат; 4-нитрофенил-2-[5'-(3-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат; 4-нитрофенил-[2-(5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этил]карбамат; 4-нитрофенил-2-[1-(4-трифторметилпиримидин-2-ил)пиперидин-4-ил]этилкарбамат; 4-нитрофенил-(2-1-[6-(4-фторфенил)пиразин-2-ил]пиперидин-4-илэтил)карбамат; 4-нитрофенил-(2-1-[5-(4-фторфенил)пиримидин-2-ил]пиперидин-4-илэтил)карбамат; 4-нитрофенил-[2-(5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этил]карбамат. Другие соединения общих формул (II), (IIa), (III), (IIIa) и (IV), а также другие реагенты являются коммерчески доступными или описаны в литературе либо же могут быть получены согласно способам,которые там описаны или которые известны специалисту в данной области. В частности, карбонат общей формулы (III) может быть получен согласно любому способу, описанному в литературе, например, путем введения во взаимодействие спирта общей формулы HOCHR3R4(IIIa), в которой R3 и R4 имеют значения, как указанные в случае общей формулы (I), такой как приведенная выше, с фенилхлорформиатом или 4-нитрофенилхлорформиатом, в присутствии основания, такого как триэтиламин, N-метилморфолин или диизопропилэтиламин, в растворителе, таком как дихлорметан или тетрагидрофуран, при температуре в диапазоне от 0 С до комнатной температуры. Нижеследующие примеры поясняют получение некоторых соединений согласно изобретению. Эти примеры не являются ограничивающими объема охраны изобретения и предназначены только для пояснения изобретения. Микроанализы, ИК- и ЯМР-спектры и/или LC-MS (жидкостная хроматография, связанная с масс-спектрометрией) подтверждают структуры и чистоту полученных соединений. Способ A: UPLC/TOF - градиент 3 мин. - Н 2 О/ACN/ТФУК, ТО: 98% А - Т 1,6 - Т 2,1 мин: 100% В Т 2,5 - Т 3 мин: 98% А, путь А: Н 2 О + 0,05% ТФУК; путь В: ACN + 0,035% ТФУК; расход: 1,0 мл/мин Т=40 С - ввод 2 мкл; колонка Acquity ВЕН С 18 (502,1 мм; 1,7 мкм); 220 нм. Способ В: ВЭЖХ/ZQ - градиент 10 мин - CH3COONH4, 5 мМ/ACN ТО: 100% А - Т 5,5 - Т 7 мин: 100% В - Т 7,1 - Т 10 мин: 100% А, путь A: CH3COONH4 + 3% ACN; путь В: ACN, расход: 0,8 мл/мин Т=40 С - ввод 2 мкл; колонка Cromasil C18 (502,1 мм; 3,5 мкм); 220 нм. Т.пл. (PF) (С) означает температуру плавления в градусах Цельсия. Номера, указанные между скобками в заголовках примеров, соответствуют номерам первой колон-8 019742 ки нижеприводимой таблицы. Номенклатура ИЮПАК (Международный союз теоретической и прикладной химии) используется для названия соединений в нижеприводимых примерах. Пример 1 (соединение 9).[1,2,3]Тиадиазол-4-илметил-2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил]этилкарбамат. 1.1. 2-(5'-Бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этанол. В автоклав вводят 11,00 г (46,43 ммоль) 2,5-дибромпиридина, 6,00 г (46,43 ммоль)пиперидин-4 илэтанола и 6,74 г (48,76 ммоль) карбоната калия в 8 мл ДМСО. Затем нагревают при температуре 160 С в течение 20 ч. Выдерживают до возврата к комнатной температуре, затем реакционную смесь обрабатывают этилацетатом и водой. Водную фазу отделяют, экстрагируют два раза этилацетатом, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия, высушивают их над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Таким образом получают 11,00 г продукта в виде масла, используемого таким, какой есть, на следующей стадии. 1.2. 2-[5'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этанол. В инертной атмосфере 3,60 г (12,62 ммоль) 2-(5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил)этанола, полученного на стадии 1.1, 3,53 г (25,25 ммоль) 4-фторфенилбороновой кислоты, 5,23 г(37,87 ммоль) карбоната калия и 4,88 г (15,15 ммоль) тетрабутиламмонийбромида суспендируют в 20 мл воды. После этого добавляют 0,142 г (0,63 ммоль) Pd(OAc)2. Реакционную смесь кипятят с обратным холодильником в течение 24 ч. Выдерживают до возврата к комнатной температуре, отделяют соли путем фильтрации через целит,затем фильтрат обрабатывают этилацетатом, отделяют водную фазу, экстрагируют ее два раза этилацетатом, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия и сушат их над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией при использовании силикагеля, элюируя смесью 50/50 этилацетата и циклогексана. Таким образом получают 1,6 г продукта в виде порошка белого цвета. Т.пл.=118-120 С. 1.3. 2-2-[5'-(4-Фторфенил)-3,4,5, 6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилизоиндол-1,3-дион. К раствору 2,00 г (6,66 ммоль) 2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил]этанола, полученного на стадии 1.2, 2,096 г (7,99 ммоль) трифенилфосфина и 1,077 г (7,32 ммоль) фталимида в 40 мл тетрагидрофурана, охлажденному до температуры около -2 С, по каплям добавляют в инертной атмосфере раствор 1,61 г (7,99 ммоль) диизопропилазодикарбоксилата (DIAD) в 4 мл тетрагидрофурана, все время поддерживая температуру реакционной среды в диапазоне от -2 до 0 С. Продолжают перемешивание при температуре 0 С в течение 1 ч, затем при комнатной температуре в течение 12 ч. Концентрируют при пониженном давлении, остаток обрабатывают дихлорметаном и водой. Водную фазу отделяют, затем ее экстрагируют 2 раза дихлорметаном. Органические фазы объединяют и промывают их последовательно водным раствором хлороводорода (1 н.), затем водным насыщенным раствором гидрокарбоната натрия и водным насыщенным раствором хлорида натрия. Органическую фазу сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Таким образом, полученный остаток очищают хроматографией при использовании силикагеля, элюируя смесью 20/80 этилацетата и циклогексана. Таким образом получают 2,1 г ожидаемого продукта в виде порошка белого цвета. Т.пл.=180-182 С. 1.4. 2-[5'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этиламин. К раствору 1,3 г (3,03 ммоль) 2-2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил]этилизоиндол-1,3-диона, полученного на стадии 1.3, в 30 мл этанола медленно добавляют при комнатной температуре 0,485 г (15,13 ммоль) гидразинмоногидрата. Затем реакционную смесь кипятят с обратным холодильником в течение 3 ч. Выдерживают до возврата к комнатной температуре, нерастворимую часть отделяют путем фильтрации и фильтрат концентрируют при пониженном давлении. Остаток обрабатывают с помощью 20 мл диэтилового эфира и выдерживают при перемешивании при комнатной температуре в течение 1 ч. Снова отделяют нерастворимую часть и фильтрат концентрируют при пониженном давлении. Таким образом получают 0,70 г ожидаемого продукта в виде порошка белого цвета. Т.пл.=88-94 С. 1 Н-ЯМР (CDCl3)(м.д.): 8,3 (д, 1 Н); 7,55 (дд, 1 Н); 7,35 (м, 2 Н); 7,05 (д, 1 Н); 7,1 (д, 1 Н); 6,65 (д, 1 Н); 4,25 (ушир. д, 2 Н); 3,0-2,8 (м, 4 Н); 1,8 (м, 2 Н); 1,6-1,1 (м, 5 Н). 1.5. 4-Нитрофенил-2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат. К раствору 5 г (16,7 ммоль) 2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил]этиламина, полученного на стадии 1.4, 4,32 г (33,40 ммоль) N,N-диизопропилэтиламина и 0,10 г (0,84 ммоль) N,N-диметиламинопиридина в 50 мл дихлорметана, охлажденному до температуры около 0 С,маленькими порциями добавляют 3,7 г (18,37 ммоль) 4-нитрофенилхлорформиата. Продолжают перемешивание при температуре 0 С в течение 1 ч, затем при комнатной температуре в течение 2 ч. К реакционной среде добавляют воду, водную фазу отделяют, экстрагируют ее несколько раз дихлорметаном, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия, их сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Таким образом получают 4,6 г продукта в виде аморфного твердого вещества белого цвета, используемого таким, какой есть, на следующей стадии.[1,2,3]Тиадиазол-4-илметил-2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил]этилкарбамат. В пробирочном реакторе при температуре 80 С в течение 12 ч нагревают раствор 0,50 г (0,50 ммоль) 4-нитрофенил-2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамата,полученного на стадии 1.5, 0,128 г (0,99 ммоль) N,N-диизопропилэтиламина, 0,030 г (0,25 ммоль) N,Nдиметиламинопиридина и 0,079 г (0,5 ммоль) [1,2,3]тиадиазол-4-илметанола (Acta Pharmaceutica Suecica,10(4), 285-296 (1973 в 5 мл 1,2-дихлорэтана. Выдерживают до возврата к комнатной температуре. Остаток обрабатывают дихлорметаном и 1 н. водным раствором гидроксида натрия, водную фазу отделяют, экстрагируют ее два раза дихлорметаном,объединенные органические фазы промывают последовательно 1 н. водным раствором гидроксида натрия, затем водным насыщенным раствором хлорида натрия и сушат их над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией при использовании силикагеля, элюируя смесью 99/1/0,1 дихлорметана, метанола и 28%-ного раствора гидроксида аммония. Таким образом получают 0,23 г чистого продукта в виде порошка белого цвета. Т.пл.: 139-141 С;H-ЯМР (ДМСО)(м.д.): 9,15 (с, 1 Н); 8,4 (с, 1 Н); 7,8 (д, 1 Н); 7,7 (дд, 2 Н); 7,40 (ушир. т, 1 Н); 7,25 (т,2 Н); 6,90 (д, 1 Н); 5,5 (с, 2 Н); 4,35 (ушир. д, 2 Н); 3,1 (м, 2 Н); 2,85 (ушир. т, 2 Н); 1,75 (ушир. д, 2 Н); 1,55 (м,1 Н); 1,4 (м, 2 Н); 1,15 (м, 2 Н). Пример 2 (соединение 5). 3-Этил-[1,2,4]оксадиазол-5-илметил-2-[5'-(4-фторфенил)-3,4,5,6 тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат. Поступают согласно методике, описанной в примере 1 (стадия 1.6). Исходя из 0,23 г (0,5 ммоль) 4 нитрофенил-2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамата, описанного в примере 1 (стадия 1.5), 0,128 г (0,99 ммоль) N,N-диизопропилэтиламина, 0,030 г (0,25 ммоль) N,Nдиметиламинопиридина, 0,067 г (0,50 ммоль) 3-этил-[1,2,4]оксадиазол-5-илметанола, и после хроматографии при использовании силикагеля, элюируя смесью 99/1/0,1 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 0,138 г чистого продукта в виде порошка белого цвета. Т.пл.: 110-112 С;N,N-диметиламинопиридина, 0,074 г (0,47 ммоль) 3-метилкарбамоилизоксазол-5-илметанола, и после хроматографии при использовании силикагеля, элюируя смесью 98/2/0,2 дихлорметана, метанола и 28%ного раствора гидроксида аммония, получают 0,170 г чистого продукта в виде порошка белого цвета. Т.пл.: 191-193 С;(ушир. д, 2 Н); 1,60 (м, 1 Н); 1,40 (м, 2 Н); 1,15 (м, 2 Н). Пример 4 (соединение 19). 3-Карбамоилизоксазол-5-илметил-2-[5'-(4-фторфенил)-3,4,5,6 тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат. В герметически закрытой пробирке нагревают при температуре 90 С в течение 12 ч раствор 0,25 г бамата, полученного на стадии 1.5, 0,139 г (1,08 ммоль) N,N-диизопропилэтиламина, 0,033 г (0,27 ммоль)N,N-диметиламинопиридина и 0,084 г (0,59 ммоль) 3-карбамоилизоксазол-5-илметанола в 5 мл 1,2 дихлорэтана. Выдерживают до возврата к комнатной температуре. Выпавший из реакционной среды осадок отфильтровывают через фильтр из пористого стекла, затем обильно промывают диэтиловым эфиром и водой. После этого твердое вещество высушивают в вакууме при температуре около 80 С в течение ночи. Таким образом получают 0,202 г чистого продукта в виде порошка белого цвета. Т.пл.: 202-204 С;H-ЯМР (ДМСО)(м.д.): 8,45 (с, 1 Н); 8,15 (ушир. с, 1 Н); 7,85 (м, 2 Н); 7,70 (дд, 2 Н); 7,45 (ушир. т,1 Н); 7,30 (т, 2 Н); 6,90 (д, 1 Н); 6,8 (с, 1 Н); 5,20 (с, 2 Н); 4,40 (ушир. д, 2 Н); 3,10 (м, 2 Н); 2,85 (ушир. т, 2 Н); 1,80 (ушир. д, 2 Н); 1,60 (м, 1 Н); 1,40 (м, 2 Н); 1,15 (м, 2 Н). Пример 5 (соединение 21). 4-Карбамоилоксазол-2-илметил-2-[5'-(4-фторфенил)-3,4,5,6 тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат. 5.1. Метил-2-ацетоксиметилоксазол-4-карбоксилат. К раствору 1,2 г (4,20 ммоль) метил-2-бромметилоксазол-4-карбоксилата (патент США 2005215577) в 42 мл ацетонитрила добавляют при комнатной температуре 0,453 г (4,62 ммоль) ацетата калия, затем продолжают перемешивание при комнатной температуре в течение 12 ч. После концентрирования при пониженном давлении остаток обрабатывают дихлорметаном и водой. Водную фазу отделяют, затем экстрагируют ее 2 раза дихлорметаном. Органические фазы объединяют и промывают их водным насыщенным раствором хлорида натрия. Органическую фазу сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Таким образом получают 1,1 г ожидаемого продукта в виде масла, используемого таким, какой есть, на следующей стадии. 5.2. 4-Карбамоилоксазол-2-илметанол. В колбу, содержащую 0,60 г (3,01 ммоль) метил-2-ацетоксиметилоксазол-4-карбоксилата, полученного на стадии 5.1, добавляют 20 мл (352 ммоль) водного 28%-ного раствора гидроксида аммония, затем реакционную среду перемешивают при комнатной температуре в течение 24 ч. После концентрирования при пониженном давлении полученный остаток очищают хроматографией при использовании силикагеля, элюируя смесью 90/10/0,1 дихлорметана, метанола и 28%-ного раствора гидроксида аммония. Таким образом получают 0,230 г чистого продукта в виде порошка белого цвета. Т.пл.: 148-150 С. 5.3. 4-Карбамоилоксазол-2-илметил-2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил 4-ил]этилкарбамат. Поступают согласно методике, описанной в примере 4. Исходя из 0,25 г (0,54 ммоль) 4 нитрофенил-2-[5'-(4-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамата, описанного в примере 1 (стадия 1.5), 0,139 г (1,08 ммоль) N,N-диизопропилэтиламина, 0,033 г (0,27 ммоль) N,Nдиметиламинопиридина, 0,084 г (0,59 ммоль) 4-карбамоилоксазол-2-илметанола, полученного на стадии 5.2, получают 0,162 г чистого продукта в виде порошка белого цвета. Т.пл.: 206-208 С;(м, 1 Н); 1,35 (м, 2 Н); 1,10 (м, 2 Н). Пример 6 (соединение 1). 3-Карбамоилизоксазол-5-илметил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамат. 6.1. 2-[1-(6-Хлорхинолин-2-ил)пиперидин-4-ил]этилметансульфонат. К раствору 4,00 г (13,76 ммоль) 2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этанола (WO2004/099176), 3,55 г (27,51 ммоль) N,N-диизопропилэтиламина и 0,84 г (6,88 ммоль) N,N-диметиламинопиридина в 30 мл дихлорметана, охлажденному до температуры около 0 С, добавляют по каплям в инертной атмосфере раствор 2,36 г (20,63 ммоль) мезилхлорида в 3 мл дихлорметана. Перемешивание продолжают при температуре 0 С в течение 2 ч, затем при комнатной температуре в течение 1 ч. К реакционной среде добавляют воду, отделяют водную фазу, ее экстрагируют несколько раз дихлорметаном, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия, сушат их над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Таким образом получают 5,1 г продукта в виде масла, используемого таким, какой есть, на следующей стадии. 6.2. 2-[4-(2-Азидоэтил)пиперидин-1-ил]-6-хлорхинолин. В инертной атмосфере в течение 4 ч кипятят с обратным холодильником раствор 5 г (13,55 ммоль) 2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилметансульфоната, полученного на стадии 6.1, и 1,76 г(27,11 ммоль) азида натрия в 30 мл N,N-диметилформамида. Выдерживают до возврата к комнатной температуре, затем концентрируют при пониженном давлении. Остаток обрабатывают дихлорметаном и водой, водную фазу отделяют, ее экстрагируют два раза дихлорметаном, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия и сушат их над сульфатом натрия. После выпаривания растворителя получают 3,8 г продукта в виде масла, используемого таким, какой есть, на следующей стадии. 6.3. 2-[1-(6-Хлорхинолин-2-ил)пиперидин-4-ил]этиламин. К раствору 3,50 г (11,08 ммоль) 2-[4-(2-азидоэтил)пиперидин-1-ил]-6-хлорхинолина, полученного на стадии 6.2, в 100 мл смеси ТГФ/вода (1/1) добавляют маленькими порциями при комнатной температуре 4,36 г (16,62 ммоль) трифенилфосфина. Продолжают перемешивание при комнатной температуре в течение 10 ч. Концентрируют при пониженном давлении. Добавляют этилацетат, отделяют водную фазу, ее экстрагируют три раза этилацетатом, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия, сушат их над сульфатом натрия и фильтрат концентрируют при пониженном давлении. После хроматографии при использовании силикагеля, элюируя смесью 90/10/1 дихлорметана,метанола и 28%-ного раствора гидроксида аммония, получают 1,77 г чистого продукта в виде масла, которое кристаллизуется при комнатной температуре. Т.пл.: 68-70 С; 1(ушир. тд, 2 Н); 2,70 (т, 2H); 1,70 (м, 2 Н); 1,60-1,10 (м, 5 Н). 6.4. 4-Нитрофенил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамат. Поступают согласно методике, описанной в примере 1 (стадия 1.5). Исходя из 5,00 г (17,25 ммоль) 2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этиламина, полученного на стадии 6.3, 3,825 г (18,98 ммоль) 4-нитрофенилхлорформиата, 4,46 г (34,51 ммоль) N,N-диизопропилэтиламина, 0,105 г (0,86 ммоль) N,Nдиметиламинопиридина, и после порошкования в смеси диизопропилового эфира и гексана получают 7,8 г чистого продукта в виде порошка белого цвета. Т.пл.: 80-84 С. 6.5. 3-Карбамоилизоксазол-5-илметил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамат. Поступают согласно методике, описанной в примере 4. Исходя из 0,50 г (1,10 ммоль) 4 нитрофенил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамата, полученного на стадии 6,4, 0,284 г (2,2 ммоль) N,N-диизопропилэтиламина, 0,067 г (0,55 ммоль) N,N-диметиламинопиридина, 0,156 г (1,1 ммоль) 3-карбамоилизоксазол-5-илметанола получают 0,250 г чистого продукта в виде порошка белого цвета. Т.пл.: 220-222 С;LC-MS: М+Н=468; 1 Н-ЯМР (ДМСО)(м.д.): 8,15 (ушир. с, 1 Н); 8,0 (д, 1 Н); 7,85 (ушир. с, 1 Н); 7,75 (д, 1 Н); 7,50 (кв,2 Н); 7,45 (ушир. т, 1 Н); 7,30 (д, 1 Н); 6,80 (с, 1 Н); 5,20 (с, 2 Н); 4,50 (ушир. д, 2 Н); 3,10 (м, 2 Н); 2,90 (ушир. т, 2 Н); 1,80 (ушир. д, 2 Н); 1,60 (м, 1 Н); 1,40 (м, 2 Н); 1,15 (м, 2 Н). Пример 7 (соединение 20). 3-Метилкарбамоилизоксазол-5-илметил-2-[1-(6-хлорхинолин-2 ил)пиперидин-4-ил]этилкарбамат. 7.1. Этил-5-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамоилоксиметилизоксазол-3 карбоксилат. Поступают согласно методике, описанной в примере 1 (стадия 1.7). Исходя из 0,5 г (1,1 ммоль) 4 нитрофенил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамата, описанного в примере 6 (стадия 6.4), 0,311 г (2,2 ммоль) N,N-диизопропилэтиламина, 0,067 г (0,55 ммоль) N,N-диметиламинопиридина,0,188 г (1,1 ммоль) этил-5-гидроксиметилизоксазол-3-карбоксилата, и после хроматографии при использовании силикагеля, элюируя смесью 98/2 дихлорметана и метанола, получают 0,4 г чистого продукта в виде порошка белого цвета. Т.пл.: 113-115 С; 1 Н-ЯМР (CDCl3)(м.д.): 7,70 (д, 1 Н); 7,50 (м, 1 Н); 7,45 (м, 1 Н); 7,35 (м, 1 Н); 6,90 (д, 1 Н); 6,65 (с,1 Н); 5,20 (с, 2 Н); 4,70 (м, 2 Н); 4,50-4,30 (м, 5 Н); 3,20 (м, 2 Н); 2,90 (ушир. т, 2 Н); 1,80 (ушир. д, 2 Н); 1,601,20 (м, 6 Н). 7.2. 3-Метилкарбамоилизоксазол-5-илметил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамат. К раствору 0,17 г(0,35 ммоль) этил-5-2-[1-(6-хлорхинолин-2-ил)пиперидин-4 ил]этилкарбамоилоксиметилизоксазол-3-карбоксилата, полученного на стадии 7.1, в 5 мл смеси 5/1 метанола и дихлорметана добавляют при комнатной температуре 1 мл (6,98 ммоль) раствора метиламина(7 М) в тетрагидрофуране. Продолжают перемешивание при температуре около 50 С в течение 2 ч. Выдерживают до возврата к комнатной температуре, затем охлаждают при использовании бани со льдом. Таким образом, выпавший осадок отфильтровывают, затем обильно промывают диэтиловым эфиром. После высушивания в вакууме при температуре около 70 С получают 0,12 г чистого продукта в ви- 12019742 де порошка белого цвета. Т.пл.: 200-202 С;LC-MS: М+Н=472; 1 Н-ЯМР (ДМСО)(м.д.): 8,70 (ушир. с, 1 Н); 8,0 (д, 1 Н); 7,80 (с, 1H); 7,55 (кв, 2 Н); 7,45 (ушир. т,1H); 7,30 (д, 1 Н); 6,80 (с, 1H); 5,20 (с, 2 Н); 4,50 (ушир. д, 2 Н); 3,10 (м, 2 Н); 2,90 (ушир. т, 2 Н); 2,80 (д, 3 Н); 1,80 (ушир. д, 2 Н); 1,60 (м, 1 Н); 1,40 (м, 2 Н); 1,15 (м, 2 Н). Пример 8 (соединение 23). 3-Карбамоилизоксазол-5-илметил-2-[1-(6-фторхинолин-2 ил)пиперидин-4-ил]этилкарбамат. 8.1. трет-Бутил-2-[1-(6-фторхинолин-2-ил)пиперидин-4-ил]этилкарбамат. В герметически закрываемую пробирку вводят 2,28 г (9,64 ммоль) 2-бром-6-фторхинолина, 2,00 г(8,76 ммоль) трет-бутил-2-пиперидин-4-илэтилкарбамата, 2,08 г (26,28 ммоль) пиридина и 15 мл ацетонитрила. Затем нагревают при температуре 80 С в течение 12 ч. Выдерживают до возврата к комнатной температуре, затем охлаждают при использовании бани со льдом. Таким образом, выпавший осадок отфильтровывают, затем обильно промывают диэтиловым эфиром. После высушивания в вакууме при температуре около 50 С получают 2,00 г чистого продукта в виде порошка белого цвета. Т.пл.: 127-129 С. 8.2. 2-[1-(6-Фторхинолин-2-ил)пиперидин-4-ил]этиламингидрохлорид. К раствору 1,9 г (5,09 ммоль) трет-бутил-2-[1-(6-фторхинолин-2-ил)пиперидин-4-ил]этилкарбамата,полученного на стадии 8.1, в 6 мл дихлорметана, охлажденному при использовании бани со смесью воды со льдом, медленно добавляют 10 мл (40 ммоль) 4 н. раствора хлороводорода в диоксане. Продолжают перемешивание при комнатной температуре в течение 2 ч. После выпаривания при пониженном давлении получают 0,9 г продукта в виде гидрохлорида, используемого таким, какой есть, на осуществляемой ниже стадии 8.4. 8.3. 3-Карбамоилизоксазол-5-илметил-4-нитрофенилкарбонат. К раствору 2,00 г (14,07 ммоль) 3-карбамоилизоксазол-5-илметанола, 1,71 мл (21,11 ммоль) пиридина и 0,172 г (1,41 ммоль) N,N-диметиламинопиридина в 15 мл дихлорметана, охлажденному до температуры около 0 С, добавляют маленькими порциями 2,84 г (14,07 ммоль) 4-нитрофенилхлорформиата. Продолжают перемешивание при температуре 0 С в течение 1 ч, затем при комнатной температуре в течение 1 ч. Таким образом, выпавший осадок отфильтровывают, затем обильно промывают диизопропиловым эфиром. После высушивания в вакууме при температуре около 60 С получают 3,12 г продукта в виде твердого вещества белого цвета, используемого таким, какой есть, на следующей стадии. Т.пл.: 143-145 С; 1H-ЯМР (ДМСО)(м.д.): 8,40 (д, 2 Н); 8,25 (ушир. с, 1 Н); 7,90 (ушир. с, 1 Н); 7,65 (д, 2 Н); 7,0 (с, 1 Н); 5,50 (с, 2 Н). 8.4. 3-Карбамоилизоксазол-5-илметил-2-[1-(6-фторхинолин-2-ил)пиперидин-4-ил]этилкарбамат. Поступают согласно методике, описанной в примере 1 на стадии 1.6. Исходя из 0,30 г (0,87 ммоль) 2-[1-(6-фторхинолин-2-ил)пиперидин-4-ил]этиламингидрохлорида, полученного на стадии 8.2, 0,266 г(0,87 ммоль) 3-карбамоилизоксазол-5-илметил-4-нитрофенилкарбоната, полученного на стадии 8.3, 0,367 г (2,6 ммоль) N,N-диизопропилэтиламина и 0,053 г (0,43 ммоль) N,N-диметиламинопиридина получают 0,260 г чистого продукта в виде порошка белого цвета. Т.пл.: 200-202 С;H-ЯМР (ДМСО)(м.д.): 8,15 (ушир. с, 1 Н); 8,05 (д, 1 Н); 7,80 (ушир. с, 1 Н); 7,55 (дд, 1 Н); 7,50 (дд,1 Н); 7,40 (м, 2 Н); 7,30 (д, 1 Н); 6,75 (с, 1 Н); 5,20 (с, 2 Н); 4,50 (ушир. д, 2 Н); 3,10 (м, 2 Н); 2,90 (ушир. т,2 Н); 1,75 (ушир. д, 2 Н); 1,60 (м, 1 Н); 1,40 (м, 2 Н); 1,15 (м, 2 Н). Пример 9 (соединение 25). 3-Метилкарбамоилизоксазол-5-илметил-2-[1-(6-фторхинолин-2 ил)пиперидин-4-ил]этилкарбамат. 9.1. 3-Метилкарбамоилизоксазол-5-илметил-4-нитрофенилкарбонат. Поступают согласно методике, описанной в примере 8 (стадия 8.3). Исходя из 2 г (12,81 ммоль) 3 метилкарбамоилизоксазол-5-илметанола, 2,58 г (12,81 ммоль) 4-нитрофенилхлорформиата, 1,52 г (19,21 ммоль) пиридина и 0,157 г (1,28 ммоль) N,N-диметиламинопиридина получают 2,6 г чистого продукта в виде порошка белого цвета. Т.пл.: 166-168 С; 1(д, 3 Н). 9.2. 3-Метилкарбамоилизоксазол-5-илметил-2-[1-(6-фторхинолин-2-ил)пиперидин-4-ил]этилкарбамат. Поступают согласно методике, описанной в примере 1 (стадия 1.6). Исходя из 0,310 г (1,13 ммоль) 2-[1-(6-фторхинолин-2-ил)пиперидин-4-ил]этиламина, полученного на стадии 8.2, 0,383 г (1,19 ммоль) 3- 13019742 метилкарбамоилизоксазол-5-илметил-4-нитрофенилкарбоната, полученного на стадии 9.1, и 0,32 г (2,27 ммоль) N,N-диизопропилэтиламина получают 0,33 г чистого продукта в виде порошка белого цвета. Т.пл.: 180-182 С;(ушир. д, 2 Н); 1,60 (м, 1 Н); 1,40 (м, 2 Н); 1,15 (м, 2 Н). Пример 10 (соединение 28). 3-Карбамоилизоксазол-5-илметил-2-[5'-(3-фторфенил)-3,4,5,6 тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат. 10.1. трет-Бутил-2-(5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этилкарбамат. В автоклав вводят 10,37 г (43,80 ммоль) 2,5-дибромпиридина, 10,00 г (43,80 ммоль) трет-бутил-2 пиперидин-4-илэтилкарбамата и 6,05 г (43,80 ммоль) карбоната калия. Затем нагревают при температуре 130 С в течение 12 ч. Выдерживают до возврата к комнатной температуре, затем реакционную смесь обрабатывают хлороформом и водным насыщенным раствором гидрокарбоната натрия. Водную фазу отделяют, экстрагируют ее два раза хлороформом, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия, сушат их над сульфатом натрия и фильтрат концентрируют при пониженном давлении. После хроматографии при использовании силикагеля, элюируя смесью 95/5 дихлорметана и метанола, получают 6,9 г чистого продукта в виде порошка белого цвета. Т.пл.: 108-110 С. 10.2. 2-(5'-Бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этиламин. К раствору 6,90 г (17,95 ммоль) трет-бутил-2-(5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил)этилкарбамата, полученного на стадии 10.1, в 100 мл дихлорметана, охлажденному при использовании бани со смесью воды со льдом, медленно добавляют 20,47 г (179,54 ммоль) трифторуксусной кислоты. Продолжают перемешивание при комнатной температуре в течение 2 ч. Реакционную смесь выливают в смесь воды со льдом и 28%-ным раствором гидроксида аммония. Декантируют, водную фазу экстрагируют два раза дихлорметаном, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия, сушат их над сульфатом натрия и концентрируют при пониженном давлении. Получают 4,9 г продукта в виде масла, используемого таким, какой есть, на следующей стадии. 10.3. 4-Нитрофенил-[2-(5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этил]карбамат. Поступают согласно методике, описанной в примере 1 (стадия 1.5). Исходя из 3,00 г (10,56 ммоль) 2-(5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этиламина, полученного на стадии 10.2, 2,34 г(1,06 ммоль) N,N-диметиламинопиридина, и после порошкования в диизопропиловом эфире получают 3,27 г продукта в виде твердого аморфного вещества. 10.4. 3-Карбамоилизоксазол-5-илметил-2-(5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил)этилкарбамат. Поступают согласно методике, описанной в примере 4. Исходя из 1,00 г (2,23 ммоль) 4 нитрофенил-[2-(5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этил]карбамата, полученного на стадии 10.3, 0,575 г (4,45 ммоль) N,N-диизопропилэтиламина, 0,136 г (1/11 ммоль) N,Nдиметиламинопиридина и 0,381 г (2,67 ммоль) 5-гидроксиметилизоксазол-3-карбоксамида, и после порошкования в диэтиловом эфире получают 0,740 г чистого продукта в виде порошка белого цвета. Т.пл.: 164-166 С. 10.5. 3-Карбамоилизоксазол-5-илметил-2-[5'-(3-фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат. В инертной атмосфере 0,735 г (1,63 ммоль) 3-карбамоилизоксазол-5-илметил-2-(5'-бром-3,4,5,6 тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этилкарбамата, полученного на стадии 10.4, 0,256 г (1,83 ммоль) 3-фторфенилбороновой кислоты, 1,493 г (4,58 ммоль) карбоната цезия вводят в виде суспензии в 8 мл смеси 9/1 тетрагидрофурана и воды. Затем добавляют 0,125 г (0,15 ммоль) PdCl2dppfCH2Cl2. После этого нагревают при температуре около 80 С в течение 18 ч. Выдерживают до возврата к комнатной температуре, соли отделяют путем фильтрации при использовании целита, потом фильтрат обрабатывают этилацетатом и водой, водную фазу отделяют, экстрагируют ее два раза этилацетатом, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия и сушат их над сульфатом натрия. После выпаривания растворителя полученное смолоподобное вещество каштанового цвета порошкуют в диизопропиловом эфире. Полученное твердое вещество зеленого цвета затем отфильтровывают, потом высушивают в вакууме при температуре около 80 С. Получают 0,651 г продукта. Т.пл.: 172-176 С; 2 Н); 1,80 (ушир. д, 2 Н); 1,60 (м, 1 Н); 1,40 (м, 2 Н); 1,15 (м, 2 Н). Пример 11 (соединение 53). 5-2-[1-(6-Хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамоилоксиметилизоксазол-3-карбоновая кислота. 11.1. трет-Бутил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамат. В герметически закрываемую пробирку вводят 2,00 г (8,76 ммоль) трет-бутил-(2-пиперидин-4 илэтил)карбамата (коммерчески доступный), 1,73 г (8,76 ммоль) 2,6-дихлорхинолина (коммерчески доступный) и 1,27 г (36,79 ммоль) карбоната калия в 11 мл ДМСО. Затем нагревают при температуре 130 С в течение 12 ч. Выдерживают до возврата к комнатной температуре, затем реакционную смесь обрабатывают дихлорметаном и водой. Водную фазу отделяют, экстрагируют ее два раза дихлорметаном, объединенные органические фазы промывают водным насыщенным раствором хлорида аммония, сушат их над сульфатом натрия и фильтрат концентрируют при пониженном давлении. После выпаривания растворителя полученный остаток очищают хроматографией при использовании силикагеля, элюируя смесью 98/2/0,2 дихлорметана, метанола и 28%-ного раствора гидроксида аммония. Таким образом получают 3,40 г чистого продукта в виде порошка.LC-MS: М+Н=390; т.пл.: 120-122 С. 1 Н-ЯМР (CDCl3)(м.д.): 7,80 (д, 1 Н); 7,65 (д, 1 Н); 7,60 (с, 1 Н); 7,40 (д, 1 Н); 7,00 (д, 1 Н); 4,50 (ушир. д, 3 Н); 3,25 (м, 2 Н); 2,90 (м, 2 Н); 1,90 (д, 2 Н); 1,65 (м, 1 Н); 1,45 (м, НН); 1,25 (м, 2 Н). 11.2. 2-[1-(6-Хлорхинолин-2-ил)пиперидин-4-ил]этиламин. К раствору 10,95 г (28,08 ммоль) трет-бутил-2-[1-(6-хлорхинолин-2-ил)пиперидин-4 ил]этилкарбамата, полученного на стадии 11.1, в 10 мл диоксана, охлажденному при использовании бани со смесью воды со льдом, медленно добавляют 28 мл (112,00 ммоль) 4 н. раствора хлороводорода в диоксане. Продолжают перемешивание при комнатной температуре в течение 3 ч. После фильтрации через фильтр из пористого стекла получают продукт в форме гидрохлорида, затем подщелачивают путем обработки 35%-ным раствором гидроксида натрия. После экстракции дихлорметаном, затем высушивания над сульфатом натрия и выпаривания досуха получают 8,13 г порошка белого цвета.H-ЯМР (CDCl3)(м.д.): 7,80 (д, 1 Н); 7,65 (д, 1 Н); 7,60 (с, 1 Н); 7,45 (д, 1 Н); 7,00 (д, 1 Н); 4,50 (ушир. д, 2 Н); 3,00 (м, 2 Н); 2,80 (т, 2 Н); 1,85 (д, 2 Н); 1,65 (м, 1 Н); 1,50 (м, 2 Н); 1,30-1,10 (м, 4 Н). 11.3. Этил-5-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамоилоксиметилизоксазол-3 карбоксилат. К раствору 3,54 г (20,70 ммоль) этил-5-гидроксиметилизоксазол-3-карбоксилата (коммерчески доступный), 7,88 мл (41,41 ммоль) N,N-диизопропилэтиламина и 1,26 г (10,35 ммоль) N,Nдиметиламинопиридина в 120 мл дихлорметана, охлажденному до температуры 0 С, порциями добавляют 4,17 г (20,70 ммоль) п-нитрофенилхлорформиата. Смесь перемешивают при температуре 10 С в течение 2 ч, затем выпаривают досуха. Полученный остаток обрабатывают с помощью 120 мл 1,2 дихлорэтана, затем добавляют 6,00 г (20,70 ммоль) 2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этиламина,полученного на стадии 11.2, и 5 мл (26,27 ммоль) N,N-диизопропилэтиламина. Смесь нагревают при температуре 70 С в течение 12 ч. После возврата к комнатной температуре отфильтровывают нерастворимую часть и к фильтрату добавляют 1 н. водный раствор гидроксида натрия. Продукт затем экстрагируют дихлорметаном. Объединенные органические фазы последовательно промывают водным насыщенным раствором хлорида аммония, затем водным насыщенным раствором хлорида натрия. После высушивания органических фаз над сульфатом натрия концентрируют при пониженном давлении. После очистки при использовании колонки с силикагелем, элюируя смесью 98/2/0,2 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, порошкуют в диизопропиловом эфире, получая 5,10 г ожидаемого продукта в виде твердого вещества белого цвета. Т.пл.: 113-115 С; 1 Н-ЯМР (CDCl3)(м.д.): 7,70 (д, 1 Н); 7,50 (м, 1 Н); 7,45 (м, 1 Н); 7,35 (м, 1 Н); 6,90 (д, 1 Н); 6,65 (с,1 Н); 5,20 (с, 2 Н); 4,70 (м, 2 Н); 4,50-4,30 (м, 5 Н); 3,20 (м, 2 Н); 2,90 (ушир. т, 2 Н); 1,80 (ушир. д, 2 Н); 1,601,20 (м, 6 Н). 11.4. 5-2-[1-(6-Хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамоилоксиметилизоксазол-3 карбоновая кислота. К раствору 1,00 г (2,05 ммоль) этил-5-2-[1-(6-хлорхинолин-2-ил)пиперидин-4-ил]этилкарбамоилоксиметилизоксазол-3-карбоксилата, полученного на стадии 11.3, в 51 мл этанола добавляют 10,27 мл(10,27 ммоль) водного раствора гидроксида натрия (1 н.). Смесь перемешивают при комнатной температуре в течение 2 ч. После выпаривания досуха остаток обрабатывают минимальным количеством воды,затем добавляют при температуре 0 С 1 н. водный раствор хлороводорода до значения рН 4-5. После декантации полученное масло порошкуют в ацетоне, получая 0,45 г ожидаемого продукта в виде твердого вещества белого цвета.(д, 1 Н); 6,85 (с, 1 Н); 5,20 (с, 2 Н); 4,50 (ушир. д, 2 Н); 3,55 (м, 2 Н); 3,10 (м, 2 Н); 1,90 (м, 2 Н) 1,70 (м, 1 Н); 1,40 (м, 2 Н); 1,25 (м, 2 Н). Пример 12 (соединение 60). 3-Метилкарбамоилизоксазол-5-илметил-2-[3-диметиламино-1-(4 трифторметилпиримидин-2-ил)азетидин-3-ил]этилкарбамат. 12.1. трет-Бутил-3-цианометил-3-диметиламиноазетидин-1-карбоксилат. В герметически закрываемой пробирке 1,20 г (6,18 ммоль) трет-бутил-3-цианометиленазетидин-1 карбоксилата (WO 2009/064835) растворяют в 15 мл метанола. Добавляют 6,18 мл (12,3 6 ммоль) раствора диметиламина в метаноле и реакционную среду перемешивают при температуре 80 С в течение 3 ч. Выдерживают до возврата к комнатной температуре, затем выпаривают досуха. Полученный остаток хроматографируют при использовании колонки с силикагелем, элюируя смесью 97/3/0,3 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, и получают 1,32 г ожидаемого продукта в виде масла.H-ЯМР (ДМСО)(м.д.): 3,75 (м, 4 Н); 2,90 (с, 2H); 2,15 (с, 6 Н); 1,40 (с, 9 Н). 12.2. трет-Бутил-3-(2-аминоэтил)-3-диметиламиноазетидин-1-карбоксилат. К раствору 1,30 г (5,43 ммоль) трет-бутил-3-цианометил-3-диметиламиноазетидин-1-карбоксилата,полученного на предыдущей стадии, в 27 мл метанола добавляют 1,59 г (27,16 ммоль) никеля Ренея. Реакционную среду помещают в аппарат Парра в атмосферу водорода (70 фунт/дюйм 2) при температуре 50 С на 6 ч. Отфильтровывают на воронке Бюхнера, затем фильтрат концентрируют при пониженном давлении. Таким образом получают 1,28 г ожидаемого продукта в виде бесцветного масла. 1H-ЯМР (CDCl3)(м.д.): 3,90 (д, 2 Н); 3,60 (д, 2 Н); 2,90 (м, 2 Н); 2,25 (с, 6 Н); 2,10 (м, 2 Н); 1,90 (м,2 Н); 1,40 (с, 9 Н). 12.3. трет-Бутил-3-диметиламино-3-[2-(3-метилкарбамоилизоксазол-5-илметоксикарбониламино)этил]азетидин-1-карбоксилат. При температуре 80 С в течение 3 ч нагревают раствор, содержащий 0,60 г (2,47 моль) трет-бутил 3-(2-аминоэтил)-3-диметиламиноазетидин-1-карбоксилата, полученного на стадии 12.2, 0,87 г (2,71 ммоль) 3-(метилкарбамоил)изоксазол-5-илметил-4-нитрофенилкарбоната, полученного на стадии 9.2, 860 мкл (4,93 ммоль) N,N-диизопропилэтиламина и 0,15 г (1,23 ммоль) N,N-диметиламинопиридина в 12 мл 1,2-дихлорэтана. К реакционной среде добавляют воду, водную фазу отделяют, экстрагируют ее несколько раз дихлорметаном, объединенные органические фазы промывают водным раствором гидроксида натрия (1 н.),затем водным насыщенным раствором хлорида аммония. Их сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. После выпаривания растворителя полученный остаток очищают хроматографией при использовании силикагеля, элюируя смесью 97/3/0,3 дихлометана, метанола и 28%-ного раствора гидроксида аммония, и получают 0,64 г ожидаемого продукта в виде воскообразного вещества.H-ЯМР (ДМСО)(м.д.): 8,70 (ушир. с, 1 Н); 7,40 (ушир. с, 1 Н); 6,80 (с, 1 Н); 5,20 (с, 2 Н); 3,80 (м,2 Н); 3,60 (м, 2 Н); 3,10 (м, 2 Н); 2,80 (с, 3 Н); 2,15 (с, 6 Н); 1,80 (м, 2 Н); 1,40 (с, 9 Н). 12.4. 3-Метилкарбамоилизоксазол-5-илметил-[2-(3-диметиламиноазетидин-3-ил)этил]карбаматгидрохлорид (1:2). Поступают согласно методике, описанной в примере 11 (стадия 11.2). Исходя из 0,58 г (1,36 ммоль) трет-бутил-3-диметиламино-3-[2-(3-метилкарбамоилизоксазол-5-илметоксикарбониламино)этил]азетидин-1-карбоксилата, полученного на стадии 12.3, 4 мл (16 ммоль) 4 н. раствора хлороводорода в диоксане и после порошкования в диэтиловом эфире получают 1,27 г ожидаемого продукта в виде порошка белого цвета. Т.пл.: 210-212 С; 1(1:2), полученного на предыдущей стадии, 0,20 г (1,10 ммоль) 2-хлор-4-трифторметилпиримидина и 700 мкл (4,02 ммоль) N,N-диизопропилэтиламина растворяют в 5 мл ацетонитрила. Реакционную среду подвергают воздействию микроволнового излучения в течение 10 мин при температуре 130 С. Выдерживают до возврата к комнатной температуре, затем к реакционной среде добавляют воду. Водную фазу отделяют, экстрагируют ее несколько раз дихлорметаном, объединенные органические фазы промывают водным насыщенным раствором хлорида аммония. Их сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией при использовании силикагеля, элюируя смесью 97/3/0,3 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, и после порошкования в диизопропиловом эфире и фильтрации получают 0,38 г ожидаемого продукта в виде порошка белого цвета. Т.пл.: 154-156 С;(д, 2 Н); 3,80 (д, 2H); 3,10 (м, 2 Н); 2,80 (с, 3 Н); 2,20 (с, 6 Н); 1,90 (м, 2 Н). Пример 13 (соединение 63). 2,2,2-Трифтор-1-(1-метил-1 Н-имидазол-2-ил)этил-2-[1-(4 хлорфталазин-1-ил)-3-диметиламиноазетидин-3-ил]этилкарбамат. 13.1. трет-Бутил-3-диметиламино-3-2-[2,2,2-трифтор-1-(1-метил-1 Н-имидазол-2-ил)этоксикарбониламино]этилазетидин-1-карбоксилат. К раствору 0,60 г (2,47 ммоль) трет-бутил-3-(2-аминоэтил)-3-диметиламиноазетидин-1 карбоксилата, полученного на стадии 12.2, 0,95 г (7,40 ммоль) N,N-диизопропилэтиламина и 0,06 г (0,49 ммоль) N,N-диметиламинопиридина в 12 мл 1,2-дихлорэтана, охлажденному до температуры около 0 С,маленькими порциями добавляют 0,497 г (2,47 ммоль) 4-нитрофенилхлорформиата в 3 мл 1,2 дихлорэтана. Продолжают перемешивание при комнатной температуре в течение 1 ч. Затем добавляют 0,488 г (2,71 ммоль) 2,2,2-трифтор-1-(1-метил-1 Н-имидазол-2-ил)этанола (коммерчески доступный) и 0,47 г (3,70 ммоль) N,N-диизопропилэтиламина. Смесь нагревают при температуре 80 С в течение 12 ч. После возврата к комнатной температуре к реакционной смеси добавляют воду, водную фазу отделяют, экстрагируют ее несколько раз дихлорметаном, объединенные органические фазы промывают водным раствором хлорида натрия (1 н.), затем водным насыщенным раствором хлорида аммония. Их сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. После очистки при использовании колонки с силикагелем, элюируя смесью 97/3/0,3 дихлорметана,метанола и 28%-ного раствора гидроксида аммония, получают 0,71 г ожидаемого продукта в виде воска.LC-MS: М+Н=450; 1 Н-ЯМР (ДМСО)(м.д.): 7,85 (т, 1H); 7,25 (с, 1 Н); 7,00 (с, 1 Н); 6,45 (м, 1 Н); 3,75 (м, 5H); 3,50 (м,2 Н); 3,10 (м, 2 Н); 2,15 (с, 6 Н); 1,85 (т, 2 Н); 1,40 (с, 9 Н). 13.2. 2,2,2-Трифтор-1-(1-метил-1 Н-имидазол-2-ил)этил-[2-(3-диметиламиноазетидин-3-ил)этил]карбаматгидрохлорид (1:2). Поступают согласно методике, описанной в примере 11 (стадия 11.2). Исходя из 0,71 г (1,58 ммоль) трет-бутил-3-диметиламино-3-2-[2,2,2-трифтор-1-(1-метил-1 Н-имидазол-2-ил)этоксикарбониламино]этилазетидин-1-карбоксилата, полученного на стадии 13.1, 3,90 мл (15,75 ммоль) 4 н. раствора хлороводорода в диоксане, и после порошкования в диэтиловом эфире получают 0,84 г ожидаемого продукта в виде твердого аморфного вещества. 1H-ЯМР (ДМСО)(м.д.): 12,50 (ушир. с, 1 Н); 10,00 (ушир. с, 1 Н); 9,20 (ушир. с, 1 Н); 8,30 (т, 1 Н); 7,60 (с, 1 Н); 7,30 (с, 1 Н); 6,80 (м, 1 Н); 4,50 (м, 2 Н); 4,10 (м, 2 Н); 3,90 (с, 3 Н); 3,40 (м, 2 Н); 2,70 (с, 6 Н); 2,15 (м, 2 Н). 13.3. 2,2,2-Трифтор-1-(1-метил-1 Н-имидазол-2-ил)этил-2-[1-(4-хлорфталазин-1-ил)-3-диметиламиноазетидин-3-ил]этилкарбамат. Поступают согласно методике, описанной в примере 12 (стадия 12.5). Исходя из 0,50 г (1,09 ммоль) 2,2,2-трифтор-1-(1-метил-1 Н-имидазол-2-ил)этил-[2-(3-диметиламиноазетидин-3-ил)этил]карбаматгидрохлорида (1:2), полученного на предыдущей стадии 13.2, 0,26 г (1,31 ммоль) 1,4-дихлорфталазина (коммерчески доступный) и 0,70 г (5,45 ммоль) N,N-диизопропилэтиламина в 5,45 мл ацетонитрила, получают 0,185 г ожидаемого продукта в виде порошка. Т.пл.: 168-170C;(26,29 ммоль) пиридина и 0,214 г (1,75 ммоль) N,N-диметиламинопиридина получают 3,80 г ожидаемого продукта в виде порошка белого цвета. Т.пл.: 85-87 С;H-ЯМР (ДМСО)(м.д.): 8,40 (д, 2 Н); 7,60 (д, 2 Н); 7,10 (с, 1 Н); 5,55 (с, 2 Н); 4,40 (кв, 2 Н); 1,40 (т, 3 Н). 14.2. трет-Бутил-4-[(3-этоксикарбонилизоксазол-5-илметоксикарбониламино)метил]-4-фторпиперидин-1-карбоксилат. Поступают согласно методике, описанной в примере 1 (стадия 1.6). Исходя из 0,70 г (3,01 ммоль) трет-бутил-4-аминометил-4-фторпиперидин-1-карбоксилата (коммерчески доступный), 1,11 г (3,31 ммоль) этил-5-(4-нитрофеноксикарбонилоксиметил)изоксазол-3-карбоксилата, полученного на стадии 14.1, получают 0,33 г чистого продукта в виде масла оранжевого цвета. 1H-ЯМР (ДМСО)(м.д.): 7,75 (ушир. т, 1 Н); 6,90 (с, 1 Н); 5,25 (с, 2 Н); 4,40 (кв, 2 Н); 3,80 (м, 2 Н); 3,00 (м, 2 Н); 3,25 (м, 2 Н); 1,75-1,45 (м, 4 Н); 1,40 (с, 9 Н); 1,30 (т, 3 Н). 14.3. Этил-5-(4-фторпиперидин-4-илметилкарбамоилоксиметил)изоксазол-3-карбоксилаттрифторацетат. К раствору 0,90 г (2,10 ммоль) трет-бутил-4-[(3-этоксикарбонилизоксазол-5-илметоксикарбониламино)метил]-4-фторпиперидин-1-карбоксилата, полученного на стадии 14.2, в 10 мл дихлорметана, охлажденному при использовании бани со смесью воды со льдом, медленно добавляют 1,06 мл (12,57 ммоль) раствора трифторуксусной кислоты. Продолжают перемешивание при комнатной температуре в течение 3 ч. После выпаривания при пониженном давлении получают 0,46 г продукта в виде трифторацетата,используемого таким, какой есть, на осуществляемой ниже стадии 14.4. 14.4. Этил-5-[1-(6-хлорхинолин-2-ил)-4-фторпиперидин-4-илметилкарбамоилоксиметил]изоксазол 3-карбоксилат. В герметически закрываемую пробирку вводят 0,465 г (1,05 ммоль) этил-5-(4-фторпиперидин-4 илметилкарбамоилоксиметил)изоксазол-3-карбоксилаттрифторацетата, полученного на стадии 14.3, 0,23 г (1,15 ммоль) 2,6-дихлорхинолина и 730 мкл (4,20 ммоль) N,N-диизопропилэтиламина в 5 мл ацетонитрила. Затем нагревают при температуре 120 С в течение 12 ч. Выдерживают до возврата к комнатной температуре, затем реакционную среду обрабатывают этилацетатом, водную фазу отделяют, экстрагируют ее два раза этилацетатом, объединенные органические фазы промывают водным насыщенным раствором хлорида аммония и сушат их над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией при использовании колонки с силикагелем, элюируя смесью 99/1 дихлорметана и метанола, и таким образом получают 0,07 г чистого продукта в виде порошка белого цвета. Т.пл.: 132-134 С; 57). 3-Метилкарбамоилизоксазол-5-илметил-[4-фтор-1-(4 трифторметилпиримидин-2-ил)пиперидин-4-ил]метилкарбамат. 15.1. Этил-5-[4-фтор-1-(4-трифторметилпиримидин-2-ил)пиперидин-4-илметилкарбамоилоксиметил]изоксазол-3-карбоксилат. Поступают согласно методике, описанной в примере 14 (стадия 14.4). Исходя из 0,46 г (1,05 ммоль) этил-5-(4-фторпиперидин-4-илметилкарбамоилоксиметил)изоксазол-3-карбоксилаттрифторацетата, полученного на стадии 14.3, 0,21 г (1,15 ммоль) 2-хлор-4-трифторметилпиримидина и 730 мкл (4,20 ммоль)N,N-диизопропилэтиламина в 5 мл ацетонитрила, получают таким образом 0,22 г чистого продукта в виде порошка белого цвета. Т.пл.: 136-138 С;(м, 4 Н); 3,40-3,15 (м, 4 Н); 1,90-1,50 (м, 4 Н); 1,30 (т, 3 Н). 15.2. 3-Метилкарбамоилизоксазол-5-илметил-[4-фтор-1-(4-трифторметилпиримидин-2-ил)пиперидин-4-ил]метилкарбамат. В герметически закрытой пробирке раствор 0,14 г (0,29 ммоль) этил-5-[4-фтор-1-(4 трифторметилпиримидин-2-ил)пиперидин-4-илметилкарбамоилоксиметил]изоксазол-3-карбоксилата,полученного на стадии 15.1, в 1,10 мл (8,83 ммоль) раствора метиламина в метаноле перемешивают при комнатной температуре в течение 1 ч 30 мин. Выпаривают досуха. Полученный остаток порошкуют в диэтиловом эфире и отфильтровывают. После высушивания в вакууме при температуре около 60 С получают 0,12 г чистого продукта в виде порошка белого цвета. Т.пл.: 187-189 С; Пример 16 (соединение 43). 3-Карбамоилизоксазол-5-илметил-[2-(5'-изобутил-3,4,5,6 тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат. 16.1. Этил-[2-(5'-бром-3, 4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этил]карбамат. Поступают согласно методике, описанной в примере 1 (стадия 1.5). Исходя из 4,52 г (15,90 ммоль) 2-(5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этиламина, полученного на стадии 10.2, 1,89 гN,N-диметиламинопиридина, и после очистки при использовании колонки с силикагелем, элюируя смесью 99/1/0,1 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 3,87 г ожидаемого продукта в виде порошка. Т.пл.: 87-89 С; 1H-ЯМР (ДМСО)(м.д.): 8,00 (м, 1 Н); 7,30 (м, 1 Н); 6,40 (д, 1 Н); 4,45 (ушир. с, 1 Н); 4,15-3,90 (м,4 Н); 3,10 (м, 2 Н); 2,60 (м, 2 Н); 1,65 (м, 2H); 1,55-1,25 (м, 3 Н); 1,20-0,95 (м, 5H). 16.2. Этил-2-[5'-(2-метилпропенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил]этилкарбамат. Поступают согласно методике, описанной в примере 10 (стадия 10.5). Исходя из 1,00 г (2,81 ммоль) этил-[2-(5'-бром-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этил]карбамата, полученного на предыдущей стадии, 0,61 г (3,37 ммоль) пинакол-2-метил-1-пропенилбороната (коммерчески доступный), 2,74 г (8,42 ммоль) карбоната цезия, в виде суспензии в 18 мл смеси 9/1 тетрагидрофурана и воды, 0,23 г (0,28 ммоль) PdCl2dppfCH2Cl2, и после очистки при использовании колонки с силикагелем, элюируя смесью 99/1/0,1 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 0,75 г ожидаемого продукта в виде воскообразного вещества. 1H-ЯМР (CDCl3)(м.д.): 8,10 (м, 1 Н); 7,40 (м, 1 Н); 6,65 (д, 1 Н); 6,10 (м, 1 Н); 4,65 (ушир. с, 1 Н); 4,40-4,10 (м, 4 Н); 3,25 (м, 2 Н); 2,85 (м, 2 Н); 1,90-1,75 (м, 8 Н); 1,70-1,40 (м, 4 Н); 1,35-1,20 (м, 4 Н). 16.3. Этил-[2-(5'-изобутил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этил]карбамат. К раствору 0,74 г (2,23 ммоль) этил-2-[5'-(2-метилпропенил)-3,4,5,6-тетрагидро-2 Н[1,2']бипиридинил-4-ил]-этилкарбамата, полученного на предыдущей стадии, в 30 мл метанола добавляют 0,10 г (0,94 ммоль) палладия-на-угле. Реакционную среду помещают в аппарат Парра в атмосферу водорода (10 фунт/дюйм 2) при комнатной температуре на 1 ч 30 мин. Отфильтровывают на воронке Бюхнера, затем фильтрат концентрируют при пониженном давлении. Таким образом получают 0,74 г ожидаемого продукта в виде порошка. Т.пл.: 78-80 С; 1H-ЯМР (CDCl3)(м.д.): 8,00 (м, 1 Н); 7,30 (м, 1H); 6,65 (д, 1 Н); 4,65 (ушир. с, 1 Н); 4,35-4,05 (м, 4 Н); 3,30 (м, 2 Н); 2,80 (м, 2 Н); 2,35 (д, 2 Н); 1,90-1,75 (м, 2 Н); 1,70-1,45 (м, 2 Н); 1,35-1,20 (м, 3 Н); 0,90 (д, 6 Н). 16.4. 2-(5'-Изобутил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этиламин. К раствору 0,64 г (1,93 ммоль) этил-[2-(5'-изобутил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил)этил]карбамата, полученного на стадии 16.3, в 9,70 мл смеси этанола и воды (1/1) добавляют при комнатной температуре 2,17 г (38,68 ммоль) гидроксида калия. Затем нагревают при температуре 110 С в течение 12 ч. Добавляют 2,17 г (38,68 ммоль) гидроксида калия и перемешивают в течение 4 ч. Выдерживают до возврата к комнатной температуре, затем концентрируют при пониженном давлении. Реакционную среду обрабатывают дихлорметаном, водную фазу отделяют, экстрагируют ее два раза дихлорметаном, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия и сушат их над сульфатом натрия. После выпаривания при пониженном давлении получают 0,37 г ожидаемого продукта в виде воскообразного вещества желтого цвета.LC-MS: М+Н=262; 1 Н-ЯМР (CDCl3)(м.д.): 8,00 (м, 1 Н); 7,30 (м, 1 Н); 6,65 (д, 1 Н); 4,25 (м, 2 Н); 2,80 (м, 4 Н); 2,35 (д,2 Н); 1,80 (м, 3 Н); 1,60 (м, 1 Н); 1,45 (м, 2 Н); 1,30 (м, 4 Н); 0,90 (д, 6 Н). 16.5. 3-Карбамоилизоксазол-5-илметил-[2-(5'-изобутил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4 ил]этилкарбамат. Поступают согласно методике, описанной в примере 1, стадия 1.6. Исходя из 0,37 г (1,42 ммоль) 2(5'-изобутил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-ил)этиламина, полученного на стадии 16.4, 0,52 г (1,70 ммоль) 3-карбамоилизоксазол-5-илметил-4-нитрофенилкарбоната, полученного на стадии 8.3,0,62 г (3,54 ммоль) N,N-диизопропилэтиламина и 0,087 г (0,71 ммоль) N,N-диметиламинопиридина, в 14 мл 1,2-дихлорэтана, получают 0,42 г чистого продукта в виде порошка белого цвета. Т.пл.: 168-170 С;H-ЯМР (CDCl3)(м.д.): 3,60-3,40 (м, 2 Н); 3,30-3,10 (м, 2 Н); 2,75 (м, 2 Н); 1,50 (с, 9 Н); 1,40-1,25 (м,6 Н); 0,95 (с, 3 Н). 17.2. трет-Бутил-4-метил-4-[2-(3-метилкарбамоилизоксазол-5-илметоксикарбониламино)этил]пиперидин-1-карбоксилат. Поступают согласно методике, описанной в примере 12 (стадия 12.3). Исходя из 0,54 г (2,22 ммоль) трет-бутил-4-(2-аминоэтил)-4-метилпиперидин-1-карбоксилата и 0,78 г (245 ммоль) 3-(метилкарбамоил)изоксазол-5-илметил-4-нитрофенилкарбоната, полученного на стадии 9.2, 580 мкл (3,34 ммоль) N,Nдиизопропилэтиламина и 0,13 г (1,11 ммоль) N,N-диметиламинопиридина, в 22 мл 1,2-дихлорэтана, получают 0,94 г ожидаемого продукта в виде воскообразного вещества.H-ЯМР (ДМСО)(м.д.): 8,70 (ушир. с, 1 Н); 7,40 (ушир. с, 1H); 6,75 (с, 1 Н); 5,20 (с, 2 Н); 3,40 (м,2 Н); 3,20 (м, 2 Н); 3,05 (м, 2 Н); 2,80 (д, 3 Н); 1,40 (м, НН); 1,25 (м, 4 Н); 0,95 (с, 3 Н). 17.3. 3-Метилкарбамоилизоксазол-5-илметил-[2-(4-метилпиперидин-4-ил)этил]карбаматгидрохлорид. Поступают согласно методике, описанной в примере 11 (стадия 11.2). Исходя из 0,97 г (2,30 ммоль) трет-бутил-4-метил-4-[2-(3-метилкарбамоилизоксазол-5-илметоксикарбониламино)этил]пиперидин-1 карбоксилата, полученного на стадии 17.2, и 5,74 мл (22,97 ммоль) 4 н. раствора хлороводорода в диоксане, и после порошкования в диэтиловом эфире получают 0,73 г ожидаемого продукта в виде порошка белого цвета. Т.пл.: 188-190 С;(м, 2 Н); 3,60 (м, 2 Н); 3,10 (м, 2 Н); 2,80 (с, 3 Н); 1,50 (м, 2 Н); 1,40 (м, 4 Н); 1,00 (с, 3 Н). Пример 18 (соединение 64). 3-Метилкарбамоилизоксазол-5-илметил-2-[1-(6-хлорхиноксалин-2 ил)-4-этилпиперидин-4-ил]этилкарбамат. 18.1. трет-Бутил-4-(цианоэтоксикарбонилметил)-4-этилпиперидин-1-карбоксилат. К раствору 2,00 г (6,79 ммоль) трет-бутил-4-(цианоэтоксикарбонилметилен)пиперидин-1 карбоксилата (WO 2006/001752) в 33 мл тетрагидрофурана добавляют по каплям и при температуре -5 С в атмосфере аргона 4,53 мл (13,59 ммоль) 3 M раствора этилмагнийбромида в диэтиловом эфире. Реакционную среду затем перемешивают при комнатной температуре в течение 12 ч. Добавляют этилацетат и среду охлаждают при использовании бани со смесью воды со льдом, затем добавляют насыщенный раствор хлорида аммония. Водную фазу отделяют, экстрагируют ее три раза этилацетатом, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия, сушат их над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Остаток хроматографируют при использовании силикагеля, элюируя смесью 95/5 циклогексана и этилацетата, и получают 1,63 г чистого продукта в виде порошка белого цвета.H-ЯМР (CDCl3)(м.д.): 4,25 (с, 1 Н); 4,20 (кв, 2 Н); 3,50-3,15 (т, 4 Н); 1,60 (кв, 2 Н); 2,50-1,55 (т, 2 Н); 1,40 (с, 9H); 1,20 (т, 3 Н); 0,85 (т, 3 Н). 18.2. трет-Бутил-4-цианометил-4-этилпиперидин-1-карбоксилат. К раствору 1,30 г (4,01 ммоль) трет-бутил-4-(цианоэтоксикарбонилметил)-4-этилпиперидин-1 карбоксилата, полученного на предыдущей стадии, в 14 мл диметилсульфоксида добавляют 0,09 г (1,60 ммоль) хлорида натрия и 0,14 г (8,01 ммоль) воды. Реакционную среду перемешивают при температуре 150 С в течение 1 ч. Добавляют диэтиловый эфир и воду. Водную фазу отделяют, экстрагируют ее три раза диэтиловым эфиром, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия, сушат их над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Остаток хроматографируют при использовании силикагеля, элюируя смесью 95/5 циклогексана и этил- 20019742H-ЯМР (CDCl3)(м.д.): 3,30 (т, 4 Н); 2,60 (с, 2 Н); 1,45 (кв, 2 Н); 1,40 (т, 4 Н); 1,35 (с, 9 Н); 0,80 (т,3 Н). 18.3. трет-Бутил-4-(2-аминоэтил)-4-этилпиперидин-1-карбоксилат. Поступают согласно методике, описанной в примере 12 (стадия 12.2). Исходя из 0,96 г (3,83 ммоль) трет-бутил-4-цианометил-4-этилпиперидин-1-карбоксилата и 1,12 г (19,15 ммоль) никеля Ренея, в 50 мл метанола, в атмосфере водорода (70 фунт/дюйм 2) при температуре 50 С и после хроматографии при использовании колонки с силикагелем, элюируя смесью 95/5/0,5 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 0,71 г ожидаемого продукта в виде воскообразного вещества.(3,06 ммоль) 3(метилкарбамоил)изоксазол-5-илметил-4-нитрофенилкарбоната, полученного на стадии 9.1, 730 мклH-ЯМР (CDCl3)(м.д.): 8,70 (д, 1 Н); 7,40 (т, 1 Н); 6,75 (с, 1 Н); 5,20 (с, 2 Н); 3,30 (кв, 2 Н); 3,25 (м,4 Н); 2,80 (д, 3 Н); 1,50-1,20 (м, 8 Н); 1,10 (с, 9 Н); 0,80 (т, 3 Н). 18.5. 3-Метилкарбамоилиоксазол-5-илметил-[2-(4-этилпиперидин-4-ил)этил]карбаматгидрохлорид. Поступают согласно методике, описанной в примере 11 (11.2). Исходя из 0,94 г (2,14 ммоль) третбутил-4-этил-4-[2-(3-метилкарбамоилизоксазол-5-илметоксикарбониламино)этил]пиперидин-1 карбоксилата, полученного на стадии 18.4, 2,68 мл (10,72 ммоль) 4 н. раствора хлороводорода в диоксане,и после порошкования в диэтиловом эфире получают 0,76 г ожидаемого продукта в виде порошка белого цвета. Т.пл.: 222-224 С;(1,33 ммоль) 2,6-дихлорхиноксалина и 460 мкл (2,66 ммоль) N,N-диизопропилэтиламина, в виде раствора в 3 мл ацетонитрила, получают 0,29 г ожидаемого продукта в виде порошка желтого цвета. Т.пл.: 158-160 С;H-ЯМР (ДМСО)(м.д.): 8,80 (с, 1 Н); 8,70 (м, 1 Н); 7,90 (с, 1 Н); 7,60 (с, 2 Н); 7,40 (м, 1 Н); 6,80 (с,1 Н); 5,20 (с, 2 Н); 3,90-3,60 (м, 4 Н); 3,00 (м, 2 Н); 2,80 (м, 3 Н); 1,50-1,30 (м, 8 Н); 0,80 (т, 3 Н). Пример 19 (соединение 65). 3-Метилкарбамоилизоксазол-5-илметил-2-[1-(6-хлорхиноксалин-2 ил)-4-изобутилпиперидин-4-ил]этилкарбамат. 19.1. трет-Бутил-4-(цианоэтоксикарбонилметил)-4-изобутилпиперидин-1-карбоксилат. Поступают согласно методике, описанной в примере 18 (стадия 18.1). Исходя из 5,00 г (16,99 ммоль) трет-бутил-4-(цианоэтоксикарбонилметилен)пиперидин-1-карбоксилата (WO 2006/001752) в 56 мл тетрагидрофурана и 16,99 мл (33,97 ммоль) 2 M раствора изобутилмагнийбромида в диэтиловом эфире получают 1,46 г чистого продукта в виде воскообразного вещества.H-ЯМР (CDCl3)(м.д.): 4,25 (кв, 2 Н); 3,80 (с, 1 Н); 3,45 (м, 2 Н); 3,30 (м, 2 Н); 1,75 (м, 5 Н); 1,60 (м,2 Н); 1,40 (с, 9 Н); 1,30 (т, 3 Н); 0,90 (д, 6 Н). 19.2. трет-Бутил-4-цианометил-4-изобутилпиперидин-1-карбоксилат. Поступают согласно методике, описанной в примере 18 (стадия 18.2). Исходя из 1,46 г (4,16 ммоль) трет-бутил-4-(цианоэтоксикарбонилметил)-4-изобутилпиперидин-1-карбоксилата, полученного на предыдущей стадии, в 14 мл диметилсульфоксида, 0,097 г (1,66 ммоль) хлорида натрия и 0,15 г (8,31 ммоль) воды получают 1,10 г чистого продукта в виде воскообразного вещества. 19.3. трет-Бутил-4-(2-аминоэтил)-4-изобутилпиперидин-1-карбоксилат. Поступают согласно методике, описанной в примере 12 (стадия 12.2). Исходя из 1,10 г (3,95 ммоль) трет-бутил-4-цианометил-4-изобутилпиперидин-1-карбоксилата и 1,16 г (19,75 ммоль) никеля Ренея, в 13 мл метанола, в атмосфере водорода (70 фунт/дюйм 2) при температуре 45 С и после хроматографии при использовании колонки с силикагелем, элюируя смесью 96/4/0,4 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 0,50 г ожидаемого продукта в виде масла.(1,91 ммоль) 3(метилкарбамоил)изоксазол-5-илметил-4-нитрофенилкарбоната, полученного на стадии 9.2, 450 мклLC-MS: М+Н=467; 1 Н-ЯМР (ДМСО)(м.д.): 8,70 (ушир. с, 1 Н); 7,40 (м, 1 Н); 6,80 (с, 1 Н); 5,20 (с, 2 Н); 3,40-3,15 (м, 4 Н); 3,00 (м, 2 Н); 2,80 (д, 3 Н); 1,70 (м, 1 Н); 1,50 (м, 2 Н); 1,40 (с, 9 Н); 1,30 (м, 4 Н); 1,20 (м, 2 Н); 0,90 (д, 6 Н). 19.5. 3-Метилкарбамоилизоксазол-5-илметил-[2-(4-изобутилпиперидин-4-ил)этил]карбамат. Поступают согласно методике, описанной в примере 11 (стадия 11.2). Исходя из 0,71 г (1,53 ммоль) трет-бутил-4-изобутил-4-[2-(3-метилкарбамоилизоксазол-5-илметоксикарбониламино)этил]пиперидин-1 карбоксилата, полученного на стадии 19.4, 3,83 мл (15,30 ммоль) 4 н. раствора хлороводорода в диоксане,и после порошкования в диэтиловом эфире получают 0,60 г ожидаемого продукта в виде масла.LC-MS: М+Н=367; 1 Н-ЯМР (ДМСО)(м.д.): 8,70 (ушир. с, 1 Н); 8,50 (ушир. с, 1 Н); 7,40 (м, 1 Н); 6,80 (с, 1 Н); 5,20 (с,2 Н); 3,00 (м, 6 Н); 2,75 (д, 3 Н); 1,70 (м, 1 Н); 1,50 (м, 6 Н); 1,30 (м, 2 Н); 0,90 (д, 6 Н). 19.6. 3-Метилкарбамоилизоксазол-5-илметил-2-[1-(6-хлорхиноксалин-2-ил)-4-изобутилпиперидин 4-ил]этилкарбамат. Поступают согласно методике, описанной в примере 12 (стадия 12.5). Исходя из 0,30 г (0,74 ммоль) 3-метилкарбамоилизоксазол-5-илметил-[2-(4-этилпиперидин-4-ил)изобутил]карбаматгидрохлорида, полученного на предыдущей стадии, 0,22 г (1,12 ммоль) 2,6-дихлорхиноксалина и 390 мкл (2,23 ммоль)N,N-диизопропилэтиламина, в виде раствора в 2,50 мл ацетонитрила, получают 0,29 г ожидаемого продукта в виде порошка желтого цвета. Т.пл.: 144-146 С;(м, 2 Н); 0,90 (д, 6 Н). Пример 20 (соединение 62). 3-Метилкарбамоилизоксазол-5-илметил-2-[4-гидрокси-1-(4 трифторметилпиримидин-2-ил)пиперидин-4-ил]этилкарбамат. 20.1. Бензил-4-этоксикарбонилметил-4-гидроксипиперидин-1-карбоксилат. К раствору 5,00 г (56,75 ммоль) этилацетата в 140 мл диэтилового эфира медленно и при температуре -78 С в атмосфере аргона добавляют 28,38 мл (66,75 ммоль) раствора диизопропиламида лития(2 н.). После перемешивания в течение 30 мин добавляют по каплям и при температуре -78 С в атмосфере аргона 12,57 г (53,91 ммоль) бензил-4-оксопиперидин-1-карбоксилата в виде раствора в 140 мл диэтилового эфира. Реакционную среду затем перемешивают при комнатной температуре в течение 2 ч. Добавляют этилацетат и среду охлаждают при использовании бани со смесью воды со льдом, затем добавляют насыщенный раствор хлорида аммония. Водную фазу отделяют, экстрагируют ее три раза этилацетатом,объединенные органические фазы промывают водным насыщенным раствором хлорида натрия, сушат их над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Остаток хроматографируют при использовании силикагеля, элюируя смесью 85/15 циклогексана и этилацетата, и получают 13,00 г чистого продукта в виде масла.(ушир. с, 2 Н); 2,40 (с, 2 Н); 1,60 (м, 4 Н); 1,20 (т, 3 Н). 20.2. Этил-(4-гидроксипиперидин-4-ил)ацетатгидробромид. К раствору 2,00 г (6,22 ммоль) бензил-4-этоксикарбонилметил-4-гидроксипиперидин-1 карбоксилата, полученного на предыдущей стадии, в 31 мл дихлорметана, охлажденному при использовании бани со смесью воды со льдом, медленно добавляют 5,46 мл (31,12 ммоль) 5,7 н. раствора бромоводорода в уксусной кислоте. Продолжают перемешивание при комнатной температуре в течение 2 ч. Добавляют 50 мл толуола и выпаривают досуха. Остаток порошкуют в диэтиловом эфире. После фильтрации через фильтр из пористого стекла получают 1,50 г продукта в виде гидробромида. 1 Н-ЯМР (ДМСО)(м.д.): 8,45 (ушир. с, 2 Н); 4,10 (кв, 2 Н); 3,40 (ушир. с, 1 Н); 3,10 (м, 4 Н); 2,40 (м,2 Н); 1,80 (м, 4 Н); 1,20 (т, 3 Н). 20.3. Этил-[4-гидрокси-1-(4-трифторметилпиримидин-2-ил)пиперидин-4-ил]ацетат. Поступают согласно методике, описанной в примере 12 (стадия 12.5). Исходя из 1,21 г (4,51 ммоль) этил(4-гидроксипиперидин-4-ил)ацетатгидробромида, полученного на предыдущей стадии, 0,90 г (4,96 ммоль) 2-хлор-4-трифторметилпиримидина и 1,65 мл (9,48 ммоль) N,N-диизопропилэтиламина, в виде раствора в 10 мл ацетонитрила, и после очистки хроматографией при использовании силикагеля, элюируя смесью 99/1/0,1 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 1,33 г ожидаемого продукта в виде воскообразного вещества. 1H-ЯМР (CDCl3)(м.д.): 8,40 (д, 1H); 6,60 (д, 2 Н); 4,45 (м, 2 Н); 4,10 (кв, 2 Н); 3,65 (ушир. с, 1 Н); 3,40-3,20 (м, 2 Н); 2,40 (с, 2 Н); 1,75 (м, 2 Н); 1,60-1,30 (м, 2 Н); 1,20 (т, 3 Н). 20.4. 4-(2-Гидроксиэтил)-1-(4-трифторметилпиримидин-2-ил)пиперидин-4-ол. К раствору 1,30 г этил-[4-гидрокси-1-(4-трифторметилпиримидин-2-ил)пиперидин-4-ил]ацетата,полученного на предыдущей стадии, в 39 мл тетрагидрофурана добавляют порциями и при температуре 10 С 0,15 г литийалюминийгидрида. Затем перемешивают при комнатной температуре в течение 1 ч. Реакционную среду охлаждают до температуры около 0 С, после чего медленно добавляют 15 мл водного раствора гидроксида натрия (1 М). Выдерживают при перемешивании при комнатной температуре в течение 30 мин, затем добавляют маленькими порциями влажный сульфат натрия. Отделяют соли путем фильтрации через целит, затем подвергают декантации. Водную фазу экстрагируют этилацетатом, объединенные органические фазы сушат над сульфатом натрия и фильтрат концентрируют при пониженном давлении. Таким образом, полученный остаток очищают хроматографией при использовании силикагеля,элюируя смесью 97/3/0,3 дихлорметана, метанола и 28%-ного раствора гидроксида аммония. Получают 0,64 г ожидаемого продукта в виде воскообразного вещества. 1(ушир. с, 1H); 2,50 (ушир. с, 1 Н); 1,80 (м, 4 Н); 1,65-1,40 (м, 2 Н). 20.5. 4,5,6,7-Тетрахлор-2-2-[4-гидрокси-1-(4-трифторметилпиримидин-2-ил)пиперидин-4 ил]этилизоиндол-1,3-дион. Поступают согласно методике, описанной в примере 1 (стадия 1.3). Исходя из 0,63 г (2,16 ммоль) 4(2-гидроксиэтил)-1-(4-трифторметилпиримидин-2-ил)пиперидин-4-ола, полученного на предыдущей стадии, 0,62 г (2,38 ммоль) трифенилфосфина, 0,69 г (2,38 ммоль) 4,5,6,7-тетрахлоризоиндол-1,3-диона и раствора 0,41 г (2,38 ммоль) диэтилазодикарбоксилата (DEAD) в 10 мл тетрагидрофурана получают 0,38 г ожидаемого продукта. 1(м, 2 Н); 1,70-1,40 (м, 4 Н). 20.6. 4-(2-Аминоэтил)-1-(4-трифторметилпиримидин-2-ил)пиперидин-4-ол. Поступают согласно методике, описанной в примере 1 (стадия 1.4). Исходя из 0,38 г (0,68 ммоль) 4,5,6,7-тетрахлор-2-2-[4-гидрокси-1-(4-трифторметилпиримидин-2-ил)пиперидин-4-ил]этилизоиндол 1,3-диона, полученного на предыдущей стадии и растворенного в смеси ацетонитрил/тетрагидрофуран/вода (2/1/1), и 0,18 г (3,06 ммоль) этилендиамина в 4,50 мл этанола, и после хроматографии при использовании силикагеля, элюируя смесью 90/10/1 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 0,15 г ожидаемого продукта в виде воскообразного вещества. 1H-ЯМР (CDCl3)(м.д.): 8,40 (д, 1 Н); 6,60 (д, 1 Н); 4,50 (м, 2 Н); 3,50-3,20 (м, 2 Н); 3,20 (м, 2 Н); 2,902,60 (ушир. с, 2 Н); 1,70 (м, 2 Н); 1,50-1,30 (м, 4 Н). 20.7. 3-Метилкарбамоилизоксазол-5-илметил-2-[4-гидрокси-1-(4-трифторметилпиримидин-2 ил)пиперидин-4-ил]этилкарбамат. Поступают согласно методике, описанной в примере 12 (стадия 12.3). Исходя из 0,13 г (0,45 ммоль) 4-(2-аминоэтил)-1-(4-трифторметилпиримидин-2-ил)пиперидин-4-ола, полученного на предыдущей стадии, 0,187 г (0,58 ммоль) 3-(метилкарбамоил)изоксазол-5-илметил-4-нитрофенилкарбоната, полученного на стадии 9.1, 200 мкл (1,12 ммоль) N,N-диизопропилэтиламина и 0,027 г (0,22 ммоль) N,Nдиметиламинопиридина, в 2,20 мл 1,2-дихлорэтана, получают 0,165 г ожидаемого продукта в виде порошка. Т.пл.: 138-140 С;(2,2'-бис-(дифенилфосфино)-1,1'-бинафтил) вводят в виде суспензии в 100 мл толуола. Затем добавляют 0,098 г (0,44 ммоль) диацетата палладия. После этого реакционную смесь кипятят с обратным холодильником в течение 6 ч. Добавляют 0,045 г (0,20 ммоль) диацетата палладия и 0,25 г (0,40 ммоль) BINAP и кипятят с обратным холодильником в течение 12 ч при перемешивании. Реакционную смесь оставляют охлаждаться и добавляют этилацетат и воду. Водную фазу отделяют, экстрагируют ее два раза этилацетатом, объединенные органические фазы промывают водным насыщенным раствором хлорида натрия и сушат над сульфатом натрия. После выпаривания растворителя полученный остаток очищают хроматографией при использовании силикагеля, элюируя смесью 98/2/0,2 дихлорметана, метанола и 28%-ного раствора гидроксида аммония и получают 1,66 г ожидаемого продукта в виде твердого вещества белого цвета. Т.пл.: 120-122 С;(м, 2 Н); 1,70 (м, 2 Н); 1,40 (с, 9 Н); 1,35 (м, 3 Н); 1,20 (м, 2 Н). 21.2. трет-Бутил-2-[1-(4'-фторбифенил-4-ил)пиперидин-4-ил]этилкарбамат. Поступают согласно методике, описанной в примере 10 (стадия 10.5). Исходя из 1,50 г (3,91 ммоль) трет-бутил-2-[1-(4-бромфенил)пиперидин-4-ил]этилкарбамата, полученного на предыдущей стадии,0,66 г (4,70 ммоль) 4-трифторфенилбороновой кислоты, 3,82 г (11,74 ммоль) карбоната цезия, в 40 мл смеси 9/1 тетрагидрофурана и воды, и 0,32 г (0,39 ммоль) PdCl2dppfCH2Cl2, и после очистки хроматографией при использовании силикагеля, элюируя смесью 98/2/0,2 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 1,23 г ожидаемого продукта в виде твердого вещества белого цвета. Т.пл.: 173-175 С;(м, 2 Н); 2,95 (м, 2 Н); 2,70 (м, 2 Н); 1,70 (м, 2 Н); 1,40 (с, 9 Н); 1,35 (м, 3 Н); 1,20 (м, 2 Н). 21.3. 2-[1-(4'-Фторбифенил-4-ил)пиперидин-4-ил]этиламин. Поступают согласно методике, описанной в примере 14 (стадия 14.3). Исходя из 1,10 г (2,76 ммоль) трет-бутил-2-[1-(4'-фторбифенил-4-ил)пиперидин-4-илэтилкарбамата, полученного на предыдущей стадии, 2,11 мл (25,09 ммоль) трифторуксусной кислоты, в 20 мл дихлорметана, и после подщелачивания путем обработки с помощью 35%-ного раствора гидроксида натрия, экстракции дихлорметаном, высушивании над сульфатом натрия и выпаривания досуха, получают 0,74 г ожидаемого продукта в виде аморфного твердого вещества оранжевого цвета.H-ЯМР (ДМСО)(м.д.): 7,60 (м, 2 Н); 7,50 (д, 2 Н); 7,25 (м, 2 Н); 7,00 (д, 2 Н); 3,75 (м, 2 Н); 2,85 (м,2 Н); 2,75 (м, 2 Н); 1,70 (м, 2 Н); 1,50 (м, 1 Н); 1,35 (м, 2 Н); 1,25 (м, 2 Н). 21.4. 3-Метилкарбамоилизоксазол-5-илметил-2-[1-(4'-фторбифенил-4-ил)пиперидин-4 ил]этилкарбамат. Поступают согласно методике, описанной в примере 12 (стадия 12.3). Исходя из 0,27 г (0,90 ммоль) 2-[1-(4'-фторбифенил-4-ил)пиперидин-4-ил]этиламина, полученного на предыдущей стадии, 0,29 г (0,90 ммоль) 3-(метилкарбамоил)изоксазол-5-илметил-4-нитрофенилкарбоната, полученного на стадии 9.1, 320 мкл (1,81 ммоль) N,N-диизопропилэтиламина, в 10 мл 1,2-дихлорэтана, и после порошкования в диэтиловом эфире, получают 0,26 г ожидаемого продукта в виде порошка белого цвета. Т.пл.: 212-215 С;(+/-)-1-Вос-3-(аминометил)пирролидина (коммерчески доступный), 3,52 г (10,98 ммоль) 3(метилкарбамоил)изоксазол-5-илметил-4-нитрофенилкарбоната, полученного на стадии 9.2, 2,61 мл(14,98 ммоль) N,N-диизопропилэтиламина и 0,61 г (4,99 ммоль) диметиламинопиридина в 100 мл 1,2 дихлорэтана, и после очистки хроматографией при использовании силикагеля, элюируя смесью от 100/0/0 до 98/2/0,2 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 1,32 г ожидаемого продукта в виде воскообразного вещества.H-ЯМР (ДМСО)(м.д.): 8,70 (с ушир., 1 Н); 7,00 (с ушир., 1 Н); 6,80 (с, 1 Н); 5,25 (с, 2 Н); 3,40 (м,3 Н); 3,00 (м, 3 Н); 2,80 (с, 3 Н); 2,20 (м, 1 Н); 1,90 (м, 1 Н); 1,60 (м, 1 Н); 1,40 (с, 9 Н). 22.2. (+/-)-3-Метилкарбамоилизоксазол-5-илметилпирролидин-3-илметилкарбаматгидрохлорид. Поступают согласно методике, описанной в примере 11 (стадия 11.2). Исходя из 1,30 г (3,40 ммоль) трет-бутил-3-[(3-метилкарбамоилизоксазол-5-илметоксикарбониламино)метил]пирролидин-1-карбоксилата, 4,25 мл 4 н. раствора хлороводорода в диоксане, и после порошкования в диэтиловом эфире получают 0,82 г порошка белого цвета. Т.пл.: 187-189 С;(+/-)-3-Метилкарбамоилизоксазол-5-илметил-[1-(4-хлорфталазин-1-ил)пирролидин-3 илметил]карбамат. Поступают согласно методике, описанной в примере 12 (стадия 12.5). Исходя из 0,19 г (0,60 ммоль) 3-метилкарбамоил-1-изоксазол-5-илметилпирролидин-3-илметилкарбаматгидрохлорида, 0,17 г (0,89 ммоль) 1,4-дихлорфталазина и 0,21 мл (0,15 ммоль) N,N-диизопропилэтиламина (15 мин, 150 С), и после очистки хроматографией при использовании силикагеля, элюируя смесью от 100/0/0 до 98/2/0,2 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 0,09 г ожидаемого продукта в виде порошка белого цвета. Т.пл.: 159-161 С;LC-MS: М+Н=445; 1 Н-ЯМР (ДМСО)(м.д.): 8,80 (м, 1 Н); 8,40 (м, 1 Н); 8,15 (м, 1 Н); 8,05 (м, 2 Н); 7,80 (м, 1 Н); 6,80 (с,1 Н); 5,25 (с, 2 Н); 3,65 (м, 1 Н); 3,50 (м, 2 Н); 3,30 (м, 1 Н); 3,20 (м, 2 Н); 2,80 (м, 4 Н); 2,05 (м, 1 Н); 1,70 (м,1 Н). Пример 23 (соединение 82). 3-Карбамоилизоксазол-5-илметил-2-[1-(4-трифторметилпиримидин-2-ил)азетидин-3-ил]этилкарбамат. 23.1. трет-Бутил-2-[1-(4-трифторметилпиримидин-2-ил)азетидин-3-ил]этилкарбамат. Поступают согласно методике, описанной в примере 14 (стадия 14.4). Исходя из 3,00 г (12,57 ммоль) трет-бутил-(2-азетидин-3-илэтил)карбамата (коммерчески доступный), 3,00 г (16,47 ммоль) 2 хлор-4-трифторметилпиримидина и 7,73 мл (44,35 ммоль), после очистки хроматографией при использовании силикагеля, элюируя смесью от 100/0/0 до 98/2/0,2 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 4,00 г продукта в виде порошка оранжевого цвета. Т.пл.: 95-97 С. 23.2. 2-[2-(4-Трифторметилпиримидин-2-ил)азетидин-3-ил]этиламин. Поступают согласно методике, описанной в примере 11 (стадия 11.2). Исходя из 3,67 г (10,60 ммоль) трет-бутил-2-[1-(4-трифторметилпиримидин-2-ил)азетидин-3-ил]этилкарбамата и 10,60 мл(42,38 ммоль) 4 н. раствора хлороводорода в диоксане, после очистки хроматографией при использовании силикагеля, элюируя смесью от 100/0/0 до 90/10/1 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 1,75 г ожидаемого продукта в виде масла желтого цвета.(3,05 ммоль) диизопропилэтиламина и 0,07 г (0,61 ммоль) диметиламинопиридина, после очистки хроматографией при использовании силикагеля, элюируя смесью от 100/0/0 до 98/2/0,2 дихлорметана, метанола и 28%-ного раствора гидроксида аммония, получают 0,41 г продукта в виде порошка белого цвета. Т.пл.: 163-165 С;(+/-)-3-Метилкарбамоилизоксазол-5-илметил-[1-(4-хлорпиримидин-2-ил)пирролидин-3 илметил]карбамата разделяют путем хиральной препаративной хроматографии ВЭЖХ (Chiralpak AD, 20 мкм, 50220 мм), элюируя смесью пропанол/н-гептан в пропорциях 25/75, с получением 0,070 г продукта, находящегося в форме основания.(+/-)-3-Метилкарбамоилизоксазол-5-илметил-[1-(4-хлорпиримидин-2-ил)пирролидин-3 илметил]карбамата разделяют путем хиральной препаративной хроматографии ВЭЖХ (Chiralpak AD, 20 мкм, 50220 мм), элюируя смесью пропанол/н-гептан в пропорциях 25/75, с получением 0,090 г продукта, находящегося в форме основания.H-ЯМР (ДМСО)(м.д.): 8,70 (с ушир., 1 Н); 3,60 (с ушир., 1 Н); 8,05 (м, 1 Н); 7,00 (м, 1 Н); 6,80 (с,1 Н); 5,25 (с, 2 Н); 3,45 (м, 2 Н); 3,30 (м, 3 Н); 3,10 (м, 1 Н); 2,80 (м, 3 Н); 2,50 (м, 1 Н); 2,00 (м, 1 Н); 1,70 (м,1 Н). В нижеследующей табл. 1 представлены химические структуры и физические свойства некоторых соединений согласно изобретению. В табл. 1 все соединения находятся в форме основания; в колонке "Т.пл.(С)" указываются температуры плавления в градусах Цельсия (С); термин "Вращение" (Rot.") показывает левовращающее или правовращающее свойство соединения; пунктирная связь означает связь, соединяющую заместитель с остальной частью молекулы. Таблица 1
МПК / Метки
МПК: A61K 31/445, C07D 403/14, A61P 25/00, C07D 413/12, C07D 407/14, A61K 31/497, A61K 31/4709, C07D 413/14, C07D 417/14, A61K 31/506, C07D 401/14, A61K 31/502, A61P 29/00, A61K 31/498, A61K 31/501
Метки: алкилгетероциклов, производные, терапии, получение, карбаматные, применение
Код ссылки
<a href="https://eas.patents.su/30-19742-karbamatnye-proizvodnye-alkilgeterociklov-ih-poluchenie-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Карбаматные производные алкилгетероциклов, их получение и их применение в терапии</a>
Предыдущий патент: Пиррольные соединения
Следующий патент: Тумблерное выдачное укупорочное устройство с шарнирным задним краем
Случайный патент: 2-(замещенный амино)бензоксазолсульфонамидные ингибиторы вич-протеазы широкого спектра












