Пиррольные соединения
Номер патента: 19741
Опубликовано: 30.05.2014
Авторы: Фудзимори Икуо, Арикава Ясуеси, Нисида Харуюки
Формула / Реферат
1. Соединение, представленное формулой (I)
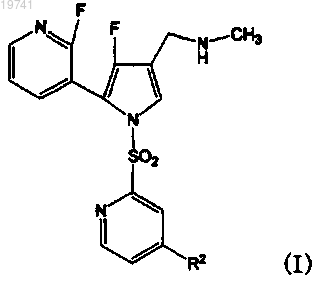
в которой R2 представляет собой С1-6алкильную группу или С1-6алкоксигруппу, или его фармацевтически приемлемая соль.
2. 1-{4-Фтор-5-(2-фторпиридин-3-ил)-1-[(4-метилпиридин-2-ил)сульфонил]-1Н-пиррол-3-ил}-N-метилметанамин или его фармацевтически приемлемая соль.
3. 1-{4-Фтор-5-(2-фторпиридин-3-ил)-1-[(4-метоксипиридин-2-ил)сульфонил]-1Н-пиррол-3-ил}-N-метилметанамин или его фармацевтически приемлемая соль.
4. Фармацевтическая композиция, содержащая соединение по п.1 или его фармацевтически приемлемую соль, причем композиция представляет собой средство для профилактики или лечения пептической язвы, синдрома Золлингера-Эллисона, гастрита, рефлюкс-эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматическая ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка или язвы, вызванной нестероидным противовоспалительным лекарственным средством, повышенной кислотности или язвы вследствие послеоперационного стресса; или ингибитора кровотечения из верхних отделов желудочно-кишечного тракта вследствие пептической язвы, острой стрессовой язвы, геморрагического гастрита или инвазивного стресса.
5. Способ лечения или предотвращения пептической язвы, синдрома Золлингера-Эллисона, гастрита, рефлюкс-эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматическая ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка или язвы, вызванной нестероидным противовоспалительным лекарственным средством, повышенной кислотности или язвы вследствие послеоперационного стресса или способ ингибирования кровотечения из верхних отделов желудочно-кишечного тракта вследствие пептической язвы, острой стрессовой язвы, геморрагического гастрита или инвазивного стресса, который включает введение млекопитающему эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
6. Применение соединения по п.1 или его фармацевтически приемлемой соли для получения средства для профилактики или лечения пептической язвы, синдрома Золлингера-Эллисона, гастрита, рефлюкс-эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматическая ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка или язвы, вызванной нестероидным противовоспалительным лекарственным средством, повышенной кислотности или язвы вследствие послеоперационного стресса или ингибитора кровотечения из верхних отделов желудочно-кишечного тракта вследствие пептической язвы, острой стрессовой язвы, геморрагического гастрита или инвазивного стресса.
Текст
в которой R2 представляет собой С 1-6 алкильную группу или C1-6 алкоксигруппу, или его фармацевтически приемлемой соли, которое обладает неожиданно мощным эффектом ингибирования протонной помпы и полностью подходит в качестве лекарственного средства. Также изобретение относится к содержащей его фармацевтической композиции и применению соединения (I) или его фармацевтически приемлемой соли для получения средства для профилактики или лечения пептической язвы, синдрома Золлингера-Эллисона, гастрита, рефлюксэзофагита и других заболеваний.(71)(73) Заявитель и патентовладелец: ТАКЕДА ФАРМАСЬЮТИКАЛ КОМПАНИ ЛИМИТЕД (JP) Область техники, к которой относится изобретение Настоящее изобретение относится к пиррольным соединениям, обладающим супрессивным действием на секрецию кислоты. Предпосылки создания изобретения В клинической практике широко используются ингибиторы протонной помпы, представленные омепразолом, которые подавляют секрецию кислоты желудочного сока для лечения пептической язвы,рефлюкс-эзофагита и т.п. Однако применение существующих ингибиторов протонной помпы ассоциировано с проблемами в плане эффективности и побочных эффектов. Для конкретики, поскольку существующие ингибиторы протонной помпы нестабильны в кислых условиях, их часто приготавливают в виде кишечно-растворимых препаратов и в этом случае требуется несколько часов до начала действия и приблизительно 5 суток до проявления максимальной эффективности при последовательном введении. Кроме того, поскольку существующие ингибиторы протонной помпы проявляют непостоянные эффекты лечения вследствие полиморфизма метаболических ферментов и взаимодействия с лекарственными средствами, такими как диазепам и т.п., желательно их усовершенствование. В качестве пиррольных соединений, обладающих ингибирующим действием в отношении протонной помпы, в ссылке на патент 1 описано соединение, представленное формулой в которой X и Y являются одинаковыми или разными и каждый представляет собой связь или спейсер, содержащий 1-20 атомов в основной цепи;r1 представляет собой необязательно замещенную углеводородную группу или необязательно замещенную гетероциклическую группу;r2, r3 и r4 являются одинаковыми или разными и каждый представляет собой атом водорода, необязательно замещенную углеводородную группу, необязательно замещенную тиенильную группу, необязательно замещенную бензо[b]тиенильную группу, необязательно замещенную фурильную группу, необязательно замещенную пиридильную группу, необязательно замещенную пиразолильную группу, необязательно замещенную пиримидильную группу, ацильную группу, атом галогена, цианогруппу или нитрогруппу; иr5 и r6 являются одинаковыми или разными и каждый представляет собой атом водорода или необязательно замещенную углеводородную группу. Кроме того, в качестве пиррольного соединения, обладающего ингибирующим действием в отношении протонной помпы, в ссылке на патент 2 описано соединение, представленное формулой в которой r7 представляет собой моноциклическую азотсодержащую гетероциклическую группу,необязательно конденсированную с бензольным кольцом или гетероциклом, моноциклическую азотсодержащую гетероциклическую группу, необязательно конденсированную с бензольным кольцом или гетероциклом, необязательно содержащим заместитель(и);r8 представляет собой необязательно замещенную С 6-14 арильную группу, необязательно замещенную тиенильную группу или необязательно замещенную пиридильную группу;r9 и r10 являются одинаковыми или разными и каждый представляет собой атом водорода или один 9 из r и r10 представляет собой атом водорода, а другой представляет собой необязательно замещенную низшую алкильную группу, ацильную группу, атом галогена, цианогруппу или нитрогруппу;r11 представляет собой алкильную группу и т.п. Кроме того, в качестве терапевтического лекарственного средства при неопластических заболеваниях или аутоиммунных заболеваниях в ссылке на патент 3 описано соединение, представленное формулойr9 представляет собой арил, гетероарил, необязательно замещенный аминометил и т.п. Список ссылок. Патентная литература: ссылка на патент 1: WO 2006/036024; ссылка на патент 2: WO 2007/026916; ссылка на патент 3: WO 2004/103968. Краткое описание сущности изобретения Задачи, подлежащие решению настоящим изобретением Предполагается, что лекарственное средство, которое эффективно подавляет секрецию кислоты желудочного сока как и известные ингибиторы протонной помпы, но с улучшенными показателями в плане стабильности в кислых условиях, разброса эффектов вследствие полиморфизма метаболических ферментов и взаимодействия с лекарственными средствами, что является недостатками известных ингибиторов протонной помпы, должно проявлять лучший эффект при лечении пептической язвы, рефлюкс-эзофагита и т.п. Однако дела обстоят так, что ингибитор протонной помпы, в должной мере удовлетворяющий указанным требованиям, найден не был. Поэтому целью настоящего изобретения является предоставление соединения, обладающего лучшим эффектом подавления секреции кислоты желудочного сока (в частности, эффектом ингибирования протонной помпы), который был улучшен в плане указанных проблем. Средства решения задач Авторы настоящего изобретения провели различные исследования и неожиданно обнаружили, что соединение, представленное формулой (I) в которой R2 представляет собой С 1-6 алкильную группу или C1-6 алкоксигруппу либо его фармацевтически приемлемую соль [здесь и далее в тексте иногда обозначаемые как соединение (I)] обладают неожиданно мощным эффектом ингибирования протонной помпы и полностью подходят в качестве лекарственного средства, что привело к созданию настоящего изобретения. Также настоящее изобретение относится к 1-4-фтор-5-(2-фторпиридин-3-ил)-1-[(4-метилпиридин 2-ил)сульфонил]-1 Н-пиррол-3-ил-N-метилметанамину или его фармацевтически приемлемой соли; 14-фтор-5-(2-фторпиридин-3-ил)-1-[(4-метоксипиридин-2-ил)сульфонил]-1 Н-пиррол-3-ил-Nметилметанамину или его фармацевтически приемлемой соли. Более того, настоящее изобретение относится к фармацевтической композиции, содержащей соединение (I) или его фармацевтически приемлемой соли, которая представляет собой средство для профилактики или лечения пептической язвы, синдрома Золлингера-Эллисона, гастрита, рефлюкс-эзофагита,симптоматической гастроэзофагеальной рефлюксной болезни (симптоматическая ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка или язвы, вызванной нестероидным противовоспалительным лекарственным средством, повышенной кислотности или язвы вследствие послеоперационного стресса; или ингибитор кровотечения из верхних отделов желудочнокишечного тракта вследствие пептической язвы, острой стрессовой язвы, геморрагического гастрита или инвазивного стресса. Настоящее изобретение также относится к способу лечения или профилактики пептической язвы,синдрома Золлингера-Эллисона, гастрита, рефлюкс-эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматическая ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка или язвы, вызванной нестероидным противовоспалительным лекарственным средством, повышенной кислотности или язвы вследствие послеоперационного стресса; или способ ингибирования кровотечения из верхних отделов желудочно-кишечного тракта вследствие пептической язвы, острой стрессовой язвы, геморрагического гастрита или инвазивного стресса, который включает введение млекопитающему эффективного количества соединения упомянутому выше или его фармацевтически приемлемой соли. Кроме того, настоящее изобретение обеспечивает применение соединения (I) или его фармацевтически приемлемой соли для получения средства для профилактики или лечения пептической язвы, синдрома Золлингера-Эллисона, гастрита, рефлюкс-эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматическая ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка или язвы, вызванной нестероидным противовоспалительным лекарственным средством, повышенной кислотности или язвы вследствие послеоперационного стресса; или ингибитора кровотечения из верхних отделов желудочно-кишечного тракта вследствие пептической язвы, острой стрессовой язвы, геморрагического гастрита или инвазивного стресса. Эффект изобретения. Соединение (I) по настоящему изобретению проявляет лучший эффект ингибирования протонной помпы. Традиционные ингибиторы протонной помпы, такие как омепразол, лансопразол и т.п., преобразуются в активные формы в кислой среде париетальных клеток желудка и образуют ковалентную связь с цистеиновым остатком Н+/K+-АТФазы и необратимо ингибируют активность фермента. В отличие от них соединение (I) ингибирует активность протонной помпы (Н+/K+-АТФазы) обратимым и конкурентным по отношению к K+ способом и, следовательно, подавляет секрецию кислоты. Поэтому его иногда называют калий-конкурентным блокатором кислоты (Р-САВ) или антагонистом кислотной помпы (АРА). Соединение (I) быстро оказывает действие и проявляет максимальную эффективность после первоначального приема. Кроме того, его метаболизм в меньшей мере зависит от метаболического полиморфизма, а разброс эффективности среди пациентов невелик. Кроме того, было обнаружено, что соединение (I) сконструировано так, что имеет характеристическую химическую структуру, которая способствует высокой ингибирующей активности в отношении протонной помпы и существенно снижает цитотоксичность. Кроме того, оно характеризуется тем, что замещение по 4-положению пиррольного кольца соединения(I) атомом фтора снижает основность (величину pKa) метиламинометильного фрагмента вследствие электроноакцепторного эффекта атома фтора и снижает риск проявления токсичности, проистекающей из сильной основности и что введение по меньшей мере одного заместителя в пиридильную группу соединения (I) оптимально регулирует продолжительность действия. Таким образом, данное изобретение может предоставить клинически применимое средство для профилактики или лечения пептической язвы(например, язвы желудка, язвы двенадцатиперстной кишки, анастомотической язвы, язвы, вызванной нестероидным противовоспалительным лекарственным средством, язвы вследствие послеоперационного стресса и т.д.), синдрома Золлингера-Эллисона, гастрита, эрозивного эзофагита, рефлюкс-эзофагита,симптоматической гастроэзофагеальной рефлюксной болезни (симптоматическая ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка или повышенной кислотности; или средство подавления кровотечения из верхних отделов желудочно-кишечного тракта вследствие пептической язвы, острой стрессовой язвы, геморрагического гастрита или инвазивного стресса и т.п. Поскольку соединение (I) характеризуется низкой токсичностью и лучшей растворимостью в воде, кинетикой in vivo и эффективностью, оно является полезным фармацевтическим препаратом. Поскольку соединение (I) стабильно даже в кислых условиях, оно может вводиться перорально в виде классической таблетки и т.п., без включения его в состав кишечно-растворимого препарата. Полезным следствием этого является то, что препарат (таблетка и т.п.) может быть сделан меньшего размера и может легко проглатываться пациентами с нарушениями глотания, особенно пожилыми людьми и детьми. Кроме этого,поскольку он лишен эффекта замедленного высвобождения, обеспечиваемого кишечно-растворимыми препаратами, начало подавления секреции кислоты желудочного сока происходит быстро и симптомы,такие как боль и т.п., могут быть быстро частично сняты. Краткое описание чертежей На фиг. 1 представлены результаты измерения рН перфузата в реперфузионной модели анестезированного желудка крысы при тестировании соединения примера 1; на фиг. 2 представлены результаты измерения рН перфузата в реперфузионной модели анестезированного желудка крысы при тестировании соединения примера 5. Из соединений (I) следующие соединения являются предпочтительными: 1-4-фтор-5-(2 фторпиридин-3-ил)-1-[(4-метилпиридин-2-ил)сульфонил]-1 Н-пиррол-3-ил-N-метилметанамин или его фармацевтически приемлемая соль,1-4-фтор-5-(2-фторпиридин-3-ил)-1-[(4-метоксипиридин-2 ил)сульфонил]-1 Н-пиррол-3-ил-N-метилметанамин или его фармацевтически приемлемая соль. Примеры соли соединения (I) включают соль металла, аммониевую соль, соли органических оснований, соли неорганических оснований, соли органических кислот, соли основных или кислых аминокислот и т.п. Предпочтительные примеры соли металла включают соли щелочного металла, такие как натриевая соль, калиевая соль и т.п.; соли щелочно-земельного металла, такие как кальциевая соль, магниевая соль, бариевая соль и т.п.; соль алюминия и т.п. Предпочтительные примеры соли органического основания включают соль триметиламина, триэтиламина, пиридина, пиколина, 2,6-лутидина, этаноламина, диэтаноламина, триэтаноламина, циклогексиламина, дициклогексиламина, N,N'-дибензилэтилендиамина и т.п. Предпочтительные примеры соли неорганической кислоты включают соль соляной кислоты, бромисто-водородной кислоты, азотной кислоты, серной кислоты, фосфорной кислоты и т.п. Предпочтительные примеры соли органической кислоты включают соль муравьиной кислоты, уксусной кислоты, трифторуксусной кислоты, фталевой кислоты, фумаровой кислоты, щавелевой кислоты, винной кислоты, малеиновой кислоты, лимонной кислоты, янтарной кислоты, яблочной кислоты, метансульфоновой кислоты, бензолсульфоновой кислоты, пара-толуолсульфоновой кислоты и т.п. Предпочтительные примеры соли основной аминокислоты включают соль аргинина, лизина, орнитина и т.п. Предпочтительные примеры соли кислой аминокислоты включают соль аспарагиновой кислоты, глутаминовой кислоты и т.п. Среди них предпочтительными являются фармацевтически приемлемые соли. Например,если соединение содержит кислую функциональную группу, то могут быть упомянуты неорганические соли, такие как соль щелочного металла (например, натриевая соль, калиевая соль и т.д.), соль щелочноземельного металла (например, кальциевая соль, магниевая соль, бариевая соль и т.д.) и т.п., аммониевая соль и т.п.; и если соединение содержит основную функциональную группу, то могут быть упомянуты,например, соли неорганической кислоты, такой как соляная кислота, бромисто-водородная кислота,азотная кислота, серная кислота, фосфорная кислота и т.п., или соли органической кислоты, такой как уксусная кислота, фталевая кислота, фумаровая кислота, щавелевая кислота, винная кислота, малеиновая кислота, лимонная кислота, янтарная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и т.п. Способы получения соединения (I) разъяснены в настоящем изобретении. Соединения формул (II)(XXXIII) могут образовывать соли и в качестве таких солей могут быть упомянуты, например, соли, аналогичные солям соединения (I). Хотя соединения, полученные на соответствующих стадиях, могут быть использованы в последующей реакции в форме реакционной смеси или неочищенного продукта, они также могут быть легко выделены из реакционной смеси и очищены посредством известных способов выделения и очистки, таких как перекристаллизация, дистилляция, хроматография и т.п. Соединение (II), в котором R8 представляет собой C1-4 алкильную группу, такую как метил, этил,пропил, изопропил, бутил и т.п., может быть получено способом, известным per se, таким как способ,описанный в Chem. Pharm. Bull., vol. 49, p. 1406 (2001), Tetrahedron Letters, vol. 35, p. 5989 (1994) и т.п.,или аналогичным ему способом. Соединение (III), значение каждого символа в котором определено выше, может быть получено путем фторирования соединения (II) фторирующим реагентом, таким как соль N-фторпиридиния, дифторид ксенона и т.п. Подлежащее использованию количество фторирующего реагента составляет 0,75-10 экв.,предпочтительно 1-5 экв., относительно соединения (II). Указанную реакцию предпочтительно проводят с использованием растворителя, инертного в реакции. Хотя при условии протекания реакции растворитель конкретно не ограничен, предпочтительными являются углеводороды, такие как бензол, толуол и т.п., тетрагидрофуран, диэтиловый эфир, ацетонитрил и т.п., или смешанный из них растворитель и т.п. Хотя продолжительность реакции варьирует в зависимости от подлежащих использованию реагентов и растворителя, она, как правило, составляет от 10 мин до 24 ч, предпочтительно от 30 мин до 12 ч. Температура реакции, как правило, составляет от -78 до 100 С, предпочтительно от -20 до 60 С. Кроме того,введение группы фтора возможно в ступенчатых реакциях, например бромирование Nбромсукцинимидом (NBS), и т.п. с последующим преобразованием до группы фтора в реакции замещения. Соединение (IV) может быть получено путем восстановления соединения (III) восстановителем, таким как алюмогидрид лития, диизобутилалюминий гидрид, боргидрид натрия, боргидрид кальция и т.п. В качестве восстановителя особенно предпочтительным является диизобутилалюминий гидрид. Подлежащее использованию количество восстановителя составляет 0,75-10 экв., предпочтительно 1-5 экв., относительно соединения (III). Указанную реакцию предпочтительно проводят с использованием растворителя, инертного в реакции. Хотя растворитель конкретно не ограничен при условии протекания реакции, предпочтительными являются такие растворители, как углеводороды, такие как бензол, толуол и т.п., эфиры, такие как тетрагидрофуран, диэтиловый эфир и т.п., и смешанный из них растворитель и т.п. Хотя продолжительность реакции варьирует в зависимости от подлежащих использованию реагентов и растворителей, она, как правило, составляет от 10 мин до 24 ч, предпочтительно от 30 мин до 8 ч. Температура реакции, как правило, составляет от -78 до 100 С, предпочтительно от -78 до 25 С. Соединение (V) может быть получено путем осуществления взаимодействия соединения (IV) с окислителем, таким как комплекс хромовой кислоты/пиридина, пиридиний хлорхромат, диоксид марган-4 019741 ца, комплекс триоксида серы/пиридина, тетра-н-пропиламмоний перрутенат и т.п. В качестве окислителя предпочтительным является диоксид марганца, комплекс триоксида серы/пиридина или тетра-нпропиламмоний перрутенат. Указанная реакция окисления может проводиться, например, в соответствии со способом, описанным в Synthesis, p. 639 (1994). Соединение (VII) может быть получено путем осуществления взаимодействия соединения (V) с соединением, представленным формулой (VI) в которой X представляет собой атом галогена, такой как атом фтора, атом хлора и т.п., а значение другого символа определено выше. Подлежащее использованию количество соединения (VI) составляет 0,75-10 моль, предпочтительно 1-3 моль, на 1 моль соединения (V). Указанную реакцию предпочтительно проводят с использованием растворителя, инертного в реакции. Хотя растворитель конкретно не ограничен при условии протекания реакции, предпочтительными являются углеводороды, такие как бензол, толуол и т.п., эфиры, такие как тетрагидрофуран и т.п., амиды,такие как N,N-диметилформамид, N,N-диметилацетамид и т.п., ацетонитрил и т.п. или смешанный из них растворитель и т.п. В реакции эффективно использование основания. В качестве основания могут быть упомянуты, например, неорганические основания, такие как гидрид натрия, гидроксид натрия, гидроксид калия и т.п.,основные соли, такие как карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия и т.п.,алкоксиды металлов, такие как этоксид калия, трет-бутоксид калия, метоксид натрия, этоксид натрия и т.п., ароматические амины, такие как пиридин, лутидин и т.п., третичные амины, такие как триэтиламин,трипропиламин,трибутиламин,циклогексилдиметиламин,4-диметиламинопиридин,N,Nдиметиланилин, N-метилпиперидин, N-метилпирролидин, N-метилморфолин и т.п. Подлежащее использованию количество основания составляет от 0,8 до 10 моль, предпочтительно от 1 до 5 моль на 1 моль соединения (V). Указанная реакция может также проводиться и предпочтительно проводится в присутствии краун-эфира. В качестве краун-эфира могут быть упомянуты, например, 15-краун-5-эфир, 18-краун 6-эфир и т.п. Подлежащее использованию количество краун-эфира составляет от 0,01 до 10 моль, предпочтительно 1-5 моль, на 1 моль соединения (V). Хотя продолжительность реакции варьирует в зависимости от подлежащих использованию реагентов и растворителя, она, как правило, составляет от 1 мин до 48 ч, предпочтительно от 10 мин до 8 ч. Температура реакции, как правило, составляет от -20 до 100 С,предпочтительно от 0 до 50 С. Соединение (I), значение каждого символа в котором определено выше, может быть получено с использованием соединения (VII) и метиламина или его соли, в реакции восстановительного аминирования, по аналогии со способом, описанным в работе Jikken Kagaku Koza (Courses in ExperimentalChemistry), vol. 14-III, p. 1380-1385 (опубликованной MARUZEN CO., LTD.), и т.п. Кроме того, соединение (II) может быть также получено в соответствии со следующим способом и соединение (I) может быть получено с использованием способа, аналогичного описанному выше способу. Соединение (VIII), значение каждого символа в котором определено выше, может быть получено способом, известным per se, например способами, описанными в Tetrahedron Letters, vol. 13, p. 5337(1972), Heterocycles, vol. 7, p. 77 (1977), Chem. Pharm. Bull., vol. 27, p. 2857 (1979), J. Org. Chem., vol. 62,p. 2649 (1997) и т.п., или аналогичным им способом. Соединение (IX), значение каждого символа в котором определено выше, может быть получено путем осуществления взаимодействия соединения (VIII) с N-бромсукцинимидом (NBS). NБромсукцинимид (NBS) предпочтительно используют в количестве 1 экв. относительно соединения(VIII), а реакцию предпочтительно проводят в атмосфере инертного газа, такого как азот, аргон и т.п. Указанную реакцию предпочтительно проводят с использованием растворителя, инертного в реакции. Хотя растворитель конкретно не ограничен при условии протекания реакции, предпочтительными являются такие растворители, как эфиры (например, тетрагидрофуран, диэтиловый эфир и т.п.), амиды(например, N,N-диметилформамид, N,N-диметилацетамид и т.п.) и т.п., смешанный из них растворитель и т.п. Хотя продолжительность реакции варьирует в зависимости от подлежащих использованию реагентов и растворителя, она, как правило, составляет от 10 мин до 24 ч, предпочтительно от 5 до 12 ч. Температура реакции, как правило, составляет от -78 до 80 С, предпочтительно от -78 до 30 С. В некоторых случаях в реакции эффективно использование основания. Хотя подлежащее использованию основание конкретно не ограничено при условии протекания реакции, могут быть упомянуты такие органические основания, как пиридин, пиколин, лутидин и т.п. Подлежащее использованию количество органического основания составляет от 0,001 до 10 экв., предпочтительно от 0,001 до 0,1 экв., относительно соединения (VIII). Соединение (X), в котором R9 представляет собой пирролзащитную группу, а значение других символов определено выше, может быть получено путем защиты атома азота в пирроле соединения (IX). Пирролзащитная группа конкретно не ограничена, и ее примеры включают трет-бутоксикарбонильную группу (ВОС-группа), бензилоксикарбонильную группу (Cbz-группа) и арилсульфонильную или гетероарилсульфонильную группу, бензильную группу, триизопропилсилильную группу и т.п. Указанная реакция введения защитной группы может проводиться в соответствии со способом, известным per se, например способом, аналогичным описанному в Protective Groups in Organic Synthesis, 3rdEd., Theodora W. Greene, Peter G.M. Wuts, p. 494-653, Wiley-Interscience (1999) и т.п. Соединение (XII), значение каждого символа в котором определено выше, может быть получено путем осуществления взаимодействия соединения (X) с соединением, представленным формулой (XIa) значение каждого символа в которой определено выше, или с различными сложноэфирными производными формулы (XIa) в соответствии со способом, описанным в Synthetic Communications, vol. 11,page 513 (1981), или аналогичным ему способом. Кроме того, оно может быть получено путем осуществления взаимодействия соединения (X) с соединением, представленным формулой (XIb) в которой R представляет собой алкильную группу или арильную группу, в соответствии со способом, описанным в Synthesis, vol. 7, p. 564-565 (1986), или аналогичным ему способом. Примеры "алкильной группы" для -R включают метильную группу и н-бутильную группу, а примеры "арильной группы" включают фенильную группу. Соединение (II), значение каждого символа в котором определено выше, может быть получено из соединения (IX) в соответствии со способом, аналогичным описанному для получения соединения (XII) из соединения (X). В качестве альтернативы соединение (II) может быть получено из соединения (XII) способом, известным per se, например способом, описанным в Protective Groups in Organic Synthesis, 3rdEd., Theodora W. Greene, Peter G. M. Wuts, p. 494-653, Wiley-Interscience (1999) и т.п., путем удаления с пиррола азотзащитной группы. Кроме того, соединение (I) может быть также получено в соответствии со следующим способом: Соединение (XIII), значение каждого символа в котором определено выше, может быть получено из соединения (III) в соответствии со способом, аналогичным описанному для получения соединения (VII) из соединения (V). Соединение (XIV), значение каждого символа в котором определено выше, может быть получено из соединения (XIII) в соответствии со способом, аналогичным описанному для получения соединения (IV) из соединения (III). Соединение (VII), значение каждого символа в котором определено выше, может быть получено из соединения (XIV) в соответствии со способом, аналогичным описанному для получения соединения (V) из соединения (IV). Соединение (I) может быть получено из соединения (VII) способом, сходным с описанным выше способом. В качестве альтернативы соединение (I) может быть также получено из соединения (XIV) в соответствии со способом, включая осуществление взаимодействия с метиламином посредством галогенирования или метансульфонилирования, причем способ включает конденсирование с метиламином,-6 019741 защищенным Boc и т.п., с последующим снятием защитной группы и т.п. Кроме того, соединение (I) может быть также получено в соответствии со следующим способом: Соединение (XV), определенное выше, может быть получено из соединения (V) в соответствии со способом, аналогичным описанному для получения соединения (I) из соединения (VII). Соединение (XVI), в котором R10 представляет собой аминозащитную группу, может быть получено путем защиты аминогруппы соединения (XV). Примеры аминозащитной группы включают без конкретного ограничения трет-бутоксикарбонильную группу (ВОС-группа), бензилоксикарбонильную группу (Cbz-группа), 2,4-диметоксибензильную группу и т.п. Указанная реакция введения защитной группы может проводиться в соответствии со способом, известным per se, например способом, описанным в Protective Groups in Organic Synthesis, 3rd Ed., Theodora W. Greene, Peter G.M. Wuts, p. 494-653, WileyInterscience (1999) и т.п. Соединение (XVII), значение каждого символа в котором определено выше, может быть получено из соединения (XVI) в соответствии со способом, аналогичным описанному для получения соединения(VII) из соединения (V). Соединение (I) может быть получено путем удаления аминозащитной группы с соединения (XVII) способом, известным per se, например способом, описанным в Protective Groups in Organic Synthesis, 3rdEd., Theodora W. Greene, Peter G.M. Wuts, p. 494-653, Wiley-Interscience (1999) и т.п. Соединение (V) также может быть получено следующим способом. Кроме того, соединение (I) может быть получено с использованием способа, аналогичного описанному выше способу. Соединение (XVIII) может быть получено способом, известным per se, например способом, описанным в Journal of Organic Chemistry (J. Org. Chem.), vol. 55, p. 6317 (1990) и т.п., или аналогичным ему способом. Соединение (XIX), значение каждого символа в котором определено выше, может быть получено из соединения (XVIII) в соответствии со способом, аналогичным описанному для получения соединения(X) из соединения (IX). Соединение (XX), значение каждого символа в котором определено выше, может быть получено из соединения (XIX) в соответствии со способом, аналогичным описанному для получения соединения(XII) из соединения (X). Соединение (XXI) может быть получено из соединения (XX) в соответствии со способом, аналогичным описанному для получения соединения (II) из соединения (XII). В качестве альтернативы соединение (XXI), значение каждого символа в котором определено выше, может быть получено из соединения (XVIII) в соответствии со способом, аналогичным описанному для получения соединения (XII) из соединения (X). Соединение (V) может быть получено из соединения (XXI) в соответствии со способом, аналогичным описанному для получения соединения (III) из соединения (II). Кроме того, соединение (V) может быть также получено в соответствии со следующим способом. Кроме того, соединение (I) может быть получено с использованием способа, аналогичного описанному выше способу. Соединение (XXII), значение каждого символа в котором определено выше, может быть получено способом, известным per se, например способом, описанным в Tetrahedron Letters, vol. 40, p. 4905-4908(1999) и т.п., или аналогичным ему способом. Соединение (XXIII), в котором R11 представляет собой гидроксизащитную группу, а значения других символов определены выше, может быть получено, например, в соответствии со способом, описанным в Organic Biomolecular Chemistry (Org. Biomol. Chem.), vol. 1, p. 3527-3534 (2003) и т.п., путем осуществления взаимодействия соединения (XXII) со сложным эфиром бром(или хлор, йод)дифторуксусной кислоты и защиты полученной гидроксигруппы. Гидроксизащитная группа конкретно не определена при условии протекания реакции, а предпочтительные примеры включают тозильную группу, мезильную группу и т.п. Соединение (XXIV), в котором R12 представляет собой амидзащитную группу, а значения других символов определены выше, может быть получено путем, при котором соединение (XXIII) подвергается реакции циклизации посредством снятия защиты с аминогруппы и защиты полученной амидогруппы. Условия снятия защиты с аминогруппы и циклизации конкретно не ограничены при условии протекания реакции, и примеры условий включают условия реакции для одновременной циклизации и снятия защитной группы в растворе хлороводорода в этилацетате и т.п. Амидзащитная группа не ограничена при условии протекания реакции, а предпочтительные примеры включают трет-бутоксикарбонильную группу (ВОС-группа) и т.п. Соединение (XXVI), значение каждого символа в котором определено выше, может быть получено путем осуществления взаимодействия соединения (XXIV) с соединением, представленным формулой(XXV), в которой Z представляет собой атом или молекулу, наделяющие нуклеофильностью, такие как Соединение (XXV) может быть получено в реакционной системе в соответствии, например, со способом, описанным в Tetrahedron Lett., vol. 21, p. 4137 (1980) или в Tetrahedron Lett., vol. 42, p. 8697 (2001),или аналогичным ему способом. Растворитель в указанной реакции конкретно не ограничен при условии протекания реакции, и предпочтительные растворители включают углеводороды, такие как н-гексан, толуол и т.п., эфиры, такие как тетрагидрофуран, диэтиловый эфир и т.п., или смешанный из них растворитель и т.п. Продолжительность реакции варьирует в зависимости от подлежащих использованию реагентов и растворителя и, как правило, составляет от 1 мин до 48 ч, предпочтительно от 10 мин до 24 ч. Соединение (XXVII) может быть получено способом, известным per se, например способом, описанным в Tetrahedron Letters, vol. 36, p. 5119-5122 (1995) и т.п., или аналогичным ему способом. В качестве альтернативы соединение (XXVII) может быть получено путем восстановления соединения (XXVI) и осуществления взаимодействия полученного соединения с основанием. Восстановитель, подлежащий использованию в указанной реакции, конкретно не ограничен при условии протекания реакции, и предпочтительные примеры включают боргидрид натрия и т.п. Примеры основания включают неорганические основания, такие как гидрид натрия, гидроксид натрия, гидроксид калия и т.п., основные соли, такие как карбонат натрия, карбонат калия, карбонат цезия,гидрокарбонат натрия и т.п., алкоксиды металлов, такие как этоксид калия, трет-бутоксид калия, метоксид натрия, этоксид натрия и т.п., ароматические амины, такие как пиридин, лутидин и т.п., третичные амины, такие как триэтиламин, трипропиламин, трибутиламин, циклогексилдиметиламин, 4 диметиламинопиридин,N,N-диметиланилин,N-метилпиперидин,N-метилпирролидин,Nметилморфолин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) и т.п. Подлежащее использованию количество оснований составляет от 0,8 до 20 моль, предпочтительно от 1 до 10 моль на 1 моль соединения(XXVI). Указанную реакцию предпочтительно проводят с использованием растворителя, инертного в реакции. Хотя растворитель конкретно не ограничен при условии протекания реакции, предпочтительными являются углеводороды, такие как бензол, толуол и т.п., эфиры, такие как тетрагидрофуран и т.п., амиды,такие как N,N-диметилформамид, N,N-диметилацетамид и т.п., ацетонитрил и т.п., или смешанный из них растворитель и т.п. Указанная реакция предпочтительна тем, что может проводиться в присутствии краун-эфиров. Примеры краун-эфиров включают 15-краун-5-эфир, 18-краун-6-эфир и т.п. Подлежащее использованию количество краун-эфира составляет от 0,01 до 10 моль, предпочтительно 1-5 моль на 1 моль соединения (XXVI). Хотя продолжительность реакции варьирует в зависимости от подлежащих использованию реагентов и растворителя, она, как правило, составляет от 1 мин до 48 ч, предпочтительно от 10 мин до 8 ч. Температура реакции, как правило, составляет от -78 до 100 С, предпочтительно от-10 до 70 С. Соединение (XXVIII), значение каждого символа в котором определено выше, может быть получено из соединения (XXVII) в соответствии со способом, аналогичным описанному для получения соединения (X) из соединения (IX). Соединение (V) может быть получено из соединения (XXVIII), например, в типичной реакции формилирования, включая обработку продукта реакции оксалилхлорида с диметилформамидом и т.п. Кроме того, соединение (V) может быть получено способом, включающим введение цианогруппы и карбоновой кислоты и преобразование полученного соединения до альдегида и т.п. Кроме того, соединение (XVI) может быть также получено в соответствии со следующим способом и соединение (I) может быть получено с использованием способа, аналогичного описанному выше способу. Соединение (XXIX), в котором значение R12 определено выше, и R13 представляет собой атом галогена, такой как атом хлора, атом брома, атом йода и т.п., может быть получено способом, известным perse, например способом, описанным в Journal of Organic Chemistry (J. Org. Chem.), vol. 66, p. 315 (2001) и т.п., или аналогичным ему способом. Примеры амидзащитной группы для R12 включают без конкретного ограничения трет-бутоксикарбонильную группу (ВОС-группа), тозильную группу, бензильную группу,аллильную группу и т.п. Соединение (XXX), значение каждого символа в котором определено выше, может быть получено путем обработки соединения (XXIX) основанием. Примеры основания включают неорганические основания, такие как гидрид натрия, гидроксид натрия, гидроксид калия и т.п., основные соли, такие как карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия и т.п., алкоксиды металлов, такие как этоксид калия, трет-бутоксид калия, метоксид натрия, этоксид натрия и т.п., ароматические амины,такие как пиридин, лутидин и т.п., третичные амины, такие как триэтиламин, трипропиламин, трибутиламин, циклогексилдиметиламин, 4-диметиламинопиридин, N,N-диметиланилин, N-метилпиперидин, Nметилпирролидин, N-метилморфолин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) и т.п. Подлежащее использованию количество основания составляет от 0,8 до 10 моль, предпочтительно от 1 до 5 моль на 1 моль соединения (XXIX). Указанную реакцию предпочтительно проводят с использованием растворителя, инертного в реакции. Хотя растворитель конкретно не ограничен при условии протекания реакции, предпочтительными являются углеводороды, такие как бензол, толуол и т.п., эфиры, такие как тетрагидрофуран и т.п., амиды,такие как N,N-диметилформамид, N,N-диметилацетамид и т.п., ацетонитрил и т.п., или смешанный из них растворитель и т.п. Хотя продолжительность реакции варьирует в зависимости от подлежащих использованию реагентов и растворителя, она, как правило, составляет от 1 мин до 48 ч, предпочтительно от 10 мин до 8 ч. Температура реакции, как правило, составляет от -78 до 100 С, предпочтительно от-10 до 70 С. Соединение (XXXIa), значение каждого символа в котором определено выше, или соединение(XXXIb), значение каждого символа в формуле которого определено выше, может быть получено из соединения (XXX) в соответствии со способом, аналогичным описанному для получения соединения(XXVI) из соединения (XXIV). Соединение (XXXII) может быть получено путем, при котором соединение (XXXIa) или соединение (XXXIb) подвергают реакциям снятия защитной группы и дегидрирования. Хотя условия реакции конкретно не ограничены, они варьируют в зависимости от типа защитной группы и растворителя, подлежащих использованию. Например, реакции снятия защитной группы и дегидрирования протекают непрерывно при обработке кислотой, такой как трифторуксусная кислота и соляная кислота. Соединение (XVI), значение каждого символа в котором определено выше, может быть получено путем обработки соединения, представленного формулой (XXXIII), значение каждого символа в котором определено выше, основанием, таким как гидрид натрия, н-бутиллитий, и т.п., и осуществления взаимодействия полученного соединения с соединением (XXXII). Защитная группа для R10 в указанной реакции конкретно не ограничена, поскольку она является уходящей, и предпочтительные примеры включают бензильную группу, 4-метоксибензильную группу,2,4-диметоксибензильную группу и т.п. Хотя растворитель, используемый в указанной реакции, конкретно не ограничен при условии протекания реакции, предпочтительными являются углеводороды, такие как н-гексан, толуол и т.п., эфиры,такие как тетрагидрофуран, диэтиловый эфир и т.п., или смешанный из них растворитель и т.п. Хотя продолжительность реакции варьирует в зависимости от подлежащих использованию субстратов и растворителя, она, как правило, составляет от 1 мин до 48 ч, предпочтительно от 10 мин до 5 ч. Температура реакции, как правило, составляет от -100 до 100 С, предпочтительно от -78 до 30 С. Соединение (I) может быть выделено и очищено посредством известных способов, таких как фазовый перенос, концентрирование, экстракция растворителем, фракционирование, жидкостная конверсия,кристаллизация, перекристаллизация, хроматография и т.п. Если соединение (I) получено в виде свободного соединения, то оно может быть преобразовано до желаемой соли посредством способа, известногоper se, или аналогичного ему способа; напротив, если соединение (I) получено в виде соли, оно может быть преобразовано до свободной формы или другой желаемой соли посредством способа, известногоper se, или аналогичного ему способа. Соединение (I) может использоваться в качестве пролекарства. Пролекарство соединения (I) означает соединение, которое преобразуется до соединения (I) в физиологических условиях в организме путем реакции с ферментом, желудочной кислотой или т.п., то есть представляет собой соединение, которое преобразуется до соединения (I) путем ферментативного окисления, восстановления, гидролиза и т.п.; соединение, которое преобразуется до соединения (I) путем гидролиза желудочной кислотой, и т.п. Пролекарство соединения (I) включает соединение, в котором аминогруппа соединения (I) модифицирована ацилом, алкилом или фосфорилом (например, соединение, в котором аминогруппа соединения (I) модифицирована эйкозаноилом, аланилом, пентиламинокарбонилом, (5-метил-2-окси-1,3-диоксолен-4 ил)метоксикарбонилом, тетрагидрофуранилом, пирролидилметилом, пивалоилоксиметилом или тетрабутилом и т.п.); соединение, в котором гидроксильная группа соединения (I) модифицирована ацилом, алкилом, фосфорной кислотой или борной кислотой (например, соединение, в котором гидроксильная группа соединения (I) модифицирована ацетилом, пальмитоилом, пропаноилом, пивалоилом, сукцинилом, фумарилом, аланилом или диметиламинометилкарбонилом и т.п.); соединение, в котором карбоксильная группа соединения (I) модифицирована сложным эфиром или амидом (например, соединение, в котором карбоксильная группа соединения (I) модифицирована сложным этиловым эфиром, сложным фениловым эфиром, сложным карбоксиметиловым эфиром, сложным диметиламинометиловым эфиром,сложным пивалоилоксиметиловым эфиром, сложным этоксикарбонилоксиэтиловым эфиром, сложным фталидиловым эфиром, сложным (5-метил-2-оксо-1,3-диоксолен-4-ил)метиловым эфиром, сложным циклогексилоксикарбонилэтиловым эфиром или метиламидом и т.п.) и т.п. Эти соединения могут быть получены из соединения (I) способом, известным per se. Кроме того, пролекарство соединения (I) может представлять собой соединение, которое преобразуется до соединения (I) в физиологических условиях,как описано в Pharmaceutical Research and Development, vol. 7 (Molecule Design), p. 163-198 (1990), опубликованной Hirokawa Publishing Co. Если соединение (I) содержит оптический изомер, стереоизомер, региоизомер или ротамер, то все эти изомеры и их смеси также охватываются соединением (I). Например, если соединение (I) содержит оптический изомер, то выделенный из рацемата оптический изомер также охватывается соединением (I). Эти изомеры могут быть получены в виде отдельных продуктов в соответствии со способами синтеза и разделения, известными per se (концентрирование, экстракция растворителем, колоночная хроматография, перекристаллизация и т.п.). Соединение (I) может представлять собой кристалл, и как отдельный кристалл, так и кристаллические смеси охватываются соединением (I). Кристаллы могут быть получены путем кристаллизации в соответствии со способами кристаллизации, известными per se. Соединение (I) может представлять собой сольват (например, гидрат и т.п.) или не сольват, оба из которых охватываются соединением (I). Соединение, меченное изотопом (например, 3 Н, 14 С, 35S, 125I и т.п.), и форма с преобразованием дейтерием, в которой 1H преобразован до 2H(D), также охватываются соединением (I). Соединение (I) или его соль либо его пролекарство по настоящему изобретению (далее в этом документе иногда подлежащее сокращению до соединения по настоящему изобретению) обладает ингибирующим действием в отношении протонной помпы и эффективно подавляет секрецию желудочной кислоты. Кроме того, поскольку они проявляют низкую токсичность (например, острую токсичность, хроническую токсичность, генетическую токсичность, репродуктивную токсичность, кардиотоксичность,взаимодействие лекарственных средств, канцерогенность и т.п.) и высокую растворимость в воде и обладают преимуществами в плане стабильности, кинетики in vivo (всасываемость, распределение, метабо- 10019741 лизм, экскреция и т.п.) и эффективности воздействия, они применимы в качестве лекарственных средств. Соединение по настоящему изобретению применимо для профилактики или лечения язвенной болезни (например, язвы желудка, язвы двенадцатиперстной кишки, анастомотической язвы, язвы, вызванной нестероидными противовоспалительными лекарственными средствами, язвы вследствие послеоперационного стресса и т.п.); синдрома Золлингера-Эллисона; гастрита; эрозивного эзофагита; рефлюксэзофагита, такого как эрозивный рефлюкс-эзофагит, и т.п.; симптоматической гастроэзофагеальной рефлюксной болезни (симптоматическая GERD), такой как неэрозивный гастроэзофагеальный рефлюкс, гастроэзофагеальный рефлюкс, не сопровождаемый эзофагитом, и т.п.; пищевода Барретта; функциональной диспепсии; рака желудка (включая рак желудка, ассоциированный с усиленной продукцией интерлейкина-1 вследствие полиморфизма гена интерлейкина-1); MALT-лимфомы желудка; повышенной кислотности; кровотечения из верхних отделов желудочно-кишечного тракта вследствие язвенной болезни, острой стрессовой язвы, геморрагического гастрита; инвазивного стресса (например, стресса, вызванного радикальной операцией, требующей интенсивной послеоперационной терапии, или цереброваскулярного нарушения, травмы головы, синдрома полиорганной недостаточности или обширного ожога,требующего интенсивного лечения) и т.п.; нарушений дыхательных путей; бронхиальной астмы и т.п., у млекопитающих (например, человек, обезьяна, овца, жвачное животное, лошадь, собака, кошка, кролик,крыса, мышь и т.п.), премедикации, эрадикации или вспомогательной эрадикации Helicobacter pylori и т.п. Используемые в этом документе упомянутые выше термины "рефлюкс-эзофагит" (эрозивный эзофагит) и "симптоматическая гастроэзофагеальная рефлюксная болезнь" (симптоматическая GERD) иногда обобщенно называют просто GERD. Содержание соединения по настоящему изобретению в фармацевтической композиции по настоящему изобретению составляет приблизительно от 0,01 приблизительно до 100 мас.% относительно всей композиции. Хотя этот подлежащий уточнению параметр зависит от цели введения, способа введения,болезни-мишени и т.п., доза соединения составляет приблизительно от 0,5 приблизительно до 1500 мг/сутки, предпочтительно приблизительно от 5 приблизительно до 150 мг/сутки, исходя из активного компонента, если соединение, например, вводят перорально в качестве противоязвенного средства взрослому человеку (60 кг). Соединение по настоящему изобретению может вводиться один раз в сутки или разделено на 2 или 3 порции в сутки. Соединение по настоящему изобретению проявляет низкую токсичность и может безопасно вводиться перорально или парентерально (например, местное, ректальное, внутривенное введения и т.п.) в неизменном виде или в виде препарата, содержащего фармацевтическую композицию, содержащую фармакологически приемлемый носитель, добавленный в соответствии с известным per se способом, такого как таблетки (включая таблетки с сахарной оболочкой и таблетки с пленочной оболочкой), порошок, гранула, капсула (включая мягкую капсулу), перорально распадающаяся таблетка, перорально распадающаяся пленка, жидкость, инъекционный препарат, суппозиторий, препарат с замедленным высвобождением, пластырь и т.п. В частности, соединение по настоящему изобретению предпочтительно вводят в виде перорального препарата в форме таблетки, гранулы, капсулы и т.п. Фармакологически приемлемый носитель, который может быть использован для получения фармацевтической композиции по настоящему изобретению, включает ряд органических или неорганических веществ-носителей, широко применяемых в качестве фармацевтических материалов, включая наполнители, смазки, связующие вещества, разрыхлители, растворимые в воде полимеры и основные неорганические соли для твердых препаратов; и растворители, солюбизирующие агенты, суспендирующие вещества, изотонизирующие вещества, буферы и успокаивающие средства для жидких препаратов и т.п. При необходимости, также могут использоваться обычные фармацевтические добавки, такие как консерванты, антиоксиданты, красители, подсластители, подкислители, образующие пузырьки средства и отдушки. Такие "наполнители" включают, например, лактозу, сахарозу, D-маннит, крахмал, кукурузный крахмал,кристаллическую целлюлозу, легкую безводную кремниевую кислоту, оксид титана и т.п. Такие "смазки" включают, например, стеарат магния, сложный эфир жирной кислоты сахарозы, полиэтиленгликоль,тальк, стеариновую кислоту и т.п. Такие "связующие вещества" включают, например, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, кристаллическую целлюлозу, крахмал, поливинилпирролидон, порошок аравийской камеди, желатин, пуллулан, гидроксипропилцеллюлозу с низкой степенью замещения и т.п. Такие "разрыхлители" включают (1) кроссповидон, (2) так называемые суперразрыхлители, такие как кросскармелоза натрия (производства FMC-Asahi Chemical Industry Co. Ltd.) и кармелоза кальция (производства Gotoku Yakuhin) и т.п., (3) натриевый карбоксиметилкрахмал (например, производства Matsutani Chemical), (4) гидроксипропилцеллюлозу с низкой степенью замещения (например,производства Shin-Etsu Chemical), (5) кукурузный крахмал и т.д. Указанный "кроссповидон" может представлять собой любой поперечно сшитый полимер с химическим названием гомополимера 1-этенил-2 пирролидинона, включая поливинилпирролидон (PVPP) и гомополимер 1-винил-2-пирролидинона, и представленный Колидон CL (зарегистрированная торговая марка; производство BASF), Полипласдон(здесь и далее в этом документе также называемая НРС), и т.п., поливинилпирролидон и т.п.], растворимые в этаноле нерастворимые в воде полимеры [например, производные целлюлозы, такие как гидроксипропилметилцеллюлоза (здесь и далее в этом документе также называемая НРМС) и т.п., метилцеллюлоза, карбоксиметилцеллюлоза натрия и т.п., полиакрилат натрия, поливиниловый спирт, альгинат натрия,гуаровая камедь и т.п.] и т.п. Такие "основные неорганические соли" включают, например, основные неорганические соли натрия, калия, магния и/или кальция. Предпочтительными являются основные неорганические соли магния и/или кальция. Более предпочтительными являются основные неорганические соли магния. Такие основные неорганические соли натрия включают, например, карбонат натрия, гидрокарбонат натрия, двузамещенный фосфорнокислый натрий и т.п. Такие основные неорганические соли калия включают, например, карбонат калия, гидрокарбонат калия и т.п. Такие основные неорганические соли магния включают, например, тяжелый карбонат магния, карбонат магния, оксид магния, гидроксид магния, алюмометасиликат магния, силикат магния, алюминат магния, синтетический гидротальцит[Mg6Al2(OH)16CO34H2O] и алюминия/магния гидроксид. Предпочтительными являются тяжелый карбонат магния, карбонат магния, оксид магния, гидроксид магния и т.п. Такие основные неорганические соли кальция включают, например, преципитированный карбонат кальция, гидроксид кальция и т.п. Такие "растворители" включают, например, воду для инъекций, спирт, пропиленгликоль, макрогол, кунжутное масло, кукурузное масло, оливковое масло и т.п. Такие "солюбизирующие агенты" включают,например, полиэтиленгликоль, пропиленгликоль, D-маннит, бензилбензоат, этанол, трисаминометан,холестерин, триэтаноламин, карбонат натрия, цитрат натрия и т.п. Такие "суспендирующие вещества" включают, например, поверхностно-активные вещества, такие как стеарилтриэтаноламин, лаурилсульфат натрия, лауриламинопропионовая кислота, лецитин, бензалкония хлорид, бензэтония хлорид, глицерилмоностеарат и т.п.; гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон,карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза,гидроксипропиллцеллюлоза и т.д., и т.п. Такие "изотонизирующие вещества" включают, например, глюкозу, D-сорбит, хлорид натрия, глицерин, D-маннит и т.п. Такие "буферы" включают, например, буферные растворы фосфатов, ацетатов, карбонатов, цитратов и т.д., и т.п. Такие "успокаивающие средства" включают, например, бензиловый спирт и т.п. Такие "консерванты" включают, например, сложные эфиры параоксибензойной кислоты, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроуксусную кислоту, сорбиновую кислоту и т.п. Такие "антиоксиданты" включают, например, сульфиты, аскорбиновую кислоту, -токоферол и т.п. Такие "красители" включают, например, пищевые красители, такие как пищевой краситель желтый 5, пищевой краситель красный 2, пищевой краситель синий 2, и т.п.; пищевые красочные лаки, оксид железа красный и т.п. Такие "подсластители" включают, например, сахарин натрия, глицирризинат калия двойной, аспартам, стевию, тауматин и т.п. Такие "подкислители" включают, например, лимонную кислоту (лимонный ангидрид), винную кислоту, яблочную кислоту и т.п. Такие "образующие пузырьки средства" включают, например, бикарбонат натрия и т.п. Такие "отдушки" могут быть синтетическими веществами или веществами натурального происхождения и включают, например, лимон, лайм, апельсин, ментол, землянику и т.п. Соединение по настоящему изобретению может быть приготовлено в виде препарата для перорального введения в соответствии с общеизвестными способами, например, путем сжатия-формования с носителем, таким как наполнитель, разрыхлитель, связующее вещество, смазка или т.п., и, при необходимости, с последующим нанесением на препарат покрытия общеизвестным способом с целью маскировки вкуса, растворения в кишечнике или замедленного высвобождения. Для кишечно-растворимого препарата с целью разделения двух слоев общеизвестным способом может быть обеспечен промежуточный слой между кишечно-растворимым слоем и слоем, содержащим лекарство. Для приготовления соединения по настоящему изобретению в виде перорально распадающейся таблетки применимые способы включают, например, способ, в котором внутренний слой, содержащий кристаллическую целлюлозу и лактозу, покрыт соединением по настоящему изобретению и, при необходимости, основной неорганической солью, а затем дополнительно покрыт оболочкой, содержащей растворимый в воде полимер, с получением композиции, которая покрыта кишечно-растворимой оболочкой, содержащей полиэтиленгликоль, дополнительно покрыта кишечно-растворимой оболочкой, содержащей триэтилцитрат, еще дополнительно покрыта кишечно-растворимой оболочкой, содержащей полиэтиленгликоль, и окончательно покрыта маннитом с получением мелкозернистых гранул, которые смешивают с добавками и формуют. Вышеупомянутая "кишечно-растворимая оболочка" включает, например, оболочку, состоящую из смеси одного или нескольких видов водных кишечно-растворимых полимерных субстратов, таких как целлюлозы ацетатфталат (САР), гидроксипропилметилцеллюлозы фталат, гидроксиметилцеллюлозы ацетатсукцинат, сополимеры метакриловой кислоты (например, Эудрагит (Eudragit) (зарегистрированная торговая марка; производства Rohm) L30D-55, Colicoat (зарегистрированная торговая марка; производства BASF) MAE30DP, Polyquid (зарегистрированная торговая марка; производства Sanyo Chemical) PA30 и т.п.), карбоксиметилэтилцеллюлозу, шеллак и т.п.; субстраты с замедленным высвобождением, такие как сополимеры метакриловой кислоты (например, Эудрагит (зарегистрированная торговая марка)NE30D, Эудрагит (зарегистрированная торговая марка) RL30D, Эудрагит (зарегистрированная торговая марка) RS30D и т.п.) и т.п.; растворимые в воде полимеры; пластификаторы, такие как триэтилцитрат,полиэтиленгликоль, ацетилированные моноглицериды, триацетин, касторовое масло и т.п. Вышеупомянутая "добавка" включает, например, растворимые в воде сахарные спирты (например,сорбит, маннит, мальтит, восстановленные сахариды крахмала, ксилит, восстановленная палатиноза,эритрит и т.п.), кристаллическую целлюлозу (например, Ceolas (зарегистрированная торговая марка) KG 801, Авицел (Avicel) (зарегистрированная торговая марка) РН 101, Авицел (зарегистрированная торговая марка) РН 102, Авицел (зарегистрированная торговая марка) РН 301, Авицел (зарегистрированная торговая марка) РН 302, Авицел (зарегистрированная торговая марка) RC-591 (кристаллическая целлюлозакармелоза натрия) и т.п.), гидроксипропилцеллюлозу с низкой степенью замещения (например, LH-22,LH-32, LH-23, LH-33 (Shin-Etsu Chemical), их смеси и т.п.) и т.п. Кроме того, также применяются связующие вещества, подкислители, образующие пузырьки средства, подсластители, отдушки, смазки, красители, стабилизаторы, наполнители, разрыхлители и т.п. Соединение по настоящему изобретению может применяться в сочетании с 1-3 другими активными ингредиентами. Такие "другие активные ингредиенты" включают, например, активные вещества противHelicobacter pylori, соединения имидазола, соли висмута, соединения хинолона и т.п. Примеры "активных веществ против Helicobacter pylori" включают пенициллиновый антибиотик (например, амоксициллин, бензилпенициллин, пиперациллин, мециллинам, ампициллин, темоциллин, бакампициллин, аспоксициллин, сультамициллин, ленампициллин и т.п.), цефемовый антибиотик (например, цефиксим, цефаклор и т.п.), макролидный антибиотик (например, эритромицин, кларитромицин, рокситромицин, рокитамицин, флуритромицин, телитромицин и т.п.), тетрациклиновый антибиотик (например, тетрациклин, миноциклин, стрептомицин и т.п.), аминогликозидный антибиотик (например, гентамицин, амикацин и т.п.), имипенем и т.п. Из них предпочтительными являются пенициллиновый антибиотик, макролидный антибиотик и т.п. Такие "соединения имидазола" включают, например, метронидазол, миконазол и т.п. Такие "соли висмута" включают, например, ацетат висмута, цитрат висмута, субсалицилат висмута и т.п. Такие "соединения хинолона" включают, например, офлоксацин, циплоксацин и т.п. Для эрадикации Helicobacter pylori предпочтительно применяют соединение (I) или его соль по настоящему изобретению вместе с пенициллиновым антибиотиком (например, амиксициллин и т.п.) и эритромициновым антибиотиком (например, кларитромицин и т.п.). Хотя в целях эрадикации Helicobacter pylori соединение по настоящему изобретению само по себе обладает анти-H. pylori действием (бактериостатическое действие или эрадикационное действие), оно может усиливать антибактериальное действие других антибиотиков, основанное на регуляции рН в желудке, и т.п., а также обеспечивает вспомогательный эффект, такой как эрадикационный эффект, основанный на действии применяемых в сочетании антибиотиков. Такие "другие активные ингредиенты" и соединение (I) или его соль по настоящему изобретению могут быть смешаны, приготовлены в соответствии с общеизвестным способом в виде однократной фармацевтической композиции [например, таблетки, порошки, гранулы, капсулы (включая мягкие капсулы), жидкости, инъецируемые препараты, суппозитории, препараты с замедленным высвобождением и т.д.] и применены в сочетании, а также могут быть приготовлены в виде отдельных препаратов и введены тому же субъекту одновременно или через некоторый промежуток времени. Кроме того, соединение по настоящему изобретению может применяться в сочетании с прокинетическим лекарственным средством, лекарственным средством, действующим на нижний пищеводный сфинктер (например, супрессант транзиторных релаксаций нижнего пищеводного сфинктера и т.д.), открывателем ClC-2 канала (стимулятора секреции кишечного сока), антагонистом гистаминового Н 2 рецептора, антацидом, седативным средством, средством, повышающим функциональную активность желудка, или нестероидным противовоспалительным препаратом (NSAID). В качестве "прокинетического лекарственного средства" могут быть упомянуты, например, домперидон, метоклопрамид, мозаприд,итоприд, тегасерод и т.п. В качестве "лекарственного средства, действующего на нижний пищеводный сфинктер" могут быть упомянуты, например, агонисты GABA-B рецептора, такие как баклофен, их оптически активные формы и т.п., антагонисты глутаминового рецептора и т.п. В качестве "открывателяClC-2 канала (стимулятора секреции кишечного сока)" может быть упомянут лубипростон и т.п. В качестве "антагониста гистаминового Н 2-рецептора" могут быть упомянуты циметидин, ранитидин, фамотидин, роксатидин, низатидин, лафутидин и т.п. В качестве "антацида" могут быть упомянуты гидрокарбонат натрия, гидроксид алюминия и т.п. В качестве "седативного средства" могут быть упомянуты диазепам, хлордиазепоксид и т.п. В качестве "средства, повышающего функциональную активность желудка" могут быть упомянуты гентиана, японская сверция, диастаза и т.п. В качестве "нестероидного противовоспалительного препарата" могут быть упомянуты, например, аспирин, индометацин, ибупрофен, мефенамовая кислота, диклофенак, этодорак, пироксикам, целекоксиб и т.п. Прокинетическое лекарственное средство, лекарственное средство, действующее на нижний пищеводный сфинктер, открыватель ClC-2 канала (стимулятор секреции кишечного сока), антагонист гиста- 13019741 минового Н 2-рецептора, антацид, седативное средство, средство, повышающее функциональную активность желудка, или нестероидный противовоспалительный препарат и соединение (I) или его соль по настоящему изобретению могут быть смешаны, приготовлены в виде однократной фармацевтической композиции [например, таблетки, порошки, гранулы, капсулы (включая мягкие капсулы), жидкости,инъецируемые препараты, суппозитории, препараты с замедленным высвобождением и т.д.] в соответствии со способом, известным per se для сочетанного применения, или также могут быть приготовлены в виде отдельных препаратов и введены тому же субъекту одновременно или через некоторый промежуток времени. Соединение по настоящему изобретению может применяться в сочетании со следующими лекарственными средствами:(ii) комбинированный пероральный антацидный препарат, например Маалокс, Алудрокс и Гевискон;(iv) противогастритный препарат, например вакцина против гастрита, итриглумид и Z-360;(xiv) антагонист ваниллоидного рецептора 1, например AMG-517 и GW-705498;(xvi) ингибитор AChE, например Z-338 и KW-5092. Вышеупомянутые лекарственные средства (i)-(xvi) и соединение (I) или его соль по настоящему изобретению могут быть смешаны, приготовлены в виде однократной фармацевтической композиции[например, таблетки, порошки, гранулы, капсулы (включая мягкие капсулы), жидкости, инъецируемые препараты, суппозитории, препараты с замедленным высвобождением и т.д.] в соответствии со способом, известным per se для сочетанного применения, или также могут быть приготовлены в виде отдельных препаратов и введены тому же субъекту одновременно или через некоторый промежуток времени. Примеры Настоящее изобретение более подробно разъясняется далее посредством справочных примеров,примеров и экспериментальных примеров, которые не должны истолковываться как ограничивающие. В последующих справочных примерах и примерах "комнатная температура", как правило, означает температуру приблизительно от 10 С приблизительно до 35 С, но конкретно строго не ограничивается. Отношение при смешивании жидкостей отражает объемное отношение. Если иное не указано особо, то% означает мас.%. Выход представлен в мол./мол.%. Колоночную хроматографию на силикагеле проводили с использованием силикагеля 60 (0,063-0,200 мм) производства MERCK, Fuji Silysia Chemical Ltd.Chromatorex (торговое наименование) NH (описываемую как колоночную хроматографию на основном силикагеле) или Purif-Pack производства MORITEX (описываемую как колоночную хроматографию на силикагеле или колоночную хроматографию на основном силикагеле). Температуру плавления измеряли с использованием аппарата для измерения температуры плавления в очень малых образцах производстваYanagimoto или аппарата для измерения температуры плавления в очень малых образцах производстваBuechi (B-545) и представляли без внесения поправок. Для получения 1 Н-ЯМР спектров в качестве внутреннего стандарта использовали тетраметилсилан, а для измерения использовали спектрометры VarianJNM-AL400 (400 МГц) производства JEOL DATUM (JEOL DATUM LTD.). Для представления результатов измерений использовали следующие сокращения: с: синглет, д: дублет, дд: двойной дублет, ддд: тройной дублет, дт: двойной триплет, т: триплет, кв: квартет, дкв: двойной квартет, м: мультиплет,ушир.: уширенный, ушир.с: уширенный синглет, J: константа взаимодействия, Гц: Герц. Справочный пример 1. трет-Бутил(2-оксоэтил)карбамат. К смешанному раствору трет-бутил (2-гидроксиэтил)карбамата (10,0 г) в диметилсульфоксиде (50 мл) и триэтиламине (12,3 г) при охлаждении на льду добавляли комплекс триоксида серы и пиридина(15,0 г) и перемешивали смесь в течение 1 ч. Реакционную смесь дополнительно перемешивали при комнатной температуре в течение 3 ч, добавляли 1 М соляную кислоту и экстрагировали смесь этилацетатом. Разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом магния и концентрировали в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на силикагелеH-ЯМР (CDCl3) : 1,46 (9 Н, с), 4,08 (2 Н, д, J=4,5 Гц), 5,19 (1 Н, ушир.с), 9,66 (1 Н, с). Справочный пример 2. Этил 4-[(трет-бутоксикарбонил)амино]-2,2-дифтор-3-[(4-метилфенил)сульфонил]оксибутаноат. Цинковый порошок (23,0 г) промывали 0,1 М соляной кислотой, этанолом и диэтиловым эфиром и сушили в условиях пониженного давления. В атмосфере аргона к суспензии промытого цинкового порошка в тетрагидрофуране (300 мл) добавляли раствор трет-бутил (2-оксоэтил)карбамата (35,0 г) в тетрагидрофуране (50 мл), постепенно по каплям при охлаждении на льду добавляли этилбромдифторацетат(75,9 г) и перемешивали смесь в течение 15 мин. К реакционной смеси добавляли 1 М соляную кислоту и экстрагировали смесь этилацетатом. Разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления. Остаток растворяли в смешанном растворе тетрагидрофурана (30 мл) и пиридина (40 мл), при комнатной температуре добавляли триэтиламин (19 мл), 4-диметиламинопиридин(3,35 г) и 4-метилбензолсульфонилхлорид (39,2 г) и перемешивали смесь в течение 2 ч. Реакционную смесь концентрировали в условиях пониженного давления, растворяли остаток в этилацетате и дважды промывали 1 М соляной кислотой. Разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на силикагеле(элюент: гексан/этилацетат = 4/1) с получением указанного в заголовке соединения в виде бледножелтого масла (выход 44,8 г, 46%). 1(100 мл) и перемешивали смесь в течение 3 ч. Реакционную смесь концентрировали в условиях пониженного давления и остаток дважды подвергали азеотропной перегонке с толуолом. Полученную смесь растворяли в ацетонитриле (20 мл), добавляли триэтиламин (15,6 г) и перемешивали смесь в течение 3 ч. При комнатной температуре добавляли ди-трет-бутилбикарбонат (33,6 г) и 4-диметиламинопиридин(3,76 г) и перемешивали смесь в течение 1 ч. Реакционную смесь концентрировали в условиях пониженного давления, остаток растворяли в этилацетате и промывали 1 М соляной кислотой. Разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: гексан/этилацетат = 2/1) с получением указанного в заголовке соединения в виде бледно-желтого масла (выход 32,0 г, 80%). 1H-ЯМР (CDCl3) : 1,55 (9 Н, с), 2,48 (3 Н, с), 3,81-3,91 (1H, м), 4,09-4,18 (1 Н, м), 4,94-5,06 (1 Н, м),7,40 (2H, д, J=8,1 Гц), 7,83 (2 Н, д, J=8,1 Гц). Справочный пример 4. 4,4-Дифтор-5-(2-фторпиридин-3-ил)-3,4-дигидро-2 Н-пиррол-3-ил 4 метилбензолсульфонал. К раствору диизопропиламина (8,76 г) в тетрагидрофуране (230 мл) при -78 С добавляли 1,6 M раствор н-бутиллития в гексане (51 мл) и перемешивали смесь в течение 1 ч. По каплям добавляли 2 фторпиридин (11,2 г) и перемешивали смесь в течение 2 ч. К полученной бледно-желтой суспензии медленно по каплям добавляли раствор трет-бутил 3,3-дифтор-4-[(4-метилфенил)сульфонил]окси-2- 15019741 оксопирролидин-1-карбоксилата (22,6 г) в тетрагидрофуране (50 мл) и перемешивали смесь в течение 1 ч. К реакционной смеси добавляли воду, смесь нагревали до комнатной температуры и концентрировали в условиях пониженного давления. Остаток разбавляли этилацетатом и промывали водой. Разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления. Полученную смесь растворяли в дихлорметане (30 мл), при охлаждении на льду по каплям добавляли трифторуксусную кислоту (100 мл) и перемешивали смесь в течение 4 ч, позволяя смеси нагреться до комнатной температуры. Реакционную смесь концентрировали в условиях пониженного давления, разбавляли этилацетатом и добавляли насыщенный водный раствор гидрокарбоната натрия до момента, когда смесь становилась нейтральной. Разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом магния и концентрировали в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: гексан/этилацетат = 9/13/1) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (выход 10,9 г, 51%). 1H-ЯМР (CDCl3) : 2,48 (3 Н, с), 4,17-4,28 (1 Н, м), 4,42-4,54 (1 Н, м), 5,06-5,13 (1 Н, м), 7,31 (1 Н, ддд,J=7,6, 4,9, 1,9 Гц), 7,39 (2 Н, д, J=7,9 Гц), 7,85 (2 Н, д, J=8,3 Гц), 8,22-8,31 (1 Н, м), 8,34-8,39 (1 Н, м). Справочный пример 5. 2-Фтор-3-(3-фтор-1 Н-пиррол-2-ил)пиридин. К раствору 4,4-дифтор-5-(2-фторпиридин-3-ил)-3,4-дигидро-2 Н-пиррол-3-ил 4 метилбензолсульфоната (18,0 г) в тетрагидрофуране (180 мл) при охлаждении на льду добавляли боргидрид натрия (3,68 г), затем добавляли метанол (90 мл) и перемешивали смесь в течение 3 ч. Реакционную смесь концентрировали в условиях пониженного давления и остаток разбавляли этилацетатом и промывали водой. Разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления с получением 4,4-дифтор-5-(2-фторпиридин-3 ил)пирролидин-3-ил 4-метилбензолсульфоната. К суспензии гидрида натрия (9,74 г) в тетрагидрофуране(100 мл) при охлаждении на льду по каплям добавляли раствор 4,4-дифтор-5-(2-фторпиридин-3 ил)пирролидин-3-ил 4-метилбензолсульфоната в тетрагидрофуране (100 мл), добавляли 15-краун-5 (32,2 г) и перемешивали смесь в течение 3 ч. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и концентрировали в условиях пониженного давления. Остаток разбавляли этилацетатом и промывали 1 М соляной кислотой. Разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным водным раствором гидрокарбоната натрия,водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: гексан/этилацетат = 9/13/1) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (выход 6,35 г, 72%). 1 Н-ЯМР (CDCl3) : 6,10 (1 Н, т, J=2,9 Гц), 6,69 (1 Н, дт, J=4,6, 3,4 Гц), 7,20-7,30 (1 Н, м), 8,00 (1 Н, дт,J=4,7, 1,7 Гц), 8,25 (1 Н, ддд, J=10,3, 7,8, 1,9 Гц), 8,69 (1 Н, ушир.с). Справочный пример 6. 2-Фтор-3-3-фтор-1-[трис-(1-метилэтил)силил]-1 Н-пиррол-2-илпиридин. К суспензии гидрида натрия (3,32 г) в тетрагидрофуране (70 мл) при охлаждении на льду по каплям добавляли раствор 2-фтор-3-(3-фтор-1 Н-пиррол-2-ил)пиридина (5,98 г) в тетрагидрофуране (30 мл) и перемешивали смесь в течение 30 мин. Добавляли 15-краун-5 (18,3 г) и трис-(1-метилэтил)силил трифторметансульфонат (25,4 г) и перемешивали смесь в течение 1 ч. Растворитель выпаривали до половины объема в условиях пониженного давления, добавляли воду и экстрагировали смесь этилацетатом. Разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на основном силикагеле (элюент: гексангексан/этилацетат = 19/1) с получением указанного в заголовке соединения в виде бледно-желтого масла (выход 10,9 г, 98%). 1H-ЯМР (CDCl3) : 1,04 (18 Н, д, J=7,0 Гц), 1,09-1,19 (3 Н, м), 6,17 (1 Н, дд, J=3,2, 1,5 Гц), 6,70 (1 Н, дд,J=4,8, 3,3 Гц), 7,21 (1 Н, ддд, J=7,3, 4,9, 1,7 Гц), 7,78 (1 Н, ддд, J=9,3, 7,3, 2,1 Гц). Справочный пример 7. 4-Фтор-5-(2-фторпиридин-3-ил)-1 Н-пиррол-3-карбальдегид. К раствору N,N-диметилформамида (717 мг) в дихлорметане (20 мл) при охлаждении на льду в атмосфере аргона добавляли оксалилхлорид (1,13 г) и перемешивали смесь в течение 10 мин. К полученной суспензии добавляли раствор 2-фтор-3-3-фтор-1-[трис-(1-метилэтил)силил]-1 Н-пиррол-2 илпиридина (1,50 г) в дихлорметане (5 мл) и перемешивали смесь при нагревании с обратным холодильником в течение 10 ч. Реакционную смесь охлаждали на льду, добавляли 1 М водный раствор гидроксида натрия (30 мл) и перемешивали смесь в течение 15 мин. Растворитель выпаривали до половины объема в условиях пониженного давления и распределяли остаток путем добавления этилацетата. Разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в условиях пониженного давления. Остаточное твердое вещество промывали диизопропиловым эфиром (30 мл) и фильтровали путем аспирации с получением указанного в заголовке соединения в виде бесцветного твердого вещества (выход 726 мг, 78%). 1[4-фтор-5-(2-фторпиридин-3-ил)-1 Н-пиррол-3 ил]метилметилкарбамат. К раствору 4-фтор-5-(2-фторпиридин-3-ил)-1 Н-пиррол-3-карбальдегида (261 мг) в тетрагидрофуране (1 мл) и метаноле (2 мл) при комнатной температуре добавляли 40% раствор метиламина в метаноле(4 мл) и перемешивали смесь в течение 20 мин. К реакционной смеси добавляли боргидрид натрия (142 мг) и перемешивали смесь в течение 1 ч. Реакционную смесь концентрировали в условиях пониженного давления и добавляли воду (4 мл) и этилацетат (4 мл). К полученной смеси при комнатной температуре добавляли ди-трет-бутилбикарбонат (410 мг) и перемешивали смесь в течение 1 ч. Реакционную смесь распределяли между этилацетатом и водным слоем и разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: гексан/этилацетат = 9/13/1) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (выход 347 мг, 86%). 1(1 Н, дт, J=4,7, 1,7 Гц), 8,23 (1 Н, ддд, J=10,2, 7,9, 1,9 Гц), 8,66 (1 Н, ушир.с). Справочный пример 9. 2-(Бензилсульфанил)-4-метилпиридин. К суспензии гидрида натрия (60% в масле, 512 мг) в тетрагидрофуране (45 мл) при комнатной температуре по каплям добавляли фенилметантиол (1,52 г), добавляли 2-бром-4-метилпиридин (2,0 г) и перемешивали смесь при 60 С в течение 72 ч. Реакционную смесь разбавляли водой и дважды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: гексангексан/этилацетат = 24/1) с получением указанного в заголовке соединения в виде коричневого масла (выход 1,40 г, 56%). 1 Н-ЯМР (CDCl3) : 2,26 (3 Н, с), 4,43 (2 Н, с), 6,82 (1 Н, д, J=5,1 Гц), 6,99 (1 Н, с), 7,17-7,32 (3 Н, м),7,35-7,44 (2 Н, м), 8,31 (1 Н, д, J=5,1 Гц). Справочный пример 10. 4-Метилпиридин-2-сульфонилфторид. К раствору 2-(бензилсульфанил)-4-метилпиридина (1,40 г) в уксусной кислоте (10 мл) и воде (5 мл) при охлаждении на льду добавляли N-хлорсукцинимид (3,48 г), смесь постепенно нагревали до комнатной температуры и перемешивали в течение 4 ч. При комнатной температуре добавляли фторид калия(379 мг) и перемешивали смесь в течение 18 ч. Реакционную смесь концентрировали в условиях пониженного давления, разбавляли этилацетатом и промывали насыщенным водным раствором гидрокарбоната натрия. Разделенный водный слой экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: гексан/этилацетат = 4/11/1) с получением указанного в заголовке соединения в виде неочищенного бледно-желтого масла (выход 343 мг, 30%). 1 Н-ЯМР (CDCl3) : 2,54 (3 Н, с), 7,50 (1 Н, дт, J=4,9, 0,7 Гц), 7,95 (1 Н, д, J=0,8 Гц), 8,69 (1 Н, д, J=4,9 Гц). Справочный пример 11. трет-Бутил (4-фтор-5-(2-фторпиридин-3-ил)-1-[(4-метилпиридин-2 ил)сульфонил]-1 Н-пиррол-3-илметил)метилкарбамат. К суспензии (3 мл) гидрида натрия (60% в масле, 60 мг) в тетрагидрофуране при комнатной температуре добавляли трет-бутил [4-фтор-5-(2-фторпиридин-3-ил)-1 Н-пиррол-3-ил]метилметилкарбамат(323 мг), 15-краун-5 (330 мг) и 4-метилпиридин-2-сульфонилфторид (343 мг) и перемешивали смесь при комнатной температуре в течение 41 ч. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: гексан/этилацетат = 4/11/1) с получением указанного в заголовке соединения в виде бледно-желтого масла (выход 333 мг, 70%). 1 Н-ЯМР (CDCl3) : 1,47 (9H, с), 2,38 (3 Н, с), 2,86 (3 Н, с), 4,27 (2 Н, ушир.с), 7,27-7,34 (3 Н, м), 7,36(1 Н, с), 7,87 (1 Н, ддд, J=9,2, 7,5, 1,9 Гц), 8,26 (1 Н, д, J=3,8 Гц), 8,45 (1 Н, д, J=4,9 Гц). Справочный пример 12. 2-(Бензилсульфанил)-4-метоксипиридин. К раствору 2-хлор-4-метоксипиридина (786 мг) в толуоле (10 мл) добавляли фенилметантиол (683 мг), N,N-диизопропилэтиламин (1,56 г), трис-(дибензилиденацетон)дипалладий(0) (202 мг) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (256 мг) и перемешивали смесь при 80 С в течение 26 ч в атмосфере аргона. Реакционную смесь фильтровали через силикагель и концентрировали фильтрат в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на силикагеле (элю- 17019741 ент: гексангексан/этилацетат = 19/1) с получением указанного в заголовке соединения в виде оранжевого масла (выход 454 мг, 38%). 1H-ЯМР (CDCl3) : 3,79 (3 Н, с), 4,43 (2 Н, с), 6,57 (1 Н, дд, J=5,9, 2,5 Гц), 6,68 (1 Н, д, J=2,3 Гц), 7,197,34 (3 Н, м), 7,36-7,44 (2 Н, м), 8,27 (1 Н, д, J=5,7 Гц). Справочный пример 13. трет-Бутил (4-фтор-5-(2-фторпиридин-3-ил)-1-[(4-метоксипиридин-2 ил)сульфонил]-1 Н-пиррол-3-илметил)метилкарбамат. К раствору 2-(бензилсульфанил)-4-метоксипиридина (453 мг) в уксусной кислоте (4 мл) и воде (2 мл) при охлаждении на льду добавляли N-хлорсукцинимид (1,10 г), постепенно нагревали до комнатной температуры и перемешивали смесь в течение 5 ч. Реакционную смесь концентрировали в условиях пониженного давления, разбавляли водой и дважды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: гексан/этилацетат = 3/11/1) с получением неочищенного 4 метоксипиридин-2-сульфонилхлорида в виде бледно-желтого масла. Затем к суспензии гидрида натрия(60% в масле, 30 мг) в тетрагидрофуране (2,5 мл) при комнатной температуре добавляли трет-бутил [4 фтор-5-(2-фторпиридин-3-ил)-1 Н-пиррол-3-ил]метилметилкарбамат (162 мг), 15-краун-5 (165 мг) и раствор полученного ранее неочищенного 4-метоксипиридин-2-сульфонилхлорида в тетрагидрофуране (2 мл) и перемешивали смесь в течение 18 ч. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Разделенный водный слой снова экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления. Остаток очищали по методу колоночной хроматографии на силикагеле (элюент: гексан/этилацетат = 17/31/1) с получением указанного в заголовке соединения в виде бесцветного масла (выход 96 мг, выход в 2 этапа 9%). 1 Н-ЯМР (CDCl3) : 1,47 (9 Н, с), 2,87 (3 Н, с), 3,84 (3 Н, с), 4,27 (2 Н, ушир.с), 6,94 (1 Н, дд, J=5,6, 2,4 Гц), 7,07 (1 Н, д, J=2,4 Гц), 7,28 (1 Н, дд, J=5,3, 2,1 Гц), 7,31 (1 Н, д, J=5,7 Гц), 7,87 (1 Н, ддд, J=9,2, 7,5, 1,8 Гц), 8,26 (1 Н, д, J=4,7 Гц), 8,39 (1 Н, д, J=5,7 Гц). Пример 1. 1-4-Фтор-5-(2-фторпиридин-3-ил)-1-[(4-метилпиридин-2-ил)сульфонил]-1 Н-пиррол-3 ил-N-метилметанамин гидрохлорид. К раствору трет-бутил (4-фтор-5-(2-фторпиридин-3-ил)-1-[(4-метилпиридин-2-ил)сульфонил]-1 Нпиррол-3-илметил)метилкарбамата (333 мг) в этилацетате (2 мл) и 2-пропаноле (1 мл) добавляли 4 M раствор хлороводорода в этилацетате (3 мл) и перемешивали смесь при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали в условиях пониженного давления и перекристаллизовывали остаток из этилацетата/этанола с получением указанного в заголовке соединения в виде белого твердого вещества (выход 191 мг, 66%). 1(1 Н, с), 7,59-7,66 (1 Н, м), 7,77-7,90 (2 Н, м), 8,33-8,40 (1 Н, м), 8,55 (1 Н, д, J=4,9 Гц), 9,11 (2 Н, ушир.с). Пример 2. 1-4-Фтор-5-(2-фторпиридин-3-ил)-1-[(4-метоксипиридин-2-ил)сульфонил]-1 Н-пиррол-3 ил-N-метилметанамин гидрохлорид. К раствору трет-бутил (4-фтор-5-(2-фторпиридин-3-ил)-1-[(4-метоксипиридин-2-ил)сульфонил]1 Н-пиррол-3-илметил)метилкарбамата (94 мг) в этилацетате (2 мл) и 2-пропаноле (1 мл) добавляли 4 М раствор хлороводорода в этилацетате (2 мл) и перемешивали смесь при комнатной температуре в течение 4 ч. Реакционную смесь концентрировали в условиях пониженного давления и перекристаллизовывали остаток из этилацетата/этанола с получением указанного в заголовке соединения в виде белого твердого вещества (выход 65 мг, 79%). 1(4-Фтор-5-(2-фторпиридин-3-ил)-1-[(4-метилпиридин-2-ил)сульфонил]-1 Н-пиррол-3-илметил)метилкарбамат гидрохлорид (751 мг) растворяли в насыщенном водном гидрокарбонате натрия и дважды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали в условиях пониженного давления с получением указанного в заголовке соединения в виде бледно-желтого масла (выход 647 мг, 95%). 1H-ЯМР (CDC13) : 2,38 (3 Н, с), 2,45 (3 Н, с), 3,64 (2 Н, с), 7,23-7,30 (2 Н, м), 7,33 (1 Н, д, J=5,7 Гц),7,36 (1 Н, с), 7,88 (1 Н, ддд, J=9,3, 7,4, 1,9 Гц), 8,22-8,29 (1 Н, м), 8,45 (1 Н, д, J=4,5 Гц), 1 Н не обнаружено. Пример 4. 1-4-Фтор-5-(2-фторпиридин-3-ил)-1-[(4-метилпиридин-2-ил)сульфонил]-1 Н-пиррол-3 ил-N-метилметанамин фумарат. К раствору фумаровой кислоты (58 мг) в этаноле (2 мл) добавляли раствор 1-4-фтор-5-(2 фторпиридин-3-ил)-1-[(4-метилпиридин-2-ил)сульфонил]-1 Н-пиррол-3-ил-N-метилметанамина (189 мг) в этилацетате (2 мл) и концентрировали смесь в условиях пониженного давления. Остаток перекристал- 18019741 лизовывали из этанола с получением указанного в заголовке соединения в виде белого твердого вещества (выход 224 мг, 91%). 1H-ЯМР (DMSO-d6) : 2,35-2,40 (6 Н, м), 3,73 (2 Н, с), 6,53 (2 Н, с), 7,44 (1 Н, ддд, J=7,3, 5,1, 1,8 Гц),7,49-7,55 (2 Н, м), 7,59 (1 Н, д, J=4,9 Гц), 7,86 (1 Н, ддд, J=9,5, 7,4, 1,9 Гц), 8,27-8,39 (1 Н, м), 8,54 (1 Н, д,J=4,9 Гц), 3 Н не обнаружено. Пример 5. 1-4-Фтор-5-(2-фторпиридин-3-ил)-1-[(4-метилпиридин-2-ил)сульфонил]-1 Н-пиррол-3 ил-N-метилметанамин сукцинат. К раствору янтарной кислоты (59 мг) в этаноле (2 мл) добавляли раствор 1-4-фтор-5-(2 фторпиридин-3-ил)-1-[(4-метилпиридин-2-ил)сульфонил]-1 Н-пиррол-3-ил-N-метилметанамина (189 мг) в этилацетате (2 мл) и концентрировали смесь в условиях пониженного давления. Остаток перекристаллизовывали из этанола/воды с получением указанного в заголовке соединения в виде белого твердого вещества (выход 232 мг, 93%). 1 Структурные формулы соединений справочных примеров 1-4. Таблица 2 Другие структурные формулы соединений справочных примеров 9, 10, 12. Экспериментальный пример 1. Тест на ингибирующую активность в отношении водороднокалиевой аденозинтрифосфатазы (Н+, K+-АТФазы). В соответствии со способом по Wallmark et al., Biochim. Biophys. Acta, 728, 31 (1983) микросомальную фракцию слизистой оболочки желудка получали из желудка свиньи. Вначале желудок удаляли,промывали водопроводной водой, погружали в 3 моль/л соляной раствор и обтирали поверхность слизистой оболочки бумажным полотенцем. Слизистую оболочку желудка отделяли, измельчали и гомогенизировали в 0,25 моль/л растворе сахарозы (рН 6,8), содержащем 1 ммоль/л EDTA и 10 ммоль/л триссоляной кислоты, с использованием Polytron (Kinematica). Полученный гомогенат центрифугировали при 20000g в течение 30 мин и центрифугировали надосадочную жидкость при 100000g в течение 90 мин. Осадок суспендировали в 0,25 моль/л растворе сахарозы, наслаивали на 0,25 моль/л раствор сахарозы,содержащий 7,5% Ficoll, и центрифугировали при 100000g в течение 5 ч. Фракцию, содержащую границу раздела двух слоев, извлекали и промывали путем центрифугирования с 0,25 моль/л раствором сахарозы. Полученную микросомальную фракцию использовали в качестве стандарта для водороднокалиевой аденозинтрифосфатазы. К 40 мкл 50 ммоль/л HEPES-трис буфера (5 ммоль/л хлорида магния, 10 ммоль/л хлорида калия, 10 мкмоль/л валиномицина, рН 6,5), содержащего 2,5 мкг/мл (исходя из концентрации белка) стандарта для фермента, добавляли тестируемое соединение (5 мкл), растворенное в 10% водном растворе диметилсульфоксида, и инкубировали смесь при 37 С в течение 30 мин. Ферментативную реакцию инициировали добавлением 5 мкл 2 ммоль/л аденозинтрифосфата в трис-солевом растворе (50 ммоль/л HEPES-трис буфера (5 ммоль/л хлорида магния, рН 6,5. Ферментативную реакцию проводили при 37 С в течение 20 мин и добавляли 15 мкл раствора малахитового зеленого (0,12% раствор малахитового зеленого в серной кислоте (2,5 моль/л), 7,5% молибдат аммония и 11% Tween 20 смешивали в соотношении 100/25/2) для гашения реакции. После отстаивания при комнатной температуре в течение 15 мин получившийся продукт взаимодействия неорганического фосфора с малахитовым зеленым определяли колориметрически при длине волны 620 нм. Кроме того, тем же способом измеряли количество неорганической фосфорной кислоты в реакционном растворе без хлорида калия, которое вычитали из количества неорганической фосфорной кислоты в присутствии хлорида калия для определения активности водородно-калиевой аденозинтрифосфатазы. Степень ингибирования (%) определяли из значения активности в контроле и значений активности для различных концентраций тестируемого соединения и определяли полумаксимальную ингибирующую концентрацию (IC50) для водородно-калиевой аденозинтрифосфатазы. Результаты представлены в табл. 4. Экспериментальный пример 2. Величины pKa рассчитывали с использованием Physchem Batch (Ver. 10) (Advanced Chemistry Development, Inc.). Результаты представлены в табл. 4. Экспериментальный пример 3. Тест на содержание АТФ. Клеточную линию HepG2 из рака печени человека (АТСС No. НВ-8065) пересевали с использова- 20019741 нием модифицированной по Дульбекко среды Игла (DMEM; Invitrogen), содержащей 10% эмбриональной бычьей сыворотки (FBS; TRACE SCIENTIFIC LTD.), 1 ммоль/л пирувата натрия (Invitrogen), 2 ммоль/л L-глутамина (Invitrogen), 50 МЕ/мл пенициллина (Invitrogen) и 50 мкг/мл стрептомицина (Invitrogen), при 5% СО 2, 37 С. Тестируемое соединение приготавливали в DMSO в концентрации 10 мМ и дополнительно разбавляли средой DMEM, содержащей 0,5% FBS, 1 ммоль/л пирувата натрия, 2 ммоль/лL-глутамина, 50 МЕ/мл пенициллина и 50 мкг/мл стрептомицина, до конечной концентрации DMSO 0,1%. HepG2 (2104 клеток/лунка) выращивали в 96-луночном белом планшете (Costar) с исследуемым соединением при 5% CO2, 37 С. После выращивания в течение одних суток измеряли внутриклеточное содержание АТФ с использованием ATPLite (PerkinElmer Life Sciences). Результаты представлены в табл. 4 (n3, среднее значениестандартное отклонение) в виде относительной величины (%) по отношению к контролю (без добавления лекарственного средства). Экспериментальный пример 4. Тест на активность каспазы-3/7. Активность каспазы-3/7 в клетках, выращиваемых в течение одних суток способом, аналогичным описанному в экспериментальном примере 3, измеряли с использованием Caspase-Glo 3/7 Assay(Promega). Результаты представлены в табл. 4 (n3, среднее значениестандартное отклонение) в виде относительной активности (%) каждого из реагентов, исходя из максимального значения активности каспазы-3/7 под действием Стауроспорина (100%) и активности без добавления тестируемого соединения(0%). Экспериментальный пример 5. Измерение рН перфузата в реперфузионной модели анестезированного желудка крысы. Самцов крыс Jcl:SD (в возрасте 8-недель) не кормили приблизительно в течение 24 ч и использовали в эксперименте. Тестируемые соединения растворяли в растворе DMAA/PEG400=1/1 до дозы 1 мл/кг. Под анестезией уретаном (1,2 г/кг, интраперитонеально) вводили катетеры из двенадцатиперстной кишки и кардиального отдела желудка в желудок, перевязывали пищевод и проводили реперфузию желудка физиологическим раствором (0,5 мл/мин). В перфузате непрерывно измеряли рН с использованием стеклянных электродов микропотокового типа (6961-15 С и 2461 А-15 Т, HORIBA). Дигидрохлорид гистамина(8 мг/кг/ч) непрерывно вводили путем внутривенного вливания в течение 1 ч или дольше. После стабилизации рН внутривенно вводили тестируемое соединение. Значение рН перфузата измеряли в течение 5 ч после введения тестируемого соединения. Результаты представлены на фиг. 1 и 2. Таблица 4 Из представленных в табл. 4 результатов ясно, что соединение (I) по настоящему изобретению обладает лучшей ингибирующей активностью в отношении Н+/K+-АТФазы и низким значением pKa, а также чрезвычайно низкой цитотоксичностью даже при использовании в высокой концентрации. Кроме того, из представленных на фиг. 1 и 2 результатов ясно, что соединение (I) обладает средней продолжительностью действия. Промышленная применимость Соединение (I) по настоящему изобретению проявляет лучший эффект ингибирования протонной помпы. Традиционные ингибиторы протонной помпы, такие как омепразол, лансопразол и т.п., преобразуются в активные формы в кислой среде париетальных клеток желудка, образуют ковалентную связь с цистеиновым остатком Н+/K+-АТФазы и необратимо ингибируют активность фермента. В отличие от них соединение (I) ингибирует активность протонной помпы (Н+/K+-АТФазы) обратимым и конкурентным по отношению к K+ способом и, следовательно, подавляет секрецию кислоты. Поэтому его иногда называют калий-конкурентным блокатором кислоты (Р-САВ) или антагонистом кислотной помпы (АРА). Соединение (I) быстро оказывает действие и проявляет максимальную эффективность после первоначального приема. Кроме того, его метаболизм в меньшей мере зависит от метаболического полиморфизма, а разброс эффективности среди пациентов невелик. Кроме того, было обнаружено, что соединение (I) сконструировано так, что имеет характеристическую химическую структуру, которая способствует высокой ингибирующей активности в отношении протонной помпы и существенно снижает цитотоксичность. Кроме того, оно характеризуется тем, что замещение по 4-положению пиррольного кольца соединения(I) атомом фтора снижает основность (величину pKa) метиламинометильного фрагмента вследствие электроноакцепторного эффекта атома фтора и снижает риск проявления токсичности, проистекающей из сильной основности, и что введение по меньшей мере одного заместителя в пиридильную группу со- 21019741 единения (I) оптимально регулирует продолжительность действия. Таким образом, данное изобретение может предоставить клинически применимое средство для профилактики или лечения пептической язвы(например, язвы желудка, язвы двенадцатиперстной кишки, анастомотической язвы, язвы, вызванной нестероидным противовоспалительным лекарственным средством, язвы вследствие послеоперационного стресса и т.д.), синдрома Золлингера-Эллисона, гастрита, эрозивного эзофагита, рефлюкс-эзофагита,симптоматической гастроэзофагеальной рефлюксной болезни (симптоматическая ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка или повышенной кислотности; или средство подавления кровотечения из верхних отделов желудочно-кишечного тракта вследствие пептической язвы, острой стрессовой язвы, геморрагического гастрита или инвазивного стресса и т.п. Поскольку соединение (I) характеризуется низкой токсичностью и лучшей растворимостью в воде, кинетикой in vivo и эффективностью, оно является полезным фармацевтическим препаратом. Поскольку соединение (I) стабильно даже в кислых условиях, оно может вводиться перорально в виде классической таблетки и т.п., без включения его в состав кишечно-растворимого препарата. Полезным следствием этого является то, что препарат (таблетка и т.п.) может быть сделан меньшего размера и может легко проглатываться пациентами с нарушениями глотания, особенно пожилыми людьми и детьми. Кроме этого,поскольку он лишен эффекта замедленного высвобождения, обеспечиваемого кишечно-растворимыми препаратами, начало подавления секреции кислоты желудочного сока происходит быстро, а симптомы,такие как боль и т.п., могут быть быстро частично сняты. Хотя некоторые варианты осуществления настоящего изобретения были подробно описаны выше,специалистам в данной области техники, тем не менее, очевидно, что в представленные конкретные варианты осуществления могут быть внесены различные усовершенствования и изменения без отступления, по существу, от новых идей и преимуществ настоящего изобретения. Такие усовершенствования и изменения охватываются сущностью и объемом настоящего изобретения, изложенными в прилагаемой формуле изобретения. Настоящее изобретение основано на зарегистрированных в Японии заявках на выдачу патента 2008-218851 и 2008-269099, полное содержание которых включено в этот документ посредством ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное формулой (I) в которой R2 представляет собой С 1-6 алкильную группу или С 1-6 алкоксигруппу, или его фармацевтически приемлемая соль. 2. 1-4-Фтор-5-(2-фторпиридин-3-ил)-1-[(4-метилпиридин-2-ил)сульфонил]-1 Н-пиррол-3-ил-Nметилметанамин или его фармацевтически приемлемая соль. 3. 1-4-Фтор-5-(2-фторпиридин-3-ил)-1-[(4-метоксипиридин-2-ил)сульфонил]-1 Н-пиррол-3-ил-Nметилметанамин или его фармацевтически приемлемая соль. 4. Фармацевтическая композиция, содержащая соединение по п.1 или его фармацевтически приемлемую соль, причем композиция представляет собой средство для профилактики или лечения пептической язвы, синдрома Золлингера-Эллисона, гастрита, рефлюкс-эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматическая ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка или язвы, вызванной нестероидным противовоспалительным лекарственным средством, повышенной кислотности или язвы вследствие послеоперационного стресса; или ингибитора кровотечения из верхних отделов желудочно-кишечного тракта вследствие пептической язвы, острой стрессовой язвы, геморрагического гастрита или инвазивного стресса. 5. Способ лечения или предотвращения пептической язвы, синдрома Золлингера-Эллисона, гастрита, рефлюкс-эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматическая ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка или язвы, вызванной нестероидным противовоспалительным лекарственным средством, повышенной кислотности или язвы вследствие послеоперационного стресса или способ ингибирования кровотечения из верхних отделов желудочно-кишечного тракта вследствие пептической язвы, острой стрессовой язвы,геморрагического гастрита или инвазивного стресса, который включает введение млекопитающему эффективного количества соединения по п.1 или его фармацевтически приемлемой соли. 6. Применение соединения по п.1 или его фармацевтически приемлемой соли для получения средства для профилактики или лечения пептической язвы, синдрома Золлингера-Эллисона, гастрита, реф- 22019741 люкс-эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматическая ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка или язвы, вызванной нестероидным противовоспалительным лекарственным средством, повышенной кислотности или язвы вследствие послеоперационного стресса или ингибитора кровотечения из верхних отделов желудочно-кишечного тракта вследствие пептической язвы, острой стрессовой язвы, геморрагического гастрита или инвазивного стресса.
МПК / Метки
МПК: A61K 31/444, C07D 401/14
Метки: соединения, пиррольные
Код ссылки
<a href="https://eas.patents.su/24-19741-pirrolnye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Пиррольные соединения</a>
Предыдущий патент: 4-циано-3-бензоиламино-n-фенилбензамиды для использования в борьбе с вредителями
Следующий патент: Карбаматные производные алкилгетероциклов, их получение и их применение в терапии
Случайный патент: Новые соли и полиморфные формы афатиниба












