Новые полиморфные формы дигидрофосфата 6-(1-метил-1h-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2h-пиридазин-3-она и способы их получения
Номер патента: 19320
Опубликовано: 28.02.2014
Авторы: Кригбаум Эва, Штибер Франк, Беккер Аксель, Дорш Дитер, Кюн Клеменс, Заал Кристоф, Шадт Оливер, Донини Кристина
Формула / Реферат
1. Кристаллический сольват дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она.
2. Кристаллический ангидрат дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она.
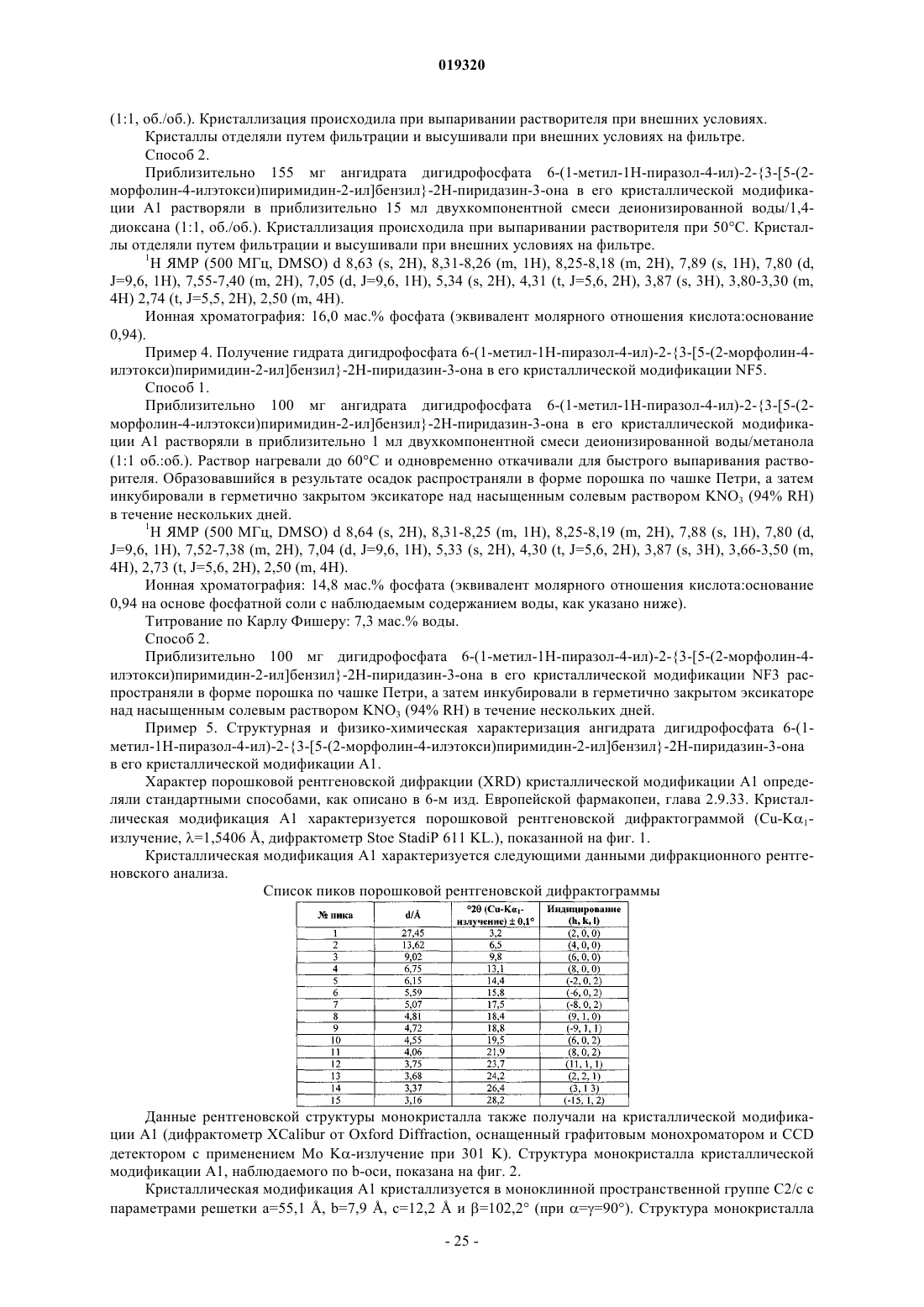
3. Соединение по п.2 в его кристаллической модификации А1, отличающееся тем, что характеризуется пиками при дифракционном рентгеновском анализе, включающими 3,2, 6,5, 9,8 и 13,1° 2θ (все ±0,1° 2θ, с применением Cu-Kα1-излучения).
4. Соединение по п.2 в его кристаллической модификации А1, отличающееся тем, что характеризуется пиками при дифракционном рентгеновском анализе, включающими 18,4, 18,8, 23,7, 24,2, 26,4 и 28,2° 2θ (все ± 0,1° 2θ, с применением Cu-Kα1-излучения).
5. Соединение по п.2 в его кристаллической модификации А1, отличающееся тем, что характеризуется пиками при дифракционном рентгеновском анализе, включающими 14,4, 15,8, 17,5, 19,5 и 21,9 2θ (все ±0,1° 2θ, с применением Cu-Kα1-излучения).
6. Соединение по любому из пп.2-5 в его кристаллической модификации А1, отличающееся тем, что характеризуется следующими данными дифракционного рентгеновского анализа:
Форма А1
7. Соединение по п.1, характеризуемое тем, что оно представляет собой кристаллический гидрат дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-он.
8. Соединение по п.7, характеризуемое тем, что оно представляет собой кристаллический дигидрат дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она.
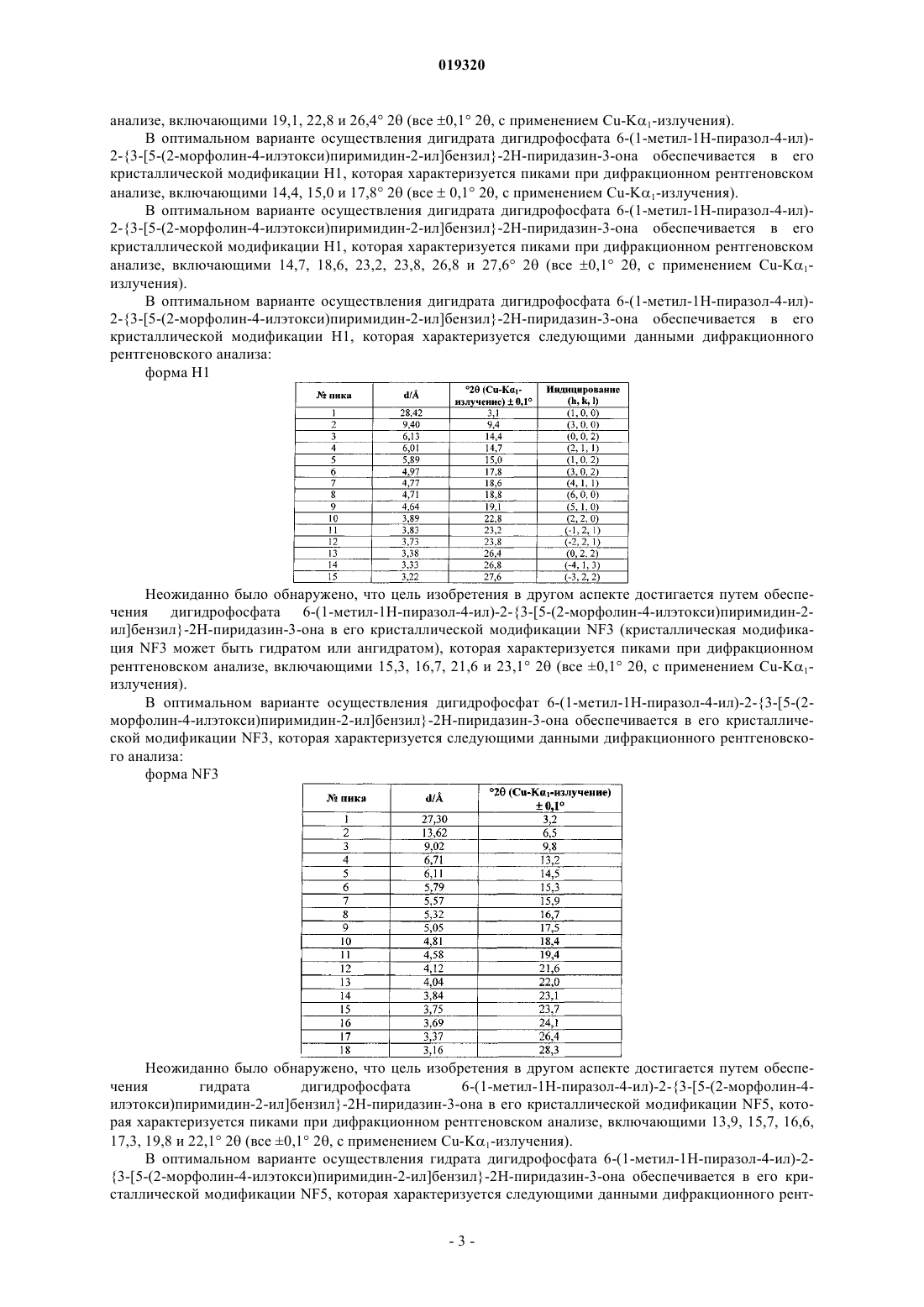
9. Соединение по п.8 в его кристаллической модификации H1, отличающееся тем, что характеризуется пиками при дифракционном рентгеновском анализе, включающими 3,1, 9,4 и 18,8° 2θ (все ± 0,1° 2θ, с применением Cu-Kα1-излучения).
10. Соединение по п.8 в его кристаллической модификации H1, отличающееся тем, что характеризуется пиками при дифракционном рентгеновском анализе, включающими 19,1, 22,8 и 26,4° 2θ (все ± 0,1° 2θ, с применением Cu-Kα1-излучения).
11. Соединение по п.8 в его кристаллической модификации H1, отличающееся тем, что характеризуется пиками при дифракционном рентгеновском анализе, включающими 14,4, 15,0 и 17,8° 2θ (все ± 0,1° 2θ, с применением Cu-Kα1-излучения).
12. Соединение по п.8 в его кристаллической модификации H1, отличающееся тем, что характеризуется пиками при дифракционном рентгеновском анализе, включающими 14,7, 18,6, 23,2, 23,8, 26,8 и 27,6° 2θ (все ± 0,1° 2θ, с применением Cu-Kα1-излучения).
13. Соединение по любому из пп.8-12 в его кристаллической модификации H1, отличающееся тем, что характеризуется следующими данными дифракционного рентгеновского анализа:
Форма H1
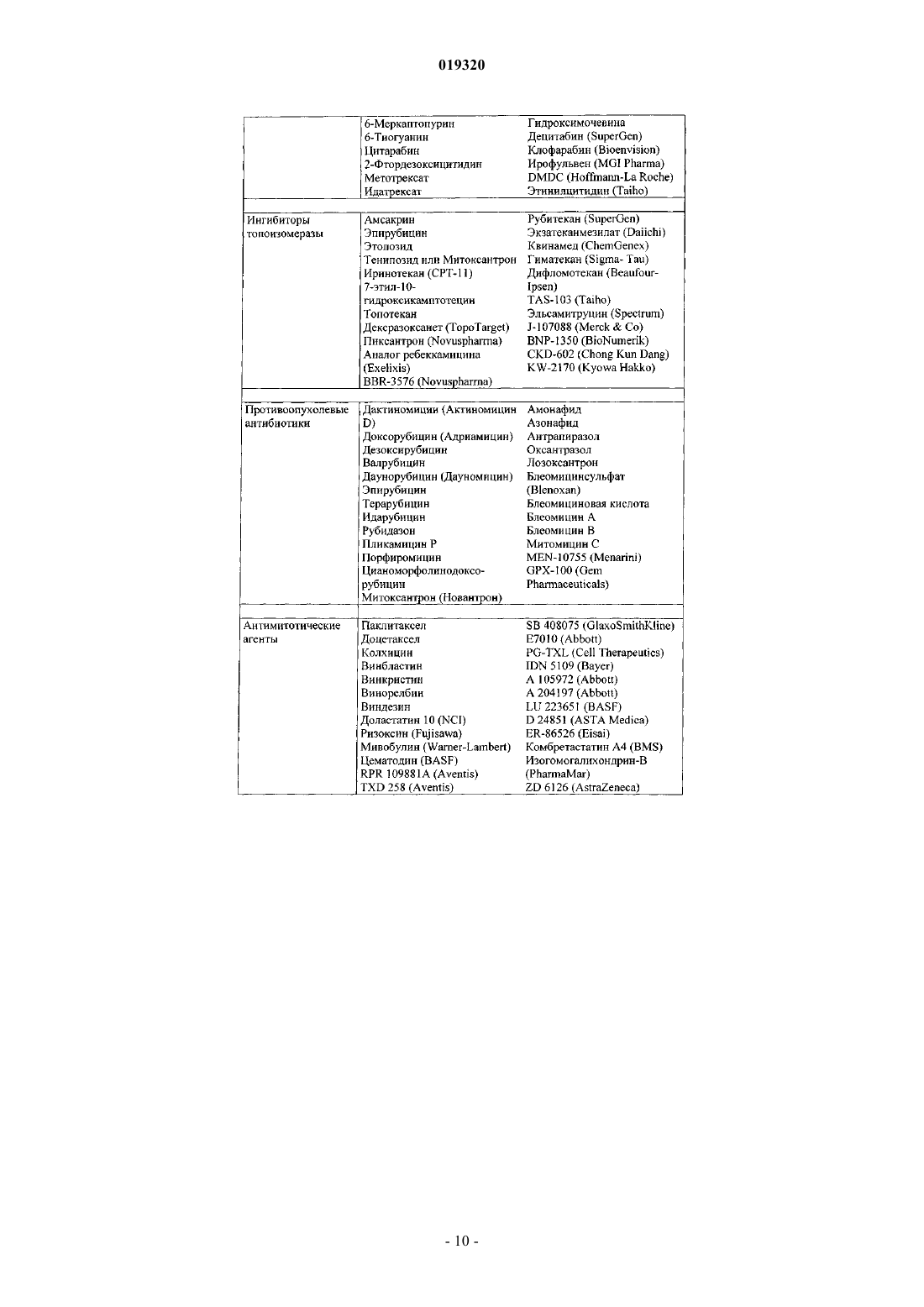
14. Дигидрофосфат 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она в его кристаллической модификации NF3, характеризующийся пиками при дифракционном рентгеновском анализе, включающими 15,3, 16,7, 21,6 и 23,1° 2θ (все ± 0,1° 2θ, с применением Cu-Kα1-излучения).
15. Соединение по п.14 в его кристаллической модификации NF3, отличающееся тем, что характеризуется следующими данными дифракционного рентгеновского анализа:
Форма NF3
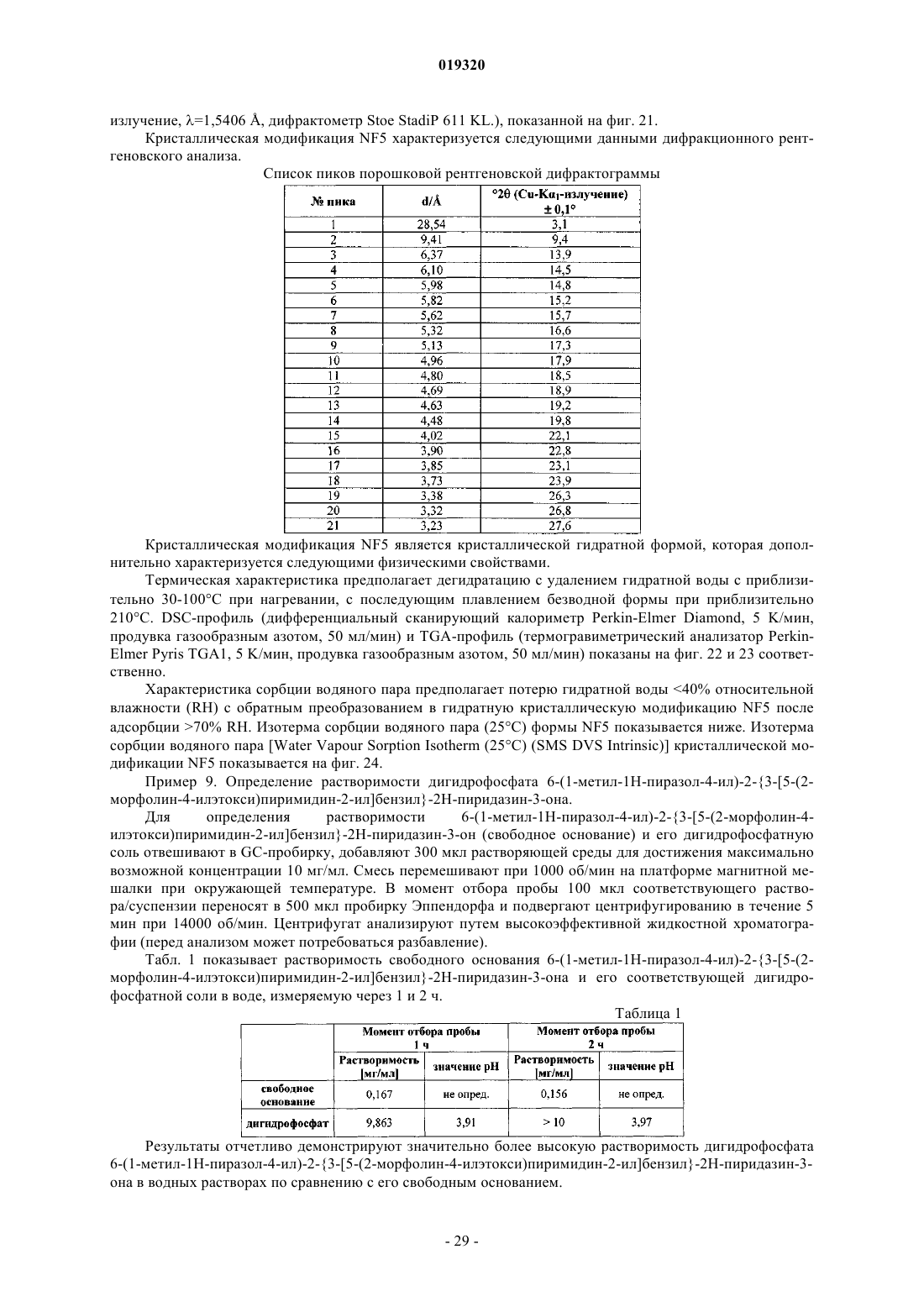
16. Соединение по п.7 в его кристаллической модификации NF5, отличающееся тем, что характеризуется пиками при дифракционном рентгеновском анализе, включающими 13,9, 15,7, 16,6, 17,3, 19,8 и 22,1° 2θ (все ± 0,1° 2θ, с применением Cu-Kα1-излучения).
17. Соединение по п.16 в его кристаллической модификации NF5, отличающееся тем, что характеризуется следующими данными дифракционного рентгеновского анализа:
Форма NF5
18. Фармацевтическая композиция, включающая терапевтически эффективное количество как минимум одного соединения по любому из пп.1-17.
19. Фармацевтическая композиция по п.18, отличающаяся тем, что также включает как минимум одно дополнительное соединение, выбранное из группы, к которой относятся физиологически приемлемые формообразующие, вспомогательные вещества, адъюванты, разбавители, носители и/или дополнительные фармацевтически активные вещества, отличные от соединений по любому из пп.1-17.
20. Медикамент, включающий как минимум одно соединение по любому из пп.1-17 или фармацевтическую композицию по любому из пп.18, 19.
21. Медикамент по п.20 для применения в лечении и/или профилактике физиологических или патофизиологических состояний, вызываемых, опосредованных и/или распространяемых ингибированием, регулированием и/или модулированием трансдукции сигнала киназ, в частности ингибированием тирозинкиназ, преимущественно Met-киназы.
22. Медикамент по п.20 для применения в лечении и/или профилактике физиологических или патофизиологических состояний, выбранных из группы, к которой относятся рак, опухоль, злокачественные опухоли, доброкачественные опухоли, плотные опухоли, саркомы, карциномы, гиперпролиферативные нарушения, карциноиды, саркомы Юинга, саркомы Капоши, опухоли головного мозга, опухоли, возникающие в головном мозге, и/или нервной системе, и/или оболочке головного мозга, глиомы, глиобластомы, нейробластомы, рак желудка, рак почек, карциномы клеток почек, рак предстательной железы, карциномы предстательной железы, опухоли соединительных тканей, саркомы мягких тканей, опухоли поджелудочной железы, опухоли печени, опухоли головы, опухоли шеи, рак гортани, рак пищевода, рак щитовидной железы, остеосаркомы, ретинобластомы, тимома, рак яичка, рак легких, аденокарцинома легких, мелкоклеточная карцинома легкого, бронхиальные карциномы, рак молочной железы, карциномы грудной железы, рак кишечника, колоректальные опухоли, карциномы толстой кишки, карциномы прямой кишки, гинекологические опухоли, опухоли яичников/овариальные опухоли, рак матки, рак шейки матки, карциномы шейки матки, рак тела матки, карциномы тела, карциномы эндометрия, рак мочевого пузыря, рак мочеполового тракта, рак кожи, эпителиальные опухоли, сквамозная эпителиальная карцинома, базалиомы, спиналиомы, меланомы, внутриглазные меланомы, лейкемии, моноцитарная лейкемия, хронические лейкемии, хроническая миелотическая лейкемия, хроническая лимфатическая лейкемия, острые лейкемии, острая миелотическая лейкемия, острая лимфатическая лейкемия и/или лимфомы.
23. Медикамент по любому из пп.20-22, отличающийся тем, что такой медикамент включает как минимум одно дополнительное фармакологически активное вещество.
24. Медикамент по любому из пп.20-22, отличающийся тем, что медикамент применяется до и/или во время и/или после лечения как минимум одним дополнительным фармакологически активным веществом.
25. Комплект, включающий терапевтически эффективное количество как минимум одного соединения по любому из пп.1-17 и/или как минимум одну фармацевтическую композицию по любому из пп.18, 19 и терапевтически эффективное количество как минимум еще одного фармакологически активного вещества, отличного от соединений по любому из пп.1-17.
26. Способ получения кристаллической модификации А1 по любому из пп.3-6, который включает следующие этапы:
(a) растворение или диспергирование 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она (свободного основания) или его одной или нескольких солей в растворителе или смеси растворителей, необязательно при перемешивании;
(b) преобразование 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она (свободного основания) или его одной или нескольких солей в соответствующую дигидрофосфатную соль путем добавления водного или этанольного раствора фосфорной кислоты, необязательно при перемешивании;
(c) перемешивание образовавшейся в результате дисперсии с этапа (b) при комнатной температуре на протяжении одного или нескольких часов или дней;
(d) отделение осажденного ангидрата дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она путем фильтрации, необязательно с последующим промыванием растворителем или смесью растворителей, с необязательной последующей сушкой, необязательно при повышенной температуре Т.
27. Способ получения кристаллической модификации А1 по любому из пп.3-6, который включает следующие этапы:
(a) диспергирование 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она (свободного основания) или его одной или нескольких солей в растворителе или смеси растворителей и добавление водного раствора фосфорной кислоты, необязательно при перемешивании;
(b) нагревание образовавшейся в результате дисперсии с этапа (а) до повышенной температуры Т1, необязательно при перемешивании, и охлаждение образовавшегося в результате раствора, необязательно при перемешивании, перед его разбавлением растворителем или смесью растворителей, необязательно при перемешивании;
(c) перемешивание образовавшейся в результате дисперсии с этапа (b) при температуре от 0 до 40°С до завершения кристаллизации и/или инкубация при комнатной температуре на протяжении одного или нескольких часов или дней, необязательно при перемешивании;
(d) отделение осажденного ангидрата дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она путем фильтрации, необязательно охлаждение образовавшейся в результате дисперсии с этапа (с) до температуры от 0 до 20°С перед фильтрацией, необязательно при перемешивании, необязательно с последующим промыванием растворителем или смесью растворителей, с необязательной последующей сушкой, необязательно при повышенной температуре Т2;
(е) необязательно кипячение образовавшихся в результате высушенных кристаллов с этапа (d) в растворителе или смеси растворителей в форме дисперсии в течение одной или нескольких минут и их отделение путем фильтрации из горячей дисперсии.
28. Способ получения кристаллической модификации А1 по любому из пп.3-6, который включает следующие этапы:
(a) диспергирование 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-он (свободное основание) или его одной или нескольких солей в смеси растворителей и добавление водного раствора фосфорной кислоты, необязательно при перемешивании;
(b) нагревание образовавшейся в результате дисперсии с этапа (а) до повышенной температуры Т1, необязательно при перемешивании, и охлаждение образовавшегося в результате раствора, необязательно при перемешивании, с определенной скоростью охлаждения, необязательно при перемешивании, до наступления кристаллизации;
(c) дальнейшее охлаждение образовавшейся в результате дисперсии с этапа (b), необязательно при перемешивании, с определенной скоростью охлаждения, необязательно при перемешивании;
(d) перемешивание образовавшейся в результате дисперсии с этапа (с) при температуре от -20 до 40°С до завершения кристаллизации;
(e) отделение кристаллизованного ангидрата дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она путем фильтрации, необязательно с последующим промыванием растворителем или смесью растворителей, с необязательной последующей сушкой, необязательно при повышенной температуре Т2.
29. Способ получения кристаллической модификации H1 по любому из пп.9-13, который включает следующие этапы:
(а) распространение ангидрата дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она кристаллической модификации А1 по поверхности и последующая его инкубация в герметично закрытом эксикаторе над водой или смесью водных растворителей на протяжении одного или нескольких дней или недель.
30. Способ получения кристаллической модификации H1 по любому из пп.9-13, который включает следующие этапы:
(a) диспергирование ангидрата дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она кристаллической модификации А1 в смеси двух или более растворителей, необязательно при перемешивании, и перемешивание образовавшейся в результате дисперсии при повышенной температуре Т1 на протяжении одного или нескольких дней или недель;
(b) отделение осажденного дигидрата дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она путем фильтрации, необязательно с последующим промыванием растворителем или смесью растворителей, с необязательной последующей сушкой, необязательно при повышенной температуре Т2.
31. Способ получения кристаллической модификации NF3 по любому из пп.14, 15, который включает следующие этапы:
(a) диспергирование или растворение ангидрата дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она кристаллической модификации А1 в смеси двух или более растворителей, необязательно при перемешивании, и последующее выпаривание смеси двух или более растворителей при комнатной температуре или повышенной температуре Т1 до наступления кристаллизации;
(b) отделение осажденного гидрата дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она путем фильтрации, необязательно с последующим промыванием растворителем или смесью растворителей, с необязательной последующей сушкой, необязательно при повышенной температуре Т2.
32. Способ получения кристаллической модификации NF5 по любому из пп.16, 17, который включает следующие этапы:
(а) растворение ангидрата дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она кристаллической модификации А1 в двухкомпонентной смеси растворителей и быстрое выпаривание смеси растворителей при повышенной температуре в вакууме до получения осадка;
(b) необязательно дополнительное распространение осадка, полученного на этапе (а), в форме порошка по поверхности и последующая его инкубация в герметично закрытом эксикаторе над водой или водными солевыми растворами с определенной относительной влажностью (RH) на протяжении одного или нескольких дней или недель.
33. Способ получения кристаллической модификации NF5 по любому из пп.16, 17, который включает следующий этап:
(а) распространение дигидрофосфата 6-(1-метил-1Н-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2Н-пиридазин-3-она кристаллической формы NF3 в форме порошка по поверхности и последующая его инкубация в герметично закрытом эксикаторе над водой или водными солевыми растворами с определенной относительной влажностью (RH) на протяжении одного или нескольких дней или недель.
Текст
НОВЫЕ ПОЛИМОРФНЫЕ ФОРМЫ ДИГИДРОФОСФАТА 6-(1-МЕТИЛ-1HПИРАЗОЛ-4-ИЛ)-2-3-[5-(2-МОРФОЛИН-4-ИЛЭТОКСИ)ПИРИМИДИН-2 ИЛ]БЕНЗИЛ-2H-ПИРИДАЗИН-3-ОНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ Изобретение касается дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, его сольватов и кристаллических модификаций. Изобретение также касается способов получения этих кристаллических модификаций, а также их применения в лечении и/или профилактике физиологических или патофизиологических состояний, вызываемых, опосредованных и/или распространяемых ингибированием, регулированием и/или модулированием трансдукции сигнала киназ, в частности ингибированием тирозинкиназ, например патофизиологических состояний, таких как рак.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) Область изобретения Настоящее изобретение касается дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, его сольватов и кристаллических модификаций, а также их применения в медицине и способов получения. Уровень техники 6-(1-Метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Нпиридазин-3-он (I) впервые был описан в международных патентных заявках РСТ/ЕР 2008/003473, поданной 29 апреля 2008 г., и РСТ/ЕР 2008/005508, поданной 4 июля 2008 г. В заявке РСТ/ЕР 2008/003473 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-он указывается как соединение "А 229". В примере 38 из заявки РСТ/ЕР 2008/003473 описывается первый способ синтезирования 6-(1-метил-1 Н-пиразол-4 ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-он. Р-толуолсульфонат и фосфат упоминаются в качестве возможных солевых форм. Кроме того, в примере 39 из заявки РСТ/ЕР 2008/003473 описывается альтернативный способ синтезирования 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она. В примере 1 из заявки РСТ/ЕР 2008/005508 описывается такой же первый способ синтезирования 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, а также упоминаются ртолуолсульфонат и фосфат в качестве возможных солевых форм. Пример 2 из заявки РСТ/ЕР 2008/005508 касается сульфата, мезилата, безилата, тозилата, фумарата и малеата в качестве дополнительных солевых форм. Ни в одном из двух документов известного уровня техники не сказано о 6-(1-метил-1 Н-пиразол-4 ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она как дигидрофосфатной соли, а также не упоминаются полиморфные формы, кристаллические модификации или другие подобные соединения дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она. Определенные кристаллические, т.е. морфологические или полиморфные, формы фармацевтических соединений могут представлять интерес для тех, кто занимается разработкой приемлемых фармацевтических лекарственных форм. Дело в том, что если определенная полиморфная форма не остается неизменной во время клинических исследований и испытаний на стабильность, то точные применяемые или измеренные дозы в разных партиях могут быть несопоставимы. После того как фармацевтическое соединение было произведено для применения, необходимо проверить морфологическую или полиморфную форму, доставляемую в каждой лекарственной форме, для того, чтобы удостовериться, что процесс производства обеспечивает доставку такой же формы и каждая доза включает одинаковое количество медикамента. Таким образом, необходимо гарантировать, чтобы присутствовала каждая отдельная морфологическая или полиморфная форма или известная комбинация морфологических или полиморфных форм. Кроме того, некоторые морфологические или полиморфные формы могут демонстрировать повышенную термодинамическую устойчивость и могут быть более подходящими, чем другие морфологические или полиморфные формы, для включения в фармацевтические композиции. Ссылка на любой источник в этой заявке необязательно предполагает, что этот источник относится к релевантному уровню техники по отношению к этой заявке. Описание изобретения Цель настоящего изобретения состоит в обеспечении новых солевых форм 6-(1-метил-1 Н-пиразол 4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, а также его новых полиморфных форм. Неожиданно было обнаружено, что цель изобретения в одном аспекте достигается путем обеспечения дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она. Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения сольвата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, предпочтительно гидрата дигидрофосфата 6-(1 метил-1H-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она. Было обнаружено, что дигидрофосфат 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она способен образовывать сольваты в кристаллических модификациях. Примерами таких сольватов могут быть сольваты из воды, сольваты из спиртов,таких как метанол, этанол, пропан-1-ол или пропан-2-ол; сольваты из органических сложных эфиров,таких как этилацетат; сольваты из нитрилов, таких как ацетонитрил; сольваты из кетонов, таких как ацетон и бутанон; сольваты из эфиров, таких как тетрагидрофуран (THF), и сольваты из хлорированных уг-1 019320 леводородов, таких как хлороформ и сольваты углеводородов, таких как n-гептан или толуол. Оптимальные сольваты образуются с полярными растворителями, предпочтительно водой, спиртами, органическими сложными эфирами, нитрилами, кетонами и эфирами. Предпочтительно дигидрофосфат 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она образует ангидраты и сольваты с водой, ацетоном, тетрагидрофураном, метанолом, этилацетатом или n-гептаном в кристаллических модификациях,что означает, что связанный растворитель вместе с дигидрофосфатом 6-(1-метил-1 Н-пиразол-4-ил)-2-3[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она образуют кристаллическую структуру. Молярное отношение растворителя дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она может быть разным, как известно специалистам в данной области. Предпочтительно молярное отношение составляет от 0,25:1 до 2,5:1,более предпочтительно от 0,5:1 до 1:1, наиболее предпочтительно 1:1 (сольват с n-гептаном 1/15:1). Следует понимать, что данные ангидраты и сольваты согласно изобретению могут содержать несвязанную воду, т.е. воду, отличную от кристаллизационной воды. Следовательно, в оптимальном варианте осуществления сольват дигидрофосфата 6-(1-метил-1 Нпиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, предпочтительно(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Нпиридазин-3-он дигидрофосфат гидрат, обеспечивается в его кристаллических модификациях. Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она. В оптимальном варианте осуществления ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-23-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она обеспечивается в его кристаллической модификации А 1, которая характеризуется пиками при дифракционном рентгеновском анализе, включающими 3,2, 6,5, 9,8 и 13,1 2 (все 0,1 2, с применением Cu-K1-излучения). В оптимальном варианте осуществления ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-23-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она обеспечивается в его кристаллической модификации А 1, которая характеризуется пиками при дифракционном рентгеновском анализе, включающими 18,4, 18,8, 23,7, 24,2, 26,4 и 28,2 2 (все 0,1 2, с применением Cu-K1 излучения). В оптимальном варианте осуществления ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-23-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она обеспечивается в его кристаллической модификации А 1, которая характеризуется пиками при дифракционном рентгеновском анализе, включающими 14,4, 15,8, 17,5, 19,5 и 21,9 2 (все 0,1 2, с применением Cu-K1-излучения). В оптимальном варианте осуществления ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-23-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она обеспечивается в его кристаллической модификации А 1, которая характеризуется следующими данными дифракционного рентгеновского анализа: форма А 1 Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она. В оптимальном варианте осуществления дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она обеспечивается в его кристаллической модификации H1, которая характеризуется пиками при дифракционном рентгеновском анализе, включающими 3,1, 9,4 и 18,8 2 (все 0,1 2, с применением Cu-K1-излучения). В оптимальном варианте осуществления дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она обеспечивается в его кристаллической модификации H1, которая характеризуется пиками при дифракционном рентгеновском анализе, включающими 19,1, 22,8 и 26,4 2 (все 0,1 2, с применением Cu-K1-излучения). В оптимальном варианте осуществления дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она обеспечивается в его кристаллической модификации H1, которая характеризуется пиками при дифракционном рентгеновском анализе, включающими 14,4, 15,0 и 17,8 2 (все 0,1 2, с применением Cu-K1-излучения). В оптимальном варианте осуществления дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она обеспечивается в его кристаллической модификации H1, которая характеризуется пиками при дифракционном рентгеновском анализе, включающими 14,7, 18,6, 23,2, 23,8, 26,8 и 27,6 2 (все 0,1 2, с применением Cu-K1 излучения). В оптимальном варианте осуществления дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она обеспечивается в его кристаллической модификации H1, которая характеризуется следующими данными дифракционного рентгеновского анализа: форма H1 Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации NF3 (кристаллическая модификация NF3 может быть гидратом или ангидратом), которая характеризуется пиками при дифракционном рентгеновском анализе, включающими 15,3, 16,7, 21,6 и 23,1 2 (все 0,1 2, с применением Cu-K1 излучения). В оптимальном варианте осуществления дигидрофосфат 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она обеспечивается в его кристаллической модификации NF3, которая характеризуется следующими данными дифракционного рентгеновского анализа: форма NF3 Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации NF5, которая характеризуется пиками при дифракционном рентгеновском анализе, включающими 13,9, 15,7, 16,6,17,3, 19,8 и 22,1 2 (все 0,1 2, с применением Cu-K1-излучения). В оптимальном варианте осуществления гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-23-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она обеспечивается в его кристаллической модификации NF5, которая характеризуется следующими данными дифракционного рент-3 019320 В контексте данного изобретения термин "кристаллическая модификация" применяется как синоним терминов "кристаллическая форма", "полиморфная форма", "полиморфная модификация", "морфологическая форма" и т.п. Кристаллические модификации согласно данному изобретению, в частности кристаллическая модификация А 1 ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, кристаллическая модификация H1 дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил 2 Н-пиридазин-3-она, кристаллическая модификация NF3 дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она (кристаллическая модификация NF3 может быть гидратом или ангидратом) и кристаллическая модификация NF5 гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил 2 Н-пиридазин-3-она неожиданно характеризуются, помимо прочего, уменьшенной гигроскопичностью,лучшей прессуемостью во время процесса таблетирования, более длительным сроком хранения, лучшей термодинамической устойчивостью, т.е. устойчивостью к теплу и влажности, лучшей устойчивостью к солнечному свету, т.е. ультрафиолетовым лучам, повышенной объемной плотностью, улучшенной растворимостью, характеристиками биодоступности, сохраняющимися неизменными в разных партиях,лучшей текучестью и пригодностью для обработки в процессе таблетирования, улучшенной цветостойкостью и лучшими фильтрационными свойствами в процессе производства. Таким образом, благодаря использованию кристаллических модификаций согласно данному изобретению существует возможность получения фармацевтических композиций с улучшенной гомогенностью, устойчивостью, чистотой и единообразием в разных партиях. Кроме того, кристаллическая модификация А 1 ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол 4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она демонстрирует превосходные качества в отношении сушки (не происходит потери гидратной воды) и обнаруживает отличные свойства, касающиеся физической стойкости в изменчивых условиях относительной влажности(RH) (физически устойчивая форма в диапазоне влажности от 0 до как минимум 70% RH) по сравнению с кристаллической модификацией H1 дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она и кристаллической модификациейNF5 гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она. Кроме того, кристаллическая модификация А 1 ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она может рассматриваться как термодинамически более устойчивая форма по сравнению с кристаллической модификацией NF3 дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, как показывают сравнительные эксперименты с преобразованием двухкомпонентной суспензии форм А 1 и NF3 в разных органических растворителях при 25 и при 50 С соответственно (см. пример 10). В отличие от вышеупомянутой кристаллическая модификация NF3 дигидрофосфата 6-(1-метил-1 Нпиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она также демонстрирует превосходные качества в отношении сушки (не происходит потери гидратной воды) и обнаруживает отличные свойства, касающиеся физической стойкости в изменчивых условиях относительной влажности (RH) (физически устойчивая форма в диапазоне влажности от 0 до как минимум 70% RH) по сравнению с кристаллической модификацией H1 дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол 4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она и кристаллической модификацией NF5 гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она. Кроме того, кристаллическая модификация NF3 дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил 2 Н-пиридазин-3-она демонстрирует более низкую кинетическую растворимость в смеси вода:ацетон(30:70, (об./об.), через 2 ч) по сравнению с кристаллической модификацией А 1 ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, что обеспечивает более высокий выход процессов кристаллизации в этой приемлемой для процесса смеси растворителей (см. пример 14). С другой стороны, кристаллическая модификация NF5 гидрата дигидрофосфата 6-(1-метил-1 Нпиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она представляет более устойчивую форму при высокой активности воды и, следовательно, является более предпочтительной в водных дисперсионных системах по сравнению с кристаллической модификацией А 1 ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она, как показывают сравнительные эксперименты с преобразованием суспензии с двухкомпонентной смесью форм NF5 и А 1 в деионизированной воде при 25 С (см. пример 11). Кроме того, кристаллическая модификация H1 дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол 4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она представляет устойчивую форму при высокой активности воды и, следовательно, является более предпочтительной в водных дисперсионных системах по сравнению с кристаллической модификацией NF5 гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Нпиридазин-3-она, как показывают сравнительные эксперименты с преобразованием суспензии и с двухкомпонентной смесью форм NF5 и H1 в деионизированной воде при 25 С, с получением в результате формы H1 через определенное время (см. пример 12). Кроме того, кристаллическая модификация H1 дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она является предпочтительной в водных дисперсионных системах по сравнению с кристаллической модификацией NF3 дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, как показывают сравнительные эксперименты с преобразованием суспензии и с двухкомпонентной смесью форм H1 и NF3 в деионизированной воде при 25 С, с получением в результате формы H1 через определенное время (см. пример 13). Что касается дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она по сравнению с 6-(1-метил-1 Н-пиразол-4-ил)-23-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-оном (свободное основание),дигидрофосфатная соль демонстрирует значительно превосходящую стойкость в водном растворе и улучшенную стойкость активного фармацевтического ингредиента (API) в растворе. Кристаллические модификации согласно данному изобретению могут характеризоваться в соответствии со стандартными способами, которые описываются, например, в публикации Rolf Hilfiker, "Polymorphism in the Pharmaceutical Industry", Wiley-VCH, Weinheim 2006, и содержащихся в ней ссылках, например, о рентгеновской дифракции (XRD; глава 6), об инфракрасной и рамановской спектроскопии(глава 5), о дифференциальной сканирующей калориметрии (DSC) и о термогравиметрическом анализе(TGA) (глава 3), об исследованиях сорбции водяного пара (глава 9), или описываются, например, в публикации H.G. Brittain (editor), Polymorphism in Pharmaceutical Solids, vol. 95, Marcel Dekker Inc., New York 1999 (глава 6: все упомянутые в ней способы). Дигидрофосфат 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она, сольват дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, предпочтительно гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Нпиридазин-3-она, предпочтительно гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации, гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин 2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации NF5, ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3 она,ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации, ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил 2 Н-пиридазин-3-она в его кристаллической модификации А 1, дигидрата дигидрофосфата 6-(1-метил-1 Нпиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил 2 Н-пиридазин-3-она в его кристаллической модификации, дигидрата дигидрофосфата 6-(1-метил-1H-5 019320 пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации H1 и дигидрофосфат 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации NF3 здесь и далее указываются как "продукт(ы) согласно (данному) изобретению". 6-(1-Метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Нпиридазин-3-он (свободное основание) может быть синтезирован, как описывается в публикации РСТ/ЕР 2008/003473, пример 38, и публикации РСТ/ЕР 2008/005508, пример 1, следующим образом: Суспензию 7,68 г (43,6 ммоль) 6-(1-метил-1 Н-пиразол-4-ил)-2 Н-пиридазин-3-она в 90 мл DMF подвергают реакции с 12,4 г (43,6 ммоль) 5-бромо-2-(3-хлорометилфенил)пиримидина и 14,2 г (43,6 ммоль) карбоната цезия на протяжении 24 ч при комнатной температуре при перемешивании. Реакционную смесь добавляют к 400 мл воды. Образовавшийся в результате осадок 2-[3-(5-бромопиримидин-2 ил)бензил]-6-(1-метил-1 Н-пиразол-4-ил)-2 Н-пиридазин-3-она отсасывают, промывают водой и высушивают in vacuo. Суспензию 14,0 г (33,0 ммоль) 2-[3-(5-бромопиримидин-2-ил)бензил]-6-(1-метил-1 Н-пиразол-4-ил)2 Н-пиридазин-3-она в 65 мл DMF подвергают реакции с 10,9 г (42,9 г) бис-(пинаколато)дибора и 9,72 г(99,0 ммоль) ацетата калия и нагревают в атмосфере азота до 70 С. После 15 мин перемешивания при этой температуре добавляют 695 мг (0,99 ммоль) бис-(трифенилфосфин)палладий(II) хлорида и реакционную смесь перемешивают на протяжении 18 ч при 70 С в атмосфере азота. Затем реакционной смеси дают охладиться до комнатной температуры, добавляют воду и дихлорометан и реакционную смесь фильтруют над диатомитом/кизельгуром перед отделением органической фазы. Затем органическую фазу сушат над сульфатом натрия, концентрируют и остаток рекристаллизуют из 2-пропанола для получения 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она. К суспензии 13,4 г (28,4 ммоль) 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в 55 мл THF и 55 мл воды порциями добавляют 8,50 г (85,1 ммоль) пербората натрия при ледяном охлаждении. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре перед отсасыванием над диатомитом/кизельгуром. Фильтрат концентрируют in vacuo приблизительно до половины первоначального объема и титруют до рН 1 при помощи 2 N хлористо-водородной кислоты. Образовавшийся в результате осадок 2-[3-(5-гидроксипиримидин-2-ил)бензил]-6-(1-метил-1 Н-пиразол-4-ил)-2 Н-пиридазин-3-она отсасывают, промывают водой и высушивают in vacuo. К суспензии 360 мг (1,00 ммоль) 2-[3-(5-гидроксипиримидин-2-ил)бензил]-6-(1-метил-1 Н-пиразол 4-ил)-2 Н-пиридазин-3-она в 2 мл THF последовательно добавляют 394 мг (1,50 ммоль) трифенилфосфина и 242 мкл (2,00 ммоль) 4-(2-гидроксиэтил)морфолина. При ледяном охлаждении по капле медленно добавляют 294 мкл (1,50 ммоль) диизопропилазодикарбоксилата. Образовавшийся в результате раствор перемешивают на протяжении 18 ч при комнатной температуре. Затем реакционную смесь концентрируют in vacuo и маслянистый остаток растворяют в 2-пропаноле. Образовавшееся через некоторое время твердое вещество 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она отсасывают, промывают 2-пропанолом и трет-бутилметиловым эфиром и высушивают in vacuo. Раствор 815 г (3,39 моль) 3-хлоро-6-йодопиридазин в 3,8 л 1,2-диметоксиэтана подвергают реакции с 705 г (3,39 моль) пинаколового сложного эфира 1-метил-1 Н-пиразол-4-бороновой кислоты и 1,44 кг трикалийфосфат тригидрата. Образовавшуюся в результате суспензию нагревают до 80 С в атмосфере азота и при перемешивании и добавляют 59,5 г (85 ммоль) бис-(трифенилфосфин)палладий(II) хлорида. Реакционную смесь перемешивают в течение 3 ч при 80 С. Затем реакционной смеси дают охладиться до комнатной температуры и добавляют 9 л воды. Образовавшийся в результате осадок 3-хлоро-6-(1-метил 1 Н-пиразол-4-ил)пиридазина отсасывают, промывают водой и высушивают in vacuo. Суспензию 615 г (2,90 моль) 3-хлоро-6-(1-метил-1 Н-пиразол-4-ил)пиридазина в смеси 1,86 л муравьиной кислоты и 2,61 л воды нагревают до 80 С при перемешивании и продолжают перемешивать на протяжении 28 ч при этой температуре. Реакционную смесь охлаждают до комнатной температуры, добавляют активированный уголь и смесь отсасывают. Фильтрат титруют при ледяном охлаждении 40% водным раствором каустической соды до рН 7 и затем инкубируют в течение 16 ч при 6 С. Образовавшийся в результате осадок 6-(1-метил-1 Н-пиразол-4-ил)-2 Н-пиридазин-3-она отсасывают, промывают водой и высушивают in vacuo. Исходный продукт 5-бромо-2-(3-хлорометилфенил)пиримидин может быть синтезирован, как описывается в публикации РСТ/ЕР 2008/003473, пример 36, следующим образом: Раствор 95,0 г (332 ммоль) 5-бромо-2-йодопиримидина в 325 мл толуола, который держат в атмосфере азота, подвергают реакции с раствором 70,0 г (660 ммоль) карбоната натрия в 325 мл воды с нагреванием смеси до 80 С. К реакционной смеси добавляют 2,3 г (3,3 ммоль) бис(трифенилфосфин)палладий(II)-хлорида, а затем по капле добавляют раствор 50,0 г (329 ммоль) 3(гидроксиметил)бензолбороновой кислоты в 650 мл этанола. Реакционную смесь перемешивают на протяжении 18 ч при 80 С. Реакционную смесь охлаждают до комнатной температуры и фильтруют. Фильтрат подвергают реакции с 1 л этилацетата и 1 л воды. Органическую фазу отделяют, высушивают над сульфатом натрия и концентрируют. Остаток [3-(5-бромопиримидин-2-ил)фенил]метанола рекристаллизуют из 2-пропанола. К 159 мл (2,19 моль) тионилхлорида, который держат при 30 С, порциями при перемешивании добавляют 116 г (438 ммоль) [3-(5-бромопиримидин-2-ил)фенил]метанола. Реакционную смесь перемешивают на протяжении 18 ч при комнатной температуре. Затем реакционную смесь концентрируют. Остаток растворяют в толуоле и снова концентрируют. Процедуру повторяют трижды. Конечный остаток 5 бром-2-(3-хлорометилфенил)пиримидина рекристаллизуют из толуола. В альтернативном варианте 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-он (свободное основание) может быть синтезирован,как описывается в публикации РСТ/ЕР 2008/003473, пример 39, следующим образом: ил)-2 Н-пиридазин-3-она, 195 мг (1,05 ммоль) N-(2-хлороэтил)морфолинийхлорида и 521 мг (1,60 ммоль) карбоната цезия в 2 мл DMF нагревают до 80 С при перемешивании и продолжают перемешивать на протяжении 6 ч при этой температуре. Затем реакционной смеси дают охладиться и добавляют 50 мл воды. Образовавшийся в результате осадок 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она отсасывают, промывают водой и высушивают invacuo. В другом аспекте изобретения обеспечивается фармацевтическая композиция, включающая терапевтически эффективное количество как минимум одного продукта изобретения. В оптимальном варианте осуществления фармацевтическая композиция также включает как минимум одно дополнительное соединение, выбранное из группы, к которой относятся физиологически приемлемые формообразующие, вспомогательные вещества, адъюванты, разбавители, носители и/или дополнительные фармацевтически активные вещества, не являющиеся продуктами изобретения. Еще один вариант осуществления данного изобретения касается способа производства вышеупомянутых фармацевтических композиций, характеризующийся тем, что один или несколько продуктов изобретения и одно или несколько соединений, выбранных из группы, к которой относятся твердые, жидкие или полужидкие формообразующие, вспомогательные вещества, адъюванты, разбавители, носители и фармацевтически активные вещества, не являющиеся продуктами изобретения, преобразуют в приемлемую лекарственную форму. В контексте данного описания термин "эффективное количество" означает любое количество медикамента или фармацевтического средства, вызывающего биологическую или медицинскую реакцию ткани, системы, организма человека или животного, которой добивается, например, исследователь или клинический врач. Кроме того, термин "терапевтически эффективное количество" означает любое количество, которое по сравнению с соответствующим субъектом, не получившим такого количества, в результате обеспечивает улучшенное лечение, заживление, профилактику или уменьшение интенсивности симптомов болезни, нарушения или побочного эффекта, или снижение скорости прогрессирования болезни или нарушения. Термин также охватывает количества, эффективные для повышения нормальной физиологической функции. В другом аспекте изобретения обеспечивается медикамент, включающий как минимум один продукт изобретения или фармацевтическую композицию, как описано авторами. В еще одном аспекте изобретения обеспечивается описанный авторами медикамент, предназначенный для лечения и/или профилактики физиологических или патофизиологических состояний, вызываемых, опосредованных и/или распространяемых ингибированием, регулированием и/или модулированием трансдукции сигнала киназ, в частности ингибированием тирозинкиназ, преимущественно Met-киназы. Также предусматривается соответствующее применение для изготовления медикамента для применения и/или профилактики вышеупомянутых состояний. В еще одном аспекте изобретения обеспечивается описанный авторами медикамент, предназначенный для лечения и/или профилактики физиологических или патофизиологических состояний, выбранный из группы, к которой относятся рак, опухоль, злокачественные опухоли, доброкачественные опухоли,плотные опухоли, саркомы, карциномы, гиперпролиферативные нарушения, карциноиды, саркомы Юинга, саркомы Капоши, опухоли головного мозга, опухоли, возникающие в головном мозге, и/или нервной системе, и/или оболочке головного мозга, глиомы, глиобластомы, нейробластомы, рак желудка, рак почек, карциномы клеток почек, рак предстательной железы, карциномы предстательной железы, опухоли соединительных тканей, саркомы мягких тканей, опухоли поджелудочной железы, опухоли печени, опухоли головы, опухоли шеи, рак гортани, рак пищевода, рак щитовидной железы, остеосаркомы, ретинобластомы, тимома, рак яичка, рак легких, аденокарцинома легких, мелкоклеточная карцинома легкого,бронхиальные карциномы, рак молочной железы, карциномы грудной железы, рак кишечника, колоректальные опухоли, карциномы толстой кишки, карциномы прямой кишки, гинекологические опухоли,опухоли яичников/овариальные опухоли, рак матки, рак шейки матки, карциномы шейки матки, рак тела матки, карциномы тела, карциномы эндометрия, рак мочевого пузыря, рак мочеполового тракта, рак кожи, эпителиальные опухоли, сквамозная эпителиальная карцинома, базалиомы, спиналиомы, меланомы,внутриглазные меланомы, лейкемии, моноцитарная лейкемия, хронические лейкемии, хроническая миелотическая лейкемия, хроническая лимфатическая лейкемия, острые лейкемии, острая миелотическая лейкемия, острая лимфатическая лейкемия и/или лимфомы. Также предусматривается соответствующее применение для изготовления медикамента для применения и/или профилактики вышеупомянутых состояний. В другом аспекте изобретения обеспечивается описанный авторами медикамент, причем такой медикамент включает как минимум одно дополнительное фармакологически активное вещество (лекарство, ингредиент). В оптимальном варианте осуществления как минимум одним фармакологически активным веществом является описанное авторами вещество. В другом аспекте изобретения обеспечивается описанный авторами медикамент, причем медика-8 019320 мент применяется до и/или во время и/или после лечения как минимум одним дополнительным фармакологически активным веществом. В оптимальном варианте осуществления как минимум одним фармакологически активным веществом является описанное авторами вещество. В еще одном аспекте изобретения обеспечивается комплект, включающий терапевтически эффективное количество как минимум одного продукта изобретения и/или как минимум одну фармацевтическую композицию, как описано авторами, и терапевтически эффективное количество как минимум еще одного фармакологически активного вещества, которые не являются продуктами изобретения. Продукты изобретения могут применяться в комбинации с одним или несколькими другими фармакологически активными веществами (ингредиентами, лекарствами) для лечения, профилактики, подавления или уменьшения симптомов болезней или состояний, при которых применяются продукты изобретения или другие вещества. Как правило, комбинация медикаментов является более безопасной или более эффективной, чем отдельный медикамент, или комбинация является более безопасной или более эффективной, чем можно было бы ожидать с учетом суммарных свойств отдельных медикаментов. Этот(и) другой(ие) медикамент(ы) может (могут) вводиться таким путем и в таком количестве, которые применяют одновременно или последовательно, с продуктом изобретения. Если продукт изобретения применяется одновременно с одним или несколькими другими медикаментами, предпочтение отдают комбинированному продукту, содержащему такой(ие) другой(ие) медикамент(ы) и продукт изобретения. Однако комбинированная терапия также включает виды терапии, согласно которым продукт изобретения и один или несколько других медикаментов вводятся в разных перекрывающихся режимах. Предусматривается,что при применении с другими активными ингредиентами продукт согласно данному изобретению или другой активный ингредиент либо и то, и другое могут применяться в более низких дозах, чем при их отдельном применении. Соответственно к фармацевтическим композициям согласно данному изобретению (описанным авторами фармацевтическим композициям) относятся такие, которые содержат один или несколько других активных ингредиентов, дополнительно к продукту изобретения. Примерами других фармакологически активных веществ (ингредиентов, лекарств), которые могут вводиться в комбинации с продуктом изобретения и вводятся отдельно или в одной фармацевтической композиции, являются, помимо прочих, классы соединений и конкретные соединения, перечисленные в табл. 1 В оптимальном варианте осуществления продукт изобретения вводят в комбинации с одним или несколькими известными противоопухолевыми средствами, к которым относятся следующие: модуляторы рецептора эстрогена, модуляторы рецептора андрогена, модуляторы ретиноидного рецептора, цитотоксические вещества, антипролиферативные агенты, ингибиторы фенилпротеинтрансферазы, ингибиторы HMG-CoA-редуктазы, ингибиторы ВИЧ-протеазы, ингибиторы обратной транскриптазы, ингибиторы ангиогенеза. Продукты изобретения являются особенно подходящими для введения в комбинации с радиотерапией. Синергетический эффект ингибирования фактора роста эндотелия сосудов в комбинации с радиотерапией известен специалистам в данной области (WO 00/61186). Термин "модуляторы рецептора эстрогена" в контексте данного изобретения означает соединения,препятствующие связыванию или ингибирующие связывание эстрогена с рецептором эстрогена независимо от механизма действия. Неограничивающими примерами модуляторов рецептора эстрогена являются тамоксифен, ралоксифен, идоксифен, LY353381, LY117081, торемифен, фулвестрант, 4-[7-(2,2 диметил-1-оксопропокси-4-метил-2-[4-[2-(1-пиперидинил)этокси]фенил]-2 Н-1-бензопиран-3-ил]фенил 2,2-диметилпропаноат, 4,4'-дигидроксибензофенон-2,4-динитрофенилгидразон и SH646. Термин "модуляторы рецептора андрогена" в контексте данного изобретения означает соединения,препятствующие связыванию или ингибирующие связывание андрогенов с рецептором андрогена независимо от механизма действия. Неограничивающими примерами модуляторов рецептора андрогена являются финастерид и другие ингибиторы 5-альфа-редуктазы, нилутамид, флутамид, бикалутамид, лиарозол и абиратерон ацетат. Термин "модуляторы ретиноидного рецептора" в контексте данного изобретения означает соединения, препятствующие связыванию или ингибирующие связывание ретиноидов с рецептором ретиноидов независимо от механизма действия. Неограничивающими примерами модуляторов ретиноидного рецептора являются бексаротен, третиноин, 13-цис-ретиноевая кислота, 9-цис-ретиноевая кислота, альфадифторометилорнитин, ILX23-7553, транс-N-(4'-гидроксифенил)ретинамид и N-4-карбоксифенилретинамид. Термин "цитотоксические вещества" в контексте данного изобретения означает соединения, первоначально запускающие механизм некроза клеток путем прямого действия на функцию (функции) клеток или препятствующие мейозу клеток или ингибирующие мейоз клеток, такие как алкилирующие агенты,факторы некроза клеток, интеркалирующие агенты, ингибиторы микротрубочек и ингибиторы топоизомеразы. Неограничивающими примерами цитотоксических веществ являются тирапазимин, сертенеф,кахектин, ифосфамид, тазонермин, лонидамин, карбоплатин, альтретамин, преднимустин, дибромодульцитол, ранимустин, фотемустин, недаплатин, оксалиплатин, темозоломид, гептаплатин, эстрамустин,импросульфан-тозилат, трофосфамид, нимустин, хлорид диброспидия, пумитепа, лобаплатин, сатраплатин,профиромицин,цисплатин,ирофульвен,дексифосфамид,цис-аминдихлоро-(2 метилпиридин)платин, бензилгуанин, глуфосфамид, GPX100, (транс,транс,транс)-бис-му-(гексан-1,6 диамин)-му-[диамин-платина(II)]-бис-[диамин(хлоро)платина(II)]тетрахлорид, диаризинилспермин, триоксид мышьяка, 1-(11-додециламино-10-гидроксиундецил)-3,7-диметилксантин, зорубицин, идарубицин,даунорубицин, бисантрен, митоксантрон, пирарубицин, пинафид, вальрубицин, амрубицин, антинеопл астон, 3'-дезамино-3'-морфолино-13-дезоксо-10-гидроксикарминомицин, аннамицин, галарубицин, элинафид, MEN10755 и 4-деметокси-3-дезамино-3-азиридинил-4-метилсульфонилдаунорубицин (WO 00/50032). Неограничивающими примерами ингибиторов микротрубочек являются паклитаксел, виндезинсульфат, 3'4'-дидегидро-4'-дезокси-8'-норвинкалейкобластин, доцетаксол, ризоксин, доластатин, мивобулин-изетионат, ауристатин, цематодин, RPR109881, BMS184476, винфлунин, криптофицин, 2,3,4,5,6 пентафторо-N-(3-фторо-4-метоксифенил)бензолсульфонамид,ангидровинбластин,N,N-диметил-Lвалил-L-валил-N-метил-L-валил-L-пролил-L-пролин-t-бутиламид, TDX258 и BMS188797. Неограничивающими примерами ингибиторов топоизомеразы являются топотекан, гикаптамин,иринотекан, рубитекан, 6-этоксипропионил-3',4'-О-экзо-бензилиден-шартрезин, 9-метокси-N,N-диметил 5-нитропиразоло[3,4,5-кл]акридин-2-(6 Н)пропанамин, 1-амино-9-этил-5-фторо-2,3-дигидро-9-гидрокси 4-метил-1 Н,12 Н-бензо-[де]-пирано-[3',4':b,7]-индолизино-[1,2b]-хинолин-10,13(9 Н,15 Н)-дион, луртотекан, 7-[2-(N-изопропиламино)этил]-(20S)камптотецин, BNP1350, BNPI1100, BN80915, BN80942, этопозид-фосфат,тенипозид,собузоксан,2'-диметиламино-2'-дезоксиэтопозид,GL331,N-[2(диметиламино)этил]-9-гидрокси-5,6-диметил-6 Н-пиридо-[4,3-b]-карбазол-1-карбоксамид,азулакрин,(5 а,5 аВ,8 аа,9b)-9-[2-[N-[2-(диметиламино)этил]-N-метиламино]этил]-5-[4-гидрокси-3,5-иметоксифенил]5,5 а,6,8,8 а,9-гексогидрофуро(3',4':6,7)нафто(2,3-d)-1,3-диоксол-6-он,2,3-(метилендиокси)-5-метил-7 гидрокси-8-метоксибензо[с]фенантридиний,6,9-бис-[(2-аминоэтил)амино]-бензо-[g]-изохинолин-5,10 дион, 5-(3-аминопропиламино)-7,10-дигидрокси-2-(2-гидроксиэтиламинометил)-6 Н-пиразоло[4,5,1-de]акридин-6-он, N-[1-[2(диэтиламино)этиламино]-7-метокси-9-оксо-9 Н-тиоксантен-4-илметил]формамид,N-(2-(диметиламино)этил)акридин-4-карбоксамид,6-2-(диметиламино)этил]амино]-3-гидрокси-7 Ниндено-[2,1-с]-хинолин-7-он и димесна. Неограничивающими примерами антипролиферативных агентов являются антисмысловые РНК- и антисмысловые ДНК-олигонуклеотиды, такие, как G3139, ODN698, RVASKRAS, GEM231 и INX3001, а"Антипролиферативные агенты" также включают моноклональные антитела против факторов роста,которые не были перечислены среди "ингибиторов ангиогенеза", таких как трастузумаб, а также гены супрессии опухоли, такие как р 53. Фармацевтические композиции согласно данному изобретению (как описано авторами) могут вводиться любыми способами, которые позволяют достичь предусмотренной цели. Например, введение может быть пероральным, парентеральным, местным, энтеральным, внутривенным, внутримышечным, ингаляционным, назальным, внутрисуставным, интраспинальным, транстрахеальным, трансокулярным,подкожным, внутрибрюшинным, чрескожным, или буккальным путями. В качестве альтернативного или параллельного средства введение может осуществляться пероральным путем. Вводимая доза зависит от возраста, состояния здоровья и массы субъекта, типа параллельного лечения при его наличии, частоты лечения и характера желаемого эффекта. Предпочтение отдается парентеральному введению. Особое предпочтение отдается пероральному введению. К приемлемым лекарственным формам относятся, помимо прочих, капсулы, таблетки, пилюли,драже, полутвердые лекарственные формы, порошки, гранулы, суппозитории, мази, кремы, лосьоны,ингаляторы, инъекции, горячие компрессы, гели, пластыри, глазные капли, растворы, сиропы, аэрозоли,суспензии, эмульсии, которые могут производиться в соответствии со способами, известными в данной области, например, как описано ниже: таблетки: смешивание активного(ых) ингредиента(ов) и вспомогательных веществ, прессование вышеупомянутой смеси в таблетки (прямое прессование), необязательно гранулирование части смеси перед прессованием; капсулы: смешивание активного(ых) ингредиента(ов) и вспомогательных веществ для получения сыпучего порошка, необязательно гранулирование порошка, заполнение порошками/гранулятом открытых капсул, закрывание капсул; полутвердые лекарственные формы (мази, гели, кремы): растворение/диспергирование активного(ых) ингредиента(ов) в водном или жировом носителе; последующее смешивание водной/жировой фазы с дополняющей жировой/водной фазой, гомогенизация (только для кремов); суппозитории (ректальные и вагинальные): растворение/диспергирование активного(ых) ингредиента(ов) в материале носителя, разжиженном путем нагревания (для ректальных материалом носителя обычно является воск; для вагинальных материалом носителя обычно является нагретый раствор гелеобразующего агента), отливка вышеупомянутой смеси в формы суппозиториев, охлаждение и вынимание суппозиториев из форм; аэрозоли: диспергирование/растворение активного(ых) агента(ов) в газе-вытеснителе, помещение вышеупомянутой смеси в распылитель. Как правило, нехимические способы производства фармацевтических композиций и/или фармацевтических препаратов включают этапы обработки на соответствующих известных специалистам в данной области механических средствах, которые переводят один или несколько продуктов изобретения в лекарственную форму, приемлемую для введения пациенту, нуждающемуся в таком лечении. Обычно перевод одного или нескольких продуктов изобретения в такую лекарственную форму включает добавление одного или нескольких соединений, выбранных из группы, к которой относятся носители, формообразующие, вспомогательные вещества и фармацевтически активные ингредиенты, не являющиеся продуктами изобретения. Соответствующие этапы обработки включают, помимо прочих, комбинирование,перемалывание, смешивание, гранулирование, растворение, диспергирование, гомогенизацию, отливку и/или прессование соответствующих активных и неактивных ингредиентов. Механические средства выполнения вышеупомянутых этапов обработки известны специалистам в данной области, например, из Энциклопедии Ульмана по промышленной химии (Ullmann's Encyclopedia of Industrial Chemistry), 5-е изд. В этом отношении активные ингредиенты предпочтительно представляют собой как минимум один продукт изобретения и одно или несколько дополнительных соединений, не являющихся продуктами изобретения, которые проявляют ценные фармацевтические свойства, предпочтительно фармацевтически активные агенты, не являющиеся продуктами изобретения, которые описаны авторами. Особенно приемлемыми для перорального применения являются таблетки, пилюли, таблетки с покрытием, капсулы, порошки, гранулы, сиропы, соки или капли, для ректального применения подходящими являются суппозитории, для парентерального применения подходящими являются растворы,предпочтительно масляные или водные растворы, а также суспензии, эмульсии или имплантаты, и для местного применения подходящими являются мази, кремы или порошки. Продукты изобретения также могут быть лиофилизированы, и образовавшиеся в результате лиофилизаты могут применяться, например, для приготовления инъекционных композиций. Указанные композиции могут подвергаться стерилизации и/или могут включать вспомогательные вещества, такие как смазывающие вещества, консерванты, стабилизаторы и/или увлажняющие средства, эмульгаторы, соли для изменения осмотического давления, буферные вещества, красители, ароматизаторы и/или множество других активных ингредиентов,например один или несколько витаминов. Подходящими формообразующими являются органические или неорганические вещества, которые приемлемы для энтерального (например, перорального), парентерального или местного применения и не реагируют с продуктами изобретения, например вода, растительные масла, бензиловые спирты, алкиленгликоли, полиэтиленгликоли, триацетат глицерина, желатин, углеводы, такие как лактоза, сахароза,маннит, сорбит или крахмал (кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал), препараты целлюлозы и/или фосфаты кальция, например трикальцийфосфат или гидрофосфат кальция, стеарат магния, тальк, желатин, трагакант, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий-карбоксиметилцеллюлоза, поливинилпирролидон и/или вазелин. В случае необходимости могут добавляться дезинтегрирующие агенты, такие как вышеупомянутые крахмалы, а также карбоксиметилкрахмал, сшитый поливинилпирролидон, агар, или альгиновая кислота либо ее соль, такая как альгинат натрия. К вспомогательным веществам, помимо прочих, относятся регулирующие текучесть агенты и смазывающие вещества, например кремнезем, тальк, стеариновая кислота или ее соли, такие как стеарат магния или стеарат кальция, и/или полиэтиленгликоль. Ядра драже обеспечивают соответствующими покрытиями, в случае необходимости, являются устойчивыми к желудочным сокам. Для этого могут применяться концентрированные растворы сахаридов, которые, необязательно, могут содержать гуммиарабик, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, лаковые растворы и подходящие органические растворители или смеси растворителей. Для получения покрытий, устойчивых к желудочным сокам, или для обеспечения лекарственной формы, дающей преимущество продленного действия, таблетка, драже или пилюля могут включать компонент внутренней дозы и внешней дозы, причем последний предусмотрен в форме оболочки поверх первого. Два компонента могут разделяться энтеросолюбильным слоем, который служит для сопротивления распаду в желудке и позволяет внутреннему компоненту пройти целым в двенадцатиперстную кишку или задержать его высвобождение. Для таких энтеросолюбильных слоев или покрытий могут применяться различные материалы, к которым могут относиться многие полимерные кислоты и смеси полимерных кислот с такими материалами, как шеллак, ацетиловый спирт, растворы подходящих препаратов целлюлозы, таких как фталат ацетилцеллюлозы, ацетат целлюлозы или фталат гидроксипропилметилцеллюлозы. К покрытиям таблеток или драже могут добавляться красители или пигменты, например, для распознавания или с целью характеризации комбинаций доз активных соединений. Подходящими веществами носителей являются органические или неорганические вещества, которые приемлемы для энтерального (т.е. перорального) или парентерального введения либо местного нанесения и не реагируют с новыми соединениями, например вода, растительные масла, бензиловые спирты,полиэтиленгликоли, желатин, углеводы, такие как лактоза или крахмал, стеарат магния, тальк и вазелин. В частности, таблетки, таблетки с покрытием, капсулы, сиропы, суспензии, капли или суппозитории применяют для энтерального введения, растворы, предпочтительно масляные или водные растворы, а также суспензии, эмульсии или имплантаты применяют для парентерального введения, а мази, кремы или порошки применяют для местного нанесения. Продукты изобретения также могут подвергаться лиофилизации, и полученные лиофилизаты могут применяться, например, для изготовления инъекционных композиций. Указанные композиции могут подвергаться стерилизации и/или могут содержать формообразующие, такие как смазывающие вещества, консерванты, стабилизаторы и/или увлажняющие средства,эмульгаторы, соли для воздействия на осмотическое давление, буферные вещества, красители, вкусовые добавки и/или ароматизаторы. В случае необходимости они также могут содержать один или несколько других активных соединений, например один или несколько витаминов. К другим фармацевтическим композициям, которые могут применяться перорально, относятсяpush-fit капсулы, выполненные из желатина, а также мягкие, плотно закрытые капсулы, выполненные из желатина и пластификатора, такого как глицерин или сорбит. Push-fit капсулы могут содержать активные соединения в форме гранул, которые могут смешиваться с наполнителями, такими как лактоза, связующими веществами, такими как крахмалы, и/или смазывающими веществами, такими как тальк или стеарат магния, и, необязательно, стабилизаторами. В мягких капсулах активные соединения предпочтительно являются растворенными или суспендированными в соответствующих жидкостях, таких как жирные кислоты или жидкий парафин. Кроме того, могут добавляться стабилизаторы. К жидким формам, в которые могут быть включены новые композиции согласно данному изобретению для перорального введения, относятся водные растворы, сиропы с соответствующими вкусовыми добавками, водные или масляные суспензии, и ароматизированные эмульсии с пищевыми маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и подобные фармацевтические наполнители. К подходящим диспергирующим или суспендирующим агентам для водных суспензий относятся синтетические и природные смолы, такие как трагакант, гуммиарабик, альгинат, декстран, натрий-карбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или желатин. К подходящим композициям для парентерального введения относятся водные растворы активных соединений в водорастворимой форме, например водорастворимые соли и щелочные растворы. Кроме того, вводят суспензии активных соединений в форме подходящих масляных инъекционных суспензий. К подходящим липофильным растворителям или наполнителям относятся жирные кислоты, например кунжутное масло, или сложные эфиры синтетических жирных кислот, например этилолеат или триглицериды либо полиэтиленгликоль-400 (соединения растворимы в PEG-400). Водные инъекционные суспензии могут содержать вещества, повышающие вязкость суспензии,включая, например, натрий-карбоксиметилцеллюлозу, сорбит и/или декстран, и суспензия также, необязательно, может содержать стабилизаторы. Для введения в виде ингаляционного аэрозоля можно применять аэрозоли, в которых активный ингредиент растворен или суспендирован в газе-вытеснителе или смеси газов-вытеснителей (например,СО 2 или хлорофторуглеродах). Активный ингредиент в оптимальном варианте применяют в тонкоизмельченной форме, и в этом случае могут присутствовать один или несколько дополнительных физиологически приемлемых растворителей, например этанол. Ингаляционные растворы могут вводиться при помощи традиционных ингаляторов. К возможным фармацевтическим композициям, которые могут применяться ректально, относятся,например, суппозитории, состоящие из комбинации одного или нескольких активных соединений с основой суппозитория. Подходящими основами суппозиториев являются, например, природные или синтетические триглицериды или предельные углеводороды. Кроме того, также возможно применение желатиновых ректальных капсул, состоящих из комбинации активных соединений с основой. К возможным материалам основы относятся, например, жидкие триглицериды, полиэтиленгликоли или предельные углеводороды. Для применения в лекарствах продукты согласно данному изобретению предусматриваются в форме фармацевтически приемлемых солей. Однако для изготовления продуктов согласно изобретению или их фармацевтически приемлемых солей могут применяться и другие соли. К подходящим фармацевтически приемлемым солям продуктов изобретения относятся кислые аддитивные соли, которые могут образовываться, например, путем смешивания раствора продукта изобретения с раствором фармацевтически приемлемой кислоты, такой как хлористо-водородная кислота, серная кислота, метансульфоновая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, оксалатная кислота, лимонная кислота, винная кислота, угольная кислота или фосфорная кислота. Кроме того, в случаях, когда продукты изобретения включают кислотный компонент, к их подходящим фармацевтически приемлемым солям могут относиться соли щелочных металлов, например соли натрия или калия; соли щелочно-земельных металлов, например соли кальция или магния; и соли, образованные с соответствующими органическими основаниями, например четвертичные аммониевые соли. Фармацевтические композиции могут применяться в качестве медикаментов для лечения людей и животных. В контексте данного описания термин "эффективное количество" означает количество медикамента или фармацевтического средства, вызывающего биологическую или медицинскую реакцию ткани, системы, организма человека или животного, которой добивается, например, исследователь или клинический врач. Кроме того, термин "терапевтически эффективное количество" означает любое количество, которое по сравнению с соответствующим субъектом, не получившим такого количества, в результате обеспечивает улучшенное лечение, заживление, профилактику или уменьшение интенсивности симптомов болезни, нарушения или побочного эффекта, или снижение скорости прогрессирования болезни или нарушения. Термин также охватывает количества, эффективные для повышения нормальной физиологической функции. Вышеупомянутое терапевтически эффективное количество одного или нескольких продуктов изобретения известно специалистам в данной области или и легко может быть определено стандартными способами, известными специалистам в данной области. Продукты изобретения и дополнительные фармакологически активные вещества обычно вводят аналогично введению препаратов промышленного производства. Как правило, подходящие дозы, которые являются терапевтически эффективными, пребывают в диапазоне от 0,0005 до 1000 мг, предпочтительно от 0,005 до 500 мг, наиболее предпочтительно от 0,5 до 100 мг на единицу дозы. Дневная доза предпочтительно составляет приблизительно от 0,001 до 10 мг/кг массы тела. Специалистам в данной области легко станет понятным, что уровни доз могут быть разными в зависимости от конкретного соединения, тяжести симптомов и восприимчивости субъекта к побочным эффектам. Некоторые из конкретных соединений являются более сильнодействующими по сравнению с другими. Оптимальные дозы для рассматриваемых соединений могут легко определяться специалистами в данной области различными способами. Оптимальным способом является измерение физиологической активности данного соединения. С точки зрения данного изобретения предполагается, что оно охватывает вес виды млекопитающих. В оптимальном варианте осуществления такими млекопитающими являются выбранные из группы, к которой относятся приматы, человек, грызуны, лошади, жвачные животные, собаки, кошки, домашние животные, крупный рогатый скот, домашний скот, комнатные животные, коровы, овцы, свиньи, козы,лошади, пони, ослы, лошаки, мулы, зайцы, кроли, коты, собаки, морские свинки, хомяки, крысы, мыши. В более предпочтительном варианте такими животными являются люди. Животные модели представляют интерес для экспериментальных исследований, обеспечивая модель для лечения человеческих болезней. Однако конкретная доза для отдельных пациентов зависит от многих факторов, например от эффективности конкретных применяемых соединений, от возраста, массы тела, общего состояния здоровья,пола, режима питания, от времени и пути введения, от скорости выведения, типа введения и вводимой лекарственной формы, фармацевтической комбинации и тяжести конкретного нарушения, по отношению к которому применяется терапия. Конкретная терапевтически эффективная доза для отдельного пациента может быть легко определена путем стандартных экспериментов, например, врачом или медиком, который рекомендует или применяет терапевтическое лечение. При многих нарушениях восприимчивость конкретной клетки к лечению с применением рассматриваемых соединений может определяться путем in vitro испытания. Обычно культуру клеток комбинируют с рассматриваемым соединением в различных концентрациях в течение периода времени, достаточного для того, чтобы активные агенты могли проявить соответствующую реакцию, обычно приблизительно от 1 ч до одной недели. Для in vitro испытания могут использоваться культивированные клетки из образца биопсии. Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения способа производства кристаллической модификации А 1 ангидрата дигидрофосфата 6-(1-метил 1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, который включает следующие этапы:(a) растворение или диспергирование 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она (свободного основания) или его одной или нескольких солей в растворителе или смеси растворителей, предпочтительно 2-пропаноле или хлороформе,необязательно при перемешивании;(b) преобразование 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она (свободного основания) или его одной или нескольких солей в соответствующую дигидрофосфатную соль путем добавления водного или этанольного раствора фосфорной кислоты, необязательно при перемешивании;(c) перемешивание образовавшейся в результате дисперсии с этапа (b) при комнатной температуре на протяжении одного или нескольких часов или дней, предпочтительно на протяжении 1 или 2 ч;(d) отделение осажденного ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она путем фильтрации, необязательно с последующим промыванием растворителем или смесью растворителей, с необязательной последующей сушкой, предпочтительно in vacuo, необязательно при повышенной температуре Т, предпочтительно от 30 до 95 С, более предпочтительно 70 С. В контексте данного изобретения термины "повышенная температура" и "повышенная температура Т или Тх (при х=1, 2, 3 и т.д.)" означает отдельную конкретную температуру для данного этапа или подэтапа процесса, которая не зависит от любой другой "повышенной температуры" и которая может быть любой температурой в диапазоне температур от "температуры выше комнатной" до "температуры кипения" данного растворителя или смеси растворителей и/или "температуры плавления" данного твердого вещества, выделенного вещества, промежуточного вещества или продукта или их смеси, в зависимости от обстоятельств. В контексте данного изобретения термин "одна или несколько солей 6-(1-метил-1 Н-пиразол-4-ил)2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она (свободного основания)" означает любые и все соли, предпочтительно фармацевтически приемлемые соли, 6-(1-метил-1 Нпиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она (свободного основания), к которым, помимо прочих, относятся ацетат, адипат, альгинат, аргинат, аспартат, бензоат, бензолсульфонат (безилат), бисульфат, бисульфит, бромид, бутират, камфорат, камфорсульфонат,каприлат, хлорид, хлоробензоат, цитрат, циклопентанпропионат, диглюконат, дигидрофосфат, динитробензоат, додецилсульфат, этансульфонат, фумарат, галактерат, галактуронат, глюкогептаноат, глюконат,глутамат, глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид,гидробромид, гидройодид, 2-гидроксиэтансульфонат, йодид, изотионат, изобутират, лактат, лактобионат,малат, малеат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2 нафталинсульфонат, никотинат, нитрат, оксалат, олеат, памоат, пектинат, персульфат, фенилацетат, 3- 18019320 фенилпропионат, фосфат, фосфонат и фталат. В контексте данного изобретения термин "растворитель или смесь растворителей" означает любые и все растворители, предпочтительно органические растворители и воду, более предпочтительно фармацевтически приемлемые органические растворители и воду, к которым, помимо прочих, относятся метанол, этанол, 2-пропанол, n-бутанол, изобутанол, ацетон, метилэтилкетон, этилацетат, 1,4-диоксан, диэтиловый эфир, МТВЕ, THF, ацетонитрил, дихлорометан, хлороформ, DMF, циклогексан, циклопентан, nгексан, n-гептан, n-пентан, толуол, о-ксилол, р-ксилол, DMSO, пиридин, уксусная кислота, анизол, бутилацетат, кумол, этилформат, муравьиная кислота, изобутилацетат, изопропилацетат, метилацетат, 3 метил-1-бутанол, метилизобутилкетон, 2-метил-1-пропанол, 1-пентанол, пропилацетат, этиленгликоль и 1-метил-2-пирролидон, а также любые и все смеси двух или более подобных растворителей, предпочтительно двухкомпонентные смеси, более предпочтительно двухкомпонентные смеси воды и фармацевтически приемлемого органического растворителя. Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения способа производства кристаллической модификации А 1 ангидрата дигидрофосфата 6-(1-метил 1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, который включает следующие этапы:(a) диспергирование 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-он (свободное основание) или его одной или нескольких солей в растворителе или смеси растворителей, предпочтительно в воде, и добавление водного раствора фосфорной кислоты, необязательно при перемешивании;(b) нагревание образовавшейся в результате дисперсии с этапа (а) до повышенной температуры Т 1,предпочтительно от 30 до 95 С, более предпочтительно 50 С, необязательно при перемешивании, и охлаждение образовавшегося в результате раствора предпочтительно до температуры от 0 до 40 С, более предпочтительно до 20 С, необязательно при перемешивании, перед его разбавлением растворителем или смесью растворителей, предпочтительно ацетоном, необязательно при перемешивании;(c) перемешивание образовавшейся в результате дисперсии с этапа (b) при температуре от 0 до 40 С, предпочтительно 10 С, до завершения кристаллизации и/или инкубация при комнатной температуре на протяжении одного или нескольких часов или дней, необязательно при перемешивании;(d) отделение осажденного ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она путем фильтрации, необязательно охлаждение образовавшейся в результате дисперсии с этапа (с) до температуры от 0 до 20 С, предпочтительно 5 С, перед фильтрацией, необязательно при перемешивании, необязательно с последующим промыванием растворителем или смесью растворителей, предпочтительно ацетоном, с необязательной последующей сушкой, предпочтительно in vacuo, необязательно при повышенной температуре Т 2, предпочтительно от 30 до 95 С, более предпочтительно 70 С;(е) необязательно кипячение образовавшихся в результате высушенных кристаллов с этапа (d) в растворителе или смеси растворителей, предпочтительно этаноле, в форме дисперсии в течение одной или нескольких минут, предпочтительно 30 мин, и их отделение путем фильтрации из горячей дисперсии. Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения способа производства кристаллической модификации А 1 ангидрата дигидрофосфата 6-(1-метил 1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, который включает следующие этапы:(a) диспергирование 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-он (свободное основание) или его одной или нескольких солей в смеси растворителей, предпочтительно в смеси вода:ацетон, и добавление водного раствора фосфорной кислоты,необязательно при перемешивании;(b) нагревание образовавшейся в результате дисперсии с этапа (а) до повышенной температуры Т 1,предпочтительно от 30 до 95 С, более предпочтительно 55 С, необязательно при перемешивании, и охлаждение образовавшегося в результате раствора предпочтительно до температуры от 0 до 50 С, необязательно при перемешивании, с определенной скоростью охлаждения, предпочтительно 0,1-1 K/мин,более предпочтительно 0,1-0,3 K/мин, необязательно при перемешивании, до наступления кристаллизации;(c) дальнейшее охлаждение образовавшейся в результате дисперсии с этапа (b) предпочтительно до температуры от -20 до 0 С, более предпочтительно до -10 С, необязательно при перемешивании, с определенной скоростью охлаждения, предпочтительно 0,1-1 K/мин, более предпочтительно 0,1-0,3 K/мин,необязательно при перемешивании;(d) перемешивание образовавшейся в результате дисперсии с этапа (с) при температуре от -20 до 40 С, предпочтительно -10 С, до завершения кристаллизации;(e) отделение кристаллизованного ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она путем фильтрации, необязатель- 19019320 но с последующим промыванием растворителем или смесью растворителей, предпочтительно ацетоном,с необязательной последующей сушкой, предпочтительно in vacuo, необязательно при повышенной температуре Т 2, предпочтительно от 30 до 95 С, более предпочтительно 70 С. Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения способа производства кристаллической модификации H1 дигидрата дигидрофосфата 6-(1-метил 1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, который включает следующие этапы:(а) распространение ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин 4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она кристаллической модификации А 1 по поверхности, предпочтительно ограниченной поверхности вместилища, более предпочтительно чашки Петри, и последующая его инкубация в герметично закрытом эксикаторе над водой или водными солевыми растворами с определенной относительной влажностью (RH), предпочтительно 80-100% RH, более предпочтительно 90-100% RH, на протяжении одного или нескольких дней или недель. Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения способа производства кристаллической модификации H1 дигидрата дигидрофосфата 6-(1-метил 1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, который включает следующие этапы:(a) диспергирование ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин 4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она кристаллической модификации А 1 в смеси двух или более растворителей, предпочтительно в двухкомпонентной смеси воды и органического растворителя, причем органический растворитель предпочтительно выбирают из группы, к которой относятся метанол, этанол, 2-пропанол, ацетон, TFH и ацетонитрил, необязательно при перемешивании, и перемешивание образовавшейся в результате дисперсии при повышенной температуре Т 1, предпочтительно от 30 до 95 С, более предпочтительно 50 С, на протяжении одного или нескольких дней или недель;(b) отделение осажденного дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она путем фильтрации, необязательно с последующим промыванием растворителем или смесью растворителей, с необязательной последующей сушкой, предпочтительно in vacuo, необязательно при повышенной температуре Т 2, предпочтительно от 30 до 95 С, более предпочтительно 70 С. Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения способа производства кристаллической модификации NF3 дигидрофосфата 6-(1-метил-1 Нпиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, который включает следующие этапы:(a) диспергирование или растворение ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она кристаллической модификации А 1 в смеси двух или более растворителей, предпочтительно двухкомпонентной смеси, причем растворители предпочтительно выбирают из группы, к которой относятся вода, метанол, этанол, 2 пропанол, ацетон, TFH, ацетонитрил и 1,4-диоксан, необязательно при перемешивании, и последующее выпаривание смеси двух или более растворителей при комнатной температуре или повышенной температуре Т 1, предпочтительно от 30 до 95 С, более предпочтительно 50 С, до наступления кристаллизации;(b) отделение осажденного гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она путем фильтрации, необязательно с последующим промыванием растворителем или смесью растворителей, с необязательной последующей сушкой, предпочтительно in vacuo, необязательно при повышенной температуре Т 2, предпочтительно от 30 до 95 С, более предпочтительно 70 С. Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения способа производства кристаллической модификации NF5 гидрата дигидрофосфата 6-(1-метил-1 Нпиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, который включает следующие этапы:(а) растворение ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она кристаллической модификации А 1 в двухкомпонентной смеси растворителей, предпочтительно вода:метанол, наиболее предпочтительно в соотношении 1:1 (об./об.), и быстрое выпаривание смеси растворителей при повышенной температуре, предпочтительно 40-80 С, наиболее предпочтительно 60 С, в вакууме до получения осадка;(b) необязательно дополнительное распространение осадка, полученного на этапе (а), в форме порошка по поверхности, предпочтительно ограниченной поверхности вместилища, более предпочтительно чашки Петри, и последующая его инкубация в герметично закрытом эксикаторе над водой или водными солевыми растворами с определенной относительной влажностью (RH), предпочтительно 80-100%RH, более предпочтительно 90-100% RH, на протяжении одного или нескольких дней или недель. Неожиданно было обнаружено, что цель изобретения в другом аспекте достигается путем обеспечения способа производства кристаллической модификации NF5 гидрата дигидрофосфата 6-(1-метил-1 Нпиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она, который включает этап:(а) распространение дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она кристаллической формы NF3 в форме порошка по поверхности, предпочтительно ограниченной поверхности вместилища, более предпочтительно чашки Петри, и последующая его инкубация в герметично закрытом эксикаторе над водой или водными солевыми растворами с определенной относительной влажностью (RH), предпочтительно 80-100% RH,более предпочтительно 90-100% RH, на протяжении одного или нескольких дней или недель. Краткое описание чертежей Фиг. 1 показывает рентгеновскую дифрактограмму порошка кристаллической модификации А 1 ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она; фиг. 2 - данные рентгеновской структуры монокристалла кристаллической модификации А 1 ангидрата дигидрофосфата 6-(1-метил-1H-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она, наблюдаемого по b-оси; фиг. 3 показывает ИК-спектр с Фурье-преобразованием кристаллической модификации А 1 ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она; фиг. 4 показывает Фурье-Раман-спектр кристаллической модификации А 1 ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Нпиридазин-3-она; фиг. 5 показывает профиль дифференциальной сканирующей калориметрии (дифференциальный сканирующий калориметр Perkin-Elmer Diamond, 5 K/мин, продувка газообразным азотом, 50 мл/мин) кристаллической модификации А 1 ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 6 показывает профиль термогравиметрического анализа (термогравиметрический анализаторPerkin-Elmer Pyris TGA1, 5 K/мин, продувка газообразным азотом, 50 мл/мин) кристаллической модификации А 1 ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 7 показывает изотерму сорбции водяного пара (25 С) (SMS DVS 1) кристаллической модификации А 1, тип а, ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 8 показывает изотерму сорбции водяного пара (25 С) (SMS DVS 1) кристаллической модификации А 1, тип b, ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 9 показывает рентгеновскую дифрактограмму порошка кристаллической модификации H1 дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она; фиг. 10 показывает данные рентгеновской структуры монокристалла кристаллической модификацииH1 дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 11 показывает ИК-спектр с Фурье-преобразованием кристаллической модификации H1 дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она; фиг. 12 показывает профиль дифференциальной сканирующей калориметрии (дифференциальный сканирующий калориметр Perkin-Elmer Diamond, 5 K/мин, продувка газообразным азотом, 50 мл/мин) кристаллической модификации H1 дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 13 показывает профиль термогравиметрического анализа (термогравиметрический анализаторH1 дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 14 показывает изотерму сорбции водяного пара (25 С) (SMS DVS Intrinsic) кристаллической модификации H1 дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 15 показывает рентгеновскую дифрактограмму порошка кристаллической модификации NF3 дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил 2 Н-пиридазин-3-она; фиг. 16 показывает ИК-спектр с Фурье-преобразованием кристаллической модификации NF3 ди- 21019320 гидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил 2 Н-пиридазин-3-она; фиг. 17 показывает Фурье-Раман-спектр кристаллической модификации NF3 дигидрофосфата 6-(1 метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 18 показывает профиль дифференциальной сканирующей калориметрии (дифференциальный сканирующий калориметр Perkin-Elmer Diamond, 5 K/мин, продувка газообразным азотом, 50 мл/мин) кристаллической модификации NF3 дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин 4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 19 показывает профиль термогравиметрического анализа (термогравиметрический анализаторPerkin-Elmer Pyris TGA1, 5 K/мин, продувка газообразным азотом, 50 мл/мин) кристаллической модификации NF3 дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она; фиг. 20 показывает изотерму сорбции водяного пара (25 С) (SMS DVS Intrinsic) кристаллической модификацииNF3 дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 21 показывает рентгеновскую дифрактограмму порошка кристаллической модификации NF5 гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она; фиг. 22 показывает профиль дифференциальной сканирующей калориметрии (дифференциальный сканирующий калориметр Perkin-Elmer Diamond, 5 K/мин, продувка газообразным азотом, 50 мл/мин) кристаллической модификации NF5 гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 23 показывает профиль термогравиметрического анализа (термогравиметрический анализаторNF5 гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она; фиг. 24 показывает изотерму сорбции водяного пара (25 С) (SMS DVS Intrinsic) кристаллической модификации NF5 гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она. Даже без дополнительных деталей предполагается, что специалист в данной области сможет применить представленное выше описание в самом широком объеме. Таким образом, оптимальные варианты осуществления следует рассматривать лишь в качестве иллюстративного описания, которое никоим образом не ограничивает объем изобретения. Содержание приведенных источников, таким образом, включается в полном объеме путем ссылки. Более детально изобретение объясняется на нижеследующих примерах, но не ограничивается ими. Примеры Пример 1. Получение ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации А 1. Способ 1. Приблизительно 118 мг 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин 2-ил]бензил-2 Н-пиридазин-3-она (свободного основания) растворяли в приблизительно 7 мл теплого 2 пропанола. После добавления приблизительно 0,017 мл водного раствора фосфорной кислоты (85%),произошло осаждение. Дисперсию взбалтывали на протяжении 2 ч при комнатной температуре, а затем фильтровали. Образовавшиеся в результате кристаллы высушивали в вакууме при 70 С. 1 Н-ЯМР (d6-DMSO):[ppm] 2,50 (m, 4 Н + DMSO), 2,75 (t, 2H), 3,57 (t, 4H), 3,87 (s, 3 Н), 4,30 (t, 2 Н),5,34 (s, 2 Н), 7,05 (d, 1H), 7,44 (m, 2 Н), 7,80 (d, 1H), 7,89 (s, 1H), 8,21 (m, 2 Н), 8,28 (m, 1H), 8,65 (s, 2H). Ионная хроматография: 19,3 мас.% фосфата (эквивалент молярного отношения кислоты основания 1,14). Способ 2. Приблизительно 500 мг 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин 2-ил]бензил-2 Н-пиридазин-3-она (свободного основания) растворяли в приблизительно 10 мл хлороформа. После добавления приблизительно 2,1 мл этанольного раствора фосфорной кислоты (0,5 ммоль/л) дисперсию взбалтывали в течение 1 ч при комнатной температуре. Образовавшийся в результате осадок фильтровали и собранные кристаллы высушивали в вакууме при 70 С. 1 Н-ЯМР (d6-DMSO):[ppm] 2,55 (m, 4H), 2,80 (t, 2H), 3,60 (m, 4H), 3,88 (s, 3 Н), 4,33 (t, 2 Н), 5,35 (s,2 Н), 7,07 (d, 1H), 7,46 (m, 2H), 7,82 (d, 1H), 7,90 (s, 1H), 8,23 (m, 2H), 8,30 (m, 1H), 8,65 (s,2H). Ионная хроматография: 14,9 мас.% фосфата (эквивалент молярного отношения кислота:основание 0,88). Способ 3. Приблизительно 354 г 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2- 22019320 ил]бензил-2 Н-пиридазин-3-она (свободного основания) диспергировали в приблизительно 450 мл деионизированной воды при 23 С. После добавления приблизительно 57,3 мл водного раствора фосфорной кислоты (85%) дисперсию нагревали до 50 С с получением в результате прозрачного раствора. Раствор охлаждали до 20 С и разбавляли приблизительно 1,2 л ацетона, в результате чего происходила кристаллизация. Дисперсию взбалтывали при 10 С до завершения кристаллизации. Дисперсию оставляли при комнатной температуре в течение нескольких дней, затем охлаждали до 5 С и фильтровали. Образовавшиеся в результате кристаллы промывали ацетоном и высушивали в вакууме при 70 С. Высушенные кристаллы затем кипятили в этаноле в форме дисперсии в течение 30 мин и отфильтровывали из горячей дисперсии. 1 Н-ЯМР (d6-DMSO):[ppm] 2,50 (m, 4H + DMSO), 2,74 (t, 2H), 3,58 (m, 4H), 3,87 (s, 3H), 4,32 (t, 2H),5,34 (s, 2H), 7,05 (d, 1H), 7,45 (m, 2H), 7,82 (d, 1H), 7,89 (s, 1H), 8,22 (m, 2H), 8,28 (m, 1H), 8,65 (s, 2H). Ионная хроматография: 19,5 мас.% фосфата (эквивалент молярного отношения кислота:основание 1,15). Способ 4. Приблизительно 1,1 кг 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она (свободного основания) диспергировали в приблизительно 1,37 л деионизированной воды при 23 С. После добавления приблизительно 240 мл водного раствора фосфорной кислоты (85%) дисперсию нагревали до 50 С с получением в результате прозрачного раствора. Раствор охлаждали до 20 С и медленно разбавляли приблизительно 1 л ацетона при взбалтывании, в результате чего начиналась кристаллизация. Медленно добавляли еще приблизительно 3 л ацетона с получением в результате белой дисперсии, которую взбалтывали при комнатной температуре до следующего дня. Дисперсию фильтровали и образовавшиеся в результате кристаллы промывали ацетоном и высушивали в вакууме при 70 С. 1 Н-ЯМР (d6-DMSO):[ppm] 2,50 (m, 4 Н + DMSO), 2,74 (t, 2H), 3,57 (m, 4H), 3,87 (s, 3 Н), 4,30 (t, 2H),5,34 (s, 2H), 7,05 (d, 1H), 7,45 (m, 2H), 7,82 (d, 1H), 7,89 (s, 1H), 8,22 (m, 2H), 8,28 (m, 1H), 8,64 (s, 2H). Ионная хроматография: 16,8 мас.% фосфата (эквивалент молярного отношения кислота:основание 0,99). Способ 5. Приблизительно 100 г 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2 ил]бензил-2 Н-пиридазин-3-она (свободного основания) диспергировали в приблизительно 171,4 г деионизированной воды при 23 С. После добавления приблизительно 36,55 г водного раствора фосфорной кислоты (85%) раствор фильтровали. Образовавшийся в результате фильтрат разбавляли приблизительно 331,05 г ацетона с получением в результате дисперсии. Дисперсию нагревали до 55 С с получением в результате прозрачного раствора. Раствор охлаждали до -10 С с определенной скоростью охлаждения 0,3K/мин, с получением в результате дисперсии, которую дополнительно суспендировали при -10 С на протяжении 1 ч. Дисперсию фильтровали и образовавшиеся в результате кристаллы промывали ацетоном и высушивали в вакууме при 70 С. 1 Н ЯМР (500 МГц, DMSO)8,64 (s, 2 Н), 8,31-8,26 (m, 1H), 8,25-8,19 (m, 2 Н), 7,89 (s, 1 Н), 7,81 (d,J=9,6, 1 Н), 7,53-7,38 (m, 2 Н), 7,05 (d, J=9,6, 1H), 5,33 (s, 2H), 4,31 (t, J=5,6, 2H), 3,87 (s, 3H), 3,65-3,52 (m,4H), 2,75 (t, J=5,6, 2H), 2,50 (m, 4H). Ионная хроматография: 17,7 мас.% фосфата (эквивалент молярного отношения кислоты основания 1,04). Способ 6. Приблизительно 15,2 кг 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин 2-ил]бензил-2 Н-пиридазин-3-она (свободного основания) диспергировали в приблизительно 31 кг деионизированной воды при Т 30 С. После добавления приблизительно 5,5 кг водного раствора фосфорной кислоты (85%) раствор суспендировали в течение 30 мин, а затем фильтровали. Образовавшийся в результате фильтрат разбавляли при 25 С приблизительно 55,8 кг ацетона с получением в результате дисперсии. Дисперсию нагревали до 62 С с получением в результате прозрачного раствора. Раствор охлаждали до 50 С (температура кожуха термостата) с определенной скоростью охлаждения 0,1 K/мин и суспендировали в течение приблизительно 6,5 ч до получения мутной дисперсии. Дисперсию дополнительно охлаждали до -10 С (температура кожуха термостата) с определенной скоростью охлаждения 0,1K/мин и дополнительно суспендировали в течение приблизительно 1 ч при этой температуре. Дисперсию фильтровали и образовавшиеся в результате кристаллы промывали ацетоном и высушивали в вакууме при 70 С. 1 Н ЯМР (500 МГц, DMSO)8,65 (s, 2H), 8,35-8,26 (m, 1H), 8,25-8,19 (m, 2 Н), 7,89 (s, 1 Н), 7,81 (d,J=9,6, 1 Н), 7,53-7,38 (m, 2 Н), 7,06 (d, J=9,6, 1H), 5,34 (s, 2H), 4,33 (t, J=5,5, 2H), 3,87 (s, 3H), 3,69-3,52 (m,4H), 2,82 (t, J=5,4, 2H), 2,64-2,53 (m, 4H). Ионная хроматография: 17,1 мас.% фосфата (эквивалент молярного отношения кислота:основание 1,01). Пример 2. Получение дигидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации H1. Способ 1. Приблизительно 400 мг ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации А 1 распространяли по чашке Петри и хранили в закрытом эксикаторе над чистой деионизированной водой (атмосфера 100% относительной влажности) в течение 2 недель. 1 Н-ЯМР (d6-DMSO):[ppm] 2,50 (m, 4 Н + DMSO), 2,74 (t, 2H), 3,57 (m, 4H), 3,87 (s, 3 Н), 4,30 (t, 2H),5,34 (s, 2H), 7,05 (d, 1H), 7,45 (m, 2H), 7,82 (d, 1H), 7,89 (s, 1H), 8,22 (m, 2H), 8,29 (m, 1H), 8,65 (s, 2H). Ионная хроматография: 17,1 мас.% фосфата (эквивалент молярного отношения кислота:основание 1,08 на основе фосфатной соли с наблюдаемым содержанием воды, как указано ниже). Титрование по Карлу Фишеру: 6,5 мас.% воды. Способ 2. Приблизительно 45 мг ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации А 1 диспергировали в приблизительно 0,2 мл двухкомпонентной смеси деионизированной воды/этанола (1:1, об./об.) и встряхивали в виде суспензии при 50 С при 1000 об/мин в течение 7 дней. Затем дисперсию фильтровали и образовавшиеся в результате кристаллы высушивали при внешних условиях на фильтре. Способ 3. Приблизительно 45 мг ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации А 1 диспергировали в приблизительно 0,2 мл двухкомпонентной смеси деионизированной воды/метанола (1:1, об./об.) и встряхивали в виде суспензии при 50 С при 1000 об/мин в течение 7 дней. Затем дисперсию фильтровали и образовавшиеся в результате кристаллы высушивали при внешних условиях на фильтре. Способ 4. Приблизительно 50 мг ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации А 1 диспергировали в приблизительно 0,2 мл двухкомпонентной смеси деионизированной воды/2 пропанола (1:1, об./об.) и встряхивали в виде суспензии при 50 С при 1000 об/мин в течение 7 дней. Затем дисперсию фильтровали и образовавшиеся в результате кристаллы высушивали при внешних условиях на фильтре. Способ 5. Приблизительно 30 мг ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации А 1 диспергировали в приблизительно 0,2 мл двухкомпонентной смеси деионизированной воды/ацетона (1:1, об./об.) и встряхивали в виде суспензии при 50 С при 1000 об/мин в течение 7 дней. Затем дисперсию фильтровали и образовавшиеся в результате кристаллы высушивали при внешних условиях на фильтре. Способ 6. Приблизительно 65 мг ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации А 1 диспергировали в приблизительно 0,2 мл двухкомпонентной смеси деионизированной воды/THF(1:1, об./об.) и встряхивали в виде суспензии при 50 С при 1000 об/мин в течение 7 дней. Затем дисперсию фильтровали и образовавшиеся в результате кристаллы высушивали при внешних условиях на фильтре. Способ 7. Приблизительно 50 мг ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации А 1 диспергировали в приблизительно 0,15 мл двухкомпонентной смеси деионизированной воды/ацетонитрила (1:1, об./об.) и встряхивали в виде суспензии при 50 С при 1000 об/мин в течение 7 дней. Затем дисперсию фильтровали и образовавшиеся в результате кристаллы высушивали при внешних условиях на фильтре. Пример 3. Получение дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации NF3. Способ 1. Приблизительно 30 мг ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации А 1 растворяли в приблизительно 3 мл двухкомпонентной смеси деионизированной воды/этанола(1:1, об./об.). Кристаллизация происходила при выпаривании растворителя при внешних условиях. Кристаллы отделяли путем фильтрации и высушивали при внешних условиях на фильтре. Способ 2. Приблизительно 155 мг ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации А 1 растворяли в приблизительно 15 мл двухкомпонентной смеси деионизированной воды/1,4 диоксана (1:1, об./об.). Кристаллизация происходила при выпаривании растворителя при 50 С. Кристаллы отделяли путем фильтрации и высушивали при внешних условиях на фильтре. 1 Н ЯМР (500 МГц, DMSO) d 8,63 (s, 2H), 8,31-8,26 (m, 1H), 8,25-8,18 (m, 2H), 7,89 (s, 1H), 7,80 (d,J=9,6, 1H), 7,55-7,40 (m, 2H), 7,05 (d, J=9,6, 1H), 5,34 (s, 2H), 4,31 (t, J=5,6, 2H), 3,87 (s, 3H), 3,80-3,30 (m,4H) 2,74 (t, J=5,5, 2H), 2,50 (m, 4H). Ионная хроматография: 16,0 мас.% фосфата (эквивалент молярного отношения кислота:основание 0,94). Пример 4. Получение гидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации NF5. Способ 1. Приблизительно 100 мг ангидрата дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации А 1 растворяли в приблизительно 1 мл двухкомпонентной смеси деионизированной воды/метанола(1:1 об.:об.). Раствор нагревали до 60 С и одновременно откачивали для быстрого выпаривания растворителя. Образовавшийся в результате осадок распространяли в форме порошка по чашке Петри, а затем инкубировали в герметично закрытом эксикаторе над насыщенным солевым раствором KNO3 (94% RH) в течение нескольких дней. 1 Н ЯМР (500 МГц, DMSO) d 8,64 (s, 2 Н), 8,31-8,25 (m, 1H), 8,25-8,19 (m, 2H), 7,88 (s, 1H), 7,80 (d,J=9,6, 1H), 7,52-7,38 (m, 2H), 7,04 (d, J=9,6, 1H), 5,33 (s, 2H), 4,30 (t, J=5,6, 2H), 3,87 (s, 3H), 3,66-3,50 (m,4H), 2,73 (t, J=5,6, 2H), 2,50 (m, 4H). Ионная хроматография: 14,8 мас.% фосфата (эквивалент молярного отношения кислота:основание 0,94 на основе фосфатной соли с наблюдаемым содержанием воды, как указано ниже). Титрование по Карлу Фишеру: 7,3 мас.% воды. Способ 2. Приблизительно 100 мг дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации NF3 распространяли в форме порошка по чашке Петри, а затем инкубировали в герметично закрытом эксикаторе над насыщенным солевым раствором KNO3 (94% RH) в течение нескольких дней. Пример 5. Структурная и физико-химическая характеризация ангидрата дигидрофосфата 6-(1 метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации А 1. Характер порошковой рентгеновской дифракции (XRD) кристаллической модификации А 1 определяли стандартными способами, как описано в 6-м изд. Европейской фармакопеи, глава 2.9.33. Кристаллическая модификация А 1 характеризуется порошковой рентгеновской дифрактограммой (Cu-K1 излучение, =1,5406 , дифрактометр Stoe StadiP 611 KL.), показанной на фиг. 1. Кристаллическая модификация А 1 характеризуется следующими данными дифракционного рентгеновского анализа. Список пиков порошковой рентгеновской дифрактограммы Данные рентгеновской структуры монокристалла также получали на кристаллической модификации А 1 (дифрактометр XCalibur от Oxford Diffraction, оснащенный графитовым монохроматором и CCD детектором с применением Мо K-излучение при 301 K). Структура монокристалла кристаллической модификации А 1, наблюдаемого по b-оси, показана на фиг. 2. Кристаллическая модификация А 1 кристаллизуется в моноклинной пространственной группе С 2/с с параметрами решетки а=55,1 , b=7,9 , с=12,2 и =102,2 (при ==90). Структура монокристалла явно свидетельствует, что кристаллическая модификация А 1 представляет безводную форму. Кристаллическая модификация А 1 далее характеризовалась при помощи инфракрасной и рамановской спектроскопии. Фурье-Раман и Фурье-ИК-спектры получали стандартными способами, как описано в 6-м изд. Европейской фармакопеи, глава 2.02.24 и 2.02.48. Для измерения Фурье-ИК- и Фурье-Раманспектров применяли спектрометр Bruker Vector 22 и Bruker RFS 100. Фурье-ИК-спектры корректировались по базисной линии с применением программы Bruker OPUS. Векторы Фурье-Раман-спектров были нормализованы при помощи той же программы. ИК-спектр с Фурье-преобразованием получали с использованием гранул KBr в качестве способа приготовления образца. ИК-спектр с Фурье-преобразованием показан на фиг. 3 и ниже добавлены позиции в диапазоне. Кристаллическая модификация А 1. Позиции ИК-диапазона +2 см-1 (относительная интенсивность): 2949 см-1 (w), 2885 см-1 (w), 2368 см-1 (w, broad), 1661 см-1 (s), 1603 см-1 (s), 1549 см-1 (m), 1446 см-1 (s),1429 см-1 (s), 1283 см-1 (s), 1261 см-1 (m), 1226 см-1 (m), 1132 см-1 (s), 1068 см-1 (s), 945 см-1 (s), 854 см-1 (s),713 см-1 (m);"s"=сильный (коэффициент пропускания 50%), "m"=средний (50%коэффициент пропускания 70%), "w"=слабый (коэффициент пропускания 70%). Фурье-Раман-спектр показан на фиг. 4 и ниже добавлены позиции в диапазоне. Кристаллическая модификация А 1. Позиции полосы комбинационного рассеяния 2 см-1 (относительная интенсивность): 3061 см-1 (w), 2951 см-1 (w), 1604 см-1 (s), 1579 см-1 (s), 1568 см-1 (m), 1515 см-1"s"=сильный (относительная интенсивность комбинационного рассеяния 0,04), "m"=средний(0,04 относительная интенсивность комбинационного рассеяния 0,02), "w"=слабый (относительная интенсивность комбинационного рассеяния 0,02). Кристаллическая модификация А 1 является кристаллической безводной формой, которая дополнительно характеризуется следующими физическими свойствами. Термическая характеристика предполагает пик плавления приблизительно 207 С с очень низкой потерей массы до температуры плавления. DSC-профиль (дифференциальный сканирующий калориметрPerkin-Elmer Diamond, 5 K/мин, продувка газообразным азотом, 50 мл/мин) и TGA-профиль (термогравиметрический анализатор Perkin-Elmer Pyris TGA1, 5 K/мин, продувка газообразным азотом, 50 мл/мин) показаны на фиг. 5 и 6 соответственно. Характеристика сорбции водяного пара предполагает низкий уровень водопоглощения при адсорбции в диапазоне 0-70% относительной влажности (RH) (кристаллическая модификация А, тип а) и 0-90%RH (кристаллическая модификация А, тип b) соответственно. Наблюдается выраженный уровень водопоглощения свыше 70% RH (кристаллическая модификация А, тип а) и свыше 90% RH (кристаллическая модификация А, тип b), соответственно в результате чего образуется кристаллическая модификация H1 дигидрата (уровень водопоглощения приблизительно 6 мас.%) при повышенной относительной влажности (RH). Изотермы сорбции водяного пара [Water Vapour Sorption Isotherm (25C) (SMS DVS 1)] кристаллической модификации A1 (типы а и b) показаны на фиг. 7 и 8 соответственно. Пример 6. Структурная и физико-химическая характеризация дигидрата дигидрофосфата 6-(1 метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации H1. Характер порошковой рентгеновской дифракции (XRD) кристаллической модификации H1 определяли стандартными способами, как описано в 6-м изд. Европейской фармакопеи, глава 2.9.33. Кристаллическая модификация H1 характеризуется порошковой рентгеновской дифрактограммой (Cu-K1 излучение, =1,5406 , дифрактометр Stoe StadiP 611 KL.), показанной на фиг. 9. Кристаллическая модификация H1 характеризуется следующими данными дифракционного рентгеновского анализа. Список пиков порошковой рентгеновской дифрактограммы Данные рентгеновской структуры монокристалла также получали на кристаллической модификации H1 (дифрактометр XCalibur от Oxford Diffraction, оснащенный графитовым монохроматором и CCD детектором с применением Мо K-излучение при 301 K). Структура монокристалла кристаллической модификации H1 показана на фиг. 10. Кристаллическая модификация H1 кристаллизуется в моноклинной пространственной группе Р 21/С с параметрами решетки а=28,2 , b=8,1 , с=12,3 и =94,1 (при ==90). Структура монокристалла явно свидетельствует, что кристаллическая модификация H1 представляет стехиометрический дигидрат. Кристаллическая модификация H1 далее характеризовалась при помощи инфракрасной спектроскопии. Фурье-ИК-спектры получали стандартными способами, как описано в 6-м изд. Европейской фармакопеи, глава 2.02.24 и 2.02.48. Для измерения Фурье-ИК-спектров применяли спектрометр BrukerVector 22. Фурье-ИК-спектры корректировались по базисной линии с применением программы BrukerOPUS. ИК-спектр с Фурье-преобразованием получали с использованием гранул KBr в качестве способа приготовления образца. ИК-спектр с Фурье-преобразованием показан на фиг. 11 и ниже добавлены позиции в диапазоне. Кристаллическая модификация H1. Позиции ИК-диапазона +2 см-1 (относительная интенсивность): 2984 см-1 (s), 2944 см-1 (s), 2451"s"=сильный (коэффициент пропускания 50%), "m"=средний (50%коэффициент пропускания 70%), "w"=слабый (коэффициент пропускания 70%). Фурье-Раман-спектроскопия кристаллической модификации H1 демонстрирует спектр, идентичный спектру кристаллической модификации А 1, поскольку дегидратация с удалением гидратной воды происходит вследствие лазерного возбуждения. Кристаллическая модификация H1 является кристаллической дигидратной формой, которая дополнительно характеризуется следующими физическими свойствами. Термическая характеристика предполагает дегидратацию с удалением гидратной воды с приблизительно 30-120 С при нагревании, с последующим плавлением безводной формы при приблизительно 208 С. DSC-профиль (дифференциальный сканирующий калориметр Perkin-Elmer Diamond, 5 K/мин,продувка газообразным азотом, 50 мл/мин) и TGA-профиль (термогравиметрический анализатор PerkinElmer Pyris TGA1, 5 K/мин, продувка газообразным азотом, 50 мл/мин) показаны на фиг. 12 и 13 соответственно. Характеристика сорбции водяного пара предполагает потерю гидратной воды 40% относительной влажности (RH) с обратным преобразованием в дигидратную кристаллическую модификацию H1 после адсорбции 70% RH. Изотерма сорбции водяного пара (25 С) формы H1 показывается ниже. Изотерма сорбции водяного пара [Water Vapour Sorption Isotherm (25C) (SMS DVS Intrinsic)] кристаллической модификации H1 показывается на фиг. 14. Пример 7. Структурная и физико-химическая характеризация дигидрофосфата 6-(1-метил-1 Нпиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации NF3. Характер порошковой рентгеновской дифракции (XRD) кристаллической модификации NF3 определяли стандартными способами, как описано в 6-м изд. Европейской фармакопеи, глава 2.9.33. Кристаллическая модификация NF3 характеризуется порошковой рентгеновской дифрактограммой (Cu-K1 излучение, =1,5406 , дифрактометр Stoe StadiP 611 KL.), показанной на фиг. 15. Кристаллическая модификация NF3 характеризуется следующими данными дифракционного рентгеновского анализа. Список пиков порошковой рентгеновской дифрактограммы Кристаллическая модификация NF3 далее характеризовалась при помощи инфракрасной и рамановской спектроскопии. Фурье-Раман и Фурье-ИК-спектры получали стандартными способами, как описано в 6-м издании Европейской фармакопеи, глава 2.02.24 и 2.02.48. Для измерения Фурье-ИК- и ФурьеРаман-спектров применяли спектрометр Bruker Vector 22 и Bruker RFS 100. Фурье-ИК-спектры корректировались по базисной линии с применением программы Bruker OPUS. Векторы Фурье-Раман-спектров были нормализованы при помощи той же программы. ИК-спектр с Фурье-преобразованием получали с использованием гранул KBr в качестве способа приготовления образца. ИК-спектр с Фурье-преобразованием показан на фиг. 16 и ниже добавлены позиции в диапазоне. Кристаллическая модификация NF3. Позиции ИК-диапазона +2 см-1 (относительная интенсивность): 2949 см-1 (m), 2873 см-1 (w), 2365"s"=сильный (коэффициент пропускания 50%), "m"=средний (50%коэффициент пропускания 70%), "w"=слабый (коэффициент пропускания 70%). Фурье-Раман-спектр показан на фиг. 17 и ниже добавлены позиции в диапазоне. Кристаллическая модификация NF3. Позиции полосы комбинационного рассеяния 2 см-1 (относительная интенсивность): 3061 см-1"s"=сильный (относительная интенсивность комбинационного рассеяния 0,04), "m"=средний(0,04 относительная интенсивность комбинационного рассеяния 0,02), "w"=слабый (относительная интенсивность комбинационного рассеяния 0,02). Кристаллическая модификация NF3 является кристаллической формой, наиболее вероятно - ангидратной формой, которая дополнительно характеризуется следующими физическими свойствами. Термическая характеристика предполагает два экзотермических явления при приблизительно 100130 С и 180-190 С с последующим пиком плавления при приблизительно 208 С, с небольшой потерей массы приблизительно 1,5 мас.% до температуры плавления. DSC-профиль (дифференциальный сканирующий калориметр Perkin-Elmer Diamond, 5 K/мин, продувка газообразным азотом, 50 мл/мин) и TGAпрофиль (термогравиметрический анализатор Perkin-Elmer Pyris TGA1, 5 K/мин, продувка газообразным азотом, 50 мл/мин) показаны на фиг. 18 и 19 соответственно. Характеристика сорбции водяного пара предполагает низкий уровень водопоглощения при адсорбции в диапазоне 0-70% относительной влажности (RH). Наблюдается выраженный уровень водопоглощения свыше 70% RH, в результате чего образуется кристаллическая гидратная модификация NF5 (уровень водопоглощения приблизительно 5-6 мас.%) при повышенной относительной влажности (RH). Изотерма сорбции водяного пара [Water Vapour Sorption Isotherm (25C) (SMS DVS Intrinsic)] кристаллической модификации NF3 показывается на фиг. 20. Пример 8. Структурная и физико-химическая характеризация гидрата дигидрофосфата 6-(1-метил 1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она в его кристаллической модификации NF5. Характер порошковой рентгеновской дифракции (XRD) кристаллической модификации NF5 определяли стандартными способами, как описано в 6-м изд. Европейской фармакопеи, глава 2.9.33. Кристаллическая модификация NF5 характеризуется порошковой рентгеновской дифрактограммой (Cu-K1- 28019320 излучение, =1,5406 , дифрактометр Stoe StadiP 611 KL.), показанной на фиг. 21. Кристаллическая модификация NF5 характеризуется следующими данными дифракционного рентгеновского анализа. Список пиков порошковой рентгеновской дифрактограммы Кристаллическая модификация NF5 является кристаллической гидратной формой, которая дополнительно характеризуется следующими физическими свойствами. Термическая характеристика предполагает дегидратацию с удалением гидратной воды с приблизительно 30-100 С при нагревании, с последующим плавлением безводной формы при приблизительно 210 С. DSC-профиль (дифференциальный сканирующий калориметр Perkin-Elmer Diamond, 5 K/мин,продувка газообразным азотом, 50 мл/мин) и TGA-профиль (термогравиметрический анализатор PerkinElmer Pyris TGA1, 5 K/мин, продувка газообразным азотом, 50 мл/мин) показаны на фиг. 22 и 23 соответственно. Характеристика сорбции водяного пара предполагает потерю гидратной воды 40% относительной влажности (RH) с обратным преобразованием в гидратную кристаллическую модификацию NF5 после адсорбции 70% RH. Изотерма сорбции водяного пара (25 С) формы NF5 показывается ниже. Изотерма сорбции водяного пара [Water Vapour Sorption Isotherm (25C) (SMS DVS Intrinsic)] кристаллической модификации NF5 показывается на фиг. 24. Пример 9. Определение растворимости дигидрофосфата 6-(1-метил-1H-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она. Для определения растворимости 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4 илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-он (свободное основание) и его дигидрофосфатную соль отвешивают в GC-пробирку, добавляют 300 мкл растворяющей среды для достижения максимально возможной концентрации 10 мг/мл. Смесь перемешивают при 1000 об/мин на платформе магнитной мешалки при окружающей температуре. В момент отбора пробы 100 мкл соответствующего раствора/суспензии переносят в 500 мкл пробирку Эппендорфа и подвергают центрифугированию в течение 5 мин при 14000 об/мин. Центрифугат анализируют путем высокоэффективной жидкостной хроматографии (перед анализом может потребоваться разбавление). Табл. 1 показывает растворимость свободного основания 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2 морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3-она и его соответствующей дигидрофосфатной соли в воде, измеряемую через 1 и 2 ч. Таблица 1 Результаты отчетливо демонстрируют значительно более высокую растворимость дигидрофосфата 6-(1-метил-1 Н-пиразол-4-ил)-2-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил-2 Н-пиридазин-3 она в водных растворах по сравнению с его свободным основанием.
МПК / Метки
МПК: A61K 31/506, A61P 35/02, C07D 403/14
Метки: 6-(1-метил-1h-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2h-пиридазин-3-она, новые, формы, полиморфные, дигидрофосфата, способы, получения
Код ссылки
<a href="https://eas.patents.su/30-19320-novye-polimorfnye-formy-digidrofosfata-6-1-metil-1h-pirazol-4-il-2-3-5-2-morfolin-4-iletoksipirimidin-2-ilbenzil-2h-piridazin-3-ona-i-sposoby-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые полиморфные формы дигидрофосфата 6-(1-метил-1h-пиразол-4-ил)-2-{3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]бензил}-2h-пиридазин-3-она и способы их получения</a>
Предыдущий патент: Способ получения ковалентного конъюгата полиэтиленгликоля с интерфероном и способ получения активированного пэг-агента
Следующий патент: Устройство для создания подъемной силы (варианты)
Случайный патент: Индолопиридины в качестве модуляторов кинезина eg5