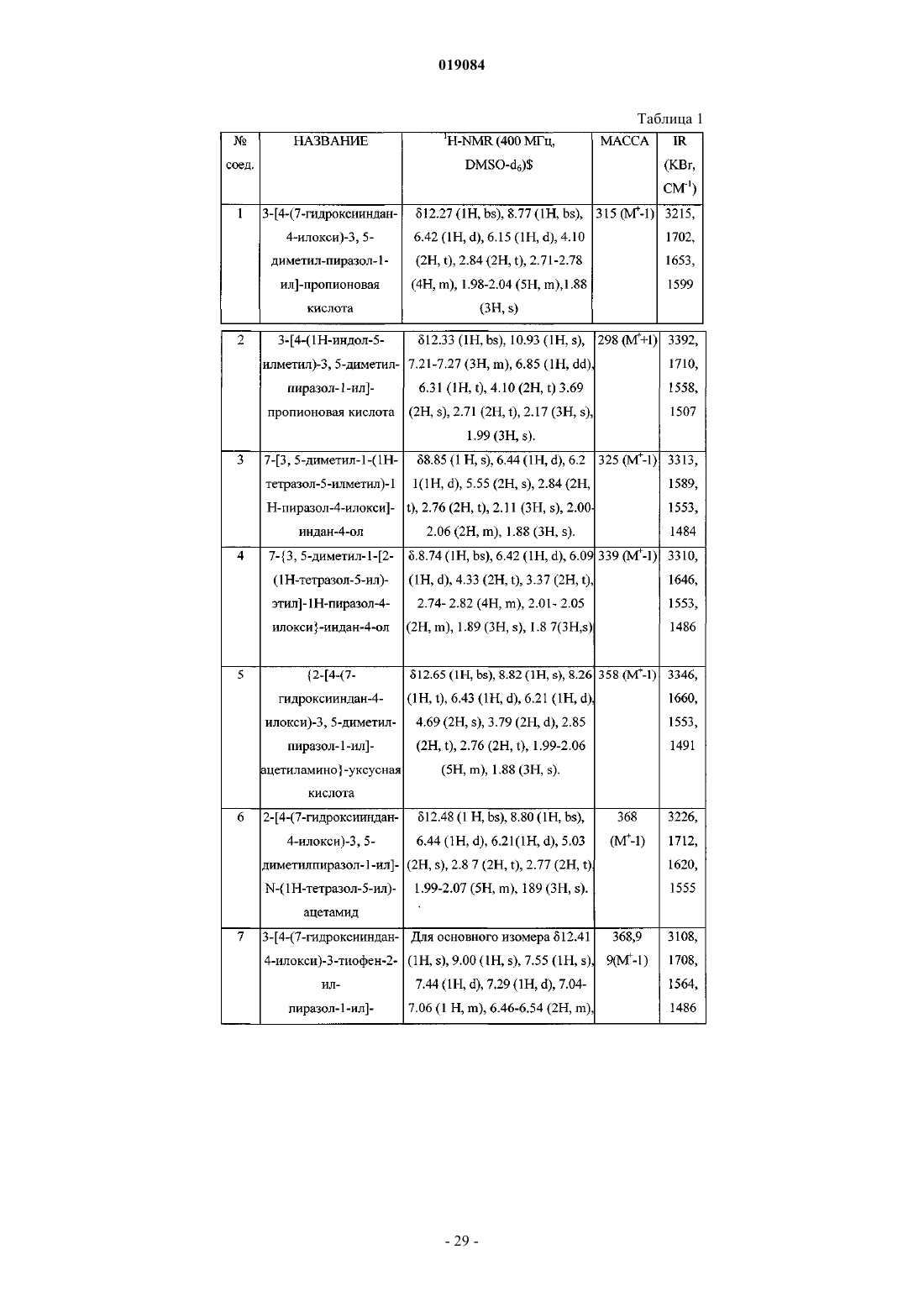
Новые тиреоидные соединения для лечения заболеваний, связанных с нарушением обмена веществ
Номер патента: 19084
Опубликовано: 30.01.2014
Авторы: Чхипа Лаксмикант, Замбад Шиталкумар Пукхарадж, Тули Давиндер, Сиддикуи М.Амир, Мунши Сиралее, Дутт С., Бхаттамисра Субрат Кумар, Чаутхайвале Виджай, Касундра Ашок, Гупта Рамеш
Формула / Реферат
1. Соединение формулы (I)
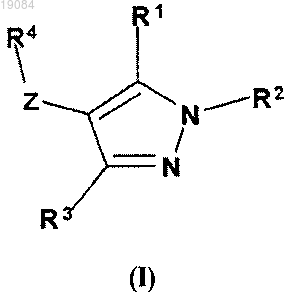
где R1 и R3 являются одинаковыми или различными и независимо выбраны из группы, включающей Н, (C1-C6)алкил, (С3-С7)циклоалкил, CF3, -О-(C1-C6)алкил, -NH2 или R6;
R2 выбран из группы, включающей (C1-C6)алкил, -С(О)-(C1-С3)алкил-СООН, (C1-C3)алкил-СООН, -С(О)-(С1-С3)алкил-СОО-(C1-C6)алкил, -С(О)-С(О)О-(C1-C6)алкил, -С(О)-(C1-C3)алкил-NH-(С1-С6)алкил, -С(О)-О-(C1-С6)алкил, -C(O)NR5, -С(О)NH-(C1-C6)алкил, -С(О)-(C1-C3)алкил-(C6-C10)арил, -С(О)-(С1-С3)алкил-R6, R6 или R7, где указанный (C1-C6)алкил по выбору замещен одним или несколькими заместителями, выбранными из группы, включающей в себя оксо, -С(О)ОН, -С(О)-О-(C1-C3)алкил, -С(О)-О-(C1-C3)алкил-(С6-С10)арил,
-С(О)-О-(C1-C3)алкил-R6, -CONH2, -CONH(C1-С3)алкил, -C(O)NH-(C6-C10)арил, -C(O)NH-R6, -CONR5,
-CONHNH2, -C(=NH)NH-(C1-C6)алкил, -C(=NH)NH2, -C(=NH)NHOH, -C(O)-R8, С(О)NHSO2(С1-С6)алкил,
-NH-С(О)-(C1-C3)алкил, -NHSO2(С1-С6)алкил, -ОН, R6 или R7;
R5 вместе с атомом азота, к которому он присоединен, образует насыщенное или ненасыщенное (C3-C6)-членное кольцо, которое может дополнительно содержать 1-2 гетероатома, выбираемых из О, N и S, при этом кольцо может быть по выбору замещено одной или несколькими группами -СООН;
R6 выбран из фенила или 5-8-членного гетероарила, содержащего 1-4 гетероатома, выбранных из О, N и S, при этом данное гетероарильное или фенильное кольцо по выбору замещено одним или несколькими заместителями, выбранными из группы, включающей в себя галоген, -ОН, -О-(C1-C6)алкил, -(C1-C6)алкил или -SO2-(C1-C6)алкил;
R7 представляет собой 3-6-членное гетероциклическое кольцо, содержащее 1-4 гетероатома, выбранных из О, N и S, при этом данное гетероциклическое кольцо по выбору замещено одним или несколькими заместителями, выбранными из группы, включающей в себя оксо, (C1-С6)алкил или -SO2-(C6-C10)арил(C1-C6)алкил;
R8 является аминокислотой, присоединенной через атом азота;
Z=О, СН2 или NH;
R4 выбран из Р, Q или Т
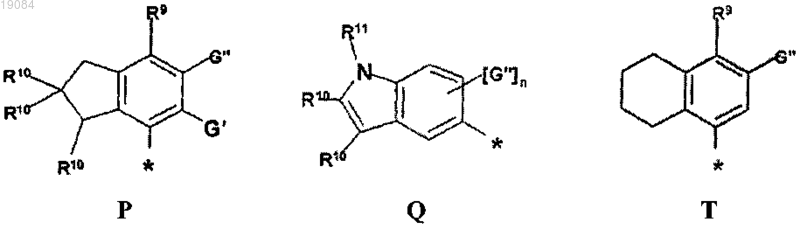
R9 выбран из группы, включающей в себя -ОН, -О-(C1-C6)алкил, галоген или -ОС(О)-(C1-C6)алкил;
R10 выбран из группы, включающей в себя Н, (C1-C6)алкил или (С6-С10)арилокси;
R11 представляет собой водород;
G' представляет собой водород;
G" выбран из группы, включающей в себя водород, (C1-C6)алкил, (C6-С10)арил, галоген, (C1-C3)алкил(C6-C10)арил или -CONR5;
n может быть равным 1 или 2;
при условии, что когда R4 представляет собой Q, R2 отличается от R6 и R7;
включая его фармацевтически приемлемые соли, гидраты и сольваты.
2. Соединение по п.1, в котором R4 выбран из Р или Т.
3. Соединение, выбранное из группы, состоящей из следующего:
1) 3-[4-(7-гидроксииндан-4-илокси)-3,5-диметилпиразол-1-ил]пропионовая кислота;
2) 3-[4-(1Н-индол-5-илметил)-3,5-диметилпиразол-1-ил]пропионовая кислота;
3) 7-[3,5-диметил-1-(1Н-тетразол-5-илметил)-1Н-пиразол-4-илокси]индан-4-ол;
4) 7-{3,5-диметил-1-[2-(1Н-тетразол-5-ил)этил]-1Н-пиразол-4-илокси}индан-4-ол;
5) {2-[4-(7-гидроксииндан-4-илокси)-3,5-диметилпиразол-1-ил]ацетиламино}уксусная кислота;
6) 2-[4-(7-гидроксииндан-4-илокси)-3,5-диметилпиразол-1-ил]-N-(1Н-тетразол-5-ил)ацетамид;
7) 3-[4-(7-гидроксииндан-4-илокси)-3-тиофен-2-ил-пиразол-1-ил]пропионовая кислота и 3-[4-(7-гидроксииндан-4-илокси)-5-тиофен-2-ил-пиразол-1-ил]пропионовая кислота;
8) 7-[1-(1Н-тетразол-5-илметил)-3-тиофен-2-ил-1Н-пиразол-4-илокси]индан-4-ол и 7-[1-(1Н-тетразол-5-илметил)-5-тиофен-2-ил-1Н-пиразол-4-илокси]индан-4-ол;
9) 3-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]пропионовая кислота;
10) 5-[4-(7-гидроксииндан-4-илокси)-3,5-диметилпиразол-1-илметил]-1Н-пиразол-3-ол;
11) 2-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]уксусная кислота;
12) 7-[1-(2-гидроксиэтил)-3,5-диметил-1Н-пиразол-4-илметил]-5-метилиндан-4-ол;
13) [4-(1Н-индол-5-илметил)-3,5-диметилпиразол-1-ил]уксусная кислота;
14) 3-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]пропионовая кислота;
15) 7-[3,5-диметил-1-(1Н-тетразол-5-илметил)-1Н-пиразол-4-илметил]-5-метилиндан-4-ол;
16) 7-[3,5-диизопропил-1-(1Н-тетразол-5-илметил)-1Н-пиразол-4-илметил]-5-метилиндан-4-ол;
17) 3-[3,5-дициклопропил-4-(7-гидроксииндан-4-илокси)пиразол-1-ил]пропионовая кислота;
18) 3-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диизопропил-пиразол-1-ил]пропионовая кислота;
19) [3,5-диэтил-4-(7-гидрокси-6-метилиндан-4-илметил)пиразол-1-ил]уксусная кислота;
20) 3-[3,5-диэтил-4-(7-гидрокси-6-метилиндан-4-илметил)пиразол-1-ил]пропионовая кислота;
21) 7-[3,5-диэтил-1-(1Н-тетразол-5-илметил)-1Н-пиразол-4-илметил]-5-метилиндан-4-ол;
22) [3,5-дициклопропил-4-(7-гидроксииндан-4-илокси)пиразол-1-ил]уксусная кислота;
23) 3-[3,5-диэтил-4-(1Н-индол-5-илметил)пиразол-1-ил]пропионовая кислота;
24) 2-[4-(1Н-индол-5-илметил)-3,5-диметилпиразол-1-ил]этанол;
25) [4-(7-гидроксииндан-4-илокси)-3,5-диметилпиразол-1-ил]уксусная кислота;
26) 3-[4-(6-хлор-7-гидроксииндан-4-илметил)-3,5-диэтилпиразол-1-ил]пропионовая кислота;
27) [4-(6-хлор-7-гидроксииндан-4-илметил)-3,5-диэтилпиразол-1-ил]уксусная кислота;
28) 3-{4-[7-гидрокси-6-(пирролидин-1-карбонил)индан-4-илметил]-3,5-диметилпиразол-1-ил}пропионовая кислота;
29) 3-[4-(6-хлор-7-гидроксииндан-4-илметил)-3,5-диметилпиразол-1-ил]пропионовая кислота;
30) 1-{2-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]ацетил}пирролидин-2-карбоновая кислота;
31) 7-[3,5-диметил-1-(1Н-тетразол-5-илметил)-1Н-пиразол-4-илокси]-5-метилиндан-4-ол;
32) [4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диизопропилпиразол-1-ил]уксусная кислота;
33) 3-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]-N-изопропилпропионамид;
34) [4-(7-гидрокси-6-метилиндан-4-илокси)-3,5-диметилпиразол-1-ил]уксусная кислота;
35) 3-[4-(7-гидрокси-6-метилиндан-4-илокси)-3,5-диметилпиразол-1-ил]пропионовая кислота;
36) 4-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]масляная кислота;
37) 3-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]-N-(1Н-тетразол-5-ил)пропионамид;
38) 5-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-илметил]-3Н-[1,3,4]оксадиазол-2-он;
39) 7-{3,5-диметил-1-[2-(1Н-тетразол-5-ил)этил]-1Н-пиразол-4-илметил}-5-метилиндан-4-ол;
40) {2-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]ацетиламино}уксусная кислота;
41) 5-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-илметил]-1Н-пиразол-3-ол;
42) 5-[3,5-диэтил-4-(7-гидрокси-6-метилиндан-4-илметил)пиразол-1-илметил]-3Н-[1,3,4]оксадиазол-2-он;
43) 5-{2-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]этил}-3H-[1,3,4]оксадиазол-2-он;
44) {2-[3,5-диэтил-4-(7-гидрокси-6-метилиндан-4-илметил)пиразол-1-ил]ацетиламино}уксусная кислота;
45) 6-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-илметил]-2-метил-3H-пиримидин-4-он;
46) 3-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-илметил]-[1,2,4]оксадиазол-5-ол;
47) 7-(1-бензил-3,5-диметил-1Н-пиразол-4-илметил)-5-метилиндан-4-ол;
48) 3-{4-[7-гидрокси-6-(4-метилбензил)индан-4-илметил]-3,5-диметилпиразол-1-ил}пропионовая кислота;
49) 2-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]пропионовая кислота;
50) 3-[4-(7-гидрокси-6-изопропилиндан-4-илметил)-3,5-диметилпиразол-1-ил]пропионовая кислота;
51) {4-[7-гидрокси-6-(4-метилбензил)индан-4-илметил]-3,5-диметилпиразол-1-ил}уксусная кислота;
52) 3-{4-[6-(4-фторбензил)-7-гидроксииндан-4-илметил]-3,5-диметилпиразол-1-ил}пропионовая кислота;
53) {4-[6-(4-фторбензил)-7-гидроксииндан-4-илметил]-3,5-диметилпиразол-1-ил}уксусная кислота;
54) натриевая соль 4-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]масляной кислоты;
55) магниевая соль 3-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]пропионовой кислоты;
56) натриевая соль 3-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]пропионовой кислоты;
57) 3-{3,5-диэтил-4-[6-(4-фторбензил)-7-гидроксииндан-4-илметил]пиразол-1-ил}пропионовая кислота;
58) этиловый эфир 3-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]-3-оксо-пропионовой кислоты;
59) [3,5-диэтил-4-(7-метокси-6-метилиндан-4-илметил)пиразол-1-ил]гидразид уксусной кислоты;
60) N-гидрокси-2-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]ацетамидин;
61) этиловый эфир [4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]оксоуксусной кислоты;
62) [4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]морфолин-4-ил-метанон;
63) 1-(4-хлорфенил)-4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметил-1Н-пиразол;
64) 2-(4-метансульфонилфенил)-1-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]этанон;
65) этиловый эфир 4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-карбоновой кислоты;
66) пропан-2-сульфоновая кислота {3-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]пропионил}амид;
67) 3-[5-этокси-4-(7-метокси-6-метилиндан-4-илметил)-3-метилпиразол-1-ил]пропионовая кислота или 3-[3-этокси-4-(7-метокси-6-метилиндан-4-илметил)-5-метилпиразол-1-ил]пропионовая кислота;
68) [4-(7-гидрокси-3,6-диметилиндан-4-илметил)-3,5-диметилпиразол-1-ил]уксусная кислота;
69) 2-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-илметил]глутаровая кислота;
70) [4-(7-метокси-2,2,6-триметилиндан-4-илметил)-3,5-диметилпиразол-1-ил]уксусная кислота;
71) N-{2-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]этил}ацетамид;
72) N-{2-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]этил}метансульфонамид;
73) 4-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]-1-(толуол-4-сульфонил)пиперидин;
74) {3,5-диэтил-4-[6-(4-фторбензил)-7-гидроксииндан-4-илметил]пиразол-1-ил}уксусная кислота;
75) 3-{4-[7-метокси-6-(4-метоксифенил)индан-4-илметил]-3,5-диметилпиразол-1-ил}пропионовая кислота;
76) 2-[3,5-диэтил-4-(7-гидрокси-6-метилиндан-4-илметил)пиразол-1-ил]-N-изопропилацетамид;
77) метиловый эфир 3-[4-(7-этоксикарбонилокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]пропионовой кислоты;
78) натриевая соль [3,5-диэтил-4-(7-гидрокси-6-метилиндан-4-илметил)пиразол-1-ил]уксусной кислоты;
79) 3-[4-(7-метокси-6-метилиндан-4-илметил)-3-метил-5-трифторметилпиразол-1-ил]пропионовая кислота и 3-[4-(7-метокси-6-метилиндан-4-илметил)-5-метил-3-трифторметилпиразол-1-ил]пропионовая кислота;
80) [4-(4-гидрокси-3-метил-5,6,7,8-тетрагидронафтален-1-илметил)-3,5-диметилпиразол-1-ил]уксусная кислота;
81) [4-(7-хлориндан-4-илокси)-3-тиофен-2-ил-пиразол-1-ил]уксусная кислота и [4-(7-хлориндан-4-илокси)-5-тиофен-2-ил-пиразол-1-ил]уксусная кислота;
82) {4-[7-метокси-6-метил-2-(4-нитрофенокси)индан-4-илметил]-3,5-диметилпиразол-1-ил}уксусная кислота;
83) [5-амино-4-(7-метокси-6-метилиндан-4-илметил)-3-(4-метоксифенил)пиразол-1-ил]уксусная кислота и [3-амино-4-(7-метокси-6-метилиндан-4-илметил)-5-(4-метоксифенил)пиразол-1-ил]уксусная кислота;
84) 2-[3,5-диэтил-4-(7-гидрокси-6-метилиндан-4-илметил)пиразол-1-ил]-N-(1Н-тетразол-5-ил)ацетамид;
85) 1-карбоксиметил-5-(5-хлортиофен-2-ил)-4-(7-метокси-6-метилиндан-4-илметил)-1Н-пиразол-3-карбоновая кислота и 2-карбоксиметил-5-(5-хлортиофен-2-ил)-4-(7-метокси-6-метилиндан-4-илметил)-2Н-пиразол-3-карбоновая кислота.
4. Фармацевтическая композиция, содержащая терапевтически эффективное количество одного соединения или нескольких соединений по пп.1, 2 или 3, по выбору ассоциированного с фармацевтически приемлемыми солями, разбавителями или носителями.
5. Применение одного или нескольких соединений по пп.1, 2 или 3 для производства лекарственного средства, предназначенного для лечения ожирения у млекопитающих, включая людей.
6. Применение одного или нескольких соединений по пп.1, 2 или 3 для производства лекарственного средства, предназначенного для улучшения резистентности к инсулину и/или предотвращения или замедления развития выраженного диабета у млекопитающих, включая людей.
7. Применение одного или нескольких соединений по пп.1, 2 или 3 для производства лекарственного средства, предназначенного для профилактики или лечения дислипидемии у млекопитающих, включая людей.
8. Применение одного или нескольких соединений по пп.1, 2 или 3 для производства лекарственного средства, предназначенного для предотвращения или лечения метаболического синдрома у млекопитающих, включая людей.
9. Применение одного или нескольких соединений по пп.1, 2 или 3 для производства лекарственного средства, предназначенного для профилактики или лечения заболевания или нарушения, связанного с неправильным действием тиреоидных гормонов у млекопитающих, включая людей.
10. Применение по п.9, в котором заболевание или нарушение выбирают из: 1) состояний, связанных с болезнью или нарушением из-за избыточного накопления жира, изменения митохондриальной функции, 2) нарушений липидного обмена, вызванных дисбалансом уровня липидов в крови или ткани, 3) нарушения толерантности к глюкозе, 4) диабета 2-го типа, 5) заместительной терапии, 6) депрессии, 7) сердечно-сосудистых заболеваний и 8) кожных болезней.
11. Способ лечения ожирения у млекопитающих, включая людей, отличающийся тем, что млекопитающим, которым показана такая терапия, вводят терапевтически эффективное количество соединения по пп.1, 2 или 3.
12. Способ улучшения резистентности к инсулину и/или профилактики или замедления развития выраженного диабета у млекопитающих, включая людей, отличающийся тем, что млекопитающим, которым показана такая терапия, вводят терапевтически эффективное количество соединения по пп.1, 2 или 3.
13. Способ профилактики и лечения дислипидемии у млекопитающих, включая людей, отличающийся тем, что млекопитающим, которым показана такая терапия, вводят терапевтически эффективное количество соединения по пп.1, 2 или 3.
14. Способ профилактики и лечения метаболического синдрома у млекопитающих, включая людей, отличающийся тем, что млекопитающим, которым показана такая терапия, вводят терапевтически эффективное количество соединения по пп.1, 2 или 3.
15. Способ профилактики и лечения заболевания или нарушения, связанного с неправильным действием тиреоидных гормонов у млекопитающих, включая людей, отличающийся тем, что млекопитающим, которым показана такая терапия, вводят терапевтически эффективное количество соединения по пп.1, 2 или 3.
16. Способ по п.15, отличающийся тем, что упомянутые заболевания или нарушения выбирают из: 1) состояний, связанных с болезнью или нарушением из-за избыточного накопления жира, изменения митохондриальной функции, 2) нарушений липидного обмена, вызванных дисбалансом уровня липидов в крови или ткани, 3) нарушения толерантности к глюкозе, 4) диабета 2-го типа, 5) заместительной терапии у пожилых лиц с гипотиреозом, 6) депрессии, 7) сердечно-сосудистых заболеваний и 8) кожных болезней.
17. Применение соединения формулы (IA) для лечения болезненного состояния, связанного с неправильным действием тиреоидных гормонов при ожирении, резистентности к инсулину, дислипидемии, метаболическом синдроме, диабете 2-го типа, заместительной терапии у пожилых лиц с гипотиреозом, депрессии, сердечно-сосудистых заболеваниях и кожных болезнях млекопитающих, включая людей
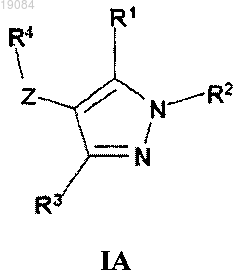
где R1 и R3 являются одинаковыми или различными и выбраны независимо из группы, включающей Н, (C1-C6)алкил, (С3-С7)циклоалкил, -CF3, -О-(C1-C6)алкил, -NH2;
R2 выбран из группы, включающей (C1-C6)алкил, -С(O)-(C1-C3)алкил-СООН, -(C1-C3)алкил-СООН, -С(О)-(C1-C3)алкил-СОО-(C1-C6)алкил, -С(O)-С(О)О-(C1-C6)алкил, -С(О)-(C1-C3)алкил-NH-(C1-C6)алкил, -С(О)-О-(C1-С6)алкил, -C(O)NR5, -С(О)NH-(C1-C6)алкил, -С(О)-(С1-С3)алкил-(С6-С10)арил, -С(О)-(C1-C3)алкил-R6, R6 или R7, где указанный (C1-C6)алкил по выбору замещен одним или несколькими заместителями, выбранными из группы, включающей в себя оксо, -С(О)ОН, -С(О)-О-(C1-C3)алкил, -С(О)-О-(C1-С3)алкил-(С6-С10)арил, -С(О)-О-(C1-C3)алкил-R6, -CONH2, -CONH(C1-С3)алкил, -C(O)NH-(C6-C10)арил, -C(O)NH-R6,
-CONR5, -CONHNH2, C(=NH)NH-(C1-C6)алкил, -C(=NH)NH2, -C(=NH)NHOH, -C(O)-R8, С(О)NHSO2(C1-C6)алкил, -NH-С(О)-(C1-C3)алкил, -OH, R6 или R7;
R5 вместе с атомом азота, к которому он присоединен, образует насыщенное или ненасыщенное (C3-C6)-членное кольцо, которое может дополнительно содержать 1-2 гетероатома, выбираемых из О, N и S, при этом кольцо может быть по выбору замещено одним или несколькими группами -СООН;
R6 выбран из фенила или 5-8-членного гетероарила, содержащего 1-4 гетероатома, выбранных из О, N и S, при этом данное гетероарильное или фенильное кольцо по выбору замещено одним или несколькими заместителями, выбранными из группы, включающей в себя галоген, -ОН, -О-(C1-C6)алкил, -(C1-C6)алкил или -SO2(C1-C6)алкил;
R7 представляет собой 3-6-членное гетероциклическое кольцо, содержащее 1-4 гетероатома, выбранных из О, N и S, при этом данное гетероциклическое кольцо по выбору замещено одним или несколькими заместителями, выбранными из группы, включающей в себя оксо, (C1-С6)алкил или -SO2-(C1-C10)арил(C1-C6)алкил;
R8 является аминокислотой, присоединенной через атом азота;
Z=О, СН2 или NH;
R4 выбран из Р, Q или Т
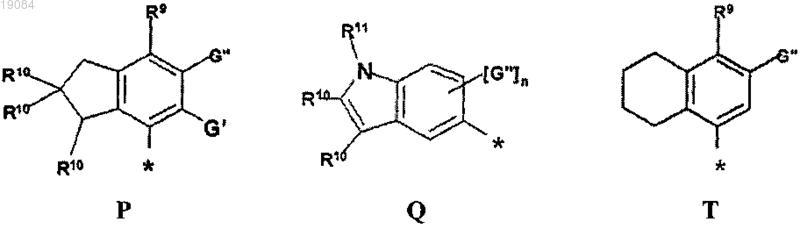
R9 выбран из группы, включающей в себя -ОН, -О-(C1-C6)алкил, галоген или -ОС(О)-(C1-C6)алкил;
R10 выбран из группы, включающей в себя Н, (C1-C6)алкил или -(C6-C10)арилокси;
R11 представляет собой водород;
G' представляет собой водород;
G" выбран из группы, включающей в себя водород, (C1-C6)алкил, -(C6-С10)арил, галоген, -(С1-C3)алкил-(C6-C10)арил или -CONR5;
n может быть равным 1 или 2;
включая его фармацевтически приемлемые соли, гидраты и сольваты.
18. Способ получения соединения по п.1, отличающийся тем, что осуществляют взаимодействие соединения формулы (II)
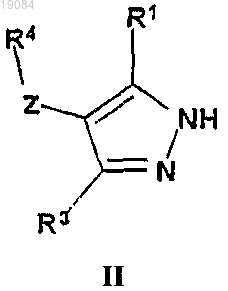
с соединением формулы
где Y представляет собой уходящую группу, представляющую собой галоген, в присутствии подходящего основания в соответствующем растворителе.
19. Способ получения соединения по п.1, отличающийся тем, что осуществляют взаимодействие соединения формулы (III) или (IX)
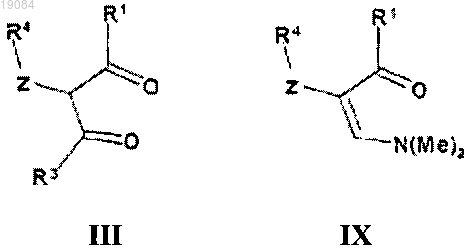
с гидратом гидразина или соответствующим замещенным гидразином формулы
Текст
НОВЫЕ ТИРЕОИДНЫЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ,СВЯЗАННЫХ С НАРУШЕНИЕМ ОБМЕНА ВЕЩЕСТВ В изобретении описаны новые тиреоидные соединения формулы (I) где R1, R2, R3, R4 и Z определены в описании, способ получения, композиция, содержащая такие соединения, и применение таких соединений и композиции в качестве лекарственного препарата. Кроме того, соединения формулы (I) имеют существенно более низкое сродство к связыванию с рецепторами щитовидной железы и, следовательно, в значительной степени лишены тиреотоксических эффектов. Изобретение также относится к применению соединения по формуле(I) для получения лекарственного препарата для лечения различных заболеваний, таких как ожирение, дислипидемия, метаболический синдром и сопутствующие патологии, связанные с метаболическим синдромом. Область техники, к которой относится изобретение Данное изобретение относится к новым тиреоидным соединениям формулы (I) где R1, R2, R3, R4 и Z определены ниже,способу получения, композиции, содержащей такие соединения, и применению таких соединений и композиции в терапии. Кроме того, соединения формулы (I) имеют существенно более низкое сродство к связыванию с рецепторами щитовидной железы и, следовательно, в значительной степени лишены тиреотоксических эффектов. Изобретение также относится к использованию соединения формулы (I) в получении лекарственного препарата для лечения различных заболеваний, таких как ожирение, дислипидемия, метаболический синдром и сопутствующие патологии, связанные с метаболическим синдромом. Предшествующий уровень техники Ожирение представляет собой избыточное накопление энергии в организме, при котором запас естественной энергии, хранимой в жировой ткани людей и других млекопитающих, увеличивается до такой степени, что его связывают с возникновением определенных заболеваний или повышенным уровнем смертности. Ожирение развивается в результате дисбаланса между расходом энергии и ее потреблением,поэтому физиологический подход к лечению ожирения состоит в достижении отрицательного энергетического и жирового баланса. В самом деле, для большинства пациентов эффективным средством является похудание с помощью диеты, однако очень немногим из них удается сохранить свое достижение на протяжении длительного времени и не набрать потерянный вес. Ожирение приняло масштабы глобальной эпидемии, так как избыточным весом страдают более 1,6 млрд взрослого населения, при этом как минимум 400 млн из них имеют клинические признаки ожирения. Во всем мире оно является основным фактором возникновения хронических заболеваний и потери трудоспособности (информационный бюллетень ВОЗ, 2006 г.). По прогнозам ВОЗ к 2015 г. избыточным весом будут страдать 2,3 млрд взрослого населения, более 700 млн будут иметь ожирение. В мире как минимум 20 млн детей в возрасте до 5 лет имеют избыточный вес (данные за 2005 г.). Ожирение и избыточный вес являются главным фактором риска возникновения серьезных хронических заболеваний, в том числе диабета 2-го типа, сердечно-сосудистых заболеваний, гипертонии, дислипидемии, метаболического синдрома, инсульта и некоторых форм рака. Последствия для здоровья могут варьироваться от повышенного риска преждевременной смерти до серьезных хронических заболеваний, снижающих общее качество жизни. Хотя на протяжении долгого времени ожирение связывали с появлением серьезных проблем с сердцем, только недавно его стали рассматривать в качестве болезни как конкретную цель медицинской терапии. Впоследствии разработке новых подходов в лечении ожирения стали отводить все более значительное место в деятельности биофармацевтической промышленности и отрасли по производству медицинского оборудования (Melnikova I.Wages D. Nature Reviews Drug Discovery (2006); 5: 369-370). Имеющиеся в распоряжении способы терапии ожирения имеют ограниченную ценность вследствие недостаточной эффективности или высокой частоты возникновения побочных эффектов. Следовательно,существует потребность в улучшенном подходе, который будет обладать желаемой эффективностью и малым количеством побочных эффектов. Многие соединения, использующие новые терапевтические подходы (такие как антагонист рецептора нейропептид-тирозина (NPY), агонист 3 и т.д.), находятся на ранней стадии разработки. В последнее время с целью использования в лечении ожирения также начали изучать выборочные лиганды рецепторов щитовидной железы. Эпидемиологические данные показывают четкую взаимосвязь между измененным углеводным и липидным обменом, отложением жира в организме и холестерином, возникновением риска развития сердечно-сосудистых заболеваний, таких как атеросклероз, гипертония и т.д. Атеросклероз как болезнь артерий считается главной причиной смерти в мире. Эпидемиологические данные четко установили, что гиперлипидемия является основным фактором риска возникновения сердечно-сосудистых заболеваний по причине атеросклероза. В последние годы медицинское сообщество возобновило призывы к снижению уровня холестерина в плазме крови, в частности холестерина в липопротеинах низкой плотности, что является крайне важным шагом для профилактики сердечно-сосудистых заболеваний. Сейчас уже известно, что верхние границы "нормы" являются значительно более низкими, чем считалось ранее. В результате встает необходимость признать тот факт, что для многочисленных слоев населения степень риска особенно высока. Такие независимые факторы риска включают непереносимость глюкозы, гипертрофию левого желудочка, гипертонию и при-1 019084 надлежность к мужскому полу. Сердечно-сосудистые заболевания больше распространены у диабетиков,по меньшей мере, отчасти вследствие наличия нескольких независимых факторов риска в этой группе. Таким образом, успешное лечение дислипидемии у населения в целом и среди диабетиков в частности имеет самую высокую клиническую важность. Гипертония представляет собой состояние, которое развивается у больных как вторичный симптом других различных заболеваний. Вместе с тем, гипертония также отмечается у многих пациентов, для которых причинные факторы неизвестны. Хотя эту "первичную" гипертонию часто связывают с такими заболеваниями как ожирение, диабет и гипертриглицеридемия, взаимосвязь между этими нарушениями четко не установлена. У многих пациентов также имеются симптомы высокого кровяного давления при полном отсутствии любых других признаков заболевания или нарушения. Известно, что гипертония может быть прямой причиной возникновения различных осложнений, таких как сердечная недостаточность, почечная недостаточность и инсульт (кровоизлияние в мозг). Гипертония может также способствовать развитию атеросклероза и ишемической болезни сердца. Гипертония редко проявляется как одиночное заболевание и обычно сопровождается другими факторами риска для сердечно-сосудистой системы, такими как резистентность к инсулину, висцеральное ожирение и дислипидемия. Эти нарушения постепенно ослабляют здоровье пациента и могут привести к смертельному исходу. Хотя обычно наиболее важным средством снижения долгосрочных осложнений гипертонии является эффективный контроль кровяного давления, в настоящий момент для улучшения исхода лечения в рекомендации по терапии начинают включать принцип общего управления сердечно-сосудистым риском. Метаболический синдром, который представляет собой группу связанных с обменом веществ отклонений, является комбинацией резистентности к инсулину, дислипидемии, ожирения и гипертонии,что ведет к повышенному уровню заболеваемости и смертности от сердечно-сосудистых заболеваний. У всех слоев населения метаболический синдром увеличивает риск сердечно-сосудистых заболеваний в 1,65 раза. Наличие метаболического синдрома предполагало повышенный риск общей смертности и смертности от сердечно-сосудистых заболеваний (Eberhard Ritz, Am. J. Cardiol (2007); 100 [Suppl]: 53-60). В одном исследовании приводится оценка о наличии метаболического синдрома более чем у 20% взрослого населения США (Young-Woo Park et al. 10 Arch intern Med (2003); 163: 427-436). При диабете 2-го типа также широко распространены ожирение и дислипидемия, а около 70% больных диабетом 2-го типа имеют также гипертонию, которая опять же ведет к повышенной смертности от сердечно-сосудистых заболеваний. Нарушения метаболизма, которые влияют на глюкозный и липидный обмен, такие как гиперлипидемия, ожирение, диабет, резистентность к инсулину, гипергликемия, непереносимость глюкозы и гипертония, имеют долгосрочные последствия для здоровья, так как ведут к хроническим болезням, включая сердечно-сосудистые заболевания и преждевременную заболеваемость. Такие нарушения метаболизма и заболевания сердечно-сосудистой системы могут иметь взаимосвязь, осложняя или вызывая друг друга, при этом создается механизм обратной связи, который еще не изучен. Таким образом, для предотвращения диабета 2-го типа и снижения общего сердечно-сосудистого риска, связанного с метаболическим синдромом, важнейшее значение имеет многофакторное вмешательство (Richard Ceska, Diabetes and Vascular Disease Research (2007); 4 (suppl): S2-S4). Более того, в общем снижении сердечно-сосудистого риска многофакторное вмешательство доказало свое преимущество по сравнению со снижением отдельного фактора риска. В настоящий момент отсутствует какая-либо терапия, которая одновременно учитывает несколько компонентов метаболического синдрома. В ответ на воздействие тиреотропным гормоном щитовидная железа вырабатывает Т 4, Т 3 и rT3. Хотя Т 4, Т 3 и rT3 вырабатываются внутри щитовидной железы, в количественном отношении главным вторичным продуктом является Т 4. Т 3 и rT3 вырабатываются в организме в очень малом количестве, которое не считается значительным по сравнению с выработкой на периферии. Т 4 преобразуется в Т 3 или rT3, либо уничтожается в результате конъюгации, дезаминирования или декарбоксилирования. По имеющимся оценкам более 70% гормона Т 4, вырабатываемого в щитовидной железе, подвергается в конечном счете дейодированию в периферийных тканях с преобразованием в Т 3 или rT3. Хотя в щитовидной железе вырабатывается некоторое количество Т 3, приблизительно 80-85% этого гормона производится вне щитовидной железы,главным образом путем преобразования из Т 4 в печени и почках. Дальнейший распад Т 3 и rT3 ведет к образованию нескольких отличительных дийодтиронинов: 3,5-Т 2, 3,3'-Т 2 и 3,5'-Т 2 (Kelly G.S. Altern MedRev (2000); 5(4): 306-333). Структурно все тиреоидные гормоны можно разделить на два кольца: внутреннее кольцо и наружное кольцо; а зависимость активности от структуры позволяет предположить непредсказуемый эффект заместителей в положениях (3'-, 5'-, 3- и 5-) на внутреннее и наружное кольцо соответственно (Burger' 6th edition, vol. 3, p. 564-565). Т 3 считается самым метаболически активным тиреоидным гормоном. Различные экспериментальные данные позволяют предположить, что основным проводником эффекта тиреоидных гормонов является Т 3. Тиреоидные гормоны оказывают влияние на метаболизм практически каждой клетки организма. При нормальном уровне эти гормоны поддерживают вес тела, скорость обмена веществ, температуру тела, настроение человека, а также влияют на сывороточный уровень липопротеина низкой плотности. Таким образом, при гипотиреозе отмечаются прибав-2 019084 ление веса, высокий уровень холестерина в липопротеине низкой плотности и депрессия. В случае увеличения уровня этих гормонов при гипертиреозе отмечаются снижение веса, гиперметаболизм, снижение сывороточного уровня липопротеина низкой плотности, сердечная аритмия, сердечная недостаточность,мышечная слабость, остеопороз у женщин в постменопаузе, а также тревожность (WO 200703419). Мозг также является важным объектом для тиреоидных гормонов, главным образом во время развития организма, но и у взрослых особей тоже. Тяжелый неонатальный гипотиреоз связывают с изменениями в мозжечке, особенно в зернистых клетках и клетках Пуркинье, которые проявляются нарушениями дифференциации и миграции: клетки Пуркинье являются недоразвитыми, а зернистые клетки не перемещаются должным образом из внешнего зародышевого слоя во внутренний зернистый слой. Интересно отметить тот факт, что по имеющимся сведениям тиреоидный гормон, известный как тироксин (Т 4), превращается в тиронин (Т 3) в коже человека под действием дейодиназы I типа, селенопротеина. Дефицит селена приводит к снижению уровня Т 3 вследствие уменьшения активности дейодиназы I типа. Такое снижение уровня Т 3 твердо связывают с потерей волос. В соответствии с этим наблюдением при приеме Т 4 в качестве побочного эффекта отмечался рост волос. Более того, гормоны Т 3 и Т 4 являются предметом нескольких патентных публикаций, относящихся к лечению потери волос, в том числе,например, публикации по заявкам на международные патенты WO 00/72810 и WO 00/72811. В настоящее время применение тиреоидных гормонов ограничивается случаями заместительной терапии при гипотиреозе. Тем не менее, заместительная терапия, особенно у пожилых пациентов, ограничена наличием определенных побочных эффектов от тиреоидных гормонов. Некоторые эффекты от их приема могут иметь терапевтическую пользу при лечении нарушений, не связанных со щитовидной железой, если при этом можно свести к минимуму или устранить негативное воздействие. К таким потенциально полезным эффектам относят снижение веса при лечении ожирения, снижение уровня холестерина при лечении гиперлипидемии, снижение симптомов депрессии и стимуляцию формирования костной ткани при остеопорозе (Liu Ye et al., JMC (2003); 46: 1580-88). Установлено, что гипертиреоз связан с низким общим сывороточным уровнем холестерина, который относят на счет тиреоидного гормона, увеличивающего выражение печеночного рецептора липопротеина низкой плотности и стимулирующего метаболизм холестерина для образования желчных кислот (Abrams J.J. et al. J. Lipid Res. (1981); 22: 32338). Гипотиреоз, в свою очередь, ассоциируется с гиперхолестеремией, при этом известно, что заместительная терапия тиреоидными гормонами снижает общий уровень холестерина (Aviram M. et al. CUn.Biochem. (1982); 15: 62-66; Abrams J.J. et al. J. Lipid Res. (1981); 22: 323-38). Эксперименты на животных показали, что тиреоидные гормоны оказывают благоприятное воздействие на увеличение уровня холестерина в аполипопротеинах высокой плотности и улучшение отношения ЛНП к ЛВП путем увеличения выражения апо A-I, одного из главных аполипротеинов ЛВП (Ness G.C. et al. Biochemical Pharmacology,(1998); 56: 121-129; Grover G.J. et al. Endocrinology, (2004); 145: 1656-1661; Grover G.J. et al. Proc. Natl.Acad. Sci. USA, (2003); 100:10067-10072). Учитывая действие, которое тиреоидные гормоны оказывают на холестерин ЛНП и ЛВП, есть вероятность того, что они также могут снижать риск атеросклероза и других сердечно-сосудистых заболеваний. Кроме того, есть данные, что тиреоидные гормоны снижают липопротеин (а) - важный фактор риска, который повышен у пациентов с атеросклерозом (Paul Webb.Expert Opin. Investig. Drugs, (2004); 13(5): 489-500; de Bruin et al. J. CUn. Endo. Metab., (1993); 76: 121126). Предшествующие попытки фармакологического использования тиреоидных гормонов для лечения таких нарушений были ограничены проявлениями гипертиреоза и в особенности сердечно-сосудистой токсичностью (тиреотоксикоз) (Liu Ye et al., JMC (2003); 46: 1580-88). Тиреоидные гормоны проявляют свой эффект посредством рецепторов щитовидной железы. В ядре клетки существует два главных подтипа рецепторов щитовидной железы (геномный эффект): TR иTR. Изоформы TR1, TR1 и TR2 связывают тиреоидный гормон и действуют как регулируемые лигандами транскрипционные факторы. Изоформа TR2 преобладает в гипофизе и других частях ЦНС, не связывает тиреоидные гормоны и во многих случаях действует как транскрипционный репрессор. Также имеет место широкое распределение TR1. Литература позволяет предположить, что многие или большинство эффектов воздействия тиреоидных гормонов на сердце, в особенности на частоту сердечных сокращений и ритм, обусловлены изоформой TR1. С другой стороны, основная доля воздействия гормонов на печень и другие ткани осуществляется посредством -форм рецепторов (Liu Ye et al., JMC(2003); 46: 1580-88). Существуют доказательства того, что тиреоидный гормон регулирует поведение многих метаболических путей, которые потенциально имеют отношение к основному обмену веществ. В общих словах,основные возможные механизмы включают отделение клеточного метаболизма от синтеза АТФ или изменение эффективности метаболических процессов на уровне ниже митохондрии. Таким образом, для лечения нарушений обмена веществ были предприняты попытки синтезировать соединения избирательного действия на -субъединицу тиреоидного гормона и/или на ткань без побочных тиреотоксических эффектов, распространяемых рецепторами TR. Пытаясь обеспечить избирательное воздействие лигандов щитовидной железы на определенные формы TR, многие исследователи пробовали синтезировать имитатор щитовидной железы. Эффект,оказываемый на него различными внутренними и наружными кольцами, а также заместителями, изучен и описан в документах US 20050085541, US 20040039028, WO 2007003419, WO 2006128056, WO 200709913, US 20010051645, US 20020049226 и US 20030040535, которые включены в настоящий документ в виде ссылки. До недавнего времени существовало мнение, что гормон Т 3 является биологически более активным по сравнению с Т 4, и в настоящее время он считается преобладающим активатором рецепторов тиреоидного гормона (Burger' 6th edition, vol. 3, p. 564-565). На протяжении последних десяти лет стали поступать данные о том, что биологический эффект оказывают встречающиеся в естественном виде йодтиронины,отличные от Т 3. Среди них можно отметить 3,5-дийодтиронин, который отвечает за быстрое краткосрочное воздействие на окислительную способность клеток и частоту дыхания путем прямого взаимодействия с участками связывания митохондрий. Накопленные данные позволяют сделать вывод о том,что Т 2 не просто повторяет действие Т 3, а оказывает специфическое воздействие посредством механизма, не зависящего от того, который запускается гормоном Т 3 с помощью рецепторов щитовидной железы (A. Lombardi. Immun Endoc and Metab Agents in Med Chem (2006); 6: 255-65; WO 200509433). Растущий объем данных наводит на мысль о том, что 3,5-дийодтиронин может вызывать снижение эффективности обмена веществ, возможно, за счет стимулирования потери энергии посредством механизма, который затрагивает митохондриальный аппарат, а не рецепторы ядра. Такое действие Т 2 в потенциале может привести к снижению тучности и сокращению набираемого веса без возникновения клинического синдрома, связанного с тиреотоксическим состоянием, что обеспечивается за счет увеличения притока жирной кислоты в митохондрию и окисления жирной кислоты (A. Lombardi. Immun Endoc andMetab Agents in Med Chem (2006); 6: 255-65; Horst C., Biochem J. (1989); 261: 945-950). С клинической точки зрения, сценарий с высоким уровнем окисления жирной кислоты, снижением накопления жира,уменьшением сывороточного уровня триглицеридов и холестерина, снижением стеатоза печени, сокращением набираемого веса без уменьшения потребления калорий/жиров является привлекательной перспективой для трудно поддающегося лечению ожирения (A. Lombardi. Immun Endoc and Metab Agents inMed Chem (2006); 6: 255-65). В документе WO 2005/009433 описана композиция 3,5 Т 2 в терапевтически эффективной дозе главным образом для применения в лечении ожирения, стеатоза печени и дислипидемии. Обобщая вышесказанное, можно отметить следующее. Тиреоидные гормоны и другие йодтиронины вместе или по отдельности оказывают влияние на обмен веществ практически каждой клетки организма. Эти гормоны играют важную физиологическую роль: поддерживают вес тела, скорость обмена веществ,температуру тела, настроение, влияют на сывороточные уровни липопротеина низкой плотности (ЛНП) и т.д. Таким образом, тиреоидные гормоны (Т 4 и Т 3) могут вызывать снижение веса путем увеличения скорости обмена веществ и снижения холестерина ЛНП посредством повышенной регуляции рецепторов ЛНП и повышенного метаболизма холестерина. Вместе с тем, возможности терапевтического использования тиреоидных гормонов для лечения ожирения и нарушений липидного обмена недостаточно широки, особенно из-за учащения сердечной деятельности. Совсем недавно появилось сообщение о том, что в качестве терапевтически эффективного средства для снижения веса и уровня холестерина в плазме без негативных побочных эффектов со стороны сердца можно использовать TR избирательные агонисты. Тем не менее, также недавно было установлено, что TR избирательные агонисты вызывают пролиферацию, например, ведут к разрастанию клеток печени и ацинарных клеток поджелудочной железы (Amedeocolumbano. Endocrinology (2006); 147(7): 3211-8). Кроме того, есть отчеты, которые свидетельствуют о том, что у животных Т 3 в малых дозах увеличивает потребление пищи вне зависимости от воздействия на ядро (Wing May Kong et al. Endocrinology (2004); 145: 5252-5258). Увеличение потребления энергии было отмечено в случае с гормоном Т 2 (Horst et al., J. Endocrinology (1995); 145: 291-297), который можно использовать в качестве компенсаторного средства при лечении ожирения. Таким образом, существует потребность в новых тиреоидных соединениях, которые полезны для лечения нарушений обмена веществ, таких как ожирение, резистентность к инсулину, диабет, дислипидемия, жировая инфильтрация печени, метаболический синдром и изменение функции щитовидной железы, при этом такие соединения не должны иметь нежелательных эффектов в виде тиреотоксикоза и увеличения потребления пищи. В этой связи авторы настоящего изобретения получили новые тиреоидные соединения, которые должны продемонстрировать свою пользу в лечении или профилактике заболеваний или нарушений,связанных с неправильным действием тиреоидных гормонов, например: 1) состояние, связанное с болезнью или нарушением из-за избыточного накопления жира, изменения митохондриальной функции; 2) ожирение; 3) нарушения липидного обмена, вызванные дисбалансом уровня липидов в крови или ткани, такие как дислипидемия, атеросклероз; 4) нарушение толерантности к глюкозе; 5) диабет 2-го типа; 6) заместительная терапия; 7) депрессия; 8) сердечно-сосудистые заболевания и 9) кожные заболевания; при этом полученные соединения в значительной степени лишены нежелательных эффектов в виде тире-4 019084 отоксикоза и увеличения потребления пищи. Документ WO 2007027842 относится к анилинопиразольным соединениям, которые являются полезными для лечения диабета и связанных с ним нарушений. US 2004110816 содержит описание определенных реверсивных ингибиторов ДНК-зависимой РНК-полимеразы производных пиразола, которые используются в лечении ВИЧ. В документе WO 9716422 описаны определенные соединения хроманила и тиохроманила, которые обладают ретиноидной активностью. Перечень фигур чертежей и иных материалов На чертеже представлено графическое изображение эффекта тестового соединения В в ОТТГ(оральный тест на толерантность к глюкозе). Сущность изобретения Одним из вариантов воплощения настоящего изобретения является соединение по формуле (I) где R1 и R3 являются одинаковыми или различными и независимо выбраны из группы, включающей Н, (C1-C6)алкил, (С 3-С 7)циклоалкил, CF3, -О-(C1-C6)алкил, -NH2 или R6;R2 выбран из группы, включающей (C1-C6)алкил, -С(О)-(C1-C3)алкил-СООН, (C1-C3)алкил-СООН,-С(О)-(С 1-С 3)алкил-СОО-(С 1-С 6)алкил, -С(О)-С(О)О-(C1-C6)алкил, -С(О)-(C1-C3)алкил-NH-(C1-C6)алкил,-С(О)-О-(C1-С 6)алкил, -C(O)NR5, -С(О)NH-(С 1-С 6)алкил, -С(O)-(C1-C3)алкил-(C6-C10)арил, -C(O)-(C1C3)алкил-R6, R6 или R7, где указанный (C1-C6)алкил по выбору замещен одним или несколькими заместителями, выбранными из группы, включающей в себя оксо, -С(О)ОН, -С(О)-О-(C1-C3)алкил, -С(О)-О-(C1C3)алкил-(С 6-С 10)арил, -С(О)-О-(C1-C3)алкил-R6, -CONH2, -CONH(C1-С 3)алкил, -С(О)NH-(С 6-С 10)арил,-C(O)NH-R6,-CONR5,-CONHNH2,C(=NH)NH-(C1-C6)алкил,-C(=NH)NH2,-C(=NH)NHOH,8R5 вместе с атомом азота, к которому он присоединен, образует насыщенное или ненасыщенное(C3-C6)-членное кольцо, которое может дополнительно содержать 1-2 гетероатома, выбираемых из О, N иS, при этом кольцо может быть по выбору замещено одной или несколькими группами -СООН;R6 выбран из фенила или 5-8-членного гетероарила, содержащего 1-4 гетероатома, выбранных из О,N и S, при этом данное гетероарильное или фенильное кольцо по выбору замещено одним или несколькими заместителями, выбранными из группы, включающей в себя галоген, -ОН, -О-(C1-C6)алкил, -(C1C6)алкил или -SO2-(C1-C6)алкил;R7 представляет собой 3-6-членное гетероциклическое кольцо, содержащее 1-4 гетероатома, выбранных из О, N и S, при этом данное гетероциклическое кольцо по выбору замещено одним или несколькими заместителями, выбранными из группы, включающей в себя оксо, (C1-С 6)алкил или -SO2-(C6C10)арил(C1-C6)алкил;R8 является аминокислотой, присоединенной через атом азота;n может быть равным 1 или 2; при условии, что, когда R4 представляет собой Q, R2 отличается от R6 и R7; включая его фармацевтически приемлемые соли, гидраты и сольваты, с оговоркой, что когда R4 представляет собой Q, то R2 отличается от R6 и R7; В другом варианте воплощения настоящее изобретение относится к соединению, указанному выше,с той лишь разницей, что оно включает только его фармацевтически приемлемые соли. В другом варианте воплощения настоящее изобретение включает в себя применение соединения по формуле (IA) для лечения заболеваний, связанных с неправильным действием тиреоидных гормонов при ожирении, резистентности к инсулину, дислипидемии, метаболическом синдроме, диабете 2-го типа,заместительной терапии у пожилых лиц с гипотиреозом, депрессии, сердечно-сосудистых заболеваниях и заболеваниях кожи путем применения терапевтически эффективного количества живыми млекопитающими организмами, в том числе людьми где R1 и R3 являются одинаковыми или различными и выбраны независимо из группы, включающей Н, (C1-C6)алкил, (С 3-С 7)циклоалкил, -CF3, -О-(C1-C6)алкил, -NH2;R2 выбран из группы, включающей (C1-C6)алкил, -С(О)-(C1-C3)алкил-СООН, -(C1-C3)алкил-СООН,-С(О)-(C1-C3)алкил-СОО-(C1-C6)алкил, -С(O)-С(О)О-(C1-C6)алкил, -С(О)-(C1-C3)алкил-NH-(C1-C6)алкил,-С(О)-О-(C1-С 6)алкил, -C(O)NR5, -С(О)NH-(C1-C6)алкил, -С(О)-(С 1-С 3)алкил-(С 6-С 10)арил, -С(О)-(C1C3)алкил-R6, R6 или R7, где указанный (C1-C6)алкил, по выбору замещен одним или несколькими заместителями, выбранными из группы, включающей в себя оксо, -С(О)ОН, -С(О)-О-(C1-C3)алкил, -С(О)-О(C1-C3)алкил-(C6-С 10)арил, -С(О)-О-(C1-C3)алкил-R6, -CONH2, -CONH(C1-С 3)алкил, -С(О)NH-(С 6 С 10)арил, -C(O)NH-R6, -CONR5, -CONHNH2, С(=NH)NH-(C1-C6)алкил, -C(=NH)NH2, -C(=NH)NHOH,-C(O)-R8, С(О)NHSO2(C1-C6)алкил, -NH-С(О)-(C1-С 3)алкил, -OH, R6 или R7;R5 вместе с атомом азота, к которому он присоединен, образует насыщенное или ненасыщенное(C3-C6)-членное кольцо, которое может дополнительно содержать 1-2 гетероатома, выбираемых из О, N иS, при этом кольцо может быть по выбору замещено одним или несколькими группами -СООН;R6 выбран из фенила или 5-8-членного гетероарила, содержащего 1-4 гетероатома, выбранных из О,N и S, при этом данное гетероарильное или фенильное кольцо по выбору замещено одним или несколькими заместителями, выбранными из группы, включающей в себя галоген, -ОН, -О-(C1-C6)алкил, -(C1C6)алкил или -SO2(C1-C6)алкил;R7 представляет собой 3-6-членное гетероциклическое кольцо, содержащее 1-4 гетероатома, выбранных из О, N и S, при этом данное гетероциклическое кольцо по выбору замещено одним или несколькими заместителями, выбранными из группы, включающей в себя оксо, (C1-С 6)алкил или -SO2-(С 6 С 10)арил(C1-C6)алкил;R8 является аминокислотой, присоединенной через атом азота;n может быть равным 1 или 2; включая его фармацевтически приемлемые соли, гидраты и сольваты. В другом варианте воплощения настоящее изобретение включает в себя синтетические промежуточные продукты, которые полезны для получения соединений по формуле (I), а также способ получения таких промежуточных продуктов. Еще одним вариантом воплощения настоящего изобретения является способ получения соединения по формуле (I) в соответствии с содержащимся ниже описанием по схемам 1-3. Еще одним вариантом воплощения настоящего изобретения является фармацевтическая компози-6 019084 ция, включающая в себя соединение по формуле (I) по выбору в смеси с фармацевтически приемлемым вспомогательным веществом, разбавителем или носителем. Еще одним вариантом воплощения настоящего изобретения является способ лечения ожирения путем применения соединения по формуле (I) у млекопитающих, которым показана такая терапия. Еще одним вариантом воплощения настоящего изобретения является способ улучшения резистентности к инсулину и/или предотвращение или замедление развития выраженного диабета путем применения соединения по формуле (I) у млекопитающих, которым показана такая терапия. Еще одним вариантом воплощения настоящего изобретения является способ предотвращения и лечения дислипидемии путем применения соединения по формуле (I) у млекопитающих, которым показана такая терапия. Еще одним вариантом воплощения настоящего изобретения является способ предотвращения и лечения метаболического синдрома путем применения соединения по формуле (I) у млекопитающих, которым показана такая терапия. Еще одним вариантом воплощения настоящего изобретения является применение соединения по формуле (I) с целью получения лекарственного препарата для лечения ожирения. Еще одним вариантом воплощения настоящего изобретения является применение соединения по формуле (I) с целью получения лекарственного препарата для улучшения резистентности к инсулину и/или предотвращения или замедления развития выраженного диабета. Еще одним вариантом воплощения настоящего изобретения является применение соединения по формуле (I) с целью получения лекарственного препарата для предотвращения и лечения дислипидемии. Еще одним вариантом воплощения настоящего изобретения является применение соединения по формуле (I) с целью получения лекарственного препарата для предотвращения и лечения метаболического синдрома. Еще одним вариантом воплощения настоящего изобретения является способ лечения болезненного состояния, связанного с неправильным действием тиреоидных гормонов, без значительного изменения аппетита путем применения терапевтически эффективного количества тиреоидного соединения. Еще одним вариантом воплощения настоящего изобретения является способ лечения болезненного состояния, связанного с неправильным действием тиреоидных гормонов, без значительного изменения аппетита путем введения субъекту терапевтически эффективного количества соединения по формуле(IA). Сведения, подтверждающие возможность осуществления изобретения Определения. За исключением конкретно оговоренных ограниченных случаев, используемые в настоящем описании термины имеют следующие определения. Термин "тиреоидное соединение (соединения)" в настоящем описании обозначает структурно схожие с дийодтиронином соединения, которые должны действовать аналогично тиреоидному гормону, но при этом в значительной степени лишены токсических эффектов тиреоидного гормона. Термин "лиганды рецепторов щитовидной железы" или "лиганды щитовидной железы" в настоящем описании обозначает любое химическое вещество, которое может связываться с рецептором щитовидной железы. Лиганды могут действовать как антагонисты, агонисты, частичные антагонисты или частичные агонисты. Термин "рецептор щитовидной железы" в настоящем описании обозначает молекулу, которая получает тиреоидный гормон и позволяет ему соединяться с ядром клетки, что позволяет действовать как активируемый гормоном транскрипционный фактор и модулировать выражение генов. Рецепторы тиреоидных гормонов связывают ДНК в отсутствие гормона, обычно подавляя транскрипцию генов. Связывание гормона включает конформационное изменение в рецепторе, которое позволяет ему активировать транскрипцию. В настоящем описании термин "соединение" относится к любому соединению группы, которая объединена общей структурной формулой, приведенной в настоящем описании. Описанные соединения могут содержать одну или более двойных связей и, следовательно, могут существовать в виде стереоизомеров, таких как изомеры с двойной связью (т.е. геометрические изомеры). Следовательно, приведенные в настоящем описании химические структуры охватывают все возможные стереоизомеры показанных соединений, в том числе стереоизометрически чистую форму (например, геометрически чистая форма) и стереоизометрические смеси. Соединения могут также существовать в нескольких таутомерных формах,включая энольную форму, кето-форму и их смеси. Аналогичным образом, приведенные в настоящем описании химические структуры охватывают все возможные таутомерные формы показанных соединений. Описанные соединения также включают в себя изотопно-меченые соединения, в которых атомная масса одного или более атомов отличается от атомной массы, обычно встречающейся в природе. Примеры изотопов, которые могут быть включены в соединения изобретения, включают, без ограничения перечисленным, 2 Н, 3 Н, 13 С, 14 С, 15N, 18O, 17 О. Соединения могут существовать в несольватированной и сольватированной форме, в том числе в гидратной форме. Определенные соединения могут существовать в многокристаллической или аморфной форме. В целом,-7 019084 подразумеваемое данным описанием использование относится ко всем физическим формам, которые включены в объем настоящего изобретения. Термин "региоизомер" известен специалистам данной области и включен в учебные пособия, например, "Органический синтез", Smith, M. (McGraw Hill), которое определяет региоизомер как "две или более молекулы с одинаковой эмпирической формулой, но различным присоединением атомов (различное соединение)". В настоящем описании термин "атропоизомер" относится к стереоизомеру, в котором элемент хиральности расположен на плоскости или оси молекулы. Необходимо учитывать, что в изображениях части структур соединений тире (-) или обозначает место присоединения части структуры к остальной молекуле. Содержащаяся в данном описании номенклатура соединений настоящего изобретения приведена в соответствии с MDL ISIS Draw Version 2.2."Фармацевтически приемлемые соли" включают производные вещества описанных соединений, в которых исходное соединение модифицировано путем создания его нетоксичной кислоты или соли присоединения основания. Данное понятие также относится к фармацевтически приемлемым сольватам таких соединений и солей, включая гидраты. Примеры фармацевтически приемлемых солей включают, без ограничения перечисленным, минеральные или органические соли присоединения кислоты базовых остатков, такие как амины; щелочные или органические соли присоединения кислотных остатков, такие как карбоксильные кислоты; другие подобные вещества, а также комбинации с одной или несколькими вышеуказанными солями. Фармацевтически приемлемые соли включают в себя нетоксичные соли и четвертичные аммониевые соли исходного соединения, полученные, например, из нетоксичных неорганических или органических кислот. Например, нетоксичные кислые соли включают соли, полученные из неорганических кислот, таких как соляная, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и подобные кислоты. Другие приемлемые неорганические соли включают соли металлов, такие как натриевая, калиевая, цезиевая и другие подобные соли; соли щелочно-земельных металлов, такие как кальциевая, магниевая и другие подобные соли, а также комбинации с одной или несколькими вышеуказанными солями. Фармацевтически приемлемые органические соли включают соли, полученные из органических кислот, таких как уксусная, трифторуксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная,лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная, глютаминовая, бензойная, салициловая, мезиловая, эзиловая, безиловая, сульфаниловая, 2-ацетилсалициловая, фумаровая,толуолсульфоновая, метансульфоновая, этионовая, щавелевая, изэтионовая, НООС-(СН 2)n-СООН, где n равно 0-4, и другие подобные соли; органические аминные соли, такие как триэтиламиновая, пиридиновая,пиколиновая,этаноламиновая,триэтаноламиновая,дициклогексаминовая,N,N'дибензилэтилендиаминовая и другие подобные соли; соли аминокислот, такие как аргинатовая, аспаргинатовая, глутаматовая и им подобные; а также комбинации с одной или несколькими вышеуказанными солями. Термин "алкил", используемый один или в сочетании с другой группой, относится к насыщенному алифатическому углеводородному радикалу, который имеет указанное количество атомов углерода и является незамещенным или необязательно замещенным. Когда применительно к алкилу или другой группе используется нижний индекс, он обозначает количество атомов углерода, которое эта группа может иметь. Например, "C1-С 6 алкил" обозначает алкильную группу, содержащую от 1 до 6 атомов углерода. Алкил может иметь прямую или разветвленную цепь. Термин "алкенил", используемый один или в сочетании с другой группой, относится к ненасыщенному (=) алифатическому углеводородному радикалу, который имеет указанное количество атомов углерода и является незамещенным или необязательно замещенным. Когда применительно к алкенилу или другой группе используется нижний индекс, он обозначает количество атомов углерода, которое эта группа может иметь. Например, "С 3-С 6 алкенил" обозначает алкенильную группу, содержащую от 3 до 6 атомов углерода. Алкенил может иметь прямую или разветвленную цепь. Термин "алкинил", используемый один или в сочетании с другой группой, относится к ненасыщенному (=) алифатическому углеводородному радикалу, который имеет указанное количество атомов углерода и является незамещенным или необязательно замещенным. Когда применительно к алкинилу или другой группе используется нижний индекс, он обозначает количество атомов углерода, которое эта группа может иметь. Например, "C3-С 6 алкинил" обозначает алкинильную группу, содержащую от 3 до 6 атомов углерода. Алкинил может иметь прямую или разветвленную цепь. Термин "циклоалкил" относится к насыщенному алифатическому углеводородному радикалу, который имеет указанное количество атомов углерода и является незамещенным или необязательно замещенным. Когда применительно к циклоалкилу или другой группе используется нижний индекс, он обозначает количество атомов углерода, которое эта группа может иметь. Например, "С 1-С 6 циклоалкил" обозначает циклоалкильную группу, содержащую от 3 до 6 атомов углерода. Термин "арил" относится к ароматической группе, представляющей собой 6-10-членную моноциклическую или бициклическую кольцевую систему, которая может быть незамещенной или замещенной. Представителями арильной группы могут быть фенил, нафтил и подобные вещества. При замещении данного кольца заместители выбраны из группы, включающей галогены (например, фтор, хлор, бром,йод), гидрокси, алкокси, нитро, карбоновую кислоту, CF3, NHSO2-алкил, NHCO-алкил, алкил, алкенил,алкинил, циклоалкил и ацил. В настоящем описании термин "гетероарил" относится к ароматической группе, представляющей собой 5-10-членную моноциклическую или бициклическую кольцевую систему, которая имеет как минимум одно кольцо, содержащее гетероатом и атом углерода. Гетероарильная группа может присоединяться к любому свободному атому азота или углерода в любом кольце. Примерами моноциклической гетероарильной группы являются пирролил, пиразолил, пиразолинил,имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, фуранил, тиенил, оксадиазолил, тетразолил, триазолил, пиридил, пиразинил, пиримидинил, пиридазинил, триазинил и подобные вещества. Примерами бициклической гетероарильной группы являются индолил, бензотиазолил, бензодиоксолил, бензоксазолил, бензотиенил, хинолинил, изохинолинил, бензимидазолил, циннолинил, хиноксалинил, индазолил, пирролопиридил, фуропиридинил и подобные вещества. Термин "алкокси" обозначает алкильную группу в соответствии с определением выше, которая присоединена к части исходной молекулы через кислородный мостик. Примеры радикалов алкокси включают метокси, этокси, n-пропокси, n-бутокси, n-пентилокси, n-гексилокси, втор-бутокси, третбутокси, трет-пентилокси и аналогичные вещества. В настоящем описании термин "галоген" обозначает группу фтора, хлора, брома или йода. Все используемые в настоящем описании заместители (R1, R2 ) и их последующие заместители могут присоединяться к главной структуре у любого гетероатома или атома углерода, что приводит к образованию устойчивого соединения. В настоящем описании термин "млекопитающие" обозначает людей или животных, таких как обезьяны, приматы, собаки, кошки, лошади, коровы и т.д. В настоящем описании термин "полиморфы" относится к соединениям, которые имеют одинаковую химическую формулу, одинаковый тип соли и одинаковую форму гидрата/сольвата, но разные кристаллографические свойства. В настоящем описании термин "гидраты" относится к соединению, у которого к молекуле присоединено несколько молекул воды. В настоящем описании термин "сольваты" относится к соединению, у которого к молекуле присоединено несколько молекул сольвента. Настоящее изобретение также охватывает пролекарственные формы соединений изобретения, т.е. вторичные соединения, которые превращаются в первичные соединения in vivo. Сложный эфир, расщепляемый in vivo, является лишь одним типом пролекарственной формы исходной молекулы. Гидролизуемый (или расщепляемый) in vivo сложный эфир соединения настоящего изобретения, содержащий карбоксильную группу, является, например, фармацевтически приемлемым сложным эфиром, в результате гидролиза которого в организме человека или животного вырабатывается исходная кислота. Подходящие фармацевтически приемлемые сложные эфиры для получения карбоксильной группы включают C1-C8-алкоксиметиловые эфиры, например метоксиметил, C1-C8 алканолоксиметиловый эфир, например пивалоилоксиметил; фталидиловые эфиры; С 3-С 8 циклоалкоксикарбонилокси-C1-C8-алкиловые эфиры, например 1-циклогексилкарбонилоксиэтил; 1,3 диоксолен-2-онилметиловые эфиры,например 5-метил-1,3-диоксолен-2-онилметил;C1-C8 алкоксикарбонилоксиэтиловые эфиры, например 1-метоксикарбонилоксиметил; они могут образовываться в любой карбоксильной группе соединений настоящего изобретения. Если нет конкретных указаний на обратное, в настоящем описании термин "лечение" также включает "профилактику". Термин "лечение" в контексте настоящего изобретения также включает введение терапевтически эффективного количества описанного соединения для облегчения доклинической стадии болезни в острой или хронической форме, либо рецидива. Данное определение также охватывает профилактическую терапию для предотвращения рецидивов и продолжение терапии хронических нарушений. Фраза "терапевтически эффективное количество" означает количество соединения, которое при введении у пациента в целях лечения болезни является достаточным для осуществления такого лечения болезни. "Терапевтически эффективное количество" варьируется в зависимости от соединения, способа введения, болезни и ее стадии, а также возраста, веса и других индивидуальных особенностей пациента. Выражения "содержит" и "содержащий" означают "включая" и "в том числе", но без ограничения перечисленным. Таким образом, могут присутствовать другие компоненты, носители и добавки. Одним из вариантов настоящего изобретения является соединение формулы (I) где R1, R2, R3, Z и R4 соответствуют определению выше. Изобретение также предлагает фармацевтически приемлемые соли и их гидраты, сольваты, атропоизомеры, региоизомеры, энантиомеры, диастереомеры, таутомеры, полиморфы, а также их пролекарственные формы. Одним из предпочтительных вариантов воплощения настоящего изобретения является соединение по формуле (I) выше, где R1, R2, R3 и Z и соответствуют данному ранее определению, a R4 выбран из Р или Т. Фармацевтическая композиция. Еще одним вариантом воплощения изобретения является фармацевтическая композиция, включающая терапевтически эффективное количество одного или нескольких соединений формулы (I). Хотя терапевтически эффективное количество соединений формулы (I) можно вводить отдельно или в комбинации непосредственно без использования технологии приготовления лекарственного средства, общепринятой практикой является введение соединений в виде фармацевтических лекарственных доз, которые содержат фармацевтически приемлемое вспомогательное вещество (вещества) и как минимум один активный компонент. Эти лекарственные формы можно вводить различными способами, в том числе перорально, локально, трансдермально, подкожно, внутримышечно, внутривенно, интраназально, пульмонально и т.д. Композиция для орального применения может иметь твердую или жидкую лекарственную форму. Твердые лекарственные формы включают гранулы, пакеты, саше и раздельные единицы, такие как таблетки, единицы в виде отдельных частиц, капсулы (мягкий и плотный желатин) и т.д. Жидкие лекарственные формы включают эликсиры, суспензии, эмульсии, растворы, сиропы и т.д. Композиция, предназначенная для перорального применения, может быть получена любым способом, известным в технологии производства этой композиции, и такие фармацевтические композиции могут содержать в дополнение к активным ингредиентам вспомогательные вещества, такие как разбавители, распадающиеся вещества, связывающие вещества, солюбилизаторы, смазывающие вещества, вещества, способствующее скольжению, сурфактанты, суспендирующие вещества, стабилизаторы, ароматизаторы, подсластители,красители и т.д. Некоторые примеры подходящих вспомогательных веществ включают лактозу, целлюлозу и ее производные, такие как микрокристаллическая целлюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, этилцеллюлоза, двухкальциевый фосфат, маннитол, крахмал, желатин, поливинилпирролидон, различные камеди, например аравийская камедь, трагакантовая, ксантановая, альгинат и их производные, сорбит, декстрозу, ксилит, стеарат магния, тальк, коллоидный кремниевый ангидрит, минеральное масло, глицерилмоностеарат, глицерилбегенат, натрия крахмалгликолят, сшитый повидон,сшитую карбоксиметилцеллюлозу, различные эмульгаторы, такие как полиэтиленгликоль, сложные эфиры сорбита и жирной кислоты, алкиловые эфиры полиэтиленгликоля, сахарные спирты, полиокситриметилен-полиоксипропилен блок-сополимеры, полиэтоксилированные эфиры жирной кислоты, диэфиры и их смеси. Стерильные композиции для инъекций могут составляться в соответствии с традиционной фармацевтической практикой путем растворения или суспендирования активного вещества в среде, например в воде для инъекций, н-метил-2-пирролидоне, пропиленгликоле и других гликолях, спиртах, природных растительных маслах, таких как кунжутное масло, кокосовое масло, арахисовое масло, хлопковое масло или в синтетических жирных средах, таких как этилолеат и подобные среды. По необходимости в состав могут включаться буферные растворы, антиоксиданты, консерванты, комплексообразующие вещества,такие как производные целлюлозы, пептиды, полипептиды и циклодекстрины. Лекарственная форма может иметь медленное, задержанное или контролируемое высвобождение активных ингредиентов в дополнение к форме с быстрым высвобождением. Количество активного ингредиента, которое необходимо для достижения терапевтического эффекта будет, конечно, варьироваться в зависимости от конкретного препарата, способа введения, субъекта,подвергаемого терапии, и конкретного нарушения или болезни, в отношении которого проводится терапия. Соединения, описанные в настоящем изобретении, могут вводиться перорально или парентерально в дозе от 0,001 до 1500 мг/кг в день, предпочтительно от 0,01 до 1500 мг/кг в день, более предпочтительно от 0,1 до 1500 мг/кг в день и наиболее предпочтительно от 0,1 до 500 мг/кг в день. Доза для взрослых людей обычно составляет от 5 мг до 35 г в день, при этом предпочтительной дозой является от 5 мг до 2 г в день. Таблетки и другие лекарственные формы, представленные в раздельных единицах, могут для удобства содержать количество соединения, описанного в настоящем изобретении, которое эффективно в такой дозировке или составляет количество, кратное такой дозировке, например единицы, содержащие от 5 до 500 мг. Соединение, описанное в настоящем изобретении, может использоваться в качестве единственного активного ингредиента в медикаменте, однако оно также может использоваться в комбинации с одним или несколькими другими активными веществами. Эти другие активные вещества могут быть другими соединениями, описанными в настоящем изобретении, или другими лекарственными веществами, например лекарством против ожирения или антидислипидемическим веществом или другим лекарственно активным веществом. Соединения, описанные в настоящем изобретении, могут использоваться в комбинации с одним или несколькими другими подходящими лекарственно активными веществами, выбираемыми из группы, в которую входят гиполипидемические вещества, антиатеросклеротические вещества, антидиабетические вещества, антиостеопорозные вещества, лекарства против ожирения, анксиолитики, антидепрессанты,антигипертензивные вещества, сердечные гликозиды, препараты для подавления аппетита, вещества,стимулирующие рост, вещества для лечения кожных заболеваний, ингибиторы резорбции кости и вещества, оказывающие действие, подобное эффектам тиреоидных гормонов. Примеры подходящих гиполипидемических веществ, используемых в комбинации с соединениями,описанными в настоящем изобретении, включают без ограничения ингибитор микросомного белка переноса триглицеридов, ингибитор гидроксиметилглутарил-кофермент А-редуктазы, ингибитор синтетазы сквалена, производное фиброевой кислоты, ингибитор АСАТ, ингибиторы липоксигеназы, ингибитор абсорбции холестерина, ингибитор со-транспорта Na +/желчной кислоты в подвздошной кишке, повышающие регуляторы рецепторов липопротеинов низкой плотности, ингибитор белка переноса холестеринового эфира, вещество, усиливающее экскрецию желчной кислоты, -агонист рецептора активатора пролиферации пероксисом, -агонист рецептора активатора пролиферации пероксисом, двойной /агонист рецептора активатора пролиферации пероксисом, двойной /-агонист рецептора активатора пролиферации пероксисом и/или никотиновую кислоту и ее производные, или фармацевтически приемлемую их соль. Примеры подходящих антидиабетических веществ, используемых в комбинации с соединениями,описанными в настоящем изобретении, включают без ограничения бигуаниды, такие как метформин,фенетилбигуанид, сульфонилмочевину, такую как гликлазид, ингибитор -глюкозидазы, -агонист рецептора активатора пролиферации пероксисом, такой как тиазолидиндион, -агонист рецептора активатора пролиферации пероксисом, такие как производные фиброевой кислоты, ингибитор -амилазы, ингибитор окисления жирной кислоты, антагонист А 2, -агонист или антагонист рецептора активатора пролиферации пероксисом, двойной /-агонист рецептора активатора пролиферации пероксисом, ингибитор аР 2, ингибитор дипептидил-пептидазы IV (DP4), ингибитор SGLT2, ингибитор гликогенфосфорилазы, глюкагоноподобный пептид-1 (GLP-1) и егоаналоги, активатор глюкокиназы, агонист рецептора VPAC2, ингибитор РТР-1 В (протеин тирозин фасфатаза-1 В), ингибитор 11-HSD 1(11 гидроксистероид дегидрогеназы 1), меглитинид, антагонист глюкокортикоида (GR), а также инсулин или фармацевтически приемлемую их соль. Примеры подходящих антиостеопорозных веществ, используемых в комбинации с соединениями,описанными в настоящем изобретении, включают без ограничения алендронат, ризедронат, паратгормон,фрагмент паратгормона, ралоксифен, кальцитонин, антагонист RANK-лиганда, антагонист кальциевого чувствительного нервного окончания, ингибиторы тартрат-резистентной кислой фосфатазы (TRAP), селективный модулятор рецепторов эстрогена (SERM) и ингибиторы АР-1 или фармацевтически приемлемую их соль. Примеры подходящих средств против ожирения, используемых в комбинации с соединениями,описанными в настоящем изобретении, включают без ограничения ингибитор переносчика 5 НТ (серотонин), ингибитор переносчика NE (норэпинефрин), антагонист/обратный агонист СВ-1 (рецептор каннабиноида-1), антагонист грелина, антагонист/обратный агонист Н 3 (гистамин Н 3), антагонист NPY1 (нейропептид Y Y1), агонист NPY2 (нейропептид Y Y2), антагонист NPY5 (нейропептид Y Y5), лептин или его производное, антагонист опиоида, антагонист орексина, агонист BRS3 (рецептор бомбезина подтип 3), агонист CCK-A (холецистокинин-А), CNTF (цилиарный нейротрофический фактор), производноеCNTF, агонист GHS (рецептор стимулятора секреции гормона роста), агонист 5 НТ 2 с (рецептор серотонина 2 с), агонист Мс 3r (рецептор меланокортинов 3-го типа), агонист Мс 4r (рецептор меланокортинов 4 го типа), ингибитор обратного захвата моноамина, агонист 3 (3-адренергический рецептор), ингибиторSCD-1 (стеароил-кофермент 1-десатуразы), ингибитор липазы, ингибитор переносчика жирных кислот,ингибитор переносчика дикарбоксилата, анорексигенные средства, такие как декстроамфетамин сульфат,фентермин, фенилпропаноламин или мазиндол или фармацевтически приемлемую их соль. Соединения, описанные в настоящем изобретении, могут комбинироваться с ускоряющими рост средствами, такими как, без ограничения, тиролиберин, диэтилстильбэстрол, теофиллин, энкефалин,простагландины серии Е или фармацевтически приемлемой их солью. Соединения, описанные в настоящем изобретении, могут также использоваться в комбинации со стимуляторами секреции гормона роста, такими как GHRP-6, GHRP-1, GHRP-2 или с фактором, высвобождающими гормон роста, и его аналогами или гормоном роста и его аналогами или соматомединами,включая IGF-1 и IGF-2, или с -адренергическими агонистами, такими как клонидин или серотонин, агонистами 5-HT.суб.D-рецепторов, такими как суматриптан, или веществами, ингибирующими соматостатин или его высвобождение, такими как физостигмин и пиридостигмин. Кроме того, соединения, описанные в настоящем изобретении, могут использоваться в комбинации с паратиреоидным гормоном, паратгормоном (1-34) или дифосфонатами, такими как MK-217 (алендронат). Примеры подходящих анксиолитиков, используемых в комбинации с соединениями, описанными в настоящем изобретении, включают диазепам, лоразепам, буспирон, оксазепам, гидроксизина памоат и подобные средства. Примеры подходящих антидепрессантов, используемых в комбинации с соединениями, описанными в настоящем изобретении, включают циталопрам, флуоксетин, нефазодон, сертралин, пароксетин и подобные средства. Примеры подходящих антигипертензивных веществ, используемых в комбинации с соединениями,описанными в настоящем изобретении, включают без ограничения ингибитор ангиотензинконвертирующего фермента (АСЕ), ингибитор ренина, блокатор -адренергического рецептора, блокатор-адренергического рецептора, блокатор кальциевых каналов, активатор калиевых каналов, ингибитор альдостерон-синтазы, ингибитор нейтральной эндопептидазы (NEP), двойной ингибитор ангиотензинконвертирующего фермента/нейтральной эндопептидазы (ACE/NEP), антагонист рецептора эндотелина,двойной антагонист ангиотензина и рецептора эндотелина (DARA), диуретик или фармацевтически приемлемую их соль. Примеры подходящих сердечных гликозидов, используемых в комбинации с соединениями, описанными в настоящем изобретении, включают дигиталис и уабаин. Примеры подходящих веществ, оказывающих действие, подобное эффектам тиреоидных гормонов,которые используются в комбинации с соединениями, описанными в настоящем изобретении, включают без ограничения KB-2115, МВ 07811 или фармацевтически приемлемую их соль. Для терапии воспалений или болезней кожи, как описано выше, соединения, описанные в настоящем изобретении, могут использоваться самостоятельно или при желании в комбинации с ретиноидом,таким как третиноин, или аналогом витамина D. Упомянутые выше другие терапевтические средства при применении в комбинации с соединениями, описанными в настоящем изобретении, могут использоваться, например, в количествах, указанных в"Настольном справочнике врача" (PDR) или в другой специальной литературе. Если соединения, описанные в настоящем изобретении, принимаются в виде комбинации с одним или несколькими другими терапевтическими средствами, прием производится одновременно, последовательно или в форме фиксированных единиц. Сокращения.TSH - тиреостимулирующий гормон (тиротропин),Т 4 - тироксин,Т 3 - трийодтиронин,Т 2 - дийодтиронин,rT3 - обратный Т 3,SAR - зависимость активности от структуры,NPY - нейропептид Y. Схемы реакций для синтеза соединений, описанных в настоящем изобретении Далее приведены схемы реакций для синтеза соединений в соответствии с другим вариантом воплощения настоящего изобретения. Схема 1 где R1, R2, R3, R4 и Z соответствуют определению выше, a Y - галоген или другая уходящая группа. В конкретном варианте воплощения соединение формулы (I) получается из производных пиразола формулы (II) или дикетоновых производных формулы (III), как указано на схеме 1. Производные формулы (II) вступают в реакцию с замещенным галоидным алкилом или любым другим производным алкила, содержащим подходящую уходящую группу в присутствии основания, селектированного из гидрида металла или карбоната металла, в полярном апротонном растворителе, таком как тетрагидрофуран с выходом соединений формулы (I). Аналогично, дикетоновое производное формулы (III), вступая в реакцию с производными замещенного гидразина в спиртовом растворе, дает соединение формулы (I). Соединения формулы (II) получаются путем обработки соединений формулы (III), указанных на схеме 1, гидратом гидразина при известных из специальной литературы условиях. Соединения формулы(III) приготовляются из соединений формулы (IV) путем реакции с замещенными гидроксиинданами формулы (XII), (XIV), (XVI), или (XVII) или с замещенными гидроксииндолами в присутствии основания, такого как гидрид металла или карбонат металла в полярном апротонном растворителе, таком как тетрагидрофуран. Соединения формулы (IV) могут получаться из дикетонового производного формулы(V) путем его растворения в подходящем растворителе, таком как ацетонитрил, в присутствии подходящего реактива, такого как триметилсилил хлорид и диметилсульфоксид. Другим способом соединения формулы (III) получаются непосредственно в результате реакции соединений формулы (V) с производными альдегида формулы (XIII) в присутствии пиперидин-уксусной кислоты с последующей гидрогенизацией в присутствии катализатора, такого как Pd/BaSO4, в водородной среде или с производными хлора формулы (XV) в присутствии гидрида металла или карбоната металла. При другом процессе соединение формулы (III) может быть получено из соединения формулы (VI) в результате его реакции с соответствующим хлорангидридом или сложным этиловым эфиром в присутствии основания, такого как гидрид металла или алкоксид металла. Соединение формулы (VI) получает- 13019084 ся из соединения формулы (VII) в результате его реакции с подходящим гидрокси- или аминоинданом формулы (XII), (XIV), (XVI) или (XVII) или производными индола в присутствии основания, предпочтительно селектированного из гидрида металла или карбоната металла. Соединение формулы (VII), указанное на схеме 1, получают путем бромирования метилкетона формулы (VIII) в соответствующем растворителе, таком как метанол. Соединения формулы (II) и формулы (I) могут быть получены из кетоновых производных формулы(IX) или из циановых производных формулы (X) путем реакции соединений формулы (IX) с соответствующим замещенным или незамещенным гидразином в присутствии спиртового растворителя с получением соединений формулы (I) и формулы (II) соответственно. Соединение формулы (IX) получается в результате реакции соединения формулы (VI) с диэтилацеталем диметилформамида. Другим способом соединения формулы (X) вступают в реакцию с соединениями формулы (XV) в присутствии основания, такого как гидрид металла, с последующей обработкой соответствующим замещенным или незамещенным гидразином в присутствии спиртового растворителя с получением соединений формулы (I) и формулы (II) соответственно. Как показано на схеме 1, циановые производные формулы (X) получаются из соединения формулы(VII) путем его растворения в органическом растворителе, таком как диметилформамид, в присутствии цианистого натрия. Соединение формулы (I), получаемое по схеме 1, является либо окончательным соединением, либо может быть преобразовано в формулу (I) путем преобразования соответствующей функциональной группы или применения обычных методов, известных из уровня техники. Промежуточные соединения формулы (XII), (XIII), (XIV) и (XV) могут быть получены, как показано на схеме 2, приведенной ниже. Схема 2 Как показано на схеме 2, промежуточные соединения (XII) получают из замещенного дигидрокумарина XI или из 4-гидроксииндана. В конкретном варианте воплощения замещенный дигидрокумарин формулы (XI) нагревается с треххлористым алюминием с последующим восстановлением кетоновой группы инданона с триэтилсиланом в трифторуксусной кислоте с получением соединения формулы(XII). Восстановление инданона может также выполняться способом, раскрытым в US 2005/0037925,WO 9943647 и US 2002/0040016. Другим способом 4-гидроксииндан вступает в реакцию с параформальдегидом с получением альдегид-замещенного соединения, которое либо восстанавливается до метиловой группы, в присутствии подходящего реактива, такого как NH2NH2-KOH-этиленгликоль или Pd/C в водородной среде либо до кислоты путем окисления альдегида с помощью мягкого окислителя, такого как сульфаминовая кислота и хлористокислый натрий. Полученная кислотная группа далее вступает в реакцию с соответствующим спиртом в присутствии минеральной кислоты с получением эфира или с помощью подходящего амина и связующего реагента, селектированного из карбодиимида, с получением амида. Далее альдегидная группа формулы (XII) также используется для получения цианового производного обычным способом. При другом процессе галогензамещенные производные гидроксииндана формулы(XII) также приготовляются путем реакции 4-гидроксииндана с N-галосукцинимидом в присутствии катализирующего количества диизопропиламина в растворителях, предпочтительно, тетрагидрофуране или дигалоалкане (G"=галоген) или путем обработки сульфурилхлорида (G"=хлор). Соединение формулы (XII) или 4-гидроксииндан (G"=H) обрабатывается гексамином в трифторуксусной кислоте с получением соединения формулы (XIII). В еще одном конкретном варианте воплощения соединение формулы (XV) может быть получено из соединения формулы (XIII) в результате его реакции с йодистым метилом в присутствии основания с последующим восстановлением в присутствии восстановителя, такого как борогидрид натрия, и последующей реакции полученного промежуточного соединения с тетрабромметаном и трифенил-фосфином или тионилхлоридом соответственно. При другом процессе соединение формулы (XIV) также получают из соединения формулы (XII) или 4-гидроксииндана путем его обработки азотной кислотой в присутствии уксусной кислоты. Промежуточные соединения формулы (XVI) и (XVII) могут быть получены, как показано на схеме 3, приведенной ниже. Схема 3 Промежуточное соединение формулы (XVI) получают из диметоксиинданона путем восстановления кетоновой группы инданона с помощью триэтилсилана или Pd-C с последующей реакцией с трехбромистым бором. Для соединений формулы (XVII), когда G"=метил, получают обработкой 7-метоксииндан-4-ола(XVI) параформальдегидом и последующим восстановлением промежуточного соединения с помощью катализирующего восстановителя, такого как Pd/C в водородной среде в присутствии подходящего спиртового растворителя, селектированного из метанола. При другом способе получения соединения формулы (XVII), когда G"=сложный эфир или амид, соединение формулы (XVI) вступает в реакцию с параформальдегидом, который при дальнейшем окислении в мягких условиях, как описано здесь выше, может быть преобразован в G"=кислота. Далее кислотная группа может вступать в реакцию с соответствующим спиртом в присутствии минеральной кислоты с получением сложного эфира или с помощью подходящего амина и связующего реагента, селектированного из карбодиимида, с получением амида. Для G"=циано- в формуле (XVII) может быть получено путем соответствующего селектирования цианозамещенного инданона или преобразованием производного амида в циано- обычным способом. Другим способом галогензамещенное соединение формулы (XVII) получается в результате реакции 7-метоксииндан-4-ола (XVI) с N-галосукцинимидом в присутствии катализирующего количества диизопропиламина в растворителях, селектированных из тетрагидрофурана или путем обработки сульфурилхлорида (G"=Cl). Примеры получения Далее настоящее изобретение проиллюстрировано, но не ограничено, приведенными ниже примерами. Примеры иллюстрируют получение соединений формулы (I) и, как таковые, не рассматриваются и не подразумеваются как ограничивающие объем изобретения, описанного в пунктах прилагаемой формулы изобретения. Пример 1 (соединение 1). 3-[4-(7-Гидроксииндан-4-илокси)-3,5-диметилпиразол-1-ил]пропионовая кислота. Этап I. Получение 4,7-диметоксииндана. К охлажденной суспензии 4,7-диметоксииндан-1-она (35 г, 0,182 моль), размешанной в триэтилсилане (105,7 г, 0,909 моль), добавляют трифторуксусную кислоту (350 мл) при температуре 10-15 С. Перемешивание продолжают при комнатной температуре в течение 2 ч, после чего охлаждают в воде и экс- 15019084 трагируют с помощью этилацетата. Слой этилацетата смывают раствором бикарбоната натрия, высушивают над сульфатом натрия и выпаривают для получения сырой массы, которую очищают путем колоночной хроматографии с использованием 5% смеси этилацетата с гексаном (22,5 г). Выход: 69,3%. 1H-NMR (400 МГц, CDCl3):6.67 (2 Н, s), 3.70 (6 Н, s), 2.74-2.78 (4 Н, m), 1.95-2.02 (2 Н, m). Этап II. Получение 7-метоксииндан-4-ола. К прозрачному раствору 4,7-диметоксииндана (22,5 г, 0,126 моль) в хлористом метилене (400 мл) добавляют трехбромистый бор (12,27 мл, 0,13 моль) при температуре 0 С. По истечении 2 ч перемешивания при температуре 0-10 С добавляют воду (100 мл), после чего реагирующую смесь экстрагируют с помощью хлористого метилена. Слой хлористого метилена высушивают над сульфатом натрия и отгоняют для получения сырой массы, которую очищают путем колоночной хроматографии с использованием 7% смеси этилацетата с гексаном (9,0 г). Выход: 43,4%. 1H-NMR (400 МГц, DMSO-d6):8.66 (1 Н, s), 6.493-6.558 (2 Н, m), 3.66 (3 Н, s), 2.71-2.75 (4 Н, m),1.92-2.00 (2 Н, m). Этап III. Получение 4-(7-метоксииндан-4-илокси)-3,5-диметил-1 Н-пиразола. К суспензии 60% гидрида натрия (2,0 г, 0,051 моль) в тетрагидрофуране (20 мл) добавляют раствор 7-метоксииндан-4-ола (7,0 г, 0,042 моль) в тетрагидрофуране (30 мл) при комнатной температуре. По истечении 1 ч в размешанный раствор 3-хлор-2,4-пентандиона (9,0 мл, 0,075 моль) добавляют тетрагидрофуран (20 мл), после чего добавляют бромистый калий (3,0 г, 0,025 моль). Реагирующую смесь размешивают при температуре 70 С в течение 6 ч. Затем добавляют воду и экстрагируют с помощью диэтилового эфира. Слой эфира отделяют и отгоняют для получения масляной массы, которую частично очищают в колонке с использованием 2% смеси этилацетата с гексаном для получения сырой массы (2,7 г). Полученную сырую массу перемешивают с гидратом гидразина (1 мл) в 20 мл этанола при температуре 10 С. Этанол выпаривают до сухого состояния. Полученный остаток разделяют на воду и этилацетат. Отделенный слой этилацетата высушивают над сульфатом натрия и отгоняют для получения желаемого продукта (2,0 г). Выход: 18,1% (в два этапа). 1(2H, t), 2.00-2.07 (5H, m), 1.91 (3H, s). Этап IV. Получение 3-[4-(7-метоксииндан-4-илокси)-3,5-диметилпиразол-1-ил]этилового эфира пропионовой кислоты. К суспензии 60% гидрида натрия (0,372 г, 0,0093 моль) в 10 мл тетрагидрофурана добавляют раствор производного пиразола, полученный на этапе III (2,0 г, 0,00775 моль), в 10 мл тетрагидрофурана в атмосфере азота при комнатной температуре. После перемешивания в течение 1 ч при комнатной температуре раствор 3-хлорэтилпропионата (1,15 г, 0,0084 моль) в 10 мл тетрагидрофурана добавляют к реакционной смеси. Перемешивают при комнатной температуре в течение 4 ч. Реакционную смесь выливают в воду, экстрагируют с помощью этилацетата. Слой этилацетата высушивают над сульфатом натрия и отгоняют. Полученную сырую массу очищают путем колоночной хроматографии с использованием 20% смеси этилацетата с гексаном для получения желаемого продукта (0,850 г). Выход: 30,6%. 1(2 Н, t), 2.78-2.83 (4 Н, m), 1.99-2.08 (5 Н, m), 1.89 (3 Н, s), 1.16 (3 Н, t). Этап V. Получение 3-[4-(7-гидроксииндан-4-илокси)-3,5-диметилпиразол-1-ил]пропионовой кислоты. К прозрачному раствору производного этилового эфира, полученного на этапе IV (0,85 г, 0,0023 моль), в 15 мл хлористого метилена, добавляют раствор трехбромистого бора (1,0 мл, 0,0105 моль) в 15 мл хлористого метилена при температуре 0 С. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре; добавляют 10 мл воды и экстрагируют с помощью этилацетата. Слой этилацетата высушивают над сульфатом натрия и отгоняют для получения твердого продукта (230 мг). Выход: 30,6%. 1H-NMR (400 МГц, DMSO-d6):12.27 (1 Н, bs), 8.77 (1 Н, bs), 6.42 (1 Н, d), 6.15 (1H, d), 4.10 (2 Н, t),2.84 (2 Н, t), 2.71-2.78 (4 Н, m), 1.98-2.04 (5 Н, m), 1.88 (3 Н, s). Масса: 315 (М+-1). Пример 2 (соединение 7). 3-[4-(7-Гидроксииндан-4-илокси)-3-тиофен-2-ил-пиразол-1-ил]пропионовая кислота и 3-[4-(7 гидроксииндан-4-илокси)-5-тиофен-2-ил-пиразол-1-ил]пропионовая кислота. Этап I. Получение 2-(7-метоксииндан-4-илокси)-1-тиофен-2-ил-этанона. К прозрачному раствору 4-гидрокси-7-метоксииндана (2,0 г, 0,0121 моль) в ацетоне (20 мл) добавляют углекислый калий (2,52 г, 0,0182 моль) при комнатной температуре и перемешивают в течение 1,5 ч. Раствор 2-бромо-1-тиофен-2-ил-этанон (3,75 г, 0,0181 моль) в ацетоне (10 мл) добавляют при температуре 0 С и перемешивают в течение 8 ч при комнатной температуре. Реакционную смесь выливают в воду (50 мл) и экстрагируют с помощью этилацетата (2100 мл). Слой этилацетата высушивают над сульфатом натрия и выпаривают для получения сырого продукта, который очищают путем колоночной хроматографии с использованием 2% смеси этилацетата с гексаном в качестве подвижной фазы. Полученный элюент выпаривают для получения желаемого продуктаH-NMR (400 МГц, DMSO-d6):8.12 (1 Н, dd), 8.09 (1 Н, dd), 7.29-7.31 (1 Н, m), 6.63 (2 Н, s), 5.33 (2 Н,s), 3.70 (3 Н, s), 2.87 (2 Н, t), 2.78 (2 Н, t), 1.98-2.06 (2 Н, m). Этап II. Получение 3-диметиламино-2-(7-метоксииндан-4-илокси)-1-тиофен-2-ил-пропенона. Соединение, полученное на этапе I примера 2 (2,0 г, 0,0059 моль), добавляют в 5 мл N,Nдиметилформамид диэтилацеталя при комнатной температуре и перемешивают при температуре 80 С в течение 2 ч. Реакционную смесь выливают в охлажденную воду (100 мл) и экстрагируют с помощью этилацетата. Слой этилацетата промывают водой, высушивают над сульфатом натрия и выпаривают для получения маслянистого продукта (1,9 г). Продукт используется в следующем этапе. Выход: 79,5%. Этап III. Получение 4-(7-метоксииндан-4-илокси)-3-тиофен-2-ил-1 Н-пиразола и 4-(7-метоксииндан 4-илокси)-5-тиофен-2-ил-1 Н-пиразола. К прозрачному раствору соединения, полученного на этапе II в примере 2 (1,9 г, 0,0055 моль), в этаноле (30 мл) добавляют гидрат гидразина (0,5 мл, 0,0102 моль) и перемешивают при температуре 60 С в течение 4 ч. Этанол выпаривают под вакуумом и добавляют воду в реакционную смесь. Экстрагируют с помощью этилацетата (250 мл). Слой этилацетата высушивают над сульфатом натрия и отгоняют под вакуумом для получения сырого продукта, который очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном (20:80) в качестве подвижной фазы. Полученный элюент выпаривают под вакуумом для получения 1,0 г желаемого продукта. Выход: 58,13%. 1H-NMR (400 МГц, DMSO-d6): для основного изомера 12.82 (1 Н, s), 7.67 (1H, d), 7.43 (1H, d), 7.24(1 Н, d), 7.02-7.08 (1H, m), 6.65 (1 Н, d), 6.56 (1 Н, d), 3.70 (3 Н, s), 2.92 (2 Н, t), 2.82 (2 Н, t), 2.03-2.10 (2 Н, m). Этап IV. Синтез этилового эфира 3-[4-(7-метоксииндан-4-илокси)-3-тиофен-2-ил-пиразол-1 ил]пропионовой кислоты и этилового эфира 3-[4-(7-митоксииндан-4-илокси)-5-тиофен-2-ил-пиразол-1 ил]пропионовой кислоты Получают способом, описанным для этапа IV в примере 1. Выход: 45,4%. 1H-NMR (400 МГц, DMSO-d6): для основного изомера 7.64 (1 Н, s), 7.45 (1 Н, dd), 7.26 (1H, dd),7.03-7.07 (1H, m), 6.67 (1 Н, d), 6.62 (1 Н, d), 4.30 (2 Н, t), 4.01-4.09 (2 Н, m), 3.72 (3 Н, s), 2.78-2.90 (6 Н, m),2.04-2.07 (2 Н, m), 1.13 (3H, t). Этап V. Получение 3-[4-(7-метоксииндан-4-илокси)-3-тиофен-2-ил-пиразол-1-ил]пропионовой кислоты и 3-[4-(7-метоксииндан-4-илокси)-5-тиофен-2-ил-пиразол-1-ил]пропионовой кислоты. В прозрачный раствор соединения, полученного на этапе IV (0,6 г, 0,0014 моль), в метаноле (5,0 мл) добавляют раствор гидроксида натрия (0,12 г, 0,0029 моль) в воде (25 мл) и перемешивают в течение 2 ч при комнатной температуре. Метанол полностью отгоняют под вакуумом, остаточный водный слой промывают в эфире (20 мл),окисляют с помощью разбавленной соляной кислоты и экстрагируют с помощью этилацетата (250 мл). Отделенный слой этилацетата высушивают над сульфатом натрия и отгоняют под вакуумом для получения производного кислоты (440 мг) в виде твердого вещества. Выход: 78,7%. 1H-NMR (400 МГц, DMSO-d6): для основного изомера 12.42 (1 Н, bs), 7.64 (1H, s), 7.44 (1 Н, d), 7.26(1H, d), 7.05 (1 Н, dd), 6.66 (1 Н, d), 6.62 (1 Н, d), 4.26 (2 Н, t), 3.72 (3 Н, s), 2.78-2.90 (6 Н, m), 2.01-2.06 (2 Н,m). Этап VI. Получение 3-[4-(7-гидроксииндан-4-илокси)-3-тиофен-2-ил-пиразол-1-ил]пропионовой кислоты и 3-[4-(7-гидроксииндан-4-илокси)-5-тиофен-2-ил-пиразол-1-ил]пропионовой кислоты. В прозрачный раствор соединения, полученного на этапе V в примере 2 (0,44 г, 0,00118 моль), в хлористом метилене (20 мл) по каплям добавляют раствор трехбромистого брома (0,35 мл, 0,0037 моль) в хлористом метилене (5 мл) при температуре 0-10 С и перемешивают в течение 2 ч при комнатной температуре (2528 С). Воду (10 мл) медленно добавляют в реакционную смесь и экстрагируют с помощью хлористого метилена (230 мл). Отделенный слой хлористого метилена высушивают над сульфатом натрия и отгоняют под вакуумом для получения желаемого продукта (200 мг) в виде твердого вещества. Выход: 47,1%. 1H-NMR (400 МГц, DMSO-d6): для основного изомера 12.41 (1H, s), 9.00 (1 Н, s), 7.55 (1 Н, s), 7.44(1 Н, d), 7.29 (1 Н, d), 7.04-7.06 (1 Н, m), 6.46-6.54 (2 Н, m), 4.24 (2 Н, t), 2.73-2.84 (6 Н, m), 1.96-2.06 (2 Н, m). Масса: 369 (М+-1). Пример 3 (соединение 3). 7-[3,5-Диметил-1-(1 Н-тетразол-5-илметил)-1 Н-пиразол-4-илокси]индан-4-ол. Этап I. Получение [4-(7-метоксииндан-4-илокси)-3,5-диметилпиразол-1-ил]ацетонитрила. Получают способом, описанным для этапа IV в примере 1 с использованием бромоацетонитрила вместо этил 3-хлорпропионата. Выход: 96,7%. 1(3,0 г, 0,0101 моль) в диметилформамиде (30 мл) добавляют азид натрия (1,2 г, 0,0185 моль) и триэтиламина гидрохлорид (4,0 г, 0,0303 моль) при комнатной температуре (27-30 С). Реакционную смесь перемешивают при температуре 90-100 С в течение 4 ч. Реакционную смесь охлаждают и выливают в разбавленную соляную кислоту (100 мл), перемешивают в течение 30 мин. Отделенное твердое вещество фильтруют и растворяют в этилацетате (100 мл). Слой этилацетата высушивают над сульфатом натрия и отгоняют под вакуумом для получения 1,5 г желаемого продукта в виде твердого вещества. Выход: 43,7%. 1(2 Н, t), 2.11 (3 Н, s), 2.03-2.09 (2 Н, m), 1.89 (3 Н, s). Этап III. 7-[3,5-Диметил-1-(1 Н-тетразол-5-илметил)-1 Н-пиразол-4-илокси]индан-4-ола. Получают способом, описанным для этапа VI в примере 2. Выход: 31,3%. 1(2 Н, t), 2.11 (3 Н, s), 2.00-2.06 (2 Н, m), 1.88 (3 Н, s). Масса: 325 (М+-1). Пример 4 (соединение 10). 5-[4-(7-Гидроксииндан-4-илокси)-3,5-диметилпиразол-1-илметил]-1H-пиразол-3-ол. Этап I. Получение этилового эфира 4-[4-(7-метоксииндан-4-илокси)-3,5-диметилпиразол-1-ил]-3 оксомасляной кислоты. Получают способом, описанным для этапа IV в примере 1, с использованием этилового эфира 4 хлор-3-оксомасляной кислоты в качестве алкилирующего средства, вместо этил 3-хлорпропионата. Выход: 35,7%. 1H-NMR (400 МГц, DMSO-d6):6.64 (1H, d), 6.33 (1H, d), 5.11 (2 Н, s), 4.11 (2 Н, q), 3.69-3.70 (5 Н,m), 2.87-2.92 (2 Н, m), 2.80 (2 Н, t), 2.02-2.07 (2 Н, m), 1.92 (3H, s), 1.90 (3 Н, s), 1.19 (3H, t). Этап II. Получение 5-[4-(7-метоксииндан-4-илокси)-3,5-диметилпиразол-1-илметил]-1 Н-пиразол-3 ола. К перемешанному раствору сложного кетоэфира, полученного на этапе 1 в примере 4 (0,8 г, 0,00207 моль), в метаноле (20 мл) добавляют раствор гидрата гидразина (0,11 мл, 0,00227 моль) в метаноле (5 мл) при температуре 0-10 С. Реакционную смесь нагревают до 75-80 С и перемешивают в течение 12 ч. Метанол отгоняют под вакуумом, и полученное твердое вещество размешивают в этилацетате (5 мл). После этого фильтруют и отжимают для получения 380 мг желаемого продукта в виде твердого вещества. Выход: 51,8%. 1H-NMR (400 МГц, DMSO-d6):11.81 (1 Н, bs), 9.57 (1 Н, bs), 6.61 (1 Н, d), 6.28 (1 Н, d), 5.27 (1 Н, bs),5.03 (2 Н, bs), 3.69 (3 Н, s), 2.88 (2 Н, t), 2.80 (2 Н, t), 2.01-2.08 (5 Н, m), 1.90 (3 Н, s). Этап III. Получение 5-[4-(7-гидроксииндан-4-илокси)-3,5-диметилпиразол-1-илметил]-1 Н-пиразол 3-ола. Получают способом, описанным для этапа VI в примере 2. Выход: 60,4%. 1[3,5-Диэтил-4-(7-гидрокси-6-метилиндан-4-илметил)пиразол-1-ил]уксусная кислота. Этап I. Получение 7-хлорметил-4-метокси-5-метилиндана. К перемешанному раствору 7-метокси-6-метилиндан-4-карбоксальдегида (39 г, 0,205 моль) в метаноле (200 мл) небольшими порциями добавляют борогидрит натрия (9,5 г, 0,225 моль) при температуре 10-20 С и перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь выливают в воду (200 мл) и окисляют с помощью разбавленной соляной кислоты до рН 6. Реакционную смесь подвергают отгонке под вакуумом и затем экстрагируют с помощью этилацетата (2200 мл). Слой этилацетата высушивают над сульфатом натрия и отгоняют под вакуумом для получения 38 г вязкого масла. К прозрачному раствору вязкого масла (38,0 г) в хлористом метилене (160 мл) добавляют тионилхлорид(29,07 мл, 0,396 моль) при температуре 10-15 С и перемешивают при температуре 20-25 С в течение 2 ч. Реакционную смесь выливают в воду (200 мл). Отделенный органический слой промывают насыщенным двууглекислым натрием, высушивают над сульфатом натрия, отгоняют под вакуумом для получения сырого продукта в виде твердого вещества. Твердый сырой продукт растворяют в гексане, фильтруют и затем фильтрат отгоняют для получения желаемого соединения (36,0 г) в виде твердого вещества. Выход: 83,5%. 1H-NMR (400 МГц, DMSO-d6):6.95 (1 Н, s), 4.66 (2 Н, s), 3.70 (3 Н, s), 2.85-2.98 (4 Н, m), 2.15 (3 Н, s),1.99-2.05 (2 Н, m). Этап II. Получение 3,5-диэтил-4-(7-метокси-6-метилиндан-4-илметил)-1 Н-пиразола. К перемешанной суспензии 3,5-гептандиона (8,7 мл, 0,0642 моль) и карбоната калия (15,0 г, 0,1086 моль) в диметилформамиде (50 мл) медленно добавляют раствор 7-хлорметил-4-метокси-5-метилиндана(15,0 г, 0,0714 моль) в диметилформамиде (25 мл) и перемешивают в течение 2,5-3 ч при температуре 4045 С. К реакционной смеси добавляют воду (500 мл), затем окисляют разбавленной соляной кислотой и экстрагируют с помощью этилацетата (2500 мл). Слой этилацетата высушивают над сульфатом натрия и отгоняют под вакуумом для получения 20 г дикетонового производного в виде вязкого масла. К прозрачному раствору полученного вязкого масла в изопропиловом спирте (80 мл) медленно добавляют раствор 99% гидрата гидразина (3,3 мл, 0,066 моль) в изопропиловом спирте (20 мл) при температуре 15-20 С. Реакционную смесь нагревают до температуры 80-85 С и перемешивают в течение 1 ч. Добавляют уксусную кислоту (7,5 мл) и продолжают нагревать в течение 11-12 ч. Изопропиловый спирт отгоняют и остаток разделяют на водный раствор двууглекислого натрия (200 мл) и этилацетат (2200 мл). Слой этилацетата высушивают над сульфатом натрия и отгоняют под вакуумом для получения твердого вещества. Полученное твердое вещество перемешивают в гексане (50 мл), фильтруют и высушивают под вакуумом для получения 9,3 г желаемого пиразола. Выход: 43,7%. 1H-NMR (400 МГц, DMSO-d6): 12.02 (1H, s), 6.46 (1 Н, s), 3.64 (3 Н, s), 3.51 (2 Н, s), 2.84-2.88 (2 Н, m),2.75 (2 Н, t), 2.36-2.40 (4 Н, m), 2.06 (3 Н, s), 1.96-2.04 (2 Н, m), 1.00-1.04 (6 Н, m). Этап III. Получение этилового эфира [3,5-диэтил-4-(7-метокси-6-метилиндан-4-илметил)пиразол-1 ил]уксусной кислоты. К перемешанному раствору производного пиразола, полученного на этапе II в примере 5 (9,0 г,0,0302 моль), и этилбромоацетата (6,7 мл, 0,0604 моль) в диметилформамиде (50 мл) добавляют углекислый цезий (14,7 г, 0,0453 моль) и перемешивают в течение 16 ч при комнатной температуре (25-30 С). Реакционную смесь выливают в воду (400 мл). Отделенное твердое вещество фильтруют, хорошо промывают водой (50 мл) и отжимают. Твердый отжатый осадок растворяют в этилацетате (200 мл) и промывают водой. Слой этилацетата высушивают над сульфатом натрия и отгоняют под вакуумом для получения сырого твердого вещества. Сырое твердое вещество перемешивают в гексане (50 мл) в течение 2 ч, фильтруют, промывают в гексане (10 мл) и высушивают под вакуумом для получения желаемого продукта в виде белого твердого вещества (9,0 г). Выход: 77,6%. 1(3 Н, t), 0.89 (3 Н, t). Этап IV. Получение [3,5-диэтил-4-(7-метокси-6-метилиндан-4-илметил)пиразол-1-ил]уксусной кислоты. К перемешанному раствору этилового эфира [3,5-диэтил-4-(7-метокси-6-метилиндан-4 илметил)пиразол-1-ил]уксусной кислоты, полученного на этапе III (9,0 г, 0,0234 моль), в тетрагидрофуране (40 мл) и метаноле (20 мл) добавляют раствор гидроксида натрия (1,87 г, 0,0468 моль) в воде (75 мл) при температуре 20-30 С и перемешивают в течение 1,5-2 ч. Реакционную смесь выливают в воду(50 мл) и экстрагируют с помощью этилацетата (2200 мл). Остаточный водный слой окисляют разбавленной соляной кислотой. Отделенное твердое вещество фильтруют, хорошо промывают водой (50 мл) и высушивают под вакуумом при температуре 60-65 С для получения желаемого продукта в виде твердого белого вещества (6,3 г). Выход: 75,5%. 1 стого бора (4,2 мл, 0,0442 моль) в хлористом метилене (20 мл) при температуре 0-5 С и перемешивают в течение 2-3 ч при температуре 20-30 С. Воду (250 мл) добавляют в реакционную смесь и перемешивают в течение 1 ч. Отделенное твердое вещество фильтруют под вакуумом, промывают в воде. Полученное твердое вещество растворяют в этилацетате (2,0 л) и промывают в воде (1 л). Этилацетат отгоняют под вакуумом и в дальнейшем полученное твердое вещество размешивают в диэтиловом эфире (50 мл),фильтруют и высушивают при температуре 55-60 С под вакуумом для получения 4,5 г желаемого продукта. Выход: 78,3%. 1I. Получение 3-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1 ил]пропионовой кислоты. Получают способом, описанным для этапа IV в примере 5. Выход: 54,0%. 1H-NMR (400 МГц, DMSO-d6):12.29 (1 Н, bs), 6.49 (1 Н, s), 4.10 (2 Н, t), 3.64 (3 Н, s), 3.48 (2 Н, s),2.86 (2 Н, t), 2.68-2.75 (4 Н, m), 2.10 (3 Н, s), 2.08 (3 Н, s), 1.96-2.03 (2 Н, m), 1.92 (3 Н, s). Этап II. Получение N-изопропил-3-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1 ил]пропионамида. К раствору 3-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]пропионовой кислоты (1,0 г, 0,00292 моль) в тетрагидрофуране (20 мл), добавляют карбонилдиимидазол (0,62 г, 0,0038 моль) при температуре 20-30 С. Реакционную смесь нагревают и перемешивают в течение 1 ч при температуре 70-75 С. Раствор изопропиламина (0,3 мл, 0,00367 моль) в тетрагидрофуране (5 мл) добавляют при температуре 20-30 С. Реакционную смесь в дальнейшем перемешивают при температуре 70 С в течение 4 ч. Реакционную смесь охлаждают и выливают в воду (50 мл), затем экстрагируют с использованием этилацетата (2100 мл). Слой этилацетата высушивают над сульфатом натрия, отгоняют под вакуумом для получения сырого продукта, который затем размешивают в гексане (20 мл) и фильтруют для получения 810 мг желаемого продукта в виде твердого вещества. Выход: 72,8%. 1(2 Н, s), 2.86 (2 Н, t), 2.73 (2 Н, t), 2.49 (2 Н, объединенный с пиком DMSO-d6), 2.08 (6 Н, s), 1.95-2.03 (2 Н,m), 1.92 (3 Н, s), 0.98 (6 Н, d). Этап III. Получение 3-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]-Nизопропилпропионамида. Получают способом, описанным для этапа VI в примере 2 Выход: 51,9%. 1H-NMR (400 МГц, DMSO-d6):8.11 (1 Н, s), 7.76 (1 Н, d), 6.40 (1 Н, s), 4.08 (2 Н, t), 3.76-3.81 (1 Н, m),3.42 (2 Н, s), 2.75 (2 Н, t), 2.69 (2 Н, t), 2.51 (2 Н, объединенный с пиком DMSO-d6), 2.07 (3 Н, s), 2.02 (3 Н, s),1.90-1.99 (5 Н, m), 0.98 (6 Н, d). Масса: 370 (М 1). Пример 7 (соединение 42). 5-[3,5-Диэтил-4-(7-гидрокси-6-метилиндан-4-илметил)пиразол-1-илметил]-3H-[1,3,4]оксадиазол-2 она. Этап I. Получение [3,5-диэтил-4-(7-метокси-6-метилиндан-4-илметил)пиразол-1-ил]гидразида уксусной кислоты. Перемешанную суспензию этилового эфира[3,5-диэтил-4-(7-метокси-6-метилиндан-4 илметил)пиразол-1-ил]уксусной кислоты (3,3 г, 0,0085 моль) и 99% гидрат гидразина (33 мл) нагревают до температуры 60-65 С в течение 3 ч. Реакционную смесь выливают в воду (200 мл), перемешивают в течение 1 ч и после этого фильтруют. Полученное твердое вещество размешивают в метаноле (10 мл),фильтруют и высушивают для получения 2,9 г желаемого продукта в виде твердого вещества. Выход: 91,4%. 1[3,5-диэтил-4-(7-метокси-6-метилиндан-4-илметил)пиразол-1 ил]гидразида уксусной кислоты (1,5 г, 0,0041 моль) в 1,4-диоксане (70 мл), добавляли карбонилдиимидазол (2,0 г, 0,0121 моль) при температуре 20-30 С. Реакционную смесь перемешивают в течение 8 ч при температуре 90-95 С. Реакционную смесь охлаждают и выливают в воду (200 мл), перемешивают в течение 2 ч, после чего отделенное твердое вещество фильтруют. После этого твердое вещество размешивают в диэтиловом эфире (25 мл) и фильтруют, затем высушивают для получения 900 мг желаемого продукта в виде твердого вещества. Выход: 56,2%. 1H-NMR (400 МГц, DMSO-d6):12.28 (1 Н, bs), 6.45 (1H, s), 5.20 (2 Н, s), 3.64 (3 Н, s), 3.54 (2 Н, s),2.87 (2 Н, t), 2.74 (2 Н, t), 2.54 (2 Н, q), 2.31 (2 Н, q), 2.06 (3 Н, s), 1.98-2.01 (2 Н, m), 1.00 (3 Н, t), 0.92 (3 Н, t). Этап III. Получение 5-[3,5-диэтил-4-(7-гидрокси-6-метилиндан-4-илметил)пиразол-1-илметил]-3H[1,3,4] оксадиазол-2-она. Получают способом, описанным для этапа VI в примере 2. Выход: 70,7%. 1H-NMR (400 МГц, DMSO-d6):12.41 (1 Н, s), 8.14 (1 Н, s), 6.37 (1H, s), 5.20 (2 Н, s), 3.49 (2 Н, s),2.69-2.77 (4 Н, m), 2.53 (2 Н, объединенный с пиком DMSO-d6), 2.31 (2 Н, q), 1.91-2.01 (5 Н, m), 0.99 (3 Н, t),0.92 (3 Н, t). Масса: 383 (М 1). Пример 8 (соединение 45). 6-[4-(7-Гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-илметил]-2-метил-3Hпиримидин-4-он. Этап I. Получение этилового эфира 4-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол 1-ил]-3-оксомасляной кислоты. Получают способом, описанным для этапа IV в примере 1 с использованием этилового эфира 4 хлор-3-оксомасляной кислоты в качестве алкилирующего средства вместо этил-3-хлорпропионата. Выход: 47,1%. 1H-NMR (400 МГц, DMSO-d6):6.53 (1 Н, s), 5.07 (2 Н, s), 4.4.08 (2 Н, q), 3.64 (3 Н, s), 3.63 (2 Н, s),3.51 (2 Н, s), 2.86 (2 Н, t), 2.74 (2 Н, t), 2.09 (3 Н, s), 1.97-2.05 (5 Н, m), 1.92 (3 Н, s), 1.18 (3 Н, t). Этап II. Получение 6-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-илметил]-2 метил-3H-пиримидин-4-она. К раствору этилового эфира 4-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]-3 оксомасляной кислоты (1,0 г, 0,0025 моль) в этаноле (60 мл), добавляют ацетамидина гидрохлорид (0,71 г, 0,0075 моль). После этого добавляют этилат натрия (0,51 г, 0,0075 моль) при температуре 5-10 С и затем перемешивают при температуре 70-75 С в течение 2 ч. Этанол отгоняется под вакуумом, и остаток разделяется на этилацетат (100 мл) и воду (100 мл). В дальнейшем водный слой экстрагируется с использованием этилацетата (2100 мл). Объединенный объем слоя этилацетата уменьшается до 20 мл и затем фильтруется для получения 800 мг желаемого продукта. Выход: 81,3%. 1 Н-NMR (400 МГц, DMSO-d6):12.42 (1H, bs), 6.50 (1 Н, s), 5.16 (1 Н, s), 4.97 (2 Н, s), 3.64 (3 Н, s),3.55 (2 Н, s), 2.87 (2 Н, t), 2.74 (2 Н, t), 2.27 (3 Н, s), 2.09 (3 Н, s), 2.05 (3 Н, s), 1.98-2.02 (2 Н, m), 1.95 (3 Н, s). Этап III. Получение 6-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-илметил]-2 метил-3H-пиримидин-4-она. Получают способом, описанным для этапа VI в примере 2. Выход: 58.4%. 1(2H, s), 2.67-2.77 (4H, m), 2.26 (3H, s), 2.03 (6H, s), 1.94-1.99 (5H, m). Масса: 379 (M1). Пример 9 (соединение 46). 3-[4-(7-Гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-илметил]-[1,2,4]оксадиазол-5-ол. Этап I. Получение [4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]ацетонитрила. Получают способом, описанным для этапа IV в примере 1 с использованием бромацетонитрила в качестве N-алкилирующего вещества вместо этил-3-хлорпропионата. Выход: 52,8%. 1(2 Н, t), 2.15 (3 Н, s), 2.09 (3 Н, s), 1.92-2.03 (5 Н, m). Этап II. Получение N-гидрокси-2-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1 ил]ацетамидина. К перемешанному раствору [4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1 ил]ацетонитрила (2,0 г, 0,00647 моль) в метаноле (50 мл) добавляют суспензию гидроксиламина гидро- 21019084 хлорид (2,29 г, 0,033 моль) и карбоната калия (4,37 г, 0,0317 моль) в воде (20 мл). Реакционную смесь перемешивают в течение 30-36 ч при температуре 70 С, охлаждают, а затем фильтруют. Полученное твердое вещество промывают в воде (10 мл), затем промывают в гексане, после чего высушивают под вакуумом для получения 1,8 г желаемого продукта Выход: 81,4%. 1N-гидрокси-2-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1 ил]ацетамидина (2,4 г, 0,00701 моль) в пиридине (50 мл), добавляют этилхлорформат (1,5 мл, 0,0157 моль) при температуре 0-5 С. Реакционную смесь перемешивают в течение 15 мин, пиридин отгоняют под вакуумом. К полученному остатку добавляют смесь воды и тетрагидрофурана (1:1) 40 мл и 1 М раствора гидроксида натрия (10 мл), и перемешивают при температуре 75 С в течение 1 ч, после чего продолжают перемешивать в течение 24 ч при температуре 25-28 С. К реакционной смеси добавляют 2 М соляную кислоту (200 мл) и экстрагируют с помощью этилацетата (2100 мл). Слой этилацетата высушивают над сульфатом натрия и отгоняют под вакуумом для получения 2,0 г твердого вещества. Полученное твердое вещество смешивается с тетрагидрофураном (5 мл) и 1 М гидроксидом натрия (50 мл) и дефлегмируют в течение 24 ч. Реакционную смесь охлаждают и добавляют 2 N соляную кислоту(100 мл). Отделенное твердое вещество фильтруют, промывают водой (20 мл) и растворяют в этилацетате (100 мл). Слой этилацетата высушивают над сульфатом натрия и отгоняют под вакуумом для получения 880 мг желаемого продукта в виде твердого вещества. Выход: 34,10%. 1(2 Н, t), 2.13 (3 Н, s), 2.08 (3 Н, s), 1.95-2.03 (2 Н, m), 1.94 (3 Н, s). Этап IV. Получение 3-[4-(7-гидрокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-илметил][1,2,4]оксадиазол-5-ола. Получают способом, описанным для этапа VI в примере 2. Выход: 79,5%. 1H-NMR (400 МГц, DMSO-d6):8.15 (1 Н, s), 6.44 (1 Н, s), 5.14 (2 Н, s), 3.46 (2 Н, s), 2.68-2.77 (4 Н, m),2.13 (3 Н, s), 2.03 (3 Н, s), 1.87-1.99 (5 Н, m). Масса: 353 (M+-1). Пример 10 (соединение 6). Пропан-2-сульфоновая кислота 3-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1 ил]пропиониламида. К суспензии 60% гидрида натрия (76 мг, 0,0019 моль) в тетрагидрофуране (2 мл) добавляют раствор 3-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]пропионамида (500 мг, 0,00146 моль) в тетрагидрофуране (5 мл) при комнатной температуре и перемешивают в течение 20 мин. Раствор изопропилсульфонилхлорида (0,18 мл, 0,0016 моль) в тетрагидрофуране (3 мл) добавляют при температуре 0-5 С и перемешивают при температуре 15-25 С в течение 3 ч. Тетрагидрофуран отгоняют под вакуумом, к реакционной смеси добавляют разбавленную соляную кислоту (20 мл) и экстрагируют с помощью этилацетата (50 мл). Слой этилацетата высушивают над сульфатом натрия и отгоняют под вакуумом для получения сырого продукта, который очищают путем колоночной хроматографии с использованием этилацетата в качестве подвижной фазы. Частицы отгоняют для получения 80 мг желаемого соединения в виде твердого вещества. Выход: 12,2%. 1(6 Н, d). Масса: 446 (М+-1). Пример 11 (соединение 12). 7-[1-(2-Гидроксиэтил)-3,5-диметил-1H-пиразол-4-илмеетил]-5-метилиндан-4-ол. Этап I. Получение 3-(7-метокси-6-метилиндан-4-илметил)пентан-2,4-диона. К раствору 7-метокси-6-метилиндан-4-карбальдегида (8,0 г, 0,042 моль) и ацетилацетона (4,63 г,0,046 моль) в толуоле (80 мл) добавляют пиперидин (0,5 мл) и уксусную кислоту (0,5 мл). Реакционную смесь дефлегмируют над молекулярным ситом 3 с использованием аппарата Дин-Старка в течение 24 ч. Толуол отгоняют под вакуумом для получения сырого продукта, который очищают путем колоночной хроматографии с использованием 5% смеси этилацетата с гексаном. Частицы отгоняют для получения 3,0 г сгущенного продукта. Продукт растворяют в метаноле (60 мл) и проводят гидрогенизацию над 5% вес. палладия на сульфате бария (350 мг) при 40-50 фунтов/кв.дюйм с использованием газообразного водорода при температуре 25-30 С. Реакционную смесь фильтруют через фильтр Hyflow и отгоняют под вакуумом для получения 2,9 г желаемого соединения в виде вязкого масла. Выход: 25,1%. Масса: 274 (М+-1). Этап II. Получение 2-[4-(7-метокси-6-метилиндан-4-илметил)-3,5-диметилпиразол-1-ил]этанола. К перемешанному раствору 3-(7-метокси-6-метилиндан-4-илметил)-пентан-2,4-диона (1,0 г, 0,0036 моль) в этаноле (15 мл) добавляют раствор 2-гидразиноэтанола (0,33 г, 0,0043 моль) в этаноле (5 мл) при температуре 25-30 С и реакционную смесь нагревают до 70 С в течение 1 ч. Добавляют уксусную кислоту (2 мл). После этого реакционную смесь перемешивают при температуре 70 С в течение 3 ч. Этанол отгоняют под вакуумом для получения остатка, который разделяют на этилацетат (50 мл) и воду (25 мл). Этилацетат отгоняют под вакуумом для получения сырого продукта. Сырой продукт отверждают после перемешивания в диэтиловом эфире (10 мл). Твердое вещество фильтруют под вакуумом и высушивают для получения 700 мг желаемого продукта в виде твердого вещества. Выход: 61,4%. Масса: 315 (М 1). Этап III. Получение 7-[1-(2-гидроксиэтил)-3,5-диметил-1 Н-пиразол-4-илметил]-5-метилиндан-4 ола. Получают способом, описанным для этапа VI в примере 2. Выход: 45,4%. 1(2 Н, s), 2.69-2.77 (4 Н, m), 2.08 (3 Н, s), 2.03 (3 Н, s), 1.92-1.99 (5 Н, m). Масса: 301 (М 1). Ниже описан процесс получения промежуточных соединений, которые использовались для получения соединений, указанных в табл. 1. Получение промежуточных соединений. 1. Получение 7-метокси-6-метилиндан-4-карбальдегида. Метод 1. Этап I. Получение 8-метилкумарина. Суспензию 2-гидрокси-3-метилбензальдегида (30 г, 0,220 моль) и безводного ацетата натрия (45 г,0,55 моль) в ангидриде уксусной кислоты (45 г, 0,44 моль) нагревают при температуре 175-180 С в течение 6 ч. Реакционную смесь охлаждают, добавляют воду (150 мл) и гексан (60 мл). Перемешивают в течение 1 ч и фильтруют. Полученное твердое вещество размешивают с диэтиловым эфиром (30 мл). В конечном итоге суспензию фильтруют и высушивают для получения 19 г желаемого продукта. Выход: 85%. 1H-NMR (400 МГц, CDCI3):7.69 (1 Н, d), 7.35-7.37 (1 Н, m), 7.30-7.32 (1 Н, m), 7.16 (1 Н, t), 6.39 (1 Н,d), 2.44 (3 Н, s). Этап II. Получение 8-метилдигидрокумарина. К раствору 8-метилкумарина (16.2 г) в этилацетате (160 мл) добавляют 10 вес.% палладированного угля (1,62 г). Гидрогенизацию проводят в течение 5 ч при температуре 55-60 С в паровом стерилизаторе при 240-250 фунтов/кв.дюйм с использованием газообразного водорода. Реакционную смесь фильтруют с помощью фильтра Hyflow и отгоняют под вакуумом для получения 14,5 г названного соединения в виде твердого белого вещества. Выход: 90%. 1H-NMR (400 МГц, DMSO-d6):7.10-7.14 (2 Н, m), 7.01 (1 Н, t), 2.93-2.97 (2 Н, m), 2.73-2.76 (2 Н, m),2.21 (3 Н, s). Этап III. Получение 4-гидрокси-5-метилиндан-1-она. Смесь 8-метилдигидрокумарина (20 г, 0,123 моль) и треххлористого алюминия (49,3 г, 0,370 моль) перемешивают в течение 2 ч при температуре 175-180 С. К реакционной смеси медленно добавляют воду (250 мл) и перемешивают в течение 1 ч. После этого смесь фильтруют и полученное твердое вещество размешивают в метаноле (60 мл). После этого суспензию фильтруют и полученное твердое вещество высушивают под вакуумом для получения 13,5 г желаемого продукта в виде твердого вещества. Выход: 67,5%. 1(3 Н, s). Этап IV. Получение 5-метилиндан-4-ола. К суспензии 4-гидрокси-5-метилиндан-1-она (8 г) в метаноле (80 мл) добавляют 10 вес.% Pd-C. Гидрогенизацию проводят в течение 5 ч при температуре 55-60 С в паровом стерилизаторе при 200-250 фунтов/кв.дюйм с использованием газообразного водорода. Реакционную смесь фильтруют с помощью фильтра Hyflow, фильтрат отгоняют под вакуумом для получения 6,0 г желаемого продукта в виде белого твердого вещества. Выход: 82,2%. 1 1.92-1.99 (2 Н, m). Этап V. Получение 7-гидрокси-6-метилиндан-4-карбальдегида. К прозрачному раствору 5-метилиндан-4-ола (6 г, 0,0405 моль) в 30 мл трифторуксусной кислоты добавляют гексаметилендиамин (5,7 г, 0,0405 моль) при температуре 25-28 С. Реакционную смесь нагревают и перемешивают при температуре 85-90 С в течение 6 ч. Охлажденную реакционную смесь выливают в насыщенный раствор бикарбоната натрия и экстрагируют с помощью этилацетата (2200 мл). Органический слой высушивают над сульфатом натрия и отгоняют под вакуумом для получения сырого продукта, который очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном (10:90) в качестве подвижной фазы. Собранные частицы отгоняют для получения 5,4 г желаемого продукта в виде твердого вещества. Выход: 76%. 1(3 Н, s), 1.99-2.08 (2 Н, m). Этап VI. Получение 7-метокси-6-метилиндан-4-карбальдегида. К размешанной суспензии 6-метил-7-гидроксииндан-4-карбальдегида (5 г, 0,0284 моль) и углекислого калия (4,7 г, 0,0340 моль) в диметилформамиде добавляют йодистый метил (2,2 мл, 0,0312 моль) при температуре 0 С. Реакционную смесь перемешивают при температуре 25-30 С в течение 4 ч, затем добавляют воду (200 мл) и экстрагируют с помощью этилацетата (2100 мл). Слой этилацетата высушивают над сульфатом натрия и выпаривают для получения сырой массы, которую очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном (10:90) в качестве подвижной фазы. Частицы отгоняют под вакуумом для получения 4,8 г желаемого продукта в виде вязкого масла. Выход: 88,9%. 1(3 Н, s), 2.01-2.08 (2 Н, m) Масса: 191 (M1) Способ 2. Этап I. Получение 4-гидроксииндан-5-карбальдегида. К размешанной суспензии хлористого магния (71,0 г, 0,745 моль) и параформальдегида (33,6 г, 1,12 моль) в тетрагидрофуране (200 мл), добавляют триэтиламин (104 мл, 0,745 моль) при комнатной температуре и перемешивают в течение 30 мин. К реакционной смеси добавляют раствор индан-4-ола (50 г,0,373) в тетрагидрофуране (100 мл) при комнатной температуре и нагревают до 70-75 С в течение 6 ч. К реакционной смеси добавляют 2 N соляную кислоту (600 мл) и экстрагируют с помощью этилацетата(2500 мл). Слой этилацетата промывают водой (300 мл), высушивают над сульфатом натрия и после этого отгоняют под вакуумом для получения вязкого масла (52,0 г), которое при хранении становится твердым. Выход: 86,0%. 1H-NMR (400 МГц, DMSO-d6):10.76 (1 Н, s), 10.04 (1 Н, s), 7.55 (1 Н, d), 6.95 (1 Н, d), 2.91 (2 Н, t),2.83 (2 Н, t), 2.02-2.09 (2 Н, m). Этап II. Получение 5-метилиндан-4-ола. К раствору 4-гидроксииндан-5-карбальдегида (5 г) в метаноле (80 мл) добавляют 10 вес.% палладированного угля (500 мг). Гидрогенизацию проводят в течение 8 ч при температуре 55-60 С в паровом стерилизаторе при 240-250 фунтов/кв.дюйм с использованием газообразного водорода. Реакционную смесь фильтруют с помощью фильтра Hyflow и отгоняют под вакуумом для получения 4,0 г указанного соединения в виде твердого вещества. Выход: 88.0%. Этап III. Получение 7-гидрокси-6-метилиндан-4-карбальдегида. Получают, следуя процедуре, описанной для этапа V способа 1 для получения промежуточного соединения 1. Этап IV. Получение 7-метокси-6-метилиндан-4-карбальдегида. Получают, следуя процедуре, описанной для этапа V способа 1 для получения промежуточного соединения 1. 2. Получение 7-метокси-6-(4-метилбензил)иридан-4-карбальдегида. Этап I. Получение 4-метоксииндан-5-карбальдегида. К размешанной суспензии 4-гидроксииндан-5-карбальдегида (52,0 г, 0,320 моль) и углекислого калия (57,2 г, 0,414 моль) в диметилформамиде (200 мл) добавляют раствор йодистого метила (22 мл,0,351 моль) в 60 мл диметилформамида при температуре 0-5 С. Реакционную смесь перемешивают при температуре 25-28 С в течение 4 ч и затем выливают в воду (200 мл), после чего экстрагируют с помощью этилацетата (2500 мл). Органический слой высушивают над сульфатом натрия, отгоняют под вакуумом для получения сырого продукта, который очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном (3:97) в качестве подвижной фазы. Собранные частицы отгоняют под вакуумом для получения 30 г желаемого продукта в виде вязкого масла.(2 Н, t), 2.03-2.10 (2 Н, m). Этап II. Получение 4-метокси-5-(4-метилбензил)индана. К перемешанной суспензии магния (1,36 г, 0,056 моль) в 60 мл диэтилового эфира добавляют 4 бромтолуола (8,7 мл, 0,071 моль) в 20 мл диэтилового эфира при температуре 30-40 С в атмосфере с высоким содержанием азота. Далее перемешивают при температуре 30-40 С в течение 45 мин. Раствор 4 метоксииндан-5-карбальдегида (5,0 г, 0,0284 моль) в 20 мл диэтилового эфира добавляют к реакционной смеси при комнатной температуре. По истечении часа перемешивания при комнатной температуре добавляют разбавленную соляную кислоту и экстрагируют с помощью этилацетата (2100 мл). Органический слой высушивают над сульфатом натрия, отгоняют под вакуумом для получения 8,0 г спиртасырца, который берут в сочетании с триэтилсиланом (40,0 мл, 0,250 моль) и добавляют трифторуксусную кислоту (80 мл) при 0-5 С. После перемешивания при температуре 70 С в течение 5 ч реакционную смесь выливают в насыщенный раствор двууглекислого натрия и экстрагируют с помощью этилацетата(2100 мл). Слой этилацетата высушивают над сульфатом натрия и отгоняют для получения сырой массы, которую очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном(3:97) в качестве подвижной фазы. Частицы отгоняют для получения 5,6 г чистого продукта в виде вязкого масла. Выход: 78,2%. 1H-NMR (400 МГц, DMSO-d6):7.05-7.07 (4 Н, s), 6.90 (1 Н, d), 6.87 (1 Н, d), 3.82 (2 Н, s), 3.62 (3 Н, s),2.88 (2 Н, t), 2.79 (2 Н, t), 2.23 (3 Н, s), 1.95-2.01 (2 Н, m). Этап III. Получение 7-метокси-6-(4-метилбензил)индан-4-карбальдегида. Получают, следуя процедуре, описанной для этапа V способа 1 для получения промежуточного соединения 1. Выход: 21%. 1(2 Н, t), 2.97 (2 Н, t), 2.24 (3 Н, s), 2.02-2.09 (2 Н, m). Масса: 281 (М 1). 3. Получение 7-метокси-3,6-диметилиндан-4-карбальдегида. Этап I. Синтез 4-метокси-5-метилиндан-1-она. К суспензии 4-гидрокси-5-метилиндан-1-она (50,0 г, 0,308 моль) и углекислого калия (127,0 г, 0,928 моль) в диметилформамиде (250 мл) добавляют диметилсульфат (90 мл, 0,928 моль) при температуре 0 С. Реакционную смесь нагревают до температуры 60-65 С и перемешивают в течение 16 ч. Реакционную смесь выливают в воду (1 л) и экстрагируют с помощью этилацетата (3250 мл). Органический слой высушивают над сульфатом натрия и отгоняют под вакуумом для получения 10,0 г сырого продукта, который очищают путем колоночной хроматографии с использованием гексана в качестве подвижной фазы. Собранные частицы отгоняют под вакуумом для получения 45,0 г желаемого продукта в виде вязкого масла. Выход: 82,5%. 1H-NMR (400 МГц, DMSO-d6):7.30 (1 Н, d), 7.27 (1 Н, d), 3.84 (3 Н, s), 3.12 (2 Н, t), 2.60-2.63 (2 Н, m),2.31 (3 Н, s). Этап II. Синтез 4-метокси-1,5-диметилиндана. К суспензии магния (2,72 г, 0,113 моль) в диэтиловом эфире (40 мл) медленно добавляют раствор йодистого метила (13,7 мл, 0,219 моль) в диэтиловом эфире (10 мл) при температуре 30-35 С в атмосфере с высоким содержанием азота. Реакционную смесь перемешивают в течение 1 ч при комнатной температуре и затем добавляют раствор 4-метокси-5-метилиндан-1-она (10,0 г, 0,0568 моль) в диэтиловом эфире (30 мл) при температуре 0 С. Реакционную смесь перемешивают в течение 1 ч при комнатной температуре и затем добавляют разбавленную соляную кислоту (50 мл). Смесь экстрагируют с помощью этилацетата (350 мл). Органический слой высушивают над сульфатом натрия, отгоняют под вакуумом для получения 10,0 г спирта-сырца. Полученный спирт берется в сочетании с триэтилсиланом (41,3 мл,0,258 моль), добавляют трифторуксусную кислоту (100 мл) при температуре 0 С. Реакционную смесь перемешивают при температуре 65-70 С в течение 4 ч и выливают в насыщенный раствор двууглекислого натрия. Смесь экстрагируют с помощью этилацетата (2100 мл), высушивают над сульфатом натрия,отгоняют под вакуумом для получения сырой массы, которую очищают путем колоночной хроматографии с использованием гексана в качестве подвижной фазы. Собранные частицы отгоняют под вакуумом для получения 5,0 г желаемого продукта в виде вязкого масла. Выход: 50%. 1(1H, m), 2.73-2.81 (1H, m), 2.21-2.28 (1H, m), 2.15 (3H, s), 1.46-1.55 (1H, m), 1.20 (3H, d). Этап III. Синтез 7-метокси-3,6-диметилиндан-4-карбальдегида. Получают, следуя процедуре, описанной для этапа V способа 1 для получения промежуточного со 1(65 мл) и гидробромистой кислоте (1 мл) добавляют раствор брома (1,47 мл, 0,0284 моль) в 5 мл уксусной кислоты при температуре 10-20 С. Реакционную смесь перемешивают при температуре 20-25 С в течение 1 ч. Затем смесь выливают в насыщенный раствор двууглекислого натрия и экстрагируют с помощью диэтилового эфира (3100 мл). Органический слой высушивают над сульфатом натрия, отгоняют под вакуумом для получения сырого продукта, который очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном (5:95) в качестве подвижной фазы. Собранные частицы отгоняют для получения 3,2 г желаемого продукта в виде вязкого масла. Выход: 44,2%. 1(3 Н, s), 3.31-3.36 (1H, объединенный с пиком воды в DMSO-d6), 2.33 (3 Н, s). Этап II. Синтез 4-метокси-5-метил-2-(4-нитрофенокси)индан-1-она. К перемешанному раствору 2-бром-4-метокси-5-метилиндан-1-она (2,0 г, 0,0078 моль) в диметилформамиде (15 мл) добавляют натриевую соль 4-нитрофенола (1,27 г, 0,0078 моль) при температуре 1015 С. По истечении 2 ч реакционную смесь перемешивают при температуре 25-28 С и выливают в воду(50 мл). Отделенное твердое вещество фильтруют, промывают в гексане и высушивают под вакуумом для получения 1,8 г желаемого продукта в виде твердого вещества. Выход: 73,4%. 1(9,0 мл, 0,0564 моль). Трифторуксусную кислоту (18 мл) добавляют при температуре 20-25 С. Реакционную смесь нагревают до температуры 60-65 С в течение 3 ч, затем выливают в насыщенный раствор двууглекислого натрия. Смесь экстрагируют с помощью этилацетата (2100 мл), высушивают над сульфатом натрия, отгоняют под вакуумом для получения сырого продукта, который очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном (2:98) в качестве подвижной фазы. Собранные частицы отгоняются под вакуумом для получения 1,2 г желаемого продукта в виде твердого вещества. Выход: 69,7%. 1H-NMR (400 МГц, DMSO-d6):8.22 (2 Н, d), 7.18 (2 Н, d), 7.02 (1 Н, d), 6.91 (1 Н, d), 5.40-5.43 (1 Н,m), 3.71 (3 Н, s), 3.38-3.51 (2 Н, m), 2.99-3.10 (2 Н, m), 2.18 (3 Н, s). Этап IV. Синтез 7-метокси-6-метил-2-(4-нитрофенокси)индан-4-карбальдегида. Получают, следуя процедуре, описанной для этапа V способа 1 для получения промежуточного соединения 1. Выход: 93,1%. 1H-NMR (400 МГц, DMSO-d6):9.95 (1H, s), 8.19 (2H, d), 7.61 (1H, s), 7.19 (2H, d), 5.47-5.50 (1H, m),3.88 (3H, s), 3.55-3.70 (2H, m), 3.42-3.46 (1H, m), 3.17-3.21 (1H, m), 2.25 (3H, s). Масса: 328 (M1) 5. Получение 7-метокси-2,2,6-триметилиндан-4-карбальдегида. Этап I. Получение 4-метокси-2, 2,5-триметилиндан-1-она. К суспензии 60% гидрида натрия (2,72 г, 0,068 моль) в 30 мл тетрагидрофурана добавляют раствор 4-метокси-5-метилиндан-1-она (10,0 г, 0,0568 моль) в тетрагидрофуране (30 мл) при температуре 0-5 С; после этого добавляют йодистый метил (9,09 мл, 0,146 моль) при температуре 0 С. Реакционную смесь перемешивают в течение 2 ч, затем добавляют воду (100 мл) и экстрагируют с помощью этилацетата(2100 мл). Слой этилацетата высушивают над сульфатом натрия и выпаривают для получения сырой массы, которую очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном (3:97) в качестве подвижной фазы. Частицы отгоняют под вакуумом для получения 3,0 г желаемого продукта в виде вязкого масла. Выход: 25,88%. 1(6 Н, s). Этап II. Получение 4-метокси-2,2,5-триметилиндана. Получают, следуя процедуре, описанной для этапа III для получения промежуточного соединения 4.(3 Н, s), 1.10 (6 Н, s). Этап III. Получение 7-метокси-2,2, 6-триметилиндан-4-карбальдегида. Получают, следуя процедуре, описанной для этапа V метода 1 для получения промежуточного соединения 1. Выход: 50,8%. 1(100 мл) добавляют сульфаминовую кислоту (19,0 г, 0,196 моль) при температуре 25-28 С. Раствор хлористокислого натрия (15,28 г, 0,169 моль) в воде (50 мл) добавляют при температуре 5-10 С. Реакционную смесь перемешивают в течение 5 ч при температуре 25-28 С. По окончании реакционную смесь выливают в воду (200 мл) и экстрагируют с помощью дихлорметана (2200 мл). Органический слой высушивают над сульфатом натрия, отгоняют под вакуумом для получения 12,0 г желаемого продукта в виде вязкого масла. Выход: 96,0%. Масса: 191 (М+-1). Этап II. Получение (4-метоксииндан-5-ил)пирролидин-1-ил-метанона. К прозрачному раствору 4-метоксииндан-5-карбоновой кислоты (12,0 г, 0,0625 моль) в тетрагидрофуране (60 мл) добавляют карбонилдиимидазол (13,24 г, 0,0812 моль) при температуре 25-28 С. Реакционную смесь нагревают до температуры 65-70 С и перемешивают в течение 2 ч, затем в реакционную смесь добавляют раствор пирролидина (5,74 мл, 0,0687 моль) в тетрагидрофуране (20 мл) при температуре 10-15 С. Реакционную смесь выливают в воду (200 мл) и экстрагируют с помощью этилацетата(2100 мл). Органический слой высушивают над сульфатом натрия, отгоняют под вакуумом и очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном (20:80) в качестве подвижной фазы. Частицы отгоняют под вакуумом для получения 6,0 г желаемого продукта в виде вязкого масла. Выход: 39,2%. 1H-NMR (400 МГц, DMSO-d6):6.98 (2 Н, s), 3.74 (3 Н, s), 3.44 (2 Н, t), 3.13 (2 Н, t), 2.85-2.94 (4 Н, m),2.01-2.06 (2 Н, m), 1.75-1.88 (4 Н, m). Этап III. Получение 7-метокси-6-(пирролидин-1-карбонил)индан-4-карбальдегида. Получают, следуя процедуре, описанной для этапа V метода 1 для получения промежуточного соединения 1. Выход: 71,7%. 1(4 Н, m), 2.97 (2 Н, t), 2.05-2.13 (2 Н, m), 1.80-1.92 (4 Н, m). Масса: 298 (М 1). 7. Получение 7-метокси-6-(4-метоксифенил)индан-4-карбальдегида. Этап I. Получение 6-бром-7-метоксииндан-4-карбальдегида. К раствору 4-гидроксииндана (10,0 г, 0,0746 моль) и диизопропиламина (1 мл) в дихлорметане (100 мл) медленно добавляют N-бромсукцинимид (13,28 г, 0,0746 моль) при температуре 5-15 С. Реакционную смесь перемешивают в течение 20 ч. Дихлорметан отгоняют, остаток разделяют на воду (100 мл) и диэтиловый эфир (200 мл). Диэтиловый эфир отгоняют под вакуумом для получения сырого продукта(14,4 г). Твердое вещество растворяют в трифторуксусной кислоте (100 мл) и добавляют гексаметилендиамин (8,4 г, 0,06 моль) при температуре 25-28 С. Далее реакционную смесь нагревают до температуры 85-90 С в течение 4 ч. Реакционную смесь выливают в насыщенный раствор двууглекислого натрия и экстрагируют с помощью этилацетата (3100 мл). Органический слой высушивают над сульфатом натрия, отгоняют под вакуумом для получения сырой массы, которую очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном (3:97) в качестве подвижной фазы. Собранные частицы отгоняют для получения 7,34 г альдегида. В конце к раствору полученного альдегида (7,34 г,0,0304 моль) в диметилформамиде (30 мл) добавляют карбонат калия (6,3 г, 0,0463 моль) и перемешивают в течение 1 ч. К реакционной смеси добавляют йодистый метил (2,9 мл, 0,0463 моль) при температуре 0-5 С и перемешивают при температуре 20-25 С в течение 4 ч. Затем добавляют воду (100 мл) и экстрагируют с помощью диэтилового эфира (3100 мл). Диэтиловый эфир высушивают над сульфатом натрия и отгоняют для получения сырого продукта,который очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном(2:98). Частицы отгоняют под вакуумом для получения 1,06 г указанного соединения в виде твердого 1(5 мл), добавляют тетракис-(трифенилфосфин)палладий(0) (2 мг) и нагревают до температуры 85-90 С,затем перемешивают в течение 6 ч. Толуол отгоняют и полученный остаток растворяют в диэтиловом эфире (50 мл). Затем смесь промывают водой (20 мл) и эфир отгоняют под вакуумом для получения сырой массы, которую очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном (1:99) в качестве подвижной фазы. Частицы отгоняют для получения 50 мг желаемого продукта в виде твердого вещества. Выход: 22,7%. 1(3H, s), 3.22 (2H, t), 2.99 (2H, t), 2.07-2.15 (2H, m). Масса: 283 (M1). 8. Получение 6-хлор-7-метоксииндан-4-карбальдегида. Этап I. Получение 5-хлориндан-4-ола. К прозрачному раствору индан-4-ола (40,0 г, 0,297 моль) и диизопропиламина (4,29 мл, 0,029 моль) в дихлорметане (140 мл) добавляют раствор сульфурилхлорида (21,76 мл, 0,267 моль) в дихлорметане(20 мл) при температуре 0-5 С. Реакционную смесь перемешивают в течение 15 ч при температуре 2025 С и выливают в воду (200 мл). Далее экстрагируют с помощью этилацетата (2200 мл). Органический слой высушивают над сульфатом натрия, отгоняют под вакуумом для получения сырого твердого вещества, которое очищают путем колоночной хроматографии с использованием смеси этилацетата с гексаном (2:98) в качестве подвижной фазы. Собранные частицы отгоняют для получения 5,7 г желаемого продукта в виде твердого вещества. Выход: 11,4%. 1(2 Н, m). Этап II. Получение 6-хлор-7-гидроксииндан-4-карбальдегида. Получают, следуя процедуре, описанной для этапа V способа 1 для получения промежуточного соединения 1. Выход: 81,2%. 1H-NMR (400 МГц, DMSO-d6):9.85 (1 Н, s), 7.67 (1 Н, s), 3.14 (2 Н, t), 2.81 (2H, t), 1.99-2.04 (2H, m). Этап III. Получение 6-хлор-7-метоксииндан-4-карбальдегида. Получают, следуя процедуре, описанной для этапа VI метода 1 для получения промежуточного соединения 1. Выход: 55,7%. 1H-NMR (400 МГц, DMSO-d6):10.04 (1H, s), 7.84 (1H, s), 3.98 (3H, s), 3.24 (2H, t), 3.08 (2H, t), 2.112.19 (2H, m). Масса: 211 (M1). 9. Получение 7-метокси-6-метилиндан-4-ола. К перемешанному раствору 7-метокси-6-метилиндан-4-карбальдегида (1,0 г, 0,0060 моль) в метаноле (20 мл) добавляют серную кислоту (0,6 мл) при комнатной температуре. К реакционной смеси добавляют 30% перекись водорода (1,6 мл) и перемешивают в течение 1 ч при температуре 0 С. Метанол отгоняют под вакуумом и остаток растворяют в этилацетате (50 мл), далее слой этилацетата промывают водой и выпаривают для получения сырого продукта, а затем при растирании в порошок с гексаном получают 600 мг указанного соединения в виде твердого вещества. Выход: 56%. 1(3 Н, s), 1.95-1.98 (2 Н, m). Масса: 177(М+-1) Следующие соединения были получены с помощью процедуры, указанной в схеме реакции, изображенной выше.
МПК / Метки
МПК: C07D 403/06, C07D 231/14, C07D 409/04, A61P 3/04, A61K 31/4155
Метки: веществ, соединения, заболеваний, лечения, обмена, связанных, тиреоидные, нарушением, новые
Код ссылки
<a href="https://eas.patents.su/30-19084-novye-tireoidnye-soedineniya-dlya-lecheniya-zabolevanijj-svyazannyh-s-narusheniem-obmena-veshhestv.html" rel="bookmark" title="База патентов Евразийского Союза">Новые тиреоидные соединения для лечения заболеваний, связанных с нарушением обмена веществ</a>
Предыдущий патент: Чистящий блок для туалета
Следующий патент: 1′,3-двузамещенные 4-(арил-х-фенил)-1н-пиридин-2-оны
Случайный патент: Полиацетальный нанокомпозит