Модуляторы γ-секретазы
Формула / Реферат
1. Соединение общей формулы I
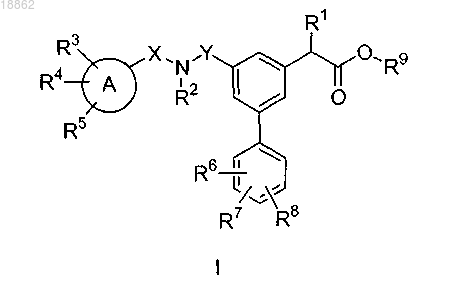
где А выбран из группы, включающей фенил, гетероцикл, который представляет собой радикал с насыщенным или частично ненасыщенным моноциклическим кольцом, выбранный из 2H-пирролила, 2-пирролинила, 3-пирролинила, пирролидинила, 1,3-диоксоланила, 2-имидазолинила, имидазолидинила, 2-пиразолинила, пиразолидинила, тетразолила, пиперидинила, 1,4-диоксанила, морфолинила, 1,4-дитианила, тиоморфолинила, пиперазинила, азепанила, гексагидро-1,4-диазепинила, пиридил,
X представляет собой СН2, прямую связь или СНС(1-5)алкил, где указанный алкил необязательно замещен одним, двумя или тремя заместителями, независимо выбранными из группы, включающей F, Cl, Br, I или CF3;
Y представляет собой СН2 или прямую связь;
R1 выбран из группы, включающей H, алкил, выбранный из группы СН3, С2Н5, изо-С3Н7, н-С3Н7, изо-С4Н9, н-С4Н9, втор-С4Н9, трет-С4Н9; алкенил, выбранный из группы С2Н3, изо-С3Н5, н-С3Н5, н-С4Н7, изо-С4Н7, втор-С4Н7; где указанные алкильная и алкенильная группы необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из группы, включающей F, Cl, Br, I и CF3;
R2 выбран из группы, включающей H, бензил, С(О)СН2СН(СН3)2, алкил, выбранный из группы СН3, С2Н5, изо-С3Н7, н-С3Н7, изо-С4Н9, н-С4Н9, втор-С4Н9, трет-С4Н9, СН2СН2СН(СН3)2; алкенил, выбранный из группы С2Н3, изо-С3Н5, н-С3Н5, н-С4Н7, изо-С4Н7, втор-С4Н7; где указанные алкильная и алкенильная группы необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из группы, включающей F, Cl, Br, I или CF3; альтернативно, если R2 представляет собой алкил, он может быть объединен с R3, кольцом А, X и азотом, к которому он присоединен, с образованием 9- или 10-членной конденсированной кольцевой системы;
R3 и R6 независимо выбраны из группы, включающей H, F, Cl, CN, CF3, OCF3 и C1-C4-алкил;
R4, R5, R7 и R8 независимо выбраны из группы, включающей CF3, H, F, Cl, ОСН3, С(1-4)алкил и CN;
R9 выбран из группы, включающей H, алкил, выбранный из группы СН3, С2Н5, изо-С3Н7, н-С3Н7, изо-С4Н9, н-С4Н9, втор-С4Н9, трет-С4Н9; алкенил, выбранный из группы С2Н3, изо-С3Н5, н-С3Н5, н-С4Н7, изо-С4Н7, втор-С4Н7; где указанные алкильная и алкенильная группы необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из группы, включающей F, Cl, Br, I и CF3;
при условии, что, если X и Y представляют собой прямую связь, А представляет собой фенил, R2 и R9 представляют собой H и R1 представляет собой Н или С1-С4алкил, R3, R4 и R5 не представляют собой H, F, Cl, CN, ОСН3, CF3 или С1-С4-алкил,
а также его сольваты, гидраты и фармацевтически приемлемые соли.
2. Соединение по п.1, где
R1 выбран из группы, включающей H, алкил, выбранный из группы СН3, С2Н5, изо-С3Н7, н-С3Н7, изо-С4Н9, н-С4Н9, втор-С4Н9, трет-С4Н9; алкенил, выбранный из группы С2Н3, изо-С3Н5, н-С3Н5, н-С4Н7, изо-С4Н7, втор-С4Н7;
R9 выбран из группы, включающей H, алкил, выбранный из группы СН3, С2Н5, изо-С3Н7, н-С3Н7, изо-С4Н9, н-С4Н9, втор-С4Н9 и трет-С4Н9,
а также его сольваты, гидраты и фармацевтически приемлемые соли.
3. Соединение по п.2, где
R2 выбран из группы, включающей H, бензил, С(О)СН2СН(СН3)2, алкил, выбранный из группы СН3, С2Н5, изо-С3Н7, н-С3Н7, изо-С4Н9, н-С4Н9, втор-С4Н9, трет-С4Н9, СН2СН2СН(СН3)2; алкенил, выбранный из группы С2Н3, изо-С3Н5, н-С3Н5, н-С4Н7, изо-С4Н7, втор-С4Н7; альтернативно, если R2 представляет собой алкил, он может быть объединен с R3, кольцом А, X и азотом, к которому он присоединен, с образованием 9- или 10-членной конденсированной кольцевой системы;
а также его сольваты, гидраты и фармацевтически приемлемые соли.
4. Соединение по п.3, где
R3 и R6 независимо выбраны из группы, включающей OCF3, CF3, F, Cl, С(1-4)алкил и CN;
R9 представляет собой H;
а также его сольваты, гидраты и фармацевтически приемлемые соли.
5. Соединение по п.4, где
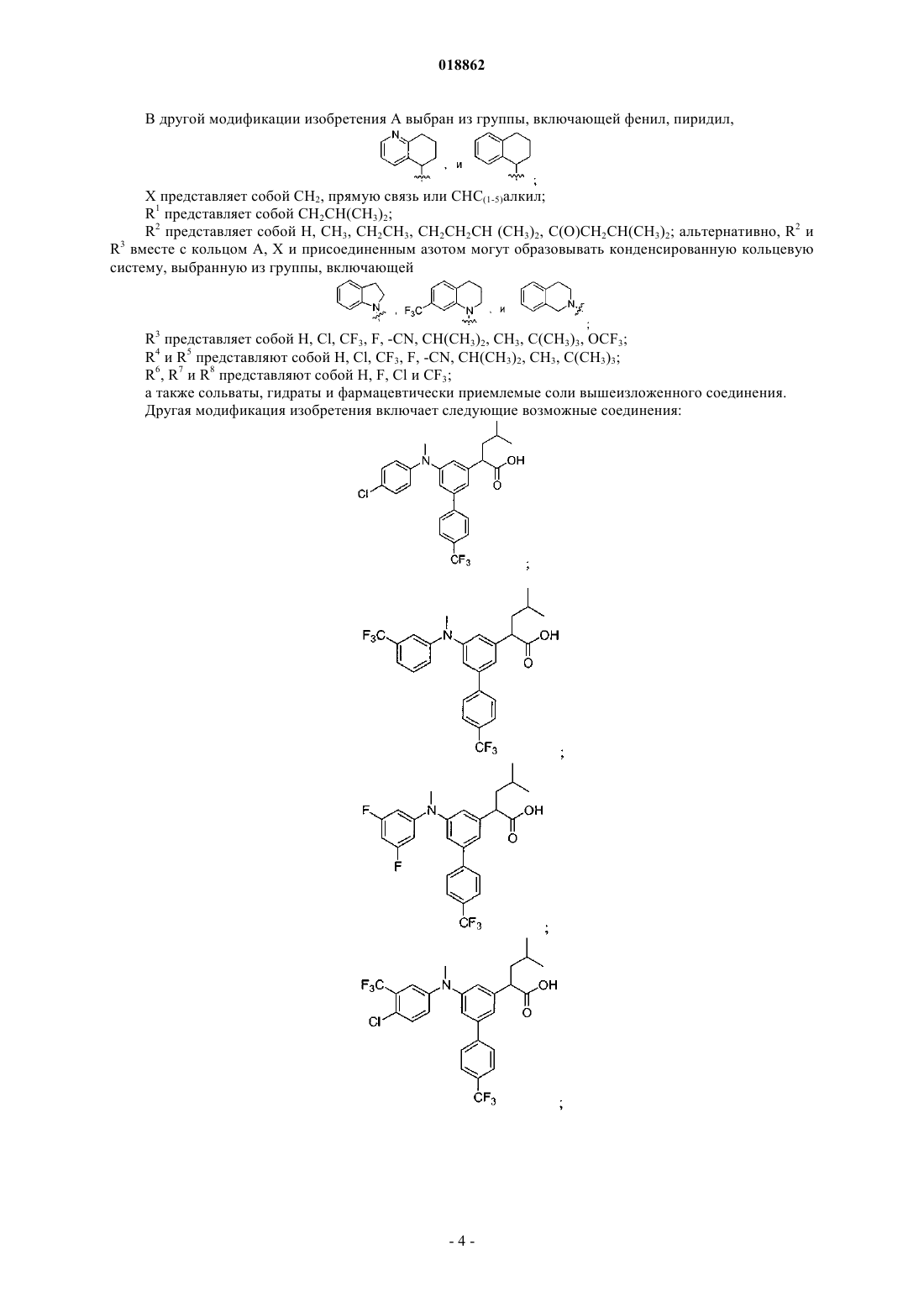
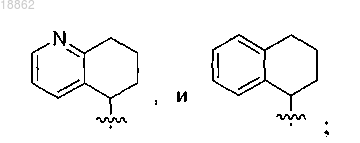
А выбран из группы, включающей фенил, пиридил,
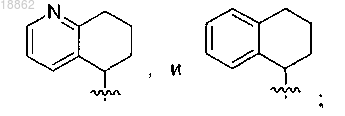
X представляет собой СН2, прямую связь или СНС(1-5)алкил;
R1 представляет собой СН2СН(СН3)2;
R2 представляет собой H, СН3, СН2СН3, СН2СН2СН(СН3)2, С(О)СН2СН(СН3)2; альтернативно, R2 и R3 вместе с кольцом А, X и присоединенным азотом могут образовывать конденсированную кольцевую систему, выбранную из группы, включающей

R3 представляет собой H, Cl, CF3, F, -CN, CH(CH3)2, CH3, C(CH3)3, OCF3;
R4 и R5 представляют собой H, Cl, CF3, F, -CN, CH(CH3)2, СН3, C(CH3)3;
R6, R7 и R8 представляют собой H, F, Cl и CF3;
а также его сольваты, гидраты и фармацевтически приемлемые соли.
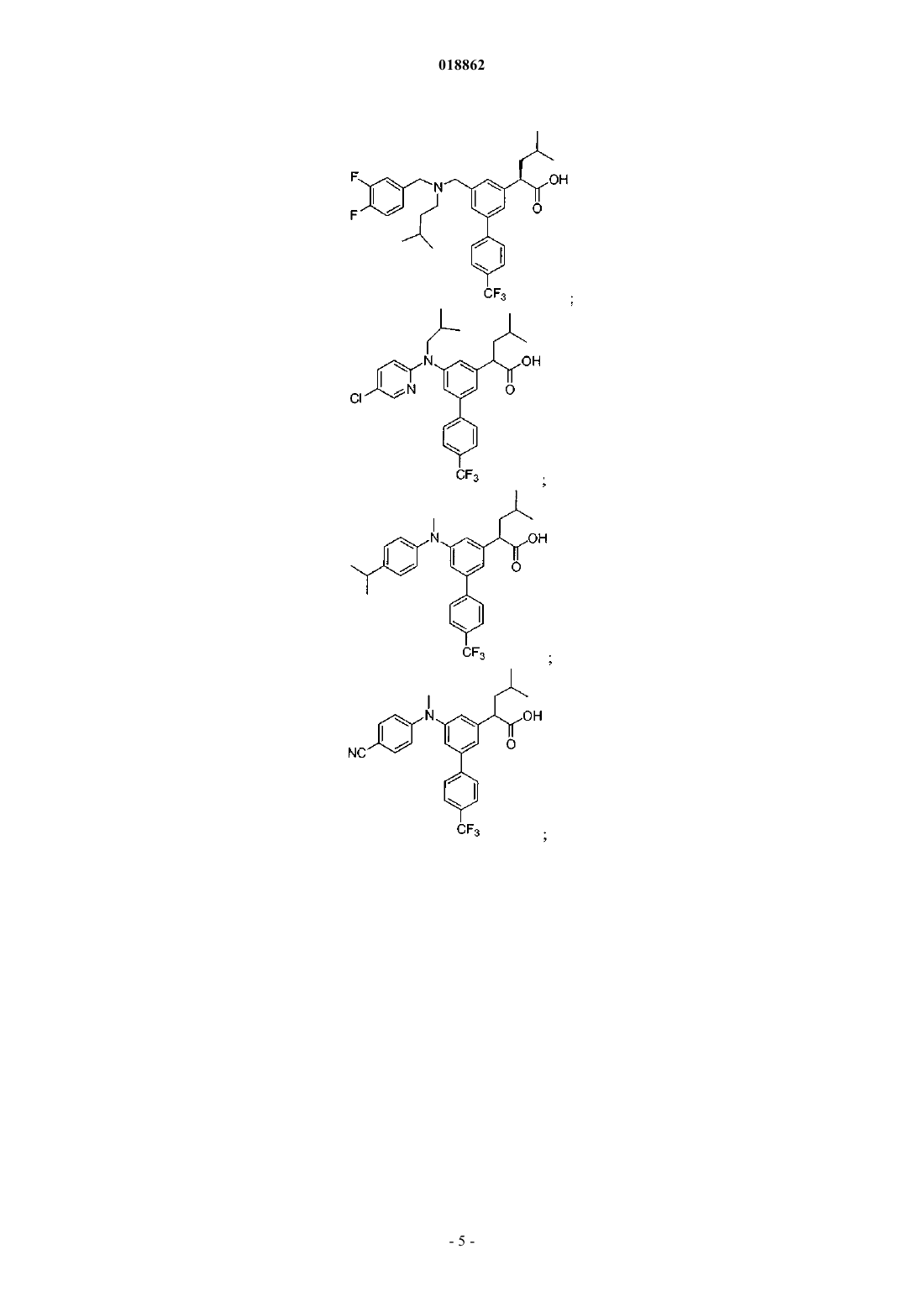
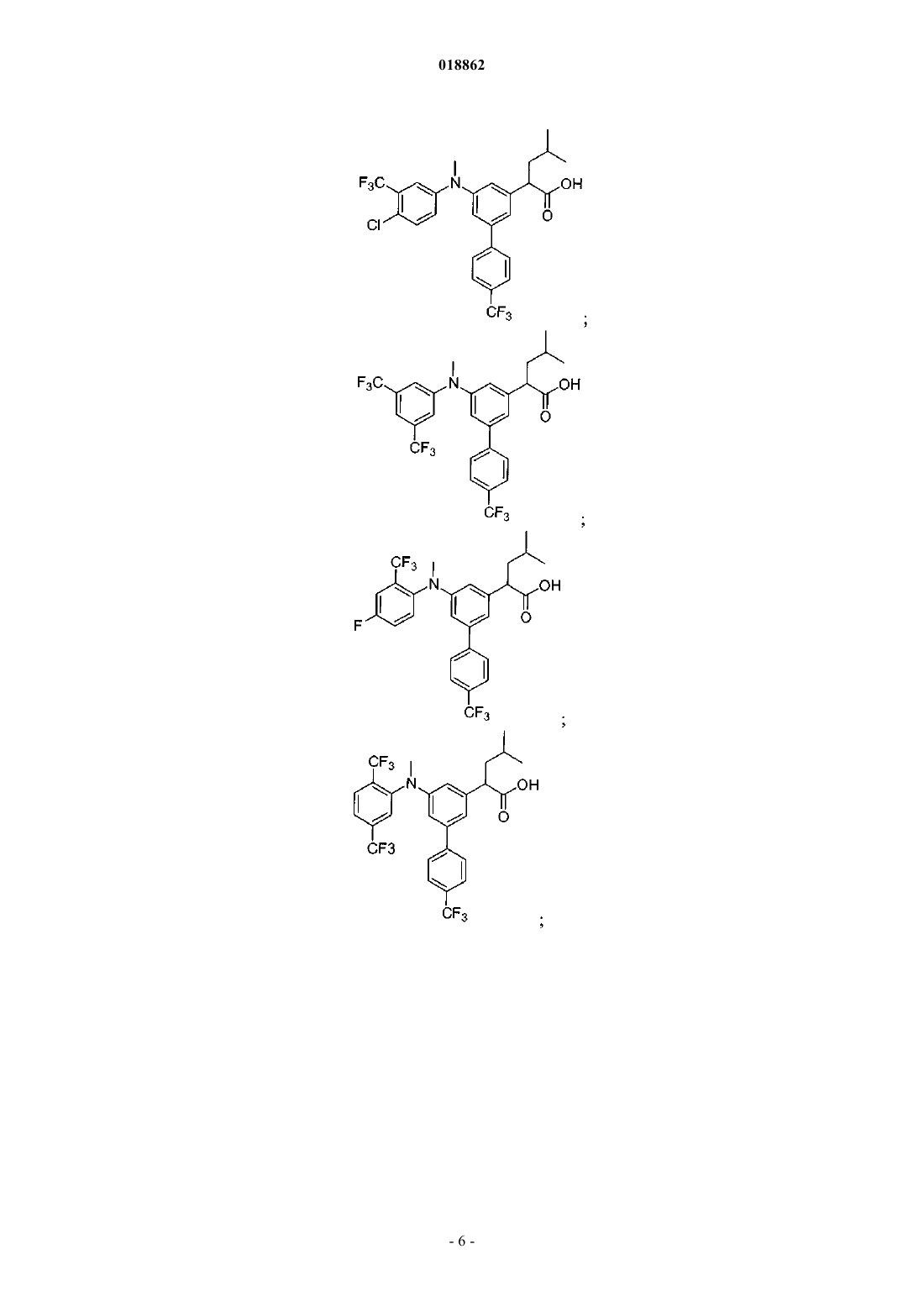
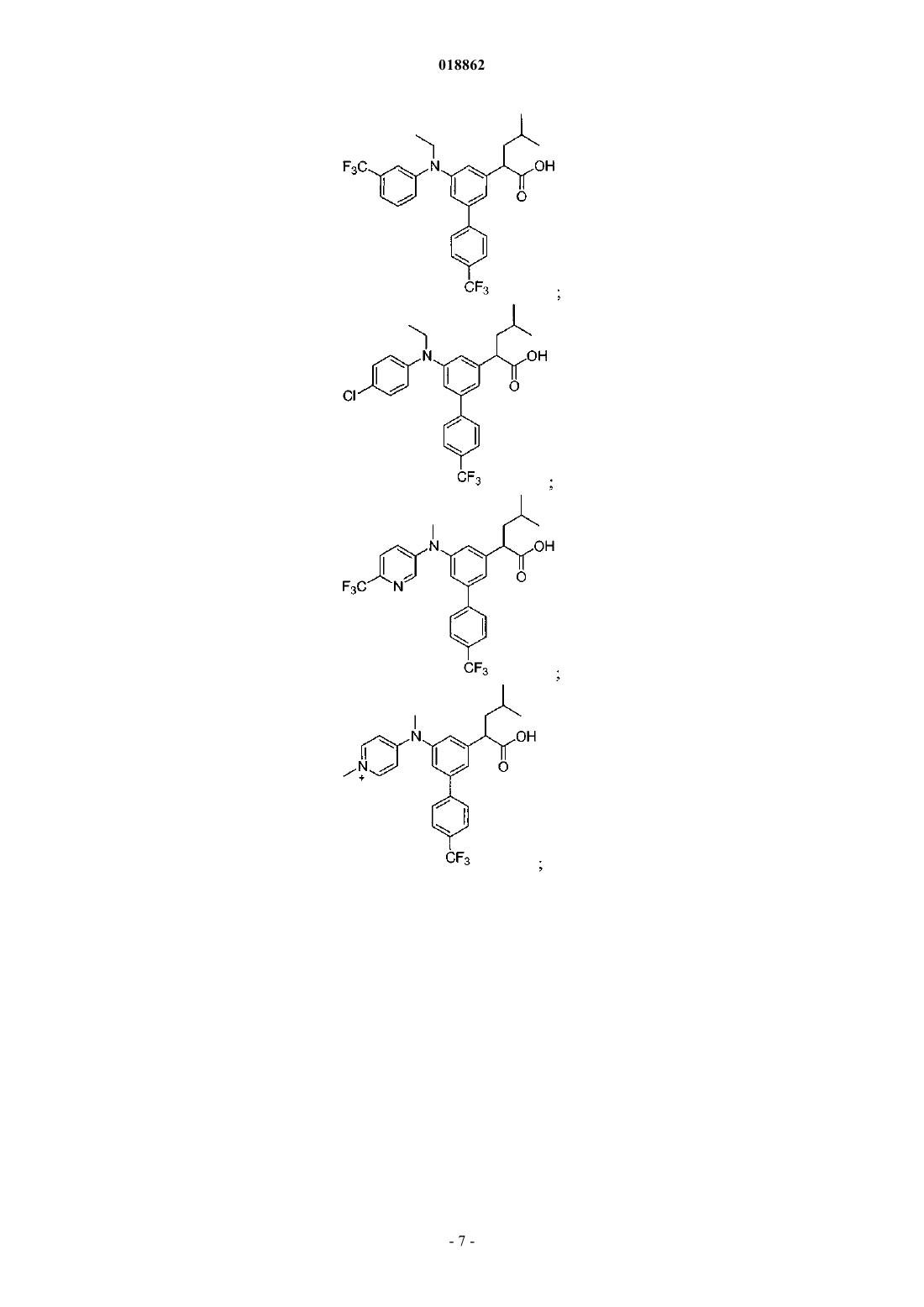
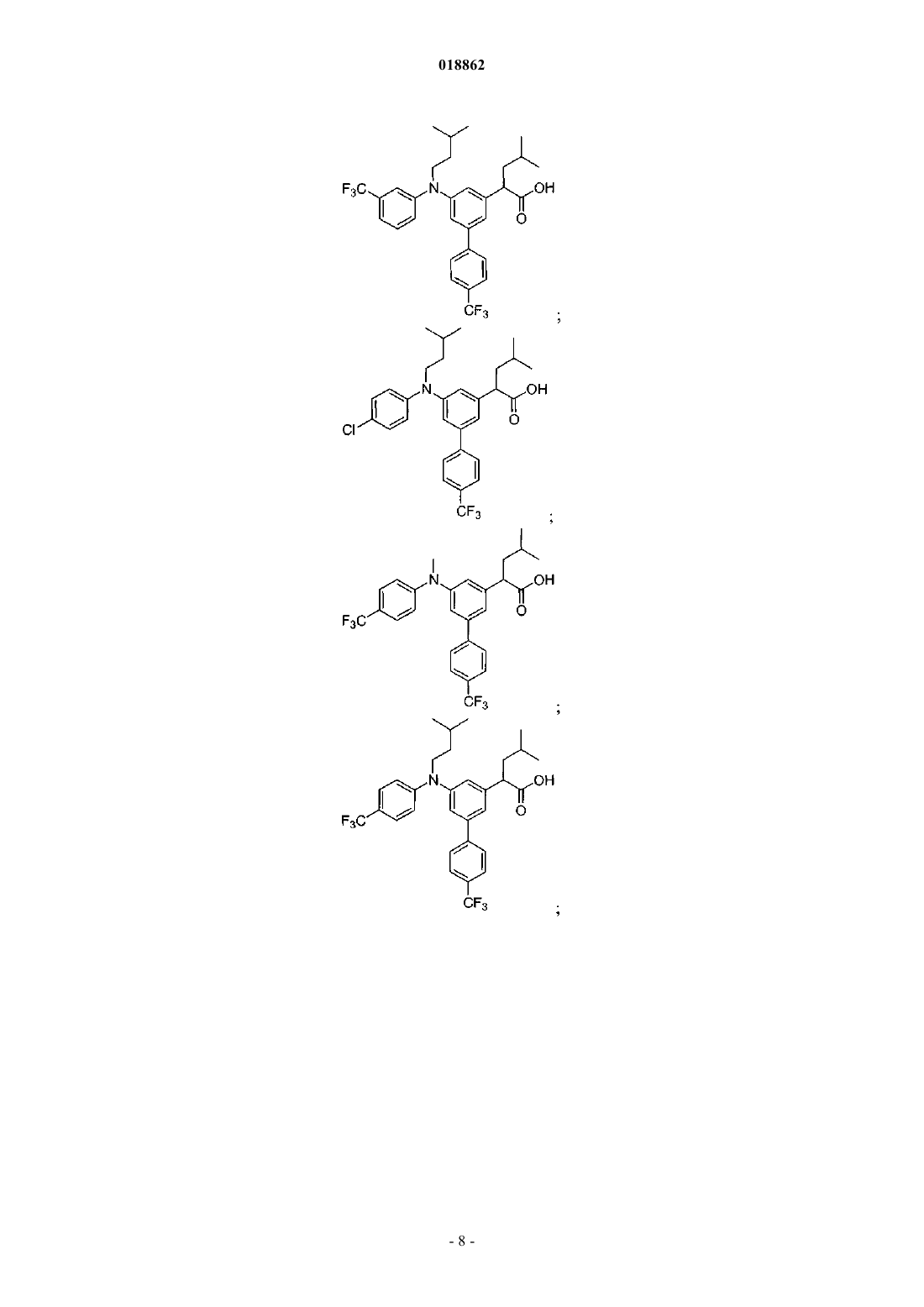
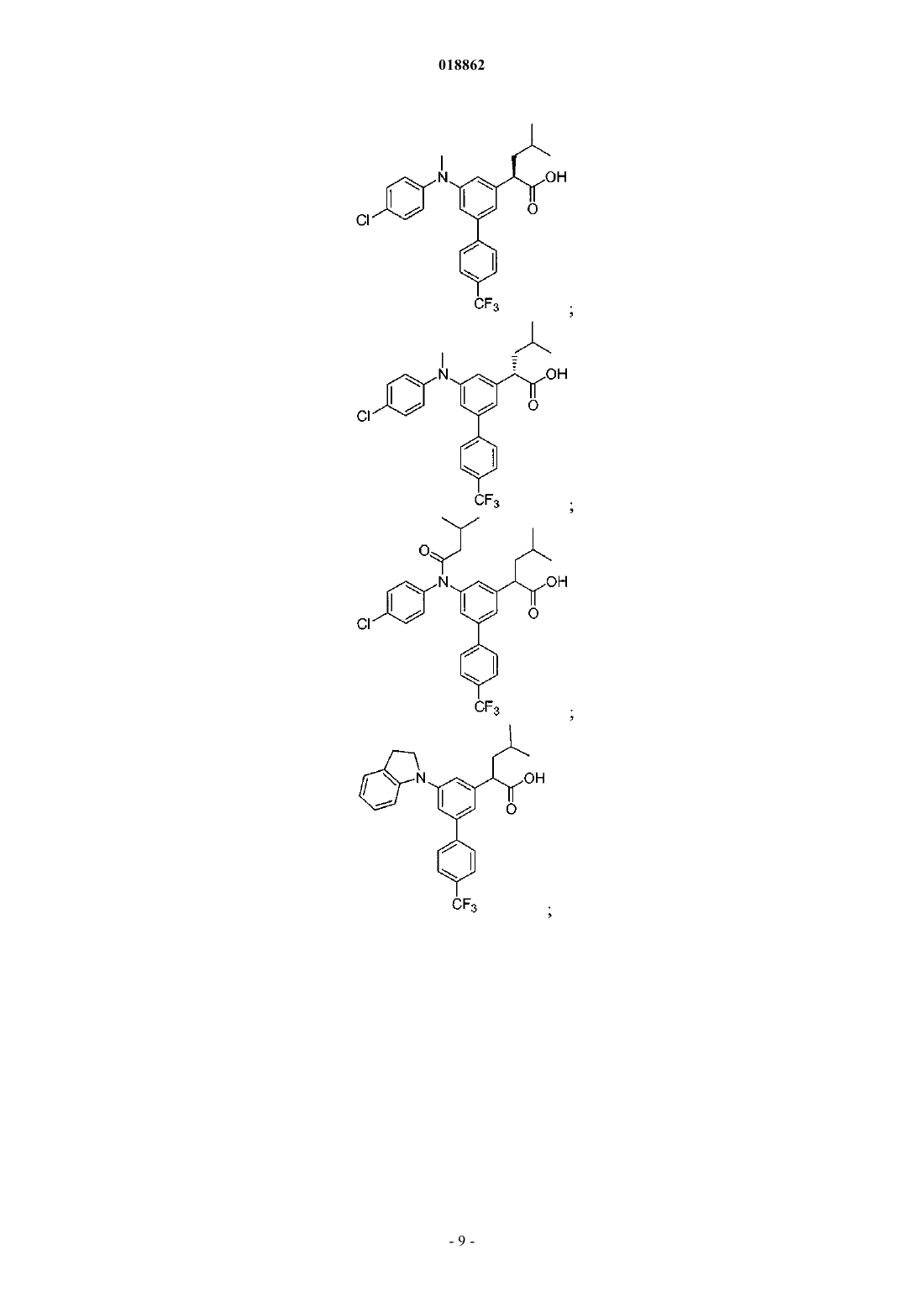
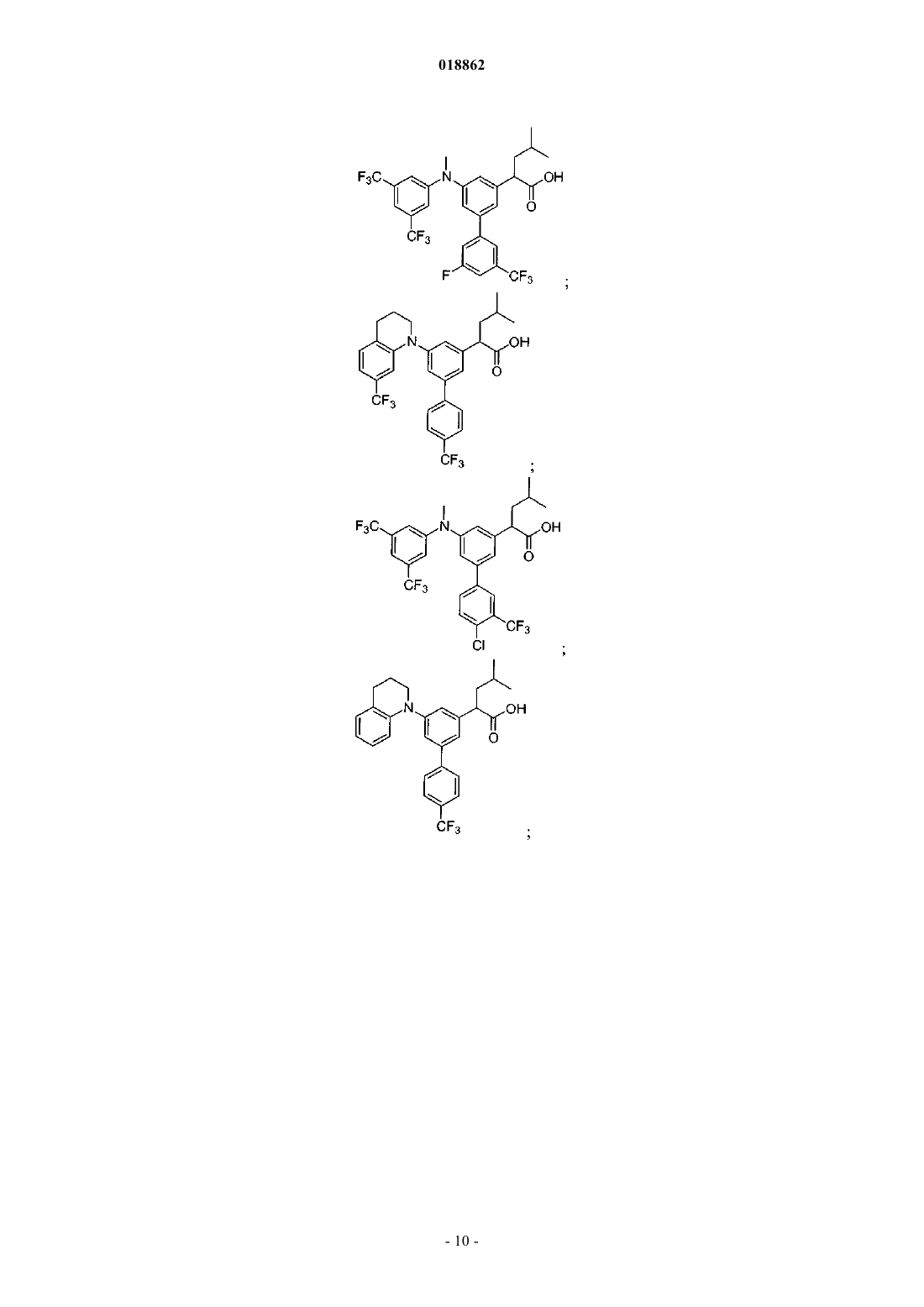
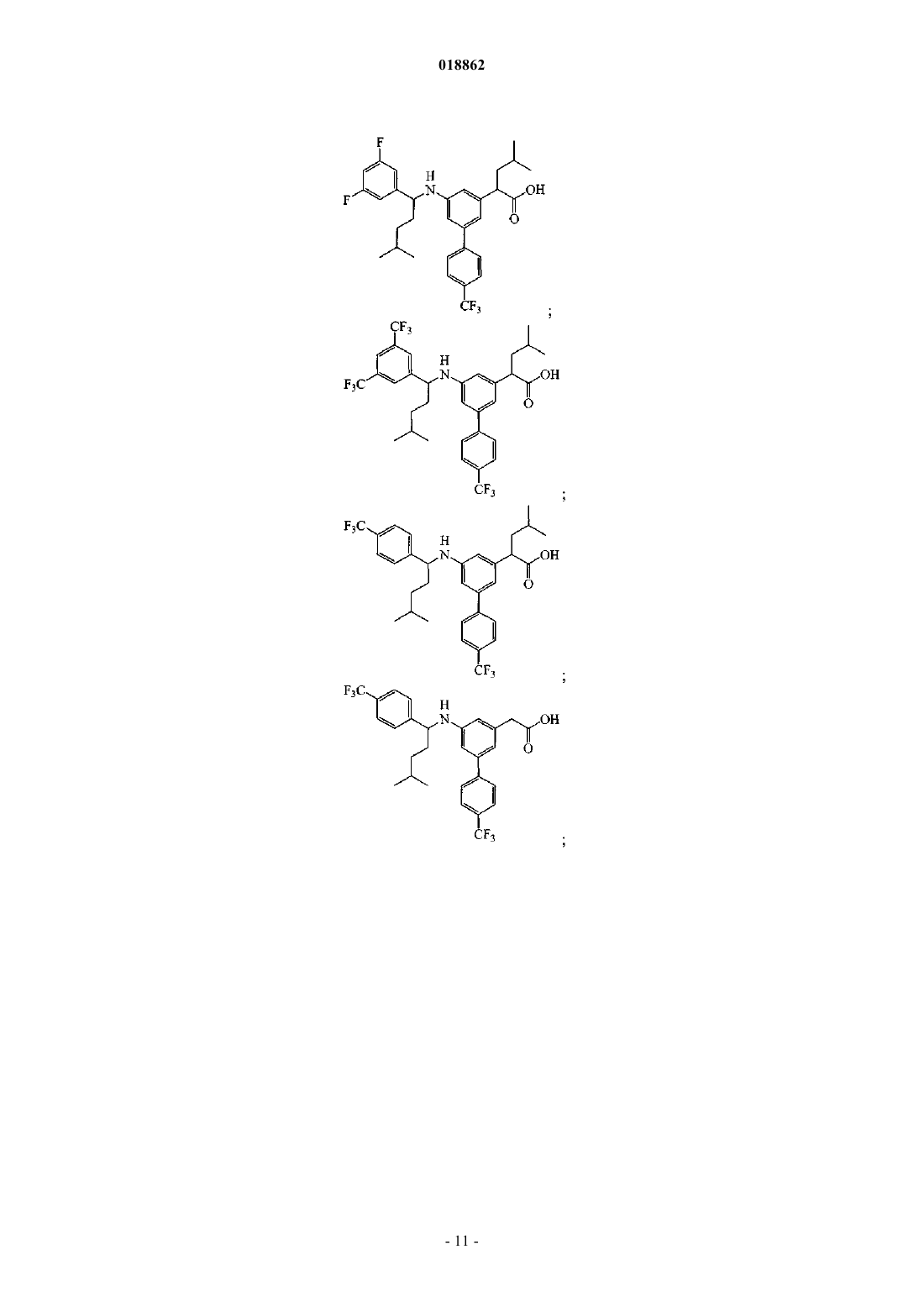
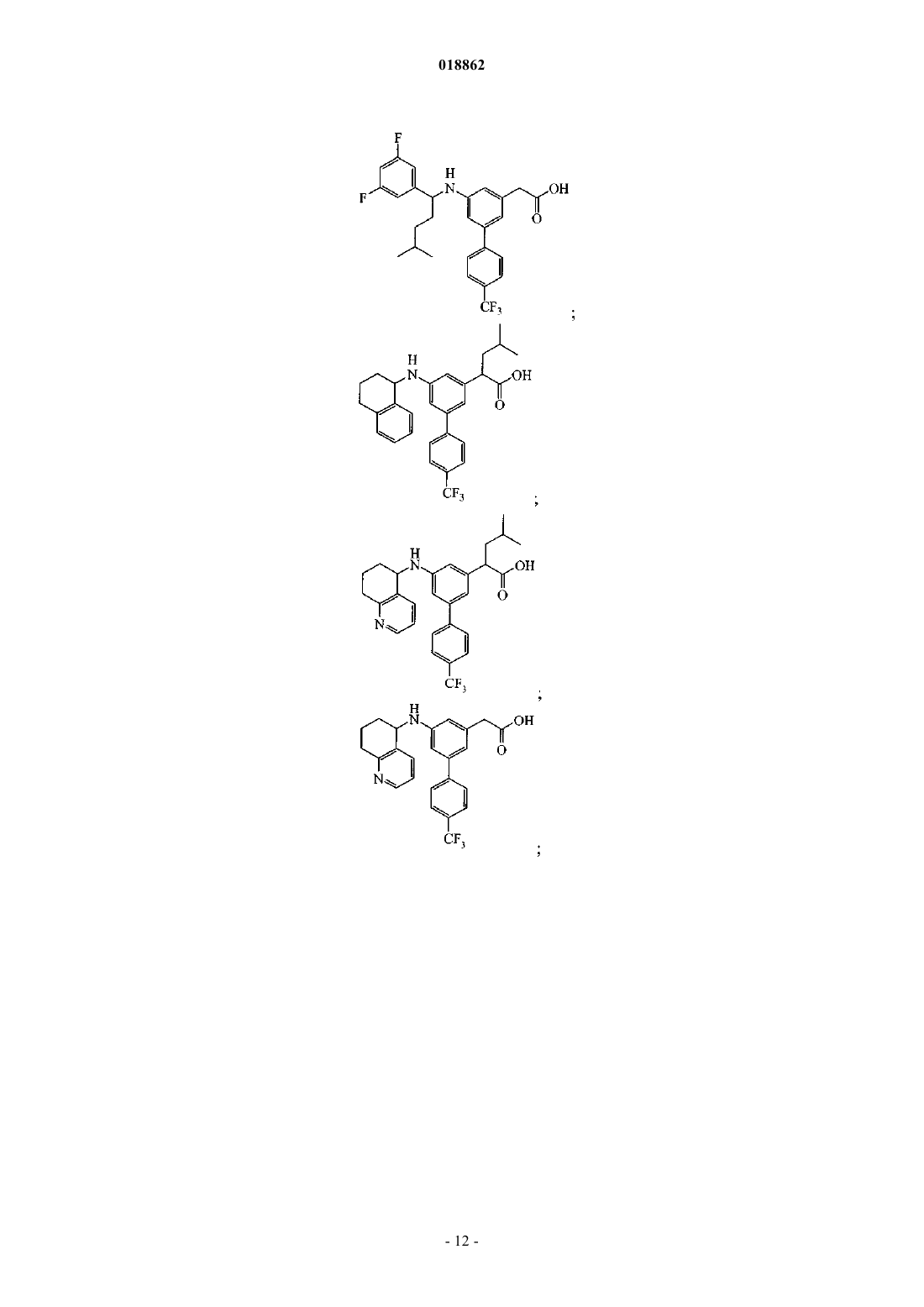
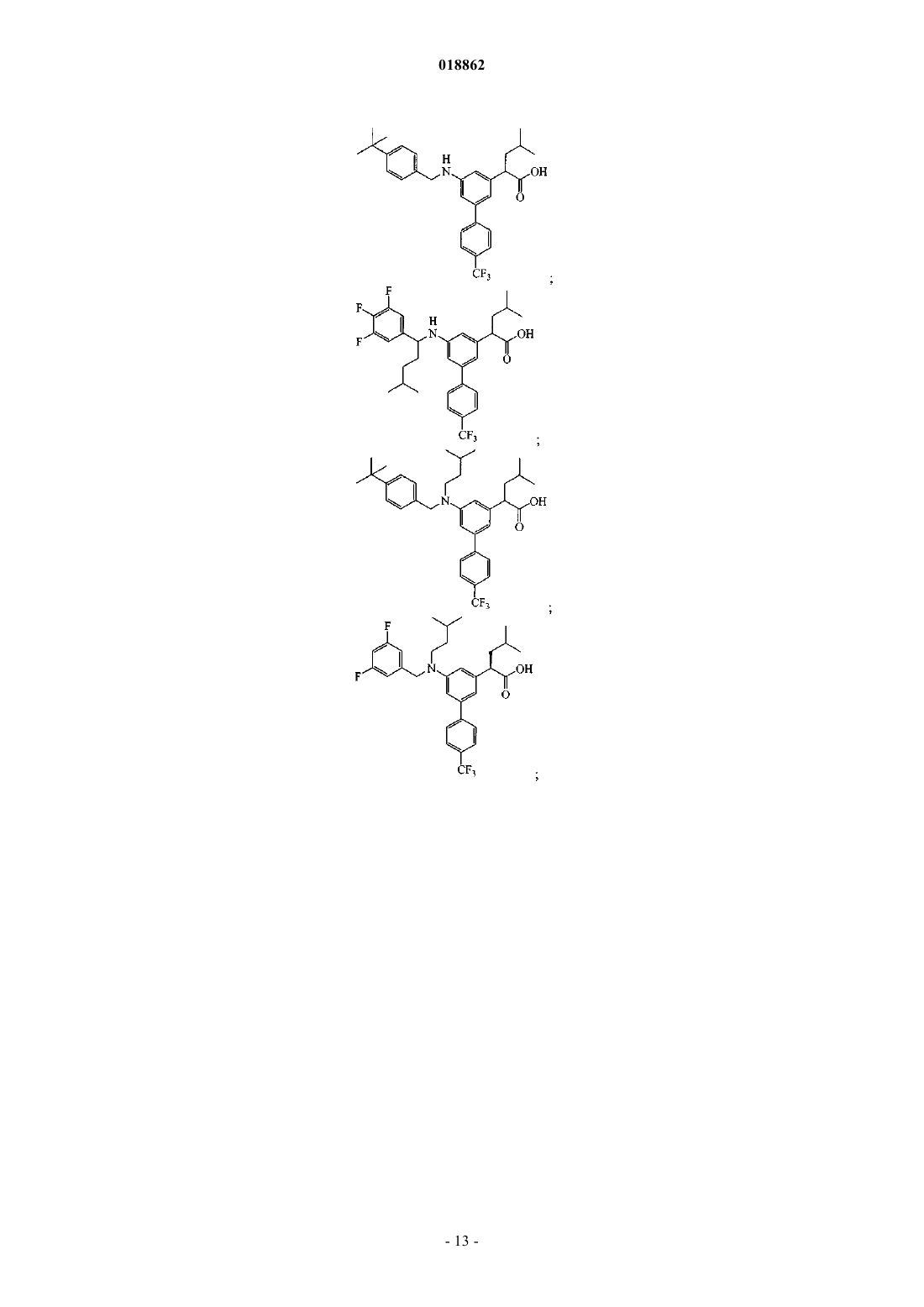
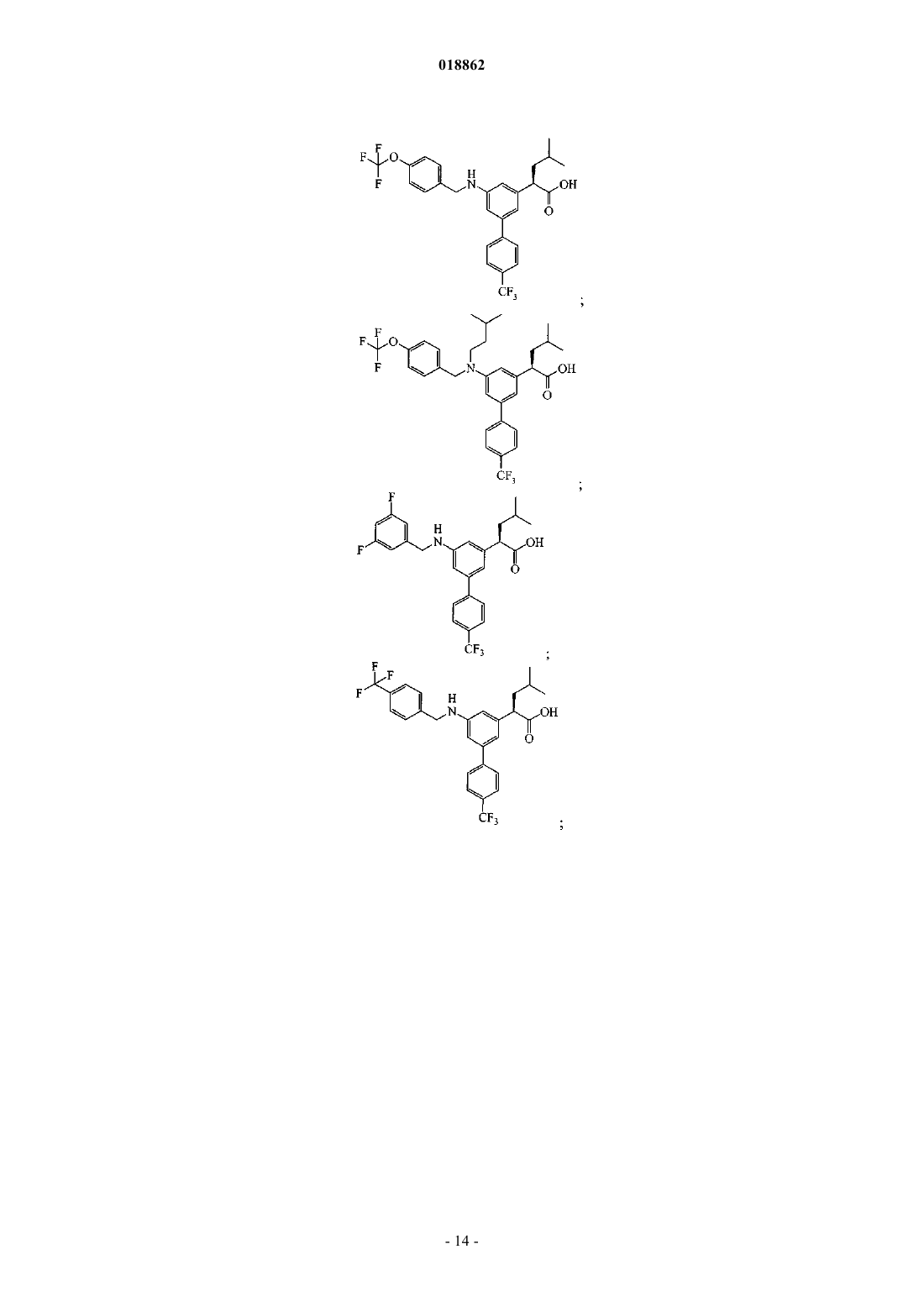
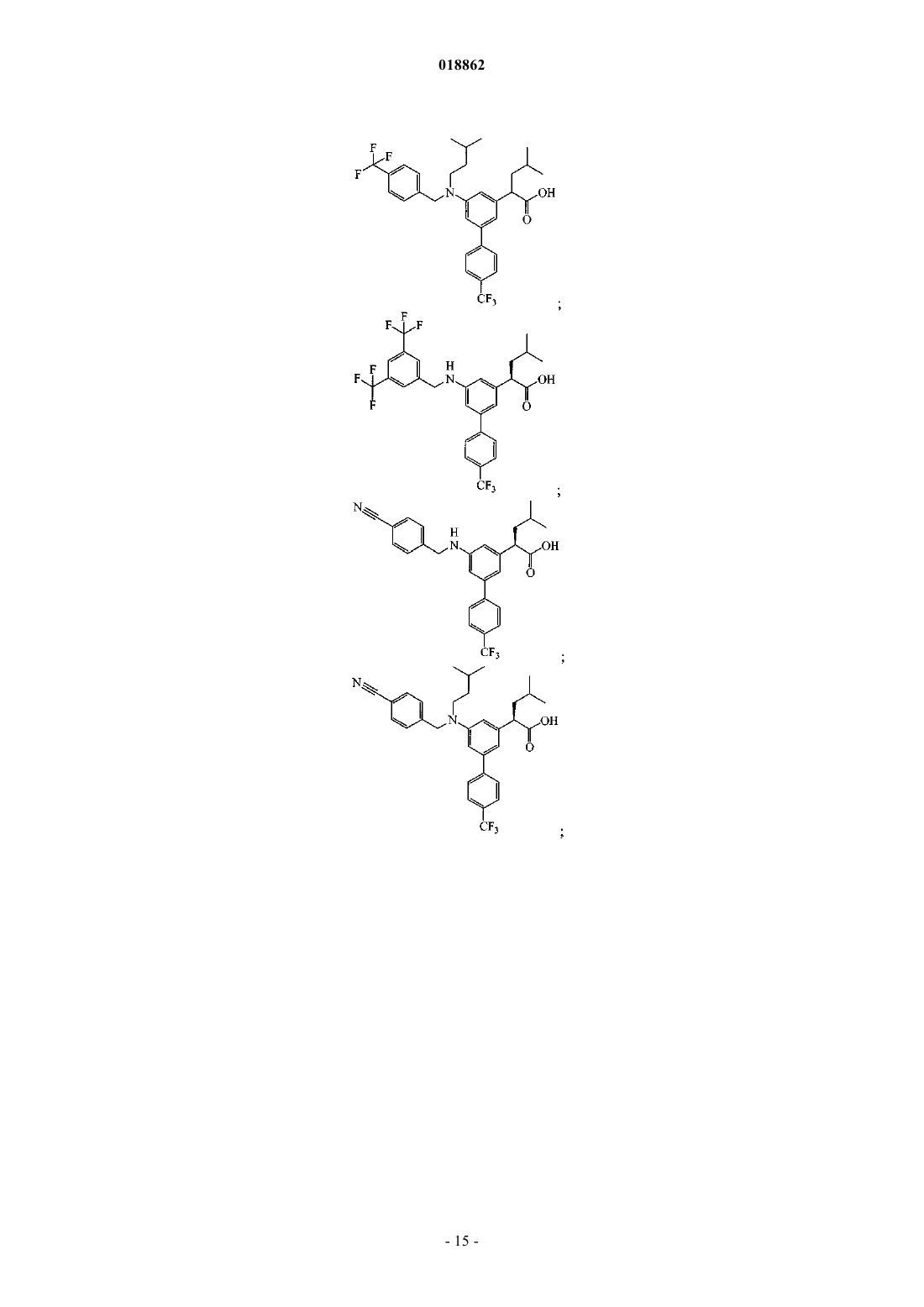
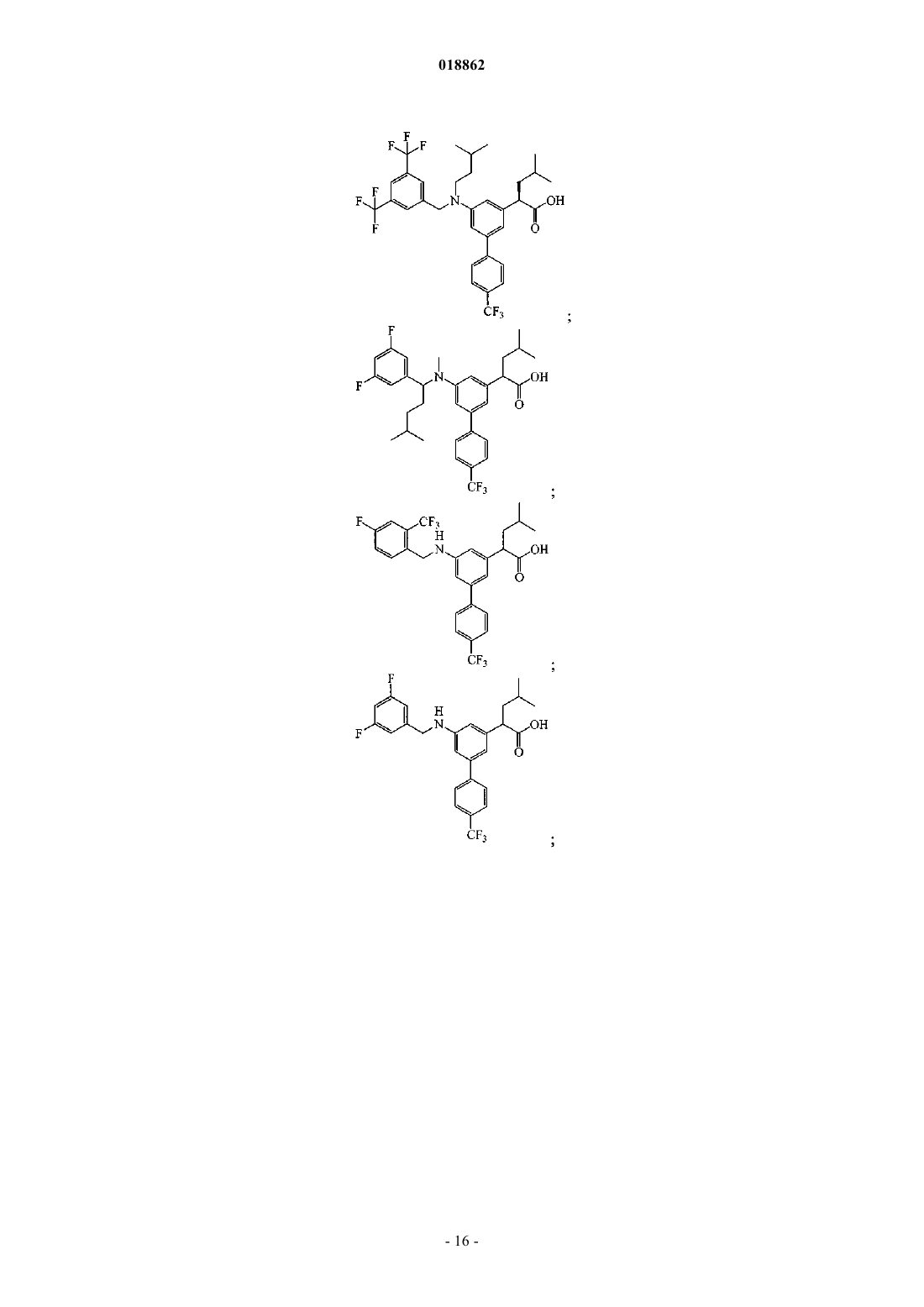
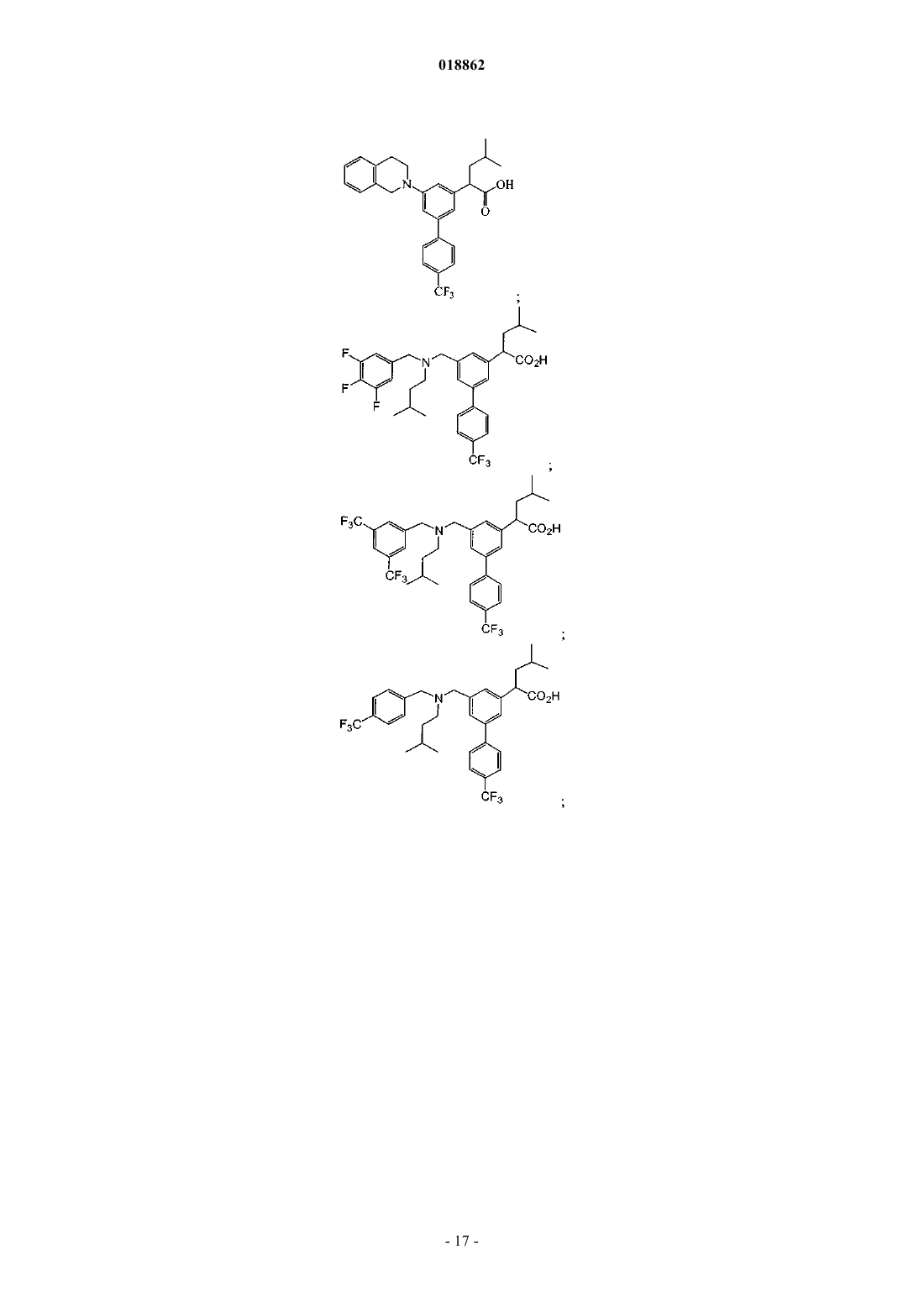
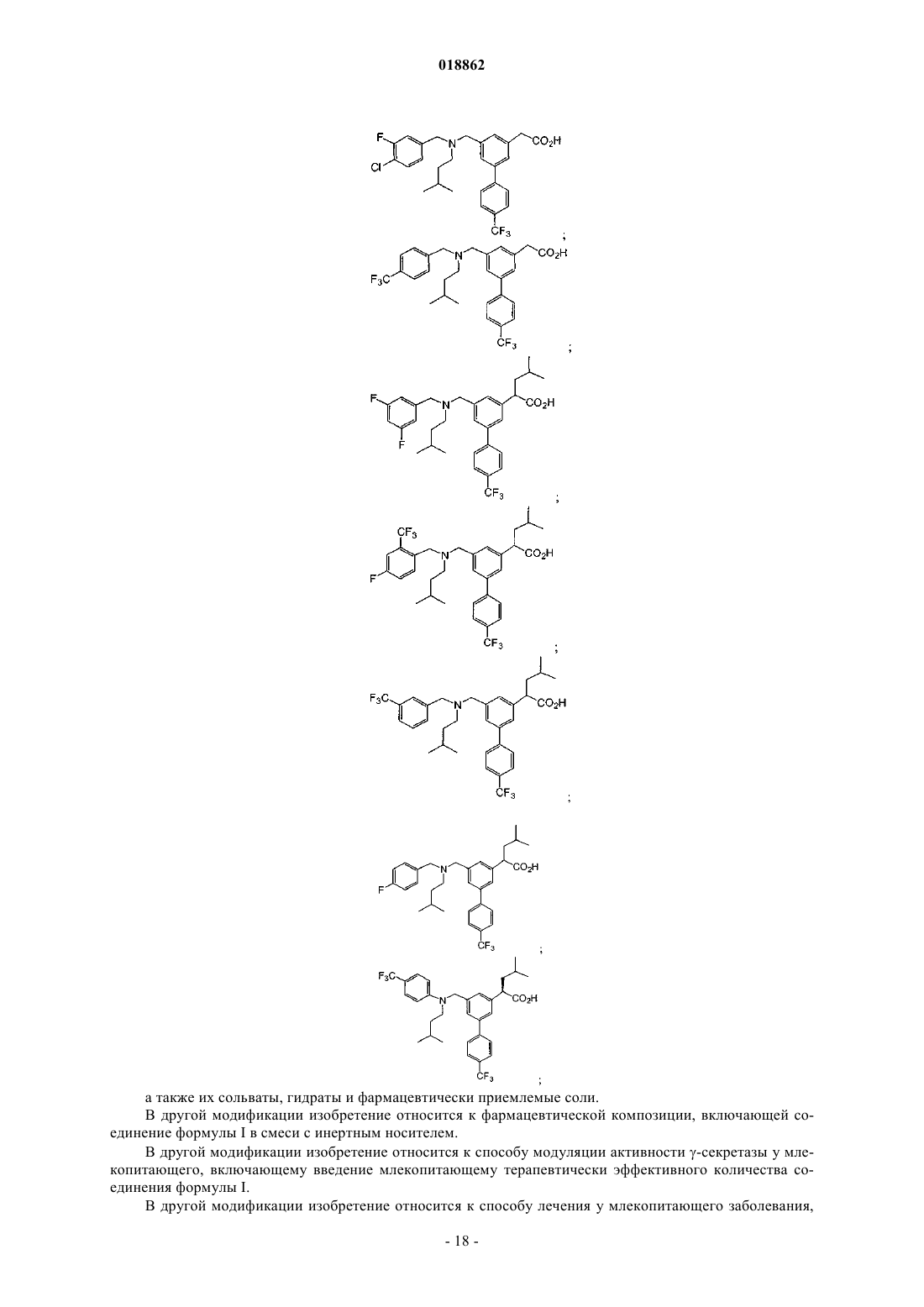
6. Соединение, выбранное из группы, включающей
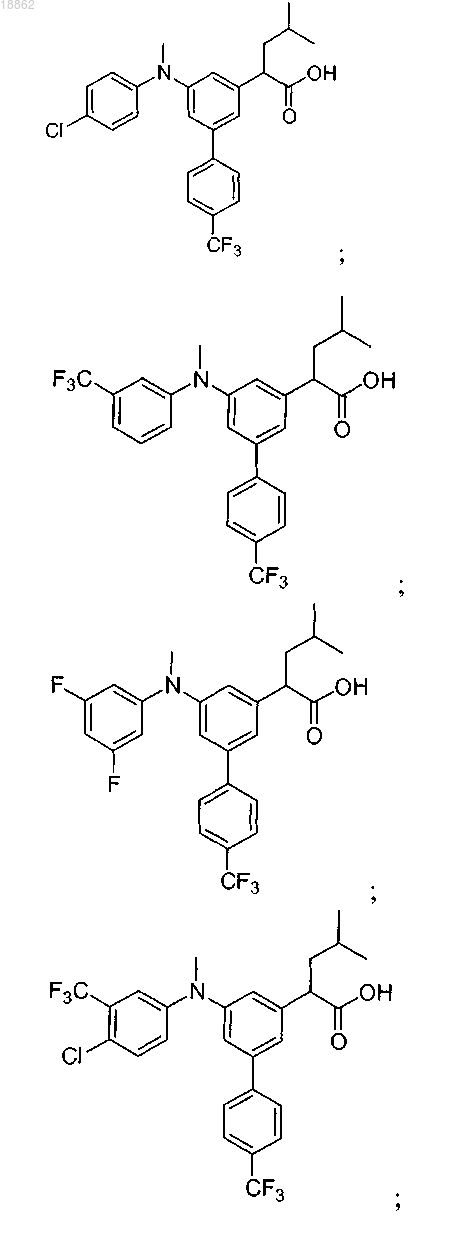
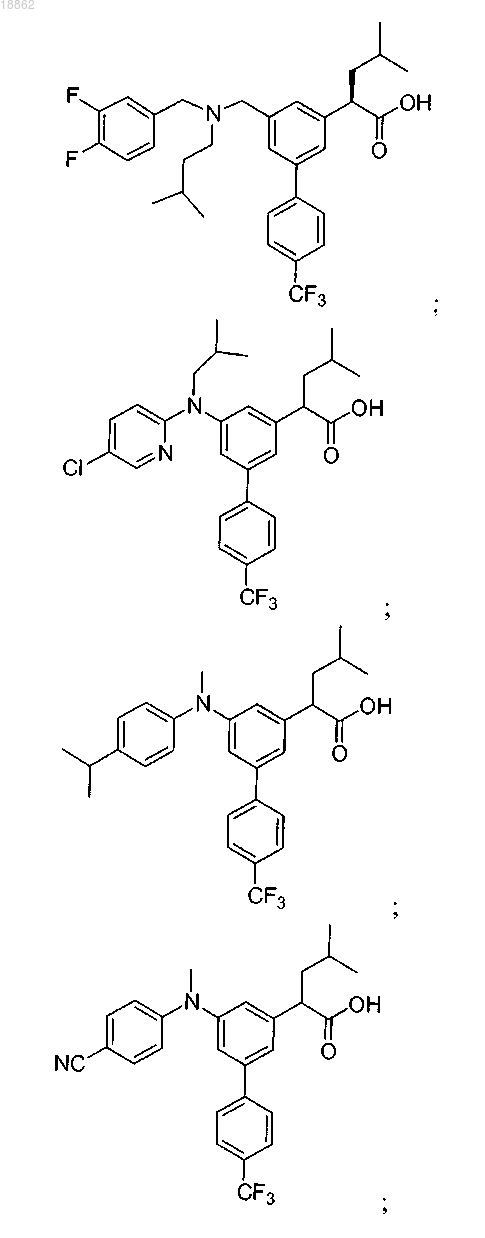
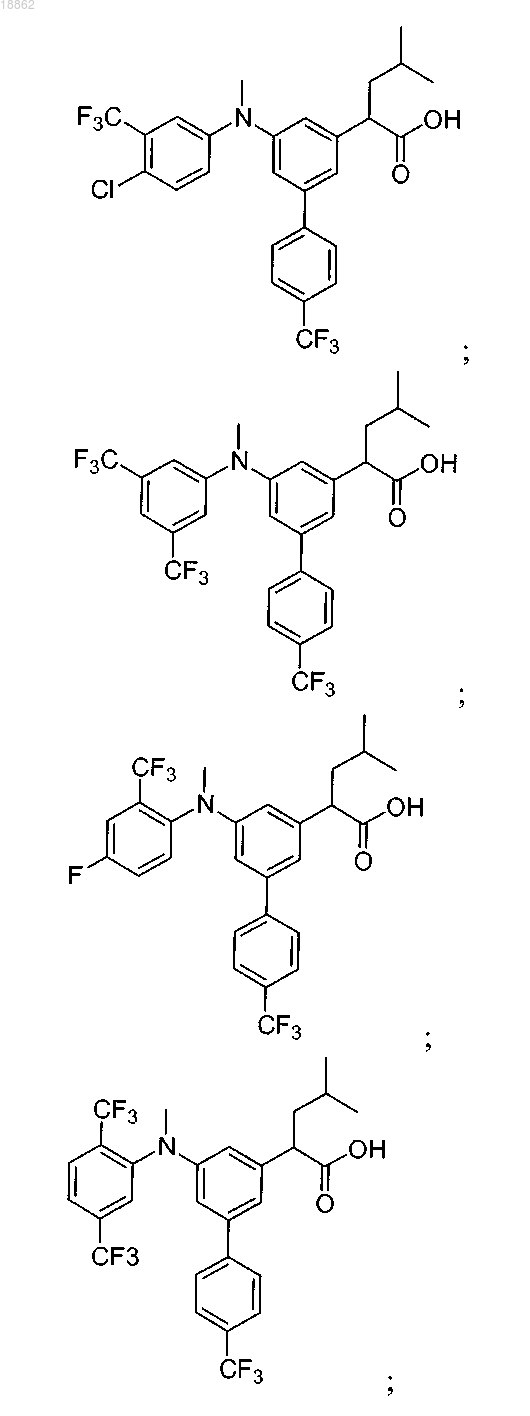


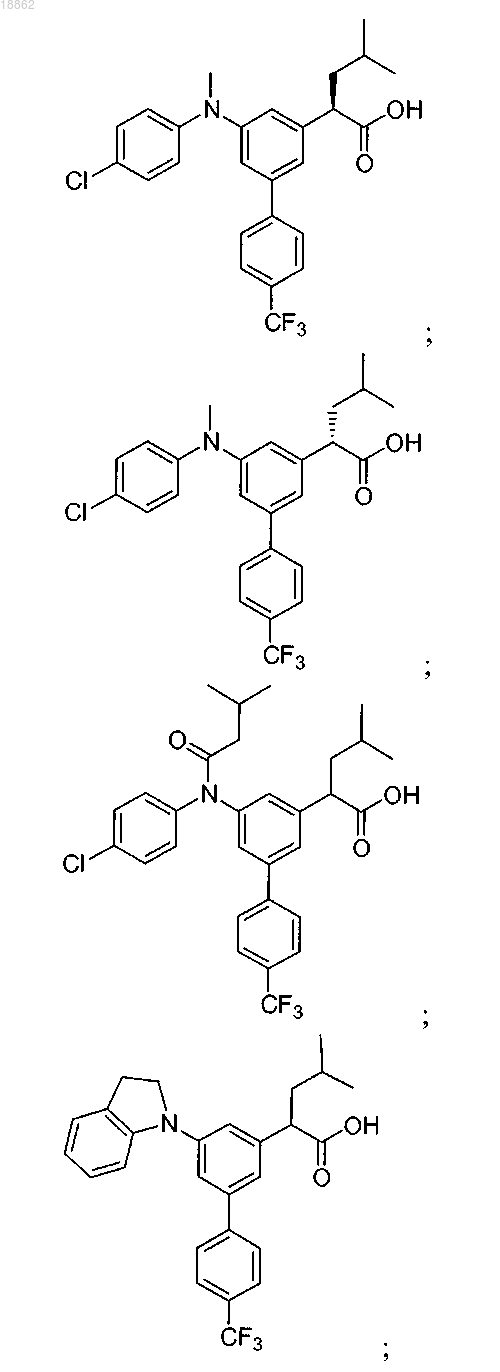
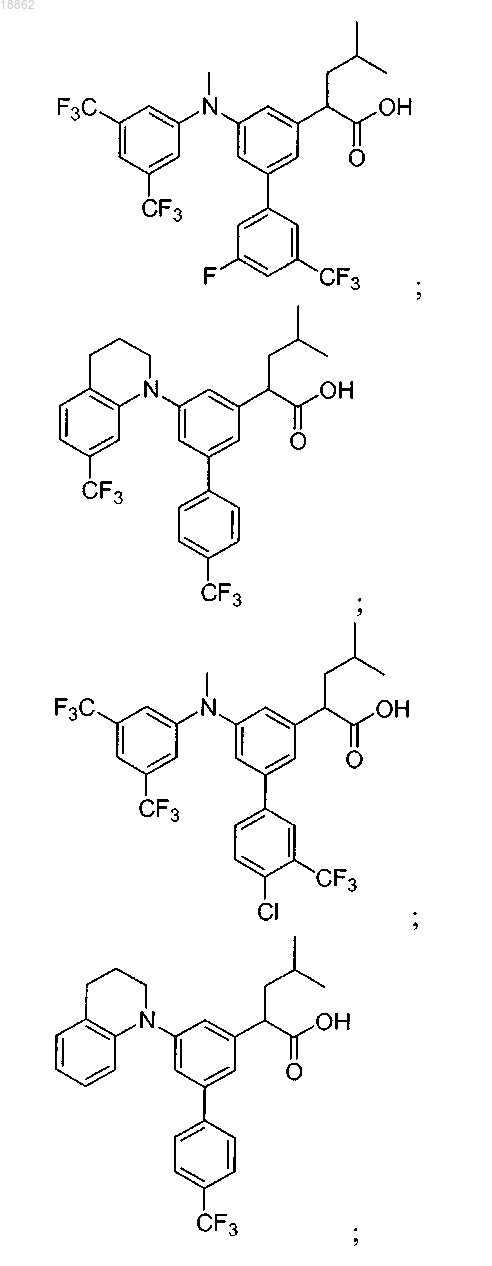
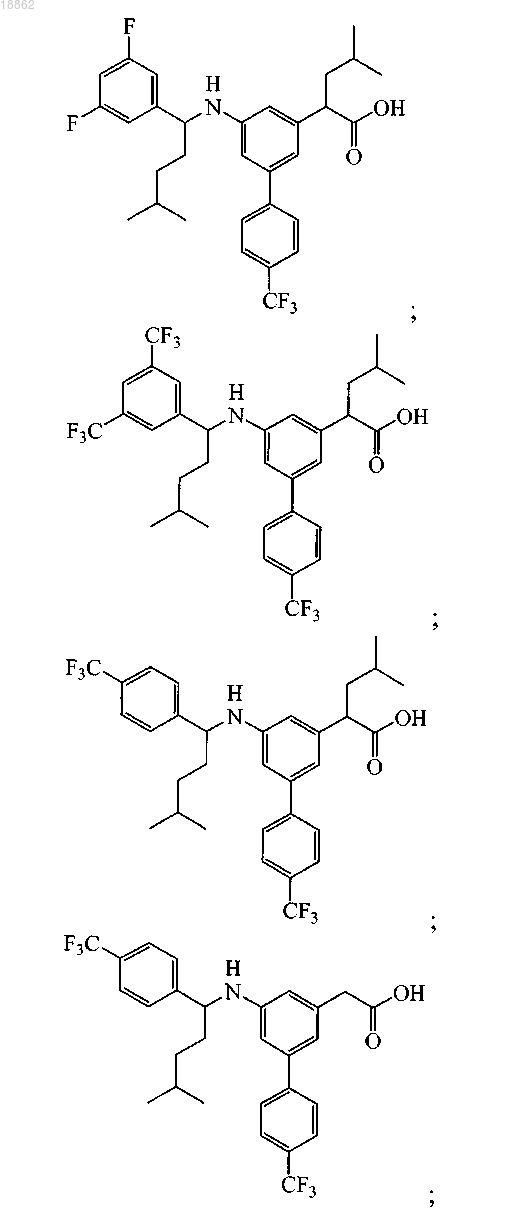
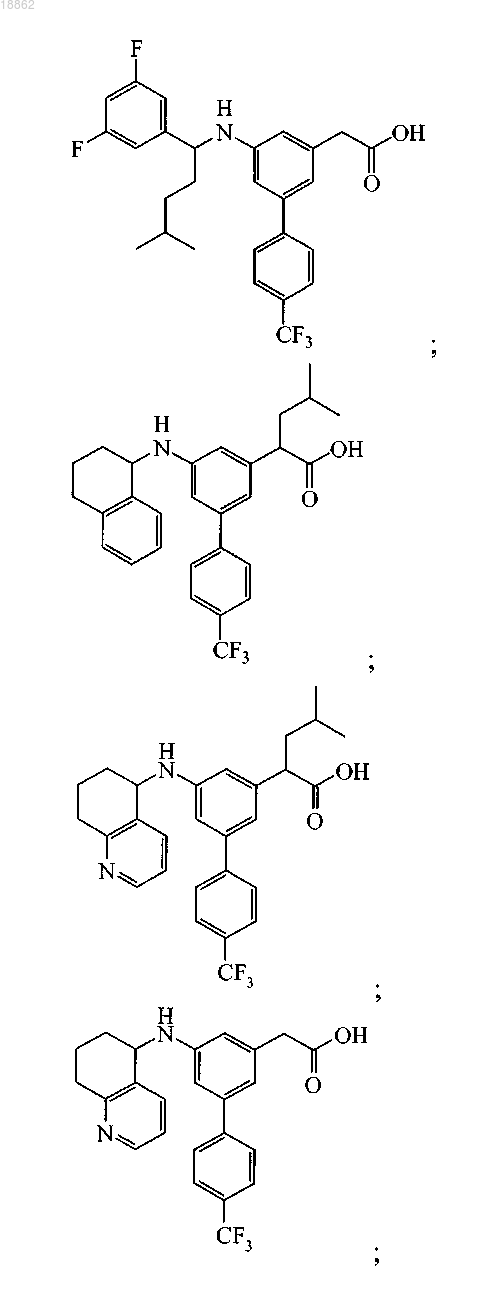
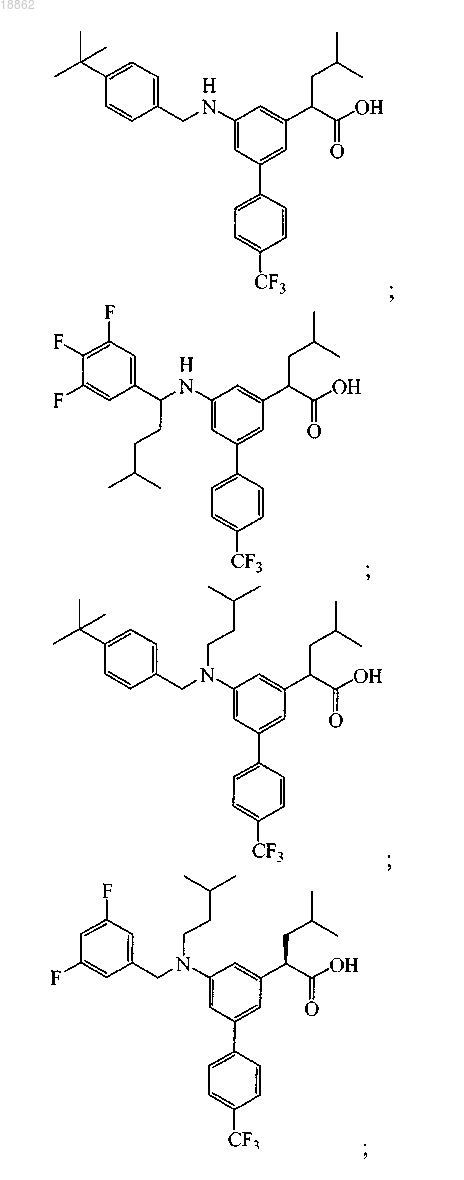
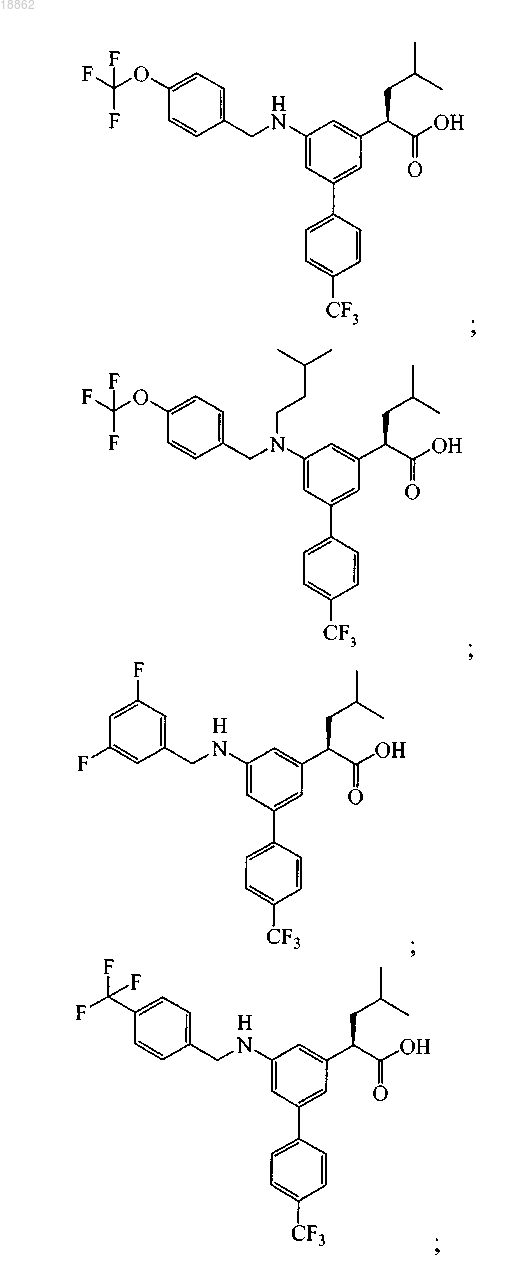
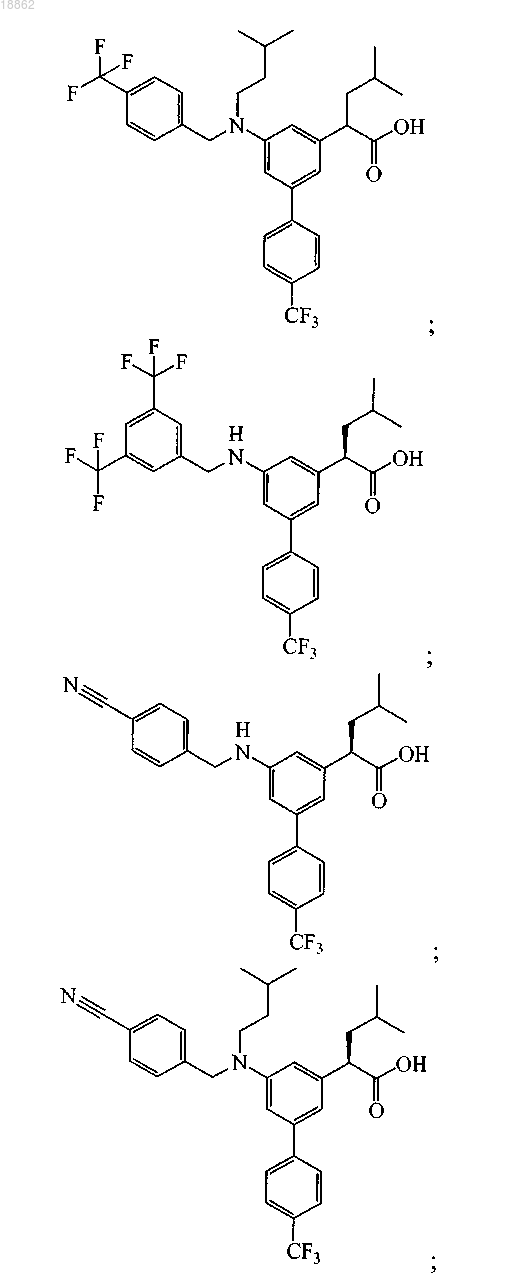
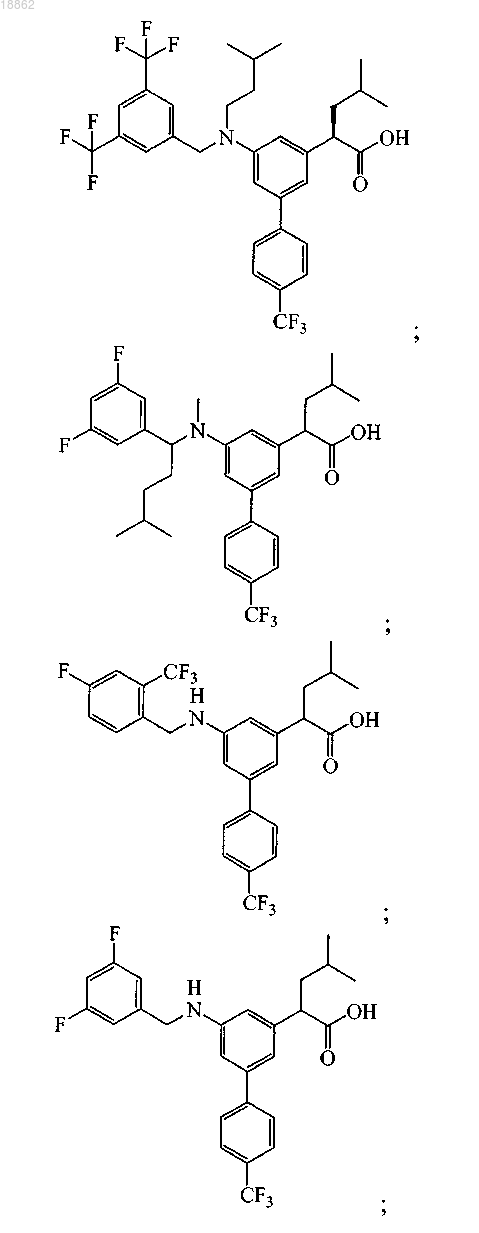
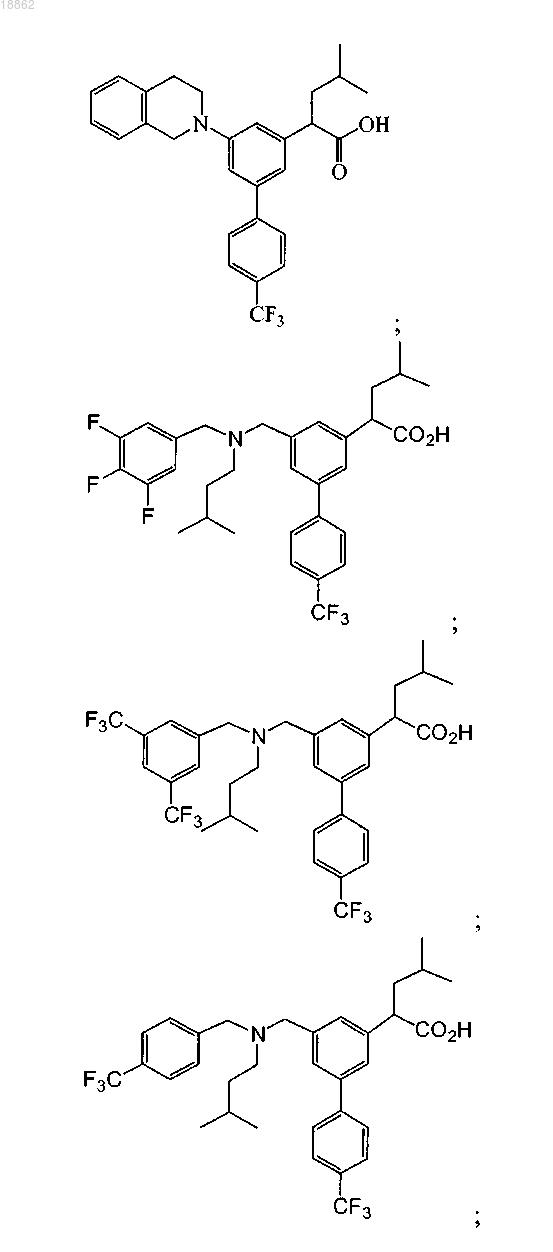

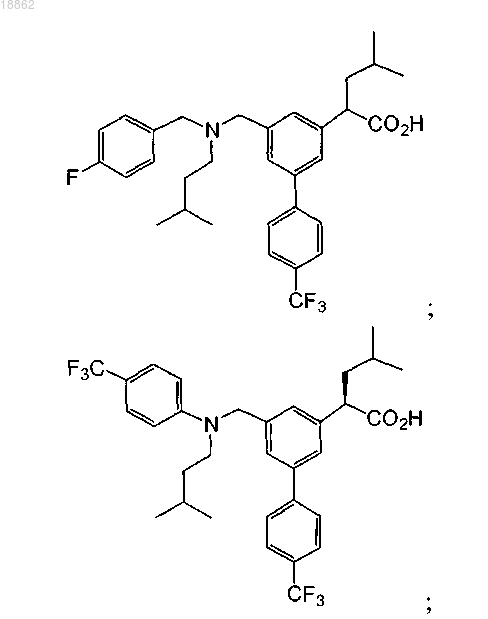
а также его сольваты, гидраты и фармацевтически приемлемые соли.
7. Фармацевтическая композиция, включающая соединение по любому из пп.1-6, в смеси с инертным носителем.
8. Способ модуляции активности γ-секретазы у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества соединения по любому из пп.1-6.
9. Способ лечения у млекопитающего заболевания, ассоциированного с повышенным уровнем продукции Aβ42, включающий введение млекопитающему терапевтически эффективного количества соединения по любому из пп.1-6.
10. Способ по п.9, где указанное заболевание является болезнью Альцгеймера.
Текст
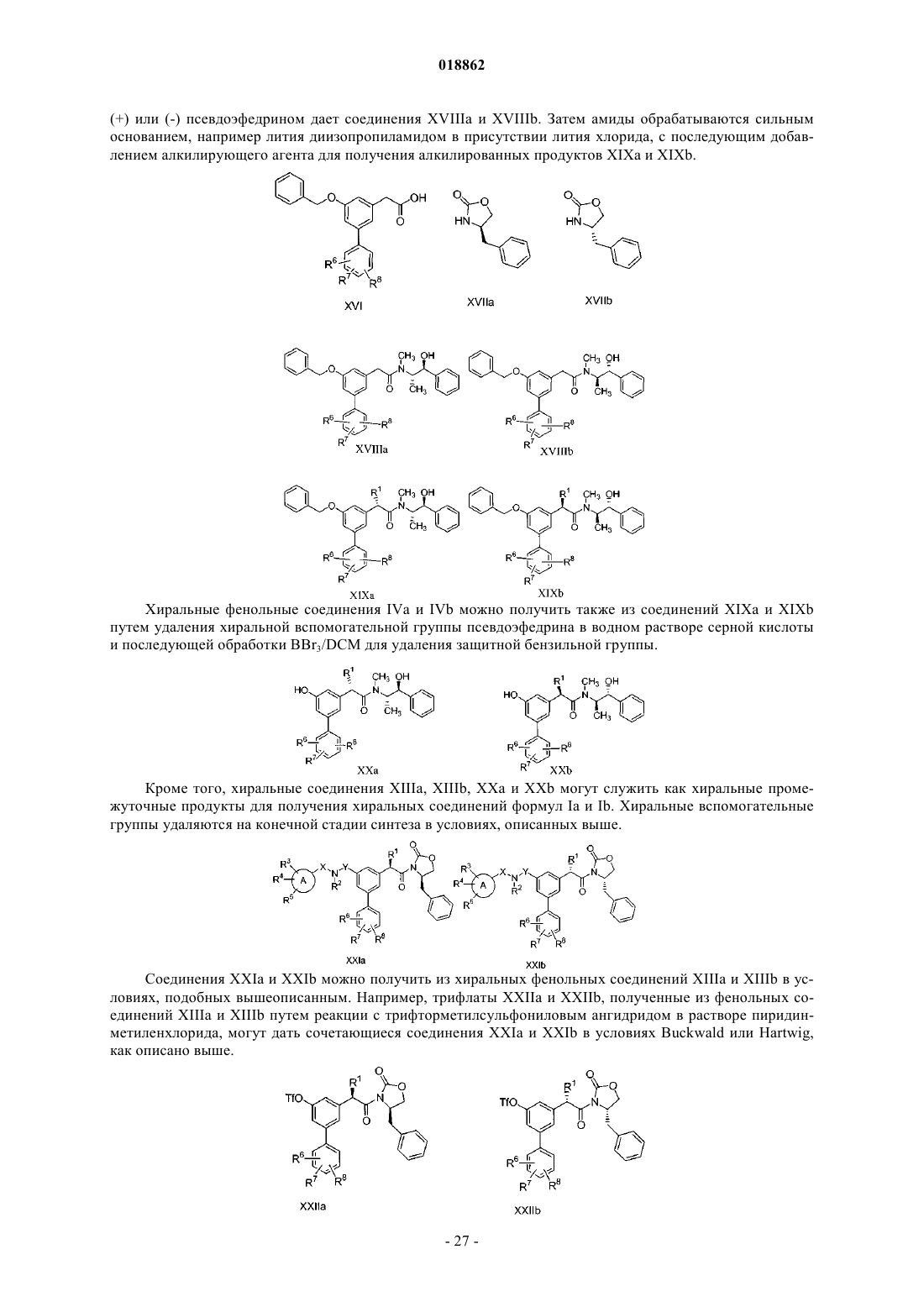
Изобретение относится к соединениям с общей формулой I, как показано ниже; определения А,X, Y, R1 R2, R3 R4, R5, R6, R7, R8 и R9 приведены в спецификации. Соединения формулы I могут применяться для лечения заболеваний, связанных с активностью -секретазы, включая болезнь Альцгеймера. Хо Чих Юнг (US) Медведев В.Н. (RU) Область изобретения Настоящее изобретение относится к применению соединений с общей формулой I, определения А,X, Y, R1 R2, R3, R4, R5, R6, R7, R8 и R9 приведены в описании. Соединения формулы I могут применяться для лечения заболеваний, связанных с активностью -секретазы, включая болезнь Альцгеймера. Болезнь Альцгеймера (БА) - прогрессирующее нейродегенеративное нарушение, характеризующееся потерей памяти, познавательной способности и стабильности поведения. БА поражает 6-10% населения в возрасте старше 65 лет и до 50% в возрасте старше 85 лет. Это самая распространенная причина деменции и третья по частоте причина смерти после сердечно-сосудистых и раковых заболеваний. В настоящее время эффективного лечения БА не существует. Общая сумма расходов, связанных с БА в США, превышает 100 млрд долларов ежегодно. Этиология БА сложна, однако известны определенные факторы риска ее развития, включающие (1) возраст, (2) семейный анамнез и (3) травмы головы; прочие факторы включают токсины окружающей среды и низкий уровень образования. Специфические нейропатологические повреждения лимбической коры и коры больших полушарий включают внутриклеточные нейрофибриллярные клубки, состоящие из гиперфосфорилированного тау-белка, и внеклеточные отложения фибриллярных агрегатов амилоидных бета-пептидов (амилоидные бляшки). Основным компонентом амилоидных бляшек являются бета-амилоидные пептиды (А-бета, Абета или A) разной длины. Полагают, что основной причиной формирования амилоида является один из вариантов, пептид А 142 (Абета-42). Другой вариант - пептид А 1-40 (Абета-40). Бета-амилоид представляет собой продукт протеолиза бета-амилоидного белка-предшественника (бета-АРР или АРР). Наследственные рано проявляющиеся аутосомно-доминантные формы БА связаны с мутацией, приводящей к образованию антисмыслового кодона белка-предшественника бета-амилоида (-АРР или АРР) и белков пресенилинов 1 и 2. У некоторых больных формами БА с поздним развитием обнаружена корреляция со специфическим аллелем гена аполипротеина Е (АпоЕ) и позднее с мутацией гена альфа-2-макроглобулина, которую можно связать с БА по крайней мере у 30% населения. Несмотря на неоднородность, все формы БА характеризуются сходными патологическими изменениями. Генетический анализ дает самые лучшие возможности логичного подхода к терапевтическому лечению БА. Все известные к настоящему времени мутации затрагивают количественное или качественное образование амилоидогенных пептидов, известных как Абета-пептиды (А), особенно А 42, и с высокой вероятностью подтверждают гипотезу "амилоидного каскада" (Tanzi and Bertram, 2005, Cell 120, 545). Вероятная связь между образованием А пептида и патологией БА подчеркивает необходимость лучшего понимания механизмов образования А и достоверно оправдывает терапевтический подход путем модуляции его содержания. Высвобождение А пептидов модулируется по крайней мере двумя протеолитическими ферментами, называемыми - и -секретазами и отщепляющими фрагменты с N-конца (связь мет-асп) и C-конца(остатки 37-42) пептида А соответственно. В секреторном пути существует свидетельство того, что секретаза отщепляет первый из указанных, что ведет к секреции s-APP (s) и удержанию конечного карбоксильного фрагмента (CFT) с молекулярной массой 11 кДа. Полагают, что последний из указанных дает начало А-пептидам после расщепления -секретазой. У больных с определенными мутациями генов гена особого белка (пресинилина) избирательно повышается содержание более длинной изоформы,А 42, и такие мутации соотносятся с проявлениями в более раннем возрасте семейной болезни Альцгеймера. Таким образом, по мнению многих исследователей А 42 является основным виновником патогенеза болезни Альцгеймера. В настоящее время стало очевидным, что активность -секретазы нельзя приписать одному конкретному белку; фактически, она обусловлена совокупностью нескольких разных белков. Гамма-секретазная активность присуща белковому комплексу, состоящему по крайней мере из четырех соединений: гетеродимер пресенилина (ПС), никастрин, aph-1 и pen-2. Гетеродимер ПС состоит из фрагментов ПС с амино- и карбоксильными концами, образовавшихся в результате эндопротеолиза белка-предшественника. Две аспартатные группы каталитического участка расположены на поверхности этого гетеродимера. Недавно было высказано предположение о том, что никастрин служит в качестве рецептора субстрата гамма-секретазы. Функции прочих членов семейства гамма-секретаз неизвестны, но все они необходимы для активности (Steiner, 2004, Curr. Alzheimer Research 1(3): 175-181). Таким образом, несмотря на то что молекулярный механизм второй стадии расщепления остается неясным до настоящего времени, гамма-секретазный комплекс стал одной из основных мишеней при поиске соединений для лечения болезни Альцгеймера. Были предложены различные стратегии воздействия на гамма-секретазу при болезни Альцгеймера,от непосредственного влияния на каталитический центр до разработки субстрат-специфичных ингибиторов и модуляторов гамма-секретазной активности (Marjaux et al., 2004, Drug Discovery Today: TherapeuticStrategiec, Volume 1, 1-6). Соответственно был описан ряд соединений, мишенями которых являются секретазы (Larner, 2004, Secretases as therapeutics targets in Alzheimer's disease: patents 2000-2004, ExpertOpin. Ther. Patents 14, 1403-1420). Действительно, этот результат был недавно подтвержден биохимическими исследованиями, показавшими воздействие определенных НСПВП на -секретазу (Weggen et al. (2001) Nature 414, 6860, 212,-1 018862WO 01/78721 и US 2002/0128319; Morihara et al. (2002) J. Neurochem. 83, 1009; Eriksen (2003) J. Clin. Invest. 112, 440). Потенциальными ограничениями применения НСПВП для лечения БА является их ингибирующее действие на циклооксигеназы, способное привести к нежелательным побочным явлениям, и низкое проникновение в ЦНС (Peretto et al., 2005, J. Med. Chem. 48, 5705-5720). Таким образом, существует сильная потребность в новых соединениях, способных модулировать активность -секретазы, тем самым открывая новые пути лечения болезни Альцгеймера. Цель настоящего изобретения - создание таких соединений. Краткое описание изобретения Соединение общей формулы I где А выбран из группы, включающей фенил; гетероцикл, который представляет собой радикал с насыщенным или частично ненасыщенным моноциклическим кольцом, выбранный из 2 Н-пирролила, 2 пирролинила, 3-пирролинила, пирролидинила, 1,3-диоксоланила, 2-имидазолинила, имидазолидинила, 2 пиразолинила, пиразолидинила, тетразолила, пиперидинила, 1,4-диоксанила, морфолинила, 1,4 дитианила, тиоморфолинила, пиперазинила, азепанила, гексагидро-1,4-диазепинила; пиридил;X представляет собой CH2, прямую связь или CHC(1-5)алкил, где указанный алкил необязательно замещен одним, двумя или тремя заместителями, независимо выбранными из группы, включающей F, Cl,Br, I или CF3;Y представляет собой СН 2 или прямую связь;R1 выбран из группы, включающей H, алкил, выбранный из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7,изо-С 4 Н 9, н-С 4 Н 9, втор-С 4 Н 9, трет-С 4 Н 9; алкенил, выбранный из группы С 2 Н 3, изо-С 3 Н 5, н-С 3 Н 5, н-С 4 Н 7,изо-С 4 Н 7, втор-С 4 Н 7; где указанные алкильная и алкенильная группы необязательно замещены одним,двумя или тремя заместителями, независимо выбранными из группы, включающей F, Cl, Br, I и CF3;R2 выбран из группы, включающей H, бензил, C(O)CH2CH(CH3)2, алкил, выбранный из группы СН 3,С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7, изо-С 4 Н 9, н-С 4 Н 9, втор-С 4 Н 9, трет-С 4 Н 9, СН 2 СН 2 СН(СН 3)2; алкенил, выбранный из группы С 2 Н 3, изо-С 3 Н 5, н-С 3 Н 5, н-С 4 Н 7, изо-С 4 Н 7, втор-С 4 Н 7; где указанные алкильная и алкенильная группы необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из группы, включающей F, Cl, Br, I или CF3; альтернативно, если R2 представляет собой алкил, он может быть объединен с R3, кольцом А, X и азотом, к которому он присоединен, с образованием 9 или 10 членной конденсированной кольцевой системы;R3 и R6 независимо выбраны из группы, включающей H, F, Cl, CN, CF3, OCF3 и C1-C4-алкил;R4, R5, R7 и R8 независимо выбраны из группы, включающей CF3, H, F, Cl, ОСН 3, С(1-4)алкил и CN;R9 выбран из группы, включающей H, алкил, выбранный из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7,изо-С 4 Н 9, н-С 4 Н 9, втор-С 4 Н 9, трет-С 4 Н 9; алкенил, выбранный из группы С 2 Н 3, изо-С 3 Н 5, н-С 3 Н 5, н-С 4 Н 7,изо-С 4 Н 7, втор-С 4 Н 7; где указанные алкильная и алкенильная группы необязательно замещены одним,двумя или тремя заместителями, независимо выбранными из группы, включающей F, Cl, Br, I и CF3; при условии, что, если X и Y представляют собой прямую связь, А представляет собой фенил, R2 и 9 Подробное описание изобретения Соединение общей формулы I где А выбран из группы, включающей фенил; гетероцикл, который представляет собой радикал с насыщенным или частично ненасыщенным моноциклическим кольцом, выбранный из 2H-пирролила, 2 пирролинила, 3-пирролинила, пирролидинила, 1,3-диоксоланила, 2-имидазолинила, имидазолидинила, 2 пиразолинила, пиразолидинила, тетразолила, пиперидинила, 1,4-диоксанила, морфолинила, 1,4 дитианила, тиоморфолинила, пиперазинила, азепанила, гексагидро-1,4-диазепинила; пиридил;X представляет собой СН 2, прямую связь или CHC(1-5)алкил, где указанный алкил необязательно замещен одним, двумя или тремя заместителями, независимо выбранными из группы, включающей F, Cl,Br, I или CF3;Y представляет собой СН 2 или прямую связь;R1 выбран из группы, включающей H, алкил, выбранный из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7,изо-С 4 Н 9, н-С 4 Н 9, втор-С 4 Н 9, трет-С 4 Н 9; алкенил, выбранный из группы С 2 Н 3, изо-С 3 Н 5, н-С 3 Н 5, н-С 4 Н 7,изо-С 4 Н 7, втор-С 4 Н 7; где указанные алкильная и алкенильная группы необязательно замещены одним,двумя или тремя заместителями, независимо выбранными из группы, включающей F, Cl, Br, I и CF3;R2 выбран из группы, включающей H, бензил, C(O)CH2CH(CH3)2, алкил, выбранный из группы СН 3,С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7, изо-С 4 Н 9, н-С 4 Н 9, втор-С 4 Н 9, трет-С 4 Н 9, СН 2 СН 2 СН(СН 3)2; алкенил, выбранный из группы С 2 Н 3, изо-С 3 Н 5, н-С 3 Н 5, н-С 4 Н 7, изо-С 4 Н 7, втор-С 4 Н 7; где указанные алкильная и алкенильная группы необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из группы, включающей F, Cl, Br, I или CF3; альтернативно, если R2 представляет собой алкил, он может быть объединен с R3, кольцом А, X и азотом, к которому он присоединен, с образованием 9 или 10 членной конденсированной кольцевой системы;R3 и R6 независимо выбраны из группы, включающей H, F, Cl, CN, CF3, OCF3 и C1-C4-алкил;R4, R5, R7 и R8 независимо выбраны из группы, включающей CF3, H, F, Cl, ОСН 3, С(1-4)алкил и CN;R9 выбран из группы, включающей H, алкил, выбранный из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7,изо-С 4 Н 9, н-С 4 Н 9, втор-С 4 Н 9, трет-С 4 Н 9; алкенил, выбранный из группы С 2 Н 3, изо-С 3 Н 5, н-С 3 Н 5, н-С 4 Н 7,изо-С 4 Н 7, втор-С 4 Н 7; где указанные алкильная и алкенильная группы необязательно замещены одним,двумя или тремя заместителями, независимо выбранными из группы, включающей F, Cl, Br, I и CF3; при условии, что, если X и Y представляют собой прямую связь, А представляет собой фенил, R2 иR1 выбран из группы, включающей H, алкил, выбранный из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7,изо-С 4 Н 9, н-С 4 Н 9, втор-С 4 Н 9, трет-С 4 Н 9; алкенил, выбранный из группы С 2 Н 3, изо-С 3 Н 5, н-С 3 Н 5, н-С 4 Н 7,изо-С 4 Н 7, втор-С 4 Н 7;R9 выбран из группы, включающей H, алкил, выбранный из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7,изо-С 4 Н 9, н-С 4 Н 9, втор-С 4 Н 9 и трет-С 4 Н 9; а также сольваты, гидраты и фармацевтически приемлемые соли вышеизложенного соединения. В другой модификации изобретения R2 выбран из группы, включающей H, бензил,C(O)CH2CH(СН 3)2, алкил, выбранный из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-С 3 Н 7, изо-С 4 Н 9, н-С 4 Н 9, вторС 4 Н 9, трет-С 4 Н 9, СН 2 СН 2 СН(СН 3)2; алкенил, выбранный из группы С 2 Н 3, изо-С 3 Н 5, н-С 3 Н 5, н-С 4 Н 7, изоС 4 Н 7, втор-С 4 Н 7; альтернативно, если R2 представляет собой алкил, он может быть объединен с R3, кольцом А, X и азотом, к которому он присоединен, с образованием 9 или 10-членной конденсированной кольцевой системы; а также сольваты, гидраты и фармацевтически приемлемые соли вышеизложенного соединения. В другой модификации изобретенияR3 и R6 независимо выбраны из группы, включающей OCF3, CF3, F, Cl, C(1-4)алкил и CN;R9 представляет собой H; а также сольваты, гидраты и фармацевтически приемлемые соли вышеизложенного соединения. В другой модификации изобретения А выбран из группы, включающей фенил, пиридил,X представляет собой СН 2, прямую связь или CHC(1-5)алкил;R1 представляет собой СН 2 СН(СН 3)2;R вместе с кольцом А, X и присоединенным азотом могут образовывать конденсированную кольцевую систему, выбранную из группы, включающейR6, R7 и R8 представляют собой H, F, Cl и CF3; а также сольваты, гидраты и фармацевтически приемлемые соли вышеизложенного соединения. Другая модификация изобретения включает следующие возможные соединения: а также их сольваты, гидраты и фармацевтически приемлемые соли. В другой модификации изобретение относится к фармацевтической композиции, включающей соединение формулы I в смеси с инертным носителем. В другой модификации изобретение относится к способу модуляции активности -секретазы у млекопитающего, включающему введение млекопитающему терапевтически эффективного количества соединения формулы I. В другой модификации изобретение относится к способу лечения у млекопитающего заболевания,- 18018862 ассоциированного с повышенным уровнем продукции A42, включающему введение млекопитающему терапевтически эффективного количества соединения формулы I. В другой модификации изобретение относится к способу лечения у млекопитающего болезни Альцгеймера. Как очевидно специалисту в данной области, соединения формулы I могут иметь один или более асимметричных углеродных атомов в своей структуре. Это предполагает, что настоящее изобретение включает формы соединений, состоящие из одного энантиомера, рацемические смеси и смеси с избытком какого-либо энантиомера. Некоторые из соединений изобретения и/или их солей или эфиров существуют в форме разных стереоизомеров. Все эти формы являются предметом данного изобретения. Ниже описаны примеры солей соединений, соответствующих настоящему изобретению. Приведенный ниже список различных солей не может рассматриваться как полный и не ограничивается перечисленным. Соединения, относящиеся к изобретению и содержащие одну или более кислых групп, могут использоваться соответственно, как и их соли щелочных металлов, соли щелочно-земельных металлов или аммония. Более точные примеры таких солей включают соли натрия, калия, кальция, магния, а также соли аммония или органических аминов, например этиламин, этаноламин, триэтаноламин или аминокислоты. Термин "фармацевтически приемлемый" означает одобренный контрольными органами, например ЕМЕА (Европа) и/или FDA (США), и/или другими национальными контрольными органами для лечения животных, предпочтительнее людей. Соответствующие соли соединений в соответствии с изобретением можно получить традиционными методами, известными специалистам, например смешиванием с органическими или неорганическими основаниями в растворителе или дисперсной среде, либо путем катионного обмена с другими солями. Кроме того, изобретение включает все соли соединений, относящихся к изобретению, которые из-за низкой физиологической совместимости не подходят для непосредственного применения в качестве фармацевтических препаратов, но которые можно использовать, например, в качестве промежуточных соединений при химических реакциях или для приготовления фармацевтически приемлемых солей, либо для изучения способности к модулированию гамма-секретазной активности соединения, относящегося к изобретению, любым подходящим способом, например in vitro. В данном описании раскрываются пролекарства, т.е. производные активного препарата, возможности доставки и терапевтическая ценность которых выше, чем у активного препарата. Пролекарства превращаются в активные лекарства в ходе ферментативных или химических процессов в организме. Кроме того, настоящее изобретение включает все сольваты соединений, относящихся к изобретению. Настоящее описание раскрывает также производные/пролекарства (в том числе их соли) соединений, относящихся к изобретению, содержащие физиологически переносимые и отщепляемые группы и подвергающиеся превращениям в организме животных, предпочтительнее млекопитающих, наиболее предпочтительно людей, в соединения, относящиеся к изобретению. Кроме того, настоящее описание раскрывает метаболиты соединений, относящихся к изобретению. Термин "метаболиты" относится ко всем молекулам-производным любых соединений, относящихся к изобретению, в клетке или организме предпочтительнее млекопитающих. Предпочтительно термин "метаболиты" относится к молекулам, отличающимся от любой молекулы, присутствующей в таких клетках или организмах в физиологических условиях. Строение метаболитов соединений, относящихся к изобретению, будет понятно любому специалисту в этой области и доступно для исследования различными подходящими методами. Изобретение также связано с теми соединениями, которые предназначаются для использования в качестве медикаментов. В частности, соединения, относящиеся к настоящему изобретению, подходят для лечения болезни Альцгеймера. Более подробная информация об использовании приведена ниже. Соединения могут использоваться для модулирования активности -секретазы. Использующийся в данном документе термин "модулирование -секретазной активности" относится к влиянию на превращение АБП -секретазным комплексом. Это предпочтительно относится к эффекту, при котором общая скорость превращения АБП остается в основном такой же, как без применения указанных соединений, но относительное количество продуктов изменяется, предпочтительнее сопровождаясь снижением образования A42-пептида. Например, могут образовываться разные формы Абета(Абета-38 или другие пептидные соединения с более короткой аминокислотной цепью вместо Абета-42) или разное относительное количество продукта (например, другое соотношение Абета-40 и Абета-42,предпочтительнее повышенное). Гамма-секретазную активность можно измерить путем оценки превращения АРР, например, определив количество образовавшихся Абета пептидов, прежде всего Абета-42 (см. раздел "Примеры" ниже). Ранее было показано, что гамма-секретазный комплекс также участвует в превращениях трансмембранного белка Notch. Это сигнальный белок, играющий решающую роль в процессах развития (например, обзор в Schweisguth F. (2004) Curr. Biol. 14, R129). Что касается применения указанных соединений для модулирования гамма-секретазной активности, особенно благоприятным представляется отсутствие воздействия на активность в отношении Notchбелка во избежание возможных нежелательных побочных явлений. Таким образом, предпочтительнее соединения, не влияющие на активность гамма-секретазного комплекса в отношении Notch-белка. В значение "влияние на активность в отношении Notch-белка" включается как ингибирование, так и активация этой активности с определенным коэффициентом. Соединение определяется как не оказывающее влияния на активность в отношении Notch-белка, если этот коэффициент менее 20, предпочтительнее менее 10, еще предпочтительнее менее 5 и предпочтительнее всего менее 2, при определении соответствующим методом, описанным Shimizu et al. (2000) Mol.Cell. Biol, 20: 6913 в концентрации 30 мкмоль. Такое модулирование гамма-секретазной активности возможно, в частности, у животных, например млекопитающих. В качестве примера можно привести таких млекопитающих, как мыши, крысы, морские свинки, обезьяны, собаки и кошки. Модуляция возможна также у человека. В конкретной модификации изобретения указанная модуляция производится in vitro или в культуре клеток. Как известно специалистам в этой области, имеется несколько in vitro-методов с культурами клеток. В качестве примера можно привести метод определения С-конечных фрагментов АБП в клеточных линиях трансгенных животных путем вестерн-блоттинга, включая, но не ограничиваясь, описанные Yanet al., 1999, Nature 402, 533-537. Пример метода определения -секретазы in vitro описан в WO 03/008635. В этом методе соответствующий пептидный субстрат добавляется к препарату гамма-секретазы и измеряется способность к расщеплению субстрата. Концентрацию разных продуктов расщепления гамма-секретазой (А-пептиды) можно определить разными методами, известными специалистам в этой области. Примеры таких методов включают определение пептидов методом масс-спектрометрии или обнаружение с помощью антител. Примеры методов анализа состава растворимых A-пептидов в среде для культур клеток и биологических жидкостях включают, но не ограничиваются, описанные в работе Wang et al., 1996, J. Biol.Chem. 271, 31894-31902. В этом методе используется сочетание иммунопреципитации Абета-пептидов специфическими антителами и обнаружение и количественное определение пептидных молекул методом время-пролетной масс-спектрометрии с ионизацией лазерной десорбцией с использованием матрицы. Примеры ИФА-методов измерения образования Абета-40 и Абета-42-пептидов включают, но не ограничиваются описанными в работе Vassar et al., 1999, Science 286, 735-741. Дальнейшая информация описана, например, в работе N. Ida et al. (1996) J. Biol. Chem. 271, 22908 и M. Jensen et al. (2000) Mol.Med. 6, 291. Подходящие антитела можно приобрести, например, в компании Genetics Company, Inc.,Швейцария. Тест-системы на основе антител выпускает также компания Innogeneticc, Бельгия. Для этих методов можно использовать клетки, экспрессирующие гамма-секретазный комплекс, а также клетки после трансфекции, временно или постоянно экспрессирующие некоторые или все компоненты гамма-секретазного комплекса. Для таких исследований подходят многочисленные имеющиеся клеточные линии, известные специалистам. Особенно хорошо подходят клетки и клеточные линии нейронного или глиального происхождения. Кроме того, могут использоваться клетки и ткани мозга, а также их гомогенаты и препараты мембран (Xia et al., 1998, Biochemistry 37, 16465-16471). Такие исследования можно проводить, например, для изучения влияния соединений, относящихся к изобретению, в разных экспериментальных условиях и конфигурациях. Кроме того, такие анализы могут проводиться в рамках функциональных исследований гаммасекретазного комплекса. Например, один или более взаимодействующих соединений (дикого типа или несущие определенные мутации и/или модификации) гамма-секретазного комплекса животных, предпочтительнее млекопитающих или предпочтительнее всего человека, могут экспрессироваться в определенных клеточных линиях, что дает возможность изучения эффекта соединений, относящихся к изобретению. Мутантные формы взаимодействующих соединений могут быть либо мутантными формами, описанными у определенных животных, предпочтительнее млекопитающих и наиболее предпочтительно людей, или мутантными формами, не описанными ранее. Модификации соединений гамма-секретазного комплекса включают физиологическую модификацию этих соединений и другие модификации, описанные как модификации белков в биологической системе. Примеры таких модификаций включают, но не ограничиваются, гликолизирование, фосфорилирование, фенилирование, миристилирование и фарнезилирование. Кроме того, соединения, относящиеся к изобретению, могут использоваться для производства медикаментов для модулирования гамма-секретазной активности. Активность гамма-секретазы можно регулировать разными способами, что будет сопровождаться изменением состава различных А-пептидов. Соответствующие дозировки, пути введения, формы и др. описаны ниже. Далее, изобретение относится к применению соединений формулы I для лечения заболевания, связанного с повышенным образованием А 42. Заболевания, сопровождающиеся повышением образования Абета-пептида и его отложением в тканях головного мозга, включают болезнь Альцгеймера (БА), церебральную амилоидную ангиопатию, мультиинфарктную деменцию, деменцию боксеров или синдром Дауна; предпочтительно БА. Использующийся в данном документе термин "лечение" относится ко всем процессам, направленным на замедление, прерывание, приостановку или прекращение прогресса болезни, но не обязательно означает полное устранение всех симптомов. Использующийся в настоящем документе термин "повышенное образование А 42" относится к состоянию, при котором продукция А 42-пептида возрастает в результате общего повышения превращения АРР или предпочтительнее в результате изменения характера превращения АРР по сравнению с АРР дикого типа и нормальной физиологической ситуацией. Как указано выше, такое повышение образования А 42 является отличительным признаком развития или наличия болезни Альцгеймера. Одно из преимуществ соединений или части соединений настоящего изобретения может заключаться в усиленном проникновении в ЦНС. Кроме того, изобретение относится к фармацевтической композиции, включающей соединения формулы I в смеси с инертным носителем. Модуляторы гамма-секретазы, полученные из соединений формулы I, могут входить в состав фармацевтических препаратов, включающих соединение формулы I, в форме смеси с инертным носителем,являющимся носителем для фармацевтически активных веществ. Термин "носитель" относится к растворителям, адъювантам, вспомогательным веществам или жидкости, с которой вводится соединение. Такими носителями могут быть стерильные жидкости, например вода или масла, включая производные нефти, животные, растительные или синтетические, включающие,но не ограничиваясь, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Для внутренних форм предпочтительным носителем является вода. Для внутривенных форм предпочтительными носителями являются физиологический раствор и водный раствор декстрозы. Солевые физиологические растворы, а также водные растворы декстрозы и глицерина являются предпочтительными жидкими носителями для инъекционных форм. Подходящие вспомогательные вещества для фармацевтических препаратов включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, уголь, силикагель,натрия стеарат, глицерина моностеарат, тальк, натрия хлорид, сухое снятое молоко, глицерин, пропител,гликоль, воду, этанол и т.п. В состав, если требуется, можно также включить незначительные количества смачивающих или эмульгирующих добавок, или буферных веществ для регулировки pH. Эти составы могут принимать формы растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, форм замедленного высвобождения и др. Возможны также формы свечей с традиционными связующими компонентами и носителями, такими как триглицериды. Внутренние формы могут включать стандартные носители для применения в фармацевтике, например маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния и др. Примеры подходящих носителей описаны в работе Remington'sPharmaceutical Sciencec, E.W. Martin. Такие составы будут содержать терапевтически эффективное количество соединения, предпочтительнее в очищенной форме, вместе с подходящим количеством носителя,для получения формы, удобной для введения больному. Состав должен соответствовать способу введения. Соединения, относящиеся к изобретению, а также их соли, пригодные для применения в фармакологии, возможно, в сочетании с другими фармакологически активными соединениями, подходят для лечения или профилактики болезни Альцгеймера или ее симптомов. Такие дополнительные соединения включают препараты, улучшающие познавательную функцию, например ингибиторы ацетилхолинэстеразы (например, донепезил, такрин, галантамин, ривастигмин), антагонисты NMDA (например, метамизин), ингибиторы PDE4 (например, Арифло) или любые другие препараты, известные специалистам в данной области, для лечения или профилактики болезни Альцгеймера. Такие соединения также включают препараты, понижающие концентрацию холестерина, например статины (в частности, симвастатин). Эти соединения могут вводиться животным, предпочтительнее млекопитающим, в особенности людям, в качестве лекарств сами по себе, в смесях или в форме фармацевтических препаратов. Могут присутствовать консерванты и другие добавки, например антимикробные вещества, антиоксиданты, хелатирующие вещества, инертные газы и т.п. Все носители можно смешивать, как необходимо, с разрыхлителями, растворителями, гранулирующими добавками, смазочными веществами, связующими агентами и т.п. по традиционным технологиям. Далее, это изобретение предоставляет способ лечения заболеваний, течение которых можно облегчить путем модуляции гамма-секретазной активности, которая включает введение больному терапевтически эффективной дозы фармацевтического препарата немедленного действия. Использующийся в данном документе термин "субъект" включает, без ограничений, любое животное или экспериментально измененное животное с заболеванием, течение которого улучшается при модулировании активности гамма-секретазы. Предпочтительнее, если субъектом является человек. Использующийся в настоящем документе термин "терапевтически эффективная доза" означает количество, достаточное для остановки, обращения или замедления прогресса заболевания. "Профилактическая эффективная доза" фармацевтического препарата соответствует количеству, достаточному для профилактики заболевания, т.е. исключения, облегчения или отсрочки его проявления. Существуют принятые методы определения терапевтических и профилактических эффективных доз для фармацевтических препаратов немедленного действия. Эффективные дозы фармацевтических препаратов для людей можно вычислить по результатам испытаний на животных. Известны различные системы доставки, которые можно использовать для введения соединения, относящегося к изобретению, при лечении болезни Альцгеймера или для модуляции активности гаммасекретазы, например инкапсуляция в липосомах, макрочастицах или микрокапсулах: если препарат не доставляется непосредственно в центральную нервную систему, предпочтительнее в головной мозг,лучше выбрать и/или изменить методы введения так, чтобы соединение могло проникать через гематоэнцефалический барьер. Методы введения включают, но не ограничиваются, внутрикожное, внутримышечное, внутрибрюшинное, подкожное, интраназальное, эпидуральное и оральное введения. Соединения могут вводиться любым удобным путем, например путем инфузии, болюсной инъекции, всасывания через эпителий или слизистую оболочку, а также вместе с другими биологически активными веществами. Введение может быть общим или местным. Кроме того, может оказаться желательным вводить лекарственные составы, относящиеся к изобретению, в центральную нервную систему любым подходящим путем, в том числе с помощью внутрижелудочковой или интратекальной инъекции, возможно, через установленный в желудочек катетер, соединенный с резервуаром, например, Ommaya. Возможно также введение через легкие, например, с помощью ингалятора и создание лекарственной формы с аэрозолеобразующим компонентом. Модуляторы активности -секретазы из соединений формулы I могут доставляться в организм в пузырьках, в частности липосомах (Langer (1990) Science 249, 1527. Модуляторы активности гамма-секретазы из соединений формулы I могут доставляться в организм с помощью системы контролируемого высвобождения. Можно также использовать насос (Sefton (1987)Med. 321, 574). В другой модификации можно использовать полимерные материалы (Ranger and PeppasAnn. Neurol. 25, 351; Howard et al. (1989) J. Neurosurg. 71, 858). В другой модификации возможно использование системы контролируемого высвобождения в непосредственной близости от органа-мишени, в данном случае головного мозга, таким образом, требуется только одна фракция системной дозы(Goodson, 1984, In: Medical Applications of Controlled Release, supra, Vol. 2, 115). Прочие системы контролируемого высвобождения обсуждаются в обзоре Langer (1990, Science 249, 1527). При выборе подходящего способа введения специалисты также учитывают способы, использующиеся для других известных препаратов против болезни Альцгеймера. Например, арисепт/донепезил и когнекс/такрин (все из которых относятся к ингибиторам ацетилхолинэстеразы) принимаются внутрь, а аксура/мемантин (антагонист рецептора NMDA) выпускаются как в форме таблеток/жидкости, так и в форме раствора для внутривенного введения. Кроме того, специалисты учитывают имеющиеся данные о способах введения препаратов семейства НСПВП во время клинических испытаний и других исследований влияния этих лекарств на течение болезни Альцгеймера. При выборе подходящей дозировки специалисты подбирают дозу, не проявлявшую токсических свойств при доклинических и клинических испытаниях и согласующуюся с приведенными ранее значениями, однако возможны отклонения. Точная доза будет также зависеть от пути введения и серьезности заболевания и должна подбираться лечащим врачом в зависимости от обстоятельств в каждом конкретном случае. Однако допустимый диапазон доз для внутривенного введения обычно составляет около 20-500 мкг активного соединения на 1 кг массы тела. Дозировка для интраназального введения обычно составляет около 0,01-1 мг/кг массы тела. Эффективные дозы можно вычислить экстраполяцией кривых доза-ответ, полученных in vitro или в экспериментах на животных. В качестве примера подопытных животных для данной цели можно привести трансгенных мышей линии "Tg2576", несущих форму АРР 695 с двойной мутацией KM670/671NL. Для справки см. патент US 5877399 и работу Hsiao et al. (1996) Science 274, 99, а также also Kawarabayahsi T. (2001) J. Neurosci. 21,- 22018862Lehman et al. (2003) Neurobiol. Aging 24, 645. При подборе подходящей дозировки для выбранной схемы лечения специалисты могут также руководствоваться вещественными данными нескольких исследований. Опубликованы результаты многочисленных исследований, описывающие влияние этих молекул на активность гамма-секретазы. Это, в частности, следующие исследования: Lim et al. (2001) Neurobiol. Aging 22, 983; Lim et al. (2000) J Neurosci. 20, 5709; Weggen et al. (2001) Nature 414, 212; Eriksen et al. (2003)J Clin Invest. 112, 440; Yan et al. (2003) J Neurosci. 23, 7504. Определения Термин "алкенил", использующийся самостоятельно или для описания части замещающей группы,например "C1-4 алкенил(арил)", обозначает одновалентный углеводородный радикал с частично ненасыщенной разветвленной или прямой углеводородной цепью, имеющий по крайней мере одну двойную связь С=С, образовавшуюся в результате отщепления одного водородного атома от каждого из соседних атомов углерода родительской молекулы, и радикал, образовавшийся в результате отщепления одного водородного атома от одного атома углерода. Атомы могут иметь цис-(Z) или транс-(Е) ориентацию относительно двойной связи. Типичные алкенильные радикалы включают этенил, пропенил, аллил (2 пропенил), бутенил и т.п., но не ограничиваются ими. В качестве примеров можно привести группыC2-8 алкенила или C2-4 алкенила. Термин "Ca-b" (где а и b - целые числа, обозначающие число углеродных атомов) обозначает алкильный, алкенильный, алкинильный, алкокси- или циклоалкильный радикал или алькильную часть радикала с цепью, содержащей от a до b углеродных атомов включительно. Например, C1-4 означает радикал, содержащий 1, 2, 3 или 4 углеродных атома. Термин "алкил" обозначает радикалы с линейной или разветвленной цепью длиной до 12 углеродных атомов, в основном до 6, если не указано иное, и включает такие группы, как метил, этил, пропил,изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил, изогексил, гептил, октил, 2,2,4-триметилпентил, нонил, децил, ундецил и додецил, но не ограничивается ими. Термин "гетероарил" обозначает 5-7-членные моноциклические или 8-10-членные бициклические ароматические системы, любое из колец которых может содержать от 1 до 4 гетероатомов (N, О или S),причем степень окисления атомов азота и серы может быть любой. Примеры включают бензимидазолил,бензотиазолил, бензотиенил, бензоксазолил, фурил, имидазолил, изотиазолил, изоксазолил, оксазолил,пиразинил, пиразолил, пиридил, пиримидинил, пирролил, хинолинил, тиазолил и тиенил. Термин "гетероцикл" относится к радикалу с насыщенным или частично ненасыщенным моноциклическим кольцом, образовавшемуся в результате отщепления одного водородного атома от одного атома углерода или азота в кольце. Типичные гетероциклические радикалы включают 2 Н-пирролил, 2 пирролинил, 3-пирролинил, пирролидинил, 1,3-диоксоланил, 2-имидазолинил (также называемый 4,5 дигидро-1 Н-имидазолилом), имидазолидинил, 2-пиразолинил, пиразолидинил, тетразолил, пиперидинил,1,4-диоксанил, морфолинил, 1,4-дитианил, тиоморфолинил, пиперазинил, азепанил, гексагидро-1,4 диазепинил и т.п. Термин "замещенный" относится к основной молекуле, один или более атомов водорода которой замещены одной или большим числом функциональных групп. Замещение не ограничено основной молекулой и может происходить также в самих радикалах-заместителях, тогда радикал-заместитель становится связующей группой. Общее описание синтеза Следующее общее описание приведено только для ознакомления и никаким образом не ограничивает изобретение. Соединения формулы I, где группы А, X, Y, R1, R2, R3, R4, R5, R6, R7 и R8 входят в формулу I, a R9 представляет собой H, могут быть получены гидролизом эфиров II в стандартной кислой или щелочной среде, включая реакцию с NaOH, при комнатной температуре, в течение нескольких часов, в соответствующей смеси растворителей, например вода, тетрагидрофуран (ТГФ) и метанол или этанол. Для иллюстрации эфиры II показаны с группой R9, соответствующей алкилу, однако, как известно специалистам,гидролиз действует и на другие группы R9 формулы I. Соединения формулы IIa, где Y - прямая связь, можно получить сочетанием соединений IIIa илиIIIb с ариламинами, гетероариламинами, арилметиленаминами или гетероарилметиленаминами в типич- 23018862 ных условиях Буквальда или Хартвига, т.е. в толуоле, диоксане или ТГФ в присутствии калия tбутоксида и катализатора, например палладия(II) ацетата (Pd(OAc)2) или палладия(0) транс, трансдибензилиденацетон при повышенной температуре (от 80-180C) или в микроволновом реакторе. Впоследствии продукты алкилируются путем реакции с галогенопроизводными алкилов или мезилатов в присутствии основания, например цезия карбоната или калия карбоната, или подвергаются восстановительному алкилированию с карбоксиальдегидами алкилов с образованием соединений IIa. Соединения IIIa могут быть получены путем реакции фенолов IV с трифторметансульфоновым ангидридом в дихлорметане в присутствии основания, например пиридина, или триэтиламина при 0C. Промежуточные продукты IIIb можно получить по реакции фенолов IV с концентрированной HCl, HBr или HI при повышенной температуре (от 25 до 120C). Альтернативно, соединения IIIb можно получить в мягких условиях путем обработки соответствующих трифталатов IIIa пинаколбораном в диоксане в присутствии триэтиламина и катализатора PdCl2 для получения эфиров пинаколбороната, на которые затем воздействуют галидами меди(II) в смеси метанола и воды; методика описана Nesmejanow et al.(Chem Ber., 1960, 2729). Описанные выше эфиры пинаколбороната можно также получить с помощьюal. (Synthesis, 2005, 547). Соединения формулы IIIc можно получить из соединений IIIa или IIIb с помощью реакции с бензофенонимином в апротонном растворителе, например ДМФ, толуоле или ТГФ в присутствии каталитической концентрации тетракистрифенилфосфина палладия(0) и трифенилфосфита с последующим щелочным гидролизом промежуточных иминов в водной среде. Альтернативно, соединения IIa можно получить из соединений IIIc путем восстановительного аминирования с арилкарбоксиальдегидами, арилкетонами, гетерокарбоксиальдегидами или гетероарилкетонами с борогидридом или триацетоксиборогидридом натрия. Образовавшиеся вторичные амины могут в последующем алкилироваться при взаимодействии с галогенопроизводными алкилов или подвергаться восстановительному аминированию с алкилальдегидами для присоединения R2 группы к аминной функциональной группе соединений IIa. Соединения IV можно получить дебензиилированием соединений V путем гидрогенизации в спирте, например MeOH или EtOH в присутствии Pd-C. Возможно дебензилирование другими методами, например BBr3 в дихлорметане, NaCN в ДМСО/120-200C или LiCl в ДМФ/120-200C. Соединения V могут быть получены алкилированием соединений VI взаимодействием с галогенопроизводными алкилов или алкенилов. Воздействие на соединения VI в ТГФ или другом апротонном растворителе основанием,например лития бис-(триметилсилил)амидом,натрия бис(триметилсилил)амидом или лития диизопропиламидом при -78C с последующим добавлением электрофильных соединений, например галогенопроизводных алкилов или алкенилов, позволяет получить алкилированные соединения V. Альтернативно, соединения VI можно получить из соединений VII путем реакции сочетания с арилбороновой кислотой в условиях Сузуки в водном растворе карбоната натрия в ДМЭ в присутствииPd(PPh3)4. Альтернативно, трифлаты можно превратить в эфиры бороната в условиях, описанных выше, а затем провести реакцию сочетания с арилборомидами или арилхлоридами для получения соединений VI. Промежуточные трифлатные соединения VII можно получить из соединений VIIIc помощью трифторметансульфонового ангидрида в дихлорметане в присутствии одного эквивалента пиридина при 0C. Промежуточное соединение VIII можно получить путем монодебензилирования соединения IX. Избирательное монодебензилирование соединения IX возможно путем селективного гидрогенолиза соединения IX в этаноле или метаноле с добавлением 1,1 экв. основания, например гидроксида натрия или калия, в присутствии катализатора Pd-C во встряхивателе Парра. Реакцию проводят до расхода одного эквивалента водорода. Промежуточный продукт IX можно легко получить путем реакции метилового эфира 3,5 дигидроксифенилуксусной кислоты, соединения X (имеющегося в продаже) с бензилбромидом или карбонатом калия в ДМФ при комнатной температуре. Соединения формулы IIb, где Y означает CH2, можно получить путем восстановительного аминирования соединений XI карбоксиальдегидами, арилкетонами, гетероарилкарбоксиальдегидами или гетероарилкетонами с использованием натрия боргидрида или натрия триацетоксиборгидрида. Продукты восстановительного аминирования альдегидов могут в последующем алкилироваться при взаимодействии с галогенопроизводными алкилов или подвергаться восстановительному аминированию с алкилальдегидами для присоединения R2 группы к аминной функциональной группе соединений IIb. СоединенияXI можно получить восстановлением соединений XII путем гидрогенизации в присутствии PtO2 в кислом спиртовом растворителе, например метаноле или этаноле. Соединения XII можно получить путем реакции соединений IIIa или IIIb с цианидом цинка при повышенной температуре (80-150C) в апротонном растворителе, например ДМФ, в присутствии каталитического количества тетракистрифенилфосфина палладия(0). Соединения формулы I имеют хиральный центру карбоксильной группы и могут существовать в форме одного или двух энантиомеров (или их смеси, с избытком одного из них или без). Показаны энантиомеры Ia (R-энантиомер) и Ib (S-энантиомер). Чистые энантиомеры Ia и Ib можно получить разделением на хиральной колонке. Энантомеры Ia и Ib также можно разделить путем перевода их в соли аминов и последующей фракционной перекристаллизацией. Кроме того, энантиомеры Ia и Ib можно получить путем кинетического разжеления рацемата соответствующих эфиров с помощью липаз, например Amanolipase Ak, Amano lipase PC, Amano lipase A, Amano lipase M, Amano lipase F-15, Amano lipase G (производства Biocatalytics Inc.) в водных и органических растворителях, например водных смесях с tбутиловым эфиром или тритоном Х-100. Альтернативно, соединения формул Ia и Ib можно получить путем хирального синтеза. Соединения формул Ia или Ib можно получить из хиральных фенольных соединений IVa и IVb, как описано выше. Хиральные соединения IVa и IVb можно получить путем удаления хиральных вспомогательных групп и последующей этерификации из соединений XIIIa и XIIIb соответственно с гидроксидом лития и пероксидом водорода в водном растворе ТГФ и последующей этерификации. Соединения XIIIa и XIIIb можно получить путем дебензилирования соединений XIVa и XIVb соответственно с помощью гидрогенизации в спиртовом растворителе, например MeOH или EtOH, в присутствии Pd-C. Соединения формул XIVa и XIVb можно получить алкилированием соединений XVa и XVb соответствующим алкилбромидом, например втор-бутилбромидом или втор-бутенилбромидом. Воздействие на соединения XVa и XVb в ТГФ или другом апротонном растворителе основанием, например лития бис(триметилсилил)амидом, натрия бис-(триметилсилил)амидом или лития диизопропиламидом при -78C с последующим добавлением электрофильных соединений, втор-бутилбромида или втор-бутинилбромида позволяет получить алкилированные соединения XIVa и XIVb соответственно. Соединения XVa и XVb можно получить из промежуточных продуктов XVI путем сочетания с Rизомером 4-бензилоксазолидин-она XVIIa или S-изомером 4-бензилоксазолидин-она XVIIb по методике Эванса. Промежуточные продукты XVI можно получить путем реакции с пивалоилхлоридом, оксалилхлоридом или изопропилхлороформатом в ТГФ в присутствии основания, например триэтиламина илиN-метилморфолина, для получения смешанных ангидридов или кислых хлоридов, которые затем реагируют с солями лития XVIIa или XVIIb в ТГФ. Альтернативно, можно использовать другие хиральные вспомогательные группы для хирального синтеза соединений IVa и IVb, например псевдоэфедрин в условиях Майерса (J. Am. Chem. Soc. 1994,116, 9361-9362). Например, взаимодействие хлоропроизводных или ангидридов карбоновых кислот или с(+) или (-) псевдоэфедрином дает соединения XVIIIa и XVIIIb. Затем амиды обрабатываются сильным основанием, например лития диизопропиламидом в присутствии лития хлорида, с последующим добавлением алкилирующего агента для получения алкилированных продуктов XIXa и XIXb. Хиральные фенольные соединения IVa и IVb можно получить также из соединений XIXa и XIXb путем удаления хиральной вспомогательной группы псевдоэфедрина в водном растворе серной кислоты и последующей обработки BBr3/DCM для удаления защитной бензильной группы. Кроме того, хиральные соединения XIIIa, XIIIb, XXa и XXb могут служить как хиральные промежуточные продукты для получения хиральных соединений формул Ia и Ib. Хиральные вспомогательные группы удаляются на конечной стадии синтеза в условиях, описанных выше. Соединения XXIa и XXIb можно получить из хиральных фенольных соединений XIIIa и XIIIb в условиях, подобных вышеописанным. Например, трифлаты XXIIa и XXIIb, полученные из фенольных соединений XIIIa и XIIIb путем реакции с трифторметилсульфониловым ангидридом в растворе пиридинметиленхлорида, могут дать сочетающиеся соединения XXIa и XXIb в условиях Buckwald или Hartwig,как описано выше. В сходных условиях, соединения XXIIIa и XXIIIb можно получить из соединений XXIIa и XXIIb путем реакции с бензофенонимином в присутствии трифенилфосфина и каталитической концентрации тетракистрифенилфосфина палладия(0), как упоминалось ранее. Восстановительное аминирование соединений XXIIIa и XXIIIb с ароматическими карбоксиальдегидами или гетероарилкарбоксиальдегидами с последующим алкилированием азота путем восстановительного аминирования или взаимодействия с галогенопроизводными алкилов и последующего удаления хиральных вспомогательных групп в реакции с гидроксидом лития и пероксидом водорода в водном растворе ТГФ позволяет получить хиральные соединения Ia и Ib. Кроме того, соединения XXIVa и XXIVb можно получить из XXIIa и XXIIb, как описывалось ранее,с помощью цианида цинка и тетракис(трифенилфосфин)палладия и последующего окисления цианосоединений оксидом платины в кислой спиртовой среде. Хиральные аминовые соединения XXIVa иXXIVb можно использовать для получения окончательных соединений формул I, Ia и Ib таким же путем,как описано ранее. Методики синтеза. Все реакции проводили в инертной атмосфере, если не указано иное. ЯМР-спектры получали с помощью прибора Bruker dpx400, ЖХ-МС проводили с помощью системы Agilent 1100 с колонкой ZORBAX SB-C18, 4,675 мм, 3,5 мкм, для метода А. Скорость протекания через колонку была 1 мл/мин, в качестве растворителей использовали воду и ацетонитрил (1% трифторуксусной кислоты), объем ввода 10 мкл. Длины волн были 254 и 210 нм. Методы описаны ниже Смесь (3,5-дигидроксифенил)уксусной кислоты метилового эфира (Aldrich, 70 г, 0,385 моль), бензилбромида (137 мл, 1,16 моль), калия карбоната (160 г, 1,16 моль) и ДМФ (1,5 л) под слоем N2 механически перемешивали в течение ночи при комнатной температуре. Полученную реакционную смесь вливали в 1,5 л ледяной воды при перемешивании. Осадок отделяли фильтрованием и промывали гептаном для удаления бензилбромида и получения указанного в заголовке соединения (123,7 г) в форме коричневого твердого вещества, которое высушивали на воздухе для следующей реакции. 1 Раствор (3,5-бис-бензилоксифенил)уксусной кислоты метилового эфира (50 г, 1,38 моль) и NaOH(6,6 г, 1,65 моль) в 1 л EtOH в присутствии 10% Pd-C гидрогенизировали во встряхивателе Парра до потребления одного эквивалента водорода. Смесь подкисляли добавлением концентрированной HCl, а за- 29
МПК / Метки
МПК: A61K 31/435, A61K 31/404, C07D 209/08, C07D 215/06, C07C 229/42, A61P 25/28, C07D 213/74, C07D 217/04, C07D 215/38, A61K 31/195, C07C 229/34, C07C 255/58
Метки: gamma;-секретазы, модуляторы
Код ссылки
<a href="https://eas.patents.su/30-18862-modulyatory-gamma-sekretazy.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы γ-секретазы</a>
Предыдущий патент: Насос с автономным питанием для нагретой жидкости, бак для нагрева и хранения жидкости и отопительная система с жидким теплоносителем, где применяется данное оборудование
Следующий патент: Органические соединения
Случайный патент: Стенд и нагрузочное устройство для обкатки и испытания под нагрузкой коробки передач