Daa-пиридин в качестве лиганда периферического бензодиазепинового рецептора для диагностической визуализации и фармацевтического лечения
Номер патента: 18650
Опубликовано: 30.09.2013
Авторы: Генрих Тобиас, Тиле Андреа, Леманн Лутц, Фолльмер Зоня
Формула / Реферат
1. Соединение формулы I
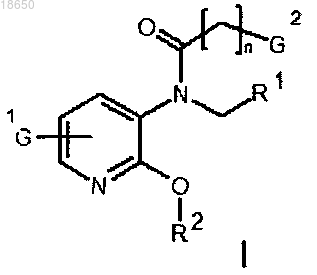
где R1 и R2, независимо и индивидуально, в каждом случае выбирают из группы, включающей (G3)(C6-C12)арил, замещенный (G3)(C6-C12)арил, (G3-(C1-C8)алкил)(C6-C12)арил, (G3-(C1-C8)алкокси)(C6-C12)арил, (G3-(C2-C8)алкинил)(C6-C12)арил, (G3-(C2-C8)алкенил)(C6-C12)арил, замещенный (G3-(C1-C8)алкил)(C6-C12)арил, замещенный (G3-(C1-C8)алкокси)(C6-C12)арил, замещенный (G3-(C2-C8)алкинил)(C6-C12)арил и замещенный (G3-(C2-C8)алкенил)(C6-C12)арил;
G1, G2 и G3, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород и L при условии, что соединения формулы I содержат только один L;
L выбирают из группы, включающей R3, [18F]-фтор и [19F]-фтор;
R3 представляет собой уходящую группу;
n представляет собой целое число от 0 до 6,
включая все изомерные формы указанного соединения, включая, но не ограничиваясь только ими, энантиомеры и диастереоизомеры, а также рацемические смеси, и любая его фармацевтически приемлемая соль, сложный эфир, амид, комплекс или пролекарство, которое обозначает любое ковалентно связанное соединение, которое высвобождает активное исходное фармацевтическое средство в соответствии с формулой I.
2. Соединение в соответствии с п.1, где R3 выбирают из группы, включающей -I+((C6-C12)арил)(Х-), -I+((C5-C14)гетероарил)(Х-), нитро, -N+(Me)3(X-), галоген, в частности хлор, бром и йод, мезилокси, тозилокси, трифторметилсульфонилокси, нонафторбутилсульфонилокси, (4-бромфенил)сульфонилокси, (4-нитрофенил)сульфонилокси, (2-нитрофенил)сульфонилокси, (4-изопропилфенил)сульфонилокси, (2,4,6-триизопропилфенил)сульфонилокси, (2,4,6-триметилфенил)сульфонилокси, (4-трет-бутилфенил)сульфонилокси и (4-метоксифенил)сульфонилокси.
3. Соединение в соответствии с п.2, где X- выбирают из группы, включающей анион неорганической кислоты и анион органической кислоты.
4. Соединение в соответствии с любым из п.3, где X- выбирают из группы, включающей CF3S(O)2O-, C4F9S(O)2O-, CF3COO-, H3CCOO-, анион йодида, анион бромида, анион хлорида, анион перхлората (ClO4-) и анион фосфата.
5. Соединение в соответствии с любым из вышеуказанных пунктов, которое выбирают из группы соединений, включающей
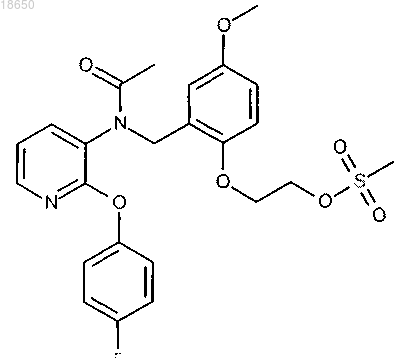
2-[2-({ацетил[2-(4-фторфенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]этил метансульфонат; или
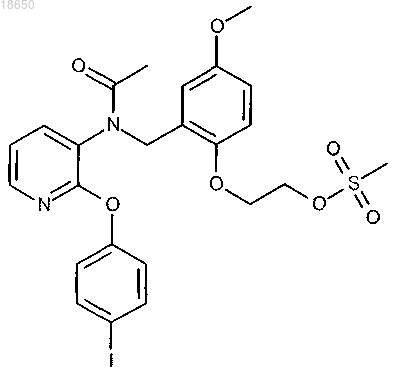
2-[2-({ацетил[2-(4-йодфенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]этил метансульфонат; или
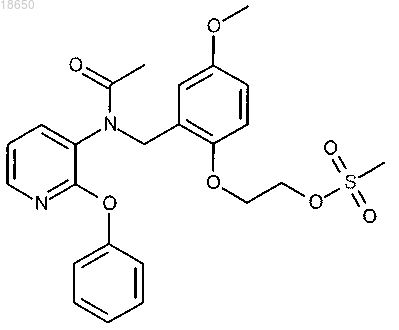
2-(2-{[ацетил(2-феноксипиридин-3-ил)амино]метил}-4-метоксифенокси)этил метансульфонат; или
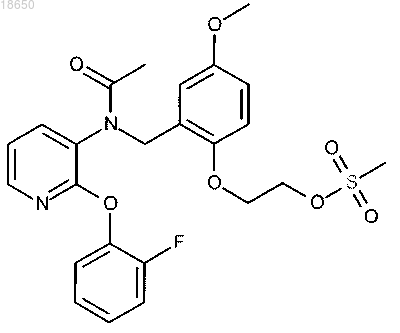
2-[2-({ацетил[2-(2-фторфенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]этил метансульфонат; или
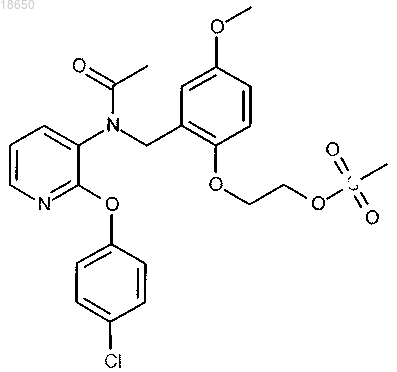
2-[2-({ацетил[2-(4-хлорфенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]этил метансульфонат; или
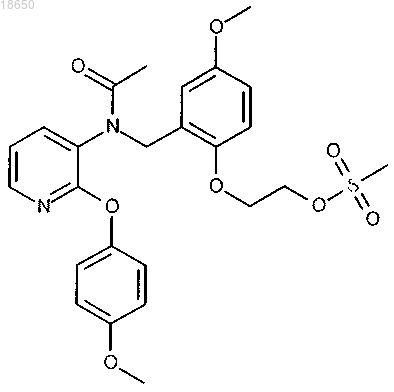
2-[2-({ацетил[2-(4-метоксифенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]этил метансульфонат; или
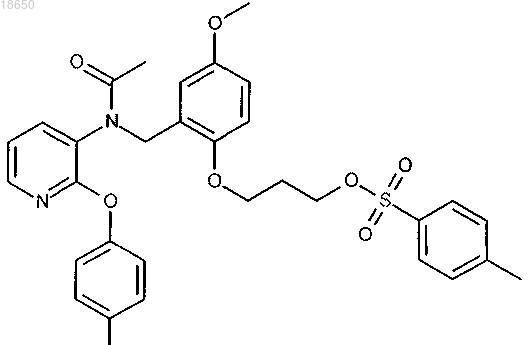
3-[2-({ацетил[2-(4-фторфенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]пропил 4-метилбензолсульфонат; или
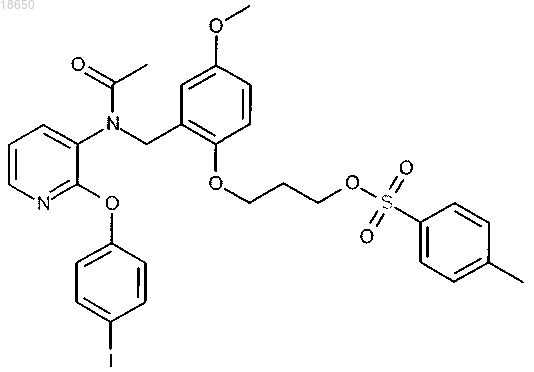
3-[2-({ацетил[2-(4-йодфенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]пропил 4-метилбензолсульфонат; или
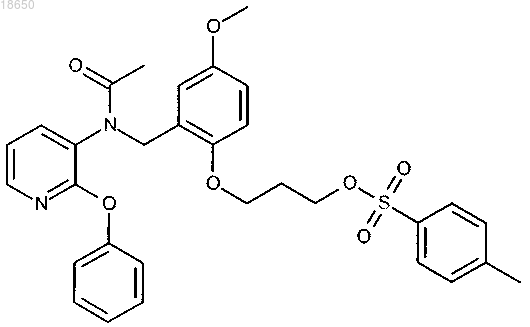
3-[2-({ацетил[2-(фенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]пропил 4-метилбензолсульфонат; или
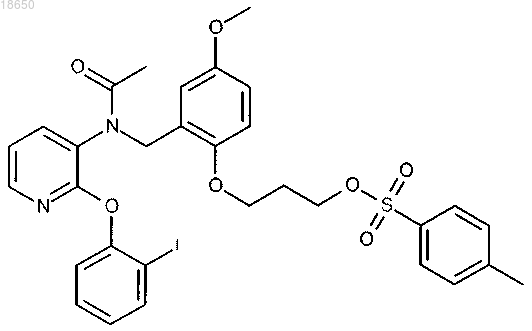
3-[2-({ацетил[2-(2-фторфенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]пропил 4-метилбензолсульфонат; или
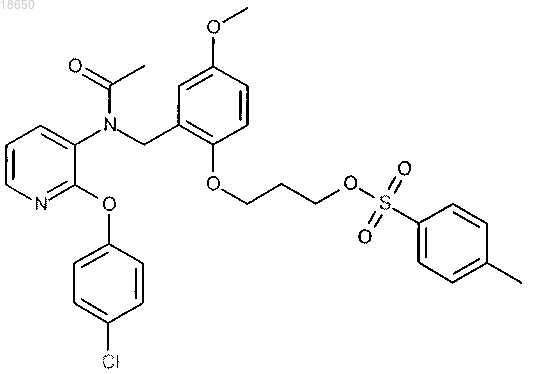
3-[2-({ацетил[2-(4-хлорфенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]пропил 4-метилбензолсульфонат; или

3-[2-({ацетил[2-(4-метоксифенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]пропил 4-метилбензолсульфонат.
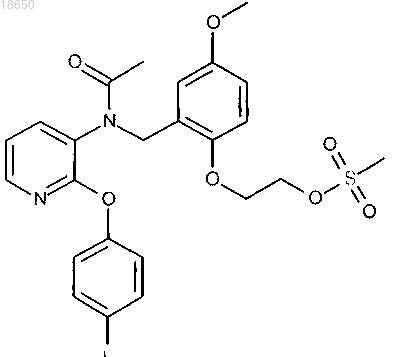
6. Соединение 2-[2-({ацетил[2-(4-фторфенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]этил метансульфонат
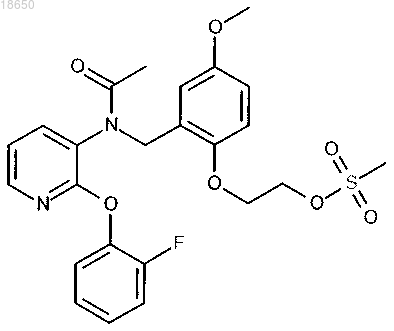
7. Соединение 2-[2-({ацетил[2-(2-фторфенокси)пиридин-3-ил]амино}метил)-4-метоксифенокси]этил метансульфонат
8. Соединение в соответствии с любым из пп.1-4, где L представляет собой [18F]-фтор, или соединение по пп.5, 6 или 7, где мезилоксигруппа и тозилоксигруппа заменены [18F]-фтором.
9. Соединение в соответствии с любым из пп.1-4, где L представляет собой [19F]-фтор, или соединение по пп.5, 6 или 7, где мезилоксигруппа и тозилоксигруппа заменены [19F]-фтором.
10. Способ синтеза соединения, как определено в п.8 или 9, где соединение в соответствии с пп.1-7 подвергают реакции с F-фторирующим средством, где F = 18F или 19F.
11. Способ в соответствии с п.10, где указанное F-фторирующее средство представляет собой соединение, содержащее F-анионы, предпочтительно соединение выбирают из группы, включающей 4,7,13,16,21,24-гексаокса-1,10-диазабицикло[8.8.8]-гексакозан KF, т.е. соль краун-эфира Kryptofix KF, KF, HF, KH F2, CsF, NaF и соли тетраалкиламмония F, такие как N-(бутил)4-F-(фторид тетрабутиламмония), где F = 18F или 19F.
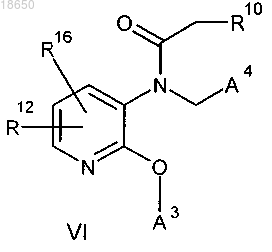
12. Соединение формулы VI
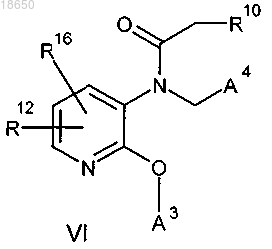
где R10 выбирают из группы, включающей (C1-C6)алкил и водород;
R16 выбирают из группы, включающей водород, галоген, трифторметил, (C1-C5)алкил, (C2-C5)алкинил, (C2-C5)алкенил и (C1-C5)алкокси;
А3 и А4 являются одинаковыми или разными и имеют структуру (R12)(R4)(R5)-фенил;
R12 выбирают из группы, включающей R13 и водород;
R13 представляет собой гидрокси при условии, что соединения формулы VI содержат только один R13;
R4 и R5, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород, галоген, трифторметил, (C1-C5)алкил, (C2-C5)алкинил, (C2-C5)алкенил и (C1-C5)алкокси, включая все изомерные формы указанного соединения, включая, но не ограничиваясь только ими, энантиомеры и диастереоизомеры, а также рацемические смеси, и любая его фармацевтически приемлемая соль, сложный эфир, амид, комплекс или пролекарство, которое обозначает любое ковалентно связанное соединение, которое высвобождает активное исходное фармацевтическое средство в соответствии с формулой VI.
13. Способ синтеза соединения, как определено в п.8 или 9, который включает следующие стадии:
F-фторирование соединения формулы V
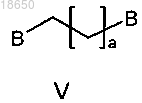
с F-фторирующим средством, получая соединение формулы IV
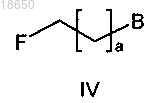
замещение указанного соединения формулы IV с соединением формулы VI
где F представляет собой [18F]-фтор или [19F]-фтор;
а представляет собой целое число от 0 до 5;
В представляет собой уходящую группу;
R10 выбирают из группы, включающей (C1-C6)алкил и водород;
R16 выбирают из группы, включающей водород, галоген, трифторметил, (C1-C5)алкил, (C2-C5)алкинил, (C2-C5)алкенил и (C1-C5)алкокси;
А3 и А4 являются одинаковыми или разными и имеют структуру (R12)(R4)(R5)-фенил;
R12 выбирают из группы, включающей R13 и водород;
R13 представляет собой гидрокси при условии, что соединения формулы VI содержат только один R13;
R4 и R5, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород, галоген, трифторметил, (C1-C5)алкил, (C2-C5)алкинил, (C2-C5)алкенил и (C1-C5)алкокси;
включая все изомерные формы указанного соединения, включая, но не ограничиваясь только ими, энантиомеры и диастереоизомеры, а также рацемические смеси,
и любая его фармацевтически приемлемая соль, сложный эфир, амид, комплекс или пролекарство, которое обозначает любое ковалентно связанное соединение, которое высвобождает активное исходное фармацевтическое средство в соответствии с формулой указанного соединения,
указанное F-фторирующее средство имеет значения, указанные в п. 10;
F = 18F или 19F,
при условии, что если соединения формулы VI содержат только один R12, то он представляет собой гидроксил.
14. Способ в соответствии с п.13, где В выбирают из группы, включающей йод, бром, хлор, мезилокси, тозилокси, трифторметилсульфонилокси и нонафторбутилсульфонилокси.
15. Композиция для лечения и для диагностической визуализации путем позитронно-эмиссионной томографии, содержащая соединение в соответствии с любым из пп.1-9 и 12 и фармацевтически приемлемый носитель или разбавитель.
16. Применение соединения в соответствии с любым из пп.1-9 в качестве фармацевтического или диагностического средства или визуализирующего средства.
17. Применение композиции в соответствии с п.15 в качестве фармацевтического или диагностического средства или визуализирующего средства.
18. Применение соединения в соответствии с п.8 в качестве диагностического средства или визуализирующего средства, в частности, для заболеваний центральной нервной системы.
19. Применение композиции в соответствии с п.15, где композиция содержит соединение в соответствии с п.8 в качестве диагностического средства или визуализирующего средства, в частности, для заболеваний центральной нервной системы.
20. Набор, включающий запечатанный сосуд, содержащий заранее определенное количество соединения в соответствии с a) пп.5 или 1-4 при условии, что L не представляет собой фтор, b) п.12 или c) формулами V и VI, как определено в любом из пп.12, 13.
21. Способ обнаружения присутствия периферического бензодиазепинового рецептора (транслокаторного белка) в организме пациента, который включает введение в организм пациента обнаруживаемого количества соединения в соответствии с п.8 или композиции в соответствии с п.15, где композиция содержит соединение по п.8, и обнаружение указанного соединения или указанной композиции путем позитронно-эмиссионной томографии.
22. Соединение, выбранное из группы, включающей соединения, которые имеют следующие структуры:
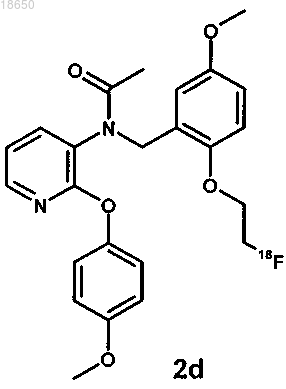
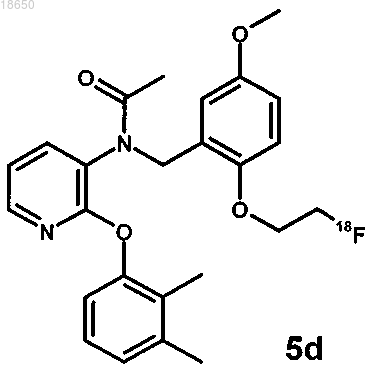
 и
и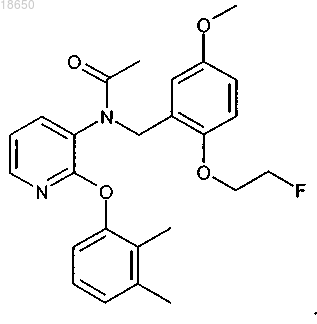
23. Соединение, которое имеет структуру
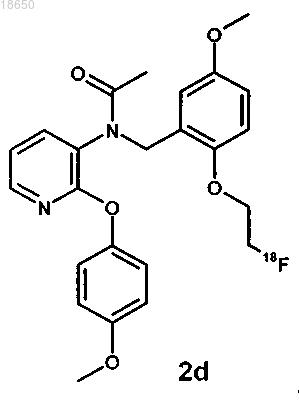
24. Соединение, которое имеет структуру
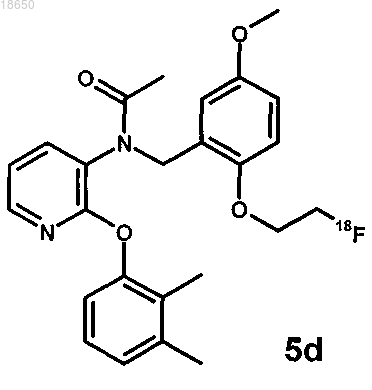
25. Фармацевтическая или диагностическая композиция, содержащая соединение, как определено в п.23 или 24.
26. Набор, включающий запечатанный сосуд, содержащий соединение, как определено в п.23 или 24, или фармацевтическую композицию в соответствии с п.25.
Текст
DAA-ПИРИДИН В КАЧЕСТВЕ ЛИГАНДА ПЕРИФЕРИЧЕСКОГО БЕНЗОДИАЗЕПИНОВОГО РЕЦЕПТОРА ДЛЯ ДИАГНОСТИЧЕСКОЙ ВИЗУАЛИЗАЦИИ И ФАРМАЦЕВТИЧЕСКОГО ЛЕЧЕНИЯ Изобретение относится к новым соединениям, пригодным для введения радиоактивных изотопов или которые уже мечены 18F, способам получения такого соединения, композициям, содержащим такие соединения, наборам, содержащим такие соединения или композиции, и применениям таких соединений, композиций или наборов для лечения и для диагностической визуализации путем позитронно-эмиссионной томографии (PET).(71)(73) Заявитель и патентовладелец: БАЙЕР ШЕРИНГ ФАРМА АКЦИЕНГЕЗЕЛЬШАФТ (DE) Область техники Настоящее изобретение относится к новым соединениям, пригодным для введения радиоактивных изотопов или которые уже мечены 18F, способам получения такого соединения, композициям, содержащим такие соединения, наборам, содержащим такие соединения или композиции, и применениям таких соединений, композиций или наборов для лечения и для диагностической визуализации путем позитронно-эмиссионной томографии (PET). Уровень техники Молекулярная визуализация предоставляет возможности определять прогрессирование заболевания или терапевтическую эффективность раньше, чем большинство общепринятых методов в области онкологии, неврологии и кардиологии. Были разработаны несколько перспективных технологий визуализации, такие как построение оптических изображений, MRI, SPECT и PET; PET представляет чрезвычайный интерес для разработки лекарственных средств в связи с его высокой чувствительностью и способностью предоставлять количественные и кинетические данные. Например, изотопы, эмитирующие позитроны, включают углерод, йод, фтор, азот и кислород. Эти изотопы могут заменять их нерадиоактивные аналоги в целевых соединениях с получением индикаторов,которые действуют биологически и являются химически идентичными оригинальным молекулам дляPET визуализации. Из этих изотопов 18F является наиболее часто используемым изотопом вследствие его относительно долгого периода полураспада (111 мин), что позволяет осуществить приготовление диагностических индикаторов и последующее изучение биохимических процессов. Дополнительно, его низкая + энергия (634 кэВ) также является благоприятной. Нуклеофильная ароматическая и алифатическая реакция [18F]-фтор-фторирования является чрезвычайно важной для меченных [18F]-фтором радиофармацевтических средств, которые используются в условиях in vivo в качестве визуализирующих средств для нацеливания и визуализации заболеваний, например солидных опухолей или заболеваний головного мозга. Чрезвычайно важными техническими задачами при использовании меченных [18F]-фтором радиофармацевтических средств являются быстрое приготовление и введение радиоактивного соединения в связи с тем фактом, что изотопы 18F имеют период полураспада только около 111 мин. Известно несколько методов для введения 18F в ароматическое кольцо (Coenen, Fluorine-18 Labeling(ред.), PET-Chemistry - The Driving Force in Molecular Imaging. Springer, Berlin Heidelberg, p. 15-50). Одним из последних открытий является вытеснение уходящей группы йодония с помощью [18F]-фторида,ср., например, WO 2005/061415 (A1), WO 2005/097713 (A1), WO 2007/010534 (A2), WO 2007/073200 (A1) и WO 2007/141529 (A1). Периферический бензодиазепиновый рецептор (PBR) экспрессируется в большинстве органов, и описано, что его экспрессия повышена в активированной микроглии в головном мозге, которые являются наименьшим типом глиальных клеток, действующих в качестве иммунных клеток центральной нервной системы (ЦНС). Микроглия относится к другим фагоцитным клеткам, включая макрофаги и дендритные клетки. Полагают, что микроглия является чрезвычайно подвижными клетками, которые выполняют различные важные функции в защите нервной системы. Полагают, что они также играют роль в нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, деменция, рассеянный склероз и боковой амиотрофический склероз. Микроглия ответственна за продуцирование воспалительной реакции до инсультов (J. Neuroinflammation, 2004, Jul. 30; 1(1):14.). Чрезвычайно важной задачей является создание эффективного CNS-PET индикатора, фармакокинетика которого в головном мозге оптимизирована. Следовательно, PET лиганд должен поступать в головной мозг в достаточном количестве. После этого большая фракция этих молекул должна сильно связываться с мишенью. После этого те молекулы, которые не были связаны, должны быть удалены из окружающей области ("промывание" из головного мозга) для получения изображения с высоким сигналом по отношению к окружающему фону. Меченная С-11 изотопом версия PK11195 (1 а) широко используется для визуализации в условиях invivo нейровоспаления и PBR, но его сигнал в головном мозге не достаточно интенсивный для стабильного количественного анализа. Кроме того, было показано, что можно разрабатывать более эффективные позитрон-эмитирующие лиганды, такие как [18F]-DPA714 (1.2), [11C]-DAA1106 (2) (например, Eur. J. Pharmacol. 1999 Apr. 29; 371(2006), 47, 43-50), для визуализации PBR: соединения 2 и 3 имеют лучшую связывающую способность к Нерадиоактивная версия соединения 2 заявляется семейством патентов-аналогов, связанным сWO 99/006353, тогда как соединение 3 заявляется семейством патентов-аналогов, связаннымUS 6870069. Недавно было опубликованы новые [18F] и [11 С] меченные PBR лиганды, которые называются [18F]FEPPA, (4) и (5) соответственно (Nuclear Medicine and Biology, 35 (2008), 305-314 и J. Med. Chem. (2008),51, 17-30 соответственно). "[18F]-FEPPA [соединение 4] проявляет умеренное поглощение головным мозгом [стандартизированное значение поглощения (SUV 0,6 через 5 мин)] и медленное вымывание (SUV 0,35 через 60 мин)" (цитируется согласно Nuclear Medicine and Biology, 35 (2008. Таким образом, соединение 4 приводит к получению изображения с относительно низким соотношением сигнал/шум. Производные такого типа также охватываются патентной заявкой WO 2007/060157 и представителями соответствующего семейства патентов-аналогов. Будет являться желательным обеспечить новые 18F-меченые соединения и способы, пригодные для визуализации заболеваний, которые сопровождаются повышенным уровнем PBR рецептора, в особенности обеспечить визуализирующие средства и доступные способы, которые легко осуществлять и которые способны визуализировать определенные уровни PBR рецептора с достаточным соотношением сигнал/фон. Эта задача решается с помощью последующего изобретения (ср. фиг. 1). Настоящее изобретение обеспечивает новые соединения формулы I. Если эти соединения формулыI не являются 18F-мечеными или 19F-мечеными, но вместо этого содержат подходящую уходящую группу, то они являются исходными веществами для синтеза 18F-меченых или 19F-меченых соединений формулы I. 19F-меченые соединения формулы I представляют собой стандартные эталонные соединения (в качестве идентификационных средств и для проверки качества) синтеза для 18F-меченых соединений формулы I. В следующих соединениях формулы I, которые содержат подходящую уходящую группу и не содержат 18F или 19F, также обозначаются как "предшественники соединений, которые имеют формулы I". Кроме того, те соединения формулы I, которые содержат 19F вместо подходящей уходящей группы, также обозначаются как "19F стандартные эталонные соединения, которые имеют формулу I". Кроме того, те соединения формулы I, которые содержат 18F и которые не содержат подходящую уходящую группу, также обозначаются как "18F-меченые соединения формулы I". Изобретение дополнительно обеспечивает способ визуализации заболеваний, способ, который включает введение пациенту обнаруживаемого количества 18F-меченого соединения формулу I или его фармацевтически приемлемой соли, сложного эфира, амида или пролекарства. Изобретение также обеспечивает 18F-меченые или 19F-меченые соединения формулы I для применения в качестве лекарственного средства. Настоящее изобретение также обеспечивает диагностические композиции, содержащие меченные радиоактивным изотопом соединения, предпочтительно 18F-меченые соединения формулы I, и фармацевтически приемлемый носитель или разбавитель. Другим аспектом изобретения является применение соединений формулы I для приготовления лекарственного средства, в частности 18F- или 19F-меченых соединений формулы I. Изобретение также обеспечивает способ синтеза 18F-меченых соединений формулы I из предшественников соединений, которые имеют формулу I. Изобретение также обеспечивает способ синтеза 19F-меченых соединений формулы I из предшественников соединений, которые имеют формулу I. Настоящее изобретение обеспечивает новые соединения формулы VI. Эти соединения служат в качестве предшественников соединений для соединений формулы I путем взаимодействия соединений формулы IV с соединениями формулы VI. Соединения формулы IV могут быть получены путем 18F- илиF-фторирования соединения формулы V. Изобретение также обеспечивает способ синтеза 18F-меченых соединений формулы I путем взаимодействия соединений формулы IV с соединениями формулы VI. Соединения формул IV могут быть получены путем 18F- или 19F-фторирования соединения формулы V. Изобретение также обеспечивает набор для приготовления радиофармацевтического препарата,указанный набор содержит запечатанный сосуд, содержащий заранее определенное количество предшественника соединения, которое имеет формулу I, или соединений формулы V и VI. Настоящее изобретение также обеспечивает набор для визуализации заболеваний. Более специфически, соединения согласно настоящему изобретению пригодны для визуализации заболеваний ЦНС,включая, но не ограничиваясь только ими, воспалительные и аутоиммунные, аллергические, инфекционные и инициированные токсином и инициированные ишемией заболевания, фармакологически инициированное воспаление с патофизиологической значимостью, нейровоспаление, нейродегенеративные заболевания. В другом варианте осуществления соединения согласно настоящему изобретению пригодны для визуализации тканей, в частности опухолей. Примерами воспалительных и аутоиммунных заболеваний являются хронические воспалительные заболевания кишечника (воспалительные заболевания кишечника, болезнь Крона, неспецифический язвенный колит), артрит, атерома, атеросклероз, воспалительная кардиомиопатия, пузырчатка, астма, рассеянный склероз, диабет, инсулинозависимый сахарный диабет I типа, ревматоидный артрит, волчанковые заболевания и другие коллагенозы, болезнь Грейвса,тиреоидит Хашимото, реакция "трансплантат против хозяина" и отторжение трансплантата. Примерами аллергических, инфекционных и инициированных токсином и инициированных ишемией заболеваний являются: саркоидоз, астма, гиперчувствительный пневмонит, сепсис, септический шок, эндотоксиновый бактериально-токсический шок, инфекционно-токсический шок, токсическая печеночная недостаточность, ARDS (острый респираторный дистресс-синдром), эклампсия, кахексия, острые вирусные инфекции (например, мононуклеоз, молниеносный гепатит) и повреждение органа после реперфузии. Примером фармакологически инициированного воспаления с патофизиологической значимостью является"первый эффект дозы" после введения антител к Т-клеткам, таких как OKT3. Примером системных воспалительных реакций, происхождение которых все еще не выяснено, является эклампсия. Примерами нейродегенеративных и нейровоспалительных заболеваний, которые связаны с регуляцией PBR, являются деменция, СПИД-деменция, боковой амиотрофический склероз, энцефалит, невропатическая боль,болезнь Крейтцфельдта-Якоба, болезнь Дауна, болезнь диффузных телец Леви, болезнь Хантингтона,лейкоэнцефалопатия, энцефалопатии, септическая энцефалопатия, гепатическая энцефалопатия, рассеянный склероз, болезнь Паркинсона, болезнь Пика, болезнь Альцгеймера, лобно-височная деменция,гиппокампальный склероз, нейроцистицеркоз, эпилепсия, удар, ишемия, опухоли головного мозга, депрессия, шизофрения, злоупотребление лекарственными средствами. Следовательно, изобретение также относится к применению визуализирущих соединений для диагностики этих заболеваний, а также для стратификации терапии и мониторинга терапии. В предпочтительном варианте осуществления соединения согласно настоящему изобретению пригодны для визуализации рассеянного склероза, болезни Альцгеймера, лобно-височной деменции, деменции с тельцами Леви, лейкоэнцефалопатии, эпилепсии, невропатической боли, бокового амиотрофического склероза, болезни Паркинсона, энцефалопатий, опухолей головного мозга, депрессии, злоупотребления лекарственными средствами, хронических воспалительных заболеваний кишечника, атеромы, атеросклероза, артрита, ревматоидного артрита, фармакологически инициированного воспаления, системного воспаления неизвестного происхождения. В более предпочтительном варианте осуществления соединения согласно настоящему изобретению пригодны для визуализации рассеянного склероза, болезни Альцгеймера, бокового амиотрофического склероза, болезни Паркинсона, лейкоэнцефалопатии, энцефалопатий, эпилепсии, опухолей головного мозга, злоупотребления лекарственными средствами, хронических воспалительных заболеваний кишечника, атеромы, ревматоидного артрита, фармакологически инициированного воспаления и системного воспаления неизвестного происхождения. В JP 2000-001476 рассмотрены соединения, сходные с описанными в настоящем изобретении, и их применение для лечения заболеваний. Подробное описание изобретения В первом аспекте настоящее изобретение относится к соединениям формулы I где R1 и R2, независимо и индивидуально, в каждом случае выбирают из группы,включающей (G3)арил, замещенный (G3)арил, (G3-(C1-C8)алкил)арил, (G3-(C1-C8)алкокси)арил,-3 018650G1, G2 и G3, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород и L, при условии, что соединения формулы I содержат только один L;R3 представляет собой уходящую группу;n представляет собой целое число от 0 до 6, предпочтительно от 0 до 2, более предпочтительно от 0 до 1, еще более предпочтительно 1; включая все изомерные формы указанного соединения, включая, но не ограничиваясь только ими,энантиомеры и диастереоизомеры, а также рацемические смеси,и любая его фармацевтически приемлемая соль, сложный эфир, амид, комплекс или пролекарство. В предпочтительном варианте осуществления R1 и R2 в формуле I, независимо и индивидуально, в каждом случае выбирают из группы, включающей (G3)фенил, (G3-(C1-C5)алкил)фенил,(G3-(C1-C5)алкокси)фенил, (G3-(C2-C5)алкинил)фенил, (G3-(C2-C5)алкенил)фенил, замещенный (G3)фенил,замещенный(G -(C2-C5)алкинил)фенил и замещенный (G -(C2-C5)алкенил)фенил; в более предпочтительном варианте осуществления R1 и R2 в формуле I, независимо и индивидуально, в каждом случае выбирают из группы, включающей (R4)(R5)(G3)фенил,(R4)(R5)(G3-(C1-C4)алкил)фенил, (R4)(R5)(G3-(C1-C4)алкокси)фенил, (R4)(R5)(G3-(C2-C4)алкенил)фенил и(R4)(R5)(G3-(C2-C4)алкинил)фенил; в еще более предпочтительном варианте осуществления R1 и R2 в формуле I, независимо и индивидуально, в каждом случае выбирают из группы, включающей (R4)(R5)(G3)фенил,(R4)(R5)(G3-(C2-C3)алкил)фенил и (R4)(R5)(G3-(C2-C3)алкокси)фенил; в наиболее предпочтительном варианте осуществления R1 и R2 в формуле I, независимо и индивидуально, в каждом случае выбирают из группы, включающей (R4)(R5)(G3)фенил и(R4)(R5)(G3-(C2-C3)алкокси)фенил; где R4 и R5, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород, галоген, трифторметил, (C1-C5)алкил, (C2-C5)алкинил, (C2-C5)алкенил и (C1-C5)алкокси; в предпочтительном варианте осуществления R4 и R5, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород, фтор, хлор, метил, метокси и трифторметил; в еще более предпочтительном варианте осуществления R4 и R5, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород, фтор, метил и метокси; в предпочтительном варианте осуществления R6 выбирают из группы, включающей водород, фтор,хлор, метил, метокси и трифторметил; в более предпочтительном варианте осуществления R6 выбирают из группы, включающей водород,фтор хлор и метил; в еще более предпочтительном варианте осуществления R6 выбирают из группы, включающей водород и хлор; в наиболее предпочтительном варианте осуществления R6 представляет собой водород; в одном варианте осуществления L представляет собой [18F]-фтор; в одном варианте осуществления L представляет собой [19F]-фтор; в одном варианте осуществления L представляет собой R3; в предпочтительном варианте осуществления R3 выбирают из группы, включающей -I+(арил)(Х-),+-I (гетероарил)(Х-), нитро, -N+(Me)3(X-), галоген, в частности хлор, бром и йод, мезилокси,тозилокси, трифторметилсульфонилокси, нонафторбутилсульфонилокси, (4-бромфенил)сульфонилокси,(4-нитрофенил)сульфонилокси, (2-нитрофенил)сульфонилокси, (4-изопропилфенил)сульфонилокси,(2,4,6-триизопропилфенил)сульфонилокси, (2,4,6-триметилфенил)сульфонилокси, (4-трет-бутилфенил)сульфонилокси и (4-метоксифенил)сульфонилокси; в более предпочтительном варианте осуществления R3 выбирают из группы, включающей нитро,+-N (Me)3(X-), галоген, в частности хлор, бром и йод, мезилокси, тозилокси, трифторметилсульфонилокси,нонафторбутилсульфонилокси,(4-бромфенил)сульфонилокси,(4-нитрофенил)сульфонилокси,(2-нитрофенил)сульфонилокси, (4-изопропенил)сульфонилокси, (2,4,6-триизопропилфенил)сульфонилокси, (2,4,6-триметилфенил)сульфонилокси, (4-трет-бутил-фенил)сульфонилокси и (4-метоксифенил)сульфонилокси; в еще более предпочтительном варианте осуществления R3 выбирают из группы, включающей нитро, -N+(Me)3(X-), хлор, бром, мезилокси и тозилокси; где X- выбирают из группы, включающей анион неорганической кислоты и анион органической кислоты; в предпочтительном варианте осуществления X- выбирают из группы, включающей CF3S(O)2O-,C4F9S(O)2O-, CF3COO-, H3CCOO-, анион йодида, анион бромида, анион хлорида, анион перхлората(CLO4-) и анион фосфата; в еще более предпочтительном варианте осуществления X- выбирают из группы, включающейCF3S(O)2O- C4F9S(O)2O-, анион йодида, анион бромида и CF3COO-. Термин "анион неорганической или органической кислоты", как используется в настоящем описании, относится к соответствующему основанию минеральных кислот, включая, но не ограничиваясь только ими, кислоты, такие как угольная, азотная или серная кислота, хлористый водород, бромистый водород, йодистый водород, фосфорная кислота, перхлорная кислота, или к соответствующему основанию подходящих органических кислот, которые включают, но не ограничиваясь только ими, кислоты,такие как алифатические, циклоалифатические, ароматические, аралифатические и гетероциклические карбоновые и сульфоновые кислоты, примерами которых являются муравьиная, уксусная, трифторуксусная, пропионовая, янтарная, гликолевая, глюконовая, молочная, яблочная, фумаровая, пировиноградная, бензойная, аминобензойная, мезиловая, салициловая, фенилуксусная, миндальная, эмбоновая, метансульфоновая,этансульфоновая,бензолсульфоновая,пантотеновая,толуолсульфоновая,1,1,2,2,3,3,4,4,4-нонафторбутан-1-сульфоновая кислота и сульфаниловая кислота. Термин "соответствующее основание", как используется в настоящем описании, относится к сопряженному основанию, которое получается после отщепления протона от кислоты. В одном варианте осуществления общей формулы I L представляет собой R3; они представляют собой вышеуказанные "предшественники соединений". Предпочтительные "предшественники соединений, которые имеют формулы I", представляют собой В другом варианте осуществления общей формулы I L представляет собой [18F]-фтор, они представляют собой 18F-меченые соединения, которые имеют формулу I.-9 018650 Предпочтительные "18F-меченые соединения, которые имеют формулу I", представляют собой В еще другом варианте осуществления общей формулы I L представляет собой [19F]-фтор, они представляют собой вышеуказанные "стандартные эталонные соединения, которые имеют формулу I". Предпочтительные "стандартные эталонные соединения, которые имеют формулу I", представляют собойR3 представляет собой уходящую группу, которая известна или очевидна для специалиста в данной области техники, включая, но не ограничиваясь только ими, те, которые описаны или указаны в SynthesisP.A., Friebe M., Lehmann L., (ред.), PET-Chemistry - The Driving Force in Molecular Imaging. Springer,Berlin Heidelberg, c. 15-50, подробно: схема 4, c. 25, схема 5, с. 28, табл. 4, с. 30, фиг. 7, c. 33). Следует принять во внимание, что в любом месте в настоящем описании при употреблении терминов "арил", "гетероарил" или любого другого термина, относящегося к ароматической системе, это также охватывает возможность, что такая ароматическая система замещена или несколькими подходящими заместителями, такими как ОН, галоген, (C1-C6)алкил, CF3, CN, (C1-C6)алкенил, (C1-C6)алкинил,(C1-C6)алкокси, NH2, NO2, S(O)2OH, -S(O)2NH2 и др. Термин "арил", как используется в настоящем описании, отдельно или в виде части другой группы,относится к моноциклическим или бициклическим ароматическим группам, содержащим от 6 до 12 углеродов в кольцевой части, предпочтительно 6-10 углеродов в кольцевой части, таким как фенил, нафтил или тетрагидронафтил, которые сами могут быть замещены одним, двумя или тремя заместителями, независимо и индивидуально выбранными из группы,включающей галоген,нитро,C1-C6)алкил)карбонил, циано, нитрил, гидроксил, трифторметил, C1-C6)алкил)сульфонил, (C1C6)алкил, (C1-C6)алкокси и (C1-C6)алкилсульфанил. Как указано выше, такой "арил" дополнительно может быть замещен одним или несколькими заместителями. Термин "гетероарил", как используется в настоящем описании, относится к группам, имеющим от 5 до 14 кольцевых атомов; 6, 10 или 14 электронов, общих в циклической структуре, и содержащим атомы углерода (которые могут быть замещены галогеном, нитро, (C1-C6)карбонилом, циано, нитрилом,трифторметилом, (C1-C6)сульфонилом, (C1-C6)алкилом, (C1-C6)алкокси или (C1-C6)сульфанилом) и 1, 2, 3 или 4 гетероатома кислорода, азота или серы (где примерами таких гетероарильных групп являются тиенильная, бензо[b]тиенильная, нафто[2,3-b]тиенильная, тиантренильная, фурильная, фуранильная, пиранильная, изобензофуранильная, бензоксазолильная, хроменильная, ксантенильная, феноксатиинильная,2 Н-пирролильная, пирролильная, имидазолильная, пиразолильная, пиридильная, пиразинильная, пиримидинильная, пиридазинильная, индолизинильная, изоиндолильная, 3 Н-индолильная, индолильная, индазолильная, пуринильная, 4 Н-хинолизинильная, изохинолильная, хинолильная, фталазинильная, нафтиридинильная, хиназолинильная, циннолинильная, птеридинильная, 4 аН-карбазолильная, карбазолильная,карболинильная, фенантридинильная, акридинильная, перимидинильная, фенантролинильная, феназинильная, изотиазолильная, фенотиазинильная, изоксазолильная, фуразанильная и феноксазинильная группы). Гетероарил может быть замещен одним, двумя или тремя заместителями, независимо и индивидуально выбранными из группы, включающей галоген, нитро, C1-C6)алкил)карбонил, циано, нитрил, гидроксил, трифторметил, C1-C6)алкил)сульфонил, (C1-C6)алкил, (C1-C6)алкенил, (C1-C6)алкинил,(C1-C6)алкокси и (C1-C6)сульфанил. Как указано выше, такой гетероарил дополнительно может быть замещен одним или несколькими заместителями. Как используется далее в описании и в пунктах формулы, термин "алкил", самостоятельно или в виде части другой группы, относится к неразветвленной или разветвленной алкильной группе с 1-10 атомами углерода, такой как, например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил,пентил, изопентил, неопентил, гептил, гексил, децил. Алкильные группы также могут быть замещены,например, атомами галогена, гидроксильными группами, C1-C4-алкоксигруппами или C6-C12-арильными группами (которые, в свою очередь, также могут быть замещены, например, 1-3 атомами галогена). Более предпочтительно алкил представляет собой C1-C10-алкил, C1-C6-алкил или C1-C4-алкил. Как используется далее в описании и в пунктах формулы, термин "алкенил" и "алкинил" определяются аналогично алкилу, но содержат по меньшей мере одну углерод-углеродную двойную или тройную связь соответственно. Как используется далее в описании и в пунктах формулы, термин "алкокси (или алкилокси)" относится к алкильным группам, соответственно связанным с помощью атома кислорода, где алкильная часть имеет значения, указанные выше. Как используется в описании и в пунктах формулы, заместитель G3, которые имеет значения, указанные выше, и является частью заместителей "алкил", "алкенил", "алкинил" и "алкокси", может быть присоединен с помощью любого атома углерода соответствующего заместителя "алкила", "алкенила","алкинила" и "алкокси". Таким образом, например, термин "(G3-(C1-C8)алкокси)арил" должен включать различные возможности относительно позиционной изомерии, например (G3-CH2-CH2-CH2-CH2-CH2CH2-CH2-CH2-О-)арил, (CH3-CH2-CH2-CH(G3)-CH2-CH2-CH2-CH2-О-)арил и (CH(-CH2-CH2-G3)(-CH2CH3)-CH2-CH2-CH2-O-)арил и т.д. Когда используется термин "замещенный", то это указывает на то, что один или несколько атомов водорода в атоме, указанном в выражении "замещенный", заменен группой, выбранной из указанной группы, при условии, что не превышается нормальная валентность указанного атома, и что замещение приводит к химически стабильного соединения, т.е. соединения, которое достаточно стабильное для выдерживания выделения в пригодной степени чистоты из реакционной смеси, и препарата в фармацевтическую композицию. Замещающие группы могут быть выбраны из атомов галогена (фтор, хлор, бром,йод), гидроксильных групп, -SO3H, нитро, C1-C6)алкил)карбонила, циано, нитрила, трифторметила,C1-C6)алкил)сульфонила, (C1-C6)алкила, (C2-C6)алкенила, (C1-C6)алкинила, (C1-C6)алкокси и(C1-C6)сульфанила. Во втором аспекте изобретения обеспечиваются 18F-меченые соединения формулы I и 19F стандартные эталонные соединения формулы I в качестве лекарственного средства или фармацевтического средства.- 18018650 Изобретение также относится к применению 18F-меченых соединений формулы I и 19F стандартных эталонных соединений формулы I для приготовления лекарственного средства или фармацевтического средства для лечения. В более предпочтительном варианте осуществления применение охватывает лечение заболевания ЦНС. Заболевания ЦНС включают, но не ограничиваясь только ими, воспалительные и аутоиммунные,аллергические, инфекционные и инициированные токсином и инициированные ишемией заболевания,фармакологически инициированное воспаление с патофизиологической значимостью, нейровоспаление,и нейродегенеративные заболевания. Более предпочтительно заболевание ЦНС выбирают из рассеянного склероза, болезни Альцгеймера, лобно-височной деменции, деменции с тельцами Леви, лейкоэнцефалопатии, эпилепсии, невропатической боли, бокового амиотрофического склероза, болезни Паркинсона,энцефалопатий, опухолей головного мозга, депрессии, злоупотребления лекарственными средствами,хронических воспалительных заболеваний кишечника, атеромы, атеросклероза, артрита, ревматоидного артрита, фармакологически инициированного воспаления, системного воспаления неизвестного происхождения. В одном варианте осуществления заболевание представляет собой ревматоидный артрит. Настоящее изобретение также относится к способу лечения заболевания центральной нервной системы, как определено выше, который включает стадию введения пациенту подходящего количества соединения формулы I, предпочтительно 18F-меченого соединения формулы I или 19F стандартного эталонного соединения формулы I. В третьем аспекте изобретения обеспечиваются 18F-меченые соединения формулы I в качестве диагностического визуализирующего средства или визуализирующего средства, предпочтительно в качестве визуализирующего средства для PET применений. Для специалиста в данной области техники будет очевидно, что соединения формулы I и родственные производные, например соединение формулы I, гдеL = йод (например, I-123) пригодны в качестве визуализирующих средств для SPECT применений. Изобретение также относится к применению 18F-меченых соединений формулы I для приготовления визуализирующего средства. В более предпочтительном варианте осуществления применение охватывает визуализацию заболеваний ЦНС. Заболевания ЦНС включают, но не ограничиваясь только ими,воспалительные и аутоиммунные, аллергические, инфекционные и инициированные токсином и инициированные ишемией заболевания, фармакологически инициированное воспаление с патофизиологической значимостью, нейровоспаление и нейродегенеративные заболевания. Более предпочтительно заболевание ЦНС выбирают из рассеянного склероза, болезни Альцгеймера, лобно-височной деменции, деменции с тельцами Леви, лейкоэнцефалопатии, эпилепсии, невропатической боли, бокового амиотрофического склероза, болезни Паркинсона, энцефалопатий опухолей головного мозга, депрессии, злоупотребления лекарственными средствами, хронических воспалительных заболеваний кишечника, атеромы, атеросклероза, артрита, ревматоидного артрита, фармакологически инициированного воспаления, системного воспаления неизвестного происхождения. Настоящее изобретение также относится к способу визуализации, который включает стадию введения пациенту обнаруживаемого количества 18F-меченого соединения формулы I и визуализации указанного пациента. Было обнаружено, что соединения формулы I проявляют хорошее начальное поглощение головным мозгом и хорошую элиминацию в более поздние промежутки времени. Этот факт выражается соотношением поглощения головным мозгом у мышей в течение от 2 до 30 мин (процент поглощения инъецированной дозы на 1 г ткани (% ID/г. Более высокое соотношение обозначает лучшее соотношение сигнала к фону. Таким образом, например, соединение 21 имеет более высокое соотношение 4,85 по сравнению,например, с FEDAA (3), которое проявляет соотношение 2,00 и DPA-714 (1.2), проявляя соотношение 2,43 (ср. фиг. 2). В четвертом аспекте изобретения обеспечиваются фармацевтические композиции, которые содержат соединение в соответствии с формулой I, предпочтительно 18F-меченые соединения формулы I, или 19F стандартные эталонные соединения формулы I, или их фармацевтически приемлемую соль неоргани- 19018650 ческой или органической кислоты, их гидрат, комплекс, сложный эфир, амид, сольват или пролекарство. Предпочтительно фармацевтическая композиция содержит физиологически приемлемый носитель, разбавитель, адъювант или наполнитель. В предпочтительном варианте осуществления фармацевтические композиции в соответствии с настоящим изобретением содержат соединение формулы I, которое представляет собой его фармацевтически приемлемую соль, гидрат, комплекс, сложный эфир, амид, сольват или пролекарство. Как используется далее в описании и в пунктах формулы, термины "неорганическая кислота" и "органическая кислота", относятся к минеральным кислотам, включая, но не ограничиваясь только ими, кислоты, такие как угольная, азотная, соляная, бромисто-водородная, йодисто-водородная, фосфорная кислота, перхлорная, перхлорная или серная кислота или их кислые соли, такие как гидросульфат калия,или к подходящим органическим кислотам, которые включают, но не ограничиваясь только ими, такие кислоты, как алифатические, циклоалифатические, ароматические, аралифатические, гетероциклические,карбоновые и сульфоновые кислоты, примерами которых являются муравьиная, уксусная, трифторуксусная, пропионовая, янтарная, гликолевая, глюконовая, молочная, яблочная, фумаровая, пировиноградная, бензойная, аминобензойная, мезиловая, салициловая, фенилуксусная, миндальная, эмбоновая, метансульфоновая, этансульфоновая, бензолсульфоновая, пантотеновая, толуолсульфоновая, трифторметансульфоновая, 1,1,2,2,3,3,4,4,4-нонафторбутан-1-сульфоновая кислота и сульфаниловая кислота соответственно. В пятом аспекте изобретения обеспечивается радиофармацевтическая композиция, которая содержит 18F-меченое соединение формулы I или его фармацевтически приемлемую соль неорганической или органической кислоты, его гидрат, комплекс, сложный эфир, амид, сольват или пролекарство. Предпочтительно фармацевтическая композиция содержит физиологически приемлемый носитель,разбавитель, адъювант или наполнитель. Соединения в соответствии с настоящим изобретением, предпочтительно соединения, меченные радиоактивным изотопом в соответствии с формулой I, которые обеспечиваются изобретением, могут вводиться внутривенно в любом фармацевтически приемлемом носителе, например общепринятой среде,такой как водная солевая среда, или в среде плазмы крови, в виде фармацевтической композиции для внутривенной инъекции. Такая среда также может содержать общепринятые фармацевтические материалы, такие как, например, фармацевтически приемлемые соли для доведения осмотического давления,буферы, консерванты и др. Из них предпочтительной средой является физиологический солевой раствор и плазма. Подходящие фармацевтически приемлемые носители известны специалисту в данной области техники. В этом отношении можно указать ссылку, например, на Remington's Practice of Pharmacy, 13-e изд. и в J. of Pharmaceutical ScienceTechnology, vol. 52, 5, sept.-oct., p. 238-311, включенная в настоящее изобретение путем ссылки. Концентрация соединений формулы I, предпочтительно 18F-меченого соединения в соответствии с настоящим изобретением и фармацевтически приемлемого носителя, например в водной среде, отличается в зависимости от конкретной области применения. Достаточное количество присутствует в фармацевтически приемлемом носителе, если достигается удовлетворительная визуализация обнаруживаемой мишени (например, PBR (транслокатор, или воспаленный участок, или опухоль). Соединения в соответствии с настоящим изобретением, в частности 18F-радиоактивно меченые соединения в соответствии с настоящим изобретением, т.е. 18F-меченые соединения формулы I, которые обеспечиваются изобретением, могут вводиться внутривенно в любом фармацевтически приемлемом носителе, например общепринятой среде, такой как водная солевая среда, или в среде плазмы крови, в виде фармацевтической композиции для внутривенной инъекции. Такая среда также может содержать общепринятые фармацевтические материалы, такие как, например, фармацевтически приемлемые соли для доведения осмотического давления, буферы, консерванты и др. Из них предпочтительной средой является изотонический солевой раствор и плазма. Подходящие фармацевтически приемлемые носители известны специалистам в данной области техники. В этом отношении можно указать ссылку, например,Remington's Practice of Pharmacy, 11-е изд. и в J. of Pharmaceutical ScienceTechnology, vol. 52, 5, sept.oct., p. 238-311.x В соответствии с изобретением соединения, меченные радиоактивным изотопом, которые имеют общую химическую формулу I, либо в виде нейтральной композиции, либо в виде соли с фармацевтически приемлемым противоионом вводят в дозированной форме для инъекции для однократного введения. Для приготовления раствора для инъекции после радиоактивного мечения можно использовать любые общепринятые носители, которые известны специалисту в данной области, такие как стерильный солевой раствор или плазма, для диагностической визуализации различных органов, опухолей и т.д. в соответствии с изобретением. Как правило, доза диагностического средства для однократного введения имеет радиоактивность от приблизительно 0,1 до приблизительно 100 мКи, предпочтительно от 1 до 20 мКи. Для радиотерапевтического средства радиоактивность терапевтической единичной дозы составляет от приблизительно 10 до 700 мКи, предпочтительно от 50 до 400 мКи. Раствор для инъекций в единичной дозе составляет от приблизительно 0,01 до приблизительно 30 мл. Для диагностических целей после внутривенного введения визуализация органа или заболевания в условиях in vivo может происходить в течение нескольких минут. Тем не менее, если это является желательным, то визуализация происходит в течение нескольких часов или даже больше после инъекции пациентам. В большинстве случаев достаточное количество вводимой дозы будет накапливаться в области, подлежащей визуализации, в течение приблизительно 0,1 ч для позволения осуществления сцинтиграфической визуализации. В соответствии с настоящим изобретением для диагностических целей можно использовать любой общепринятый метод сцинтиграфической визуализации. Как используется далее в описании и в пунктах формулы, термин "пролекарство" обозначает любое ковалентно связанное соединение, которое высвобождает активное исходное фармацевтическое средство в соответствии с формулой I, предпочтительно 18F-меченого соединения формулы I. Термин "пролекарство", как используется в тексте данного описания, обозначает фармакологически приемлемые производные, такие как сложные эфиры, амиды и фосфаты, так, что образуемый в условияхin vivo продукт биопревращения производного представляет собой активное лекарственное средство, как определено для соединений формулы I. Документ Goodman и Gilman (The Pharmaco-logical Basis ofTherapeutics, 8 ред., McGraw-HiM, Int. Ed. 1992, "Biotransformation of Drugs", p. 13-15), в котором в общем описаны пролекарства, включен в данное изобретение в качестве ссылки. Пролекарства соединения согласно настоящему изобретению получают путем модификации функциональных групп, присутствующих в соединении, таким образом, что модификации отщепляются, либо путем обычной обработки или в условиях in vivo с образованием исходного соединения. Пролекарства соединений согласно настоящему изобретению включают те соединения, в которых, например, гидроксигруппа, такая как гидроксигруппа на асимметричном атоме углерода, или аминогруппа связана с любой группой таким образом, что при введении пролекарства пациенту она отщепляется с образованием свободной гидроксильной группы или свободной аминогруппы соответственно. Типичные примеры пролекарств описаны, например, вWO 99/33795, WO 99/33815, WO 99/33793 и WO 99/33792, все эти источники включены в описание в качестве ссылки. Пролекарства могут характеризоваться очень хорошей растворимостью в воде, повышенной биодоступностью и легко метаболизируются в активные ингибиторы в условиях in vivo. Для специалиста в данной области техники является очевидным, что реакция радиофторирования соединений формулы I, где L представляет собой R3, могут вызывать образование побочных продуктов и соединений, которые не представлены формулой I. Эти продукты характеризуются обстоятельством, где,например, L представляет собой гидроксил или -N(Me)2, (осуществляется необязательно с реакциями нуклеофильного ароматического замещения) или где, например, L представляет собой гидроксил, где,например, предшественник соединения димеризуется в виде простого эфира или где уходящую группу удаляют, что приводит к получению соответствующего алкена (осуществляется необязательно с реакциями нуклеофильного алифатического замещения). Такие побочные продукты и сходные производные обычно выделяют из реакционной смеси, но они могут все еще присутствовать в определенных количествах в радиофармацевтической композиции, которую вводят пациенту или млекопитающему. В шестом аспекте настоящее изобретение относится к соединениям формулы I, где L представляет собой [19F]-фтор, предпочтительными соединениями формулы I, где L представляет собой [19F]-фтор,являются следующие. Если в соединении в соответствии с настоящим изобретением присутствует хиральный центр или другая форма изомерного центра, то объемом настоящего изобретения охватываются все формы такого стереоизомера, включая энантиомеры и диастереоизомеры. Соединения, содержащие хиральный центр,могут использоваться в качестве рацемической смеси или в качестве энантиомерно обогащенной смеси или рацемическая смесь может быть разделена с помощью хорошо известных методик и отдельный изомер может использоваться самостоятельно. В тех случаях когда соединения имеют ненасыщенные углерод-углеродные двойные связи, то объемом настоящего изобретения охватываются как (Z)-изомер, так и(Е)-изомеры. В тех случаях когда соединения могут существовать в таутомерных формах, таких как кетоенольные таутомеры, то каждая такая таутомерная форма подпадает под объем настоящего изобретения, независимо от того, существуют ли они в равновесии или преобладает одна форма. Если специально не указано иначе, при указании соединений формулы, в настоящем изобретенииper se, а также их любой фармацевтической композиции настоящее изобретение охватывает все гидраты,соли, сольваты, комплексы и пролекарства соединений согласно изобретению. Пролекарства представляют собой любые ковалентно связанные соединения, которые высвобождают активное исходное фармацевтическое средство в соответствии с формулой I. Термин "галоген" относится к фтору (F), хлору (Cl), брому (Br) и йоду (I). В седьмом аспекте настоящее изобретение относится к соединениям формулыR16 выбирают из группы, включающей водород, галоген, трифторметил, (C1-C5)алкил,(C2-C5)алкинил, (C2-C5)алкенил и (C1-C5)алкокси; А 3 и А 4 являются одинаковыми или разными и имеют структуру (R12)(R4)(R5)фенил;R13 представляет собой гидрокси при условии, что соединения формулы VI содержат только один 13R4 и R5, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород,галоген, трифторметил, (C1-C5)алкил, (C2-C5)алкинил, (C2-C5)алкенил и (C1-C5)алкокси; включая все изомерные формы указанного соединения, включая, но не ограничиваясь только ими, энантиомеры и диастереоизомеры, а также рацемические смеси и любую его фармацевтически приемлемую соль, сложный эфир, амид, комплекс или пролекарство. В предпочтительном варианте осуществления R16 выбирают из группы, включающей водород,фтор, хлор, йод, метил, метокси и трифторметил; в более предпочтительном варианте осуществления R16 выбирают из группы, включающей водород,фтор, хлор, йод и метил; в еще более предпочтительном варианте осуществления R16 выбирают из группы, включающей водород и хлор; в наиболее предпочтительном варианте осуществления R16 представляет собой водород; в предпочтительном варианте осуществления R4 и R5, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород, фтор, хлор, метил, метокси и трифторметил; в более предпочтительном варианте осуществления R4 и R5, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород, фтор, метил и метокси; в предпочтительном варианте осуществления R10 выбирают из группы, включающей метил и водород;- 24018650 при условии, что соединения формулы VI содержат только один R12. В восьмом аспекте настоящее изобретение относится к способу получения соединений формулы I,где L представляет собой [18F]-фтор или [19F]-фтор. Неожиданно были идентифицированы два метода получения таких соединений. В первом варианте изобретения предшественник соединения в соответствии с формулой I, где L представляет собой R3, как определено выше, подвергают реакции с F-фторирующим средством. Предпочтительно указанное F-фторирующее средство представляет собой соединение, содержащееF-анионы, предпочтительно соединение, выбранное из группы, включающей 4, 7, 13, 16, 21, 24 гексаокса-1,10-диазабицикло[8.8.8]-гексакозан KF, т.е. соль краун-эфира Kryptofix KF, KF, HF, KHF2,CsF, NaF и соли тетраалкиламмония F, такие как N-(бутил)4-F (фторид тетрабутиламмония), и где F = 18F или 19F. Более специфически, по отношению к 18F-меченым соединениям формулы I первый вариант осуществления способа введения радиоактивного изотопа для получения 18F-меченого соединения формулы I включает стадию 18F-введения радиоактивного изотопа в соединение формулы I, имеющее подходящую уходящую группу с фторирующим средством для получения 18F-меченого соединения формулы I. Термин "введение радиоактивного изотопа" в молекулу, как используется в настоящем описании,обычно относится к введению 18F-атома в молекулу. Фторирующее средство имеет значения, указанные выше, где F = 18F. Во втором варианте осуществления способ синтеза соединений формулы I, где L представляет собой [18F]-фтор или [19F]-фтор, включает следующие стадии: с F-фторирующим средством, получая соединение формулы IV замещение указанного соединения формулы IV с соединением формулы VI где F представляет собой [18F]-фтор или [19F]-фтор; а представляет собой целое число от 0 до 5, предпочтительно от 0 до 2, более предпочтительно от 0 до 1; В представляет собой уходящую группу, предпочтительно галоген, в частности хлор, бром, йод, мезилокси, тозилокси, трифторметилсульфонилокси, нонафторбутилсульфонилокси, (4-бромфенил)сульфонилокси, (4-нитрофенил)сульфонилокси, (2-нитрофенил)сульфонилокси, (4-изопропилфенил)сульфонилокси,(2,4,6-триизопропилфенил)сульфонилокси,(2,4,6-триметилфенил)сульфонилокси,(4-трет-бутилфенил)сульфонилокси и (4-метоксифенил)сульфонилокси;R16 выбирают из группы, включающей водород, галоген, трифторметил, (C1-C5)алкил,(C2-C5)алкинил, (C2-C5)алкенил и (С 1-С 5)алкокси; А 3 и А 4 являются одинаковыми или разными и имеют структуру (R12)(R4)(R5)фенил;R13 представляет собой гидрокси при условии, что соединения формулы VI содержат только один 13R4 и R5, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород,галоген, трифторметил, (C1-C5)алкил, (C2-C5)алкинил, (C2-C5)алкенил и (C1-C5)алкокси; в предпочтительном варианте осуществления R4 и R5, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород, фтор, хлор, метил, метокси и трифторметил; в более предпочтительном варианте осуществления R4 и R5, независимо и индивидуально, в каждом случае выбирают из группы, включающей водород, фтор, метил и метокси; в предпочтительном варианте осуществления R10 выбирают из группы, включающей водород и метил; в предпочтительном варианте осуществления R16 выбирают из группы, включающей водород, фтор,хлор, йод метил, метокси и трифторметил; в более предпочтительном варианте осуществления R16 выбирают из группы, включающей водород,- 25018650 фтор, хлор, йод и метил; в еще более предпочтительном варианте осуществления R16 выбирают из группы, включающей водород и хлор; в наиболее предпочтительном варианте осуществления R16 представляет собой водород; где указанное F-фторирующее средство имеет значения, указанные выше, и F = 18F или 19F,при условии, что соединения формулы VI содержат только один R12. Предпочтительно В выбирают из группы, включающей йод, бром, хлор, мезилокси, тозилокси,трифторметилсульфонилокси и нонафторбутилсульфонилокси. Более специфически, второй вариант осуществления способа введения радиоактивного изотопа для получения 18F-меченого соединения формулы I включает следующие стадии: 18F введение радиоактивной метки в соединение формулы V с фторирующим средством, получая соединение формулы (IV); и замещение соединения формулы IV с соединением формулы VI. 18 или его фармацевтически приемлемые соли неорганической или органической кислоты, его гидраты,комплексы, сложные эфиры, амиды, сольваты или пролекарства,где В представляет собой уходящую группу; уходящая группа В известна или очевидна для специалиста в данной области техники и она представляет собой те группы, но не ограничиваясь только ими, которые описаны или указаны в Synthesis(1982), с. 85-125, табл. 2 (с. 86 (последнее указание в табл. 2 необходимо скорректировать: "n-C4F9S(O)2O-нонафлат" вместо "n-C4H9S(O)2-O-нонафлат"), Carey and Sundberg, Organische Synthese, (1995), с. 279281, табл. 5.8 или Netscher, Recent Res. Dev. Org. Chem., 2003, 7, 71-83, схемы 1, 2, 10 и 15; в более предпочтительном варианте осуществления В выбирают из группы, включающей:g) нонафторбутилсульфонилокси; а представляет собой целое число от 0 до 4, предпочтительно от 0 до 2 и более предпочтительно целое число от 0 до 1. Соединение формулы V представляет собой или его фармацевтически приемлемые соли неорганической или органической кислоты, его гидраты,комплексы, сложные эфиры, амиды, сольваты или пролекарства,где В имеет значения, указанные выше для соединений формулы IV; и а имеет значения, указанные выше для соединений формулы IV; фторирующее средство значений, указанных выше. В предпочтительном варианте осуществления фторирующее средство представляет собой производное радиоактивного изотопа фтора. Более предпочтительно производное радиоактивного изотопа фтора представляет собой 18F производное. Более предпочтительно 18F производное представляет собой 4,7,13,16,21,24-гексаокса-1,10-диазабицикло[8.8.8]гексакозан K18F (соль краун-эфира Kryptofix K18F),K18F, H18F, KH18F2, Cs18F, Na18F или соль тетраалкиламмония 18F (например [18F]-фторид тетрабутиламмония). Более предпочтительно фторирующее средство представляет собой K18F, H18F или KH18F2, наиболее предпочтительно K18F (18F анион фторида). Реакцию радиоактивного фторирования можно осуществлять, например, в обычном реакционном сосуде (например, сосуде Wheaton), который известен для специалиста в данной области техники или в микрореакторе. Реакцию можно нагревать с помощью обычных методов, например с помощью масляной бани, нагревательного блока или микроволнового облучения. Реакции радиоактивного фторирования можно осуществлять в диметилформамиде с карбонатом калия в качестве основания и "Kryptofix" в качестве краун-эфира. Также можно использовать другие растворители, которые известны квалифицированному специалисту в данной области техники. Эти возможные условия включают, но не ограничиваясь только ими, диметилсульфоксид и ацетонитрил в качестве растворителя и тетраалкиламмоний и тетраалкилфосфоний карбонат в качестве основания. В качестве сорастворителя в такой реакции можно использовать воду и/или спирт. Реакции радиоактивного фторирования осуществляют в течение от 1 до 60 мин. Предпочтительные продолжительности реакций составляют от 5 до 50 мин. Дальнейшие предпочтительные продолжительности реакций составляют от 10 до 40 мин. Эти и другие условия для такого радиоактивного фторирования известны специалистам в данной области техники (Coenen,Fluorine-18 Labeling Methods: Features and Possibilities of Basic Reactions (2006), в: Schubiger P.A., FriebeM., Lehmann L., (ред.), PET-Chemistry - The Driving Force in Molecular Imaging. Springer, Berlin Heidelberg,p. 15-50). Радиоактивное фторирование можно осуществлять в "горячей камере" и/или путем применения модуля (обзор: Krasikowa, Synthesis Modules and Automation in F-18 labeling (2006), в: Schubiger P.A.,Friebe M., Lehmann L., (ред.), PET-Chemistry - The Driving Force in Molecular Imaging. Springer, BerlinHeidelberg, p. 289-316), что позволяет осуществить автоматизированный или полуавтоматизированный синтез. Кроме того, изобретение обеспечивает композицию, содержащую соединение в соответствии с настоящим изобретением и фармацевтически приемлемый носитель или разбавитель. В одном варианте осуществления указанное соединение представляет собой 18F-меченое соединение. В другом варианте осуществления указанное соединение представляет собой 19F-меченое соединение. В еще другом варианте осуществления указанное соединение представляет собой предшественник соединения. Изобретение также обеспечивает соединение в соответствии с настоящим изобретением, предпочтительно 18F- или 19F-меченое соединение в соответствии с настоящим изобретением или композицию в соответствии с настоящим изобретением для применения в качестве фармацевтического или диагностического средства или визуализирующего средства. Изобретение также обеспечивает применение соединения в соответствии с настоящим изобретением, предпочтительно 18F- или 19F-меченого соединения в соответствии с настоящим изобретением или композиции в соответствии с настоящим изобретением для приготовления лекарственного средства для лечения, и/или диагностики, и/или визуализации заболеваний центральной нервной системы (ЦНС). Изобретение также обеспечивает 18F-меченое соединение формулы I или композицию, содержащую такое соединение, для применения в качестве диагностического средства или визуализирующего средства, в частности, для заболеваний центральной нервной системы. Изобретение также обеспечивает набор, включающий запечатанный сосуд, содержащий заранее определенное количество соединения: а) которое представляет собой предшественник соединения, которое имеет формулу I, или б) соединения формулы V и соединения формулы VI, как определено выше. Изобретение также обеспечивает способ обнаружения присутствия PBR рецептора (транслокаторного белка) в организме пациента, предпочтительно для визуализации заболевания центральной нервной системы у пациента, который включает введение в организм пациента обнаруживаемого количества 18F-меченого соединения в соответствии с настоящим изобретением или композиции, которая содержит такое соединение; и обнаружение указанного соединения или указанной композиции путем позитронно-эмиссионной томографии (PET). Изобретение также обеспечивает способ лечения заболевания центральной нервной системы, который включает стадию введения пациенту подходящего количества соединения в соответствии с настоящим изобретением, предпочтительно 18F- или 19F-меченого соединения в соответствии с настоящим изобретением. Схема общего синтеза трициклического структурного каркаса, содержащего ароматические кольцевые системы А, В и С, представлена на схеме 1, таким образом, соединения типа Е 1 алкилируют с анионами фенола, получая соединения типа Е 2, тогда как "(N)" представляет собой азотсодержащий заместитель, предпочтительно нитро, и "(X)" представляет собой уходящую группу, например галоген. Заместитель "(N)" превращают в производное анилина Е 3 с помощью методов, которые известны специалистам в данной области техники (например, если "(N)" представляет собой нитро, то реакция гидрирования приводит к желательному соединению Е 3). Реакция восстановительного аминирования с альдегидами типа Е 8 приводит к получению анилинов типа Е 4. Соединения типа Е 3 также могут быть превращены в соединения Е 5 путем реакции амидирования или N-ацетилирования, которые известны специалисту в данной области техники. Соединения типа Е 4 могут быть превращены в амиды типа 6. Но также реакции алкилирования соединений типа Е 5 с алкилирующими средствами типа Е 9, представляющие "С-кольцо", приводят к получению соединений типа Е 6. Существует два подхода для введения 18F метки (и необязательно также соответствующей 19F метки). Например, инсталляцию подходящей уходящей группы можно осуществить путем мезилирования соответствующего спирта (ср. схему 2: (9)(10. Но также реакцию алкилирования небольших 18F-меченых строительных блоков (простетические группы, Е 10) можно использовать для их связывания с нуклеофильной функциональной группой для введения в соединения типа Е 6 (ср. схему 3, (15)(19. На схеме 2 описан предпочтительный пример методов синтеза соединений формулы I. Анилин 6 (J. Med. Chem. (2002), 45, 23, 5182-5185) и альдегид 7 (EP 1894915 A1) превращают в реакции восстановительного аминирования, используя трис-(ацетокси)борогидрид натрия. Последующая реакция ацетилирования неочищенного вторичного анилина приводит к получению желательного продукта 8. Тетрагидропиранильный простой эфир 8 отщепляют в кислотных условиях, используя PPTS в метаноле. Желательный спирт 9 превращают в соответствующий мезилат 10, используя мезилхлорид и триэтил и основание Хьюнига в дихлорметане. При последующем фторировании с KF и Kryptofix получают желательное [18F]-меченое соединение 11. Реакцию радиоактивного фторирования можно осуществлять, например, в типичном реакционном сосуде (например, сосуде Wheaton), который известен специалисту в данной области техники или в микрореакторе. Реакцию можно нагревать с помощью обычных способов, например масляной бани, нагревательного блока или микроволн. Реакции радиоактивного фторирования осуществляют в диметилформамиде с карбонатом калия в качестве основания и"Kryptofix" в качестве краун-эфира. Также можно использовать другие растворители, которые известны специалистам в данной области техники. Эти возможные условия включают, но не ограничиваясь только ими, диметилсульфоксид и ацетонитрил в качестве растворителя и тетраалкиламмоний и тетраалкилфосфоний карбонат в качестве основания. В качестве сорастворителя в такой реакции можно использовать воду и/или спирт. Реакции радиоактивного фторирования осуществляют в течение 1-60 мин. Предпочтительные продолжительности реакций составляют от 5 до 50 мин. Дальнейшие предпочтительные продолжительности реакций составляют от 10 до 40 мин. Эти и другие условия для такого радиоактивного фторирования известны специалистам в данной области техники (Coenen, Fluorine-18 LabelingMethods: Features and Possibilities of Basic Reactions (2006), in: Schubiger P.A., Friebe M., Lehmann L.,(ред.), PET-Chemistry - The Driving Force in Molecular Imaging. Springer, Berlin Heidelberg, p. 15-50). Радиоактивное фторирование можно осуществлять в "горячей камере" и/или путем применения модуля(обзор: Krasikowa, Synthesis Modules and Automation in F-18 labeling (2006), в: Schubiger P.A., Friebe M.,Lehmann L., (ред.), PET-Chemistry - The Driving Force in Molecular Imaging. Springer, Berlin Heidelberg,p. 289-316), что позволяет осуществить автоматизированный или полуавтоматизированный синтез. Другой подход представлен в качестве примера на схеме 3. Анилин 12 (ABCR) и альдегид 13(Bioorg. Med. Chem. Lett. (2007), 2614-2617) подвергают реакции друг с другом с помощью реакции восстановительного аминирования, используя трис-(ацетокси)борогидрид натрия. Последующее ацетилирование неочищенного продукта приводит к получению желательного продукта 14. Бензиловый простой эфир 14 отщепляют с помощью методов, известных специалисту в данной области техники. Используют типичное гетерогенное каталитическое гидрирование с водородом и палладием на угле для получения фенола 15. Фенол 15 можно либо алкилировать с [18F]-фторэтил бромидом (который образуется из 2-бромэтил трифлата (Bioorg. Med. Chem.; 11; 12; 2003; 2519-2528, получая соединение 19. При алкилировании соединения 15 с 2-бензилоксиэтил бромидом, используя карбонат натрия в качестве основания в ацетонитриле, получают соединение 16. Соединение 15 также можно алкилировать с 1-фтор-2 йодэтаном или с 1-бром-2-фторэтаном. Продукт этого превращение представляет собой соответствую- 29
МПК / Метки
МПК: C07D 213/81, A61K 31/44, C07B 59/00
Метки: диагностической, визуализации, бензодиазепинового, daa-пиридин, периферического, лечения, качестве, лиганда, рецептора, фармацевтического
Код ссылки
<a href="https://eas.patents.su/30-18650-daa-piridin-v-kachestve-liganda-perifericheskogo-benzodiazepinovogo-receptora-dlya-diagnosticheskojj-vizualizacii-i-farmacevticheskogo-lecheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Daa-пиридин в качестве лиганда периферического бензодиазепинового рецептора для диагностической визуализации и фармацевтического лечения</a>
Предыдущий патент: Устройство для обработки белья с тепловым насосом
Следующий патент: Способ упаковывания сигарет и система для упаковывания сигарет
Случайный патент: Четвертичные опиоидные карбоксамиды












