Гетероциклические соединения и содержащие их композиции в качестве ингибиторов киназ c-kit и pdgfr
Номер патента: 18551
Опубликовано: 30.08.2013
Авторы: Кьянелли Донателла, Ли Сяолинь, Лю Сяодон, Лорен Джон, Набакка Джульет, Йе Венс, Мольтени Валентина
Формула / Реферат
1. Соединение формулы I или его фармацевтически приемлемая соль
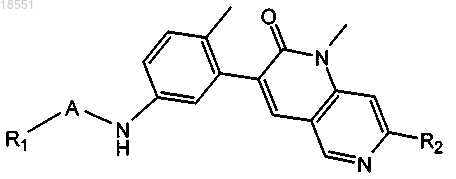
Формула (I)
в которой
R1 выбран из группы, включающей C1-С6-алкил, С3-С6-циклоалкил, 4-6-членный гетероциклоалкил, содержащий 1-2 гетероатома, независимо выбранных из N и О, фенил и 5-9-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N, О и S; где указанный C1-С6-алкил группы R1 необязательно замещен 1-2 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, =N(OH), C1-С4-алкоксигруппу и феноксигруппу, где указанный циклоалкил, гетероциклоалкил, фенил или гетероарил группы R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, цианогруппу, С1-С6-алкил, галогензамещенный C1-С6-алкил, гидроксизамещенный C1-С6-алкил, C1-С6-алкоксигруппу, галогензамещенную C1-С6-алкоксигруппу, -X1NR3aR3b, -X1C(O)R3a и 6-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N; где X1 выбран из связи и С1-С4-алкилена; R3a и R3b независимо выбраны из водорода и C1-С6-алкила;
R2 выбран из метила и этила и
А обозначает ненасыщенное 5-членное кольцо, содержащее 2 или 3 гетероатома или группы, выбранные из =N-, -NR4-, -О- и -S(O)0-, где R4 обозначает водород.
2. Соединение по п.1 формулы Ia
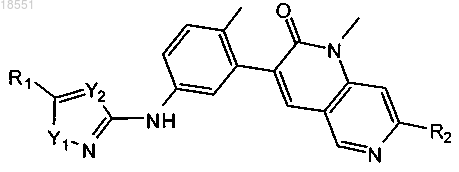
Формула (la)
в которой
R1 выбран из группы, включающей С1-С6-алкил, С3-С6-циклоалкил, 4-6-членный гетероциклоалкил, содержащий 1-2 гетероатома, независимо выбранных из N и О, фенил и 5-9-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N, О и S; где указанный С1-С6-алкил группы R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, =N(OH), С1-С4-алкоксигруппу и феноксигруппу; где указанный циклоалкил, гетероциклоалкил, фенил или гетероарил группы R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, цианогруппу, C1-С6-алкил, галогензамещенный C1-С6-алкил, гидроксизамещенный С1-С6-алкил, C1-С6-алкоксигруппу, галогензамещенную С1-С6-алкоксигруппу, -X1NR3aR3b, -X1C(O)R3a и 6-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N; где Х1 выбран из связи и С1-С4алкилена; где R3a и R3b независимо выбраны из водорода и C1-С6-алкила;
R2 выбран из метила и этила;
Y1 выбран из группы, включающей О, S и NR4, где R4 обозначает водород; и
Y2 выбран из N и CR4, где R4 обозначает водород.
3. Соединение по п.2, в котором R1 выбран из группы, включающей этил, трет-бутил, трет-бутилметил, изобутил, пропил, изопропил, неопентил, втор-бутил, пентан-3-ил, 2-гидроксипропан-2-ил, 1-гидрокси-2-метилпропан-2-ил, 1-гидроксипропан-2-ил, 1-гидрокси-2-метилпропил, 1,1-дифторэтил, 2-гидрокси-2-метилпропил, 2-гидроксипропил, этоксиметил, 1-метоксиэтил, 1-феноксиэтил, 1-(гидроксимино)этил, пиридинил, фуранил, фенил, тиазолил, 2,3-дигидробензофуран-2-ил, оксетан-3-ил, оксетан-2-ил, тетрагидро-2Н-пиран-4-ил, тетрагидро-2Н-пиран-3-ил, тетрагидро-2Н-пиран-2-ил, тетрагидрофуранил, 1Н-индол-2-ил, циклобутил, циклопропил, циклопентил и циклогексил; где указанный пиридинил, пиперазинил, фуранил, фенил, тиазолил, 2,3-дигидробензофуран-2-ил, 3-оксоциклобутил, оксетан-3-ил, оксетан-2-ил, тетрагидро-2Н-пиран-4-ил, тетрагидро-2Н-пиран-3-ил, тетрагидро-2Н-пиран-2-ил, тетрагидрофуранил, 1Н-индол-2-ил, циклобутил, циклопропил, циклопентил или циклогексил необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей хлор, фтор, бром, гидроксигруппу, гидроксиметил, пиридинил, цианогруппу, метил, метоксигруппу, аминометил, метилкарбонил, трифторметил, дифторэтил и трифторметоксигруппу.
4. Соединение по п.1, выбранное из группы, включающей 1,7-диметил-3-(2-метил-5-(5-(пиридин-2-ил)-1,2,4-оксадиазол-3-иламино)фенил)-1,6-нафтиридин-2(1Н)-он; 1,7-диметил-3-(2-метил-5-(5-(6-метилпиридин-3-ил)-1,2,4-оксадиазол-3-иламино)фенил)-1,6-нафтиридин-2(1Н)-он; 3-(5-{[5-(6-хлорпиридин-3-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2,5-диметилфуран-3-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-{5-[(5-циклопропил-1,2,4-оксадиазол-3-ил)амино]-2-метилфенил}-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-({5-[6-(трифторметил)пиридин-3-ил]-1,2,4-оксадиазол-3-ил}амино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 3-{5-[(5-этил-1,2,4-оксадиазол-3-ил)амино]-2-метилфенил}-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(пропан-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-{2-метил-5-[(5-фенил-1,2,4-оксадиазол-3-ил)амино]фенил}-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2-хлорфенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(1,3-тиазол-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(пиридин-3-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-{5-[(5-циклобутил-1,2,4-оксадиазол-3-ил)амино]-2-метилфенил}-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(4-хлорфенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(4-метилфенил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(4-метоксифенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-{5-[(5-циклопентил-1,2,4-оксадиазол-3-ил)амино]-2-метилфенил}-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(2-метилфенил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(3-метилфенил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-{5-[(5-циклогексил-1,2,4-оксадиазол-3-ил)амино]-2-метилфенил}-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2,2-диметилпропил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(3-хлорфенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(1-метил-1Н-пиррол-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(1-метил-1Н-имидазол-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(1-метилпирролидин-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(4-фторфенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(5-фторпиридин-2-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(5-хлорпиридин-2-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-({5-[(2S)-бутан-2-ил]-1,2,4-оксадиазол-3-ил}амино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-{2-метил-5-[(5-пропил-1,2,4-оксадиазол-3-ил)амино]фенил}-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(бутан-2-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-{5-[(5-трет-бутил-1,2,4-оксадиазол-3-ил)амино]-2-метилфенил}-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(пентан-3-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2-гидроксипропан-2-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(оксан-4-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(1-метилциклопропил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(1-гидрокси-2-метилпропан-2-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(4-гидроксифенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 4-(3-{[3-(1,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфенил]амино}-1,2,4-оксадиазол-5-ил)бензонитрил; 2-(3-{[3-(1,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфенил]амино}-1,2,4-оксадиазол-5-ил)бензонитрил; 3-(5-{[5-(3-гидроксифенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(3-{[3-(1,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфенил]амино}-1,2,4-оксадиазол-5-ил)бензонитрил; 1,7-диметил-3-[2-метил-5-({5-[4-(трифторметокси)фенил]-1,2,4-оксадиазол-3-ил}амино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(6-гидроксипиридин-2-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-({5-[4-(гидроксиметил)фенил]-1,2,4-оксадиазол-3-ил}амино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-({5-[2-(пиридин-3-ил)-1,3-тиазол-4-ил]-1,2,4-оксадиазол-3-ил}амино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2,5-диметил-1,3-оксазол-4-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(5-хлор-1Н-индол-2-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(6-метилпиридин-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2-хлор-6-метилпиридин-3-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(6-хлорпиридин-2-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(пиридин-4-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(6-метилпиридин-3-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(пиридин-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(5-метилпиридин-3-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(1,1-дифторэтил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2-гидроксипропил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2-гидрокси-2-метилпропил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(1-гидроксициклопропил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-({5-[1-(трифторметил)циклопропил]-1,2,4-оксадиазол-3-ил}амино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(оксан-3-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2,6-дифторфенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2,4-дифторфенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(3,4-дифторфенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 4-(3-{[3-(1,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфенил]амино}-1,2,4-оксадиазол-5-ил)-3-фторбензонитрил; 3-(5-{[5-(1-гидрокси-2-метилпропил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(3-метилоксетан-3-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(оксетан-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(1-гидроксипропан-2-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(2-метилпропил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он;3-[5-({5-[1-(гидроксиметил)циклопропил]-1,2,4-оксадиазол-3-ил}амино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(пиразин-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(5-метилпиразин-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(3-гидроксициклопентил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(этоксиметил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-({5-[(2R)оксолан-2-ил]-1,2,4-оксадиазол-3-ил}амино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-({5-[(1S)-1-метоксиэтил]-1,2,4-оксадиазол-3-ил}амино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-({5-[(2R)-оксолан-2-ил]-1,2,4-оксадиазол-3-ил}амино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(оксолан-3-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(3-метилпиридин-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2-метокси-4-метилфенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2-хлор-4-фторфенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2,4-дихлорфенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(3-гидроксициклобутил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(3-гидрокси-3-метилциклобутил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(оксан-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-{2-метил-5-[(5-фенил-1,2,4-оксадиазол-3-ил)амино]фенил}-6-оксидо-2-оксо-1,2-дигидро-1,6-нафтиридин-6-он; 3-(5-{[5-(6-метоксипиридин-3-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-({5-[6-(1,1-дифторэтил)пиридин-3-ил]-1,2,4-оксадиазол-3-ил}амино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-({5-[4-(1,1-дифторэтил)фенил]-1,2,4-оксадиазол-3-ил}амино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-({5-[4-(аминометил)фенил]-1,2,4-оксадиазол-3-ил}амино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2-фторпиридин-3-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-({5-[(1R)-1-гидрокси-2-метилпропил]-1,2,4-оксадиазол-3-ил}амино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-({5-[(1S)-1-гидрокси-2-метилпропил]-1,2,4-оксадиазол-3-ил}амино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2-ацетилфенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(4-ацетилфенил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(1-феноксиэтил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-({5-[(2R)-2-метилоксолан-2-ил]-1,2,4-оксадиазол-3-ил}амино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2,3-дигидро-1-бензофуран-2-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-({5-[(2R)-оксан-2-ил]-1,2,4-оксадиазол-3-ил}амино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-({5-[(2S)-оксан-2-ил]-1,2,4-оксадиазол-3-ил}амино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(3-гидрокси-3-метилциклобутил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(5-метилпиридин-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(5-метоксипиридин-2-ил)-1,2,4-оксадиазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 7-этил-1-метил-3-(2-метил-5-{[5-(пропан-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 7-этил-1-метил-3-(2-метил-5-{[5-(пиридин-2-ил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он и 1,7-диметил-3-{2-метил-5-[(5-фенил-1,2,4-тиадиазол-3-ил)амино]фенил}-1,2-дигидро-1,6-нафтиридин-2-он.
5. Соединение по п.1 формулы Ib

Формула (Ib)
в которой
R1 выбран из группы, включающей С1-С6-алкил, С3-С6-циклоалкил, 4-6-членный гетероциклоалкил, содержащий 1-2 гетероатома, независимо выбранных из N и О, фенил и 5-9-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N, О и S; где указанный C1-С6-алкил группы R1 необязательно замещен 1-2 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, С1-С4-алкоксигруппу и феноксигруппу; где указанный циклоалкил, гетероциклоалкил, фенил или гетероарил группы R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, цианогруппу, C1-С6-алкил, галогензамещенный C1-С6-алкил, гидроксизамещенный С1-С6-алкил, С1-С6-алкоксигруппу, галогензамещенную C1-С6-алкоксигруппу,
-X1NR3aR3b, -X1C(O)R3a и 6-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N; где X1 выбран из связи и С1-С4алкилена, где R3a и R3b независимо выбраны из водорода и C1-С6-алкила;
R2 выбран из метила и этила;
Y3 выбран из группы, включающей О, S и NR4, где R4 обозначает водород.
6. Соединение по п.5, в котором R1 выбран из группы, включающей этил, трет-бутил, трет-бутилметил, изобутил, пропил, изопропил, неопентил, втор-бутил, пентан-3-ил, 2-гидроксипропан-2-ил, 1-гидрокси-2-метилпропан-2-ил, 1-гидроксипропан-2-ил, 1-гидрокси-2-метилпропил, 1,1-дифторэтил, 2-гидрокси-2-метилпропил, 2-гидроксипропил, этоксиметил, 1-метоксиэтил, 1-феноксиэтил, 1-(гидроксимино)этил, пиридинил, фуранил, фенил, тиазолил, 2,3-дигидробензофуран-2-ил, оксетан-3-ил, оксетан-2-ил, тетрагидро-2Н-пиран-4-ил, тетрагидро-2Н-пиран-3-ил, тетрагидро-2Н-пиран-2-ил, тетрагидрофуранил, 1H-индол-2-ил, циклобутил, циклопропил, циклопентил и циклогексил; где указанный пиридинил, пиперазинил, фуранил, фенил, тиазолил, 2,3-дигидробензофуран-2-ил, 3-оксоциклобутил, оксетан-3-ил, оксетан-2-ил, тетрагидро-2Н-пиран-4-ил, тетрагидро-2Н-пиран-3-ил, тетрагидро-2Н-пиран-2-ил, тетрагидрофуранил, 1Н-индол-2-ил, циклобутил, циклопропил, циклопентил или циклогексил необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей хлор, фтор, бром, гидроксигруппу, гидроксиметил, пиридинил, цианогруппу, метил, метоксигруппу, аминометил, метилкарбонил, трифторметил, дифторэтил и трифторметоксигруппу.
7. Соединение по п.1, выбранное из группы, включающей 1,7-диметил-3-(2-метил-5-{[5-(4-метилфенил)-1,3,4-оксадиазол-2-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(4-метоксифенил)-1,3,4-оксадиазол-2-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(4-хлорфенил)-1,3,4-оксадиазол-2-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-{2-метил-5-[(5-фенил-1,3,4-оксадиазол-2-ил)амино]фенил}-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(2-метилпропил)-1,3,4-оксадиазол-2-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(4-фторфенил)-1,3,4-оксадиазол-2-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(пропан-2-ил)-1,3,4-оксадиазол-2-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-{5-[(5-трет-бутил-1,3,4-оксадиазол-2-ил)амино]-2-метилфенил}-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-{5-[(5-циклопропил-1,3,4-оксадиазол-2-ил)амино]-2-метилфенил}-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-{5-[(5-циклогексил-1,3,4-оксадиазол-2-ил)амино]-2-метилфенил}-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-{5-[(5-циклопентил-4Н-1,2,4-триазол-3-ил)амино]-2-метилфенил}-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(4-хлорфенил)-4Н-1,2,4-триазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-{5-[(5-циклогексил-4Н-1,2,4-триазол-3-ил)амино]-2-метилфенил}-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[5-(4-метилфенил)-4Н-1,2,4-триазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(2,2-диметилпропил)-4Н-1,2,4-триазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-{2-метил-5-[(5-фенил-4Н-1,2,4-триазол-3-ил)амино]фенил}-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-{[5-(3-хлорфенил)-4Н-1,2,4-триазол-3-ил]амино}-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-{5-[(5-циклобутил-4Н-1,2,4-триазол-3-ил)амино]-2-метилфенил}-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он и 1,7-диметил-3-{2-метил-5-[(5-фенил-1,3,4-тиадиазол-2-ил)амино]фенил}-1,2-дигидро-1,6-нафтиридин-2-он.
8. Соединение по п.1 формулы Ic
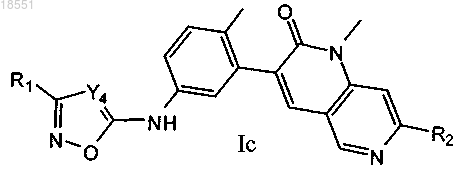
Формула (Ic)
в которой R1 выбран из группы, включающей C1-С6-алкил, С3-С6-циклоалкил, 4-6-членный гетероциклоалкил, содержащий 1-2 гетероатома, независимо выбранных из N и О, фенил и 5-9-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N, О и S; где указанный C1-С6-алкил группы R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, С1-С4-алкоксигруппу и феноксигруппу; где указанный циклоалкил, гетероциклоалкил, фенил или гетероарил группы R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, цианогруппу, C1-С6-алкил, галогензамещенный C1-C6-алкил, гидроксизамещенный C1-C6-алкил, C1-C6-алкоксигруппу, галогензамещенную С1-С6-алкоксигруппу, -X1NR3aR3b, -X1C(O)R3a и 6-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N; где X1 выбран из связи и С1-С4-алкилена, R3a и R3b независимо выбраны из водорода и C1-С6-алкила;
R2 выбран из метила и этила;
Y4 выбран из группы, включающей CR4 и N, где R4 обозначает водород.
9. Соединение по п.8, в котором R1 выбран из группы, включающей этил, трет-бутил, трет-бутилметил, изобутил, пропил, изопропил, неопентил, втор-бутил, пентан-3-ил, 2-гидроксипропан-2-ил, 1-гидрокси-2-метилпропан-2-ил, 1-гидроксипропан-2-ил, 1-гидрокси-2-метилпропил, 1,1-дифторэтил, 2-гидрокси-2-метилпропил, 2-гидроксипропил, этоксиметил, 1-метоксиэтил, 1-феноксиэтил, 1-(гидроксимино)этил, пиридинил, пиперазинил, фуранил, фенил, тиазолил, 2,3-дигидробензофуран-2-ил, 3-оксоциклобутил, оксетан-3-ил, оксетан-2-ил, тетрагидро-2Н-пиран-4-ил, тетрагидро-2Н-пиран-3-ил, тетрагидро-2Н-пиран-2-ил, тетрагидрофуранил, 1Н-индол-2-ил, циклобутил, циклопропил, циклопентил и циклогексил; где указанный пиридинил, пиперазинил, фуранил, фенил, тиазолил, 2,3-дигидробензофуран-2-ил, 3-оксоциклобутил, оксетан-3-ил, оксетан-2-ил, тетрагидро-2Н-пиран-4-ил, тетрагидро-2Н-пиран-3-ил, тетрагидро-2Н-пиран-2-ил, тетрагидрофуранил, 1Н-индол-2-ил, циклобутил, циклопропил, циклопентил или циклогексил необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей хлор, фтор, бром, гидроксигруппу, гидроксиметил, пиридинил, цианогруппу, метил, метоксигруппу, аминометил, метилкарбонил, трифторметил, дифторэтил и трифторметоксигруппу.
10. Соединение по п.1, выбранное из группы, включающей 1,7-диметил-3-{2-метил-5-[(3-фенил-1,2,4-оксадиазол-5-ил)амино]фенил}-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[3-(пиридин-2-ил)-1,2,4-оксадиазол-5-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-{[3-(пропан-2-ил)-1,2,4-оксадиазол-5-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он и 1,7-диметил-3-(2-метил-5-{[3-(1,3-тиазол-2-ил)-1,2-оксазол-5-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он.
11. Фармацевтическая композиция, обладающая активностью в качестве ингибиторов киназ c-KIT и/или PDGFR, где фармацевтическая композиция содержит терапевтически эффективное количество соединения по любому из пп.1-10 и фармацевтически приемлемый инертный наполнитель.
12. Соединение, представляющее собой 1,7-диметил-3-(2-метил-5-{[5-(3-оксоциклобутил)-1,2,4-оксадиазол-3-ил]амино}фенил)-1,2-дигидро-1,6-нафтиридин-2-он.
Текст
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ c-KIT И PDGFR Настоящее изобретение относится к новому классу соединений, фармацевтическим композициям,содержащим такие соединения, для лечения или предупреждения заболеваний или нарушений,связанных с аномальной или характеризующейся нарушенной регуляцией активностью киназы, в особенности заболеваний или нарушений, которые включают аномальную активацию киназ с-kit,PDGFR и PDGFR. Перекрестная ссылка на родственные заявки По настоящей заявке испрашивается приоритет по предварительной заявке U.S.60/916051, поданной 22 февраля 2008 г. Полное раскрытие этой заявки во всей ее полноте включено в настоящее изобретение в качестве ссылки для всех объектов. Предпосылки создания изобретения Область техники, к которой относится изобретение Настоящее изобретение относится к новому классу соединений, фармацевтическим композициям,содержащим такие соединения, и к способам применения таких соединений для лечения или предупреждения заболеваний или нарушений, связанных с аномальной или характеризующейся нарушенной регуляцией активностью киназы, в особенности заболеваний или нарушений, которые включают аномальную активацию киназ c-kit, PDGFR и PDGFR. Уровень техники Протеинкиназы представляют собой большую группу белков, которые играют центральную роль в регуляции большого количества клеточных процессов и обеспечивают регулирование клеточных функций. Частичный, неограничивающий перечень этих киназ включает рецепторные тирозинкиназы, такие как киназа рецептора тромбоцитарного фактора роста (PDGFR), рецептора фактора роста нервов, trkB, и рецептора фактора роста фибробластов, FGFR3; нерецепторные тирозинкиназы, такие как Abl, и киназы слияния BCR-Abl, Lck, Bmx и c-src; и серин/треонинкиназы, такие как киназы c-RAF, sgk, MAP (например, MKK4, MKK6 и т.п.) и SAPK2 и SAPK2. Аберрантная активность киназ обнаружена при многих патологических состояниях, включая доброкачественные и злокачественные пролиферативные заболевания, а также заболевания, обусловленные неадекватной активацией иммунной и нервной систем. Новые соединения, предлагаемые в настоящем изобретении, ингибируют активность одной или большего количества протеинкиназ и поэтому предположительно применимы для лечения связанных с киназами заболеваний. Краткое изложение сущности изобретения Одним объектом настоящего изобретения являются соединения формулы I или их фармацевтически приемлемые солиR1 выбран из группы, включающей С 1-С 6-алкил, С 3-С 6-циклоалкил, 4-6-членный гетероциклоалкил,содержащий 1-2 гетероатома, независимо выбранных из N и О, фенил и 5-9-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N, О и S; где указанный С 1-С 6-алкил группы R1 необязательно замещен 1-2 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, =N(OH), С 1-С 4-алкоксигруппу и феноксигруппу; где указанный циклоалкил, гетероциклоалкил,фенил или гетероарил группы R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, цианогруппу, С 1-С 6-алкил, галогензамещенный С 1-С 6 алкил, гидроксизамещенный C1-С 6-алкил, C1-С 6-алкоксигруппу, галогензамещенную C1-С 6 алкоксигруппу, -X1NR3aR3b, -X1C(O)R3a и 6-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N; где X1 выбран из связи и С 1-С 4-алкилена; где R3 а и R3b независимо выбраны из водорода и C1-С 6-алкила; R2 выбран из метила и этила; и А обозначает ненасыщенное 5-членное кольцо, содержащее 2 или 3 гетероатома или группы, выбранные из =N-, -NR4-, -О- и -S(O)0-; где R4 выбран из водорода. Вторым объектом настоящего изобретения является фармацевтическая композиция, которая содержит соединение формулы I или его фармацевтически приемлемую соль в смеси с одним или большим количеством подходящих инертных наполнителей. Подробное описание изобретения Определения"Алкил" в качестве группы или структурного элемента других групп, например галогензамещенного алкила и алкоксигруппы, может обладать линейной или разветвленной цепью. С 1-С 4-Алкоксигруппа включает метоксигруппу, этоксигруппу и т.п. Галогензамещенный алкил включает трифторметил, пентафторэтил и т.п."Арил" означает моноциклическую или конденсированную бициклическую ароматическую кольцевую систему, содержащую 6-10 кольцевых атомов углерода. Например, С 6-С 10-арил при использовании в настоящей заявке включает, но не ограничивается только ими, фенил или нафтил, предпочтительно фенил. "Арилен" означает двухвалентный радикал, образованный из арильной группы."Гетероарил" означает 5-15-членную ненасыщенную кольцевую систему, содержащую от 1 до 3 гетероатомов, независимо выбранных из группы, включающей -О-, -N=, -NR-, -С(О)-, -S-, -S(O)- и -S(O)2-,-1 018551 где R обозначает водород, С 1-С 4-алкил или защитную группу атома азота. Например, C1-С 10-гетероарил("C1-С 10-" указывает, что в кольцевой системе содержатся от 1 до 10 атомов углерода) при использовании в настоящей заявке включает, но не ограничивается только ими, пиразолил, пиридинил, индолил, тиазолил, 3-оксо-3,4-дигидро-2 Н-бензо[b][1,4]оксазин-6-ил, фуранил, бензо[b]фуранил, пирролил, 1 Ниндазолил, имидазо[1,2-а]пиридин-3-ил, оксазолил, бензо[d]тиазол-6-ил, 1 Н-бензо[d][1,2,3]триазол-5-ил,хинолинил, 1 Н-индолил, 3,4-дигидро-2 Н-пирано[2,3-b]пиридинил и 2,3-дигидрофуро[2,3-b]пиридинил,3-оксо-3,4-дигидро-2 Н-бензо[b][1,4]оксазин-7-ил и т.п."Циклоалкил" означает насыщенную или частично ненасыщенную моноциклическую, конденсированную бициклическую или мостиковую полициклическую кольцевую систему, содержащую указанное количество кольцевых атомов. Например, С 3-С 10-циклоалкил включает циклопропил, циклобутил, циклопентил, циклогексил и т.п."Гетероциклоалкил" означает 3-8-членную насыщенную или частично ненасыщенную кольцевую систему, содержащую от 1 до 3 гетероатомов, независимо выбранных из группы, включающей -О-, -N=,-NR-, -С(О)-, -S-, -S(O)- и -S(O)2-, где R обозначает водород, С 1-С 4-алкил или защитную группу атома азота. Например, С 3-С 8-гетероциклоалкил при использовании в настоящей заявке изобретении для описания соединений, предлагаемых в настоящем изобретении, включает, но не ограничивается только ими,морфолиновую группу, пирролидинил, азепанил, пиперидинил, изохинолинил, тетрагидрофуранил, пирролидинил, пирролидинил-2-он, пиперазинил, пиперидинилон, 1,4-диокса-8-азаспиро[4,5]дец-8-ил и т.п."Галоген" предпочтительно означает хлор или фтор, но также может означать бром или йод."Набор киназ" представляет собой перечень киназ, включающий Abl(человека), Abl(T315I), JAK2,JAK3, ALK, JNKll, ALK4, KDR, Aurora-А, Lck, Blk, MAPK1, Bmx, MAPKAP-K2, BRK, MEK1, CaMKII(крысы), Met, CDK1/циклин B, p70S6K, CHK2, PAK2, CK1, PDGFR, CK2, PDK1, c-kit, Pim-2, c-RAF,PKA(h), CSK, PKB, cSrc, PKC, DYRK2, Plk3, EGFR, ROCK-I, Fes, Ron, FGFR3, Ros, Flt3, SAPK2,Fms, SGK, Fyn, SIK, GSK3, Syk, IGF-1R, Tie-2, IKKB, TrKB, IR, WNK3, IRAK4, ZAP-70, ITK,АМРК(крысы), LIMK1, Rsk2, Axl, LKB1, SAPK2, BrSK2, Lyn (h), SAPK3, ВТК, MAPKAP-K3, SAPK4,CaMKIV, MARK1, Snk, CDK2/циклин A, MINK, SRPK1, CDK3/циклин Е, MKK4(m), TAK1, CDK5/p25,MKK6(h), TBK1, CDK6/циклин D3, MLCK, TrkA, CDKV/циклин H/MAT1, MRCK, TSSK1, CHK1,MSK1, Yes, CKld, MST2, ZIPK, c-Kit (D816V), MuSK, DAPK2, NEK2, DDR2, NEK6, DMPK, PAK4,DRAK1, PAR-lB, EphA1, PDGFR, EphA2, Pim-1, EphA5, PKB, EphB2, PKCI, EphB4, PKC, FGFR1,PKC, FGFR2, PKC, FGFR4, PKD2, Fgr, PKGl, Fltl, PRK2, Hck, PYK2, HIPK2, Ret, IKK, RIPK2, IRR,ROCK-II(человека), JNK22, Rse, JNK3, Rskl(h), PI3 K, PI3 K и PI3-K. Для соединений, предлагаемых в настоящем изобретении, проведен скрининг воздействия на этот набор киназ (дикого типа и/или их мутаций) и установлено, что они ингибируют активность по меньшей мере одного представителя указанного набора киназ."Мутантные формы BCR-Abl" означают формы с изменением одной или большего количества аминокислот по сравнению с последовательностью дикого типа. Мутации в BCR-ABL проявляются посредством нарушения критических точек взаимодействия между белком и ингибитором (например, глеевеком и т.п.), а чаще путем индуцирования перехода из неактивного состояния в активное, т.е. в конформацию, с которой не могут связываться BCR-ABL и глеевек. Анализы клинических образцов приводят к тому, что набор мутаций, обнаруживаемых в связи с резистентным фенотипом, медленно, но непрерывно увеличивается с течением времени. Мутации, видимо, группируются в четырех основных областях. Одна группа мутаций (G250E, Q252R, Y253F/H, E255K/V) включает аминокислоты, которые образуют связывающую фосфат петлю для АТФ (аденозинтрифосфат) (также известную, как Р-петля). Вторую группу(V289A, F311L, Т 3151, F317L) можно обнаружить в связывающем глеевек центре и они непосредственно взаимодействуют с ингибитором с помощью водородных связей или ван-дер-ваальсовых взаимодействий. Третья группа мутаций (М 351 Т, E355G) группируется очень близко к каталитическому домену. Четвертая группа мутаций (H396R/P) расположена в петле активации, конформация которой является молекулярным переключателем, регулирующим активацию/дезактивацию киназы. Точечные мутации BCRABL, связанные с резистентностью к глеевеку, обнаруженные у пациентов, страдающих ХМЛ и ОЛЛ(острый лимфолейкоз), включают M224V, L248V, G250E, G250R, Q252R, Q252H, Y253H, Y253F, Е 255 К,E255V, D276G, Т 277 А, V289A, F311L, T315I, T315N, F317L, М 343 Т, М 315 Т, E355G, F359V, F359A,V379I, F382L, L387M, L387F, Н 396 Р, H396R, А 397 Р, S417Y, Е 459 К и F486S (положения аминокислот,указанные односимвольным кодом, получены из последовательности GenBank, регистрационный номер ААВ 60394 и соответствуют ABL типа 1a; Martinelli et al., Haematologica/The Hematology Journal, 2005,April; 90-4). Если в контексте настоящего изобретения не указано иное, Bcr-Abl означают формы дикого типа и мутантные формы фермента."Лечение" относится к способу облегчения или смягчения заболевания и/или сопутствующих ему симптомов. Описание предпочтительных вариантов осуществления Ген c-kit кодирует рецепторную тирозинкиназу, и лиганд рецептора c-kit называется фактором стволовых клеток (SCF), который является главным фактором роста мастоцитов. Активность c-kit рецептор-2 018551 ной протеинтирозинкиназы в нормальных клетках регулируется и нормальная функциональная активность продукта гена c-kit важна для поддержания нормального гематопоэза, меланогенеза, генетогенеза и роста и дифференциации мастоцитов. Мутации, которые вызывают конститутивную активацию киназной активности c-kit при отсутствии связывания с SCF, участвуют в различных заболеваниях в диапазоне от астмы до раковых заболеваний человека. Одним вариантом осуществления соединений формулы I являются соединения формулы 1 аR1 выбран из группы, включающей С 1-С 6-алкил, С 3-С 6-циклоалкил, 4-6-членный гетероциклоалкил,содержащий 1-2 гетероатома, независимо выбранных из N и О, фенил и 5-9-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N, О и S; где указанный C1-С 6-алкил группы R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, =N(OH), С 1-С 4-алкоксигруппу и феноксигруппу; где указанный циклоалкил, гетероциклоалкил, фенил или гетероарил группы R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, цианогруппу, C1-C6-алкил, галогензамещенный С 1-С 6-алкил, гидроксизамещенный C1-С 6-алкил, C1-С 6 алкоксигруппу, галогензамещенную C1-C6-алкоксигруппу, -X1NR3aR3b, -X1C(O)R3a и 6-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N; где X1 выбран из связи и С 1-С 4-алкилена; где R3a и R3b независимо выбраны из водорода и С 1-С 6-алкила;R2 выбран из метила и этила;Y1 выбран из группы, включающей О, S и NR4; где R4 обозначает водород; и Y2 выбран из N и CR4; где R4 обозначает водород. В другом варианте осуществления R1 выбран из группы, включающей этил, трет-бутил, третбутилметил, изобутил, пропил, изопропил, неопентил, втор-бутил, пентан-3-ил, 2-гидроксипропан-2-ил,1-гидрокси-2-метилпропан-2-ил, 1-гидроксипропан-2-ил, 1-гидрокси-2-метилпропил, 1,1-дифторэтил, 2 гидрокси-2-метилпропил, 2-гидроксипропил, этоксиметил, 1-метоксиэтил, 1-феноксиэтил, 1(гидроксимино)этил, пиридинил, фуранил, фенил, тиазолил, 2,3-дигидробензофуран-2-ил, оксетан-3-ил,оксетан-2-ил, тетрагидро-2 Н-пиран-4-ил, тетрагидро-2 Н-пиран-3-ил, тетрагидро-2 Н-пиран-2-ил, тетрагидрофуранил, 1H-индол-2-ил, циклобутил, циклопропил, циклопентил и циклогексил; где указанный пиридинил, пиперазинил, фуранил, фенил, тиазолил, 2,3-дигидробензофуран-2-ил, 3-оксоциклобутил,оксетан-3-ил, оксетан-2-ил, тетрагидро-2 Н-пиран-4-ил, тетрагидро-2 Н-пиран-3-ил, тетрагидро-2 Н-пиран 2-ил, тетрагидрофуранил, 1 Н-индол-2-ил, циклобутил, циклопропил, циклопентил или циклогексил необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей хлор, фтор,бром, гидроксигруппу, гидроксиметил, пиридинил, цианогруппу, метил, метоксигруппу, аминометил,метилкарбонил, трифторметил, дифторэтил и трифторметоксигруппу. Другим вариантом осуществления являются соединения, выбранные из группы, включающей 1,7 диметил-3-(2-метил-5-(5-(пиридин-2-ил)-1,2,4-оксадиазол-3-иламино)фенил)-1,6-нафтиридин-2(1H)-он; 1,7-диметил-3-(2-метил-5-(5-(6-метилпиридин-3-ил)-1,2,4-оксадиазол-3-иламино)фенил)-1,6-нафтиридин-2(1 Н)-он; 3-(5-[5-(6-хлорпиридин-3-ил)-1,2,4-оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил 1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(2,5-диметилфуран-3-ил)-1,2,4-оксадиазол-3-ил]амино-2 метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-5-[(5-циклопропил-1,2,4-оксадиазол-3 ил)амино]-2-метилфенил-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-(5[6-(трифторметил)пиридин-3-ил]-1,2,4-оксадиазол-3-иламино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 3-5-[(5-этил-1,2,4-оксадиазол-3-ил)амино]-2-метилфенил-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2 он; 1,7-диметил-3-(2-метил-5-[5-(пропан-2-ил)-1,2,4-оксадиазол-3-ил]аминофенил)-1,2-дигидро-1,6 нафтиридин-2-он; 1,7-диметил-3-2-метил-5-[(5-фенил-1,2,4-оксадиазол-3-ил)амино]фенил-1,2-дигидро 1,6-нафтиридин-2-он; 3-(5-[5-(2-хлорфенил)-1,2,4-оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил 1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-[5-(1,3-тиазол-2-ил)-1,2,4-оксадиазол-3 ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-[5-(пиридин-3-ил)-1,2,4 оксадиазол-3-ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-5-[(5-циклобутил-1,2,4-оксадиазол 3-ил)амино]-2-метилфенил-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(4-хлорфенил)-1,2,4 оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3(2-метил-5-[5-(4-метилфенил)-1,2,4-оксадиазол-3-ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(4-метоксифенил)-1,2,4-оксадиазол-З-ил]амино-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6 нафтиридин-2-он; 3-5-[(5-циклопентил-1,2,4-оксадиазол-3-ил)амино]-2-метилфенил-1,7-диметил-1,2 дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-[5-(2-метилфенил)-1,2,4-оксадиазол-3 ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-[5-(3-метилфенил)-1,2,4-3 018551 нофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-(5-[1-(гидроксиметил)циклопропил]-1,2,4-оксадиазол-3-иламино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2 метил-5-[5-(пиразин-2-ил)-1,2,4-оксадиазол-3-ил]амино фенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7 диметил-3-(2-метил-5-[5-(5-метилпиразин-2-ил)-1,2,4-оксадиазол-3-ил]аминофенил)-1,2-дигидро-1,6 нафтиридин-2-он; 3-(5-[5-(3-гидроксициклопентил)-1,2,4-оксадиазол-3-ил]амино-2-метилфенил)-1,7 диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(этоксиметил)-1,2,4-оксадиазол-3-ил]амино-2 метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-(5-[(2R)оксолан-2-ил]-1,2,4-оксадиазол-3-иламино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-(5-[(1S)-1 метоксиэтил]-1,2,4-оксадиазол-3-иламино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2 он; 1,7-диметил-3-[2-метил-5-(5-[(2S)-оксолан-2-ил]-1,2,4-оксадиазол-3-иламино)фенил]-1,2-дигидро 1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-[5-(оксолан-3-ил)-1,2,4-оксадиазол-3-ил]аминофенил)1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-[5-(3-метилпиридин-2-ил)-1,2,4-оксадиазол-3-ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(2-метокси-4-метилфенил)-1,2,4 оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(2-хлор 4-фторфенил)-1,2,4-оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2 он; 3-(5-[5-(2,4-дихлорфенил)-1,2,4-оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил-1,2-дигидро 1,6-нафтиридин-2-он; 3-(5-[5-(3-гидроксициклобутил)-1,2,4-оксадиазол-3-ил]амино-2-метилфенил)-1,7 диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(3-гидрокси-3-метилциклобутил)-1,2,4-оксадиазол-3 ил]амино-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-[5(оксан-2-ил)-1,2,4-оксадиазол-3-ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-2 метил-5-[(5-фенил-1,2,4-оксадиазол-3-ил)амино]фенил-6-оксидо-2-оксо-1,2-дигидро-1,6-нафтиридин-6 он; 3-(5-[5-(6-метоксипиридин-3-ил)-1,2,4-оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил-1,2 дигидро-1,6-нафтиридин-2-он; 3-[5-(5-[6-(1,1-дифторэтил)пиридин-3-ил]-1,2,4-оксадиазол-3-ил амино)2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-(5-[4-(1,1-дифторэтил)фенил]-1,2,4 оксадиазол-3-иламино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-(5-[4(аминометил)фенил]-1,2,4-оксадиазол-3-иламино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(2-фторпиридин-3-ил)-1,2,4-оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил 1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-(5-[(1R)-1-гидрокси-2-метилпропил]-1,2,4-оксадиазол-3-иламино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-[5-(5-[(1S)-1-гидрокси-2-метилпропил]-1,2,4-оксадиазол-3-иламино)-2-метилфенил]-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3(5-[5-(2-ацетилфенил)-1,2,4-оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6 нафтиридин-2-он; 3-(5-[5-(4-ацетилфенил)-1,2,4-оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил 1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-[5-(1-феноксиэтил)-1,2,4-оксадиазол-3 ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-(5-[(2R)-2-метилоксолан 2-ил]-1,2,4-оксадиазол-3-иламино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(2,3-дигидро-1 бензофуран-2-ил)-1,2,4-оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-(5-[(2R)-оксан-2-ил]-1,2,4-оксадиазол-3-иламино)фенил]-1,2 дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-[2-метил-5-(5-[(2S)-оксан-2-ил]-1,2,4-оксадиазол-3 иламино)фенил]-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(3-гидрокси-3-метилциклобутил)-1,2,4 оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3(2-метил-5-[5-(5-метилпиридин-2-ил)-1,2,4-оксадиазол-3-ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(5-метоксипиридин-2-ил)-1,2,4-оксадиазол-3-ил]амино-2-метилфенил)-1,7-диметил 1,2-дигидро-1,6-нафтиридин-2-он; 7-этил-1-метил-3-(2-метил-5-[5-(пропан-2-ил)-1,2,4-оксадиазол-3 ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 7-этил-1-метил-3-(2-метил-5-[5-(пиридин-2-ил)1,2,4-оксадиазол-3-ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он и 1,7-диметил-3-2-метил-5-[(5 фенил-1,2,4-тиадиазол-3-ил)амино]фенил-1,2-дигидро-1,6-нафтиридин-2-он. Другим вариантом осуществления являются соединения формулы IbR1 выбран из группы, включающей С 1-С 6-алкил, С 3-С 6-циклоалкил, 4-6-членный гетероциклоалкил,содержащий 1-2 гетероатома, независимо выбранных из N и О, фенил и 5-9-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N, О и S; где указанный С 1-С 6-алкил группы R1 необязательно замещен 1-2 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, С 1-С 4-алкоксигруппу и феноксигруппу; где указанный циклоалкил, гетероциклоалкил, фенил или гетероарил группы R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы,включающей галоген, гидроксигруппу, цианогруппу, C1-С 6-алкил, галогензамещенный C1-С 6-алкил, гидроксизамещенный C1-С 6-алкил, С 1-С 6-алкоксигруппу, галогензамещенную C1-С 6-алкоксигруппу,-X1NR3aR3b-X1C(O)R3a и 6-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных изN; где X1 выбран из связи и С 1-С 4-алкилена; где R3a и R3b независимо выбраны из водорода и C1-С 6 алкила; R2 выбран из метила и этила; Y3 выбран из группы, включающей О, S и NR4; где R4 обозначает водород. В другом варианте осуществления R1 выбран из группы, включающей этил, трет-бутил, третбутилметил, изобутил, пропил, изопропил, неопентил, втор-бутил, пентан-3-ил, 2-гидроксипропан-2-ил,1-гидрокси-2-метилпропан-2-ил, 1-гидроксипропан-2-ил, 1-гидрокси-2-метилпропил, 1,1-дифторэтил, 2 гидрокси-2-метилпропил, 2-гидроксипропил, этоксиметил, 1-метоксиэтил, 1-феноксиэтил, 1(гидроксимино)этил, пиридинил, фуранил, фенил, тиазолил, 2,3-дигидробензофуран-2-ил, оксетан-3-ил,оксетан-2-ил, тетрагидро-2 Н-пиран-4-ил, тетрагидро-2 Н-пиран-3-ил, тетрагидро-2 Н-пиран-2-ил, тетрагидрофуранил, 1 Н-индол-2-ил, циклобутил, циклопропил, циклопентил и циклогексил; где указанный пиридинил, пиперазинил, фуранил, фенил, тиазолил, 2,3-дигидробензофуран-2-ил, 3-оксоциклобутил,оксетан-3-ил, оксетан-2-ил, тетрагидро-2 Н-пиран-4-ил, тетрагидро-2 Н-пиран-3-ил, тетрагидро-2 Н-пиран 2-ил, тетрагидрофуранил, 1 Н-индол-2-ил, циклобутил, циклопропил, циклопентил или циклогексил необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей хлор, фтор,бром, гидроксигруппу, гидроксиметил, пиридинил, цианогруппу, метил, метоксигруппу, аминометил,метилкарбонил, трифторметил, дифторэтил и трифторметоксигруппу. Другим вариантом осуществления являются соединения, выбранные из группы, включающей 1,7 диметил-3-(2-метил-5-[5-(4-метилфенил)-1,3,4-оксадиазол-2-ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(4-метоксифенил)-1,3,4-оксадиазол-2-ил]амино-2-метилфенил)-1,7-диметил-1,2 дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(4-хлорфенил)-1,3,4-оксадиазол-2-ил]амино-2-метилфенил)-1,7 диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-2-метил-5-[(5-фенил-1,3,4-оксадиазол-2 ил)амино]фенил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-[5-(2-метилпропил)1,3,4-оксадиазол-2-ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(4-фторфенил)-1,3,4 оксадиазол-2-ил]амино-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3(2-метил-5-[5-(пропан-2-ил)-1,3,4-оксадиазол-2-ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 35-[(5-трет-бутил-1,3,4-оксадиазол-2-ил)амино]-2-метилфенил-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-5-[(5-циклопропил-1,3,4-оксадиазол-2-ил)амино]-2-метилфенил-1,7-диметил-1,2-дигидро 1,6-нафтиридин-2-он; 3-5-[(5-циклогексил-1,3,4-оксадиазол-2-ил)амино]-2-метилфенил-1,7-диметил 1,2-дигидро-1,6-нафтиридин-2-он; 3-5-[(5-циклопентил-4 Н-1,2,4-триазол-3-ил)амино]-2-метилфенил 1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(4-хлорфенил)-4 Н-1,2,4-триазол-3-ил]амино-2 метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 3-5-[(5-циклогексил-4 Н-1,2,4-триазол-3 ил)амино]-2-метилфенил-1,7-диметил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-[5(4-метилфенил)-4 Н-1,2,4-триазол-3-ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(2,2 диметилпропил)-4 Н-1,2,4-триазол-3-ил]амино-2-метилфенил)-1,7-диметил-1,2-дигидро-1,6-нафтиридин 2-он; 1,7-диметил-3-2-метил-5-[(5-фенил-4 Н-1,2,4-триазол-3-ил)амино]фенил-1,2-дигидро-1,6-нафтиридин-2-он; 3-(5-[5-(3-хлорфенил)-4 Н-1,2,4-триазол-3-ил]амино-2-метилфенил)-1,7-диметил-1,2 дигидро-1,6-нафтиридин-2-он; 3-5-[(5-циклобутил-4 Н-1,2,4-триазол-3-ил)амино]-2-метилфенил-1,7 диметил-1,2-дигидро-1,6-нафтиридин-2-он и 1,7-диметил-3-2-метил-5-[(5-фенил-1,3,4-тиадиазол-2 ил)амино]фенил-1,2-дигидро-1,6-нафтиридин-2-он. Другим вариантом осуществления являются соединения формулы IcR1 выбран из группы, включающей C1-C6-алкил, С 3-С 6-циклоалкил, 4-6-членный гетероциклоалкил,содержащий 1-2 гетероатома, независимо выбранных из N и О, фенил и 5-9-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных из N, О и S; где указанный C1-С 6-алкил группы R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, гидроксигруппу, С 1-С 4-алкоксигруппу и феноксигруппу; где указанный циклоалкил, гетероциклоалкил, фенил или гетероарил группы R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы,включающей галоген, гидроксигруппу, цианогруппу, C1-С 6-алкил, галогензамещенный C1-С 6-алкил, гидроксизамещенный С 1-С 6-алкил, С 1-С 6-алкоксигруппу, галогензамещенную C1-С 6-алкоксигруппу,-X1NR3aR3b, -X1C(O)R3a и 6-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранных изN; где X1 выбран из связи и С 1-С 4-алкилена; где R3a и R3b независимо выбраны из водорода и С 1-С 6 алкила;R2 выбран из метила и этила;Y4 выбран из группы, включающей CR4 и N; где R4 обозначает водород. В другом варианте осуществления R1 выбран из группы, включающей этил, трет-бутил, третбутилметил, изобутил, пропил, изопропил, неопентил, втор-бутил, пентан-3-ил, 2-гидроксипропан-2-ил,1-гидрокси-2-метилпропан-2-ил, 1-гидроксипропан-2-ил, 1-гидрокси-2-метилпропил, 1,1-дифторэтил, 2-6 018551 гидрокси-2-метилпропил, 2-гидроксипропил, этоксиметил, 1-метоксиэтил, 1-феноксиэтил, 1(гидроксимино)этил, пиридинил, пиперазинил, фуранил, фенил, тиазолил, 2,3-дигидробензофуран-2-ил,3-оксоциклобутил, оксетан-3-ил, оксетан-2-ил, тетрагидро-2 Н-пиран-4-ил, тетрагидро-2 Н-пиран-3-ил,тетрагидро-2 Н-пиран-2-ил, тетрагидрофуранил, 1 Н-индол-2-ил, циклобутил, циклопропил, циклопентил и циклогексил; где указанный пиридинил, пиперазинил, фуранил, фенил, тиазолил, 2,3 дигидробензофуран-2-ил, 3-оксоциклобутил, оксетан-3-ил, оксетан-2-ил, тетрагидро-2 Н-пиран-4-ил, тетрагидро-2 Н-пиран-3-ил, тетрагидро-2 Н-пиран-2-ил, тетрагидрофуранил, 1 Н-индол-2-ил, циклобутил,циклопропил, циклопентил или циклогексил необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей хлор, фтор, бром, гидроксигруппу, гидроксиметил, пиридинил, цианогруппу, метил, метоксигруппу, аминометил, метилкарбонил, трифторметил, дифторэтил и трифторметоксигруппу. Другим вариантом осуществления являются соединения, выбранные из группы, включающей 1,7 диметил-3-2-метил-5-[(3-фенил-1,2,4-оксадиазол-5-ил)амино]фенил-1,2-дигидро-1,6-нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-[3-(пиридин-2-ил)-1,2,4-оксадиазол-5-ил]аминофенил)-1,2-дигидро-1,6 нафтиридин-2-он; 1,7-диметил-3-(2-метил-5-[3-(пропан-2-ил)-1,2,4-оксадиазол-5-ил]аминофенил)-1,2 дигидро-1,6-нафтиридин-2-он и 1,7-диметил-3-(2-метил-5-[3-(1,3-тиазол-2-ил)-1,2-оксазол-5-ил]амино фенил)-1,2-дигидро-1,6-нафтиридин-2-он. Другим вариантом осуществления является соединение 1,7-диметил-3-(2-метил-5-[5-(3 оксоциклобутил)-1,2,4-оксадиазол-3-ил]аминофенил)-1,2-дигидро-1,6-нафтиридин-2-он. Настоящее изобретение также относится ко всем подходящим изотопозамещенным вариантам соединений, предлагаемых в настоящем изобретении, или их фармацевтически приемлемым солям. Изотопозамещенный вариант соединения, предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли определяется, как такой, в котором по меньшей мере один атом заменен на атом, обладающий таким же атомным номером, но атомной массой, отличающейся от атомной массы, обычно обнаруживаемой в природе. Примеры изотопов, которые можно включать в соединения, предлагаемые в настоящем изобретении, и их фармацевтически приемлемые соли включают, но не ограничиваются только ими, изотопы водорода, углерода, азота и кислорода, такие как 2 Н, 3 Н, 13 С, 14 С, 15N, 17 О, 18 О, 35S,18F и 36Cl. Некоторые изотопозамещенные варианты соединений, предлагаемых в настоящем изобретении, и их фармацевтически приемлемых солей, например, такие, в которые включены радиоактивные изотопы, такие как 3 Н или 14 С, применимы в лекарственных средствах и/или для исследований распределения в соответствующих тканях. В предпочтительных примерах изотопы 3 Н и 14 С можно использовать вследствие легкости их приготовления и обнаружения. В других примерах замещение изотопами, такими как 2 Н, может обеспечить некоторые терапевтические преимущества, обусловленные большей метаболической стабильностью, например увеличением периода полувыведения in vivo или уменьшением необходимой дозы. Изотопозамещенные варианты соединений, предлагаемых в настоящем изобретении, или их фармацевтически приемлемые соли обычно можно получить по стандартным методикам с использованием соответствующих изотопозамещенных вариантов подходящих реагентов. Соединения согласно изобретению могут применятся в способах лечения заболевания или патологического состояния, модулирующегося киназами рецепторов c-kit и PDGFR и/или , включающим введение соединений формулы I или их фармацевтически приемлемых солей или содержащих их фармацевтических композиций. Примеры опосредуемых с помощью c-kit и/или PDGFR заболеваний или патологических состояний,которые можно опосредовать с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, опухолевое нарушение, аллергическое нарушение, воспалительное нарушение, аутоиммунное нарушение, реакция "трансплантант против хозяина",заболевание, связанное с Plasmodium, заболевание, связанное с мастоцитами, метаболический синдром,нарушение, связанное с ЦНС, нейродегенеративное нарушение, боль, токсикоманию, прионное заболевание, рак, заболевание сердца, фиброзное заболевание, артериальную легочную гипертензию (АЛГ) и первичную легочную гипертензию (ПЛГ). Примеры заболевания, связанного с мастоцитами, которое можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, акне и акне, вызыванные Propionibacterium, прогрессирующую оссифицирующую фибродисплазию(ПОФ), воспаление и разрушение ткани, вызванное воздействием химического или бактериологического оружия (такого как сибирская язва и сернистый иприт), муковисцидоз, заболевание почек, воспалительные мышечные нарушения, ВИЧ (вирус иммунодефицита человека), диабет типа II, ишемию головного мозга, мастоцитоз, лекарственную зависимость и симптомы отмены, нарушения ЦНС (центральная нервная система), предупреждение или сведение к минимуму потери волос, бактериальные инфекции,интерстициальный цистит, воспалительный синдром кишечника (ВСК), воспалительную болезнь кишечника (ВБК), ангиогенез опухоли, аутоиммунные заболевания, воспалительные заболевания, рассеянный склероз (PC), аллергические нарушения (включая астму) и потерю костной массы. Примеры опухолевых нарушений, которые можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, мастоцитоз,-7 018551 желудочно-кишечную стромальную опухоль, мелкоклеточный рак легких, немелкоклеточный рак легких, острый миелоцитарный лейкоз, острый лимфолейкоз, миелодиспластический синдром, хронический миелолейкоз, колоректальную карциному, карциному желудка, тестикулярный рак, глиобластому или астроцитому и меланому. Примеры аллергических нарушений, которые можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, астму,аллергический ринит, аллергический синусит, анафилактический синдром, уртикарию, ангионевротический отек, атопический дерматит, аллергический контактный дерматит, дерматоз, нодозную эритему,полиморфную эритему, кожный некротический венулит, кожное воспаление вследствие укуса насекомого и заражение кровососущими паразитами. Примеры воспалительных нарушений, которые можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, ревматоидный артрит, ВСК, ВБК, конъюнктивит, анкилозирующий спондилит, остеоартрит и подагрический артрит. Примеры аутоиммунных нарушений, которые можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, рассеянный склероз, псориаз, воспалительное заболевание кишечника, язвенный колит, болезнь Крона, ревматоидный артрит, полиартрит, ограниченную или системную склеродермию, системную красную волчанку, дискоидную красную волчанку, кожную волчанку, дерматомиозит, полимиозит, синдром Шегрена,нодозный панартериит, аутоиммунную энтеропатию и пролиферативный гломерулонефрит. Примеры реакций "трансплантант против хозяина", которые можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, отторжение трансплантата после трансплантации органа, такого как трансплантация почки,трансплантация поджелудочной железы, трансплантация печени, трансплантация сердца, трансплантация легкого или трансплантация костного мозга. Примеры метаболического синдрома, который можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, диабет типа I, диабет типа II и ожирение. Примеры нарушений, связанных с ЦНС, которые можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, депрессию, дистимическое нарушение, циклотимическое нарушение, анорексию, булимию, предменструальный синдром, постменопаузный синдром, замедление мышления, ухудшение концентрации внимания, пессимистическую тревогу, тревожное возбуждение, самоуничижение и пониженное либидо, тревожное нарушение, психическое нарушение и шизофрению. Примеры депрессивных состояний, которые можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, биполярную депрессию, тяжелую или меланхолическую депрессию, атипическую депрессию, стойкую депрессию и сезонную депрессию. Примеры тревожных нарушений, которое можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, тревожное нарушение, связанное с гипервентиляцией и аритмиями сердца, фобические нарушения, обсессивно-компульсивное нарушение, посттравматический стресс, острый стресс и генерализованное тревожное нарушение. Примеры психических нарушений, которые можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, приступы паники, включая психоз, бредовые нарушения, конверсионные нарушения,фобии, мании, бред, диссоциативные приступы, включая диссоциативную амнезию, диссоциативное бегство и диссоциативное суицидальное поведение, неряшливость, буйное или агрессивное поведение,травму, пограничные личностные характеристики и острый психоз, такой как шизофрению, включая параноидную шизофрению, дезорганизованную шизофрению, кататоническую шизофрению и недифференцированную шизофрению. Примеры нейродегенеративного нарушения, которое можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, прионные заболевания, заболевание двигательных нейронов (ЗДН) и боковой амиотрофический склероз (БАС). Примеры болей, которые можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, острую боль, послеоперационную боль, хроническую боль, ноцицептивную боль, боль при раке, невропатическую боль и психогенный болевой синдром. Примеры токсикомании, которую можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, привыкание к чрезмерному употреблению лекарственного средства или наркотика, злоупотребление лекарственным средством или наркотиком, привыкание к лекарственному средству или наркотику, зависимость от лекарственного средства или наркотика, синдром отмены или передозировку. Примеры раковых заболеваний, которые можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, меланому,желудочно-кишечную стромальную опухоль (ЖКСО), мелкоклеточный рак легких и другие солидные опухоли. Примеры фиброзных заболеваний, которые можно лечить с использованием соединений и композиций, предлагаемых в настоящем изобретении, включают, но не ограничиваются только ими, гепатит С(HCV), фиброз печени, неалкогольный стеатогепатит (НАСГ), цирроз печени, склеродермию, фиброз легких и фиброз костного мозга. Соединения согласно изобретению могут применятся в способах лечения заболевания или патологического состояния, модулирующегося киназой рецептора c-kit, включающим введение соединений формулы I или их фармацевтически приемлемых солей или содержащих их фармацевтических композиций. Фармакология и применение Соединения, предлагаемые в настоящем изобретении, модулируют активность киназ и как таковые применимы для лечения заболеваний или нарушений, при которых киназы способствуют патологии и/или симптоматике этого заболевания. Примеры киназ, которые ингибируются соединениями и композициями, описанными в настоящем изобретении и по отношению к которых применимы способы, описанные в настоящем изобретении, включают, но не ограничиваются только ими, киназы c-kit, Abl, Lyn,MAPK14 (р 38-дельта), PDGFR, PDGFR, ARG, BCR-Abl, BRK, EphB, Fms, Fyn, KDR, LCK, b-Raf, cRaf, SAPK2, Src, Tie2 и TrkB. Мастоциты (МЦ) являются тканевыми элементами, образованными из особой подгруппы гематопоэтических стволовых клеток, которые продуцируют много разных медиаторов, большинство из которых обладает высокой провоспалительной активностью. Поскольку МЦ распределены почти по всем участкам организма, гиперсекреция медиаторов активированными элементами может привести к поражениям множества органов. Поэтому мастоциты являются главными элементами, участвующими во многих заболеваниях. Настоящее изобретение относится к способу лечения связанных с мастоцитами заболеваний,включающему введение человеку, нуждающемуся в таком лечении, соединения, способного уменьшать количество мастоцитов, или соединения, подавляющего дегрануляцию мастоцитов. Такие соединения можно выбрать из числа ингибиторов c-kit и более предпочтительно - из числа нетоксичных, селективных и активных ингибиторов c-kit. Предпочтительно, если указанные ингибиторы неспособны стимулировать гибель зависимых от IL-3 клеток, выращенных в присутствии IL-3. Связанные с мастоцитами заболевания включают, но не ограничиваются только ими, акне и акне,вызыванные Propionibacterium (акне включает все формы хронического воспаления кожи, включая акне,вызыванные Propionibacterium); чрезвычайно редкое и приводящее к потере трудоспособности генетическое заболевание соединительной ткани, известное как прогрессирующая оссифицирующая фибродисплазия (ПОФ); вредные последствия воспаления и разрушения ткани, вызванного воздействием химического или бактериологического оружия (такого как сибирская язва, сернистый иприт и т. п.); муковисцидоз (генетическое заболевание легких, пищеварительной и репродуктивной системы); заболевание почек,такое как синдром острого нефрита, гломерулонефрит, почечный амилоидоз, почечный интерстициальный фиброз (конечное общее направление, приводящее к терминальной стадии заболевания почек при различных нефропатиях); воспалительные мышечные нарушения, включая миозит и мышечную дистрофию; ВИЧ (например, уменьшение количества инфицированных посредством ВИЧ мастоцитов может представлять собой новый путь лечения инфицирования посредством ВИЧ и родственных заболеваний); лечение диабета типа II, ожирения и родственных нарушений (мастоциты регулируют целый ряд процессов, которые способствуют развитию атеросклероза, включая гипергликемию, гиперхолестеринемию,гипертензию, эндотелиальную дисфункцию, резистентность к инсулину и ремоделирование сосудов); ишемию головного мозга; мастоцитоз (очень неоднородная группа нарушений, характеризующаяся аномальным накоплением мастоцитов в различных тканях, преимущественно в коже и костном мозге, а также в селезенке, печени, лимфатических узлах и желудочно-кишечном тракте); токсикоманию и симптомы отмены (в особенности привыкание к чрезмерному употреблению лекарственного средства или наркотика, злоупотребление лекарственным средством или наркотиком, привыкание к лекарственному средству или наркотику, зависимость от лекарственного средства или наркотика, синдром отмены и передозировку); нарушения ЦНС (в особенности депрессию, шизофрению, тревожное состояние, мигрень, потерю памяти, боль и нейродегенеративные заболевания); стимулирование роста волос (включая предупреждение или сведение к минимуму потери волос); бактериальные инфекции (в особенности инфекции,вызванные бактериями, экспрессирующими FimH); интерстициальный цистит (хроническое воспаление стенки мочевого пузыря, приводящее к повреждению ткани, в особенности в интерстициальном пространстве между клетками в выстилке мочевого пузыря); воспалительные заболевания кишечника вания "трансплантат против хозяина"); воспалительные заболевания, такие как ревматоидный артрит(РА); рассеянный склероз (PC); аллергические нарушения (в особенности аллергический ринит, аллергический синусит, анафилактический синдром, уртикария, ангионевротический отек, атопический дерматит, аллергический контактный дерматит, нодозная эритема, полиморфная эритема, кожный некротический венулит и кожное воспаление вследствие укуса насекомого, бронхиальная астма); полипоз носа и потерю костной массы. Тирозинкиназа Abelson (т.е. Abl, с-Abl) участвует в регуляции клеточного цикла, в клеточном ответе на генотоксичный стресс и в передаче информации о клеточном окружении с помощью сигнала интегрином. В целом представляется, что белок Abl играет сложную роль в качестве клеточного модуля,который объединяет сигналы разных внеклеточных и внутриклеточных источников и который влияет на реакцию, связанную с клеточным циклом и апоптозом. Тирозинкиназа Abelson включает производные подтипы, такие как химерная киназа слияния (онкопротеин) BCR-Abl с дерегулированной тирозинкиназной активностью или v-Abl. BCR-Abl критична для патогенеза в 95% случаев хронического миелолейкоза (ХМЛ) и в 10% случаев острого лимфолейкоза. STI-571 (глеевек) является ингибитором онкогенной тирозинкиназы BCR-Abl и применяется для лечения хронического миелолейкоза (ХМЛ). Однако некоторые пациенты на стадии бластного криза ХМЛ резистентны к STI-571 вследствие мутации в киназе BCRAbl. К настоящему времени описаны более 22 мутаций и самыми распространенными являются G250E,E255V, Т 3151, F317L и М 351 Т. Некоторые соединения, предлагаемые в настоящем изобретении, ингибируют киназу abl, в особенности, киназу v-abl. Некоторые из соединений, предлагаемые в настоящем изобретении, также ингибируют киназу дикого типа BCR-Abl и мутации киназы BCR-Abl и поэтому пригодны для лечения характеризующихся положительной реакцией на Bcr-abl раковых и опухолевых заболеваний, таких как лейкозы(в особенности хронический миелолейкоз и острый лимфобластный лейкоз, для которых обнаружены специфические апоптические механизмы действия), а также оказывают воздействие на подгруппу лейкозных стволовых клеток, а также могут очищать эти клетки in vitro после удаления указанных клеток(например, удаления костного мозга) и реимплантации после их очистки от раковых клеток (например,реимплантации очищенных клеток костного мозга). Путь передачи сигнала Ras-Raf-MEK-ERK опосредует клеточный ответ на сигналы роста. Ras мутирует в онкогенную форму в 15% случаях рака человека. Семейство Raf относится к серин/треонинпротеинкиназам и включает трех представителей, A-Raf, B-Raf и c-Raf (или Raf-1). Воздействие на Raf как на мишень лекарственного средства направлено на роль Raf, как расположенного в прямом направлении эффектора Ras. Однако последние данные показывают, что B-Raf может играть заметную роль в образовании некоторых опухолей без необходимости наличия активированного Ras аллеля(Nature 417, 949-954 (01 J мкл 2002). В частности, мутации B-Raf обнаружены в значительной части злокачественных меланом. Имеющиеся медицинские средства лечения меланомы обладают ограниченной эффективностью, в особенности на поздних стадиях меланом. Соединения, предлагаемые в настоящем изобретении, также подавляют клеточные процессы, включающие b-Raf киназу, и предоставляют новые возможности для лечения раковых заболеваний людей, в особенности меланомы. Соединения, предлагаемые в настоящем изобретении, также подавляют клеточные процессы, включающие c-Raf киназу. c-Raf активируется онкогеном ras, который мутрован при большом количестве раковых заболеваний людей. Поэтому ингибирование киназной активности c-Raf может предоставить средство для предупреждения роста опухоли, опосредуемого ras [Campbell S. L., Oncogene, 17, 1395PDGF (тромбоцитарный фактор роста) является широко распространенным фактором роста, который играет важную роль и при нормальном росте, и при патологической пролиферации клеток, такой как наблюдающаяся при канцерогенезе и заболеваниях гладкомышечных клеток кровеносных сосудов, например при атеросклерозе и тромбозе. Соединения, предлагаемые в настоящем изобретении, могут ингибировать активность рецептора PDGF (PDGFR) и поэтому пригодны для лечения опухолевых заболеваний, таких как глиомы, саркомы, опухоли предстательной железы и опухоли толстой кишки, молочной железы и яичников; гиперэозинофилии; фиброза, такого как фиброз легких; легочной гипертензии и сердечно-сосудистых заболеваний. Соединения, предлагаемые в настоящем изобретении, можно применять не только в качестве веществ, подавляющих опухоли, например при мелкоклеточном раке легких, но и в качестве средства для лечения незлокачественных пролиферативных нарушений, таких как атеросклероз, тромбоз, псориаз,склеродермия и фиброз, а также для защиты стволовых клеток, например, для противодействия гемотоксическому воздействию химиотерапевтических средств, таких как 5-фторурацил, и при астме. Соединения, предлагаемые в настоящем изобретении, предпочтительно можно применять для лечения заболеваний, которые реагируют на ингибирование киназы рецептора PDGF. Соединения, предлагаемые в настоящем изобретении, оказывают полезное воздействие при лечении нарушений, возникающих вследствие трансплантации, например аллогенной трансплантации, в особенности отторжения тканей, в особенности такого как облитерирующий бронхиолит (ОБ), т.е. хрониче- 10018551 ское отторжение аллогенных трансплантатов легких. В отличие от пациентов, не страдающих ОБ, у страдающих ОБ часто обнаруживается повышенная концентрация PDGF в жидких бронхоальвеолярных выделениях. Соединения, предлагаемые в настоящем изобретении, также эффективны при заболеваниях, связанных с миграцией и пролиферацией гладкомышечных клеток сосудов (при которых часто играют рольPDGF и PDGFR), таких как рестеноз и атеросклероз. Эти эффекты и их последствия для пролиферации или миграции гладкомышечных клеток сосудов in vitro и in vivo можно продемонстрировать путем введения соединений, предлагаемых в настоящем изобретении, а также путем исследования их влияния на утолщение интимы сосудов in vivo после механического повреждения. Группа trk нейротропиновых рецепторов (trkA, trkB, trkC) стимулирует жизнеспособность, рост и дифференциацию нейронных и не нейронных тканей. Белок TrkB экспрессируется в клетках нейроэндокринного типа в тонком кишечнике и толстой кишке, в альфа-клетках поджелудочной железы, в моноцитах и макрофагах лимфатических узлов и селезенки и в зернистом слое эпидермиса (Shibayama andKoizumi, 1996). Экспрессирование белка TrkB связывали с неблагоприятным прогрессированием опухолей Вилма и нейробластомами. Кроме того, TkrB экспрессируется в раковых клетках предстательной железы, но не в нормальных клетках. Путь передачи сигналов в прямом направлении от рецепторов trk включает каскад активации МАРК с помощью Shc, активированный Ras, гены ERK-1 и ERK-2 и путь трансдукции PLC-гамма (Sugimoto et al., 2001). Киназа c-Src передает онкогенные сигналы многих рецепторов. Например, сверхэкспрессированиеEGFR или HER2/neu в опухолях приводит к конститутивной активации c-src, характерной для злокачественной клетки, но отсутствующей в нормальной клетке. С другой стороны, мыши, у которых отсутствует экспрессирование c-src, обладают остеопетротическим фенотипом, что указывает на ключевую роль c-src в функции остеокластов и о возможном участии в связанных с этим нарушениях. Киназа семейства Tec, Bmx, нерецепторная протеинтирозинкиназа, регулирует пролиферацию раковых клеток эпителия млекопитающих. Показано, что рецептор 3 фактора роста фибробластов оказывает негативное регуляторное влияние на рост костей и ингибирование пролиферации хондроцитов. Летальная дисплазия вызывается различными мутациями рецептора 3 фактора роста фибробластов, и одна мутация, TDII FGFR3, обладает конститутивной тирозинкиназной активностью, что активирует фактор транскрипции Statl, что приводит к экспрессированию ингибитора клеточного цикла, остановке роста и аномальному развитию костей (Su etal., Nature, 1997, 386, 288-292). FGFR3 также часто экспрессируется при раковых заболеваниях типа множественной миеломы. Ингибиторы активности FGFR3 применимы для лечения опосредуемых Тклетками воспалительных или аутоиммунных заболеваний, включая, но не ограничиваясь только ими,ревматоидный артрит (РА), коллагеновый артрит II, рассеянный склероз (PC), системную красную волчанку (СКВ), псориаз, юношеский диабет, болезнь Шегрена, заболевание щитовидной железы, саркоидоз, аутоиммунный увеит, воспалительную болезнь кишечника (болезнь Крона и язвенный колит), глютеиновую болезнь и миастению gravis. Активность киназы, экспрессируемой под действием сыворотки или глюкокортикоидов (SGK),коррелирует с измененными активностями ионных каналов, в частности натриевых и/или калиевых каналов, и соединения, предлагаемые в настоящем изобретении, можно использовать для лечения гипертензии.Lin et al. (1997) J. Clin. Invest. 100, 8: 2072-2078 и Р. Lin (1998) PNAS 95, 8829-8834, с помощью моделей ксенотрансплататов опухоли молочной железы и меланомы показали, что происходит подавление роста опухоли и васкуляризации, а также уменьшение метастазирования в легкие при аденовирусных инфекциях или при инъекции внутриклеточного домена Tie-2 (Тек). Ингибиторы Tie2 можно использовать в случаях, когда происходит неприемлемая неоваскуляризация (т.е. при диабетической ретинопатии,хроническом воспалении, псориазе, саркоме Капоши, хронической неоваскуляризации вследствие дегенерации желтого пятна, ревматоидном артрите, младенческой гемангиоме и раковых заболеваниях).Lck участвует в Т-клеточной сигнализации. Мыши, лишенные гена Lck, обладают плохой способностью вырабатывать тимоциты. Функция Lck как положительного активатора Т-клеточной сигнализации показывает, что ингибиторы Lck могут быть полезными для лечения аутоиммунного заболевания,такого как ревматоидный артрит. Разные JNK, как и другие МАРК, участвуют в опосредовании клеточного ответа на рак, индуцируемой тромбином агрегации тромбоцитов, иммунодефицитных состояниях, аутоиммунных заболеваниях, гибели клеток, аллергиях, остеопорозе и заболевании сердца. Объекты лечебного воздействия, связанные с активацией пути JNK, включают хронический миелолейкоз (ХМЛ), ревматоидный артрит, астму, остеоартрит, ишемию, рак и нейродегенеративные заболевания. Вследствие важности активацииJNK, связанной с заболеванием печени или приступами печеночной ишемии, соединения, предлагаемые в настоящем изобретении, также могут быть применимы для лечения различных заболеваний печени. Также описана роль JNK в сердечно-сосудистом заболевании, таком как инфаркт миокарда или застойная сердечная недостаточность, и было показано, что JNK опосредует гипертрофические ответы на различные формы сердечного стресса. Показано, что каскад JNK также участвует в активации Т-клеток,- 11018551 включая активацию промотора IL-2. Таким образом, ингибиторы JNK могут быть полезны для применения при измененных патологических иммунных ответах. Также выявлена роль активации JNK при различных раковых заболеваниях, что свидетельствует о возможности применения ингибиторов JNK при раке. Например, конститутивно активированный JNK связан с опосредуемым HTLV-1 онкогенезом [Oncogene 13:135-42 (1996)]. JNK может играть роль при саркоме Капоши (СК). Другие пролиферативные эффекты других цитокинов, участвующих в пролиферации при СК, таких как сосудистый эндотелиальный фактор роста (VEGF), IL-6 и TNF , также могут опосредоваться с помощью JNK. Кроме того, регуляция гена c-jun в р 210 BCR-ABL трансформированных клетках соответствует активности JNK и свидетельствует о роли ингибиторов JNK при лечении хронического миелолейкоза (ХМЛ) [Blood 92:2450-60(1998)]. Предполагается, что некоторые аномальные пролиферативные патологические состояния связаны с экспрессированием raf и поэтому предположительно чувствительны к ингибированию экспрессированияraf. Аномально высокие уровни экспрессирования белка raf также связаны с трансформацией и аномальной пролиферацией клеток. Также предполагается, что эти аномальные пролиферативные патологические состояния чувствительны к ингибированию экспрессирования raf. Например, экспрессирование белка c-raf предположительно играет роль при аномальной пролиферации клеток, поскольку сообщали,что 60% всех линий клеток карциномы легких экспрессируют необычно высокие уровни мРНК и белка craf. Другими примерами аномальных пролиферативных патологических состояний являются гиперпролиферативные нарушения, такие как раковые заболевания, опухоли, гиперплазия, фиброз легких, ангиогенез, псориаз, атеросклероз и пролиферация гладкомышечных клеток кровеносных сосудов, такие как стеноз или рестеноз после ангиопластики. Клеточные сигнальные пути, частью которых является raf,также участвуют в воспалительных нарушениях, характеризующихся пролиферацией Т-клеток (активация и рост Т-клеток), таких как, например, отторжение тканевого лоскута, эндотоксиновый шок и гломерулонефрит. Активированные стрессом протеинкиназы (SAPK) представляют собой семейство протеинкиназ,которые характеризуют предпоследнюю стадию путей передачи сигналов, которые приводят к активации фактора транскрипции c-jun и экспрессированию генов, регулируемых с помощью c-jun. В частности, cjun участвует в транскрипции генов, кодирующих белки, участвующие в репарации ДНК, которая повреждена вследствие генотоксичных инсультов. Поэтому средства, которые ингибируют активностьSAPK в клетке, предотвращают репарацию ДНК и сенсибилизируют клетку по отношению к средствам,которые индуцируют повреждение ДНК или ингибируют синтез ДНК и индуцируют апоптоз клетки, или по отношению к средствам, которые подавляют пролиферацию клеток. Активированные митогеном протеинкиназы (MAPK) являются представителями консервативных путей передачи сигналов, которые активируют факторы транскрипции, факторы трансляции и другие целевые молекулы в ответ на различные внеклеточные сигналы. МАРК активируются фосфорилированием по двойному мотиву фосфорилирования, обладающему последовательностью Thr-X-Tyr, с помощью активированных митогеном протеинкиназкиназ (МКК). У высших эукариотов физиологическая роль передачи сигналов с помощью MAPK была скоррелирована с такими клеточными проявлениями, как пролиферация, онкогенез, развитие и дифференциация. В соответствии с этим способность регулировать трансдукцию сигналов по этим путям (в особенности через MKK4 и MKK6) может привести к разработке средств лечения и профилактики заболеваний, связанных с передачей сигналов с помощью MAPK,таких как воспалительные заболевания, аутоиммунные заболевания и рак. Семейство рибосомных протеинкиназ S6 человека включает по меньшей мере 8 представителей(RSK1, RSK2, RSK3, RSK4, MSK1, MSK2, p70S6K и p70S6 Kb). Протеинкиназы рибосомного белка S6 выполняют важные плейотропные функции, в частности, играют ключевую роль в регуляции трансляции мРНК при биосинтезе белка (Eur. J. Biochem 2000 November; 267(21): 6321-30, Exp Cell Res. Nov. 25,1999; 253 (l):100-9, Mol. Cell Endocrinol. May 25, 1999;151(l-2):65-77). Также показано, что фосфорилирование рибосомного белка S6 посредством p70S6 участвует в регуляции клеточной подвижности (Immunol. Cell Biol. 2000 August;78(4):447-51) и росте клеток (Prog. Nucleic Acid Res. Mol. Biol., 2000;65:101-27) и поэтому может быть важным для метастазирования опухоли, иммунного ответа и восстановления ткани, а также для других патологических состояний.SAPK (также называющиеся "jun N-концевые киназы" или "JNK's") представляют собой семейство протеинкиназ, которые характеризуют предпоследнюю стадию путей передачи сигналов, которые приводят к активации фактора транскрипции c-jun и экспрессированию генов, регулируемых с помощью cjun. В частности, c-jun участвует в транскрипции генов, кодирующих белки, участвующие в репарации ДНК, которая повреждена вследствие генотоксичных инсультов. Средства, которые ингибируют активность SAPK в клетке, предотвращают репарацию ДНК и сенсибилизируют клетку по отношению к средствам лечения рака, которые действуют путем индуцирования повреждения ДНК. ВТК играет роль в аутоиммунном и/или воспалительном заболевании, таком как системная красная волчанка (СКВ), ревматоидный артрит, множественные васкулиты, идиопатическая тромбоцитопеническая пурпура (ИТП), миастения gravis и астма. Вследствие участия ВТК в активации В-клеток ингибиторы ВТК применимы в качестве ингибиторов опосредуемой В-клетками патогенной активности, такой как продуцирование аутоантител, и применимы для лечения В-клеточной лимфомы и лейкоза.CHK2 является представителем семейства киназ checkpoint серин/треонинпротеинкиназ и участвует в механизме, использующемся для контроля повреждения ДНК, такого как повреждение, вызванное мутагенами окружающей среды и эндогенными реакционноспособными кислородсодержащими соединениями. Поэтому она связана с подавлением опухоли и является объектом противораковой терапии.CSK влияет на метастатическую способность раковых клеток, в особенности при колоректальном раке.Fes является нерецепторной протеинтирозинкиназой, которая участвует в различных путях передачи сигналов цитокинов, а также в дифференциации миелоидных клеток. Fes также является основным компонентом дифференциации гранулоцитов. Активность Flt3 рецепторной тирозинкиназы связана с лейкозами и миелодиспластическим синдромом. Примерно в 25% случаев ОМЛ лейкозные клетки экспрессируют конститутивно активную форму аутофосфорилированной (р) FLT3 тирозинкиназы на поверхности клеток. Активность p-FLT3 способствует росту и жизнеспособности лейкозных клеток. Для пациентов, страдающих острым лейкозом, лейкозные клетки которых экспрессируют активную киназу p-FLT3, прогноз результатов химиотерапии является плохим. Ингибирование активности киназы p-FLT3 индуцирует апоптоз (запрограммированную гибель клеток) лейкозных клеток. Ингибиторы IKK и IKK (1 и 2) являются средствами лечения заболеваний, которые включают ревматоидный артрит, отторжение трансплантата, воспалительную болезнь кишечника, остеоартрит, астму, хроническое обструктивное заболевание легких, атеросклероз, псориаз, рассеянный склероз, удар,системную красную волчанку, болезнь Альцгеймера, ишемию головного мозга, травматическое поражение головного мозга, болезнь Паркинсона, боковой амиотрофический склероз, субарахноидальное кровоизлияние и другие заболевания или нарушения, связанные с избыточным продуцированием воспалительных медиаторов в головном мозге и центральной нервной системе.Met связана с большинством типов основных раковых заболеваний человека, и ее экспрессия часто коррелирует с плохим прогнозом и метастазами. Ингибиторы Met являются средствами лечения заболеваний, которые включают раковые заболевания, такие как рак легких, НМКРЛ (немелкоклеточный рак легких), рак кости, рак поджелудочной железы, рак кожи, рак головы и шеи, кожную или внутриглазную меланому, рак матки, рак яичников, рак прямой кишки, рак анальной области, рак желудка, колоректальный рак, рак молочной железы, гинекологические опухоли (например, саркомы матки, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища и карцинома вульвы), болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак эндокринной системы (например, рак щитовидной железы, паращитовидной железы или надпочечников), саркомы мягких тканей, рак мочеиспускательного канала, рак пениса, рак предстательной железы, хронический или острый лейкоз, солидные опухоли у детей, лимфоцитарные лимфомы, рак мочевого пузыря, рак почек или мочеточника (например, почечноклеточная карцинома, карцинома почечной лоханки), злокачественные новообразования у детей, новообразования центральной нервной системы (например, первичная лимфома ЦНС, опухоли оси позвоночника, глиома ствола головного мозга или аденомы гипофиза), раковые заболевания крови,такие как острый миелолейкоз, хронический миелолейкоз и т. п., язву пищевода Баррета (предраковый синдром), опухолевое кожное заболевание, псориаз, фунгоидную гранулему и доброкачественную гипертрофию предстательной железы, связанные с диабетом заболевания, такие как диабетическая ретинопатия, ретинальная ишемия и ретинальная реваскуляризация, цирроз печени, сердечно-сосудистое заболевание, такое как атеросклероз, иммунологическое заболевание, такое как аутоиммунное заболевание и заболевание почек. Предпочтительным заболеванием является рак, такой как острый миелолейкоз и колоректальный рак. Связанная с Nima киназа 2 (Nek2) является регуляторной протеинкиназой клеточного цикла с максимальной активностью в начале митоза, которая локализуется в центросоме. Исследования ее воздействия показали, что Nek2 участвует в регуляции отделения центросомы и образовании веретена. В линиях клеток, полученных из различных опухолей человека, включая опухоли шейки матки, яичников, предстательной железы и в особенности молочной железы, белок Nek2 содержит от 2 до 5 складок. Опосредуемые с помощью p70S6K заболевания или патологические состояния включают, но не ограничиваются только ими, пролиферативные нарушения, такие как рак и туберозный склероз. В соответствии с приведенным выше настоящее изобретение также относится к способу предупреждения или лечения любого из заболеваний или нарушений, описанных выше, у субъекта, нуждающегося в таком лечении, и этот способ включает введение указанному субъекту соединения формулы I или его фармацевтически приемлемой соли в терапевтически эффективном количестве (см. ниже "Введение и фармацевтические композиции"). Для любого из указанных случаев применения необходимая доза меняется в зависимости от пути введения, конкретного подвергающегося лечению патологического состояния и необходимого эффекта. Введение и фармацевтические композиции Обычно соединения, предлагаемые в настоящем изобретении, вводят в терапевтически эффективных количествах посредством любого из обычных и приемлемых путей, известных в данной области техники, по отдельности или в комбинации с одним или большим количеством терапевтических средств. Терапевтически эффективное количество может меняться в широких пределах в зависимости от тяжести заболевания, возраста и относительного состояния здоровья субъекта, активности применяющегося соединения и других факторов. Имеются указания о том, что обычно удовлетворительные результаты получают при системном воздействии и суточных дозах, равных примерно от 0,03 до 2,5 мг/(кг массы тела). Указанная суточная доза для более крупного млекопитающего, например, человека, находится в диапазоне от примерно 0,5 до примерно 100 мг, обычно вводится, например, в виде разделенных доз вплоть до 4 раз в сутки или в форме пролонгированного действия. Разовые дозированные формы, подходящие для перорального введения, содержат примерно от 1 до 50 мг активного ингредиента. Соединения, предлагаемые в настоящем изобретении, можно вводить в виде фармацевтических композиций любым обычным путем, в частности энтерально, например, перорально, например, в виде таблеток или капсул, или парентерально, например, в виде растворов или суспензий для инъекций, местно, например, в виде лосьонов, гелей, мазей или кремов, или в назальной, ингаляционной форме или в форме суппозиториев. Фармацевтические композиции, включающие соединение, предлагаемое в настоящем изобретении, в свободной форме или в форме фармацевтически приемлемой соли совместно по меньшей мере с одним фармацевтически приемлемым носителем или разбавителем, можно приготовить обычным путем по методикам смешивания, гранулирования или нанесения покрытий. Например, композиции для перорального введения могут представлять собой таблетки или желатиновые капсулы, включающие активный ингредиент совместно с: а) разбавителями, например лактозой, декстрозой, сахарозой,маннитом, сорбитом, целлюлозой и/или глицином; b) смазывающими веществами, например диоксидом кремния, тальком, стеариновой кислотой, ее магниевой или кальциевой солью и/или полиэтиленгликолем; для таблеток также со с) связующими, например алюмосиликатом магния, крахмальной пастой, желатином, трагакантовой камедью, метилцеллюлозой, натриевой солью карбоксиметилцеллюлозы и/или поливинилпирролидоном; при необходимости с d) разрыхлителями, например крахмалами, агаром, альгиновой кислотой или ее натриевой солью, или шипучими смесями; и/или е) абсорбентами, красителями,вкусовыми добавками и подсластителями. Композиции для инъекций могут представлять собой водные изотонические растворы или суспензии, и суппозитории можно приготовить из эмульсий или суспензий жирных веществ. Композиции могут быть стерилизованы и/или содержать вспомогательные вещества,такие как консервирующие, стабилизирующие, смачивающие или эмульгирующие агенты, стимуляторы растворения, соли для регулирования осмотического давления и/или буферные вещества. Кроме того,они также могут содержать другие терапевтически полезные вещества. Препараты, подходящие для чрескожного введения, включают эффективное количество соединения, предлагаемого в настоящем изобретении, вместе с носителем. Носитель может включать впитывающиеся фармакологически приемлемые растворители, содействующие проникновению через кожу реципиента. Например, чрескожные устройства представляют собой повязку, включающую защитный элемент, резервуар, содержащий соединение,необязательно совместно с носителями, необязательно регулирующий скорость барьерный элемент для доставки соединения к коже реципиента с регулируемой и заранее заданной скоростью в течение продолжительного периода времени и средства для закрепления устройства на коже. Также можно использовать матричные препараты для чрескожного введения. Препаратами, подходящими для местного нанесения, например, на кожу и в глаза, предпочтительно являются водные растворы, мази, кремы или гели,хорошо известные в данной области техники. Они могут содержать солюбилизаторы, стабилизаторы,усиливающие тоничность агенты, буферные вещества и консерванты. Подходящие фармацевтические инертные наполнители известны в данной области техники (см. публикацию Handbook of PharmaceuticalExcipients, Fifth Edition - edited by Raymond Rowe, Рамкл Sheskey and Sian Owen). Соединения, предлагаемые в настоящем изобретении, можно вводить в терапевтически эффективных количествах в комбинации с одним или большим количеством терапевтических средств (фармацевтические комбинации). Например, синергетический эффект может проявляться при использовании других средств лечения астмы, например стероидов и антагонистов лейкотриена. Например, синергетический эффект может проявляться при использовании других иммуномодулирующих или противовоспалительных средств, например, при использовании в комбинации с циклоспорином, рапамицином или аскомицином или с их иммунодепрессантными аналогами, например циклоспорином A (CsA), циклоспорином G, FK-506, рапамицином или сравнимыми соединениями, кортикостероидами, циклофосфамидом, азатиоприном, метотрексатом, брехинаром, лефлуномидом, мизорибином, микофеноловой кислотой, микофенолятмитефилом, 15-дезоксиспергуалином, иммунодепрессантными антителами, в особенности моноклональными антителами к рецепторам лейкоцитов, например МНС, CD2, CD3, CD4, CD7, CD25, CD28, В 7, CD45, CD58 или их лигандами, или другими иммуномодулирующими соединениями, такими как CTLA41g. Соединения, предлагаемые в настоящем изобретении,можно использовать в комбинации с антифиброзными средствами, такими как пирфенидон и такролимус; средствами, применяющимися для лечения АЛГ, такими как антагонисты эндотелина (например,босентан) и ингибиторами PDE5 (например, силденафилом); лекарственными препаратами для лечения астмы, например, бронхолитическими средствами, такими как агонисты 2, ксантины (например, метилксантины) и антихолинергетики; и противовоспалительным средством. Когда соединения, предла- 14018551 гаемые в настоящем изобретении, вводят совместно с другими средствами, разумеется, дозы вводимых совместно соединений будут меняться в зависимости от типа используемого совместно лекарственного средства, конкретного используемого лекарственного средства, подвергающегося лечению патологического состояния и т.п. Настоящее изобретение также относится к фармацевтическим комбинациям, например к набору,включающему: а) первое средство, которое является соединением, предлагаемым в настоящем изобретении, раскрытым в настоящем изобретении, в свободной форме или в форме фармацевтически приемлемой соли, и b) по меньшей мере одно дополнительное средство. Набор может включать инструкции по его введению. Термины "совместное введение" или "комбинированное введение" и т.п. при использовании в настоящем изобретении означают введение выбранных терапевтических средств одному пациенту и включает режимы лечения, при которых средства необязательно вводят по одному и тому же пути введения или в одно и то же время. Термин "фармацевтическая комбинация" при использовании в настоящем изобретении означает препарат, который получен смешиванием или объединением более одного активного ингредиента и включает и фиксированные, и нефиксированные комбинации активных ингредиентов. Термин "фиксированная комбинация" означает, что активные ингредиенты, например соединение формулы I и дополнительное средство, оба вводят пациенту одновременно в виде одного препарата или дозированной формы. Термин "нефиксированная комбинация" означает, что активные ингредиенты, например, соединение формулы I и дополнительное средство, оба вводят пациенту в виде отдельных препаратов одновременно,по отдельности или последовательно без наложения специальных ограничений по времени, и при таком введении в организме пациента создаются терапевтически эффективные уровни этих 2 соединений. Последнее также относится к смешанному лечению, например с введением 3 или большего количества активных ингредиентов. Способы получения соединений, предлагаемых в настоящем изобретении Настоящее изобретение также относится к способам получения соединений, предлагаемых в настоящем изобретении. Для описанных реакций может оказаться необходимой защита реакционноспособных функциональных групп, например гидрокси-, амино-, имино-, тио- или карбоксигрупп, если необходимо, чтобы они содержались в конечном продукте, чтобы избежать их нежелательного участия в реакциях. Можно использовать обычные защитные группы в соответствии со стандартной практикой; см., например, T.W. Greene and P. G. M. Wuts in "Protective Groups in Organic Chemistry", John Wiley andSons, 1991. Соединения формулы Ia можно получить по следующим схемам реакций I: Схема реакций I где R1 и Y являются такими, как описано в Кратком изложении сущности изобретения. Соединение формулы Ia можно получить по реакции соединения формулы 2 с подходящим промежуточным продуктом (например, NH2OH и т.п.) и в присутствии подходящего растворителя (например, этанола и т.п.). Реакция протекает в температурном диапазоне от примерно 50 до примерно 180 С и до завершения может продолжаться в течение до 24 ч. Схема реакций II где R1 и Y являются такими, как описано в Кратком изложении сущности изобретения. Соединение формулы Ib можно получить по реакции соединения формулы 3 с подходящим реагентом (например,POCl3 и т.п.) и в присутствии подходящего растворителя (например, ТГФ (тетрагидрофуран) и т.п.). Реакция протекает в температурном диапазоне от примерно 50 до примерно 180 С и до завершения может продолжаться в течение до 24 ч. Подробное описание синтеза соединение формулы I приведено в представленных ниже примерах. Дополнительные методики синтеза соединений, предлагаемых в настоящем изобретении Соединение, предлагаемое в настоящем изобретении, можно получить в виде фармацевтически приемлемой соли присоединения с кислотой по реакции соединения в свободной форме с фармацевтически приемлемой неорганической или органической кислотой. Альтернативно, фармацевтически приемлемую соль присоединения соединения, предлагаемого в настоящем изобретении, с основанием можно получить по реакции соединения в форме свободной кислоты с фармацевтически приемлемым неоргани- 15018551 ческим или органическим основанием. Альтернативно, солевые формы соединений, предлагаемых в настоящем изобретении, можно получить с использованием солей исходных веществ или промежуточных продуктов. Формы свободной кислоты или свободного основания соединений, предлагаемых в настоящем изобретении, можно получить из соответствующих солей присоединения с основаниями или солей присоединения с кислотами соответственно. Например, соединение, предлагаемое в настоящем изобретении, в форме соли присоединения с кислотой можно превратить в соответствующее свободное основание путем обработки подходящим основанием (например, раствором гидроксида аммония, гидроксидом натрия и т.п.). Например, соединение, предлагаемое в настоящем изобретении, в форме соли присоединения с основанием можно превратить в соответствующую свободную кислоту путем обработки подходящей кислотой (например, хлористо-водородной кислотой и т.п.). Соединения, предлагаемые в настоящем изобретении, в неокисленной форме можно получить из Nоксидов соединений, предлагаемых в настоящем изобретении, путем обработки восстановительным реагентом (например, серой, диоксидом серы, трифенилфосфином, борогидридом лития, борогидридом натрия, трихлоридом, трибромидом фосфора и т.п.) в подходящем инертном органическом растворителе(например, ацетонитриле, этаноле, водном растворе диоксана и т.п.) при температуре от 0 до 80 С. Пролекарственные производные соединений, предлагаемых в настоящем изобретении, можно получить по методикам, известным специалистам с общей подготовкой в данной области техники (дополнительные подробности см., например, в публикации Saulnier et al., (1994), Bioorganic and MedicinalChemistry Letters, vol. 4, p. 1985). Например, подходящие пролекарства можно получить по реакции не являющегося производным соединения, предлагаемого в настоящем изобретении, с подходящим карбамоилирующим реагентом (например, 1,1-ацилоксиалкилкарбанохлоридатом, п-нитрофенилкарбонатом и т.п.). Защищенные производные соединений, предлагаемых в настоящем изобретении, можно получить по методикам, известным специалистам с общей подготовкой в данной области техники. Подробное описание методик, применимых для введения защитных групп и их удаления, приведено в публикации Т. W.Greene, "Protecting Groups in Organic Chemistry", 3 edition, John Wiley и Sons, Inc., 1999. Соединения, предлагаемые в настоящем изобретении, можно легко получить или сформировать способом, предлагаемым в настоящем изобретении, в виде сольватов (например, гидратов). Гидраты соединений, предлагаемых в настоящем изобретении, можно легко получить путем перекристаллизации из водно/органических смесей растворителей с использованием органических растворителей, таких как диоксан, тетрагидрофуран или метанол. Соединения, предлагаемые в настоящем изобретении, можно получить в виде отдельных стереоизомеров с помощью реакции рацемической смеси соединения с оптически активным разделяющим реагентом с образованием пары диастереоизомерных соединений, разделения диастереоизомеров и выделения оптически чистых энантиомеров. Хотя разделение энантиомеров можно провести с использованием ковалентных диастереоизомерных производных соединений, предлагаемых в настоящем изобретении,предпочтительны диссоциирующие комплексы (например, кристаллические соли диастереоизомеров). Диастереоизомеры обладают разными физическими характеристиками (например, температурами плавления, температурами кипения, растворимостями, реакционной способностью и т.п.) и их можно легко разделить с использованием этих различий. Диастереоизомеры можно разделить с помощью хроматографии или, предпочтительно, по методикам разделения, основанным на различиях их растворимостей. Затем оптически чистый энантиомер вместе с разделяющим реагентом извлекают по любой возможной методике, которая не приводит к рацемизации. Более подробное описание методик, пригодных для выделения стереоизомерных соединений из их рацемической смеси, приведено в публикации Jean Jacques,Andre Collet, Samuel H. Wilen, "Enantiomers, Racemates и Resolutions", John Wiley And Sons, Inc., 1981. Резюмируя, можно сказать, что соединения формулы I можно получить способом, который включает:(a) проведение реакций по схемам реакций I и II и(c) необязательное превращение солевой формы соединения, предлагаемого в настоящем изобретении, в несолевую форму;(d) необязательное превращение неокисленной формы соединения, предлагаемого в настоящем изобретении, в фармацевтически приемлемый N-оксид;(f) необязательное выделение индивидуального изомера соединения, предлагаемого в настоящем изобретении, из смеси изомеров;(g) необязательное превращение не являющегося производным соединения, предлагаемого в настоящем изобретении, в фармацевтически приемлемое пролекарственное производное и(h) необязательное превращение пролекарственного производного соединения, предлагаемого в на- 16018551 стоящем изобретении, в его не являющуюся производным форму. Если получение исходных веществ специально не описано, то эти соединения являются известными или их можно получить по методикам, аналогичным известным в данной области техники или раскрытым в приведенных ниже примерах. Специалист в данной области техники должен понимать, что описанные выше превращения являются только примерами методик получения соединений, предлагаемых в настоящем изобретении, и что также можно использовать другие хорошо известные методики. Примеры Настоящее изобретение дополнительно описывается, но не ограничивается приведенными ниже примерами, которые иллюстрируют получение соединений формулы I, предлагаемых в настоящем изобретении. Синтез промежуточных продуктов Синтез 3-(5-амино-2-метилфенил)-7-хлор-1 -метил-1,6-нафтиридин-2( 1 Н)-она (8) В колбу объемом 2 л помещали диэтил-1,3-ацетондикарбоксилат 1 (160 г, 0,79 моль), триэтилортоформиат (129 г, 0,87 моль) и уксусный ангидрид (161 г, 1,58 моль). Полученную смесь нагревали при 120 С в течение 1,5 ч. Смесь охлаждали до КТ (комнатная температура) и летучие вещества удаляли с помощью перегонки в вакууме (150-200 мм рт.ст.) при 90-100 С. Светло-желтое масло собирали в холодильнике. Затем остаток, находящийся в колбе охлаждали в бане со льдом, смешивали с 30% раствором аммиака (65 мл). Реакционную смесь выдерживали в бане со льдом в течение 1 ч и затем с помощью 2 н. HCl подкисляли до рН 5. Смесь концентрировали в вакууме и неочищенный продукт очищали с помощью флэшхроматографии (этилацетат : петролейный эфир =1:1). Продукт 2 выделяли в виде бесцветного масла. Этиловый эфир 4,6-дигидроксиникотиновой кислоты 2 (5 г, 0,3 моль) смешивали с POCl3 (500 мл) в колбе объемом 2 л и нагревали при 110 С в течение 3 ч. После охлаждения до КТ большую часть POCl3 удаляли в вакууме. Неочищенный обладающий темной окраской продукт выливали в небольшое количество смеси воды со льдом и нейтрализовывали насыщенным водным раствором карбонат натрия. Продукт экстрагировали дважды этилацетатом. Объединенный органический слой промывали насыщенным водным раствором хлорид натрия и сушили над Na2SO4. Очистка с помощью флэш-хроматографии(этилацетат : петролейный эфир =1:3) давала продукт, этиловый эфир 4,6-дихлорникотиновой кислоты 3,в виде белого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3)8,85 (s, 1H), 7,47 (s, 1H), 4,43 (q, J = 7,2 Гц, 2 Н), 1,41 (t, J =7,2 Гц, 3 Н). Этиловый эфир 4,6-дихлорникотиновой кислоты 3 (43 г, 195 моль) растворяли в ацетонитриле (600 мл), охлаждали до 0 С и медленно добавляли метиламин (125 мл 40% водного раствора, 977 ммоль). Реакционную смесь перемешивали при 0 С в течение 30 мин и нагревали при КТ в течение еще 3 ч. Растворитель удаляли в вакууме и неочищенный продукт очищали с помощью флэш-хроматографии (этилацетат : петролейный эфир =1:1). Продукт 4 выделяли в виде белого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3)8,66 (s, 1 Н), 8,12 (bs, 1H), 6,53 (s, 1H), 4,34 (q, J = 7,2 Гц, 2 Н), 2,92 (s,3H), 1,37 (t, J = 7,2 Гц, 3 Н). Этиловый эфир 6-хлор-4-метиламиноникотиновой кислоты 4 (33 г, 156 моль) растворяли в безводном ТГФ (500 мл) и охлаждали до -78 С. К раствору медленно добавляли раствор АГЛ (алюмогидрид лития) (12,5 г, 329 ммоль) в ТГФ (500 мл). После завершения добавления реакционную смесь выдержи- 17018551 вали при -78 С в течение 1 ч. Смесь нагревали до КТ и медленно добавляли небольшое количество смеси МеОН/этилацетат (1/1) для разложения избытка АГЛ. Неочищенный продукт фильтровали через слой целита и дважды промывали этилацетатом. После удаления растворителя в вакууме неочищенный продукт очищали с помощью флэш-хроматографии (этилацетат : петролейный эфир = 1 : 1). Продукт 5 получали в виде белого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3)7,36 (s, 1H), 6,48 (s, 1H), 5,55 (bs, 1H), 4,63 (s, 2H), 2,89 (d, J = 5,1 Гц,3 Н). Соединение 5 (20 г, 116 моль) растворяли в ДХМ (дихлорметан) (250 мл) и добавляли MnO2 (100 г,1,16 моль). Реакционную смесь перемешивали при КТ в течение ночи, затем фильтровали через слой целита и промывали этилацетатом. После удаления растворителя в вакууме получали 6 и использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (300 МГц, CDCl3)9,85 (s, 1H), 8,59 (bs, 1H), 8,31 (s, 1H), 6,59 (s, 1H), 2,96 (d, J= 5,1 Гц,3 Н). 6-Хлор-4-метиламинопиридин-3-карбальдегид 6 (19,8 г, 116 моль) смешивали с метиловым эфиром 2-(5-амино-2-метилфенил)уксусной кислоты 7 (27 г, 151 ммоль) и карбонатом калия (48,1 г, 348 моль) в ДМФ (диметилформамид) (1 л). Смесь нагревали при 100 С в течение 16 ч. После охлаждения до КТ и удаления растворителя в вакууме неочищенный продукт очищали с помощью флэш-хроматографии(этилацетат : петролейный эфир = 1:1). Искомое соединение 8 получали в виде палевого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3)8,56 (s, 1H), 7,63 (s, 1H), 7,27 (s, 1H), 7,06 (d, J = 8,1 Гц, 1H), 6,74 (dd, J = 2,4,8,1 Гц, 1H), 6,58 (d, J = 2,4 Гц, 1H), 3,71 (s, 2H), 2,10 (s, 3H). Синтез метил-2-(5-амино-2-метилфенил)ацетата (7) 2-Метил-5-нитробензойную кислоту 9 (125 г, 690 моль) растворяли в безводном ТГФ (1,25 л). После добавления борана (517 мл 2 М раствора в ТГФ, 1,04 моль) реакционную смесь перемешивали при КТ в течение 18 ч. Реакцию останавливали водным раствором карбоната калия (112,5 г в 2,5 л). После удаления ТГФ в вакууме водный раствор экстрагировали с помощью ДХМ и объединенный органический слой промывали рассолом и сушили над сульфатом натрия. После фильтрования и удаления растворителя в вакууме получали продукт 10 в виде бледно-желтого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3)8,29 (d, J = 3 Гц, 1H), 8,50 (m, 1H), 7,29 (m, 1H), 4,78 (s, 2H), 2,41 (s,3 Н).(2-Метил-5-нитрофенил)метанол 10 (96 г, 574 ммоль) растворяли в безводном ДХМ (2,5 л), охлаждали до 0 С и в течение 30 мин обрабатывали метансульфонилхлоридом (72 г, 632 ммоль) и диизопропилэтиламином (89 г, 689 моль). Реакционную смесь нагревали до КТ и перемешивали в течение еще 30 мин. Реакцию останавливали путем добавления воды (600 мл). Органический слой промывали рассолом,сушили над сульфатом натрия и фильтровали. После удаления растворителя в вакууме продукт 11 выделяли в виде желтого масла и использовали на следующей стадии без дополнительной очистки. К раствору неочищенного 11 (141 г, 0,575 моль) в ацетонитриле (4 л) добавляли цианид натрия(84,4 г, 1,7 моль) и полученную смесь кипятили с обратным холодильником в течение 8 ч. Реакционную смесь охлаждали до КТ и растворитель удаляли в вакууме. Неочищенный продукт растворяли в ДХМ и фильтровали. Фильтрат промывали рассолом и сушили над сульфатом натрия. После удаления растворителя в вакууме неочищенный продукт очищали с помощью флэш-хроматографии (этилацетат : петролейный эфир = 1 : 1). Продукт 12 получали в виде желтого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3)8,25 (d, J =2,4 Гц, 1H), 8,13 (dd, J = 2,4, 8,1 Гц, 1H), 7,41 J = 8,1 Гц,1 Н), 3,78 (s, 2H), 2,48 (s, 3 Н). 2-(2-Метил-5-нитрофенил)этаннитрил 12 (87 г, 494 ммоль) растворяли в смеси метанол : вода =1:1(1,2 л). Добавляли гидроксид калия (277 г, 4,94 моль) в воде (1 л) и реакционную смесь кипятили с обратным холодильником в течение 14 ч. После охлаждения до КТ и удаления метанола в вакууме водный слой промывали с помощью ДХМ и эфиром. Объединенный органический слой промывали рассолом,сушили над сульфатом натрия и фильтровали. После удаления растворителя в вакууме получали продукт 13 в виде оранжевого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3) 5 8,07 (m, 2H), 7,35 (d, J = 8,1 Гц, 1H), 3,78 (s,2H), 2,43 (s, 3 Н). 2-(2-Метил-5-нитрофенил)уксусную кислоту 13 (30 г, 154 ммоль) растворяли в метаноле (700 мл) и добавляли HCl (79 мл 4 М раствора в 1,4-диоксане, 316 моль). Реакционную смесь кипятили с обратным холодильником в течение 14 ч. После охлаждения до КТ и удаления растворителя в вакууме неочищенный продукт растворяли в воде (500 мл) и подщелачивали до рН 12 2 н. гидроксидом натрия. Раствор экстрагировали этилацетатом и объединенный органический слой промывали рассолом, сушили над сульфатом натрия и фильтровали. После удаления растворителя в вакууме продукт 14 получали в виде темно-желтого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3)8,06 (m, 2 Н), 7,33 (d, J = 8,4 Гц, 1 Н), 3,73 (s, 3H), 3,72 (s, 2H), 2,41 (s,3 Н). Метиловый эфир 2-(2-метил-5-нитрофенил)уксусной кислоты 14 (32 г, 153 ммоль) растворяли в этаноле (750 мл). К этому раствору добавляли 10% палладий на угле (3,2 г). После дегазации смеси присоединяли баллон с водородом. Реакционную смесь перемешивали при КТ в течение 16 ч. После удаления катализатора фильтрованием через слой целита и удаления растворителя в вакууме неочищенный продукт очищали с помощью флэш-хроматографии (этилацетат : петролейный эфир = 5 : 1). Продукт 7 выделяли в виде желтого масла. 1 Н ЯМР (300 МГц, CDCl3)6,9 (d, J = 7,8 Гц), 6,59 (m, 1H), 6,56 (m, 1H), 3,69 (s, 3 Н). Синтез 3-(5-амино-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1H)-она (15) К раствору 3-(5-амино-2-метилфенил)-7-хлор-1-метил-1,6-нафтиридин-2-она 8 (0,53 ммоль) в диоксане (3 мл) добавляли трифенилфосфин (0,08 ммоль), Pd2(dba)3 (16 мкмолей) и триметилалюминий (0,8 мл 2,0 М раствора в толуоле). Смесь дегазировали в течение 10 мин. Сосуд для проведения реакции герметизировали и нагревали микроволновым излучением в течение 10 мин при 150 С. Реакционную смесь охлаждали до КТ и выливали в 1 М HCl (30 мл) и промывали с помощью EtOAc. Водный слой подщелачивали с помощью 3 М NaOH и экстрагировали с помощью EtOAc (320 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и выпаривали досуха. Неочищенное желтое масло очищали с помощью флэш-хроматографии на диоксиде кремния с использованием ДХМ, содержащего 35% МеОН, в качестве элюента и получали желтое стеклообразное твердое вещество 15. 1 Н ЯМР (400 МГц, CDCl3)8,67 (s, 1H), 7,63 (s, 1H), 7,08 (s, 1H), 7,05 (d, J = 8,4 Гц, 1H), 6,65 (dd, J= 8,4, 2,4 Гц, 1H), 6,57 (d, J = 2,4 Гц, 1H), 3,72 (s, 3H), 2,70 (s, 3H), 2,11 (s, 3H). MC m/z (M+l)+: 280,1. Синтез 3-(5-амино-2-метилфенил)-7-этил-1-метил-1,6-нафтиридин-2(1 Н)-она (15 а) С использованием в качестве исходного вещества 8 (1,0 ммоль) получали 3-(5-амино-2 метилфенил)-7-этил-1-метил-1,6-нафтиридин-2(1 Н)-он (15 а) и очищали так же, как (15) и получали желтое твердое вещество. MC m/z (M+1) : 294,1. Синтез К раствору бромциана (0,08 г, 0,7 ммоль, 1,0 экв.) в безводном метаноле (3 мл) добавляли ацетат калия (0,21 г, 2,1 ммоль, 3,0 экв.) и охлаждали до 0 С. Затем добавляли раствор анилина 15 (0,2 г, 0,7 ммоль, 1,0 экв.) в безводном метаноле (2 мл). После добавления реакционную смесь нагревали до КТ и перемешивали в течение еще 3 ч. За расходом анилина 15 следили с помощью ЖХ/МС (жидкостная хроматография/масс-спектрометрия) и после его полного израсходования реакционную смесь разбавляли с помощью ДХМ (30 мл) и промывали водой и рассолом. Органический слой сушили над сульфатом магния, фильтровали и растворитель удаляли. Неочищенный цианамид 16 использовали на следующей стадии без дополнительной очистки. К раствору неочищенного цианамида 16 (0,22 г, 0,7 ммоль) в абсолютном этаноле (10 мл) добавляли гидроксиламин (0,07 мл, 1,5 экв. 50% водного раствора). Реакционную смесь перемешивали при КТ в течение 12 ч. Растворитель выпаривали досуха и неочищенный остаток растворяли в ДХМ (10-15 мл) и Промежуточный продукт 17 а получали так же, как соединение 17, с использованием в качестве исходного вещества 0,3 ммоль 15 а. Синтез N-(3-(1,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфенил)-1 Н-имидазол-1 карбоксамида (18) К раствору 3-(5-амино-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-она 15 (22 мг, 0,08 ммоль) в АЦН (ацетонитрил) (0,5 мл) добавляли карбонилдиимидазол (16 мг, 0,09 ммоль). После перемешивания при КТ в течение 2 ч растворитель удаляли и неочищенное вещество, N-(3-(1,7-диметил-2 оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфенил)-1 Н-имидазол-1-карбоксамид 18, использовали без дополнительной очистки. MC m/z 374,3 (М+1). Синтез 3-(5-изотиоцианато-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-она (19) К раствору 3-(5-амино-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-она 15 (280 мг, 1 ммоль) в ДХМ (5 мл) при КТ добавляли 1,1-тиокарбонилдипиридин-2(1 Н)-он (233 мг, 1 ммоль). Через 1 ч растворитель удаляли в вакууме. Неочищенное белое твердое вещество, 3-(5-изотиоцианато-2-метилфенил)1,7-диметил-1,6-нафтиридин-2(1 Н)-он 19, использовали без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3)8,64 (s, 1H), 7,18 (d, J = 8,0 Гц, 1H), 7,09 (dd, J = 2,4, 8,0 Гц, 1H), 7,05 (d,J = 2 Гц, 1H), 7,04 (s, 1H), 3,66 (s, 3H), 2,64 (s, 3H), 2,16 (s, 3H). MC m/z 322,2 (M+l). Синтез соединений, предлагаемых в настоящем изобретении Методика 1 Пример А 5. Синтез 3-(5-(5-этил-1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1,7-диметил-1,6 нафтиридин-2(1 Н)-она Ангидрид пропионовой кислоты (46 мкл, 0,35 ммоль) добавляли к гидроксигуанидину 17 (0,1 г, 0,30 ммоль) в сухом диоксане (3 мл). Полученную смесь перемешивали при 100 С в течение 3 ч. После охлаждения и фильтрования смесь очищали с помощью препаративной ЖХ/МС и получали 3-(5-(5-этил 1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-он (А 5). Белое твердое вещество суспендировали в безводном ДХМ и обрабатывали 2 М раствором HCl и получали соответствующую соль с HCl с количественным выходом. 1 Н ЯМР (400 МГц, d4-СН 3 ОН)9,08 (s, 1H), 8,04 (s, 1 Н), 7,45 (s, 1H), 7,34 (dd, J = 8,0 и 4,0 Гц, 1 Н),7,25 (d, J = 8,0 Гц, 1H), 3,82 (s, 3 Н), 2,85 (s, 3 Н), 2,85 (q, J = 8,0 Гц, 2 Н), 2,16 (s, 3H), 1,35 (t, J = 8,0 Гц, 3 Н). К раствору 3-(5-амино-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-она 15 (280 мг, 1 ммоль) в ДХМ (5 мл) при КТ добавляли бензоилизотиоцианат (180 мг, 1,1 ммоль). Через 10 мин растворитель удаляли в вакууме. Остаток промывали с помощью EtOH и получали искомый продукт, N-(3-(1,7 диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфенилкарбамотиоил)бензамид 20, в виде белого твердого вещества. МС m/z 443,1 (М+1). К растворуN-(3-(l,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфенилкарбамотиоил)бензамида 20 (22 мг, 0,05 ммоль) в ДХМ (0,5 мл) добавляли твердый порошкообразный NaOH(20 мг, 0,5 ммоль) и MeI (7 мг, 0,05 ммоль). Смесь перемешивали при КТ в течение 1 ч и после удаления ДХМ получали (Z)-метил-N'-бензоил-N-(3-(1,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4 метилфенил)карбамимидотиоат 21. Неочищенный 21 использовали без дополнительной очистки. МС m/z 457,2 (М+1). Гидроксиламингидрохлорид (35 мг, 0,5 ммоль) и EtOH (1 мл) добавляли к неочищенному 21 (0,05 ммоль). Смесь нагревали при 80 С в течение 2 ч. После фильтрования смесь очищали с помощью препаративной ЖХ/МС и получали 1,7-диметил-3-(2-метил-5-(5-фенил-1,2,4-оксадиазол-3-иламино)фенил)1,6-нафтиридин-2(1 Н)-он А 7. 1 Н ЯМР (400 МГц, d4-МеОН)9,03 (s, 1H), 8,12 (s, 1 Н), 8,1 (d, J= 1,5 Гц, 1H), 8,05 (s, 1H), 7,83 (s, 1H),7,65 (d, J= 6,2 Гц, 1H), 7,59 (d, J = 6,3 Гц, 1 Н), 7,57 (d, J = 7,2 Гц, 1H), 7,5 (d, J = 2,4 Гц, 1H), 7,43 (dd, J = 8,3, 2,5 Гц, 1H), 7,27 (d, J= 8,4 Гц, 1H), 3,84 (s, 3H), 2,83 (s, 3H), 2,18 (s, 3H). MC m/z 424,1 (M+1). Пример А 6. Синтез 3-(5-(5-изопропил-1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1,7-диметил-1,6 нафтиридин-2(1 Н)-она Смесь изобутирилхлорида (160 мг, 1,5 ммоль) и изотиоцианата аммония (114,2 мг,1,5 ммоль) в ацетоне (2,0 мл) нагревали при 40 С в течение 3 ч. К полученной выше реакционной смеси при КТ добавляли 3-(5-амино-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-он (15) (419 мг, 1,5 ммоль) и перемешивали в течение 30 мин. Растворитель удаляли в вакууме и получали N-(3-(1,7-диметил-2-оксо-1,2 дигидро-1,6-нафтиридин-3-ил)-4-метилфенилкарбамотиоил)изобутирамид 22, который использовали без очистки. MC m/z 409,2 (М+1). К неочищенномуN-(3-(1,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфенилкарбамотиоил)изобутирамиду 22, полученному выше, в EtOH (2,0 мл) добавляли NaOH (180 мг, 4,5 ммоль) и Mel (213 мг, 1,5 ммоль) и полученную смесь перемешивали при КТ в течение 1 ч. Затем добавляли гидроксиламингидрохлорид (313 мг, 4,5 ммоль) и реакционную смесь нагревали при 80 С в течение 30 мин. Очистка с помощью ВЭЖХ (высокоэффективная жидкостная хроматография) и препаративной ТСХ К раствору бензойной кислоты (0,67 г, 5,5 ммоль), HATU (О-(7-азабензотриазол-1-ил)-N,N,N',N'тетраметилуронийгексафторфосфат) (2,09 г, 11 моль) и ДИПЭА (диизопропилэтиламин) (1,05 мл, 6 ммоль) в сухом ДМФ (10 мл) при КТ в присутствии безводного Na2SO4 (7 г, 50 ммоль) медленно добавляли 17 (1,69 г, 5 ммоль). С помощью ЖХ/МС зарегистрировано полное израсходование 17. Добавляли дополнительное количество безводного ДМФ (40 мл) и смесь нагревали при 100 С в течение 1 ч. Твердое вещество отфильтровывали и большую часть ДМФ удаляли в вакууме. Остаток подвергали распределению в смеси воды (150 мл), водного раствора Na2CO3 (2 М, 10 мл), EtOAc (200 мл) и МеОН (20 мл). Затем органическую фазу промывали водой (2 50 мл). После сушки и удаления EtOAc твердый остаток суспендировали и перемешивали в АЦН (40 мл) в течение 16 ч. Фильтрование и промывка большим количеством АЦН давали А 7 в виде твердого вещества. 1 Н ЯМР (400 МГц, d4-МеОН)9,03 (s, 1 Н), 8,12 (s, 1H), 8,1 (d, J = 1,5 Гц, 1H), 8,05 (s, 1H), 7,83 (s,1H), 7,65 (d, J = 6,2 Гц, 1H), 7,59 (d, J = 6,3 Гц, 1H), 7,57 (d, J = 7,2 Гц, 1H), 7,5 (d, J=2,4 Гц, 1H), 7,43 (dd,J = 8,3, 2,5 Гц, 1H), 7,27 (d, J = 8,4 Гц, 1 Н), 3,84 (s, 3 Н), 2,83 (s, 3 Н), 2,18 (s, 3 Н). МС m/z 424,1 (М+1). Пример А 32. Синтез 3-(5-(5-(2-гидроксипропан-2-ил)-1,2,4-оксадиазол-3-иламино)-2-метилфенил)1,7-диметил-1,6-нафтиридин-2(1 Н)-она(0,027 мл, 0,15 ммоль) перемешивали в сухом ДМФ (3 мл) в течение 1 ч и затем при КТ добавляли 17 (50 мг, 0,14 ммоль). Перемешивание продолжали в течение 1 ч и затем смесь нагревали при 100 С в течение 5 ч. После охлаждения и фильтрования смесь очищали с помощью препаративной ЖХ/МС и получали 3(5-(5-(2-гидроксипропан-2-ил)-1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1,7-диметил-1,6-нафтиридин 2(1 Н)-он (А 32) в виде твердого вещества. 1 К раствору 1-метилциклопропанкарбоновой кислоты (6 мг, 0,06 ммоль) в ДМФ (1 мл) добавляли ДИПЭА (31 мкл, 0,18 ммоль) и HATU (23 мг, 0,06 ммоль). После перемешивания при КТ в течение 15 мин добавляли 17 (20 мг, 0,06 ммоль) в виде раствора в ДМФ (0,5 мл). Реакционную смесь перемешивали при КТ, пока с помощью ЖХ/МС не обнаруживали полное израсходование 17, и затем нагревали при 100 С в течение 1 ч. Затем реакционную смесь охлаждали до КТ, фильтровали и очищали с помощью препаративной ЖХ/МС и получали 1,7-диметил-3-(2-метил-5-(5-(1-метилциклопропил)-1,2,4-оксадиазол 3-иламино)фенил)-1,6-нафтиридин-2(1 Н)-он (А 34) в виде почти белого твердого вещества. 1 Н ЯМР (400 МГц, d6-ДМСО)9,87 (s, 1H), 9,13 (s, 1H), 8,05 (s, 1H), 7,87 (s, 1H), 7,37 (dd, J = 8,2 Гц, 1 Н),7,30 (d, J = 2 Гц, 1H), 7,22 (d, J = 8 Гц, 2 Н), 3,70 (s, 3 Н), 2,75 (s, 3 Н), 2,07 (s, 3 Н), 1,47 (s, 3 Н), 1,27 К раствору 3-гидрокси-2,2-диметилпропановой кислоты (88 мг, 0,7 ммоль) в ДМФ (5 мл) добавляли ДИПЭА (0,26 мл, 1,5 ммоль) и HATU (0,21 г, 0,7 ммоль). После перемешивания при КТ в течение 15 мин добавляли 17 (0,25 г, 0,7 ммоль) в виде раствора в ДМФ (2 мл). Реакционную смесь перемешивали при КТ, пока с помощью ЖХ/МС не обнаруживали полное израсходование 17, и затем нагревали при 100 С в течение 2 ч. Затем реакционную смесь охлаждали до КТ, подвергали распределению между EtOAc (30 мл) и 5% водным раствором NaHCO3 (20 мл). Водный слой экстрагировали свежим EtOAc (2 20 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и выпаривали досуха. Неочищенное вещество очищали с помощью колоночной флэш-хроматографии на диоксиде кремния с использованием смеси ДХМ/4% МеОН в качестве элюента и получали 3-(5-(5-(1-гидрокси-2 метилпропан-2-ил)-1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-он(А 35) в виде прозрачного стеклообразного твердого вещества. 6-Метилникотиновую кислоту (0,67 г, 4,89 ммоль), HATU (1,86 г, 4,89 ммоль) и ДИПЭА (0,85 мл,4,89 ммоль) перемешивали в сухом ДМФ (20 мл) в течение 1 ч и затем при КТ добавляли 17 (1,5 г, 4,44 ммоль). Перемешивание продолжали в течение 1 ч и затем смесь нагревали при 100 С в течение 5 ч. После охлаждения и фильтрования смесь очищали с помощью препаративной ЖХ/МС и получали 1,7 диметил-3-(2-метил-5-(5-(6-метилпиридин-3-ил)-1,2,4-оксадиазол-3-иламино)фенил)-1,6-нафтиридин 2(1 Н)-он (А 51) в виде твердого вещества. 1 Н ЯМР (400 МГц, d6-ДМСО)9,27 (d, J = 2,0 Гц, 1 Н), 9,10 (s, 1H), 8,73 (dd, J = 2,0, 8,4 Гц, 1H),8,07 (s, 1 Н), 7,94 (s, 1 Н), 7,85 (d, J = 8,4 Гц, 1 Н), 7,50 (d, J = 2,4 Гц, 1 Н), 7,46 (dd, J = 2,4, 8,4 Гц, 1H), 7,29 К раствору пиколиновой кислоты (1,35 г, 11 ммоль), HATU (4,18 г, 11 моль) и ДИПЭА (2,09 мл, 12 моль) в сухом ДМФ (50 мл) при КТ в присутствии безводного Na2SO4 (7 г, 50 моль) медленно добавляли 17 (3,37 г, 10 моль). С помощью ЖХ/МС устанавливали полное израсходование 17. Добавляли дополнительное количество безводного ДМФ (50 мл) и смесь нагревали при 100 С в течение 16 ч. Твердое вещество отфильтровывали и большую часть ДМФ удаляли в вакууме. Остаток подвергали распределению в смеси воды (200 мл), водного раствора Na2CO3 (2 М, 20 мл), EtOAc (300 мл) и МеОН (30 мл). Затем органическую фазу промывали водой (2 50 мл). После сушки и удаления EtOAc остаток обрабатывали смесями ДХМ/МеОН (30 мл/3 мл) и промывали с помощью ДХМ и получали А 52 в виде твердого осадка(1,4 г). Маточный раствор очищали с помощью хроматографии на силикагеле (8% МеОН в ДХМ) для удаления большей части примесей. Большую часть фракций, содержащих продукт, объединяли и получали твердый продукт который затем растирали с АЦН (60 мл) и несколько раз промывали с помощью АЦН и получали 0,9 г продукта А 52. Фракции, содержащие немного продукта и большое количество примесей, объединяли и получали неочищенный остаток который очищали с помощью препаративной ВЭЖХ и выделяли еще 0,3 г А 52. Все 3 порции 1,7-диметил-3-(2-метил-5-(5-(пиридин-2-ил)-1,2,4 оксадиазол-3-иламино)фенил)-1,6-нафтиридин-2(1 Н)-она (А 52) характеризовались одинаковыми ЯМР и ЖХ/МС. 1 Н ЯМР (400 МГц, d6-ДМСО)10,1 (s, 1H), 8,83 (т, 2 Н), 8,18 (dt, J = 8,8, 1 Гц, 1 Н), 8,1 (td, J = 7,7,1,7 Гц, 1 Н), 7,97 (s, 1H), 7,71 (ddd, J= 7,6, 4,8, 1,2 Гц, 1 Н), 7,47 (dd, J = 8,3, 2,4 Гц, 1H), 7,44 (s, 1H), 7,37 (d,J = 2,4 Гц, 1 Н), 7,25 (d, J = 8,5 Гц, 1H), 3,66 (s, 3 Н), 3,34 (s, 3 Н), 2,01 (s, 3 Н). МС m/z 425,1 (М+1). Пример А 54. Синтез 3-(5-(5-(1,1-дифторэтил)-1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1,7 диметил-1,6-нафтиридин-2( 1 Н)-она(15 мг, 0,12 ммоль) в сухом ДМФ (0,5 мл) при КТ в присутствии безводного Na2SO4 (71 мг, 0,5 ммоль) медленно добавляли 17 (33,7 мг, 0,10 ммоль). С помощью ЖХ/МС устанавливали полное израсходование 17. Смесь нагревали при 100 С в течение 2 ч. Твердое вещество отфильтровывали и остаток очищали с помощью препаративной ВЭЖХ и получали 3-(5-(5-(1,1-дифторэтил)-1,2,4-оксадиазол-3-иламино)-2 метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-он (А 54). 1 Н ЯМР (400 МГц, ДМСО-d6)10,27 (s, 1H), 9,00 (s, 1 Н), 8,03 (s, 1H), 7,70 (s, 1H), 7,42 (d, J = 8,4 Гц, 1H), 7,33 (s, 1H), 7,27 (d, J = 8,0 Гц, 1 Н), 2,70 (s, 3 Н), 2,51 (s, 3 Н), 2,16 (t, J = 19,6 Гц, 3 Н), 2,10 (s, 3 Н). МС m/z 412,2 (М+1). К раствору 3-гидрокси-3-метилбутановой кислоты (6 мг, 0,06 ммоль) в ДМФ (1 мл) добавляли ДИПЭА (31 мкл, 0,18 ммоль) и HATU (23 мг, 0,06 ммоль). После перемешивания при КТ в течение 15 мин добавляли 17 (20 мг, 0,06 ммоль) в виде раствора в ДМФ (0,5 мл). Реакционную смесь перемешивали при КТ, пока с помощью ЖХ/МС не обнаруживали полное израсходование 17, и затем нагревали при 100 С в течение 1 ч. Затем реакционную смесь охлаждали до КТ, фильтровали и очищали с помощью препаративной ЖХ/МС и получали 3-(5-(5-(2-гидрокси-2-метилпропил)-1,2,4-оксадиазол-3-иламино)-2 метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-он (А 56). МС m/z 420,4 (М+1). Пример А 57. Синтез 3-(5-(5-(1-гидроксициклопропил)-1,2,4-оксадиазол-3-иламино)-2-метилфенил)1,7-диметил-1,6-нафтиридин-2(1 Н)-она К раствору 1-гидроксициклопропанкарбоновой кислоты (6 мг, 0,06 ммоль) в ДМФ (1 мл) добавляли ДИПЭА (31 мкл, 0,18 ммоль) и HATU (23 мг, 0,06 ммоль). После перемешивания при КТ в течение 15 мин добавляли 17 (20 мг, 0,06 ммоль) в виде раствора в ДМФ (0,5 мл). Реакционную смесь перемешивали при КТ, пока с помощью ЖХ/МС не обнаруживали полное израсходование 17, и затем нагревали при 100 С в течение 1 ч. Затем реакционную смесь охлаждали до КТ, фильтровали и очищали с помощью препаративной ЖХ/МС и получали 3-(5-(5-(1-гидроксициклопропил)-1,2,4-оксадиазол-3-иламино)-2 метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-он (А 57). МС m/z 404,4 (М+1). Пример А 58. Синтез 1,7-диметил-3-(2-метил-5-(5-(1-(трифторметил)циклопропил)-1,2,4 оксадиазол-3-иламино)фенил)-1,6-нафтиридин-2(1 Н)-она К раствору 1-(трифторметил)циклопропанкарбоновой кислоты (9 мг, 0,06 ммоль) в ДМФ (1 мл) добавляли ДИПЭА (31 мкл, 0,18 ммоль) и HATU (23 мг, 0,06 ммоль). После перемешивания при КТ в течение 15 мин добавляли 17 (20 мг, 0,06 ммоль) в виде раствора в ДМФ (0,5 мл). Реакционную смесь перемешивали при КТ, пока с помощью ЖХ/МС не обнаруживали полное израсходование 17, и затем нагревали при 100 С в течение 1 ч. Затем реакционную смесь охлаждали до КТ, фильтровали и очищали с помощью препаративной ЖХ/МС и получали 1,7-диметил-3-(2-метил-5-(5-(1-(трифторметил)циклопропил)-1,2,4-оксадиазол-3-иламино)фенил)-1,6-нафтиридин-2(1 Н)-он (А 58). МС m/z 456,6 К раствору 2-гидрокси-3-метилбутановой кислоты (70 мг, 0,6 ммоль) в ДМФ (6 мл) добавляли ДИПЭА (0,125 мл, 0,7 ммоль) и HATU (0,23 г, 0,6 ммоль). После перемешивания при КТ в течение 15 мин добавляли 17 (0,2 г, 0,6 ммоль) в виде раствора в ДМФ (2 мл). Реакционную смесь перемешивали при КТ, пока с помощью ЖХ/МС не обнаруживали полное израсходование 17, и затем нагревали при 100 С в течение 1 ч. Реакционную смесь охлаждали до КТ, очищали с помощью препаративной ЖХМС и получали неочищенное вещество, которое дополнительно очищали с помощью колоночной флэшхроматографии на диоксиде кремния с использованием смеси ДХМ/2% МеОН в качестве элюента и получали 3-(5-(5-(1-гидрокси-2-метилпропил)-1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1,7-диметил 1,6-нафтиридин-2(1 Н)-он (А 64) в виде почти белого твердого вещества. 2-Метил-3-(триизопропилсилилокси)пропановую кислоту (34 мг, 0,12 ммоль), HATU (50 мг, 0,12 ммоль) и ДИПЭА (0,023 мл, 0,12 ммоль) перемешивали в сухом ДМФ (3 мл) в течение 1 ч и затем при КТ добавляли 17 (40 мг, 0,118 ммоль). Перемешивание продолжали в течение 1 ч и затем смесь нагревали при 100 С в течение 5 ч. После охлаждения добавляли ТБАФ (тетрабутиламмонийфторид) (1 мл, 1 MB ТГФ) И перемешивали в течение 5 ч при КТ. После фильтрования смесь очищали с помощью препаративной ЖХ/МС и получали 3-(5-(5-(1-гидроксипропан-2-ил)-1,2,4-оксадиазол-3-иламино)-2 метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-он (А 67) в виде твердого вещества. 1 3-Метилбутановую кислоту (13 мг, 0,12 ммоль), HATU (50 мг, 0,12 ммоль) и ДИПЭА (0,023 мл, 0,12 ммоль) перемешивали в сухом ДМФ (3 мл) в течение 1 ч и затем при КТ добавляли 17 (40 мг, 0,118 ммоль). Перемешивание продолжали в течение 1 ч и затем смесь нагревали при 100 С в течение 5 ч. После охлаждения и фильтрования смесь очищали с помощью препаративной ЖХ/МС и получали 3-(5-(5 изобутил-1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-он (А 68) в виде твердого вещества. 1 Н ЯМР (400 МГц, d4-МеОН)8,92 (s, 1H), 7,92 (s, 1H), 7,73 (s, 1H), 7,33 (d, J = 1 Гц, 1H), 7,24 (dd, J = 8,4 Гц, 1H), 7,14 (d, J = 4 Гц, 1H), 3,72 (s, 3 Н), 2,72 (s, 3 Н), 2,60 (d, J = 8 Гц, 2 Н), 2,10-2,01 (m, 1H), 2,06 (s, 3H),0,92 (d, J = 8 Гц, 6 Н). МС m/z 403,4, 404,5 (М+1). Пример А 69. Синтез 3-(5-(5-(1-(гидроксиметил)циклопропил)-1,2,4-оксадиазол-3-иламино)-2 метилфенил)-1,7-диметил-1,6-нафтиридин-2( 1 Н)-онаNa2SO4 (284 мг, 2,0 ммоль) медленно добавляли 17 (130 мг, 0,39 ммоль). С помощью ЖХ/МС устанавливали полное израсходование 17. Смесь нагревали при 100 С в течение 2 ч. Твердое вещество отфильтровывали и остаток растворяли в EtOAc (50 мл). Органический слой дважды промывали водой, сушили надNa2SO4, фильтровали и выпаривали и получали остаток, который очищали с помощью флэшхроматографии на диоксиде кремния с использованием смеси 3-5% МеОН в ДХМ в качестве элюента и получали метил-1-(3-(3-(1,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфениламино)1,2,4-оксадиазол-5-ил)циклопропанкарбоксилат 23. МС m/z 446,2 (М+1). К раствору 1-(3-(3-(1,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфениламино)1,2,4-оксадиазол-5-ил)циклопропанкарбоксилата 23 (100 мг, 0,22 ммоль) в МеОН (10 мл) в течение 30 мин тремя порциями добавляли NaBH4 (66,5 мг, 1,76 ммоль). После того как с помощью ЖХ/МС устанавливали, что реакция завершилась, для остановки реакции добавляли раствор хлорида аммония. Полученную смесь экстрагировали с помощью ДХМ (50 мл). Органический слой сушили над Na2SO4, фильтровали и выпаривали, и получали остаток, который очищали с помощью препаративной ВЭЖХ и получали 3-(5-(5-(1-(гидроксиметил)циклопропил)-1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1,7-диметил 1,6-нафтиридин-2(1 Н)-он (А 69).(0,023 мл, 0,12 ммоль) перемешивали в сухом ДМФ (3 мл) в течение 1 ч и затем при КТ добавляли 17 (40 мг, 0,118 ммоль). Перемешивание продолжали в течение 1 ч и затем смесь нагревали при 100 С в течение 5 ч. После охлаждения добавляли NaBH4 (20 мг) и перемешивали в течение 5 ч при КТ. После фильтрования смесь очищали с помощью препаративной ЖХ/МС и получали 3-(5-(5-(3 гидроксициклопентил)-1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)он (А 73) в виде твердого вещества. МС m/z 431,5, 432,6 (М+1). Пример А 76. Синтез(65 мкл, 0,4 ммоль) и HATU (0,14 г, 0,4 ммоль). После перемешивания при КТ в течение 15 мин добавляли 17 (0,13 г, 0,4 ммоль) в виде раствора в ДМФ (1 мл). Реакционную смесь перемешивали при КТ, пока с помощью ЖХ/МС не обнаруживали полное израсходование 17, и затем нагревали при 100 С в течение 3 ч. Затем реакционную смесь охлаждали до КТ, подвергали распределению между EtOAc (30 мл) и 5% водным раствором NaHCO3 (20 мл). Водный слой экстрагировали свежим EtOAc (220 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и выпаривали досуха. Неочищенное вещество очищали с помощью колоночной флэш-хроматографии на диоксиде кремния с использованием смеси ДХМ/2% МеОН в качестве элюента и получали (8)-3-(5-(5-(1-метоксиэтил)-1,2,4-оксадиазол-3 иламино)-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-он (А 76) в виде прозрачного белого стеклообразного твердого вещества. 1 Н ЯМР (400 МГц, d6-ДМСО)9,94 (s, 1H), 8,81 (s, 1H), 7,94 (s, 1H), 7,43 (s, 1H), 7,40 (dd, J = 8,2 Гц, 1 Н),7,30 (d, J = 2 Гц, 1H), 7,22 (d, J = 8 Гц, 1 Н), 4,68 (d, J = 6 Гц, 1 Н), 3,65 (s, 3 Н), 3,45 (s, 3 Н), 2,61 (s,3 Н), 2,07 (s, 3 Н), 1,49 (d, J = 6 Гц, 3 Н). МС m/z 406,4 (М+1). Пример А 77. Синтез(S)-Тетрагидрофуран-2-карбоновую кислоту (75,7 мг, 0,65 ммоль), HATU (247 мг, 0,65 ммоль) и ДИПЭА (0,11 мл, 0,65 ммоль) перемешивали в сухом ДМФ (6 мл) в течение 1 ч и затем при КТ добавляли 17 (200 мг, 0,59 ммоль). Перемешивание продолжали в течение 1 ч и затем смесь нагревали при 100 С в течение 5 ч. После охлаждения и фильтрования смесь очищали с помощью препаративной ЖХ/МС и получали (S)-1,7-диметил-3-(2-метил-5-(5-(тетрагидрофуран-2-ил)-1,2,4-оксадиазол-3-иламино)фенил)1,6-нафтиридин-2(1 Н)-он (А 77) в виде твердого вещества. 1 Н ЯМР (400 МГц, d4-МеОН)9,07 (s, 1 Н), 8,04 (s, 1H), 7,91 (s, 1H), 7,45 (d, J = 4 Гц, 1 Н), 7,36 (dd, J = 8,4 Гц, 1 Н), 7,25 (d, J = 4 Гц, 1 Н), 5,10 (dd, J = 8, 4 Гц, 1 H), 4,03 (dd, J = 12, 8 Гц, 1H), 3,96 (dd, J = 12, 8 Гц, 1 H),3,83 (s, 3H), 2,85 (s, 3 H), 2,41-2,34 (m, 1H), 2,28-2,20 (m, 1 H), 2,16 (s, 3H), 2,12-2,03 (m, 2H). MC m/z 417,5,418,5 (M+l). Пример А 92. Синтез (11)-3-(5-(5-(1-гидрокси-2-метилпропил)-1,2,4-оксадиазол-3-иламино)-2 метилфенил)-1,7-диметил-1,6-нафтиридин-2( 1 Н)-она К раствору (11)-2-(трет-бутилдиметилсилилокси)-3-метилбутановой кислоты (83 мг, 0,35 ммоль) в ДМФ (2 мл) добавляли ДИПЭА (52 мкл, 0,3 ммоль) и HATU (0,11 г, 0,3 ммоль). После перемешивания при КТ в течение 15 мин добавляли 17 (0,10 г, 0,3 ммоль) в виде раствора в ДМФ (1 мл). Реакционную смесь перемешивали при КТ, пока с помощью ЖХ/МС не обнаруживали полное израсходование 17, и затем нагревали при 100 С в течение 1 ч. Затем реакционную смесь охлаждали до КТ, подвергали распределению между EtOAc (30 мл) и 5% водным раствором NaHCO3 (20 мл). Водный слой экстрагировали свежим EtOAc (220 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и выпаривали досуха. Неочищенное вещество растворяли в ТГФ и добавляли ТБАФ (2,7 мл 1,0 М раствора в ТГФ). Смесь перемешивали при КТ в течение 2 ч. Затем реакционную смесь разбавляли с помощью EtOAc (20 мл) и промывали водой и рассолом. Органический слой сушили над сульфатом магния,фильтровали и выпаривали досуха. Неочищенный продукт очищали с помощью препаративной ЖХМС и получали К раствору изомасляной кислоты (8 мкл, 0,09 ммоль) в ДМФ (1 мл) добавляли ДИПЭА (16 мкл, 0,09 ммоль) и HATU (33 мг, 0,09 ммоль). После перемешивания при КТ в течение 15 мин добавляли 17 а (30 мг, 0,09 ммоль) в виде раствора в ДМФ (0,5 мл). Реакционную смесь перемешивали при КТ, пока с помощью ЖХ/МС не обнаруживали полное израсходование 17 а, и затем нагревали при 100 С в течение 1 ч. Затем реакционную смесь охлаждали до КТ, фильтровали и очищали с помощью препаративной ЖХ/МС и получали 7-этил-3-(5-(5-изопропил-1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1-метил-1,6 нафтиридин-2(1 Н)-он (А 104). 1 Н ЯМР (400 МГц, d6-ДМСО)9,91 (s, 1H), 9,10 (s, 1H), 8,05 (s, 1H), 7,78 (s, 1H), 7,41 (dd, J = 8, 2 Гц, 1 Н), 7,33 (d, J = 2 Гц, 1 Н), 7,23 (d, J = 8 Гц, 1H), 3,72 (s, 3 Н), 3,19 (т, 1H), 3,01 (q, J = 1,6 Гц, 2 Н), 2,08 К раствору пиколиновой кислоты (10 мг, 0,09 ммоль) в ДМФ (1 мл) добавляли ДИПЭА (16 мкл,0,09 ммоль) и HATU (33 мг, 0,09 ммоль). После перемешивания при КТ в течение 15 мин добавляли 17 а(30 мг, 0,09 ммоль) в виде раствора в ДМФ (0,5 мл). Реакционную смесь перемешивали при КТ, пока с помощью ЖХ/МС не обнаруживали полное израсходование 17 а, и затем нагревали при 100 С в течение 1 ч. Затем реакционную смесь охлаждали до КТ, фильтровали и очищали с помощью препаративной ЖХ/МС и получали 7-этил-1-метил-3-(2-метил-5-(5-(пиридин-2-ил)-1,2,4-оксадиазол-3-иламино)фенил)1,6-нафтиридин-2(1 Н)-он (А 105). 1 К раствору 17 (0,1 ммоль) в ТГФ (1 мл) добавляли тиазол-2-карбонилхлорид (0,1 ммоль). Реакционную смесь перемешивали при КТ в течение 30 мин. Затем добавляли этанол (1 мл) и кипятили с обратным холодильником в течение 3 ч. После фильтрования смесь очищали с помощью препаративной ЖХ/МС и получали 3-(5-(5-(тиазол-2-ил)-1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1,7-диметил-1,6 нафтиридин-2(1H)-он (А 9) MC m/z 431,1 (М+1). Методика 5 Пример A3. Синтез 3-(5-(5-циклопропил-1,2,4-оксадиазол-3-иламино)-2-метилфенил)-1,7-диметил 1,6-нафтиридин-2( 1 Н)-она 1-Гидроксипирролидин-2,5-дион (1,18 г, 10,3 ммоль), циклопропанкарбоновую кислоту (1,01 мл, 10 моль), ЭДХ (этилендихлорид) (2,01 г, 10,5 ммоль) и Et3N (2,8 ммоль, 20 моль) в ДХМ перемешивали при КТ в течение 5 ч и затем смесь подвергали распределению с насыщенным раствором NH4Cl. Органический слой промывали рассолом и сушили над Na2SO4. После фильтрования и концентрирования выделяли 2,5-диоксопирролидин-1-ил циклопропанкарбоксилат 24 и его использовали без дополнительной очистки. 2,5-Диоксопирролидин-1-ил циклопропанкарбоксилат 24 (0,62 г, 3,38 ммоль) и гидроксигуанидин 17 (1,0 г, 2,96 ммоль) в сухом диоксане (10 мл) перемешивали при 100 С в течение 4 ч. После охлаждения и фильтрования смесь очищали с помощью препаративной ЖХ/МС и получали A3 в виде твердого вещества. МС m/z 388,4 (М+1). Методика 6 Пример В 4 Синтез 1,7-диметил-3-(2-метил-5-(5-фенил-1,3,4-оксадиазол-2-иламино)фенил)-1,6-нафтиридин 2(1 Н)-она Неочищенный 18 (0,08 ммоль) растворяли в ТГФ (0,5 мл) и при КТ добавляли бензоилгидразид (14 мг, 0,1 ммоль). Реакционную смесь перемешивали при КТ в течение 1 ч и получали неочищенный 2 бензоил-N-(3-(1,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфенил)гидразинкарбоксамид 25, который использовали без очистки после удаления ТГФ. МС m/z 442,2 (М+1). Неочищенный 25 (0,08 ммоль) кипятили с обратным холодильником с POCl3 (0,1 мл) в течение 2 ч. После выпаривания остаток очищали с помощью препаративной ЖХМС и получали искомое соединение В 4 в виде соли с ТФК (трифторуксусная кислота). 1 Н ЯМР (400 МГц, d4-МеОН)9,07 (s, 1H), 8,09 (s, 1 Н), 7,96 (m, 2 Н), 7,89 (s, 1 Н), 7,64 (d, J = 2,4 Гц,1 Н), 7,55 (т, 3 Н), 7,43 (dd, J = 8,3, 2,4 Гц, 1H), 7,32 (d, J = 8,3 Гц, 1H), 3,84 (s, 3 Н), 2,85 (s, 3 Н), 2,2 (s, 3 Н). МС m/z 424,3 (М+1). Пример В 5. Синтез 3-(5-(5-изобутил-1,3,4-оксадиазол-2-иламино)-2-метилфенил)-1,7-диметил-1,6 нафтиридин-2(1 Н)-она Неочищенный 18 (0,08 ммоль) растворяли в ТГФ (0,5 мл) и при КТ добавляли 3- 28018551 метилбутангидразид (12 мг, 0,1 ммоль). Реакционную смесь перемешивали при КТ в течение 1 ч и получали неочищенный N-(3-(l,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфенил)-2-(3 метилбутаноил)гидразинкарбоксамид 26, который использовали без очистки после удаления ТГФ. МСm/z 422,2 (М+1). Полученный выше неочищенный N-(3-(1,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4 метилфенил)-2-(3-метилбутаноил)гидразинкарбоксамид 26 (0,08 ммоль) кипятили с обратным холодильником с POCl3 (0,1 мл) в течение 2 ч. После выпаривания остаток очищали с помощью препаративной ЖХМС и получали искомое соединение В 5 в виде соли с ТФК. МС m/z 404,2 (М+1). Методика 7 Пример С 1. Синтез 3-(5-(5-циклопентил-4 Н-1,2,4-триазол-3-иламино)-2-метилфенил)-1,7-диметил 1,6-нафтиридин-2(1 Н)-она Смесь циклопентанкарбонилхлорида (13 мг, 0,1 ммоль) и изотиоцианата аммония (7,6 мг, 0,1 ммоль) в ацетоне (1,0 мл) нагревали при 40 С в течение 3 ч. К полученной выше реакционной смеси при КТ добавляли 3-(5-амино-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-он (15) (27,5 мг, 0,1 ммоль) и перемешивали в течение 30 мин. Растворитель удаляли в вакууме и получали N-(3-(1,7-диметил-2-оксо-1,2-дигидро-1,6 нафтиридин-3-ил)-4-метилфенилкарбамотиоил)циклопентанкарбоксамид 27, который использовали без очистки. МС m/z 435,2 (М+1). К неочищенному N-(3-(1,7-диметил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-4-метилфенилкарбамотиоил)циклопентанкарбоксамиду 27, полученному выше, в EtOH (1,0 мл) добавляли гидразин (4 мг,0,12 ммоль) и полученную смесь нагревали при 80 С в течение 2 ч. Остаток очищали с помощью препаративной ЖХ/МС и получали С 1. МС m/z 415,2 (М+1). Пример С 6. Синтез 1,7-диметил-3-(2-метил-5-(5-фенил-4 Н-1,2,4-триазол-3-иламино)фенил)-1,6 нафтиридин-2(1 Н)-она К раствору 20 (44 мг, 0,1 ммоль) в EtOH (1 мл) добавляли гидразин (16 мкл, 0,5 ммоль). Смесь кипятили с обратным холодильником в течение 2 ч. Растворитель удаляли в вакууме и неочищенный продукт очищали с помощью препаративной ЖХ/МС и получали С 6. 1 Н ЯМР (400 МГц, d4-МеОН)9,04 (s, 1H), 8,05 (s, 1 Н), 7,95 (m, 1H), 7,93 (d, J = 2 Гц, 1 Н), 7,86 (s,1H), 7,47 (m, 5H), 7,25 (d, J = 7,9 Гц, 1H), 7,29 (d, J = 8,4 Гц, 1 Н), 3,83 (s, 3 Н), 2,84 (s, 3 Н), 2,17 (s, 3 Н). MC К раствору ацетофенона (24,0 мг, 0,2 ммоль) и NaH (16,0 мг, 0,4 ммоль, 60% в минеральном масле) в ДМФ (1 мл) при КТ добавляли 3-(5-изотиоцианато-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1H)он 19 (64,5 мг, 0,2 ммоль). Реакцию останавливали водой через 1 ч. Реакционную смесь экстрагировали с помощью EtOAc. Органический слой промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали и получали неочищенный 3-(5-изотиоцианато-2-метилфенил)-1,7-диметил-1,6-нафтиридин 2(1 Н)-он 28, который использовали без очистки. МС m/z 442,2 (М+1). К раствору 3-(5-изотиоцианато-2-метилфенил)-1,7-диметил-1,6-нафтиридин-2(1 Н)-она 28 (22 мг,0,05 ммоль) в EtOH (0,5 мл) добавляли твердый NaOH (20 мг, 0,5 ммоль) и MeI (7 мг, 0,05 ммоль). Смесь
МПК / Метки
МПК: A61P 37/00, A61P 9/00, A61K 31/4375, A61P 25/00, A61P 35/00, A61P 29/00, C07D 471/04
Метки: киназ, качестве, содержащие, pdgfr, c-kit, гетероциклические, соединения, композиции, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-18551-geterociklicheskie-soedineniya-i-soderzhashhie-ih-kompozicii-v-kachestve-ingibitorov-kinaz-c-kit-i-pdgfr.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклические соединения и содержащие их композиции в качестве ингибиторов киназ c-kit и pdgfr</a>
Предыдущий патент: Поглощающее изделие
Следующий патент: Способ производства труб
Случайный патент: Система для осуществления гидроразрыва без дополнительного вмешательства


































