Тетрагидропирролопиримидиндионы и их применение в качестве ингибиторов эластазы нейтрофилов человека
Номер патента: 18061
Опубликовано: 30.05.2013
Авторы: Эдвардс Кристина, О`коннор Элизабет, Финч Гарри, Рей Николас Чарльз
Формула / Реферат
1. Соединение формулы (I)
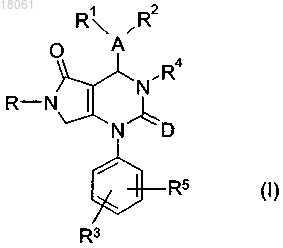
где А представляет собой фенил или пиридинил;
D представляет собой атом кислорода;
R1, R2 и R3, каждый независимо, представляют собой атом водорода, галоген, циано, C1-C6-алкил, С2-С6-алкинил, где C1-C6-алкил может быть дополнительно замещен идентичными или различными радикалами в количестве от одного до трех, выбранными из группы, состоящей из галогена;
R5 представляет собой Н и
R и R4, каждый независимо, представляет собой радикал формулы
-[X]m-[Alk1]p-[Q]n-[Alk2]q-[X1]k-Z,
где k, m, n, р и q независимо представляют собой 0 или 1;
Alk1 и Alk2, каждый независимо, представляют собой возможно замещенный C1-С6 алкиленовый или С2-С6 алкениленовый радикал, который может дополнительно содержать амино (-NRC-) связь, где RC представляет собой C1-С3-алкил, причем указанные возможные заместители являются совместимыми заместителями в количестве вплоть до четырех, каждый из которых независимо может представлять собой (С1-С6)алкил, -NH2, -NHRA, -NRARB, где RA и RB независимо представляют собой (C1-C6)алкил, (С3-С6)циклоалкил, фенил или моноциклический гетероарил, имеющий 5 или 6 кольцевых атомов, содержащий один или более чем один гетероатом, выбранный из S, N и О, либо RA и RB, когда они присоединены к одному и тому же атому азота, образуют циклическое аминокольцо, выбранное из пиперидинила, морфолинила или пиперазинила;
Q представляет собой -N(RA)-, -N+(RA)(RB)-, -C(=O)O-, -C(=NRD)NRE-, -NRAC(=NRA)NRB-, где RA, RB, RD и RE независимо представляют собой атом водорода, C1-C6 алкил либо RA и RB или RD и RE, взятые вместе с атомом азота, к которому они присоединены, образуют моноциклическое гетероциклическое кольцо из 5-7 кольцевых атомов, которое может содержать дополнительный гетероатом О;
X представляет собой -(С=О)- или -(C=O)NRA-, где RA представляет собой атом водорода, C1-C6 алкил;
X1 представляет собой -О- и
Z представляет собой атом водорода или гетероциклический радикал, имеющий 3-6 кольцевых атомов, содержащий один или более чем один гетероатом, выбранный из S, N и О,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1, R2 и R3, каждый независимо, представляют собой атом водорода, галоген, циано, C1-C3-алкил, С2-С3-алкинил.
3. Соединение по п.1, где R1, R2 и R3, каждый независимо, представляют собой атом водорода, фтор, хлор, бром, циано, метил и -СºСН.
4. Соединение по любому из пп.1-3, где один из R1 и R2 представляет собой метил, -СºСН или циано.
5. Соединение по п.1, где -AR1R2 представляет собой 4-цианофенил или 4-этинилфенил.
6. Соединение по любому из пп.1-5, где R3 представляет собой 3-трифторметил, 3-хлор или 3-бром.
7. Соединение по любому из пп.1-6, где R4 и/или R представляет собой радикал формулы
-[X]m-[Alk1]p-[Q]n-[Alk2]q-[X1]k-Z,
где m равно 0, k, р, n и q, каждое, равны 1, Q представляет собой -N(RA) или -N+(RA)(RB)-, и RA, RB, Alk1, Alk2, X, X1 и Z являются такими, как определено в п.1.
8. Соединение по п.7, где Z представляет собой моноциклический гетероарил, где последний имеет 5 или 6 кольцевых атомов, содержащий один или более чем один гетероатом, выбранный из S, N и О.
9. Соединение по любому из пп.7, 8, где один из R и R4 представляет собой атом водорода.
10. Соединение по любому из пп.1-6, где R и/или R4 представляет собой группу формулы (VIIIA), (VIIIB) или (VIIIC)
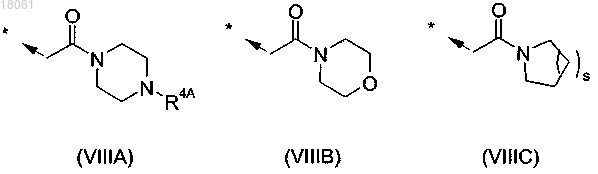
где R4A представляет собой атом водорода или C1-C6-алкил, и s равно 1 или 2;
11. Соединение по любому из пп.1-6, где R и/или R4 представляет собой группу формулы (IX)
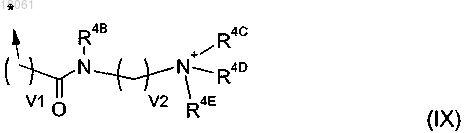
где R4B представляет собой атом водорода или C1-C6-алкил;
R4C, R4D, R4E каждый представляет собой C1-C6-алкил и атом азота, к которому они присоединены, является четвертичным и имеет положительный заряд; и, кроме того, любые два из R4C, R4D, R4E могут быть соединены с образованием 3-6-членного кольца, возможно содержащего второй гетероатом, выбранный из кислорода или азота;
либо один из R4C, R4D, R4E представляет собой неподеленную пару, а другие группы являются такими, как определено выше, и атом азота, к которому они присоединены, является третичным; и
v1 и v2 каждое независимо равно 0-5.
12. Соединение по любому из пп.1-6, где R и/или R4 представляет собой группу, выбранную из приведенного ниже:
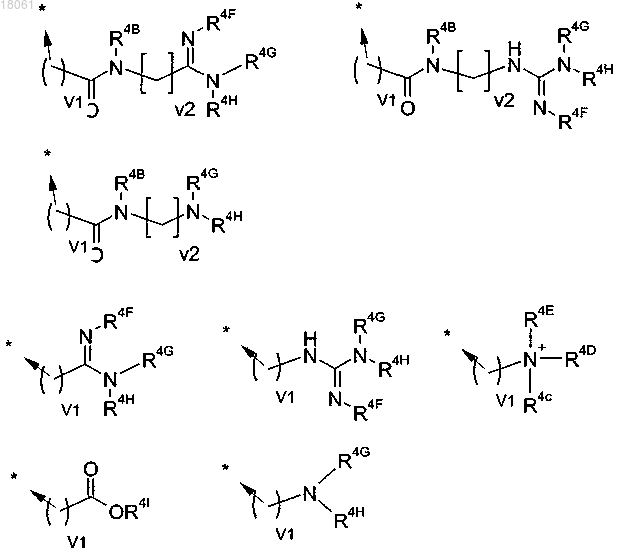
где R4B представляет собой атом водорода или C1-C6-алкил;
R4C, R4D, R4E каждый представляет собой C1-C6-алкил и атом азота, к которому они присоединены, является четвертичным и имеет положительный заряд; и, кроме того, любые два из R4C, R4D, R4E могут быть соединены с образованием 3-6-членного кольца, возможно содержащего второй гетероатом, выбранный из кислорода или азота; либо
один из R4C, R4D, R4E представляет собой неподеленную пару, а другие группы являются такими, как определено выше, и атом азота, к которому они присоединены, является третичным;
R4F и R4I независимо представляют собой атом водорода или C1-C6-алкил;
R4G и R4H независимо представляют собой атом водорода или C1-C6-алкил, либо R4G и R4H, взятые вместе с атомом азота, к которому они присоединены, образуют моноциклическое гетероциклическое кольцо из 5-7 кольцевых атомов, которое может содержать дополнительный гетероатом, выбранный из N, О и S; и
v1 и v2 каждое независимо равно 0-5.
13. Соединение по любому из пп.10-12, где R или R4, но не оба, представляют собой атом водорода.
14. Соединение, имеющее формулу M-L-M1, где L представляет собой линкерный радикал и М и М1, каждый независимо, представляют собой радикал формулы (IA), где D, А и R1-R5 являются такими, как определено в любом из пп.1-13

или М и М1, каждый независимо, представляют собой радикал формулы (IB), где D, А и R, R1,
R2, R3 и R5 являются такими, как определено в любом из пп.1-13
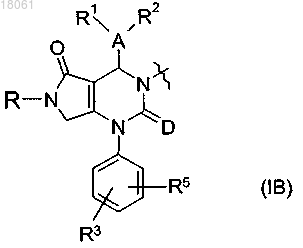
причем линкерный радикал L представляет собой двухвалентный линейный, насыщенный или ненасыщенный углеводородный радикал, имеющий от 2 до 12 атомов углерода в указанной цепи, и где один или более чем один атом углерода может быть замещен двухвалентным моноциклическим или бициклическим карбоциклическим или гетероциклическим радикалом, имеющим от 3 до 7 кольцевых атомов в каждом кольце, содержащим один или более чем один гетероатом, выбранный из S, N и О, или группой -О-, -S-, -S(=O)-, -S(=O)2-, -C(=O)-, -N(RP)-, -N+(RP)(RQ)-, -C(=O)O-, -OC(=O)-, -C(=O)NRA-,
-NRAC(=O)-, -S(O2)NRA-, -NRAS(O2)-, -NRAC(=O)NRB-, -NRAC(=NRA)NRB-, -C(=NRD)NRE- или
-NREC(=NRD)-, где RA, RB, RD и RE независимо представляют собой атом водорода, C1-C6-алкил или С3-С6-циклоалкил, и RP и RQ независимо представляют собой атом водорода, C1-C6-алкил или С3-С6-циклоалкил, НО-(С1-С6 алкил)-, RARBN-(C1-C6 алкил)- или НОС(=О)-(С1-С6 алкил)-, либо RA и RB или RD и RE или RP и RQ, взятые вместе с атомами азота, к которым они присоединены, образуют моноциклическое гетероциклическое кольцо из 5-7 кольцевых атомов, которое может содержать дополнительный гетероатом, выбранный из N, О и S,
или его фармацевтически приемлемая соль.
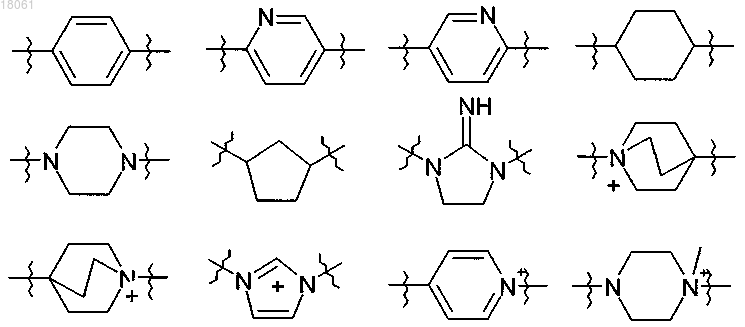
15. Соединение по п.14, где, когда одна или более чем одна группа -(СН2)-линкерного радикала L замещена двухвалентным моноциклическим или бициклическим карбоциклическим или гетероциклическим радикалом, указанный радикал выбран из приведенного ниже:
16. Соединение по п.14, где линкерный радикал L имеет одну из приведенных ниже структур (А), (В), (С), (D) и (Е)
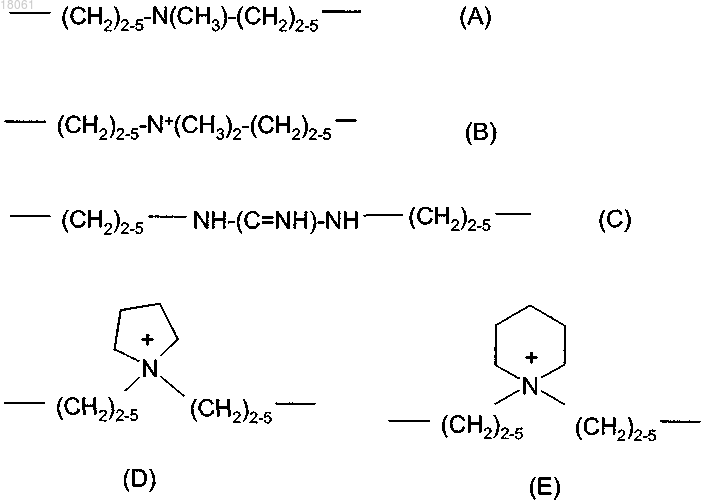
17. Соединение по п.14, где линкерный радикал L имеет одну из приведенных ниже структур (G) и (Н)
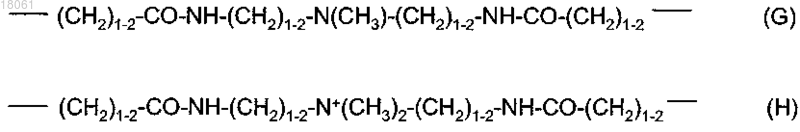
18. Соединение по п.14-17, где М и М1 являются одинаковыми.
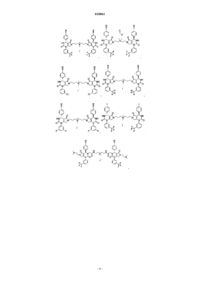
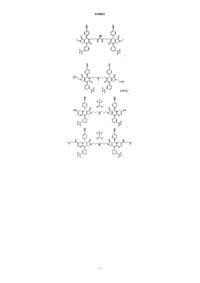
19. Соединение, имеющее любую из следующих структур
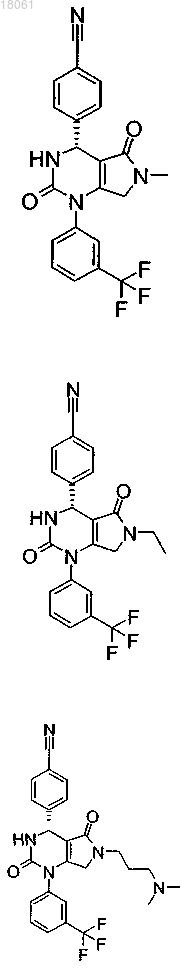
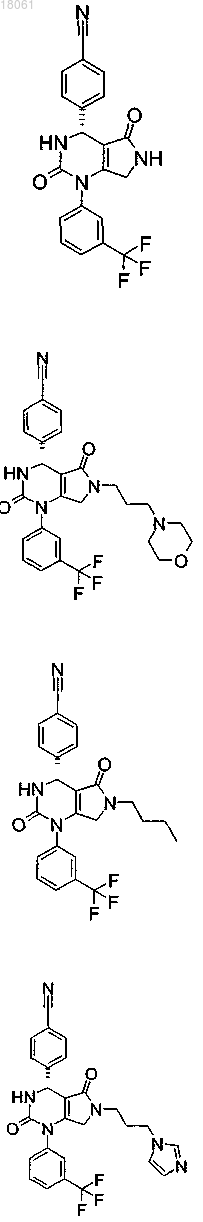
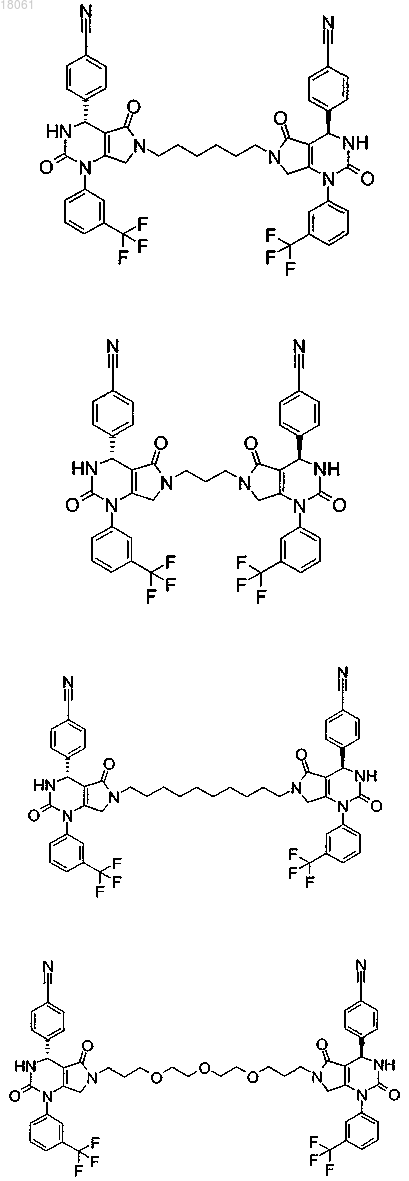
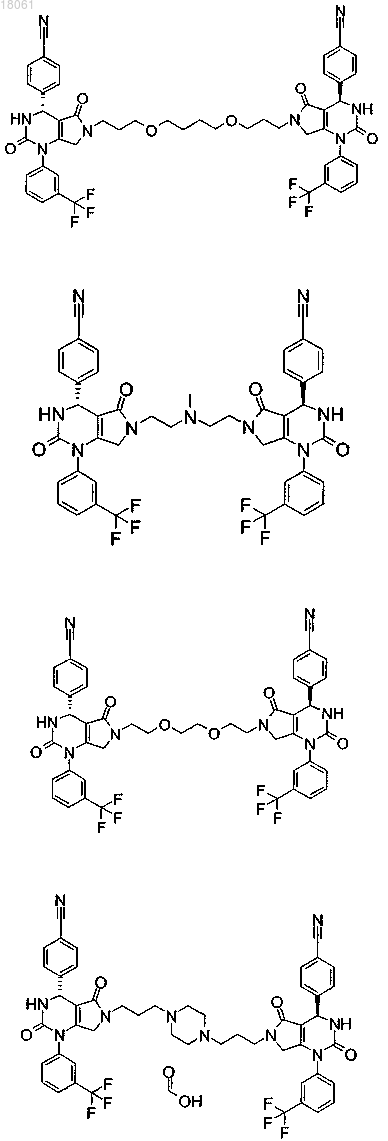
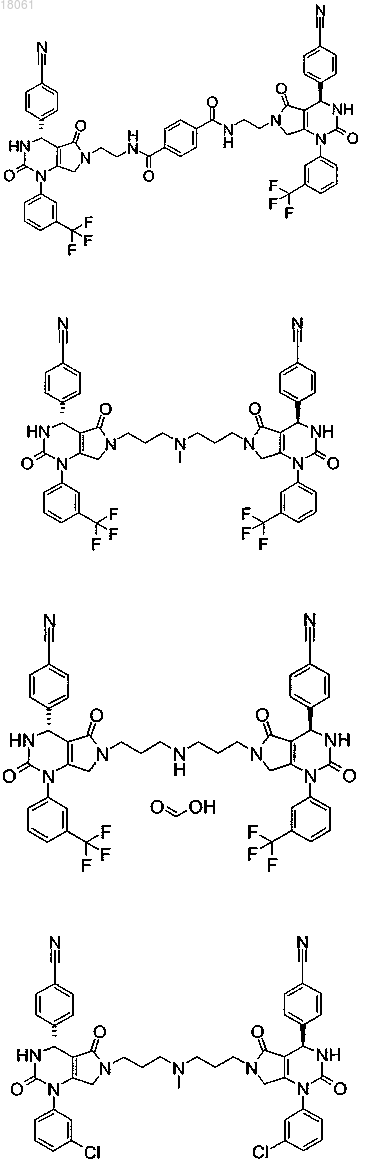
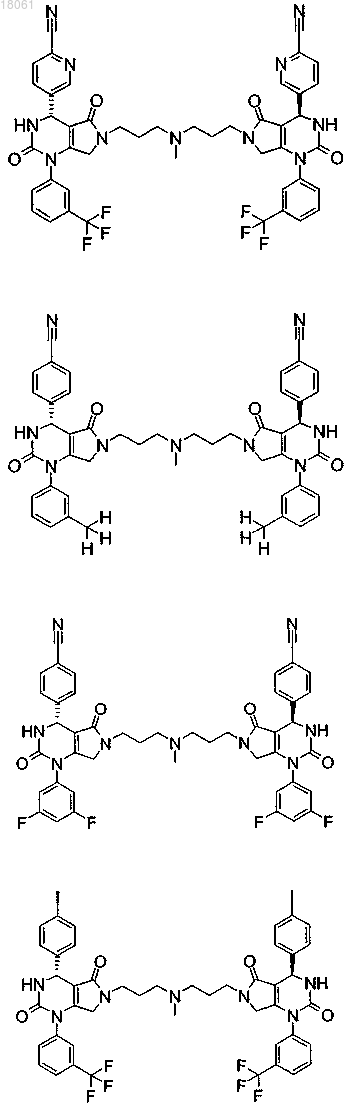
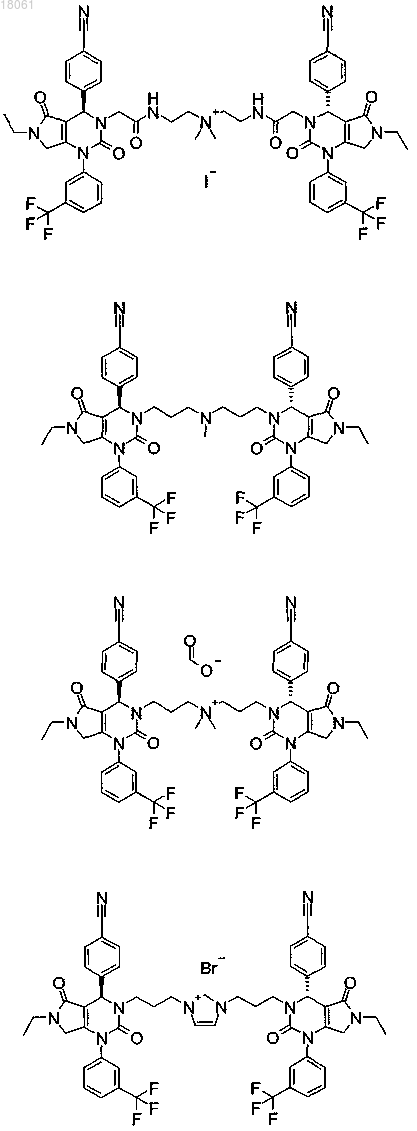
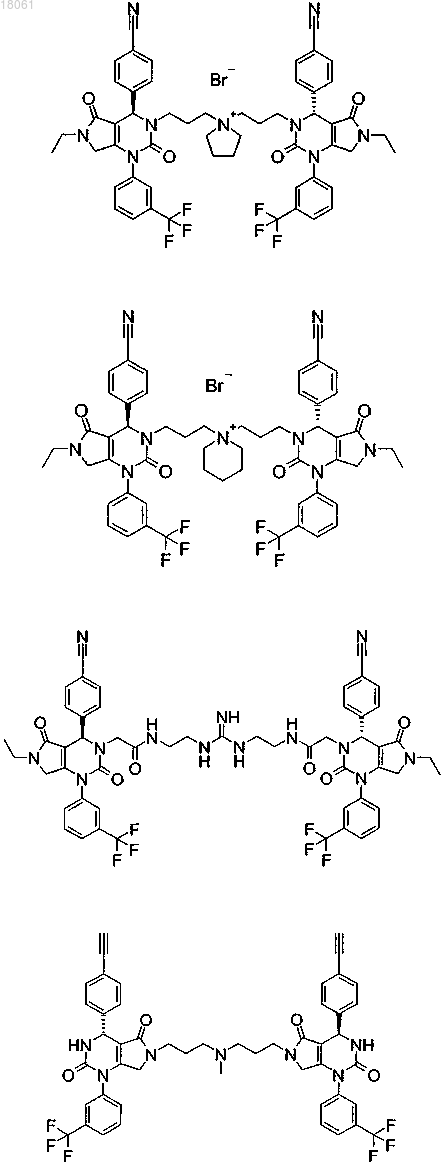
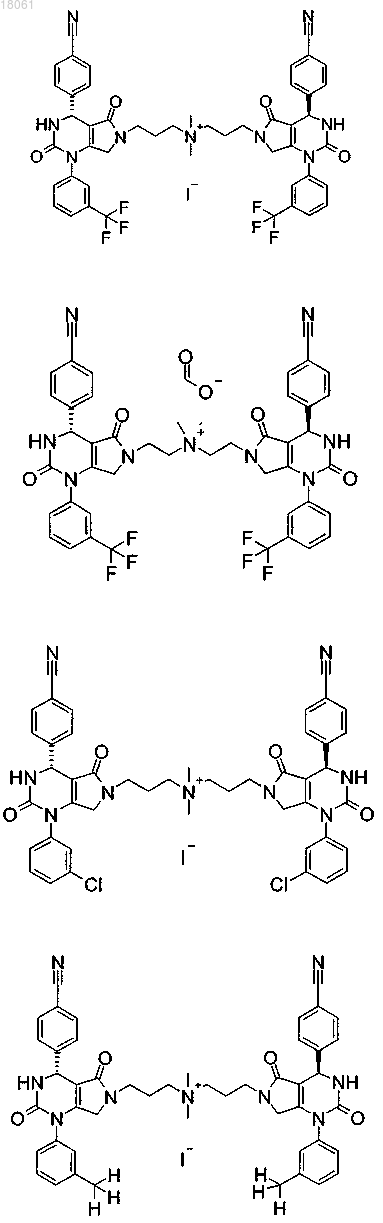
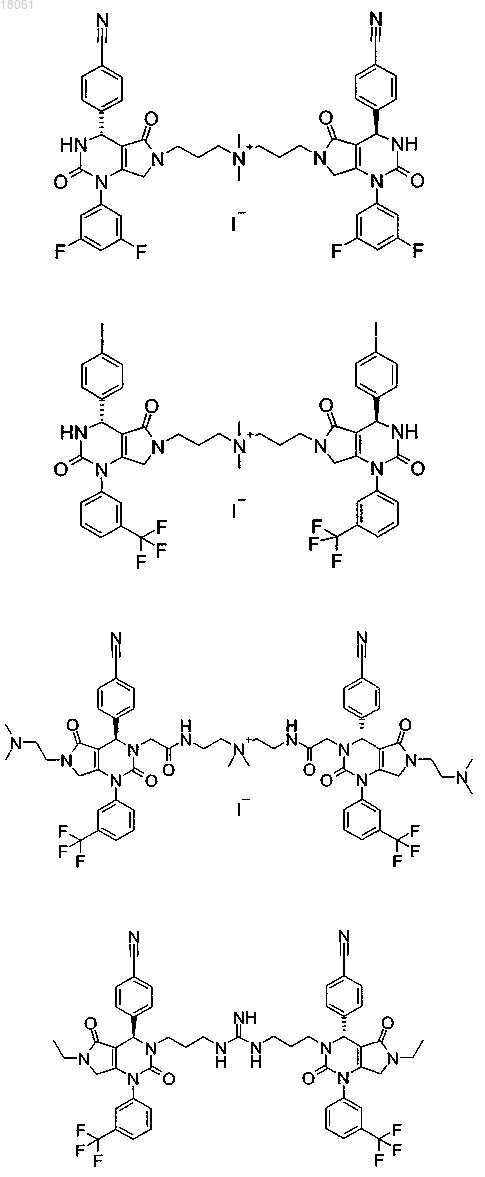

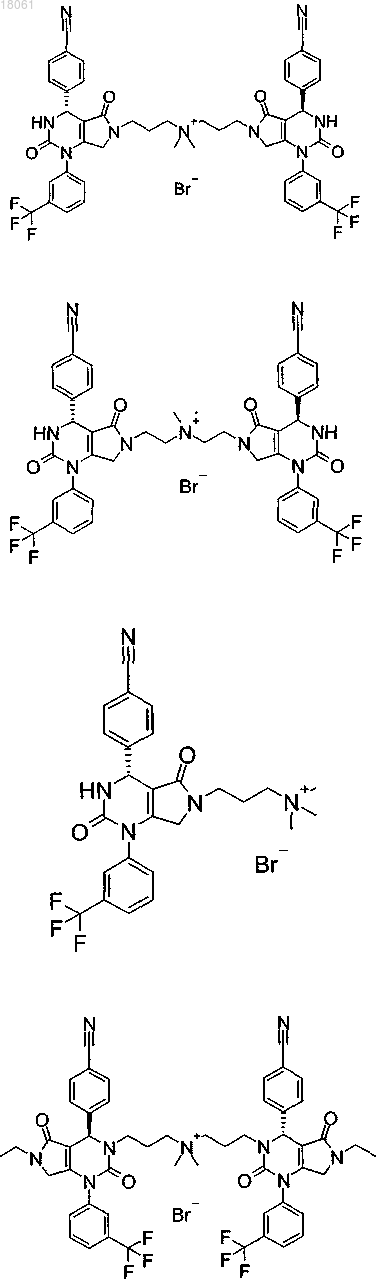
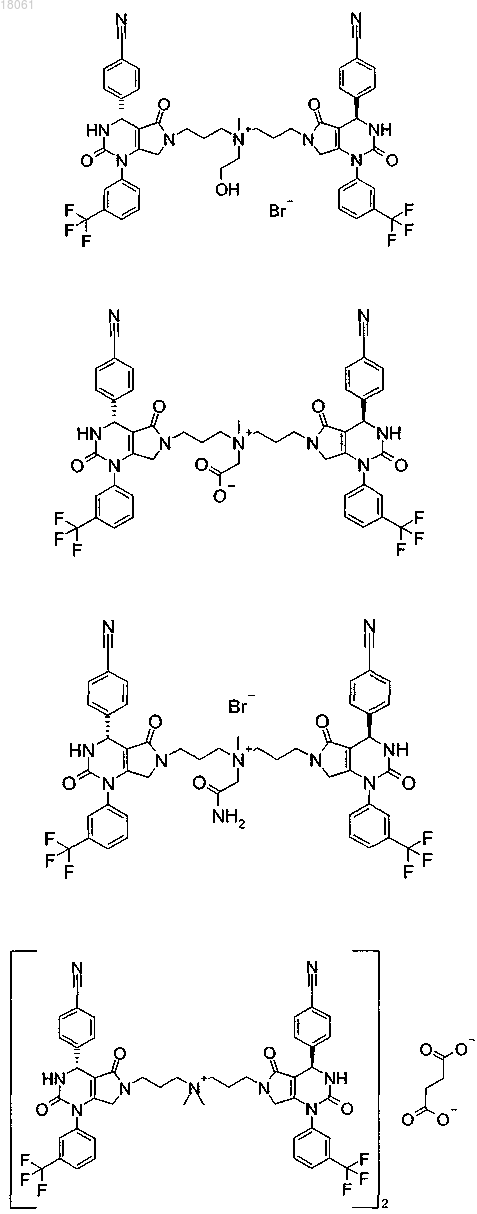
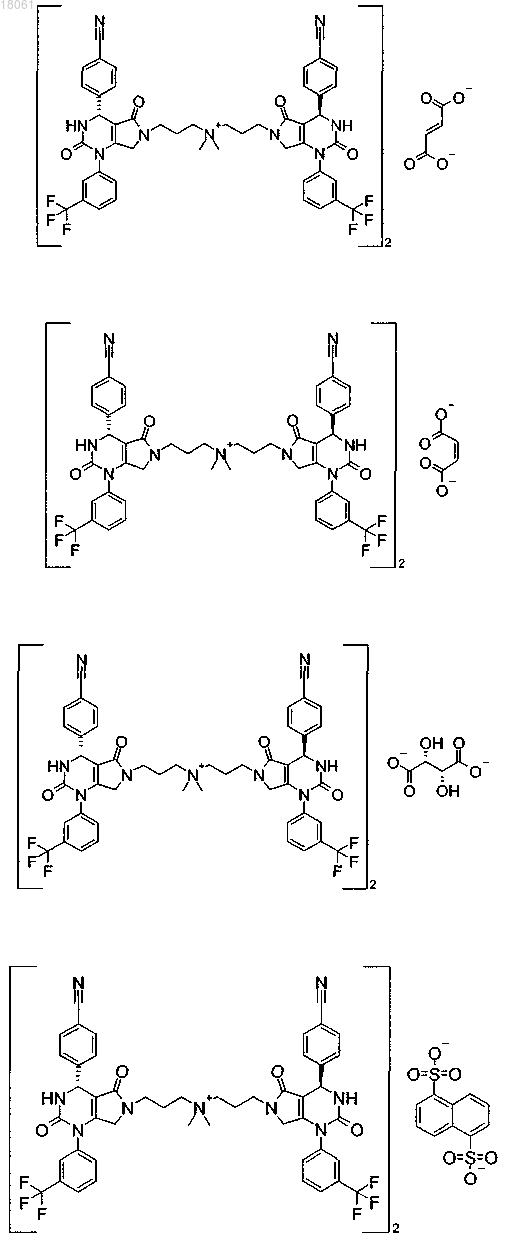
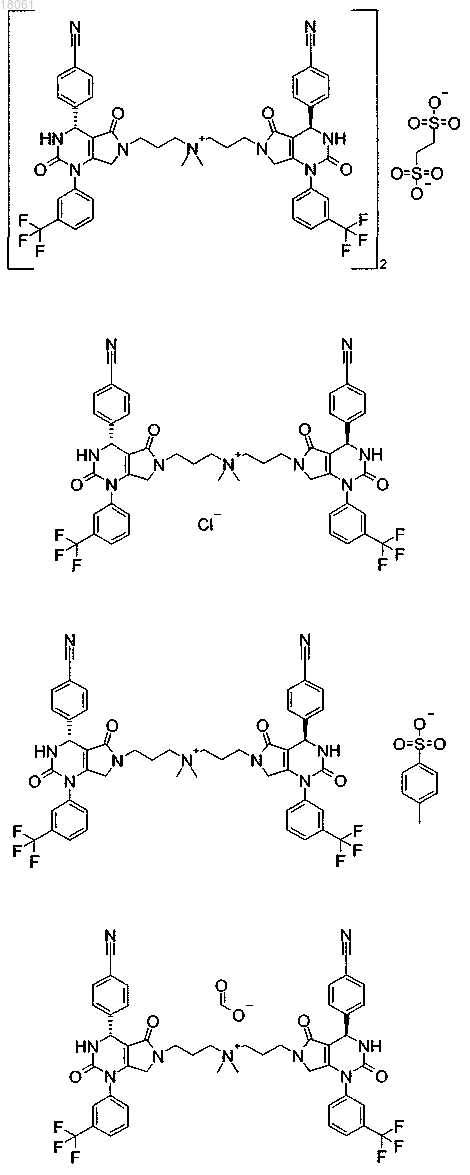
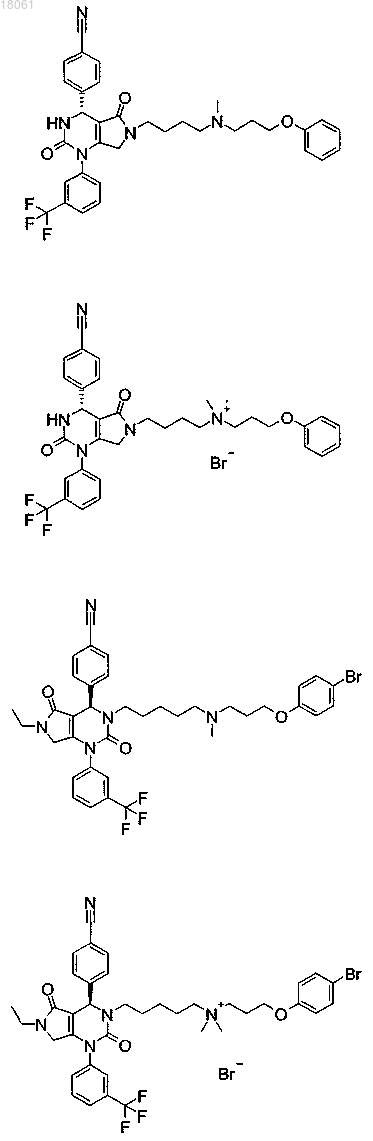
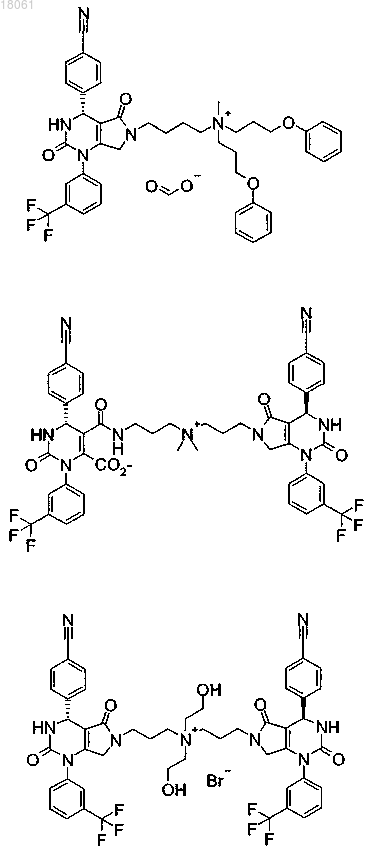
или его фармацевтически приемлемая соль.
20. Соединение по п.14, имеющее формулу (X), (Y) или (Z)
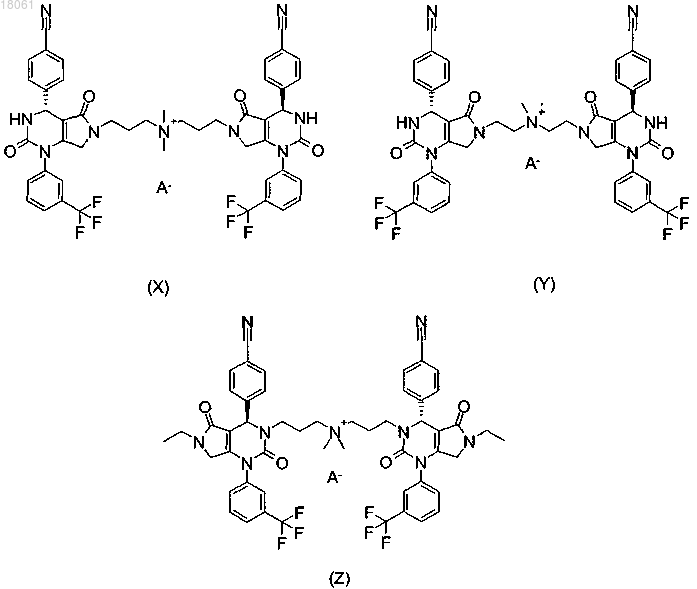
где А- представляет собой фармацевтически приемлемый анион.
21. Применение соединения по любому из пп.1-20 в терапии для лечения хронической обструктивной болезни легких и муковисцидоза.
22. Фармацевтическая композиция, содержащая соединение по любому из пп.1-20 и фармацевтически приемлемый носитель или эксципиент.
23. Применение соединения по любому из пп.1-20 для изготовления лекарства для лечения хронической обструктивной болезни легких и муковисцидоза.
24. Способ лечения хронической обструктивной болезни легких или муковисцидоза, при котором субъекту, страдающему таким заболеванием, вводят эффективное количество соединения по любому из пп.1-20.
Текст
ТЕТРАГИДРОПИРРОЛОПИРИМИДИНДИОНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ЭЛАСТАЗЫ НЕЙТРОФИЛОВ ЧЕЛОВЕКА Соединения формулы (I) и их мультимеры являются ингибиторами активности человеческой нейтрофильной эластазы и обладают пользой при лечении, например, хронической обструктивной болезни легких (ХОБЛ), где все заместители являются такими, как определено в п.1 формулы изобретения. Данное изобретение относится к гетероциклическим соединениям, которые представляют собой замещенные 3,4,6,7-тетрагидро-1 Н-пирроло[3,4-d]пиримидин-2,5-дионы, и к их применению в терапии. Предшествующий уровень техники Человеческая нейтрофильная эластаза (HNE) представляет собой 32 кДа сериновую протеазу, обнаруженную в азурофильных гранулах нейтрофилов. Она играет роль в разрушении широкого ряда белков внеклеточного матрикса, включая фибронектин, ламинин, протеогликаны, коллагены типа III и типа IV,а также эластин (Bieth, G. In Regulation of Matrix accumulation, Mecham, R. P. (Eds), Academic Press, NY,USA 1986,217-306). Долгое время считали, что HNE играет важную роль в гомеостазе посредством репарации и удаления поврежденных тканей путем разрушения тканевых структурных белков. Она также является релевантной при защите против бактериальной инвазии посредством разрушения бактериальной клетки. Кроме ее эффектов на матриксные ткани, HNE вовлечена в повышающую регуляцию экспрессии гена ИЛ-8, а также индуцирует высвобождение ИЛ-8 из эпителиальных клеток легкого. В моделях хронической обструктивной болезни легких на животных, индуцированной воздействием табачного дыма, как низкомолекулярные ингибиторы, так и белковые ингибиторы HNE ингибируют воспалительный ответ и развитие эмфиземы (Wright, J. L. et al. Am. J. Respir. Crit. Care Med. 2002, 166, 954-960;Churg, A. et al. Am. J. Respir. Crit. Care Med. 2003, 168, 199-207). Таким образом, HNE может играть роль как в разрушении матрикса, так и в усилении воспалительных ответов при хронических заболеваниях дыхательных путей, где приток нейтрофилов является характерным признаком. Действительно, считают,что HNE играет роль при некоторых легочных заболеваниях, включая хроническую обструктивную болезнь легких (ХОБЛ), муковисцидоз (MB), острый респираторный дистресс-синдром (ОРДС), эмфизему легких, пневмонию и легочный фиброз. Она также вовлечена в некоторые сердечно-сосудистые заболевания, в которые вовлечено ремоделирование тканей, например, при сердечной недостаточности и образовании ишемического тканевого повреждения после острого инфаркта миокарда. ХОБЛ является обобщающим термином, охватывающим три различных патологических состояния,из которых все вносят вклад в ограничение потока воздуха: хронический бронхит, эмфизему и заболевание мелких дыхательных путей. Как правило, все три состояния в различной степени существуют у пациентов, пораженных ХОБЛ, и все три могут быть следствием воспаления, опосредованного нейтрофилами, что подтверждено повышенным числом нейтрофилов, наблюдаемым в бронхоальвеолярных лаважных жидкостях (БАЛ) пациентов с ХОБЛ (Thompson, А. В.; Daughton, D.; et al. Am. Rev. Respir. Dis. 1989, 140, 1527-1537). Основной патогенетической детерминантой при ХОБЛ долгое время считали протеазно-антипротеазный баланс (также известный как "гипотеза эластазы: антиэластазы"), при котором дисбаланс HNE и эндогенных антипротеаз, таких как 1-антитрипсин (1-АТ), секреторный лейкоцитарный ингибитор протеаз (СЛИП) и преэлафин, приводит к различным воспалительным расстройствам при ХОБЛ. У индивидуумов, которые имеют генетический дефицит ингибитора протеаз 1-антитрипсина,развивается эмфизема, тяжесть которой возрастает со временем (Laurrell, С. В., Erikkson, S Scand. J. Clin.Invest. 1963 15, 132-140). Поэтому избыток HNE является деструктивным, приводя к нарушению морфологии легких при потере эластичности и деструкции альвеолярных присоединений дыхательных путей в легком (эмфиземе) при одновременном повышении капиллярной проницаемости и повышенной секреции слизистой оболочки (хроническом бронхите). Мультимерные лиганды состоят из множественных связывающих доменов, которые связаны вместе через подходящий каркас. Следовательно, индивидуальные связывающие домены сшиты вместе в одну молекулу, повышая вероятность того, что мультимер последовательно ступенчато связывается с множественными активными центрами, приводя в результате к высоко аффинным взаимодействиям (Handl, H.L. et al. Expert Opin. Ther. Targets 2004, 8,565-586; Han, Y. F. et al., Bioorg. Med. Chem. Letts. 1999, 7, 25692575). Также множественные связывающие взаимодействия (либо последовательные, либо параллельные) с относительно высокими степенями связывания могут объединяться с получением низкой степени связывания для мультимерноголиганда. Таким образом, можно ожидать, что молекула, состоящая из подходящего линкера и лигандов, проявляет преимущество по сравнению с отдельными мономерными лигандами в отношении эффективности и/или длительности действия. Маловероятно, что мультимерные соединения обладают пероральной биодоступностью (как предсказано "Правилом пяти" Липински), что может иметь преимущество, если целью является ингаляционный путь введения в легкие, поскольку даже после ингаляционного введения большая доля лекарства, вероятно, попадает в ЖК тракт. Таким образом, можно ожидать, что такие соединения проявляют пониженное системное воздействие после ингаляционного введения и, следовательно, улучшенный профиль токсичности по сравнению с терапиями, вводимыми перорально. Краткое изложение сущности изобретения В данном изобретении предложены новые соединения, которые являются ингибиторами HNE и полезны при лечении заболеваний или состояний, при которых принимает участие активность HNE. Соединения по изобретению можно применять в виде мономеров или, в частности, в случае местного легочного введения путем ингаляции, в форме мультимеров, таких как димеры, ковалентно сшитые посредством линкерного каркаса. Подробное описание изобретения В одном воплощении в изобретении предложено соединение формулы (I) где А представляет собой фенил или пиридинил;D представляет собой атом кислорода;R1, R2 и R3, каждый независимо, представляет собой атом водорода, галоген, циано, C1-C6-алкил, С 2 С 6-алкинил, где C1-C6-алкил может быть дополнительно замещен идентичными или различными радикалами в количестве от одного до трех, выбранными из группы, состоящей из галогена;R и R4, каждый независимо, представляет собой радикал формулы -[X]m-[Alk1]p-[Q]n-[Alk2]q-[X1]k-Z,где k, m, n, p и q независимо представляют собой 0 или 1;Alk1 и Alk2, каждый независимо, представляет собой возможно замещенный C1-С 6 алкиленовый или С 2-С 6 алкениленовый радикал, который может дополнительно содержать амино (-NRC-) связь, где RC представляет собой C1-C3 алкил, причем указанные возможные заместители явлются совместимыми заместителями в количестве вплоть до четырех, каждый из которых независимо может представлять собой(C1-C6)алкил, -NH2, -NHRA, -NRARB, где RA и RB независимо представляют собой (C1-C6)алкил, (C3-C6) циклоалкил, фенил или моноциклический гетероарил, имеющий 5 или 6 кольцевых атомов, содержащий один или более чем один гетероатом, выбранный из S, N и О, либо RA и RB, когда они присоединены к одному и тому же атому азота, образуют циклическое аминокольцо, выбранное из пиперидинила, морфолинила или пиперазинила;R , RB, RD и RE независимо представляют собой атом водорода, C1-C6 алкил, либо RA и RB, или RD и RE взятые вместе с атомом азота, к которому они присоединены, образуют моноциклическое гетероциклическое кольцо из 5-7-кольцевых атомов, которое может содержать дополнительный гетероатом О;X представляет собой -(С=О)- или -(C=O)NRA-, где RA представляет собой атом водорода, C1-C6 алкил;Z представляет собой атом водорода или гетероциклический радикал, имеющий 3-6-кольцевых атомов, содержащий один или более чем один гетероатом, выбранный из S, N и О,или его фармацевтически приемлемую соль. Изобретение также включает соединение, имеющее формулу M-L-M1, где L представляет собой линкерный радикал, и М и М 1, каждый независимо, представляет собой радикал формулы (IA), где D, А и R1-R5 являются такими, как определено выше: или М и М 1, каждый независимо, представляет собой радикал формулы (IB), где D, А и R, R1, R2, R3 и R являются такими, как определено выше: 5 причем линкерный радикал L представляет собой двухвалентный прямоцепочечный, насыщенный или ненасыщенный углеводородный радикал, имеющий от 2 до 12 атомов углерода в указанной цепи, и где один или более чем один атом углерода может быть замещен двухвалентным моноциклическим или бициклическим карбоциклическим или гетероциклическим радикалом, имеющим от 3 до 7 кольцевых атомов в каждом кольце, содержащий один или более чем один гетероатом, выбранный из S, N и О, или группой -О-, -S-, -S(=O)-, -S(=O)2-, -C(=O)-, -N(RP)-, -N+(RP)(RQ)-, -C(=O)O-, -OC(=O)-, -C(=O)NRA-,-NRAC(=O)-, -S(O2)NRA-, -NRAS(O2)-, -NRAC(=O)NRB-, -NRAC(=NRA)NRB-, -C(=NRD)NRE- или-NREC(=NRD)-, где RA, RB, RD и RE независимо представляют собой атом водорода, C1-C6 алкил или С 3-С 6-2 018061 циклоалкил, и RP и RQ независимо представляют собой атом водорода, C1-C6 алкил или С 3-С 6 циклоалкил, НО-(C1-C6 алкил)-, RARBN-(C1-C6 алкил)- или НОС(=О)-(C1-C6 алкил)-, либо RA и RB или RD и RE илиRP и RQ, взятые вместе с атомами азота, к которым они присоединены, образуют моноциклическое гетероциклическое кольцо из 5-7 кольцевых атомов, которое может содержать дополнительный гетероатом,выбранный из N, О и S или его фармацевтически приемлемую соль. Предложены, в частности, соединения, имеющие любую из следующих структур Соединения приведенных выше формул и их мультимеры могут быть получены в форме их солей, в частности фармацевтически приемлемых солей, N-оксидов, гидратов и сольватов. Здесь любое требование к соединению или любая ссылка на "соединения по изобретению", "соединения, к которым относится изобретение", соединения формулы (I) и тому подобное включает соли, N-оксиды, гидраты и сольваты таких соединений. Соединения по изобретению могут быть полезны при лечении или предупреждении заболеваний, в которые вовлечена HNE, например, хронической обструктивной болезни легких (ХОБЛ), хронического бронхита, легочного фиброза, пневмонии, острого респираторного дистресс-синдрома (ОРДС), эмфиземы легких, эмфиземы, вызванной курением, и муковисцидоза. Следовательно, другими аспектами изобретения являются применение соединения по изобретению в терапии при лечении хронической обструктивной болезни легких и муковисцидоза, фармацевтическая композиция, содержащая соединение по изобретению и фармацевтически приемлемый носитель или эксципиент, применение соединения по изобретению для изготовления лекарства для применения при лечении хронической обструктивной болезни легких и муковисцидоза, и способ лечения хронической обструктивной болезни легких или муковисцидоза, при котором субъекту, страдающему таким заболеванием, вводят эффективное количество соединения по изобретению. Терминология Как используют здесь, термин "(Ca-Cb)алкил", где а и b представляют собой целые числа, относится к прямоцепочечному или разветвленному алкильному радикалу, имеющему от а до b атомов углерода. Таким образом, когда а равно 1 и b равно 6, например, этот термин включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил и н-гексил. Как используют здесь, термин "(Ca-Cb)алкенил", где а и b представляют собой целые числа, относится к прямоцепочечной или разветвленной алкенильной группировке, имеющей от а до b атомов углерода, имеющей по меньшей мере одну двойную связь либо Е, либо Z стехиометрией, где применимо. Таким образом, когда а равно 2 и b равно 6, например, этот термин включает, например, винил, аллил, 1 и 2-бутенил и 2-метил-2-пропенил. Как используют здесь, термин "Ca-Cb алкинил", где а и b представляют собой целые числа, относит- 11018061 ся к прямоцепочечным или разветвленным углеводородным группам, имеющим от а до b атомов углерода и дополнительно имеющим одну тройную связь Таким образом, когда а равно 2 и b равно 6, например,этот термин включает, например, этинил (-ССН), 1-пропинил, 1- и 2-бутинил, 2-метил-2-пропинил, 2 пентинил, 3-пентинил, 4-пентинил, 2-гексинил, 3-гексинил, 4-гексинил и 5-гексинил. Как используют здесь, термин "двухвалентный (Ca-Cb)алкиленовый радикал", где а и b представляют собой целые числа, относится к насыщенной углеводородной цепи, имеющей от а до b атомов углерода и две незанятые валентности. Как используют здесь, термин "двухвалентный (Ca-Cb)алкениленовый радикал", где а и b представляют собой целые числа, относится к двухвалентной углеводородной цепи, имеющей от а до b атомов углерода и по меньшей мере одну двойную связь. Как используют здесь, не уточненный термин "карбоциклический" относится к моно-, би- или трициклическому радикалу, имеющему вплоть до 16 кольцевых атомов, все из которых представляют собой атомы углерода, и включает арил и циклоалкил. Как используют здесь, не уточненный термин "циклоалкил" относится к моноциклическому насыщенному карбоциклическому радикалу, имеющему 3-8 атомов углерода, и включает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Как используют здесь, не уточненный термин "арил" относится к моно-, би- или трициклическому карбоциклическому ароматическому радикалу и включает радикалы, имеющие два моноциклических карбоциклических ароматических кольца, которые связаны прямой ковалентной связью. Иллюстративными примерами таких радикалов являются фенил, дифенил и нафтил. Как используют здесь, не уточненный термин "гетероарил" относится к моно-, би- или трициклическому ароматическому радикалу, содержащему один или более чем один гетероатом, выбранный из S, N и О, и включает радикалы, имеющие два таких моноциклических кольца или одно такое моноциклическое кольцо и одно моноциклическое арильное кольцо, которые связаны прямой ковалентной связью. Иллюстративными примерами таких радикалов являются тиенил, бензотиенил, фурил, бензофурил, пирролил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изотиазолил, бензизотиазолил, пиразолил,оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, изотиазолил, триазолил, бензотриазолил, тиадиазолил, оксадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, триазинил, индолил и индазолил. Как используют здесь, не уточненный термин "гетероциклил", либо "гетероциклический", либо "гетероциклоалкил" включает "гетероарил", как определено выше, и в его неароматическом значении относится к моно-, би- или трициклическому неароматическому радикалу, содержащему один или более чем один гетероатом, выбранный из S, N и О, и к группам, состоящим из моноциклических неароматических радикалов, содержащим один или более чем один такой гетероатом, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом. Иллюстративными примерами таких радикалов являются пирролил, фуранил, тиенил, пиперидинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, пиразолил, пиридинил, пирролидинил, пиримидинил, морфолинил,пиперазинил, индолил, бензофуранил, пиранил, бензимидазолил, метилендиоксифенил, этилендиоксифенил, группы малеимидо и сукцинимидо. Если не указано иное в контексте, где он встречается, термин "замещенный" применительно к любой группировке здесь означает замещенный совместимыми заместителями в количестве вплоть до четырех, каждый из которых независимо может представлять собой, например, (C1-C6)алкил, циклоалкил,(C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкил, меркапто, меркапто(C1-C6)алкил, (C1-C6)алкилтио, фенил, моноциклический гетероарил, имеющий 5- или 6-кольцевых атомов, галогено (включая фторо, бромо и хлоро), трифторметил, трифторметокси, нитро, нитрил (-CN), оксо, -СООН, -COORA, -CORA,-SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB,-OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2OH,-NRBSO2ORA,-NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или -NRACONRARB,где RA и RB независимо представляют собой (C1-С 6)алкил, (С 3-С 6) циклоалкил, фенил или моноциклический гетероарил, имеющий 5 или 6 кольцевых атомов, либо RA и RB, когда они присоединены к одному и тому же атому азота, образуют циклическое аминокольцо, такое как пиперидинил, морфолинил или пиперазинил. "Возможный заместитель" может представлять собой одну из вышеуказанных групп заместителя. Как используют здесь, термин "соль" включает соли присоединения основания, присоединения кислоты и четвертичные соли. Соединения по изобретению, которые являются кислыми, могут образовать соли, включая фармацевтически приемлемые соли, с основаниями, такими как гидроксиды щелочных металлов, например, гидроксиды натрия и калия; гидроксиды щелочно-земельных металлов, например гидроксиды кальция, бария и магния; с органическими основаниями, например с N-метил-Dглюкамином, холином, трис(гидроксиметил)аминометаном, L-аргинином, L-лизином, N-этилпиперидином, дибензиламином и тому подобным. Те соединения (I), которые являются основными, могут образовать соли, включая фармацевтически приемлемые соли, с неорганическими кислотами, например с гидрогалогенидными кислотами, такими как соляная или бромисто-водородная кислота, с серной кислотой,- 12018061 азотной кислотой или фосфорной кислотой и тому подобным, и с органическими кислотами, например с уксусной, винной, янтарной, фумаровой, малеиновой, яблочной, салициловой, лимонной, метансульфоновой, лара-толуолсульфоновой, бензойной, бензолсульфоновой, глутаминовой, молочной и миндальной кислотами и тому подобным. Те соединения (I), которые имеют основной атом азота, могут также образовать четвертичные аммонийные соли с фармацевтически приемлемым противоионом, таким как хлорид, бромид, ацетат, формиат, пара-толуолсульфонат, сукцинат, гемисукцинат, нафталин-бис-сульфонат,метансульфонат, ксинафоат и тому подобное. Соединения по изобретению, которые содержат один или более чем один действительный или потенциальный хиральный центр, в связи с присутствием асимметрических атомов углерода могут существовать в виде ряда диастереоизомеров с R или S стехиометрией при каждом хиральном центре. В изобретение включены все такие диастереоизомеры и их смеси. В соединениях по изобретению целесообразно, когда R1, R2 и R3, каждый независимо, представляет собой атом водорода, галоген, циано, C1-С 3-алкил, С 2-С 3-алкинил; например R1, R2 и R3 каждый независимо представляет собой атом водорода, фтор, хлор, бром, циано, метил, метокси и -ССН, в частности один из R1 и R2 представляет собой метил, -ССН или циано. В соединениях по изобретению -AR1R2 может представлять собой 4-цианофенил или 4 этинилфенил. В соединениях по изобретению R3 может представлять собой 3-трифторметил, 3-хлор или 3-бром. В соединениях по изобретению R4 и/или R может представлять собой радикал формулы -[X]m1[Alk ]p-[Q]n-[Alk2]q-[X1]k-Z, где m равно 0, k, р, n и q каждое равно 1, Q представляет собой -N(RA) или N+(RA)(RB)-, где RA, RB Alk1, Alk2, X1 являются такими как определено выше. В соединениях по изобретению Z может представлять собой моноциклический гетероарил, где последний имеет 5 или 6 кольцевых атомов, содержащий один или более чем один гетероатом, выбранный из S, N и О. В соединениях по изобретению целесообразно, когда один из R и R4 представляет собой атом водорода. В настоящее время считают, что мономеры по изобретению могут взаимодействовать с HNE в качестве ингибиторов, где заместитель R или R4 локализован удаленно от поверхности связывания, распространяясь в направлении растворителя. Следовательно, эти группы создают центры модулирования растворимости и других фармакокинетических свойств. Соответственно, R и R4 могут широко варьировать и определены в отношении формулы (I) как радикал формулы -[X]m-[Alk1]p-[Q]n-[Alk2]q-[X1]k-Z. В соответствии с этим определением k, m, n, p и q могут быть все равны 0, и Z может представлять собой атом водорода, так что сам R или R4 может представлять собой атом водорода. Однако многие другие классы заместителей R или R4 охвачены выбором различных комбинаций значений для переменных. Другие типы групп R и R4 имеют формулу (VIIIA), (VIIIB) или (VIIIC): где R4A представляет собой атом водорода или C1-C6-алкил, и s равно 1 или 2. Другие типы групп R и R4 имеют формулу (IX) где R4B представляет собой атом водорода или C1-C6-алкил;R4C, R4D, R4E каждый представляет собой C1-C6-алкил, и атом азота, к которому они присоединены,является четвертичным и несет положительный заряд; и, кроме того, любые два из R4C, R4D, R4E могут быть соединены с образованием кольца, возможно содержащего второй гетероатом, выбранный из кислорода или азота; либо один из R4C, R4D, R4E представляет собой неподеленную пару, а другие группы являются такими, как определено выше, и атом азота, к которому они присоединены, является третичным; иv1 и v2 каждое независимо равно 0-5. Другие группы R и R4 представляют собой те, которые выбраны из приведенных ниже: где R4B представляет собой атом водорода или C1-C6-алкил;R4C, R4D, R4E каждый представляет собой C1-C6-алкил, и атом азота, к которому они присоединены,является четвертичным и несет положительный заряд; и, кроме того, любые два из R4C, R4D, R4E могут быть соединены с образованием кольца, возможно содержащего второй гетероатом, выбранный из кислорода или азота; либо один из R4C, R4D, представляет собой неподеленную пару, а другие группы являются такими,как определено выше, и атом азота, к которому они присоединены, является третичным;R4F и R4I независимо представляют собой атом водорода или C1-C6-алкил;R4G и R4H независимо представляют собой атом водорода или C1-C6-алкил, либо R4G и R4H, взятые вместе с атомом азота, к которому они присоединены, образуют моноциклическое гетероциклическое кольцо из 5-7-кольцевых атомов, которое может содержать дополнительный гетероатом, выбранный изv1 и v2, каждое независимо, равно 0-5. Целесообразно, когда R или R4, но не оба, представляет собой атом водорода. В мультимерных соединениях молекулы мономерного соединения по изобретению могут быть ковалентно сшиты через линкерный радикал (каркас). Поскольку линкерный каркас не играет активной роли при взаимодействии с ферментом HNE, его роль состоит в том, чтобы просто давать возможность связывающего контакта между одним или более чем одним из мономерных элементов и ферментом. Следовательно, обширный круг химических составов может быть рассмотрен для линкерного каркаса. Кроме того, точка присоединения мономерных элементов к линкерному каркасу может быть выбрана в соответствии с конкретным химическим составом используемого линкера. В настоящем случае предпочтительно, чтобы молекулы были связаны с линкерным каркасом через их соответствующие атомы азота,показанные в формуле (I) как связанные с R или R4. Кроме того, в настоящем случае предпочтительно, чтобы только два из мономеров были связаны таким образом. Когда одна или более чем одна группа -(СН 2)- линкерного каркаса замещена двухвалентным моноциклическим или бициклическим карбоциклическим или гетероциклическим радикалом, указанный радикал может быть выбран, например, из приведенного ниже: Линкерный радикал может иметь, например, одну из приведенных ниже структур (А), (В),(С), (D),(Е), (G) и (Н): Конкретные линкерные каркасы вышеуказанного типа включают те, которые присутствуют в димерных соединениях приведенных здесь примеров. Также предпочтительно, когда мономеры (М и М 1) являются одинаковыми. Предпочтительные димеры имеют формулу (X), (Y) или (Z) Конкретные примеры таких димерных соединений формулы (IA) и (IB) включают соединения приведенных здесь примеров. Терапевтическая польза настоящих соединений относится к любому заболеванию, которое известно как, по меньшей мере частично, опосредованное действием человеческой нейтрофильной эластазы. Например, настоящие соединения могут быть полезны при лечении хронической обструктивной болезни легких (ХОБЛ), муковисцидоза (MB), острого респираторного дистресс-синдрома (ОРДС), эмфиземы легких, пневмонии и легочного фиброза. Настоящее изобретение также относится к фармацевтическим препаратам, содержащим в качестве активного ингредиента соединение по изобретению. Другие соединения можно комбинировать с соединениями по данному изобретению для предупреждения и лечения воспалительных заболеваний легкого. Таким образом, настоящее изобретение также относится к фармацевтическим композициям для предупреждения и лечения воспалительных заболеваний легкого, содержащим терапевтически эффективное количество соединения по изобретению и одного или более чем одного из других терапевтических агентов. Пригодные терапевтические агенты для комбинированной терапии с соединениями по изобретению включают: (1) кортикостероид, например, флутиказон или будесонид; (2) агонист 2-адренорецепторов,например салметерол или формотерол; (3) модулятор лейкотриенов, например, монтелукаст или пранлукаст; (4) антихолинергические агенты, например, селективные антагонисты мускаринного-3 (М 3) рецептора, такие как тиотропия бромид; (5) ингибиторы фосфодиэстеразы-IV (PDE-IV), такие как рофлумиласт или циломиласт; (6) противокашлевые агенты, такие как кодеин или декстраморфан; и (7) нестероидный противовоспалительный агент (НСПВЛ), например ибупрофен или кетопрофен. Массовое отношение первого и второго активных ингредиентов может варьировать и зависит от эффективной дозы каждого ингредиента. Как правило, следует применять эффективную дозу каждого. Величина профилактической или терапевтической дозы соединения по изобретению должна, конечно, варьировать в зависимости от природы и тяжести состояния, подлежащего лечению, а также от конкретного соединения и пути его введения, и, как правило, она должна быть определена путем клинического испытания, как требуется в области фармацевтики. Она также должна варьировать в соответствии с возрастом, массой и реакцией индивидуального пациента. Как правило, диапазон суточной дозы должен находиться в интервале от примерно 0,001 мг до примерно 100 мг на кг массы тела млекопитающего, предпочтительно от 0,01 мг до примерно 50 мг на кг, и наиболее предпочтительно от 0,1 до 10 мг на кг, в однократной дозе или в дробных дозах. С другой стороны, в некоторых случаях может быть не- 15018061 обходимо применение дозировок вне этих пределов. В другом аспекте настоящего изобретения предложены фармацевтические композиции, которые содержат соединение по изобретению и фармацевтически приемлемый носитель. В термин "композиция", как в фармацевтической композиции, следует включать продукт, содержащий активный ингредиент(ы) и инертный ингредиент(ы) (фармацевтически приемлемые эксципиенты), который составляет носитель, а также любой продукт, который является результатом, прямо или косвенно, объединения, комплексообразования или агрегации любых двух или более чем двух ингредиентов, либо диссоциации одного или более чем одного ингредиента, либо других типов реакций или взаимодействий одного или более чем одного из ингредиентов Соответственно, фармацевтические композиции по настоящему изобретению охватывают любую композицию, полученную путем смешивания соединения по изобретению,дополнительного активного ингредиента(ов) и фармацевтически приемлемых эксципиентов. Фармацевтические композиции по настоящему изобретению содержат в качестве активного ингредиента соединение по изобретению или его фармацевтически приемлемую соль и могут также содержать фармацевтически приемлемый носитель и возможно другие терапевтические ингредиенты. Термин"фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические основания или кислоты и органические основания или кислоты. Любой пригодный путь введения можно применять для обеспечения млекопитающего, в частности человека, эффективной дозой соединения по настоящему изобретению. При терапевтическом применении активное соединение можно вводить любым удобным, пригодным или эффективным путем. Пригодные пути введения известны специалистам в данной области техники и включают пероральный,внутривенный, ректальный, парентеральный, местный, глазной, назальный, трансбуккальный и легочный. Предпочтительна доставка путем ингаляции. Композиции, пригодные для введения путем ингаляции, известны и могут включать носители и/или разбавители, которые известны для использования в таких композициях. Композиция может содержать 0,01-99% мас./мас. активного соединения. Предпочтительно стандартная доза содержит активное соединение в количестве от 1 мкг до 10 мг. Наиболее пригодный уровень дозировки можно определить любым подходящим способом, известным специалистам в данной области техники. Однако должно быть понятно, что конкретное количество для любого конкретного пациента должно зависеть от ряда факторов, включая активность конкретного соединения, которое применяют, возраст, массу тела, режим питания, общее состояние здоровья и пол пациента, время введения, путь введения, скорость выделения, применение каких-либо других лекарств и тяжесть заболевания, подлежащего лечению. Для доставки путем ингаляции активное соединение предпочтительно находится в форме микрочастиц. Они могут быть получены с помощью ряда методик, включая распылительную сушку, лиофилизацию и измельчение в микронной коллоидной мельнице. Для примера, композицию по изобретению можно готовить в виде суспензии для доставки из небулайзера или в виде аэрозоля в жидком пропелленте, например, для применения в герметизированном дозирующем ингаляторе (ГДИ). Пропелленты, пригодные для использования в ГДИ, известны специалистам в данной области техники и включают CFC-12, HFA-134a, HFA-227, HCFC-22 (CCl2F2) и HFA-152(C2H4F2 и изобутан). В предпочтительном воплощении изобретения композиция по изобретению находится в форме сухого порошка для доставки с использованием ингалятора сухого порошка (ИСП). Известно множество типов ИСП. Микрочастицы для доставки путем введения можно готовить с эксципиентами, которые способствуют доставке и высвобождению. Например, в сухом порошкообразном препарате микрочастицы можно включать в препарат с частицами носителя большего размера, которые способствуют потоку из ИСП в легкое. Пригодные носители в виде частиц известны и включают частицы лактозы; они могут иметь среднемассовый аэродинамический диаметр более чем 90 мкм. В случае препарата на основе аэрозоля предпочтительная композиция представляет собой: Соединения по изобретению можно применять в комбинации с другими лекарствами, которые применяют при лечении/предупреждении/подавлении или облегчении заболеваний или состояний, для которых полезны настоящие соединения. Такие другие лекарства можно вводить путем и в количестве, которые обычно применяют для них, одновременно или последовательно с соединением по изобретению. Когда соединение по изобретению применяют одновременно с одним или более чем одним другим лекарством, предпочтительна фармацевтическая композиция, содержащая такие другие лекарства в дополнение к соединению по изобретению. Соответственно, фармацевтические композиции по настоящему изобретению включают те, которые содержат один или более чем один из других активных ингредиентов в дополнение к соединению по изобретению. Агенты по изобретению можно вводить в ингаляционной форме. Получение аэрозоля можно осуществить, используя, например, управляемые давлением струйные распылители или ультразвуковые распылители, предпочтительно используя направляемые пропеллентом дозированные аэрозоли или введение без пропеллента активных соединений, измельченных в микронной коллоидной мельнице, например, из ингаляционных капсул или других систем доставки "сухого порошка". Активные соединения можно дозировать, как описано, в зависимости от используемой системы ингалятора. В дополнение к активным соединениям формы введения могут дополнительно содержать эксципиенты, такие как, например, пропелленты (например, хладон в случае дозированных аэрозолей), поверхностно-активные вещества, эмульгаторы, стабилизаторы, консерванты, корригенты, наполнители(например, лактозу в случае порошковых ингаляторов) или, если пригодно, дополнительные активные соединения. Для целей ингаляции в продаже имеется широкий ряд систем, с помощью которых можно получать и вводить аэрозоли оптимального размера частиц, используя ингаляционную методику, которая пригодна для пациента. Кроме использования адаптеров (спейсеров, расширителей) и грушевидных контейнеров (например, Nebulator, Volumatic) и автоматических устройств, испускающих распыляемый аэрозоль (Autohaler), для дозированных аэрозолей, в частности, в случае порошковых ингаляторов, доступен ряд технических решений (например, Diskhaler, Rotadisk, Turbohaler или такие ингаляторы, которые, например, описаны в ЕР-А-0505321). Способы синтеза Соединения по настоящему изобретению могут быть получены в соответствии с методиками приведенных ниже схем и примеров, используя подходящие материалы, и примеры которых дополнительно приведены нижеследующими конкретными примерами. Кроме того, путем использования методик, описанных в приведенном здесь описании, обычный специалист в данной области техники может легко получить дополнительные соединения по настоящему изобретению, заявленные здесь. Соединения, проиллюстрированные в примерах, однако, не следует рассматривать как составляющие единственный класс,который считают изобретением. Примеры дополнительно иллюстрируют подробности получения соединений по настоящему изобретению. Специалистам в данной области техники должно быть легко понятно, что известные вариации условий и процессов приведенных ниже препаративных методик можно использовать для получения этих соединений. Соединения по изобретению можно выделить в форме их фармацевтически приемлемых солей, таких как описаны ранее здесь выше. Форму свободной кислоты или основания, соответствующую выделенным солям, можно образовать путем нейтрализации подходящим основанием или кислотой, как, например, гидроксид натрия, карбонат калия, уксусная кислота и соляная кислота, и экстракции высвобожденной свободной кислоты или основания в органическом растворителе с последующим выпариванием. Свободную форму, выделенную таким способом, можно далее превратить в другую фармацевтически приемлемую соль путем растворения в органическом растворителе с последующим добавлением подходящей кислоты или основания и последующим выпариванием, осаждением или кристаллизацией. Может быть необходимо защитить реакционные функциональные группы (например, гидрокси,амино, тио или карбокси) в промежуточных соединениях, используемых при получении соединения по изобретению, чтобы избежать их нежелательного участия в реакции, приводящей к образованию соединений. Можно использовать общепринятые защитные группы, например, описанные Т. W. Greene и Р. G.M. Wuts в "Protective groups in organic chemistry" John Wiley and Sons, 1999. Соединения по изобретению могут быть получены в соответствии с путями, проиллюстрированными на схемах 1 и 2. Схема 1 Приведенные ниже примеры иллюстрируют изобретение. Общие экспериментальные детали. Все растворители и коммерческие реагенты использовали в том виде, в котором получали. Где продукты очищали, используя картридж Isolute SPE Si II, "картридж Isolute SPE Si" относится к предварительно набитой полипропиленовой колонке, содержащей несвязанный активированный кремнезем с частицами неправильной формы со средним размером 50 мкм и номинальной пористостью 60. Где использовали картридж Isolute SCX-2, "картридж Isolute SCX-2" относится к предварительно набитой полипропиленовой колонке, содержащей сильный ионообменный сорбент, представляющий собой кремнезем, функционализированный пропилсульфоновой кислотой без концевой функциональной группы."Картридж Isolute AI-N" относится к предварительно набитой полипропиленовой колонке, содержащей нейтральный глинозем со средним размером частиц 50-200 мкм и диаметром пор 120 . Условия препаративной ВЭЖХ ВЭЖХ система 1. Колонка С 18 с обращенной фазой (колонка 10022,5 мм i.d Genesis с размером частиц 7 мкм),элюирование градиентом А: вода + 0,1% муравьиная кислота; В: ацетонитрил + 0,1% муравьиная кислота при скорости тока 5 мл/мин и градиенте 1%/мин повышения в содержании В. Обнаружение с помощью УФ при 230 нм. Соединения были получены в виде соли формиат, где указано. ВЭЖХ система 2. Колонка С 18 с обращенной фазой с концевой функциональной группой (колонка 25021,2 мм Gemini с размером частиц 5 мкм), элюирование градиентом А: вода + 0,1% муравьиная кислота; В: ацетонитрил + 0,1% муравьиная кислота при скорости тока типично 17 мл/мин и градиенте 1 %/мин повышения в содержании В. Обнаружение с помощью УФ при 254 нм. Соединения были получены в виде соли формиат, где указано. ВЭЖХ система 3. Колонка С 18 с обращенной фазой с концевой функциональной группой (колонка 25021,2 мм Gemini с размером частиц 5 мкм), элюирование градиентом А: вода; В: ацетонитрил при скорости тока типично 17 мл/мин и градиенте 1%/мин повышения в содержании В. Обнаружение с помощью УФ при 254 нм. ВЭЖХ система 4. Колонка С 18 с обращенной фазой с концевой функциональной группой (колонка 25021,2 мм Gemini с размером частиц 5 мкм), элюирование градиентом А: вода; В: МеОН при скорости тока типично 17 мл/мин и градиенте 1%/мин повышения в содержании В. Обнаружение с помощью УФ при 254 нм. ВЭЖХ система 5. Колонка С 18 с обращенной фазой (250 21,2 мм Luna с размером частиц 5 мкм), элюирование градиентом А: вода + 0,1 % муравьиная кислота; В: ацетонитрил + 0,1% муравьиная кислота при скорости тока 15 мл/мин и градиенте 1%/мин повышения в содержании В. Обнаружение с помощью УФ при 254 нм. Соединения были получены в виде соли формиат, где указано. ЖХ-МС (жидкостная хроматография с масс-спектрометрией) способ 1. Обнаружение - МС, ЭСЭП (электронная спектроскопия энергетических потерь), УФ (щель для МС 100 мкл с встроенным УФ-детектором). Способ ионизации МС - электрораспыление (положительный и отрицательный ион). ЖХ-МС способ 2. Обнаружение - МС, ЭСЭП, УФ (щель для МС 100 мкл с встроенным УФ-детектором). Способ ионизации МС - электрораспыление (положительный и отрицательный ион). ЖХ-МС способ 3. Обнаружение - МС, ЭСЭП, УФ (щель для МС 100 мкл с встроенным УФ-детектором). Способ ионизации МС - электрораспыление (положительный ион). ЖХ-МС способ 4. Обнаружение - МС, ЭСЭП, УФ (щель для МС 100 мкл с встроенным УФ-детектором). Способ ионизации МС - электрораспыление (положительный ион). Сокращения, используемые в экспериментальном разделе: ДХМ = дихлорметан; ДМФ = N,N-диметилформамид; ВЭЖХ = высокоэффективная жидкостная хроматография; ПМС = промышленные метилированные спирты;RT = время удерживания; ТГФ = тетрагидрофуран. Приведенные ниже промежуточные соединения могут быть получены в соответствии с данными ссылками: Полифосфорную кислоту (17,2 г) суспендировали в ТГФ (90 мл) и перемешивали механически, добавляя в это время 3,5-дифторфенилмочевину (5,40 г, 31,4 ммоль), 4-цианобензальдегид (4,94 г, 37,6 ммоль) и этилацетоацетат (3,97 мл, 31,4 ммоль). Полученную в результате смесь нагревали с обратным холодильником в течение 17 ч, а затем оставляли при комнатной температуре на 48 ч. Растворитель удаляли при пониженном давлении и остаток распределяли между водой и EtOAc. Органический слой промывали водой, водным раствором карбоната натрия, водой, затем рассолом и высушивали (MgSO4),фильтровали и концентрировали. Полученную в результате пену очищали в двух партиях на картридже для флэш-хроматографии Biotage (90 г), нанося в ДХМ и элюируя 17,5-20-25% EtOAc в изогексанах. Пену, полученную таким образом, растирали с изогексанами/Et2O, затем собирали фильтрованием в виде белого твердого вещества, подвергали одной вытеснительной отмывке 2:1 изогексанами:Et2O и высушивали в вакуумной печи. Выход: 6,63 г (53%). ЖХ-МС (способ 1): RT = 3,55 мин, m/z = 398 [М+Н]+. Промежуточное соединение 15 было получено из 4-йодобензальдегида, этилацетоацетата и 3(трифторметил)фенилмочевины, используя способ, подобный использованному при получении промежуточного соединения 14. Выход: (25%). ЖХ-МС (способ 1): RT = 4,17 мин, m/z = 531 [М+Н]+. Промежуточное соединение 16 Промежуточное соединение 1 (5,00 г, 11,7 ммоль) растворяли в хлороформе (140 мл) и добавляли по каплям бром (1,87 г, 11,7 ммоль) при перемешивании. Через 30 мин добавляли несколько капель брома до тех пор, пока сохранялся оранжевый цвет. В результате выпаривания летучих веществ получили желтую пену. Выход: количественный. ЖХ-МС (способ 2): RT = 3,82 мин, m/z = 508/510 [M+H]+. Приведенные ниже промежуточные соединения были получены подобным способом: Промежуточное соединение 13 (32 мг, 0,029 ммоль) растворяли в хлороформе (2 мл) и добавляли бром (4 капли). Раствор перемешивали при КТ в течение 1 ч, после чего летучие вещества выпаривали. Продукт был получен в виде кремовой пены. Выход: количественный. ЖХ-МС (способ 2): RT = 3,35 мин, m/z = 1182 [М]+. Приведенные ниже промежуточные соединения были получены подобным способом: Промежуточное соединение 1 (1,00 г, 2,331 ммоль) растворяли в безводном ДМФ (25 мл) и раствор охлаждали до -10 С в атмосфере аргона. Добавляли гидрид натрия (60% дисперсия в минеральном масле) (93 мг, 2,331 ммоль) и реакционную смесь перемешивали до прекращения выделения пузырьков газа Добавляли N-Boc-3-бромпропиламин (610 мг, 2,563 ммоль) и перемешивание продолжали при 0 С еще в течение 2,5 ч, после чего добавляли водный раствор хлорида аммония (60 мл) и EtOAc (60 мл). Органический слой отделяли, и водный слой дополнительно экстрагировали EtOAc (60 мл). Органические экстракты объединяли и промывали водой (50 мл) и насыщенным рассолом (30 мл), высушивали (Na2SO4) и выпаривали. Остаток очищали на картридже Isolute Si II, элюируя 0-30% EtOAc в пентане, с получением продукта в виде бледно-желтого масла. Выход 783 мг (57%). ЖХ-МС (способ 2): RT = 4,31 мин, m/z = 585 [М-Н]-. Промежуточное соединение 30 Промежуточное соединение 29 (776 мг, 1,32 ммоль) растворяли в ДХМ (20 мл) и добавляли Nбромсукцинимид (236 мг, 1,32 ммоль). Раствор перемешивали при КТ в течение 1,5 ч, а затем смесь разбавляли ДХМ (80 мл), промывали насыщенным водным NaHCO3 (50 мл), водой (50 мл) и рассолом (30 мл) и высушивали (Na2SO4). В результате выпаривания получили бледно-желтую смолу. Выход: количественный. ЖХ-МС (способ 2): RT = 4,36 мин, m/z = 565/567 [М-Вос+2 Н]+. Промежуточное соединение 31 Промежуточное соединение 30 (731 мг, 1,099 ммоль) растворяли в ацетонитриле (20 мл) и добавляли гидрокарбонат натрия (277 мг, 3,297 ммоль) и 2 М этиламин в ТГФ (0,8 мл, 1,65 ммоль). Смесь нагревали при 80 С в течение 3,5 ч, давали охладиться, фильтровали и выпаривали. Остаток распределяли между ДХМ (70 мл) и водой (50 мл). Органический слой отделяли и выпаривали и сырой продукт очищали на картридже Isolute Si II (10 г), элюируя 40-80% EtOAc в пентане, с получением продукта в виде кремовой пены. Выход: 297 мг (46%). ЖХ-МС (способ 2): RT = 3,71 мин, m/z = 582 [М-Н]-. Промежуточное соединение 32 Промежуточное соединение 31 (292 мг, 0,501 ммоль) растворяли в 20% ТФУ в ДХМ (20 мл). Через 2 ч летучие вещества выпаривали и остаток растворяли в МеОН и наносили на картридж Isolute SCX-2(5 г), который был предварительно обработан МеОН. После промывания МеОН продукт элюировали 2 М аммиаком в МеОН. В результате выпаривания УФ-активных фракций получили чистый продукт в виде бледно-желтой смолы. Выход: 221 мг(91%). ЖХ-МС (способ 2): RT = 2,33 мин, m/z = 484 [М+Н]+. Промежуточное соединение 32 (214 мг, 0,443 ммоль) растворяли в ДХМ (10 мл) и добавляли 1,1'тиокарбонилдипиридон (51 мг, 0,222 ммоль). Раствору давали стоять при КТ в течение 48 ч, а затем обрабатывали амином, связанным со смолой, в течение 15 мин. После фильтрования растворитель выпаривали и сырой продукт очищали на картридже Isolute Si II (5 г), элюируя 0-5% МеОН в EtOAc. Фракции,которые содержали продукт, объединяли и выпаривали, остаток растворяли в МеОН и пропускали через картридж Isolute SCX-2 (5 г), дополнительно промывая метанолом. В результате выпаривания получили белую пену. Выход: 160 мг (36%). ЖХ-МС (cпособ 2): RT = 3,91 мин, m/z = 1009 [М+Н]+. Промежуточное соединение 34 Промежуточное соединение 34 было получено из промежуточного соединения 1 и третбутилбромацетата, используя методику, подобную использованной при синтезе промежуточного соединения 29. Выход: (80%). ЖХ-МС (способ 2): RT = 4,31 мин, m/z = 488 [M+H-tBu]+. Промежуточное соединение 35 Промежуточное соединение 35 было получено из промежуточного соединения 34, используя способ, подобный используемому при получении промежуточного соединения 30. Выход: (41%). ЖХ-МС (Способ 2): RT = 4,41 мин, m/z = 566/568 [M+H-tBu]+. Промежуточное соединение 36 Раствор промежуточного соединения 35 (467 мг, 0,751 ммоль) в ацетонитриле (15 мл) обрабатывалиN,N-бис(3-аминопропил)метиламином (54 мг, 0,375 ммоль) и гидрокарбонатом натрия (252 мг, 3,00 ммоль). Реакционную смесь нагревали при 80 С в течение 3,5 ч. После того как смеси дали охладиться,ее фильтровали и фильтрат выпаривали. В результате хроматографии с использованием картриджа Isolute Si II (10 г) и элюирования 1-20% МеОН в EtOAc получили чистый продукт в виде белого твердого вещества. Выход: 182 мг (43%). ЖХ-МС (способ 2): RT = 3,22 мин, m/z = 1136 [М+Н]+. Промежуточное соединение 37 на (8 мл). После стояния при КТ в течение 3 суток летучие вещества выпаривали и остаток растворяли в ацетонитриле (13 мл). Добавляли йодометан (4 мл) и гидрокарбонат натрия (39 мг, 0,468 ммоль) и смесь нагревали при 80 С с обратным холодильником. Через 17 ч летучие вещества выпаривали и остаток распределяли между ДХМ (50 мл) и водой (50 мл). Органическую фазу отделяли и высушивали (Na2SO4). В результате выпаривания получили бежевую пену. Выход: 181 мг (91%). ЖХ-МС (способ 2): RT = 3,20 мин, m/z = 1150 [М]+. Промежуточное соединение 38 Промежуточное соединение 38 было получено из промежуточного соединения 16 и 0,5 эквивалентов (2-аминоэтил)2-[(2-аминоэтил)трет-бутоксикарбониламино]этилкарбаминовой кислоты трет-бутилового эфира способом, подобным используемому при синтезе промежуточного соединения 36. Выход: (61%). ЖХ-МС (способ 2): RT = 3,58 мин, m/z = 1009 [М+Н]+. Промежуточное соединение 39 Защитные группы трет-бутилоксикарбонил в промежуточном соединении 39 удаляли, используя методику, аналогичную описанной для удаления защиты промежуточного соединения 31. Выход: (89%). ЖХ-МС (способ 2): RT = 2,17 мин, m/z = 909 [М+Н]+. Промежуточное соединение 40 Раствору промежуточного соединения 39 (219 мг, 0,241 ммоль) и 1,1'-тиокарбонилдипиридона (28 мг, 0,121 ммоль) в ДХМ (10 мл) давали стоять при КТ в течение 24 ч. Добавляли дополнительную порцию 1,1'-тиокарбонилдипиридона (20 мг, 0,086 ммоль) и через 4 ч реакционную смесь обрабатывали аминной смолой. Смесь перемешивали в течение 15 мин, фильтровали и наносили в картридж IsoluteSCX-2 (10 г), который был уравновешен МеОН. Картридж промывали МеОН, и элюент выпаривали. Белое твердое вещество подвергали хроматографии на картридже Isolute Si II (10 г), элюируя 0-10% МеОН в EtOAc. В результате выпаривания получили белое твердое вещество. Выход: 150 мг (66%). ЖХ-МС (способ 2): RT = 3,00 мин, m/z = 951 [М+Н]+. Промежуточное соединение 41 Раствор примера 23 (130 мг, 0,117 ммоль) в триэтиламине (0,5 мл) и ДМФ (0,5 мл) дегазировали,после чего добавляли (триметилсилил)ацетилен (34 мкл, 0,235 ммоль), йодид меди (I) (1,7 мг, 3 мол.%) и бис(трифенилфосфин)палладия(II)хлорид (8,4 мг, 5 мол.%), затем перемешивали и нагревали при 115 С в атмосфере аргона в течение 2 ч. Охлажденную смесь наливали в разбавленную серную кислоту (25 мл) и экстрагировали EtOAc (225 мл). Эти экстракты промывали рассолом (10 мл), после чего органическую фазу выделяли, высушивали (MgSO4), фильтровали и концентрировали в вакууме. Очистка была достигнута с использованием картриджа Isolute Si II, элюируя 0-10% МеОН в градиенте ДХМ. Продукт выделяли в виде твердого вещества кремового цвета. Выход: 48 мг (39%). ЖХ-МС (способ 1): RT 3,36 мин, m/z 1050 [М+Н]+. Промежуточное соединение 42 Раствор промежуточного соединения 16 (200 мг, 0,394 ммоль) и (3-аминобутил)метилкарбаминовой кислоты трет-бутилового эфира (370 мг, 1,83 ммоль) в ацетонитриле (10 мл) нагревали при 40 С в течение 2 ч. Растворитель выпаривали и остаток растворяли в МеОН и наносили на картридж Isolute SCX-2(5 г), который был уравновешен МеОН. Продукт вымывали МеОН. Выход: 225 мг (98%). ЖХ-МС (способ 2): RT = 3,63 мин, m/z = 484 [М+Н-Вос]+. Промежуточное соединение 43 Защиту промежуточного соединения 42 удаляли способом, подобным промежуточному соединению 31. Выход: (94%). ЖХ-МС (способ 2): RT = 2,11 мин, m/z = 484 [М+Н]+ Промежуточное соединение 44 Промежуточное соединение 3 (219 мг, 0,379 ммоль) растворяли в ацетонитриле (13 мл) и добавляли 2 М раствор метиламина в ТГФ (2 мл). Раствор нагревали при 50 С в течение 3 ч, а затем раствору давали стоять при КТ в течение 3 суток. Летучие вещества выпаривали и остаток распределяли между ДХМ(100 мл) и водой (80 мл). Органический слой отделяли и высушивали (Na2SO4). В результате выпаривания получили белую пену. Выход: 170 мг (85%). ЖХ-МС (способ 2): RT = 2,67 мин, m/z = 529 [М+Н]+. Промежуточное соединение 45 Раствор промежуточного соединения 44 (165 мг, 0,313 ммоль) и феноксипропилбромида (67 мг,0,313 ммоль) в ацетонитриле (10 мл) обрабатывали гидрокарбонатом натрия (53 мг, 0,626 ммоль) и реакционную смесь нагревали при 80 С в течение 4 суток. Раствор декантировали на картридже IsoluteSCX-2 (5 г), который был уравновешен МеОН. Картридж промывали МеОН, а затем продукт элюировали 2 М NH3 в МеОН. В результате выпаривания получили бесцветную смолу. Выход: 105 мг (51%). ЖХ-МС (способ 1): RT = 2,98 мин, m/z = 663 [М+Н]+. Раствор промежуточного соединения 45 (100 мг, 0,151 ммоль) в хлороформе (6 мл) обрабатывали бромом (10 мкл). Через 1 ч добавляли дополнительную порцию (20 мкл). Летучие вещества выпаривали с получением дибромированного продукта. Выход, количественный ЖХ-МС (способ 2): RT = 3,12 мин, m/z = 821 [М+Н]+. Пример 1 К раствору промежуточного соединения 16 (200 мг, 0,394 ммоль) в ацетонитриле (5 мл) добавляли 2 М раствор метиламина в ТГФ (197 мкл, 0,394 ммоль) и гидрокарбонат натрия (165 мг, 1,97 ммоль) Раствор нагревали при 80 С в течение 16 ч, а затем смесь фильтровали. Продукт очищали ВЭЖХ Системы 1, и фракции, содержащие чистый материал, объединяли и лиофилизировали. Продукт был получен в виде желтого твердого вещества. Выход: 62 мг (38%). ЖХ-МС (способ 3): RT = 8,67 мин, m/z = 413 [М+Н]+. 1 Н ЯМР (400 МГц, ДМСО-d6):= 2.73 (s, 3H), 3.78 (d, 1H), 3.83 (d, 1H), 5.44 (d, 1 Н), 7.67-7.82 (m,5 Н), 7.85-7.90 (m, 2 Н), 7.91 (m, 1 Н), 8.19 (d, 1H) млн-1. Приведенные ниже примеры были получены подобным способом из промежуточного соединения 16 и амина:
МПК / Метки
МПК: A61P 11/00, A61K 31/519, C07D 487/04
Метки: тетрагидропирролопиримидиндионы, эластазы, качестве, нейтрофилов, ингибиторов, применение, человека
Код ссылки
<a href="https://eas.patents.su/30-18061-tetragidropirrolopirimidindiony-i-ih-primenenie-v-kachestve-ingibitorov-elastazy-nejjtrofilov-cheloveka.html" rel="bookmark" title="База патентов Евразийского Союза">Тетрагидропирролопиримидиндионы и их применение в качестве ингибиторов эластазы нейтрофилов человека</a>