Замещенные триазолы в качестве ингибиторов кбв
Номер патента: 17748
Опубликовано: 28.02.2013
Авторы: Вальтер Аннетте О., Ся И, Барсанти Пол А., Менденхолл Крис Г., Ренхоу Пол А., Дал Дейвид
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
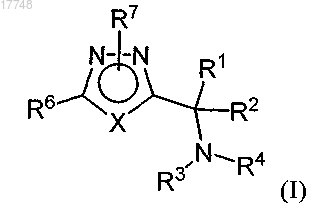
в которой R1 обозначает алкил;
R2 обозначает водород;
R3 обозначает -L1-А1, где L1 обозначает -C(O)- и А1 выбран из группы, включающей алкил, замещенный алкил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероциклоалкил, замещенный гетероциклоалкил и NR8R9;
R4 обозначает замещенный алкил;
или R3 и R4 вместе с атомом азота, с которым они связаны, объединяются с образованием 5-7-членной гетероциклоалкильной или замещенной гетероциклоалкильной группы, в которой необязательно еще один кольцевой атом выбран из группы, включающей O, S и NR11;
X обозначает N;
R6 обозначает арил, который необязательно может быть замещен -(R10)m, где R10 является таким, как определено здесь, m равно 1 или 2 и каждый R10 может быть одинаковым или разным, если m равно 2;
R7 обозначает -L2-А2, где L2 обозначает C1-C5-алкилен и А2 обозначает арил или замещенный арил, при условии, что R7 не присоединен к X;
R8 выбран из группы, включающей водород и алкил;
R9 выбран из группы, включающей алкил и замещенный алкил;
или R8 и R9 вместе с атомом азота, с которым они связаны, объединяются и образуют гетероциклоалкил или замещенный гетероциклоалкил;
R10 выбран из группы, включающей цианогруппу, алкил, замещенный алкил, -CF3, галоген и гидроксигруппу; и
R11 выбран из группы, включающей водород и алкил;
"алкил" означает одновалентную насыщенную алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;
"алкоксигруппа" означает группу "алкил-O-";
"замещенный алкил" означает алкильную группу, содержащую от 1 до 3 заместителей, выбранных из группы, включающей алкоксигруппу, ацил, ациламиногруппу, ацилоксигруппу, аминогруппу, цианогруппу, галоген, гидроксигруппу и -SO2-алкил;
"арил" означает фенил или нафтил;
"замещенный арил" означает арил, содержащий от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, ацил, ациламиногруппу, алкил, алкоксигруппу, аминогруппу, аминоацил, цианогруппу и галоген;
"гетероарил" означает ароматическую группу, содержащую в кольце от 1 до 10 атомов углерода и от 1 до 4 гетероатомов, выбранных из группы, включающей кислород, азот и серу;
"замещенный гетероарил" означает гетероарильные группы, содержащие от 1 до 3 заместителей, выбранных из той же самой группы заместителей, указанной для замещенного арила;
"гетероцикл", или "гетероциклический", или "гетероциклоалкил" означает насыщенную или ненасыщенную (но не ароматическую) группу, содержащую одно кольцо или несколько конденсированных колец, содержащую в кольце от 1 до 10 атомов углерода и от 1 до 4 гетероатомов, выбранных из группы, включающей кислород, азот и серу;
"замещенный гетероциклический" или "замещенный гетероциклоалкил" означает гетероциклоалкильные группы, содержащие от 1 до 3 заместителей, выбранных из группы, включающей алкил, замещенный алкил, оксогруппу (=O), алкоксигруппу, ацил, ациламиногруппу, аминогруппу, замещенную аминогруппу, аминоацил, цианогруппу, галоген, гидроксигруппу и -SO2-алкил.
2. Соединение по п.1 формулы (Ia) или его фармацевтически приемлемая соль
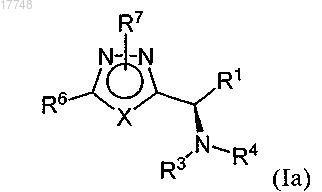
где значения X, R1, R3, R4, R6 и R7 являются такими, как определено в п.1.
3. Соединение по п.1 формулы (Id) или его фармацевтически приемлемая соль
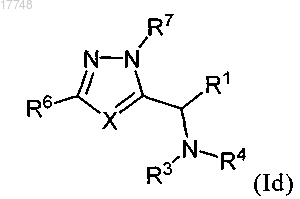
где значения X, R1, R3, R4, R6 и R7 являются такими, как определено в п.1.
4. Соединение по п.1 формулы (Ie) или его фармацевтически приемлемая соль

где значения X, R1, R3, R4, R6 и R7 являются такими, как определено в п.1.
5. Соединение по п.1 формулы (II) или его фармацевтически приемлемая соль
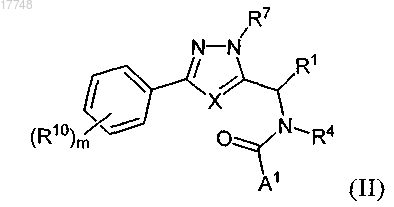
где R4 обозначает алкил, содержащий от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, алкоксигруппу, аминогруппу, ациламиногруппу и галоген;
значения X, R1, A1, R10, m и R7 являются такими, как определено в п.1.
6. Соединение по п.5 формулы (IIb) или его фармацевтически приемлемая соль

где значения R1, R10, R4, m, А1 и R7 являются такими, как определено в п.1.
7. Соединение по пп.1-5, в котором R1 выбран из группы, включающей изопропил, трет-бутил и пропил.
8. Соединение по любому из пп.1-5, в котором А1 обозначает фенил или замещенный фенил.
9. Соединение по пп.1-5, в котором А1 обозначает замещенный или незамещенный пиридил.
10. Соединение по любому из пп.1-5, в котором А1 обозначает гетероциклоалкил или замещенный гетероциклоалкил.
11. Соединение по п.10, в котором А1 обозначает замещенную или незамещенную морфолиновую группу.
12. Соединение по любому из пп.1-5, в котором А1 обозначает алкил или замещенный алкил.
13. Соединение по п.12, в котором указанный замещенный алкил замещен алкоксигруппой или гидроксигруппой.
14. Соединение по любому из пп.1-5, в котором А1 обозначает замещенную арильную или гетероарильную группу, выбранную из группы, включающей 4-трет-бутилфенил, 2-хлорфенил, 2-хлор-6-метилпирид-4-ил, 3-хлорфенил, 4-хлорфенил, 6-хлорпиридин-3-ил, 3,4-дихлорфенил, 2,4-дифторфенил, 2-метоксифенил, 4-метоксифенил, 4-метилфенил, 6-метилпиридин-3-ил, 2-пирролидин-3-илфенил, 4-(трифторметил)фенил и 6-(трифторметил)пиридин-3-ил.
15. Соединение по любому из пп.1-5, в котором А1 обозначает замещенный алкил, выбранный из группы, включающей
3-амино-2-оксо-1(2H)-пиридинилметил, цианометил, (N,N-диметиламино)метил,
этоксиметил, п-фторфеноксиметил, гидроксиметил, 1H-имидазол-1-илметил, метоксиметил,
(N-метиламино)метил, метилсульфонилметил, (5-метил-1H-тетразол-1-ил)метил,
(5-метил-2H-тетразол-2-ил)метил, морфолин-4-илметил, 1Н-пиразол-1-илметил,
1H-1,2,3-триазол-1-илметил, 2H-1,2,3-триазол-2-илметил, 1H-1,2,4-триазол-1-илметил,
2H-1,2,4-триазол-2-илметил, 4H-1,2,4-триазол-4-илметил, 1H-тетразол-1-илметил,
1H-тетразол-5-илметил, 2H-тетразол-2-илметил, имидазол-4-илметил,
1-метилпиразол-3-илметил, пиперидин-4-илметил, трифторметил, диметиламиноэтил и
2-оксо-3-аминопирролидин-1-илметил.
16. Соединение по любому из пп.1-5, в котором А1 обозначает NR8R9.
17. Соединение по п.16, в котором R8 обозначает водород.
18. Соединение по п.16, в котором R8 и R9 обозначают водород.
19. Соединение по п.16, в котором R9 выбран из группы, включающей метил, гидроксиметил, метоксиметил, метоксиэтил, 2-гидроксиэтил и изопропил.
20. Соединение по п.1, в котором R4 обозначает алкил, содержащий от 1 до 3 заместителей, выбранных из группы, включающей аминогруппу, галоген, алкоксигруппу и гидроксигруппу.
21. Соединение по любому из пп.1-5, в котором R4 выбран из группы, включающей
-(CH2)2-NH2, -CH2CH(NH2)CH2OH, -(CH2)3-OH, -(CH2)3-NH2, -CH2CHOHCH2NH2,
-CH2CH(CH2OH)CH2NH2, -(CH2)2CH(NH2)CH2OH, -(CH2)2CH(NH2)CH3, -CH2CHFCH2NH2,
-(CH2)3-NHCH2CH2OH, -(CH2)3-NHCH2CO2H, -(CH2)3NHCH2CO2CH2CH3, -(CH2)3-N(CH2CH2OH)2,
-(CH2)2CH(NH2)CH2OH, -(CH2)2C(CH3)2NH2, -(CH2)2CH(NH2)CH2OCH3, -(CH2)2CH(NH2)CH2F и
-CH2CHFCH(NH2)CH2OH.
22. Соединение по любому из пп.1-5, в котором R4 выбран из группы, включающей
-(CH2)3NH2, -(CH2)2CH(CH2OH)NH2, -CH2CH(F)CH2NH2, -(CH2)2CH(CH2F)NH2, -(CH2)2C(CH3)2NH2,
-(CH2)2CH(CH3)NH2 и -(CH2)CH(CH2OCH3)NH2.
23. Соединение по любому из пп.1-5, в котором R3 и R4 или А1 и R4 вместе с соответствующими связанными с ними атомами объединяются с образованием 5-7-членной гетероциклоалкильной или замещенной гетероциклоалкильной группы.
24. Соединение по п.23, в котором гетероциклоалкильная или замещенная гетероциклоалкильная группа выбрана из группы, включающей

25. Соединение по любому из пп.1-5, в котором R6 выбран из группы, включающей фенил, 3-хлорфенил, 3-фторфенил, 2,5-дифторфенил и 2,3,5-трифторфенил.
26. Соединение по любому из пп.1-5, в котором L2 обозначает метилен и А2 выбран из группы, включающей фенил, 3-фторфенил или 3-гидроксифенил.
27. Соединение по любому из пп.1-5, в котором R7 обозначает бензил.
28. Соединение по любому из пп.1-5, в котором R1 обозначает трет-бутил, L2 обозначает метилен, А2 обозначает фенил и R6 обозначает фенил или замещенный фенил.
29. Соединение по п.28, в котором R1 обозначает трет-бутил, L2 обозначает метилен, А1 обозначает фенил, R6 обозначает фенил, замещенный 1-2 галогенидными заместителями.
30. Соединение по любому из пп.1-5, в котором R1 обозначает трет-бутил, R2 обозначает водород, L2 обозначает метилен, А2 обозначает фенил, R4 обозначает замещенный алкил.
31. Соединение по п.30, в котором R4 обозначает -(CH2)3NH2, -CH2CH(F)CH2NH2, -(CH2)2CH(CH2F)NH2,
-(CH2)2CH(CH2OCH3)NH2, -(CH2)2CH(CH3)NH2, -(CH2)2C(CH3)2NH2 или -(CH2)2CH(CH2OH)NH2.
32. Фармацевтическая композиция, включающая соединение по п.1 в терапевтически эффективном количестве и фармацевтически приемлемый носитель.
33. Композиция по п.32, дополнительно включающая по меньшей мере одно дополнительное средство, предназначенное для лечения рака.
34. Композиция по п.33, в которой дополнительное средство, предназначенное для лечения рака, выбрано из группы, включающей иринотекан, топотекан, гемцитабин, иматиниб, трастузумаб, 5-фторурацил, лейковорин, карбоплатин, цисплатин, доцетаксел, паклитаксел, тезацитабин, циклофосфамид, алкалоиды барвинка, антрациклины, ритуксимаб и трастузумаб.
35. Применение композиции по п.32 для получения лекарственного средства, предназначенного для лечения нарушения, по меньшей мере частично, опосредуемого с помощью КБВ, у млекопитающего пациента.
36. Применение по п.35, в котором нарушение представляет собой клеточное пролиферативное заболевание.
37. Применение по п.36, в котором клеточное пролиферативное заболевание представляет собой рак.
38. Применение по п.37, в котором рак выбран из группы, включающей рак легких и бронхов, предстательной железы, молочной железы, поджелудочной железы, ободочной и прямой кишки, щитовидной железы, желудка, печени и внутрипеченочных желчных протоков, почек и почечных лоханок, мочевого пузыря, тела матки, шейки матки, яичников, множественную миелому, рак пищевода, острый миелогенный лейкоз, хронический миелогенный лейкоз, лимфолейкоз, миелолейкоз, рак головного мозга, полости рта и глотки, гортани, тонкой кишки, неходжкинскую лимфому, меланому и ворсинчатую аденому ободочной кишки.
39. Применение по п.38, дополнительно включающее введение млекопитающему одного дополнительного средства, предназначенного для лечения рака.
40. Применение по п.39, в котором дополнительное средство, предназначенное для лечения рака, выбрано из группы, включающей иринотекан, топотекан, гемцитабин, иматиниб, трастузумаб, 5-фторурацил, лейковорин, карбоплатин, цисплатин, доцетаксел, паклитаксел, тезацитабин, циклофосфамид, алкалоиды барвинка, антрациклины, ритуксимаб и трастузумаб.
41. Соединение по п.1, выбранное из группы, включающей
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)никотинамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)морфолин-4-карбоксамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-метоксиацетамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксиацетамид;
N-((R)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)пиперидин-1-карбоксамид;
N-((R)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)морфолин-4-карбоксамид;
(2S,6R)-N-((R)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2,6-диметилморфолин-4-карбоксамид;
1-((R)-3-амино-4-фторбутил)-1-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-3,3-диметилмочевина;
1-((R)-3-амино-4-фторбутил)-1-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-3-метилмочевина;
(2S,6R)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2,6-диметилморфолин-4-карбоксамид;
1-((S)-3-амино-4-фторбутил)-1-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-3,3-диметилмочевина;
1-((S)-3-амино-4-фторбутил)-1-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-3-метилмочевина;
N-((R)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)тиоморфолин-4-карбоксамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)тиоморфолин-4-карбоксамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)пиперидин-1-карбоксамид;
(R)-6-(аминометил)-4-((R)-1-(1-бензил-3-фенил-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-1,4-оксазепан-3-он и
(S)-6-(аминометил)-4-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-1,4-оксазепан-3-он,
или его фармацевтически приемлемая соль.
42. Соединение по п.1, выбранное из группы, включающей
N-((R)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-гидроксиацетамид;
N-((R)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)никотинамид;
N-((R)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-1,1-диоксотиоморфолин-4-карбоксамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-1,1-диоксотиоморфолин-4-карбоксамид;
(2R)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-(гидроксиметил)пирролидин-1-карбоксамид;
(2S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-(гидроксиметил)пирролидин-1-карбоксамид;
(2R)-N-((R)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-(гидроксиметил)пирролидин-1-карбоксамид;
(2S)-N-((R)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-(гидроксиметил)пирролидин-1-карбоксамид;
(2S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
N-(3-аминопропил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)никотинамид;
(2S)-N-(3-аминопропил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
N-(3-аминопропил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-гидроксиацетамид;
(2S)-N-(3-аминопропил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-(гидроксиметил)пирролидин-1-карбоксамид;
N-(3-аминопропил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)морфолин-4-карбоксамид;
(2S,6R)-N-(3-аминопропил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2,6-диметилморфолин-4-карбоксамид;
N-(3-аминопропил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-4-(метилсульфонил)пиперазин-1-карбоксамид;
(2S)-N-((R)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(2S)-N-((S)-3-амино-2-фторпропил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-(гидроксиметил)пирролидин-1-карбоксамид;
(2S,6R)-N-((S)-3-амино-2-фторпропил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2,6-диметилморфолин-4-карбоксамид;
N-((S)-3-амино-2-фторпропил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-гидроксиацетамид;
(2S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)тетрагидрофуран-2-карбоксамид;
(2S)-N-((R)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)тетрагидрофуран-2-карбоксамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-6-метилпиридин-3-карбоксамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)изоникотинамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)пиколинамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-(метилсульфонил)ацетамид;
N-((S)-3-амино-2-фторпропил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)никотинамид;
(2S)-N-((S)-3-амино-2-фторпропил)-N-((R)-1-(2-бензил-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
N-((R)-1-(2-(3-бромбензил)-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-N-((S)-3-амино-4-фторбутил)-2-гидроксиацетамид;
(2S)-N-((R)-1-(2-(3-бромбензил)-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-N-((S)-3-амино-4-фторбутил)-2-гидроксипропанамид;
N-((R)-1-(2-(3-бромбензил)-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-N-((S)-3-амино-4-фторбутил)никотинамид;
N-((R)-1-(2-(3-бромбензил)-5-(2,5-дифторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-N-((S)-3-амино-4-фторбутил)бензамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(5-хлор-2-фторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-метоксиацетамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(2-бензил-5-(5-хлор-2-фторфенил)-2H-1,2,4-триазол-3-ил)-2,2-диметилпропил)-2-гидроксиацетамид;
(S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(5-хлор-2-фторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(5-хлор-2-фторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)бензамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(5-хлор-2-фторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-4-метилбензамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(5-хлор-2-фторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)никотинамид;
(R)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-(3-бромбензил)-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)тетрагидрофуран-2-карбоксамид;
(S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-(3-бромбензил)-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)тетрагидрофуран-2-карбоксамид;
(R)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)тетрагидрофуран-2-карбоксамид;
(S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-(3-цианобензил)-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(5-хлор-2-фторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)морфолин-4-карбоксамид;
(2S,6R)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(5-хлор-2-фторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2,6-диметилморфолин-4-карбоксамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(5-хлор-2-фторфенил)-1H-1,2,4-триазол-5-ил)-2-метилпропил)бензамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(5-хлор-2-фторфенил)-1H-1,2,4-триазол-5-ил)-2-метилпропил)-4-метилбензамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(5-хлор-2-фторфенил)-1H-1,2,4-триазол-5-ил)-2-метилпропил)-2-метоксиацетамид;
N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(5-хлор-2-фторфенил)-1H-1,2,4-триазол-5-ил)-2-метилпропил)-2-гидроксиацетамид;
(S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(5-хлор-2-фторфенил)-1H-1,2,4-триазол-5-ил)-2-метилпропил)-2-гидроксипропанамид;
(S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-метоксипропанамид;
(S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(3-(2,5-дифторфенил)-1-(3-метилбензил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(2S,6R)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(3-(2,5-дифторфенил)-1-(3-метилбензил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2,6-диметилморфолин-4-карбоксамид;
(S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(3,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(3,5-дихлорфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(2S,6R)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(3,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2,6-диметилморфолин-4-карбоксамид;
(S)-N-((S)-3-амино-4,4-дифторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(S)-N-((R)-3-амино-4,4-дифторбутил)-N-((R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(S)-N-((R)-3-амино-4,4-дифторбутил)-N-((R)-1-(3-(2,5-дифторфенил)-1-(3-метилбензил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(S)-N-((S)-3-амино-4,4-дифторбутил)-N-((R)-1-(1-(3-цианобензил)-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(S)-N-((R)-3-амино-4,4-дифторбутил)-N-((R)-1-(1-(3-цианобензил)-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(S)-N-((R)-3-амино-4,4-дифторбутил)-N-((R)-1-(3-(2,5-дифторфенил)-1-(3-(трифторметил)бензил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(S)-N-((S)-3-амино-4,4-дифторбутил)-N-((R)-1-(3-(2,5-дифторфенил)-1-(3-метилбензил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(S)-N-((S)-3-амино-4,4-дифторбутил)-N-((R)-1-(3-(2,5-дифторфенил)-1-(3-(трифторметил)бензил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(S)-N-((S)-3-амино-4,4-дифторбутил)-N-((R)-1-(1-(3-бромбензил)-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(S)-N-((R)-3-амино-4,4-дифторбутил)-N-((R)-1-(1-(3-бромбензил)-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(2-хлор-5-фторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид;
(S)-N-((S)-3-амино-4-фторбутил)-N-((R)-1-(1-бензил-3-(5-хлор-2-фторфенил)-1H-1,2,4-триазол-5-ил)-2-метилпропил)-3-(гидроксиметил)морфолин-4-карбоксамид;
(S)-N-((S)-3-амино-4,4-дифторбутил)-N-((R)-1-(3-(2,5-дифторфенил)-1-(3-изопропилбензил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид и
(S)-N-((R)-3-амино-4,4-дифторбутил)-N-((R)-1-(3-(2,5-дифторфенил)-1-(3-изопропилбензил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)-2-гидроксипропанамид,
или его фармацевтически приемлемая соль.
Текст
Изобретение относится к новым соединениям, представляющим собой замещенные триазолы формулы (I), и к их фармацевтически приемлемым солям, к композиции, содержащей эти производные совместно с фармацевтически приемлемыми носителями, а также к их использованию. 017748 Предпосылки создания изобретения Перекрестная ссылка на родственную заявку По заявке на данное изобретение в соответствии с 35 U.S.С. 119(е) испрашивается приоритет по предварительной заявке US60/858964, поданной 13 ноября 2006 г., которая во всей своей полноте включена в настоящее изобретение в качестве ссылки. Область техники, к которой относится изобретение Настоящее изобретение, в целом, относится к замещенным триазолам и их фармацевтически приемлемым солям. Настоящее изобретение также относится к композициям таких соединений вместе с фармацевтически приемлемыми носителями и к применению таких соединений. Уровень техники Кинезины являются моторными белками, которые используют аденозинтрифосфат для связывания с микротрубочками и генерации механического усилия. Кинезины характеризуются моторным доменом,содержащим примерно 350 аминокислотных остатков. Расшифрована кристаллическая структура нескольких моторных доменов кинезина. К настоящему времени идентифицированы около тысячи родственных кинезину белков (РКБ). Кинезины участвуют во многих биологических процессах в клетках, включая транспорт органелл и везикул и поддержание эндоплазматического ретикулума. Различные РКБ взаимодействуют с микротрубочками митотического веретена или с хромосомами непосредственно и, видимо, играют главную роль на митотических стадиях клеточного цикла. Эти митотические РКБ представляют особый интерес для разработки противораковых средств. Кинезин - белок веретена (КБВ) (также известный, как Eg5, HsEg5, KNSL1 или KIF11) является одним из нескольких кинезиноподобных моторных белков, которые локализованы в митотическом веретене и для которых известно, что они необходимы для образования и/или функционирования биполярного митотического веретена. В 1995 г. показано, что уменьшение содержания КБВ с помощью антител против C-конца КБВ останавливает митоз клеток HeLa с помощью последовательностей моноастральных микротрубочек(Blangy et al., Cell. 83:1159-1169, 1995). Мутации в генах bimC и cut7, которые считаются гомологами КБВ, приводят к нарушению отделения центросом в Aspergillus nidulans (Enos, A.P., and N.R. Morris, Cell. 60:1019-1027, 1990) и Schizosaccharomyces pombe (Hagan, I., and M. Yanagida, Nature. 347:563-566, 1990). Обработка клеток с помощью ATRA (полностью-транс-ретиноевая кислота), которая уменьшает экспрессирование КБВ на уровне белка, или уменьшение количества КБВ с помощью антисмысловых олигонуклеотидов показали, что происходит значительное подавление роста клеток DAN-G карциномы поджелудочной железы, и это указывает на то, что КБВ может участвовать в антипролиферативном воздействии полностью-транс-ретиноевой кислоты (Kaiser, A., et al., J. Biol. Chem. 274, 18925-18931, 1999). Интересно, что показано, что родственная Xenopus laevis Aurora протеинкиназа pEg2 связывается сX1Eg5 и фосфорилирует его (Giet, R., et al., J. Biol. Chem. 274:15005-15013, 1999). Возможные субстраты родственных Aurora киназ представляют особый интерес для разработки противораковых средств. Например, у пациентов, страдающих раком толстой кишки, киназы Aurora 1 и 2 сверхэкспрессируются на уровне белка и ДНК и гены амплифицируются. Показано, что первая проникающая в клетку небольшая молекула - ингибитор КБВ, "монастрол",останавливает клеточный цикл у клеток с монополярными веретенами, но не влияет на полимеризацию микротрубочек, на которую влияют обычные химиотерапевтические средства, такие как таксаны и алкалоиды барвинка (Mayer, T.U., et al., Science. 286:971-974, 1999). При исследованиях, основанных на фенотипе, установлено, что монастрол является ингибитором, и предположено, что это соединение может послужить основой для разработки противораковых лекарственных средств. Установлено, что ингибирование не является конкурентным по отношению к аденозинтрифосфату и быстро обратимо (DeBonis, S.,et al., Biochemistry, 42:338-349, 2003; Kapoor, T.M., et al., J. Cell Biol., 750:975-988, 2000). Вследствие важности улучшенных химиотерапевтических средств необходимы ингибиторы КБВ,которые in vivo являются эффективными ингибиторами КБВ и белков, родственных КБВ.-1 017748 Краткое изложение сущности изобретения В одном варианте осуществления настоящее изобретение относится к замещенным триазолам и их фармацевтически приемлемым солям, к их получению, к фармацевтическим композициям и к их применению для лечения опосредуемых КБВ заболеваний, где соединения описываются формулой (I)R4 обозначает замещенный алкил; или R3 и R4 вместе с атомом азота, с которым они связаны, объединяются с образованием 5-7-членной гетероциклоалкильной или замещенной гетероциклоалкильной группы, в которой необязательно еще один кольцевой атом выбран из группы, включающей O, S и NR11;R6 обозначает арил, который необязательно может быть замещен -(R10)m, где R10 является таким, как определено здесь, m равно 1 или 2 и каждый R10 может быть одинаковым или разным, если m равно 2;R7 обозначает -L2-А 2, где L2 обозначает C1-C5-алкилен и А 2 обозначает арил или замещенный арил,при условии, что R7 не присоединен к X;R9 выбран из группы, включающей алкил и замещенный алкил; или R8 и R9 вместе с атомом азота, с которым они связаны, объединяются и образуют гетероциклоалкил или замещенный гетероциклоалкил;"алкил" означает одновалентную насыщенную алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;"арил" означает фенил или нафтил;"замещенный гетероарил" означает гетероарильные группы, содержащие от 1 до 3 заместителей,выбранных из той же самой группы заместителей, указанной для замещенного арила;"гетероцикл" или "гетероциклический" или "гетероциклоалкил" означает насыщенную или ненасыщенную (но не ароматическую) группу, содержащую одно кольцо или несколько конденсированных колец, содержащую в кольце от 1 до 10 атомов углерода и от 1 до 4 гетероатомов, выбранных из группы,включающей кислород, азот и серу;-2 017748 Подробное описание изобретения А. Соединения, предлагаемые в настоящем изобретении. Соединения, предлагаемые в настоящем изобретении, включают соединения формулы (I) или их фармацевтически приемлемую сольR4 обозначает замещенный алкил; или R3 и R4 вместе с атомом азота, с которым они связаны, объединяются с образованием 5-7-членной гетероциклоалкильной или замещенной гетероциклоалкильной группы, в которой необязательно еще один кольцевой атом выбран из группы, включающей O, S и NR11;R6 обозначает арил, который необязательно может быть замещен -(R10)m, где R10 является таким, как определено здесь, m равно 1 или 2 и каждый R10 может быть одинаковым или разным, если m равно 2;R7 обозначает -L2-А 2, где L2 обозначает C1-C5-алкилен и А 2 обозначает арил или замещенный арил,при условии, что R7 не присоединен к X;R9 выбран из группы, включающей алкил и замещенный алкил; или R8 и R9 вместе с атомом азота, с которым они связаны, объединяются и образуют гетероциклоалкил или замещенный гетероциклоалкил;R11 выбран из группы, включающей водород и алкил. Один вариант осуществления относится к соединениям формул (Ia), (Id) или (Ie) или их фармацевтически приемлемой соли где R1, R3, R4, X, R6 и R7 являются такими, как определено для формулы (I). В одном варианте осуществления соединения, предлагаемые в настоящем изобретении, включают соединения формулы (II) или их фармацевтически приемлемую соль в которой R4 обозначает алкил, содержащий от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, алкоксигруппу, аминогруппу, ациламиногруппу и галоген; значения X, R1, A1, R10, m и R7 являются такими, как определено для формулы (I).-3 017748 Другой вариант осуществления относится к соединению формулы (IIb) или его фармацевтически приемлемой соли В одном варианте осуществления А 1 обозначает арил или замещенный арил. В некоторых вариантах осуществления А 1 обозначает замещенный или незамещенный фенил. В одном варианте осуществления А 1 обозначает гетероарил или замещенный гетероарил. В некоторых вариантах осуществления А 1 обозначает замещенный или незамещенный пиридил. В одном варианте осуществления А 1 обозначает гетероциклоалкил или замещенный гетероциклоалкил. В некоторых вариантах осуществления А 1 обозначает замещенную или незамещенную морфолиновую группу. В одном варианте осуществления А 1 обозначает алкил или замещенный алкил. В некоторых вариантах осуществления А 1 обозначает алкил, замещенный алкоксигруппой или гидроксигруппой. В одном варианте осуществления А 1 обозначает 1,3-бензотиадиазол-4-ил, фуран-3-ил, изоксазол-3 ил, метил, фенил, пиперидин-3-ил, пиперидин-4-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиразин-2-ил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидро-2H-пиран-4-ил, 1H-тетразол-1-ил,2H-тетразол-2-ил, тиазол-4-ил, 1,3,4-тиадиазол-2-ил, 1,3-бензотиадиазол-6-ил, 3,3-дигидробензо[1,2,3]тиадиазол-4-ил, бензимидазол-2-ил, бензимидазол-6-ил, бензо[1,2,5]тиадиазол, бензоксадиазол-4-ил,имидазол-4-ил, индазол-6-ил, изооксазол-5-ил, морфолин-2-ил, морфолиновую группу, тиадиазол-4-ил,пирролидин-N-ил, пиразол-3-ил, пирролидин-2-ил, пирролидин-3-ил, оксазол-4-ил, тетразол-5-ил или пиперидин-N-ил. В одном варианте осуществления А 1 обозначает замещенную арильную или гетероарильную группу, выбранную из группы, включающей 5-метил-2H-имидазол-4-ил, 2-аминотиазол-4-ил, 4-третбутилфенил, 2-хлорфенил, 2-хлор-6-метилпирид-4-ил, 3-хлорфенил, 4-хлорфенил, 6-хлорпиридин-3-ил,3,4-дихлорфенил, 2,4-дифторфенил, 1,5-диметил-1H-пиразол-3-ил, 2,4-диметилтиазол-5-ил, 1-этил-3 метил-1H-пиразол-5-ил, 2-метоксифенил, 4-метоксифенил, 4-метилизоксазол-3-ил, 5-метилизоксазол-4 ил, 4-метилфенил, 1-метил-3-трифторметил-1H-пиразол-4-ил, 1-метил-5-хлор-1H-пиразол-4-ил, 5-метил 1H-пиразол-3-ил,6-метилпиридин-3-ил,2-пирролидин-3-илфенил,4-(трифторметил)фенил,6-(трифторметил)пиридин-3-ил, 2,5-диметилоксазол-4-ил, 2-аминотиазол-4-ил, 4-метилпиразол-5-ил,3-трифторметилпиразол-4-ил, 2-метил-3-трифторметилпиразол-5-ил, 4-хлор-1,3-диметилпиразоло[3,4]пиридин и 1-метилбензимидазол-2-ил. В одном варианте осуществления А 1 обозначает замещенный гетероциклил, выбранный из группы,включающей 1-метилпиперазин-4-ил, 1-метилкарбонилпиперидин-4-ил, 1-метоксикарбонилпиперидин-4 ил, хинуклидин-3-ил, 2-оксопирролидин-5-ил, 2-оксопирролидин-4-ил, 2-оксодигидрофуран-5-ил,2-оксотиазолидин-4-ил и 3-гидроксипирролидин-5-ил. В одном варианте осуществления А 1 обозначает 2-(гидроксиметил)пирролидин-1-ил. В одном варианте осуществления А 1 обозначает замещенный алкил, выбранный из группы, включающей 3-амино-2-оксо-1(2H)пиридинилметил, цианометил, (N,N-диметиламино)метил,этоксиметил, п-фторфеноксиметил, гидроксиметил, 1H-имидазол-1-илметил, метоксиметил,(N-метиламино)метил, метилсульфонилметил, (5-метил-1H-тетразол-1-ил)метил,(5-метил-2H-тетразол-2-ил)метил, морфолин-4-илметил, 1H-пиразол-1-илметил,1H-1,2,3-триазол-1-илметил, 2H-1,2,3-триазол-2-илметил, 1H-1,2,4-триазол-1-илметил,2H-1,2,4-триазол-2-илметил, 4H-1,2,4-триазол-4-илметил, 1H-тетразол-1-илметил,1H-тетразол-5-илметил, 2H-тетразол-2-илметил, имидазол-4-илметил,1-метилпиразол-3-илметил, пиперидин-4-илметил, трифторметил, диметиламиноэтил и 2-оксо-3-аминопирролидин-1-илметил. В одном варианте осуществления А 1 обозначает NR8R9. В одном варианте осуществления R8 обозначает водород. В одном варианте осуществления R8 и R9 обозначают алкил. В некоторых вариантах осуществления 8R и R9 обозначают метил. В одном варианте осуществления R9 выбран из группы, включающей метил, гидроксиметил, метоксиметил, метоксиэтил, 2-гидроксиэтил и изопропил.-4 017748 В некоторых вариантах осуществления -NR8R9 выбраны из группы, включающей тиаморфолин-N-ил, 1,1-диоксотиаморфолин-N-ил, 1-оксотиаморфолин-1-ил,2-(аминометилен)пирролидин-N-ил, 2-(метоксикарбонил)пирролидин-N-ил,2,6-диметилморфолин-N-ил, 3-гидроксипиперидин-N-ил, 3-гидроксипирролидин-N-ил,4-(бутилсульфонил)пиперазин-N-ил, 4-(циклопропилсульфонил)пиперазин-N-ил,4-(диметиламино)пиперидин-N-ил, 4-(этоксикарбонил)пиперазин-N-ил,4-(этилсульфонил)пиперазин-N-ил, 4-(изопропилсульфонил)пиперазин-N-ил,4-(метилкарбонил)пиперазин-N-ил, 4-(метилсульфонил)пиперидин-N-ил,4-(метилсульфонил)пиперазин-N-ил, 4-(морфолин-N-ил)пиперидин-N-ил,4-(пиперидин-N-ил)пиперидин-N-ил, 4-(пропилсульфонил)пиперазин-N-ил,4-циклогексилпиперазин-N-ил, 4-гидроксипиперидин-N-ил, 4-изопропилпиперазин-4-ил,4-метилпиперидин-N-ил, изоксазолидин-2-ил, морфолин-N-ил, пиперазин-N-ил, пиперидин-N-ил,2-(гидразинокарбонил)пирролидин-N-ил и пирролидин-N-ил. В некоторых вариантах осуществления R4 выбран из группы, включающей-CH2CHFCH(NH2)CH2OH. В одном варианте осуществления R4 выбран из группы, включающей-(CH2)3NH2, -(CH2)2CH(CH2OH)NH2, -CH2CH(F)CH2NH2, -(CH2)2CH(CH2F)NH2,-(CH2)2C(CH3)2NH2, -(CH2)2CH(CH3)NH2 и -(CH2)CH(CH2OCH3)NH2. В некоторых вариантах осуществления гетероциклоалкильная или замещенная гетероциклоалкильная группа выбрана из группы, включающей В некоторых вариантах осуществления R6 выбран из группы, включающей фенил, 3-хлорфенил, 3 фторфенил, 2,5-дифторфенил и 2,3,5-трифторфенил. В одном варианте осуществления R6 выбран из группы, включающей фенил, 3-бромфенил, 2-фтор-5-хлорфенил, 2-хлор-5-фторфенил, 3,5-дихлорфенил, 3-хлорфенил,4-цианофенил, 2,5-дифторфенил, 3-фторфенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил,4-метилфенил, 2-трифторметилфенил и 3-трифторметилфенил. В одном варианте осуществления R6 выбран из группы, включающей 5-хлор-2-фторфенил, 2-фтор 5-хлорфенил, 3,5-дифторфенил и 3,5-дихлорфенил.-5 017748 В одном варианте осуществления А 2 выбран из группы, включающей фенил, 3-хлорфенил, 3-цианофенил, 2,4-дифторфенил, 2,5-дифторфенил, 3,5-дифторфенил,2-фторфенил, 3-фторфенил, 4-фторфенил, 3-гидроксифенил, 3-метоксифенил, 2-метилфенил,3-метилфенил, 4-метилфенил. В одном варианте осуществления А 2 обозначает 3-бромфенил или 3-трифторметилфенил. В одном варианте осуществления L2 обозначает метилен и А 2 выбран из группы, включающей фенил, 3-фторфенил и 3-гидроксифенил. В некоторых вариантах осуществления R7 обозначает бензил. В одном варианте осуществления R1 обозначает трет-бутил, L2 обозначает метилен, А 2 обозначает фенил и R6 обозначает фенил или замещенный фенил. В другом варианте осуществления R1 обозначает трет-бутил, L2 обозначает метилен, А 2 обозначает фенил, R6 обозначает фенил, замещенный 1-2 галогенидными заместителями, такими как хлор или фтор. В одном варианте осуществления R1 обозначает трет-бутил, R2 обозначает водород, L2 обозначает метилен, А 2 обозначает фенил, R4 обозначает замещенный алкил. В некоторых таких вариантах осуществления R4 обозначает -(CH2)3NH2, -CH2CH(F)CH2NH2,-(CH2)2CH(CH2F)NH2,-(CH2)2CH(CH2OCH3)NH2,-(CH2)2CH(CH3)NH2,-(CH2)2C(CH3)2NH2 или-(CH2)2CH(CH2OH)NH2. Типичные соединения, предлагаемые в настоящем изобретении. Конкретные соединения, входящие в объем настоящего изобретения, приведены в качестве примеров в таблице и в экспериментальном разделе. Способы и композиции, предлагаемые в настоящем изобретении. Настоящее изобретение также относится к композиции, включающей соединение формулы (I)(включая их смеси и/или соли) и фармацевтически приемлемый инертный наполнитель или носитель. Соединение формулы (I) может быть использовано для лечения млекопитающего, страдающего от нарушения опосредуемого, по меньшей мере частично, КБВ, включающим введение пациенту терапевтически эффективного количества соединения формулы (I) (включая их смеси) по отдельности или в комбинации с другими противораковыми средствами. В. Определения и общий обзор. Как отмечено выше, настоящее изобретение частично относится к новым замещенным триазолам. Следует понимать, что терминология, использующаяся в настоящем изобретении, предназначена только для описания конкретных вариантов осуществления и не предназначена для ограничения объема настоящего изобретения. Следует отметить, что при использовании в настоящем изобретении и формуле изобретения термины в единственном числе включают и термины во множественном числе, если из контекста явно не следует иное. В настоящем описании и приведенной ниже формуле изобретения используется целый ряд терминов, которые обладают указанными ниже значениями. При использовании в настоящем изобретении "алкил" означает одновалентные насыщенные алифатические углеводородные группы, содержащие от 1 до 6 атомов углерода и более предпочтительно от 1 до 3 атомов углерода. Примерами этого термина являются такие группы, как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил и т.п."Алкилен" означает двухвалентные насыщенные алифатические гидрокарбильные группы, предпочтительно содержащие от 1 до 5 и более предпочтительно от 1 до 3 атомов углерода, которые обладают разветвленной или линейной цепью. Примерами этого термина являются такие группы, как метилен (-CH2-), этилен (-CH2CH2-), н-пропилен (-CH2CH2CH2-), изопропилен (-CH2CH(CH3)-) или"Ацил" означает группы H-C(O)-, алкил-C(O)-, замещенный алкил-C(O)-, алкенил-C(O)-, замещенный алкенил-C(O)-, алкинил-C(O)-, замещенный алкинил-C(O)- циклоалкил-C(O)-, замещенный циклоалкил-C(O)-, арил-C(O)- замещенный арил-C(O)-, гетероарил-C(O)-, замещенный гетероарил-C(O)-, гетероциклил-C(O)-, и замещенный гетероциклил-C(O)-, где алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил, замещенный циклоалкил, арил, замещенный арил,гетероарил, замещенный гетероарил, гетероциклил и замещенный гетероциклил являются такими, как определено в настоящем изобретении."Ацилоксигруппа" означает группы алкил-C(O)O-, замещенный алкил-C(O)O-, алкенил-C(O)O-, замещенный алкенил-C(O)O-, алкинил-C(O)O-, замещенный алкинил-C(O)O-, арил-C(O)O-, замещенный арил-C(O)O-, циклоалкил-C(O)O-, замещенный циклоалкил-C(O)O-, гетероарил-C(O)O-, замещенный гетероарил-C(O)O-, гетероциклил-C(O)O- и замещенный гетероциклил-C(O)O-, где алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил, замещенный цикло-6 017748 алкил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероциклил и замещенный гетероциклил являются такими, как определено в настоящем изобретении.-NRC(O)алкил,-NRC(O)замещенный алкил,-NRC(O)циклоалкил, -NRC(O)замещенный циклоалкил, -NRC(O)алкенил, -NRC(O)замещенный алкенил,-NRC(O)алкинил, -NRC(O)замещенный алкинил, -NRC(O)арил, -NRC(O)замещенный арил,-NRC(O)гетероарил, -NRC(O)замещенный гетероарил, -NRC(O)гетероциклил и -NRC(O)замещенный гетероциклил, где R обозначает водород или алкил и где алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил, замещенный циклоалкил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероциклил и замещенный гетероциклил являются такими,как определено в настоящем изобретении."Арил" или "Ar" означает фенил или нафтил."Галоген" означает фтор, хлор, бром или йод и предпочтительно означает фтор или хлор."Гетероарил" означает ароматическую группу, содержащую в кольце от 1 до 10 атомов углерода и от 1 до 4 гетероатомов, выбранных из группы, включающей кислород, азот и серу. Такие гетероарильные группы могут содержать одно кольцо (например, пиридинил или фурил) или несколько конденсированных колец (например, индолизинил или бензотиенил), где конденсированные кольца могут быть или не быть ароматическими и/или содержать гетероатом при условии, что присоединение происходит по атому ароматической гетероарильной группы. В одном варианте осуществления кольцевой атом(ы) азота и/или серы гетероарильной группы необязательно окислены с образованием N-оксидного (NO), сульфинильного или сульфонильного фрагментов. Предпочтительные гетероарилы включают пиридинил, пирролил,индолил, тиофенил и фуранил."Замещенный гетероарил" означает гетероарильные группы, содержащие от 1 до 3 заместителей,выбранных из группы заместителей, указанной для замещенного арила."Гетероцикл", или "гетероциклический", или "гетероциклоалкил", или "гетероциклил" означает насыщенную или ненасыщенную (но не ароматическую) группу, содержащую одно кольцо или несколько конденсированных колец, включая конденсированные, мостиковые и спироциклические системы, содержащую в кольце от 1 до 10 атомов углерода и от 1 до 4 гетероатомов, выбранных из группы, включающей кислород, азот и серу, где в конденсированных кольцевых системах одно или большее количество колец могут представлять собой циклоалкил, арил или гетероарил при условии, что присоединение происходит по гетероциклическому кольцу. В одном варианте осуществления атом(ы) азота и/или серы гетероциклической группы необязательно окислены с образованием N-оксидного, сульфинильного или сульфонильного фрагментов."Замещенный гетероцикл", или "замещенный гетероциклоалкил", или "замещенный гетероциклил" означает гетероциклильные группы, содержащие от 1 до 3 таких же заместителей, которые указаны для замещенного циклоалкила. Примеры гетероциклилов и гетероарилов включают, но не ограничиваются только ими, азетидин,пиррол, имидазол, пиразол, пиридин, пиразин, пиримидин, пиридазин, индолизин, изоиндол, индол, дигидроиндол, индазол, пурин, хинолизин, изохинолин, хинолин, фталазин, нафтилпиридин, хиноксалин,хиназолин, циннолин, птеридин, карбазол, карболин, фенантридин, акридин, фенантролин, изотиазол,феназин, изоксазол, феноксазин, фенотиазин, имидазолидин, имидазолин, пиперидин, пиперазин, индолин, фталимид, 1,2,3,4-тетрагидроизохинолин, 4,5,6,7-тетрагидробензо[b]тиофен, тиазол, тиазолидин,тиофен, бензо[b]тиофен, морфолинил, тиоморфолинил (также называющийся тиаморфолинилом), 1,1 диоксотиоморфолинил, пиперидинил, пирролидин, тетрагидрофуранил и т.п."Азотсодержащий гетероциклил" и "азотсодержащий замещенный гетероциклил" означает гетероциклические группы и замещенные гетероциклические группы, содержащие по меньшей мере один кольцевой атом азота и необязательно содержащие другие кольцевые гетероатомы, не являющиеся атомами азота, такие как серу, кислород и т.п."Биологическая активность" при использовании в настоящем изобретении означает уменьшение концентрации по данным исследования с помощью по меньшей мере одной из методик, описанных в любом из примеров 12-14 и в соответствии с определением по меньшей мере в одном из этих примеров. При использовании в настоящем изобретении термин "фармацевтически приемлемые соли" означает нетоксичные соли с кислотой или щелочно-земельным металлом соединений формулы (I). Эти соли можно получить in situ во время окончательного выделения и очистки соединений формулы (I) или посредством отдельной реакции основной или кислотной группы с подходящей органической или неорганической кислотой или основанием соответственно. Типичные соли включают, но не ограничиваются только ими, следующие: ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисуль-7 017748 фат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид,гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат,2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат и ундеканоат. Кроме того, основные азотсодержащие группы можно кватернизировать такими реагентами, как алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, -бромиды и -йодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты, галогениды с длинными цепями, такие как децил-, лаурил-, миристил- и стеарилхлориды, -бромиды и -йодиды, арилалкилгалогениды, такие как бензил- и фенетилбромиды и др. Таким образом получают растворимые или диспергирующиеся в воде или масле продукты. Примеры кислот, которые можно использовать для получения фармацевтически приемлемых солей присоединения с кислотами, включают такие неорганические кислоты, как хлористо-водородная кислота, серная кислота и фосфорная кислота, и такие органические кислоты, как щавелевая кислота, малеиновая кислота, метансульфоновая кислота, янтарная кислота и лимонная кислота. Соли присоединения с основаниями можно получить in situ при окончательном выделении и очистке соединений формулы (I) или путем раздельных реакций кислотных групп карбоновых кислот с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, или с аммиаком или с первичным, вторичным или третичным органическим амином. Фармацевтически приемлемые соли включают, но не ограничиваются только ими, соли, содержащие катионы щелочных и щелочноземельных металлов, такие как соли натрия, лития, калия, кальция, магния, алюминия и т.п., а также нетоксичные соли аммония, четвертичного аммония и аминов, включая, но не ограничиваясь только ими,соли аммония, тетраметиламмония, тетраэтиламмония, метиламина, диметиламина, триметиламина, триэтиламина, этиламина и т.п. Другие типичные органические амины, применяющиеся для получения солей присоединения с основаниями, включают диэтиламин, этилендиамин, этаноламин, диэтаноламин,пиперазин и т.п. Соединения формулы (I) могут существовать в виде "фармацевтически приемлемого сложного эфира", что означает сложные эфиры, которые гидролизуются in vivo, и включают такие, которые легко разрушаются в организме человека с высвобождением исходного соединения или его соли. Подходящие сложноэфирные группы включают, например, образованные из фармацевтически приемлемых алифатических карбоновых кислот, предпочтительно - алканкарбоновых, алкенкарбоновых, циклоалканкарбоновых и алкандикарбоновых кислот, в которых каждый алкильный или алкенильный фрагмент предпочтительно содержит не более 6 атомов углерода. Типичные примеры предпочтительных сложных эфиров включают, но не ограничиваются только ими, формиаты, ацетаты, пропионаты, бутираты, акрилаты и этилсукцинаты. Соединения формулы (I) могут существовать в виде "фармацевтически приемлемого пролекарства",что означает соединения, применимые с медицинской точки зрения для взаимодействия с тканями человека и низших животных без проявления нежелательной токсичности, раздражения, аллергической реакции и т.п., характеризуются разумным соотношением польза/риск и эффективные для применения по назначению, а также, когда это возможно, цвиттерионные формы соединений, предлагаемых в настоящем изобретении. Термин "пролекарство" означает соединения, которые быстро подвергаются превращению in vivo и образуют исходные соединения указанной выше формулы, например, путем гидролиза в крови. Подробное обсуждение приведено в публикациях Higuchi, T., and V. Stella, "Pro-drugs as NovelRoche (ed.), American Pharmaceutical Association, Pergamon Press, 1987, которые включены в настоящее изобретение в качестве ссылки. При использовании в настоящем изобретении "противораковые средства" или "средство для лечения рака" означают средства, которые включают, например, только средства, которые вызывают апоптоз; полинуклеотиды (например, рибозимы); полипептиды (например, ферменты); лекарственные средства; биологические миметики; алкалоиды; алкилирующие средства; противоопухолевые антибиотики; антиметаболиты; гормоны; соединения платины; моноклональные антитела, конъюгированные с противораковыми лекарственными средствами, токсинами и/или радионуклидами; модификаторы биологического ответа (например, интерфероны и интерлейкины и т.п.); средства для адоптивной иммунотерапии; гематопоэтические факторы роста; средства, которые вызывают дифференциацию опухолевых клеток (например, полностью транс-ретиноевая кислота и т.п.); реагенты для генной терапии; реагенты для антисмысловой терапии и нуклеотиды; противоопухолевые вакцины; ингибиторы ангиогенеза и т.п. Многочисленные другие средства, известные специалистам в данной области техники. Следует понимать, что для всех замещенных групп, определенных выше, в объем настоящего изобретения не входят полимеры, получающиеся путем определения заместителей, в которые входят собственные заместители. В таких случаях максимальное количество таких заместителей равно трем. Например, последовательное замещение замещенных арильных групп двумя другими замещенными арильными группами ограничено системой -замещенный арил-(замещенный арил)-замещенный арил.-8 017748 Аналогичным образом, следует понимать, что приведенные выше определения не включают неразрешенные схемы замещения (например, метил, замещенный 5 фторидными группами, или гидроксигруппу, находящуюся в альфа-положении по отношению к двойной или тройной связи). Такие неразрешенные схемы замещения хорошо известны специалистам в данной области техники. Соединения, предлагаемые в настоящем изобретении, могут обладать стереоизомерией вследствие наличия в соединениях одного или большего количества асимметрических или хиральных центров. Изображения соединений формулы (I), (Ia), (Id), (Ie), (II) или (IIb) включает их стереоизомеры, если их стереохимии конкретного стереохимического центра не следует иное. Некоторые из соединений, предлагаемых в настоящем изобретении, содержат асимметрично замещенные атомы углерода. Такие асимметрично замещенные атомы углерода могут привести к соединениям, предлагаемым в настоящем изобретении, включающим смеси стереоизомеров по конкретному асимметрично замещенному атому углерода или к одному стереоизомеру. Поэтому рацемические смеси, смеси диастереоизомеров, отдельные энантиомеры, а также отдельные диастереоизомеры соединений, предлагаемых в настоящем изобретении,включены в объем настоящего изобретения. Термины "S"- и "R"-конфигурация, при использовании в настоящем изобретении являются такими, как определено в публикации IUPAC 1974 "Recommendationsfor Section E, Fundamental Stereochemistry", Pure Appl. Chem. 45:13-30, 1976. Искомые энантиомеры можно получить хиральным синтезом из имеющихся в продаже хиральных исходных веществ по методикам,хорошо известным в данной области техники, или их можно получить из смеси энантиомеров путем выделения искомого энантиомера по известным методикам. Соединения, предлагаемые в настоящем изобретении, также могут обладать геометрической изомерией. Геометрические изомеры включают цис- и трансформы соединений, предлагаемых в настоящем изобретении, содержащие алкенильные или алкениленильные фрагменты.C. Получение соединений. Соединения, предлагаемые в настоящем изобретении, можно получить из легкодоступных исходных веществ по описанным ниже общим методикам и процедурам. Если не указано иное, то исходные вещества имеются в продаже и хорошо известны в данной области техники. Следует понимать, что если указаны типичные или предпочтительные условия выполнения методики (т.е. температура, длительность проведения реакции, молярные отношения реагентов, растворители, давления), то также можно использовать другие условия, если не указано иное. Оптимальные условия проведения реакций могут меняться в зависимости от конкретных использующихся реагентов и растворителей, и такие условия может определить специалист в данной области техники с помощью стандартных методик оптимизации. Кроме того, как должно быть очевидно специалистам в данной области техники, для того чтобы некоторые функциональные группы не вступали в нежелательные реакции, может потребоваться использование обычных защитных групп. Защитные группы, подходящие для различных функциональных групп,хорошо известны в данной области техники. Например, многочисленные защитные группы описаны в публикации T.W. Greene and G.M. Wuts, Protecting Groups in Organic Synthesis, Third Edition, Wiley, NewYork, 1999 и в цитированной в ней литературе. Кроме того, соединения, соответствующие предпочтительным вариантам осуществления, могут содержать один или большее количество хиральных центров. Поэтому при необходимости такие соединения можно получить или выделить в виде чистых стереоизомеров, т.е. в виде отдельных энантиомеров,или диастереоизомеров, или в виде смесей, обогащенных стереоизомером. Все такие стереоизомеры (и обогащенные смеси) включены в объем настоящего изобретения, если не указано иное. Чистые стереоизомеры (или обогащенные смеси) можно получить с использованием, например, оптически активных исходных веществ или стереоселективных реагентов, хорошо известных в данной области техники. Альтернативно, рацемические смеси таких соединений можно разделить с помощью, например, хиральной колоночной хроматографии, хиральных разделительных реагентов и т.п. Один вариант осуществления относится к способу получения соединения формулы (I):a) взаимодействие соединения формулы (III) с соединением формулы (IV) при условиях ацилирования с образованием соединения формулы (V), в которой R1, R2 и R6 определены выше и PG обозначает защитную группу атома азота:b) нагревание соединения формулы (V) с образованием соединения формулы (VI):c) взаимодействие соединения формулы (VI) с R7-X7 с образованием соединения формулы (VIIa) или (VIIb), в которой R7 определен выше и X7 обозначает отщепляющуюся группу:d) обработку соединения формулы (VIIa) или (VIIb) в условиях удаления защитной группы для удаления защитной группы PG с образованием (VIIIa) или (VIIIb): е) взаимодействие соединения формулы (VIIIa) или (VIIIb) с R4-X4 при условиях сочетания или сR CHO при условиях восстановительного аминирования, в которой R4 определен выше и R4aCH2- обозначает R4 и X4 обозначает отщепляющуюся группу, с образованием соединения формулы (IXa) илиf) взаимодействие соединения формулы (IXa) или (IXb) с R3-X3 при условиях сочетания, в которойR определен выше и X3 обозначает отщепляющуюся группу, с образованием соединения формулы (I), в которой X обозначает N: 3g) необязательно превращение соединения формулы (IXa) или (IXb) в соединение формулы (Xa) или (Xb), в которой W обозначает -C(Y)-X3, где X3 обозначает отщепляющуюся группу и Y обозначает=O или =S, и взаимодействие соединения, где W обозначает -C(Y)-X3, с HNR8R9 с образованием соединения формулы (I), в которой R3 обозначает -C(Y)NR8R9:h) необязательно превращение соединения формулы (I), в которой X обозначает N, в его сложный эфир, пролекарство или фармацевтически приемлемую соль. В одном варианте осуществления соединение формулы (III) получают по реакции нитрила (XI), где Подходящие сульфиды включают (NH4)2S и подходящие амины включают триэтиламин и/или пиридин. Тиоамид (XII) затем вводят в реакцию с одним или двумя эквивалентами гидразина в полярном растворителе, таком как этанол, и получают (III). Пример такой методики, в которой R6 обозначает 2,5-дифторбензонитрил, приведен на стадии A примера 1.- 10017748 Другой вариант осуществления относится к способу получения соединения формулы (V) по реакции (III) с (IV) при условиях ацилирования: Такие условия включают превращение (IV) в смешанный ангидрид, например, по реакции (IV) с алкилхлорформиатом, таким как этилхлорформиат, и обработку полученного ангидрида гидразидом (III) с образованием (V). В некоторых вариантах осуществления защитной группой аминогруппы является трет-бутоксикарбонилоксигруппа (Boc). Пример такой методики получения (V), где R6 обозначает 2,5-дифторбензонитрил, PG обозначает Boc, R1 обозначает трет-бутил и R2 обозначает водород, приведен на стадии В примера 1. Один вариант осуществления относится к способу получения соединения формулы (VI) путем нагревания (V) в растворителе, обладающем температурой кипения, превышающей 100C, таком как ксилол: Обычно (V) нагревают в ксилолах примерно до 150C и для удаления более низкокипящей воды,являющейся побочным продуктом, используют ловушку Дина-Штарка. Один вариант осуществления относится к способу получения соединения формулы (VIIa) или(VIIb). Соединение формулы (VI) вводят во взаимодействие с R7-X7, в которой R7 определен выше и X7 обозначает отщепляющуюся группу. В некоторых вариантах осуществления R7 обозначает бензил. В других вариантах осуществления X7 обозначает галоген. В других вариантах осуществления R7-X7 обозначает бензилбромид. Реакцию можно провести при условиях алкилирования. Такие условия включают использование полярного растворителя, такого как диметилформамид, и основания, такого как Cs2CO3. Реакция может привести к смеси (VIIa) и (VIIb) и каждое соединение можно по отдельности извлечь с помощью хроматографии на этой стадии или на последующей стадии, на которой эти соединения используются в качестве исходных веществ. Пример получения (VIIa) и (VIIb), где R7 обозначает бензил,приведен на стадии E примера 1: Один вариант осуществления относится к промежуточному соединению формулы (VIIIa) или(VIIIb), в которой R1, R2, R6 и R7 являются такими, как определено для формулы (I): Другой вариант осуществления относится к способу получения промежуточного соединения формулы (VIIIa) или (VIIIb) путем обработки соединения формулы (VIIa) или (VIIb) в условиях удаления защитной группы. В одном варианте осуществления, в котором PG обозначает Boc, защитную группу удаляют путем обработки кислотой, такой как трифторуксусная кислота. Пример удаления защитной группы приведен на стадии F примера 1. Другой вариант осуществления относится к способу получения промежуточного соединения формулы (IXa) или (IXb): Соединение формулы (VIIIa) или (VIIIb) вводят во взаимодействие с R4-X4, где X4 обозначает отщепляющуюся группу, такую как атом галогена, или с R4aCHO при условиях восстановительного аминирования, где R4 и R4a определены выше, с образованием соединения формулы (IXa) или (IXb). Подходящие условия восстановительного аминирования включают обработку раствора, содержащего (VIIIa) и(VIIIb), слабой кислотой для образования имина с последующим прибавлением восстановительного реагента. В некоторых вариантах осуществления кислотой является органическая кислота, такая как камфорсульфоновая кислота, или неорганическая кислота, такая как уксусная кислота, и восстановительным реагентом является борогидрид, такой как триацетоксиборогидрид. Другой вариант осуществления относится к способу получения соединения формулы (I), в которой путем взаимодействия соединения формулы (IXa) или (IXb) при подходящих условиях сочетания сR3-X3, где R3 определен выше и X3 обозначает отщепляющуюся группу, такую как атом галогена. В некоторых вариантах осуществления R3-X3 обозначает ацилгалогенид и реакцию проводят в присутствии органического основания, такого как триэтиламин. Соединения формулы (I), в которой X обозначает N, необязательно можно получить путем превращения соединения формулы (IXa) или (IXb) в соединение формулы (Xa) или (Xb), в которой W обозначает -C(Y)-X3, где X3 обозначает отщепляющуюся группу и Y обозначает =O или =S. В одном примере(IXa) или (IXb) вводят во взаимодействие с трифосгеном с образованием (Xa) или (Xb), где W обозначает-C(O)-Cl. Затем полученный промежуточный продукт вводят в реакцию с HNR8R9 с образованием мочевины формулы (I), в которой R3 обозначает -C(O)NR8R9: Дополнительные модификации (Xa) и (Xb) с образованием соединений формулы (I), в которой W иR4 объединены с образованием гетероциклоалкильного или замещенного гетероциклоалкильного кольца,должны быть очевидны специалисту в данной области техники. Пример такой модификации приведен в примере 5. Другой вариант осуществления относится к способу получения свободного основания соединения формулы (I), (Ia), (Id), (Ie), (II) или (IIb), включающему реакцию соли присоединения соединения с кислотой с основанием с образованием соответствующего свободного основания. Другой вариант осуществления относится к способу получения соли соединения формулы (I), (Ia),(Id), (Ie), (II) или (IIb), включающему:a) реакцию свободного основания соединения формулы (I), (Ia), (Id), (Ie), (II) или (IIb) с кислотой с получением соли присоединения соединения с кислотой илиb) превращение соли соединения формулы (I), (Ia), (Id), (Ie), (II) или (IIb) в другую соль соединения формулы (I), (Ia), (Id), (Ie), (II) или (IIb).D. Фармацевтические композиции. При использовании в качестве фармацевтических средств соединения, предлагаемые в настоящем изобретении, обычно вводят в форме фармацевтических композиций. Эти композиции можно вводить различными путями, включая пероральный, парентеральный, чрескожный, местный, ректальный и назальный. Эти соединения эффективны, например, при введении путем инъекции и пероральном введении композиции. Такие композиции получают по технологиям, хорошо известным в фармацевтике, и они включают по меньшей мере одно активное соединение. Настоящее изобретение также относится к фармацевтическим композициям, которые содержат в качестве активного ингредиента одно или большее количество соединений, предлагаемых выше в настоящем изобретении, вместе с фармацевтически приемлемыми носителями. Для приготовления композиций, предлагаемых в настоящем изобретении, активный ингредиент обычно смешивают с инертным наполнителем, разбавляют инертным наполнителем или заключают в такой носитель, который может представлять собой капсулу, пакетик, бумажный или другой контейнер. Использующийся инертный наполнитель обычно представляет собой инертный наполнитель, подходящий для введения людям или другим млекопитающим. Если инертный наполнитель выступает в качестве разбавителя, он может быть твердым, полужидким или жидким материалом, который выступает в качестве разбавителя, носителя или среды для активного ингредиента. Таким образом, композиции могут находиться в форме таблеток, пилюль, порошков, пастилок, саше, облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (таких как твердые или в жидкой среде), мазей, содержащих, например, до 10 мас.% активного соединения, капсул из мягкого или твердого желатина, суппозиториев, стерильных растворов для инъекций и стерильно упакованных порошков.- 12017748 Для приготовления препарата может потребоваться размолоть активное соединение с получением частиц необходимого размера до объединения с другими ингредиентами. Если активное соединение является в основном нерастворимым, то обычно его размалывают до частиц размером менее 200 меш. Если активное соединение в значительной степени растворимо в воде, то обычно размер частиц регулируют путем размола с обеспечением в основном равномерного распределения в препарате частиц, например,размером примерно 40 меш. Некоторые примеры подходящих инертных наполнителей включают лактозу, декстрозу, сахарозу,сорбит, маннит, крахмалы, камедь акации, фосфат кальция, альгинаты, трагакантовую камедь, желатин,силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, стерильную воду, сироп и метилцеллюлозу. Кроме того, препараты могут включать смазывающие агенты, такие как тальк, стеарат магния и минеральное масло; смачивающие агенты; эмульгирующие и суспендирующие агенты; консервирующие агенты, такие как метил- и пропилгидроксибензоаты; подсластители и вкусовые агенты. Композиции, предлагаемые в настоящем изобретении, можно приготовить так, чтобы после введения пациенту обеспечить быстрое, замедленное или задержанное высвобождение активного ингредиента путем использования методик, известных в данной области техники. Количество активного компонента, т.е. соединения, предлагаемого в настоящем изобретении, содержащееся в фармацевтической композиции и ее разовой дозированной форме, можно менять или регулировать в зависимости от конкретного случая применения, активности конкретного соединения и необходимой концентрации. Композиции предпочтительно готовят в виде разовой дозированной формы, каждая доза содержит от примерно 1 до примерно 500 мг, обычно от примерно 5 до примерно 100 мг, иногда от примерно 10 до примерно 30 мг активного ингредиента. Термин "разовые дозированные формы" означает отдельные порции, в качестве разовых доз пригодные для введения людям и другим млекопитающим, причем каждая порция содержит заранее заданное количество активного вещества, по оценке оказывающее необходимое терапевтическое воздействие, совместно с подходящим фармацевтическим инертным наполнителем. Предпочтительно соединение, предлагаемое выше в настоящем изобретении, используют в количестве, составляющем не более примерно 20 мас.% в пересчете на фармацевтическую композицию, более предпочтительно не более примерно 15 мас.%, а остальное составляет фармацевтически инертный носитель (носители). Активное соединение эффективно в широком диапазоне доз и обычно его вводят в фармацевтически или терапевтически эффективном количестве. Однако следует понимать, что фактически вводимое количество соединения устанавливает врач с учетом сопутствующих обстоятельств, включая подвергающееся лечению патологическое состояние, тяжесть подвергающегося лечению патологического состояния, выбранный путь введения, конкретное вводимое соединение, возраст, массу тела и реакцию конкретного пациента, тяжесть симптомов, наблюдающихся у пациента, и т.п. При использовании для лечения рака или борьбы с ним у млекопитающих соединения или их фармацевтические композиции вводят подходящим путем, таким как пероральный, местный, чрескожный и/или парентеральный, в дозе, обеспечивающей создание и поддерживание концентрации, т.е. количества, или содержания активного компонента в крови млекопитающего, подвергающегося лечению, которое будет терапевтически эффективным. Обычно такое терапевтически эффективное количество активного компонента (т.е. эффективная доза) находится в диапазоне, составляющем от примерно 0,1 до примерно 100, более предпочтительно от примерно 1,0 до примерно 50 мг/кг массы тела/сутки. Для приготовления твердых композиций, таких как таблетки, основной активный ингредиент смешивают с фармацевтическим инертным наполнителем с образованием твердой предварительной композиции, содержащей однородную смесь, включающую соединение, предлагаемое в настоящем изобретении. Указание на эти предварительные композиции как на однородные подразумевает, что активный ингредиент равномерно диспергирован в композиции, так что композицию можно легко разделить на одинаково эффективные разовые дозированные формы, такие как таблетки, пилюли или капсулы. Эту твердую предварительную композицию затем разделяют на разовые дозированные формы описанного выше типа, содержащие, например, от 0,1 до примерно 500 мг активного ингредиента,предлагаемого в настоящем изобретении. Таблетки или пилюли, предлагаемые в настоящем изобретении, могут быть снабжены покрытием или иным образом обработаны, так чтобы получить дозированную форму, обеспечивающую преимущества пролонгированного действия. Например, таблетка или пилюля может содержать внутренний компонент дозы и наружный компонент дозы, последний может представлять собой оболочку, окружающую первую. Эти два компонента могут быть разделены энтеросолюбильным слоем, который препятствует распаду в желудке, и в результате внутренний компонент попадает неповрежденным в двенадцатиперстную кишку или задерживается его высвобождение. Для образования таких энтеросолюбильных слоев или покрытий можно использовать различные материалы, такие материалы включают ряд полимерных кислот и смеси полимерных кислот с такими материалами, как шеллак, цетиловый спирт и ацетат целлюлозы.- 13017748 Жидкие формы, в которые можно включить новые композиции, предлагаемые в настоящем изобретении, для перорального введения или введения путем инъекции, включают водные растворы, предпочтительно ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии с пищевыми маслами, такими как кукурузное масло, хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и аналогичные фармацевтические разбавители. Композиции для ингаляции или вдувания включают растворы и суспензии в фармацевтически приемлемых водных или органических растворителях или их смеси и порошки. Жидкие или твердые композиции могут содержать подходящие фармацевтически приемлемые инертные наполнители, описанные выше. Предпочтительно, если композиции вводят пероральным или назальным респираторным путем с обеспечением местного или системного воздействия. Композиции, предпочтительно в фармацевтически приемлемых растворителях, можно распылить с использованием инертных газов. Распыленные растворы можно вдыхать непосредственно из распыляющего устройства или распыляющее устройство можно присоединить к шлему лицевой маски или дыхательному аппарату периодического действия, создающему избыточное давление. Раствор, суспензию или порошкообразные композиции можно вводить, предпочтительно перорально или назально, с помощью устройств, которые соответствующим образом подают композицию. Описанные ниже примеры препаратов иллюстрируют типичные фармацевтические композиции,предлагаемые в настоящем изобретении. Пример препарата 1. Готовят капсулы из твердого желатина, содержащие следующие ингредиенты: Указанные выше ингредиенты смешивают и помещают в капсулы из твердого желатина порциями по 340 мг. Пример препарата 2. Таблетки готовят с использованием указанных ниже ингредиентов: Компоненты смешивают и прессуют с получением таблеток массой 240 мг каждая. Пример препарата 3. Готовят сухую порошкообразную композицию для ингаляции, содержащую следующие компоненты: Активный ингредиент смешивают с лактозой и смесь помещают в ингалятор для сухого порошка. Пример препарата 4. Таблетки, содержащие по 30 мг активного ингредиента, готовят следующим образом: Активный ингредиент, крахмал и целлюлозу пропускают через сито 20 меш США и тщательно пе- 14017748 ремешивают. Раствор поливинилпирролидона смешивают с полученным порошком и затем пропускают через сито 16 меш США. Полученные таким образом гранулы сушат при температуре от 50 до 60C и пропускают через сито 16 меш США. Натриевую соль карбоксиметилкрахмала, стеарат магния и тальк,предварительно пропущенные через сито 30 меш США, затем прибавляют к гранулам и после перемешивания прессуют в таблетирующей машине и получают таблетки массой 120 мг каждая. Пример препарата 5. Капсулы, содержащие по 40 мг лекарственного средства, готовят следующим образом: Активный ингредиент, крахмал и стеарат магния смешивают, пропускают через сито 20 меш США и помещают в капсулы из твердого желатина порциями по 150 мг. Пример препарата 6. Суппозитории, содержащие по 25 мг активного ингредиента, готовят следующим образом: Активный ингредиент пропускают через сито 60 меш США и суспендируют в предварительно расплавленных глицеридах насыщенной жирной кислоты при минимально необходимом нагревании. Затем смесь выливают в форму для суппозиториев номинальной вместимостью 2,0 г и дают охладиться. Пример препарата 7. Суспензии, содержащие по 50 мг лекарственного средства в дозе объемом 5,0 мл, готовят следующим образом: Активный ингредиент, сахарозу и ксантановую камедь смешивают, пропускают через сито 10 меш США и затем смешивают с предварительно приготовленным водным раствором микрокристаллической целлюлозы и натриевой соли карбоксиметилцеллюлозы. Бензоат натрия, ароматизатор и краситель разбавляют небольшим количеством воды и прибавляют при перемешивании. Затем прибавляют количество воды, достаточное для получения необходимого объема. Пример препарата 8. Активный ингредиент, крахмал и стеарат магния смешивают, пропускают через сито 20 меш США и помещают в капсулы из твердого желатина порциями по 425,0 мг. Пример препарата 9. Можно приготовить композицию для подкожного введения следующего состава:- 15017748 Пример препарата 10. Композицию для местного нанесения можно приготовить следующим образом: Мягкий белый парафин нагревают до плавления. Прибавляют жидкий парафин и эмульгирующийся воск и перемешивают до растворения. Прибавляют активный ингредиент и перемешивание продолжают до образования дисперсии. Затем смесь охлаждают до затвердевания. Пример препарата 11. Можно приготовить композицию для внутривенного введения следующего состава: Для других предпочтительных препаратов, применяющихся в способах, предлагаемых в настоящем изобретении, используются чрескожные устройства доставки ("пластыри"). Такие чрескожные пластыри можно использовать для проведения непрерывного или периодического введения соединений, предлагаемых в настоящем изобретении, в регулируемых количествах. Конструкция и применение чрескожных пластырей для доставки фармацевтических средств хорошо известны в данной области техники. См.,например, патент US 5023252, выданный 11 июня 1991 г., включенный в настоящее изобретение в качестве ссылки. Такие пластыри могут быть изготовлены для непрерывной, импульсной или проводимой при необходимости доставки фармацевтических средств. Часто желательно или необходимо введение фармацевтической композиции в головной мозг, прямо или косвенно. Методики прямого введения обычно включают введение катетера, доставляющего лекарственное средство, в сосудистую систему реципиента для преодоления гематоэнцефалического барьера. Одна такая имплантируемая система доставки, применяющаяся для введения биологических факторов в конкретные анатомические области организма, описана в патенте US 5011472, который включен в настоящее изобретение в качестве ссылки. Методики косвенного введения, которые обычно являются предпочтительными, обычно включают приготовление композиций с образованием латентной формы лекарственного вещества путем превращения гидрофильных лекарственных веществ в растворимые в липидах лекарственные средства. Образование латентной формы обычно проводят путем блокирования гидроксигрупп, карбонильных, сульфатных или первичных аминогрупп, содержащихся в лекарственном веществе, чтобы сделать лекарственное вещество лучше растворимым в липидах и способным к переходу через гематоэнцефалический барьер. Альтернативно, доставку гидрофильных лекарственных веществ можно улучшить путем внутриартериального вливания гипертонических растворов, что может временно открыть гематоэнцефалический барьер. Другие препараты, подходящие для применения в настоящем изобретении, описаны в публикацииE. Дозировка и введение. Как отмечено выше, соединения, описанные в настоящем изобретении, являются подходящими для использования в различных системах доставки лекарственных средств, описанных выше. Кроме того,для увеличения периода полувыведения введенного соединения из сыворотки in vivo соединения можно капсулировать, вводить в просвет липосом, приготовить в виде коллоида или использовать другие методики, которые обеспечивают увеличение периода полувыведения соединения из сыворотки. Существуют различные методики получения липосом, например, описанные в публикациях Szoka, et al., патентахUS 4235871, US 4501728 и US 4837028, которые включены в настоящее изобретение в качестве ссылки. Соединения, предлагаемые в настоящем изобретении, применимы для подавления или лечения нарушения, опосредуемого, по меньшей мере частично, активностью КБВ. В одном варианте осуществления нарушение, которое опосредуется, по меньшей мере частично, с помощью КБВ, является клеточным пролиферативным нарушением. Термин "клеточное пролиферативное нарушение" или "пролиферативное нарушение клетки" означает заболевания, включающие, например, рак, опухоль, гиперплазию, рестеноз, гипертрофию сердца, иммунное нарушение и воспаление. Настоящее изобретение относится к способам лечения человека или млекопитающего, нуждающегося в таком лечении, включающим введение субъекту терапевтически эффективного количества соединение формулы (I) или (II), по отдельности или в комбинации с другими противораковыми средствами. Соединения, предлагаемые в настоящем изобретении, применимы in vitro или in vivo для подавления роста раковых клеток. Термин "рак" означает раковые заболевания, включающие, например, рак лег- 16017748 ких и бронхов, предстательной железы, молочной железы, поджелудочной железы, ободочной и прямой кишки, щитовидной железы, желудка, печени и внутрипеченочных желчных протоков, почек и почечных лоханок, мочевого пузыря, тела матки, шейки матки, яичников, множественную миелому, рак пищевода,острый миелогенный лейкоз, хронический миелогенный лейкоз, лимфолейкоз, миелолейкоз, рак головного мозга, полости рта и глотки, гортани, тонкой кишки, неходжкинскую лимфому, меланому и ворсинчатую аденому ободочной кишки. К раку также относятся опухоли и новообразования, выбранные из группы, включающей карциномы, аденокарциномы, саркомы и гематологические злокачественные новообразования. Кроме того, тип рака можно выбрать из группы, включающей рост солидных опухолей/злокачественных новообразований, миксоидную и круглоклеточную карциному, локальные запущенные опухоли, карциному мягких тканей человека, метастазы рака, плоскоклеточную карциному,плоскоклеточную карциному пищевода, карциному полости рта, кожную T-клеточную лимфому, ходжкинскую лимфому, неходжкинскую лимфому, рак надпочечников, опухоли, продуцирующие АКТГ(адренокортикотропный гормон), немелкоклеточные раковые заболевания, рак молочной железы, желудочно-кишечные раковые заболевания, урологические раковые заболевания, злокачественные новообразования женских половых путей, злокачественные новообразования мужских половых путей, рак почки,рак головного мозга, раковые заболевания костей, раковые заболевания кожи, рак щитовидной железы,ретинобластому, нейробластому, брюшинный выпот, злокачественный плевральный выпот, мезотелиому, опухоли Вильмса, рак желчного пузыря, трофобластические новообразования, гемангиоперицитому и саркому Капоши. Соединение или композицию, предлагаемую в настоящем изобретении, можно вводить млекопитающему подходящим путем, таким как пероральный, внутривенный, парентеральный, чрескожный, местный, ректальный или назальный. Млекопитающие включают, например, людей и других приматов, домашних животных, таких как собаки и кошки, лабораторных животных, таких как крысы, мыши и кролики, и сельскохозяйственных животных, таких как лошади, свиньи, овцы и крупный рогатый скот. Опухоли или новообразования включают рост клеток тканей, при котором размножение клеток является неконтролируемым и прогрессирующим. Иногда такой рост является доброкачественным, но в других случаях его называют "злокачественным", и он может привести к гибели организма. Злокачественные новообразования, или "раковые заболевания" в дополнение к агрессивному размножению клеток отличаются от доброкачественного роста тем, что они могут проникать в соседние ткани и метастазировать. Кроме того, злокачественные новообразования характеризуются тем, что они обнаруживают более значительную потерю дифференциации (более значительную "дедифференциацию") и организации по отношению друг к другу и к окружающим тканям. Это явление называется "анаплазией". Соединения, обладающие необходимой биологической активностью, можно модифицировать так,чтобы придать необходимые характеристики, такие как улучшенные фармакологические характеристики(например, стабильность, биологическую доступность in vivo), или возможность обнаружения при использовании в диагностике. Стабильность можно оценить различными путями, такими как измерение периода полувыведения соединений при инкубации с пептидазами или плазмой или сывороткой человека. Для использования в диагностике к соединениям можно прикрепить самые различные метки, которые могут обеспечить прямой или непрямой регистрируемый сигнал. Таким образом, соединения и/или композиции, предлагаемые в настоящем изобретении, можно модифицировать различными путями для различных случаев применения при сохранении биологической активности. Кроме того, можно ввести различные реакционноспособные центры для связывания с частицами, твердыми подложками, макромолекулами и т.п. Меченые соединения можно использовать для разных целей in vivo или in vitro. Можно использовать самые разные метки, такие как радионуклиды (например, гамма-излучающие радиоизотопы, такие как технеций-99 или индий-111), флуоресцентные вещества (например, флуоресцеин), ферменты, субстраты ферментов, кофакторы ферментов, ингибиторы ферментов, хемолюминесцентные соединения,биолюминесцентные соединения и т.п. Специалисты с общей подготовкой в данной области техники должны знать другие метки, подходящие для связывания с комплексами, или быть способными найти их по стандартным методикам. Присоединение этих меток проводят по стандартным методикам, известным специалистам с общей подготовкой в данной области техники. Фармацевтические композиции, предлагаемые в настоящем изобретении, являются подходящими для использования в различных системах доставки лекарственных средств. Препараты, подходящие для применения в настоящем изобретении, описаны в публикации Remington's Pharmaceutical Sciences, MacePublishing Company, Philadelphia, Pa., 17th ed. (1985). Количество, вводимое пациенту, зависит от вводимого средства, назначения введения, такого как профилактика или лечение, состояния пациента, пути введения и т.п. При использовании для лечения композиции вводят пациенту, уже страдающему от заболевания, в количестве, достаточном для излечивания или, по меньшей мере, остановки прогрессирования или симптомов заболевания и его осложне- 17017748 ний. Достаточное для этого количество определяется как "терапевтически эффективная доза". Количество, эффективное для такого применения, зависит от подвергающегося лечению патологического состояния, а также от решения лечащего врача, зависящего от таких факторов, как тяжесть заболевания, нарушения или патологического состояния, возраст, масса тела и общее состояние пациента и т.п. Соединения, вводимые пациенту, обычно находятся в форме фармацевтических композиций, описанных выше. Эти композиции могут быть стерилизованы по обычным методикам стерилизации или могут быть стерилизованы фильтрованием. Полученные водные растворы можно упаковать для применения в том виде, в котором они получены, или лиофилизировать, лиофилизированный препарат перед введением объединяют со стерильным водным носителем. Значения pH препаратов соединения обычно составляют примерно от 3 до 11, более предпочтительно примерно от 5 до 9 и наиболее предпочтительно примерно от 7 до 8. Следует понимать, что использование некоторых из указанных выше инертных наполнителей, носителей или стабилизаторов приведет к образованию фармацевтических солей. Терапевтическая доза соединений и/или композиций, предлагаемых в настоящем изобретении, меняется, например, в зависимости от конкретного случая, для которого предназначено лечение, пути введения, состояния здоровья пациента и решения лечащего врача. Например, при пероральном введении доза обычно находится в диапазоне, составляющем от примерно 5 мкг до примерно 50 мг/кг массы тела/сутки, предпочтительно от примерно 1 до примерно 10 мг/кг массы тела/сутки. Альтернативно, при внутривенном введении доза обычно находится в диапазоне, составляющем от примерно 5 до примерно 50 мкг/кг массы тела, предпочтительно от примерно 500 до примерно 5000 мкг/кг массы тела. Альтернативные пути введения включают, но не ограничиваются только ими, назальный, чрескожный, ингаляционный, подкожный и внутримышечный. Эффективные дозы можно экстраполировать по зависимостям доза-ответ, полученным с помощью исследований in vitro или экспериментальных моделей на животных. Обычно соединения и/или композиции, предлагаемые в настоящем изобретении, вводят в терапевтически эффективном количестве по любому из принятых путей введения средств, которые предназначены для аналогичных целей. Токсичность и терапевтическую эффективность таких соединений можно определить по стандартным фармацевтических методикам с использованием культур клеток или экспериментальных моделей на животных, например, для определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции). Отношение доз, приводящих к токсическому и терапевтическому эффекту, представляет собой терапевтический индекс, и его можно представить как отношение LD50/ED50. Соединения, которые обладают более значительными терапевтическими индексами, являются предпочтительными. Данные, полученные с помощью исследований с использованием культур клеток или экспериментальных моделей на животных, можно использовать для установления диапазона доз, использующихся для людей. Дозы таких соединений предпочтительно находятся в диапазоне концентраций в кровотоке,который включает ED50 с проявлением небольшой токсичности или без ее проявления. Доза может меняться в этом диапазоне в зависимости от использующейся дозированной формы и пути введения. Для любого соединения и/или композиции, применяющейся в способе, предлагаемом в настоящем изобретении, терапевтически эффективную дозу можно первоначально оценить с помощью исследований с использованием культур клеток. Дозу можно оценить с использованием экспериментальных моделей на животных, как обеспечивающую в плазме циркулирующей крови значение в диапазоне, который включает значение IC50 (концентрация исследуемого соединения, которая обеспечивает равное половине максимального ингибирование активности), определенное с помощью исследований с использованием культур клеток. Такую информацию можно использовать для более точного определения доз, применимых для людей. Содержание в плазме можно определить, например, с помощью высокоэффективной жидкостной хроматографии. Описанные ниже примеры синтеза и биологические примеры предназначены для иллюстрации настоящего изобретения, и их не следует понимать в качестве каким-либо образом ограничивающих настоящее изобретение. Примеры В приведенных ниже примерах соединения, предлагаемые в настоящем изобретении, синтезировали по методикам, описанным в настоящем изобретении, или по другим методикам, которые хорошо известны в данной области техники. Следует понимать, что соединения, которые не получены или не проанализированы, можно получить или проанализировать по методикам, описанным в настоящем изобретении, или по другим методикам, которые хорошо известны в данной области техники. Соединения и/или промежуточные продукты исследовали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием хроматографической системы Waters Millenium с модулем разделения 2690 (Milford, MA). Использовали аналитические колонки Alltima C-18 с обращенной фазой, 4,6250 мм, выпускающиеся фирмой Alltech (Deerfield, IL). Проводили элюирование в градиентном режиме, обычно начиная со смеси 5% ацетонитрила/95% воды и переходя к 100% ацетонитрилу в течение 40 мин. Все растворители содержали 0,1% трифторуксусной кислоты (ТФК). Соединения детектировали по поглощению в ультрафиолетовой (УФ) области спектра при 220 или 254 нм. Для ВЭЖХ использовали растворители, выпускающиеся фирмой Burdick and Jackson (Muskegan, MI) или FisherScientific (Pittsburgh, PA). В некоторых случаях чистоту определяли с помощью тонкослойной хроматографии (ТСХ) с использованием стеклянных или пластмассовых пластинок с силикагелем, таких как,например, гибкие пластины Baker-Flex Silica Gel 1B2-F. Данные ТСХ обычно легко изучали визуально с использованием ультрафиолетового излучения или хорошо известной методики на основе паров йода и различных других методик окрашивания. Масс-спектрометрический анализ проводили на двух приборах ЖХ/МС: система Waters (AllianceHT HPLC и масс-спектрометр Micromass ZQ; колонка: Eclipse XDB-C18, 2,150 мм; система растворителей: 5-95% (или 35-95%, или 65-95%, или 95-95%) ацетонитрил в воде с прибавлением 0,05% ТФК; скорость потока 0,8 мл/мин; диапазон молекулярных масс 500-1500; напряжение на конусе 20 В; температура колонки 40C) или система Hewlett Packard (Series 1100 HPLC; колонка: Eclipse XDB-C18, 2,150 мм; система растворителей: 1-95% ацетонитрил в воде с прибавлением 0,05% ТФК; скорость потока 0,4 мл/мин; диапазон молекулярных масс 150-850; напряжение на конусе 50 В; температура колонки 30C). Все массы приведены для протонированных исходных ионов. Анализы с помощью ГХ/МС проводили на приборе Hewlett Packard (газовый хроматограф НР 6890Series с селективным по массе детектором 5973; инжектируемый объем: 1 мл; начальная температура колонки: 50C; конечная температура колонки: 250C; время линейного повышения: 20 мин; скорость потока газа: 1 мл/мин; колонка: 5% фенилметилсилоксан, Model No. HP 190915-443, размеры: 30,0250,25 м). Исследования с помощью ядерного магнитного резонанса (ЯМР) проводили для некоторых соединений на приборе Varian 300 МГц NMR (Palo Alto, CA). В качестве стандарта использовали ТМС или известный химический сдвиг растворителя. Некоторые образцы соединений исследовали при повышенных температурах (например, 75C), чтобы повысить растворимость образца. Чистоту некоторых соединений, предлагаемых в настоящем изобретении, исследовали с помощью элементного анализа (Desert Analytics, Tucson, AZ). Температуры плавления определяли на приборе Laboratory Devices Mel-Temp apparatus (Holliston,MA). Препаративные разделения проводили с помощью хроматографической системы Flash 40 и KP-Sil,60A (Biotage, Charlottesville, VA), или с помощью колоночной флэш-хроматографии с использованием силикагеля (230-400 меш) в качестве насадки, или с помощью ВЭЖХ с использованием C-18 колонки с обращенной фазой. Типичными растворителями, использованными для системы Flash 40 Biotage и колоночной флэш-хроматографии, являлись дихлорметан, метанол, EtOAc, гексан, ацетон, водный раствор гидроксиламина и триэтиламин. Типичными растворителями, использованными для ВЭЖХ с обращенной фазой, являлись ацетонитрил в разных концентрациях и вода с прибавлением 0,1% трифторуксусной кислоты. Если не указано иное, все температуры приведены в градусах Цельсия. Кроме того, в этих примерах и в остальной части текста аббревиатуры обладают следующими значениями: При перемешивании раствор подходящего бензонитрила, например, 2,5-дифторбензонитрила (1-1),(15 ммоль) в пиридине (10 мл) обрабатывали сульфидом (20 мас.% водный раствор, 16,5 ммоль) и триэтиламин (16,5 ммоль). Реакционную смесь перемешивали при 50C в течение 5 ч до завершения реакции. После охлаждения до КТ смесь разбавляли холодной водой. Экстрагировали с помощью EtOAc и органические вещества отделяли, затем промывали с помощью H2O (3), насыщенным рассолом (3),затем сушили (Na2SO4), фильтровали и выпаривали при пониженном давлении и получали неочищенное вещество. Очищали на колонке с силикагелем (20% этилацетат/гексан) и получали тиоамид в виде желтого твердого вещества, 1-2 (выход 88,5%). 1H ЯМР (300 МГц, CDCl3):7,12 (m, 2H), 7,90 (br, 2H), 8,08(7,5 ммоль). После перемешивания при КТ в течение 30 мин по данным ЖХ/МС реакция завершалась и осаждалось белое твердое вещество. Осадок отфильтровывали и промывали гексаном и получали гидразид 1-3 (выход 94%).N-Boc-D-трет-бутилглицин 1-3 (2 ммоль) превращали в смешанный ангидрид путем прибавления этилхлорформиата (2,4 ммоль), Et3N (3 ммоль) в сухом ТГФ при температуре от -5 до 0C. Смесь перемешивали при -5C в течение 30 мин. Полученное твердое вещество отфильтровывали. Дополнительно прибавляли сухой ТГФ для промывки осадка. Полученный раствор при -5C прибавляли к раствору гидразида (1-3, 2 ммоль) в ТГФ. Затем реакционную смесь перемешивали и постепенно нагревали до КТ в течение ночи. После завершения реакции смесь подвергали распределению между EtOAc и H2O. Органический слой отделяли и промывали с помощью H2O (3), насыщенным рассолом (3), затем сушили(Na2SO4), фильтровали, выпаривали при пониженном давлении и получали неочищенный продукт, который очищали на колонке с силикагелем (гексан/этилацетат) и получали 1-5 (выход 67%). Стадия D. Получение фенилтриазола: Соединение 1-5 (2,86 ммоль) растворяли в ксилолах (5,7 мл). Устанавливали ловушку Дина-Штарка и реакционную смесь нагревали до 150C. После завершения реакции смеси давали охладиться до КТ,затем подвергали распределению между EtOAc и насыщенным водным раствором NaHCO3. Органические вещества отделяли, затем промывали насыщенным водным раствором NaHCO3 (2), H2O (3), насыщенным рассолом (3), затем сушили (Na2SO4), фильтровали, выпаривали при пониженном давлении и получали фенилтриазол 6, который являлся достаточно чистым для использования непосредственно на следующей стадии. Стадия Е. Бензилирование фенилтриазола: При перемешивании к раствору/суспензии триазола (2,0 ммоль) и Cs2CO3 (4,0 ммоль) в ДМФ (5 мл) прибавляли бензилирующий реагент, например бензилбромид (2,2 ммоль). После завершения реакции смесь подвергали распределению между EtOAc и H2O. Органический слой отделяли и промывали с помощью H2O (3), насыщенным рассолом (3), затем сушили (Na2SO4), фильтровали, выпаривали при пониженном давлении и получали смесь неочищенных бензилированных фенилтриазолов. Региоизомеры 1-7 а и 1-7b разделяли на колонке с силикагелем (гексан/этилацетат). Региохимический выход проверяли с помощью 1 Н ЯМР, эксперименты nOe. 1-7 а: кристаллы, МС (m/z): 457,3 [MH+], ВУ (время удерживания) = 4,00 мин; 1(d, 2H), 1,43 (s, 9H), 0,97 (s, 9H). Стадия F. Удаление защитной группы с получением свободного основания амина: Содержащий защитную группу Boc-амин (1,0 ммоль) обрабатывали с помощью 10% ТФК в CH2Cl2(5 мл). После завершения реакции реакционную смесь концентрировали в вакууме и затем подвергали распределению между EtOAc и насыщенным водным раствором NaHCO3. Органические вещества отделяли, затем промывали насыщенным водным раствором NaHCO3 (2), H2O (2), насыщенным рассолом(2), затем сушили (Na2SO4), фильтровали и выпаривали при пониженном давлении и получали фенил- 21017748 триазол в виде свободного основания амина, который являлся достаточно чистым для использования непосредственно на следующей стадии. Стадия G. Восстановительное аминирование для введения боковой цепи:(1,0 ммоль). Смесь перемешивали в течение 5 мин и затем прибавляли триацетоксиборогидрид натрия(1,10 ммоль). После завершения реакции смесь концентрировали в вакууме, подвергали распределению между EtOAc и 2 М водным раствором Na2CO3. Органические вещества отделяли, затем промывали 2 М водным раствором Na2CO3 (2), H2O (2), насыщенным рассолом (2), затем сушили (Na2SO4), фильтровали и выпаривали при пониженном давлении и получали продукт, который очищали на колонке с силикагелем или, что чаще, который являлся достаточно чистым для использования непосредственно на следующей стадии. Стадия Н. Ацилирование: При перемешивании к раствору амина 1-9 (1,0 ммоль) в CH2Cl2 (6 мл) прибавляли Et3N (2,0 ммоль) и затем соответствующий хлорангидрид кислоты, например никотинилхлорид (1,0 ммоль). После завершения реакции смесь подвергали распределению между CH2Cl2 и насыщенным водным растворомNaHCO3. Органические вещества отделяли и промывали с помощью H2O (2), насыщенным рассолом(2), затем сушили (Na2SO4), фильтровали, выпаривали при пониженном давлении и получали продукт. Стадия I. Заключительное удаление защитной группы с получением ингибитора Eg5: При перемешивании к раствору фталимида 1-10 (0,3 ммоль) в EtOH (1,5 мл) прибавляли безводный гидразин (1,5 ммоль). После завершения реакции реакционную смесь выпаривали при пониженном давлении и получали искомое соединение, которое очищали с помощью препаративной ВЭЖХ с обращенной фазой. Пример 2.- 22017748 Стадия А. Получение хлорангидрида карбаминовой кислоты:(0,184 ммоль). После завершения реакции реакционную смесь концентрировали в вакууме, подвергали распределению между EtOAc и насыщенным водным раствором NaHCO3. Органические вещества отделяли, затем промывали насыщенным водным раствором NaHCO3 (2), Н 2 О (1), рассолом (2), затем сушили (Na2SO4), фильтровали выпаривали при пониженном давлении и получали неочищенный хлорангидрид карбаминовой кислоты, который без обработки использовали на следующей стадии. Стадия В. Получение мочевины: При перемешивании к раствору хлорангидрида карбаминовой кислоты (0,032 ммоль) в ДХМ (1 мл) прибавляли Et3N (0,161 ммоль) и затем соответствующий амин, например морфолин (0,097 ммоль). После завершения реакции смесь концентрировали в вакууме, подвергали распределению между EtOAc и насыщенным водным раствором NaHCO3. Органические вещества отделяли, затем промывали насыщенным водным раствором NaHCO3 (2), H2O (1), рассолом (2), затем сушили (Na2SO4), фильтровали и выпаривали при пониженном давлении и получали неочищенный продукт. Стадия С. Удаление защитной группы: Удаление фталимид защитной группы по методике примера 1 давало N-S)-3-амино-4-фторбутил)N-R)-1-(1-бензил-3-(2,5-дифторфенил)-1H-1,2,4-триазол-5-ил)-2,2-диметилпропил)никотинамид. 1 Триол 3-1 (1 экв.) растворяли в ДМФ при концентрации, равной примерно 0,5 М, и прибавляли 2,2-диметоксипропан (1,16 экв.) и моногидрат п-толуолсульфоновой кислоты (0,03 экв.). Раствор перемешивали в течение одного или большего количества дней и реакцию останавливали с помощью ТЭА(0,5 экв.). Как можно большее количество растворителя удаляли в вакууме и остаток очищали перегонкой в вакууме. Пример 4. 2,2-Диметил-1,3-диоксан-5-карбальдегид: В атмосфере азота оксалилхлорид (1,4 экв.) растворяли в ДХМ, затем охлаждали до -78C. По каплям прибавляли ДМСО (2,2 экв.). Этот раствор перемешивали в течение примерно 10 мин, затем триол- 23017748 3-2 (1 экв.) растворяли в дополнительном количестве ДХМ до полной концентрации, равной 0,2 М. После проведения реакции в течение 5 мин прибавляли ТЭА (5 экв.). Эту смесь перемешивали в течение 10 мин при -78C, затем в течение еще 10 мин при комнатной температуре. За протеканием этой реакции лучше всего было следить с помощью ТСХ с использованием смеси состава 1:1 гексан:этилацетат в качестве проявляющего растворителя и визуализации результата путем окрашивания посредством МЦА. Реакционную смесь использовали без дополнительной обработки. Пример 5. Амин 5-1 (1 экв.), растворенный в ДХМ, прибавляли к альдегиду 4-2 до полной концентрации, равной 0,1-0,15 М. Через 5 мин реакционную смесь охлаждали до 0C и прибавляли Na(OAc)3BH (1,5 экв.) и ледяную уксусную кислоту (1 экв.). Завершение реакции определяли с помощью ЖХ/МС. Реакционную смесь разбавляли этилацетатом, затем трижды промывали насыщенным водным раствором бикарбоната натрия. В заключение продукт сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли в вакууме. Стадия В. Ацетилирование: Амин 5-2 растворяли в ДХМ с получением 0,2 М раствора и охлаждали до 0C. Медленно прибавляли ТЭА (5 экв.) и перемешивали в течение 5 мин. По каплям прибавляли хлорацетил хлорид (3 экв.). Для завершения реакции реакционную смесь разбавляли этилацетатом, затем трижды промывали насыщенным водным раствором бикарбоната натрия. В заключение продукт сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли в вакууме. Продукт очищали с помощью хроматографии в градиентном режиме примерно 0-70% этилацетат в гексане. Стадия С. Удаление защитной группы диола: Хлорид 5-3 растворяли в ацетонитриле и охлаждали до 0C. По каплям прибавляли 3 н. HCl и за протеканием реакции следили с помощью ЖХ/МС, затем дополнительно прибавляли HCl до завершения удаления защитной группы. Раствор концентрировали в вакууме, разбавляли этилацетатом и трижды промывали насыщенным водным раствором бикарбоната натрия. В заключение продукт сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли в вакууме. После удаления защитной группы спирт растворяли в ДМФ с получением 0,1 М раствора. Прибавляли 1 экв. Cs2CO3 и каталитическое количество ТБАЙ (тетрабутиламмониййодид). Реакционную смесь нагревали примерно при 40-55C в течение 4-6 ч. После завершения реакции реакционную смесь концентрировали в вакууме, разбавляли с помощью EtOAc и промывали насыщенным раствором бикарбоната. Содержащий EtOAc слой концентрировали в вакууме и очищали с помощью хроматографии в градиентном режиме примерно 0-75% этилацетат в гексане. Стадия Е. Получение альдегида для рацемизации спирта: В атмосфере N2 оксалилхлорид (1,4 экв.) растворяли в ДХМ и затем охлаждали до -78C. По каплям прибавляли ДМСО (2,2 экв.). Этот раствор перемешивали в течение примерно 10 мин, затем спирт 5-5(1 экв.) растворяли в дополнительном количестве ДХМ до полной концентрации, равной 0,2 М. После проведения реакции в течение 5 мин прибавляли ТЭА (5 экв.). Эту смесь перемешивали в течение 10 мин при -78C, затем еще 10 мин при комнатной температуре. Реакционную смесь разбавляли этилацетатом,затем трижды промывали насыщенным водным раствором бикарбоната натрия. В заключение продукт сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли в вакууме. Стадия F. Превращение в (R)- и (S)-спирты: Альдегид 5-6 растворяли в метаноле с образованием 0,2 М раствора и охлаждали до 0C. Прибавляли борогидрид натрия (1,5 экв.) и реакционную смесь выдерживали в течение от 5 до 10 мин. Раствор концентрировали в вакууме, разбавляли с помощью EtOAc и промывали насыщенным раствором бикарбоната. Содержащий EtOAc слой концентрировали в вакууме и очищали с помощью хроматографии. На этой стадии два диастереоизомера спирта разделяли с помощью ВЭЖХ с обращенной фазой. Стадия F. Превращение в амин: К каждому отделенному диастереоизомеру спирта, растворенному в сухом ТГФ, прибавляли 5 экв. связанного со смолой PPh3, 5 экв. фталимида и 5 экв. ДИАД. Реакционную смесь нагревали примерно при 55C в течение 30 мин. После завершения превращения в производное фталимида реакционную смесь разбавляли с помощью ЕОАс, фильтровали через целит и промывали насыщенным растворомNaHCO3. Содержащий EtOAc слой сушили над безводным Na2SO4, концентрировали в вакууме и очищали с помощью ВЭЖХ. Очищенные производные фталимида вводили в заключительную стадию удаления защитной группы с помощью 2 М MeNH2 в метаноле (использовавшемся в качестве растворителя) при 60C в течение примерно 1 ч. Неочищенный продукт очищали с помощью ВЭЖХ с обращенной фазой. При перемешивании к раствору безводного K2CO3 (46,53 г, 0,3371 моль) в ДМФ (500 мл) одной порцией прибавляли гидрохлорид метилового эфира D-серина (35,0 г, 0,2250 моль), KI (18,66 г,0,1124 моль) и бензилбромид (96,18 г, 0,5623 моль). Реакционную смесь энергично перемешивали в течение 5 ч при КТ. После завершения реакции содержимое выливали в воду со льдом и экстрагировали с помощью EtOAc. Объединенный органический слой промывали водой, рассолом, сушили над Na2SO4,концентрировали и получали неочищенный продукт 6-2. Проводили очистку с помощью колоночной хроматографии и получали чистый продукт (61,7 г, 91,7%) в виде бледно-желтого масла. Стадия В. Фторирование: При перемешивании к раствору диэтиламинтрифторида серы (32,3 мл, 0,2006 моль) в ТГФ (400 мл) в течение 3 ч при КТ прибавляли соединение 6-2. После завершения прибавления перемешивание продолжали в течение еще 1 ч. Смесь экстрагировали этилацетатом и объединенную органическую фазу промывали насыщенным раствором NaHCO3. Удаление растворителя в вакууме давало неочищенный продукт, который очищали с помощью колоночной хроматографии в градиентном режиме от гексана до 3% EtOAc в гексане и получали продукт 6-3 (70,4 г, 69,9%) в виде бледно-желтого масла. Стадия С. Восстановление: При механическом перемешивании к раствору LiBH4 (230,8 мл, 0,4651 моль) в ТГФ (2,0 л) через капельную воронку в течение 3 ч при -15C в атмосфере N2 по каплям прибавляли метиловый эфир 6-3(100,0 г, 0,3322 моль) в ТГФ (1,0 л). После завершения прибавления перемешивание продолжали в течение 4 ч при КТ. К указанной смеси по каплям прибавляли насыщенный раствор NH4Cl (500 мл) и экстрагировали с помощью EtOAc. Объединенную органическую фазу промывали водой, рассолом, сушили над Na2SO4 и концентрировали в вакууме. Оставшееся масло растворяли в 1 н. HCl (200 мл), экстрагировали диэтиловым эфиром и pH водного слоя доводили до 10 с помощью NH4OH (50%, 300 мл). Полученную смесь экстрагировали с помощью EtOAc и объединенные экстракты концентрировали в вакууме и получали продукт 6-4 (86,2 г, 95,0%) в виде бледно-коричневого масла. Стадия D. Удаление защитной группы: Смесь спирта 6-4 (50 г, 0,18315 моль) и Pd(OH)2 на угле (20%, 6,26 г, 0,04395 моль) в абсолютном этаноле (500 мл) перемешивали в течение 7 ч под давлением водорода 50-60 фунт-сила/дюйм 2. После завершения реакции уголь удаляли фильтрованием и остаток концентрировали в роторном испарителе и получали продукт 6-5 (15,8 г, 92,7%) в виде бледно-коричневого масла. Стадия Е. Введение защитной группы Boc:(Вос)2 О (38,66 г, 0,17733 моль). Реакционную смесь после прибавления перемешивали в течение ночи при КТ. К указанной смеси прибавляли насыщенный раствор KHSO4 для доведения pH до 3-4 и экстрагировали с помощью EtOAc. Органическую фазу концентрировали в вакууме и получали чистый продукт 6-6 (27,7 г, 89,0%) в виде бледно-коричневого масла. Стадия F. Окисление в альдегид:(180 мл) прибавляли раствор ДМСО (168 ммоль) в CH2Cl2 (90 мл). Через 1 ч прибавляли раствор спирта 6-6 (56 ммоль) в CH2Cl2 (90 мл). Через 1 ч прибавляли триэтиламин (281 ммоль) и перемешивали в течение еще 1 ч. Затем прибавляли насыщенный водный раствор NH4Cl и смеси давали нагреться до КТ. Органические вещества отделяли, промывали с помощью H2O (2), насыщенным рассолом (2), затем сушили, фильтровали и выпаривали при пониженном давлении и получали неочищенный альдегид. Очистка с помощью колоночной хроматографии давала чистый (S)-альдегид 6-7. С использованием другого энантиомера в качестве исходного вещества метиловый эфир (L)-серина превращали в (R)-энантиомер (6-8). Пример 7-А. Получение промежуточного продукта с -фторметильной боковой цепью. При перемешивании к раствору соединения 7-1 (10,0 ммоль) в 20 мл ДХМ прибавляли 10 мл ТФК. Смесь перемешивали при КТ в течение 24 ч. За протеканием реакции следили с помощью ЖХ/МС. После завершения реакции растворитель и ТФК удаляли путем выпаривания при пониженном давлении и лиофилизации и получали белое твердое вещество в виде солей с ТФК. Неочищенное твердое вещество суспендировали в 50 мл ТГФ и прибавляли N-карбэтоксифталимид (10,5 ммоль), Et3N (10 ммоль). Смесь кипятили с обратным холодильником в атмосфере N2 в течение 18 ч. Реакционную смесь охлаждали и растворители выпаривали. ДХМ прибавляли и промывали водой, рассолом, сушили над сульфатом натрия, фильтровали и концентрировали. Очищали с помощью хроматографии на колонке с силикагелем При перемешивании к раствору (S)-3-бензилокси)карбонил)-2-(1,3-диоксоизоиндолин-2 ил)пропановой кислоты (соединение 7-2, 6,07 ммоль) в 30 мл сухого ТГФ при -15C последовательно прибавляли N-метилморфолин (6,07 ммоль), изобутилхлорформиат (6,07 ммоль). После перемешивания в течение 5 мин при -15C одной порцией прибавляли раствор NaBH4 (689 мг, 18,21 ммоль) в 2,73 мл воды. Реакционную смесь перемешивали при -15C в течение 2 мин, затем гидролизовали водой (30 мл). Экстрагировали с помощью EtOAc (3), промывали водой (3), рассолом (1), сушили над сульфатом натрия, фильтровали, концентрировали. Очищали с помощью хроматографии на колонке с силикагелем(7-3, 5,6 ммоль) в ацетонитриле (28 мл) прибавляли перфтор-1-бутансульфонилфторид (44,8 ммоль), диизопропилэтиламин (44,8 ммоль) и диизопропилэтиламинтригидрофторид (134 ммоль). Смесь перемешивали при 50C в течение ночи. За протеканием реакции следили с помощью ЖХ/МС. После завершения реакции реакционную смесь охлаждали до КТ и затем выпаривали при пониженном давлении. Затем смесь подвергали распределению с ДХМ, промывали водой (3), рассолом (2), сушили над сульфатом натрия, фильтровали, концентрировали. Очищали с помощью хроматографии на колонке с силикагелем При перемешивании к раствору (S)-бензил 4-фтор-3-(1,3-диоксоизоиндолин-2-ил)бутаноата (соединение 7-4, 0,5 ммоль) в сухом эфире (5 мл) по каплям прибавляли диизобутилалюминийгидрид (1,0 М в толуоле, 1,5 ммоль) при -78C. Реакционную смесь перемешивали при -78C в течение примерно 30 мин и за протеканием реакции следили с помощью ЖХ/МС. После завершения реакцию останавливали путем прибавления воды (10 мл) при -78C. Экстрагировали этилацетатом, промывали водой (3), рассолом(2), сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт, соединение 7-5, использовали на следующей стадии реакции. Пример 7-В. Альтернативная методика получения соединения 7-5. Стадия А. Получение соединения 7-6:(0,20 ммоль) растворяли в этаноле (5 мл). Этот раствор продували азотом в течение 10 мин, затем прибавляли 10% палладий на угле (0,02 ммоль палладия) в атмосфере азота. Затем при перемешивании в течение примерно 1 ч через раствор быстро пропускали водород. За протеканием реакции следили с помощью ЖХ/МС. Реакционную смесь фильтровали через целит для удаления палладия. Целит дважды промывали метиленхлоридом. Затем фильтрат концентрировали и получали неочищенный продукт, соединение 7-6. Неочищенный продукт использовали на следующей стадии реакции. Стадия В. Получение (S)-S-этил-4-фтор-3-(1,3-диоксоизоиндолин-2-ил)бутантиоата: Соединение 7-5 (0,20 ммоль), 1,3-дициклогексилкарбодиимид (0,30 ммоль), этантриол (0,6 ммоль) и 4-диметиламинопиридин (0,10 ммоль) растворяли в ДМФ (5 мл). Смесь перемешивали в течение ночи при комнатной температуре. За протеканием реакции следили с помощью ЖХ/МС. К реакционной смеси прибавляли EtOAc. Затем ее промывали водой (2) и рассолом (2). Затем содержащий EtOAc слой сушили над сульфатом натрия, фильтровали и концентрировали. Затем неочищенный продукт, соединение 7-7, очищали с помощью флэш-хроматографии. Стадия С. Получение (S)-4-фтор-3-(1,3-диоксоизоиндолин-2-ил)бутаналя:- 28017748 Соединение 7-7 (0,20 ммоль) растворяли в сухом ацетоне (10 мл). Затем в атмосфере азота прибавляли 10% палладий (0,02 ммоль) на угле. Затем прибавляли триэтилсилан (0,5 ммоль). Примерно через 10 с начиналось выделение пузырьков и реакции давали протекать до прекращения выделения пузырьков(30 мин). За протеканием реакции следили с помощью ЖХ/МС. Реакционную смесь фильтровали через слой целита. Слой целита дважды промывали метиленхлоридом и затем фильтрат концентрировали и получали неочищенный продукт, соединение 7-5. Неочищенный продукт использовали в следующей реакции. С использованием другого(R)-энантиомер (7-8), обладающий следующей химической структурой: Пример 7-С. Альтернативное получение промежуточного продукта с -фторметильной боковой цепью. Схема 1 Стадия А. Получение соединения 7-10. Метанол (300 мл) помещали в круглодонную колбу объемом 1000 мл и систему охлаждали в бане со льдом. В течение 15 мин по каплям прибавляли ацетилхлорид (89,3 мл; 1251 ммоль). Полученный раствор нагревали до температуры окружающей среды и одной порцией прибавляли (S)-2-амино-4 пентеновую кислоту (7-9) (6,0 г; 139 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 2 ч и затем охлаждали до температуры окружающей среды. Затем смесь концентрировали в вакууме и получали бледно-желтое масло. Продукт диспергировали в этилацетате (150 мл) и повторно концентрировали в вакууме. Эту последовательность действий повторяли 4 раза. Продукт 7-10 представлял собой масло, которое затвердевало при выдерживании в вакууме в течение ночи. Анализ с помощью 1 Н ЯМР показывал, что продукт являлся достаточно чистым для использования без дополнительной очистки. ТСХ: Rf=7,1 (диоксид кремния; элюент 5:3:1 CHCl3:MeOH:(7:3 Н 2 О:АсОН); визуализация нингидрином). 1C ЯМР (101 МГц, d6-ДМСО):169,33, 131,37, 119,88, 52,65, 51,65, 34,22. Стадия В. Получение соединения 7-11. Неочищенный (S)-метил-2-амино-4-пентеноатгидрохлорид (7-10), полученный на предыдущей стадии, при осторожном нагревании растворяли в ТГФ (190 мл). Полученный раствор по каплям прибавляли к раствору LiAlH4 в ТГФ (280 мл 1,0 М раствора) с такой скоростью, чтобы внутренняя температура поддерживалась равной примерно 5C. Для растворения кристаллизующегося аминоэфира капельную воронку, содержащую раствор (S)-метил-2-амино-4-пентеноатгидрохлорида, периодически немного нагревали. После завершения прибавления капельную воронку промывали с помощью еще 20 мл ТГФ. Затем смесь разбавляли диэтиловым эфиром (500 мл) и избыток LiAlH4 разрушали путем последовательного прибавления H2O (11 мл), прибавляли 15% (мас./об.) водный раствор NaOH (11 мл) и H2O (33 мл) с такой скоростью, чтобы внутренняя температура поддерживалась ниже 10C. Смесь фильтровали и оса- 29
МПК / Метки
МПК: A61K 31/55, C07D 413/12, C07D 249/08, C07D 403/12, A61P 35/00, C07D 401/12
Метки: триазолы, замещенные, качестве, ингибиторов, кбв
Код ссылки
<a href="https://eas.patents.su/30-17748-zameshhennye-triazoly-v-kachestve-ingibitorov-kbv.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные триазолы в качестве ингибиторов кбв</a>
Предыдущий патент: Оранжерейный светильник, оранжерейная осветительная система и способ изменения характеристики излучения оранжерейного светильника
Следующий патент: Гербицидная смесь синергического действия, гербицидная композиция, содержащая синергическую гербицидную смесь, и способ борьбы с нежелательной растительностью
Случайный патент: Способ выявления зон вертикальной трещиноватости в горном массиве












