Производные 1,4-дизамещенного 3-цианопиридона и их применение в качестве положительных модуляторов рецептора mglur2
Номер патента: 17267
Опубликовано: 30.11.2012
Авторы: Лютьенс Роберт Иоганнес, Макдональд Грегор Джеймс, Дювей Гийом Альбер Жак, Сид-Нуньес Хосе Мария, Трабанко-Суарес Андрес Авелино
Формула / Реферат
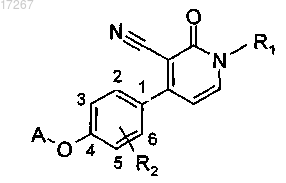
1. Соединение формулы
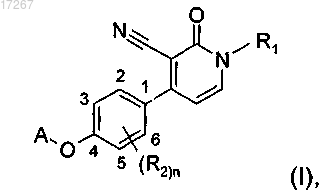
включая любые его стереохимически изомерные формы, где
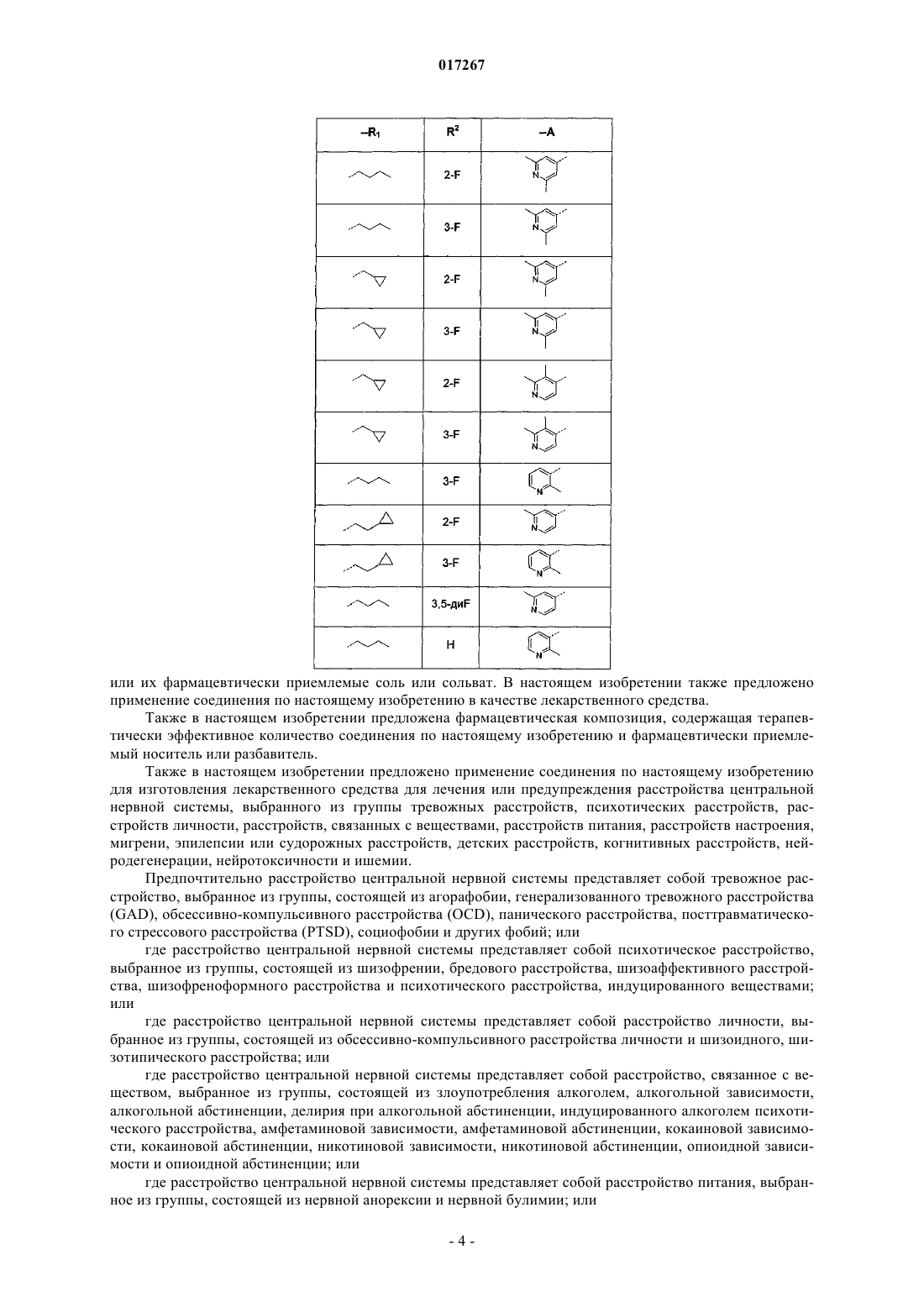
R1 представляет собой С4-6алкил или C1-3алкил, замещенный C3-7циклоалкилом;
R2 представляет собой водород или галогено;
А представляет собой пиридинил, замещенный одним или двумя заместителями, где каждый заместитель независимо выбран из галогено или С1-4алкила;
n представляет собой целое число со значением 1 или 2;
или его фармацевтически приемлемые соль или сольват;
при условии, что когда R2 представляет собой 2-фторо, тогда А не является 3-пиридинилом, замещенным одним или двумя заместителями, где каждый заместитель независимо выбран из галогено или C1-4алкила, и
при условии, что это соединение не является
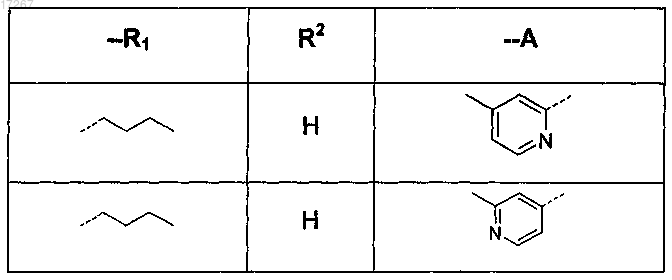
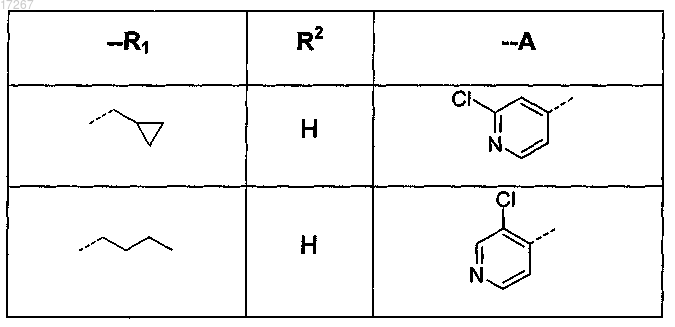
2. Соединение по п.1, где R1 представляет собой 1-бутил или 3-метил-1-бутил, циклопропилметил или 2-(циклопропил)-1-этил.
3. Соединение по любому из пп.1-2, где R2 представляет собой водород или фторо.
4. Соединение по любому из пп.1-3, где n равен 1 или 2 и R2 представляет собой галогено.
5. Соединение по любому из пп.1-4, где пиридинильное кольцо, представляющее собой А, замещено одним заместителем, выбранным из хлоро или метила; или где пиридинильное кольцо, представляющее собой А, замещено двумя заместителями, где каждый заместитель независимо выбран из хлоро или метила.
6. Соединение по п.1, где R1 представляет собой 1-бутил, 3-метил-1-бутил, циклопропилметил или 2-(циклопропил)-1-этил; R2 представляет собой водород или фторо; n равен 1 или 2; А представляет собой пиридинил, замещенный одним или двумя заместителями, где каждый заместитель независимо выбран из метила или хлоро.
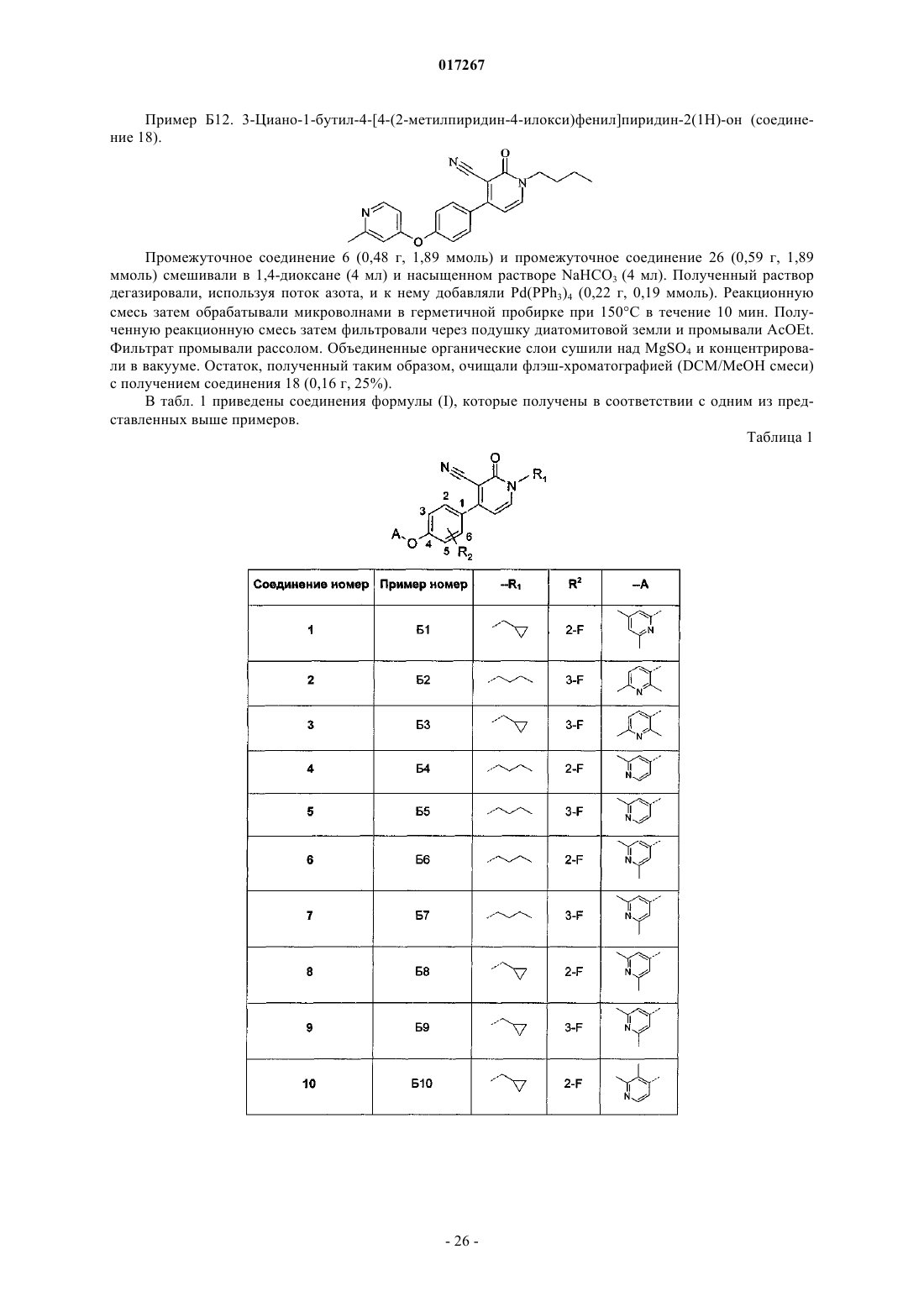
7. Соединение по п.1, выбранное из
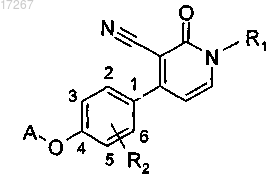
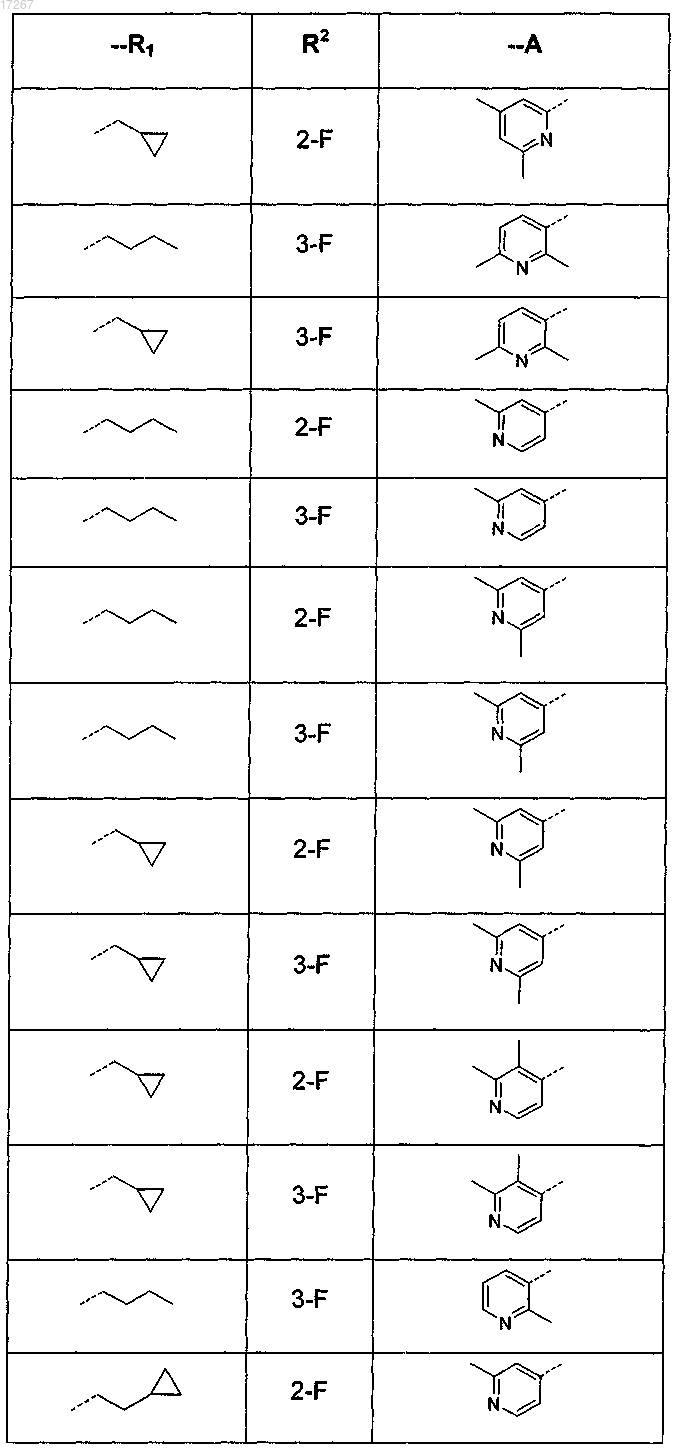
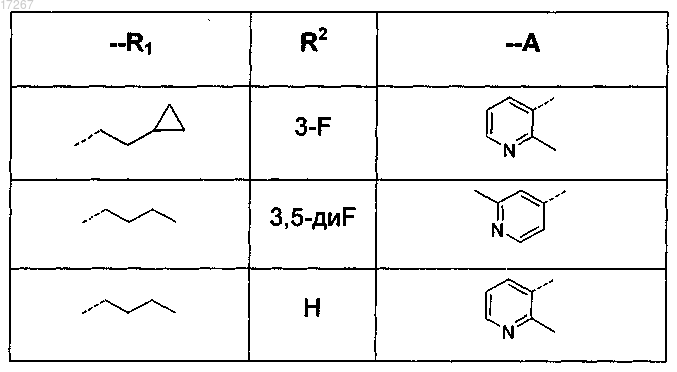
или его фармацевтически приемлемые соль или сольват.
8. Применение соединения по любому из пп.1-7 в качестве лекарственного средства.
9. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-7 и фармацевтически приемлемый носитель или разбавитель.
10. Применение соединения по любому из пп.1-7 для изготовления лекарственного средства для лечения или предупреждения расстройства центральной нервной системы, выбранного из группы тревожных расстройств, психотических расстройств, расстройств личности, расстройств, связанных с веществами, расстройств питания, расстройств настроения, мигрени, эпилепсии или судорожных расстройств, детских расстройств, когнитивных расстройств, нейродегенерации, нейротоксичности и ишемии.
11. Применение по п.10, где расстройство центральной нервной системы представляет собой тревожное расстройство, выбранное из группы, состоящей из агорафобии, генерализованного тревожного расстройства (GAD), обсессивно-компульсивного расстройства (OCD), панического расстройства, посттравматического стрессового расстройства (PTSD), социофобии и других фобий; или
где расстройство центральной нервной системы представляет собой психотическое расстройство, выбранное из группы, состоящей из шизофрении, бредового расстройства, шизоаффективного расстройства, шизофреноформного расстройства и психотического расстройства, индуцированного веществами; или
где расстройство центральной нервной системы представляет собой расстройство личности, выбранное из группы, состоящей из обсессивно-компульсивного расстройства личности и шизоидного, шизотипического расстройства; или
где расстройство центральной нервной системы представляет собой расстройство, связанное с веществом, выбранное из группы, состоящей из злоупотребления алкоголем, алкогольной зависимости, алкогольной абстиненции, делирия при алкогольной абстиненции, индуцированного алкоголем психотического расстройства, амфетаминовой зависимости, амфетаминовой абстиненции, кокаиновой зависимости, кокаиновой абстиненции, никотиновой зависимости, никотиновой абстиненции, опиоидной зависимости и опиоидной абстиненции; или
где расстройство центральной нервной системы представляет собой расстройство питания, выбранное из группы, состоящей из нервной анорексии и нервной булимии; или
где расстройство центральной нервной системы представляет собой расстройство настроения, выбранное из группы, состоящей из биполярных расстройств (I и II), циклотимического расстройства, депрессии, дистимического расстройства, глубокого депрессивного расстройства и расстройства настроения, индуцированного веществами; или
где расстройство центральной нервной системы представляет собой мигрень; или
где расстройство центральной нервной системы представляет собой эпилепсию или судорожное расстройство, выбранное из группы, состоящей из генерализованной бессудорожной эпилепсии, генерализованной судорожной эпилепсии, малого эпилептического припадка, большого эпилептического припадка, парциальной эпилепсии с нарушением сознания или без нарушения сознания, младенческих судорог, эпилепсии парциальной непрерывной (Кожевникова) и других форм эпилепсии; или
где расстройство центральной нервной системы представляет собой детское расстройство, например расстройство дефицита внимания/гиперактивности; или
где расстройство центральной нервной системы представляет собой когнитивное расстройство, выбранное из группы, состоящей из делирия, персистирующего делирия, индуцированного веществами, деменции, деменции вследствие ВИЧ-заболевания, деменции вследствие болезни Хантингтона, деменции вследствие болезни Паркинсона, деменции альцгеймеровского типа, персистирующей деменции, индуцированной веществами, и умеренного когнитивного нарушения; или
где расстройство центральной нервной системы выбрано из группы, состоящей из тревоги, шизофрении, мигрени, депрессии и эпилепсии.
12. Применение соединения по любому из пп.1-7 в комбинации с ортостерическим агонистом mGluR2 для изготовления лекарственного средства для лечения или предупреждения состояния, указанного в любом из пп.10-11, у млекопитающего, включая человека.
13. Способ получения соединения по п.1, характеризующийся стадиями: взаимодействия промежуточного соединения формулы (II), где Y представляет собой группу, подходящую для Pd-опосредованного сочетания с бороновыми кислотами или бороновыми сложными эфирами, с промежуточным соединением формулы (III), где R3 и R4 представляют собой водород или C1-4алкил или где R3 и R4 могут быть взяты вместе с образованием бивалентного радикала формулы -СН2СН2-, -СН2СН2СН2- или -С(СН3)2С(CH3)2-, при нагревании в подходящем реакционно-инертном растворителе, в присутствии подходящего основания и подходящего катализатора
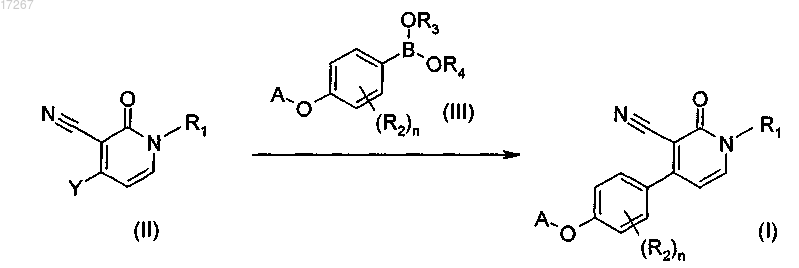
где R1, R2, А и n являются такими, как они определены в п.1;
и, возможно, дополнительного превращения соединений формулы (I) друг в друга; возможно, превращения соединений формулы (I) в терапевтически активную нетоксичную соль присоединения кислоты путем обработки кислотой или превращения образующейся соли присоединения кислоты в свободное основание путем обработки щелочью; или, возможно, получения его стереохимически изомерной формы.
Текст
ПРОИЗВОДНЫЕ 1,4-ДИЗАМЕЩЕННОГО 3-ЦИАНОПИРИДОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПОЛОЖИТЕЛЬНЫХ МОДУЛЯТОРОВ РЕЦЕПТОРА MGLUR2 Сид-Нуньес Хосе Мария, Трабанко-Суарес Андрес Авелино (ES), Макдональд Грегор Джеймс (BE), Дювей Гийом Альбер Жак(FR), Лютьенс Роберт Иоганнес (CH) Настоящее изобретение относится к новым соединениям, в частности к новым производным пиридинона формулы (I),включая любую их стереохимически изомерную форму или его фармацевтически приемлемую соль или сольват, где все радикалы определены в описании и формуле изобретения. Соединения по изобретению являются положительными аллостерическими модуляторами метаботропных глутаматных рецепторов подтипа 2 (mGluR2), которые полезны для лечения или предупреждения неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией, и заболеваний, в которые вовлечен mGluR2 подтип метаботропных рецепторов. В частности, такие заболевания представляют собой расстройства центральной нервной системы, выбранные из группы, состоящей из тревоги, шизофрении, мигрени, депрессии и эпилепсии. Изобретение также относится к фармацевтическим композициям и к способам получения таких соединений и таких композиций, а также к применению таких соединений для предупреждения и лечения таких заболеваний, в которые вовлечен mGluR2. 017267 Область изобретения Настоящее изобретение относится к новым производным пиридин-2-она, которые являются положительными аллостерическими модуляторами метаботропных глутаматных рецепторов подтипа 2(mGluR2) и которые полезны для лечения или предупреждения неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией, и заболеваний, в которые вовлечен mGluR2 подтип метаботропных рецепторов. Изобретение также относится к фармацевтическим композициям,содержащим такие соединения, к способам получения таких соединений и таких композиций, а также к применению таких соединений для предупреждения и лечения неврологических и психиатрических расстройств и заболеваний, в которые вовлечен mGluR2. Предшествующий уровень техники Глутамат представляет собой важный аминокислотный нейротрансмиттер в центральной нервной системе млекопитающих. Глутамат играет важную роль в многочисленных физиологических функциях,таких как обучение и память, а также сенсорное восприятие, развитие синаптической пластичности, двигательный контроль, дыхание и регуляция сердечно-сосудистой функции. Кроме того, глутамат является ключевым моментом в некоторых других неврологических и психиатрических заболеваниях, где существует дисбаланс глутаматергической нейротрансмиссии. Глутамат опосредует синаптическую нейротрансмиссию путем активации ионотропных глутаматных рецепторных каналов (iGluRs) и NMDA- (N-метил-D-аспартат), АМРА- (альфа-аминометилизоксазолпропионовая кислота) и каинатных рецепторов, которые отвечают за быструю возбуждающую трансмиссию. Кроме того, глутамат активирует метаботропные глутаматные рецепторы (mGluR), которые больше играют модуляторную роль, чем способствуют точной настройке синаптической эффективности. Глутамат активирует mGluR путем связывания с большим внеклеточным аминоконцевым доменом рецептора, называемым в данном описании изобретения ортостерическим сайтом связывания. Данное связывание индуцирует конформационное изменение в рецепторе, что приводит к активации белка G и внутриклеточного сигнального пути. Подтип mGluR2 негативно связан с аденилатциклазой через активацию белка Gi, и его активация ведет к ингибированию высвобождения глутамата в синапсе. В центральной нервной системе (CNS) рецепторы mGluR2 распределены главным образом в коре головного мозга, талимических областях, дополнительной обонятельной луковице, гиппокампе, миндалевидной железе, хвостатом ядре-путамене и прилежащем ядре. Активация mGluR2, как было показано в клинических испытаниях, эффективна для лечения тревожных расстройств. Кроме того, активация mGluR2, как было показано, эффективна в различных животных моделях, и, таким образом, представляет собой эффективный новый терапевтический подход к лечению шизофрении, эпилепсии, аддикции/лекарственной зависимости, болезни Паркинсона, боли, расстройств сна и болезни Хантингтона. В настоящий момент большинство имеющихся фармакологических средств, нацеленных на mGluR,представляют собой ортостерические лиганды, которые активируют некоторые члены семейства, так как они являются структурными аналогами глутамата. Новым путем разработки селективных соединений, действующих на mGluR, является идентификации соединений, которые действуют через аллостерические механизмы, модулируя рецептор посредством связывания с сайтом, отличным от высококонсервативного ортостерического сайта связывания. Положительные аллостерические модуляторы mGluR появились недавно как новые фармакологические объекты, предлагающие данную привлекательную альтернативу. Различные соединения были описаны как положительные аллостерические модуляторы mGluR2. В WO 2004/092135 (NPSAstra Zeneca), WO 2004/018386, WO 2006/014918 и WO 2006/015158(Merck), WO 2001/56990 (Eli Lilly) и WO 2006/030032 (AddexJanssen Pharmaceutica) описаны соответственно производные фенилсульфонамида, ацетофенона, инданона, пиридилметилсульфонамида и пиридинона в качестве положительных аллостерических модуляторов mGluR2. Ни одно из конкретно раскрытых соединений не является структурно близким к соединениям по данному изобретению. В WO 2007/104783 описаны 1,4-дизамещенные производные 3-цианопиридона, которые являются положительными аллостерическими модуляторами метаботропных рецепторов подтипа 2 (mGluR2). Продемонстрировано, что такие соединения сами по себе не активируют рецептор. Скорее, они дают возможность рецептору продуцировать максимальный ответ на концентрацию глутамата, которая сама по себе индуцирует минимальный ответ. Мутационный анализ недвусмысленно продемонстрировал, что связывание mGluR2 положительных аллостерических модуляторов происходит не на ортостерическом сайте, а на аллостерическом сайте, расположенном в пределах семи трансмембранных участков рецептора. Данные, полученные на животных, свидетельствуют о том, что положительные аллостерические модуляторы mGluR2 оказывают действие в моделях тревоги и психоза, аналогичных полученным с ортостерическими агонистами. Аллостерические модуляторы mGluR2, как показано, были активными при потенциируемом испугом вздрагивании, и при стресс-индуцированных гипетермических моделях трево-1 017267 ги. Кроме того, такие соединения, как было показано, активны в инверсии кетамин- или амфетамининдуцированной гиперлокомоции, и в инверсии амфетамин-индуцированного нарушения преимпульсного ингибирования эффекта акустической реакции испуга в модели шизофрении (J. Pharmacol. Exp. Ther. 2006, 318, 173-185; Psychopharmacology 2005, 779, 271-283). Последние исследования на животных дополнительно выявили, что селективный положительный аллостерический модулятор метаботропного глутаматного рецептора подтипа 2 бифенил-инданон(BINA) блокирует галлюциногенную лекарственную модель психоза, поддерживая стратегию нацеливания рецепторов mGluR2 на лечение глутаматергической дисфункции при шизофрении (Mol. Pharmacol. 2007, 72, 477-484). Положительные аллостерические модуляторы обеспечивают потенциацию глутаматного ответа, но они также, как было показано, потенциируют ответ на ортостерические агонисты mGluR2, такие какLY379268 или DCG-IV. Эти данные являются свидетельством еще одного нового терапевтического подхода к лечению вышеупомянутых неврологических и психиатрических заболеваний с вовлечениемmGluR2, при которых применяют комбинацию положительного аллостерического модулятора mGluR2 вместе с ортостерическим агонистом mGluR2. Настоящие соединения характеризуются центральной пиридин-2-оновой группировкой, замещенной по положению 3 циано и по положению 4 возможно замещенным фенилом, который, в свою очередь,замещен по положению 4 замещенным пиридинилокси. Настоящие соединения являются эффективными положительными аллостерическими модуляторами mGluR2 и демонстрируют улучшенный профиль сердечно-сосудистой безопасности. Описание изобретения Изобретение относится к соединениям, обладающим активностью модулятора метаботропного глутаматного рецептора 2. В настоящем изобретении предложено соединение формулы (I) включая любые его стереохимически изомерные формы, гдеR2 представляет собой водород или галогено; А представляет собой пиридинил, замещенный одним или двумя заместителями, где каждый заместитель независимо выбран из галогено или С 1-4 алкила;n представляет собой целое число со значением 1 или 2; или его фармацевтически приемлемые соль или сольват; при условии, что, когда R2 представляет собой 2-фторо, тогда А не является 3-пиридинилом, замещенным одним или двумя заместителями, где каждый заместитель независимо выбран из галогено или С 1-4 алкила, и при условии, что это соединение не является Одним воплощением настоящего изобретения являются те соединения по настоящему изобрете-2 017267 нию, где R1 представляет собой 1-бутил или 3-метил-1-бутил, циклопропилметил или 2-(циклопропил)-1 этил. Другим воплощением настоящего изобретения являются те соединения по настоящему изобретению, где R2 представляет собой водород или фторо. Еще одним воплощением настоящего изобретения являются те соединения по настоящему изобретению, где n равен 1 или 2, и R2 представляет собой галогено. Еще одним воплощением настоящего изобретения являются те соединения по настоящему изобретению, где пиридинильное кольцо, представляющее собой А, замещено одним заместителем, выбранным из хлоро или метила; или где пиридинильное кольцо, представляющее собой А, замещено двумя заместителями, где каждый заместитель независимо выбран из хлоро или метила. Еще одним воплощением настоящего изобретения являются те соединения по настоящему изобретению, где R1 представляет собой 1-бутил, 3-метил-1-бутил, циклопропилметил или 2-(циклопропил)-1 этил; R2 представляет собой водород или фторо; n равен 1 или 2; А представляет собой пиридинил, замещенный одним или двумя заместителями, где каждый заместитель независимо выбран из метила или хлоро. Еще одним воплощением настоящего изобретения являются соединения по настоящему изобретению, выбранные из или их фармацевтически приемлемые соль или сольват. В настоящем изобретении также предложено применение соединения по настоящему изобретению в качестве лекарственного средства. Также в настоящем изобретении предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый носитель или разбавитель. Также в настоящем изобретении предложено применение соединения по настоящему изобретению для изготовления лекарственного средства для лечения или предупреждения расстройства центральной нервной системы, выбранного из группы тревожных расстройств, психотических расстройств, расстройств личности, расстройств, связанных с веществами, расстройств питания, расстройств настроения,мигрени, эпилепсии или судорожных расстройств, детских расстройств, когнитивных расстройств, нейродегенерации, нейротоксичности и ишемии. Предпочтительно расстройство центральной нервной системы представляет собой тревожное расстройство, выбранное из группы, состоящей из агорафобии, генерализованного тревожного расстройства(GAD), обсессивно-компульсивного расстройства (OCD), панического расстройства, посттравматического стрессового расстройства (PTSD), социофобии и других фобий; или где расстройство центральной нервной системы представляет собой психотическое расстройство,выбранное из группы, состоящей из шизофрении, бредового расстройства, шизоаффективного расстройства, шизофреноформного расстройства и психотического расстройства, индуцированного веществами; или где расстройство центральной нервной системы представляет собой расстройство личности, выбранное из группы, состоящей из обсессивно-компульсивного расстройства личности и шизоидного, шизотипического расстройства; или где расстройство центральной нервной системы представляет собой расстройство, связанное с веществом, выбранное из группы, состоящей из злоупотребления алкоголем, алкогольной зависимости,алкогольной абстиненции, делирия при алкогольной абстиненции, индуцированного алкоголем психотического расстройства, амфетаминовой зависимости, амфетаминовой абстиненции, кокаиновой зависимости, кокаиновой абстиненции, никотиновой зависимости, никотиновой абстиненции, опиоидной зависимости и опиоидной абстиненции; или где расстройство центральной нервной системы представляет собой расстройство питания, выбранное из группы, состоящей из нервной анорексии и нервной булимии; или-4 017267 где расстройство центральной нервной системы представляет собой расстройство настроения, выбранное из группы, состоящей из биполярных расстройств (I и II), циклотимического расстройства, депрессии, дистимического расстройства, глубокого депрессивного расстройства и расстройства настроения, индуцированного веществами; или где расстройство центральной нервной системы представляет собой мигрень; или где расстройство центральной нервной системы представляет собой эпилепсию или судорожное расстройство, выбранное из группы, состоящей из генерализованной бессудорожной эпилепсии, генерализованной судорожной эпилепсии, малого эпилептического припадка, большого эпилептического припадка, парциальной эпилепсии с нарушением сознания или без нарушения сознания, младенческих судорог, эпилепсии парциальной непрерывной (Кожевникова) и других форм эпилепсии; или где расстройство центральной нервной системы представляет собой детское расстройство, например расстройство дефицита внимания/гиперактивности; или где расстройство центральной нервной системы представляет собой когнитивное расстройство, выбранное из группы, состоящей из делирия, персистирующего делирия, индуцированного веществами,деменции, деменции вследствие ВИЧ-заболевания, деменции вследствие болезни Хантингтона, деменции вследствие болезни Паркинсона, деменции альцгеймеровского типа, персистирующей деменции,индуцированной веществами, и умеренного когнитивного нарушения; или где расстройство центральной нервной системы выбрано из группы, состоящей из тревоги, шизофрении, мигрени, депрессии и эпилепсии. Также в настоящем изобретении предложено применение соединения по настоящему изобретению в комбинации с ортостерическим агонистом mGluR2 для изготовления лекарственного средства для лечения или предупреждения состояния, указанного в данном описании, у млекопитающего, включая человека. Кроме того, в настоящем изобретении предложен способ получения соединения по настоящему изобретению, характеризующийся стадиями взаимодействия промежуточного соединения формулы (II),где Y представляет собой группу, подходящую для Pd-опосредованного сочетания с бороновыми кислотами или бороновыми сложными эфирами, с промежуточным соединением формулы (III), где R3 и R4 представляют собой водород или C1-4 алкил, или где R3 и R4 могут быть взяты вместе с образованием бивалентного радикала формулы -СН 2 СН 2-, -СН 2 СН 2 СН 2- или -С(CH3)2 С(CH3)2-, при нагревании в подходящем реакционно-инертном растворителе, в присутствии подходящего основания и подходящего катализатора где R1, R2, А и n являются такими, как они определены в данном описании; и, возможно, дополнительного превращения соединений формулы (I) друг в друга; возможно, превращения соединений формулы (I) в терапевтически активную нетоксичную соль присоединения кислоты путем обработки кислотой или превращения образующейся соли присоединения кислоты в свободное основание путем обработки щелочью; или, возможно, получения его стереохимически изомерной формы. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению, где R1 представляет собой C4-6 алкил, в частности С 4-5 алкил, такой как, например, 1-бутил, 2-метил 1-пропил, 3-метил-1-бутил; в частности 1-бутил или 3-метил-1-бутил; в более частном случае 1-бутил. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению, где R1 представляет собой C1-3 алкил, замещенный C3-7 циклоалкилом, в частности циклопропилметил или 2-(циклопропил)-1-этил, в более частном случае циклопропилметил. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или любая их подгруппа, как упомянуто в описании изобретения выше как воплощение, где R2 представляет собой водород или фтор, в частности фтор. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или любая их подгруппа, как упомянуто в описании изобретения выше как воплощение, где R2 представляет собой галогено, в частности фтор. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или, где это можно, любая их подгруппа, как упомянуто в описании изобретения выше как воплощение,где n равен 1 и R2 представляет собой водород. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или, где это можно, любая их подгруппа, как упомянуто в описании изобретения выше как воплощение,-5 017267 где n равен 1, и R2 представляет собой галогено, в частности фтор. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или, где это можно, любая их подгруппа, как упомянуто в описании изобретения выше как воплощение,где n равен 2 и R2 представляет собой галогено, в частности фтор. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или, где это можно, любая их подгруппа, как упомянуто в описании изобретения выше как воплощение,где n равен 1, и R2 представляет собой галогено, в частности фтор, и находится в орто-положении относительно пиридиноновой группировки, т.е. в положении 2. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или, где это можно, любая их подгруппа, как упомянуто в описании изобретения выше как воплощение,где n равен 1 и R2 представляет собой галогено, в частности фтор, и находится в мета-положении относительно пиридиноновой группировки, т.е. в положении 3. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или, где это можно, любая их подгруппа, как упомянуто в описании изобретения выше как воплощение,где n равен 2 и R2 представляет собой галогено, в частности фтор, и заместители R2 находится в метаположении относительно пиридиноновой группировки, т.е. в положениях 3 и 5. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или, где это можно, любая их подгруппа, как упомянуто в описании изобретения выше как воплощение,где n равен 2 и R2 представляет собой галогено, в частности фтор, и заместители R2 находится в ортоположении относительно пиридиноновой группировки, т.е. в положениях 2 и 6. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или, где это можно, любая их подгруппа, как упомянуто в описании изобретения выше как воплощение,где А представляет собой замещенный 2-пиридинил. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или, где это можно, любая их подгруппа, как упомянуто в описании изобретения выше как воплощение,где А представляет собой замещенный 3-пиридинил. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или, где это можно, любая их подгруппа, как упомянуто в описании изобретения выше как воплощение,где А представляет собой замещенный 4-пиридинил. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или, где это можно, любая их подгруппа, как упомянуто в описании изобретения выше как воплощение,где пиридинильное кольцо, представляющее собой А, замещено одним заместителем, выбранным из галогено, в частности фтора, или C1-4 алкила, в частности метила. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению или, где это можно, любая их подгруппа, как упомянуто в описании изобретения выше как воплощение,где пиридинильное кольцо, представляющее собой А, замещено двумя заместителями, где каждый заместитель независимо выбран из галогено, в частности хлора, или С 1-4 алкила, в частности метила. Одним воплощением настоящего изобретения являются те соединения по настоящему изобретению, где R1 представляет собой C4-6 алкил, в частности 1-бутил или 3-метил-1-бутил; или C1-3 алкил, замещенный С 3-7 циклоалкилом, в частности циклопропилметил или 2-(циклопропил)-1-этил;R2 представляет собой водород или фтор;n равен 1 или 2; А представляет собой пиридинил, замещенный одним или двумя заместителями, где каждый заместитель независимо выбран из метила или хлоро. Как используется в данном описании изобретения выше или ниже, обозначение C1-3 алкила как группы или части группы означает насыщенный, прямой или разветвленный углеводородный радикал,имеющий от 1 до 3 атомов углерода, такой как метил, этил, 1-пропил и 1-метил-1-этил. ПредпочтительноC1-3 алкил представляет собой метил. Как используется в данном описании изобретения выше или ниже, обозначение C1-4 алкила как группы или части группы означает насыщенный, прямой или разветвленный углеводородный радикал,имеющий от 1 до 4 атомов углерода, такой как метил, этил, пропил, 1-метил-1-этил, 1-бутил, 2-метил-1 пропил. Предпочтительно C1-4 алкил представляет собой метил. Как используется в данном описании изобретения выше или ниже, обозначение C4-6 акила как группы или части группы означает насыщенный, прямой или разветвленный углеводородный радикал,имеющий от 4 до 6 атомов углерода, такой как 1-бутил, 2-метил-1-пропил, 1-пентил, 2-метил-1-бутил, 3 метил-1-бутил, 1-гексил и подобные. Предпочтительно C4-6 алкил представляет собой 1-бутил. Как используется в данном описании изобретения выше или ниже, обозначение C4-5 алкила как группы или части группы означает насыщенный, прямой или разветвленный углеводородный радикал,имеющий 4 или 5 атомов углерода, такой как 1-бутил, 2-метил-1-пропил, 1-пентил, 2-метил-1-бутил, 3 метил-1-бутил и подобные. Как используется в данном описании изобретения выше или ниже, обозначение С 3-7 циклоалкил означает насыщенный, циклический углеводородный радикал, имеющий от 3 до 7 атомов углерода, такой-6 017267 как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Предпочтительно C3-7 циклоалкил представляет собой циклопропил. Как используется в данном описании изобретения выше или ниже, обозначение галогено является общим для фторо, хлоро, бромо и йодо. Для терапевтического применения солями соединений по настоящему изобретению являются те,где противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые являются фармацевтически неприемлемыми, также могут найти применение, например, в получении или очистке фармацевтически приемлемого соединения. Все соли, и фармацевтически приемлемые, и нет,включены в объем настоящего изобретения. Как определено, фармацевтически приемлемые соли включают терапевтически активные нетоксичные солевые формы присоединения кислот, которые соединения по настоящему изобретению способны образовать. Указанные соли могут быть получены путем обработки основной формы соединений по настоящему изобретению соответствующими кислотами, например неорганическими кислотами, например галогенводородной кислотой, в частности соляной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой; органическими кислотами, например уксусной кислотой, гидроксиуксусной кислотой, пропановой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, паратолуолсульфоновой кислотой, цикламовой кислотой, салициловой кислотой, парааминосалициловой кислотой и памовой кислотой. В свою очередь, указанные кислотно-солевые формы могут быть превращена в форму свободного основания путем обработки соответствующим основанием. Соединения по настоящему изобретению, содержащие кислотные протоны, также могут быть превращены в их терапевтически активные нетоксичные формы солей основания посредством обработки соответствующим органическим и неорганическим основаниями. Подходящие солевые формы оснований включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, в частности соли лития, натрия, калия, магния и кальция, соли органических оснований, например бензатина, Nметил-D-глюкамина, гибрамина (hybramine) соли, и соли аминокислот, например аргинина и лизина. В свою очередь, указанные формы солей оснований могут быть превращены в формы свободных кислот посредством обработки соответствующей кислотой. Фармацевтически приемлемые солевые формы присоединения кислот соединений по настоящему изобретению являются предпочтительными фармацевтически приемлемыми солевыми формами соединений по настоящему изобретению. Термин "сольват" включает формы присоединения растворителя, а также их фармацевтически приемлемые соли, которые соединения по настоящему изобретению способны образовать. Примерами таких форм присоединения растворителя являются, например, гидраты, алкоголяты и подобные. Очевидно, что некоторые соединения по настоящему изобретению и их соли и сольваты могут содержать один или более чем один центр хиральности и существовать в виде стереохимически изомерных форм. Термин "стереохимически изомерные формы" при использовании выше в данном описании изобретения означает все возможные изомерные формы, которые могут иметь соединения по настоящему изобретению. Если не упомянуто или не указано иное, химическое обозначение соединения означает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры с основной молекулярной структурой. Но данное изобретение также охватывает каждую из индивидуальных изомерных форм по настоящему изобретению и их солей или сольватов, по существу, не содержащие, т.е. ассоциированные менее чем с 10%, предпочтительно менее чем с 5%, в частности менее чем с 2% и наиболее предпочтительно менее чем с 1% других изомеров. Таким образом,когда соединение по настоящему изобретению, например, указано как (R), это означает, что это соединение, по существу, не содержит свободного (S)-изомера. В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь или цис-, или трансконфигурацию. Следуя терминологическим соглашениям CAS (Chemical Abstract Service), когда в соединении присутствуют два стереогенных центра с известной абсолютной конфигурацией, R- или S-дескриптор присваивается (на основании правила последовательности Кана-Инголда-Прелога) хиральному центру с самым маленьким номером, центру отсчета. Конфигурацию второго стереогенного центра указывают, используя относительные дескрипторы [R,R] или [R,S], где R всегда указывается как точка отсчета, a[R,R] указывает центры с такой же хиральностью и [R,S] указывает центры с другой хиральностью. Например, если хиральный центр с самым маленьким номером в соединении имеет S-конфигурацию, а второй центр R, стереодескриптор будет указан как S-[R,S]. Если используютсяи , положение заместителя с наибольшим приоритетом на асимметрическом атоме углерода в кольцевой системе, имею-7 017267 щей наименьший номер кольца, находится произвольно всегда в -положении средней плоскости, детерниминированной кольцевой системой. Положение заместителя с наиболее высоким приоритетом на другом асимметрическом атоме углерода в кольцевой системе (атом водорода в соединениях по настоящему изобретению) относительно положения заместителя с наиболее высоким приоритетом на атоме отсчета обозначают как , если оно находится на той же стороне средней плоскости, детерниминированной кольцевой системой, или , если оно находится на другой стороне средней плоскости, детерниминированной кольцевой системой. При использовании в описании изобретения ниже подразумевается, что термин "соединения по настоящему изобретению" или любая их подгруппа также включает их стереохимически изомерные формы, их фармацевтически приемлемые соли и их сольваты. Особенный интерес представляют соединения по настоящему изобретению, которые являются стереохимически чистыми. В рамках данной заявки элемент, в частности упомянутый в отношении соединения по настоящему изобретению, включает все изотопы и изотопные смеси данного элемента, либо встречающиеся в природе, либо синтетически продуцируемые, либо с естественным избытком, либо в изотопно обогащенной форме. В частности, когда упоминается водород, подразумевается, что он относится к 1 Н, 2 Н, 3 Н или их смесями; когда упоминается углерод, подразумевается, что он относится к 11 С, 12 С, 13 С, 14 С или их смесям; когда упоминается азот, подразумевается, что он относится к 13N, 14N, 15N или их смесям; когда упоминается кислород, подразумевается, что он относится к 14 О, 15 О, 16 О, 17 О, 18 О или их смесям; и когда упоминается фтор, подразумевается, что он относится к 18F, 19F или их смесям. Соединения по настоящему изобретению, следовательно, также содержат соединения с одним или более изотопами одного или более элементов и их смеси, включая радиоактивные соединения, также называемые радиоактивно меченными соединениями, где один или более чем один нерадиоактивный атом замещен его одним радиоактивным изотопом. В частности, радиоактивный атом выбран из группы водород, углерод, азот, сера,кислород и галоген. Предпочтительно радиоактивный атом выбран из группы водород, углерод и галоген. В частности, радиоактивный изотоп выбран из группы 3 Н, 11 С, 18F, 122I, 123I, 125I, 131I, 75Br, 76Br, 77Br и 82Br. Предпостительно радиоактивный изотоп выбран из группы 3 Н, 11 С и 18F. При указании в описании изобретения выше или ниже того, что заместители могут быть выбраны каждый независимо из списка определений, предполагаются все возможные комбинации, которые химически возможны. Линии, нарисованные от заместителей в кольцевые системы, указывают, что связь может быть присоединена к любому из подходящих кольцевых атомов. В общем случае соединения по настоящему изобретению могут быть получены в соответствии с нижеприведенными экспериментальными методами 1. Экспериментальный метод 1. Соединения формулы (I) могут быть получены путем взаимодействия промежуточного соединения формулы (II), где Y представляет собой группу, подходящую для Pd-опосредованного сочетания с бороновыми кислотами или бороновыми сложными эфирами, такую как, например, галогено или трифлат, с промежуточным соединением формулы (III), где R3 и R4 представляют собой водород или С 1-4 алкил или где R3 и R4 могут быть взяты вместе с образованием, например, бивалентного радикала формулы-СН 2 СН 2-, -СН 2 СН 2 СН 2- или -С(CH3)2 С(СН 3)2- в соответствии со схемой взаимодействия (1). Взаимодействие можно осуществить в подходящем реакционно-инертном растворителе, таком как, например, 1,4 диоксан, или смеси инертных растворителей, таких как, например, 1,4-диоксан/DMF, в присутствии подходящего основания, такого как, например, водный NaHCO3 или Na2CO3, подходящего катализатора,такого как, например, катализатор на основе комплекса Pd, такой как, например, Pd(PPh3)4, в термических условиях, таких как, например, нагревание реакционной смеси при 150C микроволновым излучением, в течение, например, 10 мин. В схеме взаимодействия (1) все переменные определены, как в формуле (I) или как они определены в описании изобретения выше. Схема взаимодействия (1) Соединения формулы (I) и некоторые промежуточные соединения по настоящему изобретению могут содержать асимметрический атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений могут быть получены путем применения методов,известных из уровня техники. Например, диастереоизомеры могут быть разделены физическими способами, такими как селективная кристаллизация, или хроматографическими методами, например противо-8 017267 точным распределением, хиральной жидкостной хроматографией и подобными способами. Энантиомеры могут быть получены из рацемических смесей сначала путем превращения указанной рацемической смеси с подходящими разделяющими агентами, такими как, например, хиральные кислоты, в смеси диастереомерных солей или соединений; затем физического разделения указанных смесей диастереомерных солей или соединений, например посредством селективной кристаллизации или хроматографических методов, например жидкостной хроматографии и подобных; и, наконец, превращения указанных разделенных диастереомерных солей или соединений на соответствующие энантиомеры. Чистые стереохимически изомерные формы также могут быть получены из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных веществ, при условии, что промежуточные взаимодействия происходят стереоспецифически. Альтернативный способ разделения энантиомерных форм соединений формулы (I) и промежуточных соединений включает жидкостную хроматографию или SCF (сверхкритическую флюидную) хроматографию, в частности с использованием хиральной стационарной фазы. Некоторые промежуточные соединения и исходные вещества являются известными соединениями и могут быть куплены или могут быть получены в соответствии с методами, известными из уровня техники. Промежуточные соединения также могут быть получены в соответствии с представленными ниже экспериментальными методами 2-10. Экспериментальный метод 2. Промежуточные соединения формулы (II), где Y представляет собой галогено, где указанные промежуточные соединения представлены формулой (II-а), могут быть получены путем взаимодействия промежуточного соединения формулы (IV) с подходящим галогенирующим агентом, таким как, например, Р(=О)Br3, в соответствии со схемой взаимодействия (2). Взаимодействие может быть осуществлено в подходящем реакционно-инертном растворителе, таком как, например, DMF, при умеренно повышенной температуре, такой как, например, 110C. В схеме взаимодействия (2) все переменные определены как в формуле (I). Схема взаимодействия (2) Экспериментальный метод 3. Промежуточные соединения формулы (II), где Y представляет собой F3C-S(=O)2-O-, указанные промежуточные соединения представлены формулой (II-b), могут быть получены путем взаимодействия промежуточного соединения формулы (IV) с трифликовым ангидридом (также называемым трифторметансульфоновый ангидрид) в соответствии со схемой взаимодействия (3). Взаимодействие может быть осуществлено в подходящем реакционно-инертном растворителе, таком как, например, дихлорметан, в присутствии подходящего основания, такого как, например, пиридин, при низкой температуре, такой как, например, -78C. В схеме взаимодействия (3) все переменные определены, как в формуле (I). Схема взаимодействия (3) Экспериментальный метод 4. Промежуточные соединения формулы (IV) могут быть получены известными из уровня техники методами путем взаимодействия промежуточного соединения формулы (V) с подходящим реагентом для расщепления метилового эфира, таким как, например, NaOH, в соответствии со схемой взаимодействия(4). Это взаимодействие может быть осуществлено в подходящем растворителе, таком как, например,вода, THF, при умеренно высокой температуре, такой как, например, 100C. В схеме взаимодействия (4) все переменные определены, как в формуле (I). Экспериментальный метод 5. Промежуточные соединения формулы (V) могут быть получены посредством известных из уровня техники методов путем взаимодействия имеющегося в продаже 4-метокси-2-оксо-1,2-дигидропиридин-3 карбонитрила с алкилирующим агентом формулы (VI), где Z представляет собой подходящую уходящую группу, такую как, например, галогено, например бром и подобную, в соответствии со схемой взаимодействия (5). Примером алкилирующего агента формулы (VI) является, например, циклопропилметилбромид. Взаимодействие может быть осуществлено в инертном растворителе, таком как, например, ацетонитрил, с использованием подходящего основания, такого как, например, K2CO3, и, возможно, йодной соли, такой как, например, KI, при умеренно высокой температуре, такой как, например, 120C. В схеме взаимодействия (5) все переменные такие, как определено в формуле (I). Схема взаимодействия (5) Экспериментальный метод 6. Промежуточные соединения формулы (III) могут быть получены известными из уровня техники методами путем взаимодействия промежуточного соединения формулы (VII), где А' представляет собой пиридинильную группировку А, как определено в описании изобретения выше для формулы (I), или ееN-оксид, с подходящим источником бора, таким как, например, бис(пинаколато)диборан в присутствии подходящего палладиевого катализатора, такого как, например, 1,1'-бис(дифенилфосфино)ферроценпалладия(II)дихлорид, в соответствии со схемой взаимодействия (6). Взаимодействие может быть осуществлено в инертном растворителе, таком как, например, дихлорметан, в присутствии подходящей соли, такой как, например, калия ацетат, при умеренно повышенной температуре, такой как, например, 110C, в течение, например, 16 ч. Альтернативно, промежуточные соединения формулы (III) также могут быть получены известными из уровня техники методами обмена металл-галоген и последующего взаимодействия с подходящим источником бора из промежуточных соединений формулы (VII). Например, промежуточное соединение формулы (VII) может взаимодействовать с литийорганическим соединением, таким как, например, нбутиллитий, при умеренно низкой температуре, такой как, например, -40C, в инертном растворителе,таком как, например, THF, с последующим взаимодействием с соответствующим источником бора, таким как, например, триметоксиборан. В схеме взаимодействия (6) все переменные определены, как в формуле (I) или как они определены в описании изобретения выше. Схема взаимодействия (6) Экспериментальный метод 7. Промежуточные соединения формулы (VII) могут быть получены известными из уровня техники методами путем взаимодействия гидроксифенольного промежуточного соединения формулы (VIII) с подходящим промежуточным соединением формулы (IX), где X представляет собой подходящую уходящую группу, такую как, например, галогено или нитро, в соответствии со схемой взаимодействия (7). Примерами промежуточных соединений формулы (IX) являются 2,3-диметил-4-нитропиридин 1-оксид и 2-бром-4,6-диметилпиридин. Взаимодействие может быть осуществлено в инертном растворителе, таком как, например, диметилформамид или ксилол, в присутствии подходящего основания, такого как, например, натрия гидрид или калия карбонат, при умеренно повышенной температуре, такой как, например, 180C, в течение, например, 60 мин при нагревании либо классическом, либо посредством микроволнового излучения. В схеме взаимодействия (7) все переменные определены, как в формуле (I). Экспериментальный метод 8. Промежуточные соединения формулы (VII), где А' представляет собой А, причем указанные промежуточные соединения представлены формулой (VII-a), могут быть получены известными из уровня техники методами из анилиноподобного промежуточного соединения формулы (X) посредством взаимодействия зандмейеровского типа в соответствии со схемой взаимодействия (8). В схеме взаимодействия (8) все переменные определены, как в формуле (I). Схема взаимодействия (8) Экспериментальный метод 9. Промежуточные соединения формулы (X) могут быть получены известными из уровня техники методами из соответствующего промежуточного нитросоединения формулы (XI) путем восстановления нитрогруппы до функциональной аминогруппы методами, известными из уровня техники, такими как каталитическое гидрирование с использованием подходящего катализатора, такого как, например, 10%ный палладий на активированном угле, или применение дигидрата хлорида олова(II) в качестве восстановителя, в соответствии со схемой взаимодействия (9). В схеме взаимодействия (9) все переменные определены, как в формуле (I). Схема взаимодействия (9) Экспериментальный метод 10. Промежуточные соединения формулы (XI) могут быть получены известными из уровня техники методами путем взаимодействия промежуточного соединения формулы (XII) с подходящим гидроксипиридильным промежуточным соединением формулы (XIII), таким как, например, 2-метил-3 гидроксипиридин, в соответствии со схемой взаимодействия (10). Взаимодействие может быть осуществлено в инертном растворителе, таком как, например, тетрагидрофуран, в присутствии подходящего основания, такого как, например, карбонат цезия, при умеренно повышенной температуре, такой как, например, 140C, в течение, например, 16 ч. В схеме взаимодействия (10) все переменные определены, как в формуле (I). Схема взаимодействия (10) Фармакология Соединения, предложенные в данном изобретении, являются положительными аллостерическими модуляторами метаботропных глутаматных рецепторов, в частности, они являются положительными аллостерическими модуляторами mGluR2. Соединения по настоящему изобретению, по-видимому, связываются не с сайтом распознавания глутамата, сайтом ортостерического лиганда, а, вместо этого, с аллостерическим сайтом в пределах семи трансмембранных областей рецептора. В присутствии глутамата или агониста mGluR2 соединения по данному изобретению увеличивают mGluR2-ответ. Соединения,предложенные в данном изобретении, как ожидается, воздействуют на mGluR2 посредством своей способности усиливать ответ таких рецепторов на глутамат или агонисты mGluR2, усиливая ответ рецепто- 11017267 ра. Следовательно, настоящее изобретение относится к соединению по настоящему изобретению для применения в качестве лекарственного средства, а также к применению соединения в соответствии с изобретением или фармацевтической композиции в соответствии с изобретением для изготовления лекарственного средства для лечения или предупреждения, в частности лечения, состояния млекопитающего, включая человека, лечение или предупреждение которого поддается воздействию или облегчается нейромодуляторным эффектом аллостерических модуляторов mGluR2, в частности его положительных аллостерических модуляторов. Настоящее изобретение также относится к соединению по настоящему изобретению или к фармацевтической композиции по изобретению для применения в изготовлении лекарственного средства для лечения или предупреждения, в частности лечения, состояния млекопитающего, включая человека, лечение или предупреждение которого поддается воздействию или облегчается нейромодуляторным эффектом аллостерических модуляторов mGluR2, в частности его положительных аллостерических модуляторов. Настоящее изобретение также относится к соединению по настоящему изобретению или к фармацевтической композиции по изобретению для лечения или предупреждения, в частности лечения, состояния млекопитающего, включая человека, лечение или предупреждение которого поддается воздействию или облегчается нейромодуляторным эффектом аллостерических модуляторовmGluR2, в частности его положительных аллостерических модуляторов. Также настоящее изобретение относится к применению соединения по изобретению или фармацевтической композиции по изобретению для изготовления лекарственного средства для лечения, предупреждения, облегчения, контроля или уменьшения риска различных неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией у млекопитающего, включая человека, лечение или предупреждение которого поддается воздействию или облегчается нейромодуляторным эффектом положительных аллостерических модуляторов mGluR2. Когда указано, что изобретение относится к применению соединения или композиции по изобретению для изготовления лекарственного средства для, например, лечения млекопитающего, следует понимать, что такое применение следует интерпретировать в некоторых сферах действия как способ, например, лечения млекопитающего, включающий введение млекопитающему с необходимостью в таком, например, лечении эффективного количества соединения или композиции по изобретению. В частности, неврологические и психиатрические расстройства, ассоциированные с глутаматной дисфункцией, включают одно или более из следующих состояний или заболеваний: острые неврологические и психиатрические расстройства, такие как, например, недостаточность мозгового кровообращения после хирургической операции сердечного шунтирования и трансплантации, инсульт, церебральная ишемия, травма спинного мозга, травма головы, перинатальная гипоксия, остановка сердца, гипогликемическое повреждение нейронов, деменция (включая СПИД-индуцированную деменцию), болезнь Альцгеймера, хорея Хантингтона, амиотрофический боковой склероз, повреждение глаз, ретинопатия, когнитивные расстройства, идиопатическая и индуцированная лекарственными средствами болезнь Паркинсона, мышечные спазмы и расстройства, ассоциированные с мышечной спастичностью, включая треморы,эпилепсия, конвульсии, мигрень (включая мигреневую головную боль), недержание мочи, толерантность к веществам, синдром абстиненции при отмене веществ (включая такие вещества, как, например, опиаты, никотин, табачные продукты, алкоголь, бензодиазепины, кокаин, седативные средства, снотворные средства и т.д.), психоз, шизофрения, тревога (включая генерализованное тревожное расстройство, паническое расстройство, и обсессивно-компульсивное расстройство), расстройства настроения (включая депрессию, манию, биполярное расстройство), невралгия тройничного нерва, потеря слуха, шум в ушах,дегенерация желтого пятна глаз, рвота, отек головного мозга, боль (включая острые и хронические состояния, сильную боль, некупирумую боль, невропатическую боль и пост-травматическую боль), поздняя дискинезия, расстройства сна (включая нарколепсию), расстройство дефицита внимания/гиперактивности и расстройство поведения. В частности, настоящее изобретение относится к применению соединения по настоящему изобретению для изготовления лекарственного средства для лечения или предупреждения, в частности для лечения, расстройства центральной нервной системы, выбранного из группы тревожных расстройств, психотических расстройств, расстройств личности, расстройств, связанных с веществами, расстройств питания, расстройств настроения, мигрени, эпилепсии или судорожных расстройств, детских расстройств,когнитивных расстройств, нейродегенерации, нейротоксичности и ишемии. Предпочтительно расстройство центральной нервной системы представляет собой тревожное расстройство, выбранное из группы агорафобия, генерализованное тревожное расстройство (GAD), обсессивно-компульсивное расстройство (OCD), паническое расстройство, посттравматическое стрессовое расстройство (PTSD), социофобия и другие фобии. Предпочтительно расстройство центральной нервной системы представляет собой психотическое расстройство, выбранное из группы шизофрения, бредовое расстройство, шизоаффективное расстройство, шизофреноформное расстройство и индуцированное веществами психотическое расстройство. Предпочтительно расстройство центральной нервной системы представляет собой расстройство личности, выбранное из группы обсессивное-компульсивное расстройство личности и шизоидное, шизотипическое расстройство.- 12017267 Предпочтительно расстройство центральной нервной системы представляет собой расстройство,связанное с веществами, выбранное из группы: злоупотребление алкоголем, алкогольная зависимость,синдром алкогольной абстиненции, делирий при алкогольной абстиненции, алкоголь-индуцированное психотическое расстройство, амфетаминовая зависимость, амфетаминовая абстиненция, кокаиновая зависимость, кокаиновая абстиненция, никотиновая зависимость, никотиновая абстиненция, опиоидная зависимость и опиоидная абстиненция. Предпочтительно расстройство центральной нервной системы представляет собой расстройство питания, выбранное из группы нервная анорексия и нервная булимия. Предпочтительно расстройство центральной нервной системы представляет собой расстройство настроения, выбранное из группы биполярное расстройств (I и II), циклотимическое расстройство, депрессия, дистимическое расстройство, глубокое депрессивное расстройство и индуцированное веществом расстройство настроения. Предпочтительно расстройство центральной нервной системы представляет собой мигрень. Предпочтительно расстройство центральной нервной системы представляет собой эпилепсию или судорожное расстройство, выбранное из группы генерализованная несудорожная эпилепсия, генерализованная судорожная эпилепсия, малый эпилептический припадок, большой эпилептический припадок,парциальная эпилепсия с нарушением сознания или без нарушения сознания, младенческие судороги,эпилепсия парциальная непрерывная (Кожевникова) и другие формы эпилепсии. Предпочтительно расстройство центральной нервной системы представляет собой расстройство дефицита внимания/гиперактивности. Предпочтительно расстройство центральной нервной системы представляет собой когнитивное расстройство, выбранное из группы делирий, индуцированный веществом персистирующий делирий,деменция, деменция вследствие ВИЧ-заболевания, деменция вследствие болезни Хантингтона, деменция вследствие болезни Паркинсона, деменция альцгеймеровского типа, персистирующая деменция, индуцированная веществом и умеренное когнитивное нарушение. Из упомянутых выше расстройств лечение тревоги, шизофрении, мигрени, депрессии и эпилепсии являются особенно важными. В настоящее время в четвертом издании DiagnosticStatistical Manual Mental Disorders (DSM-IV) Американской психиатрической ассоциации предлагается диагностический инструмент идентификация расстройств, описанных в описании изобретения. Специалист в данной области техники понимает, что существуют альтернативные терминологии, нозологии и классификационные системы неврологических и психиатрических расстройств, описанных в данном описании изобретения, и что они будут развиваться вместе с развитием медицины и науки. Так как такие положительные аллостерические модуляторы mGluR2, включая соединения по настоящему изобретению, усиливают ответ mGluR2 на глутамат, преимуществом является то, что в настоящих способах используют эндогенный глутамат. Так как положительные аллостерические модуляторы mGluR2, включая соединения по настоящему изобретению, усиливают ответ mGluR2 на агонисты, понятно, что настоящее изобретение распространяется на лечение неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией, путем введения эффективного количества положительного аллостерического модулятораmGluR2, включая соединения по настоящему изобретению, в комбинации с агонистом mGluR2. Соединения по настоящему изобретению можно использовать в комбинации с одним или более другими лекарственными средствами в лечении, предупреждении, контроле, облегчении или уменьшении риска заболеваний или состояний, для которых соединения по настоящему изобретению или другие лекарственные средства могут быть полезны, где комбинация лекарственных средств вместе является более безопасной или более эффективной, чем любое из лекарственных средств само по себе. Фармацевтические композиции Данное изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или разбавитель и в качестве активного ингредиента терапевтически эффективное количество соединения по изобретению, в частности соединения по настоящему изобретению, включая его стереохимически изомерные формы или его фармацевтически приемлемую соль или сольват. Соединения по изобретению, в частности соединения по настоящему изобретению, включая их стереохимически изомерные формы, или их фармацевтически приемлемые соль или сольват, или какуюлибо их подгруппу или комбинацию, могут быть приготовлены с целью введения в виде препарата в различных фармацевтических формах. В качестве подходящих композиций могут быть упомянуты все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтической композиции по данному изобретению эффективное количество конкретного соединения, возможно, в солевой форме в качестве активного ингредиента объединяют в однородную смесь с фармацевтически приемлемым носителем или разбавителем, где носитель или разбавитель может принимать широкий ряд форм в зависимости от формы препарата, желательной для введения. Эти фармацевтические композиции желательны в единой лекарственной форме, подходящей, в частности, для перорального, ректального, чрескожного введения, путем парантеральной инъекции или- 13017267 ингаляции. Например, при получении композиции в пероральной лекарственной форме, можно использовать любую из обычных фармацевтических сред, такую как, например, вода, гликоли, масла, спирты и подобные, в случае пероральных жидких препаратов, таких как, например, суспензии, сиропы, эликсиры,эмульсии и растворы; или твердые носители, такие как, например, крахмалы, сахара, каолин, разбавители, смазывающие агенты, связывающие вещества, разрыхлители и подобные, в случае порошков, пилюль, капсул и таблеток. Из-за легкости введения пероральное введение является предпочтительным, и таблетки и капсулы являются наиболее предпочтительными пероральными формами дозированных единиц, причем в этом случае, как очевидно, используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно содержит стерильную воду, по меньшей мере, большей частью,хотя могут быть включены другие ингредиенты, например способствующие растворению. Могут быть получены, например, инъецируемые растворы, в которых носитель включает физиологический раствор,раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть получены инъецируемые суспензии, где могут быть использованы подходящие жидкие носители, суспендирующие агенты и подобное. Также включены твердые препараты, которые, как предполагается, будут превращены незадолго до применения в жидкие препараты. В композициях, подходящих для чрескожного введения, носитель возможно включает агент усиления проницаемости и/или подходящий увлажнитель, возможно объединенный с подходящими добавками любой природы в минорных пропорциях, причем добавки не оказывают значительного дополнительного вредного влияния на кожу. Указанные добавки могут облегчать введение на кожу и/или могут быть полезны для получения желательной композиции. Эти композиции могут быть введены различными способами, например в виде трансдермального пластыря, в виде точечного нанесения, в виде мази. Особенно предпочтительно приготовить вышеупомянутые фармацевтические композиции в стандартной лекарственной форме для легкости введения и однородности дозировки. Стандартная лекарственная форма при использовании в данном описании изобретения относится к физически отдельной единице, пригодной в качестве однократных дозировок, причем каждая единица содержит предварительно определенное количество активного ингредиента, рассчитанное так, чтобы получить желательный терапевтический эффект, вместе с требующимся фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с насечкой или покрытые оболочкой),капсулы, пилюли, пакеты с порошком, облатки, суппозитории, инъецируемые растворы или суспензии и подобное и их обособленные составные части. Точная дозировка и частота введения зависят от конкретного используемого соединения по настоящему изобретению, конкретного состояния, которое лечат, тяжести состояния, которое лечат, возраста, массы, пола, степени расстройства и общего физического состояния конкретного пациента, а также других медикаментозных лечений, которые может принимать индивидуум, как хорошо известно специалистам в данной области. Кроме того, очевидно, что указанное эффективное суточное количество может быть уменьшено или увеличено в зависимости от ответа субъекта, которого лечат, и/или в зависимости от оценки врача, предписывающего соединения по настоящему изобретению. В зависимости от способа введения, фармацевтическая композиция содержит от 0,05 до 99 мас.%,предпочтительно от 0,1 до 70 мас.%, более предпочтительно от 0,1 до 50 мас.% активного ингредиента и от 1 до 99,95 мас.%, предпочтительно от 30 до 99,9 мас.%, более предпочтительно от 50 до 99,9 мас.% фармацевтически приемлемого носителя, где все проценты основаны на общей массе композиции. Как уже упомянуто, изобретение также относится к фармацевтической композиции, содержащей соединения по изобретению и одно или более чем одно другое лекарственное средство, в лечении, предупреждении, контроле, облегчении или уменьшении риска заболеваний или состояний, для которых могут быть полезны соединения по настоящему изобретению или другие лекарственные средства, а также к применению такой композиции для изготовления лекарственного средства. Настоящее изобретение также относится к комбинации соединения по настоящему изобретению и mGluR2 ортостерического агониста. Настоящее изобретение также относится к такой комбинации для применения в качестве лекарственного средства. Настоящее изобретение также относится к продукту, содержащему (а) соединение по настоящему изобретению, его фармацевтически приемлемую соль или сольват, и (б) mGluR2 ортостерический агонист,в виде комбинированного препарата для одновременного, раздельного или последовательного применения в лечении или предупреждении состояния млекопитающего, включая человека, лечение или предупреждение которого поддается воздействию или облегчается нейромодуляторным эффектом mGluR2 аллостерических модуляторов, в частности положительных mGluR2 аллостерических модуляторов. Различные лекарственные средства в такой комбинация или продукте могут быть объединены в одном препарате вместе с фармацевтически приемлемыми носителями или разбавителями или каждый из них может присутствовать в отдельном препарате вместе с фармацевтически приемлемыми носителями или разбавителями. Следующие примеры, как предполагается, иллюстрируют, но не ограничивают объем настоящего изобретения. Экспериментальная часть Некоторые способы получения соединений по данному изобретении показаны в следующих приме- 14017267 рах. Если не указано иное, все исходные вещества получали из коммерческих источников и использовали без дополнительной очистки. Более конкретно, следующие сокращения могут быть использованы в примерах и в тексте описания. Все ссылки на рассол относятся к насыщенному водному раствору NaCl. Если не указано иное, все температуры выражены в C (градусы Цельсия). Все реакции осуществляют в инертной атмосфере при комнатной температуре, если не указано иное. Взаимодействия с участием микроволн осуществляли в одномодовом реакторе: микроволновый реактор Emrys Optimizer (Personal Chemistry А.В., в настоящее время Biotage) или в мультимодовом реакторе MicroSYNTH Labstation (Milestone, Inc.). А. Получение промежуточных соединений. Пример А.1. 1-Циклопропилметил-4-метокси-2-оксо-1,2-дигидропиридин-3-карбонитрил (промежуточное соединение 1). К раствору 4-метокси-2-оксо-1,2-дигидропиридин-3-карбонитрила (12,2 г, 81,48 ммоль) в ацетонитриле (250 мл) добавляли (бромметил)циклопропан (11 г, 81,48 ммоль) и карбонат калия (22,48 г, 162,9 ммоль) и смесь нагревали при 110C в течение 24 ч. Смесь охлаждали до комнатной температуры и твердое вещество отфильтровывали. Фильтрат упаривали досуха и полученный неочищенный остаток затем растирали с диэтиловым эфиром с получением чистого промежуточного соединения 1 (15,72 г, 94%) в виде белого твердого вещества. Пример А.2. 1-Бутил-4-метокси-2-оксо-1,2-дигидропиридин-3-карбонитрил (промежуточное соединение 2).(800 мл) добавляли 1-бромбутан (15,8 мл, 146 ммоль) и карбонат калия (36,7 г, 266 ммоль) и смесь нагревали при 110C в течение 24 ч. Смесь охлаждали до комнатной температуры и твердое вещество отфильтровывали. Фильтрат упаривали досуха и полученный неочищенный остаток затем растирали с диэтиловым эфиром с получением чистого промежуточного соединения 2 (27,39 г, 99%) в виде белого твердого вещества. Пример А.3. 1-Циклопропилметил-4-гидрокси-2-оксо-1,2-дигидропиридин-3-карбонитрил (промежуточное соединение 3). Промежуточное соединение 1 (15,7 г, 76,8 ммоль) добавляли при комнатной температуре к 1 н. водному раствору гидроксида натрия (300 мл) и THF (50 мл). Реакционную смесь нагревали при 140C (температура масляной бани) в течение 16 ч. Смесь охлаждали до комнатной температуры и большую частьTHF упаривали в вакууме. Водный слой охлаждали до 0C и подкисляли добавлением водной 2 н. HCl,доводя значение pH до примерно 3, при котором осаждалось белое твердое вещество. Твердое вещество отфильтровывали, промывали Et2O и сушили в вакууме с получением промежуточного соединения 3 в виде белого твердого вещества (10,44 г, 71%), которое использовали без дополнительной очистки. Промежуточное соединение 2 (27,39 г, 133 ммоль) добавляли при комнатной температуре к 1 н. водному раствору гидроксида натрия (500 мл) и THF (100 мл). Реакционную смесь нагревали при 110C(температура масляной бани) в течение 24 ч. Смесь охлаждали до комнатной температуры и растворитель выпаривали в вакууме, пока объем не уменьшался до приблизительно 250 мл. Водный слой затем охлаждали до 0C и подкисляли добавлением водной 2 н. HCl, доводя значение pH до примерно 3, при котором осаждалось белое твердое вещество. Твердое вещество отфильтровывали, промывали Et2O и сушили в вакууме с получением промежуточного соединения 4 в виде белого твердого вещества (25 г,98%), которое использовали без дополнительной очистки. Пример А.5. 4-Бром-1-циклопропилметил-2-оксо-1,2-дигидропиридин-3-карбонитрил (промежуточное соединение 5). К раствору промежуточного соединения 3 (10,4 г, 54,67 ммоль) в DMF (250 мл) добавляли фосфорилтрибромид (31,3 г, 109,3 ммоль) и смесь нагревали при 110C в течение 1,5 ч. После охлаждения в ледяной бане раствор разделяли между водой и EtOAc. После трех экстракций EtOAc объединенные органические фракции промывали рассолом, сушили над MgSO4, растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения 5 (8,83 г, 64%). Пример А.6. 4-Бром-1-бутил-2-оксо-1,2-дигидропиридин-3-карбонитрил (промежуточное соединение 6). К раствору промежуточного соединения 4 (39 г, 203 ммоль) в DMF (600 мл) добавляли фосфорилтрибромид (116 г, 406 ммоль) и смесь нагревали при 110C в течение 1,5 ч. После охлаждения в ледяной бане раствор разделяли между водой и EtOAc. После трех экстракций EtOAc объединенные органические фракции промывали рассолом, сушили над Na2SO4 и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения 6 (36,7 г, 72%). Пример А.7. 2-(4-Бром-3-фторфенокси)-4,6-диметилпиридин (промежуточное соединение 7). Смесь 2-бром-4,6-диметилпиридина (1 г, 5,4 ммоль), 4-бром-3-фторфенола (1,03 г, 5,4 ммоль) и карбоната калия (0,89 г, 6,4 ммоль) нагревали при 150C (температура масляной бани) в герметичной пробирке в течение 7 суток. После охлаждения до комнатной температуры смесь разбавляли DCM и фильтровали через подушку диатомитовой земли. Фильтрат упаривали досуха, и неочищенный продукт,полученный таким образом, очищали колоночной хроматографией (силикагель; DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения 7 (1,1 г, 53%). Пример А.8. 2-[3-Фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенокси]-4,6-диметилпиридин (промежуточное соединение 8). К раствору промежуточного соединения 7 (0,5 г, 1,69 ммоль) в 1,4-диоксане (9 мл) и DMF (1 мл) добавляли бис(пинаколато)диборан (0,643 г, 2,53 ммоль) и ацетат калия (0,497 г, 5,06 ммоль). Смесь дегазировали, и затем добавляли [1,1'-бис(дифенилфосфино)ферроцен]-дихлорпалладий(II); комплекс сDCM (1:1) (0,0413 г, 0,05 ммоль; CAS [95464-05-4]). Реакционную смесь нагревали при 150C в течение 40 мин под микроволновым излучением. После охлаждения до комнатной температуры добавляли воду,и смесь экстрагировали EtOAc. Органическую фракцию сушили (Na2SO4), и растворитель выпаривали в вакууме с получением желательного промежуточного соединения 8 (0,6 г, 100%) в виде неочищенного продукта, который использовали без дополнительной очистки. Пример А.9. 3-(2-Фтор-4-нитрофенокси)-2,6-диметилпиридин (промежуточное соединение 9). К раствору 2,6-диметил-3-пиридинола (3 г, 24,35 ммоль) в THF (30 мл) комнатной температуры добавляли карбонат цезия (15,87 г, 48,71 ммоль) и 3,4-дифтор-1-нитробензол (3,87 г, 24,35 ммоль). Реакционную смесь нагревали при кипении с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры твердые вещества отфильтровывали и фильтрат упаривали досуха. Неочищенный продукт очищали колоночной хроматографией (силикагель; от DCM до DCM/MeOH(NH3) вплоть до 2% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения 9 (5,88 г, 92%). Пример А.10. 4-(2,6-Диметилпиридин-3-илокси)-3-фторфениламин (промежуточное соединение 10). Раствор промежуточного соединения 9 (5,88 г, 22,44 ммоль) в этаноле (200 мл) гидрировали при комнатной температуре в присутствии 10%-ного палладия на активированном угле (0,58 г) в течение 3 ч. Твердые вещества отфильтровывали, и фильтрат упаривали досуха с получением промежуточного соединения 10 (5,20 г, 99%), которое использовали без дополнительной очистки. Пример А.11. 3-(4-Бром-2-фторфенокси)-2,6-диметилпиридин (промежуточное соединение 11). К раствору промежуточного соединения 10 (7,7 г, 33,2 ммоль) в HBr (75 мл, 48%-ный водный), охлажденному до 0C, по каплям добавляли раствор нитрита натрия (4,57 г, 66,3 ммоль) в воде (75 мл) в течение 45 мин. Реакционную смесь нагревали до комнатной температуры и дополнительно перемешивали в течение 15 мин. Смесь охлаждали до 0C и по частям добавляли бромид меди(I) (4,0 г, 28,4 ммоль). Перемешивание продолжали в течение 15 мин при 0C и затем смесь нагревали до комнатной температуры и дополнительно перемешивали в течение 15 мин. Реакционную смесь затем нагревали при 140C в течение 1,5 ч. Смесь охлаждали до комнатной температуры и осторожно нейтрализовали водным насыщенным раствором карбоната калия. Затем добавляли EtOAc и слои разделяли. Органическую фазу сушили (Na2SO4) и упаривали досуха. Неочищенный продукт очищали колоночной хроматографией (силикагель; гептан до гептан/EtOAc вплоть до 10% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения 11 (8,75 г, 89%). К раствору промежуточного соединения 11 (1,5 г, 5,07 ммоль) в 1,4-диоксане (9 мл) и DMF (3 мл) добавляли бис(пинаколато)диборан (3,86 г, 15,2 ммоль) и ацетат калия (1,48 г, 15,2 ммоль). Смесь дегазировали и затем добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II); комплекс с DCM(1:1) (0,16 г, 0,20 ммоль; CAS [95464-05-4]). Реакционную смесь нагревали при 150C в течение 10 мин под микроволновым излучением. После охлаждения до комнатной температуры добавляли воду и смесь экстрагировали EtOAc. Органическую фракцию сушили (Na2SO4) и растворитель выпаривали в вакууме с получением нужного боратного промежуточного соединения 12 (1,74 г, 100%) в виде неочищенного продукта, который использовали без дополнительной очистки. Пример А.13. 4-(4-Бром-3-фторфенокси)-2-метилпиридин-1-оксид (промежуточное соединение 13).(20 мл) по частям добавляли гидрид натрия (1,34 г, 56 ммоль, 60% в минеральное масло). После перемешивания в течение 10 мин добавляли 4-нитро-2-пиколин-N-оксид (5,6 г, 36,12 ммоль). Реакционную смесь нагревали при 180C в течение 60 мин под микроволновым излучением. После охлаждения до комнатной температуры смесь разбавляли EtOAc (250 мл) и промывали водой (250 мл). Раствор затем экстрагировали дополнительным EtOAc (2150 мл). Объединенные органические экстракты сушили(Na2SO4) и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; от DCM до DCM/MeOH(NH3) вплоть до 2% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения 13 (3,61 г, 39%). Пример А.14. 2-Фтор-4-(2-метил-4-пиридилокси)фенилбороновая кислота (промежуточное соединение 14). К раствору промежуточного соединения 13 (1,05 г, 3,52 ммоль) в 1,4-диоксане (9 мл) и DMF (4 мл) добавляли бис(пинаколато)диборан (2,68 г, 10,56 ммоль) и ацетат калия (1,035 г, 10,56 ммоль). Смесь дегазировали и затем добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II); комплекс сDCM (1:1) (0,115 г, 0,141 ммоль; CAS [95464-05-4]). Реакционную смесь нагревали при 150C в течение 15 мин под микроволновым излучением. После охлаждения до комнатной температуры добавляли воду и смесь экстрагировали EtOAc (20 мл). Органическую фракцию сушили (Na2SO4) и растворитель выпаривали в вакууме с получением желательного боратного промежуточного соединения 14 (0,87 г, 100%) в виде неочищенного продукта, который использовали без дополнительной очистки. Пример А.15. 4-(4-Бром-2-фторфенокси)-2-метилпиридин-1-оксид (промежуточное соединение 15). К раствору 4-бром-2-фторфенола (3,44 мл, 31,41 ммоль) в N-метилпирролидоне (20 мл) комнатной температуры по частям добавляли натрия гидрид (1,34 г, 56 ммоль, 60% в минеральном масле). После перемешивания в течение 20 мин добавляли 4-нитро-2-пиколин-N-оксид (5,6 г, 36,12 ммоль), реакционную смесь нагревали при 180C в течение 60 мин под микроволновым излучением. После охлаждения до комнатной температуры смесь разбавляли EtOAc (250 мл) и промывали водой (250 мл). Раствор затем экстрагировали дополнительно EtOAc (2150 мл). Объединенные органические экстракты сушили(Na2SO4) и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; DCM до DCM/MeOH(NH3) вплоть до 2% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения 15 (4,36 г, 47%). Пример А.16. 3-Фтор-4-(2-метил-4-пиридилокси)фенилбороновая кислота (промежуточное соединение 16). К раствору промежуточного соединения 15 (1,05 г, 3,52 ммоль) в 1,4-диоксане (9 мл) и DMF (4 мл) добавляли бис(пинаколато)диборан (2,68 г, 10,56 ммоль) и ацетат калия (1,035 г, 10,56 ммоль). Смесь дегазировали и затем добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II); комплекс сDCM (1:1) (0,115 г, 0,141 ммоль; CAS [95464-05-4]). Реакционную смесь нагревали при 150C в течение 15 мин под микроволновым излучением. После охлаждения до комнатной температуры добавляли воду и смесь экстрагировали EtOAc (20 мл). Органические фракции сушили (Na2SO4) и растворитель выпаривали в вакууме с получением нужного боратного промежуточного соединения 16 (0,87 г, 100%) в виде неочищенного продукта, который использовали без дополнительной очистки. Пример А.17. 4-(4-Бром-3-фторфенокси)-2,6-диметилпиридин (промежуточное соединение 17). Смесь 4-бром-2,6-диметилпиридина (1 г, 5,4 ммоль), 4-бром-3-фторфенола (0,59 г, 5,4 ммоль) и карбоната калия (0,89 г, 6,4 ммоль) в ксилолах (2 мл) нагревали при 150C (температура масляной бани) в герметичной пробирке в течение 48 ч. После охлаждения до комнатной температуры смесь разбавлялиEtOAc и фильтровали через подушку диатомитовой земли. Фильтрат упаривали досуха и неочищенный продукт, полученный таким образом, очищали колоночной хроматографией (силикагель; от DCM доDCM/EtOAc вплоть до 10% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения 17 (1,18 г, 72%). Пример А.18. 4-[3-Фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенокси]-2,6-диметилпиридин (промежуточное соединение 18). К раствору промежуточного соединения 17 (1 г, 3,37 ммоль) в 1,4-диоксане (10,8 мл) и DMF (1,2 мл) добавляли бис(пинаколато)диборан (1,286 г, 5,06 ммоль) и ацетат калия (0,994 г, 10,13 ммоль). Смесь дегазировали и затем добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II); комплекс сDCM (1:1) (0,0827 г, 0,101 ммоль; CAS [95464-05-4]). Реакционную смесь нагревали при 150C в течение 10 мин под микроволновым излучением. После охлаждения до комнатной температуры добавляли воду и смесь экстрагировали EtOAc. Органическую фракцию сушили (Na2SO4) и растворитель выпаривали в вакууме с получением желательного боратного промежуточного соединения 18 (1,14 г, 100%) в виде неочищенного продукта, который использовали без дополнительной очистки. Пример А.19. 4-(4-Бром-2-фторфенокси)-2,6-диметилпиридин (промежуточное соединение 19). Смесь 4-бром-2,6-диметилпиридина (1 г, 5.4 ммоль), 4-бром-2-фторфенола (0,59 г, 5.4 ммоль) и карбоната калия (0,89 г, 6,4 ммоль) в ксилолах (2 мл) нагревали при 150C (температура масляной бани) в герметичной пробирке в течение 48 ч. После охлаждения до комнатной температуры смесь разбавлялиEtOAc и фильтровали через подушку диатомитовой земли. Фильтрат упаривали досуха и неочищенный продукт, полученный таким образом, очищали колоночной хроматографией (силикагель; от DCM доDCM/EtOAc вплоть до 10% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения 19 (1,28 г, 80%). Пример А.20. 4-[2-Фтор-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенокси]-2,6-диметилпиридин (промежуточное соединение 20). К раствору промежуточного соединения 19 (1 г, 3,37 ммоль) в 1,4-диоксане (10,8 мл) и DMF (1,2 мл) добавляли бис(пинаколато)диборан (1,286 г, 5,06 ммоль) и ацетат калия (0,994 г, 10,13 ммоль). Смесь дегазировали и затем добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II); комплекс сDCM (1:1) (0,0827 г, 0,101 ммоль; CAS [95464-05-4]). Реакционную смесь нагревали при 150C в течение 10 мин под микроволновым излучением. После охлаждения до комнатной температуры добавляли воду,и смесь экстрагировали EtOAc. Органическую фракцию сушили (Na2SO4) и растворитель выпаривали в вакууме с получением нужного боратного промежуточного соединения 20 (1,15 г, 100%) в виде неочищенного продукта, который использовали без дополнительной очистки. Пример А.21. 4-(4-Бром-3-фторфенокси)-2,3-диметилпиридин-1-оксид (промежуточное соединение 21). К раствору 4-бром-3-фторфенола (15 г, 78,53 ммоль) в DMF (50 мл) комнатной температуры по частям добавляли гидрид натрия (3,32 г, 85,67 ммоль, 60% в минеральном масле). После перемешивания в течение 10 мин добавляли 2,3-диметил-4-нитропиридин-1-оксид (1,05 г, 6,28 ммоль). Реакционную смесь нагревали при 180C в течение 60 мин под микроволновым излучением. После охлаждения до комнатной температуры смесь фильтровали через подушку диатомитовой земли и фильтрат затем разбавляли EtOAc и промывали водой. Раствор затем экстрагировали дополнительно EtOAc (2150 мл). Органический слой сушили (Na2SO4) и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; DCM до DCM/MeOH вплоть до 5% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения 21 (3,44 г, 19%). Пример А.22. 2-Фтор-4-(2,3-диметил-4-пиридилокси)фенилбороновая кислота (промежуточное соединение 22). К раствору промежуточного соединения 21 (0,40 г, 1,28 ммоль) в 1,4-диоксане (2,6 мл) и DMF (0,8 мл) добавляли бис(пинаколато)диборан (0,97 г, 3,84 ммоль) и ацетат калия (0,37 г, 3,84 ммоль). Смесь дегазировали и затем добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II); комплекс сDCM (1:1) (0,042 г, 0,051 ммоль; CAS [95464-05-4]). Реакционную смесь нагревали при 150C в течение 15 мин под микроволновым излучением. После охлаждения до комнатной температуры добавляли воду и смесь экстрагировали EtOAc. Органическую фракцию сушили (Na2SO4) и растворитель выпаривали в вакууме с получением нужного боратного промежуточного соединения 22 (0,334 г, 100%) в виде неочищенного продукта, который использовали без дополнительной очистки. Пример А.23. 4-(4-Бром-2-фторфенокси)-2,3-диметилпиридин-1-оксид (промежуточное соединение 23). К раствору 4-бром-2-фторфенола (1 г, 5,23 ммоль) в N-метилпирролидоне (10 мл) комнатной температуры по частям добавляли гидрид натрия (0,27 г, 6,79 ммоль, 60% в минеральном масле). После перемешивания в течение 10 мин добавляли 2,3-диметил-4-нитропиридин-1-оксид (1,05 г, 6,28 ммоль), реакционную смесь нагревали при 180C в течение 60 мин под микроволновым излучением. После охлаждения до комнатной температуры смесь фильтровали через подушку диатомитовой земли и фильтрат затем разбавляли EtOAc и промывали водой. Раствор затем экстрагировали дополнительно EtOAc (2150 мл). Органический слой сушили (Na2SO4) и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; от DCM до DCM/MeOH вплоть до 3% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения 23 (0,75 г, 46%). Пример А.24. 4-[2-Фтор-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенокси]-2,3-диметилпиридин (промежуточное соединение 24). К раствору промежуточного соединения 23 (0,420 г, 1,36 ммоль) в 1,4-диоксане (6 мл) и DMF (2 мл) добавляли бис(пинаколато)диборан (1,025 г, 4,03 ммоль) и ацетат калия (0,385 г, 4,03 ммоль). Смесь дегазировали и затем добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II); комплекс сDCM (1:1) (0,044 г, 0,054 ммоль; CAS [95464-05-4]). Реакционную смесь нагревали при 150C в течение 10 мин под микроволновым излучением. После охлаждения до комнатной температуры добавляли воду и смесь экстрагировали EtOAc. Органическую фракцию сушили (Na2SO4) и растворитель выпаривали в вакууме с получением нужного боратного промежуточного соединения 24 (1,41 г, 100%) в виде неочищенного продукта, который использовали без дополнительной очистки. Пример А.25. 4-(4-Бромфенокси)-2-метилпиридин (промежуточное соединение 25). К раствору NaH (60% в минеральном масле) (0,13 г, 3,25 ммоль) в DMF (5 мл) добавляли имеющийся в продаже 4-бромфенол (0,50 г, 2,89 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 10 мин. Затем добавляли 4-хлор-2-пиколин (0,30 г, 2,40 ммоль) и полученную реакционную смесь затем обрабатывали микроволнами при 150C в течение 10 мин. После охлаждения смесь- 21017267 разбавляли водой и экстрагировали Et2O. Объединенные органические слои сушили над Na2SO4 и концентрировали в вакууме. Остаток, полученный таким образом, очищали флэш-хроматографией (DCM) с получением промежуточного соединения 25 (0,52 г, 81%). Пример А.26. 4-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенокси]-2-метилпиридин (промежуточное соединение 26). К раствору промежуточного соединения 25 (0,50 г, 1,89 ммоль) в DMSO (5 мл) добавляли бис(пинаколато)дибор (0,72 г, 2,84 ммоль) и KOAc (0,56 г, 5,68 ммоль), раствор затем дегазировали, используя поток азота, и затем к реакционной смеси добавляли 1,1'-бис(дифенилфосфино)ферроценпалладия(II) дихлорид, DCM (0,05 г, 0,06 ммоль). Реакционную смесь затем нагревали при 110C в атмосфере азота в течение 16 ч. Реакционную смесь затем охлаждали до комнатной температуры и разбавляли водой и полученный раствор экстрагировали AcOEt. Органические фракции затем сушили над Na2SO4 и концентрировали в вакууме с получением промежуточного соединения 26 (0,58 г, 100%), используемого на следующей реакционной стадии без дополнительной очистки. Б. Получение конечных соединений. Пример Б.1. 1-Циклопропилметил-4-[4-(4,6-диметилпиридин-2-илокси)-2-фторфенил]-2-оксо-1,2 дигидропиридин-3-карбонитрил (соединение 1). К раствору промежуточного соединения 8 (1,42 ммоль) в 1,4-диоксане (6 мл) и насыщенному раствору NaHCO3 (5 мл) добавляли промежуточное соединение 5 (0,329 г, 1,3 ммоль). Полученный раствор дегазировали, используя поток азота, и к нему добавляли Pd(PPh3)4 (0,15 мг, 0,13 ммоль). Реакционную смесь затем обрабатывали микроволнами в герметичной пробирке при 140C в течение 5 мин. Полученную охлажденную реакционную смесь затем разбавляли EtOAc и фильтровали через подушку диатомитовой земли. Фильтрат промывали водой, сушили (Na2SO4) и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией (силикагель; от DCM до DCM/EtOAc вплоть до 10% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения 1, которое промывали диэтиловым эфиром и сушили в вакууме (0,207 г, 41%). Точка плавления: 137,0C. Пример Б.2. 1-Бутил-4-[4-(2,6-диметилпиридин-3-илокси)-3-фторфенил]-2-оксо-1,2-дигидропиридин-3-карбонитрил (соединение 2). К раствору промежуточного соединения 12 (2 ммоль) в 1,4-диоксане (6 мл) и насыщенному раствору NaHCO3 (6 мл) добавляли промежуточное соединение 6 (0,51 г, 2 ммоль). Полученный раствор дегазировали, используя поток азота, и к нему добавляли Pd(PPh3)4 (0,231 мг, 0,2 ммоль). Реакционную смесь затем обрабатывали микроволнами в герметичной пробирке при 150C в течение 10 мин. Полученную охлажденную реакционную смесь фильтровали через подушку диатомитовой земли и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией (силикагель;DCM до DCM/MeOH вплоть до 3% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения 2 (0,405 г, 52%). Точка плавления: 156,4C. Соединения 12, 14 и 16 (см. табл. 1) могут быть получены в соответствии с протоколом, описанным для соединения 2. К раствору промежуточного соединения 12 (2 ммоль) в 1,4-диоксане (6 мл) и насыщенному раствору NaHCO3 (6 мл) добавляли промежуточное соединение 5 (0,51 г, 2 ммоль). Полученный раствор дегазировали, используя поток азота, и к нему добавляли Pd(PPh3)4 (0,231 мг, 0,2 ммоль). Реакционную смесь затем обрабатывали микроволнами в герметичной пробирке при 150C в течение 10 мин. Полученную охлажденную реакционную смесь фильтровали через подушку диатомитовой земли и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией (силикагель; отDCM до DCM/MeOH вплоть до 3% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения 3 (0,445 г, 58%). Точка плавления: 152,7C. Пример Б.4. 1-Бутил-4-[2-фтор-4-(2-метилпиридин-4-илокси)фенил]-2-оксо-1,2-дигидропиридин-3 карбонитрил (соединение 4). К раствору промежуточного соединения 14 (1,77 ммоль) в 1,4-диоксане (6 мл) и насыщенному раствору NaHCO3 (6 мл) добавляли промежуточное соединение 6 (0,451 г, 1,77 ммоль). Полученный раствор дегазировали, используя поток азота, и к нему добавляли Pd(PPh3)4 (0,204 мг, 0,177 ммоль). Реакционную смесь затем обрабатывали микроволнами в герметичной пробирке при 150C в течение 10 мин. Полученную охлажденную реакционную смесь фильтровали через подушку диатомитовой земли и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией(силикагель; от DCM к DCM/MeOH вплоть до 3% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения 4 (0,45 г, 68%). Точка плавления: 127,1C. Соединения 13, 17, 19 и 20 (см. табл. 1) могут быть получены в соответствии с протоколом, описанным для соединения 4. Пример Б.5. 1-Бутил-4-[3-фтор-4-(2-метилпиридин-4-илокси)фенил]-2-оксо-1,2-дигидропиридин-3 карбонитрил (соединение 5). К раствору промежуточного соединения 16 (1,77 ммоль) в 1,4-диоксане (6 мл) и насыщенному раствору NaHCO3 (6 мл) добавляли промежуточное соединение 6 (0,451 г, 1,77 ммоль). Полученный раствор дегазировали, используя поток азота, и к нему добавляли Pd(PPh3)4 (0,204 мг, 0,177 ммоль). Реакционную смесь затем обрабатывали микроволнами в герметичной пробирке при 150C в течение 10 мин. Полученную охлажденную реакционную смесь фильтровали через подушку диатомитовой земли и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией(силикагель; от DCM до DCM/MeOH вплоть до 3% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения 5 (0,45 г, 68%). Точка плавления: 125,4C. Соединение 15 (см. табл. 1) может быть получено в соответствии с протоколом, описанным для со- 23017267 единения 5. Пример Б.6. 1-Бутил-4-[4-(2,6-диметилпиридин-4-илокси)-2-фторфенил]-2-оксо-1,2-дигидропиридин-3-карбонитрил (соединение 6). К раствору промежуточного соединения 18 (1,078 ммоль) в 1,4-диоксане (6 мл) и насыщенному раствору NaHCO3 (5 мл) добавляли промежуточное соединение 6 (0,25 г, 0,979 ммоль). Полученный раствор дегазировали, используя поток азота, и к нему добавляли Pd(PPh3)4 (0,113 мг, 0,098 ммоль). Реакционную смесь затем обрабатывали микроволнами в герметичной пробирке при 150C в течение 10 мин. Полученную охлажденную реакционную смесь фильтровали через подушку диатомитовой земли и подушку диатомитовой земли промывали EtOAc. Объединенные фильтраты промывали водой и органический слой разделяли, сушили (Na2SO4) и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией (силикагель; от DCM до DCM/MeOH вплоть до 2% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения 6, которое осаждали из диэтилового эфира (0,220 г, 57%). Точка плавления: 169,9C. Пример Б.7. 1-Бутил-4-[4-(2,6-диметилпиридин-4-илокси)-3-фторфенил]-2-оксо-1,2-дигидропиридин-3-карбонитрил (соединение 7). К раствору промежуточного соединения 20 (1,078 ммоль) в 1,4-диоксане (6 мл) и насыщенного раствора NaHCO3 (5 мл) добавляли промежуточное соединение 6 (0,25 г, 0,979 ммоль). Полученный раствор дегазировали, используя поток азота, и к нему добавляли Pd(PPh3)4 (0,113 мг, 0,098 ммоль). Реакционную смесь затем обрабатывали микроволнами в герметичной пробирке при 150C в течение 10 мин. Полученную охлажденную реакционную смесь фильтровали через подушку диатомитовой земли и подушку диатомитовой земли промывали EtOAc. Объединенные фильтраты промывали водой и органический слой разделяли, сушили (Na2SO4) и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией (силикагель; от DCM до DCM/MeOH вплоть до 2% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения 7, которое осаждали из диэтилового эфира (0,225 г, 59%). Точка плавления: 205,4C. Пример Б.8. 1-Циклопропилметил-4-[4-(2,6-диметилпиридин-4-илокси)-2-фторфенил]-2-оксо-1,2 дигидропиридин-3-карбонитрил (соединение 8). К раствору промежуточного соединения 18 (1,05 ммоль) в 1,4-диоксане (4,5 мл) и насыщенному раствору NaHCO3 (4,5 мл) добавляли промежуточное соединение 5 (0,22 г, 0,892 ммоль). Полученный раствор дегазировали, используя поток азота, и к нему добавляли Pd(PPh3)4 (0,13 мг, 0,114 ммоль). Реакционную смесь затем обрабатывали микроволнами в герметичной пробирке при 150C в течение 10 мин. Полученную охлажденную реакционную смесь фильтровали через подушку диатомитовой земли. Фильтрат разбавляли EtOAc и затем его промывали водой, сушили над Na2SO4 и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией (силикагель;DCM к DCM/MeOH вплоть до 5% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением остатка, который дополнительно очищали колоночной хроматографией (силикагель;DCM к DCM/EtOAc вплоть до 10% в качестве элюента). Нужные фракции собирали и упаривали в ва- 24017267 кууме с получением соединения 8, которое осаждали из диизопропилового эфира (0,176 г, 51%). Точка плавления: разлагается. Пример Б.9. 1-Циклопропилметил-4-[4-(2,6-диметилпиридин-4-илокси)-3-фторфенил]-2-оксо-1,2 дигидропиридин-3-карбонитрил (соединение 9). К раствору промежуточного соединения 20 (1,066 ммоль) в 1,4-диоксане (4,5 мл) и насыщенному раствору NaHCO3 (4,5 мл) добавляли промежуточное соединение 5 (0,23 г, 0,906 ммоль). Полученный раствор дегазировали, используя поток азота, и к нему добавляли Pd(PPh3)4 (0,12 мг, 0,106 ммоль). Реакционную смесь затем обрабатывали микроволнами в герметичной пробирке при 150C в течение 10 мин. Полученную охлажденную реакционную смесь фильтровали через подушку диатомитовой земли. Фильтрат разбавляли EtOAc и затем его промывали водой, сушили (Na2SO4) и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией (силикагель; DCM кDCM/EtOAc вплоть до 50% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения 9, которое осаждали из диэтилового эфира (0,144 г, 42%). Точка плавления: 201,2C. Пример Б.10. 1-Циклопропилметил-4-[4-(2,3-диметилпиридин-4-илокси)-2-фторфенил]-2-оксо-1,2 дигидропиридин-3-карбонитрил (соединение 10). К раствору промежуточного соединения 22 (0,34 г, 1,321 ммоль) в 1,4-диоксане (5,5 мл) и насыщенному раствору NaHCO3 (5,5 мл) добавляли промежуточное соединение 5 (0,28 г, 1,123 ммоль). Полученный раствор дегазировали, используя поток азота, и к нему добавляли Pd(PPh3)4 (0,15 мг, 0,132 ммоль). Реакционную смесь затем обрабатывали микроволнами в герметичной пробирке при 150C в течение 10 мин. Полученную охлажденную реакционную смесь фильтровали через подушку диатомитовой земли. Фильтрат разбавляли EtOAc и затем его промывали водой, сушили (Na2SO4) и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией (силикагель; DCM кDCM/AcOEt 1:1 в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением остатка, который растирали с Et2O с выходом соединения 10 (0,068 г, 16%). Пример Б.11. 1-Циклопропилметил-4-[4-(2,3-диметилпиридин-4-илокси)-3-фторфенил]-2-оксо-1,2 дигидропиридин-3-карбонитрил (соединение 11). К раствору промежуточного соединения 24 (1,769 ммоль) в 1,4-диоксане (7 мл) и насыщенному раствору NaHCO3 (7 мл) добавляли промежуточное соединение 5 (0,38 г, 1,504 ммоль). Полученный раствор дегазировали, используя поток азота, и к нему добавляли Pd(PPh3)4 (0,2 мг, 0,176 ммоль). Реакционную смесь затем обрабатывали микроволнами в герметичной пробирке при 150C в течение 10 мин. Полученную охлажденную реакционную смесь фильтровали через подушку диатомитовой земли. Фильтрат разбавляли EtOAc и затем его промывали водой, сушили (Na2SO4) и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией (силикагель; от DCM доDCM/MeOH вплоть до 5% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения 11, осажденного из диизопропилового эфира (0,190 г, 32%). Точка плавления: разлагается. Промежуточное соединение 6 (0,48 г, 1,89 ммоль) и промежуточное соединение 26 (0,59 г, 1,89 ммоль) смешивали в 1,4-диоксане (4 мл) и насыщенном растворе NaHCO3 (4 мл). Полученный раствор дегазировали, используя поток азота, и к нему добавляли Pd(PPh3)4 (0,22 г, 0,19 ммоль). Реакционную смесь затем обрабатывали микроволнами в герметичной пробирке при 150C в течение 10 мин. Полученную реакционную смесь затем фильтровали через подушку диатомитовой земли и промывали AcOEt. Фильтрат промывали рассолом. Объединенные органические слои сушили над MgSO4 и концентрировали в вакууме. Остаток, полученный таким образом, очищали флэш-хроматографией (DCM/MeOH смеси) с получением соединения 18 (0,16 г, 25%). В табл. 1 приведены соединения формулы (I), которые получены в соответствии с одним из представленных выше примеров. Таблица 1 В. Аналитическая часть. Для LCMS-характеристики соединений по настоящему изобретению использовали следующий метод.(для четырехкомпонентных смесей или бинарный) с дегазатором, автоматический пробоотборник, термостат колонки, диодно-матричный детектор (DAD) и колонку, как указано в соответствующих способах ниже. Поток из колонки расщеплялся до MS детектора. MS детектор был скомпонован с источником ионизации электрораспылением. Азот использовали как распылительный газ. Температуру источника поддерживали при 140C. Сбор данных осуществляли с помощью программного обеспечения MaccLynxOpenlynx. Способ 1. В дополнение к общему методу HPLC на обращенной фазе осуществляли на картридже XDB-C18(1,8 мкм, 2,130 мм) от Agilent, со скоростью потока 1 мл/мин при 60C. Используемыми градиентными условиями являлись 90% А (0,5 г/л раствор аммония ацетата), 5% Б (ацетонитрил), 5% В (метанол) до 50% Б и 50% В за 6,5 мин, до 100% Б в 7 мин и уравновешивание до первоначального состояния в 7,5-9,0 мин. Инъекционный объем 2 мкл. Масс-спектр высокого разрешения (время пролета, TOF) получали только в режиме положительной ионизации путем сканирования от 100 до 750 за 0,5 с, используя время запаздывания 0,1 с. Напряжение на капиллярной игле составляло 2,5 кВ и напряжение на конусе 20 В. Лейцинэнкефалин был стандартным веществом, используемым для калибровки с фиксированной массой. Способ 2. В дополнение к общему методу HPLC на обращенной фазе осуществляли на картридже XDB-C18(1,8 мкм, 2,130 мм) от Agilent, со скоростью потока 1,0 мл/мин при 60C. Используемыми градиентными условиями являлись 90% А (0,5 г/л раствор аммония ацетата), 10% Б (смесь ацетонитрил/метанол,1/1), до 100% Б в 6,5 мин, выдерживали до 7 мин и уравновешивали до первоначальных условий в 7,5-9,0 мин. Инъекционный объем 2 мкл. Масс-спектр низкого разрешения (ZQ детектор; квадрупольный) получали, сканируя из 100 до 1000 за 1,0 с, используя время запаздывания 0,3 с. Напряжение на капиллярной игле составляло 3 кВ. Напряжение на конусе 20 В и 50 В для метода положительной ионизации и 20 В для метода отрицательной ионизации. Способ 3. В дополнение к общему методу Б HPLC на обращенной фазе осуществляли на колонке АСЕ-С 18(3,0 мкм, 4,630 мм) от Advanced Chromatography Technologies, со скоростью потока 1,5 мл/мин при- 27017267 40C. Используемыми градиентными условиями являлись 80% А (0,5 г/л раствор аммония ацетата), 10% Б (ацетонитрил), 10% В (метанол) до 50% Б и 50% В в 6,5 мин, до 100% Б в 7 мин и уравновешивали до первоначальных условий в 7,5-9,0 мин. Инъекционный объем 5 мкл. Масс-спектр высокого разрешения(время пролета, TOF) получали только в режиме положительной ионизации, сканируя от 100 до 750 за 0,5 с, используя время запаздывания 0,1 с. Напряжение на капиллярной игле составляло 2,5 кВ для режима положительной ионизации и напряжение на конусе 20 В. Лейцин-энкефалин был стандартным веществом, используемым для калибровки с фиксированной массой. Определение точки плавления. Определения точки плавления осуществляли на аппарате Mettler FP62. Таблица 2 Аналитическая данные (Rt означает время удерживания в минутах;(МН)+ означает протонированную массу соединения (свободное основание) н.о.: не определяли. Г. Фармакологические примеры. Соединения, предложенные в настоящем изобретении, являются положительными аллостерическими модуляторами mGluR2. Эти соединения, по-видимому, потенциируют глутаматные ответы путем связывания с аллостерическим сайтом, не являющимся сайтом связывания глутамата. Ответ mGluR2 на концентрацию глутамата возрастает, когда присутствуют соединения по настоящему изобретению. Соединения по настоящему изобретению, как ожидается, будут оказывать эффект, по существу, на mGluR2 посредством их способности усиливать функцию рецептора. Поведение положительных аллостерических модуляторов тестировали на mGluR2, используя аналитический метод [35S]GTPS-связывания, описанный ниже, который подходит для идентификации таких соединений и более конкретно соединений формулы (I), показаных в табл. 3. Анализ связывания [35S]GTPS. Анализ связывания [35S]GTPS представляет собой функциональный, основанный на мембранах анализ, используемый для исследования функции рецептора, сопряженного с белком G (GPCR), посредством которого измеряют инкорпорирование негидролизуемой формы GTP, [35S]GTPS (гуанозин 5'трифосфат, меченный гамма-излучающий 35S). -Субъединица белка G катализирует обмен гуанозин-5'дифосфата (GDP) на гуанозин-трифосфат (GTP) и при активации GPCR агонистом, [35S]GTPS, инкорпо- 28017267 рируется и не может быть отщеплен для продолжения обменного цикла (Harper (1998) Current Protocols[35S]GTPS является прямым измерением активности белка G и, следовательно, может быть определена активность агониста. Рецепторы mGluR2, как показано, предпочтительно сопряжены с Gi-белком, предпочтительным сочетанием для данного способа, и, следовательно, широко используются для исследования рецепторной активации рецепторов mGluR2 как в рекомбинантных клеточных линиях, так и в тканиSchaffhauser et al. (1998) Molecular Pharmacology 53:228-33). Здесь авторы изобретения описывают применение анализа связывания [35S]GTPS с использованием мембран из клеток, трансфицированныхmGluR2-рецептором человека и адаптированных из Schaffhauser et al. 2003) Molecular Pharmacology 4:798-810) для детекции свойства положительных аллостерических модуляторов (РАМ) соединений по данному изобретению. Получение мембран. Клетки СНО (яичников китайских хомячков) культивировали до состояния непосредственно перед слиянием и стимулировали 5 мМ бутирата в течение 24 ч, затем промывали PBS и затем собирали путем соскабливания в буфер для гомогенизации (50 мм Трис-HCl буфер, pH 7,4, 4C). Клеточные лизаты быстро (15 с) гомогенезируют, используя гомогенезатор Ultra-Turrax. Гомогенат центрифугировали при 23500g в течение 10 мин и супернатант отбрасывали. Осадок ресуспендировали в 5 мм Трис-HCl, pH 7,4 и снова центрифугировали (30000g, 20 мин, 4C). Конечный осадок ресуспендировали в 50 мм HEPES,pH 7,4 и хранили при -80C в подходящих аликвотах до использования. Концентрацию белка определяли методом Bradford (Bio-Rad, USA) с бычим сывороточным альбумином в качестве стандарта. Анализ связывания [35S]GTPS. Измерение mGluR2 положительный аллостерический модуляторной активности тестируемых соединений в мембранах, содержащих mGluR2 человека, осуществляли, используя замороженные мембраны, которые оттаивали и быстро гомогенизировали перед предварительной инкубацией в 96-луночных микропланшетах (15 мкг/аналитическую ячейку, 30 мин, 30C) в аналитическом буфере (50 мм HEPESpH 7,4, 100 мм NaCl, 3 мм MgCl2, 50 мкМ GDP, 10 мкг/мл сапонина) с увеличением концентраций положительного аллостерического модулятора (от 0,3 нм до 50 мкМ) и либо минимальной предварительно определенной концентрацией глутамата (РАМ анализ), либо без добавления глутамата. Для РАМ анализа мембраны предварительно инкубировали с глутаматом в концентрации ЕС 25, т.е. концентрации, которая обеспечивает 25% максимального ответа на глутамат и согласуется с опубликованными данными (Pin etal. (1999) Eur. J. Pharmacol. 375:277-294). После добавления [35S]GTPS (0,1 нМ, f.c.) до достижения общего объема реакционной смеси 200 мкл микропланшеты быстро встряхивали и дополнительно инкубировали, чтобы обеспечить возможность инкорпорирования [35S]GTPS при активации (30 мин, 30C). Взаимодействие останавливали быстрой вакуум-фильтрацией на фильтровальных планшетах из стекловолокна (Unifilter 96-луночный GF/B фильтровальный планшет, Perkin-Elmer, Downers Grove, USA) микропланшете, используя клеточный коллектор для 96-луночных планшетов (Filtermate, Perkin-Elmer,USA), и затем промывали три раза 300 мкл ледяного промывочного буфера (Na2PO42H2O 10 мм,NaH2PO4H2O 10 мм, pH 7,4). Фильтры затем сушили на воздухе и добавляли 40 мкл жидкого сцинтилляционного коктейля (Microscint-O) в каждую лунку, мембранное связывание [35S]GTPS измеряют в считывающем устройстве для 96-луночных сцинтилляционных планшетов (Top-Count, Perkin-Elmer, USA). Неспецифическое связывание [35S]GTPS определяют в присутствии холодного 10 мкМ GTP. Каждую кривую выполняли по меньшей мере один раз, используя два образца на точку данных и при 11 концентрациях. Анализ данных. Кривые концентрация-ответ для типичных соединений по настоящему изобретению в присутствии добавленных ЕС 25 mGluR2-агониста глутамата для определения положительной аллостерической модуляции (РАМ), были получены с использованием программного обеспечения Prism GraphPad (Graph PadInc, San Diego, USA). Кривые аппроксимировали к четырехпараметрическому логистическому уравнению (Y = нижнее + (верхнее - нижнее)/(1+10logEC50-Х)Наклон), обеспечивая возможность определения значения EC50. ЕС 50 представляет собой концентрацию соединения, которая вызывает половину от максимальной потенциации глутаматного ответа. Ее рассчитывают путем вычитания максимальных ответов глутамата в присутствии полностью насыщающей концентрации положительного аллостерического модулятора из ответа глутамата в отсутствие положительного аллостерического модулятора. Концентрацию, вызывающую половину максимального эффекта, затем рассчитывают как ЕС 50.
МПК / Метки
МПК: C07D 405/06, C07D 409/04, A61K 31/4439, A61K 31/443, C07D 401/12, C07D 401/04, A61K 31/4436, A61K 31/4418, C07D 401/10, C07D 401/14, C07D 213/85, A61P 25/22, C07D 401/06, A61K 31/4412, A61K 31/444
Метки: 3-цианопиридона, 1,4-дизамещенного, mglur2, применение, качестве, рецептора, производные, модуляторов, положительных
Код ссылки
<a href="https://eas.patents.su/30-17267-proizvodnye-14-dizameshhennogo-3-cianopiridona-i-ih-primenenie-v-kachestve-polozhitelnyh-modulyatorov-receptora-mglur2.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1,4-дизамещенного 3-цианопиридона и их применение в качестве положительных модуляторов рецептора mglur2</a>
Предыдущий патент: Биокатализатор, способ его приготовления и способ получения глюкозофруктозных сиропов
Следующий патент: Применение пенообразователя в качестве прилипателя
Случайный патент: Электрод для емкостной деионизации