Тетрагидропиримидоазепины и их применение в качестве модуляторов trpv1
Номер патента: 17069
Опубликовано: 28.09.2012
Авторы: Мерит Джеффри Е., Макклур Келли Дж., Лебсак Алек Д., Брайтенбухер Джеймс Гай, Гаврилюк Натали А., Хэк Майкл Д., Эллисон Бретт Д., Бранстеттер Брайан Джеймс
Формула / Реферат
1. Соединение формулы (I)
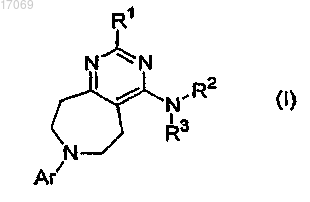
где R1 означает -H; -NRaRb; -OH; -C1-6алкильную, -OC1-6алкильную, -O-(насыщенную моноциклическую
C3-6циклоалкильную), -ОС1алкил(насыщенную моноциклическую C3-7циклоалкильную), -O-(насыщенную моноциклическую гетероциклоалкильную), -O-фенильную, -S-C1-6алкильную, -S-(насыщенную моноциклическую C3-6циклоалкильную), -S-С1алкил(насыщенную моноциклическую C3-6циклоалкильную), -S-(насыщенную моноциклическую гетероциклоалкильную), -S-фенильную, -S-бензильную или -SO2-C1-6алкильную группу, незамещенную или замещенную одной или двумя группами, независимо выбираемыми из группы, состоящей из -C1-6алкила, -OH, -OC1-4алкила, -NReRf; либо фенильную, моноциклическую C3-6циклоалкильную или моноциклическую гетероарильную группу, незамещенную или замещенную -C1-6алкилом, -OH, -OC1-4алкилом;
где Ra и Rb, каждый независимо, означают -H; C1-6алкил; -C2-3алкильную группу, замещенную -OC1-4алкилом или -NRcRd; либо насыщенную моноциклическую C3-6циклоалкильную, -С1алкил(насыщенную моноциклическую C3-6циклоалкильную), насыщенную моноциклическую гетероциклоалкильную,
-С1алкил(насыщенную моноциклическую гетероциклоалкильную), фенильную или -С1алкил(моноциклическую гетероарильную) группу, незамещенную или замещенную -C1-6алкилом; или
Ra и Rb вместе с атомом азота, к которому они присоединены, образуют насыщенную моноциклическую гетероциклоалкильную или мостиковую бициклическую гетероциклоалкильную группу, незамещенную или замещенную одной, двумя или тремя группами, независимо выбираемыми из группы, состоящей из -C1-6алкила, -C1-4алкил-OH, -C1-2алкил-OC1-2алкила, -OH, -OC1-4алкила, галогена, -CO2H и бензила;
где Rc и Rd, каждый независимо, означают -H или -C1-6алкил либо Rc и Rd вместе с атомом азота, к которому они присоединены, образуют насыщенный моноциклический гетероциклоалкил;
где Re и Rf вместе с атомом азота, к которому они присоединены, образуют насыщенный моноциклический гетероциклоалкил;
R2 означает -H;
R3 означает моноциклическую C3-6циклоалкильную, фенильную, бензильную, фенетильную, инданильную, пиридильную, пиридилметильную, пиримидинильную, пиразинильную, бензотиадиазолильную, хинолинильную, изохинолинильную, тетрагидрохинолинильную или тетрагидроизохинолинильную группу, незамещенную или замещенную одним, двумя или тремя заместителями Rg;
где каждый заместитель Rg означает -C1-6алкил; -C1-4алкил-OH, незамещенный или замещенный -CF3; насыщенный моноциклический C3-6циклоалкил; -OC1-6алкил; фенокси; -CN; -NO2; -N(Rh)Ri; -C(O)N(Rh)Ri;
-C(O)C1-6алкил; -S(О)0-2-C1-6алкил; -SO2CF3; -SO2N(Rh)Ri; галоген; -CF3; -OCF3; -CO2H; -CO2C1-6алкил;
-C(Rj)(Rx)-CN; -C(Rj)(Rx)-OH; -C(Rj)(Rx)-CO2C1-6алкил; -C(Rj)(Rx)-CO2H; фенил или моноциклический гетероарил; либо два смежных заместителя Rg, вместе взятые, образуют -OC1-2алкилО-;
где Rh и Ri, каждый независимо, означают -H или C1-6алкил; либо Rh и Ri (при наличии обоих элементов) вместе с атомом азота, к которому они присоединены, образуют насыщенную моноциклическую гетероциклоалкильную группу;
Rj независимо означает -H, -C1-6алкил или -CF3;
Rx означает -H или -C1-6алкил;
Ar означает фенильную, пиридильную, пиримидинильную, пиразинильную или конденсированную бициклическую гетероарильную группу, незамещенную или замещенную одним, двумя или тремя заместителями Rk;
где каждый заместитель Rk независимо означает -C1-6алкил, -C1-2алкил-OH, -CN, -NO2, -N(Rl)Rm,
-C(O)N(Rl)Rm, -N(Rl)SO2C1-6алкил, -S(О)0-2-C1-6алкил, -SO2N(Rl)Rm, галоген, -CF3, -OCF3, -CO2H или CO2C1-6 алкил либо два смежных заместителя Rk, вместе взятые, образуют -OC1-2алкилО-;
где Rl и Rm, каждый независимо, означают -H, -C1-6алкил, насыщенный моноциклический C3-6циклоалкил;
причем гетероциклоалкильная группа содержит 4-7 атомов в кольцевой структуре, выбираемых из атомов углерода, и до трех гетероатомов, выбираемых из азота, кислорода и серы, при этом кольцевая структура может необязательно содержать до двух оксогрупп у атомов углерода или серы в кольце;
гетероарильная группа содержит 5-10 атомов в одном гетероцикле, выбираемых из атомов углерода, и до двух гетероатомов, выбираемых из атомов азота и кислорода; или
его фармацевтически приемлемая соль.
2. Соединение, фармацевтически приемлемая соль по п.1, в котором R1 означает -NRaRb, где Ra и Rb вместе с атомом азота, к которому они присоединены, образуют азиридинильную, пиперидинильную, 2-оксопиперидин-1-ильную, пиперазинильную, оксопиперазинильную, морфолинильную, тиоморфолинильную, 1,1-диоксо-1l6-тиоморфолин-4-ильную, пирролидинильную, 1,1-диоксо-1l6-[1,2]тиазинан-2-ильную, азепанильную, 1,4-оксазепанильную или 7-азабицикло[2.2.1]гепт-7-ильную группу, незамещенную или замещенную -C1-6алкилом, гидроксиметилом, гидроксиэтилом, метоксиметилом, метоксиэтилом, фтором, -OH или -CO2H.
3. Соединение, фармацевтически приемлемая соль по п.1, в котором Ar означает 2-пиридил, замещенный -CF3.
4. Соединение, выбираемое из группы, включающей
(4-трет-бутилфенил)-[7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
(4-трифторметилфенил)-[7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
(4-трет-бутилфенил)-[2-циклопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
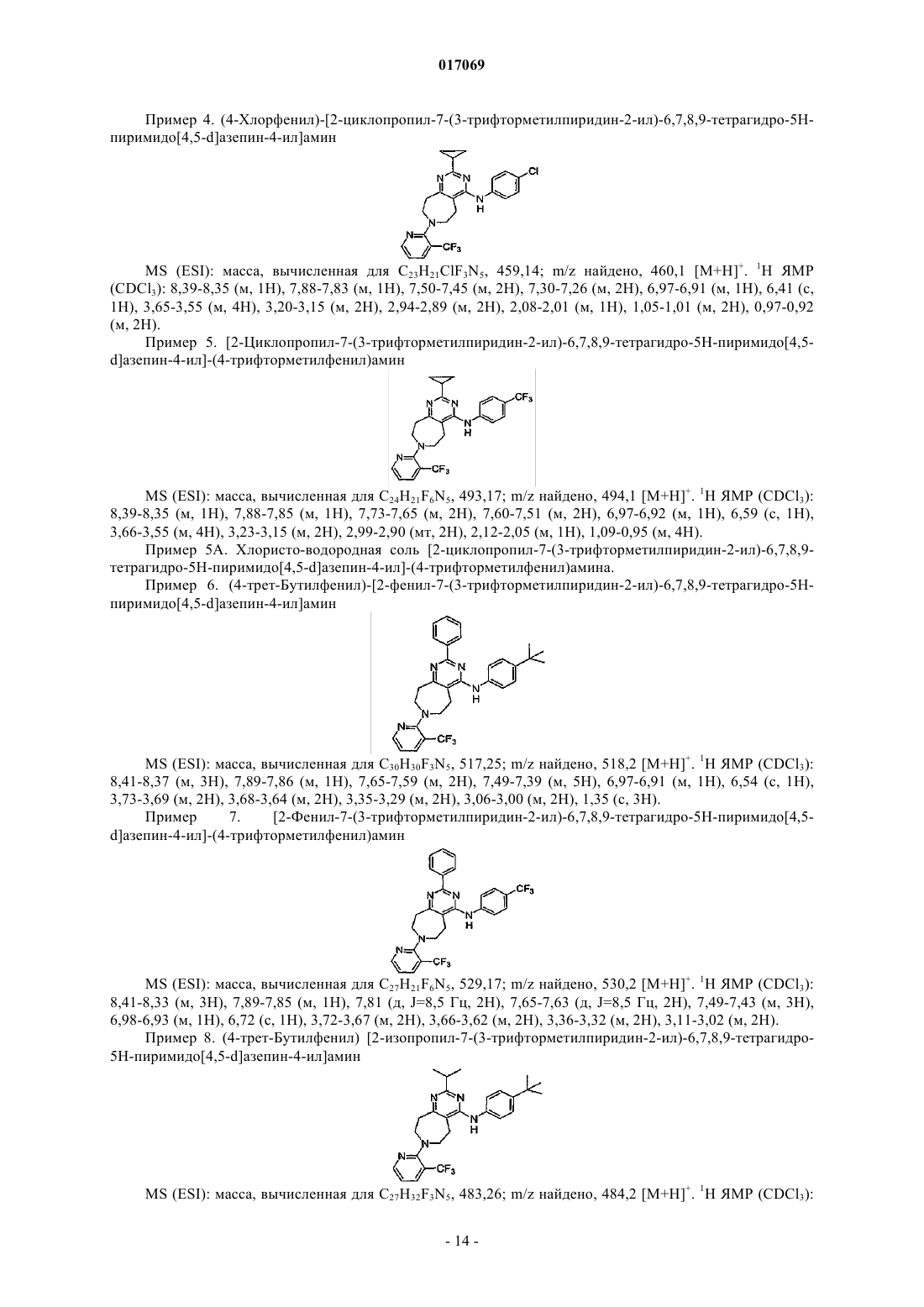
(4-хлорфенил)-[2-циклопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
[2-циклопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
(4-трет-бутилфенил)-[2-фенил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
[2-фенил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
(4-трет-бутилфенил)-[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(3-трифторметилфенил)амин;
[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметоксифенил)амин;
[2-(4-фторфенил)этил]-[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
[2-(2-хлорфенил)этил]-[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
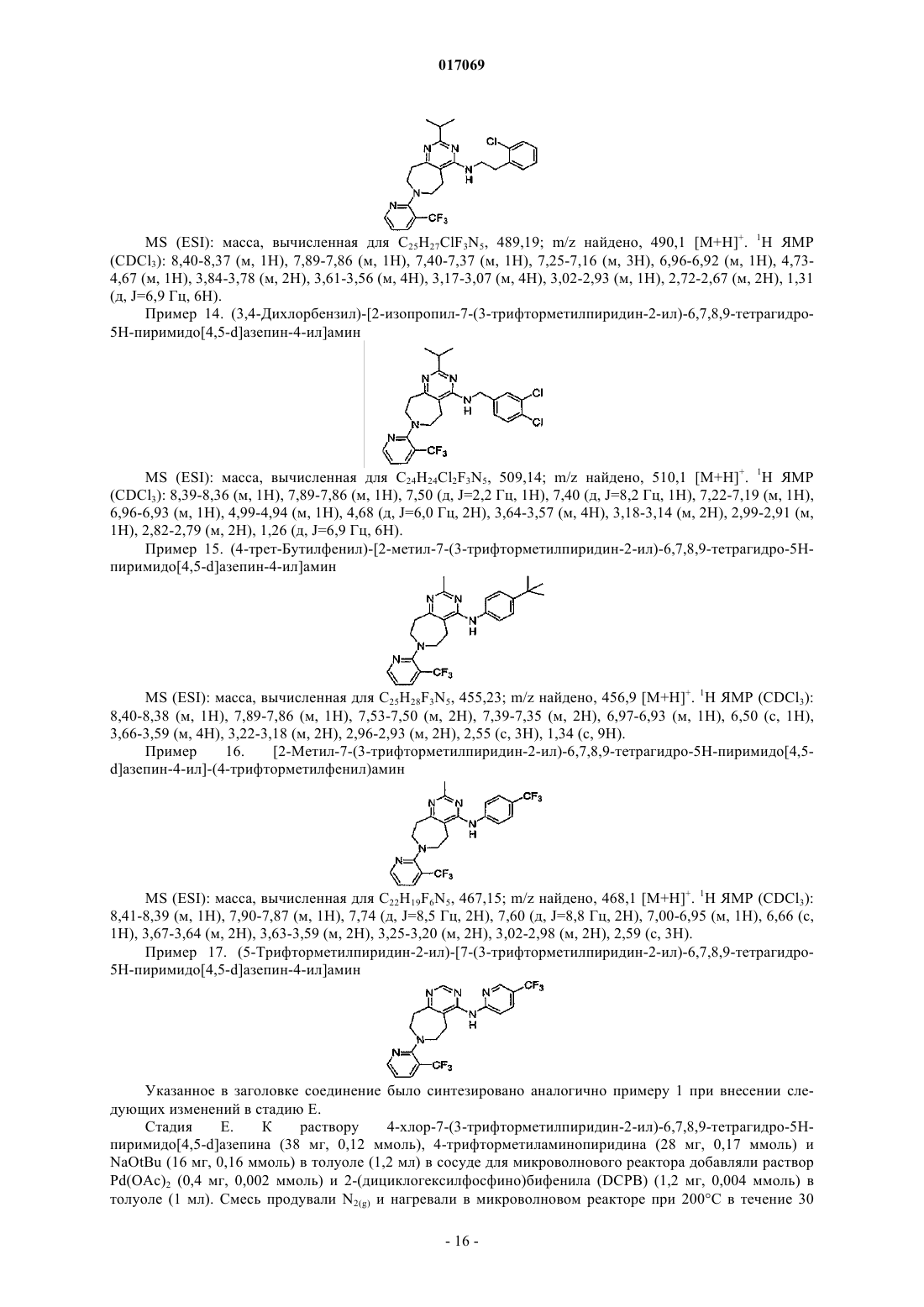
(3,4-дихлорбензил)-[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
(4-трет-бутилфенил)-[2-метил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
[2-метил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
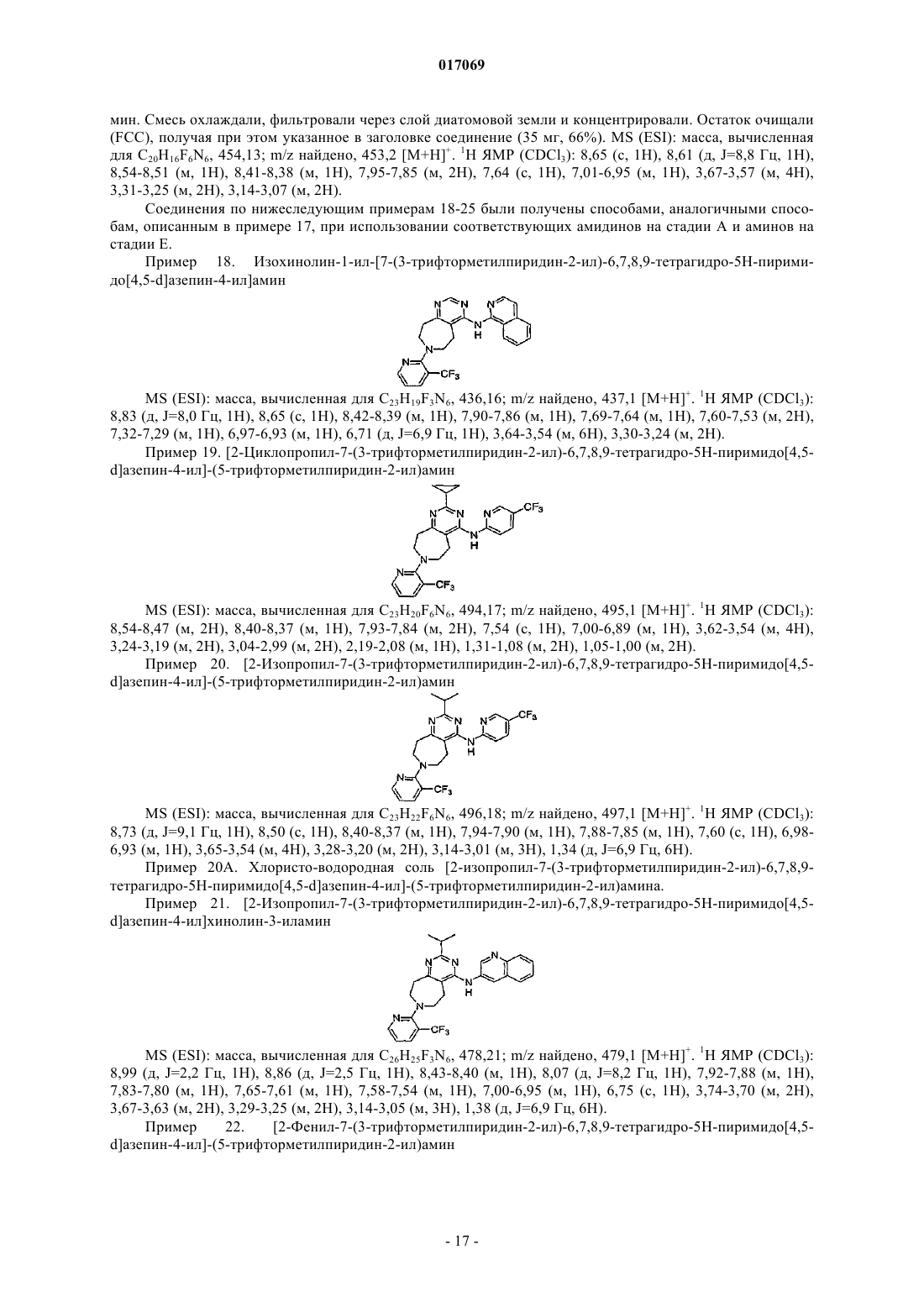
(5-трифторметилпиридин-2-ил)-[7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
изохинолин-1-ил-[7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
[2-циклопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(5-трифторметилпиридин-2-ил)амин;
[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(5-трифторметилпиридин-2-ил)амин;
[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]хинолин-3-иламин;
[2-фенил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(5-трифторметилпиридин-2-ил)амин;
[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(6-трифторметилпиридин-3-ил)амин;
[2-метил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(5-трифторметилпиридин-2-ил)амин;
[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-феноксифенил)амин;
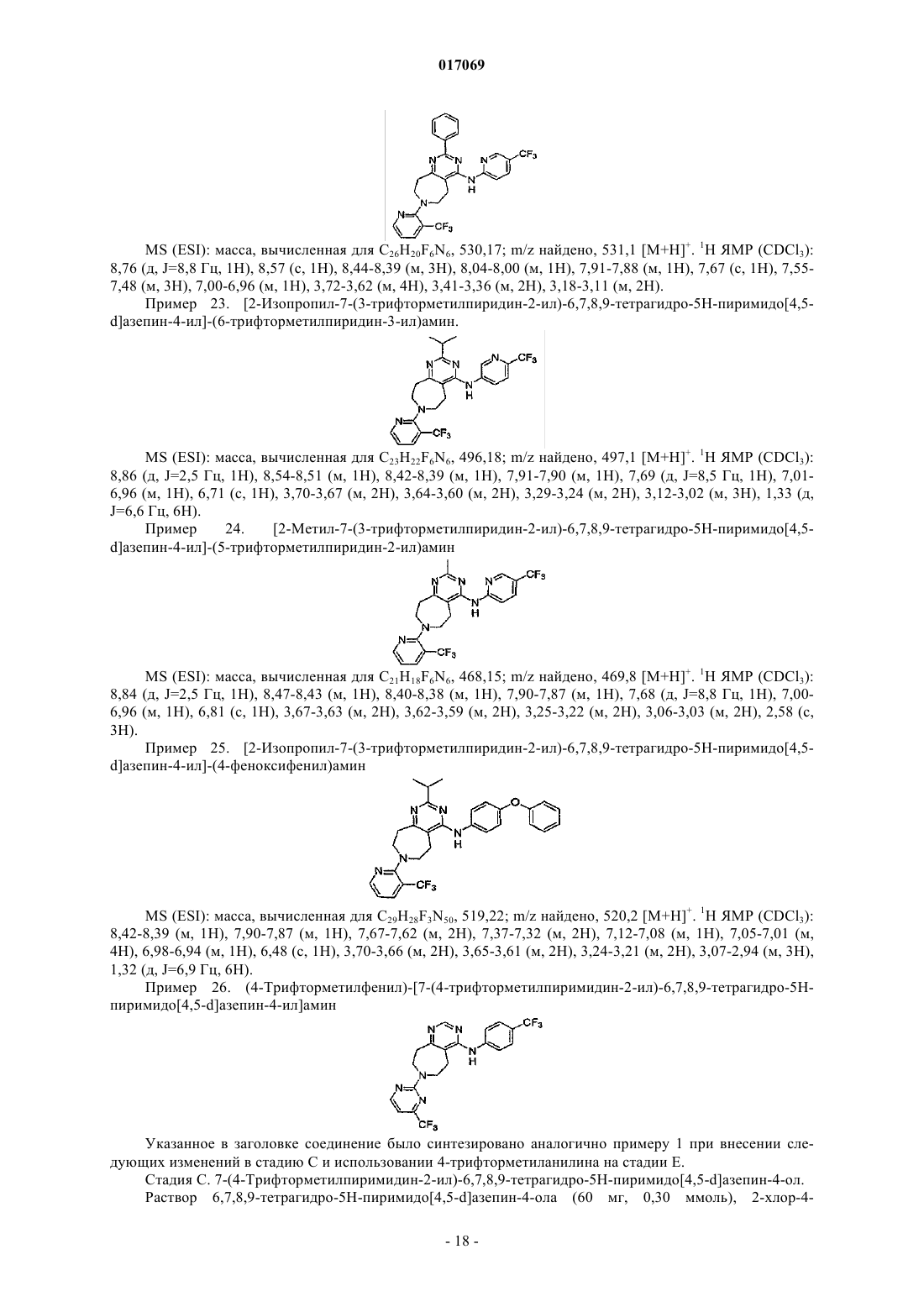
(4-трифторметилфенил)-[7-(4-трифторметилпиримидин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
(7-пиримидин-2-ил-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил)-(4-трифторметилфенил)амин;
(7-пиразин-2-ил-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил)-(4-трифторметилфенил)амин;
(7-хиноксалин-2-ил-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил)-(4-трифторметилфенил)амин;
[7-(3-хлорпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
(4-трет-бутилфенил)-[7-(6-хлор-5-метилпиримидин-4-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
(4-трет-бутилфенил)-[7-(3-метилхиноксалин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
(4-трет-бутилфенил)-[2-изопропил-7-(3-метилхиноксалин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
[2-изопропил-7-(3-метилхиноксалин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[2-изопропил-7-(3-трифторметилхиноксалин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[2-изопропил-7-(3-метансульфонилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
(4-трет-бутилфенил)-(7-фталазин-1-ил-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил)амин;
(4-трет-бутилфенил)-[7-(5-метилпиримидин-4-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
[2-пиперидин-1-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[2-морфолин-4-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[2-морфолин-4-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(5-трифторметилпиридин-2-ил)амин;
(4-трет-бутилфенил)-[2-пиперидин-1-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
N2,N2-диметил-N4-(6-трифторметилпиридин-3-ил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
N2,N2-диметил-N4-(5-трифторметилпиридин-2-ил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
N4-(3-хлор-4-трифторметилфенил)-N2,N2-диметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
(4-бромфенил)-[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
(4-трет-бутилфенил)-[2-морфолин-4-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
N4-(4-трет-бутилфенил)-N2,N2-диметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
N2,N2-диметил-N4-(4-трифторметилфенил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
N4-(4-хлорфенил)-N2,N2-диметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
N4-(4-трифторметилфенил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
[2-метилсульфанил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[2-метансульфонил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
N2-фенил-N4-(4-трифторметилфенил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
N2-циклопропил-N4-(4-трифторметилфенил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
[2-азетидин-1-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
1-[4-(4-трифторметилфениламино)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2-ил]пиперидин-4-карбоновую кислоту;
N2-(2-пиперидин-1-илэтил)-N4-(4-трифторметилфенил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
1-[4-(4-трифторметилфениламино)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2-ил]пиперидин-4-ол;
[2-(4-изопропилпиперазин-1-ил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
N2-(тетрагидропиран-4-ил)-N4-(4-трифторметилфенил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
[2-метокси-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
N4-(3,4-дихлорфенил)-N2,N2-диметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
N4-(4-метокси-3-трифторметилфенил)-N2,N2-диметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
2-{4-[2-диметиламино-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-иламино]фенил}-2-метилпропионитрил;
(4-трет-бутилфенил)-[2-пиперидин-1-илметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
(4-трет-бутилфенил)-[2-метоксиметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
N4-(2,3-дигидробензо[1,4]диоксин-6-ил)-N2,N2-диметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
[2-метил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(5-трифторметилпиридин-2-ил)амин;
N4-бензил-N2,N2-диметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
4-[2-диметиламино-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-иламино]бензолсульфонамид;
N2,N2-диметил-N4-(4-нитрофенил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
N4-(3,4-дихлорбензил)-N2,N2-диметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
[2-метилсульфанил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(5-трифторметилпиридин-2-ил)амин;
[2-метилсульфанил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(6-трифторметилпиридин-3-ил)амин;
[2-метоксиметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
метиловый эфир 4-[2-диметиламино-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-иламино]бензойной кислоты;
4-[2-диметиламино-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-иламино]бензонитрил;
N4-(4-диметиламинофенил)-N2,N2-диметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
(3-хлор-4-трифторметилфенил)-[2-метоксиметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
N4-(4-метоксифенил)-N2,N2-диметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
N4-индан-2-ил-N2,N2-диметил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
[7-(5-амино-3-метилпиридин-2-ил)-2-изопропил-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[7-(2-аминофенил)-2-изопропил-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[2-изопропил-7-(2-нитрофенил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[7-(3-аминопиридин-2-ил)-2-изопропил-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[2-изопропил-7-(3-метил-5-нитропиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[2-изопропил-7-(3-нитропиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
N-{2-[2-изопропил-4-(4-трифторметилфениламино)-5,6,8,9-тетрагидропиримидо[4,5-d]азепин-7-ил]фенил}метансульфонамид;
4-[4-(4-трифторметилфениламино)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2-ил]пиперазин-2-он;
(R)-1-[4-(4-трифторметилфениламино)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2-ил]пиперидин-3-ол;
[2-(4-метилпиперазин-1-ил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
N2-(2-метоксиэтил)-N2-метил-N4-(4-трифторметилфенил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
(S)-1-[4-(4-трифторметилфениламино)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2-ил]пиперидин-3-ол;
N2-циклопропилметил-N4-(4-трифторметилфенил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин;
1-{4-[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-иламино]фенил}этанон;
4-[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-иламино]бензонитрил;
(3,4-дихлорбензил)-[2-метилсульфанил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
[2-пиперазин-1-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[2-тиоморфолин-4-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметансульфонилфенил)амин;
[2-(4-бензилпиперазин-1-ил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
метиловый эфир 4-[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-иламино]бензойной кислоты;
[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилсульфанилфенил)амин;
[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]пиримидин-4-иламин;
[2-пирролидин-1-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин;
[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]пиримидин-2-иламин;
[2-(3,4-дихлорфенил)этил]-[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин;
(3,4-дихлорфенил)-[2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин и
их фармацевтически приемлемые соли.
5. Фармацевтическая композиция для лечения заболевания, нарушения или состояния, подлежащего лечению, опосредованного активностью TRPV1, которая содержит:
(а) эффективное количество агента, выбираемого из группы, включающей соединения формулы (I)
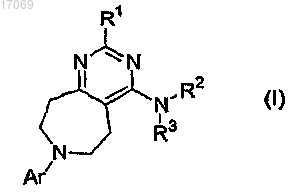
где R1 означает -H; -NRaRb; -OH; -C1-6алкильную, -OC1-6алкильную, -O-(насыщенную моноциклическую C3-6 циклоалкильную), -ОС1алкил(насыщенную моноциклическую C3-7циклоалкильную), -O-(насыщенную моноциклическую гетероциклоалкильную), -O-фенильную, -S-C1-6алкильную, -S-(насыщенную моноциклическую C3-6циклоалкильную), -S-С1алкил(насыщенную моноциклическую C3-6циклоалкильную), -S-(насыщенную моноциклическую гетероциклоалкильную), -S-фенильную, -S-бензильную или -SO2-C1-6алкильную группу, незамещенную или замещенную одной или двумя группами, независимо выбираемыми из группы, состоящей из -C1-6алкила, -OH, -OC1-4алкила, -NReRf; либо фенильную, моноциклическую C3-6циклоалкильную или моноциклическую гетероарильную группу, незамещенную или замещенную -C1-6алкилом, -OH, -OC1-4алкилом;
где Ra и Rb, каждый независимо, означают -H; C1-6алкил; -C2-3алкильную группу, замещенную -OC1-4алкилом или -NRcRd; либо насыщенную моноциклическую C3-6циклоалкильную, -С1алкил(насыщенную моноциклическую C3-6циклоалкильную), насыщенную моноциклическую гетероциклоалкильную, -С1алкил(насыщенную моноциклическую гетероциклоалкильную), фенильную или -С1алкил(моноциклическую гетероарильную) группу, незамещенную или замещенную -C1-6алкилом; или
Ra и Rb вместе с атомом азота, к которому они присоединены, образуют насыщенную моноциклическую гетероциклоалкильную или мостиковую бициклическую гетероциклоалкильную группу, незамещенную или замещенную одной, двумя или тремя группами, независимо выбираемыми из группы, состоящей из -C1-6алкила, -C1-4алкил-OH, -C1-2алкил-OC1-2алкила, -OH, -OC1-4алкила, галогена, -CO2H и бензила;
где Rc и Rd, каждый независимо, означают -H или -C1-6алкил; либо Rc и Rd вместе с атомом азота, к которому они присоединены, образуют насыщенный моноциклический гетероциклоалкил;
где Re и Rf вместе с атомом азота, к которому они присоединены, образуют насыщенный моноциклический гетероциклоалкил;
R2 означает -H;
R3 означает моноциклическую C3-6циклоалкильную, фенильную, бензильную, фенетильную, инданильную, пиридильную, пиридилметильную, пиримидинильную, пиразинильную, бензотиадиазолильную, хинолинильную, изохинолинильную, тетрагидрохинолинильную или тетрагидроизохинолинильную группу, незамещенную или замещенную одним, двумя или тремя заместителями Rg;
где каждый заместитель Rg означает -C1-6алкил; -C1-4алкил-OH, незамещенный или замещенный -CF3; насыщенный моноциклический C3-6циклоалкил; -OC1-6алкил; фенокси; -CN; -NO2; -N(Rh)Ri; -C(O)N(Rh)Ri;
-C(O)C1-6алкил; -S(O)0-2-C1-6алкил; -SO2CF3; -SO2N(Rh)Ri; галоген; -CF3; -OCF3; -CO2H; -CO2C1-6алкил;
-C(Rj)(Rx)-CN; -C(Rj)(Rx)-OH; -C(Rj)(Rx)-CO2C1-6алкил; -C(Rj)(Rx)-CO2H; фенил или моноциклический гетероарил; либо два смежных заместителя Rg, вместе взятые, образуют -OC1-2алкилО-;
где Rh и Ri, каждый независимо, означают -H или C1-6алкил; либо Rh и Ri (при наличии обоих элементов) вместе с атомом азота, к которому они присоединены, образуют насыщенную моноциклическую гетероциклоалкильную группу;
Rj независимо означает -H, -C1-6алкил или -CF3;
Rx означает -H или -C1-6алкил и
Ar означает фенильную, пиридильную, пиримидинильную, пиразинильную или конденсированную бициклическую гетероарильную группу, незамещенную или замещенную одним, двумя или тремя заместителями Rk;
где каждый заместитель Rk независимо означает -C1-6алкил, -C1-2 алкил-OH, -CN, -NO2, -N(Rl)Rm,
-C(O)N(Rl)Rm, -N(Rl)SO2C1-6алкил, -S(O)0-2-C1-6алкил, -SO2N(Rl)Rm, галоген, -CF3, -OCF3, -CO2H или CO2C1-6 алкил;
либо два смежных заместителя Rk, вместе взятые, образуют -OC1-2алкилО-;
где Rl и Rm, каждый независимо, означают -H, -C1-6алкил, насыщенный моноциклический C3-6циклоалкил;
причем гетероциклоалкильная группа содержит 4-7 атомов в кольцевой структуре, выбираемых из атомов углерода, и до трех гетероатомов, выбираемых из азота, кислорода и серы, при этом кольцевая структура может необязательно содержать до двух оксогрупп у атомов углерода или серы в кольце;
гетероарильная группа содержит 5-10 атомов в одном гетероцикле, выбираемых из атомов углерода, и до двух гетероатомов, выбираемых из атомов азота и кислорода; или
его фармацевтически приемлемую соль;
(b) фармацевтически приемлемый наполнитель.
6. Способ лечения субъекта, который страдает или у которого диагностировано заболевание, нарушение или состояние, подлежащее лечению, опосредованное активностью TRPV1, включающий введение указанному субъекту, нуждающемуся в таком лечении, эффективного количества соединения формулы (I), его фармацевтически приемлемой соли
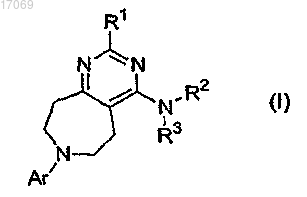
где R1 означает -H; -NRaRb; -OH; -C1-6алкильную, -OC1-6алкильную, -O-(насыщенную моноциклическую C3-6 циклоалкильную), -ОС1алкил(насыщенную моноциклическую C3-7циклоалкильную), -O-(насыщенную моноциклическую гетероциклоалкильную), -O-фенильную, -S-C1-6алкильную, -S-(насыщенную моноциклическую C3-6циклоалкильную), -S-С1алкил(насыщенную моноциклическую C3-6циклоалкильную), -S-(насыщенную моноциклическую гетероциклоалкильную), -S-фенильную, -S-бензильную или -SO2-C1-6алкильную группу, незамещенную или замещенную одной или двумя группами, независимо выбираемыми из группы, состоящей из -C1-6алкила, -OH, -OC1-4алкила, -NReRf; либо фенильную, моноциклическую C3-6циклоалкильную или моноциклическую гетероарильную группу, незамещенную или замещенную -C1-6алкилом, -OH, -OC1-4алкилом;
где Ra и Rb, каждый независимо, означают -H; C1-6алкил; -C2-3алкильную группу, замещенную -OC1-4алкилом или -NRcRd; либо насыщенную моноциклическую C3-6циклоалкильную, -С1алкил(насыщенную моноциклическую C3-6циклоалкильную), насыщенную моноциклическую гетероциклоалкильную,
-С1алкил(насыщенную моноциклическую гетероциклоалкильную), фенильную или -С1алкил(моноциклическую гетероарильную) группу, незамещенную или замещенную -C1-6алкилом; или
Ra и Rb вместе с атомом азота, к которому они присоединены, образуют насыщенную моноциклическую гетероциклоалкильную или мостиковую бициклическую гетероциклоалкильную группу, незамещенную или замещенную одной, двумя или тремя группами, независимо выбираемыми из группы, состоящей из -C1-6алкила, -C1-4алкил-OH, -C1-2алкил-OC1-2алкила, -OH, -OC1-4алкила, галогена, CO2H и бензила;
где Rc и Rd, каждый независимо, означают -H или -C1-6алкил; либо Rc и Rd вместе с атомом азота, к которому они присоединены, образуют насыщенный моноциклический гетероциклоалкил;
где Re и Rf вместе с атомом азота, к которому они присоединены, образуют насыщенный моноциклический гетероциклоалкил;
R2 означает -H;
R3 означает моноциклическую C3-6циклоалкильную, фенильную, бензильную, фенетильную, инданильную, пиридильную, пиридилметильную, пиримидинильную, пиразинильную, бензотиадиазолильную, хинолинильную, изохинолинильную, тетрагидрохинолинильную или тетрагидроизохинолинильную группу, незамещенную или замещенную одним, двумя или тремя заместителями Rg;
где каждый заместитель Rg означает -C1-6алкил; -C1-4алкил-OH, незамещенный или замещенный -CF3; насыщенный моноциклический C3-6циклоалкил; -OC1-6алкил; фенокси; -CN; -NO2; -N(Rh)Ri; -C(O)N(Rh)Ri;
-C(O)C1-6алкил; -S(O)0-2-C1-6алкил; -SO2CF3; -SO2N(Rh)Ri; галоген; -CF3; -OCF3; -CO2H; -CO2C1-6алкил;
-C(Rj)(Rx)-CN; -C(Rj)(Rx)-OH; -C(Rj)(Rx)-CO2C1-6алкил; -C(Rj)(Rx)-CO2H; фенил или моноциклический гетероарил либо два смежных заместителя Rg, вместе взятые, образуют -OC1-2алкилО-;
где Rh и Ri, каждый независимо, означают -H или C1-6алкил; либо Rh и Ri (при наличии обоих элементов) вместе с атомом азота, к которому они присоединены, образуют насыщенную моноциклическую гетероциклоалкильную группу;
Rj независимо означает -H, -C1-6алкил или -CF3;
Rx означает -H или -C1-6алкил и
Ar означает фенильную, пиридильную, пиримидинильную, пиразинильную или конденсированную бициклическую гетероарильную группу, незамещенную или замещенную одним, двумя или тремя заместителями Rk;
где каждый заместитель Rk независимо означает -C1-6алкил, -C1-2алкил-OH, -CN, -NO2, -N(Rl)Rm,
-C(O)N(Rl)Rm, -N(Rl)SO2C1-6алкил, -S(O)0-2-C1-6алкил, -SO2N(Rl)Rm, галоген, -CF3, -OCF3, -CO2H или CO2C1-6 алкил;
либо два смежных заместителя Rk, вместе взятые, образуют -OC1-2алкилО-;
где Rl и Rm, каждый независимо, означают -H, -C1-6алкил, насыщенный моноциклический C3-6циклоалкил;
причем гетероциклоалкильная группа содержит 4-7 атомов в кольцевой структуре, выбираемых из атомов углерода, и до трех гетероатомов, выбираемых из азота, кислорода и серы, при этом кольцевая структура может необязательно содержать до двух оксогрупп у атомов углерода или серы в кольце;
гетероарильная группа содержит 5-10 атомов в одном гетероцикле, выбираемых из атомов углерода, и до двух гетероатомов, выбираемых из атомов азота и кислорода.
Текст
Изобретение относится к определенным соединениям тетрагидропиримидоазепина формулы (I),предназначенным для применения в качестве модуляторов TRPV1. Такие соединения могут быть использованы в фармацевтических композициях и способах их применения для лечения заболеваний, нарушений и состояний, опосредованных TRPV1. Таким образом, соединения по настоящему изобретению можно вводить для лечения, например, боли, зуда, кашля, астмы или воспалительного заболевания кишечника. 017069 Перекрестная ссылка на родственную заявку Настоящая заявка заявляет приоритет предварительной заявки на патент США 60/785415, поданной 21 марта 2006 г. Область техники, к которой относится изобретение Настоящее изобретение относится к определенным соединениям тетрагидропиримидоазепина,фармацевтическим композициям, содержащим указанные соединения, и способам их применения для лечения заболеваний, нарушений и состояний, опосредованных активностью TRPV1. Уровень техники Каналообразующие белки транзиторного рецепторного потенциала (TRP) составляют большое и разнообразное семейство белков, экспрессированных во многих тканях и линиях клеток. Одним представляющим особый интерес каналообразующим белком TRP является рецептор ванилоида 1 (TRPV1 или VR1), неселективный Ca+2 канал, который является молекулярной мишенью для соединений ванилоида (таких как капсаицин и резинифератоксин). Известно, что такие соединения ванилоида избирательно деполяризуют ноцицепторы, специфические основные афферентные нейроны, участвующие в передаче сигналов по сигнальному пути, вызывающему ощущение боли. TRPV1 активируется разными раздражителями, включающими ванилоиды, деполяризацию мембраны, тепло, растяжение, низкое значение pH, воспалительные раздражители (например, метаболиты липоксигеназы) и соединения эндоканнабиноидов. Так как выявленная активность ноцицепторов способствует появлению у млекопитающих нежелательной боли, воспалений, нарушению терморегуляции, регуляции тонуса гладких мышц и рефлексов, то при лечении и профилактике разных клинических синдромов важное значение имеет модуляция передачи сигналов в указанном сигнальном пути (Caterina, M.J., Pain 2003, 105(1-2), 5-9; Caterina,M.J. et al., Annu. Rev. Neurosci. 2001, 24, 487-517; Tominaga, M. et al., J. Neurobiol. 2004, 61, 3-12; Voets, T.et al., Nature 2004, 430, 748-754). Благодаря связи TRPV1 с сенсорной нервной системой агонисты и антагонисты TRPV1 могут быть терапевтически полезны при лечении или профилактике заболеваний, нарушений и состояний, опосредованных активностью TRPV1, таких как i) боль (например, острая, хроническая, воспалительная или нейропатическая боль); ii) зуд (Kim et al., Neurosci. Lett. 2004, 361, 159) и разные воспалительные заболевания (Stucky, C.L. et al., Neuroscience 1998, 84, 1257; Moore, B.A. et al., Am. J. Physiol. Gastrointest. LiverPhysiol. 2002, 282, G1045; Kwak, J.Y. et al., Neuroscience 1998, 86, 619; Morris, V.H. et al., Pain 1997, 71,179; Greiff, L. et al., Thorax 1995, 50, 225); iii) заболевания внутреннего уха (Balaban, C.D. et al., Hear. Res. 2003, 175, 165-70; Zheng, J. et al., J. Neurophys. 2003, 90, 444-55); iv) жар и другие нарушения или симптомы, связанные с терморегуляцией (Jancso-Gabor et al., J. Physiol. 1970, 206, 495; Swanson et al., J. Med.Chem. 48, 1857; Lida et al., Neurosci. Lett. 2005, 378, 28); v) трахеобронхиальная и диафрагмальная дисфункция и vi) заболевания желудочно-кишечного тракта и мочевых путей (Lazzeri, M. et al., Eur. Urology 200, 792-798; Apostolidis, A. et al., Urology 2005, 65, 400-405). Кроме того, модуляторы TRPV1 могут быть терапевтически полезны при лечении или профилактике состояния тревоги (Marsch, R. et al., J. Neurosci. 2007, 27(4), 832-839); заболеваний глаз (таких как глаукома, потеря зрения и повышенное внутриглазное давление) (Calkins, D.J. et al., Abstract from ARVO 2006 Annual Meeting, Program.1557, Poster B93); алопеции (например, для стимуляции роста волос) (Bodo, E. et al., Am. J. Pathol. 2005, 166(4), 985-998); диабета (включая инсулинрезистентный диабет или диабетические заболевания, опосредованные чувствительностью к инсулину или секрецией инсулина) (Razavi, R. et al., Cell 2006, 127(6), 1097-1099; Akiba,Y., et al., Biochem. Biophys. Res. Commun. 2004, 321(1), 219-225). Ацидоз является хорошо известным признаком ишемии головного мозга. Показатель pH ткани может снижаться до 6 или ниже, что является достаточным для активации каналов TRPV1, экспрессированных в центральной нервной системе (CNS). Поэтому антагонисты TRPV1 могут быть полезны при лечении заболеваний, ассоциированных с пониженным притоком крови в CNS или гипоксией CNS, таких как черепно-мозговая травма, повреждение спинного мозга, тромбоэмболический или геморрагический удар, преходящее ишемическое нарушение мозгового кровообращения, спазм сосудов головного мозга,гипогликемия, остановка сердца, эпилептический статус, перинатальная асфиксия, болезнь Альцгеймера и хорея Гентингтона. В международной публикации WO 05/014558 (17 февраля 2005 года) описаны определенные аминопиримидиновые ингибиторы потенциалозависимых натриевых и калиевых каналов. Разные бициклические пиримидины описаны в качестве модуляторов рецепторов серотонина в заявке на патент США 11/460294, поданной 27 июля 2006 года (реестр поверенногоPRD2511). Конденсированные соединения пиримидина описаны в качестве ингибиторов потенциалозависимых ионных каналов в международной публикации WO 05/014558. Разные бициклические пиримидины описаны в качестве ингибиторов канала TRPV1 также в международной публикации WO 05/066171 и в публикации заявки на патент США 2005/0165032. Однако существует потребность в сильнодействующих модуляторах TRPV1 с требуемыми фармацевтическими свойствами. Сущность изобретения В настоящее время установлено, что определенные производные тетрагидропиримидоазепина обладают TRPV1-модулирующей активностью. Таким образом, настоящее изобретение относится к общим-1 017069 и предпочтительным вариантам осуществления, рассмотренным соответственно в независимых и зависимых пунктах прилагаемой формулы изобретения, которые включены в настоящее описание изобретения в качестве ссылки. Таким образом, одним общим объектом настоящего изобретения являются соединения следующей формулы (I):C3-6 циклоалкильную), -S-(насыщенную моноциклическую гетероциклоалкильную), -S-фенильную, -Sбензильную или -SO2-C1-6 алкильную группу, незамещенную или замещенную одной или двумя группами, независимо выбираемыми из группы, состоящей из -C1-6 алкила, -OH, -OC1-4 алкила, -NReRf; либо фенильную, моноциклическую C3-6 циклоалкильную или моноциклическую гетероарильную группу, незамещенную или замещенную -C1-6 алкилом, -OH, -OC1-4 алкилом; где Ra и Rb, каждый независимо, означают -H; C1-6 алкил; -C2-3 алкильную группу, замещенную-С 1 алкил(моноциклическую гетероарильную) группу, незамещенную или замещенную -C1-6 алкилом; илиRa и Rb вместе с атомом азота, к которому они присоединены, образуют насыщенную моноциклическую гетероциклоалкильную или мостиковую бициклическую гетероциклоалкильную группу, незамещенную или замещенную одной, двумя или тремя группами, независимо выбираемыми из группы, состоящей из -C1-6 алкила, -C1-4 алкил-OH, -C1-2 алкил-OC1-2 алкила, -OH, -OC1-4 алкила, галогена, -CO2H и бензила; где Rc и Rd, каждый независимо, означают -H или -C1-6 алкил либо Rc и Rd вместе с атомом азота, к которому они присоединены, образуют насыщенный моноциклический гетероциклоалкил; где Re и Rf вместе с атомом азота, к которому они присоединены, образуют насыщенный моноциклический гетероциклоалкил;R3 означает моноциклическую C3-6 циклоалкильную, фенильную, бензильную, фенетильную, инданильную, пиридильную, пиридилметильную, пиримидинильную, пиразинильную, бензотиадиазолильную, хинолинильную, изохинолинильную, тетрагидрохинолинильную или тетрагидроизохинолинильную группу, незамещенную или замещенную одним, двумя или тремя заместителями Rg; где каждый заместитель Rg означает -C1-6 алкил; -C1-4 алкил-OH, незамещенный или замещенный-CO2C1-6 алкил; -C(Rj)(Rx)-CN; -C(Rj)(Rx)-OH; -C(Rj)(Rx)-CO2C1-6 алкил; -C(Rj)(Rx)-CO2H; фенил или моноциклический гетероарил; либо два смежных заместителя Rg, вместе взятые, образуют -OC1-2 алкилО-; где Rh и Ri, каждый независимо, означают -H или C1-6 алкил; либо Rh и Ri (при наличии обоих элементов) вместе с атомом азота, к которому они присоединены, образуют насыщенную моноциклическую гетероциклоалкильную группу;Ar означает фенильную, пиридильную, пиримидинильную, пиразинильную или конденсированную бициклическую гетероарильную группу, незамещенную или замещенную одним, двумя или тремя заместителями Rk; где каждый заместитель Rk независимо означает -C1-6 алкил, -C1-2 алкил-OH, -CN, -NO2, -N(Rl)Rm,-C(O)N(Rl)Rm, -N(Rl)SO2C1-6 алкил, -S(O)0-2-C1-6 алкил, -SO2N(Rl)Rm, галоген, -CF3, -OCF3, CO2H илиCO2C1-6 алкил; либо два смежных заместителя Rk, вместе взятые, образуют -OC1-2 алкилО-; где Rl и Rm, каждый независимо, означают -H, -C1-6 алкил, насыщенный моноциклическийC3-6 циклоалкил; причем гетероциклоалкильная группа содержит 4-7 атомов в кольцевой структуре, выбираемых из атомов углерода, и до трех гетероатомов, выбираемых из азота, кислорода и серы, при этом кольцевая структура может необязательно содержать до двух оксогрупп у атомов углерода или серы в кольце;-2 017069 гетероарильная группа содержит 5-10 атомов в одном гетероцикле, выбираемых из атомов углерода, и до двух гетероатомов, выбираемых из атомов азота и кислорода. Настоящее изобретение относится также к фармацевтически приемлемым солям соединений формулы (I). В некоторых предпочтительных вариантах осуществления изобретения соединение формулы (I) является соединением, выбираемым из соединений, описанных или приведенных в качестве примеров в нижеследующем подробном описании изобретения. Другим общим объектом настоящего изобретения являются фармацевтические композиции, содержащие (a) эффективное количество агента, выбираемого из соединений формулы (I) и их фармацевтически приемлемых солей; и (b) фармацевтически приемлемый наполнитель. Другим общим объектом настоящего изобретения является способ лечения субъекта, который страдает или у которого диагностировано заболевание, нарушение или состояние, подлежащее лечению, опосредованное активностью TRPV1, который включает введение указанному субъекту, нуждающемуся в таком лечении, эффективного количества соединения формулы (I), фармацевтически приемлемой соли такого соединения. Такими заболеваниями, нарушениями или состояниями, подлежащими лечению, являются выбираемые из боли (острой, хронической, воспалительной или нейропатической боли); зуда или разных воспалительных заболеваний; заболеваний внутреннего уха; жара и других состояний и нарушений терморегуляции; трахеобронхиальной и диафрагмальной дисфункции; заболеваний желудочнокишечного тракта и мочевых путей и заболеваний, ассоциированных с пониженным притоком крови вCNS или гипоксией CNS. Дополнительные варианты осуществления, особенности и преимущества настоящего изобретения будут очевидны из приведенного ниже подробного описания изобретения и практического осуществления изобретения. Подробное описание изобретения и предпочтительных вариантов осуществления изобретения Настоящее изобретение может быть лучше понято со ссылкой на приведенное ниже описание,включающее словарь терминов и примеры осуществления изобретения. Для краткости содержание публикаций, включая патенты, приведенные в настоящем описании изобретения, включено в описание изобретения в качестве ссылки. В используемом в описании значении термины "включающий" и "содержащий" использованы в настоящем описании изобретения в широком смысле, не имеющем каких-либо ограничений. Термин "алкил" означает алкильную группу с прямой или разветвленной цепью, содержащей 1-12 атомов углерода. Типичные алкильные группы включают метил (Me, который может быть также структурно отображен символом a), этил (Et), н-пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил(tBu), пентил, изопентил, трет-пентил, гексил, изогексил и т.п. Термин "алкенил" означает алкенильную группу с прямой или разветвленной цепью, содержащей 2-12 атомов углерода (двойная связь алкенильной группы образована двумя гибридизированными атомами углерода sp2). Иллюстративные алкенильные группы включают проп-2-енил, бут-2-енил, бут-3 енил, 2-метилпроп-2-енил, гекс-2-енил и т.п. Термин "циклоалкил" означает насыщенное или частично насыщенное, моноциклическое, конденсированное полициклическое или мостиковое полициклическое углеродное кольцо, содержащее 3-12 атомов в одном углеродном кольце. Иллюстративные примеры циклоалкильных групп включают следующие группы:"Гетероциклоалкил" означает моноциклическую или конденсированную, мостиковую или спирополициклическую кольцевую структуру, которая является насыщенной или частично насыщенной и содержит 3-12 атомов в одной кольцевой структуре, выбираемых из атомов углерода, и до трех гетероатомов, выбираемых из азота, кислорода и серы. Указанная кольцевая структура может необязательно содержать до двух оксогрупп у атомов углерода или серы в кольце. Иллюстративные примеры гетероциклоалкильных групп включают: и т.п. Термин "гетероарил" означает моноциклический, конденсированный бициклический или конденсированный полициклический ароматический гетероцикл (кольцевая структура, содержащая в кольце атомы, выбираемые из атомов углерода, и до четырех гетероатомов, выбираемых из атомов азота, кислорода и серы), содержащий 3-12 атомов в одном гетероцикле. Иллюстративные примеры гетероарильных групп включают следующие группы: и т.п. Специалистам в данной области должно быть понятно, что циклоалкильные, гетероциклоалкильные и гетероарильные группы, приведенные или проиллюстрированные выше, не исключают использования других групп, поэтому также могут быть выбраны дополнительные группы, входящие в объем определений вышеуказанных терминов. Термин "галоген" означает хлор, фтор, бром или йод. Термин "замещенный" означает, что указанная группа или часть имеет один или несколько заместителей. Термин "незамещенный" означает, что указанная группа не имеет заместителей. Термин "необязательно замещенный" означает, что указанная группа может быть не замещена или замещена одним или несколькими заместителями. Когда термин "замещенный" служит для описания структурной системы,замещение может иметь место в любом положении системы с допустимой валентностью. В тех случаях,когда определенно не указано, что данная часть или группа может быть необязательно замещена или замещена любым указанным заместителем, считается, что такая часть или группа не замещена. Любая формула, приведенная в настоящем описании изобретения, служит для обозначения соединений, имеющих структуру, выраженную данной структурной формулой, а также определенными вариантами или формами. В частности, соединения, выраженные любой формулой, приведенной в настоящем описании изобретения, могут иметь асимметричные центры и поэтому существуют в разных энантиомерных формах. Со ссылкой на любую формулу, приведенную в настоящем описании изобретения, следует отметить, что выбор конкретной группы из перечня возможных групп для указанного переменного элемента не предполагает определения группы для данного переменного элемента. Другими словами, при неоднократном использовании переменного элемента выбор групп из приведенного перечня не зависит от выбора группы для того же переменного элемента в другом случае. В предпочтительных вариантах агентов формулы (I) R1 означает -NRaRb, где Ra и Rb вместе с атомом азота, к которому они присоединены, образуют азиридинильную, пиперидинильную, 2 оксопиперидин-1-ильную, пиперазинильную, оксопиперазинильную, морфолинильную, тиоморфолинильную, 1,1-диоксо-16-тиоморфолин-4-ильную, пирролидинильную, 1,1-диоксо-16-[1,2]тиазинан-2 ильную, азепанильную, 1,4-оксазепанильную или 7-азабицикло[2.2.1]гепт-7-ильную группу, незамещенную или замещенную -C1-6 алкилом, гидроксиметилом, гидроксиэтилом, метоксиметилом, метоксиэтилом, фтором, -OH или -CO2H. В другом предпочтительном варианте Ar означает 2-пиридил, замещенный -CF3. Настоящее изобретение относится также к фармацевтически приемлемым солям соединений, выраженных формулой (I), предпочтительно вышеописанных соединений. Особенно предпочтительными являются фармацевтически приемлемые соли конкретных соединений, приведенных в настоящем описании изобретения. Термин "фармацевтически приемлемая соль" означает соль свободной кислоты или основания соединения, выраженного формулой (I), которая является нетоксичной, биологически переносимой или-4 017069 биологически пригодной для введения субъекту, см. публикации S.M. Berge et al., "Pharmaceutical Salts",J. Pharm. Sci., 1977, 66: 1-19, и Handbook of Pharmaceutical Salts, Properties, Selection, and Use, Stahl andWermuth, Eds., Wiley-VCH and VHCA, Zurich, 2002. Предпочтительными фармацевтически приемлемыми солями являются соли, которые являются фармакологически эффективными и приемлемыми для контактирования с тканями субъектов, не вызывая необоснованной токсичности, раздражения или аллергической реакции. Соединение формулы (I) может содержать достаточно кислую группу, достаточно основную группу или функциональные группы обоих типов и, таким образом, взаимодействовать с целым рядом неорганических или органических оснований и неорганических и органических кислот с образованием фармацевтически приемлемой соли. Типичные фармацевтически приемлемые соли включают сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, иодиды, ацетаты, пропионаты, деканоаты,каприлаты, акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты,сукцинаты, субераты, себакаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты,хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, гидроксибутираты, гликоляты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты,нафталин-2-сульфонаты и манделаты. Если соединение формулы (I) содержит основный атом азота, требуемая фармацевтически приемлемая соль может быть получена любым приемлемым способом, известным в данной области, например путем обработки свободного основания неорганической кислотой, такой как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, сульфаминовая кислота, азотная кислота, борная кислота, фосфорная кислота и т.п., или органической кислотой, такой как уксусная кислота, фенилуксусная кислота, пропионовая кислота, стеариновая кислота, молочная кислота, аскорбиновая кислота, малеиновая кислота, гидроксималеиновая кислота, изетионовая кислота, янтарная кислота, валериановая кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, олеиновая кислота, пальмитиновая кислота, лауриновая кислота, пиранозидильная кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфаоксикислота, такая как миндальная кислота, лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота, 2-ацетоксибензойная кислота, нафтойная кислота или циннаминовая кислота, сульфоновая кислота, такая как лаурилсульфоновая кислота, паратолуолсульфоновая кислота, метансульфоновая кислота,этансульфоновая кислота или т.п. Если соединение формулы (I) является кислотой, такой как карбоновая кислота или сульфоновая кислота, требуемая фармацевтически приемлемая соль может быть получена любым приемлемым способом, например путем обработки свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла, или гидроксид щелочно-земельного металла, или т.п. Иллюстративные примеры приемлемых солей включают органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиака, карбонатов, бикарбонатов, первичного, вторичного и третичного аминов, и циклических аминов, таких как бензиламины, пирролидинов, пиперидина, морфолина и пиперазина, и неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития. Предпочтительные варианты осуществления настоящего изобретения относятся к соединениям формулы (I) и их сульфату, гидрохлориду, фумарату, тартрату, фосфату, соли метансульфоновой кислоты (мезилату), соли бензолсульфоновой кислоты (безилату) и соли паратолуолсульфоной кислоты (тозилату). Настоящее изобретение относится также к способам лечения с использованием соединений формулы (I), их фармацевтически приемлемых солей по настоящему изобретению. Соединения формулы (I), их фармацевтически приемлемые соли (далее агенты) по настоящему изобретению пригодны для использования в качестве модуляторов TRPV1 в способах по настоящему изобретению. Указанные агенты могут быть использованы в способах по настоящему изобретению для лечения или предупреждения состояний, подлежащих лечению, заболеваний или нарушений, опосредованных модуляцией TRPV1, рассмотренных в настоящем описании изобретения. Симптомы или состояния должны входить в объем определения "состояний, подлежащих лечению, нарушений или заболеваний". Таким образом, настоящее изобретение относится к использованию фармацевтических агентов,рассмотренных в настоящем описании изобретения, для лечению субъектов, которые страдают или у которых диагностировано заболевание, нарушение или состояние, опосредованное активностью TRPV1,такое как i) боль (острая, хроническая, воспалительная или нейропатическая боль); ii) зуд или разные воспалительные заболевания; iii) заболевания внутреннего уха; iv) жар и другие нарушения терморегуляции; v) трахеобронхиальная и диафрагмальная дисфункция; vi) заболевания желудочно-кишечного тракта и мочевых путей и vii) нарушения, ассоциированные с пониженным притоком крови в CNS или гипоксией CNS. Боль может быть ассоциирована с разными заболеваниями, нарушениями или состояниями и может-5 017069 иметь разную этиологию. Типичные виды боли, подлежащие лечению TRPV1-модулирующим агентом по настоящему изобретению, включают боль, причиной которой является остеоартрит, заболевания мышцы-вращателя, артрит (например, ревматоидный артрит или воспалительный артрит), фибромиалгия, мигрень и головная боль (например, кластерная головная боль, синусовая головная боль или нервная головная боль; см. публикацию Goadsby Curr. Pain Headache Reports 2004, 8, 393), синусит, воспаление слизистой оболочки полости рта, зубная боль, травма зубов, удаление зубов, инфекционное поражение зубов, ожог, солнечная эритема, дерматит, псориаз, экзема, укус или след укуса насекомого, ожоговая боль (Bolkskei et al., Pain 2005, in press), заболевания костно-мышечной системы, переломы костей, растяжение связок, подошвенный фасцит, реберный хондрит, тендинит, бурсит, лучеплечевой бурсит, травматический эпикондилит, пателлярный тендинит, повторное повреждение связок, мышечно-лицевой синдром, растяжение мышц, миозит, дисфункционально-болевой синдром височно-нижнечелюстного сустава, ампутация, боль в нижней части спины, травма спинного мозга, боль в шее, побои, спазмы мочевого пузыря, заболевания желудочно-кишечного тракта, интерстициальный цистит, инфекционное поражение мочевых путей, колика мочеиспускательного канала, почечная колика, фарингит, простой герпес, стоматит, наружный отит, отит среднего уха (Chan et al., Lancet 2003, 361, 385), синдром жжения полости рта, воспаление слизистой оболочки, боль в пищеводе, спазмы пищевода, заболевания брюшной полости, гастроэзофагеальная рефлюксная болезнь, панкреатит, энтерит, спастический колит, воспалительное заболевание кишечника, болезнь Крона, язвенный колит, вздутие ободочной кишки, сжимающая боль брюшной полости, дивертикулез, дивертикулит, газообразование в кишечнике, геморрой, трещины заднего прохода, заболевания прямой кишки и заднего прохода, простатит, эпидидимит, боль в яичке,проктит, боль в прямой кишке, холецистит, роды, эндометриоз, менструальные боли, боли в полости таза, вульвит, вагинит, инфекционные поражения полости рта, губ и половых органов (например, простой герпес), плеврит, перикардит, экстракардиальная боль в груди, ушибы, ссадины, порезы (Honore, P. et al.,J. Pharmacol. Exp. Ther. 2005, 314, 410-21), послеоперационная боль, периферическая невропатия, центральная невропатия, диабетическая невропатия, острая невралгия при опоясывающем лишае, постгерпетическая невралгия, невралгия тройничного нерва, глоссофарингеальная невралгия, атипичная боль в области лица, градикулопатия, ВИЧ-ассоциированная невропатия, физическое повреждение нерва, каузалгия, рефлекторная симпатическая дистрофия, ишиалгия, цервикальная, торакальная или поясничная радикулопатия, плечевая плексопатия, поясничная плексопатия, нейродегенеративные заболевания, затылочная невралгия, межреберная невралгия, супраорбитальная невралгия, паховая невралгия, невралгия латерального кожного нерва бедра, генитофеморальная невралгия, синдром канала запястья, синдром Мортона, постмастэктомический синдром, постторакотомический синдром, постполиомиелитный синдром, синдром Гийома-Барре, синдром Рейно, спазм коронарной артерии (изменчивая стенокардия или стенокардия Принцметала), висцеральная гипералгезия (Pomonis, J.D. et al., J. Pharmacol. Exp. Ther. 2003,306, 387; Walker, K.M. et al., J. Pharmacol. Exp. Ther. 2003, 304(1), 56-62), таламическая боль, рак (например, боль, вызванная раком, при лечении рака лучевой терапией или химиотерапией, или поражения нервов или костей, обусловленные раком (см. публикации Menendez, L. et al., Neurosci. Lett. 2005, 393(1),70-73; Asai, H. et al., Pain 2005, 117, 19-29), или боль, вызванная разрушением кости (см. публикациюGhilardi, J.R. et al., J. Neurosci. 2005, 25, 3126-31, инфекция или болезнь обмена веществ. Кроме того,соединения по настоящему изобретению могут быть использованы для лечения такой боли, как висцеральная боль, внутриглазная боль, боль, вызванная термическим ожогом, зубная боль, боль, вызванная капсаицином (а также другие симптомы, вызванные капсаицином, такие как кашель, лакримация и бронхоспазм). В другом предпочтительном варианте осуществления изобретения агенты вводят для лечения зуда различного происхождения, вызванного дерматологическими или воспалительными заболеваниями; или воспалительных заболеваний, выбираемых из группы, включающей заболевания почек или печени и желчного пузыря, иммунологические заболевания, реакции на лекарственные средства и неизвестные/идиопатические заболевания. Воспалительные заболевания, подлежащие лечению агентом по настоящему изобретению, включают, например, воспалительное заболевание кишечника (IBD), болезнь Крона и язвенный колит (Geppetti, P. et al., Br. J. Pharmacol. 2004, 141, 1313-20; Yiangou, Y., et al., Lancet 2001, 357, 1338-39; Kimball, E.S. et al., Neurogastroenterol. Motil., 2004, 16, 811), остеоартрит (Szabo, A. etal., J. Pharmacol. Exp. Ther. 2005, 314, 111-119), псориаз, псориатический артрит, ревматоидный артрит,миастению gravis, рассеянный склероз, склеродермию, гломерулонефрит, панкреатит, воспалительный гепатит, астму, хроническое обструктивное заболевание легкого, аллергический ринит, увеит, сердечнососудистые проявления воспаления, включающие атеросклероз, миокардит, перикардит и васкулит. Соединение (агент) по настоящему изобретению предназначено для лечения заболеваний внутреннего уха. Такие заболевания включают, например, гиперакузию, шум в ушах, повышенную вестибулярную чувствительность и периодическое головокружение. Агент по настоящему изобретению предназначен для лечения трахеобронхиальных и диафрагмальных дисфункций, которые включают, например, астму и обусловленные аллергией иммунные реакцииAppl. Pharmacol. 2003, 192, 21-35), кашель (например, острый или хронический кашель или кашель, вы-6 017069 званный раздражением вследствие гастроэзофагеальной рефлюксной болезни; см. публикацию Lalloo,U.G. et al., J. Appl. Physiol. 1995, 79(4), 1082-7), бронхоспазм, хроническое обструктивное заболевание легкого, хронический бронхит, эмфизему и икоту (hiccoughs, singultus). Также агент по настоящему изобретению предназначен для лечения заболеваний желудочнокишечного тракта и мочевых путей, таких как повышенная активность мочевого пузыря, воспалительная гипералгезия, висцеральная гиперрефлексия мочевого пузыря, геморрагический цистит (Dinis, P. et al., J.Neurosci. 2004, 24, 11253-11263), интерстициальный цистит (Sculptoreanu, A. et al., Neurosci. Lett. 2005,381, 42-46), воспалительное заболевание предстательной железы, простатит (Sanchez, M. et al., Eur. J.Pharmacol. 2005, 515, 20-27), тошнота, рвота, кишечные спазмы, вздутие кишечника, спазмы мочевого пузыря, позывы к неотложному мочеиспусканию, позывы к неотложной дефекации и недержание мочи. Агент по настоящему изобретению может быть предназначен для лечения пониженного притока крови к CNS или гипоксии CNS. Такие заболевания включают, например, черепно-мозговую травму,повреждение спинного мозга, тромбоэмболический или геморрагический удар, преходящее ишемическое нарушение мозгового кровообращения, спазм сосудов головного мозга, гипогликемию, остановку сердца, эпилептический статус, перинатальную асфиксию, болезнь Альцгеймера и хорею Гентингтона. Агенты по настоящему изобретению вводят для лечения других заболеваний, нарушений или состояний, опосредованных активностью TRPV1, таких как состояние тревоги, нарушение познавательной способности или расстройство памяти; заболевания глаз (такие как глаукома, потеря зрения, повышенное внутриглазное давление и конъюнктивит); алопеция (например, для стимуляции роста волос); диабет(включая инсулинрезистентный диабет или диабетические заболевания, опосредованные чувствительностью к инсулину или секрецией инсулина); ожирение (например, для подавления аппетита); диспепсия; желчная колика; почечная колика; синдром болезненного мочевого пузыря; воспаление пищевода; заболевание верхних дыхательных путей; недержание мочи; острый цистит и интоксикация, обусловленная нападением ядовитого животного (например, морского животного, змеи или жалящих насекомых, таких как ядовитые медузы, пауки или хвостоколы). Согласно терапевтическим способам по настоящему изобретению эффективные количества модуляторов TRPV1 вводят для лечения боли, зуда, кашля, астмы или воспалительного заболевания кишечника. Термин "лечить" или "лечение" в использованном в описании значении означает введение субъекту агента или композиции по настоящему изобретению с целью оказания благоприятного терапевтического или профилактического воздействия путем модуляции активности TRPV1. Лечение включает обратное развитие, уменьшение интенсивности, ослабление симптомов, задержку развития, облегчение тяжести или предотвращение заболевания, нарушения или состояния, одного или нескольких симптомов такого заболевания, нарушения или состояния путем модуляции активности TRPV1. Термин "субъект" означает млекопитающее, нуждающееся в таком лечении, в частности человека. "Модуляторы" включают как ингибиторы, так и активаторы, при этом "ингибиторы" являются соединениями, которые уменьшают, предотвращают, инактивируют, десенсибилизируют или снижают экспрессию или активность TRPV1, и "активаторы" являются соединениями, которые увеличивают, активируют, облегчают, сенсибилизируют или повышают экспрессию или активность TRPV1. При осуществлении способов лечения по настоящему изобретению субъекту, который страдает или у которого диагностировано такое заболевание, нарушение или состояние, вводят эффективное количество фармацевтического агента по настоящему изобретению. Термин "эффективное количество" означает количество или дозу, достаточную для оказания благоприятного терапевтического или профилактического воздействия на субъектов, нуждающихся в таком лечении выявленного заболевания, нарушения или состояния. Эффективные количества или дозы агентов по настоящему изобретению могут быть установлены стандартными методами, такими как моделирование, исследования увеличения дозы или клинические испытания, и с учетом обычных факторов, таких как режим или способ введения или доставки лекарственного средства, фармакокинетика агента, тяжесть и продолжительность заболевания, нарушения или состояния, предшествующая или проводимая терапия, состояние здоровья и реакция субъекта на лекарственные средства и решение лечащего врача. Типичная доза составляет от около 0,001 до около 200 мг агента на 1 кг массы тела субъекта в сутки, предпочтительно около 0,05-100 мг/кг/сутки, около 135 или около 0,1-10 мг/кг/сутки в виде однократных или разделенных лекарственных форм (например,BID, TID, QID). Для человека с массой тела 70 кг иллюстративный диапазон приемлемой дозы составляет от около 0,05 до около 7 г/сутки или от около 0,2 до около 2,5 г/сутки. При уменьшении интенсивности заболевания, нарушения или состояния субъекта может быть назначена доза, соответствующая профилактическому или поддерживающему лечению. Например, доза или частота введения либо оба параметра могут быть уменьшены в зависимости от симптомов до уровня, позволяющего поддерживать желаемое терапевтическое или профилактическое действие. Если симптомы были ослаблены до требуемого уровня, лечение может быть прекращено. Однако субъектам может потребоваться периодическое лечение на долговременной основе при любом повторном появлении симптомов. Фармацевтическая композиция по настоящему изобретению включает: (a) эффективное количество фармацевтического агента по настоящему изобретению и (b) фармацевтически приемлемый наполни-7 017069 тель. Термин "фармацевтически приемлемый наполнитель" означает вещество, которое не является токсичным, биологически непереносимым или каким-либо другим образом биологически неприемлемым для введения субъекту, а именно инертное вещество, добавляемое в фармакологическую композицию или используемое в качестве среды, носителя или разбавителя для облегчения введения фармацевтического агента и совместимое с данным агентом. Примеры наполнителей включают карбонат кальция,фосфат кальция, разные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли. Отпускаемые формы фармацевтических композиций, содержащих одну или несколько лекарственных форм фармацевтических агентов, можно получить, используя приемлемые фармацевтические наполнители и методы смешивания, известные специалистам в данной области. Указанные композиции можно вводить при осуществлении способов по настоящему изобретению приемлемым способом введения, например перорально, парентерально, ректально, местно, в глаза или путем ингаляции. Препарат может быть в форме таблеток, капсул, саше, драже, порошков, гранул, лепешек, восстанавливаемых порошков, жидких препаратов или суппозиториев. Указанные композиции предпочтительно предназначены для внутривенного вливания, местного применения или перорального введения. Соединения по настоящему изобретению, предназначенные для перорального введения, могут быть получены в форме таблеток или капсул, в виде раствора, эмульсии или суспензии. При получении композиций для перорального введения агенты по настоящему изобретению могут входить в состав препарата в дозе от около 0,05 до около 50 мг/кг/сутки, от около 0,05 до около 20 мг/кг/сутки или от около 0,1 до около 10 мг/кг/сутки. Таблетки для перорального введения могут содержать агент по настоящему изобретению и любые другие активные ингредиенты в смеси с совместимыми фармацевтическими приемлемыми наполнителями, такими как разбавители, дезинтеграторы, связывающие вещества, смазывающие вещества, подсластители, ароматизаторы, красители и консерванты. Приемлемые инертные наполнители включают карбонат натрия и кальция, фосфат натрия и кальция, лактозу, крахмал, сахар, глюкозу, метилцеллюлозу,стеарат магния, маннит, сорбит и т.п. Типичные жидкие наполнителя для перорального введения включают этанол, глицерин, воду и т.п. Крахмал, поливинилпирролидон (PVP), гликолят натриевого крахмала, микрокристаллическая целлюлоза и альгиновая кислота являются типичными дезинтеграторами. Связывающие вещества могут включать крахмал и желатин. Смазывающее вещество, в случае его применения, может представлять собой стеарат магния, стеариновую кислоту или тальк. При желании на таблетки может быть нанесено такое вещество как глицерилмоностеарат или глицерилдистеарат для замедления абсорбции в желудочно-кишечном тракте или энтеросолюбильное покрытие. Капсулы для перорального введения включают твердые и мягкие желатиновые капсулы. При получении твердых желатиновых капсул активный ингредиент смешивают с твердым, полутвердым или жидким разбавителем. Мягкие желатиновые капсулы могут быть получены путем смешивания активного ингредиента с водой, маслом, таким как арахисовое масло, кунжутное масло или оливковое масло, жидким парафином, смесью моно- и диглицеридов короткоцепных жирных кислот, полиэтиленгликолем 400 или пропиленгликолем. Жидкости для перорального введения могут быть в форме суспензий, растворов, эмульсий или сиропов либо могут быть лиофилизованы или присутствовать в виде сухого продукта, предназначенного для восстановления водой или в другой приемлемой среде перед применением. Такие жидкие композиции могут необязательно содержать фармацевтически приемлемые наполнители, такие как суспендирующие агенты (например, сорбит, метилцеллюлоза, альгинат натрия, желатин, гидроксиэтилцеллюлоза,карбоксиметилцеллюлоза, гелеобразный стеарат алюминия и т.п.); неводные наполнители, например масло (например, миндальное масло или фракционированное кокосовое масло), пропиленгликоль, этиловый спирт или вода; консерванты (например, метил- или пропилпарагидроксибензоат или сорбиновая кислота); смачивающие вещества, такие как лецитин; и при желании ароматизаторы или красители. Активные агенты по настоящему изобретению можно также вводить непероральными способами введения. Например, указанные композиции могут быть получены для ректального введения в виде суппозитория. Агенты по настоящему изобретению, предназначенные для парентерального введения, включая внутривенное, внутримышечное, внутрибрюшинное или подкожное введение, могут быть получены в виде стерильных водных растворов или суспензий, содержащих буфер, обеспечивающий достижение соответствующего показателя pH и изотоничности, или в масле, приемлемом для парентерального введения. Приемлемые водные среды включают раствор Рингера и изотонический раствор хлорида натрия. Такие формы могут быть получены в виде однократных лекарственных форм, таких как ампулы или устройства для инъекций однократного применения, в виде лекарственных форм для многократного приема,таких как флаконы, из которых может быть отобрана требуемая доза, в виде твердой формы или концентрата, который может быть использован для приготовления инъецируемого препарата. Иллюстративные дозы вливаний составляют около 1-1000 мкг/кг/мин агента в смеси с фармацевтическим носителем, вводимого в течение периода времени от нескольких минут до нескольких дней. Агенты, предназначенные для местного применения, могут быть смешаны с фармацевтическим но-8 017069 сителем в концентрации от около 0,1 до около 10% лекарственного средства относительно наполнителя. Другим способом введения агентов по настоящему изобретению может быть применение пластыря,обеспечивающего чрескожную доставку лекарственного средства. При осуществлении способов по настоящему изобретению агенты можно альтернативно вводить путем ингаляции, назально или перорально, например, в виде распыляемого препарата, содержащего также приемлемый носитель. Предпочтительные агенты, используемые при осуществлении способов по настоящему изобретению, будут далее описаны со ссылкой на иллюстративные схемы синтеза и приведенные ниже конкретные примеры. Специалистам должно быть известно, что исходные вещества, используемые для получения разных описанных соединений, могут быть выбраны таким образом, чтобы необходимые заместители были сохранены на протяжении всей схемы реакций с защитой или без защиты, как это необходимо для получения требуемого продукта. Альтернативно, может быть необходимо или желательно использовать вместо требуемого заместителя приемлемую группу, которая может быть сохранена на протяжении всей схемы реакций и затем заменена требуемым заместителем. За исключением особо оговоренных случаев переменные элементы имеют указанные выше значения со ссылкой на формулу (I). Схема A Как показано на общей схеме A, соединения формулы (I) могут быть получены из сложных кетоэфиров (VI), где X1 означает приемлемую аминозащитную группу, такую как бензильная или карбаматная группа. Защищенные пиперидоны (V) могут быть приобретены коммерческим путем или могут быть получены известными методами. Предпочтительные защитные группы для аминов включают третбутилкарбаматные (Boc) или бензильные группы. Сложные -кетоэфиры (VI) могут быть получены общими методами, известными в данной области. Например, сложные -кетоэфиры (VI) могут быть получены из пиперидонов (V) путем расширения кольца пиперидонов (V) этилдиазоацетатом в присутствии кислоты Льюиса, такой как BF3OEt, в приемлемом растворителе, таком как Et2O, CH2Cl2 или их смесь,при температуре в интервале от около 0 С до около комнатной температуры (rt). Сложные -кетоэфиры(VI) могут быть подвергнуты взаимодействию с амидинами или карбоксимидамидами (VII), мочевинами или тиомочевинами (VIII), например, в присутствии NaOEt или KOtBu в растворителе, таком как EtOH,tBuOH или их смесь, при температуре в интервале от комнатной температуры до температуры кипения растворителя с обратным холодильником с образованием гидроксипиримидинов (IX). При конденсации с мочевиной или тиомочевиной алкилирование in situ алкилхлоридом или бромидом позволяет получить пиримидины (IX), в которых R1 означает -S-C1-6 алкил или -O-C1-6 алкил. Защитная группа X1 может быть удалена известными методами. Например, Boc группа может быть удалена кислотой, такой ТФУ илиHCl, в растворителе, таком как Et2O, диоксан, EtOH, MeOH или их смесь, с образованием аминов (IX), в которых X1=-H. При получении кислой соли соответствующее свободное основание может быть получено приемлемыми общими методами, известными в данной области. Свободное основание предпочтительно получают фильтрованием соли через связанный смолой карбонат с использованием спиртового растворителя, предпочтительно MeOH. Когда X1 является бензильной группой, указанная группа может быть удалена стандартными методами, такими как гидрирование в присутствии палладиевого катализатора, такого как Pd/C или Pd(OH)2/C, в растворителе, таком как EtOH. Гидроксипиримидины (IX), в которых X1 означает -H, могут быть затем превращены в амины (X) известными методами, такими как замещение SN-арила или опосредуемое палладием перекрестное связывание. Замещение SN-арила можно произвести путем обработки гидроксипиримидинов (XI), в которых X1 означает -H, при помощи Ar-HAL(где HAL означает галоген), такого как 2-хлор-3-трифторметилпиридин, в присутствии основания, такого как K2CO3, в полярном растворителе, таком как ДМСО, при температурах в интервале от около комнатной температуры до температуры кипения растворителя с обратным холодильником. Опосредуемое палладием перекрестное связывание выполняют, осуществляя взаимодействие Ar-HAL в присутствии палладиевого катализатора. Гидроксипиримидины (IX), в которых X1 означает -H, предпочтительно обрабатывают Et3N или (iPr)2NEt в приемлемых растворителях, таких как n-BuOH, tBuOH, трет-амиловый спирт, ДМФА, ДМСО, DME, NMP или их смесь, при температурах от около 100 до около 200C. Пиримидины (X) затем могут быть активированы для использования в опосредуемых палладием реакциях перекрестного связывания или реакциях SN2, выполняемых обычными методами, известными в данной-9 017069 области. Например, обработка POCl3, PCl3, PBr3 или POBr3 позволяет получить соответствующие галогенпиримидины (XI), в которых Z означает хлорид или бромид. Обработка пиримидинов (X) ангидридом трифторметансульфоновой кислоты или N-фенил-бис-(трифторметансульфонимидом) в DCE, CH2Cl2,ТГФ или их смеси в присутствии основания, такого как пиридин, Et3N, (iPr)2NEt или KOtBu, позволяет получить трифлаты (XI), в которых Z означает -OSO2CF3. В предпочтительном варианте осуществления изобретения пиримидины (X) обрабатывают POCl3 в CH3CN при температурах от около 80 до около 100C. Замещение пиримидинов (XI)аминами HN(R2)R3 с целью получения соединений формулы (I) можно произвести разными приемлемыми методами, известными специалистам в данной области. Когда Z означает Cl, замещение может быть произведено путем нагревания хлорпиримидинов (XI) с приемлемыми аминами (XII) в спиртовых растворителях, таких как MeOH, EtOH, tBuOH, n-BuOH, трет-амил-OH или их смесь, при температурах в интервале от около комнатной температуры до температуры кипения растворителя с обратным холодильником. Растворителем предпочтительно является n-BuOH, и температура равна примерно 130C. Альтернативно, хлорпиримидины (XI) могут быть подвергнуты взаимодействию с аминами (XII) в присутствии кислотного катализатора, предпочтительно паратолуолсульфоновой кислоты или ТФУ, в толуоле или диоксане при температурах от около 100 до около 150C с образованием соединений формулы (I). Связывание галогенидов или трифлатов (XI) с аминами (XII) в присутствии катализатора, такого как Pd(OAc)2, Pd(PPh3)4, PdCl2(PPh3)2 или PdCl2(Po-tol3)2, в растворителе, таком как ТГФ, 1,4-диоксан, DMA, ДМФА, DME, толуол или их смеси, в присутствии основания, такого какK2PO4,с добавкой,такой как 2(дициклогексилфосфанил)бифенил (DCPB), или без нее также позволяет получить пиримидины (I). В предпочтительном варианте осуществления изобретения связывание осуществляют в присутствии катализатора Pd(OAc)2, DCPB и NaOtBu в толуоле при температурах от около 100 до около 200C в микроволновом реакторе. Схема B Как показано на схеме B, соединения формулы (I) могут быть получены альтернативным общим способом. Защищенные пиперидоны (XV), такие как 1,4-диокса-8-азаспиро[4.5]декан (где PG означает O-(CH2)2-O-), могут быть превращены в ариламины (XIV) путем замещения SN-арила или опосредуемого палладием перекрестного связывания, показанного на схеме A. Удаление защитной группы известными общими методами, такими как использование концентрированной HCl, позволяет получить кетоны (XV). Кетоны (XV) могут быть превращены в соединения формулы (I) путем расширения кольца, конденсации,активации и замещения, показанных на схеме A. Схема C Как показано на схеме C, простые тиоэфиры (XVI), полученные способом, показанным на схеме A,могут быть окислены известными методами с образованием сульфонов (XVII). Сульфон замещают, осуществляя взаимодействие со спиртами HO-C1-6 алкил или аминами HN(Ra)Rb в растворителях, таких какMeOH, EtOH, n-BuOH, ТГФ, ДМФА, ДМСО, толуол или их смесь, в присутствии или в отсутствие приемлемого основания, такого как NaOMe, NaOEt, KOtBu, NaH, Et3N, (iPr)2EtN или пиридин, при температурах в интервале от комнатной температуры до температуры кипения растворителя с обратным холодильником. Предпочтительно замещение аминами HN(Ra)Rb выполняют, нагревая с сульфонами (XVII) в толуоле в запаянной трубке при 110C. Соединения формулы (I) могут быть превращены в соответствующие соли методами, известными специалистам в данной области. Например, амины формулы (I) могут быть обработаны трифторуксусной- 10017069 кислотой, HCl, лимонной кислотой, H2SO4, метансульфоновой кислотой (MsOH), бензолсульфоновой кислотой или паратолуолсульфоновой кислотой (TsOH) в растворителе, таком как Et2O, EtOAc, CH2Cl2,ТГФ, MeOH или их смесь, с образованием соответствующих солей. Соединения, получаемые в соответствии с показанными выше схемами, могут быть получены в виде отдельных энантиомеров, диастереомеров, региоизомеров, рацемических смесей или смесей энантиомеров, диастереомеров или региоизомеров. Изомеры в смесях региоизомеров или диастереомеров могут быть разделены стандартными методами, такими как хроматография или кристаллизация. Отдельные энантиомеры в рацемических (1:1) и нерацемических (отношение не равно 1:1) смесях могут быть выделены стандартными методами разделения, известными специалистам в данной области. Особенно пригодные методы разделения могут включать хиральную хроматографию, перекристаллизацию, образование диастереомерной соли или получение аддуктов диастереомеров с последующим разделением. Приведенные ниже примеры служат для дальнейшей иллюстрации объектов настоящего изобретения и разных предпочтительных вариантов осуществления изобретения. Примеры Химия. Для получения данных исследований, описанных в приведенных ниже примерах, были использованы следующие аналитические методы за исключением особо оговоренных случаев. Спектры ЯМР были получены в спектрометрах модели DRX Bruker. Данные 1H ЯМР представлены следующим образом: химический сдвиг в миллионных долях (ppm) внизу от тетраметилсиланового эталона (мультиплетность, константа взаимодействия J в Гц, интеграция). Масс-спектры были получены в устройстве MSD серии 1100 Agilent в условиях электрораспылительной ионизации (ESI) в режиме положительных или отрицательных колебаний в соответствии с инструкцией. Вычисленная масса соответствует точной массе. Тонкослойную хроматографию выполняли на пластинках из силикагеля Merck, предварительно покрытых 60 F254, размером 2,57,5 см 250 мкм или 5,010,0 см 250 мкм. Препаративную тонкослойную хроматографию выполняли на пластинках из силикагеля EM Science, предварительно покрытых 60 F254,размером 2020 см 0,5 мм, с зоной концентрирования 204 см. Очистку в нормальной фазе обычно производили флэш-хроматографией с нормальной фазой (FCC) на колонках с силикагелем RediSep, используя EtOAc/гексаны в качестве элюента, за исключением особо оговоренных случаев. Высокоэффективную жидкостную хроматографию (ВЭЖХ) с обращенной фазой выполняли в следующих условиях: прибор Shimadzu; колонка Phenomenex Gemini 5 мкм C18 (15021,2 мм) или WatersXterra RP18 OBD 5 мкм (10030 мм); градиент от 95:5 до 0:100 воды (0,5% ТФУ)/CH3CN (0,05% ТФУ); скорость потока 30 мл/мин; детектирование, УФ при =254 нМ. Реакции в микроволновом диапазоне выполняли в микроволновом реакторе CEM Discover или"Концентрированные" растворы концентрировали в роторном испарителе при пониженном давлении. За исключением особо оговоренных случаев реакционные растворы перемешивали при комнатной температуре (rt) в атмосфере N2(g). Хлористо-водородные соли были получены путем обработки соответствующих свободных оснований хлористо-водородной кислотой (HCl) (4 н. раствор в диоксане) при комнатной температуре. Смеси концентрировали для получения хлористо-водородной соли, или образовавшееся твердое вещество выделяли фильтрованием. Соли трифторуксусной кислоты были получены в результате очистки неочищенного продукта реакции при помощи препаративной ВЭЖХ с обращенной фазой. Промежуточное соединение А. 1-трет-Бутиловый эфир и 4-этиловый эфир 5-оксоазепан-1,4 дикарбоновой кислоты К раствору 1-BOC-4-пиперидона (20 г, 0,10 моль) в Et2O (200 мл) при 0C добавляли BF3Et2O (14 мл, 0,11 моль) и затем по каплям добавляли этилдиазоацетат (13,7 мл, 0,11 моль) в течение 1 ч. Закончив добавление, смесь перемешивали при 0C в течение 1 ч. Смесь разбавляли 30% водным растворомNa2CO3 и водой при 0C и экстрагировали EtOAc. Объединенные органические слои сушили (Na2SO4) и концентрировали. Остаток (FCC) очищали, получая при этом указанное в заголовке соединение (25,6 г,98%). 1 Указанное в заголовке соединение было получено аналогично промежуточному соединению A из 3'-трифторметил-2,3,5,6-тетрагидро-[1,2']бипиридинил-4-она (см. публикацию заявки на патент США 2005/080095) с использованием CH2Cl2 вместо Et2O при комнатной температуре и времени реакции, равном 12 ч. MS (ESI): масса, вычисленная для C15H17F3N2O3, 330,12; m/z найдено, 331,1 [M+H]+. 1(8,8 г, 30,8 ммоль) в EtOH (308 мл) добавляли NaOEt (21% в EtOH/ 38 мл) и ацетат формамидина (4,8 г,45,9 ммоль). Смесь нагревали с обратным холодильником в течение 2 ч и концентрировали, получая азеотропную смесь с толуолом. Остаток растворяли в воде и подщелачивали, добавляя 50% водный раствор NaOH. Водный слой экстрагировали толуолом и подкисляли до pH 7, добавляя HOAc (с образованием осадка). Смесь нагревали при 100C в течение 1 ч, охлаждали до 0C и фильтровали, получая при этом указанное в заголовке соединение (2,5 г, 31%), которое использовали без дальнейшей очистки. Стадия В. 6,7,8,9-Тетрагидро-5H-пиримидо[4,5-d]азепин-4-ол(200 мг, 1,0 ммоль) растворяли в MeOH (10 мл), фильтровали через смолу четвертичного амина в виде карбоната (1,0 г) и концентрировали, получая при этом указанное в заголовке соединение (159 мг, 97%). Стадия С. 7-(3-Трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ол Раствор 6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ола (353 мг, 1,76 ммоль), 2-фтор-3 трифторметилпиридина (582 мг, 3,53 ммоль), iPr2NEt (0,9 мл, 5,28 ммоль) и трет-амилового спирта (5 мл) нагревали в микроволновом реакторе при 180C в течение 5 ч. Смесь концентрировали, разбавляли водой и экстрагировали EtOAc. Объединенные органические слои сушили (Na2SO4) и концентрировали,получая при этом указанное в заголовке соединение (185 мг, 34%), которое использовали на следующей- 12017069 стадии без дальнейшей очистки. Стадия D. 4-Хлор-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин(185 мг, 0,60 ммоль) в CH3CN (2 мл) добавляли POCl3 (0,11 мл, 1,19 ммоль). Реакционную смесь нагревали при 90C в течение 2 ч. Смесь охлаждали до комнатной температуры, разбавляли EtOAc и медленно гасили насыщенным водным раствором NaHCO3. Объединенные органические слои сушили (Na2SO4) и концентрировали. Неочищенный остаток очищали (FCC), получая при этом указанное в заголовке соединение (65 мг, 33%). СтадияE. К раствору 4-хлор-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5Hпиримидо[4,5-d]азепина (27 мг, 0,085 ммоль) в n-BuOH (1 мл) добавляли 4-трет-бутиланилин (27 мкл,0,17 ммоль). Смесь нагревали при 135C в течение 2 ч, охлаждали до комнатной температуры, гасили насыщенным водным раствором NaHCO3 и экстрагировали EtOAc. Объединенные органические слои сушили (Na2SO4) и концентрировали. Остаток очищали (FCC), получая при этом указанное в заголовке соединение (33 мг, 89%). MS (ESI): масса, вычисленная для C24H26F3N5, 441,21; m/z найдено, 442,2[M+H]+. 1 Н ЯМР (CDCl3): 8,50 (с, 1H), 8,40-8,37 (м, 1H), 7,90-7,85 (м, 1H), 7,46-7,36 (м, 4H), 6,98-6,93 (м,1H), 6,45 (с, 1H), 3,70-3,65 (м, 2H), 3,64-3,60 (м, 2H), 3,26-3,20 (м, 2H), 3,02-2,95 (м, 2H), 1,32 (с, 9H). Альтернативно, реакция на данной стадии может быть выполнена в микроволновом реакторе при 180C в течение 30 мин. Пример 1A. Хлористо-водородная соль (4-трет-бутилфенил)-[7-(3-трифторметилпиридин-2-ил)6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амина. Соединения по нижеследующим примерам 2-16 были получены способами, аналогичными способам, описанным в примере 1, при использовании соответствующих амидинов на стадии A и аминов на стадии E. Пример 2. Указанное в заголовке соединение было синтезировано аналогично примеру 1 при внесении следующих изменений в стадию E. СтадияNaOtBu (16 мг, 0,16 ммоль) в толуоле (1,2 мл) в сосуде для микроволнового реактора добавляли растворPd(OAc)2 (0,4 мг, 0,002 ммоль) и 2-(дициклогексилфосфино)бифенила (DCPB) (1,2 мг, 0,004 ммоль) в толуоле (1 мл). Смесь продували N2(g) и нагревали в микроволновом реакторе при 200C в течение 30- 16017069 мин. Смесь охлаждали, фильтровали через слой диатомовой земли и концентрировали. Остаток очищали(FCC), получая при этом указанное в заголовке соединение (35 мг, 66%). MS (ESI): масса, вычисленная для C20H16F6N6, 454,13; m/z найдено, 453,2 [M+H]+. 1H ЯМР (CDCl3): 8,65 (с, 1H), 8,61 (д, J=8,8 Гц, 1H),8,54-8,51 (м, 1H), 8,41-8,38 (м, 1H), 7,95-7,85 (м, 2H), 7,64 (с, 1H), 7,01-6,95 (м, 1H), 3,67-3,57 (м, 4H),3,31-3,25 (м, 2H), 3,14-3,07 (м, 2H). Соединения по нижеследующим примерам 18-25 были получены способами, аналогичными способам, описанным в примере 17, при использовании соответствующих амидинов на стадии A и аминов на стадии E. Пример 18. Изохинолин-1-ил-[7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]амин Указанное в заголовке соединение было синтезировано аналогично примеру 1 при внесении следующих изменений в стадию С и использовании 4-трифторметиланилина на стадии E. Стадия С. 7-(4-Трифторметилпиримидин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ол. Раствор 6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ола (60 мг, 0,30 ммоль), 2-хлор-4- 18017069 трифторпиримидина (36 мкл, 0,30 ммоль) и Et3N (0,11 мл, 0,81 ммоль) в ДМФА (1,2 мл) нагревали при 120C в течение 2 ч. Смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировалиEtOAc. Объединенные органические слои сушили (Na2SO4) и концентрировали, получая при этом указанное в заголовке соединение (69 мг, 68%), которое использовали без дальнейшей очистки. Стадия E. MS (ESI): масса, вычисленная для C20H16F6N6, 454,13; m/z найдено, 455,1 [M+H]+. 1H ЯМР Указанное в заголовке соединение было получено аналогично способу, описанному в примере 26,при использовании 2-хлорпиримидина на стадии С. MS (ESI): масса, вычисленная для C19H17F3N6, 386,15; Указанное в заголовке соединение было получено аналогично примеру 26 при использовании 2 хлорпиразина на стадии C. MS (ESI): масса, вычисленная для C19H17F3N6, 386,15; m/z найдено, 387,1 Указанное в заголовке соединение было получено аналогично примеру 26 при использовании 2 хлорхиноксалина на стадии C. MS (ESI): масса, вычисленная для C23H19F3N6, 436,16; m/z найдено, 437,1 Указанное в заголовке соединение было получено аналогично примеру 26 при использовании 2,3 дихлорпиридина на стадии C. MS (ESI): масса, вычисленная для C20H17ClF3N5, 419,11; m/z найдено, 420,1 Указанное в заголовке соединение было получено аналогично примеру 26 при использовании 4,6 дихлор-5-метилпиримидина на стадии C и 4-трет-бутиланилина на стадии Е. MS (ESI-): масса, вычисленная для C23H27ClN6, 422,20; m/z найдено, 421,2 [M-H]-. 1H ЯМР (CDCl3): 8,50 (с, 1H), 8,33 (с, 1H), 7,447,36 (м, 4H), 6,43 (с, 1H), 3,91-3,84 (м, 2H), 3,81-3,75 (м, 2H), 3,26-3,19 (м, 2H), 3,04-2,98 (м, 2H), 2,31 (с,3H), 1,32 (с, 9H). Пример 32. (4-трет-Бутилфенил)-[7-(3-метилхиноксалин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5d]азепин-4-ил]амин Указанное в заголовке соединение было получено аналогично примеру 26 при использовании 2 хлор-3-метилхинолина на стадии С и 4-трет-бутиланилина на стадии E. MS (ESI-): масса, вычисленная для C27H30N6, 438,25; m/z найдено, 437,2 [M-H]-. 1H ЯМР (CDCl3): 8,51 (с, 1H), 7,90-7,87 (м, 1H), 7,79-7,76 Указанное в заголовке соединение было получено аналогично примеру 26 при использовании 2 хлор-3-метилхинолина на стадии C и 4-трет-бутиланилина на стадии E. MS (ESI-): масса, вычисленная для C30H36N6, 480,3; m/z найдено, 479,3 [M-H]-. 1H ЯМР (CDCl3): 7,89-7,86 (м, 1H), 7,78-7,76 (м, 1H), 7,627,54 (м, 3H), 7,51-7,47 (м, 1H), 7,37-7,34 (м, 2H), 6,48 (с, 1H), 3,77-3,73 (м, 2H), 3,71-3,67 (м, 2H), 3,29-3,23 Указанное в заголовке соединение было получено аналогично примеру 26 при использовании 2 хлор-3-метилхинолина на стадии C. MS (ESI): масса, вычисленная для C27H27F3N6, 492,22; m/z найдено,493,2 [M+H]+. 1H ЯМР (CDCl3): 7,89-7,86 (м, 1H), 7,81-7,75 (м, 3H), 7,61-7,55 (м, 3H), 7,53-7,48 (м, 1H),6,67 (с, 1H), 3,78-3,75 (м, 2H), 3,72-3,68 (м, 2H), 3,32-3,27 (м, 2H), 3,09-3,02 (м, 3H), 2,75 (с, 3H), 1,32 (д,J=7,1 Гц, 6H). Пример 35. [2-Изопропил-7-(3-трифторметилхиноксалин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин Указанное в заголовке соединение было получено аналогично примеру 26 при использовании 2 хлор-3-трифторметилхинолина на стадии C. MS (ESI): масса, вычисленная для C27H24F6N6, 546,2; m/z найдено, 547,2 [M+H]+. 1H ЯМР (CDCl3): 8,06-8,03 (м, 1H), 7,88-7,71 (м, 4H), 7,65-7,57 (м, 3H), 6,66 (с,1H), 3,87-3,77 (м, 4H), 3,33-3,27 (м, 2H), 3,10-3,00 (м, 3H), 1,32 (д, J=6,8 Гц, 6H). Пример 36. [2-Изопропил-7-(3-метансульфонилпиридин-2-ил)-6,7,8,9-тетрагидро-6H-пиримидо[4,5d]азепин-4-ил]-(4-трифторметилфенил)амин Указанное в заголовке соединение было получено аналогично примеру 26 при использовании 2 хлор-3-(метилсульфонил)пиридина (см. публикацию Ponticello, G.S. et al., J. Org. Chem. 1979, 44(17),3080-3082) на стадии C. MS (ESI): масса, вычисленная для C24H26F3N5O2S, 505,18; m/z найдено, 506,1 Указанное в заголовке соединение было синтезировано аналогично примеру 1 при внесении следующих изменений в стадию С и использовании 4-трет-бутиланилина на стадии E. Стадия C. 7-Фталазин-1-ил-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ол. Раствор 6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ола (50 мг, 0,33 ммоль), 1,4 дихлорфталазина (55 мг, 0,28 ммоль) и Et2N (0,11 мл, 0,81 ммоль) в ДМФА (5 мл) нагревали при 120C в течение 2 ч. Смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали EtOAc. Объединенные органические слои сушили (Na2SO4) и концентрировали с образованием 7-(4 хлорфталазин-1-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ола (50 мг, 55%), 23 мг (0,14 ммоль) которого обрабатывали формиатом аммония (116 мг, 1,85 ммоль) и Pd(OH)2/C (14 мг, 0,08 ммоль) вMeOH/диоксане (1:1, 4 мл). Смесь нагревали при 100C в течение 1 ч, охлаждали до комнатной температуры, фильтровали через диатомовую землю и концентрировали, получая при этом указанное в заголовке соединение, которое ипользовали на стадии D аналогично примеру 1. MS (ESI-): масса, вычисленная для Указанное в заголовке соединение было получено аналогично примеру 37 при использовании 4,6 дихлор-5-метилпиримидина на стадии С. MS (ESI): масса, вычисленная для C23H28N6, 388,24; m/z найдено, 389,2 [M+H]+. 1 Н ЯМР (CDCl3): 8,53 (с, 1H), 8,49 (с, 1H), 8,09 (с, 1H), 7,43-7,35 (м, 4H), 6,43 (с, 1H),3,97-3,94 (м, 2H), 3,88-3,84 (м, 2H), 3,25-3,21 (м, 2H), 3,03-2,97 (м, 2H), 2,28 (с, 3H), 1,31 (с, 9H). Пример 39. [2-Пиперидин-1-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин Стадия A. 2-Пиперидин-1-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ол. К раствору KOtBu (1,3 г, 5,7 7 ммоль) в tBuOH (32 мл) добавляли этиловый эфир 5-оксо-1-(3 трифторметилпиридин-2-ил)азепан-4-карбоновой кислоты (промежуточное соединение B; 1,27 г, 3,85 ммоль) и гидробромид пиперидин-1-карбоксимидамида (1,2 г, 5,77 ммоль). Смесь нагревали с обратным холодильником в течение 24 ч, охлаждали и концентрировали. Остаток растворяли в воде и CH2Cl2. Водный слой подкисляли до pH 7, добавляя HOAc. Слои разделяли и водный слой экстрагировали CH2Cl2. Объединенные органические слои сушили (Na2SO4) и концентрировали. Остаток растирали в Et2O и фильтровали. Фильтрат концентрировали и остаток очищали (FCC), получая при этом указанное в заголовке соединение (776,4 г, 51% - объединяли, фильтровали и хроматографировали). СтадияB. 4-Хлор-2-пиперидин-1-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5Hпиримидо[4,5-d]азепин. К раствору 2-пиперидин-1-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5Hпиримидо[4,5-d]азепин-4-ола (435 мг, 1,11 ммоль) в CH3CN (9 мл) добавляли POCl3 (0,41 мл, 4,43 ммоль). Смесь нагревали при 80C в течение 1,5 ч, охлаждали до комнатной температуры, разбавляли EtOAc и медленно гасили насыщенным водным раствором NaHCO3. Органические слои объединяли, сушили(Na2SO4) и концентрировали. Неочищенный остаток очищали (FCC), получая при этом указанное в заголовке соединение (160 мг, 35%). Стадия C. [2-Пиперидин-1-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин. К раствору 4-хлор-2-пиперидин-1-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5Hпиримидо[4,5-d]азепина (50 мг, 0,12 ммоль), 4-трифторметиланилина (0,02 мл, 0,18 ммоль) и NaOtBu (16 мг, 0,17 ммоль) в толуоле (1,5 мл) в сосуде для микроволнового реактора добавляли раствор Pd(OAc)2(0,4 мг, 0,002 ммоль) и DCPB (1,3 мг, 0,004 ммоль) в толуоле (1 мл). Смесь продували N2(g) и нагревали в микроволновом реакторе при 200C в течение 50 мин. Смесь охлаждали и фильтровали через слой диатомовой земли. Фильтрат концентрировали и остаток очищали (FCC), получая при этом указанное в заголовке соединение (48 мг, 89%). MS (ESI): масса, вычисленная для C26H26F6N6, 536,21; m/z найдено,537,2 [M+H]+. 1H ЯМР (CDCl3): 8,40-8,37 (м, 1H), 7,87 (д, J=1,8 Гц, 1H), 7,65 (д, J=8,6 Гц, 2H), 7,55 (д,J=8,8 Гц, 2H), 6,97-6,91 (м, 1H), 6,49 (с, 1H), 3,77-3,71 (м, 4H), 3,62-3,54 (м, 4H), 3,10-3,06 (м, 2H), 2,892,84 (м, 2H), 1,70-1,56 (м, 6H). Пример 39A. Хлористо-водородная соль [2-пиперидин-1-ил-7-(3-трифторметилпиридин-2-ил)6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амина. 1H ЯМР (CD3OD): 8,48-8,45 (м, 1H), 8,05 (дд, J=7,8, 1,6 Гц, 1H), 7,78-7,68 (м, 4H), 7,19-7,13 (м, 1H),3,75-3,69 (м, 4H), 3,65-3,59 (м, 2H), 3,58-3,53 (м, 2H), 3,33-3,28 (м, 2H), 3,13-3,09 (м, 2H), 1,79-1,62 (м,- 22017069 6H). Соединения по нижеследующим примерам 40-45 были получены способом, аналогичным способу,описанному в примере 39, при использовании соответствующих карбоксимидамидов на стадии A. Пример 40. [2-Морфолин-4-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин Пример 43 В. Соль трифторуксусной кислоты N2,N2-Диметил-N4-(6-трифторметилпиридин-3-ил)-7(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамина. Указанное в заголовке соединение было синтезировано аналогично примеру 39 при внесении следующих изменений в стадию С. Стадия C. Смесь [4-хлор-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5d]азепин-2-ил]диметиламина (50 мг, 0,14 ммоль), 3-хлор-4-трифторметиланилина (40 мг, 0,20 ммоль) и паратолуолсульфоновой кислоты (51 мг, 0,27 ммоль) в толуоле (2 мл) нагревали в запаянной трубке при 120C в течение 18 ч. Смесь охлаждали, разбавляли насыщенным водным раствором NaHCO3 и экстрагировали CH2Cl2. Органический слой сушили (MgSO4) и концентрировали. Остаток очищали (FCC), получая при этом указанное в заголовке соединение (55 мг, 78%). MS (ESI): масса, вычисленная для Указанное в заголовке соединение было получено способами, аналогичными способам по примеру 1, при внесении следующих изменений в стадию E. Стадия E. Смесь 4-хлор-2-изопропил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5Hпиримидо[4,5-d]азепина (50 мг, 0,14 ммоль), 4-броманилина (35 мг, 0,36 ммоль) и паратолуолсульфоновой кислоты (51 мг, 0,27 ммоль) в толуоле (2 мл) нагревали в запаянной трубке при 130C в течение 18 ч. Смесь охлаждали, разбавляли насыщенным водным раствором NaHCO3 и экстрагировали EtOAc. Органический слой сушили (Na2SO4) и концентрировали. Остаток очищали (FCC), получая при этом указанное в заголовке соединение (57 мг, 77%). MS (ESI): масса, вычисленная для C23H23BrF3K5, 505,11; m/z найдено, 506,1 [M+H]+. 1H ЯМР (CDCl3): 8,41-8,39 (м, 1H), 7,90-7,87 (м, 1H), 7,61-7,56 (м, 2H), 7,48-7,43- 24017069 Указанное в заголовке соединение было синтезировано аналогично примеру 39 при внесении следующих изменений в стадию С. СтадияC. К раствору 4-хлор-2-морфолин-4-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9 тетрагидро-5H-пиримидо[4,5-d]азепина (30 мг, 0,08 ммоль) в n-BuOH (2 мл) добавляли 4-третбутиланилин (23 мкл, 0,15 ммоль). Смесь нагревали в микроволновом реакторе при 180C в течение 90 мин, охлаждали до комнатной температуры, разбавляли MeOH и фильтровали через смолу четвертичного амина в виде карбоната (500 мг). Фильтрат концентрировали и остаток очищали (FCC), получая при этом указанное в заголовке соединение (39 мг, 99%). MS (ESI): масса, вычисленная для C28H33F3N6O,526,27; m/z найдено, 527,2 [M+H]+. 1H ЯМР (CDCl3): 8,40-8,37 (м, 1H), 7,87 (д, J=1,8 Гц, 1H), 7,48-7,43 (м,2H), 7,37-7,31 (м, 2H), 6,96-6,89 (м, 1H), 6,35 (с, 1H), 3,80-3,70 (м, 8H), 3,64-3,54 (м, 4H), 3,11-3,04 (м, 2H),2,88-2,82 (м, 2H), 1,33 (с, 9H). Соединения по нижеследующим примерам 48-51 были получены аналогично способам по примеру 47 при использовании соответствующих карбоксимидамидов на стадии A и аминов на стадии C. Пример 48.MS (ESI): масса, вычисленная для C26H31F3N6, 484,26; m/z найдено, 485,9 [M+H]+. Пример 48. Соль трифторуксусной кислоты N4-(4-трет-бутилфенил)-N2,N2-диметил-7-(3 трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамина. 1A. 2-Метилсульфанил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5Hпиримидо[4,5-d]азепин-4-ол. К раствору этилового эфира 5-оксо-1-(3-трифторметилпиридин-2-ил)азепан-4-карбоновой кислоты(3,0 г, 9,09 ммоль) в EtOH (40 мл) добавляли NaOEt (1,97 г, 29,1 ммоль) и тиомочевину (1,1 г, 13,6 ммоль). Смесь нагревали с обратным холодильником в течение 12 ч. Смесь охлаждали, по каплям добавляли MeI (0,74 мл, 11,8 ммоль) и перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали, остаток растворяли в воде и подкисляли до pH 7, добавляя HOAc (с образованием осадка). Твердое вещество фильтровали, получая при этом указанное в заголовке соединение (3,3 г, 99%), которое использовали на следующей стадии без дальнейшей очистки. СтадияB. 4-Хлор-2-метилсульфанил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5Hпиримидо[4,5-d]азепин. К раствору 2-метилсульфанил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5Hпиримидо[4,5-d]азепин-4-ола (1,8 г, 4,92 ммоль) в CH3CN (40 мл) добавляли POCl3 (1,4 мл, 14,8 ммоль). Смесь нагревали при 80C в течение 15 мин, охлаждали до комнатной температуры, разбавляли EtOAc и медленно гасили насыщенным водным раствором NaHCO3. Органический слой отделяли, сушили(MgSO4) и концентрировали. Неочищенный остаток очищали (FCC), получая при этом указанное в заголовке соединение (1,6 г, 89%). Стадия C. К раствору 4-хлор-2-метилсульфанил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9 тетрагидро-5H-пиримидо[4,5-d]азепина (830 мг, 2,22 ммоль) в n-BuOH (5 мл) добавляли 4 трифторметиланилин (0,4 мл, 3,30 ммоль). Смесь нагревали в микроволновом реакторе при 160C в течение 30 мин, затем охлаждали до комнатной температуры, гасили наыщенным водным раствором NaHCO3 и экстрагировали EtOAc. Объединенные органические слои сушили (MgSO4) и концентрировали. Остаток очищали (FCC), получая при этом указанное в заголовке соединение (950 мг, 86%). MS (ESI): масса,вычисленная для C22H19F6N5S, 499,13; m/z найдено, 500,1 [M+H]+. 1H ЯМР (CDCl3): 8,40-8,37 (м, 1H),7,89-7,86 (м, 1H), 7,69 (д, J=8,6 Гц, 2H), 7,58 (д, J=9,1 Гц, 2H), 6,99-6,94 (м, 1H), 6,65 (с, 1H), 3,66-3,62 (м,2H), 3,60-3,56 (м, 2H), 3,21-3,16 (м, 2H), 2,99-2,94 (м, 2H), 2,53 (с, 3H). Пример 53. [2-Метансульфонил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин[2-метилсульфанил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5Hпиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амина (пример 52; 513 мг, 1,02 ммоль) в CH2Cl2 (10 мл) добавляли mCPBA (77%; 480 мг, 2,22 ммоль). Через 2 ч смесь разбавляли насыщенным водным раствором NaHCO3 и экстрагировали CH2Cl2. Объединенные органические слои сушили (MgSO4) и концентрировали. Остаток очищали (FCC; MeOH/CH2Cl2), получая при этом указанное в заголовке соединение Раствор [2-метансульфонил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5d]азепин-4-ил]-(4-трифторметилфенил)амина (пример 53; 30 мг, 0,06 ммоль), анилина (8 мг, 0,09 ммоль) и паратолуолсульфоновой кислоты (21,3 мг, 0,11 ммоль) в толуоле (2 мл) нагревали при 125C в течение 12 ч. Смесь охлаждали и очищали препаративной ВЭЖХ, получая при этом указанное в заголовке соединение (20 мг, 67%). MS (ESI): масса, вычисленная для C27H22F6N6, 544,18; m/z найдено, 545,9 [M+H]+. 1H ЯМР (CD3OD): 8,46-8,44 (м, 1H), 8,00-7,97 (м, 1H), 7,66-7,58 (м, 4H), 7,48 (с, 1H), 7,45-7,42 (м, 2H), 7,247,19 (м, 2H), 7,16-7,11 (м, 2H), 3,63-3,59 (м, 2H), 3,57-3,53 (м, 2H), 3,29-3,25 (м, 2H), 3,11-3,07 (м, 2H). Пример 55. N2-Циклопропил-N4-(4-трифторметилфенил)-7-(3-трифторметилпиридин-2-ил)-6,7,8,9 тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамин Указанное в заголовке соединение было получено способами, аналогичными способам, описанным в примере 54, при использовании н-бутанола или трет-амилового спирта в качестве растворителя и нагревании в запаянной трубке при 130C без добавления паратолуолсульфоновой кислоты. Пример 55B. Соль трифторуксусной кислоты N2-циклопропил-N4-(4-трифторметилфенил)-7-(3 трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2,4-диамина.(м, 2H). Соединения по примерам 56-61 были получены способами, аналогичными способам, описанным в примере 55. Пример 56. [2-Азетидин-1-ил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амин Пример 56B. Соль трифторуксусной кислоты [2-азетидин-1-ил-7-(3-трифторметилпиридин-2-ил)6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амина. Пример 57B. Соль трифторуксусной кислоты 1-[4-(4-трифторметилфениламино)-7-(3 трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2-ил]пиперидин-4-карбоновой кислоты. Пример 59 В. Соль трифторуксусной кислоты 1-[4-(4-трифторметилфениламино)-7-(3 трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-2-ил]пиперидин-4-ола. Пример 60B. Соль трифторуксусной кислоты [2-(4-изопролилпиперазин-1-ил)-7-(3-трифторметилпиридин 2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5-d]азепин-4-ил]-(4-трифторметилфенил)амина. Раствор [2-метансульфонил-7-(3-трифторметилпиридин-2-ил)-6,7,8,9-тетрагидро-5H-пиримидо[4,5d]азепин-4-ил]-(4-трифторметилфенил)амина (пример 53; 44 мг, 0,08 ммоль) и NaOMe (100 мг, 0,25 ммоль) в MeOH (1,5 мл) нагревали при 60C в течение 1 ч. Смесь охлаждали, подкисляли HOAc (3 капли) и очищали препаративной ВЭЖХ (условия выполнения такие же, как в примере 54), получая при этом указанное в заголовке соединение (35 мг, 89%). MS (ESI): масса, вычисленная для C22H19F6N5O,483,15; m/z найдено, 484,8 [M+H]+. 1H ЯМР (CDCl3): 9,63 (с, 1H), 8,39 (д, J=3,3 Гц, 1H), 7,89 (д, J=7,7 Гц,1H), 7,73 (д, J=8,5 Гц, 2H), 7,63 (д, J=8,5 Гц, 2H), 7,06-7,02 (м, 1H), 3,88 (с, 3H), 3,50-3,44 (м, 4H), 3,263,22 (м, 2H), 3,11-3,07 (м, 2H). Соединения по нижеследующим примерам 63-109 были получены способами, аналогичными способам, описанным в предыдущих примерах. Пример 63.MS (ESI): масса, вычисленная для C22H21Cl2F3N6, 496,12; m/z найдено, 497,8 [M+H]+. Пример 63 В. Соль трифторуксусной кислоты N4-(3,4-дихлорфенил)-N2,N2-диметил-7-(3- 29
МПК / Метки
МПК: A61K 31/55, A61P 1/00, A61P 17/00, C07D 487/04, A61P 25/04, A61P 11/06, A61P 11/14, A61K 31/519
Метки: тетрагидропиримидоазепины, применение, качестве, trpv1, модуляторов
Код ссылки
<a href="https://eas.patents.su/30-17069-tetragidropirimidoazepiny-i-ih-primenenie-v-kachestve-modulyatorov-trpv1.html" rel="bookmark" title="База патентов Евразийского Союза">Тетрагидропиримидоазепины и их применение в качестве модуляторов trpv1</a>
Следующий патент: Способ получения оптических активных хиральных аминов
Случайный патент: Гидропривод универсального превентора