Производные бензимидазола
Номер патента: 16888
Опубликовано: 30.08.2012
Авторы: Райтер Лоренс Алан, Ла Грека Сьюзан, Ли Цифан, Джоунз Кристофер Скотт, Манчхоф Майкл Джон
Формула / Реферат
1. Соединение формулы II(а)
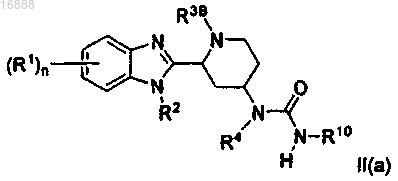
где каждый R1 независимо представляет собой галоген, (C1-С6)алкил, (C1-C6)алкокси, -CF3, -CN или
-NR16R17;
R2 представляет собой водород или (C1-C6)алкил;
R3B представляет собой водород, (C1-C6)алкил, -(CH2)t(C6-С12)арил или -(СН2)t(C3-C12)карбоциклил;
R4 представляет собой водород или (C1-C6)алкил;
R10 представляет собой -(СН2)t(C6-C12)арил или -(СН2)t(4-14-членный гетероциклил), где каждый указанный (С6-С12)арил и (4-14-членный гетероциклил) необязательно замещен от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-С6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1-C6)алкокси, -NO2,
-(СН2)t(С6-С12)арила, -С(О)((C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -S((C1-C6)алкила);
каждый R16 и R17 независимо выбран из водорода и (C1-C6)алкила;
n равен 0, 1, 2, 3 или 4;
каждый t независимо представляет собой 0, 1 или 2;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где
каждый R1 независимо представляет собой F, Cl, Br, -СН3, -ОСН3, -CF3, -CN или -NR16R17;
R2 представляет собой водород;
R3B представляет собой водород, -СН3, -СН2СН3, -СН2СН2СН3, -СН(СН3)2, -СН2СН2СН2СН3, -СН2СН(СН3)2 или -СН2(фенил);
R4 представляет собой водород;
R10 представляет собой фенил, пиридил или 2,3-дигидро-1,4-бензодиоксинил, где каждый указанный фенил, пиридил и 2,3-дигидро-1,4-бензодиоксинил необязательно замещен от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-С6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1-C6)алкокси, -NO2,
-(CH2)t(C6-C12)арила, -C(O)((C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -S((C1-C6)алкила);
или его фармацевтически приемлемая соль.
3. Соединение по п.2, где
каждый R1 независимо представляет собой F, Cl, -СН3, -ОСН3, -CF3, -CN или -N(CH3)2;
R3B представляет собой -СН3;
R10 представляет собой фенил, 2-пиридил, 3-пиридил, 4-пиридил или 2,3-дигидро-1,4-бензодиоксин-6-ил, где каждый указанный фенил, 2-пиридил, 3-пиридил, 4-пиридил и 2,3-дигидро-1,4-бензодиоксин-6-ил необязательно замещен от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-С6)алкила,
-CN, галогена, -CF3, -OCF3, -NR16R17, (C1-C6)алкокси, -NO2, -(СН2)t(C6-C12)арила, -C(O)((C1-C6)алкила),
-C(O)CF3, азидо, (4-12-членного гетероциклила) и -S((C1-C6)алкила);
или его фармацевтически приемлемая соль.
4. Соединение по п.3, где R10 представляет собой фенил, 3-пиридил или 2,3-дигидро-1,4-бензодиоксин-6-ил, где каждый указанный фенил, 3-пиридил и 2,3-дигидро-1,4-бензодиоксин-6-ил необязательно замещен от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-C6)алкила, -CN, галогена, -CF3, -OCF3,
-NR16R17, (C1-C6)алкокси, -NO2, -(CH2)t(C6-C12)арила, -C(O)((C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -S((C1-C6)алкила); или его фармацевтически приемлемая соль.
5. Соединение по п.4, где R10 представляет собой фенил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-C6)алкила, -CN, галогена, -CF3, -OCF3,
-NR16R17, (C1-C6)алкокси, -NO2, -(CH2)t(C6-C12)арила, -C(O)((C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -S((C1-C6)алкила); или его фармацевтически приемлемая соль.
6. Соединение по п.5, где R10 представляет собой фенил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из -СН3, -CN, -F, -Cl, -Br, -CF3, -OCF3, -NR16R17,
-ОСН3 и -NO2; или его фармацевтически приемлемая соль.
7. Соединение формулы III(а)

где каждый R1 независимо представляет собой галоген, (C1-С6)алкил, (C1-C6)алкокси, -CF3, -CN или
-NR16R17;
R2 представляет собой водород или (C1-C6)алкил;
R3B представляет собой водород, (C1-C6)алкил, -(CH2)t(C6-С12)арил или -(СН2)t(С3-С12)карбоциклил;
R4 представляет собой водород или (C1-C6)алкил;
R11 представляет собой -(СН2)t(C6-C12)арил или -(СН2)t(4-14-членный гетероциклил), где каждый указанный (С6-С12)арил и (4-14-членный гетероциклил) необязательно замещен от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-С6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1-C6)алкокси, -NO2,
-(СН2)t(С6-С12)арила, -C(O)((C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -S((C1-C6)алкила);
каждый R16 и R17 независимо выбран из водорода и (C1-С6)алкила;
n равен 0, 1, 2, 3 или 4;
каждый t независимо представляет собой 0, 1 или 2;
или его фармацевтически приемлемая соль.
8. Соединение формулы IV(а)
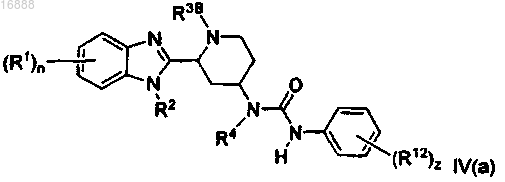
где каждый R1 независимо представляет собой галоген, (C1-С6)алкил, (C1-C6)алкокси, -CF3, -CN или
-NR16R17;
R2 представляет собой водород или (C1-C6)алкил;
R3B представляет собой водород, (C1-C6)алкил, -(СН2)t(С6-С12)арил или -(СН2)t(C3-C12)карбоциклил;
R4 представляет собой водород или (C1-C6)алкил;
каждый R12 независимо выбран из -(СН2)t(С6-С12)арила, -(СН2)t(4-14-членного гетероциклила), (C1-C6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1-C6)алкокси, -NO2, -(CH2)t(C6-С12)арила, -C(O)((C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -S((C1-C6)алкила);
каждый R16 и R17 независимо выбран из водорода и (C1-С6)алкила;
n равен 0, 1, 2, 3 или 4;
каждый t независимо представляет собой 0, 1 или 2;
z равен 0, 1, 2, 3, 4 или 5;
или его фармацевтически приемлемая соль.
9. Соединение по п.8, где
R2 представляет собой водород;
R3B представляет собой -СН3;
R4 представляет собой водород;
каждый R12 независимо выбран из -CN, -F, -Cl, -Br, -CF3, -OCF3, -NR16R17, -ОСН3 и -NO2;
или его фармацевтически приемлемая соль.
10. Соединение по п.9, где
каждый R1 независимо представляет собой галоген, -СН3, -ОСН3, -CF3, -CN или -N(CH3)2;
R12 представляет собой -CN, -F, -Cl, -Br, -CF3, -OCF3, -OCH3 или -NO2;
z равен 1;
или его фармацевтически приемлемая соль.
11. Соединение по п.10, где
R12 представляет собой -CN, -F, -Cl, -Br или -CF3;
n равен 0;
или его фармацевтически приемлемая соль.
12. Соединение по п.11, где R12 представляет собой -CN, или его фармацевтически приемлемая соль.
13. Соединение, выбранное из группы, состоящей из
1-[(2R,4R)-2-(1Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-3-(4-цианофенил)мочевины;
1-[(2R,4R)-2-(1Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-3-(4-хлорфенил)мочевины;
1-[(2R,4R)-2-(1Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-3-(6-фторпиридин-3-ил)мочевины;
N-[(2R,4R)-2-(1Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]хроман-6-карбоксамида;
N-[(2R,4R)-2-(6-хлор-1Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-2,3-дигидро-1,4-бензодиоксин-6-карбоксамида;
1-{(2R,4R)-1-метил-2-[5-(трифторметил)-1Н-бензимидазол-2-ил]пиперидин-4-ил}-3-[6-(трифторметил)пиридин-3-ил]мочевины;
1-[(2R,4R)-2-(1Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-3-(4-метоксифенил)мочевины;
N-[(2R,4R)-2-(6-метокси-1Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-2,3-дигидро-1,4-бензодиоксин-6-карбоксамида;
1-[(2R,4R)-2-(1Н-бензимидазол-2-ил)-1-изобутилпиперидин-4-ил]-3-(4-цианофенил)мочевины;
1-[(2R,4R)-2-(1Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-3-(6-фтор-5-метилпиридин-3-ил)мочевины;
или его фармацевтически приемлемая соль.
14. Фармацевтическая композиция, содержащая по меньшей мере одно соединение по любому из пп.1-13 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
15. Соединение, представляющее собой
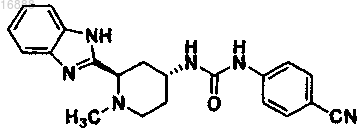
или его фармацевтически приемлемая соль.
16. Фармацевтическая композиция, содержащая соединение по п.15 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Текст
Настоящее изобретение относится к соединению формулы II(а), III(а) и IV(a): Джоунз Кристофер Скотт, Ла Грека Сьюзан, Ли Цифан, Манчхоф Майкл Джон, Райтер Лоренс Алан (US) или его фармацевтически приемлемой соли, где R1, R2, R3B, R4, R10, R11, R12, n и z имеют указанные в формуле изобретения значения. Такие новые производные бензимидазола могут быть использованы в лечении патологического роста клеток, такого как злокачественная опухоль,у млекопитающих. Данное изобретение относится также к фармацевтическим композициям,содержащим указанные соединения. 016888 Область техники, к которой относится изобретение По заявке на данный патент испрашивается приоритет заявок США 60/947287, поданной 29 июня 2007 г., и 60/041645, поданной 2 апреля 2008 г., обе включены в настоящий документ в качестве ссылки в полном объеме. Настоящее изобретение относится к новым производным бензимидазола, которые используют в лечении патологического роста клеток, такого как злокачественная опухоль, у млекопитающих. Настоящее изобретение также относится к способу применения таких соединений в лечении патологического роста клеток у млекопитающих, главным образом человека, и в фармацевтических композициях, содержащих такие соединения. Уровень техники Белки семейства Hedgehog (Hh) представляют собой секретированные морфогены, которые участвуют во множестве биологических процессов в течение эмбрионального развития. Постнатально, Hh играют важную роль в гомеостазе ткани, и аберрантная передача сигнала Hh связана с нарушениями развития и несколькими типами злокачественной опухоли. На поверхности клетки сигнал Hh, как полагают,передается посредством белка Patched (Ptc) с 12 трансмембранными доменами (Hooper and Scott, Cell 59: 75 1-65 (1989); Nakano et al., Nature 341: 508-13 (1989 и белка Smoothened (Smo), сходного с G-белоксвязывающим рецептором (Alcedo et al., Cell 86: 221-232 (1996); van den Heuvel and Tngham, Nature 382: 547-551 (1996. Как генетические, так и биохимические данные подтверждают рецепторную модель,причем Ptch и Smo являются частью мультикомпонентного рецепторного комплекса (Chen and Struhl,Cell 87: 553-63 (1996); Mango et al., Nature 384: 176-9 (1996); Stone et al., Nature 384:129-34 (1996. После связывания Hh с Ptch нормальный ингибирующий эффект Ptch в отношении Smo ослабляется, позволяяSmo передавать сигнал Hh через плазменную мембрану. Однако точный механизм, посредством которого Ptch контролирует активность Smo, до сих пор не ясен. Сигнальный каскад, запускаемый Smo, приводит к активации транскрипционных факторов Gli, которые переносятся в ядро и осуществляют в нем контроль транскрипции гена-мишени. Было показано,что Gli оказывает влияние на транскрипцию ингибиторов пути Hh, таких как Ptc и Hip I, с помощью петли отрицательной обратной связи, что указывает на то, что жесткий контроль активации пути Hh необходим для правильной клеточной дифференцировки и формирования органа. Неуправляемая активация сигнальных путей Hh связана с развитием злокачественных опухолей, в частности опухолей головного мозга, кожи и мышц, а также с ангиогенезом. Объяснением этому является тот факт, что, как было показано, путь Hh контролирует клеточную пролиферацию взрослого организма, активируя гены, участвующие в процессе клеточного цикла, такие как циклин D, который вовлечен в передачу G1-S. Также SonicHedgehog (SHh), ортолог Hh, блокирует остановку клеточного цикла, опосредованную р 21, ингибитором циклин-зависимой киназы. Сигнальный путь Hh дополнительно вовлечен в развитие рака за счет индукции компонентов пути EGFR (EGF, Her2), участвующих в пролиферации, а также компонентов в путяхPDGF (PDGFa) и VEGF, участвующих в ангиогенезе. Мутации с утратой функции гена Ptch обнаружили у пациентов с синдромом базально-клеточного невуса (BCNS), наследственным заболеванием, характеризуемым множественным базально-клеточным раком (ВСС). Мутации гена Ptch, приводящие к его дисфункции, также связаны с большим процентом спорадического базально-клеточного рака (Chidambaramal., Am. J. Hum. Genet. 60: 21-6 (1997. Утрата функции гена Ptch, как полагают, вызывает безконтрольную активацию сигнального пути Smo при базально-клеточном раке. Аналогично, при спорадических ВСС опухолях были идентифицированы мутации с активацией Smo (Xie et al., Nature 391: 90-2 (1998,что подчеркивает роль Smo в качестве сигнальной субъединицы в рецепторном комплексе SHh. Проводились исследования в отношении различных ингибиторов сигнального пути hedgehog, такого как циклопамин, природный алкалоид, который, как было показано, ингибирует клеточный цикл на стадии G0G1 и индуцирует апоптоз SCLC. Циклопамин, как полагают, ингибирует Smo, связываясь с его гептаспиральным участком. Было показано, что форсколин ингибирует путь Hh в обратном направлении отSmo, активируя киназный белок А (РКА), который поддерживает транскрипционные факторы Gli в неактивном состоянии. Несмотря на преимущества этих и других соединений, остается потребность в эффективных ингибиторах сигнального пути hedgehog.-1 016888 Сущность изобретения Настоящее изобретение относится к соединению формулы II(а) где каждый R1 независимо представляет собой галоген, (C1-C6)алкил, (C1-C6)алкокси, -CF3, -CN илиR2 представляет собой водород или (C1-C6)алкил;R4 представляет собой водород или (C1-C6)алкил;R10 представляет собой -(СН 2)t(C6-C12)арил или -(СН 2)t(4-14-членный гетероциклил), где каждый указанный (С 6-С 12)арил и (4-14-членный гетероциклил) необязательно замещен от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-С 6)алкила, -CN, галогена, -CF3, -OCF3,-NR16R17, (C1-C6)алкокси, -NO2, -(СН 2)t(С 6-С 12)арила, -C(O)C1-C6)алкила), -C(O)CF3, азидо, (4-12 членного гетероциклила) и -SC1-C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. В другом варианте осуществления изобретение относится к соединению формулы II(а), где каждый R1 независимо представляет собой F, Cl, Br, -СН 3, -ОСН 3, -CF3, -CN или -NR16R17;R10 представляет собой фенил, пиридил или 2,3-дигидро-1,4-бензодиоксинил, где каждый указанный фенил, пиридил и 2,3-дигидро-1,4-бензодиоксинил необязательно замещен от 1 до 5 заместителями,каждый из которых независимо выбран из (С 1-С 6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1C6)алкокси, -NO2, -(CH2)t(C6-C12)арила, -C(O)C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -SC1-C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. В еще одном варианте осуществления изобретение относится к соединению формулы II(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R10 представляет собой фенил, 2-пиридил, 3-пиридил, 4-пиридил или 2,3-дигидро-1,4 бензодиоксин-6-ил, где каждый указанный фенил, 2-пиридил, 3-пиридил, 4-пиридил и 2,3-дигидро-1,4 бензодиоксин-6-ил необязательно замещен от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-С 6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1-C6)алкокси, -NO2, -(CH2)t(C6-C12)арила,-C(O)C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -SC1-C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. В другом варианте осуществления изобретение относится к соединению формулы II(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN, -N(CH3)2;R10 представляет собой фенил, 3-пиридил или 2,3-дигидро-1,4-бензодиоксин-6-ил, где каждый указанный фенил, 3-пиридил и 2,3-дигидро-1,4-бензодиоксин-6-ил необязательно замещен от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-С 6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17,(C1-C6)алкокси, -NO2, -(CH2)t(C6-C12)арила, -C(O)C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -SC1-C6)алкила); 16-2 016888 каждый R16 и R17 независимо выбран из водорода и (C1-C6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. В следующем варианте осуществления изобретение относится к соединению формулы II(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R10 представляет собой фенил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-С 6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1-C6)алкокси, -NO2,-(CH2)t(C6-C12)арила, -С(О)(С 1-С 6 алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -SC1C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-C6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. Также настоящее изобретение относится к соединению формулы II(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R10 представляет собой фенил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из -СН 3, -CN, -F, -Cl, -Br, -CF3, -OCF3, -NR16R17, -OCH3 и -NO2; каждый R16 и R17 независимо выбран из водорода и (С 1-С 6)алкила;n равен 0, 1, 2, 3 или 4; или его фармацевтически приемлемой соли. В другом варианте осуществления изобретение относится к соединению формулы II(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R10 представляет собой 3-пиридил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-C6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1-С 6)алкокси, -NO2,-(CH2)t(C6-C12)арила, -C(O)C1-C6)алкила), C(O)CF3, азидо, (4-12-членного гетероциклила) и -SC1C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. В другом варианте осуществления изобретение относится к соединению формулы II(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R10 представляет собой 3-пиридил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из -СН 3, -CN, -F, -Cl, -Br, -CF3, -OCF3, -NR16R17, -OCH3 и -NO2; каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;n равен 0, 1, 2, 3 или 4; или его фармацевтически приемлемой соли. В другом варианте осуществления изобретение относится к соединению формулы II(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R10 представляет собой 2,3-дигидро-1,4-бензодиоксин-6-ил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-C6)алкила, -CN, галогена, -CF3, -OCF3,-NR16R17, (C1-C6)алкокси, -NO2, -(СН 2)t(С 6-С 12)арила, С(О)C1-C6)алкила), -C(O)CF3, азидо, (4-12 членного гетероциклила) и -SC1-C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-C6)алкила;-3 016888 или его фармацевтически приемлемой соли. В другом варианте осуществления изобретение относится к соединению формулы II(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R10 представляет собой 2,3-дигидро-1,4-бензодиоксин-6-ил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из -СН 3, -CN, -F, -Cl, -Br, -CF3, OCF3, -NR16R17,-OCH3 и -NO2; каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;n равен 0, 1, 2, 3 или 4; или его фармацевтически приемлемой соли. Кроме того, изобретение относится к соединению формулы III(а) где каждый R1 независимо представляет собой галоген, (C1-С 6)алкил, (C1-C6)алкокси, -CF3, -CN илиR2 представляет собой водород или (C1-C6)алкил;R4 представляет собой водород или (C1-C6)алкил;R11 представляет собой -(СН 2)t(С 6-С 12)арил или -(СН 2)t(4-14-членный гетероциклил), где каждый указанный (С 6-С 12)арил и (4-14-членный гетероциклил) необязательно замещен от 1 до 5 заместителями,каждый из которых независимо выбран из (C1-С 6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1C6)алкокси, -NO2, -(CH2)t(C6-C12)арила, -C(O)C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -SC1-C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-C6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. Кроме того, изобретение относится к соединению формулы III(а), где каждый R1 независимо представляет собой F, Cl, Br, -СН 3, -ОСН 3, -CF3, -CN или -NR16R17;R11 представляет собой фенил, пиридил или 2,3-дигидро-1,4-бензодиоксинил, где каждый указанный фенил, пиридил и 2,3-дигидро-1,4-бензодиоксинил необязательно замещен от 1 до 5 заместителями,каждый из которых независимо выбран из (C1-С 6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1C6)алкокси, -NO2, -CH2K(C6-C12)арила, -C(O)C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -SC1-C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. Дополнительно изобретение относится к соединению формулы III(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R11 представляет собой фенил, 2-пиридил, 3-пиридил, 4-пиридил или 2,3-дигидро-1,4 бензодиоксин-6-ил, где каждый указанный фенил, 2-пиридил, 3-пиридил, 4-пиридил и 2,3-дигидро-1,4 бензодиоксин-6-ил необязательно замещен от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-С 6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1-C6)алкокси, -NO2, -(СН 2)t(С 6-С 12)арила,-C(O)C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -SC1-C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. Кроме того, изобретение относится к соединению формулы III(а), где 16-4 016888 каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R11 представляет собой фенил, 3-пиридил или 2,3-дигидро-1,4-бензодиоксин-6-ил, где каждый указанный фенил, 3-пиридил и 2,3-дигидро-1,4-бензодиоксин-6-ил необязательно замещен от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-С 6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17,(C1-C6)алкокси, -NO2, -(CH2)t(C6-C12)арила, -C(O)C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -SC1-C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-C6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. Далее изобретение относится к соединению формулы III(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R11 представляет собой фенил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-С 6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1-C6)алкокси, -NO2,-(CH2)t(C6-C12)арила, -C(O)C1-C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -SC1C6)алкила); каждый R15 и R17 независимо выбран из водорода и (C1-C6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. Кроме того, изобретение относится к соединению формулы III(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R11 представляет собой фенил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из -СН 3, -CN, -F, -Cl, -Br, -CF3, -OCF3, -NR16R17, -OCH3 и -NO2; каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;n равен 0, 1, 2, 3 или 4; или его фармацевтически приемлемой соли. Кроме того, изобретение относится к соединению формулы III(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R11 представляет собой 3-пиридил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-C6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1-С 6)алкокси, -NO2,-(CH2)t(C6-C12)арила, -C(O)C1-C6)алкила), C(O)CF3, азидо, (4-12-членного гетероциклила) и -SC1C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-C6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. Кроме того, изобретение относится к соединению формулы III(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R11 представляет собой 3-пиридил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из -СН 3, -CN, -F, -Cl, -Br, -CF3, -OCF3, -NR16R17, -OCH3 и -NO2; каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;n равен 0, 1, 2, 3 или 4; или его фармацевтически приемлемой соли. Кроме того, изобретение относится к соединению формулы III(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R11 представляет собой 2,3-дигидро-1,4-бензодиоксин-6-ил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из (C1-C6)алкила, -CN, галогена, -CF3, -OCF3,-NR16R17, (C1-C6)алкокси, -NO2, -(СН 2)t(С 6-С 12)арила, С(O)C1-C6)алкила), -C(O)CF3, азидо, (4-12 членного гетероциклила) и -SC1-C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;n равен 0, 1, 2, 3 или 4; каждый t независимо равен 0, 1 или 2; или его фармацевтически приемлемой соли. Кроме того, изобретение относится к соединению формулы III(а), где каждый R1 независимо представляет собой F, Cl, -СН 3, -ОСН 3, -CF3, -CN или -N(CH3)2;R11 представляет собой 2,3-дигидро-1,4-бензодиоксин-6-ил, необязательно замещенный от 1 до 5 заместителями, каждый из которых независимо выбран из -СН 3, -CN, -F, -Cl, -Br, -CF3, OCF3, -NR16R17,-OCH3 и -NO2; каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;n равен 0, 1, 2, 3 или 4; или его фармацевтически приемлемой соли. Также изобретение относится к соединению формулы IV(a) где каждый R1 независимо представляет собой галоген, (C1-С 6)алкил, (C1-C6)алкокси, -CF3, -CN илиR2 представляет собой водород или (C1-C6)алкил;R4 представляет собой водород или (C1-C6)алкил; каждый R12 независимо выбран из -(СН 2)t(C6-C12)арила, (СН 2)t(4-14-членного гетероциклила), (C1C6)алкила, -CN, галогена, -CF3, -OCF3, -NR16R17, (C1-C6)алкокси, -NO2, -(СН 2)t(C6-C12)арила, -C(O)C1C6)алкила), -C(O)CF3, азидо, (4-12-членного гетероциклила) и -SC1-C6)алкила); каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;z равен 0, 1, 2, 3, 4 или 5; или его фармацевтически приемлемой соли. В другом варианте осуществления изобретение относится к соединению формулы IV(а), где каждый R1 независимо представляет собой галоген, (C1-С 6)алкил, (C1-C6)алкокси, -CF3, -CN или 16 17R4 представляет собой водород; каждый R12 независимо выбран из -CN, -F, -Cl, -Br, -CF3, -OCF3, -NR16R17, -ОСН 3 и -NO2; каждый R16 и R17 независимо выбран из водорода и (C1-С 6)алкила;z равен 0, 1, 2, 3, 4 или 5; или его фармацевтически приемлемой соли. Дополнительно изобретение относится к соединению формулы IV(а), где каждый R1 независимо представляет собой галоген, -СН 3, ОСН 3, -CF3, -CN или -N(СН 3)2;z равен 1; или его фармацевтически приемлемой соли. 16-6 016888 Дополнительно изобретение относится к соединению формулы IV(а), гдеz равен 1; или его фармацевтически приемлемой соли. Кроме того, изобретение относится к соединению формулы IV(а), гдеz равен 1; или его фармацевтически приемлемой соли. В настоящем документе предполагается, в частности, что каждая формула II(а), III(а) и IV(a) представляет отдельные варианты осуществления. В одном из вариантов осуществления изобретение относится к соединению, выбранному из группы,состоящей из 1-[(2R,4R)-2-(1 Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-3-(4-цианофенил)мочевины; 1-[(2R,4R)-2-(1 Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-3-(4-хлорфенил)мочевины; 1-[(2R,4R)-2-(1 Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-3-(6-фторпиридин-3-ил)мочевины;N-[(2R,4R)-2-(6-метокси-1 Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-2,3-дигидро-1,4 бензодиоксин-6-карбоксамида; 1-[(2R,4R)-2-(1 Н-бензимидазол-2-ил)-1-изобутилпиперидин-4-ил]-3-(4-цианофенил)мочевины и 1-[(2R,4R)-2-(1 Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-3-(6-фтор-5-метилпиридин-3 ил)мочевины; или его фармацевтически приемлемой соли. В одном из вариантов осуществления изобретение относится к соединению, представляющему собой 1-[(2R,4R)-2-(1 Н-бензимидазол-2-ил)-1-метилпиперидин-4-ил]-3-(4-цианофенил)мочевину или ее фармацевтически приемлемую соль. Настоящее изобретение также относится к фармацевтической композиции, содержащей эффективное количество соединения по изобретению или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя. Настоящее изобретение также относится к фармацевтически приемлемым солям добавления кислот соединений по изобретению. Кислотами, которые используют для получения фармацевтически приемлемых солей добавления кислот вышеуказанных основных соединений по данному изобретению, являются кислоты, которые образуют нетоксичные соли добавления кислот, т.е. соли, содержащие фармакологически приемлемые анионы, такие как, но ими не ограничиваются, хлорид, бромид, йодид, нитрат,сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат, цитрат, кислый цитрат, тартрат, битартрат,сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)]. Изобретение также относится к солям добавления оснований соединений по изобретению. Химическими основаниями, которые могут быть использованы в качестве реагентов для получения фармацевтически приемлемых основных солей этих соединений по изобретению, которые являются кислыми по своему характеру, являются те, которые образуют нетоксичные соли оснований с такими соединениями. Такие нетоксичные соли оснований включают, но не ограничиваются полученными из таких фармакологически приемлемых катионов, таких как катионы щелочных металлов (например, калий и натрий) и катионы щелочно-земельных металлов (например, кальций и магний), аммоний или водорастворимые соли добавления амина, такие как N-метилглюкамин-(меглумин) и низший алканоламмоний и другие соли оснований фармацевтически приемлемых органических аминов. Используемые в настоящем документе термины "соединение по изобретению" и "соединения по изобретению" включают фармацевтически приемлемые соли указанных соединений. Используемые в настоящем документе фразы "соединение формулы (I)" и "соединение формулы (I) или его фармацевтически приемлемая соль" включают их сольваты или гидраты.-7 016888 Используемая в настоящем документе фраза "фармацевтически приемлемая(ые) соль(и)", если не указано иное, включает соли кислотных или основных групп, которые могут присутствовать в соединениях по настоящему изобретению. Соединения по настоящему изобретению, которые являются основными по своему характеру, способны образовывать широкий ряд солей с помощью различных неорганических и органических кислот. Кислотами, которые могут быть использованы для получения фармацевтически приемлемых солей добавления кислот таких основных соединений, являются те, которые образуют нетоксичные соли добавления кислот, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат,аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1,1'-метиленбис-(2-гидрокси-3-нафтоат)]. Соединения по настоящему изобретению, которые включают основной фрагмент, такой как аминогруппа, могут образовывать фармацевтически приемлемые соли с различными аминокислотами, помимо указанных выше кислот. Настоящее изобретение также относится к фармацевтическим композициям, содержащим пролекарства соединений по изобретению. Соединения соединений по изобретению, содержащие свободные амино, амидо, гидрокси или карбоновые группы, могут быть преобразованы в пролекарства. Пролекарства включают соединения, в которых аминокислотный остаток или полипептидная цепь из двух или более(например, два, три или четыре) аминокислотных остатка ковалентно присоединены посредством пептидных связей к свободным амино, гидрокси или карбоксильным группам соединений по изобретению. Аминокислотные остатаки включают 20 природных аминокислот, обычно обозначаемых тремя буквенными символами, и также включают, 4-гидроксипролин, гидроксилизин, демозин, изодемозин, 3 метилгистидин, норвалин, бета-аланин, гамма-аминомасляная кислота, цитруллин, гомоцистеин, гомосерин, орнитин и метионин сульфон. Пролекарства также включают соединения, где карбонаты, карбаматы, амиды и алкиловые сложные эфиры, которые ковалентно связаны с вышеуказанными заместителями соединений по изобретению через карбонил углерод боковую цепь пролекарства. Также настоящее изобретение относится к соединениям по изобретению, содержащим защитные группы. Специалист в данной области также примет во внимание, что соединения по изобретению могут также быть получены с помощью определенных защитных групп, которые могут быть использованы для очистки или хранения и могут быть удалены перед введением пациенту. Введение и удаление защитных групп в функциональных группах описаны в "Protective Groups in Organic Chemistry", edited by J.W.F.Wuts, Wiley-Interscience (1999). Соединения по данному изобретению включают все стереоизомеры (например, цис- и трансизомеры) и все оптические изомеры соединений по изобретению (например, R и S энантиомеры), а также рацемические, диастереомерные и другие смеси таких изомеров. Хотя все стереоизомеры включены в объем настоящей формулы изобретения, любой специалист в данной области определит, какие конкретные стереоизомеры могут быть предпочтительными. Например, в случае, когда А представляет собой пиперидиновое кольцо и R3A и R3B представляют собой Н, предпочтительные соединения содержат R конфигурацию в положении 4, где фрагмент -N(R4)С(=Х)R5 присоединен, как показано в структуре (i) ниже (заметьте, что в кольце А атом N отмечен как положение 1, а остальные положения пронумерованы против часовой стрелки относительно положения 1). Наиболее предпочтительные соединения, когда А представляет собой пиперидиновое кольцо, имеют конфигурацию R в точке присоединения к фрагменту Соединения, соли и пролекарства по настоящему изобретению могут находиться в нескольких таутомерных формах, включая энольную и иминовую форму, и кето и энаминовой форме и геометрических изомерах и их смесях. Все такие таутомерные формы включены в объем настоящего изобретения. Таутомеры существуют в виде смесей таутомерных форм в растворе. В твердой форме обычно доминирует один таутомер. Несмотря на то что может быть описан только один таутомер, настоящее изобретение включает все таутомеры настоящего соединения.-8 016888 Настоящее изобретение также включает атропизомеры по настоящему изобретению. Атропизомеры относятся к соединениям по изобретению, которые могут быть разделены на вращательно ограниченные изомеры. Термин "2-амино-N-[(3R,5S)-5-[5-(фенилметил)-1 Н-бензимидазол-2-ил]-3-пирролидинил]ацетамид" обозначает соединение формулы Используемый в настоящем документе термин "(C1-C6)алкил" обозначает насыщенные моновалентные углеводородные радикалы, содержащие от одного до шести атомов углерода, имеющие прямые или разветвленные фрагменты. Используемые в настоящем документе термины "карбоцикл", "карбоциклил", "карбоцикло", "карбоциклический" или "(С 3-C12)карбоциклил" обозначают алифатическую кольцевую систему, содержащую от трех до двенадцати членов. Термины "карбоцикл", "карбоциклил", "карбоцикло" или "карбоциклический", насыщенный или частично ненасыщенный, также относятся к кольцам, которые являются необязательно замещенными. Термины также включают алифатические кольца, которые конденсированы с одним или несколькими ароматическими или неароматическими кольцами, такими как в декагидронафтиле или тетрагидронафтиле, где радикалом или точкой присоединения является алифатическое кольцо. Используемый в настоящем документе термин "циклоалкил" относится к моно, конденсированным или соединенным мостиковой связью бициклическим или трициклическим карбоциклическим кольцам(например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопентенил, циклогексенил, бицикло[2,2,1]гептанил, бицикло[3,2,1]октанил и бицикло[5,2,0]нонанил, норборнил, адамантанил и т.д.); указанные кольца могут необязательно содержать 1 или 2 двойные связи. Термин "циклоалкил" также включает спироциклоалкильные группы, включая, без ограничения, мультикольцевые системы, присоединенные посредством одного атома. Термин "алкокси", используемый в настоящем документе, обозначает О-алкильные группы, где алкил является таким, как определено выше. Термины "гидроксиалкил", "алкоксиалкил" и "алкоксикарбонил", используемые самостоятельно или как часть большего фрагмента, включают как прямые, так и разветвленные цепи, содержащие от одного до шести атомов углерода. Термин "алкенил", используемый самостоятельно или как часть большего фрагмента, включает как прямые, так и разветвленные цепи, содержащие от двух до десяти атомов углерода, имея по крайней мере одну углерод-углерод двойную связь. Термины "алкинил", используемый самостоятельно или как часть большего фрагмента, включает как прямые, так и разветвленные цепи, содержащие от двух до десяти атомов углерода, имея по крайней мере одну углерод-углерод тройную связь. Термины "галогеналкил", галогеналкенил" и "галогеналкокси" обозначают алкил, алкенил или алкокси, в зависимости от обстоятельств, замещены одним или несколькими атомами галогена. Используемый в настоящем документе термин "галоген" обозначает F, Cl, Br или I. Предпочтительными группами галогена являются F, Cl и Br. Термин "гетероатом" обозначает азот, кислород или серу и включает любую окисленную форму азота и серы и кватернизированную форму любого азотистого основания. Также термин "азот" включает замещаемый азот в гетероциклическом кольце. Например, в насыщенном или частично ненасыщенном кольце, содержащем от 1 до 3 гетероатомов, выбранных из кислорода, серы или азота, азотом может быть N (например, в 3,4-дигидро-2 Н-пирролиле), NH (например, в пирролидиниле) или NOR (например,в N-замещеном пирролидиниле)."Арил" и "(C6-C12)арил" обозначает ароматические радикалы, такие как фенил, нафтил, тетрагидронафтил, инданил и т.п. Термин также включает конденсированные полициклические ароматические кольцевые системы, в которых ароматическое кольцо конденсировано с одним или несколькими кольцами. Примеры включают 1-нафтил, 2-нафтил, 1-антрацил и 2-антрацил. Также используемый в настоящем документе термин "арил" включает группу, в которой ароматическое кольцо конденсировано с одним или несколькими неароматическими кольцами, например в инданиле, фенантридиниле или тетрагидронафтиле, где радикал или точка присоединения находится на ароматическом кольце. Термин "арил" также относится к кольцам, которые необязательно замещены. Термин "арил" может быть использован взаимозаменяемо с термином "арильное кольцо". Используемый в настоящем документе термин "гетероцикл", "гетероциклил" или "гетероциклический" включает ароматические и неароматические кольцевые системы, содержащие от четырех до четырнадцати членов, предпочтительно от пяти до десяти, в которых один или несколько кольцевых углеродов, предпочтительно от одного до четырех, замещены, каждый, гетероатомом, таким как N, О или S. Неароматические гетероциклические группы включают группы, содержащие только 4 атома в своих кольцевых системах, а ароматические гетероциклические группы должны содержать по меньшей мере-9 016888 5 атомов в своей кольцевой системе. Гетероциклические группы включают бензоконденсированные кольцевые системы. Примеры гетероциклических колец включают 3-1 Н-бензимидазол-2-он, (1 замещены)-2-оксобензимидазол-3-ил, 2-тетрагидрофуранил, 3-тетрагидрофуранил, 2-тетрагидропиранил,3-тетрагидропиранил, 4-тетрагидропиранил, [1,3]диоксаланил, [1,3]дитиоланил, [1,3]диоксанил, 2 тетрагидротиофенил, 3-тетрагидротиофенил, 2-морфолинил, 3-морфолинил, 4-морфолинил, 2 тиоморфолинил, 3-тиоморфолинил, 4-тиоморфолинил, 1-пирролидинил, 2-пирролидинил, 3 пирролидинил, 1-пиперазинил, 2-пиперазинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4 пиперидинил, 4-тиазолидинил, диазолонил, N-замещены диазолонил, 1-фталимидинил, бензоксанил,бензо[1,3]диоксин, бензо[1,4]диоксин, бензопирролидинил, бензопиперидинил, бензоксоланил, бензотиоланил, 4,5,6,7-тетрагидропиразол[1,5-альфа]пиридин и бензотианил. Также используемый в настоящем документе термин "гетероциклил" или "гетероциклический" включает группу, в которой неароматическое содержащее гетероатом кольцо конденсировано с одним или несколькими ароматическими или неароматическими кольцами, например, в индолиниле, хроманиле, фенантридиниле или тетрагидрохинолиниле, где радикал или точка присоединения находится на неароматическом содержащем гетероатом кольце. Термин "гетероцикл", "гетероциклил" или "гетероциклический", насыщенный или частично ненасыщенный, также относится к кольцам, которые необязательно замещены. Примером 4-членной гетероциклической группы является азетидинил (производное азетидина). Примером 5-членной гетероциклической группы является тиазолил и примером 10-членной гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил,пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил,оксепанил,тиепанил,оксазепинил,диазепинил,тизепинил,1,2,3,6 тетрагидропиридинил, 2-пирролинил, 3-пирролинил, индолинил, 2 Н-пиранил, 4 Н-пиранил, диоксанил,1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил,пиразолидинил,имидазолинил,имидазолидинил,3-азабицикло[3,1,0]гексанил,3 азабицикло[4,1,0]гептанил, 3H-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил,изотиазолил, пирролил, хинолинил, хинолинил, индолил, бензимидазолил, бензофуранил, циннолинил,индазолил, индолизинил, фталазинил, пиридазинил, триазинил, индолил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Вышеуказанные группы, как образованные из перечисленных выше групп, могут быть С-присоединенными или N-присоединенными, в случае, когда это возможно. Например, группа, образованная из пиррола, может представлять собой пиррол-1-ил (Nприсоединенный) или пиррол-3-ил (С-присоединенный). Кроме того, группа, образованная из имидазола,может представлять собой имидазол-1-ил (N-присоединенный) или имидазол-2-ил (С-присоединенный). Примером гетероциклической группы, где 1 или 2 кольцевых атома углерода замещены оксо (=O) фрагментами, является 1,1-диоксотиоморфолинил, тиенопиридинон или пиримидин-2,4-дион. Примером гетероциклической группы, где 1 кольцевой атом серы замещен 2 оксо (=O) фрагментами, является тетрагидротиофендиоксид. Также используемый в настоящем документе термин "гетероарил" включает группу, в которой гетероароматическое кольцо конденсировано с одним или несколькими ароматическими или неароматическими кольцами, где радикал или точка присоединения находится на гетероароматическом кольце. Примеры включают тетрагидрохинолинил, тетрагидроизохинолинил и пиридо[3,4-d]пиримидинил. Термин "гетероарил", используемый самостоятельно или как часть большего фрагмента, например в "гетероаралкиле" или "гетероарилалкокси", относится к группам гетероароматического кольца, имеющим от пяти до четырнадцати членов. Примеры гетероарильных колец включают 2-фуранил, 3-фуранил,3-фуразанил, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4-изоксазолил,5-изоксазолил, 2-оксадиазолил, 5-оксадиазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 1-пирролил, 2 пирролил, 3-пирролил, 1-пиразолил, 2,5-пиразолил, 3-пиразолил, 2-пиридил, 3-пиридил, 4-пиридил, 2 пиримидил, 4-пиримидил, 5-пиримидил, 3-пиридазинил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 5 тетразолил, 2-триазолил, 5-триазолил, 2-тиенил, 3-тиенил, карбазолил, бензимидазолил, бензотиенил,бензофуранил, индолил, хинолинил, бензотриазолил, бензотиазолил, бензооксазолил, бензимидазолил,изохинолинил, индазолил, изоиндолил, акридинил или бензоизоксазолил. Термин "гетероарил" также относится к кольцам, которые необязательно замещены. Термин "гетероарил" может быть использован эквивалентно термину "гетероарильное кольцо" или термину "гетероароматический". Арильная (включая аралкил, аралкокси, арилоксиалкил и т.п.) или гетероарильная(включая гетероаралкил и гетероарилалкокси и т.п.) группа может содержать один или несколько заместителей R5. При получении соединений по изобретению в соответствии с изобретением специалист в данной- 10016888 области обычным способом выберет форму промежуточного соединения, которая обеспечит лучшее сочетание характеристик для этой цели. Такие характеристики включают точку плавления, растворимость,пригодность для обработки и выход промежуточной формы продукта и получаемую легкость, с которой продукт может быть очищен при выделении. Изобретение также относится к способам получения промежуточных соединений, которые могут быть использованы для получения соединений по изобретению. Как отмечено выше, изобретение также относится к фармацевтически приемлемым солям соединений по изобретению. Фармацевтически приемлемые соли соединений по изобретению включают соли добавления кислот и оснований соединений. Подходящие соли добавления кислот получают с помощью кислот, которые образуют нетоксичные соли. Неограничивающие примеры подходящих солей добавления кислот включают соли: ацетат, адипат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камзилат, цитрат, цикламат, эдисилат, эсилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, хибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, илиотат, оксалат, пальмитат, памоат, фосфат/водород, фосфат/дигидрофосфат, пироглютамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинофоат. Подходящие соли оснований получают с помощью оснований, которые образуют нетоксичные соли. Неограничивающие примеры подходящих солей оснований включают соли алюминия, аргинина,бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Также могут быть получены гемисоли кислот и оснований, например гемисульфат и гемикальциевые соли. Обзор подходящих солей см. Handbook of Pharmaceutical Salts: Properties, Selection and Use by Stahland Wermuth (Wiley-VCH, 2002). Способы получения фармацевтически приемлемых солей соединений по изобретению известны специалистам в данной области. Соединения по изобретению могут также существовать в несольватированной и сольватированной формах. Соответственно изобретение также относится к гидратам и сольватам соединений по изобретению. Термин "сольват" используется в настоящем документе для описания молекулярного комплекса,содержащего соединение по изобретению и одну или несколько фармацевтически приемлемых молекул растворителя, например этанола. Термин "гидрат" используется в случае, когда указанным растворителем является вода. Примерами гидрата являются гидрат, который определяет изолированный участок, канал, или гидраты скоординированные ион-металл - см. Polymorphism in Pharmaceutical Solids by K.R. Morris (Ed. H.G. Brittain, MarcelDekker, 1995). Гидраты с изолированными участками представляют собой гидраты, в которых молекулы воды изолированы от непосредственного контакта друг с другом при содействии органических молекул. В канальных гидратах молекулы воды располагаются в каналах кристаллической решетки, где они находятся рядом с другими молекулами воды. В ион-металл скоординированных гидратах молекулы воды связаны с ионом металла. Когда растворитель или вода имеет прочную связь, комплекс будет иметь строго определенную стехиометрию, независимую от влажности. Однако, когда растворитель или вода имеет слабую связь,как, например, в канальных сольватах и гигроскопичных соединениях, содержание вода/растворитель будет зависеть от условий влажности и сухости. В таких случаях нестехиометрия будет нормой. Изобретение также относится к пролекарствам соединений по изобретению. Соответственно некоторые производные соединений по изобретению, которые сами по себе могут иметь небольшую или могут не иметь фармакологической активности, при введении в организм или нанесении на организм могут преобразовываться в соединения по изобретению, имеющие желаемую активность, например, путем гидролитического расщепления. Такие производные называются "пролекарствами". Дополнительную информацию по использованию пролекарств можно найти в Pro-drugs as Novel Delivery Systems, vol. 14,ACS Symposium Series (T. Higuchi and W. Stella) и Bioreversible Carriers in Drug Design, Pergamon Press,1987 (Ed. E. B. Roche, American Pharmaceutical Association). Пролекарства в соответствии с изобретением могут быть получены, например, путем замены подходящих функциональных групп, присутствующих в соединениях по изобретению, на определенные фрагменты, известные специалистам в данной области как "профрагменты", как описано, например, вDesign of Prodrugs by H. Bundgaard (Elsevier, 1985). Некоторые неограничивающие примеры пролекарств по изобретению включают:(i) случай, когда соединение по изобретению содержит функциональную группу карбоновой кислоты (-СООН), ее сложный эфир, например соединение, в котором водород в функциональной группе карбоновой кислоты в соединении формулы I заменен на (C1-C6)алкил;(ii) случай, когда соединение по изобретению содержит функциональную группу спирта (-ОН), ее эфир, например соединение, в котором водород в функциональной группе спирта в соединении по изобретению заменен на (C1-C6)алканоилоксиметил;(iii) случай, когда соединение по изобретению содержит первичные или вторичные функциональные группы амино (-NH2 или -NHR, где RH), их амид, например соединение, где в зависимости от обстоятельств один или оба атома водорода в функциональной группе амино в соединении по изобретению заменен(ы) на (C1-C6)алканоил. Дополнительные примеры групп замены в соответствии с вышеуказанными примерами и примерами других типов пролекарств можно найти в вышеуказанных ссылках. Кроме того, некоторые соединения по изобретению могут сами оказывать действие как пролекарства других соединений по изобретению. Также в объем изобретения включены метаболиты соединений по изобретению, т.е. соединения,образуемые in vivo при введении лекарственного средства. Некоторые примеры метаболитов в соответствии с изобретением включают:(i) в случае, когда соединение по изобретению содержит метильную группу, ее гидроксиметильное производное (например, -СН 3-СН 2 ОН):(ii) в случае, когда соединение по изобретению содержит алкоксигруппу, ее гидроксипроизводное(iii) в случае, когда соединение по изобретению содержит третичную аминогруппу, ее вторичное амино производное;(iv) в случае, когда соединение по изобретению содержит вторичную аминогруппу, ее первичное производное (например, NH2);(v) в случае, когда соединение по изобретению содержит фенильный фрагмент, его фенольное производное (например, -Ph-PhOH);(vi) в случае, когда соединение по изобретению содержит амидную группу, ее производное карбоновой кислоты (например, -CONH2 СООН). Соединения по изобретению, содержащие один или несколько асимметричных атомов углерода,могут существовать в виде двух или более стереоизомеров. Когда соединение по изобретению содержит алкенильную или алкениленовую группу, возможны геометрические цис/транс (или Z/E) изомеры. В случае, когда структурные изомеры взаимопревращаемы, по причине низкого энергетического барьера,может иметь место таутомерная изомерия (таутомерия). Она может принимать форму протонной таутомерии в соединениях по изобретению, содержащих, например, имино, кето или оксим группу, или так называемой валентной таутомерии в соединениях, которые содержат ароматический фрагмент. Соответственно отдельные соединения могут демонстрировать более одного типа изомерии. В объем настоящего изобретения включены все стереоизомеры, геометрические изомеры и таутомерные формы соединений по изобретению, включая соединения, демонстрирующие более одного типа изомерии, и смеси одного или нескольких этих форм соединений. Также включены соли добавления кислот или оснований, где противоион является оптически активным, например d-лактат или l-лизин, или рацемическим, например dl-тартрат или dl-аргинин. Термин "стереоизомеры" относится к соединениям, которые имеют одинаковое химическое строение, но отличаются расположением своих атомов, или групп, в пространстве. В частности, термин "энантиомеры" относится к двум стереоизомерам соединения, которые не являются суперпозиционными зеркальными отражениями друг друга. Используемые в настоящем документе термины "рацемический" или"рацемическая смесь" относятся к 1:1 смеси энантиомеров конкретного соединения. С другой стороны,термин "диастереомеры" относится к взаимоотношению между парой стереоизомеров, которые содержат два или более асимметричных центра и не являются зеркальным отражением друг друга. Соединения по настоящему изобретению могут содержать асимметричные атомы углерода. Углерод-углерод связи соединений по настоящему изобретению могут быть изображены здесь в виде сплошной линии, сплошного клина или в виде штрихпунктирного клина. Использование сплошной линии, показывающей связи от асимметричных атомов углерода, означает, что включены все возможные стереоизомеры на этом атоме углерода. Использование сплошного или штрихпунктирного клина, показывающего связи от асимметричных атомов углерода, означает, что включен только показанный стереоизомер. Возможно, что соединения по изобретению могут содержать более чем один асимметричный атом углерода. В этих соединениях использование сплошной линии, показывающей связи от асимметричных атомов углерода, означает, что включены все возможные стереоизомеры. Использование сплошной линии, показывающей связи от одного или нескольких асимметричных атомов углерода в соединении по изобретению, и сплошного или штрихпунктирного клина, показывающего связи от других асимметричных атомов углерода в этом же соединении, означает, что присутствует смесь диастереомеров. Цис/транс изомеры могут быть разделены обычными способами, хорошо известными специалистам в данной области, например хроматографией и фракционной кристаллизацией. Обычные способы получения/выделения отдельных энантиомеров включают хиральный синтез из подходящего оптически чистого исходного продукта или расщепление рацемата (или рацемата соли или производного), используя, например, хиральную высокоэффективную жидкостную хроматографию(ВЭЖХ). Альтернативно, рацемат (или рацемическое исходное вещество) может взаимодействовать с подходящим оптически активным соединением, например спиртом, или, в случае, когда соединение по изобретению содержит кислотный или основной фрагмент, основанием или кислотой, таким как 1 фенилэтиламин или винная кислота. Полученная диастереомерная смесь может быть разделена с помощью хроматографии и/или фракционной кристаллизации, и один или оба диастереоизомера преобразованы в соответствующий(ие) чистый(ые) энантиомер(ы) способами, хорошо известными специалисту в данной области. Хиральные соединения по изобретению (и их хиральные предшественники) могут быть получены в энантиомерно-обогащенной форме, используя хроматографию, обычно ВЭЖХ, на асимметричной смоле с подвижной фазой, состоящей из углеводорода, обычно гептана или гексана, содержащего от 0 до 50% по объему спиртового растворителя, такого как изопропанол, обычно от 2 до 20% и от 0 до 5% по объему алкиламина, обычно 0,1% диэтиламина. Концентрация элюата дает обогащенную смесь. При кристаллизации любого рацемата возможно образование кристаллов двух разных типов. Первый тип представляет собой указанное выше рацемическое соединение (истинный рацемат), в котором образуется одна однородная форма кристалла, содержащая оба энантиомера в эквимолярных количествах. Второй тип представляет собой рацемическую смесь или конгломерат, в котором образуются две формы кристалла в эквимолярных количествах, содержащая каждая отдельный энантиомер. Несмотря на то что обе кристаллические формы, имеющиеся в рацемической смеси, обладают одинаковыми физическими свойствами, они могут обладать различными физическими свойствами по сравнению с истинным рацематом. Рацемические смеси могут быть разделены обычными методами, известными специалистам в данной области - см., например, Stereochemistry of Organic Compounds by E.L. Elieland S.H. Wilen (Wiley, 1994). Изобретение также относится к способам лечения патологического роста клеток у млекопитающего. В одном из вариантов осуществления изобретение относится к способу лечения патологического роста клеток у млекопитающего, включающему введение указанному млекопитающему количества соединения по изобретению, эффективного в лечении патологического роста клеток. В другом варианте осуществления патологическим ростом клеток является злокачественная опухоль. В другом варианте осуществления злокачественная опухоль выбрана из группы, состоящей из рака легких, рака костей, рака поджелудочной железы, рака кожи, рака головы или шеи, меланомы кожи или внутриглазной меланомы, рака матки, рака яичников, рака прямой кишки, рака заднепроходной области,рака желудка, рака толстой кишки, рака молочной железы, рака матки, карциномы маточных труб, карциномы эндометрия, карциномы шейки матки, карциномы влагалища, карциномы вульвы, болезни Ходжкина, рака пищевода, рака тонкого кишечника, рака эндокринной системы, рака щитовидной железы,рака паращитовидной железы, рака надпочечной железы, саркомы мягких тканей, рака уретры, рака полового члена, рака предстательной железы, хронического или острого лейкоза, лимфоцитарной лимфомы, рака мочевого пузыря, рака почек или мочеточника, почечно-клеточного рака, карциномы почечной лоханки, неоплазм центральной нервной системы (ЦНС), первичной лимфомы ЦНС, опухоли спинного мозга, глиомы ствола мозга, аденомы гипофиза или сочетания одного или нескольких вышеуказанных злокачественных опухолей. Изобретение также относится к способам лечения злокачественных солидных опухолей у млекопитающего. В одном из вариантов осуществления изобретение относится к лечению раковой солидной опухоли у млекопитающего, включающему введение указанному млекопитающему количества соединения по изобретению, которое эффективно в лечении указанных солидных злокачественных опухолей. В другом варианте осуществления солидная злокачественная опухоль представляет собой рак молочной железы, легкого, толстой кишки, головы, простаты, желудка, поджелудочной железы, яичников,кожи (меланома), органов эндокринной системы, матки, яичек или мочевого пузыря. В другом варианте осуществления изобретение относится к способу лечения патологического роста клеток у млекопитающего, который включает введение указанному млекопитающему количества соединения по изобретению, эффективного в лечении патологического роста клеток в сочетании с противоопухолевым средством, выбранным из группы, включающей митотические ингибиторы, алкилирующие вещества, антиметаболиты, интеркалирующие антибиотики, ингибиторы фактора роста, лучевое воздействие, ингибиторы клеточного цикла, ферменты, ингибиторы топоизомеразы, модификаторы биологического ответа, антитела, цитотоксины, антигормоны и антиандрогены. В одном из вариантов осуществления изобретение относится к способу лечения злокачественных опухолей эктодермального, мезодермального или эндодермального происхождения. В другом варианте осуществления изобретение относится к фармацевтической композиции для лечения патологического роста клеток у млекопитающего, содержащей количество соединения по изобретению, эффективное в лечении патологического роста клеток, и фармацевтически приемлемый носитель.- 13016888 Подробное описание изобретения Соединения по изобретению могут быть получены следующими общими способами и способами,подробно описанными в экспериментальной части изобретения. Схема 1 Заявленные в настоящем документе соединения могут быть получены способом, описанным на схеме 1. На стадии 1, соединение А, замещенное эфиром карбоновой кислоты и защищенным амином,взаимодействует с мезилхлоридом с образованием соответствующего мезилата спирта, который затем замещают азидом натрия и далее восстанавливают в условиях гидрирования или аналогичных условиях восстановления, хорошо известных специалисту в данной области. Любой специалист в данной области определит, что это преобразование может альтернативно быть выполнено несколькими различными способами, такими как окисление спирта до кетона и последующее восстановительное аминирование с защищенным амином, у которого затем удаляют защитную группу. На стадии 2 аминогруппа, присоединенная к соединению В, может взаимодействовать, например, с активированной карбоновой кислотой,изоцианатом или карбамоил хлоридом с получением соединений соединения С. Карбоновая кислота может быть активирована в виде хлорида карбоновой кислоты, смешанного ангидрида, полученного из,например, пивалоил хлорида, или изопропилхлорформиата, или в виде активного промежуточного соединения, например, полученного обработкой карбоновой кислоты с конденсирующими реагентами, такими как N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорид, ангидрид пропилфосфоновой кислоты или другие образующие амид реагенты, хорошо известные специалистам в данной области. Оптимально стадию 2 выполняют в апротонном растворителе, таком как тетрагидрофуран, 1,4-диоксан или диметилформамид, и при различных значениях температуры, но обычно в пределах от комнатной до приблизительно 80 С. На стадии 3 у эфира карбоновой кислоты может быть удалена защитная группа способами, хорошо известными любому специалисту в данной области. Например, сложный этиловый эфир может быть омылен гидрохлоридом лития, гидрохлоридом натрия или гидрохлоридом калия, например, в спиртовом растворителе, такие как этанол или в смеси органического растворителя, такого как- 14016888 этанол, метанол или тетрагидрофуран, с водой. Омыление может быть выполнено при различных значениях температуры, но обычно в пределах от комнатной до приблизительно 80 С. На стадии 4 карбоновая кислота соединения D взаимодействует с замещенным бензол-1,2-диамином в присутствии связующего реагента, такого как N-(3-диметиламинопропил)-N'-этилкарбодиимид гидрохлорид, ангидрид пропилфосфоновой кислоты, или другими образующими амид реагентами, хорошо известными специалистам в данной области. Исходные вещества являются коммерчески доступными, если не указано иное в примерах. Оптимально взаимодействие выполняют в апротонном растворителе, таком как тетрагидрофуран,1,4-диоксан, диметилформамид или ацетонитрил. Взаимодействие может быть выполнено при различных значениях температуры, но обычно в пределах от комнатной до приблизительно 80 С. На стадии 5 полученный бензол-1,2-диамин моноамид может затем быть циклизован с образованием бензимидазольного кольца путем нагревания до приблизительно 100 С в присутствии кислоты, такой как уксусная кислота, или путем обработки дополнительными частями связующего вещества, как описано выше. Потом на стадии 6 защитную группу трет-бутоксикарбонила удаляют с помощью гидрохлорида в подходящем растворителе, таком как 1,4-диоксан, этилацетат или метиленхлорид, или с помощью трифторуксусной кислоты, чистой или в подходящем растворителе, таком как метиленхлорид. Стадия 6 может быть выполнена при различных значениях температуры, но обычно в пределах от комнатной до приблизительно 0 С. Любой специалист в данной области определит, что хотя защитная группа трет-бутоксикарбонила показана на схеме 1, амин может быть защищен альтернативными способами, например, с помощью бензилоксикарбонильной группы, которая может быть удалена способами, хорошо известными специалисту в данной области. На стадии 7 амин соединения G может быть замещен взаимодействием с альдегидом и восстановлением полученного имина с помощью восстанавливающего агента, такого как цианборгидрид натрия в растворителе, таком как метанол, при температурах в пределах от около 0 до около 80 С. Могут быть использованы альтернативные восстанавливающие агенты, такие как триацетоксиборгидрид натрия, а также другие вещества, известные специалисту в данной области. Также стадия 7 может быть выполнена путем взаимодействия соединения G с алкилирующим агентом, таким как метилйодид, с соответствующей защитой реактивной функциональной группы в соединении G, что будет понятно специалисту в данной области. Например, синтез свободного основания в примере 31 представлен на схеме 2 и описан более подробно ниже. Соединение J защищенного сложного эфира, которое является коммерчески доступным,может взаимодействовать со смесью метансульфонил хлорида и 4-N,N-диметиламинопиридина (DMAP) в пиридине с получением соединения K. Затем соединение K может взаимодействовать с азидом натрия в N,N-диметилформамиде (ДМФ) с полученем азидо соединения L, которое потом восстанавливают, используя водород и палладий на угле с получением амино соединения М. Взаимодействие соединения М с 4-изоцианатобензонитрилом в тетрагидрофуране (ТГФ) и в присутствии триэтиламина дает соединениеN производного мочевины. Затем сложный эфир в соединении N омыляют, используя гидрохлорид лития в смеси ТГФ, метанола и воды с получением соответствующего соединения О карбоновой кислоты. Конденсацию соединения О с 1,2-фенилендиамином, используя бензотриазол-1-ил-окси-трис(диметиламино)фосфоний гексафторфосфат (ВОР) в качестве связующего агента и диизопропилэтиламин (DIEA), выполняют в ДМФ с получением соединения Р амида. Сначала взаимодействие соединения Р с уксусной кислотой дает ВОС-защищенное промежуточное соединение индола, которое потом может взаимодействовать с трифторуксусной кислотой для удаления ВОС группы. Затем это дополнительное промежуточное соединение может взаимодействовать с формальдегидом в присутствии цианборгидрида натрия с получением конечного соединения Q. Соединение Q может быть получено в форме свободного основания или форме соли способами, известными рядовому специалисту в данной области. Исходные соединения, такие как J и соответствующие стереоизомеры, являются коммерчески доступными или могут быть получены способами, известными специалисту в данной области. Как отмечено выше, соединения по изобретению могут быть использованы в качестве ингибиторовSMO. Способы определения in vitro активности этих соединений описаны ниже. Анализ временной транскрипционной активации smoothened (SMO)/Sonic Hedgehog (SHh) В 1-й день разделяли 2106 клеток C3 Н 10 Т 1/2 (АТСС CCL-226) и высевали их в 12 мл питательной среды - базальной среде Игла (ВМЕ, Invitrogen 21010-046) с добавлением 2 мМ L-глутамина(Invitrogen 25030-081), 0,1 единиц/мл пенициллина и 0,1 мкг/мл стрептомицина (Invitrogen 15140-122) и 10% бычьего сывороточного альбумина (FBS, Invitrogen 16140-071) в сосуд Т-75 (Costar 3376). Клетки оставляли прикрепляться на 4 ч при 37 С, 5% СО 2. Затем клетки трансфецировали, используя Fugene 6 (Roch 11814443001) в следующей реакционной смеси: 48 мкл Fugene 6 и 745 мкл Opti-MEM (Invitrogen 31985-070) смешивали и оставляли при комнатной температуре в течение 5 мин. Добавляли 8 мкгpGL4,14/mGli(CS) ДНК (10 элементов Gli и минимальный промотор CS) и 0,5 мкг pEGFP ДНК (Clontech), осторожно смешивали и инкубировали при комнатной температуре в течение 20 мин. Затем всю эту трансфицированную смесь добавляли в Т-75 сосуд, содержащий клетки. Клетки инкубировали при 37 С, 5% CO2 в течение 18-24 ч. На 2-й день трансфецированные клетки обрабатывали трипсином и высеивали в белые 96-луночные планшеты (Costar 3917) с 100 мкл/лунка питательной средой с концентрацией 20000 клеток/лунка. Клетки оставляли восстанавливаться в течение 4 ч, а затем добавляли бессывороточную среду Игла, модифицированную по способу Дульбекко (DMEM, Invitrogen 21063-029) с добавлением 2 мМ Lглутамина, 0,1 единиц/мл пенициллина и 0,1 мкг/мл стрептомицина и 0,5% телячьей сыворотки(CS, Invitrogen 26170-043). Питательную среду отсасывали и клетки промывали 100 мкл бессывороточной средой. Затем в каждую лунку добавляли 95 мкл среды без сыворотки. Клетки инкубировали в течение 20 ч при 37 С, 5% СО 2. На 3-й день к клеткам дозировано добавляли контрольные соединения с конечной концентрацией в пределах от 2 мкМ до 2 нМ. Сразу после добавления соединений к клеткам добавляли рекомбинантный"sonic hedgehog" человека (SHh, RD Systems 1845-SH) до конечной концентрации, составляющей 250 нг/мл. В 25-мкг сосуде с SHh восстанавливали 250 мкл PBS/0,1% BSA с получением 100 нг/мкл основного раствора. Затем этот основной раствор разбавляли 1:20 в среде без сыворотки. Трансфецированные клетки инкубировали с соединениями и SHh в течение 20 ч при 37 С, 5% CO2. Исследования с люциферазой выполняли на 4-й день, используя систему для анализа с люцеферазой Dual-Glo (Promega Е 2940) в соответствии с протоколом Promega. Коротко, получали люциферазный реагент Dual-Glo и 100 мкл добавляли в каждую лунку 96-луночного планшета, содержащего среду. Планшеты встряхивали при комнатной температуре в течение 10 мин и затем считывали на TopCount(Perkin-Elmer). Люминесценцию регистрировали. Настоящее изобретение также относится к способу лечения патологического роста клеток у млекопитающего, включая человека, включающему введение указанному млекопитающему количества соединения по изобретению, как определено выше, или его фармацевтически приемлемой соли, сольвата, гидрата или пролекарства, которое эффективно в лечении патологического роста клеток. В одном из вариантов осуществления этого способа патологическим ростом клеток является злокачественная опухоль,включая, но ими не ограничиваются, рак легких, рак костей, рак поджелудочной железы, рак кожи, рак головы или шеи, меланома кожи или внутриглазная меланома, рак матки, рак яичников, рак прямой кишки, рак ануса, рак желудка, рак толстой кишки, рак молочной железы, рак матки, карцинома маточных труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища, карцинома вульвы,болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечной железы, саркома мягких тканей, рак уретры, рак полового члена, рак предстательной железы, хронический или острый лейкоз, лимфоцитарная лимфома,множественная миелома, рак мочевого пузыря, рак почки или уретры, почечно-клеточный рак, карциному почечной лоханки, неоплазмы центральной нервной системы (ЦНС), первичную лимфому ЦНС, опухоли спинного мозга, глиому ствола мозга, аденому гипофиза, медуллобластому или сочетание одной или нескольких вышеуказанных злокачественных опухолей. В одном из вариантов осуществления изобретение относится к способу, включающему введение млекопитающему количества соединения по изобретению, которое эффективно в лечении указанной злокачественной солидной опухоли. В одном из вариантов осуществления изобретение относится к способу лечения солидных опухолей и гемобластоз у млекопитающих, включающему введение указанному млекопитающему соединения по изобретению,которое эффективно в лечении таких опухолей. В одном из вариантов осуществления солидной опухолью является рак молочной железы, легкого, толстой кишки, головы, простаты, желудка, поджелудочной железы, яичников, кожи (меланома), желез внутренней секреции, матки, яичка и мочевого пузыря. В другом варианте осуществления указанного способа указанным патологическим ростом клеток является доброкачественное пролиферативное заболевание, включая, но ими не ограничиваясь, псориаз,доброкачественную гипертрофию предстательной железы или рестеноз. В другом варианте осуществления изобретение относится к способу лечения множественной миеломы у млекопитающего, включающему введение указанному млекопитающему количества соединения по изобретению, эффективного в лечении множественной миеломы. Настоящее изобретение также относится к способу лечения патологического роста клеток у млекопитающего, который включает введение указанному млекопитающему количества соединения по изобретению или его фармацевтически приемлемой соли, сольвата, гидрата или пролекарства, которое эффективно в лечении патологический роста клеток, в сочетании с противоопухолевым средством, выбранным из группы, состоящей из митотических ингибиторов, алкилирующих веществ, антиметаболитов,интеркалирующих антибиотиков, ингибиторов фактора роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антител, цитотоксинов, антигормонов и антиандрогенов. Настоящее изобретение также относится к фармацевтической композиции для лечения патологического роста клеток у млекопитающего, включая человека, содержащей количество соединения по изобретению, как описано выше, или его фармацевтически приемлемой соли, сольвата, гидрата или пролекарства, которое эффективно в лечении патологического роста клеток, и фармацевтически приемлемый носитель. В одном из вариантов осуществления указанной композиции указанным патологическим ростом клеток является злокачественная опухоль, включая, но ими не ограничиваясь, базальноклеточную карциному, рак легких, рак костей, рак поджелудочной железы, рак кожи, рак головы или шеи, меланому кожи или внутриглазную меланому, рак матки, рак яичников, рак прямой кишки, рак заднепроходной области, рак желудка, рак толстой кишки, рак молочной железы, рак матки, карциному маточных труб,карциному эндометрия, карциному шейки матки, карциному влагалища, карциному вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы,рак паращитовидной железы, рак надпочечной железы, саркому мягких тканей, рак уретры, рак полового члена, рак предстательной железы, хронический или острый лейкоз, лимфоцитарную лимфому, рак мочевого пузыря, рак почек или мочеточника, почечно-клеточный рак, карциному почечной лоханки, неоплазмы центральной нервной системы (ЦНС), первичную лимфому ЦНС, опухоли спинного мозга,глиому ствола мозга, аденому гипофиза или сочетание одной или нескольких вышеуказанных злокачест- 17016888 венных опухолей. В другом варианте осуществления указанной фармацевтической композиции указанным патологическим ростом клеток является доброкачественное пролиферативное заболевание, включая, но ими не ограничиваются, псориаз, доброкачественную гипертрофию предстательной железы или рестеноз. Настоящее изобретение также относится к способу лечения патологического роста клеток у млекопитающего, который включает введение указанному млекопитающему количества соединения по изобретению, или его фармацевтически приемлемой соли, сольвата, гидрата или пролекарства, которое эффективно в лечении патологического роста клеток, в сочетании с другим противоопухолевым средством,выбранным из группы, включающей противометастатические средства, митотические ингибиторы, алкилирующие вещества, антиметаболиты, интеркалирующие антибиотики, ингибиторы фактора роста, ингибиторы клеточного цикла, ферменты, ингибиторы топоизомеразы, модификаторы биологического ответа, антитела, цитотоксины, антигормоны и антиандрогены. Изобретение также относится к фармацевтической композиции для лечения патологического роста клеток, где композиция включает соединение по изобретению, как описано выше, или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство, которое эффективно в лечении патологического роста клеток, и другое противоопухолевое средство, выбранное из группы, включающей митотические ингибиторы, алкилирующие вещества, антиметаболиты, интеркалирующие антибиотики, ингибиторы фактора роста, ингибиторы клеточного цикла, ферменты, ингибиторы топоизомеразы, модификаторы биологического ответа, антитела, цитотоксины, антигормоны и антиандрогены. В одном из вариантов осуществления изобретение относится к способу лечения патологического роста клеток у млекопитающего, включающему введение указанному млекопитающему количества соединения по изобретению в сочетании с терапевтическими способами нацеливания. Изобретение также относится к способу ингибирования продукции стволовых клеток или регенерации стволовых клеток у млекопитающего, включающему введение соединения по изобретению указанному млекопитающему в количестве, эффективном для ингибирования продукции стволовых клеток или регенерации стволовых клеток. Изобретение также относится к способу лечения эритроидных и миелоидных заболеваний крови у млекопитающего, включающему введение соединения по изобретению указанному млекопитающему в количестве, эффективном для лечения таких заболеваний крови. Настоящее изобретение также относится к способу лечения расстройства, связанного с ангиогенезом у млекопитающего, включая человека, включающему введение указанному млекопитающему количества соединения по изобретению, как определено выше, или его фармацевтически приемлемой соли,сольвата, гидрата или пролекарства, которое эффективно в лечении указанного расстройства, в сочетании с одним или несколькими противоопухолевыми средствами, перечисленными выше. Такие расстройства включают раковые опухоли, такие как меланома; заболевания глаз, такие как возрастная дегенерация желтого пятна, синдром предполагаемого гистоплазмоза глаз и реваскуляризация сетчатки при пролиферативной диабетической ретинопатии; ревматоидный артит; заболевания, относящиеся к потере костной массы, такие как остеопороз, болезнь Педжета, гуморальная гиперкальцемия при злокачественной опухоли, гиперкальцемия при метастазирующих в кость опухолях, и остеопороз, вызванный лечением глюкокортикоидами; рестеноз коронарных артерий; и некоторые микробные инфекции, включая относящиеся к микробным патогенам, выбранным из аденовируса, хантавирусы, Borrelia burgdorferi,Yersinia spp., Bordetella pertussis и группа A Streptococcus. Настоящее изобретение также относится к способу (и к фармацевтической композиции для) лечения патологического роста клеток у млекопитающего, который включает количество соединения по изобретению, или его фармацевтически приемлемой соли, сольвата, гидрата или пролекарства, в сочетании с количеством одного или нескольких веществ, выбранных из антиангиогенезных средств, ингибиторов сигнальной трансдукции и антипролиферативных средств, чьи количества совместно эффективны в лечении указанного патологического роста клеток. Антиангиогенезные средства, такие как ингибиторы ММР-2 (матричная металлопротеиназа-2), ингибиторы ММР-9 (матричная металлопротеиназа-9) и ингибиторы COX-II (циклооксигеназа II), могут быть использованы совместно с соединением по изобретению в способах и фармацевтических композициях, описанных в настоящем документе. Примеры используемых ингибиторов COX-II включаютCELEBREX (целекоксиб), Bextra (валдекоксиб), паракоксиб, Vioxx (рофекоксиб) и Arcoxia (эторикоксиб). Примеры используемых ингибиторов матричных металлопротеиназ описаны в следующих документах: WO 96/33172 (опубликована 24 октября 1996 г.), WO 96/27583 (опубликована 7 марта 1996 г.),Европейская патентная заявка 97304971.1 (подана 8 июля 1997 г.), Европейская патентная заявка 99308617.2 (подана 29 октября 1999 г.), WO 98/07697 (опубликована 26 февраля 1998 г.), WO 98/03516(опубликована 29 января 1998 г.), WO 98/34918 (опубликована 13 августа 1998 г.), WO 98/34915 (опубликована 13 августа 1998 г.), WO 98/33768 (опубликована 6 августа 1998 г.), WO 98/30566 (опубликована 16 июля 1998 г.), публикация Европейского патента 606046 (опубликована 13 июля 1994 г.), публикация Европейского патента 931788 (опубликована 28 июля 1999 г.), WO 90/05719 (опубликована 31 мая 1990 г.), WO 99/52910 (опубликована 21 октября 1999 г.), WO 99/52889 (опубликована 21 октября(подана 21 июля 1998 г.), Европейская патентная заявка 99302232.1 (подана 25 марта 1999 г.), патентная заявка Великобритании 9912961.1 (подана 3 июня 1999 г.), предварительная заявка США 60/148464 (подана 12 августа 1999 г.), патент США 5863949 (выдан 26 января 1999 г.), патент США 5861510 (выдан 19 января 1999 г.) и публикация Европейского патента 780386 (опубликована 25 июня 1997 г.), каждая из которых включена здесь в качестве ссылки полностью. Предпочтительными ингибиторами ММР-2 и ММР-9 являются ингибиторы, имеющие небольшую или не имеющие активность ингибирования ММР-1. Более предпочтительными являются ингибиторы, которые избирательно ингибируют ММР-2 и/или ММР-9 относительно других матричных металлопротеиназ (т.е. ММР-1, ММР-3, ММР-4,ММР-5, ММР-6, ММР-7, ММР-8, ММР-10, ММР-11, ММР-12 и ММР-13). Некоторыми конкретными примерами ММР ингибиторов, используемых в сочетании с соединениями по настоящему изобретению, являются AG-3340, RO 32-3555, RS 13-0830 и соединения, перечисленные далее: 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовая кислота; гидроксиамид 3-экзо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-окса-бицикло[3,2,1]октан-3 карбоновой кислоты; гидроксиамид(2R,3R) 1-[4-(4-фтор-2-метилбензилокси)бензолсульфонил]-3-гидрокси-3 метилпиперидин-2-карбоновой кислоты; 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоил-1-метилэтил)амино]пропионовая кислота; 3-4-(4-фторфенокси)бензолсульфонил]-(4-гидроксикарбамоилтетрагидропиран-4 ил)амино]пропионовая кислота; гидроксиамид 3-экзо-3-[4-(4-хлорфенокси)бензолсульфониламино]-8-окса-бицикло[3,2,1]октан-3 карбоновой кислоты; гидроксиамид 3-эндо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-окса-бицикло[3,2,1]октан-3 карбоновой кислоты; гидроксиамид 3-[4-(4-фторфенокси)бензолсульфониламино]тетрагидрофуран-3-карбоновой кислоты и фармацевтически приемлемые соли, сольваты и пролекарства указанных соединений. Также с соединением по изобретению могут сочетаться VEGF ингибиторы, например SU-11248,SU-5416 и SU-6668 (Pfizer Inc. of South San Francisco, California, USA). VEGF ингибиторами являются ингибиторы, например, описанные в следующих документах: WO 99/24440 (опубликована 20 мая 1999 г.), международная заявка PCT/IB99/00797 (подана 3 мая 1999 г.), в WO 95/21613 (опубликована 17 августа 1995 г.), WO 99/61422 (опубликована 2 декабря 1999 г.), патент США 5834504 (выдан 10 ноября 1998 г.), WO 98/50356 (опубликована 12 ноября 1998 г.), патент США 5883113 (выдан 16 марта 1999 г.),патент США 5886020 (выдан 23 марта 1999 г.), патент США 5792783 (выдан 11 августа 1998 г.), патент США 6653308 (выдан 25 ноября 2003 г.), WO 99/10349 (опубликована 4 марта 1999 г.), WO 97/32856(опубликована 12 сентября 1997 г.), WO 97/22596 (опубликована 26 июня 1997 г.), WO 98/54093 (опубликована 3 декабря 1998 г.), WO 98/02438 (опубликована 22 января 1998 г.), WO 99/16755 (опубликована 8 апреля 1999 г.) и WO 98/02437 (опубликована 22 января 1998 г.), каждая из которых включена здесь полностью в качестве ссылки. Другими примерами некоторых специфических VEGF ингибиторов являются IM862 (Cytran Inc. of Kirkland, Washington, USA); Авастин, анти-VEGF моноклональное антитело,производство фирмы Genentech, Inc. South San Francisco, California; и ангиозим, синтетический рибозим,производство фирмы Ribozyme (Boulder, Colorado) и Chiron (Emeryville, California). Ингибиторы рецептора ErbB2, такие как GW-282974 (Glaxo Wellcome pic), и моноклональные антитела AR-209 (Aronex Pharmaceuticals Inc., The Woodlands, Texas, USA) и 2 В-1 (Chiron) могут вводиться в сочетании с соединением по изобретению. Такие erbB2 ингибиторы включают херцептин, 2 С 4 и пертузумаб. Такие erbB2 ингибиторы включают ингибиторы, описанные в следующих документах:- 19016888 США 5587458 (выдан 24 декабря 1996 г.) и патент США 5877305 (выдан 2 марта 1999 г.), каждый из которых включен здесь полностью в качестве ссылки. Используемые в настоящем изобретении ингибиторы рецептора ErbB2 также описаны в предварительной заявке США 60/117341, поданной 27 января 1999 г., и в предварительной заявке США 60/117346, поданной 27 января 1999 г., обе из которых включены здесь полностью в качестве ссылки. Другие ингибиторы рецептора erbb2 включают TAK-165(Takeda) и GW-572016 (Glaxo-Wellcome). Различные другие соединения, такие как производные стирола, также демонстрировали свойства ингибирования тирозинкиназы, и некоторые ингибиторы тирозинкиназы были идентифицированы как ингибиторы рецептора erbB2. Более поздние пять публикаций Европейского патента, а именно ЕР 0566226 А 1 (опубликована 20 октября 1993 г.), ЕР 0602851 А 1 (опубликована 22 июня 1994 г.),ЕР 0635507 А 1 (опубликована 25 января 1995 г.), ЕР 0635498 А 1 (опубликована 25 января 1995 г.) и ЕР 0520722 А 1 (опубликована 30 декабря 1992 г.), относятся к некоторым бициклическим производным,в частности производным хиназолина, которые обладают противораковыми свойствами, что является следствием их ингибирующих тирозинкиназу свойств. Также, международная патентная заявкаWO 92/20642 (опубликована 26 ноября 1992 г.) относится к некоторым бис-, моно- и бициклическим соединениям арила и гетероарила в качестве ингибиторов тирозинкиназы, которые могут быть использованы в ингибировании патологической пролиферации клеток. Международные патентные заявки(опубликована 21 августа 1997 г.), WO 98/02434 (опубликована 22 января 1998 г.), WO 98/02437 (опубликована 22 января 1998 г.) и WO 98/02438 (опубликована 22 января 1998 г.) также относятся к замещенным бициклическим гетероароматическим производным в качестве ингибиторов тирозинкиназы, которые могут быть использованы для этой же цели. Другими патентными заявками, которые относятся к противораковым соединениям, являются международная патентная заявка WO 00/44728 (опубликована 3 августа 2000 г.), ЕР 1029853 А 1 (опубликована 23 августа 2000 г.) и WO 01/98277 (опубликована 12 декабря 2001 г.), каждая из которых включена в настоящем документе полностью в качестве ссылки. Другие антипролиферативные средства, которые могут быть использованы с соединениями по настоящему изобретению, включают ингибиторы фермента фарнезилпротеинтрансферазы и ингибиторы рецептора тирозинкиназы PDGFr, включая соединения, описанные и заявленные в следующих патентных заявках США: 09/221946 (подана 28 декабря 1998 г.); 09/454058 (подана 2 декабря 1999 г.); 09/501163(подана 9 февраля 2000 г.); 09/539930 (подана 31 марта 2000 г.); 09/202796 (подана 22 мая 1997 г.); 09/384339 (подана 26 августа 1999 г.) и 09/383755 (подана 26 августа 1999 г.); и соединения, описанные и заявленные в следующих предварительных патентных заявках США: 60/168207 (подана 30 ноября 1999 г.); 60/170119 (подана 10 декабря 1999 г.); 60/177718 (подана 21 января 2000 г.); 60/168217 (подана 30 ноября 1999 г.) и 60/200834 (подана 1 мая 2000 г.). Каждая из вышеуказанных патентных заявок и предварительных патентных заявок включена в настоящем документе полностью в качестве ссылки. Соединение по изобретению может также быть использовано с другими средствами, применяемыми в лечении патологического роста клеток или злокачественной опухоли, включая, но ими не ограничиваясь, средства, способные усиливать противоопухолевый иммунный ответ, такие как антитела к CTLA4(антиген 4 цитотоксических Т лимфоцитов), и другие средства, способные блокировать CTLA4; и антипролиферативные средства, например другие ингибиторы фермента фарнезилпротеинтрансферазы, такие как ингибиторы фермента фарнезилпротеинтрансферазы, описанные в ссылках, приведенных выше в части "уровень техники". Конкретные антитела к CTLA4, которые могут быть использованы в настоящем изобретении, включают антитела, описанные в предварительной заявке США 60/113647 (подана 23 декабря 1998 г.), которая включена здесь в качестве ссылки полностью. Соединение по изобретению может быть использовано в качестве самостоятельной терапии или может сочетаться с одним или несколькими другими противоопухолевыми средствами, например средствами, выбранными из, например, митотических ингибиторов, например винбластин; алкилирующих веществ, например цис-платин, оксалиплатин, карбоплатин и циклофосфамид; антиметаболитов, например 5-фторурацил, капецитабин, цитозин арабинозид и гидроксимочевина, или, например, одного из предпочтительных антиметаболитов, описанных в Европейской патентной заявке 239362, напримерN-(5-[N-(3,4-дигидро-2-метил-4-оксохиназолин-6-илметил)-N-метиламино]-2-теноил)-L-глутаминовая кислота; ингибиторов фактора роста; ингибиторов клеточного цикла; интеркалирующих антибиотиков,например адриамицин и блеомицин; ферментов, например интерферон; и антигормонов, например, антиэстрогены, такие как Нолвадекс (тамоксифен) или, например, антиандрогены, такие как Касодекс (4'циано-3-(4-фторфенилсульфонил)-2-гидрокси-2-метил-3'-(трифторметил)пропионанилид). Соединения по настоящему изобретению могут быть использованы самостоятельно или в сочетании с одним или несколькими из множества противораковых средств или средств поддерживающей терапии. Например, соединения по настоящему изобретению могут быть использованы в сочетании с цитотоксичными средствами, например одним или несколькими средствами, выбранными из группы,включающей камптотецин, иринотекан HCl (Камптосар), эдотекарин, SU-11248, эпирубицин (Элленс),доцетаксел (Таксотер), паклитаксел, ритуксимаб (Ритуксан) бевацизумаб (Авастин), иматиниб мезилат(гливак), эрбитукс, гефитиниб (Иресса) и их сочетания. Изобретение также относится к применению со- 20016888 единений по настоящему изобретению совместно с гормональной терапией, например эксеместан (Аромазин), лупрон, анастрозол (Аримидекс), тамоксифен цитрат (Нолвадекс), трелстар и их сочетание. Кроме того, изобретение относится к использованию соединения по настоящему изобретению самостоятельно или в сочетании с одним или несколькими продуктами поддерживающей терапии, например продуктом, выбранным из группы, включающей филграстим (Нейпоген), ондансетрон (Зофран), фрагмин, прокрит, алокси, эменд или их сочетание. Такое совместное лечение может быть успешным при одновременном, последовательном или раздельном приеме доз отдельных компонентов лечения. Соединения по изобретению могут быть использованы с противоопухолевыми средствами, алкилирующими веществами, антиметаболитами, антибиотиками, противоопухолевыми средствами растительного происхождения, производными камптотецина, ингибиторами тирозинкиназы, антителами, интерферонами и/или модификаторами биологического ответа. В этом отношении далее представлен неограничивающий список примеров вторичных средств, которые могут быть использованы с соединениями по изобретению. Алкилирующие вещества включают, но ими не ограничиваются, горчичный-N-оксид азота, циклофосфамид, ифосфамид, мелфалан, бусульфан, митобронитол, карбоквон, тиотепа, ранимустин, нимустин,темозоломид, AMD-473, альтретамин, АР-5280, апазиквон, бросталлицин, бендамустин, кармустин, эстрамустин, фотемустин, глуфосфамид, ифосфамид, KW-2170, мафосфамид и митолактол; алкилирующие соединения производные платины включают, но ими не ограничиваются, цисплатин, карбоплатин, эптаплатин, лобаплатин, недаплатин, оксалиплатин или сатрплатин. Антиметаболиты включают, но ими не ограничиваются, метотрексат, 6-меркаптопурин рибозид,меркаптопурин, 5-фторурацил (5-FU) самостоятельно или в сочетании с лейковорином, тегафур, UFT,доксифлуридин, кармофур, цитарабин, цитарабин окфосфат, эноцитабин, S-1, гемцитабин, флударабин,5-азацитидин, капецитабин, кладрибин, клофарабин, децитабин, эфлорнитин, этинилцитидин, цитозин арабинозид, гидроксимочевина, TS-1, мелфалан, неларабин, нолатрексед, окфосфат, динатрия преметрексед, пентостатин, перитрексол, ралтитрексед, триапин, триметрексат, видарабин, винкристин, винорелбин; или, например, один из предпочтительных антиметаболитов, описанных в Европейской патентной заявке 239362, например N-(5-[N-(3,4-дигидро-2-метил-4-оксохиназолин-6-илметил)-Nметиламино]-2-теноил)-L-глутаминовая кислота. Антибиотики включают, но ими не ограничиваются, акларубицин, актиномицин D, амрубицин, аннамицин, блеомицин, даунорубицин, доксорубицин, эльсамитруцин, эпирубицин, галарубицин, идарубицин, митомицин С, неморубицин, неокарзиностатин, пепломицин, пирарубицин, ребеккамицин, стималамер, стрептозоцин, валрубицин или зиностатин. Гормональные терапевтические средства включают, например, эксеместан (Аромазин), лупрон, анастрозол (Аримидекс), доксеркальциферол, фадрозол, форместан, антиэстрогены, такие как тамоксифен цитрат (Нолвадекс) и фулвестрант, трелстар, торемифен, ралоксифен, лазофоксифен, летрозол (Фемара),или антиандрогены, такие как бикалутамид, флутамид, мифепристон, нилутамид, Касодекс (4'-циано-3(4-фторфенилсульфонил)-2-гидрокси-2-метил-3'-(трифторметил)пропионанилид) и их сочетание. Полученные из растений противоопухолевые вещества включают, например, вещества, выбранные из митотических ингибиторов, например винбластин, доцетаксел (Таксотер) и паклитаксел. Цитотоксичные средства, ингибирующие топоизомеразу, включают одно или несколько средств,выбранных из группы, состоящей из следующего: акларубицин, амонафид, белотекан, камптотецин, 10 гидроксикамптотецин, 9-аминокамптотецин, дифломотекан, иринотекан HCl (Камптосар), эдотекарин,эпирубицин (Элленс), этопозид, эксатекан, гиматекан, луртотекан, митоксантрон, пирарубицин, пиксантрон, рубитекан, собузоксан, SN-38, тафлупозид и топотекан и их сочетание. Средства для повышения иммунитета включают интерфероны и множество других повышающих иммунитет средств. Интерфероны включают интерферон альфа, интерферон альфа-2 а, интерферон, альфа-2b, интерферон бета, интерферон гамма-1a или интерферон гамма-n1. Другие средства включаютPF3512676, филграстим, лентинан, сизофилан, TheraCys, убенимекс, WF-10, альдеслейкин, алемтузумаб,ВАМ-002, дакарбазин, даклизумаб, денилейкин, гемтузумаб озогамицин, ибритумомаб, имиквимод, ленограстим, лентинан, вакцина против меланомы (Corixa), молграмостин, OncoVAX-CL, сарграмостин,тазонермин, теклейкин, тималазин, тозитумомаб, Вирулизин, Z-100, эпратузумаб, митумомаб, ореговомаб, пемтумомаб, Provenge. Модификаторами биологического ответа являются средства, которые модифицируют защитные механизмы живых организмов или биологические ответы, такие как выживаемость, рост или дифференцировка клеток ткани, контролируя их противоопухолевую активность. Такие средства включают крестин,лентинан, сизофиран, пицибанил или убенимекс. Другие противораковые средства включают следующее: алитретиноин, амплиген, атразентан, бексаротен, бортезомиб, бозентан, кальцитриол, эксисулинд, финастерид, фотемустин, ибандроновая кислота, милтефозин, митоксантрон, 1-аспарагиназа, прокарбазиин, дакарбазин, гидроксикарбамид, пегаспаргаза, пентостатин, тазаротин, TLK-286, велкайд, тарцева или третиноин. Другие антиангиогенные соединения включают следующее: ацитретин, фенретинид, талидомид,золендроновая кислота, ангиостатин, аплидин, циленгтид, комбретастатин А-4, эндостатин, галогенфу- 21016888 гинон, ребимастат, ремоваб, Ревлимид, скваламин, украин и Витаксин. Соединения - производные платины - включают, но ими не ограничиваются, цисплатин, карбоплатин, недаплатин или оксалиплатин. Производные камптотецина включают, но ими не ограничиваются, камптотецин, 10 гидроксикамптотецин, 9-аминокамптотецин, иринотекан, SN-38, эдотекарин и топотекан. Ингибиторами тирозинкиназы являются иресса или SU5416. Антитела включают херцептин, эрбитукс, авастин или ритуксимаб. Интерфероны включают интерферон альфа, интерферон альфа-2 а, интерферон, альфа-2b, интерферон бета, интерферон гамма-1 а или интерферон гамма-n1. Модификаторами биологического ответа являются средства, которые модифицируют защитные механизмы живых организмов или биологические ответы, такие как выживаемость, рост или дифференцировка клеток ткани, контролируя их противоопухолевую активность. Такие средства включают крестин,лентинан, сизофиран, пицибанил или убенимекс. Другие противоопухолевые средства включают митоксантрон, 1-аспарагиназу, прокарбазин, дакарбазин, гидроксикарбамид, пентостатин или третиноин. Используемый в настоящем документе термин "патологический рост клеток", если не указано иное,относится к росту клеток, который не зависит от нормальных механизмов регулирования (например, утрата контактного торможения). Он включает патологический рост: (1) опухолевых клеток (опухолей),которые пролифелируют путем экспрессирования мутированной тирозинкиназы или сверхэкспрессирования рецепторной тирозинкиназы; (2) доброкачественных и злокачественных клеток других пролиферативных заболеваний, в которых происходит патологическая активация тирозинкиназы; (4) любых опухолей, которые пролифелируют с помощью рецепторных тирозинкиназ; (5) любых опухолей, которые пролифелируют путем патологической активации серин/треонинкиназы; и (6) доброкачественных и злокачественных клеток при других пролиферативных заболеваниях, в которых происходит патологическая активация серин/треонинкиназы. Соединения по настоящему изобретению представляют собой мощные ингибиторы SMO и соответственно вполне могут использоваться в качестве антипролиферативных средств (например, противораковых), противоопухолевых средств (например, эффективных в отношении солидных опухолей), антиангиогенезных средств (например, останавливающих или предотвращающих пролиферацию кровеносных сосудов) для лечения млекопитающих, в частности человека. В частности, соединения по настоящему изобретению могут быть использованы для профилактики и лечения ряда гиперпролиферативных нарушений у человека, таких как злокачественные и доброкачественные опухоли печени, почек, мочевого пузыря, молочной железы, желудка, яичников, прямой кишки, простаты, поджелудочной железы, легкого, вульвы, щитовидной железы, карциномы печени, саркомы, глиобластомы, головы и шеи, и других гиперпластических состояний, таких как доброкачественные гиперплазия кожи (например, псориаз) и доброкачественная гиперплазия простаты (например, ВРН). Кроме того, ожидается, что соединение по настоящему изобретению может обладать активностью в отношении ряда лейкозов и лимфоидных злокачественных опухолей. В одном из вариантов осуществления по настоящему изобретению злокачественная опухоль выбрана из рака легких, рака костей, рака поджелудочной железы, рака желудка, рака кожи, рака головы или шеи, меланомы кожи или внутриглазной меланомы, рака матки, рака яичников, других типов рака женских репродуктивных органов, рака прямой кишки, рака заднепроходной области, рака желудка, рака толстой кишки, рака молочной железы, рака матки, карциномы маточных труб, карциномы эндометрия,карциномы шейки матки, карциномы влагалища, карциномы вульвы, болезни Ходжкина, рака пищевода,рака тонкого кишечника, рака эндокринной системы, рака щитовидной железы, рака паращитовидной железы, рака надпочечной железы, саркомы мягких тканей, рака уретры, рака полового члена, плоскоклеточного рака, рака предстательной железы, хронического или острого лейкоза, лимфоцитарной лимфомы, рака мочевого пузыря, рака почек или мочеточника, почечно-клеточного рака, карциномы почечной лоханки, неоплазмы центральной нервной системы (ЦНС), первичной лимфомы ЦНС, опухоли спинного мозга, головного мозга, аденомы гипофиза, или сочетания одной или нескольких вышеуказанных злокачественных опухолей. В другом варианте осуществления злокачественная опухоль выбрана из солидной опухоли, например, но ими не ограничиваясь, молочной железы, легкого, толстой кишки, головы (например, глиобластома), простаты, желудка, поджелудочной железы, яичников, кожи (меланома), желез внутренней секреции, матки, яичек и мочевого пузыря. Способы по настоящему изобретению включают использование небольших молекул, которые ингибируют Smo, в регуляции репарации и/или функциональной активности большого ряда клеток, тканей и органов, включая нормальные клетки, ткани и органы, а клетки ткани и органы с фенотипом потери функции ptc, с усиленной функцией hedgehog или усиленной функцией smoothened. Например, метод по изобретению может использоваться в терапии и косметологии, начиная с регуляции нейрональных тканей, остеогенеза и образования хрящей и репарации, регуляции сперматогенеза, гладких мышц, легкого,печени и других органов, развивающихся из первичной кишки, регуляции гематопоэтической функции,- 22016888 контроля роста кожи и волос и т.п. Кроме того, способы по настоящему изобретению могут быть выполнены в отношении клеток, выращенных культурально (in vitro), или в отношении клеток интактного организма животного (in vivo), см., например, публикации РСТ WO 95/18856 и WO 96/17924. Используемый здесь термин "лечить", если не указано иное, обозначает изменение направления,уменьшение, подавление прогресса, или профилактику, расстройств или состояний, к которым такой термин применим, или одного или нескольких симптомов такого расстройства или состояния. Используемый здесь термин "лечение", если не указано иное, относится к процессу воздействия - "лечения", как определено непосредственно выше. Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение по изобретению, или его фармацевтически приемлемую соль, или сольват, как определено выше, в сочетании с фармацевтически приемлемым адъювантом, разбавителем или носителем. Изобретение далее относится к фармацевтической композиции по изобретению, которая содержит смесь соединения по изобретению, или его фармацевтически приемлемую соль, или сольват, как определено выше, с фармацевтически приемлемым адъювантом, разбавителем или носителем. Для вышеуказанных терапевтических применений вводимая доза, разумеется, будет изменяться в зависимости от используемого соединения, способа введения, желаемого лечения и определенного расстройства. Суточная доза соединения формулы (I) или фармацевтически приемлемой соли может быть в пределе от 1 мг до 1 г, предпочтительно 1-250 мг, более предпочтительно 10-100 мг. Настоящее изобретение также включает композиции с замедленным высвобождением активного вещества. Введение соединений по настоящему изобретению (далее "активное(ые) соединение(я)") может быть эффективно при любом способе, который обеспечивает доставку соединений к месту приложения действия. Эти способы включают пероральные способы введения, интрадуоденальные способы введения, парентеральный способ введения - инъекция (включая внутривенную, подкожную, внутримышечную, внутрисосудистую или вливание), топический и ректальный способ введения. Активное соединение может быть использовано как самостоятельное терапевтическое средство или может сочетаться с одним или несколькими другими противоопухолевыми веществами, выбранными из,например, митотических ингибиторов, например винбластин; алкилирующих веществ, например цисплатин, карбоплатин и циклофосфамид; антиметаболитов, например 5-фторурацил, цитозин арабинозид и гидроксимочевина, или, например, один из предпочтительных антиметаболитов, описанных в Европейской патентной заявке 239362, такие как N-(5-[N-(3,4-дигидро-2-метил-4-оксохиназолин-6-илметил)N-метиламино]-2-теноил)-L-глутаминовая кислота; ингибиторов фактора роста; ингибиторов клеточного цикла; интеркалирующих антибиотиков, например адриамицин и блеомицин; ферментов, например интерферон; и антигормонов, например антиэстрогены, такие как Нолвадекс (тамоксифен) или, например,антиандрогенов, таких как Касодекс (4'-циано-3-(4-фторфенилсульфонил)-2-гидрокси-2-метил-3'(трифторметил)пропионанилид). Такое совместное лечение может быть успешно осуществлено путем одновременного, последовательного или раздельного введения доз индивидуальных компонентов лечения. Фармацевтическая композиция может быть, например, в форме, подходящей для перорального введения, например в форме таблетки, капсулы, пилюли, порошка, композиции с замедленным высвобождением, раствора, суспензии, для парентеральной инъекции - в виде стерильного раствора, суспензии или эмульсии, для топического введения - в виде мази или крема, или для ректального введения - в виде свечей. Фармацевтическая композиция может быть в формах для однократного введения, подходящих для разового введения точно некоторого количества лекарственного средства. Фармацевтическая композиция будет включать обычно используемый фармацевтический носитель или наполнитель и соединение по изобретению в качестве активного ингредиента. Кроме того, композиция может включать другие лекарственные или фармацевтические средства, носители, адъюванты и т.д. Приведенные в качестве примера формы, предназначенные для парентерального введения, включают растворы или суспензии активного соединения в стерильных водных растворах, например водных растворах пропиленгликоля или декстрозы. Такие лекарственные формы могут быть соответственно буферизованы, если желательно. Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители. Фармацевтические композиции могут, если желательно, содержать дополнительные ингредиенты, такие как ароматизаторы, связующие вещества, наполнители и т.п. Таким образом, для перорального введения таблетки, содержащие различные наполнители, такие как лимонная кислота, могут быть использованы вместе с различными дезинтегрирующими веществами,такими как крахмал, альгиновая кислота, и некоторыми комплексными силикатами и связующими веществами, такими как сахароза, желатин и гуммиарабик. Кроме того, для таблетирования часто используют смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. В мягких и твердых наполняемых желатиновых капсулах могут также быть использованы твердые композиции аналогичного типа. С этой целью предпочтительные вещества включают лактозу или молочный сахар и высокомоле- 23016888 кулярные полиэтиленгликоли. В случае если для перорального введения используют водные суспензии или эликсиры, активное соединение в них может сочетаться с различными подсластителями или ароматизаторами, красителями и, если желательно, эмульгирующими веществами или суспендирующими веществами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их сочетанием. Способы получения различных фармацевтических композиций с определенным количеством активного соединения известны, или будут очевидны, для специалиста в данной области. Напримеры, см.Remington's Pharmaceutical Sciences, Mack Publishing Company, Easter, Pa., 15th Edition (1975). В приведенных ниже примерах и способах получения дополнительно иллюстрированы и приведены в качестве примера соединения по настоящему изобретению и способы получения таких соединений. Понятно, что объем настоящего изобретения не ограничивается каким-либо образом следующими примерами и способами получения. В следующих примерах молекулы с одним хиральным центром, если не указано иное, существуют в виде рацемической смеси. Молекулы с двумя или более хиральными центрами, если не указано иное, существуют в виде рацемической смеси диастереомеров. Отдельные энантиомеры/диастереомеры могут быть получены способами, известными специалистам в данной области. Примеры В случаях, когда в нижеописанных способах получения и примерах применяют ВЭЖХ, общими используемыми условиями, если не указано иное, являются следующие. Используют колонку Polaris 5 С 18 А, 202,0 мм, с 3,76 мин градиентным элюированием, начиная при 95% А/5% В (А: 98% вода, 2% ацетонитрил, 0,01% муравьиная кислота; В: 100% ацетонитрил, 0,005% муравьиная кислота), заканчивая при 100% В при скорости потока 1,0 мл/мин. Соединения определяют методом поглощения УФ-лучей и методом электрораспылительной ионизации. Приведенные ниже примеры и способы получения дополнительно иллюстрируют и приводят в качестве примера соединения по настоящему изобретению и способы получения таких соединений. Понятно, что объем настоящего изобретения не ограничивается следующими примерами и способами получения. В следующих примерах молекулы с одним хиральным центром, если не указано иное, существуют в виде рацемической смеси. Молекулы с двумя или более хиральными центрами, если не указано иное,существуют в виде рацемической смеси диастереомеров. Отдельные энантиомеры/диастереомеры могут быть получены способами, известными специалистам в данной области. Пример 1.(2R,4S)-1-трет-бутил 2-метил 4-(метилсульфонилокси)пиперидин-1,2-дикарбоксилат (как описано в работе F. Machetti, F.M. Cordero, F. De Sarlo, A.M. Papini, М.С. Alcaro, A. Brandi, Eur. J. Org. Chem. 2004,2928-2935). К раствору (2R,4S)-1-трет-бутил 2-метил 4-гидроксипиперидин-1,2-дикарбоксилата (21 г, 81 ммоль) и DMAP (100 мг, 0,81 ммоль) в пиридине (50 мл) при температуре 0 С добавляли по каплям MsCl(6,61 мл, 85 ммоль). Смесь перемешивали при комнатной температуре в течение 5 ч и затем концентрировали при пониженном давлении для удаления большей части растворителя. Добавляли насыщенный солевой раствор (200 мл) и экстрагировали этилацетатом (2200 мл). Органический слой сушили надMgSO4, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения 26,7 г (98%) в виде бесцветного масла.(26,7 г, 81 ммоль) в сухом ДМФ (100 мл) добавляли NaN3 (15,8 г, 243 ммоль). Смесь нагревали при температуре 60 С в течение 18 ч. В реакционную смесь добавляли воду (300 мл) и экстрагировали смесью этилацетат/гептан (2:1) (2200 мл). Объединенный органический слой промывали с помощью насыщенного солевого раствора и сушили над MgSO4, фильтровали и концентрировали при пониженном давлении с получением бесцветного масла 22,5 г (98%).(2R,4R)-1-трет-бутил 2-метил 4-азидопиперидин-1,2-дикарбоксилат (22,5 г, 79 ммоль) растворяли в метаноле (400 мл), добавляли Pd/C (10%, 6 г) и аппарат три раза продували N2 и Н 2. Реакционную смесь гидрировали под давлением 50 пси при комнатной температуре в течение 20 ч, фильтровали через целит и промывали метанолом и затем концентрировали при пониженном давлении с получением амина в виде(5,3 мл, 30 ммоль) в ДМФ (50 мл) добавляли ВОР (6,59 г, 14,9 ммоль). Затем к смеси добавляли (2R,4R)1-трет-бутил 2-метил 4-аминопиперидин-1,2-дикарбоксилат (3,5 г, 13,5 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 18 ч. Для гашения реакции добавляли воду(100 мл) и экстрагировали этилацетатом (2100 мл), органические слои сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали с помощью Companion (ReadySep, 120 г, заполнение силикагелем), используя смесь этилацетат/гептан от 20-50% с получением амида в виде не совсем белого твердого продукта 5,4 г (95%).(2R,4R)-1-трет-бутил 2-метил 4-(2,3-дигидробензо[b][1,4]диоксин-6 карбоксамидо)пиперидин-1,2-дикарбоксилата (5,4 г, 12,8 ммоль) в смеси ТГФ/МеОН/вода (3:2:1) (60 мл) добавляли LiOH (1,23 г, 51,4 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 18 ч. Для установления pH равным приблизительно 3 к реакционному раствору добавляли 1 М раствор HCl, экстрагировали этилацетатом (2100 мл). Органические слои сушили над MgSO4 и концентрировали с получением кислоты в виде белого твердого продукта, 5,0 г (96%).(4,3 мл, 24,6 ммоль) в ДМФ (30 мл) добавляли 4-метилбензол-1,2-диамин (1,65 г, 13,5 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 8 ч. В реакционную смесь добавляли воду (100 мл) и затем экстрагировали этилацетатом (2100 мл). Органические слои сушили над MgSO4 и концентрировали с получением твердого продукта красного цвета. Очистку осуществляли с помощьюCompanion (ReadySep, 120 г, заполнение силикагелем), используя смесь метанол/метиленхлорид от 1-5% с получением указанного в заголовке соединения в виде твердого продукта коричневого цвета, 4,85 г(2R,4R)-трет-бутил 2-2-амино-4-метилфенил)карбамоил)-4-(2,3-дигидробензо[b][1,4]диоксин-6 карбоксамидо)пиперидин-1-карбоксилат (4,8 г, 9,4 ммоль) растворяли в уксусной кислоте (10 мл) и перемешивали при температуре 65 С в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении для удаления уксусной кислоты. Затем к остатку добавляли ТФУ (10 мл). Полученный раствор перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали для удаления ТФУ и проводили последующую реакцию без дополнительной очистки. К раствору остатка в метаноле (50 мл) добавляли 37%-ный раствор формальдегида в воде (3,5 мл, 47 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем при температуре 0 С осторожно добавляли 1 М цианборгидрид натрия в ТГФ (29 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и затем растворитель упаривали в вакууме. Добавляли насыщенный раствор бикарбоната натрия (100 мл) и этилацетат (200 мл) и смесь перемешивали приблизительно 30 мин. Органический слой отделяли, сушили над MgSO4 и концентрировали. Продукт очищали с помощью Companion (ReadySep 120 г, заполнение силикагелем) в смеси CH3OH/CH2Cl2 от 2-6-8% с получением указанного в заголовке соединения в виде не совсем белого твердого продукта, 3,0 г (78%). К раствору N-2R,4R)-2-(1 Н-бензо[d]имидазол-2-ил)пиперидин-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксамида (50 мг, 0,13 ммоль) в метаноле (2 мл) добавляли уксусную кислоту (0,075 мл,1,3 ммоль) и затем к реакционному раствору добавляли (1-этоксициклопропокси)триметилсилан (138 мг,1,79 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 10 мин, затем осторожно добавляли цианборгидрид натрия (37 мг, 0,59 ммоль). Реакционную смесь перемешивали при температуре 50 С 24 ч. Добавляли насыщенный раствор бикарбоната натрия (10 мл) и этилацетат(30 мл). Органический слой отделяли, сушили над MgSO4 и концентрировали. Продукт очищали с помощью Companion (ReadySep, 12 г, заполнение силикагелем) с CH3OH/CH2Cl2 1-5% с получением указанного соединения в виде белого твердого продукта, 46 мг (85%). 4-(3-(6-(трифторметил)пиридин-3-ил)уреидо)пиперидин-1,2 К раствору (2R,4R)-1-трет-бутил 2-метил 4-аминопиперидин-1,2-дикарбоксилата (500 мг,1,94 ммоль) в ТГФ (15 мл) при комнатной температуре добавляли раствор CDI (345 мг, 2,13 ммоль) в ТГФ (10 мл). Реакционную смесь перемешивали при температуре 70 С в течение 3 ч. Затем к смеси добавляли 6-(трифторметил)пиридин-3-амин (345 мг, 2,13 ммоль) и полученный раствор перемешивали при температуре 60 С в течение 24 ч. Добавляли к смеси воду (50 мл) и этилацетат (50 мл). Органический слой отделяли и сушили над MgSO4 и концентрировали при пониженном давлении. Очистку осуществляли с помощью Companion (ReadySep, 40 г, заполнение силикагелем), используя смесь этилацетат/гептан от 40-60% с получением 10 в виде твердого продукта цвета, 550 мг (64%).(118 мг, 4,93 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 18 ч. Для установления pH равным приблизительно 3 к реакционному раствору добавляли 1 М раствор HCl,экстрагировали этилацетатом (250 мл). Органические слои сушили над MgSO4 и концентрировали с получением кислоты в виде твердого продукта белого цвета, 500 мг (94%).(2R,4R)-1-(трет-бутоксикарбонил)-4-(3-(6-(трифторметил)пиридин-3-ил)уреидо)пиперидин-2-карбоновой кислоты (500 мг, 1,16 ммоль), ВОР (563 мг, 1,27 ммоль) и DIEA (0,403 мл,2,31 ммоль) в ДМФ (5 мл) добавляли бензол-1,2-диамин (131 мг, 1,21 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 8 ч. В реакционную смесь добавляли воду (20 мл) и затем экстрагировали этилацетатом (230 мл). Органические слои сушили над MgSO4 и концентрировали с получением твердого продукта красного цвета. Очистку осуществляли с помощью Companion(ReadySep, 40 г, заполнение силикагелем), используя смесь метанолом/метиленхлорид от 1-5% с получением указанного в заголовке соединения в виде твердого продукта белого цвета, 550 мг (91%).(2R,4R)-трет-бутил 2-2-аминофенил)карбамоил)-4-(3-(6-(трифторметил)пиридин-3-ил)уреидо)пиперидин-1-карбоксилат (550 мг, 1,05 ммоль) растворяли в уксусной кислоте (5 мл) и перемешивали при температуре 65 С в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении для удаления уксусной кислоты. Затем к остатку добавляли ТФУ (3 мл). Полученный раствор перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали для удаления ТФУ и проводили последующую реакцию без дополнительной очистки. К раствору остатка в метаноле (5 мл) добавляли 37%-ный раствор формальдегида (0,25 мл, 3,2 ммоль) в воде и реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем при температуре 0 С осторожно добавляли 1 М цианборгидрид натрия в ТГФ (3,2 мл, 3,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и затем растворитель упаривали в вакууме. Добавляли насыщенный раствор бикарбоната натрия (20 мл) и этилацетат (40 мл) и смесь перемешивали приблизительно 30 мин. Органический слой отделяли, сушили над MgSO4 и концентрировали. Продукт очищали с помощью Companion (ReadySep 40 г, заполнение силикагелем), используя смесь CH3OH/CH2Cl2 от 2-6-8% с получением указанного в заголовке соединения в виде не совсем белого твердого продукта, 270 мгNEt3 (1,3 мл, 9,3 ммоль) в ТГФ (30 мл) добавляли 4-изоцианатобензонитрил (1,17 г, 8,13 ммоль), полученный раствор перемешивали при комнатной температуре в течение 6 ч. Для гашения избытка изоцианина к реакционной смеси добавляли 1 М аммиак в метаноле (5 мл). К смеси добавляли воду (100 мл) и этилацетат (200 мл). Органический слой отделяли и сушили над MgSO4 и концентрировали с получением твердого продукта. Очистку осуществляли с помощью Companion (ReadySep, 80 г, заполнение силикагелем), используя смесь этилацетат/гептан от 40-70% с получением мочевины в виде твердого продукта белого цвета, 2,9 г (90%).(2R,4R)-1-трет-бутил 2-метил 4-(3-(4-цианофенил)уреидо)пиперидин-1,2- 27016888 дикарбоксилата (1200 мг, 2,98 ммоль) в смеси ТГФ/МеОН/вода (3:2:1) (24 мл) добавляли LiOH (143 мг,5,96 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 18 ч. Для установления pH равным приблизительно 3 к реакционному раствору добавляли 1 М раствор HCl и экстрагировали этилацетатом (250 мл). Органические слои сушили над MgSO4 и концентрировали с получением кислоты в виде твердого продукта белого цвета, 1150 мг (99%).(2R,4R)-трет-бутил 2-2-амино-4,5-диметилфенил)карбамоил)-4-(3-(4-цианофенил)уреидо)пиперидин-1-карбоксилат. К смеси (2R,4R)-1-(трет-бутоксикарбонил)-4-(3-(4-цианофенил)уреидо)пиперидин-2-карбоновой кислоты (100 мг, 0,258 ммоль), ВОР (120 мг, 0,27 ммоль) и DIEA (0,09 мл, 0,52 ммоль) в ДМФ (1 мл) добавляли 4,5-диметилбензол-1,2-диамин (39 мг, 0,286 ммоль), полученный раствор перемешивали при комнатной температуре в течение 8 ч. В реакционную смесь добавляли воду (10 мл) и затем экстрагировали этилацетатом (220 мл). Органические слои сушили над MgSO4 и концентрировали с получением твердого продукта красного цвета. Очистку осуществляли с помощью Companion (ReadySep, 12 г, заполнение силикагелем), используя смесь этилацетат/гептан от 50-80% с получением указанного в заголовке соединения в виде твердого продукта белого цвета, 104 мг (80%).(2R,4R)-трет-бутил 2-2-амино-4,5-диметилфенил)карбамоил)-4-(3-(4-цианофенил)уреидо)пиперидин-1-карбоксилат (104 мг, 0,205 ммоль) растворяли в уксусной кислоте (1 мл) и перемешивали при температуре 65 С в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении для удаления уксусной кислоты. Затем к остатку добавляли ТФУ (1 мл). Полученный раствор перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали для удаления ТФУ и проводили последующую реакцию без дополнительной очистки. К раствору остатка в метаноле (2 мл) добавляли 37%-ный раствор формальдегида (0,046 мл, 0,616 ммоль) в воде и реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем при температуре 0 С осторожно добавляли 1 М цианборгидрид натрия в ТГФ (0,62 мл, 0,62 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч и затем растворитель упаривали в вакууме. Добавляли насыщенный раствор бикарбоната натрия (5 мл) и этилацетат (20 мл) и смесь перемешивали приблизительно 30 мин. Органический слой отделяли, сушили над MgSO4 и концентрировали. Продукт очищали с помощью Companion (ReadySep 12 г, заполнение силикагелем) с CH3OH/CH2Cl2 от 1-5% с получением указанного в заголовке соединения в виде не совсем белого твердого продукта, 71 мг (73%). К раствору (2R,4R)-трет-бутил 2-(1 Н-бензо[d]имидазол-2-ил)-4-(2,3-дигидробензо[b][1,4]диоксин-6 карбоксамидо)пиперидин-1-карбоксилата (200 мг, 0,418 ммоль) в ДМФ (2 мл) добавляли 2-(2 бромэтокси)-тетрагидро-2 Н-пиран (114 мг, 0,543 ммоль) и K2CO3 (116 мг, 0,836 ммоль) и реакционную смесь перемешивали при температуре 80 С в течение ночи. К смеси добавляли воду и этилацетат, органический слой отделяли и сушили над MgSO4 и концентрировали. Остаток очищали с помощью ВЭЖХ с помощью смеси 0,1% НСООН в воде/0,1% НСООН в ACN от 45-70% с получением указанного соединения в виде твердого продукта белого цвета, 90 мг (35%).(2R,4R)-трет-бутил 4-(2,3-дигидробензо[b][1,4]диоксин-6-карбоксамидо)-2-(1-(2-гидроксиэтил)-1 Нбензо[d]имидазол-2-ил)пиперидин-1-карбоксилат. К раствору уксусной кислоты (2 мл), ТГФ (1 мл) и воды (0,5 мл) (4:2:1) добавляли (2R,4R)-третбутил 4-(2,3-дигидробензо[b][1,4]диоксин-6-карбоксамидо)-2-(1-(2-(тетрагидро-2 Н-пиран-2-илокси)этил)-1 Н-бензо[d]имидазол-2-ил)пиперидин-1-карбоксилат (90 мг, 0,15 ммоль), полученный раствор перемешивали при температуре 45 С в течение ночи. Реакционную смесь концентрировали с получением масла желтого цвета в качестве указанного в заголовке соединения (LC-MC: 523,2, t=2,3 мин) с проведением последующей реакции без дополнительной очистки.(3,5 мг) в пиридине (1 мл) при температуре 0 С добавляли метансульфонил хлорид (51,3 мг, 0,448 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 5 ч. В реакционную смесь добавляли воду и этилацетат. Органический слой отделяли и сушили над MgSO4 и концентрировали с получением твердого продукта желтого цвета, который очищали с помощью Companion (ReadSep, 12 г, заполнение силикагелем), используя смесь этилацетат/гептан от 30-70% с получением указанного в заголовке соединения в виде твердого продукта белого цвета, 65 мг (73%).(1 мл) и перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали для удаления ТФУ, остаток растворяли в ДМФ (1 мл) и добавляли K2CO3 (30 мг, 0,22 ммоль), полученную смесь перемешивали при температуре 60 С в течение ночи. К реакционной смеси добавляли воду и этилацетат, органический слой отделяли, сушили над MgSO4 и концентрировали. Очистку осуществляли с помощью Companion (ReadSep, 12 г, заполнение силикагелем) с помощью смеси CH3OH/CH2Cl2 от 15% с получением твердого продукта белого цвета, 30 мг (60%) в качестве указанного в заголовке соединения.LC-MC: 405,2 (t=1,4 мин). Свободное основание по примеру 31NEt3 (1,3 мл, 9,3 ммоль) в ТГФ (30 мл) добавляли 4-изоцианатобензонитрил (1,17 г, 8,13 ммоль), полученный раствор перемешивали при комнатной температуре в течение 6 ч. Для гашения избытка изоцианина в реакционную смесь затем добавляли 1 М аммиак в метаноле (5 мл). К смеси добавляли воду(100 мл) и этилацетат (200 мл). Органический слой отделяли, сушили над MgSO4 и концентрировали с получением твердого продукта. Очистку осуществляли с помощью Companion (ReadySep, 80 г, заполнение силикагелем), используя смесь этилацетат/гептан от 40-70% в качестве элюента с получением указанного в заголовке соединения в виде твердого продукта белого цвета, 2,9 г (90%).(2R,4R)-1-трет-бутил 2-метил 4-(3-(4-цианофенил)уреидо)пиперидин-1,2 дикарбоксилата (1200 мг, 2,98 ммоль) в ТГФ/МеОН/вода (3:2:1) (24 мл) добавляли LiOH (143 мг,5,96 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 18 ч. Для установления pH равным приблизительно 3 к реакционному раствору добавляли 1 М раствор HCl, смесь затем экстрагировали этилацетатом (2150 мл) и объединенные органические слои сушили над MgSO4 и концентрировали с получением кислоты в виде белого твердого продукта, 1150 мг (99%).
МПК / Метки
МПК: A61K 31/4439, C07D 405/14, A61P 35/00, A61K 31/517, C07D 413/14, C07D 401/12, C07D 409/14, A61K 31/4433, C07D 403/04, C07D 471/04, C07D 401/04, C07D 401/14, C07D 403/14
Метки: бензимидазола, производные
Код ссылки
<a href="https://eas.patents.su/30-16888-proizvodnye-benzimidazola.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензимидазола</a>
Предыдущий патент: Замещенные феноксиаминотиазолоны в качестве модуляторов родственного эстрогеновому рецептору рецептора-α
Следующий патент: Устройство и способ для обеспечения тары индивидуальным оформлением
Случайный патент: Летающий клапан и способ эксплуатации скважин












