Замещенные пиридиламидные соединения в качестве модуляторов гистаминового н3-рецептора
Номер патента: 15555
Опубликовано: 31.08.2011
Авторы: Чжун Хуа, Миллз Джон Е., Ли Киев С., Виллани Фрэнк Дж., Мани Неелакандха С., Пандит Ченнагири Р., Летавич Майкл А., Кейт Джон М.
Формула / Реферат
1. Соединение формулы (I)
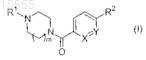
где R1представляет собой -C1-4алкил или насыщенный моноциклический циклоалкил, содержащий от 3 до 12 атомов углерода;
m равно 1 или 2;
X представляет собой N или CH;
Y представляет собой N или CRa;
Ra представляет собой -H, -Z-Ar, -CH2NRbRc, -CN или -CONRbRc;
где каждый из Rb и Rc независимо представляет собой -H или -C1-4алкил;
R2 представляет собой -H или -Z-Ar;
при условии что один из X и Y представляет собой N, а один из Ra и R2 представляет собой -Z-Ar;
где Z представляет собой O или S;
Ar представляет собой фенильную или моноциклическую гетероарильную группу, содержащую один атом азота, незамещенную или замещенную одним, двумя или тремя заместителями R3;
где каждый из заместителей R3 независимо выбран из группы, состоящей из галогена, -C1-4алкила, -SC1-4 алкила и -CN;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой метил, этил, пропил, изопропил, бутил, втор-бутил или трет-бутил.
3. Соединение по п.1, где R1 представляет собой метил или изопропил.
4. Соединение по п.1, где R1 представляет собой циклопропил, циклобутил, циклопентил или циклогексил.
5. Соединение по п.1, где m равно 1.
6. Соединение по п.1, где m равно 2.
7. Соединение по п.1, где X представляет собой N, Y представляет собой CRa, a R2 представляет собой -Z-Ar.
8. Соединение по п.1, где X представляет собой CH, Y представляет собой N, a R2 представляет собой -Z-Ar.
9. Соединение по п.1, где X представляет собой N, Y представляет собой CRa, a R2 представляет собой -H, где Ra представляет собой -Z-Ar.
10. Соединение по п.1, где Ra представляет собой -CN, -CONH2 или -CH2NH2.
11. Соединение по п.1, где Ra представляет собой -H.
12. Соединение по п.1, где Z представляет собой O.
13. Соединение по п.1, где Z представляет собой S.
14. Соединение по п.1, где Ar представляет собой фенильную, пирролильную или пиридильную группу, каждая из которых является незамещенной или замещена одним, двумя или тремя заместителями R3.
15. Соединение по п.1, где Ar представляет собой фенильную группу, которая является незамещенной или замещена одним, двумя или тремя заместителями R3.
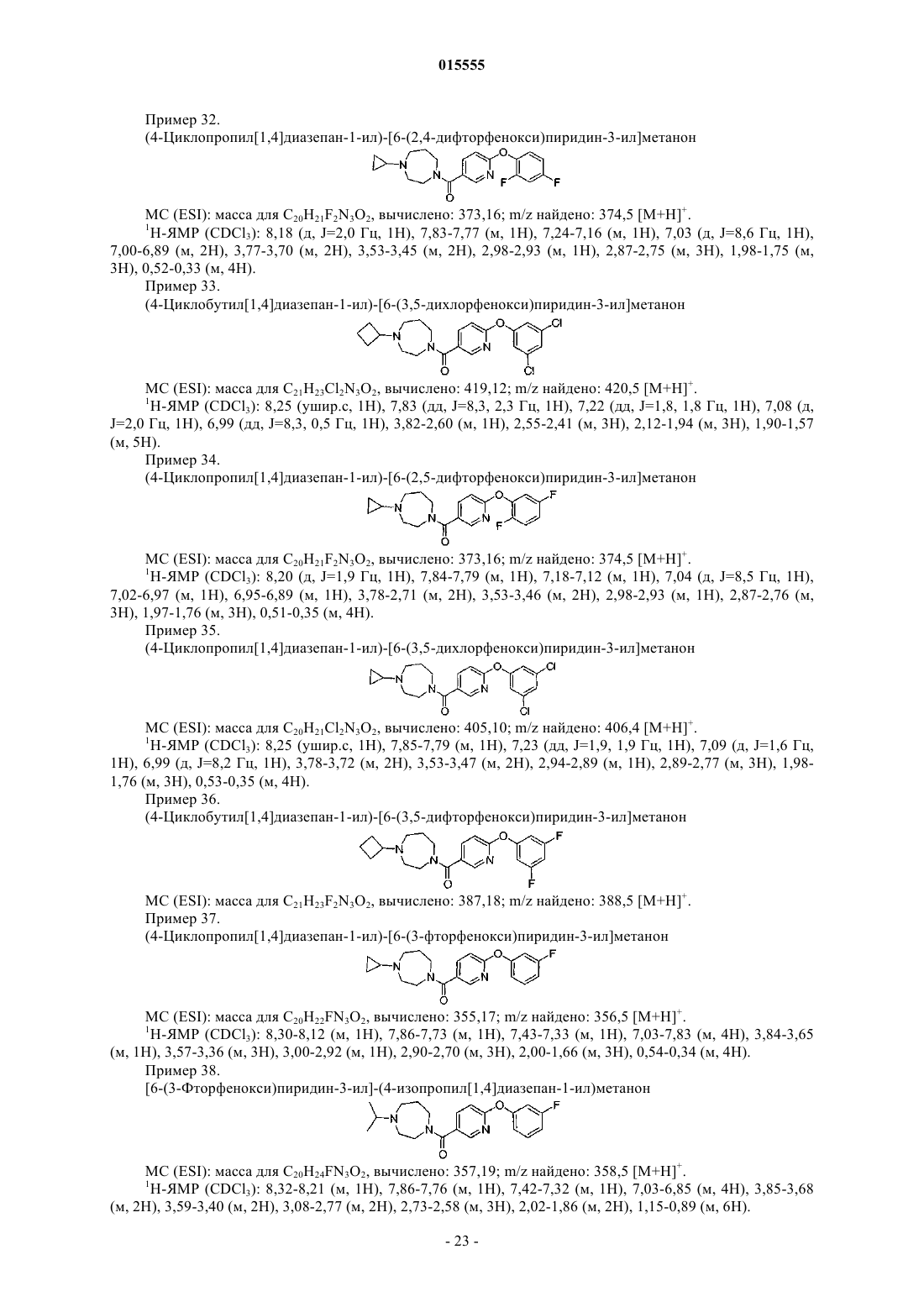
16. Соединение по п.1, где Ar представляет собой 4-галогенфенильную группу.
17. Соединение по п.1, где Ar представляет собой фенил, 3,4-дихлорфенил, 4-метилсульфанилфенил, 3-хлорфенил, 3-фторфенил, 4-хлор-3-метилфенил, 3-цианофенил, 4-хлорфенил, 4-фторфенил, 3,4-дифторфенил, 2-фторфенил, 3-хлорфенил, 2,4-дифторфенил, 3,5-дихлорфенил, 2,5-дифторфенил, 3,5-дифторфенил, 3-метил-4-метилсульфанилфенил или 3-пиридил.
18. Соединение формулы (II)
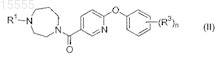
где R1представляет собой -C1-4алкил или насыщенный моноциклический циклоалкил, содержащий от 3 до 12 атомов углерода;
каждый из заместителей R3 независимо выбран из группы, состоящей из галогена, -C1-4алкила, -SC1-4алкила и -CN;
n равно 0, 1, 2 или 3;
или его фармацевтически приемлемая соль.
19. Соединение по п.18, где R1 представляет собой циклопропил, циклобутил, циклопентил или циклогексил.
20. Соединение формулы (III)
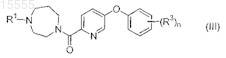
где R1представляет собой -C1-4алкил или насыщенный моноциклический циклоалкил, содержащий от 3 до 12 атомов углерода;
каждый из заместителей R3 независимо выбран из группы, состоящей из галогена, -C1-4алкила, -SC1-4алкила и -CN;
n равно 0, 1, 2 или 3;
или его фармацевтически приемлемая соль.
21. Соединение по п.20, где R1 представляет собой циклопропил, циклобутил, циклопентил или циклогексил.
22. Соединение, выбранное из группы, состоящей из
[6-(3,4-дихлорфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-изопропилпиперазин-1-ил)-[6-(пиридин-3-илокси)пиридин-3-ил]метанона;
(4-изопропилпиперазин-1-ил)-[6-(4-метилсульфанилфенокси)пиридин-3-ил]метанона;
[6-(3-хлорфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-изопропилпиперазин-1-ил)-(6-феноксипиридин-3-ил)метанона;
[6-(4-хлор-3-метилфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
3-[5-(4-изопропилпиперазин-1-карбонил)пиридин-2-илокси]бензонитрила;
[6-(4-хлорфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(3,4-дихлорфенокси)пиридин-3-ил]метанона;
[6-(4-хлорфенокси)пиридин-3-ил]-(4-циклопропил[1,4]диазепан-1-ил)метанона;
3-[5-(4-циклопропил[1,4]диазепан-1-карбонил)пиридин-2-илокси]бензонитрила;
[6-(4-хлор-3-метилфенокси)пиридин-3-ил]-(4-циклопропил[1,4]диазепан-1-ил)метанона;
(4-циклопропил[1,4]диазепан-1-ил)-(6-феноксипиридин-3-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3,4-дихлорфенокси)пиридин-3-ил]метанона;
[6-(3,4-дихлорфенокси)пиридин-3-ил]-(4-изопропил[1,4]диазепан-1-ил)метанона;
[6-(4-хлор-3-метилфенокси)пиридин-3-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
[6-(4-хлор-3-метилфенокси)пиридин-3-ил]-(4-изопропил[1,4]диазепан-1-ил)метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
3-[5-(4-циклобутил[1,4]диазепан-1-карбонил)пиридин-2-илокси]бензонитрила;
(4-циклобутил[1,4]диазепан-1-ил)-(6-феноксипиридин-3-ил)метанона;
(4-циклопропилпиперазин-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
[6-(3-хлорфенокси)пиридин-3-ил]-(4-циклопропил[1,4]диазепан-1-ил)метанона;
[6-(3-хлорфенокси)пиридин-3-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
[6-(4-хлорфенокси)пиридин-3-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3,4-дифторфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(3,4-дифторфенокси)пиридин-3-ил]метанона;
[6-(3,4-дифторфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(2-фторфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(2,4-дифторфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(2-фторфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(2,4-дифторфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3,5-дихлорфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(2,5-дифторфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(3,5-дихлорфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3,5-дифторфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(3-фторфенокси)пиридин-3-ил]метанона;
[6-(3-фторфенокси)пиридин-3-ил]-(4-изопропил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3-фторфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
(4-изопропил[1,4]диазепан-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
[6-(3,4-дихлорфенокси)пиридин-2-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(3,4-дихлорфенокси)пиридин-2-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3,4-дихлорфенокси)пиридин-2-ил]метанона;
[6-(3,4-дихлорфенокси)пиридин-2-ил]-(4-изопропил[1,4]диазепан-1-ил)метанона;
[6-(4-хлор-3-метилфенокси)пиридин-2-ил]-(4-циклопропил[1,4]диазепан-1-ил)метанона;
[6-(4-хлор-3-метилфенокси)пиридин-2-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
[6-(4-хлор-3-метилфенокси)пиридин-2-ил]-(4-изопропил[1,4]диазепан-1-ил)метанона;
[5-(3,4-дихлорфенокси)пиридин-2-ил]-(4-изопропил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[5-(3,4-дихлорфенокси)пиридин-2-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[5-(3,4-дихлорфенокси)пиридин-2-ил]метанона;
3-(3,4-дихлорфенокси)-6-(4-изопропилпиперазин-1-карбонил)пиридин-2-карбонитрила;
амида 3-(3,4-дихлорфенокси)-6-(4-изопропилпиперазин-1-карбонил)пиридин-2-карбоновой кислоты;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(4-метилсульфанилфенокси)пиридин-2-карбонитрила;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(пиридин-3-илокси)пиридин-2-карбонитрила;
3-(4-хлор-3-метилфенокси)-6-(4-циклопропил[1,4]диазепан-1-карбонил)пиридин-2-карбонитрила;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(3,4-дихлорфенокси)пиридин-2-карбонитрила;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(4-фторфенокси)пиридин-2-карбонитрила;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(3-фторфенокси)пиридин-2-карбонитрила;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(2-фторфенокси)пиридин-2-карбонитрила;
амида 6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(4-метилсульфанилфенокси)пиридин-2-карбоновой кислоты;
амида 6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(пиридин-3-илокси)пиридин-2-карбоновой кислоты;
[6-аминометил-5-(3,4-дихлорфенокси)пиридин-2-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-циклопентил[1,4]диазепан-1-ил)-(6-феноксипиридин-3-ил)метанона;
(4-циклопентил[1,4]диазепан-1-ил)-[6-(3,4-дихлорфенокси)пиридин-3-ил]метанона;
(4-циклопентил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
[5-(4-хлорфенокси)пиридин-2-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[5-(4-фторфенокси)пиридин-2-ил]метанона;
[5-(3-хлорфенокси)пиридин-2-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[5-(3-фторфенокси)пиридин-2-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[5-(2-фторфенокси)пиридин-2-ил]метанона;
[6-(2-хлорфенокси)пиридин-3-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
(4-циклопентилпиперазин-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
[6-(2-хлорфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
[6-(2-хлорфенокси)пиридин-3-ил]-(4-циклопентилпиперазин-1-ил)метанона;
[6-(4-хлорфенокси)пиридин-3-ил]-(4-циклопентилпиперазин-1-ил)метанона;
(4-циклопентилпиперазин-1-ил)-[6-(2-фторфенокси)пиридин-3-ил]метанона;
(4-циклобутилпиперазин-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
[1,4]диазепан-1-ил-[6-(4-фторфенокси)пиридин-3-ил]метанона;
[6-(4-фторфенокси)пиридин-3-ил]-(4-метил[1,4]диазепан-1-ил)метанона;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-феноксипиридин-2-карбонитрила;
6-(4-циклобутил[1,4]диазепан-1-карбонил)-3-(4-фторфенокси)пиридин-2-карбонитрила;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенилсульфанил)пиридин-3-ил]метанона
и их фармацевтически приемлемых солей.
23. Фармацевтическая композиция для лечения заболевания, расстройства или патологического состояния, опосредуемого активностью гистаминового H3-рецептора, где указанная композиция включает:
(a) эффективное количество соединения формулы (I)
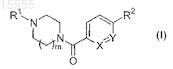
где R1представляет собой -C1-4алкил или насыщенный моноциклический циклоалкил, содержащий от 3 до 12 атомов углерода;
m равно 1 или 2;
X представляет собой N или CH;
Y представляет собой N или CRa;
Ra представляет собой -H, -Z-Ar, -CH2NRbRc, -CN или -CONRbRc,
где каждый из Rb и Rc независимо представляет собой -H или -C1-4алкил;
R2 представляет собой -Н или -Z-Ar;
при условии что один из X и Y представляет собой N, а один из Ra и R2 представляет собой -Z-Ar;
где Z представляет собой O или S;
Ar представляет собой фенильную или моноциклическую гетероарильную группу, содержащую один атом азота, незамещенную или замещенную одним, двумя или тремя заместителями R3;
где каждый из заместителей R3 независимо выбран из группы, состоящей из галогена, -C1-4алкила, -SC1-4 алкила и -CN;
или его фармацевтически приемлемой соли; и
(b) фармацевтически приемлемый эксципиент.
24. Фармацевтическая композиция по п.23, дополнительно включающая активный ингредиент, выбранный из группы, состоящей из антагонистов H1-рецептора, антагонистов H2-рецептора, антагонистов H3-рецептора, ингибиторов поглощения серотонина-норэпинефрина, селективных ингибиторов поглощения серотонина, ингибиторов поглощения норадренергических соединений, неселективных ингибиторов поглощения серотонина, ингибиторов ацетилхолинэстеразы и модафинила.
25. Способ лечения индивидуума, страдающего заболеванием, расстройством или патологическим состоянием, опосредуемым активностью гистаминового H3-рецептора, или индивидуума, у которого было диагностировано такое заболевание, расстройство или патологическое состояние, где указанный способ включает введение индивидууму, нуждающемуся в таком лечении, эффективного количества соединения формулы (I)

где R1представляет собой -C1-4алкил или насыщенный моноциклический циклоалкил, содержащий от 3 до 12 атомов углерода;
m равно 1 или 2;
X представляет собой N или CH;
Y представляет собой N или CRa;
Ra представляет собой -H, -Z-Ar, -CH2NRbRc, -CN- или -CONRbRc;
где каждый из Rb и Rc независимо представляет собой -H или -C1-4алкил;
R2 представляет собой -Н или -Z-Ar;
при условии что один из X и Y представляет собой N, а один из Ra и R2 представляет собой -Z-Ar;
где Z представляет собой O или S;
Ar представляет собой фенильную или моноциклическую гетероарильную группу, содержащую один атом азота, незамещенную или замещенную одним, двумя или тремя заместителями R3;
где каждый из заместителей R3 независимо выбран из группы, состоящей из галогена, -C1-4алкила, -SC1-4 алкила и -CN;
или его фармацевтически приемлемой соли.
26. Способ по п.25, где указанные заболевание, расстройство или патологическое состояние выбраны из группы, состоящей из нарушения познавательной способности, расстройств сна, психиатрических расстройств и других расстройств.
27. Способ по п.25, где указанные заболевание, расстройство или патологическое состояние выбраны из группы, состоящей из деменции, болезни Альцгеймера, нарушения познавательной функции, легкого нарушения познавательной способности, предеменции, гиперактивности с дефицитом внимания, расстройства, ассоциированного с дефицитом внимания, нарушения способности к обучению и расстройства памяти.
28. Способ по п.25, где указанные заболевание, расстройство или патологическое состояние выбраны из группы, состоящей из нарушения способности к обучению, ухудшения памяти и потери памяти.
29. Способ по п.25, где указанные заболевание, расстройство или патологическое состояние выбраны из группы, состоящей из бессонницы, нарушения сна, нарколепсии, ассоциированной или не ассоциированной с катаплексией, катаплексии, расстройства физиологического цикла засыпания/пробуждения, идиопатической сонливости, чрезмерной сонливости в дневное время, нарушения циркадного ритма, усталости, летаргии и расстройства нормального циркадного ритма в результате быстрого перемещения между часовыми поясами.
30. Способ по п.25, где указанные заболевание, расстройство или патологическое состояние выбраны из группы, состоящей из апноэ во сне, гормональных сдвигов, ассоциированных с перименопаузой, болезни Паркинсона, рассеянного склероза, депрессии, химиотерапии и изменения графика работы.
31. Способ по п.25, где указанные заболевание, расстройство или патологическое состояние выбраны из группы, состоящей из шизофрении, биполярных расстройств, маний, депрессии, обсессивно-компульсивного расстройства и посттравматического стресса.
32. Способ по п.25, где указанные заболевание, расстройство или патологическое состояние выбраны из группы, состоящей из морской болезни, вертиго, эпилепсии, мигрени, нейрогенного воспаления, нарушения питания, ожирения и расстройств, вызываемых злоупотреблением наркотическими средствами.
33. Способ по п.25, где указанные заболевание, расстройство или патологическое состояние выбраны из группы, состоящей из депрессии, нарушения сна, усталости, летаргии, нарушения познавательной способности, нарушения памяти, потери памяти, нарушения способности к обучению, расстройств, ассоциированных с дефицитом внимания, и нарушения питания.
34. Соединение, выбранное из группы, состоящей из
(4-циклобутил[1,4]диазепан-1-ил)-[5-(4-фторфенилсульфанил)пиридин-2-ил]метанона;
[6-(4-хлорфенилсульфанил)пиридин-3-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(6-фенилсульфанилпиридин-3-ил)метанона;
(4-циклопентилпиперазин-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
(4-изопропилпиперазин-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
[6-(4-фторфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-этил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(5-фенилсульфанилпиридин-2-ил)метанона;
[6-(4-фторфенокси)пиридин-3-ил]-(4-метил[1,4]диазепан-1-ил)метанона;
[6-(4-фторфенокси)пиридин-3-ил]-(4-изобутилпиперазин-1-ил)метанона
и их фармацевтически приемлемых солей.
35. Фармацевтическая композиция по п.23, которая дополнительно содержит топирамат.
36. Способ по п.25, где указанные заболевание, расстройство или патологическое состояние выбраны из группы, состоящей из возрастного снижения познавательной способности, расстройства сна на фазе быстрого движения глаз, слабого постурального вертиго, шума в ушах, нарушения двигательной системы, синдрома усталых ног, глазных болезней, дегенерации желтого пятна и пигментоза сетчатки.
37. Соединение, выбранное из группы, состоящей из
(4-циклобутил[1,4]диазепан-1-ил)-(5-фенилсульфанилпиридин-2-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(6-фенилсульфанилпиридин-3-ил)метанона;
[6-(4-хлорфенилсульфанил)пиридин-3-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенилсульфанил)пиридин-3-ил]метанона;
(4-этил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
[6-(4-фторфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-циклопентилпиперазин-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
(4-изопропилпиперазин-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(6-о-толилоксипиридин-3-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(6-м-толилоксипиридин-3-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(6-п-толилоксипиридин-3-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(4-метилсульфанилфенокси)пиридин-3-ил]метанона
и их фармацевтически приемлемых солей.
38. Соединение по п.1 или его моногидрат гидрохлорида.
39. Соединение, выбранное из группы, состоящей из
[6-(3,4-дихлорфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-изопропилпиперазин-1-ил)-[6-(пиридин-3-илокси)пиридин-3-ил]метанона;
(4-изопропилпиперазин-1-ил)-[6-(4-метилсульфанилфенокси)пиридин-3-ил]метанона;
[6-(3-хлорфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-изопропилпиперазин-1-ил)-(6-феноксипиридин-3-ил)метанона;
[6-(4-хлор-3-метилфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
3-[5-(4-изопропилпиперазин-1-карбонил)пиридин-2-илокси]бензонитрила;
[6-(4-хлорфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(3,4-дихлорфенокси)пиридин-3-ил]метанона;
[6-(4-хлорфенокси)пиридин-3-ил]-(4-циклопропил[1,4]диазепан-1-ил)метанона;
3-[5-(4-циклопропил[1,4]диазепан-1-карбонил)пиридин-2-илокси]бензонитрила;
[6-(4-хлор-3-метилфенокси)пиридин-3-ил]-(4-циклопропил[1,4]диазепан-1-ил)метанона;
(4-циклопропил[1,4]диазепан-1-ил)-(6-феноксипиридин-3-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3,4-дихлорфенокси)пиридин-3-ил]метанона;
[6-(3,4-дихлорфенокси)пиридин-3-ил]-(4-изопропил[1,4]диазепан-1-ил)метанона;
[6-(4-хлор-3-метилфенокси)пиридин-3-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
[6-(4-хлор-3-метилфенокси)пиридин-3-ил]-(4-изопропил[1,4]диазепан-1-ил)метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
3-[5-(4-циклобутил[1,4]диазепан-1-карбонил)пиридин-2-илокси]бензонитрила;
(4-циклобутил[1,4]диазепан-1-ил)-(6-феноксипиридин-3-ил)метанона;
(4-циклопропилпиперазин-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
[6-(3-хлорфенокси)пиридин-3-ил]-(4-циклопропил[1,4]диазепан-1-ил)метанона;
[6-(3-хлорфенокси)пиридин-3-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
[6-(4-хлорфенокси)пиридин-3-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3,4-дифторфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(3,4-дифторфенокси)пиридин-3-ил]метанона;
[6-(3,4-дифторфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(2-фторфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(2,4-дифторфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(2-фторфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(2,4-дифторфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3,5-дихлорфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(2,5-дифторфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(3,5-дихлорфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3,5-дифторфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(3-фторфенокси)пиридин-3-ил]метанона;
[6-(3-фторфенокси)пиридин-3-ил]-(4-изопропил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3-фторфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
(4-изопропил[1,4]диазепан-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
[6-(3,4-дихлорфенокси)пиридин-2-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[6-(3,4-дихлорфенокси)пиридин-2-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(3,4-дихлорфенокси)пиридин-2-ил]метанона;
[6-(3,4-дихлорфенокси)пиридин-2-ил]-(4-изопропил[1,4]диазепан-1-ил)метанона;
[6-(4-хлор-3-метилфенокси)пиридин-2-ил]-(4-циклопропил[1,4]диазепан-1-ил)метанона;
[6-(4-хлор-3-метилфенокси)пиридин-2-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
[6-(4-хлор-3-метилфенокси)пиридин-2-ил]-(4-изопропил[1,4]диазепан-1-ил)метанона;
[5-(3,4-дихлорфенокси)пиридин-2-ил]-(4-изопропил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[5-(3,4-дихлорфенокси)пиридин-2-ил]метанона;
(4-циклопропил[1,4]диазепан-1-ил)-[5-(3,4-дихлорфенокси)пиридин-2-ил]метанона;
3-(3,4-дихлорфенокси)-6-(4-изопропилпиперазин-1-карбонил)пиридин-2-карбонитрила;
амида 3-(3,4-дихлорфенокси)-6-(4-изопропилпиперазин-1-карбонил)пиридин-2-карбоновой кислоты;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(4-метилсульфанилфенокси)пиридин-2-карбонитрила;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(пиридин-3-илокси)пиридин-2-карбонитрила;
3-(4-хлор-3-метилфенокси)-6-(4-циклопропил[1,4]диазепан-1-карбонил)пиридин-2-карбонитрила;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(3,4-дихлорфенокси)пиридин-2-карбонитрила;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(4-фторфенокси)пиридин-2-карбонитрила;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(3-фторфенокси)пиридин-2-карбонитрила;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(2-фторфенокси)пиридин-2-карбонитрила;
амида 6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(4-метилсульфанилфенокси)пиридин-2-карбоновой кислоты;
амида 6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(пиридин-3-илокси)пиридин-2-карбоновой кислоты;
[6-аминометил-5-(3,4-дихлорфенокси)пиридин-2-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-циклопентил[1,4]диазепан-1-ил)-(6-феноксипиридин-3-ил)метанона;
(4-циклопентил[1,4]диазепан-1-ил)-[6-(3,4-дихлорфенокси)пиридин-3-ил]метанона;
(4-циклопентил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
[5-(4-хлорфенокси)пиридин-2-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[5-(4-фторфенокси)пиридин-2-ил]метанона;
[5-(3-хлорфенокси)пиридин-2-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[5-(3-фторфенокси)пиридин-2-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[5-(2-фторфенокси)пиридин-2-ил]метанона;
[6-(2-хлорфенокси)пиридин-3-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
(4-циклопентилпиперазин-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
[6-(2-хлорфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
[6-(2-хлорфенокси)пиридин-3-ил]-(4-циклопентилпиперазин-1-ил)метанона;
[6-(4-хлорфенокси)пиридин-3-ил]-(4-циклопентилпиперазин-1-ил)метанона;
(4-циклопентилпиперазин-1-ил)-[6-(2-фторфенокси)пиридин-3-ил]метанона;
(4-циклобутилпиперазин-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
[6-(4-фторфенокси)пиридин-3-ил]-(4-метил[1,4]диазепан-1-ил)метанона;
6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-феноксипиридин-2-карбонитрила;
6-(4-циклобутил[1,4]диазепан-1-карбонил)-3-(4-фторфенокси)пиридин-2-карбонитрила;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенилсульфанил)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[5-(4-фторфенилсульфанил)пиридин-2-ил]метанона;
[6-(4-хлорфенилсульфанил)пиридин-3-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(6-фенилсульфанилпиридин-3-ил)метанона;
(4-циклопентилпиперазин-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
(4-изопропилпиперазин-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
[6-(4-фторфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-этил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(5-фенилсульфанилпиридин-2-ил)метанона;
[6-(4-фторфенокси)пиридин-3-ил]-(4-метил[1,4]диазепан-1-ил)метанона;
[6-(4-фторфенокси)пиридин-3-ил]-(4-изобутилпиперазин-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(5-фенилсульфанилпиридин-2-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(6-фенилсульфанилпиридин-3-ил)метанона;
[6-(4-хлорфенилсульфанил)пиридин-3-ил]-(4-циклобутил[1,4]диазепан-1-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенилсульфанил)пиридин-3-ил]метанона;
(4-этил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона;
[6-(4-фторфенокси)пиридин-3-ил]-(4-изопропилпиперазин-1-ил)метанона;
(4-циклопентилпиперазин-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
(4-изопропилпиперазин-1-ил)-[6-(3-метил-4-метилсульфанилфенокси)пиридин-3-ил]метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(6-о-толилоксипиридин-3-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(6-м-толилоксипиридин-3-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-(6-п-толилоксипиридин-3-ил)метанона;
(4-циклобутил[1,4]диазепан-1-ил)-[6-(4-метилсульфанилфенокси)пиридин-3-ил]метанона
и их моногидратов моногидрохлорида.
40. Способ получения соединения формулы (II)
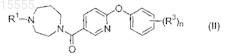
или его фармацевтически приемлемой соли, включающий реакцию взаимодействия соединения формулы (7-1)
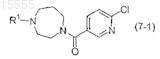
с соединением формулы (B3)
![]()
в присутствии по меньшей мере 1 экв. первого основания в первом органическом растворителе с образованием соединения формулы (II),
где R1представляет собой -C1-4алкил или насыщенный моноциклический циклоалкил, содержащий от 3 до 12 атомов углерода;
каждый из заместителей R3 независимо выбран из группы, состоящей из галогена, -C1-4алкила, -SC1-4алкила и -CN;
n равно 0, 1, 2 или 3;
первое основание представляет собой NaOH, KOH, K2CO3 или Cs2CO3;
первый органический растворитель представляет собой ДМФ, ДМА, ДМЭ, ДМСО или ацетонитрил или их смеси.
41. Способ по п.40, где реакционную смесь нагревают до температуры примерно 100°C.
42. Способ по п.40, где соединение формулы (7-1) представляет собой (6-хлорпиридин-3-ил)-(4-циклобутил[1,4]диазепан-1-ил)метанон, соединение формулы (B3) представляет собой 4-фторфенол, основание представляет собой по меньшей мере 1,5 экв. Cs2CO3, растворитель представляет собой ДМА, а соединение формулы (II) представляет собой (4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанон.
43. Способ по п.40, который дополнительно включает реакцию взаимодействия соединения формулы (5-1)
![]()
с 6-хлорникотинилхлоридом в присутствии второго основания во втором органическом растворителе с получением соединения формулы (7-1), где второе основание представляет собой водный NaOH, водный KOH, Et3N или iPr2NEt и второй органический растворитель представляет собой ДХМ, ДХЭ, толуол или изопропилацетат.
44. Способ по п.43, где соединение формулы (5-1) представляет собой дигидрохлорид 1-циклобутил[1,4]диазепана, второе основание представляет собой 1н. водный NaOH, второй органический растворитель представляет собой изопропилацетат, а соединение формулы (7-1) представляет собой (6-хлорпиридин-3-ил)-(4-циклобутил[1,4]диазепан-1-ил)метанон.
45. Способ по п.43, который дополнительно включает реакцию взаимодействия соединения формулы (B2)
![]()
с кислотой в третьем органическом растворителе с получением соли амина формулы (5-1), где кислота представляет собой TFA или HCl и третий органический растворитель представляет собой ДХМ, диоксан или MeOH или их смесь.
46. Способ по п.43, где соединение формулы (B2) представляет собой трет-бутиловый эфир 4-циклобутил[1,4]диазепан-1-карбоновой кислоты, кислота представляет собой HCl, третий органический растворитель представляет собой диоксан, а соединение формулы (5-1) представляет собой дигидрохлорид 1-циклобутил[1,4]диазепана.
47. Способ по п.40, который дополнительно включает реакцию взаимодействия трет-бутилгомопиперазин-1-карбоксилата с соединением формулы R1=O в присутствии восстановителя в четвертом органическом растворителе с получением соединения формулы (B2), где восстановитель представляет собой NaB(OAc)3H или NaCNBH3, а четвертый органический растворитель представляет собой ДХЭ, ТГФ, EtOAc, этанол или метанол.
48. Способ по п.47, где R1=O представляет собой циклобутанон, восстановитель представляет собой по меньшей мере 1,1 экв. NaB(OAc)3H, четвертый органический растворитель представляет собой дихлорэтан, а соединение формулы (B2) представляет собой трет-бутиловый эфир 4-циклобутил[1,4]диазепан-1-карбоновой кислоты.
49. Способ по п.40, который дополнительно включает реакцию взаимодействия соединения формулы (II) с HCl в пятом органическом растворителе с получением фармацевтически приемлемой соли соединения (II), где пятый органический растворитель представляет собой этанол, метанол, изопропанол, EtOAc или смесь этанол/Et2O.
50. Способ по п.49, где указанную реакцию взаимодействия осуществляют с использованием примерно 0,95 экв. HCl.
51. Способ по п.49, где указанное соединение формулы (II) представляет собой (4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанон, а фармацевтически приемлемая соль формулы (II) представляет собой моногидрат гидрохлорида (4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона.
52. Способ получения соединения формулы (II)
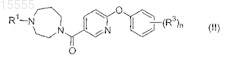
или его фармацевтически приемлемой соли, включающий реакцию взаимодействия соединения формулы E3
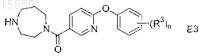
с соединением формулы R1=O в присутствии восстановителя в шестом органическом растворителе при температуре примерно от 0 до 40°C с образованием соединения формулы (II),
где R1представляет собой -C1-4алкил или насыщенный моноциклический циклоалкил, содержащий от 3 до 12 атомов углерода;
каждый из заместителей R3 независимо выбран из группы, состоящей из галогена, -C1-4алкила, -SC1-4алкила и -CN;
n равно 0, 1, 2 или 3;
восстановитель представляет собой NaB(OAc)3H или NaCNBH3,
а шестой органический растворитель представляет собой ДХЭ, ТГФ, EtOAc, этанол или метанол.
53. Способ по п.52, где соединение формулы E3 представляет собой (1,4-диазепан-1-ил)-(6-(4-фторфенокси)пиридин-3-ил)метанон, R1=O представляет собой циклобутанон, восстановитель представляет собой NaB(OAc)3H, шестой органический растворитель представляет собой EtOAc, а соединение формулы (II) представляет собой (4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанон.
54. Способ по п.52, который дополнительно включает реакцию взаимодействия соединения формулы E2
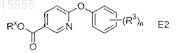
с гомопиперазином в присутствии металлорганического реагента в апротонном органическом растворителе при температуре примерно от 0 до 30°C с получением соединения формулы Е3, где Rx представляет собой метил или этил.
55. Способ по п.54, где указанный металлорганический реагент представляет собой RyMgBr, RyMgCl или RyLi, где Ry представляет собой метил, этил, пропил, изопропил, бутил или гексил.
56. Способ по п.54, где апротонный органический растворитель представляет собой ТГФ, Et2O, МТВЕ или 2-метил-ТГФ.
57. Способ по п.54, где соединение формулы E2 представляет собой этил 6-(4-фторфенокси)никотинат, металлорганический реагент представляет собой гексиллитий, апротонный органический растворитель представляет собой ТГФ, а соединение формулы E3 представляет собой [1,4]диазепан-1-ил-[6-(4-фторфенокси)пиридин-3-ил]метанон.
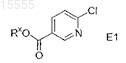
58. Способ по п.54, который дополнительно включает реакцию взаимодействия соединения формулы E1
с соединением формулы B3
![]()
в присутствии основания в полярном апротонном органическом растворителе при температуре примерно от комнатной температуры до 80°C с получением соединения формулы E2
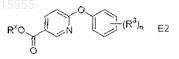
где Rx представляет собой метил или этил,
а основание представляет собой Cs2CO3, K2CO3, NaOH или KOH.
59. Способ по п.58, где полярный апротонный органический растворитель представляет собой ДМФ, ДМА, ДМСО или ацетонитрил.
60. Способ по п.58, где соединение формулы E1 представляет собой этил 6-хлорникотинат, соединение формулы B3 представляет собой 4-фторфенол, основание представляет собой Cs2CO3, полярный апротонный органический растворитель представляет собой ДМФ, а соединение формулы E2 представляет собой этил 6-(4-фторфенокси)никотинат.
61. Способ по п.52, который дополнительно включает:
a) разбавление раствора соединения формулы (II) в EtOAc этанолом и
b) обработку полученного раствора концентрированной водной HCl с получением гидрохлоридной соли соединения формулы (II).
62. Способ по п.61, где раствор соединения формулы (II) в EtOAc получают в результате реакции взаимодействия соединения формулы E3 с соединением формулы R1=O.
63. Способ по п.61, где соединение формулы (II) представляет собой (4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанон.
64. Способ по п.61, где фармацевтически приемлемая соль соединения формулы (II) представляет собой моногидрат гидрохлорида (4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента ЗАМЕЩЕННЫЕ ПИРИДИЛАМИДНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ГИСТАМИНОВОГО Н 3-РЕЦЕПТОРА Пиридиламидные соединения формулы (I) где R1 представляет собой -C1-4 алкил или насыщенный моноциклический циклоалкил; m равно 1 или 2; X представляет собой N или CH; Y представляет собой N или CRa; Ra представляет собой -H, -Z-Ar, -CH2NRbRc, -CN, -CO2C1-4 алкил, -CO2H или -CONRbRc; где каждый из Rb и Rc независимо представляет собой -H или -C1-4 алкил; R2 представляет собой -H или -Z-Ar; при условии, что один из X и Y представляет собой N, а один из Ra и R2 представляет собой -Z-Ar; где Z представляет собой O или S; а Ar представляет собой фенильную или моноциклическую гетероарильную группу, незамещенную или замещенную одним, двумя или тремя заместителямиR3; где каждый из заместителей R3 независимо выбран из группы, состоящей из галогена,-C1-4 алкила, -OH, -OC1-4 алкила, -SC1-4 алкила, -CN, -CONRdRe и -NO2, где каждый из Rd и Re независимо представляет собой -H или -C1-4 алкил; где указанные соединения представляют собой модуляторы гистаминового H3-рецептора, которые могут быть использованы для лечения заболеваний, опосредуемых гистаминовым H3-рецептором. 015555 Область, к которой относится изобретение Настоящее изобретение относится к некоторым пиридиламидным соединениям, к способам их получения, к фармацевтическим композициям, содержащим эти соединения, и к способам их применения для лечения патологических состояний, расстройств и состояний, опосредуемых гистаминовым H3 рецептором. Предшествующий уровень техники Гистаминовый H3-рецептор был впервые описан как пресинаптический ауторецептор центральной нервной системы (ЦНС) (Arrang, J.-M. et al., Nature 1983, 302, 332-837), регулирующий синтез и высвобождение гистамина. Гистаминовый H3-рецептор экспрессируется, главным образом, в центральной нервной системе (ЦНС) млекопитающих и почти на минимальном уровне - в периферических тканях,таких как гладкие мышцы сосудов. Таким образом, на основе фармакологии, разработанной в экспериментах на животных и в других экспериментах с использованием известных антагонистов гистаминового H3-рецептора (например, тиоперамида), были сделаны предположения относительно нескольких показаний для применения антагонистов и обратных агонистов гистаминового H3-рецептора (см. "The Histamine H3 Receptor-A Target for NewDrugs", Leurs, R. and Timmerman, H. (Eds.), Elsevier, 1998; Morisset, S. et al., Nature 2000, 408, 860-864). Указанными показаниями являются такие состояния, как нарушение познавательной способности, расстройство сна, психиатрические расстройства и другие расстройства. Так, например, было показано, что антагонисты гистаминового H3-рецептора обладают фармакологической активностью, направленной на некоторые основные симптомы депрессии, включая расстройства сна (например, нарушение сна, усталость и летаргию) и нарушение познавательной способностиDiscovery Today 2005, 10 (23/24), 1613-1627; Hancock, A.A. Biochem. Pharmacol. 2006, 71, 1103-1113. Замещенные диазепанилбензамиды были описаны как антагонисты гистаминового H3-рецептора в публикации международной патентной заявки WO 05/040144 (6 мая 2005 г.). Замещенные пиридины с антиангиогенными свойствами описаны в публикации заявки на патент США 2004/0014744 (22 января 2004 г.). Замещенные пиперазины и диазепаны описаны как модуляторы гистаминового H3-рецептора в публикации международной патентной заявки WO 03/004480 (16 января 2003 г.). Однако необходимость в получении эффективных модуляторов гистаминового H3-рецептора с нужными фармацевтическими свойствами остается актуальной. Сущность изобретения В настоящее время обнаружено, что некоторые пиридиламидные производные обладают активностью, направленной на модуляцию гистидинового H3-рецептора. Поэтому настоящее изобретение относится к общим и предпочтительным вариантам, определенным соответственно в независимых и зависимых пунктах прилагаемой формулы изобретения и вводимым в настоящее описание посредством ссылки. В одном из своих общих аспектов настоящее изобретение относится к соединению следующей формулы (I): где R1 представляет собой -C1-4 алкил или насыщенный моноциклический циклоалкил;Ra представляет собой -H, -Z-Ar, -CH2NRbRc, -CN, -CO2C1-4 алкил, -CO2H или -CONRbRc; где каждый из Rb и Rc независимо представляет собой -H или -C1-4 алкил;R2 представляет собой -Н или -Z-Ar; при условии, что один из X и Y представляет собой N, а один из Ra и R2 представляет собой -Z-Ar; где Z представляет собой O или S;Ar представляет собой фенил или моноциклическую гетероарильную группу, незамещенную или замещенную одним, двумя или тремя заместителями R3; каждый из заместителей R3 независимо выбран из группы, состоящей из галогена, -C1-4 алкила,-OH, -OC1-4 алкила, -SC1-4 алкила, -CN, -CONRdRe и -NO2; где каждый из Rd и Re независимо представляет собой -H или -C1-4 алкил; или к его фармацевтически приемлемой соли, фармацевтически приемлемому пролекарству или фармацевтически активному метаболиту.-1 015555 В некоторых своих вариантах настоящее изобретение относится к соединениям формулы (II) где R1 представляет собой -C1-4 алкил или насыщенный моноциклический циклоалкил; каждый из заместителей R3 независимо выбран из группы, состоящей из галогена, -C1-4 алкила, -OH,-OC1-4 алкила, -SC1-4 алкила, -CN, -CONRdRe и -NO2; где каждый из Rd и Re независимо представляет собой -H или -C1-4 алкил;n равно 0, 1, 2 или 3; или к их фармацевтически приемлемой соли, фармацевтически приемлемому пролекарству или фармацевтически активному метаболиту. В некоторых своих вариантах настоящее изобретение относится к соединениям формулы (III) где R1 представляет собой -C1-4 алкил или насыщенный моноциклический циклоалкил; каждый из заместителей R3 независимо выбран из группы, состоящей из галогена -C1-4 алкила, -OH,-OC1-4 алкила, -SC1-4 алкила, -CN, -CONRdRe и -NO2; где каждый из Rd и Re независимо представляет собой -H или -C1-4 алкил;n равно 0, 1, 2 или 3; или к их фармацевтически приемлемой соли, фармацевтически приемлемому пролекарству или фармацевтически активному метаболиту. В другом своем общем аспекте настоящее изобретение относится к фармацевтическим композициям, каждая из которых содержит (a) эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого пролекарства или фармацевтически активного метаболита и (b) фармацевтически приемлемый эксципиент. В другом своем общем аспекте настоящее изобретение относится к способу лечения индивидуума,страдающего заболеванием, расстройством или патологическим состоянием, опосредуемым активностью гистаминового H3-рецептора, или индивидуума, у которого были диагностированы такие заболевания,расстройства или патологические состояния, где указанный способ включает введение индивидууму,нуждающемуся в таком лечении, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого пролекарства или фармацевтически активного метаболита. В некоторых предпочтительных вариантах способа согласно изобретению указанное заболевание,расстройство или патологическое состояние выбрано из нарушений познавательной способности, расстройств сна, психиатрических расстройств и других расстройств. В другом своем общем аспекте настоящее изобретение относится к способам получения соединений формулы (I) или формулы (II) или их фармацевтически приемлемых солей. Другие варианты, признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания изобретения и его осуществления. Подробное описание изобретения Настоящее изобретение будет более понятным из нижеследующего описания, включая определения терминов и нижеследующие примеры. Для краткости, содержание публикаций, включая патенты, цитируемые в настоящем изобретении, вводится в настоящее описание посредством ссылки. Используемые здесь термины "включающий", "содержащий" и "составляющий" употребляются в настоящем описании в их прямом неограничивающем смысле. Термин "алкил" означает алкильную группу с прямой или разветвленной цепью, имеющей от 1 до 12 атомов углерода в цепи. Примерами алкильных групп являются метил (Me, который может также иметь структурное обозначение /), этил (Et), н-пропил, изопропил, бутил, изобутил, втор-бутил, третбутил (tBu), пентил, изопентил, трет-пентил, гексил, изогексил и группы, которые, как понятно специалисту в данной области и как указано в настоящем патенте, рассматриваются как эквивалентные любой одной из вышеперечисленных групп. Термин "циклоалкил" означает насыщенный или частично насыщенный моноциклический, конденсированный полициклический или спирополициклический карбоцикл, имеющий от 3 до 12 атомов в кольце карбоцикла. Репрезентативными примерами циклоалкильных групп являются нижеследующие группы в виде соответствующим образом связанных фрагментов: Термин "гетероциклоалкил" означает моноциклическую или конденсированную, мостиковую или спирополициклическую структуру, которая является насыщенной или частично насыщенной и имеет от 3 до 12 атомов в кольце на циклическую структуру, выбранных из атомов углерода и 1-3 гетероатомов,выбранных из азота, кислорода и серы. Циклическая структура может, но необязательно, содержать до двух оксогрупп у атома углерода или атомов серы кольца. Репрезентативными примерами, имеющими форму соответствующим образом связанных фрагментов, являются Термин "гетероарил" означает моноциклический, конденсированный бициклический или конденсированный полициклический ароматический гетероцикл (циклическую структуру, имеющую атомы в кольце, выбранные из атомов углерода и 1-4 гетероатомов, выбранных из азота, кислорода и серы),имеющий от 3 до 12 атомов на гетероцикл. Репрезентативными примерами гетероарильных групп являются нижеследующие примеры в форме соответствующим образом связанных фрагментов: Для специалиста в данной области очевидно, что циклоалкильные, гетероциклоалкильные и гетероарильные группы не ограничиваются группами, перечисленными или проиллюстрированными выше, и что в объем этих определенных терминов могут также входить и другие выбранные группы. Термин "галоген" означает хлор, фтор, бром или йод. Термин "галогено" означает группузаместитель хлор, фтор, бром или йод. Термин "замещенный" означает, что конкретная группа или фрагмент имеет один или несколько заместителей. Термин "незамещенный" означает, что конкретная группане имеет заместителей. Термин"необязательно замещенный" означает, что конкретная группа является незамещенной или замещена одним или несколькими заместителями. Если термин "замещенный" используется для описания структурной системы, то это означает, что замещение присутствует в любом положении системы, если допускает валентность. В тех случаях когда точно не указано, что конкретный фрагмент или группа является необязательно замещенной или замещена любым конкретным заместителем, то подразумевается, что такой фрагмент или группа является незамещенной. Любая приведенная здесь формула представляет соединения, имеющие структуры, описанные структурной формулой, а также некоторые их варианты или формы. В частности, соединения любой из представленных здесь формул могут иметь асимметрические центры, а поэтому они существуют в различных энантиомерных формах. Все оптические изомеры и стереоизомеры соединений общей формулы и их смеси входят в объем данной формулы. Таким образом, любая приведенная здесь формула представляет рацемат, одну или несколько энантиомерных форм, одну или несколько диастереомерных форм,-3 015555 одну или несколько атропизомерных форм и их смеси. Кроме того, некоторые структуры могут присутствовать в виде геометрических изомеров (т.е. цис- и транс-изомеров), таутомеров или атропизомеров. Кроме того, любая приведенная здесь формула включает гидраты, сольваты и полиморфы таких соединений и их смеси. Любая приведенная здесь формула также представляет немеченые формы, а также меченные изотопами формы соединений. Меченные изотопами соединения имеют структуры, представленные приведенными здесь формулами, за исключением того, что один или несколько атомов заменены выбранным атомом, имеющим конкретную атомную массу или конкретное массовое число. Примерами изотопов,которые могут быть включены в соединения согласно изобретению, являются изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 11C, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F,36Cl, 125I соответственно. Такие меченные изотопами соединения могут быть использованы в исследованиях метаболизма (предпочтительно 14C), в исследованиях кинетики реакций (например, 2H или 3H), в способах детектирования или визуализации [таких как позитронно-эмиссионная томография (PET) или однофотонная эмиссионная компьютерная томография (SPECT)], включая анализы на распределение лекарственных средств или субстратов в тканях, или для лечения пациентов с использованием радиоактивных веществ. В частности, для PET- или SPECT-исследований особенно предпочтительными могут оказаться F- или C-меченые соединения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т.е. 2H), может давать определенные терапевтические эффекты, обусловленные повышением метаболической стабильности, например увеличением времени полужизни in vivo или уменьшением требуемой дозы. Меченные изотопами соединения согласно изобретению и их пролекарства в основном могут быть получены путем проведения процедур, описанных в схемах или в приведенных ниже примерах и в препаративных примерах, путем замены не меченного изотопом реагента легко доступным реагентом, меченным изотопом. В описании любой представленной здесь формулы выбор определенного фрагмента из списка возможных представителей для данной конкретной переменной группы не означает, что такой фрагмент должен определять переменную, присутствующую в другом положении. Другими словами, если такая переменная встречается в формуле более чем один раз, то выбор представителя из данного конкретного списка не зависит от выбора представителя для той же самой переменной, присутствующей в другом положении данной формулы. В предпочтительных вариантах формулы (I) R1 представляет собой метил, этил, пропил, изопропил,бутил, втор-бутил или трет-бутил. В других предпочтительных вариантах изобретения R1 представляет собой метил или изопропил. В других предпочтительных вариантах изобретения R1 представляет собой циклопропил, циклобутил, циклопентил или циклогексил. В предпочтительных вариантах изобретения m равно 1, в других предпочтительных вариантах изобретения m равно 2. В предпочтительных вариантах изобретения X представляет собой N, Y представляет собой CRa, a 2R представляет собой -Z-Ar. В других предпочтительных вариантах изобретения X представляет собойCH, Y представляет собой N, a R2 представляет собой -Z-Ar. В других предпочтительных вариантах изобретения X представляет собой N, Y представляет собой CRa, a R2 представляет собой -H, где Ra представляет собой -Z-Ar. В предпочтительных вариантах изобретения Ra представляет собой -CN, -CONH2 или -CH2NH2. В других предпочтительных вариантах изобретения Ra представляет собой -H. В предпочтительных вариантах изобретения Z представляет собой O. В других предпочтительных вариантах изобретения Z представляет собой S. В предпочтительных вариантах изобретения Ar представляет собой фенильную, пирролильную,фуранильную, тиофенильную, имидазолильную, пиразолильную, оксазолильную, изоксазолильную, тиазолильную, пиридильную, пиримидинильную или пиразинильную группу, каждая из которых является незамещенной или замещена одним, двумя или тремя заместителями R3. В других предпочтительных вариантах изобретения Ar представляет собой фенильную группу, которая является незамещенной или замещена одним, двумя или тремя заместителями R3. В других предпочтительных вариантах изобретенияAr представляет собой 4-галогенфенильную группу. В других предпочтительных вариантах изобретенияAr представляет собой фенил, 3,4-дихлорфенил, 4-метилсульфанилфенил, 3-хлорфенил, 3-фторфенил,4-хлор-3-метилфенил, 3-цианофенил, 4-хлорфенил, 4-фторфенил, 3,4-дифторфенил, 2-фторфенил,3-хлорфенил, 2,4-дифторфенил, 3,5-дихлорфенил, 2,5-дифторфенил, 3,5-дифторфенил, 3-метил-4 метилсульфанилфенил или 3-пиридил. В предпочтительных вариантах соединений формул (II) и (III) R1 представляет собой циклопропил,циклобутил, циклопентил или циклогексил.-4 015555 В некоторых предпочтительных вариантах изобретения соединение формулы (I) выбрано из группы, состоящей из таких соединений, как и их фармацевтически приемлемые соли. Настоящее изобретение также включает фармацевтически приемлемые соли соединений формулы(I), предпочтительно соединений, описанных выше и конкретно проиллюстрированных в примерах, а также способы лечения с применением таких солей. В своем предпочтительном варианте настоящее изобретение относится к моногидратам гидрохлорида соединений формулы (I)."Фармацевтически приемлемая соль" означает соль свободной кислоты или основания соединения,имеющего формулу (I), и представляет собой нетоксическое, биологически толерантное соединение или соединение, обладающее какими-либо другими биологическими свойствами, подходящими для их введения индивидууму. См. например, S.M. Berge, et al., "Pharmaceutical Salts", J. Pharm. Sci., 1977, 66:1-19 иVHCA, Zurich, 2002. Примерами фармацевтически приемлемых солей являются фармакологически эффективные соли, которые могут контактировать с тканями пациентов и не оказывают излишнего токсического и раздражающего действия или не вызывают аллергического ответа. Соединение формулы (I) может иметь в достаточной степени кислотную группу, в достаточной степени основную группу или функциональные группы обоих типов и соответственно может реагировать с различными неорганическими или органическими основаниями и неорганическими и органическими кислотами с образованием фармацевтически приемлемой соли. Примерами фармацевтически приемлемых солей являются сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, монобифосфаты, дигидрофосфаты,метафосфаты, пирофосфаты, хлориды, бромиды, иодиды, ацетаты, пропионаты, деканоаты, каприлаты,акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты,субераты, себакаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты,метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, -гидроксибутираты,гликоляты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты, нафталин-2 сульфонаты и манделаты. Если соединение формулы (I) содержит основную азотсодержащую группу, то нужная фармацевтически приемлемая соль может быть получена любым подходящим методом, известным специалистам,например путем обработки свободного основания неорганической кислотой, такой как хлористоводородная кислота, бромисто-водородная кислота, серная кислота, сульфаминовая кислота, азотная кислота, борная кислота, фосфорная кислота и т.п., или органической кислотой, такой как уксусная кислота, фенилуксусная кислота, пропионовая кислота, стеариновая кислота, молочная кислота, аскорбиновая кислота, малеиновая кислота, гидроксималеиновая кислота, изетионовая кислота, янтарная кислота, ва-8 015555 лериановая кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, олеиновая кислота, пальмитиновая кислота, лауриновая кислота, пиранозидиловая кислота, такая как глюкуроновая кислота или галактуроновая кислота; альфаоксикислота, такая как миндальная кислота, лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота, 2-ацетоксибензойная кислота, нафтойная кислота или коричная кислота, сульфоновая кислота,такая как лаурилсульфоновая кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, этансульфоновая кислота, любая совместимая смесь кислот, например кислот, примеры которых приведены выше, и любая другая кислота и их смесь, которые рассматриваются как эквиваленты или приемлемые замены, очевидные специалисту в данной области. Если соединение формулы (I) представляет собой кислоту, такую как карбоновая кислота или сульфоновая кислота, то нужная фармацевтически приемлемая соль может быть получена любым подходящим методом, например путем обработки свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла, гидроксид щелочно-земельного металла, любая подходящая смесь оснований, таких как основания, перечисленные выше, и любое другое основание и их смесь, которые рассматриваются как эквиваленты или приемлемые замены, очевидные специалисту в данной области. Репрезентативными примерами подходящих солей являются соли органических соединений, например соли аминокислот, таких как глицин и аргинин; соли аммиака; карбонаты; бикарбонаты; соли первичных, вторичных и третичных аминов и циклических аминов, таких как бензиламины, пирролидины, пиперидин, морфолин и пиперазин; и соли неорганических соединений, такие как соли натрия, кальция, калия, магния, марганца, железа, меди, цинка,алюминия и лития. Настоящее изобретение также относится к фармацевтически приемлемым пролекарствам соединений формулы (I) и к способам лечения с применением таких фармацевтически приемлемых пролекарств. Термин "пролекарство" означает предшественник назначаемого соединения, которое после его введения индивидууму образует соединение in vivo посредством химического или физиологического процесса,такого как сольволиз или ферментативное расщепление, или под действиемфизиологических условий(например, пролекарство, доведенное до физиологического pH, превращается в соединение формулы (I."Фармацевтически приемлемое пролекарство" представляет собой пролекарство, которое является нетоксичным, биологически толерантным и в других отношениях биологически приемлемым для введения индивидууму. Иллюстративные процедуры отбора и получения подходящих производных пролекарств описаны, например, в публикации "Design of Prodrugs", ed. H. Bundgaard, Elsevier, 1985. Примерами пролекарств являются соединения, имеющие аминокислотный остаток или полипептидную цепь из двух или более (например, из двух, трех или четырех) аминокислотных остатков, ковалентно связанных посредством амидной или сложноэфирной связи со свободной аминогруппой, гидроксигруппой или группой карбоновой кислоты соединения формулы (I). Примерами аминокислотных остатков являются двадцать природных аминокислот, обычно обозначаемых трехбуквенными символами, а также 4-гидроксипролин, гидроксилизин, демозин, изодемозин, 3-метилгистидин, норвалин, бета-аланин,гамма-аминомасляная кислота, цитруллин, гомоцистеин, гомосерин, орнитин и метионинсульфон. Пролекарства других типов могут быть получены, например, путем получения производных свободных карбоксильных групп структур формулы (I) в виде амидов или алкиловых сложных эфиров. Примерами амидов являются амиды, полученные из аммиака, первичных C1-6 алкиламинов и вторичных ди(C1-6 алкил)аминов. Вторичными аминами являются 5- или 6-членные гетероциклоалкильные или гетероарильные циклические группы. Примерами амидов являются амиды, полученные из аммиака, первичныхC1-3 алкиламинов и ди(C1-2 алкил)аминов. Примерами сложных эфиров согласно изобретению являютсяC1-7 алкиловый, C5-7 циклоалкиловый, фениловый и фенил(C1-6 алкиловый) эфиры. Предпочтительными сложными эфирами являются метиловые эфиры. Пролекарства могут быть также получены путем модификации свободных гидроксигрупп с использованием таких групп, как гемисукцинаты, сложные эфиры фосфорной кислоты, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, в соответствии с процедурами, описанными в публикации Adv. Drug Delivery Rev. 1996, 19, 115. Пролекарства могут быть также получены из карбаматных производных гидроксигрупп и аминогрупп. Пролекарства могут быть также получены из производных карбонатов, сложных эфиров сульфоновой кислоты и гидрксилсодержащих эфиров серной кислоты. Пролекарства могут быть также получены путем модификации гидроксигрупп с получением (ацилокси)метиловых и (ацилокси)этиловых эфиров, где ацильной группой может быть алкиловый эфир, необязательно замещенный одним или несколькими эфирными, аминовыми или карбоновокислотными функциональными группами, или где указанной ацильной группой является сложный эфир аминокислоты, описанный выше. Пролекарства такого типа могут быть получены, как описано в публикации J. Med. Chem. 1996, 39, 10. Свободные амины могут быть также модифицированы с получением амидов, сульфонамидов или фосфонамидов. Все эти молекулы пролекарств могут включать такие функциональные группы, как эфир, амин и карбоновая кислота.-9 015555 Настоящее изобретение также относится к фармацевтически активным метаболитам соединений (I),которые могут быть также использованы в способах согласно изобретению. Термин "фармацевтически активный метаболит" означает фармакологически активный продукт метаболизма соединения (I) или его соли в организме. Пролекарства и активные метаболиты соединения могут быть определены рутинными методами, которые известны специалистам или являются доступными в уровне техники. См., например,Bertolini, et al., J. Med. Chem. 1997, 40, 2011-2016; Shan, et al., J. Pharm. Sci. 1997, 86 (7), 765-767;(Krogsgaard-Larsen, et al., eds., Harwood Academic Publishers, 1991). Соединения формулы (I) и их фармацевтически приемлемые соли, фармацевтически приемлемые пролекарства и фармацевтически активные метаболиты согласно изобретению могут быть использованы в качестве модуляторов гистаминового H3-рецептора в способах согласно изобретению. Указанные соединения, используемые в качестве таких модуляторов, могут действовать как антагонисты, агонисты или обратные агонисты. Соединения согласно изобретению могут быть использованы в способах лечения или предупреждения патологических состояний, заболеваний или расстройств посредством модуляции гистаминового H3-рецептора, такого как рецептор, описанный в настоящем изобретении. Используемые здесь термины "лечить" или "лечение" означают введение соединения или композиции согласно изобретению индивидууму в целях достижения терапевтического или профилактического эффекта посредством модуляции активности гистаминового H3-рецептора. Термин "лечение" включает реверсию, предотвращение, ослабление и ингибирование прогрессирования заболевания, расстройства или состояния, либо одного или нескольких симптомов такого заболевания, расстройства или состояния,либо снижение тяжести или предупреждение такого заболевания, расстройства или состояния или их симптомов посредством модуляции активности гистаминового H3-рецептора. Термин "индивидуум" означает млекопитающее, нуждающееся в таком лечении, например человека. "Модуляторами" являются ингибиторы и активаторы, где термин "ингибиторы" означает соединения, уменьшающие, предупреждающие, инактивирующие, десенсибилизирующие или ингибирующие экспрессию или активность гистаминового H3-рецептора, а термин "активаторы" означает соединения, повышающие, активирующие,облегчающие, сенсибилизирующие или стимулирующие экспрессию или активность гистаминового H3 рецептора. В соответствии с этим настоящее изобретение относится к способам применения описанных здесь соединений для лечения индивидуумов, у которых было диагностировано заболевание, расстройство или состояние, опосредуемое активностью гистаминового H3-рецептора, такие как нарушение познавательной способности, расстройство сна, психиатрические расстройства и другие расстройства, или у индивидуумов, страдающих указанными заболеваниями, расстройствами или состояниями. Симптомы или болезни входят в объем определения "патологические состояния, расстройства или заболевания". Нарушения познавательной способности включают, например, деменцию, болезнь Альцгеймера(Panula, P. et al., Soc. Neurosci. Abstr. 1995, 21, 1977), нарушение познавательной функции, легкое нарушение познавательной способности (предеменция), гиперактивность с дефицитом внимания (ADHD),расстройства, ассоциированные с дефицитом внимания, и нарушение способности к обучению и расстройства памяти (Barnes, J.C. et al., Soc. Neurosci. Abstr. 1993, 19, 1813). Нарушение способности к обучению и расстройства памяти включают, например, ухудшение способности к обучению, ухудшение памяти, возрастное снижение познавательной способности и потерю памяти. Было показано, что антагонисты H3 способствуют улучшению памяти в различных испытаниях на потерю памяти, включая тест "возвышение плюс лабиринт", проводимый на мышах (Miyazaki, S. et al. Life Sci. 1995, 57 (23), 2137-2144),двухстадийное испытание на узнавание места (Orsetti, M. et al. Behav. Brain Res. 2001, 124 (2), 235-242),тест на пассивное избегание, проводимый на мышах (Miyazaki, S. et al. Meth. Find. Exp. Clin. Pharmacol. 1995, 17 (10), 653-658) и тест "радиальный лабиринт", проводимый на крысах (Chen, Z. Acta Pharmacol.Sin. 2000, 21 (10), 905-910). Кроме того, на моделях животных, используемых для изучения нарушения способности к обучению при расстройствах с дефицитом внимания, было обнаружено, что действие антагонистов H3-рецептора приводит к улучшению памяти у крыс со спонтанной гипертензией (Fox, G.B. etal. Behav. Brain Res. 2002, 131 (1-2), 151-161). Расстройства сна включают, например, бессонницу, нарушение сна, нарколепсию (ассоциированную или не ассоциированную с катаплексией), катаплексию, расстройство физиологического цикла засыпания/пробуждения, идиопатическую сонливость, чрезмерную сонливость в дневное время (EDS),нарушение циркадного ритма, усталость, летаргию, расстройство нормального циркадного ритма в результате быстрого перемещения между часовыми поясами (jet lag) и расстройство сна на фазе быстрого движения глаз. Усталость и/или нарушение сна может быть вызвано различными причинами, такими как,например, апноэ во сне, гормональные сдвиги, ассоциированные с перименопаузой, болезнь Паркинсона,рассеянный склероз (PC), депрессия, химиотерапия или изменения в графике работы. Психиатрическими расстройствами являются, например, шизофрения (Schlicker, E. and Marr, I.,Naunyn-Schmiedeberg's Arch. Pharmacol. 1996, 353, 290-294), биполярные расстройства, мании, депрессияet al., Prog. Drug Res. 1995, 45, 107-165 и цитируемые там работы), обсессивно-компульсивное расстройство и посттравматический стресс. Другими расстройствами являются, например, морская болезнь, вертиго (например, вертиго или слабое постуральное вертиго), ощущение шума, эпилепсия (Yokoyama, H. et al., Eur. J. Pharmacol. 1993,234, 129-133), мигрень, нейрогенное воспаление, нарушение питания (Machidori, H. et al., Brain Res. 1992,590, 180-186), ожирение, расстройства, вызываемые злоупотреблением различными веществами, нарушение двигательной системы (например, синдром усталых ног) и глазные болезни (например, дегенерация желтого пятна и пигментоз сетчатки). В частности, соединения согласно изобретению, используемые в качестве модуляторов гистаминового H3-рецептора, могут быть применены для лечения или предупреждения депрессии, нарушения сна,нарколепсии, усталости, летаргии, нарушения познавательной способности, нарушения памяти, потери памяти, нарушения способности к обучению, расстройств, ассоциированных с дефицитом внимания, и нарушения питания. В способах лечения согласно изобретению эффективное количество по меньшей мере одного соединения согласно изобретению вводят индивидууму, страдающему указанным заболеванием, расстройством или состоянием, или индивидууму, у которого были диагностированы такие заболевания, расстройства или состояния. Термин "эффективное количество" означает количество или дозу, по существу,достаточные для достижения нужного терапевтического или профилактического эффекта у пациентов,нуждающихся в лечении указанного заболевания, расстройства или состояния. Эффективные количества или дозы соединений согласно изобретению могут быть вычислены рутинными методами, такими как моделирование, исследования или клинические испытания с использованием возрастающих доз, и зависят от известных факторов, например от схемы или способа введения или доставки лекарственного средства, фармакокинетики данного соединения, тяжести и течения заболевания, расстройства или состояния, от терапии, проводимой ранее или одновременно, от состояния здоровья индивидуума и от его восприимчивости к лекарственным средствам, а также от назначения лечащего врача. Репрезентативной дозой является доза, составляющая примерно от 0,001 до 200 мг соединения на 1 кг массы тела индивидуума в день, предпочтительно примерно от 0,05 до 100 мг/кг/день или примерно от 1 до 35 мг/кг/день, вводимая один раз или несколько раз в день (например, два раза в день (BID), три раза в день (TID), четыре раза в день (QID. Для человека весом 70 кг репрезентативной дозой является доза, составляющая примерно от 0,05 до 7 г/день или примерно от 0,2 до 2,5 г/день. После наступления положительной динамики в течение данного заболевания, расстройства или состояния у пациента доза может быть скорректирована для проведения профилактической или поддерживающей терапии. Так, например, доза или частота введения или то и другое, могут быть снижены в зависимости от симптомов до уровня, при котором поддерживается нужный терапевтический или профилактический эффект. Совершенно очевидно, что если наблюдается ослабление симптомов до соответствующего уровня, то такое лечение может быть прекращено. Однако после рецидива симптомов пациентам может потребоваться длительное периодическое лечение. Кроме того, для лечения вышеуказанных состояний соединения согласно изобретению могут быть использованы в комбинации с другими активными ингредиентами. В репрезентативном варианте изобретения дополнительными активными ингредиентами являются ингредиенты, которые, как известно или как было обнаружено, являются эффективными для лечения состояний, расстройств или заболеваний, опосредуемых активностью гистаминового H3-рецептора, или которые обладают активностью, направленной против другой мишени, ассоциированной с конкретным состоянием, расстройством или заболеванием, например, такие как антагонисты H1-рецептора, антагонисты H2-рецептора, антагонисты H3 рецептора, топирамат (Topamax) и модуляторы нейромедиаторов, такие как ингибиторы поглощения серотонина-норэпинефрина, селективные ингибиторы поглощения серотонина (SSRI), ингибиторы поглощения норадренергических соединений, неселективные ингибиторы поглощения серотонина (NSSRI),ингибиторы ацетилхолинэстеразы (такие как тетрагидроаминоакридин, донепезил (Aricept), ривастигмин или галантамин (Reminyl, или модафинил. Такая комбинация может служить для повышения эффективности лечения (например, благодаря включению в данную комбинацию соединения, усиливающего активность или эффективность соединения согласно изобретению), ослабления одного или нескольких побочных эффектов или снижения требуемой дозы соединения согласно изобретению. Более конкретно, соединения согласно изобретению в комбинации с модафинилом могут быть использованы для лечения нарколепсии; чрезмерной сонливости в дневное время (EDS); болезни Альцгеймера; депрессии; расстройств, ассоциированных с дефицитом внимания; усталости, ассоциированной с рассеянным склерозом; состояния опьянения после анестезии, нарушения познавательной способности; шизофрении; спазма, ассоциированного с церебральным параличом; возрастного ослабления памяти; идиопатической сонливости или расстройства нормального циркадного ритма в результате быстрого перемещения между часовыми поясами. В комбинированной терапии модафинил предпочтительно исполь- 11015555 зуется в дозах, составляющих примерно от 20 до 300 мг на дозу. В другом варианте изобретения соединения согласно изобретению в комбинации с топираматом могут быть использованы для лечения ожирения. В комбинированной терапии топирамат предпочтительно используется в дозах, составляющих примерно от 20 до 400 мг на дозу. Для составления фармацевтических композиций согласно изобретению соединения согласно изобретению могут быть использованы отдельно или в комбинации с одним или несколькими другими активными ингредиентами. Фармацевтическая композиция согласно изобретению содержит (a) эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемого пролекарства или фармацевтически активного метаболита; (b) фармацевтически приемлемый эксципиент. Термин "фармацевтически приемлемый эксципиент" означает вещество, которое является нетоксичным, биологически толерантным и в других отношениях биологически приемлемым для введения индивидууму, например инертное вещество, которое добавляется в фармакологическую композицию или как-либо иначе используется в качестве среды, носителя или разбавителя для облегчения введения соединения согласно изобретению и которое является совместимым с этим соединением. Примерами эксципиентов являются карбонат кальция, фосфат кальция, различные сахара и крахмалы, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли. Формы для доставки фармацевтических композиций, содержащих одну или несколько дозированных единиц соединений согласно изобретению, могут быть получены с использованием подходящих фармацевтических эксципиентов и с применением методов смешивания соединений, которые известны в настоящее время или будут разработаны в будущем. Эти композиции могут быть введены способами согласно изобретению перорально, парентерально, ректально, местно, офтальмически или путем ингаляции. Препарат может быть получен в форме таблеток, капсул, саше, драже, порошков, гранул, пастилок,порошков для разведения, жидких препаратов или суппозиториев. Указанные композиции предпочтительно составляют для внутривенного вливания, местного введения или перорального введения. Для перорального введения соединения согласно изобретению могут быть приготовлены в виде таблеток или капсул или в виде раствора, эмульсии или суспензии. Для получения пероральных композиций эти соединения могут быть приготовлены в дозе, составляющей, например, приблизительно от 0,05 до 100 мг/кг в день, или приблизительно от 0,05 до 35 мг/кг в день, или приблизительно от 0,1 до 10 мг/кг в день. Таблетки для перорального введения могут включать соединение согласно изобретению, смешанное с фармацевтически приемлемыми эксципиентами, такими как инертные разбавители, дезинтегрирующие агенты, связывающие агенты, лубриканты, подсластители, отдушки, красители и консерванты. Подходящими инертными наполнителями являются карбонат натрия и кальция, фосфат натрия и кальция, лактоза, крахмал, сахар, глюкоза, метилцеллюлоза, стеарат магния, маннит, сорбит и т.п. Репрезентативными жидкими эксципиентами для перорального введения являются этанол, глицерин, вода и т.п. Подходящими дезинтегрирующими агентами являются крахмал, поливинилпирролидон (ПВП), натрийсодержащий гликолят крахмала, микрокристаллическая целлюлоза и альгиновая кислота. Связывающими агентами могут быть крахмал и желатин. Лубрикантами, если они присутствуют, могут быть стеарат магния, стеариновая кислота или тальк. Таблетки, если это необходимо для отсрочки абсорбции в желудочно-кишечном тракте, могут быть покрыты таким материалом, как глицерилмоностеарат или глицерилдистеарат,либо они могут быть покрыты энтеросолюбильным покрытием. Капсулами для перорального введения являются жесткие и мягкие желатиновые капсулы. Для получения жестких желатиновых капсул соединения согласно изобретению могут быть смешаны с твердым, полутвердым или жидким разбавителем. Мягкие желатиновые капсулы могут быть получены путем смешивания соединения согласно изобретению с водой, маслом, таким как арахисовое масло, кунжутное масло или оливковое масло, с вазелиновым маслом, со смесью моно- и диглицеридов, содержащей короткоцепочечные жирные кислоты, с полиэтиленгликолем 400 или пропиленгликолем. Жидкости для перорального введения могут быть приготовлены в виде суспензий, растворов,эмульсий или сиропов либо они могут быть приготовлены в виде сухого продукта для восстановления водой или другим подходящим носителем перед их использованием. Такие жидкие композиции могут,но необязательно, содержать фармацевтически приемлемые эксципиенты, такие как суспендирующие агенты (например, сорбит, метилцеллюлоза, альгинат натрия, желатин, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, гель на основе стеарата алюминия и т.п.); неводные среды, например масло (например, миндальное масло или фракционированное кокосовое масло), пропиленгликоль, этиловый спирт или вода; консерванты (например, метил- или пропил-п-гидроксибензоат или сорбиновая кислота); смачивающие агенты, такие как лецитин; и, если это необходимо, ароматизаторы или красители. Соединения согласно изобретению могут быть также введены непероральным способом. Так, например, композиции могут быть приготовлены для ректального введения в виде суппозиториев. Для парентерального введения, включая внутривенное, внутримышечное, внутрибрюшинное или подкожное введение, соединения согласно изобретению могут быть приготовлены в виде стерильных водных рас- 12015555 творов или суспензий, забуференных до достижения соответствующего pH и изотоничности, или в виде парентерально приемлемого масла. Подходящими водными средами являются раствор Рингера и изотонический раствор хлорида натрия. Такие композиции могут быть получены в виде единичной дозированной формы, такой как ампулы или одноразовые шприцы для инъекций, в виде форм для многократного введения, таких как сосуды, из которых может быть взята соответствующая доза, или в виде твердой формы или предварительно полученного концентрата, который может быть использован в целях получения препарата для инъекций. Репрезентативные дозы для вливания соединений, смешанных с фармацевтическим носителем, могут составлять примерно от 1 до 1000 мкг/кг/мин, где такое вливание может быть проведено в течение периода времени от нескольких минут до нескольких дней. Для местного введения соединения согласно изобретению могут быть смешаны с фармацевтическим носителем при концентрации лекарственного средства, составляющей примерно от 0,1 до 10% по отношению к носителю. Другим способом введения соединений согласно изобретению может быть пластырь для чрескожной доставки. Альтернативно, соединения согласно изобретению могут быть введены способами согласно изобретению путем ингаляции, например интраназально или перорально, например, в виде спрея, также содержащего подходящий носитель. Получение репрезентативных соединений, которые могут быть использованы в способах согласно изобретению, описано ниже на иллюстративных общих схемах синтеза и в конкретных примерах. Специалисту в данной области очевидно, что подходящие исходные вещества, используемые для получения различных описанных здесь соединений, могут быть выбраны так, чтобы в конечном счете нужные заместители, если это желательно, были введены во время проведения данной схемы реакций с соответствующей защитой или без нее, с получением нужного продукта. Альтернативно, может оказаться необходимым или желательным использовать вместо нужного заместителя подходящую группу, которая может быть введена при проведении данной схемы реакций и которая затем может быть заменена, если это необходимо, нужным заместителем. Если это не оговорено особо, то указанные группы-заместители являются такими, как они были определены выше в формуле (I). Реакции могут быть проведены при температуре в пределах от температуры плавления до температуры кипения растворителя, а предпочтительно при температуре от 0C до температуры кипения растворителя. Схема A На схеме A 3-бромпиридины (3), где Hal представляет собой бром, хлор или фтор, являются коммерчески доступными либо они могут быть получены методами, известными специалистам. Замещение галогена (Hal) осуществляют посредством реакции взаимодействия с реагентами Ar-ZH в присутствии подходящего основания, такого как K2CO3, Na2CO3, Cs2CO3, NaH или их смеси в полярном растворителе,таком как N,N-диметилформамид (ДМФ), диметиловый эфир этиленгликоля (ДМЭ), N,Nдиметилацетамид (ДМА), диметилсульфоксид (ДМСО) или их смесь, при температуре в пределах от комнатной температуры до температуры кипения растворителя или посредством облучения в микроволновой печи с получением эфиров и тиоэфиров (4). После проведения катализируемой переходным металлом реакции взаимодействия бромидов (4) с аминами (5) и CO-эквивалентом, таким как газ CO илиMo(CO)6, в присутствии подходящего палладиевого (II) катализатора и необязательных добавок, таких как t-BuPHBF4+, получают соединения формулы (I), где Y представляет собой N, а R2 представляет собой-Z-Ar. Альтернативно, в результате обмена атома брома соединения (4) по реакции "галоген-металл" путем обработки n-BuLi или t-BuLi и гашения реакции CO2-эквивалентом получают соответствующие карбоновые кислоты. Реакция амидного сочетания таких кислот с аминами (5) в присутствии агентов сочетания, известных специалистам, также дает соединения формулы (I), где Y представляет собой N, a R2 представляет собой -Z-Ar. Схема B Реакция амидного сочетания пиридинкарбоновых кислот (6) (где A представляет собой OH) с аминами (5) дает амиды (7). Альтернативно, хлорангидриды кислот (6) (где A представляет собой Cl) могут быть подвергнуты реакции взаимодействия с аминами (5) в присутствии подходящего основания, такого как Et3N, iPr2NEt, пиридин или их смеси, с образованием амидов (7). Для специалиста в данной области очевидно, что R1 может быть заменен подходящей аминзащитной группой и затем введен в синтез на- 13015555 более поздней стадии. После замещения группы Hal, как показано на схеме A, получают соединение формулы (I), где Y представляет собой N, a R2 представляет собой -Z-Ar. Схема B-1 Способ получения соединения формулы (II) или его фармацевтически приемлемой соли проиллюстрирован на схеме B-1. Способ получения соединения (II) или его фармацевтически приемлемой соли включает реакцию взаимодействия соединения формулы (7-1) с соединением формулы B3 в присутствии по меньшей мере 1 экв. первого основания, такого как NaOH, KOH, K2CO3 или Cs2CO3, в первом органическом растворителе, таком как ДМФ, ДМА, ДМЭ, ДМСО или ацетонитрил или их смесь, с образованием соединения формулы (II). В предпочтительных вариантах изобретения реакционную смесь нагревают до температуры примерно 100C. В другом предпочтительном варианте изобретения соединение формулы (7-1) представляет собой (6-хлорпиридин-3-ил)-(4-циклобутил[1,4]диазепан-1-ил)метанон, соединение формулы B3 представляет собой 4-фторфенол, первое основание представляет собой Cs2CO3 (предпочтительно по меньшей мере 1,5 экв., а более предпочтительно примерно 2 экв.), первый органический растворитель представляет собой ДМА (предпочтительно примерно 0,5-0,75 М раствор), а соединение формулы (II) представляет собой (4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3 ил]метанон. Способ получения соединения формулы (II) также включает реакцию взаимодействия соединения формулы (5-1) с 6-хлорникотинилхлоридом в присутствии второго основания, такого как водный NaOH,водный KOH, Et3N или iPr2NEt, во втором органическом растворителе, таком как ДХМ, дихлорэтан(ДХЭ), толуол или изопропилацетат, с образованием соединения формулы (7-1). В другом предпочтительном варианте изобретения соединение формулы (5-1) представляет собой дигидрохлорид 1 циклобутил[1,4]диазепана, второе основание представляет собой 1 н. водный NaOH, второй органический растворитель представляет собой изопропилацетат, а соединение формулы (7-1) представляет собой (6 хлорпиридин-3-ил)-(4-циклобутил[1,4]диазепан-1-ил)метанон. Способ получения соединения формулы (II) также включает реакцию взаимодействия соединения формулы (B2) с подходящей кислотой, такой как TFA или HCl, в третьем органическом растворителе,таком как ДХМ, диоксан или MeOH или их смесь, с образованием соли амина формулы (5-1). В другом предпочтительном варианте изобретения соединение формулы (B2) представляет собой трет-бутиловый эфир 4-циклобутил[1,4]диазепан-1-карбоновой кислоты, кислота представляет собой HCl, третий органический растворитель представляет собой диоксан, а соединение формулы (5-1) представляет собой дигидрохлорид 1-циклобутил[1,4]диазепана. Способ получения соединения формулы (II) также включает реакцию взаимодействия третбутилгомопиперазин-1-карбоксилата (предпочтительно примерно 0,9-1,1 мол.экв.) посредством восстановительного аминирования с альдегидом или кетоном формулы R1=O (предпочтительно примерно 0,91,1 мол.экв.) в присутствии по меньшей мере 1 мол.экв. восстановителя, такого как NaB(OAc)3H илиNaCNBH3, в четвертом органическом растворителе, таком как ДХЭ, ТГФ, EtOAc, этанол или метанол, с образованием соединения формулы (B2). В другом предпочтительном варианте изобретения R1=O представляет собой циклобутанон, восстановитель представляет собой NaB(OAc)3H (предпочтительно по меньшей мере 1,1 мол.экв.), четвертый органический растворитель представляет собой дихлорэтан(предпочтительно примерно 0,2-0,5 М раствор), а соединение формулы (B2) представляет собой третбутиловый эфир 4-циклобутил[1,4]диазепан-1-карбоновой кислоты. В предпочтительном варианте изобретения соединение формулы (II) подвергают реакции взаимодействия с HCl (предпочтительно примерно 0,95 экв.) в пятом органическом растворителе, таком как этанол, метанол, изопропанол, EtOAc или смесь этанола/Et2O, с получением фармацевтически приемлемой соли соединения формулы (II). В другом предпочтительном варианте изобретения соединение формулы (II) представляет собой (4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3 ил]метанон, пятый органический растворитель представляет собой этанол/Et2O (предпочтительно смесь в- 14015555 отношении примерно 1:1), а фармацевтически приемлемая соль формулы (II) представляет собой моногидрат гидрохлорида (4-циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона. Схема C На схеме C пиридины (8), где галогеновый заместитель присутствует в 5- или 6-положении пиридина, подвергают реакции сочетания с аминами (5) общими методами проведения реакций сочетания с образованием амидов (9). Замену галогенового заместителя группой -Z-Ar осуществляют посредством 1) реакции замещения реагентами Ar-ZH в основных условиях, описанных на схеме A; или 2) реакции сочетания Ульмана в присутствии подходящего медного (I) катализатора, такого как CuI, в растворителе,таком как ДМФ, ДМСО, гексаметилфосфорамид (HMPA) или их смесь, с получением соединений формулы (I), где Y представляет собой CRa, Ra представляет собой -Z-Ar, и R2 представляет собой -H, или соединений формулы (I), где Y представляет собой CH, a R2 представляет собой -Z-Ar. Схема D Соединения формулы (I), где X представляет собой N, Y представляет собой CRa, Ra представляет собой -CN, a R2 представляет собой -Z-Ar, могут быть получены из цианоамидов (15), полученных, как показано на схеме D. Пиридин-2-карбоновые кислоты (10) превращают в N-оксидные аналоги (12) посредством взаимодействия с комплексом "мочевина-пероксид водорода" и ангидридом трифторуксусной кислоты. Введение цианозаместителя осуществляют посредством реакции взаимодействия с триметилсилилцианидом (TMSCN) и диметилкарбамилхлоридом с получением нитриловых кислот (13). Альтернативно, кислоты (10) могут быть этерифицированы известными методами с получением сложных эфиров (11), которые могут быть превращены в сложные эфиры N-оксидов (12). После проведения реакции взаимодействия с TMSCN и диметилкарбамилхлоридом для введения цианогруппы осуществляют гидролиз сложноэфирной группы с получением кислот (13). Кислоты (13) превращают в цианоамиды (15) посредством реакции амидного сочетания с аминами (5), как описано на схеме A. Альтернативно, Nоксиды (12), где R представляет собой H, могут быть подвергнуты прямой реакции сочетания с аминами(5) с применением методов амидного сочетания, описанных на схеме A. Амиды N-оксидов (14) подвергают реакции взаимодействия с TMSCN и диметилкарбамилхлоридом, с получением соответствующих цианоамидов (15). После взаимодействия амидов (15) посредством реакции замещения или в соответствии с протоколом проведения реакции сочетания Ульмана, описанных на схемах A и C, получают соединения формулы (I), где X представляет собой N, Y представляет собой CRa, Ra представляет собой -CN, аR2 представляет собой -Z-Ar. Нитрилы (15) восстанавливают до соответствующих аминометиловых аналогов или гидролизуют с образованием амидов (данные не приводятся). Схема E Способ получения соединения формулы (II) или его фармацевтически приемлемой соли также проиллюстрирован на схеме E. Способ получения соединения формулы (II) или его фармацевтически приемлемой соли включает проведение реакции взаимодействия соединения формулы E3 (предпочтительно- 15015555 примерно 1 экв.) посредством восстановительного аминирования с соединением формулы R1=O (предпочтительно по меньшей мере 1 экв., а более предпочтительно примерно 1,2 экв.) в присутствии подходящего восстановителя, такого как NaB(OAc)3H или NaCNBH3 (предпочтительно по меньшей мере 1 экв., а более предпочтительно примерно 1,5 экв.), в шестом органическом растворителе, таком как ДХЭ, ТГФ, EtOAc, этанол или метанол, при температуре примерно от 0 до 40C с образованием соединения формулы (II). В другом предпочтительном варианте изобретения соединение формулы E3 представляет собой (1,4-диазепан-1-ил)-(6-(4-фторфенокси)пиридин-3-ил)метанон, R1=O представляет собой циклобутанон, восстановитель представляет собой NaB(OAc)3H, шестой органический растворитель представляет собой EtOAc, а соединение формулы (II) представляет собой (4-циклобутил[1,4]диазепан-1 ил)-[6-(4-фторфенокси)пиридин-3-ил]метанон. Способ получения соединения формулы (II) или его фармацевтически приемлемой соли также включает реакцию взаимодействия соединения формулы E2 (предпочтительно по меньшей мере 1 экв.) с гомопиперазином (предпочтительно по меньшей мере 1 экв., а более предпочтительно примерно 2,4 экв.), в присутствии металлорганического реагента, такого как алкиловый реактив Гриньяра или алкиллитиевый реактив (предпочтительно по меньшей мере 1 экв., а более предпочтительно примерно 1,5 экв.), в апротонном органическом растворителе при температуре примерно 0-30C, с образованием соединения формулы E3. Примерами подходящих металлорганических реагентов являются RyMgBr,RyMgCl или RyLi, где Ry представляет собой метил, этил, пропил, изопропил, бутил или гексил. Подходящими апротонными органическими растворителями являются ТГФ, Et2O, MTBE или 2-метил-ТГФ. В предпочтительном варианте изобретения соединение формулы E2 представляет собой этил 6-(4 фторфенокси)никотинат, металлорганический реагент представляет собой гексиллитий, апротонный органический растворитель представляет собой ТГФ, а соединение формулы E3 представляет собой[1,4]диазепан-1-ил-[6-(4-фторфенокси)пиридин-3-ил]метанон. Способ получения соединения формулы (II) или его фармацевтически приемлемой соли также включает реакцию взаимодействия соединения формулы E1, где Rx представляет собой метил или этил(предпочтительно по меньшей мере 1 экв.), с соединением формулы B3 (предпочтительно по меньшей мере 1,1 экв.) в присутствии основания (такого как Cs2CO3, K2CO3, NaOH или KOH или т.п.) (предпочтительно по меньшей мере 1,1 экв.), в полярном апротонном органическом растворителе при температуре примерно от комнатной температуры до 80C с образованием соединения формулы E2. Подходящими полярными апротонными органическими растворителями являются ДМФ, ДМА, ДМСО или ацетонитрил. В другом предпочтительном варианте изобретения соединение формулы E1 представляет собой этил 6-хлорникотинат, соединение формулы B3 представляет собой 4-фторфенол, основание представляет собой Cs2CO3, полярный апротонный органический растворитель представляет собой ДМФ, а соединение формулы E2 представляет собой этил 6-(4-фторфенокси)никотинат. Способ получения соединения формулы (II) или его фармацевтически приемлемой соли также включает а) разбавление раствора соединения формулы (II) в EtOAc этанолом и b) обработку полученного раствора концентрированной водной HCl (0,95 экв.) с получением гидрохлоридной соли соединения формулы (II). При этом предпочтительно образуется моногидрат гидрохлорида соединения формулы (II). Предпочтительно раствор соединения формулы (II) в EtOAc получают посредством реакции взаимодействия соединения формулы E3 с соединением формулы R1=O. В предпочтительном варианте изобретения соединение формулы (II) представляет собой (4-циклобутил[1,4]диазепан-1-ил)-[6-(4 фторфенокси)пиридин-3-ил]метанон. В предпочтительном варианте изобретения фармацевтически приемлемая соль соединения формулы (II) представляет собой моногидрат гидрохлорида (4 циклобутил[1,4]диазепан-1-ил)-[6-(4-фторфенокси)пиридин-3-ил]метанона. Для специалиста в данной области очевидно, что некоторые химические превращения, описанные выше, могут быть осуществлены не в том порядке, который был описан в вышеприведенных схемах. Соединения формулы (I) могут быть превращены в их соответствующие соли методами, известными специалистам. Так, например, амины формулы (I) могут быть обработаны трифторуксусной кислотой(TFA), HCl или лимонной кислотой в растворителе, таком как диэтиловый эфир (Et2O), дихлорметан(ДХМ), тетрагидрофуран (ТГФ) или метанол (MeOH), с получением соответствующих солевых форм. Соединения, образованные в результате реакций, проводимых в соответствии с вышеописанными схемами, могут быть получены в форме отдельных энантиомеров, диастереомеров или региоизомеров посредством энантио-, диастерео- или региоспецифического синтеза или путем разделения. Альтернативно, соединения, полученные, как описано в вышеприведенных схемах, могут существовать в форме рацемических (1:1) или не рацемических (в других, не 1:1, отношениях) смесей или в форме смесей диастереомеров или региоизомеров. При получении рацемических и нерацемических смесей энантиомеров отдельные энантиомеры могут быть выделены стандартными методами разделения, известными специалистам, такими как хиральная хроматография, перекристаллизация, образование диастереомерных солей,модификация с образованием диастереомерных аддуктов, биотрансформация или ферментативное превращение. При получении региоизомерных или диастереомерных смесей отдельные изомеры могут быть разделены стандартными методами, такими как хроматография или кристаллизация.- 16015555 Для более подробного описания изобретения и различных предпочтительных вариантов его осуществления приводятся нижеследующие примеры. Примеры Химический метод. Для получения соединений, описанных в нижеследующих примерах, могут быть применены, если это не оговорено особо, общие экспериментальные методы. Если растворы или смеси являются "концентрированными", то это означает, что они были концентрированы при пониженном давлении на роторном испарителе. Если это не оговорено особо, то реакционные растворы перемешивали при комнатной температуре (к.т.) в атмосфере газа N2. Колоночную флэш-хроматографию с нормальной фазой (КФХ) обычно осуществляют, если это не оговорено особо, на колонках с силикагелем RediSep с использованием 2 М NH3 в MeOH/ДХМ в качестве элюента. Препаративную обращенно-фазовую высокоэффективную жидкостную хроматографию (ВЭЖХ) обычно проводят на устройстве Gilson с YMC-Pack ODS-A, 5 мкм, на колонке 7530 мм, при скорости потока 25 мл/мин с детектированием на 220 и 254 нм в градиенте 15-99% ацетонитрил/(вода/0,05% TFA)Hewlett-Packard HP1100, снабженной Zorbax Eclipse XDB-C18, 1,8 мкМ, на колонке 4,650 мм, при скорости потока 2 мл/мин с детектированием на 220 и 250 нм. Подвижной фазой является растворитель A: 0,1% TFA/вода; растворитель B: 0,1% TFA/ацетонитрил. Градиент: 0 мин (A:B, 75:25); 1,0 мин (A:B,75:25); 2,0 мин (A:B, 5:95). Соли трифторуксусной кислоты были получены путем очистки неочищенного реакционного продукта, проводимой с помощью препаративной обращенно-фазовой ВЭЖХ. Для получения данных характеризации, описанных в нижеследующих примерах, использовали следующие протоколы анализов, если это не оговорено особо. Масс-спектры получали на системе Agilent series 1100 MSD с ионизацией электрораспылением(ESI) в режиме детектирования положительных или отрицательных ионов, как указано в описании спектров. Вычисленные массы соответствуют точной массе. ЯМР-спектры были получены на спектрометре Bruker модели DPX400 (400 МГц), DPX500(500 МГц), DRX600 (600 МГц). Данные 1H-ЯМР представляют собой химический сдвиг в м.д. в сторону более слабого поля по отношению к стандарту тетраметилсилана (мультиплетность, константа взаимодействия J в Гц, интегральная интенсивность). Химические названия были даны с использованием ChemDraw Ultra 6.0.2 (CambridgeSoft Corp.,Cambridge, MA). Пример 1. Стадия A. 5-Бром-2-(3,4-дихлорфенокси)пиридин. К раствору 2,5-дибромпиридина (2,412 г, 10,18 ммоль) в ДМФ (50 мл) добавляли K2CO3 (5,22 г,37,8 ммоль) и 3,4-дихлорфенол (2,66 г, 16,3 ммоль). Смесь нагревали при 90C в течение 18 ч, а затем охлаждали до комнатной температуры (к.т.). После этого добавляли воду и смесь экстрагировали ДХМ. После очистки колоночной флэш-хроматографией (КФХ) получали нужный продукт (3,23 г, 100%). 1H-ЯМР (400 МГц, CDCl3): 8,21 (дд, J=2,5, 0,8 Гц, 1H), 7,81 (дд, J=8,3, 3,0 Гц, 1H), 7,45 (д, J=8,8 Гц,1H), 7,26 (д, J=1,5 Гц, 1H), 7,00 (дд, J=9,0, 2,5 Гц, 1H), 6,88 (дд, J=8,8, 0,8 Гц, 1H). Стадия B. К раствору 5-бром-2-(3,4-дихлорфенокси)пиридина (0,303 г, 0,949 ммоль) в ТГФ (4 мл) добавляли 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU; 0,30 мл, 2,0 ммоль), циклопропилпиперазин (0,30 мл,2,4 ммоль), транс-ди-м-ацетатобис-[2-(ди-о-толилфосфино)бензил]дипалладий(II) (катализатор Эрмана; 36,7 мг, 0,039 ммоль), t-BuPHBF4+ (17,4 мг, 0,060 ммоль) и Mo(CO)6 (301 мг, 1,14 ммоль). Реакционную смесь нагревали в микроволновой печи в течение 6 мин при 125C, охлаждали до комнатной температуры, а затем концентрировали. После очистки колоночной флэш-хроматографией (КФХ) получали нужный продукт (284 мг, 76%). Стадия A. (6-Бромпиридин-2-ил)-(4-изопропилпиперазин-1-ил)метанон. К раствору 6-бромпиридин-2-карбоновой кислоты (100,00 мг, 0,50 ммоль) в ДХМ (5,0 мл) добавляли 1-изопропилпиперазин (95,20 мг, 0,74 ммоль), а затем гидрохлорид 1-(3-диметиламинопропил)-3 этилкарбодиимида (EDC; 189,78 мг, 0,99 ммоль), 1-гидроксибензотриазол (HOBt; 133,78 мг, 0,99 ммоль) и iPr2NEt (0,86 мл, 4,95 ммоль). После выдерживания в течение 18 ч при комнатной температуре смесь разбавляли водой и экстрагировали ДХМ. После очистки колоночной флэш-хроматографией (КФХ) получали нужный продукт (83,0 мг, 54%).H-ЯМР (CDCl3): 7,69-7,59 (м, 2H), 7,56-7,52 (м, 1H), 3,84-3,76 (м, 2H), 2,79-2,68 (м, 1H), 2,62 (т,J=5,1 Гц, 2H), 2,53 (т, J=5,1 Гц, 2H), 1,06 (д, J=6,5 Гц, 6H). Анализ 1 (человеческий H3): Ki=1400 нМ. Стадия B. К раствору (6-бромпиридин-2-ил)-(4-изопропилпиперазин-1-ил)метанона (76,7 мг, 0,25 ммоль) в ДМФ (2,5 мл) добавляли 3,4-дихлорфенол (40,07 мг, 0,25 ммоль) и K2CO3 (101,93 мг, 0,74 ммоль). После выдерживания в течение 18 ч при 120C смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали ДХМ. После очистки колоночной флэш-хроматографией (КФХ), а затем обращеннофазовой ВЭЖХ (в основных условиях) получали нужный продукт (10,0 мг, 3,5%).H-ЯМР (CDCl3): 7,82 (дд, J=8,2, 7,4 Гц, 1H), 7,52-7,44 (м, 2H), 7,26 (д, J=2,7 Гц, 1H), 7,06-6,98 (м,- 24015555 2H), 3,75-3,67 (м, 2H), 3,50-3,44 (м, 2H), 2,70-2,61 (м, 1H), 2,55-2,48 (м, 2H), 2,23-2,15 (м, 2H), 1,01 (д,J=6,6 Гц, 6H). Соединения в примерах 44-52 получали методами, аналогичными методам, описанным в примере 43. При получении солей трифторуксусной кислоты очистку проводили с помощью препаративной ВЭЖХ (в кислотных условиях). Пример 44.(12,5 мл) в MeOH (250 мл) нагревали до 60C и разбавляли дополнительным количеством MeOH(250 мл). После выдерживания в течение 13 ч при 60C смесь охлаждали до комнатной температуры,разбавляли ДХМ и промывали раствором, состоящим из 21 г KOH в 200 мл воды, насыщенным K2CO3 и воды. Органический слой сушили и концентрировали с получением указанного в заголовке соединения(21,4 г, 76%) в виде белого твердого вещества. Полученное вещество использовали на следующей стадии без дополнительной очистки. Стадия B. Метиловый эфир 5-бром-1-оксопиридин-2-карбоновой кислоты. К смеси метилового эфира 5-бромпиридин-2-карбоновой кислоты (10,1 г, 46,8 ммоль) и комплекса"мочевина-пероксид водорода" (9,33 г, 99,2 ммоль) в ацетонитриле (150 мл) при 0C добавляли ангидрид трифторуксусной кислоты (13,0 мл, 93,7 ммоль). Через 2 ч смесь выливали в 0,5 М HCl и экстрагировали ДХМ. Органический слой промывали насыщенным водным NaHCO3, сушили и концентрировали. Остаток очищали колоночной флэш-хроматографией (КФХ) (этилацетат (EtOAc)/гексан) с получением указанного в заголовке соединения (9,70 г, 89%) в виде бесцветного вязкого масла.H-ЯМР (d6-ацетон): 8,49-8,48 (м, 1H), 7,63-7,62 (м, 2H), 3,89 (с, 3H). Стадия C. Метиловый эфир 5-бром-6-цианопиридин-2-карбоновой кислоты. Смесь метилового эфира 5-бром-1-оксопиридин-2-карбоновой кислоты (9,43 г, 40,6 ммоль),TMSCN (54 мл) и диметилкарбамилхлорида (38 мл) нагревали при 50C в течение 16 ч. Смесь охлаждали до комнатной температуры и выливали в ледяную воду, содержащую NaOH (40 г, 1 моль). Смесь экстрагировали ДХМ (2) и объединенные органические слои сушили и концентрировали с получением неочищенного продукта в виде красного твердого вещества. После перекристаллизации из горячего MeOH концентрированный маточный раствор очищали колоночной флэш-хроматографией (КФХ)H-ЯМР (d6-ацетон): 8,83 (д, J=8,4 Гц, 1H), 8,27 (д, J=8,4 Гц, 1H), 3,96 (с, 3H). Стадия D. 5-Бром-6-цианопиридин-2-карбоновая кислота. К раствору триметилсиланоата калия (0,80 г, 6,22 ммоль) в ТГФ (26 мл) добавляли метиловый эфир 5-бром-6-цианопиридин-2-карбоновой кислоты (998 мг, 4,15 ммоль). Смесь нагревали при 50C в течение 3 ч, а затем охлаждали до комнатной температуры и обрабатывали HCl (4 н. в диоксане; 1,60 мл). Через 30 мин смесь концентрировали. Остаток растворяли в горячем EtOAc и фильтровали. Полученный фильтрат концентрировали с получением указанного в заголовке соединения (993 мг, 100%), который использовали на следующей стадии без дополнительной очистки. Стадия E. 3-Бром-6-(4-изопропилпиперазин-1-карбонил)пиридин-2-карбонитрил. Смесь 5-бром-6-цианопиридин-2-карбоновой кислоты (875 мг, 3,85 ммоль), HOBt (882 мг,6,53 ммоль) и EDC (1,11 г, 5,80 ммоль) в ДМФ (32 мл) перемешивали в течение 5 мин, а затем обрабатывали 1-изопропилпиперазином (943 мг, 7,35 ммоль). Через 5 ч смесь разбавляли ДХМ, промывали 1 н.NaOH и водой, а затем сушили и концентрировали. После очистки остатка колоночной флэшхроматографией (КФХ) получали вязкую пену, которая кристаллизовалась при отстаивании. После дополнительной очистки с помощью обращенно-фазовой ВЭЖХ получали указанное в заголовке соединение (476 мг, 37%).- 27015555 Стадия F. Смесь 3-бром-6-(4-изопропилпиперазин-1-карбонил)пиридин-2-карбонитрила (54,4 мг), 3,4 дихлорфенола (76,8 мг) и безводного Cs2CO3 (350 мг) в ДМСО (0,6 мл) нагревали путем облучения в микроволновой печи при 150C в течение 30 мин. Смесь очищали с помощью ВЭЖХ и получали указанное в заголовке соединение (18,5 мг, 31%) в виде TFA-соли.H-ЯМР (MeOD): 8,00 (д, J=9,0 Гц, 1H), 7,67 (д, J=8,4 Гц, 1H), 7,63 (д, J=9,0 Гц, 1H), 7,51 (д, J=3,0 Гц, 1H), 7,23-7,21 (дд, J=8,7, 2,4 Гц, 1H), 4,87-4,80 (ушир.с, 1H), 4,59-4,48 (ушир.с, 1H), 3,70-3,46 (м, 4H),3,35-3,18 (ушир.с, 3H), 1,41 (д, J=7,2 Гц, 6H). Пример 54. Трифторацетатная соль амида 3-(3,4-дихлорфенокси)-6-(4-изопропилпиперазин-1-карбонил)пиридин-2-карбоновой кислоты Указанное в заголовке соединение получали из соединения примера 53 способами, аналогичными способам, описанным в примере 62 (9,8 мг, 16%). Стадия A. 5-Бром-1-оксопиридин-2-карбоновая кислота. К смеси 5-бромпиколиновой кислоты (18,5 г, 91,6 ммоль) и комплекса "мочевина-пероксид водорода" (18,2 г, 0,194 моль) в ацетонитриле (275 мл) при 0C добавляли ангидрид трифторуксусной кислоты(26 мл, 0,187 моль). Через 4,5 ч смесь обрабатывали водным Na2S2O3 при 0C, перемешивали в течение 10 мин, а затем экстрагировали ДХМ (300 мл 5). Объединенные органические слои концентрировали с получением неочищенного продукта, который затем суспендировали в кипящей воде (500 мл) и фильтровали. Отфильтрованное твердое вещество два раза растирали с кипящим MeOH (500 мл), в результате чего образовывалось желтое твердое вещество. Водный и метаноловый экстракты объединяли и концентрировали досуха с получением 100% кислоты в виде коричневато-желтого твердого вещества.H-ЯМР (d6-ДМСО): 17,70 (с, 1H), 9,19 (д, J=1,5 Гц, 1H), 8,18-8,12 (м, 2H). Стадия B. (5-Бром-1-оксопиридин-2-ил)-(4-циклопропил[1,4]диазепан-1-ил)метанон. Смесь 5-бром-1-оксопиридин-2-карбоновой кислоты (1,12 г, 5,15 ммоль), HOBt (1,17 г, 8,69 ммоль) и EDC (1,56 г, 8,14 ммоль) в ДМФ (32 мл) перемешивали в течение 5 мин, а затем обрабатывали дигидрохлоридом 1-циклопропил[1,4]диазепана (1,38 г, 6,48 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-еном(DBU; 2,3 мл, 15,4 ммоль). Через 22 ч смесь разбавляли ДХМ и промывали 1 н. NaOH и водой. Органический слой сушили и концентрировали. Остаток очищали колоночной флэш-хроматографией (КФХ) с получением указанного в заголовке соединения (1,13 г, 65%).- 28015555 Соединения примеров 56-61 получали способами, аналогичными способам, описанным в примере 55, если это не оговорено особо. Пример 56. Гидрохлоридная соль 6-(4-циклопропил[1,4]диазепан-1-карбонил)-3-(пиридин-3-илокси)пиридин-2 карбонитрила(м, 2H), 2,93-2,88 (м, 2H), 2,85-2,81 (м, 2H), 1,96-1,83 (м, 3H), 0,47-0,41 (м, 2H), 0,38-0,35 (м, 1H), 0,330,31 (м, 1H). Свободное основание растворяли в избытке HCl (1,25 М в MeOH) и концентрировали с получением гидрохлоридной соли. Пример 57. 3-(4-Хлор-3-метилфенокси)-6-(4-циклопропил[1,4]диазепан-1-карбонил)пиридин-2-карбонитрил 1
МПК / Метки
МПК: A61K 31/44, C07D 213/81, A61P 25/00
Метки: гистаминового, модуляторов, соединения, качестве, замещенные, н3-рецептора, пиридиламидные
Код ссылки
<a href="https://eas.patents.su/30-15555-zameshhennye-piridilamidnye-soedineniya-v-kachestve-modulyatorov-gistaminovogo-n3-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные пиридиламидные соединения в качестве модуляторов гистаминового н3-рецептора</a>
Предыдущий патент: Устройство, система и способ для очистки скважины
Следующий патент: Способ ароматизации сигарет и система его реализации
Случайный патент: Крышка с сигнализацией