Производные хиназолина в качестве mtki
Номер патента: 14779
Опубликовано: 28.02.2011
Авторы: Папаникос Александра, Сторк Пьер Анри, Мевеллек Лоранс Анн, Тен Холтэ Петер, Эмбрехтс Вернер Констант Йохан, Фрейн Эдди Жан Эдгар, Виллемс Марк
Формула / Реферат
1. Соединение, имеющее формулу (I)
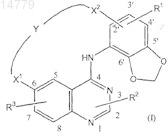
его N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы, где
Y означает -С3-9алкил-, -С1-5алкил-O-С1-5алкил-, -С1-5алкил-NR6-С1-5алкил-, -С1-5алкил-NR7-СО-С1-5алкил-,
-С1-6алкил-NR7-CO-, NR7-СО-С1-6алкил-, -C1-3алкил-NR7-CO-Het1-, -С1-6алкил-NR8-Het2-, -С1-6алкил-СО-С1-6 алкил-, -С1-6алкил-СО-NR7- или -CO-NR7-С1-6алкил-;
X1 означает -O-, -O-С1-2алкил- или -NR4-С1-2алкил-;
X2 означает прямую связь, -С1-2алкил-, -О-, -О-С1-2алкил- или NR5-С1-2алкил-;
R1 означает водород, цианогруппу, галоген, гидроксигруппу, С1-4алкил, Het3, Ar1, Het3-O- или Ar1-O-;
R2 означает водород, цианогруппу, галоген, С2-6алкенил, С2-6алкинил, С3-7циклоалкил или С1-6алкил, причем указанные С2-6алкенил, С2-6алкинил, С3-7циклоалкил или С1-6алкил необязательно замещены одним или, где это возможно, двумя и более заместителями, выбранными из гидроксигруппы или галогена;
R3 означает гидроксигруппу; C1-4алкилоксигруппу или C1-4алкилоксигруппу, замещенную одним или, где возможно, двумя или более заместителями, каждый из которых независимо выбран из Het4, гидроксигруппы, C1-4алкилоксигруппы, галогена, NR9R10, C1-4алкил-O-С(=O)-O-, Ar2, NR11R12-карбонила, Het5-карбонила и оксиранила;
R4 означает водород, Ar3-S(=O)2-, Ar3-S(=O)-, С1-4алкил, С2-4алкенил, С3-7циклоалкил, С2-4алкинил, С1-4 алкилкарбонил или С1-4алкилоксикарбонил, причем указанные С1-4алкил, С2-4алкенил, С3-7циклоалкил, С2-4 алкинил, С1-4алкилкарбонил или C1-4алкилоксикарбонил необязательно замещены С1-4алкилокси-, Het6 или фенилом;
R5 означает водород, Ar3-S(=O)2-, Ar3-S(=O)-, С1-4алкил, С2-4алкенил, С3-7циклоалкил, С2-4алкинил, С1-4 алкилкарбонил или С1-4алкилоксикарбонил, причем указанные С1-4алкил, С2-4алкенил, С3-7циклоалкил, С2-4 алкинил, С1-4алкилкарбонил или C1-4алкилоксикарбонил необязательно замещены С1-4алкилокси-, Het6 или фенилом;
R6 означает водород, Ar4-S(=O)2-, Ar4-S(=O)-, С1-4алкил, С2-4алкенил, С3-7циклоалкил, С2-4алкинил, С1-4 алкилкарбонил или C1-4алкилоксикарбонил, причем указанные С1-4алкил, С2-4алкенил, С3-7циклоалкил, С2-4 алкинил, С1-4алкилкарбонил или C1-4алкилоксикарбонил необязательно замещены С1-4алкилоксигруппой, Het7 или фенилом;
R7 означает водород, Ar4-S(=O)2-, Ar4-S(=O)-, С1-4алкил, С2-4алкенил, С3-7циклоалкил, С2-4алкинил, С1-4 алкилкарбонил или С1-4алкилоксикарбонил, причем указанные С1-4алкил, С2-4алкенил, С3-7циклоалкил, С2-4 алкинил, С1-4алкилкарбонил или С1-4алкилоксикарбонил необязательно замещены С1-4алкилоксигруппой, Het8 или фенилом;
R8 означает водород, Ar5-S(=O)2-, Ar5-S(=O)-, С1-4алкил, С2-4алкенил, С3-7циклоалкил, С2-4алкинил, С1-4 алкилкарбонил или C1-4алкилоксикарбонил, причем указанные С1-4алкил, С2-4алкенил, С3-7циклоалкил, С2-4 алкинил, С1-4алкилкарбонил или C1-4алкилоксикарбонил необязательно замещены С1-4алкилоксигруппой, Het8 или фенилом;
R9 и R10, каждый независимо, означают водород; Het9; Het11-S(=O)2; С1-4алкил или С1-4алкил, замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С1-4 алкилоксигруппы, С1-4алкил-S(=O)2, галогена, Het10, С1-4алкил-С(=O)-NR13-, С1-4алкил-S(=O)2-NR14-, амино-С(=O)-NR15, моно- или ди(С1-4алкил)амино-С(=O)-NR16-, аминокарбонила, аминокарбонилоксигруппы, моно- или ди-(С1-4алкил)аминокарбонила, моно- или ди(С1-4алкил)аминокарбонилоксигруппы, Het12-оксикарбонила, С1-4алкилокси-С1-4алкилоксигруппы, Het3-карбонила или С1-4алкил-S(=O)2-С1-4алкил-NR17-С(=O);
R11 и R12, каждый независимо, означают водород; С1-4алкил или C1-4алкил, замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, C1-4алкилоксигруппы или C1-4 алкил-S(=O)2-;
R13 означает водород или С1-4алкил;
R14 означает водород или С1-4алкил;
R15, R16 и R17, каждый независимо, означают водород или C1-4алкил;
R18 и R19, каждый независимо, означают водород; С1-4алкил или С1-4алкил, замещенный одним или, где возможно, двумя или более заместителями, выбранными из гидроксигруппы, C1-4алкилоксигруппы или С1-4 алкил-S(=O)2-;
Het1 означает пирролидинил, 2-пирролидинонил или пиперидинил, причем указанный Het1необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С1-4алкила, С1-4алкилоксигруппы или C1-4алкилоксикарбонильной группы;
Het2 означает пирролидинил, 2-пирролидинонил или пиперидинил, причем указанный Het2необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С1-4алкила, С1-4алкилоксигруппы или С1-4алкилоксикарбонильной группы;
Het3 означает морфолинил, пиперазинил, пиперидинил, фуранил, пиразолил, диоксоланил, тиазолил, оксазолил, имидазолил, изоксазолил, оксадиазолил, пиридинил или пирролидинил, причем указанный Het3 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С1-4алкила, С1-4алкилоксигруппы или С1-4алкилсульфонильной группы;
Het4 означает морфолинил, пиперидинил, пирролидинил, 1,1-диоксотиоморфолинил, пиперазинил, фуранил, тиоморфолинил, имидазолил или пиразолидинил, причем указанный Het4 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы; С1-4алкила; аминогруппы; моно- или ди(С1-4алкил)аминогруппы; С1-4алкил-S(=O)2-; С1-4алкила, замещенного одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, C1-4алкил-С(=O)-NH-, С1-4алкил-S(=O)2-, аминогруппы, моно- или ди(С1-4алкил)аминокарбонильной группы, NR18R19, аминокарбонила, С1-4алкилокси и моно- или ди(С1-4алкил)аминокарбонила, С1-4алкил-С(=O)-, необязательно замещенного одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, C1-4алкилоксигруппы и С1-4алкилсульфонильной группы; или C1-4алкилоксикарбонилом, необязательно замещенным одним или, где это возможно, двумя или более заместителями, выбранными из гидрокси, С1-4алкилокси и С1-4алкилсульфонила;
Het5 означает морфолинил, пиперидинил, пирролидинил, 1,1-диоксотиоморфолинил, пиперазинил или тиоморфолинил, причем указанный Het5необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из C1-4алкила; гидроксигруппы; аминогруппы; моно- или ди(С1-4алкил) аминогруппы; С1-4алкил-S(=O)2; и С1-4алкила, замещенного одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С1-4алкил-С(=O)-NH- и С1-4алкил-S(=O)2-;
Het6, Het7и Het8, каждый независимо, означают морфолинил, пиперазинил, пиперидинил или пирролидинил, причем указанные Het6, Het7и Het8 необязательно замещены одним или более заместителями, выбранными из гидроксигруппы, аминогруппы, C1-4алкила и С1-4алкила, замещенного одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, галогена и С1-4алкилоксигруппы;
Het9 и Het10, каждый независимо, означают морфолинил, пиперидинил, пирролидинил, 1,1-диоксотиоморфолинил, пиперазинил или тиоморфолинил, причем указанные Het9и Het10 необязательно замещены одним или, где это возможно, двумя или более заместителями, выбранными из С1-4алкила; гидроксигруппы; аминогруппы; моно- или ди(С1-4алкил)аминогруппы; С1-4алкил-S(=O)2 и С1-4алкила, замещенного одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, C1-4алкил-С(=O)-NH- и С1-4алкил-S(=O)2-;
Het11, Het12 и Het13, каждый независимо, означают морфолинил, пиперазинил, пиперидинил или пирролидинил, причем указанные Het11, Het12 и Het13 необязательно замещены одним или более заместителями, выбранными из гидроксигруппы, аминогруппы, С1-4алкила и С1-4алкила, замещенного одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, галогена и С1-4алкилоксигруппы;
Ar1 и Ar2, каждый независимо, означают фенил, необязательно замещенный нитрогруппой, цианогруппой, гидроксигруппой, C1-4алкилом, С1-4алкилоксигруппой или аминогруппой;
Ar3, Ar4и Ar5, каждый независимо, означают фенил, необязательно замещенный нитрогруппой, цианогруппой, гидроксигруппой, С1-4алкилом, С1-4алкилоксигруппой или аминогруппой.
2. Соединение по п.1, в котором
Y означает -С3-9алкил-, -С1-5алкил-NR6-С1-5алкил-, -С1-5алкил-NR7-СО-С1-5алкил-, -С1-6алкил-NH-CO-, -С1-3алкил-NH-СО-Het1-, -C1-6алкил-NR8-Het2-;
X1 означает -О- или -O-С1-2алкил-;
X2 означает прямую связь, -C1-2алкил- или -NR5-С1-2алкил-;
R1 означает водород, цианогруппу, галоген, гидроксигруппу, С1-4алкил, Het3, Het3-O- или Ar1-О-;
R2 означает водород;
R3 означает гидроксигруппу, С1-4-алкилоксигруппу или C1-4алкилоксигруппу, замещенную одним или, где это возможно, двумя или более заместителями, каждый из которых независимо выбран из Het4, гидроксигруппы, С1-4алкилоксигруппы, галогена, NR9R10, C1-4алкил-O-С(=O)-O- и оксиранила;
R5 означает водород, С1-4алкил, С1-4алкилоксикарбонил или Ar3-S(=O)2-, причем указанный С1-4алкилоксикарбонил необязательно замещен фенилом;
R6 означает водород, С1-4алкил или С1-4алкилоксикарбонил, причем указанный С1-4алкилоксикарбонил необязательно замещен фенилом;
R7 означает водород или С1-4алкил;
R8 означает водород, С1-4алкил, Ar5-S(=O)2- или C1-4алкилоксикарбонил;
R9 и R10, каждый независимо, означают водород; С1-4алкил или С1-4алкил, замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, C1-4алкилоксигруппы, С1-4алкил-S(=O)2, галогена или С1-4алкилокси-С1-4алкилоксигруппы;
Het1 означает пирролидинил или пиперидинил, причем указанный Het1необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы или С1-4алкила;
Het2 означает пирролидинил или пиперидинил, причем указанный Het2необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы или С1-4алкила;
Het3 означает морфолинил, пиперидинил, пиперазинил или пирролидинил, причем указанный Het3 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы или С1-4алкила;
Het4 означает морфолинил, пиперидинил, пирролидинил, 1,1-диоксотиоморфолинил или пиперазинил, причем указанный Het4 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы; С1-4алкила; аминогруппы; С1-4алкил-S(=O)2-; С1-4алкила, замещенного одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы и С1-4алкил-С(=O)-NH-; или C1-4алкил-С(=O)-, необязательно замещенного одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С1-4алкилоксигруппы и
С1-4алкилсульфонильной группы;
Ar3 и Ar5, каждый независимо, означают фенил, необязательно замещенный нитрогруппой, цианогруппой, гидроксигруппой или C1-4алкилоксигруппой.
3. Соединение по пп.1, 2, в котором
R3 означает гидроксигруппу; C1-4алкилоксигруппу или C1-4алкилоксигруппу, замещенную одним или, где это возможно, двумя или более заместителями, каждый из которых независимо выбран из Het4, гидроксигруппы, С1-4алкилоксигруппы, галогена, NR9R10 и C1-4алкил-O-С(=O)-О-.
4. Соединение по пп.1, 2 или 3, в котором
Y означает -С3-9алкил-, -С1-5алкил-NR6-С1-5алкил- или -С1-5алкил-NR7-СО-С1-5алкил-;
X1 означает -О-;
X2 означает NR5-С1-2алкил;
R1 означает водород, галоген или Het3-O-;
R2 означает водород;
R3 означает гидроксигруппу, С1-4-алкилоксигруппу или C1-4алкилоксигруппу, замещенную одним или двумя заместителями, каждый из которых независимо выбран из Het4, гидроксигруппы, C1-4алкилоксигруппы, С1-4 алкилокси-С1-4алкилоксигруппы и NR9R10;
R5 означает водород или С1-4алкил;
R6 означает водород или С1-4алкил;
R7 означает водород;
R9 и R10, каждый независимо, означают водород; С1-4алкил-S(=O)2-С1-4алкил-С(=O)-; С1-4алкил или С1-4алкил, замещенный гидроксигруппой;
Het3 означает пиридинил, необязательно замещенный C1-4алкилом;
Het4 означает морфолинил, пиперидинил или пиперазинил, причем указанный Het4необязательно замещен гидрокси-С1-4алкилом или С1-4алкил-S(=O)2-С1-4алкилом.
5. Соединение по любому из пп.1-4, в котором
X1 означает -О-;
X2 означает -NR5-С1-2алкил-, в частности -N(СН3)-С1-2алкил-;
R1 означает фтор, хлор или бром;
R2 означает цианогруппу;
R3 находится в положении 7 структурной формулы (I).
6. Соединение по любому из пп.1-5, в котором R3 означает С1-4алкилоксигруппу, замещенную гидроксигруппой и одним заместителем, выбранным из NR9R10 или Het4-.
7. Соединение по любому из пп.1-5, в котором R3 означает С1-4алкилоксигруппу, замещенную С1-4алкилокси-С1-4алкилоксигруппой.
8. Соединение по любому из пп.1-5, в котором R3 означает С1-4алкилоксигруппу.
9. Соединение по любому из пп.1-5, в котором R9 означает водород или метил и R10 означает С1-4алкил-S(=O)2-С1-4алкил-С(=O)-, С1-4алкил или гидрокси-С1-4алкил.
10. Соединение по любому из пп.1-5, в котором Het4 означает пиперидинил или пиперазинил, причем указанный Het4 замещен метилом или гидроксиэтилом.
11. Соединение по любому из пп.1-10, в котором заместитель X2находится в положении 2', заместитель R1представляет водород или галоген и находится в положении 4', заместитель R2 находится в положении 2 и заместитель R3 находится в положении 7 структурной формулы (I) или в котором заместитель X2 находится в положении 3', заместитель R1 представляет водород или галоген и находится в положении 4', заместитель R2 находится в положении 2 и заместитель R3находится в положении 7 структурной формулы (I).
12. Соединение формулы (I), выбранное из группы, состоящей из



13. Ингибитор киназы формулы (I).
14. Применение соединения по любому из пп.1-12 в качестве лекарственного средства.
15. Применение соединения по любому из пп.1-12 для получения лекарственного средства для лечения расстройств клеточной пролиферации, таких как атеросклероз, рестеноз и рак.
16. Применение соединения по любому из пп.1-12 для получения лекарственного средства для лечения невропатической боли.
17. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и в качестве активного ингредиента соединение по любому из пп.1-12 в количестве, эффективном для ингибирования киназы.
Текст
Изобретение относится к соединениям формулы (I), их N-оксидным формам, фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам, где Y означает -С 3-9 алкил-, -С 1-5 алкил-NR6-С 1-5 алкил- или -С 1-5 алкил-NR7-СО-С 1-5 алкил-; X1 означает -O-; X2 означаетNR5-С 1-2 алкил; R1 означает водород, галоген или Het3-O-; R2 означает водород; R3 означает гидроксигруппу, С 1-4 алкилоксигруппу или C1-4 алкилоксигруппу, замещенную одним или двумя заместителями, каждый из которых независимо выбран из Het4, гидроксигруппы,C1-4 алкилоксигруппы, С 1-4 алкилокси-С 1-4 алкилоксигруппы и NR9R10; R5 означает водород илиC1-4 алкил; R6 означает водород или С 1-4 алкил; R7 означает водород; R9 и R10, каждый независимо,означают водород, C1-4 алкил-S(=O)2-С 1-4 алкил-С(=O)-; C1-4 алкил или C1-4 алкил, замещенный гидроксигруппой; Het3 означает пиридинил, необязательно замещенный C1-4 алкилом; Het4 означает морфолинил, пиперидинил или пиперазинил, причем указанный Het4 необязательно замещен гидрокси-С 1-4 алкилом или С 1-4 алкил-S(=O)2-С 1-4 алкилом. Папаникос Александра, Фрейн Эдди Жан Эдгар, Тен Холтэ Петер, Виллемс Марк,Эмбрехтс Вернер Констант Йохан (BE),Мевеллек Лоранс Анн, Сторк Пьер-Анри 014779 Настоящее изобретение относится к некоторым новым производным хиназолина или их фармацевтически приемлемым солям, которые обладают противоопухолевой активностью и, соответственно, применимы при лечении людей и животных. Изобретение также относится к способам получения вышеуказанных производных хиназолина, содержащим их фармацевтическим композициям и их применению в терапевтических методах, например, при производстве лекарственных средств для предотвращения и лечения клеточных пролиферативных заболеваний, таких как атеросклероз, рестеноз и рак у людей и животных. Недавно было открыто, что клетка может становиться раковой посредством трансформации части ее ДНК в онкоген, то есть ген, который при активации приводит к образованию злокачественных опухолевых клеток (Bradshaw, Mutagenesis, 1986, 1, 91). Некоторые такие онкогены инициируют выработку пептидов, которые являются рецепторами для факторов роста. Активация рецепторного комплекса факторов роста впоследствии приводит к увеличению клеточной пролиферации. Известно, например, что некоторые онкогены кодируют ферменты тирозинкиназы и что определенные рецепторы факторов роста являются также ферментами тирозинкиназами (Yarden et al., Ann. Rev. Biochem., 1988, 57, 443; Larsen atal., Ann. Reports in Med. Chem., 1989, Chpt. 13). Первая группа тирозинкиназ, которую идентифицировали, происходит из таких вирусных онкогенов, например, pp60v-Src тиразинкиназа (также известная как(также известная как c-Src). Рецепторные тирозинкиназы играют важную роль в трансмиссии биохимических сигналов, которые инициируют клеточную репликацию. Они являются большими ферментами, которые пронизывают клеточную мембрану, и обладают внеклеточным связующим доменом для факторов роста, таким как эпидермальный фактор роста (EGF), и внутриклеточной частью, которая действует как киназа для фосфорилирования аминокислот тирозина в белках и, следовательно, влияет на клеточную пролиферацию. Известны разные классы рецепторных тирозинкиназ (Wilks, Advances in Cancer Research, 1993, 60, 43-73),основанные на семействах факторов роста, которые объединяют разные рецепторные тирозинкиназы. Классификация включает класс I рецепторных тирозинкиназ, включающий семейство EGF рецепторных тирозинкиназ, таких как EGFR (или Her1, или erbB1), HER2 (или ErbB2), HER3 (или ErbB3) и HER4 (илиErbB4). Среди этих рецепторов класса I HER3 не обладает тирозинкиназной активностью, но сохраняет функцию связывания лигандов и способен к сигнальной трансдукции. Более того, классификация включает класс II рецепторных тирозинкиназ, включающих семейство инсулиновых рецепторных тирозинкиназ, таких как инсулин и IGFI рецепторов и инсулин-родственный рецептор (IRR) и класс III рецепторных тирозинкиназ, включающий семейство рецепторных тирозинкиназ тромбоцитарного фактора роста(PDGF), таких как PDGF, PDGF; и рецепторы колониестимулирующего фактора 1 (CSF 1). Также известно, что некоторые тирозинкиназы принадлежат к классу нерецепторных тирозинкиназ,которые располагаются внутри клеток и участвуют в трансмиссии биохимических сигналов, таких как те, что влияют на подвижность, распространение и инвазивность опухолевых клеток, и, следовательно,метастатический рост опухоли (Ulkich et al., Cell, 1990, 61, 203-212, Bolen et al., FASEB J., 1992, 6, 34033409, Brickell et al., Critical Reviews in Oncogenesis, 1992, 3, 401-406, Bohlen et al., Oncogene, 1993, 8, 20252031, Courtneidge et al., Semin. Cancer Biol., 1994, 5, 239-246, Lauffenburger et al., Cell, 1996, 84, 359-369,Hanks et al., BioEssays, 1996, 19, 137-145, Parsons et al., Current Opinion in Cell Biology, 1997, 9, 187-192,Brown et al., Biochimica et Biophysica Acta, 1996, 1287, 121-149 и Schlaepfer et al., Progress in Biophysicsand Molecular Biology, 1999, 71, 435-478). Известны разнообразные классы нерецепторных тирозинкиназ,включающие семейство Src, такие как Src, Lyn, Fyn и Yes тирозинкиназы, семейство Abl, такие как Abl иArg, и семейство Jak, такие как Jak 1 и Tyk 2. Известно, что нерецепторные тирозинкиназы семейства Src в значительной степени регулируются в обычных клетках и при отсутствии возбуждающего воздействия на клетки извне сохраняются в неактивной конформации. Однако некоторые члены семейства Src, например c-Src тирозинкиназы, часто значительно активируются (по сравнению с уровнем нормальных клеток) в известных видах рака у человека,таких как рак желудочно-кишечного тракта, рак толстой кишки, рак прямой кишки, рак желудка (Cartwright et al., Proc. Natl. Acad. Sci; USA, 1990, 87, 558-762 и Mao et al., Oncogene, 1997, 15, 3083-3090) и рак груди (Muthuswamy et al., Oncogenen, 1995, 11, 1801-1810). Src-семейство нерецепторных тирозинкиназ также идентифицировали в других известных видах рака человека, таких как виды немелкоклеточного рака легких (NSCLCS), включающие аденокарциному и плоскоклеточный рак легких (Mazurenko et al.,European Journal of Cancer, 1992, 28, 372-7), рак мочевого пузыря (Fanning et al., Cancer Reseach, 1992, 52,1457-62), рак пищевода (Jankowski et al., Gut, 1992, 33, 1033-8), рак простаты, рак яичников (Wiener et al.,Clin. Cancer Research, 1999, A, 2164-70) и рак поджелудочной железы (Lutz et al., Biochem. and Biophys.Res. Comm., 1998, 243, 503-8). Так как все большее число опухолевых тканей человека тестируется наSrc-семейство нерецепторных тирозинкиназ, то ожидается, что станет известно об их широком распространении и повсеместном существовании. Более того, известно, что предоминантной ролью c-Src нерецепторной тирозинкиназы является регулирование совокупности фокальных адгезионных комплексов посредством взаимодействия с рядом цитоплазматических белков, включающих, например, фокальную адгезионную киназу и паксиллин. Кро-1 014779 ме того, c-Src присоединяется к сигнальным путям, что регулирует цитоскелет актина, который способствует клеточной подвижности. Подобным образом, важные роли играют c-Src, c-Yes и c-Fyn нерецепторные тирозинкиназы в опосредованном интегрином сигнализировании и в разрыве кадеринзависимых межклеточных сочленений (Owens et al., Molecular Biology of the Cell, 2000, LI, 51-64 и Klinghoffer et al.,EMBO Journal, 1999, 18, 2459-2471). Клеточная подвижность обязательно требуется для локализованной опухоли для развития через стадии распространения в кровоток, инвазии других тканей и инициации метастатического роста опухоли. Например, развитие опухоли толстой кишки от локализованной до диссеминированной, инвазивное метастатическое заболевание коррелировалось активностью c-Src нерецепторной тирозинкиназы (Brunton et al., Oncogene, 1997, 14, 283-293, Fincham et al., EMBO J., 1998, 17, 8192 и Verbeek et al., Exp. Cell Reseach, 1999, 248, 531-537). Соответственно, было обнаружено, что ингибитор таких нерецепторных тирозинкиназ должен быть ценным как избирательный ингибитор подвижности опухолевых клеток, и как избирательный ингибитор распространения и инвазии раковых клеток млекопитающих, приводящий к ингибированию метастатического роста опухоли. В частности, ингибитор таких нерецепторных тирозинкиназ должен быть ценным, как антиинвазивный агент для использования при сдерживании и/или лечении солидных опухолей. Поддержка этой точки зрения обеспечивается разработкой Herceptin (Trastuzumab) и Gleevec (imatinib mesylate), первых примеров таргетных противораковых лекарственных веществ. Herceptin (Trastuzumab) является таргетным препаратом противHer2/neu, являющейся рецепторной тирозинкиназой, для которой обнаружено усилие амплификации в 100 раз у приблизительно 30% пациентов с инвазивным раком груди. При клинических испытаниях доказано, что Herceptin (Trastuzumab) обладал противоопухолевой активностью против рака груди (Review by L.K.Shawer et al., "Smart Drugs: Tyrosine kinase inhibitors in cancer therapy", 2002, Cancer cell Vol.1,117) и, соответственно, обеспечивал доказательство принципа лечения, направленного на рецепторные тирозинкиназы. Второй пример, Gleevec (imatinib mesylate), разработанный против Абельсон тирозинкиназы (Bcr-Abl), конститутивно активной цитоплазматической тирозинкиназы, присутствующей фактически у всех пациентов с хронической миелогенной лейкемией (CML) и 15-30% взрослых пациентов с острой лимфобластической лейкемией. При клинических испытаниях Gleevec (imatinib mecylate) показал великолепную эффективность с минимальными побочными эффектами, что привело к одобрению в течение 3 месяцев с момента подачи документов. Скорость прохождения этого препарата через клинические испытания и регуляционное тестирование стало предметом отдельного изучения быстрой разработки лекарственного средства (Drucker B.J.Lydon N., "Lessons learned from the development of an Abl tyrosine kinase inhibitor for chronic myelogenous leukaemia.", 2000, J. Clin. Invest., 105, 3). Авторами изобретения было неожиданно обнаружено, что некоторые производные хиназолина обладают потенциальной противоопухолевой активностью. Не делая предварительных прогнозов, что соединения, раскрытые в настоящем изобретении, обладают фармакологической активностью только на основании воздействия на единичный биологический процесс, очевидно, что соединения предоставляют противоопухолевое действие посредством ингибирования одной или нескольких рецепторных и нерецепторных тирозин-специфических протеинкиназ, которые участвуют в стадиях сигнальной трансдукции, которая приводит к инвазионной и миграционной способности метастатических опухолевых клеток. В частности, вероятно, что соединения настоящего изобретения обеспечивают противоопухолевое действие посредством ингибирования Src-семейства нерецепторных тирозинкиназ, например путем ингибирования одной или нескольких из c-Src, c-Yes и c-Fyn. Также известно, что c-Src фермент нерецепторной тирозинкиназы участвует в управлении остеокластуправляемой резорбцией костной ткани (Soriano et al., Cell 1991, 64, 693-702; Boyce et al., J. Clin.Invest., 1992, 90, 1622-1627; Yoneda et al., J. Clin. Invest., 1993, 91, 2791-2795 и Missbach et al., Bone, 1999,24, 43749). Ингибитор c-Src нерецепторной тирозинкиназы по этой причине является ценным для предотвращения и лечения заболеваний костной ткани, таких как остеопороз, болезнь Педжета, метастатическое заболевание в кости и гиперкальцемия, вызванная индуцированными злокачественными новообразованиями. Показано, что опосредованное Fyn киназой фосфорилирование NR2B субъединицы NMDA рецептора является существенным для сохранения невропатической боли (Abe et al., Eur. J. Neurosci, 2005, 22,1445-1454). Следовательно, ингибитор Fyn киназы важен при лечении невропатической боли. Соединения настоящего изобретения также применяются при ингибировании неуправляемой клеточной пролиферации, которая возникает в результате разнообразных доброкачественных заболеваний,таких как воспалительные заболевания (например, ревматоидный артрит и воспалительное заболевание кишечника), фиброзные заболевания (например, цирроз печени и легочный фиброз), гломерулонефрит,рассеянный склероз, псориаз, гиперчувствительные реакции кожи, заболевания кровеносных сосудов(например, атеросклероз и рестеноз), аллергическая астма, инсулинозависимые формы диабета, диабетическая ретинопатия и диабетическая невропатия. В общем случае соединения настоящего изобретения обладают потенциальной ингибирующей активностью против Src-семейства нерецепторных тирозинкиназ, например посредством ингибирования cSrc и/или c-Yes, и в то же время обладают менее потенциальной ингибирующей активностью против-2 014779 других ферментов тирозинкиназ, таких как рецепторные тирозинкиназы, например EGF рецепторная тирозинкиназа и/или VEGF рецепторная тирозинкиназа. Более того, некоторые соединения настоящего изобретения имеют значительно большую активностью против Src-семейства нерецепторных тирозинкиназ, например c-Src и/или c-Yes, чем против VEGF рецепторной тирозинкиназы. Такие соединения обладают значительной активностью против Src-семейства нерецепторных тирозинкиназ, например c-Src и/или c-Yes, так что их можно использовать в количестве, достаточном для ингибирования, например, cSrc и/или c-Yes, в то же время демонстрируя небольшую активность против VEGF рецепторной тирозинкиназы. В US 2005/0009867 раскрывается, что некоторые производные 4-(2,3-метилендиоксианилино)-3 цианохинолина применяются для ингибирования Src-зависимой клеточной пролиферации. В нем нет сведений о каких-либо макроциклических производных 4-(2,3-метилендиоксианилино)-3-хиназолина. В US 2005/0250797 раскрыто, что некоторые 7-алкинил-1,3-бензодиоксол-4-ил-содержащие или 7 алкенил-1,3-бензодиоксол-4-ил-содержащие хиназолины полезны для лечения гиперпролиферативных заболеваний, таких как рак. В нем нет сведений о каких-либо макроциклических производных 4-(2,3 метилендиоксианилино)-3-хиназолина. Соответственно, предметом настоящего изобретения является предоставление дополнительных ингибиторов тирозинкиназ, применимых для производства лекарственных средств, для лечения расстройств, связанных с клеточной пролиферацией. Следующим объектом настоящего изобретения является предоставление ингибиторов Fyn киназы,использующихся для производства лекарственных средств, для лечения невропатической боли. Настоящее изобретение относится к соединениям формулы (I) их N-оксидным формам, фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам, в которыхR2 означает водород, цианогруппу, галоген, С 2-6 алкенил, С 2-6 алкинил, С 3-7 циклоалкил или C1-6 алкил,причем указанные С 2-6 алкенил, С 2-6 алкинил, С 3-7 циклоалкил или -С 1-6 алкил необязательно замещены одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы или галогена; в частности R2 означает водород, цианогруппу, галоген или С 1-6 алкил, необязательно замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы или галогена;R3 означает гидроксигруппу, C1-4-алкилоксигруппу или С 1-4-алкилоксигруппу, замещенную одним или, где это возможно, двумя или более заместителями, каждый из которых независимо выбран из Het4,гидроксигруппы, C1-4-алкилоксигруппы, галогена, NR9R10, C1-4 алкил-O-С(=O)-O-, Ar2, NR11R12-карбонила, Het5-карбонила и оксиранила;R8 означает водород, Ar5-S(=O)2-, Ar5-S(=O)-, С 1-4 алкил, С 2-4 алкенил, С 3-7 циклоалкил, С 2-4 алкинил,С 1-4 алкилкарбонил или С 1-4 алкилоксикарбонил-, причем указанные С 1-4 алкил, С 2-4 алкенил, С 3-7 циклоалкил, С 2-4 алкинил, С 1-4 алкилкарбонил или С 1-4 алкилоксикарбонил необязательно замещены С 1-4 алкилоксигруппой, Het8 или фенилом, в частности R8 означает водород, С 1-4 алкил, Ar5-S(=O)2-, Ar5-S(=O)-, С 1-4 алкилоксикарбонил или Het8-C1-4 алкилоксикарбонил;R9 и R10, каждый независимо, означают водород; Het9; Het11-S(=O)2; Het11-S(=O)-; С 1-4-алкил или С 1-4-алкил, замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С 1-4 алкилоксигруппы, С 1-4-алкил-S(=O)2, галогена, Het10, С 1-4 алкил-С(=O)-NR13-,С 1-4 алкил-S(=O)2-NR14-, С 1-4 алкил-С(=O)-NR14-, амино-С(=O)-NR15, моно- или ди(С 1-4 алкил)аминоС(=O)-NR16-, аминокарбонила, аминокарбонилоксигруппы, моно- или ди(С 1-4 алкил)аминокарбонила,моно- или ди (С 1-4 алкил)аминокарбонилоксигруппы, Het12-оксикарбонила, С 1-4 алкилокси-С 1-4 алкилоксигруппы, Het13-карбонила; С 1-4 алкил-S (=O)-С 1-4 алкил-NR17-С(=O)-; или С 1-4 алкил-S (=O)2-C1-4 алкилNR17-С (=O)-;R11 и R12, каждый независимо, означают водород;С 1-4-алкил илиС 1-4-алкил, замещенный одним или,где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, C1-4 алкилоксигруппы, С 1-4-алкил-S(=O)- или С 1-4-алкил-S(=O)2-;R13 означает водород или С 1-4 алкил;R14 означает водород или С 1-4 алкил;R15, R16 и R17, каждый независимо, означают водород или C1-4 алкил;R18 и R19, каждый независимо, означает водород; С 1-4 алкил или С 1-4 алкилоксигруппу, замещенные одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, C1-4 алкилоксигруппы, С 1-4-алкил-S(=O)- или С 1-4-алкил-S(=O)2-;Het1 означает пирролидинил, 2-пирролидинонил или пиперидинил, причем указанный Het1 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С 1-4-алкила, С 1-4-алкилоксигруппы или C1-4-алкилоксикарбонильной группы;Het2 означает пирролидинил, 2-пирролидинонил или пиперидинил, причем указанный Het2 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С 1-4-алкила, C1-4-алкилоксигруппы или C1-4-алкилоксикарбонильной группы;Het3 означает морфолинил, пиперазинил, пиперидинил, фуранил, пиразолил, диоксоланил, тиазолил, оксазолил, имидазолил, изоксазолил, оксадиазолил, пиридинил или пирролидинил, причем указанный Het3 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С 1-4 алкила, С 1-4 алкилоксигруппы или С 1-4 алкилсульфонильной группы;Het4 означает морфолинил, пиперидинил, пирролидинил, 1,1-диоксотиоморфолинил, пиперазинил,фуранил, тиоморфолинил, имидазолил или пиразолидинил, в котором указанный Het4 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы,С 1-4 алкила, аминогруппы, моно- или ди(С 1-4 алкил)аминогруппы, С 1-4 алкил-S(=O)2-, С 1-4 алкил-S(=O)-; C1-4 алкил, замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С 1-4 алкил-С(=O)-NH-, С 1-4 алкил-S(=O)2-, С 1-4 алкил-S(=O)-, аминогруппы, моно- или ди(С 1-4 алкил)аминокарбонила; С 1-4 алкил-С(=O)-, необязательно замещенный одним или, где это возможно,двумя или более заместителями, выбранными из гидроксигруппы, С 1-4 алкилоксигруппы, С 1-4 алкилсульфоксигруппы и C1-4 алкилсульфонильной группы; или С 1-4 алкилоксикарбонил, необязательно замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С 1-4 алкилоксигруппы, С 1-4 алкилсульфоксигруппы и C1-4 алкилсульфонильной группы;Het5 означает морфолинил, пиперидинил, пирролидинил, 1,1-диоксотиоморфолинил, пиперазинил или тиоморфолинил, в котором указанный Het5 необязательно замещен одним или, где это возможно,двумя или более заместителями, выбранными из С 1-4 алкила, гидроксигруппы, аминогруппы, моно- или ди(С 1-4 алкил) аминогруппы, С 1-4 алкил-S(=O)2, С 1-4 алкил-S(=O) и С 1-4 алкил, замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С 1-4 алкил-С(=O)-NH-,С 1-4 алкил-S(=O)2- и С 1-4 алкил-S(=O);Het6, Het7 и Het8, каждый независимо, означают морфолинил, пиперазинил, пиперидинил или пирролидинил, в которых указанные Het6, Het7 и Het8 необязательно замещены одним или, где это возможно,-4 014779 двумя или более заместителями, выбранными из гидроксигруппы, амино, С 1-4 алкила и С 1-4 алкила, замещенного одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы,галогена и С 1-4 алкилоксигруппы;Het9 и Het10, каждый независимо, означают морфолинил, пиперидинил, пирролидинил, 1,1-диоксотиоморфолинил, пиперазинил или тиоморфолинил, где указанные Het9 и Het10 необязательно замещены одним или, где это возможно, двумя или более заместителями, выбранными из С 1-4 алкила, гидроксигруппы, аминогруппы, моно- или ди(С 1-4 алкил)аминогруппы, С 1-4 алкил-S(=O)2, и С 1-4 алкил, замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С 1-4 алкил-С(=O)-NH-, С 1-4 алкил-S(=O)2- и С 1-4 алкил-S(=O);Het11, Het12 и Het13, каждый независимо, означают морфолинил, пиперазинил, пиперидинил или пирролидинил, где указанные Het11, Het12 и Het13 необязательно замещены одним или более заместителями, выбранными из гидроксигруппы, аминогруппы, С 1-4 алкила и С 1-4 алкила, замещенного одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, галогена и С 1-4 алкилоксигруппы;Ar3, Ar4 и Ar5, каждый независимо, означают фенил, необязательно замещенный нитрогруппой,цианогруппой, гидроксигруппой, С 1-4 алкилом, С 1-4 алкилоксигруппой или аминогруппой. Определения, употребляющиеся в вышеизложенном материале и в дальнейшем описании: С 1-2 алкил обозначает метил или этил; С 1-4 алкил обозначает углеводородные радикалы с неразветвленной или разветвленной насыщенной цепью, имеющие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1 метилэтил, 2-метилпропил, 2,2-диметилэтил и тому подобное; С 1-5 алкил обозначает углеводородные радикалы с неразветвленной или разветвленной насыщенной цепью, имеющие от 1 до 5 атомов углерода, такие как, например, метил, этил, пропил, бутил, пентил, 1 метилбутил, 2,2-диметилпропил, 2,2-диметилэтил и тому подобное; подразумевается, что С 1-6 алкил включает С 1-5 алкил и его высшие гомологи, имеющие 6 атомов углерода, такие как, например, гексил, 1,2-диметилбутил, 2-метилпентил и тому подобное; подразумевается, что С 1-7 алкил включает C1-6 алкил и его высшие гомологи, имеющие 7 атомов углерода, такие как, например, 1,2,3-диметилбутил, 1,2-метилпентил и тому подобное; С 3-9 алкил обозначает углеводородные радикалы с неразветвленной или разветвленной насыщенной цепью, имеющие от 3 до 9 атомов углерода, такие как, например, пропил, бутил, пентил, гексил, гептил,октил, нонил и тому подобное; С 1-4 алкилокси обозначает углеводородные радикалы с неразветвленной или разветвленной насыщенной цепью, такие как метокси, этокси, пропилокси, бутилокси, 1-метилэтилокси, 2-метилпропилокси и тому подобное;C1-6 алкилокси включает С 1-4 алкилокси и его высшие гомологи, такие как метокси, этокси, пропилокси, бутилокси, 1-метилэтилокси, 2-метилпропилокси и тому подобное; Употребляющийся в тексте данного документа ранее термин "(=O)" относится к карбонильной составляющей в случае соединения с атомом углерода, к сульфоксидной составляющей в случае соединения с атомом серы и сульфонильной составляющей, когда оба вышеуказанных компонента присоединены к атому серы. Термин "галоген" представляет собой фтор, хлор, бром и йод. Употребляющиеся в вышеизложенном материале и в дальнейшем описании полигалоген С 1-6 алкил как группа или часть группы определяется как моно- или полигалогензамещенный С 1-6 алкил, например метил с одним или более атомами фтора, например, дифторметил или трифторметил, 1,1-дифторэтил и тому подобное. В случае, когда более чем один атом галогена присоединен к алкильной группе, в рамках определения полигалогенС 1-4 алкил или полигалоген С 1-6 алкил, они могут быть одинаковыми или различными. Подразумевается, что гетероциклы, упоминавшиеся в вышеизложенных определениях и в дальнейшем тексте документа, включают все их возможные изомерные формы, например, пирролил также включает 2 Н-пирролил; триазолил включает 1,2,4-триазолил и 1,3,4-триазолил; оксадиазолил включает 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил и 1, 3,4-оксадиазолил; тиадиазолил включает 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил и 1,3,4-тиадиазолил; пиранил включает 2 Н-пиранил и 4 Н-пиранил. Кроме того, гетероциклы, упоминавшиеся в вышеизложенных определениях и в дальнейшем тексте документа, могут присоединяться к основной части молекулы формулы (I) через любой атом углерода в кольце или гетероатом, при необходимости. Таким образом, например, когда гетероцикл является имидазолилом, это может быть 1-имидазолил, 2-имидазолил, 3-имидазолил, 4-имидазолил и 5-имидазолил; когда это тиазолил, это может быть 2-тиазолил, 4-тиазолил и 5-тиазолил; когда это триазолил, это может быть 1,2,4-триазол-1-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-5-ил, 1,3,4-триазол-1-ил и 1,3,4-триазол-2-ил; когда это бензотиазолил, это может быть 2-бензотиазолил, 4-бензотиазолил, 5-бензотиазолил, 6 бензотиазолил и 7-бензотиазолил.-5 014779 Фармацевтически приемлемые аддитивные соли, упоминавшиеся ранее, включают терапевтически активные нетоксические формы аддитивных солей кислот, которые способны образовывать соединения формулы (I). Последние можно подходящим образом получить при обработке основной формы соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, то есть хлористо-водородная или бромисто-водородная кислота; серную; азотную; фосфорную и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная (то есть бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая,этансульфоновая,бензолсульфоновая,п-толуолсульфоновая,цикламовая,салициловая,памиосалициловая, памовая и подобные кислоты. Фармацевтически приемлемые аддитивные соли, упоминавшиеся ранее, включают терапевтически активные нетоксичные формы аддитивных солей оснований, которые способны образовывать соединения формулы (I). Примерами таких форм аддитивных солей оснований являются, например, соли натрия,калия и кальция, и также соли с фармацевтически приемлемыми аминами, такими как, например, аммония, алкиламины, бензатин, трометамин, N-метил-D-глюкамин, гидрабамин, аминокислоты, например аргинин, лизин. С другой стороны, формы солей могут видоизменяться при обработке соответствующими основаниями или кислотами в форму свободной кислоты или основания. Термин "аддитивная соль", выше, также включает сольваты, которые соединения формулы (I), также как их соли, способны образовывать. Такими сольватами являются, например, гидраты, алкоголяты и тому подобное. Термин "стереохимические изомерные формы", выше, определяет возможные различные изомерные, а также конформационные формы, которыми соединения формулы (I) могут обладать. Если не указано или определено особо, химическое название соединений обозначает смесь всех возможных стереохимически и конформационно изомерных форм, указанные смеси, содержащие все диастереомеры, энантиомеры и/или конформеры основной молекулярной структуры. Все стереохимически изомерные формы соединений формулы (I) как в чистом виде, так и в смеси друг с другом, входят в объем настоящего изобретения. Некоторые соединения формулы (I) могут также существовать в таутомерных формах. Такие формы, хотя и не определяются явно в вышеуказанной формуле, должны быть включены в область настоящего изобретения.N-оксидные формы соединений формулы (I) включают такие соединения формулы (I), в которых один или несколько атомов азота окисляются до так называемых N-оксидов. Химические названия макроциклических соединений настоящего изобретения получили в соответствии с правилами номенклатуры, утвержденными Chemical Abstracts Service (CAS). В случае таутомерных форм создавали название структуры изображенной таутомерной формы. Однако следует понимать,что другая, не изображенная, таутомерная форма также включена в область настоящего изобретения. Первая группа соединений, соответствующих настоящему изобретению, состоит из таких соединений формулы (I), в которых применяется одно или несколько следующих ограничений:R3 означает гидроксигруппу, С 1-4 алкилоксигруппу или С 1-4-алкилоксигруппу, замещенную одним или, где это возможно, двумя или более заместителями, каждый из которых независимо выбран из Het4,гидроксигруппы, C1-4-алкилоксигруппы, галогена, NR9R10, C1-4-алкил-О-С(=O)-О- и оксиранила;R5 означает водород, С 1-4 алкил, С 1-4 алкилоксикарбонил, Ar3-S(=O)- или Ar3-S(=O)2-, где указанный С 1-4 алкилоксикарбонил необязательно замещен фенилом;R6 означает водород, С 1-4 алкил или С 1-4 алкилоксикарбонил-, причем указанный С 1-4 алкилоксикарбонил необязательно замещен фенилом;R7 означает водород или С 1-4 алкил;R9 и R10, каждый независимо, означают водород; С 1-4 алкил или С 1-4 алкил, замещенный одним или,где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С 1-4 алкилоксигруппы, С 1-4 алкил-S(=O), С 1-4 алкил-S(=O)2, галогена или С 1-4 алкилокси-С 1-4 алкилоксигруппы, в частности R9 и R10, каждый независимо, означает водород; С 1-4 алкил или С 1-4 алкил, замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С 1-4 алкилоксигруппы или С 1-4 алкил-S(=O)2;Het1 означает пирролидинил или пиперидинил, причем указанный Het1 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы или С 1-4 алкила, в частности Het1 означает пирролидинил необязательно замещенный гидроксигруппой или C1-4 алкилом;Het2 означает пирролидинил или пиперидинил, причем указанный Het2 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы или С 1-4 алкила, в частности Het2 означает пирролидинил, необязательно замещенный гидроксигруппой или C1-4 алкилом;Het3 означает морфолинил, пиперидинил, пиперазинил или пирролидинил, причем указанный Het3 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы или С 1-4 алкила, в частности Het3 означает пиперидинил, необязательно замещенный гидроксигруппой или С 1-4 алкилом;Het4 означает морфолинил, пиперидинил, пирролидинил, 1,1-диоксотиоморфолинил или пиперазинил, в котором указанный Het4 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы, С 1-4 алкила, аминогруппы, С 1-4 алкил-S(=O)-, С 1-4 алкилS(=O)2-, С 1-4 алкил, замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы и С 1-4 алкил-С(=O)-NH; или С 1-4 алкил-С(=O)-, необязательно замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы,С 1-4 алкилоксигруппы и С 1-4 алкилсульфонильной группы, в частности Het4 означает морфолинил, пиперидинил,пирролидинил, 1,1-диоксотиоморфолинил или пиперазинил, в котором указанный Het4 необязательно замещен одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы,C1-4 алкила, аминогруппы, С 1-4 алкил-S(=O)-, C1-4 алкил-S(=O)2-, C1-4 алкил, замещенный одним или, где это возможно, двумя или более заместителями, выбранными из гидроксигруппы и С 1-4 алкил-С(=O)-NH-; или С 1-4 алкил-С(=O)-, необязательно замещенный С 1-4 алкилсульфонильной группой;Ar3 и Ar5, каждый независимо, означают фенил, необязательно замещенный нитрогруппой, цианогруппой, гидроксигруппой или C1-4 алкилоксигруппой, в частности Ar3 и Ar5, каждый независимо, означают фенил, необязательно замещенный нитрогруппой. Другая группа соединений, соответствующих настоящему изобретению, состоит из тех соединений формулы (I), в которых применяются следующие ограничения:R3 означает гидроксигруппу, С 1-4 алкилоксигруппу или C1-4 алкилоксигруппу, замещенную одним или, где это возможно, двумя или более заместителями, каждый из которых независимо выбран из Het4,гидроксигруппы, С 1-4 алкилоксигруппы, галогена, NR9R10 и C1-4 алкил-O-С(=O)-O-, Ar2, NR11R12-карбонила и Het5-карбонила. Другая группа соединений, соответствующих настоящему изобретению, состоит из тех соединений первой группы, в которых применяются следующие ограничения:R3 означает гидроксигруппу, C1-4-алкилоксигруппу или C1-4-алкилоксигруппу, замещенную одним или, где это возможно, двумя или более заместителями, каждый из которых независимо выбран из Het4,гидроксигруппы, C1-4-алкилоксигруппы, галогена, NR9R10 и C1-4 алкил-O-С(=O)-O-. Другая группа соединений, соответствующих настоящему изобретению, состоит из тех соединений формулы (I), в которых применяется одно или несколько следующих ограничений:R3 означает гидроксигруппу, С 1-4 алкилоксигруппу или C1-4 алкилоксигруппу, замещенную одним или двумя заместителями, каждый из которых независимо выбран из Het4, гидроксигруппы, C1-4 алкилоксигруппы, С 1-4 алкилокси-С 1-4 алкилоксигруппы и NR9R10;R5 означает водород или С 1-4 алкил, в частности R5 означает водород или метил;R6 означает водород или С 1-4 алкил, в частности R6 означает водород или метил;Het4 означает морфолинил, пиперидинил или пиперазинил, в котором указанный Het4 необязательно замещен гидрокси-С 1-4 алкилом или C1-4-алкил-S(=O)2-С 1-4 алкилом. Более интересная группа соединений состоит из тех соединений формулы (I), которые выбраны из группы, состоящей из Другой специальной группой соединений являются: те соединения формулы (I), в которых -X1- означает -О-; те соединения формулы (I), в которых X2 означает -NR5-C1-2 алкил, в частности -N(СН 3)-C1-2 алкил-; те соединения формулы (I), в которых R1 означает фтор, хлор или бром; те соединения формулы (I), в которых R2 означает цианогруппу; те соединения формулы (I), в которых R3 находится в 7 положении структурной формулы (I); те соединения формулы (I), в которых R3 означает C1-4 алкилоксигруппу, замещенную гидроксигруппой или одним заместителем, выбранным из NR9R10 или Het4-; те соединения формулы (I), в которых R3 означает C1-4 алкилоксигруппу, замещенную С 1-4 алкилокси-С 1-4-алкилоксигруппой; те соединения формулы (I), в которых R3 означает C1-4-алкилоксигруппу, в более частном случае-9 014779 метоксигруппу; те соединения формулы (I), в которых R9 означает водород или метил, и R10 означает С 1-4 алкил-S(=O)2-С 1-4 алкил-С(=O)-, C1-4 алкил или гидрокси-С 1-4 алкил, в частности те соединения формулы (I), в которых R9 означает водород или метил и R10 означает метил-S(=O)2-С(=O)- или гидрокси-С 1-4 алкил; в более частном случае, те соединения формулы (I), в которых R9 означает водород или метил и R10 означает метил-S(=O)2-(CH2)2-C(=O)- или гидроксиэтил- ; те соединения формулы (I), в которых Het4 означает пиперидинил или пиперазинил, причем указанный Het4 замещен метилом или гидроксиэтилом; те соединения формулы (I), которые выбраны из группы, состоящей из В следующем варианте осуществления настоящего изобретенияX2 заместитель находится в положении 2', заместитель R1 представляет водород или галоген и находится в положении 4', заместитель R2 находится в положении 2 и заместитель R3 находится в положении 7 структурной формулы (I); альтернативно заместитель X2 находится в положении 3', заместитель R1 представляет водород или галоген и находится в положении 4', заместитель R2 находится в положении 2 и заместитель R3 находится в положении 7 структурной формулы (I). Соединения настоящего изобретения можно получать любым из нескольких стандартных способов синтеза, которые широко применяются специалистами в области органической химии и описанными,например, в следующих ссылках: "Heterocyclic Compounds" - Vol.24 (part 4) p. 261-304 Fused pyrimidines,Wiley-Interscience; Chem. Pharm. Bull., Vol. 41(2), 362-368 (1993); J. Chem. Soc, Perkin. Trans. 1, 2001, 130137. Как далее показано в примерах экспериментальной части в описании, отдельная группа соединений является теми соединениями формулы (I), в которых -X1- означает -О- в описании, на которые ссылаются как на соединения формулы (3). Вышеуказанные соединения в общем случае получают из известного исходного соединения, 6-ацетокси-4-хлор-7-метоксихиназолина (II'), который можно получить из коммерчески доступной вератровой кислоты и 4-гидрокси-3-метоксибензойной кислоты, соответственно. Соединение последних с подходящими замещенными бензодиоксоламинами (III') при стандартных условиях, например перемешивании в 2-пропаноле при повышенной температуре в пределах от 40 до 100 С, в течение 3-12 ч, дает промежуточные соединения (IV') (схема 1). Схема 1V=водород или защитная группа, такая как, например, метилкарбонильная, трет-бутильная, метильная, этильная, бензильная или триалкилсилильная группы.X2, Y, R1 и R2 определяются как для соединений формулы (I). Снятие защиты у промежуточных соединений формулы (IV'), как описано в Protective Groups in Organic Synthesis by T.W. Greene and P.G.M. Wuts, 3rd edition, 1998, с последующим замыканием кольца при соблюдении условий реакции Мицунобу дает макроциклические соединения (1) настоящего изобретенияV=водород или защитная группа, такая как, например, метилкарбонильная, трет-бутильная, ме- 10014779 тильная, этильная, бензильная или триалкилсилильная группы.X2, Y, R1 и R2 определяются как для соединений формулы (I). Дальнейшая модификация указанной метоксигруппы дает соединения настоящего изобретения (I), в которых R3 отличается от метоксигруппы (схема 3). Если говорить кратко, то указанные макроциклические соединения формулы (1) деметилируются при соблюдении известных в этой области техники условий, таких как, например, нагревание с концентрированной HI или HBr. Специфические примеры этой реакции деметилирования представлены в примерах А 1k); A2i) и A5i) далее в описании. Последующее алкилирование соответствующим спиртом при соблюдении известных в этой области техники условий дает соединения настоящего изобретения, в которых R является иным, чем метил (3). Алкилирование обычно проходит в условиях реакции Мицунобу, таких как, например, предусмотрены в примерах A1l); в которой R означает С 1-4 алкил- или R означает С 1-4 алкил, замещенный одним или, где это возможно, двумя или более заместителями, выбранными из Het4, гидроксигруппы, C1-4-алкилоксигруппы, галогена, NR9R10, С 1-4 алкил-O-С (=O)-O-, Ar2, NR11R12-карбонила и Het5-карбонила. Ar2, Het4, Het5, Y, X2, R1,R9, R10, R11 и R12 определяются как для соединений формулы (I) далее в описании. Как далее показано в описании, отдельная группа соединений является теми соединениями формулы (3), в которых R представляетС 1-4 алкил, замещенный NR9R10 или Het4, в которой Het4 присоединен к остатку молекулы через атом азота. Указанные соединения общей формулы (5) в общем случае получают в соответствии со схемой синтеза 4, исходя из соединений общей формулы (2). Схема 4 в которой n=1, 2, 3 или 4; Y, X2, R1, R9 и R10 определяются как для соединений формулы (I) или R7 иR , взятые вместе с атомом азота, к которому они присоединены, из гетероцикла, причем указанный гетероцикл определяется как Het4 для соединений формулы (I) далее в описании. В свою очередь, на первой стадии спирт (2) алкилировали соответствующим галогеналкиловым спиртом в условиях реакции Мицунобу с последующим аминированием с соблюдением известных в этой области техники условий. Альтернативно вышеуказанному и, в частности, для тех соединений формулы (5), в которых С 1-4 алкильный фрагмент далее замещается гидроксигруппой, указанные соединения образуются при задействовании реакции нуклеофильного присоединения, исходя из аналога оксирана 3' (схема 5) Схема 5 8- 11014779 в которой Y, X2, R1, R9 и R10 определяются как для соединений формулы (I) или R9 и R10 взяты вместе с атомом азота, к которому они присоединены, из гетероцикла, в котором указанный гетероцикл определяется как Het4 для соединений формулы (I) далее в описании. Реакция выполняется при соблюдении известных в этой области техники условий, таких как, например, представлены в примере В 1 далее в описании. Замыкание кольца по Мицунобу, как представлено на схеме 2 в описании, в частности полезно для тех соединений формулы (I), в которых X1 обозначает -O-; X2 обозначает NR5-С 1-2-алкил-; и Y обозначает-С 3-9 алкил- далее в описании, на которые ссылаются как на соединения формулы (7). Для указанных соединений замещенный бензодиоксоламин (12) получали из известных 4-гидрокси-3-метокси-2 нитробензальдегидов (8), в которых X3 является водородом или галогеном (схема 6). Деметилирование с использованием известных в этой области техники условий, таких как, например, представлены в примере А 7 а) далее в описании, то есть с использованием смеси подходящих растворителей, таких как пиридин/CH2Cl2 в присутствии AlCl3 (обезвоженном), дает двухатомный спирт (9) (схема 6 а), который после алкилирования с соответствующим алкилгалогенидом, таким как дихлор- или дийодметан, дает производные бензодиоксола общей формулы (10) (схема 6b). Эта реакция алкилирования также известна как реакция Вильямсона, включает обработку галогенида ароксид-ионом, который образуется при удалении протона из спиртов при использовании, например, K2CO3 в ДМФ; твердый KOH в Me2SO; HgO и HBF4 вCH2Cl2 или третичный алкоксид меди(I). Более специфические примеры рассматриваются в примерах А 7b) и А 12b) далее в описании. Чтобы ввести С 3-9 алкилэтиленовый линкер в молекулу, использовали восстановительное аминирование с последующей необязательной защитой свободного амина, в случае первичного амина (схема 6d) получили производные нитробензодиоксола общей формулы (11) (схема 6 с). Реакция восстановительного аминирования выполняется при соблюдении условий, известных в этой области техники, в которой альдегид обрабатывается соответствующим первичным или вторичным амином в присутствии водорода и катализатора гидрирования или используя другие восстанавливающие агенты, такие как боргидрид натрия, пентакарбонил железа, NaBH(ОАс)3 и муравьиной кислоты в подходящем растворителе, таком как этанол или дихлорэтан. Более конкретные примеры восстановительного аминирования показаны в примерах А 7 с) и А 12 е) далее в описании. Необязательная защита амина может выполняться посредством использования защитной группы, такой как, например, трет-бутилоксикарбонил или бензилоксикарбонил, как описано в Protective Groups in Organic Synthesis by T.W. Greene and P.G.M. Wuts, 3rd edition, 1998. Восстановление производных нитробензодиоксола (11) (схема 6 е) в конечном итоге дает бензодиоксоламины формулы (12). Это восстановление выполняется при стандартных условиях, например, используя гидрогенолиз (Н 2, Pt/C, тиофен, МеОН) или хлорида олова (II) (SnCl2, H2, EtOH) . Схема 6 в которой n=0 или 1; X1 обозначает водород или галоген; R5 определяется, как для соединений формулы (I) далее в описании; и R5' включает обозначение R5, как определено для соединений формулы (I) далее в описании, и защитную группу, такую как, например, трет-бутилоксикарбонил или бензилоксикарбонил. Для тех соединений формулы (I), в которых -X1YX2- линкер содержит диамин или амид, в частности для тех соединений, в которых X1 означает -O-; X2 означает NR5-C1-2 алкил- и Y означает С 1-5 алкилNR6-С 1-5 алкил-, С 1-5 алкил-NR7-СО-С 1-5 алкил-, -С 1-6 алкил-NH-CO-, NH-CO-C1-6 алкил-, С 1-3 алкил-NH-СОHet1-, С 1-6 алкил-NR8-Het2-, С 1-6 алкил-CO-NH или CO-NH-C1-6 алкил; далее в описании ссылались как на соединения формулы (Ia), использовали альтернативную схему синтеза (схема 7) для замыкания кольца по Мицунобу. Промежуточные соединения формулы (V) получаются, как описано далее в описании. Образование соответствующего эфира (13 а) выполняется при использовании соответствующего аминированного алкилгалогенида в стандартных условиях, то есть при использовании реакции Вильямсона, в которой гало- 12014779 генид обрабатывается ароксид-ионом, который получается при удалении протона из спиртов, используя,например, K2CO3 в ДМФ; твердый KOH в Me2SO; HgO и HBF4 в CH2Cl2 или третичный алкоксид меди(I). Более конкретный случай рассматривается в примере А 5 е) далее в описании. Снятие защиты с последующим замыканием кольца позволяет получить заданные соединения формулы (Ia). Снятие защиты выполняется в стандартных условиях, таких как, например, описаны в Protective Groups in Organic Synthesis by T.W. Greene and P.G.M. Wuts, 3rd edition, 1998. Замыкание кольца является либо типичным образованием амина, либо замещением гидроксигруппы амином. Образование амида в известных в этой области техники условиях, таких как, например, использование конденсирующих агентов для протекания процесса с хорошим выходом при комнатной температуре или слегка выше. Конденсирующими агентами являются те агенты, которые обычно применяют при синтезе пептидов, такие как, например, дициклогексилкарбодиимид; N,N'-карбонилдиимидазол, POCl3,хлорсульфонилизоцианат, смесь Bu3P и PhCNO и смесь DIPEA и HBTU. Замена гидроксигруппы амином, то есть преобразование спирта в амин, выполняется при соблюдении известных в данной области условий, таких как, например, путем обработки трифенилфосфиндибромидом в присутствии триэтиламина или при обработке трифенилфосфином в присутствии бис(1 метилэтил)диазиндикарбоксилата. Схема 7 Для тех соединений формулы (I), в которых -X1YX2- линкер содержит диамин, в частности для тех соединений формулы (I), в которых X1 означает -O-; X2 означает NR5-С 1-2 алкил- и Y означает С 1-5 алкилNR6-С 1-5 алкил- или С 1-6 алкил-NR8-Het2-, как альтернатива схеме 7, промежуточное соединение (V) может алкилироваться в аналогичных условиях, как описано в схеме 7 далее в описании, то есть используя реакцию Вильямсона с дигалогенированным алкилом вместо этого. В полученном таким образом промежуточном соединении (15) спирт, у которого сняли защиту, сначала преобразуется во вторичный амин,используя аналогичные условия реакции, как описано в схеме 7 далее в описании, с последующим окончательным замыканием кольца, которое теперь включает реакцию алкилирования вторичного амина с алкилгалогенидом, присутствующим на фрагменте хиназолина. С другой стороны, эта реакция алкилирования выполняется в стандартных условиях, таких как, например, в подходящем растворителе, таком как CH3CN, в присутствии йодид тетрабутиламмония и Cs2CO3. Эти и другие условия реакции рассматриваются более подробно в примерах далее в описании. Схема 8- 13014779 Где это необходимо или желательно, могут быть выполнены одна или несколько любых следующих дополнительных стадий в любом порядке:(i) удаление любой оставшейся защитной группы (групп);(ii) преобразование соединения формулы (I) или его защищенной формы в последующее соединение формулы (I) или его защищенную форму;(iii) преобразование соединения формулы (I) или его защищенной формы в его N-оксид, соль, четвертичный амин или сольват соединения формулы (I) или его защищенную форму;(iv) преобразование N-оксида, соли, четвертичного амина или сольвата соединения формулы (I) или его защищенной формы в соединение формулы (I) или его защищенную форму;(v) преобразование N-оксида, соли, четвертичного амина или сольвата соединения формулы (I) или его защищенной формы в другой N-оксид, фармацевтически приемлемую аддитивную соль, четвертичный амин или сольват соединения формулы (I) или его защищенную форму;(vi) когда соединение формулы (I) получается в виде смеси (R)- и (S)-энантиомеров, разделение смеси является необходимым для получения желаемого энантиомера. Соединения формулы (I), их N-оксидные формы, аддитивные соли, четвертичные амины и стереохимически изомерные формы могут преобразовываться в последующие соединения, соответствующие настоящему изобретению, при использовании методик, известных в этой области техники. Специалистам в этой области будет понятно, что в способах, описанных выше, для функциональных групп промежуточного соединения и макроциклических соединений, которые используются на следующей стадии реакции, может требоваться блокировка защитными группами. Функциональные группы, которые желательно защитить, включают гидрокси, амино и карбоксильную группы. Подходящие защитные группы для гидроксила включают триалкилсилильные группы (например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), бензил и тетрагидропиранил. Подходящие защитные группы для аминогруппы включают трет-бутилоксикарбонил или бензилоксикарбонил. Подходящие защитные группы для карбоксильной группы включают С(1-6)алкиловые или бензиловые сложные эфиры. Защита и снятие защиты функциональных групп могут иметь место до или после реакционной стадии. Кроме того, N-атомы в соединениях формулы (I) могут метилироваться известными в этой области способами, используя СН 3-I в подходящем растворителе, таком как, например, 2-пропанон, тетрагидрофуран или диметилформамид. Соединения формулы (I) могут также преобразовываться друг в друга, если следовать известным в этой области методикам трансформирования функциональных групп, некоторые примеры которых упоминаются далее в описании. Соединения формулы (I) можно также превращать в соответствующие N-оксидные формы, следуя известным в этой области методикам преобразования трехвалентного азота в N-оксидную форму. Вышеуказанная реакция N-окисления, в общем случае, может выполняться при взаимодействии исходного соединения формулы (I) с 3-фенил-2-(фенилсульфонил)оксазиридином или с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например перекись водорода, пероксиды щелочных и щелочно-земельных металлов, например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать пероксикислоты, такие как, например, пероксобензойная кислота или галогенозамещенная пероксобензойная кислота, например 3-хлорпероксобензойная кислота, пероксоалкановая кислота, например, перуксусная кислота, алкилгидропероксиды, например, третбутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например,этанол и тому подобное, углеводороды, например толуол, кетоны, 2-бутанон, галогенированные углеводороды, например, дихлорметан, и смеси таких растворителей. Чистые стереохимически изомерные формы соединений формулы (I) можно получить при использовании известных в этой области техники методик. Диастереомеры можно разделить физическими способами, такими как фракционная кристаллизация, и хроматографическими способами, например противоточное распределение, жидкостная хроматография и тому подобным. Некоторые соединения формулы (I) и некоторые промежуточные соединения в настоящем изобретении могут содержать асимметричный атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений могут получаться при использовании известных в этой области методик. Например, диастереоизомеры можно разделить физическими способами, такими как фракционная кристаллизация, или хроматографическими способами, например, противоточное распределение, жидкостная хроматография и тому подобными способами. Энантиомеры могут получаться из рацемических смесей сначала преобразованием указанных рацемических смесей подходящими разделяющими агентами, такими как, например, хиральные кислоты, до смесей диастереомерных солей или соединений; затем физическим разделением указанных смесей диастереомерных солей или соединений, например, фракционной кристаллизацией или хроматографическими способами, например жидкостной хроматографией и тому подобными способами, и в итоге, преобразованием указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохи- 14014779 мически изомерные формы можно также получить из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных соединений при условии, что имеющие место реакции происходят стереоспецифически. Альтернативный способ разделения энантиомерных форм соединений формулы (I) и промежуточных соединений подразумевает жидкостную хроматографию, в частности жидкостную хроматографию,использующую хиральную стационарную фазу. Некоторые промежуточные соединения и исходные вещества, использованные в методиках, упомянутых ранее в описании, являются известными соединениями и могут быть коммерчески доступными или могут получаться в соответствии с известными в этой области методиками. Как описано в экспериментальной части далее в описании, рост ингибирующего действия и противоопухолевой активности настоящих соединений демонстрировали in vitro в ферментных анализах на рецепторных тирозинкиназах, таких как, например, EGFR, Abl, Fyn, Flt1, Hck или Src-семействах киназ,таких как, например, Lyn, Yes и c-Src. В альтернативном исследовании рост ингибирующего действия соединений тестировали на ряде раковых клеточных линий, в частности в клеточной линии карциномы яичников SKOV3 и линии плоскоклеточной карциномы А 431, используя известные в этой области цитотоксические исследования, такие как МТТ. Соответственно настоящее изобретение предусматривает применение соединений формулы (I) и их фармацевтически приемлемых N-оксидных форм, аддитивных солей, четвертичных аминов и стереохимически изомерных форм в терапии. В более частном случае для лечения или предотвращения заболеваний, связанных с клеточной пролиферацией. На соединения формулы (I) и их фармацевтически приемлемые N-оксидные формы, аддитивные соли, четвертичные амины и стереохимически изомерные формы можно, далее в описании, ссылаться, как на соединения, соответствующие настоящему изобретению. Соединения, соответствующие настоящему изобретению, в частности, используются как избирательный ингибитор подвижности опухолевых клеток и, как избирательный ингибитор распространения и инвазивности раковых клеток млекопитающих, приводящие к ингибированию метастатического роста опухоли. Соответственно было обнаружено, что ингибитор таких нерецепторных тирозинкиназ должен быть ценным при лечении известных видов рака у человека, таких как рак желудочно-кишечного тракта,например, рака толстой кишки, прямой кишки и желудка; рак груди; немелкоклеточный рак легких, такой как аденокарцинома и плоскоклеточный рак легких; рак мочевого пузыря; рак пищевода; рак простаты; рак яичников и рак поджелудочной железы. Ингибитор нерецепторной тирозинкиназы будет также полезен для предотвращения и лечения неуправляемой клеточной пролиферации, которая возникает из разных незлокачественных заболеваний, таких как заболевания костей (например, остеопетроз, болезнь Педжета, метастатические заболевания в костях и вызванная опухолью гиперкальциемия), воспалительные заболевания (например, ревматоидный артрит и воспаление пищеварительного тракта), фиброзные заболевания (например, цирроз печени и легочный фиброз), гломерулонефриты, рассеянный склероз,псориаз, гиперчувствительная реакция кожи, заболевания кровеносных сосудов (например, атеросклероз и рестеноз), аллергическая астма, инсулинозависимые диабеты, диабетическая ретинопатия и диабетическая невропатия. С точки зрения полезности соединений, соответствующих настоящему изобретению, предусматривается способ лечения расстройства клеточной пролиферации, таких как атеросклероз, рестеноз и рак,способ, включающий введение животному, нуждающемуся в таком лечении, например млекопитающему, включая человека, страдающему от расстройства клеточной пролиферации, терапевтически эффективного количества соединения, соответствующего настоящему изобретению. Указанный способ включает системное или местное введение эффективного количества соединения, соответствующего настоящему изобретению, животным, в том числе людям. Специалист в этой области установит, что терапевтически эффективным количеством ингибиторов нерецепторной тирозинкиназы Src-семейства является количество, достаточное для индуцирования роста ингибиторного действия,и что это количество варьируется, в числе прочего, в зависимости от размера, типа неоплазии, концентрации соединения в терапевтической рецептуре и состояния пациента. В общем случае, количество Srcингибитора, которое следует вводить, в качестве терапевтического средства для лечения расстройства клеточной пролиферации, такой как атеросклероз, рестеноз и рак, будет определяться индивидуально лечащим врачом. В общем случае, подходящей дозой является та доза, которая дает в результате концентрацию Srcингибитора в зоне лечения в пределе от 0,5 нМ до 200 мкМ и более обычно от 5 нМ до 10 мкМ. Чтобы получить эти концентрации для лечения, пациенту, нуждающемуся в лечении, наиболее вероятно будут введены от 0,01 до 300 мг/кг массы тела, в частности от 10 до 100 мг/кг массы тела. Как отмечено ранее в описании, вышеуказанные количества могут варьироваться индивидуально. В этих способах лечения соединения, соответствующие настоящему изобретению, предпочтительно включаются в рецептуру до поступления. Как описано ниже в описании, подходящие фармацевтические рецептуры получаются известными способами с использованием хорошо известных и легкодоступных ингредиентов. В связи с их высокой избирательностью как Src-ингибиторов, соединения формулы (I), определенные выше, также применяются для маркировки или идентификации домена киназы среди рецепторных- 15014779 тирозинкиназных рецепторов. С этой целью у соединений настоящего изобретения можно сделать метки,в частности, при замене, частично или полностью, одним или несколькими атомами в молекуле с помощью их радиоактивных изотопов. Примерами интересных меченых соединений являются соединения,имеющие по меньшей мере один галоген, который является радиоактивным изотопом йода, брома или фтора; или соединения, имеющие по меньшей мере один 11 С-атом или атом трития. Одна конкретная группа состоит из таких соединений формулы (I), в которых R1 обозначает радиоактивный атом галогена. По существу, любое соединение формулы (I), содержащее атом галогена, предрасположено для введения радиоактивной метки путем замены атома галогена на подходящий изотоп. Подходящими галогеновыми радиоизотопами для этой цели являются радиоактивные иодиды, например,122 123 125 131I, I, I, I; радиоактивные бромиды, например 75Br, 7 бBr, 77Br и 82Br; и радиоактивные фториды,например, 18F. Введение радиоактивного атома галогена может выполняться подходящей реакцией обмена или при использовании любой из процедур, описанных выше в описании, для получения производных галогена формулы (I). Другой интересной формой введения радиоактивных меток является замещение атома углерода 11 Сатомом или замещение атома водорода атомом трития. Следовательно, указанные соединения с радиоактивными метками формулы (I) могут использоваться в способе специфического введения метки в рецепторные области в биологическом материале. Указанный способ включает стадии (а) введения радиоактивной метки в соединение формулы (I), (b) введение этого меченого соединения с радиоактивной меткой в биологический материал и последующее(с) определение эмиссий от соединений с радиоактивной меткой. Альтернативно, в соединения вводятся в качестве меток стабильные изотопы. В этой форме введения меток природные распространенные изотопы водорода, углерода и азота (1 Н, 12 С и 14N) заменяются стабильными изотопами этих элементов (2 Н [дейтерий], 13 С и 15N соответственно). Введение меток стабильными изотопами применяется для двух основных целей: введение стабильных изотопов в белки, углеводы и нуклеиновые кислоты способствует определению их структуры на атомном уровне; исследования метаболизма, в которых используют соединения увеличенной массы, помеченные стабильными изотопами. Подразумевается, что термин "биологический материал" включает все материалы, которые имеют биологическое происхождение. В более частном случае этот термин относится к образцам тканей, плазме или жидкостям организма, а также к животным, особенно теплокровным животным, или частям животных, таким как органы. При проведении испытаний на живых организмах соединения с радиоактивными метками вводятся в соответствующей композиции животному и местонахождение вышеуказанных соединений с радиоактивными метками определяется с помощью методов воспроизведения изображения, таких как, например,однофотонная эмиссионная компьютерная томография (SPECT) или позитрон-эмиссионная томография(PET) и тому подобное. Таким образом, распределение до конкретного рецепторного участка может наглядно представляться с помощью методов воспроизведения изображения, упомянутых ранее в описании. Этот процесс изображения органа при введении соединения с радиоактивной меткой формулы (I) и определение эмиссий от радиоактивного соединения также является частью настоящего изобретения. В еще одном аспекте настоящее изобретение предусматривает применение соединений, соответствующих настоящему изобретению, при производстве лекарственного средства для лечения любых из вышеупомянутых клеточных пролиферативных расстройств или симптомов. Количество соединения, соответствующего настоящему изобретению, на которое также ссылаются в данном описании как на активный ингредиент, - это количество, которое требуется для достижения терапевтического эффекта, будет, конечно, варьироваться в зависимости от конкретного соединения,способа введения, возраста и состояния пациента, и конкретного расстройства или заболевания, которое лечится. Подходящей дневной дозой может быть от 0,01 до 300 мг/кг массы тела, в частности от 10 мг/кг до 100 мг/кг массы тела. Способ лечения может также включать введение активного ингредиента, по схеме лечения, от одного до четырех приемов в день. Хотя и возможно введение только активного ингредиента, все же предпочтительно, чтобы он присутствовал в составе фармацевтической композиции. Соответственно, настоящее изобретение, кроме того, предусматривает фармацевтическую композицию, включающую соединение, соответствующее настоящему изобретению, вместе с фармацевтически приемлемым носителем или разбавителем. Носитель или разбавитель должны быть "приемлемыми", то есть быть совместимыми с другими ингредиентами композиции и не приносить вреда реципиентам, которые их принимают. Фармацевтические композиции настоящего изобретения можно получить любыми способами, хорошо известными в области фармацевтики, например, используя способы, такие как те, что описаны вGennaro et al. Remington's Pharmaceutical Sciences (18th ed., Mack Publishing Company, 1990, см., в частности, Part 8: Pharmaceutical preparations and their Manufacture). Терапевтически эффективное количество конкретного соединения в виде основания или в виде аддитивной соли как активный ингредиент соединяется в однородную смесь с фармацевтически приемлемым носителем, который может принимать ши- 16014779 рокое разнообразие форм в зависимости от желаемой формы препарата. Эти фармацевтические композиции, желательно в одноразовой лекарственной форме, подходят предпочтительно для систематического введения, такого как оральное введение, введение через кожу или парентеральное введение; или местного введения, такого как посредством ингаляции, назального спрея, капель для глаз или посредством крема, геля, шампуня или тому подобного. Например, при получении композиций в лекарственной форме для орального введения могут использоваться любые из обычных фармацевтических сред, таких как,например, вода, гликоли, масла, спирты или тому подобное, в случае жидких препаратов для орального введения, таких как суспензии, сиропы, эликсиры и растворы, или твердые носители, такие как крахмалы, сахара, каолин, скользящие вещества, связывающие агенты, дезинтегрирующие вещества и тому подобное, в случае порошков, пилюль, капсул и таблеток. Вследствие своей простоты для введения таблетки и капсулы представляют собой наиболее предпочтительные лекарственные формы для орального введения, очевидно, что в этом случае используются твердые фармацевтические носители. Для парентеральных композиций носитель обычно будет содержать стерильную воду, по меньшей мере большая часть композиции, хотя и другие ингредиенты, например, для способствования растворимости могут быть включены. Можно получить, например, растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также можно получить суспензии для инъекций, в которых могут использоваться соответствующие жидкие носители, суспендирующие вещества и тому подобное. В композициях, подходящих для введения через кожу, носитель необязательно содержит агент, улучшающий проникновение, и/или подходящий увлажняющий агент, необязательно связанный с подходящими дополнительными веществами любой природы в минимальных пропорциях, причем такие дополнительные вещества не оказывают никаких значительных вредных воздействий на кожу. Указанные дополнительные вещества могут способствовать введению в кожу и/или могут содействовать получению желательных композиций. Эти композиции могут вводиться различными путями, например, как трансдермальный пластырь, как капли для нанесения на кожу (spot-on) или как мазь. Особенно предпочтительно составить рецептуру вышеупомянутых фармацевтических композиций для единичной лекарственной формы для облегчения введения и единообразия дозировки. Единичная лекарственная форма, так как использовано в спецификации и формуле изобретения в настоящем описании, относится к физически дискретным единицам, подходящим в качестве однократных доз, где каждая единица содержит заранее определенное количество активного ингредиента, рассчитанного для получения желаемого терапевтического эффекта, в комплексе с требуемым фармацевтическим носителем. Примерами таких единиц лекарственных форм являются таблетки (включая таблетки с насечкой или таблетки с оболочкой), капсулы,пилюли, пакеты с порошком, пластинки, растворы или суспензии для инъекций, чайная ложка, столовая ложка и тому подобное, и их сегрегированные многочисленные разновидности. Экспериментальная часть В дальнейшем в этом описании термин "THF" означает тетрагидрофуран, "DMF" означает N,Nдиметилформамид, "EtOAc" означает этилацетат, "MgSO4" означает сульфат магния, "NaBH(OAc)3" означает триацетоксиборгидрид натрия, "CH2Cl2" означает дихлорметан, "Na2SO4" означает сульфат натрия, "СН 3 ОН" означает метанол, "DMA" означает диметилацетамид, "NaBH4" означает тетрагидроборат(1-) натрия, "NaHCO3" означает мононатриевую соль угольной кислоты, "DIAD" означает бис(1 метилэтил)эфир диазендикарбоновой кислоты, "Et3N" означает триэтиламин, "DIPEA" означает N-этилN-(1-метилэтил)-2-пропанамин, "K2 СО 3" означает карбонат калия, "DIPE" означает диизопропиловый эфир,"EtOH" означает этанол,"HBTU" означает 1-[бис(диметиламино)метилен]-1 Нбензотриазолийгексафторфосфат(1-)3-оксид, "HCTU" означает 1-[бис(диметиламино)метилен]-5-хлор 1 Н-бензотриазолийгексафторфосфат(1-)3-оксид, "Cs2CO3" означает карбонат цезия, "Et2O" означает диэтиловый эфир, "CHCl3" означает хлороформ, "AlCl3" означает хлорид алюминия, "NaOCH3" означает натриевую соль метанола, "NaH3PO4 означает мононатриевую соль фосфорной кислоты, "HCl" означает моногидрохлорид. А. Получение соединений настоящего изобретения и их промежуточных продуктов. Пример А 1. а) Получение соединения А 1 Метиллитий (0,0389 моль) добавляли по каплям при -78 С к раствору (5-бром-1,3-бензодиоксол-4 ил)-1,1-диметилэтилового эфира карбаминовой кислоты (0,0389 моль) в THF (150 мл) в атмосфере N2. Смесь перемешивали 15 мин. Бутиллитий (0,0778 моль) добавляли по каплям. Смесь перемешивали 30 мин. Раствор DMF (0,389 моль) в THF (50 мл) добавляли при -78 С. Смесь перемешивали 1 ч, выливали на лед при -78 С и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали с получением 16 г соединения А 1.(160 мл) и перемешивали при комнатной температуре 45 мин. Смесь охлаждали до 0 С и уксусную кислоту (4,35 мл) добавляли в течение 5 мин. NaBH(OAc)3 (75,5 ммоль) добавляли порциями и перемешивание при 0 С продолжали 30 мин. Смесь перемешивали при комнатной температуре 17 ч, приливали к насыщенному водному раствору NaHCO3 и экстрагировали два раза CH2Cl2. Объединенные органические слои сушили (Na2SO4) , фильтровали и растворитель выпаривали с получением 15 г (светлое масло) соединения А 2, которое использовали без очистки на следующей стадии. с) Получение соединения A3 Раствор неочищенного соединения А 2 (2,26 ммоль) в сухом CH2Cl2 (10 мл) охлаждали до 0 С. 1(Фенилметокси)карбонил]окси]-2,5-пирролидиндион (2,49 ммоль) добавляли по частям. Смесь перемешивали 30 мин при 0 С, затем один час при комнатной температуре. Реакционную смесь распределили между CH2Cl2 и водой. Отделенный органический слой сушили (Na2SO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: EtOAc/гексан 1:1 до 2:1). Фракции продукта собирали и растворитель выпаривали с получением 0,900 г (81,8%, бесцветная пена) соединения A3. Аналитическая ВЭЖХ: способ 2 (см. раздел "Идентификация соединения", способ 2), Rt=4,68 При 0 С раствор соединения A3 (3,90 ммоль) в CH2Cl2 (7,5 мл) обрабатывали раствором HCl (4 М в диоксане) (37 мл). Смеси позволяли нагреться до комнатной температуры и перемешивали приблизительно 2 ч, затем выливали в смесь льда и воды. Эту смесь экстрагировали EtOAc. Органическую фазу отделяли, сушили (MgSO4), фильтровали и концентрировали с получением соединения А 4, которое использовали без какой-либо очистки на следующей стадии. е) Получение соединения А 5 Раствор неочищенного соединения А 4 (26,2 ммоль) в ацетонитриле (130 мл) обрабатывали 4-хлор-7 метокси-6-хиназолинолацетат (эфир) (26,2 ммоль). Смесь нагревали до 85 С 1,5 ч. Смесь охлаждали до комнатной температуры. Растворитель выпаривали, остаток сушили в вакууме (18 г зеленого масла и пены) и затем очищали колоночной флэш-хроматографией на силикагеле (элюент: CH2Cl2/CH3OH 100:1 до 95:5). Фракции продукта собирали, и растворитель выпаривали с получением 14,0 г (89%) соединения А 5. Аналитическая ВЭЖХ: способ 2, Rt = 3,71 (98%). APCI-MS: 603 (100, [М+Н]+).(0,83 ммоль) и нагревали 3 ч при 90-95 С. Остаток распределили между EtOAc и насыщенным водным раствором NaHCO3. Органический слой отделили, промыли водой с последующим промыванием насыщенным водным раствором NaCl, сушили (Na2SO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: EtOAc). Фракции продукта собирали и растворитель выпаривали с получением 0,041 г (40%, бесцветная пена) соединения А 6. Раствор неочищенного соединения А 6 (0,83 ммоль) в СН 3 ОН (5 мл) обрабатывали концентрированным водным HCl раствором (0,21 мл) и реакционную смесь нагревали до 60 С, 6 ч. Растворитель выпаривали. Остаток распределили между EtOAc и насыщенным водным раствором NaHCO3. Органический слой отделяли, промывали водой и насыщенным водным раствором NaCl, затем сушили (Na2SO4),фильтровали и растворитель выпаривали с получением 0,440 г (94%) соединения А 7.(0,00107 ммоль) в DMA (4 мл). Реакционную смесь распределили между EtOAc и лед/вода. Органический слой отделяли, промывали насыщенным водным NaCl раствором, сушили (Na2SO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной флэш-хроматографией на силикагеле (SI-60(230-400 MESH; элюент: гексан/EtOAc 100:1 до 0:100, затем CH2Cl2/СН 3 ОН 100:0 до 96:4. Фракции продукта собирали и растворитель выпаривали с получением 0,167 г соединения А 8. Аналитическая ВЭЖХ: способ 11, Rt = 3,66 (98%). APCI-MS: 543 (100, [М+Н]+) . Смесь соединения А 8 (0,21 ммоль) и 48% водного HBr раствора (2 мл) перемешивали 15 мин при 80 С. После добавления 2-пропанола (1 мл) перемешивание продолжали при 80 С 20 мин. Растворители выпаривали. Остаток распределили между EtOAc и насыщенным водным раствором NaHCO3, Органический слой отделяли, промывали насыщенным водным раствором NaCl, сушили (Na2SO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент:CH2Cl2/СН 3 ОН 100:0 до 95:5). Фракции продукта собирали и растворитель выпаривали с получением 0,042 г (48%, светлый порошок) соединения А 9. Аналитическая ВЭЖХ: способ 1, Rt = 2,94 (97%). APCI-MS: 409 (100, [М+Н]+) . Суспензию соединения А 9 (0,05 ммоль) в 2-пропаноле (2 мл) обрабатывали 48% водным HBr раствором (0,2 мл) и выпаривали. Остаток выпаривали два раза из 2-пропанола. Затем его суспендировали в смеси 2-пропанол/Et2O 1:1, фильтровали, сушили в вакууме с получением 0,027 г (42% в целом; светлое порошкообразное вещество) соединения А 10 в виде соли бромисто-водородной кислоты (2HBr). Аналитическая ВЭЖХ: способ 2, Rt = 2,70 (99%). APCI-MS: 409 (100, [М+Н]+).- 19014779 Смесь соединения А 9 (0,50 ммоль), формальдегида (0,030 г, 1,0 ммоль) и NaOCH3 (0,135 г,2,5 ммоль) обрабатывали СН 3 ОН (4 мл) и THF (2 мл). Раствор перемешивали 24 ч при комнатной температуре. NaBH4 (0,038 г, 1,0 ммоль) добавляли и перемешивание продолжали в течение 5 ч. Смесь распределяли между CH2Cl2 и насыщенным водным раствором NaHCO3. Органический слой отделили, сушили Смесь соединения A11 (0,62 ммоль), хлорид лития (6,16 ммоль), сульфида натрия (Na2S) нонагидрат (6,16 ммоль) в DMF (5 мл) нагревали в микроволновом устройстве до 150 С 2,5 ч. Реакционную смесь распределили между CH2Cl2 и насыщенным водным раствором NaHCO3 и водой. Отделенный органический слой сушили (Na2SO4) , фильтровали и растворитель выпаривали. Остаток очищали испарительной колоночной хроматографией на силикагеле (CH2Cl2/CH3OH 100:0 до 92:8). Фракции продукта собирали и растворитель выпаривали. Остаток (0,116 г, желтый порошок) суспендировали в Et2O, диспергировали с помощью ультразвука (например, в ультразвуковой ванне) в течение 10 мин, фильтровали и сушили в вакууме. Получали желтый порошок (0,090 г), который очищали колоночной флэшхроматографией на силикагеле (элюент: CH2Cl2/CH3OH 100:0 до 92:8). Фракции продукта собирали, растворитель выпаривали с получением 0,074 г (29,4%, желтое твердое вещество) соединения А 12. Т.пл.230 С, с разложением. Аналитическая ВЭЖХ: способ 1, время удерживания = 1,22 (99%). Смесь соединения А 12 (0,16 ммоль) и трифенилфосфина (0,24 ммоль) сушили (в вакууме) и обрабатывали THF (2 мл). Добавляли (2R)-оксиранметанол (0,17 ммоль). Медленно добавляли раствор бис(1 метилэтиловый) эфир диазендикарбоновой кислоты (0,17 ммоль) в THF (1,3 мл). Смесь перемешивали при комнатной температуре в течение 1,5 ч, затем добавляли дополнительное количество трифенилфосфина (0,24 ммоль), (2R)-оксиранметанола (0,00017 моль) и бис(1-метилэтилового) эфира диазендикарбоновой кислоты (0,17 моль). Перемешивание продолжали в течение 1,5 ч и растворители выпаривали. Остаток очищали испарительной колоночной хроматографией на силикагеле (элюент: CH2Cl2/СН 3 ОН от 100:0 до 95:5). Фракции продукта собирали и растворитель выпаривали с получением 0,094 г соединения А 13 (S-конфигурации). Пример А 2. а) Получение соединения А 14 К соединению А 1 (37,7 ммоль), растворенному в 1,2-дихлорэтане (160 мл), добавляли 2(метиламино)этанол (75,4 ммоль) и уксусную кислоту (17,5 ммоль). Раствор перемешивали при комнатной температуре 1 ч, затем охлаждали до 0 С. NaBH(OAc)3 (75,5 ммоль) добавляли по частям, дали реакционной смеси нагреться до комнатной температуры и перемешивание продолжали 18 ч. Смесь разделили между CH2Cl2 и насыщенным водным NaHCO3 раствором. Органический слой сушили (Na2SO4) и растворитель концентрировали в вакууме. Это дало белое твердое вещество, которое сушили в вакууме сCH2Cl2 (5 мл). Раствор перемешивали 1 ч при 0 С, затем в течение 1 ч при комнатной температуре. Растворители выпаривали и остаток обрабатывали Et2O (10 мл), диспергировали с помощью ультразвука 10 мин, перемешивали 30 мин и фильтровали. Твердое вещество сушили в вакууме с получением 460 мг(количественный выход, белый порошок) соединения А 15 в виде гидрохлоридной соли (2HCl). Аналитическая ВЭЖХ: способ 1, Rt=l,72 (96%). APCI-MS: 225 (100, [М+Н]+), 150 (100). с) Получение соединения А 16 В атмосфере инертного газа соединение А 15 (21,9 ммоль) и 4-хлор-7-метокси-6-хиназолинолацетат(сложный эфир) (22,0 ммоль) суспендировали в сухом ацетонитриле (170 мл) и кипятили с обратным холодильником 90 мин (через 60 мин появлялся прозрачный оранжевый раствор). Раствор охлаждали и выливали в смесь CH2Cl2 и насыщенного водного раствора NaHCO3. Органическую фазу отделяли, водную фазу экстрагировали CH2Cl2. Органические фазы промывали (насыщенным водным растворомNaHCO3), сушили (Na2SO4), фильтровали и концентрировали. Неочищенный продукт выпаривали изCH2Cl2 и обрабатывали смесью Et2O/гексан 1:1 (100 мл), диспергировали с помощью ультразвука и перемешивали, чтобы получить мелкодисперсное твердое вещество, которое фильтровали и сушили в вакууме с получением 9,6 г (99%) соединения А 16. Аналитическая ВЭЖХ: способ 1, Rt=2,76 (92%). APCI-MS: 441 (100, [М+Н]+). 32% водный HCl раствор (3 мл) медленно добавляли к суспензии соединения А 16 (4,54 ммоль) в СН 3 ОН (30 мл). Получившийся в результате коричневый раствор перемешивали 2,5 ч при 65 С. Смесь разделили между CH2Cl2 и насыщенным водным раствором NaHCO3. Органический слой сушили(Na2SO4), и растворитель удаляли концентрированием в вакууме с получением 1,62 г (89,5%, бесцветный порошок) соединения А 17. Аналитическая ВЭЖХ: способ 1, Rt=2,56 (95%). APCI-MS: 399 (100, [М+Н]+). е) Получение соединения А 18 Смесь соединения А 17 (4,84 ммоль) и K2CO3 (9,69 ммоль) сушили в вакууме один час, затем растворили в сухом DMF (37 мл) и перемешивали при комнатной температуре один час. 1,3-Дибромпропан(9,69 ммоль) добавляли по каплям в течение 5 мин и перемешивание смеси продолжали 15 ч. Смесь разделили на порции между EtOAc и полунасыщенным водным раствором NaHCO3. Органический слой сушили (Na2SO4) и растворитель удаляли концентрированием в вакууме. Полученный остаток распределяли между водой и насыщенным водным раствором NaCl. Органический слой сушили (Na2SO4) и растворитель удаляли концентрированием в вакууме, с последующей очисткой колоночной флэшхроматографией на силикагеле Si-60 (230-400 меш) (элюент: CH2Cl2/СН 3 ОН 97:3, затем CH2Cl2/СН 3 ОН 97:3 с 0,5% насыщенным водным раствором NH3 до CH2Cl2/CH3OH 95:5 с 0,5% насыщенным водным(6,2 ммоль) сушили в вакууме 15 мин и растворили в атмосфере инертного газа в сухом THF (20 мл).DIAD (6,0 ммоль) добавляли по каплям. Раствор перемешивали 2 ч при комнатной температуре. Образовался осадок. Растворители выпаривали и остаток очищали колоночной флэш-хроматографией на силикагеле (Si-60 (230-400 меш) (элюент: EtOAc, CH2Cl2/CH3OH 100:0 до 96:4. Фракции продукта собирали и растворитель выпаривали с получением 1,02 г (72,6%, желтая пена) соединения А 19. Аналитическая ВЭЖХ: способ 2, Rt=3,33 (79%). APCI-MS: 703/705 (100, [М+Н]+). Смесь Cs2CO3 (6,8 ммоль) и иодид тетрабутиламмония (2,8 ммоль) сушили в вакууме 15 мин и атмосфере инертного газа, обработали сухим ацетонитрилом (105 мл). Раствор соединения А 19 (1,4 ммоль) в ацетонитриле (20 мл) добавляли по каплям в течение 10 мин. Смесь перемешивали 15 ч и концентрировали. Концентрат разделили на порции между EtOAc и водой. Органический слой сушили (Na2SO4) и растворитель концентрировали в вакууме. Сырой продукт очищали колоночной флэш-хроматографией на силикагеле (Si-60 (230-400 меш) (элюент: CH2Cl2/CH3OH 100:0 до 95:5, чтобы получить продукт, попрежнему загрязненный некоторым количеством иодида тетрабутиламмония. Материал растворили вEtOAc и промыли дважды водой с получением 0,62 г (72,7%, светлый порошок) соединения А 20. Аналитическая ВЭЖХ: способ 2, Rt=3,32 (93%). APCI-MS: 623 (100, [М+Н]+) .(1,1 ммоль) добавляли и смесь перемешивали при комнатной температуре 15 ч. Концентрат разделили на порции между EtOAc и водой. Органический слой отделили, сушили (Na2SO4), фильтровали и концентрировали. В результате очистки колоночной флэш-хроматографией на силикагеле (Si-60 (230-400 меш)(ушир.с, 2 Н), 2,25 (с, NCH3), 1,80 (ушир.м, 3 Н). Образец соединения А 21 (0,16 ммоль) поместили в 2-пропанол (3 мл), обработанный приблизительно 0,2 мл 32% водным раствором HCl. Эту обработку повторили дважды. Затем остаток упаривали дважды из 2-пропанола (2 мл) и Et2O (2 мл). Затем его суспендировали в Et2O и фильтровали. Твердое вещество промывали (Et2O/гексан 1:1) и сушили в вакууме, чтобы получить 75 мг (86,2%) соединение А 22 в виде гидрохлоридной соли (3HCl). Аналитическая ВЭЖХ: способ 2, Rt=2,69 (100%). APCI-MS: 438 (100, [М+Н]+).(Na2S) (5,7 ммоль) обработали DMF (5 мл) и нагрели в микроволновом устройстве до 150 С в течение 15 мин. Остаток распределили между EtOAc, CH2Cl2 и насыщенным водным раствором NaHCO3. Отделенный органический слой сушили (Na2SO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: CH2Cl2/СН 3 ОН 100:0 до 90:10, затемCH2Cl2/СН 3 ОН 90:10 с 1% концентрированным водным раствором NH3). Фракции продукта собирали и растворитель выпаривали с получением 0,142 г (58%, желтое твердое вещество) соединения А 23. Раствор соединения 23 (1,44 ммоль) в обезвоженном THF (17 мл) обработали Et3N (1,58 ммоль). Выпал осадок. Добавили дополнительное количество THF (5 мл). Раствор Вос-ангидрид (1,58 ммоль) в сухом THF (8 мл) добавляли по каплям при 0 С. Смесь перемешивали при 0 С в течение 30 мин, затем при комнатной температуре в течение 1 ч. Добавили дополнительное количество Вос-ангидрида (63 мг) и продолжали перемешивание в течение 1 ч. Концентрат распределили между EtOAc и насыщенным водным раствором NaHCO3. Органический слой сушили (Na2SO4) и растворитель удаляли концентрированием в вакууме. После очистки колоночной флэш-хроматографией на силикагеле (Si-60 (230-400 меш) Смесь соединения А 24 (0,15 ммоль) и трифенилфосфина (0,31 ммоль) сушили под вакуумом 30 мин. В атмосфере инертного газа добавляли сухой THF (3 мл) и 3-бром-1-пропанол (0,24 ммоль). По каплям добавляли DIAD (0,24 ммоль) в THF (1 мл). Раствор перемешивали при комнатной температуре 2 ч и растворитель выпаривали с получением соединения А 26. Соединение А 26 (0,124 ммоль) растворили в сухом ацетонитриле (4 мл). Добавляли 1 метилпиперазин (4,47 ммоль) и реакционную смесь перемешивали в течение ночи при температуре окружающей среды. Смесь обработали насыщенным водным раствором NaHCO3, затем экстрагировали дважды CHCl3. Органический слой промыли насыщенным водным раствором NaHCO3, сушили (Na2SO4),фильтровали и растворитель выпарили. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: CH2Cl2/СН 3 ОН 100:0 до 90:10 до CH2Cl2/(СН 3 ОН/1% NH3) 90:10). Фракции продукта собирали и растворитель выпаривали с получением 0,075 г (желтой пены; 91,5% выход за 2 стадии) соединения А 27. Соединение А 24 (0,115 ммоль) и трифенилфосфин (0,241 ммоль) объединили и сушили 30 мин, используя вакуумный насос. Добавили сухой THF (2 мл), с последующим добавлением 2-(2-метоксиэтокси) этанола (0,183 ммоль). По каплям добавляли DIAD (0,183 ммоль) в THF (1 мл). Полученный в результате реакционный раствор перемешивали при комнатной температуре 2 ч. Растворитель выпаривали. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: CH2Cl2/СН 3 ОН от 100:0 до 96:4) с получением 0,062 г (86%, в виде бежевой пены) соединения А 28. Пример А 4. а) Получение соединения А 29 Соединение А 26 (0,124 ммоль), 2-(метиламино)этанол (4,47 ммоль) и сухой ацетонитрил (4 мл) поместили в запаянную пробирку. Реакционную смесь нагрели до 60 С, затем перемешивали в течение ночи при 60 С. Реакционную смесь охладили, затем поместили в CHCl3 и дважды промыли насыщенным водным раствором NaHCO3. Отделенный органический слой сушили (Na2SO4), фильтровали и растворитель выпарили. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH от 100:0 до 90:10 до CH2Cl2/(СН 3 ОН/1% NH3) 90:10) с получением 0,069 г соединения А 29. Пример А 5. а) Получение соединения А 30(90,5 ммоль), соединение А 1 (30,1 ммоль) и NaBH(OAc)3 (60,3 ммоль) по частям. Реакционную смесь перемешивали в течение ночи при комнатной температуре, разбавили насыщенным водным растворомNaHCO3 и экстрагировали EtOAc. Объединенные экстракты органической фазы промыли дважды насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (элюент: гексан/EtOAc 2:1) с получением 9,5 г(86%) соединения А 30 (S-конфигурации) в виде белого твердого вещества. Аналитическая ВЭЖХ: способ 1, Rt=3,47 (100%). APCI-MS: 367 (100, [М+Н]+). К раствору соединение А 30 (8,22 ммоль) в безводном CH2Cl2 (30 мл) при 0 С добавляли HCl раствор (4 М в диоксане) (48 мл). Через 1,5 ч реакционную смесь концентрировали при пониженном давлении. Остаток перенесли в Et2O, фильтровали и промыли Et2O. Твердое вещество собирали и сушили в вакууме с получением 3,62 г (количественное количество, содержащее диоксан) соединения А 31 (Sконфигурации, светлый порошок) в виде гидрохлоридной соли (2HCl). Аналитическая ВЭЖХ: способ 1, Rt=3,02 (98%). с) Получение соединения А 32 Соединение А 31 (1,36 ммоль) и 6-ацетокси-4-хлор-7-метоксихиназолин (1,36 ммоль) сушили в вакууме 15 мин. Добавляли ацетонитрил (15 мл). Реакционную смесь кипятили с обратным холодильником 40 мин, затем позволяли остыть до комнатной температуры, разбавляли насыщенным водным растворомNaHCO3 и экстрагировали EtOAc. Объединенные экстракты органической фазы сушили (Na2SO4),фильтровали и концентрировали при пониженном давлении и очищали хроматографией на силикагеле(элюент: EtOAc). Фракции продукта собирали и растворитель выпаривали с получением 0,498 г (61%; в виде белой пены; S-конфигурации) соединения А 32. Аналитическая ВЭЖХ: cпособ 1, Rt=3,02 (95%). APCI-MS: 483 (100, [М+Н]+) . К раствору соединение А 32 (11,0 ммоль) в СН 3 ОН (55 мл) добавляли 32% HCl раствор (10,4 мл). Реакционную смесь перемешивали при 50 С 3 ч и затем концентрировали при пониженном давлении. Остаток перенесли в насыщенный водный раствор NaHCO3 и экстрагировали Et2O. Объединенные органические экстракты промыли водой, насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением 5,04 г (количественный выход; Sконфигурации) соединения А 33 в виде светлой пены, которую использовали без дальнейшей очистки. Аналитическая ВЭЖХ: cпособ 1, Rt=2,79 (99%). APCI-MS: 441 (100, [М+Н]+). е) Получение соединения A34 К раствору соединения А 33 (10,4 ммоль) в сухом DMF (95 мл) добавляли безводный K2CO3 (15,5 ммоль). Реакционную смесь перемешивали при комнатной температуре 15 мин. Затем добавляли третбутил-(3-бромпропил)карбамат (11,4 ммоль). Затем реакционную смесь перемешивали при 50 С. Через 6 ч добавляли дополнительно трет-бутил-(3-бромпропил)карбамат (0,5 г, 2,10 ммоль). Через 5 ч смесь отфильтровывали. Остаток промывали EtOAc. Фильтрат промывали водой, солевым раствором, сушили над Na2SO4, фильтровали, концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле (элюент: CH2Cl2/СН 3 ОН от 100:0 до 95:5) с получением 4,549 г (80%; Sконфигурации) соединения А 34 в виде бесцветной пены. Аналитическая ВЭЖХ: способ 1, Rt=3,41 (100%). APCI-MS: 599 (100, [М+Н]+). К раствору соединения А 34 (300 мг, 0,50 ммоль) в безводном CH2Cl2 (10 мл) при 0 С добавляли трифторуксусную кислоту (10 мл, 0,13 ммоль). Через 1 ч реакционную смесь концентрировали при пониженном давлении. Остаточное количество трифторуксусной кислоты удаляли выпариванием с CH2Cl2. Остаток перенесли в воду, доведенную до щелочного значения рН 8-9 добавлением насыщенного водно- 25014779 го раствора NaHCO3, экстрагировали несколько раз EtOAc, затем CH2Cl2. Объединенные экстракты органической фазы сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением 0,293 г (количественный выход; S-конфигурация, использованный на следующей стадии без дальнейшей очистки) соединения A35. Аналитическая ВЭЖХ: способ 1, Rt=2,69 (97%). APCI-MS: 498 (100, [М+Н]+). Соединение А 35 в виде соли трифторуксусной кислоты (1,67 ммоль) растворили в смеси СН 3 ОН (15 мл) и воды (1,5 мл). Раствор охладили до 0 С. Безводный раствор гидроксида лития (1,0 М) (17 ммоль) добавляли и смеси давали нагреться до комнатной температуры при перемешивании. Реакционную смесь перемешивали 26 ч, затем концентрировали до половины первоначального объема и добавляли несколько капель NaH3PO4 до рН 8. Слои разделили. Водную фазу экстрагировали CH2Cl2/CH3OH 95/5 (16100 мл). Объединенные экстракты органической фазы сушили (Na2SO4), фильтровали и растворитель выпаривали с получением 0,950 г (количественный выход; S-конфигурации, использованный на следующей стадии без дальнейшей очистки) соединения A36. Аналитическая ВЭЖХ: способ 1, Rt=2,64 (100%). APCI-MS: 484 (100, [М+Н]+) . К раствору неочищенного соединения А 36 (0,21 ммоль) в безводном DMF (20 мл) добавляли раствор HBTU (0,62 ммоль) и DIPEA (1,05 ммоль) в безводной DMF (20 мл) в течение 5,5 ч через насос посредством впрыскивания. Затем реакционную смесь дополнительно перемешивали 10 ч и концентрировали при пониженном давлении. Остаток перенесли в СН 3 ОН и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали хроматографией на силикагеле (CHCl3/СН 3 ОН 100:0 до 99:1) с получением 47 мг (49%; S-конфигурация) соединения А 37. Аналитическая ВЭЖХ: Способ 1, Rt=2,90 (100%). APCI-MS: 466 (100, [М+Н]+). 1 Н-ЯМР (CDCl3): d 8,58 (с, 1 Н), 7,17 (с, 1 Н), 7,14 (ушир.с, 1 Н), 6,78 (ушир.с, 1 Н), 6,69 (д, J=7,8 Гц, 1 Н), 6,61 (д, J=7,8 Гц, 1 Н),5,97 (д, J=3,3 Гц, 2 Н), 4,33 (ушир.с, 2 Н), 3,94 (с, ОСН 3), 3,67 (ушир.с, 2 Н), 3,47 (ушир.с, 3 Н), 2,18 (с,NCH3), 2,09 (м, 2 Н), 1,25 (д, J=6,6 Гц, 3 Н). Соединение А 37 преобразовывали в соль HCl обработкой 2-пропанолом (8 мл) и концентрированным водным раствором HCl (0,1 мл) с получением 36 мг соединения А 38 (S-конфигурация) в виде гидрохлоридной соли (2HCl). Аналитическая ВЭЖХ: способ 1, Rt=2,87 (100%). APCI-MS: 466 (100, [М+Н]+). В пробирку ввели сульфид натрия (Na2S) нонагидрат (2,68 ммоль), соединение А 37 (0,27 ммоль),хлорид лития (2,67 ммоль) и безводный DMF (2,2 мл). Затем пробирку запаяли, установили в микроволновом устройстве и перемешивали при 150 С в течение 15 мин. После охлаждения до комнатной температуры реакционную смесь развели насыщенным водным NaHCO3 раствором и экстрагировали EtOAc. Объединенные экстракты органической фазы сушили (Na2SO4), фильтровали, концентрировали при пониженном давлении и очищали хроматографией на силикагеле (элюент: CHCl3/гексаны/СН 3 ОН от 5:5:0 до 5:5:1) с получением 40 мг (33%; S-конфигурации) соединения А 39. Соединение А 39 (35 мг) преобразовывали в HCl соль обработкой 2-пропанолом и концентрированным водным HCl раствором (0,1 мл) с получением 33 мг (S-конфигурации) соединения А 40 в виде гид- 26014779 рохлоридной соли (2HCl). Аналитическая ВЭЖХ: способ 1, Rt=2,78 (100%). APCI-MS: 452 (100, [М+Н]+) . Смесь соединения A39 (0,22 ммоль) и трифенилфосфина (0,46 ммоль) сушили в вакууме 30 мин и растворили в сухом THF (2 мл). Добавляли 3-бром-1-пропанол (31 мл, 0,35 ммоль). Медленно добавляли раствор DIPEA (0,35 ммоль) в THF (2 мл). Смесь перемешивали 2 ч при комнатной температуре и растворитель выпаривали. Остаток фильтровали через силикагель (элюент: CH2Cl2/CH3OH от 100:0 до 93:7). Фракции продукта собирали и растворитель выпаривали с получением соединения А 41 (S-конфигурация) в виде неочищенного соединения, которое использовали без какой-либо дальнейшей очистки. К суспензии неочищенного соединения А 41 (0,22 ммоль) в безводном сухом ацетонитриле (7 мл) добавляли морфолин (7,29 ммоль). Реакционную смесь перемешивали при комнатной температуре 89 ч,затем разводили насыщенным водным NaHCO3 и экстрагировали EtOAc. Объединенные экстракты органической фазы сушили (Na2SO4), фильтровали, концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (элюент: CH2Cl2/СН 3 ОН 10:0 до 9:1). Фракции продукта собирали и растворитель выпаривали с получением 0,015 г (90% за две стадии; S-конфигурация, грязно-белая пена) соединения А 42. Аналитическая ВЭЖХ: способ 1, Rt=2,60 (96%). APCI-MS: 579 (100, [М+Н]+). Пример А 6. а) Получение соединения А 43 Соединение A39 (0,177 ммоль) и трифенилфосфин (0,372 ммоль) объединили, затем сушили, используя вакуумный насос. В атмосфере инертного газа добавили сухой THF (2 мл). Суспензию перемешивали. Добавили 2-(2-метоксиэтокси)этанол (0,283 ммоль). По каплям добавляли раствор DIPEA (0,283 ммоль) в сухом THF (1 мл). Полученный в результате реакционный раствор перемешивали 2,5 ч при комнатной температуре. Растворитель выпарили, затем сушили в вакууме один час. Остаток (0,300 мг) очищали колоночной флэш-хроматографией на силикагеле (элюент: CH2Cl2/СН 3 ОН 100:0, через 99:1,98:2, 97:3 до 95:5). Фракции продукта собирали и растворитель выпаривали с получением 0,074 г (76%; К суспензии безводного AlCl3 (9,45 ммоль) в безводном, сухом CH2Cl2 (5 мл) добавляли по каплям 5-бром-4-гидрокси-3-метокси-2-нитробензальдегид (3,62 ммоль). Реакционную смесь охлаждали до 0 С и по каплям добавляли пиридин (15,9 ммоль). Затем реакционной смеси дали нагреться до комнатной температуры, перемешивали в течение ночи, перелили в смесь воды и концентрированной водной раствор HCl (3,9 мл), перемешивали при 55 С один час и снова охладили до 0 С. Осадок фильтровали, промыли водой, собрали и сушили в вакууме с получением 0,755 г (79%; в виде желтого порошка) соединения А 44. Аналитическая ВЭЖХ: способ 2, Rt=3,56 (98%). 1 Н-ЯМР (ДМСО-d6): около 10,0 (очень уш.с, ОН),9,68 (с, СНО), 7,80 (с, 1 Н). К раствору соединения А 44 в безводном DMF (10 мл) добавляли дийодометан (3,81 ммоль). Гидрид натрия (55% в минеральном масле, 460 ммоль) добавляли по каплям. Реакционную смесь нагревали до 80 С и перемешивали в течение ночи. После охлаждения до комнатной температуры реакционную смесь разводили водным 1 М HCl раствором и экстрагировали EtOAc. Объединенные экстракты органической фазы сушили (Na2SO4), фильтровали, концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (элюент: EtOAc/гексаны 0:100 до 30:70). Фракции продукта собирали и растворитель выпаривали с получением 0,097 г (19% в виде оранжевого порошка) соединения А 45. Аналитическая ВЭЖХ: Способ 10, Rt=3,35 (90%). APCI-MS: 273/275 (100, [М+Н]+). 1H-ЯМР 5-Амино-1-пентанол (2,81 ммоль) добавляли к раствору соединения А 45 (1,36 ммоль) в 1,2 дихлорэтане (14,4 мл). Смесь перемешивали в течение 15 мин и охлаждали до 0 С. Добавляли одной порцией ледяную уксусную кислоту (2,8 ммоль) и по частям добавляли NaBH(OAc)3. Смесь перемешивали при комнатной температуре 6 ч. Остаток распределили между CH2Cl2 и насыщенным водным растворомNaHCO3. Органический слой отделили, промыли насыщенным водным раствором NaHCO3, сушили(Na2SO4), фильтровали и выпарили при пониженном давлении с получением 0,490 г (количественный выход, который использовали на следующей стадии реакции без дальнейшей очистки) соединения А 46. К раствору неочищенного амина соединения А 46 (1,36 ммоль) в безводном CH2Cl2 (19 мл) при 0 С добавляли по частям 1-(фенилметокси)карбонил]окси]-2,5-пирролидиндион (1,88 ммоль). Реакционной смеси дали нагреться до комнатной температуры, перемешивали 4 ч, развели CH2Cl2, промыли водой,сушили (Na2SO4), фильтровали, концентрировали при пониженном давлении. Сырой продукт очищали хроматографией на силикагеле (элюент: EtOAc/гексаны 1:1, затем 6:4). Фракции продукта собирали и растворитель выпаривали с получением 0,500 г (74%) соединения А 47. Аналитическая ВЭЖХ: способ 10, Rt=4,49 (96%). APCI-MS: 495/497 (100, [М+Н]+). е) Получение соединения А 48 Раствор соединения А 47 (0,1 ммоль) в THF (1,4 мл, содержащий 0,1 моль эквивалента Et3N) гидрировали 2 ч в присутствии раствора тиофена (4% в DIPE, 0,005 мл), оксида ванадия(V) (5,7 мг) и Pt/C (5%)(50 мг). Затем реакционную смесь фильтровали через целит. Остаток на фильтре промывали CH2Cl2. Фильтрат концентрировали при пониженном давлении с получением 0,045 г (97%, использовавшихся непосредственно без дальнейшей очистки) соединения А 48. К раствору соединения А 48 (1,05 ммоль) в 2-пропаноле (10,7 мл) добавляли 4-хлор-7-метокси-6 хиназолинол ацетата (эфир) (1,26 ммоль). Реакционную смесь нагревали с обратным холодильником. Через 3 и 4 ч добавили дополнительное количество 4-хлор-7-метокси-6-хиназолинол ацетата (эфир) (53 мг и 80 мг соответственно). Через 5 ч смеси дали охладиться до комнатной температуры и концентрировали при пониженном давлении. Сырой продукт очищали хроматографией на силикагеле (элюент:CH2Cl2/СН 3 ОН от 100:0 до 98:2). Фракции продукта собирали и растворитель выпаривали с получением 0,492 г (69%) соединения А 49. Аналитическая ВЭЖХ: способ 10, Rt=3,56 (92%). APCI-MS: 681/683 (100, [М+Н]+). К раствору соединения А 49 (0,44 ммоль) в безводном DMA (4 мл) добавляли метансульфонилхлорид (2,46 ммоль). Реакционную смесь поместили в предварительно нагретую масляную баню при 95 С и перемешивали 3,5 ч. После охлаждения до температуры окружающей среды реакционную смесь разбавили EtOAc, промыли насыщенным водным раствором NaHCO3, водой, солевым раствором, сушили(Na2SO4), фильтровали и концентрировали при пониженном давлении с получением 0,319 г (количественный выход, который использовали непосредственно на следующей стадии) соединения А 50. К раствору неочищенного соединения А 50 (0,44 ммоль) в CH3OH (2 мл) добавляли 32% HCl раствор (0,84 ммоль; 0,083 мл). Реакционную смесь перемешивали при 50 С в течение 6,5 ч и комнатной температуре в течение ночи. Растворитель выпарили при пониженном давлении. Остаток объединили с насыщенным водным раствором NaHCO3 и экстрагировали EtOAc. Объединенные органические экстракты промыли водой и солевым раствором, затем сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением 0,283 г (98% выход, который использовали непосредственно на следующей стадии) соединения А 51. Аналитическая ВЭЖХ: способ 1, Rt=4,48 (93%). APCI-MS: 657/659/661 (100, [М+Н]+).(4,2 мл). Затем реакционную смесь перемешивали при 65 С в течение 12 ч, дали охладиться до комнат- 29
МПК / Метки
МПК: A61P 35/00, C07D 498/14, A61K 31/519
Метки: производные, хиназолина, качестве
Код ссылки
<a href="https://eas.patents.su/30-14779-proizvodnye-hinazolina-v-kachestve-mtki.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хиназолина в качестве mtki</a>
Предыдущий патент: Комбинированное лечение вич-инфекций
Следующий патент: Офтальмическая композиция
Случайный патент: Ингибиторы mapk/erk-киназ












