Производные трициклических n-гетероарилкарбоксамидов, содержащих группу бензимидазола, их получение и применение в терапии
Номер патента: 14450
Опубликовано: 30.12.2010
Авторы: Эванно Янник, Дюбуа Лоран, Ракотоарисоа Натали, Жилль Катрин, Эвен Люк, Маланда Андре, Машник Давид
Формула / Реферат
1. Соединение, соответствующее общей формуле (I)
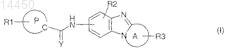
где А вместе со связью C-N бензимидазола, с которой он сконденсирован, представляет собой моноциклический гетероцикл или моноциклический гетероарил, имеющий от 4 до 7 членов и содержащий от одного до трех гетероатомов, выбранных из О, S или N, включая атом азота бензимидазола;
Р представляет собой 8-, 9-, 10- или 11-членный бициклический гетероцикл или бициклический гетероарил, содержащий от 1 до 6 гетероатомов, выбранных из N, О и S; причем Р связан с группой -C(Y)- по атому углерода;
при условии, что в случае, когда А представляет собой 7-членный насыщенный гетероцикл, Р отличается от 2,3-дигидро-1,4-бензодиоксана, 1-бензопиран-2-она и изоиндола;
R1 представляет собой от одного до четырех атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена, групп оксо, тио, C1-С6-алкила, С3-С7-циклоалкила, С3-С7-циклоалкил-С1-С3-алкилена, С1-С6-фторалкила, арилокси-С1-С6-алкила, гетероарилокси-С1-С6-алкила, арил-C1-С3-алкиленокси-С1-С6-алкила, гетероарил-C1-С3-алкиленокси-C1-С6-алкила, арилтио-С1-С6-алкила, гетероарилтио-С1-С6-алкила, арил-С1-С3-алкилентио-С1-С6-алкила, гетероарил-С1-С3-алкилентио-С1-С6-алкила, C1-С6-алкокси, С3-С7-циклоалкилокси, С3-С7-циклоалкил-С1-С3-алкиленокси, C1-С6-фторалкокси, циано, C(O)NR4R5, нитро, NR4R5, C1-С6-тиоалкила, С3-С7-циклоалкилтио, С3-С7-циклоалкил-С1-С3-алкилентио, -S(О)-C1-С6-алкила, -S(О)-С3-С7-циклоалкила, -S(О)-С1-С3-алкилен-С3-С7-циклоалкила, С1-С6-алкил-S(О)2-, C1-С6-фторалкил-S(O)2-, С3-С7-циклоалкил-S(О)2-, С3-С7-циклоалкил-С1-С3-алкилен-S(O)2-, SO2NR4R5, SF5, NR6C(O)R7, NR6SO2R8, R4R5NC(О)-C1-С3-алкилена, арила, гетероарила, арил-С1-С5-алкилена, гетероарил-C1-С5-алкилена, арилокси, арилтио, гетероарилокси или гетероарилтио;
причем указанные гетероарилы или арилы R1 необязательно замещены одним или несколькими заместителями R9, являющимися одинаковыми или различными;
при условии, что в случае, когда R1 присоединен к атому азота группы Р, R1 отличается от атома галогена, оксо, тио, циано, нитро, SF5, NR4R5, C1-С6-тиоалкила, тиоарила, тиогетероарила, С1-С6-алкокси, арилокси, гетероарилокси, -NR6COR7 и NR6SO2R8;
Y представляет собой атом кислорода или серы;
R2 представляет собой атома водорода, атом галогена, C1-С6-алкил, С3-С7-циклоалкил, С3-С7-циклоалкил-С1-С3-алкилен, C1-С6-фторалкил или С1-С6-алкокси;
R3 представляет собой от одного до трех атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена, C1-С6-алкила, С3-С7-циклоалкила, С3-С7-циклоалкил-С1-С3-алкилена, C1-С6-фторалкила, гидроксила, С1-С6-алкокси, С3-С7-циклоалкилокси, С3-С7-циклоалкил-С1-С3-алкиленокси, в случае, когда R3 присоединен к атому углерода; или
R3 представляет собой от одного до двух атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена, C1-С6-алкила, С3-С7-циклоалкила, С3-С7-циклоалкил-С1-С3-алкилена, С1-С6-фторалкила, арил-С(О)-, С1-С6-алкил-С(О)-, С3-С7-циклоалкил-С(О)-, С3-С7-циклоалкил-С1-С3-алкилен-С(О)-, C1-С6-фторалкил-С(О)-, арил-S(О)2-, С1-С6-алкил-S(O)2-, С1-С6-фторалкил-S(О)2-, С3-С7-циклоалкил-S(О)2-, С3-С7-циклоалкил-С1-С3-алкилен-S(О)2-, С1-С6-алкил-О-С(О)-, арил-C1-С3-алкил-О-С(О)-, С3-С7-циклоалкил-O-C(О)-, С3-С7-циклоалкил-С1-С3-алкилен-О-С(О)-, C1-С6-фторалкил-О-С(О)-, арил-О-С(О)-, гетероарил-О-С(О)-, в случае, когда R3присоединен к атому азота;
R4 и R5представляют собой независимо друг от друга атом водорода или C1-С6-алкил, С3-С7-циклоалкил, С3-С7-циклоалкил-С1-С3-алкилен, арил-С1-С5-алкилен или арил; или
R4 и R5вместе с атомом азота, к которому они присоединены, образуют азетидин, пирролидин, пиперидин, азепин, морфолин, тиоморфолин, пиперазин, гомопиперазин, причем группа NR4R5 необязательно замещена С1-С6-алкилом, С3-С7-циклоалкилом, С3-С7-циклоалкил-С1-С3-алкиленом, арил-С1-С6-алкиленом, арилом, гетероарилом, арил-S(O)2-, С1-С6-алкил-S(О)2-, С1-С6-фторалкил-S(O)2-, С3-С7-циклоалкил-S(О)2-, С3-С7-циклоалкил-С1-С3-алкилен-S(O)2-, арил-С(О)-, С1-С6-алкил-С(О)-, С3-С7-циклоалкил-С(О)-, С3-С7-циклоалкил-С1-С3-алкилен-С(О)-, С1-С6-фторалкил-С(О)-, гидроксилом, С1-С6-алкилокси, C1-С6-фторалкилом, арилокси-С1-С6-алкиленом, арилокси, гетероарилокси-С1-С6-алкиленом, гетероарилокси;
R6 и R7представляют собой независимо друг от друга атом водорода, С1-С6-алкил, С3-С7-циклоалкил, С3-С7-циклоалкил-С1-С3-алкилен, арил-С1-С6-алкилен или арил или
R6 и R7вместе образуют лактам, имеющий от 4 до 7 членов и содержащий атом азота и группу С(О), к которым они присоединены;
R8 представляет собой С1-С6-алкил, С3-С7-циклоалкил, С3-С7-циклоалкил-С1-С3-алкилен, арил-С1-С6-алкилен или арил или
R6 и R8вместе образуют сультам, имеющий от 4 до 7 членов и содержащий атом азота и группу S(O)2, к которым они присоединены;
R9 представляет собой атом галогена, C1-С6-алкил, С3-С7-циклоалкил, С3-С7-циклоалкил-С1-С3-алкилен, С1-С6-фторалкил, С1-С6-алкокси, С1-С6-фторалкокси, нитро, циано, NR4R5, R4R5N-C1-С3-алкилен, арил, гетероарил, арилокси, арилтио, гетероарилокси или гетероарилтио, причем указанные гетероарилы или арилы необязательно замещены одним или несколькими заместителями, выбранными из атома галогена, С1-С6-алкила, С3-С7-циклоалкила, С3-С7-циклоалкил-С1-С3-алкилена, С1-С6-фторалкила, С1-С6-алкокси, С1-С6-фторалкокси, нитро, циано, NR4R5, R4R5N-C1-С3-алкилена;
один или несколько атомов серы гетероцикла А могут находиться в окисленной форме (в виде S(О) или S(O)2);
один или несколько атомов азота могут находиться в окисленной форме (в виде N-оксида);
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата;
причем 2-(2-хлорфенил)-1,3-диоксо-N-(7,8,9,10-тетрагидро-6Н-азепино[1,2-а]бензимидазол-3-ил)изоиндолин-5-карбоксамид исключен.
2. Соединение по п.1, отличающееся тем, что оно соответствует общей формуле (II)
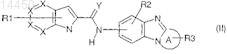
где X представляет собой атомы углерода или азота; причем группы X являются одинаковыми или различными и число групп X, представляющих собой N, не превышает 2;
R1, R2, R3, Y и А являются такими, как определено в общей формуле (I) по п.1, и R1 может быть связан с 6- или 5-членным бициклом;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
3. Соединение по п.1 или 2, отличающееся тем, что оно соответствует общей формуле (III)

где R1a представляет собой один или несколько атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена или С1-С6-алкила, C1-С6-фторалкила, C1-С6-алкокси, C1-С6-тиоалкила, С1-С6-алкил-S(О)2-, NR4R5, нитро;
R1b представляет собой атом водорода, С1-С6-алкил, гетероарилокси-С1-С6-алкил, арил-С1-С3-алкиленокси-С1-С6-алкил, R4R5NC(О)-C1-С3-алкилен, арил, гетероарил, арил-С1-С6-алкилен или гетероарил-С1-С6-алкилен;
причем указанные гетероарилы или арилы R1b необязательно замещены одним или несколькими заместителями R9, являющимися одинаковыми или различными;
R9 представляет собой атом галогена или C1-С6-алкил, C1-С6-алкокси, С1-С6-фторалкил, арил, гетероарил, NR4R5, арилтио, причем указанные гетероарилы или арилы необязательно замещены одним или несколькими заместителями, выбранными из атома галогена, С1-С6-алкила, С3-С7-циклоалкила, С3-С7-циклоалкил-С1-С3-алкилена, C1-С6-фторалкила, С1-С6-алкокси, C1-С6-фторалкокси, нитро, циано, R4R5N-С1-С3-алкилена;
R2, R3, R4, R5, А, X и Y являются такими, как определено в общей формуле (II) по п.2;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
4. Соединение по любому из пп.1-3, отличающееся тем, что оно соответствует общей формуле (IV)
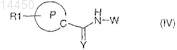
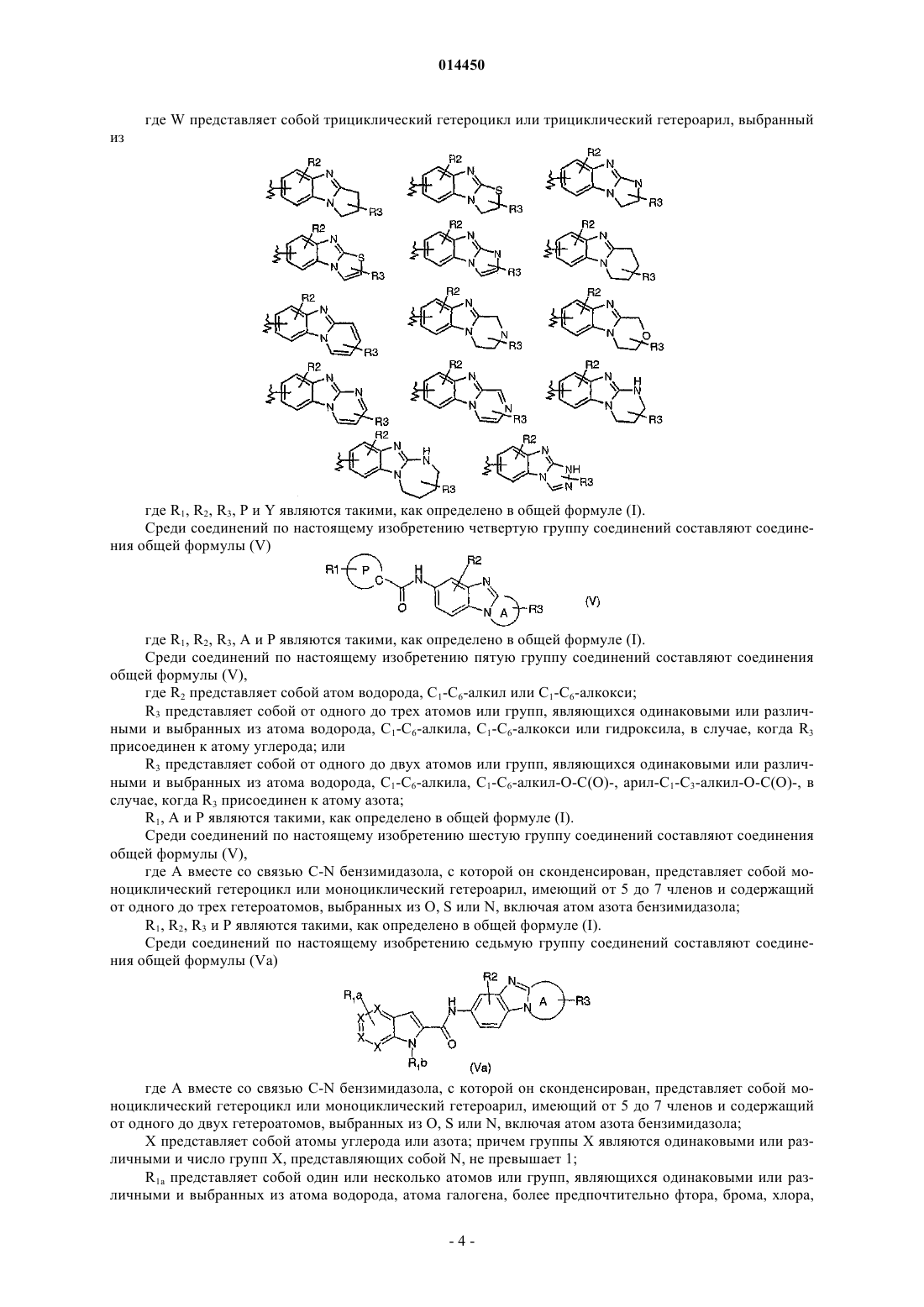
где W представляет собой трициклический гетероцикл или трициклический гетероарил, выбранный из

где R1, R2, R3, Р и Y являются такими, как определено в общей формуле (I) по п.1;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
5. Соединение по любому из пп.1-4, отличающееся тем, что оно соответствует общей формуле (V)
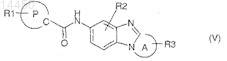
где R1, R2, R3, A и Р являются такими, как определено в общей формуле (I) по п.1;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
6. Соединение по любому из пп.1-5, отличающееся тем, что оно соответствует общей формуле (V)
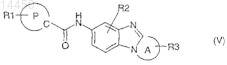
где R2представляет собой атом водорода, C1-С6-алкил или C1-С6-алкокси;
R3 представляет собой от одного до трех атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, C1-С6-алкила, С1-С6-алкокси или гидроксила, в случае, когда R3присоединен к атому углерода; или
R3 представляет собой от одного до двух атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, C1-С6-алкила, С1-С6-алкил-O-С(О)-, арил-С1-С3-алкил-О-С(О)-, в случае, когда R3 присоединен к атому азота;
R1, A и Р являются такими, как определено в общей формуле (I) по п.1;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
7. Соединение по любому из пп.1-6, отличающееся тем, что оно соответствует общей формуле (V)
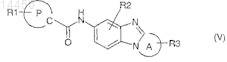
где А вместе со связью C-N бензимидазола, с которой он сконденсирован, представляет собой моноциклический гетероцикл или моноциклический гетероарил, имеющий от 5 до 7 членов и содержащий от одного до трех гетероатомов, выбранных из О, S или N, включая атом азота бензимидазола;
R1, R2, R3 и Р являются такими, как определено в общей формуле (I) по п.1;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
8. Соединение по любому из пп.1-7, отличающееся тем, что оно соответствует общей формуле (Va)
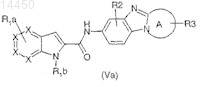
где А вместе со связью C-N бензимидазола, с которой он сконденсирован, представляет собой моноциклический гетероцикл или моноциклический гетероарил, имеющий от 5 до 7 членов и содержащий от одного до двух гетероатомов, выбранных из О, S или N, включая атом азота бензимидазола;
X представляет собой атомы углерода или азота; причем группы X являются одинаковыми или различными и число групп X, представляющих собой N, не превышает 1;
R1a представляет собой один или несколько атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена или C1-С6-алкила, C1-С6-фторалкила, C1-С6-алкокси, C1-С6-тиоалкила, C1-С6-алкил-S(О)2-, NR4R5, нитро;
R1b представляет собой атом водорода, C1-С6-алкил, гетероарилокси-С1-С6-алкил, арил-С1-С3-алкиленокси-С1-С6-алкил, R4R5NC(О)-C1-С3-алкилен, арил, гетероарил, арил-С1-С6-алкилен или гетероарил-С1-С6-алкилен;
причем указанные гетероарилы или арилы R1b необязательно замещены одним или несколькими заместителями R9, являющимися одинаковыми или различными;
R2 представляет собой атом водорода;
R3 представляет собой атом или группу, выбранные из атома водорода, C1-С6-алкила, C1-С6-алкокси или гидроксила, в случае, когда R3 присоединен к атому углерода;
или R3представляет собой атом или группу, выбранные из атома водорода, С1-С6-алкила, C1-С6-алкил-О-С(О)-, в случае, когда R3 присоединен к атому азота;
R4 и R5представляют собой независимо друг от друга С1-С6-алкил;
или R4и R5 вместе с атомом азота, к которому они присоединены, образуют пирролидин или морфолин;
R9 представляет собой атом галогена или С1-С6-алкил, С1-С6-алкокси, C1-С6-фторалкил, арил, гетероарил, NR4R5, арилтио, причем указанные арилы необязательно замещены одним или несколькими C1-С6-алкилами;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
9. Соединение по любому из пп.1-8, отличающееся тем, что оно соответствует общей формуле (I), где одновременно R1, и/или R2, и/или R3, и/или А, и/или Р, и/или Y являются такими, как определено в пп.1-8;
в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата.
10. Способ получения соединения формулы (I) по любому из пп.1-9, отличающийся тем, что соединение общей формулы (VI)
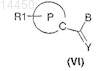
где Р, R1и Y являются такими, как определено в общей формуле (I) по п.1, и В представляет собой C1-С6-алкокси, С3-С7-циклоалкилокси, С3-С7-циклоалкил-С1-С3-алкиленокси, арил-C1-С3-алкиленокси, при кипячении с обратным холодильником в растворителе подвергают взаимодействию с амидом соединения общей формулы (VII)
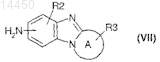
где A, R2и R3 являются такими, как определено в общей формуле (I) по п.1, причем амид соединения общей формулы (VII) предварительно получают воздействием триметилалюминия на амины общей формулы (VII).
11. Способ получения соединения формулы (I) по любому из пп.1-9, отличающийся тем, что соединение общей формулы (VI)

где Р, R1и Y являются такими, как определено в общей формуле (I) по п.1, и В представляет собой гидроксил, преобразовывают в хлорангидрид воздействием тионилхлорида при кипячении с обратным холодильником в растворителе, затем полученное соединение общей формулы (VI), где Р, R1 и Y являются такими, как определено в общей формуле (I) по п.1, и В представляет собой атом хлора, подвергают взаимодействию в присутствии основания с соединением общей формулы (VII)
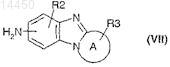
где A, R2и R3 являются такими, как определено в общей формуле (I) по п.1;
или в присутствии агента сочетания и основания в растворителе проводят реакцию сочетания между соединением общей формулы (VI), где Р, R1и Y являются такими, как определено в общей формуле (I) по п.1, и В представляет собой гидроксил, и соединением общей формулы (VII), где A, R2и R3 являются такими, как определено в общей формуле (I) по п.1.
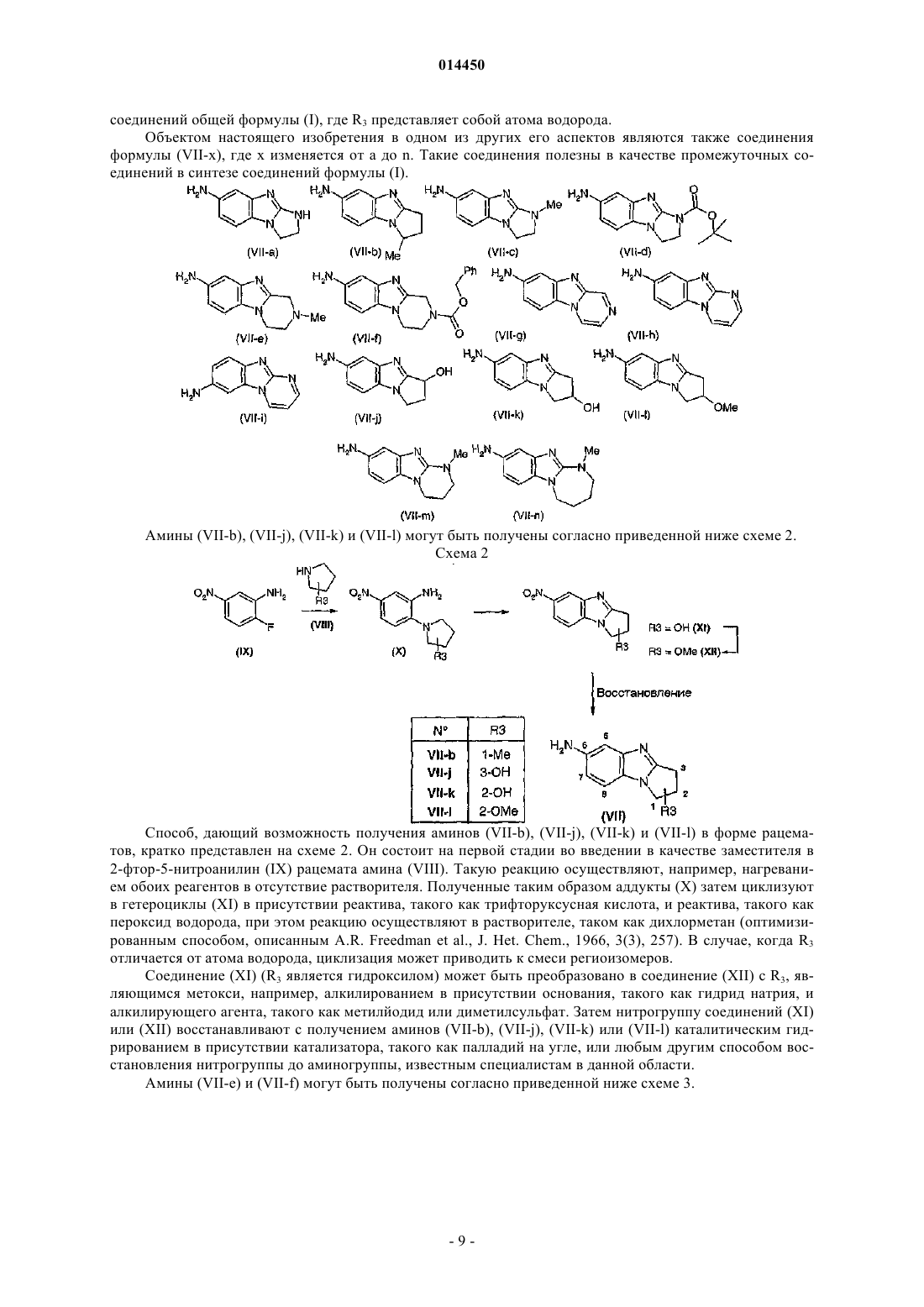
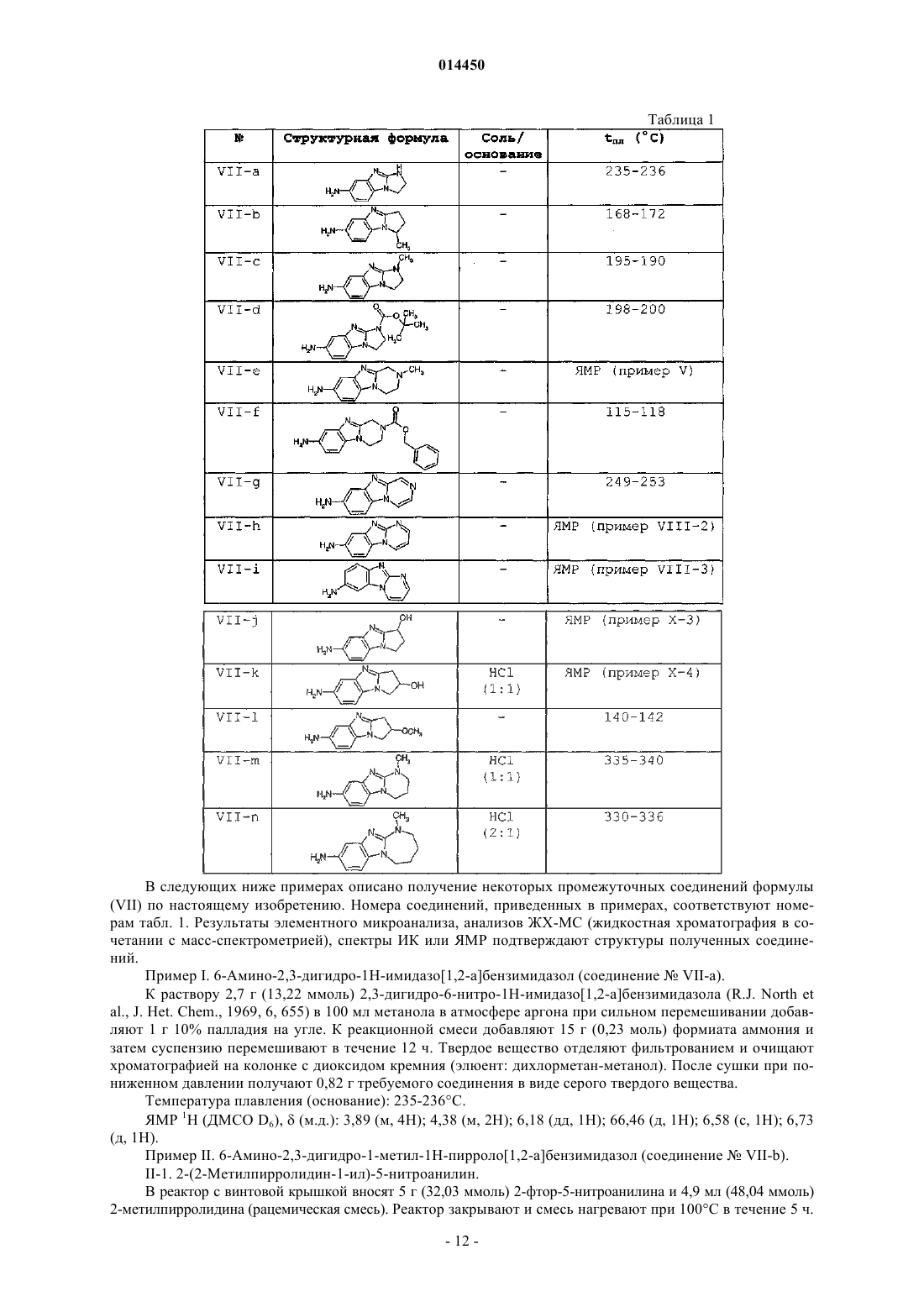
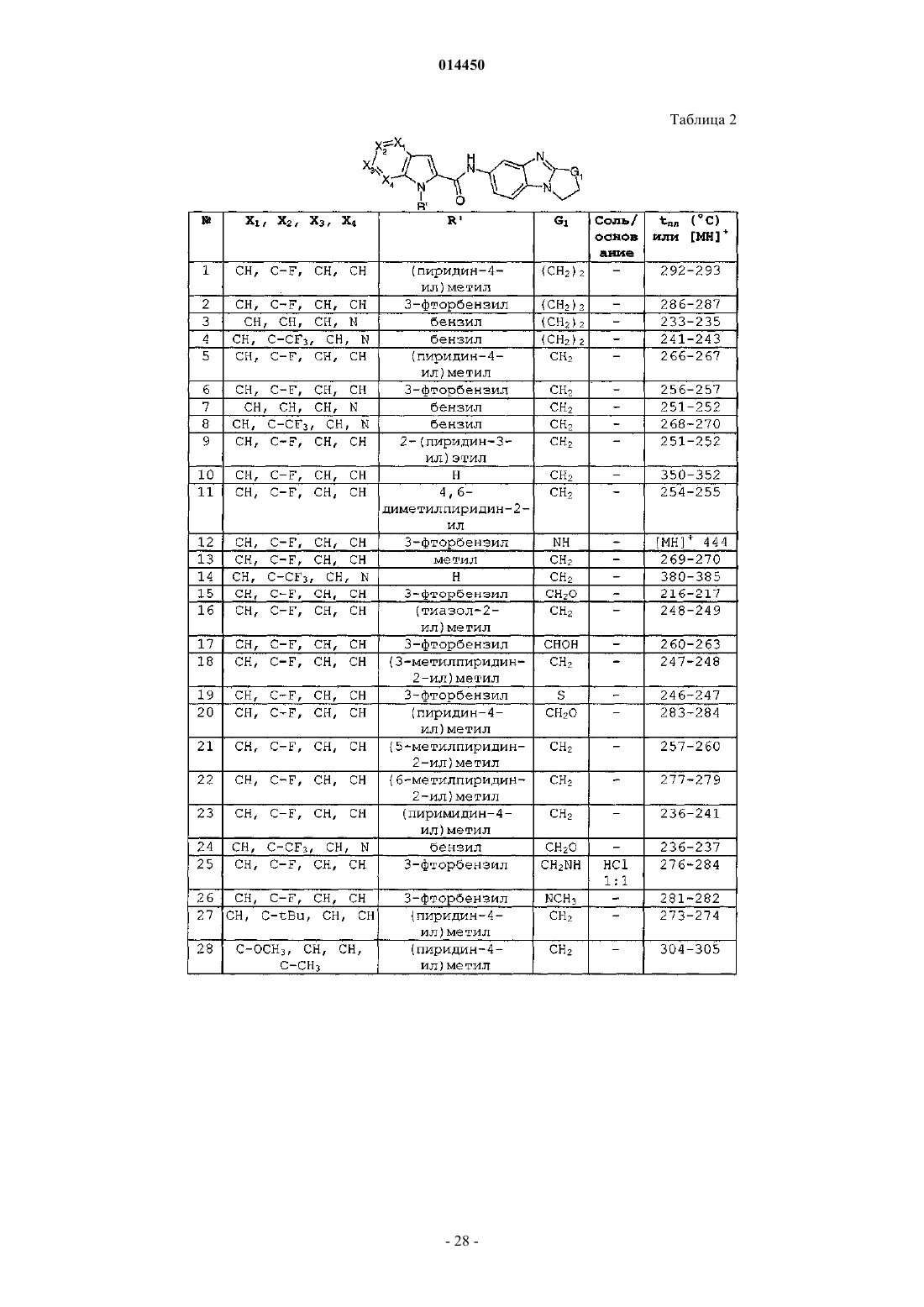
12. Соединение общей формулы (VII-a), (VII-b), (VII-c), (VII-d), (VII-e), (VII-f), (VII-g), (VII-h), (VII-i), (VII-j), (VII-k), (VII-l), (VII-m), (VII-n)
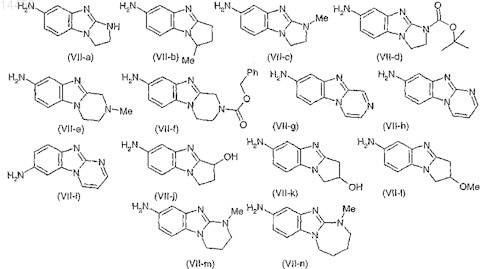
13. Лекарственное средство, отличающееся тем, что содержит по меньшей мере одно соединение формулы (I) по любому из пп.1-9 или аддитивную соль данного соединения с фармацевтически приемлемой кислотой или гидрат или сольват соединения формулы (I).
14. Фармацевтическая композиция, отличающаяся тем, что содержит по меньшей мере одно соединение формулы (I) по любому из пп.1-9 или фармацевтически приемлемую соль, гидрат или сольват такого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
15. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства, предназначенного для профилактики и лечения патологий, в которые вовлечены рецепторы типа TRPV1.
16. Применение соединения формулы (I) по любому из пп.1-9 для получения лекарственного средства, предназначенного для профилактики или лечения боли, воспаления, метаболических нарушений, урологических нарушений, гинекологических нарушений, желудочно-кишечных нарушений, респираторных нарушений, псориаза, зуда, раздражений кожи, глаз или слизистых оболочек, герпеса, опоясывающего лишая, рассеянного склероза и депрессии.
Текст
Изобретение относится к производным трициклических N-гетероарилкарбоксамидов,содержащих группу бензимидазола, общей формулы (I), где А вместе со связью C-N бензимидазола, с которой он сконденсирован, представляет собой моноциклический гетероцикл или моноциклический гетероарил, имеющий от 4 до 7 членов и содержащий от одного до трех гетероатомов, выбранных из О, S или N, включая атом азота бензимидазола; Р представляет собой 8-, 9-, 10- или 11-членный бициклический гетероцикл или бициклический гетероарил,содержащий от 1 до 6 гетероатомов, выбранных из N, О и S; R1 представляет собой от одного до четырех атомов или групп, являющихся одинаковыми или различными; Y представляет собой атом кислорода или серы; R2 представляет собой атом водорода, атом галогена, С 1-С 6-алкил, С 3 С 7-циклоалкил, С 3-С 7-циклоалкил-С 1-С 3-алкилен, С 1-С 6-фторалкил или C1-С 6-алкокси; R3 представляет собой от одного до трех атомов или групп, являющихся одинаковыми или различными; в виде основания или кислотно-аддитивной соли, а также в виде гидрата или сольвата. Изобретение относится также к способу получения таких соединений и их применению в терапии. 014450 Изобретение относится к производным трициклических N-гетероарилкарбоксамидов, содержащих группу бензимидазола, их получению и применению в терапии. Объектом настоящего изобретения являются производные соединения трициклических N-гетероарилкарбоксамидов, содержащих группу бензимидазола, проявляющие in vitro и in vivo активность в качестве антагонистов или агонистов рецепторов типа TRPV1 (или VR1). Объектом настоящего изобретения являются соединения, соответствующие формуле (I) где А вместе со связью C-N бензимидазола, с которой он сконденсирован, представляет собой моноциклический гетероцикл или моноциклический гетероарил, имеющий от 4 до 7 членов и содержащий от одного до трех гетероатомов, выбранных из О, S или N, включая атом азота бензимидазола; Р представляет собой 8-, 9-, 10- или 11-членный бициклический гетероцикл или бициклический гетероарил, содержащий от 1 до 6 гетероатомов, выбранных из N, О и S; причем Р связан с группой -С(Y)по атому углерода; при условии, что в случае, когда А представляет собой 7-членный насыщенный гетероцикл, Р отличается от 2,3-дигидро-1,4-бензодиоксана, 1-бензопиран-2-она и изоиндола;R1 представляет собой от одного до четырех атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена, оксо, тио, C1-С 6-алкила, С 3-С 7-циклоалкила,С 3-С 7-циклоалкил-С 1-С 3-алкилена, С 1-С 6-фторалкила, арилокси-С 1-С 6-алкила, гетероарилокси-С 1-С 6 алкила, арил-C1-С 3-алкиленокси-С 1-С 6-алкила, гетероарил-С 1-С 3-алкиленокси-С 1-С 6-алкила, арилтио-С 1 С 6-алкила, гетероарилтио-С 1-С 6-алкила, арил-С 1-С 3-алкилентио-С 1-С 6-алкила, гетероарил-С 1-С 3-алкилентио-С 1-С 6-алкила, С 1-С 6-алкокси, С 3-С 7-циклоалкилокси, С 3-С 7-циклоалкил-С 1-С 3-алкиленокси, С 1-С 6 фторалкокси, циано, C(O)NR4R5, нитро, NR4R5, С 1-С 6-тиоалкила, С 3-С 7-циклоалкилтио, С 3-С 7-циклоалкил-С 1-С 3-алкилентио, -S(О)-С 1-С 6-алкила, -S(О)-С 3-С 7-циклоалкила, -S(О)-С 1-С 3-алкилен-С 3-С 7-циклоалкила, С 1-С 6-алкил-S(О)2-, С 1-С 6-фторалкил-S(O)2-, С 3-С 7-циклоалкил-S(О)2-, С 3-С 7-циклоалкил-С 1-С 3 алкилен-S(O)2-, SO2NR4R5, SF5, NR6C(O)R7, NR6SO2R8, R4R5NC(О)-С 1-С 3-алкилена, арила, гетероарила,арил-С 1-С 5-алкилена, гетероарил-С 1-С 5-алкилена, арилокси, арилтио, гетероарилокси или гетероарилтио; причем указанные гетероарилы или арилы R1 необязательно замещены одним или несколькими заместителями R9, являющимися одинаковыми или различными; при условии, что в случае, когда R1 присоединен к атому азота группы Р, R1 отличается от атома галогена, оксо, тио, циано, нитро, SF5, NR4R5, С 1-С 6-тиоалкила, тиоарила, тиогетероарила, С 1-С 6-алкокси,арилокси, гетероарилокси, -NR6COR7 и NR6SO2R8;Y представляет собой атом кислорода или серы;R2 представляет собой атома водорода, атом галогена, С 1-С 6-алкил, С 3-С 7-циклоалкил, С 3-С 7 циклоалкил-С 1-С 3-алкилен, С 1-С 6-фторалкил или С 1-С 6-алкокси;R3 представляет собой от одного до трех атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена, С 1-С 6-алкила, С 3-С 7-циклоалкила, С 3-С 7 циклоалкил-С 1-С 3-алкилена, С 1-С 6-фторалкила, гидроксила, С 1-С 6-алкокси, С 3-С 7-циклоалкилокси, С 3-С 7 циклоалкил-С 1-С 3-алкиленокси, в случае, когда R3 присоединен к атому углерода; или R3 представляет собой от одного до двух атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена, С 1-С 6-алкила, С 3-С 7-циклоалкила, С 3-С 7 циклоалкил-С 1-С 3-алкилена, С 1-С 6-фторалкила, арил-С(О)-, С 1-С 6-алкил-С(О)-, С 3-С 7-циклоалкил-С(О)-,С 3-С 7-циклоалкил-С 1-С 3-алкилен-С(О)-, С 1-С 6-фторалкил-С(О)-, арил-S(О)2-, С 1-С 6-алкил-S(O)2-, С 1-С 6 фторалкил-S(О)2-, С 3-С 7-циклоалкил-S(О)2-, С 3-С 7-циклоалкил-С 1-С 3-алкилен-S(О)2-, С 1-С 6-алкил-ОС(О)-, арил-С 1-С 3-алкил-О-С(О)-, С 3-С 7-циклоалкил-O-С(O)-, С 3-С 7-циклоалкил-С 1-С 3-алкилен-О-C(О)-,С 1-С 6-фторалкил-O-C(О)-, арил-О-C(О)-, гетероарил-О-C(О)-, в случае, когда R3 присоединен к атому азота;R4 и R5 представляют собой независимо друг от друга атом водорода или С 1-С 6-алкил, С 3-С 7 циклоалкил, С 3-С 7-циклоалкил-С 1-С 3-алкилен, арил-С 1-С 5-алкилен или арил илиR6 и R7 представляют собой независимо друг от друга атом водорода, С 1-С 6-алкил, С 3-С 7-циклоалкил, С 3-С 7-циклоалкил-С 1-С 3-алкилен, арил-С 1-С 6-алкилен или арил илиR6 и R7 вместе образуют лактам, имеющий от 4 до 7 членов и содержащий атом азота и группуR8 представляет собой С 1-С 6-алкил, С 3-С 7-циклоалкил, С 3-С 7-циклоалкил-С 1-С 3-алкилен, арил-С 1 С 6-алкилен или арил; или R6 и R8 вместе образуют сультам, имеющий от 4 до 7 членов и содержащий атом азота и группуR9 представляет собой атом галогена, С 1-С 6-алкил, С 3-С 7-циклоалкил, С 3-С 7-циклоалкил-С 1-С 3 алкилен, C1-С 6-фторалкил, C1-С 6-алкокси, С 1-С 6-фторалкокси, нитро, циано, NR4R5, R4R5N-C1-С 3 алкилен, арил, гетероарил, арилокси, арилтио, гетероарилокси или гетероарилтио, причем указанные гетероарилы или арилы необязательно замещены одним или несколькими заместителями, выбранными из атома галогена, C1-С 6-алкила, С 3-С 7-циклоалкила, С 3-С 7-циклоалкил-С 1-С 3-алкилена, C1-С 6-фторалкила,С 1-С 6-алкокси, C1-С 6-фторалкокси, нитро, циано, NR4R5, R4R5N-С 1-С 3-алкилена. В соединениях общей формулы (I) один или несколько атомов серы гетероцикла А могут находиться в окисленной форме (в виде S(О) или S(О)2); один или несколько атомов азота могут находиться в окисленной форме (в виде N-оксида). Соединения формулы (I) могут содержать один или несколько асимметричных атомов углерода. Они могут, таким образом, существовать в форме энантиомеров или диастереоизомеров. Такие энантиомеры, диастереоизомеры, а также их смеси, включая рацемические смеси, составляют часть настоящего изобретения. Соединения формулы (I) могут существовать в виде оснований или кислотно-аддитивных солей. Такие аддитивные соли составляют часть настоящего изобретения. Как данные соли, которые могут быть получены с фармацевтически приемлемыми кислотами, так и соли других кислот, например, используемых для очистки или выделения соединений формулы (I), в равной мере составляют часть настоящего изобретения. Соединения формулы (I) также могут существовать в виде гидратов или сольватов, а именно в виде ассоциатов или комбинаций с одной или несколькими молекулами воды или растворителя. Такие гидраты и сольваты также составляют часть настоящего изобретения. В описании настоящего изобретения атом галогена означает фтор, хлор, бром или йод;Ct-Cz означает углеродную цепь, которая может содержать от t до z атомов углерода, причем t и z могут принимать значения от 1 до 7; например C1-С 3 является углеродной цепью, которая может содержать от 1 до 3 атомов углерода; алкил означает алифатическую насыщенную линейную или разветвленную группу; в качестве примеров можно привести метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил и т.д.; алкилен означает насыщенную линейную или разветвленную двухвалентную группу, например C1 С 3-алкилен представляет собой линейную или разветвленную двухвалентную углеродную цепь, содержащую от 1 до 3 атомов углерода, в частности метилен, этилен, 1-метилэтилен, пропилен; циклоалкил означает циклический алкил. В качестве примеров можно привести циклопропил, циклобутил, циклопентил, циклогексил и т.д.; фторалкил означает алкил, в котором один или несколько атомов водорода заменены атомами фтора; алкокси означает -О-алкил, в котором алкил является таким, как определено выше; фторалкокси означает алкоксигруппу, в которой один или несколько атомов водорода заменены атомами фтора; тиоалкил или алкилтио означает -S-алкил, в котором алкил является таким, как определено выше; арил означает ароматический моно- или бицикл, содержащий от 6 до 10 атомов углерода. В качестве примеров арилов можно привести фенил или нафтил; гетероцикл означает насыщенный или частично ненасыщенный моно-, би- или трицикл, имеющий от 5 до 17 членов и содержащий от 1 до 8 гетероатомов, выбранных из О, S или N; в качестве примеров моноциклических гетероциклов можно привести азетидинил, пирролидинил,пиперидил, азепинил, морфолинил, тиоморфолинил, пиперазинил, гомопиперазинил, дигидрооксазолил,дигидротиазолил, дигидроимидазолил, дигидропирролил или тетрагидропиридил; в качестве примеров бициклических гетероциклов можно привести индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиофенил, дигидробензоксазолинил, дигидроизобензофуранил, дигидробензимидазолил, дигидроизобензотиазолил, дигидрохинолил, тетрагидрохинолил, дигидроизохинолил,тетрагидроизохинолил, дигидробензоксазинил, бензотиазинил, дигидробензотиазинил, дигидрохиназолинил, тетрагидрохиназолинил, дигидрохиноксалинил, тетрагидрохиноксалинил, дигидрофталазинил,тетрагидрофталазинил, тетрагидробензазепинил, тетрагидробензо[1,4]диазепинил, тетрагидробензо[1,4]оксазепинил или тетрагидробензо[1,4]тиазепинил; в качестве примеров трициклических гетероциклов можно привести дигидроимидазо[1,2-а]бензимидазолил, дигидропирроло[1,2-а]бензимидазолил, тетрагидропиридо[1,2-а]бензимидазолил или дигидро-2 014450 тиазоло[1,2-а]бензимидазолил, тетрагидропиримидо[1,2-а]бензимидазолил, тетрагидродиазепино[1,3][1,2 а]бензимидазолил, дигидрооксазино[1,4][4,3-а]бензимидазолил, тетрагидропиразино[1,2-а]бензимидазолил; гетероарил означает ароматический моно-, би- или трицикл, имеющий от 5 до 14 членов и содержащий от 1 до 8 гетероатомов, выбранных из О, S или N; в качестве примеров моноциклических гетероарилов можно привести имидазолил, пиразолил, тиазолил, оксазолил, изотиазолил, изоксазолил, фурил, тиофенил, оксадиазолил, тиадиазолил, триазолил,тетразолил, пиридил, пиразинил, пиримидинил, пиридазинил, триазинил; в качестве примеров бициклических гетероарилов можно привести индолил, изоиндолил, бензофуранил, бензотиофенил, бензоксазолил, бензимидазолил, индазолил, бензотиазолил, изобензофуранил,изобензотиазолил, пирроло[2,3-c]пиридил, пирроло[2,3-b]пиридил, пирроло[3,2-b]пиридил, пирроло[3,2 с]пиридил, хинолил, изохинолил, циннолинил, хиназолинил или хиноксалинил; в качестве примеров трициклических гетероарилов можно привести пиридо[1,2-а]бензимидазолил,тиазоло[1,2-а]бензимидазолил или имидазо[1,2-а]бензимидазолил, пиримидо[1,2-а]бензимидазолил, пиразино[1,2-а]бензимидазолил;"тио" означает "=S". Среди соединений по настоящему изобретению первую группу соединений составляют соединения общей формулы (II) где X представляет собой атомы углерода или азота; причем звенья X являются одинаковыми или различными и число групп X, представляющих собой N, не превышает 2;R1, R2, R3, Y и А являются такими, как определено в общей формуле (I), и R1 может быть связан с 6- или 5-членным бициклом. Среди соединений по настоящему изобретению вторую группу соединений составляют соединения общей формулы (III) где R1a представляет собой один или несколько атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена или C1-С 6-алкила, C1-С 6-фторалкила, С 1-С 6 алкокси, C1-С 6-тиоалкила, C1-С 6-алкил-S(О)2-, NR4R5, нитро;R1b представляет собой атом водорода, С 1-С 6-алкил, гетероарилокси-С 1-С 6-алкил, арил-С 1-С 3 алкиленокси-С 1-С 6-алкил, R4R5NC(О)-C1-С 3-алкилен, арил, гетероарил, арил-С 1-С 6-алкилен или гетероарил-С 1-С 6-алкилен; причем указанные гетероарилы или арилы R1b необязательно замещены одним или несколькими заместителями R9, являющимися одинаковыми или различными;R9 представляет собой атом галогена или C1-С 6-алкил, C1-С 6-алкокси, C1-С 6-фторалкил, арил, гетероарил, NR4R5, арилтио, причем указанные гетероарилы или арилы необязательно замещены одним или несколькими заместителями, выбранными из атома галогена, C1-С 6-алкила, С 3-С 7-циклоалкила, С 3-С 7 циклоалкил-С 1-С 3-алкилена, C1-С 6-фторалкила, С 1-С 6-алкокси, C1-С 6-фторалкокси, нитро, циано, R4R5NС 1-С 3-алкилена;R2, R3, R4, R5, A, X и Y являются такими, как определено в общей формуле (II). Среди соединений по настоящему изобретению третью группу соединений составляют соединения общей формулы (IV)-3 014450 где W представляет собой трициклический гетероцикл или трициклический гетероарил, выбранный из где R1, R2, R3, Р и Y являются такими, как определено в общей формуле (I). Среди соединений по настоящему изобретению четвертую группу соединений составляют соединения общей формулы (V) где R1, R2, R3, A и Р являются такими, как определено в общей формуле (I). Среди соединений по настоящему изобретению пятую группу соединений составляют соединения общей формулы (V),где R2 представляет собой атом водорода, C1-С 6-алкил или C1-С 6-алкокси;R3 представляет собой от одного до трех атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, С 1-С 6-алкила, С 1-С 6-алкокси или гидроксила, в случае, когда R3 присоединен к атому углерода; илиR3 представляет собой от одного до двух атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, C1-С 6-алкила, C1-С 6-алкил-О-С(О)-, арил-С 1-С 3-алкил-O-С(O)-, в случае, когда R3 присоединен к атому азота;R1, А и Р являются такими, как определено в общей формуле (I). Среди соединений по настоящему изобретению шестую группу соединений составляют соединения общей формулы (V),где А вместе со связью C-N бензимидазола, с которой он сконденсирован, представляет собой моноциклический гетероцикл или моноциклический гетероарил, имеющий от 5 до 7 членов и содержащий от одного до трех гетероатомов, выбранных из О, S или N, включая атом азота бензимидазола;R1, R2, R3 и Р являются такими, как определено в общей формуле (I). Среди соединений по настоящему изобретению седьмую группу соединений составляют соединения общей формулы (Va) где А вместе со связью C-N бензимидазола, с которой он сконденсирован, представляет собой моноциклический гетероцикл или моноциклический гетероарил, имеющий от 5 до 7 членов и содержащий от одного до двух гетероатомов, выбранных из О, S или N, включая атом азота бензимидазола;X представляет собой атомы углерода или азота; причем группы X являются одинаковыми или различными и число групп X, представляющих собой N, не превышает 1;R1a представляет собой один или несколько атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена, более предпочтительно фтора, брома, хлора,-4 014450 или C1-С 6-алкила, более предпочтительно метила, этила, изопропила, трет-бутила, C1-С 6-фторалкила,более предпочтительно трифторметила, C1-С 6-алкокси, более предпочтительно метокси, C1-С 6 тиоалкила, более предпочтительно SCH3, С 1-С 6 алкил-S(О)2-, более предпочтительно -SO2CH3, NR4R5,нитро;R1b представляет собой атом водорода, C1-С 6-алкил, более предпочтительно метил, гетероарилоксиС 1-С 6-алкил, более предпочтительно пиридилоксиэтил, арил-С 1-С 3-алкиленокси-С 1-С 6-алкил, более предпочтительно бензилоксиэтил, R4R5NC(О)-C1-С 3-алкилен, более предпочтительно R4R5NC(О)СН 2-, арил,более предпочтительно фенил, гетероарил, более предпочтительно пиридил, арил-С 1-С 6-алкилен, более предпочтительно бензил или нафтилметил, фенилэтил, фенилпропил, или гетероарил-С 1-С 6-алкилен, более предпочтительно пиридилметил, пиридилэтил, пиридилпропил, тиазолилметил, пиримидинилметил,хинолилметил, хиноксалинилметил, фуранилметил, пиразинилметил, бензотиазолилметил; причем указанные гетероарилы или арилы R1b необязательно замещены одним или несколькими заместителями R9, являющимися одинаковыми или различными;R2 представляет собой атом водорода;R3 представляет собой атом или группу, выбранные из атома водорода, C1-С 6-алкила, более предпочтительно метила, C1-С 6-алкокси, более предпочтительно метокси, или гидроксила, в случае, когда R3 присоединен к атому углерода; илиR3 представляет собой атом или группу, выбранные из атома водорода, C1-С 6-алкила, более предпочтительно метила, C1-С 6-алкил-О-C(О)-, более предпочтительно (СН 3)3 С-О-C(О)-, в случае, когда R3 присоединен к атому азота;R4 и R5 представляют собой независимо друг от друга C1-С 6-алкил, более предпочтительно метил или этил; илиR4 и R5 вместе с атомом азота, к которому они присоединены, образуют пирролидин или морфолин;R9 представляет собой атом галогена, более предпочтительно фтора или хлора, или C1-С 6-алкил, более предпочтительно метил, С 1-С 6-алкокси, более предпочтительно метокси, C1-С 6-фторалкил, более предпочтительно трифторметил, арил, более предпочтительно фенил, гетероарил, более предпочтительно имидазолил, NR4R5, арилтио, более предпочтительно фенилтио, причем указанные арилы необязательно замещены одним или несколькими С 1-С 6-алкилами, более предпочтительно метилами. Среди соединений по настоящему изобретению восьмую группу соединений составляют соединения общей формулы (I), где одновременно R1, и/или R2, и/или R3, и/или А, и/или Р, и/или Y являются такими, как определено в предыдущих группах. Среди соединений по настоящему изобретению девятую группу соединений составляют соединения общей формулы (I') где А вместе со связью C-N бензимидазола, с которой он сконденсирован, представляет собой моноциклический гетероцикл или моноциклический гетероарил, имеющий от 4 до 7 членов и содержащий от 1 до 3 гетероатомов, выбранных из О, S или N, включая атом азота бензимидазола; Р представляет собой 8-, 9-, 10- или 11-членный бициклический гетероцикл или бициклический гетероарил, содержащий от 1 до 6 гетероатомов, выбранных из N, О и S; при условии, что в случае, когда А представляет собой 7-членный насыщенный гетероцикл, Р отличается от 2,3-дигидро-1,4-бензодиоксана и 1-бензопиран-2-она;R1 представляет собой от 1 до 4 атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена, оксо, тио, C1-С 6-алкила, С 3-С 7-циклоалкила, С 3-С 7 циклоалкил-С 1-С 3-алкилена, C1-С 6-фторалкила, С 1-С 6-алкокси, С 3-С 7-циклоалкилокси, С 3-С 7-циклоалкилС 1-С 3-алкиленокси, С 1-С 6-фторалкокси, циано, C(O)NR4R5, нитро, NR4R5, С 1-С 6-тиоалкила, С 3-С 7-циклоалкилтио, С 3-С 7-циклоалкил-С 1-С 3-алкилентио, -S(O)-C1-С 6-алкила, -S(О)-С 3-С 7-циклоалкила, -S(О)-С 1 С 3-алкилен-С 3-С 7-циклоалкила, С 1-С 6-алкил-S(О)2-, С 1-С 6-фторалкил-S(О)2-, С 3-С 7-циклоалкил-S(О)2-, С 3 С 7-циклоалкил-С 1-С 3-алкилен-S(О)2-, SO2NR4R5, NR6C(O)R7, NR6SO2R8, R4R5NC(О)-С 1-С 3-алкилена, арила, гетероарила, арил-С 1-С 5-алкилена, гетероарил-С 1-С 5-алкилена, арилокси, арилтио, гетероарилокси или гетероарилтио, причем указанные гетероарилы или арилы необязательно замещены одним или несколькими заместителями, выбранными из атома галогена, С 1-С 6-алкила, С 3-С 7-циклоалкила, С 3-С 7 циклоалкил-С 1-С 3-алкилена, С 1-С 6-фторалкила, С 1-С 6-алкокси, С 1-С 6-фторалкокси, нитро, циано, NR4R5,R4R5N-C1-C3-алкилена; при условии, что в случае, когда R1 присоединен к атому азота группы Р, R1 отличается от атома галогена, оксо, тио, циано, нитро, NR4R5, С 1-С 6-тиоалкила, тиоарила, тиогетероарила, С 1-С 6-алкокси, арилокси, гетероарилокси, -NR6COR7 и -NR6SO2R8;Y представляет собой атом кислорода или серы;R2 представляет собой атома водорода, атом галогена, С 1-С 6-алкил, С 3-С 7-циклоалкил, С 3-С 7-5 014450 циклоалкил-С 1-С 3-алкилен, С 1-С 6-фторалкил или С 1-С 6-алкокси;R3 представляет собой от 1 до 3 атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена, С 1-С 6-алкила, С 3-С 7-циклоалкила, С 3-С 7-циклоалкил-С 1 С 3-алкилена, С 1-С 6-фторалкила, С 1-С 6-алкокси, С 3-С 7-циклоалкилокси, С 3-С 7-циклоалкил-С 1-С 3-алкиленокси, в случае, когда R3 присоединен к атому углерода; илиR3 представляет собой от 1 до 2 атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена, С 1-С 6-алкила, С 3-С 7-циклоалкила, С 3-С 7-циклоалкил-С 1 С 3-алкилена, С 1-С 6-фторалкила, арил-С(О)-, С 3-С 6-алкил-C(О)-, С 3-С 7-циклоалкил-C(О)-, С 3-С 7-циклоалкил-С 1-С 3-алкилен-С(О)-, С 1-С 6-фторалкил-С(О)-, арил-S(O)2-, С 1-С 6-алкил-S(O)2-, С 1-С 6-фторалкилS(О)2-, С 3-С 7-циклоалкил-S(О)2-, C3-С 7-циклоалкил-С 1-С 3-алкилен-S(O)2-, С 1-С 6-алкил-О-С(О)-, С 3-С 7 циклоалкил-O-С(О)-, С 3-С 7-циклоалкил-С 1-С 3-алкилен-O-С(О)-, C1-С 6-фторалкил-О-С(О)-, арил-О-C(О)-,гетероарил-О-C(О)-, в случае, когда R3 присоединен к атому азота;R4 и R5 представляют собой независимо друг от друга атом водорода или C1-С 6-алкил, С 3-С 7-циклоалкил, С 3-С 7-циклоалкил-С 1-С 3-алкилен, арил-С 1-С 5-алкилен или арил илиR4 и R5 вместе с атомом азота, к которому они присоединены, образуют азетидин, пирролидин, пиперидин, азепин, морфолин, тиоморфолин, пиперазин, гомопиперазин, причем указанные группы необязательно замещены C1-С 6-алкилом, С 3-С 7-циклоалкилом, С 3-С 7-циклоалкил-С 1-С 3-алкиленом, арил-C1-С 6 алкиленом, арилом, гетероарилом, арил-S(О)2-, С 1-С 6-алкил-S(О)2-, С 1-С 6-фторалкил-S(О)2-, С 3-С 7 циклоалкил-S(О)2-, С 3-С 7-циклоалкил-С 1-С 3-алкилен-S(О)2-, арил-С(О)-, C1-С 6-алкил-C(О)-, С 3-С 7-циклоалкил-С(О)-, С 3-С 7-циклоалкил-С 1-С 3-алкилен-С(О)-, C1-С 6-фторалкил-С(О)-;R6 и R7 представляют собой независимо друг от друга атом водорода, C1-С 6-алкил, С 3-С 7 циклоалкил, С 3-С 7-циклоалкил-С 1-С 3-алкилен-, арил-С 1-С 6-алкилен- или арил;R8 представляет собой С 1-С 6-алкил, С 3-С 7-циклоалкил, С 3-С 7-циклоалкил-С 1-С 3-алкилен-, арил-С 1 С 6-алкилен- или арил. Среди соединений по настоящему изобретению десятую группу соединений составляют соединения общей формулы (II') где X представляет собой атомы углерода или азота; причем группы X являются одинаковыми или различными, и число групп X, представляющих собой N, не превышает 2;R1, R2, R3, Y и А являются такими, как определено в общей формуле (I), и R1 может быть связан с 5 или 6-членным бициклом. Среди соединений по настоящему изобретению одиннадцатую группу соединений составляют соединения общей формулы (III') где R1a представляет собой один или несколько атомов или групп, являющихся одинаковыми или различными и выбранных из атома водорода, атома галогена или С 1-С 6-фторалкила;R1b представляет собой атом водорода, С 1-С 6-алкил, арил, гетероарил, арил-С 1-С 6-алкилен- или гетероарил-С 1-С 6-алкилен-, причем указанные группы необязательно замещены одной или несколькими группами или атомами, являющихся одинаковыми или различными и выбранными из атома галогена или С 1-С 6-алкила;R2, R3, А, X и Y являются такими, как определено в общей формуле (II). Среди соединений по настоящему изобретению двенадцатую группу соединений составляют соединения общей формулы (IV)-6 014450 где W представляет собой трициклический гетероцикл или трициклический гетероарил, выбранный из где R1, R2, R3, Р и Y являются такими, как определено в общей формуле (I). Среди соединений по настоящему изобретению тринадцатую группу соединений составляют соединения общей формулы (V) где R1, R2, R3, А, Р и Y являются такими, как определено в общей формуле (I). Среди соединений по настоящему изобретению четырнадцатую группу соединений составляют соединения общей формулы (V),где R2 и R3 представляют собой независимо друг от друга атом водорода или С 1-С 6-алкил;R1, A, P и Y являются такими, как определено в общей формуле (I). Среди соединений по настоящему изобретению пятнадцатую группу соединений составляют соединения общей формулы (I), где одновременно R1, и/или R2, и/или R3, и/или А, и/или Р, и/или Y являются такими, как определено выше в группах 9-14. Под уходящей группой в данном описании понимают группу, которая может быть легко отщеплена от молекулы разрывом гетеролитической связи с удалением электронной пары. Такая группа также может быть легко заменена другой группой, например, по реакции замещения. Такими уходящими группами являются, например, галогены или активная гидроксигруппа, такая как метансульфонат, бензолсульфонат, п-толуолсульфонат, трифлат, ацетат и т.д. Примеры уходящих групп, а также информация по их получению приведены в издании "Advances in Organic Chemistry", J. March, 5th Edition, Wiley Interscience,2001. Под защитной группой в данном описании понимают группу, которая может быть временно включена в химическую структуру с целью временно инактивировать часть молекулы на стадии проведения реакции и которая может быть легко удалена на последующей стадии синтеза. Примеры защитных групп, а также информация по их свойствам приведены в издании T.W. Greene, P.G.M. Wutz, 3rd Edition,Wiley Interscience, 1999. Соединения по настоящему изобретению общей формулы (I) можно получить способом, который пояснен приведенной далее общей схемой 1. Схема 1 Соединения (I) могут быть получены взаимодействием соединения общей формулы (VI), где В представляет собой C1-С 6-алкокси, С 3-С 7-циклоалкилокси, С 3-С 7-циклоалкил-С 1-С 3-алкиленокси, арилС 1-С 3-алкиленокси и Р, Y и R1 являются такими, как определено в общей формуле (I), с амидом соединения общей формулы (VII), где А, R2 и R3 являются такими, как определено выше в общей формуле (I),при кипячении с обратным холодильником в растворителе, таком как толуол. Алюминий, производное амина соединения общей формулы (VII), получают предварительным воздействием триметилалюминия на амины общей формулы (VII). Исходя из соединений общей формулы (VI), где В представляет собой гидроксил и Р, Y и R1 являются такими, как определено в общей формуле (I), карбоксильная группа предварительно может быть преобразована в группу галогенангидрида, такого как хлорангидрид, воздействием, например, тионил-7 014450 хлорида при кипячении с обратным холодильником в растворителе, таком как дихлорметан или дихлорэтан. При этом соединение общей формулы (I) получают взаимодействием соединений общей формулы(VI), где В представляет собой атом хлора и Р, Y и R1 являются такими, как определено в общей формуле(I), с соединением общей формулы (VII), где A, R2 и R3 являются такими, как определено выше в общей формуле (I), в присутствии основания, такого как триэтиламин или карбонат натрия. Альтернативно, соединения общей формулы (VI), где В представляет собой гидроксил и Р, Y и R1 являются такими, как определено в общей формуле (I), могут быть подвергнуты сочетанию с соединениями общей формулы (VII) в присутствии агента сочетания, такого как диалкилкарбодиимид, гексафторфосфат [(бензотриазол-1-ил)окси][трис-(пирролидино)]фосфония, диэтилцианофосфонат, или любого другого агента сочетания, известного специалистам в данной области, в присутствии основания, такого как триэтиламин, в растворителе, таком как, например, диметилформамид. Показанные на схеме 1 соединения общей формулы (VI) и (VII) и другие реагенты, в отношении которых способ получения не описан, коммерчески доступны, описаны в литературных источниках или могут быть получены, например, аналогично способам, описанным в литературных источниках (R.S. Begunov et al., Russian J. Org. Chem., 2004, 40(11), 1740-1742; V.M. Reddy et al., J. Indian Chem. Soc, 1984,(111), 89-91; K.V.B. Rao et al., Eur. J. Med. Chem., 1981, 16(1), 35-38; R.J. North et al., J. Het. Chem., 1969, 6,655; A.R. Freedman et al., J. Het. Chem., 1966, 3(3), 257; Mullock E.B., J. Chem. Soc, Section C, 1970, (6),829-833). Соединения общей формулы (VI) или (I), замещенные по атому С арила или гетероарила алкилом,могут быть получены сочетанием, катализируемым металлом, таким как палладий или железо, с соответствующими соединениями общих формул (VI) или (I), содержащими в качестве заместителей атом галогена, такой как хлор, в присутствии, например, галогенида алкилмагния или галогенида алкилцинка, по методикам, описанным, например, в литературных источниках (A. Furstner et al., J. Am. Chem. Soc, 2002,124(46), 13856; G. Queguiner et al., J. Org. Chem., 1998, 63(9), 2892) или известным специалистам в данной области. Соединения общей формулы (VI) или (I), замещенные по атому С арила или гетероарила цианогруппой, арилом или гетероарилом, могут быть получены сочетанием, катализируемым металлом, таким как палладий, с соответствующими соединениями общей формулы (VI) или (I), замещенными, например,атомом брома, в присутствии триметилсилилцианида, арилбороновой кислоты или гетероарилбороновой кислоты либо любым другим способом, описанным в литературных источниках или известным специалистам в данной области. Соединения общей формулы (VI) или (I), где группа Р замещена по атому N заместителем R1, соответствующим арилу или гетероарилу, могут быть получены сочетанием, катализируемым металлом, таким как медь, с соответствующими аминами общей формулы (VI) или (I) в присутствии галогенарила или галогенгетероарила, способом Бухвальда (S.L. Buchwald et al., J. Am. Chem. Soc, 2002, 124, 11684) или любым другим способом, описанным в литературных источниках или известным специалистам в данной области. Соединения общей формулы (I) или (VI), замещенные по атому С арила или гетероарила группамиNR4R5, NR6COR7 или NR6SO2R8, могут быть получены исходя из соответствующих соединений общей формулы (I) или (VI), замещенных, например, атомом брома, сочетанием с соответствующим амином,амидом или сульфонамидом в присутствии основания, фосфина и катализатора на основе палладия способами, описанными в литературных источниках или известными специалистам в данной области. Соединения общей формулы (I) или (VI), замещенные группой C(O)NR4R5, могут быть получены исходя из соответствующих соединений общей формулы (I) или (VI), замещенных цианогруппой, способами, описанными в литературных источниках или известными специалистам в данной области. Соединения общей формулы (I) или (VI), замещенные S(O)алкилом или -S(О)2 алкилом, могут быть получены окислением соответствующих соединений общей формулы (VI) или (I), замещенных тиоалкилом, способами, описанными в литературных источниках или известными специалистам в данной области. Соединения общей формулы (VI) или (I), замещенные группами NR4R5, NR6COR7 или NR6SO2R8,могут быть получены исходя из соответствующих соединений общей формулы (VI) или (I), замещенных нитрогруппой, например, восстановлением с последующим ацилированием или сульфонилированием способами, описанными в литературных источниках или известными специалистам в данной области. Соединения общей формулы (VI) или (I), замещенные группой SO2NR4R5, могут быть получены способом, аналогично описанному в Pharmazie, 1990, 45, 346, или способами, описанными в литературных источниках или известными специалистам в данной области. Соединения общей формулы (I) или (VI), где Y представляет собой атом серы, могут быть получены, например, сочетанием соответствующих соединений общей формулы (I) или (VI), где Y представляет собой атом кислорода, с реагентом, таким как реактив Лоуссона. Защитные группы в соединениях общей формулы (I), где R3 соответствует защитной группе, присоединенной к азоту, такой как этоксикарбонил, трет-бутилоксикарбонил или бензилоксикарбонил, могут быть удалены химическими способами, известными специалистам в данной области, для получения-8 014450 соединений общей формулы (I), где R3 представляет собой атома водорода. Объектом настоящего изобретения в одном из других его аспектов являются также соединения формулы (VII-x), где х изменяется от а до n. Такие соединения полезны в качестве промежуточных соединений в синтезе соединений формулы (I). Амины (VII-b), (VII-j), (VII-k) и (VII-l) могут быть получены согласно приведенной ниже схеме 2. Схема 2 Способ, дающий возможность получения аминов (VII-b), (VII-j), (VII-k) и (VII-l) в форме рацематов, кратко представлен на схеме 2. Он состоит на первой стадии во введении в качестве заместителя в 2-фтор-5-нитроанилин (IX) рацемата амина (VIII). Такую реакцию осуществляют, например, нагреванием обоих реагентов в отсутствие растворителя. Полученные таким образом аддукты (X) затем циклизуют в гетероциклы (XI) в присутствии реактива, такого как трифторуксусная кислота, и реактива, такого как пероксид водорода, при этом реакцию осуществляют в растворителе, таком как дихлорметан (оптимизированным способом, описанным A.R. Freedman et al., J. Het. Chem., 1966, 3(3), 257). В случае, когда R3 отличается от атома водорода, циклизация может приводить к смеси региоизомеров. Соединение (XI) (R3 является гидроксилом) может быть преобразовано в соединение (XII) с R3, являющимся метокси, например, алкилированием в присутствии основания, такого как гидрид натрия, и алкилирующего агента, такого как метилйодид или диметилсульфат. Затем нитрогруппу соединений (XI) или (XII) восстанавливают с получением аминов (VII-b), (VII-j), (VII-k) или (VII-l) каталитическим гидрированием в присутствии катализатора, такого как палладий на угле, или любым другим способом восстановления нитрогруппы до аминогруппы, известным специалистам в данной области. Амины (VII-е) и (VII-f) могут быть получены согласно приведенной ниже схеме 3. Способ, дающий возможность получения аминов (VII-е) и (VII-f), состоит на первой стадии во введении в качестве заместителя в 2-фтор-5-нитроанилин (IX) пиперазина (XIII), замещенного по одному из атомов азота защитной группой G. Такую реакцию осуществляют, например, нагреванием обоих реагентов в отсутствие растворителя. Полученное таким образом аддитивное соединение (XIV) затем циклизуют в гетероциклическое соединение (XV) в присутствии реактива, такого как трифторуксусная или муравьиная кислота, и реактива, такого как пероксид водорода, при этом реакцию осуществляют в растворителе, таком как дихлорметан. Затем защитная группа гетероциклического соединения (XV) может быть удалена; например, если G представляет собой СО 2 СН 3, то гидролиз соединения (XV) в присутствии кислоты, такой как хлористо-водородная кислота, приводит к амину (XVI), который может быть алкилирован, например, в присутствии основания, такого как гидрид натрия, и алкилирующего агента, такого как метилйодид, в растворителе, таком как тетрагидрофуран или диметилформамид, с получением гетероцикла (XVII). Далее нитрогруппу соединения (XVII) восстанавливают с получением амина (VII-e) каталитическим гидрированием в присутствии катализатора, такого как палладий на угле, или любым другим способом восстановления нитрогруппы до аминогруппы, известным специалистам в данной области. Амин (VII-f) получают восстановлением нитрогруппы соединения (XV), например, при G, представляющим собой CO2CH2Ph, взаимодействием с реагентом, таким как хлорид олова, в растворителе,таком как диметилформамид. Амины (VII-a), (VII-c) и (VII-d) могут быть получены согласно приведенной ниже схеме 4. Схема 4 Амин (VII-a) может быть получен восстановлением соответствующего предшественника с нитрогруппой (XVIII), описанного в литературных источниках (R.J. North et al., J. Het. Chem., 1969, 6, 655),например, каталитическим гидрированием в присутствии катализатора, такого как палладий на угле, или любым другим способом восстановления нитрогруппы до аминогруппы, известным специалистам в данной области. Амин (VII-c) может быть получен в две стадии исходя из описанного выше предшественника с нитрогруппой (XVIII). Промежуточное соединение (XIX) получают исходя из предшественника (XVIII),используя основание, такое как гидрид натрия, и алкилирующий агент, такой как метилйодид, в растворителе, таком как тетрагидрофуран или диметилформамид. Затем полученное таким образом соединение(XIX) может быть преобразовано в амин (VII-c) каталитическим гидрированием в присутствии катализатора, такого как палладий на угле, или любым другим способом восстановления нитрогруппы до аминогруппы, известным специалистам в данной области. Амин (VII-d) может быть получен в две стадии исходя из описанного выше предшественника с нитрогруппой (XVIII). Промежуточное соединение (XX) получают исходя из предшественника (XVIII), используя основание, такое как гидрид натрия и ди-трет-бутилдикарбонат. Затем полученное таким образом соединение (XX) может быть преобразовано в амин (VII-d) каталитическим гидрированием в присутствии катализатора, такого как палладий на угле, или любым другим способом восстановления нитрогруппы до аминогруппы, известным специалистам в данной области.- 10014450 Амин (VII-g) может быть получен согласно приведенной ниже схеме 5. Схема 5 Амин (VII-g) может быть получен в две стадии исходя из 2-йод-4-нитрохлорбензола (XXI)(G.A. Olah, J. Org. Chem., 1993, (58) 3194-3195). На первой стадии соединение (XXI) подвергают взаимодействию с аминопиразином (XXII) в присутствии катализатора, такого как диацетат палладия, фосфина и основания, такого как карбонат цезия, в растворителе, таком как толуол. В таких условиях получают циклизованное соединение (XXIII), из которого, в конечном счете, можно получить амин (VII-g) каталитическим гидрированием в присутствии катализатора, такого как палладий на угле, или любым другим способом восстановления нитрогруппы до аминогруппы, известным специалистам в данной области. Амины (VII-h) и (VII-i) могут быть получены согласно приведенной ниже схеме 6. Схема 6 Конденсация 2-амино-5-нитробензимидазола (XXIV) с реагентом, таким как диацеталь (XXV), дает возможность получения циклизованного соединения (XXVI) в виде смеси двух изомеров. Нитрогруппа гетероцикла (XXVI) может быть восстановлена до аминогруппы взаимодействием с хлоридом олова или любым другим способом восстановления нитрогруппы до аминогруппы, известным специалистам в данной области. Таким образом получают амины (VII-h) и (VII-i). Амины (VII-m) и (VII-n) могут быть получены согласно приведенной ниже схеме 7. Схема 7 Амины (VII-m) и (VII-n) могут быть получены в четыре стадии исходя из формамида (XXVII)(S.L. Chupak, US 2006/135447). Формамид (XXVII) может быть активирован в виде дихлоримина(XXVIII) взаимодействием со смесью SOCl2 и SO2Cl2. Затем соединение (XXVIII) может быть замещено диамином формулы (XXIX), где n равно 3 или 4, с получением соединения формулы (XXX). Последнее соединение может быть преобразовано затем в трициклический бензимидазол (XXXI) в присутствии катализатора, такого как диацетат палладия, фосфина и основания, такого как карбонат цезия. Восстановление нитрогруппы соединения (XXXI) каталитическим гидрированием в присутствии катализатора, такого как палладий на угле, или любым другим способом восстановления нитрогруппы до аминогруппы,известным специалистам в данной области, дает возможность получить амины (VII-m) или (VII-n). Приведенная ниже таблица дана для иллюстрации химической структуры и физических свойств некоторых промежуточных соединений формулы (VII) по настоящему изобретению. В указанной таблице в столбце "tпл (C)" приведены температуры плавления соединений в градусах Цельсия (С), сокращение "ЯМР" означает, что спектр ЯМР описан в примерах; в столбце "Соль/основание" знак "-" означает соединение в виде свободного основания, тогда как формула "HCl" означает соединение в виде гидрохлорида и соотношение, приведенное в скобках, означает соотношение (кислота:основание). В следующих ниже примерах описано получение некоторых промежуточных соединений формулы(VII) по настоящему изобретению. Номера соединений, приведенных в примерах, соответствуют номерам табл. 1. Результаты элементного микроанализа, анализов ЖХ-МС (жидкостная хроматография в сочетании с масс-спектрометрией), спектры ИК или ЯМР подтверждают структуры полученных соединений. Пример I. 6-Амино-2,3-дигидро-1H-имидазо[1,2-а]бензимидазол (соединениеVII-a). К раствору 2,7 г (13,22 ммоль) 2,3-дигидро-6-нитро-1H-имидазо[1,2-а]бензимидазола (R.J. North etal., J. Het. Chem., 1969, 6, 655) в 100 мл метанола в атмосфере аргона при сильном перемешивании добавляют 1 г 10% палладия на угле. К реакционной смеси добавляют 15 г (0,23 моль) формиата аммония и затем суспензию перемешивают в течение 12 ч. Твердое вещество отделяют фильтрованием и очищают хроматографией на колонке с диоксидом кремния (элюент: дихлорметан-метанол). После сушки при пониженном давлении получают 0,82 г требуемого соединения в виде серого твердого вещества. Температура плавления (основание): 235-236 С. ЯМР 1 Н (ДМСО D6),(м.д.): 3,89 (м, 4 Н); 4,38 (м, 2 Н); 6,18 (дд, 1 Н); 66,46 (д, 1 Н); 6,58 (с, 1 Н); 6,73II-1. 2-(2-Метилпирролидин-1-ил)-5-нитроанилин. В реактор с винтовой крышкой вносят 5 г (32,03 ммоль) 2-фтор-5-нитроанилина и 4,9 мл (48,04 ммоль) 2-метилпирролидина (рацемическая смесь). Реактор закрывают и смесь нагревают при 100 С в течение 5 ч.- 12014450 После охлаждения смесь обрабатывают 100 мл воды и 100 мл дихлорметана. Органический слой отделяют, промывают 50 мл насыщенного раствора хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученное вещество используют в таком виде в последующей реакции.II-2. 2,3-Дигидро-1-метил-6-нитро-1H-пирроло[1,2-а]бензимидазол. 2 мл (22,6 ммоль) 35%-ного водного раствора пероксида водорода по каплям добавляют к раствору 1 г (4,52 ммоль) 2-(2-метилпирролидин-1-ил)-5-нитроанилина, полученного на предыдущей стадии, и 4 мл (51,92 ммоль) трифторуксусной кислоты в 20 мл дихлорметана. Смесь нагревают при кипении с обратным холодильником в течение 30 мин, затем охлаждают и обрабатывают 100 мл дихлорметана и 100 мл насыщенного водного раствора гидрокарбоната натрия. Органический слой отделяют, промывают 50 мл насыщенного раствора хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Образовавшееся оранжевое маслянистое вещество (0,89 г) используют в таком виде в последующей реакции.II-3. 6-Амино-2,3-дигидро-1-метил-1H-пирроло[1,2-а]бензимидазол (VII-b). Смесь 0,25 г (1,15 ммоль) 2,3-дигидро-1-метил-6-нитро-1H-пирроло[1,2-а]бензимидазола, полученного на предыдущей стадии, и 10 мг 10% палладия на угле в виде суспензии в 15 мл этанола и 1 мл 1 н. водного раствора хлористо-водородной кислоты перемешивают в течение 4 ч при комнатной температуре в атмосфере водорода при давлении 4 бар. Затем смесь фильтруют, концентрируют при пониженном давлении, обрабатывают 100 мл дихлорметана и 100 мл 30%-ного водного раствора гидроксида натрия. Органический слой отделяют, промывают 50 мл насыщенного раствора хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Образовавшееся твердое вещество очищают хроматографией на колонке с диоксидом кремния (элюент: дихлорметан-метанол). После сушки при пониженном давлении получают 0,133 г требуемого соединения в виде бежевого твердого вещества. Температура плавления (основание): 168-172 С. ЯМР 1 Н (ДМСО D6),(м.д.): 1,49 (д, 3 Н); 2,16 (м, 1 Н); 2,75 (м, 1 Н); 2,9 (м, 2 Н); 3,2 (м, 2 Н); 4,41III-1. 2,3-Дигидро-3-метил-6-нитро-1H-имидазо[1,2-а]бензимидазол (соединениеXIX). К перемешиваемой при 20 С суспензии 0,023 г (0,59 ммоль) 60%-ного гидрида натрия в 5 мл тетрагидрофурана в атмосфере аргона добавляют 0,1 г (0,49 ммоль) 2,3-дигидро-6-нитро-1H-имидазо[1,2 а]бензимидазола (R.J. North et al., J. Het. Chem., 1969, 6, 655) в 10 мл тетрагидрофурана. Через 45 мин перемешивания при 20 С добавляют 30 мкл (0,54 ммоль) метилйодида и далее перемешивают в течение 12 ч при 20 С. Затем реакционную смесь выливают в 100 мл воды и затем экстрагируют дихлорметаном три раза по 30 мл. Органические слои объединяют, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Таким образом получают 0,1 г требуемого соединения (XIX) в виде желтого твердого вещества, которое используют в таком виде в последующем синтезе. Температура плавления (основание): 208-209 С.III-2. 6-Амино-2,3-дигидро-3-метил-1H-имидазо[1,2-а]бензимидазол (соединениеVII-c). К раствору 0,81 г (3,71 ммоль) соединения (XIX), полученного на предыдущей стадии, в 70 мл метанола в атмосфере аргона при сильном перемешивании добавляют 0,5 г 10% палладия на угле. К реакционной смеси добавляют 10 г (0,153 моль) формиата аммония и затем суспензию перемешивают в течение 12 ч. Твердое вещество отделяют фильтрованием и очищают хроматографией на колонке с диоксидом кремния (элюент: дихлорметан-метанол). После сушки при пониженном давлении получают 0,26 г требуемого соединения в виде серого твердого вещества. Температура плавления (основание): 185-190 С. ЯМР 1 Н (ДМСО D6),(м.д.): 2,84 (с, 3 Н); 3,76 (м, 2 Н); 3,91 (м, 2 Н); 4,41 (с, NH2); 6,19 (дд, 1 Н); 6,48IV-1. 6-Нитро-2,3-дигидро-3-трет-бутоксикарбонил-1H-имидазо[1,2-а]бензимидазол (соединениеXX). К перемешиваемой в атмосфере аргона при 20 С суспензии 3,47 г (86,8 ммоль) 60%-ного гидрида натрия в 482 мл тетрагидрофурана несколькими порциями добавляют 13,9 г (57,86 ммоль) 2,3-дигидро-6 нитро-1H-имидазо[1,2-а]бензимидазола (R.J. North et al., J. Het. Chem., 1969, 6, 655). Через 2 ч перемешивания при 20 С добавляют 15,1 мл (65,73 ммоль) ди-трет-бутилдикарбоната и далее перемешивают в течение 1 ч 30 мин при 20 С. Затем реакционную смесь выливают в 50 мл воды. Осадок отделяют фильтрованием и сушат при пониженном давлении. Таким образом получают 14,31 г требуемого соединения(XX) в виде желтого твердого вещества, которое используют в таком виде в последующем синтезе. Температура плавления (основание): 222-224 С.IV-2. 6-Амино-2,3-дигидро-3-трет-бутоксикарбонил-1H-имидазо[1,2-а]бензимидазол (соединениеVII-d). Суспензию 0,1 г (0,33 ммоль) соединения (XX) и 0,5 г 10% палладия на угле в 150 мл этанола перемешивают при 20 С в атмосфере водорода при давлении 5 бар в течение 4 ч. После удаления нерастворимых веществ фильтрованием полученный этанольный раствор концентрируют при пониженном давлении. Таким образом получают 70 мг требуемого соединения в виде белого твердого вещества. Температура плавления (основание): 198-200 С. ЯМР 1H (CDCl3),(м.д.): 1,51 (с, 9 Н); 2,25-3,55 (уширенный пик, NH2); 4,01 (м, 2H); 4,32 (м, 2H); 6,48 (дд, 1 Н); 6,83 (д, 1 Н); 6,91 (д, 1 Н). Пример V. 7-Амино-3-метил-1,2,3,4-тетрагидропиразино[1,2-а]бензимидазол (соединениеVII-e).V-1. 2-[4-(Этоксикарбонил)пиразин-1-ил]-5-нитроанилин (соединениеXIV, G=CO2Et) Смесь 10 г (64,06 ммоль) 2-фтор-5-нитроанилина и 20,08 мл (137,72 ммоль) N-(этоксикарбонил)пиперазина нагревают в течение 12 ч при 140 С. Затем смесь концентрируют при пониженном давлении и затем добавляют 5 мл уксусной кислоты. Осадок отделяют фильтрованием, промывают водой и затем сушат при пониженном давлении. Таким образом получают 18,5 г требуемого соединения в виде желтого твердого вещества. ЯМР 1H (ДМСО D6),(м.д.): 1,15 (т, 3 Н); 2,82 (м, 4 Н); 3,51 (м, 4 Н); 4,02 (кв, 2 Н); 5,35 (с, NH2); 6,95V-2. 3-Этоксикарбонил-7-нитро-1,2,3,4-тетрагидропиразино[1,2-a]бензимидазол (соединениеXV,G=CO2Et). 15 мл (169,5 ммоль) 35%-ного водного раствора пероксида водорода по каплям добавляют к раствору 17 г (57,76 ммоль) соединения (XIV), полученного на предыдущей стадии, и 60 мл (51,92 ммоль) муравьиной кислоты. Смесь нагревают в течение одного часа при 50 С, затем охлаждают, концентрируют при пониженном давлении и обрабатывают 200 мл дихлорметана и 300 мл насыщенного водного раствора бикарбоната калия. Органический слой отделяют, промывают 100 мл насыщенного раствора хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшееся губчатое вещество очищают хроматографией на колонке с диоксидом кремния, элюируя смесью дихлорметана и метанола. Таким образом получают 3,9 г требуемого соединения в виде твердого вещества, которое используют в таком виде в последующем синтезе.V-3. 7-Нитро-1,2,3,4-тетрагидропиразино[1,2-а]бензимидазол (соединениеXVI). Раствор 3,9 г (13,44 ммоль) соединения (XV), полученного на предыдущей стадии, в 100 мл 6 н. раствора хлористо-водородной кислоты нагревают при кипении с обратным холодильником в течение 12 ч. Затем рН охлажденного раствора доводят до 9 с последующим добавлением концентрированного раствора гидроксида натрия и затем экстрагируют дихлорметаном три раза по 100 мл. Органические слои объединяют, промывают 150 мл воды, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученное вещество очищают хроматографией на колонке с диоксидом кремния,элюируя смесью дихлорметана и метанола. Таким образом получают 0,3 г требуемого соединения в виде твердого вещества, которое используют в таком виде в последующем синтезе. ЯМР 1 Н (CDCl3),(м.д.): 1,91 (1 уширенный пик, NH); 5,56 (м, 2 Н); 4,28 (м, 2 Н); 4,48 (с, 2 Н); 7,5 (д,1 Н); 8,31 (дд, 1 Н); 8,72 (д, 1 Н).V-4. 3-Метил-7-нитро-1,2,3,4-тетрагидропиразино[1,2-а]бензимидазол (соединениеXVII). К перемешиваемой при 20 С суспензии 0,07 г (1,65 ммоль) 60%-ного гидрида натрия в 15 мл тетрагидрофурана в атмосфере аргона добавляют 0,3 г (1,37 ммоль) соединения (XVI), полученного на предыдущей стадии, в 20 мкл (1,65 ммоль) метилйодида и затем перемешивают в течение 12 ч при 20 С. Затем реакционную смесь выливают в 100 мл воды и экстрагируют дихлорметаном три раза по 30 мл. Органические слои объединяют, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Таким образом получают 0,13 г требуемого соединения (XVII), которое используют в таком виде в последующем синтезе. ЯМР 1 Н (CDCl3),(м.д.): 2,49 (с, 3 Н); 2,93 (м, 2 Н); 3,82 (с, 2 Н); 4,11 (м, 2 Н); 7,29 (д, 1H); 8,09 (дд,1 Н); 8,49 (д, 1H).V-5. 7-Амино-3-метил-1,2,3,4-тетрагидропиразино[1,2-а]бензимидазол (соединениеVII-e). Суспензию 0,13 г (0,56 ммоль) соединения (XVII), полученного на предыдущей стадии, 0,2 г 10% палладия на угле и 5 г (79,36 ммоль) формиата аммония перемешивают в течение 12 ч при 20 С. После удаления нерастворимых веществ фильтрованием фильтрат концентрируют при пониженном давлении. Таким образом получают 80 мг требуемого соединения в виде маслянистого вещества. ЯМР 1H (CDCl3),(м.д.): 2,48 (с, 3 Н); 2,89 (м, 2 Н); 3,75 (с, 2 Н); 3,85 (уширенный пик, NH2); 3,97 (м,2 Н); 6,57 (дд, 1 Н); 6,91 (д, 1 Н); 7 (д, 1 Н). Пример VI. 7-Амино-3-бензилоксикарбонил-1,2,3,4-тетрагидропиразино[1,2-а]бензимидазол (соединениеVII-f).VI-1. 2-[4-(Бензилоксикарбонил)пиразин-1-ил]-5-нитроанилин (соединениеXIV, G=CO2Ph). Смесь 9,44 г (60,5 ммоль) 2-фтор-5-нитроанилина и 24,98 мл (130,08 ммоль) N-(бензилокси- 14014450 карбонил)пиперазина нагревают в течение 12 ч при 140 С. Затем смесь растворяют в 200 мл дихлорметана. Органический слой последовательно промывают насыщенным водным раствором карбоната калия и три раза водой по 50 мл, затем сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с диоксидом кремния, элюируя смесью дихлорметана и этилацетата. Таким образом получают 8,6 г требуемого соединения. ЯМР 1H (CDCl3),(м.д.): 2,91 (м, 4 Н); 3,68 (м, 4H); 4,16 (с, NH2); 5,18 (с, 2 Н); 6,92 (д, 1H); 7,35 (м,5 Н); 7,6 (м, 2H).VI-2. 3-Бензилоксикарбонил-7-нитро-1,2,3,4-тетрагидропиразино[1,2-а]бензимидазол (соединениеXV, G=CO2CH2Ph). 17,7 мл (0,2 моль) 35%-ного водного раствора пероксида водорода в течение двух часов по каплям добавляют при перемешивании при 0 С к раствору 8,6 г (24,13 ммоль) 2-[4-(бензилоксикарбонил)пиразин-1-ил]-5-нитроанилина, полученного на предыдущей стадии, и 34,4 мл (29,4 ммоль) муравьиной кислоты. Смесь перемешивают в течение 3 ч при 0 С, далее перемешивают в течение 12 ч при 20 С и затем выливают на 300 г льда. рН среды доводят до 8 добавлением водного раствора аммиака и затем экстрагируют 200 мл дихлорметана. Органический слой промывают 100 мл насыщенного раствора хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с диоксидом кремния, элюируя смесью дихлорметана и этилацетата. Таким образом получают 1,2 г требуемого соединения. ЯМР 1 Н (CDCl3),(м.д.): 4,11 (м, 2 Н); 4,21 (м, 2 Н); 5,05 (с, 2H); 5,18 (с, 2 Н); 7,38 (м, 6H); 8,21 (дд,1 Н); 8,61 (д, 1H).VI-3. 7-Амино-3-бензилоксикарбонил-1,2,3,4-тетрагидропиразино[1,2-а]бензимидазол (соединениеVII-f). 7,68 г (34,06 ммоль) дигидрата хлорида олова несколькими порциями добавляют к раствору в 56 мл диметилформамида 2 г (5,68 ммоль) соединения (XV), полученного на предыдущей стадии, и 2,6 г(8,85 ммоль) тетрабутиламмонийбромида. Смесь перемешивают в течение 24 ч при 20 С, затем концентрируют и растворяют в 100 мл воды. рН раствора, полученного таким образом, доводят до 9 добавлением раствора аммиака. Затем смесь экстрагируют этилацетатом два раза по 100 мл. Органические слои объединяют, промывают водой два раза по 50 мл и один раз 50 мл насыщенного раствора хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с диоксидом кремния, элюируя смесью дихлорметана и метанола. Таким образом получают 1,45 г требуемого соединения.Xantphos (9,9-диметил-4,5-бис(дифенилфосфино)ксантен) и 30 мг (0,13 ммоль) диацетата палладия в 20 мл безводного толуола нагревают в течение 12 ч при 120 С. Затем смесь концентрируют при пониженном давлении и обрабатывают 350 мл дихлорметана и 200 мл воды. Органический слой отделяют,промывают 100 мл насыщенного раствора хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученное вещество обрабатывают 10 мл дихлорметана и получают 0,23 г требуемого соединения в виде осадка, который отделяют фильтрованием. Фильтрат очищают хроматографией на колонке с диоксидом кремния, элюируя смесью этилацетата и гептана. Таким образом дополнительно получают 25 мг требуемого соединения.VII-2. 7-Аминопиразино[1,2-а]бензимидазол (соединениеVII-g). Суспензию 0,22 г (1,03 ммоль) 7-нитропиразино[1,2-а]бензимидазола, полученного на предыдущей стадии, 0,5 г никеля Ренея и 0,1 мл моногидрата гидразина (2,05 ммоль) в 100 мл этанола перемешивают в течение 2 ч при 20 С. Нерастворимые вещества удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Таким образом получают 0,16 г требуемого соединения в виде бежевого твердого вещества.VIII-1. Гидрохлорид 7-нитропиримидо[1,2-а]бензимидазола и 8-нитропиримидо[1,2-а]бензимидазола (соединенияXXVI). Смесь 2 г (11,2 ммоль) 2-амино-5-нитробензимидазола (J. Med. Chem., 1995, 38 (20), 4098-4105) и 3,6 мл (15 ммоль) 1,1,3,3-тетраэтоксипропана в 50 мл этанола и 2 мл концентрированной хлористо- 15014450 водородной кислоты нагревают при кипении с обратным холодильником в течение 12 ч. Фильтрованием отделяют 1,97 г бежевого осадка и сушат при пониженном давлении. Получают смесь изомеров, которую используют в таком виде на следующей стадии.VIII-2. 7-Аминопиримидо[1,2-а]бензимидазол (соединениеVII-h). 4,5 г (19,95 ммоль) дигидрата хлорида олова в 4 мл воды добавляют к нагретой до 100 С суспензии 1 г (3,99 ммоль) смеси соединений (XXVI), полученной на предыдущей стадии, в 8 мл концентрированной хлористо-водородной кислоты. Реакционную смесь нагревают в течение 3 ч, затем охлаждают и рН среды доводят до 8 последующим добавлением 30%-ного раствора аммиака. Смесь экстрагируют дихлорметаном три раза по 100 мл. Органические слои объединяют, сушат над сульфатом магния, концентрируют при пониженном давлении и затем очищают хроматографией на колонке с диоксидом кремния,элюируя смесью дихлорметана и метанола. Таким образом получают 7-аминопиримидо[1,2-а]бензимидазол в виде оранжевого твердого вещества. ЯМР 1 Н (ДМСО D6),(м.д.): 5,21 (м, NH2); 6,7 (д, 1 Н); 6,81 (с, 1 Н); 6,95 (м, 1 Н); 7,9 (д, 1 Н); 7,58 (м,1 Н); 9,25 (дд, 1 Н).VIII-3. 8-Аминопиримидо[1,2-а]бензимидазол (соединениеVII-i). Во время экстрагирования, описанного в примере VIII-2, в водном слое в осадок выпадает нерастворимое вещество. Данное нерастворимое вещество отделяют фильтрованием через пористый стеклянный фильтр, что дает возможность получить 0,13 г оранжевого твердого вещества, соответствующего соединениюVII-i. ЯМР 1 Н (ДМСО D6),(м.д.): 5,21 (м, NH2); 6,91 (м, 2 Н); 7,2 (д, 1 Н); 7,51 (д, 1 Н); 8,57 (м, 1 Н); 9,12IX-1. 2-(3-Гидроксипирролидин-1-ил)-5-нитроанилин. По методике, аналогично описанной в примере II-1, исходя из 3 г (19,22 ммоль) 2-фтор-5-нитроанилина и 1,76 мл (21,14 ммоль) 3-гидроксипирролидина, получают 2 г требуемого соединения в виде желтого твердого вещества.IX-2. 2,3-Дигидро-3-гидрокси-6-нитро-1H-пирроло[1,2-a]бензимидазол и 2,3-дигидро-2-гидрокси-6 нитро-1H-пирроло[1,2-а]бензимидазол. По методике, аналогично описанной в примере II-2, исходя из 2 г (7,7 ммоль) 2-(3-гидроксипирролидин-1-ил)-5-нитроанилина, полученного на предыдущей стадии, получают после очистки хроматографией на колонке с диоксидом кремния 48 мг желтого твердого вещества, соответствующего 2,3-дигидро 3-гидрокси-6-нитро-1H-пирроло[1,2-а]бензимидазолу, и 280 мг желтого твердого вещества, соответствующего 2,3-дигидро-2-гидрокси-6-нитро-1H-пирроло[1,2-а]бензимидазолу.IX-3. 6-Амино-2,3-дигидро-3-гидрокси-1H-пирроло[1,2-а]бензимидазол (соединениеVII-j). По методике, аналогично описанной в примере VII-2, исходя из 0,13 г (0,56 ммоль) 2,3-дигидро-3 гидрокси-6-нитро-1H-пирроло[1,2-а]бензимидазола, полученного на стадии IX-2, получают 0,1 г требуемого амина в виде коричневого твердого вещества (в данном случае реакционную смесь перемешивают в течение 2 дней при 20C). ЯМР 1H (CDCl3),(м.д.): 2,61 (м, 1H); 2,92 (м, 1H); 3,94 (м, 1 Н); 4,18 (м, 1 Н); 5,29 (м, 1 Н); 6,61 (д,1H); 6,98 (с, 1H); 7,05 (д, 1H).VII-k). Смесь 0,3 г (1,36 ммоль) 2,3-дигидро-2-гидрокси-6-нитро-1H-пирроло[1,2-а]бензимидазола, полученного на стадии IX-2, и 100 мг 10% палладия на угле в 15 мл этанола и 2 мл 1 н. раствора хлористоводородной кислоты перемешивают в течение 3 ч при 20 С в атмосфере водорода при давлении 4 бар. Затем реакционную смесь фильтруют через целит, фильтрат концентрируют при пониженном давлении и получают 0,35 г требуемого соединения в виде твердого вещества. ЯМР 1 Н (ДМСО D6),(м.д.): 3,05 (м, 1H); 3,55 (дд, 1 Н); 4,15 (м, 1 Н); 4,45 (дд, 1 Н); 5,1 (м, 1H); 7,0(м, 1 Н); 7,3 (м, 1 Н); 7, 66 (м, 1 Н). Пример X. 6-Амино-2,3-дигидро-2-метокси-1H-пирроло[1,2-а]бензимидазол (соединениеVII-1). Х-1. 2,3-Дигидро-2-метокси-6-нитро-1H-пирроло[1,2-а]бензимидазол. К перемешиваемой в атмосфере аргона при 20 С суспензии 0,2 г (5 ммоль) 60%-ного гидрида натрия в 10 мл тетрагидрофурана добавляют раствор 0,28 г (1,28 ммоль) 2,3-дигидро-2-гидрокси-6-нитро 1H-пирроло[1,2-а]бензимидазола (стадия IX-2 примера IX) в 5 мл тетрагидрофурана. Через 15 мин перемешивания добавляют 0,24 мл (2,5 ммоль) диметилсульфата. Реакционную смесь перемешивают в течение 12 ч при 20 С, затем выливают в 100 мл воды и экстрагируют этилацетатом три раза по 50 мл. Органические слои объединяют, промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с диоксидом кремния, элюируя смесью дихлорметана и метанола. Таким образом получают 70 мг требуемого соединения в виде губчатого вещества.- 16014450 Х-2. 6-Амино-2,3-дигидро-2-метокси-1H-пирроло[1,2-а]бензимидазол (соединениеVII-1). По методике, аналогично описанной в примере VII-2, исходя из 0,185 г (0,79 ммоль) 2,3-дигидро-2 метокси-6-нитро-1H-пирроло[1,2-а]бензимидазола, получают после очистки хроматографией на колонке с диоксидом кремния 60 мг бежевого твердого вещества, соответствующего требуемому соединению.XI-1. Дихлорид N-(2-бром-5-нитрофенил)формимидоила (XXVIII). Раствор 5 г (20,4 ммоль) N-(2-бром-5-нитрофенил)формамида (XXVII) в 12 мл (164 ммоль) тионилхлорида и 4,5 мл (56 ммоль) сульфурилхлорида нагревают в течение 24 ч при 60 С. Реакционную смесь концентрируют при пониженном давлении и получают 5,3 г серого твердого вещества, которое используют в таком виде в последующем синтезе.XI-2. N-(2-Бром-5-нитрофенил)-N-(1-метил-1H-3,4,5,6-тетрагидропиримидин-2-илиден)амин (XXX). К перемешиваемому при 0 С раствору 10,5 мл (0,1 моль) N-метил-1,3-пропилдиамина (XXIX, n=3) в 50 мл тетрагидрофурана несколькими порциями добавляют суспензию 5,3 г (17,8 ммоль) промежуточного соединения (XXVIII) в 30 мл тетрагидрофурана. Далее реакционную смесь перемешивают в течение 48 ч при 20 С и затем выливают в 200 мл воды. Смесь экстрагируют этилацетатом три раза по 50 мл. Органические слои объединяют, промывают 100 мл насыщенного водного раствора хлорида натрия, затем сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученное вещество очищают хроматографией на колонке с диоксидом кремния, элюируя смесью дихлорметана и метанола. Таким образом получают 0,72 г требуемого соединения (XXIX) в виде желтого твердого вещества.XI-3. 4-Метил-7-нитро-1,2,3,4-тетрагидропиримидо[1,2-а]бензимидазол (XXXI). Смесь 0,72 г (2,3 ммоль) промежуточного соединения (XXX), 0,16 г (0,28 ммоль) Xantphos (9,9 диметил-4,5-бис(дифенилфосфино)ксантен), 1,5 г (4,6 ммоль) карбоната цезия и 30 мг (0,14 ммоль) диацетата палладия в 20 мл толуола нагревают в течение 24 ч при 120 С. Затем смесь концентрируют при пониженном давлении и очищают хроматографией на колонке с диоксидом кремния, элюируя смесью дихлорметана и метанола. Таким образом получают 0,44 г требуемого соединения (XXXI).XI-4. Гидрохлорид (1:1) 7-амино-4-метил-1,2,3,4-тетрагидропиримидо[1,2-а]бензимидазола (соединениеVII-m). 0,2 мл (3,8 ммоль) моногидрата гидразина добавляют к суспензии 0,44 г (1,89 ммоль) соединения(XXX) и 0,3 г никеля Ренея. Смесь перемешивают в течение 3 ч при 20 С, затем фильтруют через целит,концентрируют при пониженном давлении и очищают хроматографией на колонке с диоксидом кремния,элюируя смесью дихлорметана и метанола. Таким образом получают 0,36 г требуемого соединения(VII-m). При необходимости соединение может быть выделено в виде гидрохлорида обработкой полученного соединения 50 мл 0,1 н. раствора хлористо-водородной кислоты в изопропаноле и концентрированием полученного раствора при пониженном давлении. Таким образом получают гидрохлорид амина(д, 1H); 6,76 (д, 1 Н). Пример XII. 8-Амино-5-метил-1,2,3,4-тетрагидро-5-H-[1,3]диазепино[1,2-а]бензимидазол (соединениеVII-n). Соединение (VII-n) получают по методике, аналогично описанной в примере (XIII), исходя из промежуточных соединений (XXVIII) и (XXIX, n=4).tпл (2 HCl): 330-336 С. ЯМР 1 Н (CDCl3),(м.д.): 1,84 (м, 4 Н); 3,06 (с, 3 Н); 3,08 (м, 2 Н); 3,8 (м, 2 Н); 6,42 (дд, 1 Н); 6,81 (д,1H); 6,85 (с, 1 Н). В следующих ниже примерах описано получение некоторых соединений по настоящему изобретению. Данные примеры не являются ограничивающими и приведены только для иллюстрации настоящего изобретения. Номера соединений, приведенных в примерах, соответствуют номерам в табл. 2, 3 и 4. Результаты элементного микроанализа, анализов ЖХ-МС (жидкостная хроматография в сочетании с массспектрометрией), спектры ИК или ЯМР подтверждают структуры полученных соединений. Пример 1. N-(1,2,3,4-тетрагидропиридо[1,2-а]бензимидазол-7-ил)-5-фтор-1-[(пиридин-4-ил)метил]1H-индол-2-карбоксамид (соединение 1 в табл. 2). 1.1. Этил-5-фтор-1-[(пиридин-4-ил)метил]-1H-индол-2-карбоксилат. Раствор 5,5 г (21,72 ммоль) 1,1'-азодикарбонилдипиперидина в 15 мл безводного толуола в атмо- 17014450 сфере аргона при 20 С по каплям добавляют к раствору 3 г (14,48 ммоль) этил-5-фтор-1H-индол-2 карбоксилата, 2,37 г (21,72 ммоль) 4-пиридилкарбинола и 5,45 мл (21,72 ммоль) н-трибутилфосфина в 200 мл толуола. Смесь перемешивают в течение 48 ч при 20 С. Затем реакционную смесь концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с диоксидом кремния (элюент: гептан/этилацетат). Таким образом получают 3,2 г требуемого соединения, которое используют в таком виде в последующем синтезе. 1.2.et al., J. Chem. Soc, 1955, 3275-3287) в 70 мл безводного толуола в атмосфере аргона добавляют 1,26 мл триметилалюминия (2 М раствор в толуоле). Через 15 мин перемешивания при 0 С смесь нагревают до 50 С и перемешивают в течение 30 мин. Затем смесь охлаждают до 0 С. Добавляют 0,5 г (1,68 ммоль) этил-5-фтор-1-[(пиридин-4-ил)метил]-1H-индол-2-карбоксилата, полученного на стадии 1.1. Реакционную смесь нагревают при кипении с обратным холодильником в течение 12 ч, затем охлаждают и добавляют к 20 мл 1 н. ледяного раствора хлористо-водородной кислоты. рН водного слоя доводят до 9. Нерастворенное вещество отделяют фильтрованием и очищают хроматографией на колонке с диоксидом кремния (элюент: дихлорметан-метанол). Очищенное таким образом вещество перекристаллизовывают из смеси дихлорметана и гептана. После сушки при пониженном давлении получают 0,41 г белого твердого вещества. Температура плавления (основание): 292-293 С. ЯМР 1 Н (ДМСО D6),(м.д.): 1,91 (м, 4 Н); 2,89 (т, 2 Н); 4,02 (т, 2 Н); 5,9 (с, 2 Н); 6,93 (д, 2 Н); 7,09 (тд,1 Н); 7,5 (м, 5 Н); 7,89 (д, 1 Н); 8,4 (д, 2 Н); 10,35 (с, 1 Н). Пример 2. N-(1,2,3,4-Тетрагидропиридо[1,2-а]бензимидазол-7-ил)-5-фтор-1-(3-фторбензил)-1Hиндол-2-карбоксамид (соединение 2 в табл. 2). 2.1. Этил-5-фтор-1-(3-фторбензил)-1H-индол-2-карбоксилат. Суспензию 1,035 г (5 ммоль) этил-5-фтор-1H-индол-2-карбоксилата, 0,865 г (6 ммоль) 3-фторбензилхлорида и 1,38 г (10 ммоль) карбоната калия в 50 мл диметилформамида перемешивают в течение 24 ч при 60 С. Затем реакционную смесь охлаждают и выливают в смесь ледяной воды и этилацетата. После декантации органический слой отделяют, затем промывают водой два раза по 200 мл и затем 200 мл насыщенного раствора хлорида натрия. Раствор сушат над сульфатом магния, фильтруют и затем фильтрат концентрируют при пониженном давлении. Получают 0,97 г маслянистого вещества, которое используют в таком виде на следующей стадии. 2.2. N-(1,2,3,4-Тетрагидропиридо[1,2-а]бензимидазол-7-ил)-5-фтор-1-(3-фторбензил)-1 Н-индол-2 карбоксамид (соединение 2). К раствору 0,426 г (2,28 ммоль) 7-амино-1,2,3,4-тетрагидропиридо[1,2-а]бензимидазола (Saunderset al., J. Chem. Soc, 1955, 3275-3287) в 70 мл безводного толуола в атмосфере аргона добавляют 1,43 мл триметилалюминия (2 M раствор в толуоле). Через 15 мин перемешивания при 0 С смесь нагревают до 50 С и перемешивают в течение 30 мин. Затем смесь охлаждают до 0 С и добавляют 0,6 г (1,9 ммоль) этил-5-фтор-1-(3-фторбензил)-1 Н-индол-2-карбоксилата, полученного на стадии 2.1. Реакционную смесь нагревают при кипении с обратным холодильником в течение 12 ч, затем охлаждают и добавляют к 20 мл 1 н. ледяного раствора хлористо-водородной кислоты. рН водного слоя доводят до 9. Нерастворенное вещество отделяют фильтрованием и очищают хроматографией на колонке с диоксидом кремния(элюент: дихлорметан-метанол). Очищенное таким образом вещество перекристаллизовывают из метанола. После сушки при пониженном давлении получают 0,46 г белого твердого вещества. Температура плавления (основание): 286-287 С. ЯМР 1 Н (ДМСО D6),(м.д.): 2 (м, 4H); 2,9 (т, 2H); 4,05 (т, 2 Н); 5,88 (с, 2 Н); 7,11 (м, 10 Н); 7,91 (с,1 Н); 10,38 (с, 1 Н). Пример 3. N-(1,2,3,4-Тетрагидропиридо[1,2-а]бензимидазол-7-ил)-1-бензил-1H-пирроло[2,3-b]пиридин-2-карбоксамид (соединение 3 в табл. 2). 3.1. Этил-1-бензил-1H-пирроло[2,3-b]пиридин-2-карбоксилат. К перемешиваемой при 20 С суспензии 0,44 г (11 ммоль) гидрида натрия в 50 мл ДМФА добавляют порциями 2 г (10 ммоль) этилпирроло[2,3-b]пиридин-2-карбоксилата (WO 2004/101563). Через 1 ч перемешивания при комнатной температуре добавляют по каплям 2,1 г (12 ммоль) бензилбромида и реакционную смесь перемешивают в течение 20 ч при комнатной температуре. Затем при перемешивании добавляют 150 мл воды и 150 мл этилового эфира. Водный слой отделяют и экстрагируют этиловым эфиром два раза по 50 мл. Органические слои объединяют, промывают 100 мл воды, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученное вещество очищают хроматографией на колонке с диоксидом кремния, элюируя смесью гептана и дихлорметана. Таким образом получают 2,3 г требуемого соединения. Температура плавления: 71-72 С.et al., J. Chem. Soc, 1955, 3275-3287) в 20 мл безводного толуола в атмосфере аргона добавляют 1,1 мл триметилалюминия (2 M раствор в толуоле). Через 15 мин перемешивания при 0 С смесь нагревают до 50 С и перемешивают в течение 30 мин. Затем смесь охлаждают до 0 С и добавляют 0,4 г (1,43 ммоль) этил-1-бензил-1H-пирроло[2,3-b]пиридин-2-карбоксилата, полученного на стадии 3.1. Реакционную смесь нагревают при кипении с обратным холодильником в течение 6 ч, затем охлаждают и при перемешивании добавляют 150 мл воды, две капли 35%-ного водного раствора гидроксида натрия и 150 мл дихлорметана. Водный слой отделяют и экстрагируют дихлорметаном два раза по 50 мл. Органические слои объединяют, промывают 100 мл воды, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученное вещество очищают хроматографией на колонке с диоксидом кремния, элюируя смесью метанол-дихлорметан. Таким образом получают 0,55 г вещества, которое перекристаллизовывают из этанола с получением после сушки в вакууме 0,45 г требуемого соединения в виде порошка. Температура плавления: 233-235 С. ЯМР 1 Н (ДМСО D6),(м.д.): 1,91 (м, 4 Н); 2,91 (т, 2H); 4,02 (т, 2 Н); 5,9 (с, 2 Н); 7,12 (м, 6 Н); 7,38 (м,2 Н); 7,48 (м, 1 Н); 7,9 (с, 1 Н); 8,18 (дд, 1 Н); 8,4 (дд, 1 Н). Пример 4. N-(1,2,3,4-Тетрагидропиридо[1,2-а]бензимидазол-7-ил)-1-бензил-5-трифторметил-1Hпирроло[2,3-b]пиридин-2-карбоксамид (соединение 4 в табл. 2). 4.1. Этил-1-бензил-5-трифторметил-1H-пирроло[2,3-b]пиридин-2-карбоксилат. К суспензии 0,9 г (3,5 ммоль) этил-5-трифторметил-1H-пирроло[2,3-b]пиридин-2-карбоксилата(Nazare M. et al., Angewandte Chemie, International Ed., 2004, 43(34), 4526-4528) в 45 мл безводного тетрагидрофурана при перемешивании добавляют 0,58 г (5,23 ммоль) бензилового спирта, 1,4 г (5,23 ммоль) трифенилфосфина и 0,94 г (5,23 ммоль) диэтилазодикарбоксилата (DEAD). Через 20 ч перемешивания при комнатной температуре реакционную смесь концентрируют при пониженном давлении и полученное вещество очищают хроматографией на колонке с диоксидом кремния, элюируя смесью дихлорметана и гептана. Таким образом получают 1 г требуемого соединения. Температура плавления: 72-73 С. 4.2.et al., J. Chem. Soc, 1955, 3275-3287) в 20 мл безводного толуола в атмосфере аргона добавляют 0,65 мл триметилалюминия (2 M раствор в толуоле). Через 15 мин перемешивания при 0 С смесь нагревают до 50 С и перемешивают в течение 30 мин. Затем смесь охлаждают до 0 С и добавляют 0,3 г (0,86 ммоль) этил-1-бензил-5-трифторметил-1H-пирроло[2,3-b]пиридин-2-карбоксилата, полученного на стадии 4.1. Реакционную смесь нагревают при кипении с обратным холодильником в течение 6 ч, затем охлаждают и при перемешивании добавляют 150 мл воды, 2 капли 35%-ного водного раствора гидроксида натрия и 150 мл дихлорметана. Водный слой отделяют и экстрагируют дихлорметаном два раза по 50 мл. Органические слои объединяют, промывают 100 мл воды, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученное вещество очищают хроматографией на колонке с диоксидом кремния, элюируя смесью метанол-дихлорметан. Таким образом получают 0,4 г вещества, которое перекристаллизовывают из ацетонитрила с получением после сушки в вакууме 0,35 г требуемого соединения в виде порошка. Температура плавления: 241-243 С. ЯМР 1 Н (ДМСО D6),(м.д.): 1,91 (м, 4 Н); 2,93 (т, 2 Н); 4,05 (т, 2 Н); 5,98 (с, 2 Н); 7,15 (м, 5 Н); 7,42 (м,3 Н); 7,9 (д, 1H); 8,7 (дд, 2 Н); 10,5 (с, 1 Н). Пример 5. N-(2,3-Дигидро-1H-пирроло[1,2-а]бензимидазол-6-ил)-5-фтор-1-[(пиридин-4-ил)метил]1H-индол-2-карбоксамид (соединение 5 в табл. 2). К раствору 0,35 г (2,01 ммоль) 6-амино-2,3-дигидро-1H-пирроло[1,2-а]бензимидазола (Freedmanet al., J. Het. Chem., 1966, 3, (3), 257-259) в 70 мл безводного толуола в атмосфере аргона добавляют 1,26 мл триметилалюминия (2 М раствор в толуоле). Через 15 мин перемешивания при 0 С смесь нагревают до 50 С и перемешивают в течение 30 мин. Смесь охлаждают до 0 С и добавляют 0,5 г (1,68 ммоль) этил-5-фтор-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксилата, полученного на стадии 1.1. Реакционную смесь нагревают при кипении с обратным холодильником в течение 12 ч, затем охлаждают и выливают в 20 мл 1 н. ледяного раствора хлористо-водородной кислоты. рН водного слоя доводят до 9. Нерастворенное вещество отделяют фильтрованием и очищают хроматографией на колонке с диоксидом кремния (элюент: дихлорметан-метанол). Очищенное таким образом вещество перекристаллизовывают из смеси дихлорметан-гептан. После сушки при пониженном давлении получают 0,23 г белого твердого вещества. Температура плавления (основание): 266-267 С.et al., J. Het. Chem., 1966, 3, (3), 257-259) в 70 мл безводного толуола в атмосфере аргона добавляют 1,43 мл триметилалюминия (2 М раствор в толуоле). Через 15 мин перемешивания при 0 С смесь нагревают до 50 С и перемешивают в течение 30 мин. Затем смесь охлаждают до 0 С и добавляют 0,6 г(1,9 ммоль) этил-5-фтор-1-(3-фторбензил)-1H-индол-2-карбоксилата, полученного на стадии 2.1. Реакционную смесь нагревают при кипении с обратным холодильником в течение 12 ч, затем охлаждают и выливают в 20 мл 1 н. ледяного раствора хлористо-водородной кислоты. рН водного слоя доводят до 9. Нерастворенное вещество отделяют фильтрованием и очищают хроматографией на колонке с диоксидом кремния (элюент: дихлорметан-метанол). Очищенное таким образом вещество перекристаллизовывают из смеси дихлорметана и гептана. После сушки при пониженном давлении получают 0,45 г белого твердого вещества. Температура плавления (основание): 256-257 С. ЯМР 1H (ДМСО D6),(м.д.): 2,56 (м, 2 Н); 2,91 (т, 2H); 4,04 (т, 2 Н); 5,9 (с, 2H); 7,2 (м, 10 Н); 7,92 (д,1 Н); 10,32 (с, 1 Н). Пример 7. N-(2,3-Дигидро-1H-пирроло[1,2-а]бензимидазол-6-ил)-1-бензил-1H-пирроло[2,3-b]пиридин-2-карбоксамид (соединение 7 в табл. 2). К раствору 0,185 г (1,07 ммоль) 6-амино-2,3-дигидро-1H-пирроло[1,3-а]бензимидазола (Freedmanet al., J. Het. Chem., 1966, 3, (3), 257-259) в 20 мл безводного толуола в атмосфере аргона добавляют 0,67 мл триметилалюминия (2 M раствор в толуоле). Через 15 мин перемешивания при 0 С смесь нагревают до 50 С и перемешивают в течение 30 мин. Затем смесь охлаждают до 0 С и добавляют 0,25 г(0,89 ммоль) этил-1-бензил-1H-пирроло[2,3-b]пиридин-2-карбоксилата, полученного на стадии 3.1. Реакционную смесь нагревают при кипении с обратным холодильником в течение 6 ч, затем охлаждают и при перемешивании добавляют 150 мл воды, 2 капли 35%-ного водного раствора гидроксида натрия и 150 мл дихлорметана. Водный слой отделяют и экстрагируют дихлорметаном два раза по 50 мл. Органические слои объединяют, промывают 100 мл воды, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученное вещество очищают хроматографией на колонке с диоксидом кремния, элюируя смесью метанола и дихлорметана. Таким образом получают 0,34 г вещества, которое перекристаллизовывают из этанола с получением после сушки в вакууме 0,31 г требуемого соединения в виде порошка. Температура плавления: 251-252 С. ЯМР 1H (ДМСО D6),(м.д.): 2,6 (м, 2 Н); 2,9 (т, 2H); 4,04 (т, 2 Н); 5,9 (с, 2 Н); 7,15 (м, 9H); 7,9 (д, 1 Н); 8,18 (дд, 1 Н); 8,4 (дд, 1 Н). Пример 8. N-(2,3-Дигидро-1H-пирроло[1,2-а]бензимидазол-6-ил)-1-бензил-5-трифторметил-1H-пирроло[2,3-b]пиридин-2-карбоксамид (соединение 8 в табл. 2). К раствору 0,18 г (1,03 ммоль) 6-амино-2,3-дигидро-1H-пирроло[1,2-а]бензимидазола (Freedmanet al., J. Het. Chem., 1966, 3, (3), 257-259) в 20 мл безводного толуола в атмосфере аргона добавляют 0,65 мл триметилалюминия (2 M раствор в толуоле). Через 15 мин перемешивания при 0 С смесь нагревают до 50 С и перемешивают в течение 30 мин. Затем смесь охлаждают до 0 С и добавляют 0,3 г(0,86 ммоль) этил-1-бензил-5-трифторметил-1H-пирроло[2,3-b]пиридин-2-карбоксилата, полученного на стадии 4.1. Реакционную смесь нагревают при кипении с обратным холодильником в течение 6 ч, затем охлаждают и при перемешивании добавляют 150 мл воды, 2 капли 35%-ного водного раствора гидроксида натрия и 150 мл дихлорметана. Водный слой отделяют и экстрагируют дихлорметаном два раза по 50 мл. Органические слои объединяют, промывают 100 мл воды, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученное вещество очищают хроматографией на колонке с диоксидом кремния, элюируя смесью метанол-дихлорметан. Таким образом получают 0,37 г вещества, которое перекристаллизовывают из ацетонитрила с получением после сушки в вакууме 0,3 г требуемого соединения в виде порошка. Температура плавления: 268-270 С. ЯМР 1H (ДМСО D6),(м.д.): 2,6 (м, 2 Н); 2,9 (т, 2 Н); 4,04 (т, 2 Н); 6 (с, 2 Н); 7,12 (м, 5 Н); 7,42 (м, 3 Н); 7,92 (с, 1 Н); 8,7 (д, 2 Н). Пример 9. N-(Пиридо[1,2-а]бензимидазол-7-ил)-5-фтор-1-(3-фторбензил)-1H-индол-2-карбоксамидChem., 2004, (40), 11, 1694-1696) в 70 мл безводного толуола в атмосфере аргона добавляют 1,19 мл триметилалюминия (2 М раствор в толуоле). Через 15 мин перемешивания при 0 С смесь нагревают до 50 С и перемешивают в течение 30 мин. Затем смесь охлаждают до 0 С и добавляют 0,5 г (1,9 ммоль) этил-5 фтор-1-(3-фторбензил)-1H-индол-2-карбоксилата, полученного на стадии 2.1. Реакционную смесь нагре- 20014450 вают при кипении с обратным холодильником в течение 12 ч, затем охлаждают и добавляют к 20 мл 1 н. ледяного раствора хлористо-водородной кислоты. рН водного слоя доводят до 9. Нерастворенное вещество отделяют фильтрованием и очищают препаративной хроматографией (элюент: дихлорметанметанол). Очищенное таким образом вещество перекристаллизовывают из метанола. После сушки при пониженном давлении получают 0,53 г требуемого соединения в виде белого твердого вещества. Температура плавления (основание): 261-262 С. ЯМР 1 Н (ДМСО D6),(м.д.): 5,9 (с, 2H); 7,01 (м, 6 Н); 7,55 (м, 6 Н); 8,2 (д, 2 Н); 9,0 (с, 1 Н). Пример 10. N-(Пиридо[1,2-а]бензимидазол-7-ил)-5-фтор-1-[(пиридин-4-ил)метил]-1H-индол-2-карбоксамид (соединение 149 в табл. 3). К раствору 0,442 г (2,41 ммоль) 7-аминопиридо[1,2-а]бензимидазола (Begunov et al., Russian J. Org.Chem., 2004, (40), 11, 1694-1696) в 70 мл безводного толуола в атмосфере аргона добавляют 1,51 мл триметилалюминия (2 М раствор в толуоле). Через 15 мин перемешивания при 0 С смесь нагревают до 50C и перемешивают в течение 30 мин. Затем смесь охлаждают до 0 С и добавляют 0,6 г (2,01 ммоль) этил-5 фтор-1-[(пиридин-4-ил)метил]-1H-индол-2-карбоксилата, полученного на стадии 1.1. Реакционную смесь нагревают при кипении с обратным холодильником в течение 12 ч, затем охлаждают и добавляют к 20 мл 1 н. ледяного раствора хлористо-водородной кислоты. рН водного слоя доводят до 9. Нерастворенное вещество отделяют фильтрованием и очищают препаративной хроматографией (элюент: дихлорметан-метанол). Очищенное таким образом вещество перекристаллизовывают из метанола. После сушки при пониженном давлении получают 0,35 г требуемого соединения в виде белого твердого вещества. Температура плавления (основание): 277-278 С. ЯМР 1 Н (ДМСО D6),(м.д.): 5,9 (с, 2 Н); 6,99 (м, 3 Н); 7,11 (дт, 1 Н); 7,58 (м, 6 Н); 8,21 (м, 2 Н); 8,44(д, 2 Н); 9,05 (д, 1 Н). Пример 11. N-(Пиримидо[1,2-a]бензимидазол-7-ил)-5-фтор-1-(3-фторбензил)-1H-индол-2-карбоксамид (соединение 150 в табл. 3). 11.1. 5-Фтор-1-(3-фторбензил)-1H-индол-2-карбоновая кислота. Водный раствор гидроксида натрия, приготовленный исходя из 1,15 г (28,92 ммоль) гидроксида натрия в таблетках в 50 мл воды, добавляют к раствору 7,6 г (24,10 ммоль) этил-5-фтор-1-(3-фторбензил)1H-индол-2-карбоксилата (полученного на стадии 2.1) в 240 мл этанола. Смесь нагревают в течение двух часов и затем концентрируют при пониженном давлении. Образовавшееся твердое вещество растворяют в 200 мл воды. Раствор промывают этиловым эфиром два раза по 100 мл, подкисляют последующим добавлением небольшого количества концентрированной хлористо-водородной кислоты и затем экстрагируют 200 мл этилацетата. В завершение органические слои промывают водой два раза по 100 мл и один раз 50 мл насыщенного раствора хлорида натрия, сушат над сульфатом магния и концентрируют при пониженном давлении. После сушки при 50 С и пониженном давлении получают 6,4 г требуемого соединения в виде твердого вещества, которое используют в таком виде на следующей стадии. 11.2. N-(Пиримидо[1,2-a]бензимидазол-7-ил)-5-фтор-1-(3-фторбензил)-1H-индол-2-карбоксамид (соединение 150). К перемешиваемому при 20 С раствору 0,22 г (0,76 ммоль) соединения, полученного на стадии 11.1, 14 6 мг (0,76 ммоль) гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDAC) и 103 мг (0,76 ммоль) 1-гидроксибензотриазола (НОВТ) в 5 мл ДМФА добавляют 140 мг (0,532 ммоль) 7 аминопиримидо[1,2-а]бензимидазол (VII-h) 70%-ной чистоты. Реакционную смесь перемешивают в течение 48 ч при 20 С и затем выливают в 50 мл воды. Далее смесь экстрагируют этилацетатом три раза по 30 мл. Объединенные органические слои промывают водой два раза по 20 мл, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученное вещество очищают хроматографией на колонке с диоксидом кремния, элюируя смесью дихлорметана и метанола. Таким образом получают 90 мг требуемого соединения.tпл=295-298C. ЯМР 1 Н (ДМСО D6),(м.д.): 10,7 (с, 1 Н); 9,49 (д, 1H); 8,82 (д, 1H); 8,3 (м, 2 Н); 7,79 (д, 1 Н); 7,6 (м,2H); 7,47 (с, 1 Н); 7,31 (м, 1 Н); 7,17 (м, 2 Н); 7,05 (м, 1 Н); 6,82 (м, 2 Н); 5,93 (с, 2 Н). Пример 12. Гидрохлорид (1:1) N-(2-метоксипирроло[1,2-а]бензимидазол-6-ил)-5-фтор-1-(3 фторбензил)-1H-индол-2-карбоксамида (соединение 154 в табл. 4). Соединение 154 получают по методике, аналогично описанной в примере 11.2, исходя из кислоты, полученной на стадии 11.1, и 6-амино-2-метоксипирроло[1,2-а]бензимидазола (VII-l). Затем полученное твердое вещество растворяют при нагревании в смеси 2,1 мл 0,1 н. раствора хлористо-водородной кислоты в изопропаноле и 1 мл метанола. После охлаждения реакционной массы осадок отделяют фильтрованием и сушат при пониженном давлении. Таким образом получают требуемое соединение в виде гидрохлорида.tпл (HCl 1:1)=225-230 С. ЯМР 1 Н (ДМСО D6),(м.д.): 5,91 (с, 2 Н); 6,81-7,38 (м, 5 Н); 7,58 (м, 3 Н); 7,91 (д, 1 Н); 8,22 (д, 1 Н); 8,49 (м, 2 Н); 9,2 (д, 1 Н); 9,33 (с, 1 Н); 10,8 (с, 1 Н). Пример 14. N-(2,3-Дигидро-3-метилимидазо[1,2-а]бензимидазол-6-ил)-5-фтор-1-(3-фторбензил)-1Hиндол-2-карбоксамид ( 26 в табл. 2). Соединение 26 получают по методике, аналогично описанной в примере 1.2, исходя из этил-5 фтор-1-(3-фторбензил)-1H-индол-2-карбоксилата, полученного на стадии 2.1, и 6-амино-2,3-дигидро-1 метилимидазо[1,2-а]бензимидазола (VII-c).(Nazare M. et al., Angewandte Chemie, International Ed., 2004, 43(34), 4526-4528) в 2 мл безводного тетрагидрофурана при перемешивании добавляют 0,14 г (0,871 ммоль) (хинол-2-ил)метанола, 0,228 г(0,871 ммоль) трифенилфосфина и 0,151 г (0,871 ммоль) диэтилазодикарбоксилата (DEAD). Через 20 ч перемешивания при комнатной температуре реакционную смесь концентрируют при пониженном давлении и полученное вещество очищают хроматографией на колонке с диоксидом кремния, элюируя смесью дихлорметана и гептана. Таким образом получают 0,18 г требуемого соединения в виде маслянистого вещества желтого цвета. 15.2. N-(2,3-Дигидро-1H-пирроло[1,2-а]бензимидазол-6-ил)-1-[(хинол-2-ил)метил]-5-трифторметил 1H-пирроло[2,3-b]пиридин-2-карбоксамид (соединение 50). Соединение 50 получают по методике, аналогично описанной в примере 5, исходя из 0,18 г(0,45 ммоль) соединения, полученного на стадии 15.1, и 0,094 г (0,541 ммоль) 6-амино-2,3-дигидро-1Hпирроло[1,2-а]бензимидазола (Freedman et al., J. Met. Chem., 1966, 3, (3), 257-259). Таким образом получают 0,22 г требуемого соединения.(д, 1 Н); 7,55-7,46 (м, 2 Н); 7,6 (с, 1 Н); 7,67 (дт, 1 Н); 7,8 (д, 1 Н); 7,95-7,81 (м, 2 Н); 8,27 (д, 1 Н); 8,73 (с, 2 Н); 10,65 (с, 1 Н). Пример 16. N-(1,2,3,4-Тетрагидропиразино[1,2-а]бензимидазол-7-ил)-5-фтор-1-(3-фторбензил)-1Hиндол-2-карбоксамид ( 25 в табл. 2). 16.1. N-(2-Бензилоксикарбонил-1,2,3,4-тетрагидропиразино[1,2-а]бензимидазол-7-ил)-5-фтор-1-(3 фторбензил)-1H-индол-2-карбоксамид. Соединение получают по методике, аналогично описанной в примере 11.2, исходя из 5-фтор-1-(3 фторбензил)-1H-индол-2-карбоновой кислоты, описанной в примере 11.1, и амина VII-f. 16.2. N-(1,2,3,4-Тетрагидропиразино[1,2-а]бензимидазол-7-ил)-5-фтор-1-(3-фторбензил)-1H-индол 2-карбоксамид (соединение 25). Суспензию 1 г (1,69 ммоль) соединения, полученного на предыдущей стадии, и 0,1 г 10% палладия на угле в 100 мл этанола перемешивают в течение 6 ч при 20 С в атмосфере водорода при давлении 5,5 бар. Затем суспензию фильтруют через целитовый фильтр и концентрируют при пониженном давлении. Полученное вещество очищают хроматографией на колонке с диоксидом кремния, элюируя смесью дихлорметана и метанола. Очищенное вещество растворяют в 10 мл 0,1 н. раствора хлористо-водородной кислоты в изопропаноле, раствор концентрируют при пониженном давлении и образовавшееся твердое вещество растирают в этиловом эфире, с получением 0,48 г требуемого соединения.tпл (1 HCl)=276-284 С. ЯМР 1 Н (ДМСО D6),(м.д.): 3,73 (т, 2 Н); 4,38 (т, 2 Н); 4,59 (с, 3 Н); 5,59 (с, 2 Н); 6,9 (м, 2 Н); 7,02 (тд,1 Н); 7,15 (тд, 1 Н); 7,31 (м, 1 Н); 7,45 (с, 1 Н); 7,58 (м, 3 Н); 8,1 (с, 1H); 9,97 (с, 1 Н); 10,45 (с, 1 Н). Пример 17. N-(3-Метил-1,2,3,4-тетрагидропиразино[1,2-а]бензимидазол-7-ил)-5-фтор-1-(3-фторбензил)-1H-индол-2-карбоксамид ( 81 в табл. 2). Соединение 81 получают по методике, аналогично описанной в примере 6, исходя из этил-5 фтор-1-(3-фторбензил)-1H-индол-2-карбоксилата, полученного на стадии 2.1, и 7-амино-3-метил-1,2,3,4 тетрагидропиразино[1,2-а]бензимидазола (VII-е). ЯМР 1H (ДМСО D6),(м.д.): 2,45 (с, 3 Н); 2,89 (т, 2 Н); 3,74 (с, 2 Н); 4,1 (т, 2 Н); 5,9 (с, 2 Н); 6,81-7,6- 22014450 Пример 18. N-(2,3-Дигидро-1H-пирроло[1,2-а]бензимидазол-6-ил)-5-фтор-1-(2-бензилоксиэтил)-1Hиндол-2-карбоксамид ( 84 в табл. 2). 18.1. Этил-5-фтор-1-(2-бензилоксиэтил)-1H-индол-2-карбоксилат. 94 мкл (0,657 ммоль) 2-бензилоксиэтанола и 50,4 мг (0,438 ммоль) (цианометилен)триметилфосфорана (Tet. Lett., 1996, 37, 2459-2462) добавляют к раствору 68 мг (0,329 ммоль) этил-5-фтор-1Hиндол-2-карбоксилата в 2 мл толуола при перемешивании при 20 С. Реакционную смесь нагревают в течение 12 ч при 110 С, затем концентрируют при пониженном давлении, растворяют в 20 мл этилового эфира, фильтруют через целит и концентрируют при пониженном давлении. Полученный остаток очищают препаративной ВЭЖХ, элюируя смесью воды, ацетонитрила и трифторуксусной кислоты. Таким образом получают 99 мг желтого маслянистого вещества. ЯМР 1 Н (ДМСО D6),(м.д.): 1,3 (т, 3 Н); 3,72 (т, 2 Н); 4,28 (кв, 2 Н); 4,38 (с, 2 Н); 4,81 (т, 2 Н); 7,28-7,07 (м, 7 Н); 7,45 (дд, 1 Н); 7,68 (дд, 1 Н). 18.2. N-(2,3-Дигидро-1H-пирроло[1,2-a]бензимидазол-6-ил)-5-фтор-1-(2-бензилоксиэтил)-1H-индол 2-карбоксамид (соединение 84). Соединение 84 получают по методике, аналогично описанной в примере 6, исходя из этил-5 фтор-1-(2-бензилоксиэтил)-1 Н-индол-2-карбоксилата, полученного на предыдущей стадии, и 6-амино 2,3-дигидро-1H-пирроло[1,2-а]бензимидазола (Freedman et al., J. Het. Chem., 1966, 3, (3), 257-259).(м, 2 Н); 7,01-7,19 (м, 6 Н); 7,25 (с, 1 Н); 7,31-7,62 (м, 3 Н); 7,62 (дд, 1 Н); 7,97 (м, 1 Н); 10,23 (с, 1 Н). Пример 19. N-(2,3-Дигидро-1H-пирроло[1,2-а]бензимидазол-6-ил)-5-фтор-1-2-[(5-метилпиридин-2 ил)окси]этил-1H-индол-2-карбоксамид ( 82 в табл. 2). 19.1. 2-[(5-Метилпиридин-2-ил)окси]этанол. Суспензию 0,291 мл (4,12 ммоль) 2-бромэтанола, 0,3 г (2,75 ммоль) 2-гидрокси-5-метилпиридина и 0,85 г (6,18 ммоль) карбоната калия в 3 мл диметилформамида сильно перемешивают и нагревают при кипении с обратным холодильником в течение 12 ч. Затем смесь разбавляют 100 мл воды и экстрагируют 100 мл дихлорметана. Органический слой промывают 50 мл воды, сушат над сульфатом натрия, концентрируют при пониженном давлении и затем хроматографируют на колонке с диоксидом кремния, элюируя смесью гексана и этилацетата. Таким образом получают требуемое соединение. ЯМР 1 Н (ДМСО D6),(м.д.): 2,2 (с, 3 Н); 3,66-3,71 (м, 2 Н); 4,22 (т, 2 Н); 4,77 (т, 1 Н); 6,71 (д, 1 Н); 7,51(дд, 1 Н); 7,95 (дд, 1 Н). 19.2. Этил-5-фтор-1-2-[(5-метилпиридин-2-ил)окси]этил-1H-индол-2-карбоксилат. Промежуточное соединение этил-5-фтор-1-2-[(5-метилпиридин-2-ил)окси]этил-1H-индол-2 карбоксилат получают по методике, аналогично описанной в примере 18.1, исходя из этил-5-фтор-1Hиндол-2-карбоксилата и 2-(5-метилпиридин-2-илокси)этанола, полученного на предыдущей стадии. 19.3. N-(2,3-Дигидро-1H-пирроло[1,2-а]бензимидазол-6-ил)-5-фтор-1-2-[(5-метилпиридин-2-ил)окси]этил-1H-индол-2-карбоксамид (соединение 82). Соединение 82 получают по методике, аналогично описанной в примере 6, исходя из соединения, полученного на предыдущей стадии, и 6-амино-2,3-дигидро-1H-пирроло[1,2-а]бензимидазола(м, 2 Н); 6,41 (д, 1 Н); 7,11 (дт, 1 Н); 7,21 (с, 1 Н); 7,32-7,56 (м, 4 Н); 7,62 (дд, 1 Н); 7,89 (д, 1 Н); 7,97 (д, 1 Н); 10,29 (с, 1 Н). Пример 20. N-(2,3-Дигидро-1H-пирроло[1,2-а]бензимидазол-6-ил)-5-фтор-1-[2-[(5-трифторметил)пиридин-2-ил]оксиэтил]-1H-индол-2-карбоксамид ( 83 в табл. 2). 20.1. 2-[(5-Трифторметил)пиридин-2-ил]оксиэтанол. Соединение получают по методике, аналогично описанной в примере 19.1, исходя из 2-бромэтанола и 2-гидрокси-(5-трифторметил)пиридина. 20.2. Этил-5-фтор-1-[2-[(5-трифторметил)пиридин-2-ил]оксиэтил]-1H-индол-2-карбоксилат. Данное промежуточное соединение получают по методике, аналогично описанной в примере 18.1,исходя из этил-5-фтор-1H-индол-2-карбоксилата и 2-[(5-трифторметил)пиридин-2-ил]окси]этанола, полученного на предыдущей стадии. 20.3. N-(2,3-Дигидро-1H-пирроло[1,2-a]бензимидазол-6-ил)-5-фтор-1-[2-[(5-трифторметил)пиридин-2-ил]оксиэтил]-1H-индол-2-карбоксамид (соединение 83). Соединение 83 получают по методике, аналогично описанной в примере 6, исходя из этил-5 фтор-1-[2-[(5-трифторметил)пиридин-2-ил]оксиэтил]-1H-индол-2-карбоксилата, полученного на предыдущей стадии, и 6-амино-2,3-дигидро-1 Н-пирроло[1,2-а]бензимидазола (Freedman et al., J. Het. Chem.,1966, 3, (3), 257-259).(д, 1 Н); 7,11 (дт, 1 Н); 7,23 (с, 1 Н); 7,3-7,52 (м, ЗН); 7,63 (дд, 1 Н); 7,84 (дд, 1 Н); 7,97 (с, 1 Н); 8,45 (с, 1 Н); 10,28 (с, 1 Н). Пример 21. N-(3,4-Дигидро-1H-оксазино[1,4][4,3-а]бензимидазол-7-ил)-1-бензил-5-фтор-1H-пирроло[2,3-b]пиридин-2-карбоксамид ( 127 в табл. 2). 21.1. 2-Амино-3-йод-5-фторпиридин. В двугорлую колбу объемом 500 мл, снабженную магнитной мешалкой, вносят 5 г (44,6 ммоль) 2-амино-5-фторпиридина, 13,9 г (44,6 ммоль) сульфата серебра и 400 мл этанола. Затем небольшими порциями добавляют 11,31 г (44,6 ммоль) йода в порошке. Перемешивают при комнатной температуре в течение 24 ч. Нерастворенное вещество отделяют фильтрованием и промывают этанолом и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток обрабатывают смесью этилацетата (200 мл) и раствора карбоната натрия (200 мл). После разделения органический слой промывают последовательно 25%-ным водным раствором тиосульфата натрия, затем насыщенным водным раствором хлорида натрия, далее сушат над сульфатом натрия и концентрируют при пониженном давлении. Образовавшееся твердое вещество очищают хроматографией на колонке с диоксидом кремния, элюируя смесью н-гептана и этилацетата. Получают 2,67 г (11,22 ммоль) требуемого соединения. ЯМР 1H (ДМСО D6),(м.д.): 7,95 (с, 1 Н); 7,85 (с, 1 Н); 5,9 (с, NH2). 21.2. 5-Фтор-1H-пирроло[2,3-b]пиридин-2-карбоновая кислота. В герметизируемый, снабженный магнитной мешалкой и продуваемый аргоном цилиндрический реактор объемом 25 мл вносят 0,5 г (2,10 ммоль) 2-амино-3-йод-5-фторпиридина, полученного на стадии 5.1, 0,55 г (6,3 ммоль) пировиноградной кислоты, 0,71 г (6,3 ммоль) 1,4-диазабицикло[2,2,2]октана(DABCO) и 15 мл безводного диметилформамида. Через несколько минут добавляют 0,05 г (0,22 ммоль) ацетата палладия. Реакционную смесь перемешивают и продувают аргоном в течение 20 мин, затем быстро герметизируют и выдерживают при 100 С в течение 2 ч 30 мин. Охлажденный раствор концентрируют при пониженном давлении. Затем остаток обрабатывают этилацетатом (100 мл) и водой (75 мл). Органический слой промывают водой и затем экстрагируют 2 н. водным раствором гидроксида натрия два раза по 50 мл. Щелочные водные слои объединяют, охлаждают до 0 С и затем подкисляют добавлением хлористо-водородной кислоты (рН 3). Раствор экстрагируют этилацетатом (450 мл), объединенные органические слои сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Получают 0,158 г (0,88 ммоль) требуемого соединения в виде порошка желтого цвета. ЯМР 1 Н (ДМСО D6),(м.д.): 13,2 (с, 1 Н); 12,4 (с, 1 Н); 8,4 (д, 1 Н); 7,95 (дд, 1 Н); 7,1 (д, 1 Н). 21.3. Этил-5-фтор-1H-пирроло[2,3-b]пиридин-2-карбоксилат. В колбу объемом 100 мл, снабженную магнитной мешалкой, вносят 0,2 г (1,11 ммоль) кислоты, полученной на стадии 21.2, и 10 мл этанола. К реакционной смеси добавляют 1 мл концентрированной серной кислоты и затем нагревают при кипении с обратным холодильником в течение 18 ч. Охлажденный раствор концентрируют досуха при пониженном давлении. Остаток растворяют в этилацетате (50 мл) и промывают последовательно однонормальным водным раствором гидроксида натрия (210 мл), водой(10 мл) и затем насыщенным водным раствором хлорида натрия. Органический слой сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Получают 0,21 г требуемого соединения. ЯМР 1 Н (ДМСО D6),(м.д.): 12,6 (с, NH); 8,4 (д, 1 Н); 8,0 (дд, 1 Н); 7,1 (д, 1 Н); 4,35 (кв, 2 Н); 1,35 (т,3 Н). 21.4. Этил-1-бензил-5-фтор-1H-пирроло[2,3-b]пиридин-2-карбоксилат. Этил-1-бензил-5-фтор-1H-пирроло[2,3-b]пиридин-2-карбоксилат получают по методике, аналогично описанной в примере 4.1, исходя из бензилового спирта и этил-5-фтор-1 Н-пирроло[2,3-b]пиридин-2 карбоксилата, полученного на предыдущей стадии.tпл=74-75C. 21.5. N-(3,4-Дигидро-1H-оксазино[1,4][4,3-а]бензимидазол-7-ил)-1-бензил-5-фтор-1H-пирроло[2,3b]пиридин-2-карбоксамид (соединение 127). Соединение 127 получают по методике, аналогично описанной в примере 4.2, исходя из этил-1 бензил-5-фтор-1H-пирроло[2,3-b]пиридин-2-карбоксилата, описанного на предыдущей стадии, и 7 аминоморфолино[4,3-а]бензимидазола (Mullock E.B., J. Chem. Soc, Section С, 1970, (6), 829-833).- 24014450 Пример 23. N-(2,3-Дигидро-1H-пирроло[1,2-a]бензимидазол-6-ил)-1-бензил-5-трифторметил-1Hпирроло[3,2-b]пиридин-2-карбоксамид (соединение 129 в табл. 2). 23.1. 3-Амино-2-йод-6-(трифторметил)пиридин. 1,56 г (6,17 ммоль) йода несколькими порциями добавляют при перемешивании в атмосфере аргона при 20 С к смеси 1 г (6,17 ммоль) 3-амино-6-(трифторметил)пиридина и 1,25 г (6,17 ммоль) сульфата серебра в 40 мл этанола. Затем перемешивают при комнатной температуре в течение 18 ч. Нерастворенное вещество отделяют фильтрованием и промывают этанолом, фильтрат концентрируют при пониженном давлении и остаток растворяют в 100 мл дихлорметана. Органический слой промывают последовательно 20 мл 5%-ного водного раствора гидроксида натрия, 40 мл воды и 20 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом натрия, концентрируют при пониженном давлении и затем очищают хроматографией на колонке с диоксидом кремния (элюент: гептан-этилацетат). Таким образом получают 1,17 г требуемого соединения, которое используют в таком виде в последующем синтезе. 23.2. 5-Трифторметилпирроло[3,2-b]пиридин-2-карбоновая кислота. В герметизируемый цилиндрический реактор в атмосфере аргона вносят 0,5 г (1,74 ммоль) 3-амино 2-йод-6-(трифторметил)пиридина, полученного на стадии 23.1, 0,45 г (5,21 ммоль) пировиноградной кислоты, 0,51 мл (5,21 ммоль) 1,4-диазабицикло[2.2.2]октана и 10 мл безводного диметилформамида. Раствор дегазируют в течение нескольких минут, затем добавляют 0,19 г (0,87 ммоль) ацетата палладия, реактор закрывают и нагревают при кипении с обратным холодильником при 130 С в течение 4 ч. Затем охлажденный раствор концентрируют при пониженном давлении и остаток растворяют в 100 мл этилацетата. Органический слой последовательно экстрагируют 2 н. водным раствором гидроксида натрия два раза по 50 мл. Щелочные водные слои объединяют, охлаждают до 0 С, подкисляют добавлением хлористо-водородной кислоты и затем экстрагируют этилацетатом четыре раза по 50 мл. Органические слои объединяют, промывают 20 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Получают 0,22 г вещества, которое используют в таком виде на следующей стадии. 23.3. Этил-5-(трифторметил)пирроло[3,2-b]пиридин-2-карбоксилат. 1 мл (18,71 ммоль) концентрированной серной кислоты добавляют к раствору 0,2 г (0,87 ммоль) 5-трифторметил-1H-пирроло[3,2-b]пиридин-2-карбоновой кислоты, полученной на стадии 23.2, в 10 мл этанола. Перемешивают при кипячении с обратным холодильником в течение 20 ч, далее раствор охлаждают и концентрируют при пониженном давлении. Затем полученный остаток растворяют в 50 мл дихлорметана и далее промывают последовательно 20 мл насыщенного водного раствора гидрокарбоната натрия, 40 мл воды и 20 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Получают 0,19 г вещества, которое используют в таком виде на следующей стадии. 23.4. Этил-1-бензил-5-трифторметил-1H-пирроло[3,2-b]пиридин-2-карбоксилат. Этил-1-бензил-5-трифторметил-1H-пирроло[3,2-b]пиридин-2-карбоксилат получают по методике,аналогично описанной в примере 4.1, исходя из бензилового спирта и соединения, полученного на предыдущей стадии. 23.5. N-(2,3-дигидро-1H-пирроло[1,2-а]бензимидазол-6-ил)-1-бензил-5-трифторметил-1H-пирроло[3,2b]пиридин-2-карбоксамид (соединение 129). Соединение 129 получают по методике, аналогично описанной в примере 4.2, исходя из этил-1 бензил-5-трифторметил-1H-пирроло[3,2-b]пиридин-2-карбоксилата, описанного на предыдущей стадии,и 6-амино-2,3-дигидро-1H-пирроло[1,2-а]бензимидазола (Freedman et al., J. Het. Chem., 1966, 3, (3), 257259).tпл=251-252C. ЯМР 1 Н (ДМСО D6),(м.д.): 2,61 (м, 2 Н); 2,91 (т, 2 Н); 4,09 (т, 2 Н); 5,92 (с, 2 Н); 7,05-7,29 (м, 5 Н); 7,31-7,5 (м, 2 Н); 7,56 (с, 1 Н); 7,7 (д, 1 Н); 7,91 (с, 1 Н); 8,29 (д, 1 Н); 10, 51 (с, 1 Н). Пример 24. N-(2,3-Дигидро-1H-пирроло[1,2-а]бензимидазол-6-ил)-1-[(пиридин-4-ил)метил]-5-фтор 1H-пирроло[2,3-b]пиридин-2-карбоксамид (соединение 130 в табл. 2). 24.1. Этил-1-[(пиридин-4-ил)метил]-5-фтор-1H-пирроло[2,3-b]пиридин-2-карбоксилат. К перемешиваемому при 20 С раствору 5 г (24,02 ммоль) этил-5-фтор-1 Н-пирроло[2,3-b]пиридин-2 карбоксилата (пример 21.3), 3,97 г (36,02 ммоль) (пиридин-4-ил)метанола и 7,5 г (36,02 ммоль) трибутилфосфина в 150 мл толуола в течение четверти часа добавляют 9,18 г (36,02 ммоль) 1,1'-(азодикарбонил)дипиперидина. Реакционную смесь перемешивают в течение 16 ч при 20 С, фильтруют через целит, концентрируют при пониженном давлении и затем растворяют в 100 мл дихлорметана. Органический раствор промывают 5%-ным водным раствором карбоната калия два раза по 50 мл и затем один раз 50 мл воды, сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученное вещество хроматографируют на колонке с диоксидом кремния, элюируя смесью гептана и этилацетата, и таким образом получают 4,5 г требуемого сложного эфира.N-(2,3-Дигидро-1 Н-пирроло[1,2-а]бензимидазол-6-ил)-1-[(пиридин-4-ил)метил]-5-фтор-1Hпирроло[2,3-b]пиридин-2-карбоксамид (соединение 130). Соединение 130 получают по методике, аналогично описанной в примере 1.2, исходя из этил-1[(пиридин-4-ил)метил]-5-фтор-1H-пирроло[2,3-b]пиридин-2-карбоксилата, описанного на предыдущей стадии, и 6-амино-2,3-дигидро-1H-пирроло[1,2-а]бензимидазола (Freedman et al., J. Het. Chem., 1966, 3,(3), 257-259).tпл=130-131C. 25.2. N-(2,3-Дигидро-1H-пирроло[1,2-а]бензимидазол-6-ил)-1-[(пиридин-4-ил)метил]-5-трифторметил-1H-пирроло[3,2-b]пиридин-2-карбоксамид (соединение 131). По методике, аналогично описанной в примере 24.2, исходя из 0,3 г (0,86 ммоль) соединения, полученного на предыдущей стадии, и 0,178 г (1,03 ммоль) 6-амино-2,3-дигидро-1H-пирроло[1,2-а]бензимидазола (Freedman et al., J. Het. Chem., 1966, 3, (3), 257-259), получают 0,25 г требуемого соединения в виде белого твердого вещества.(1,09 ммоль) 5-фтор-1-(3-фторбензил)-1H-индол-2-карбоновой кислоты и 0,22 г (1,09 ммоль) 7-амино-4 метил-1,2,3,4-тетрагидропиримидо[1,2-а]бензимидазола (VII-m). Получают 0,41 г требуемого соединения в виде светло-желтого твердого вещества. Вещество растворяют в 50 мл 0,1 н. раствора хлористоводородной кислоты в изопропаноле. Полученный раствор концентрируют при пониженном давлении и таким образом получают соединение 139 в виде гидрохлорида.tпл=236-237C. ЯМР 1 Н (ДМСО D6),(м.д.): 4,12 (м, 4 Н); 4,91 (с, 2 Н); 5,95 (с, 2 Н); 7,02-7,28 (м, 5 Н); 7,5 (м, 3 Н); 8,01 (д, 1 Н); 8,68 (д, 1 Н); 8,78 (д, 1 Н); 10,55 (с, 1 Н). Пример 28. N-(3,4-Дигидро-1H-оксазино[1,4][4,3-а]бензимидазол-7-ил)-5-фтор-1-(3-фторбензил)1H-индол-2-карбоксамид (соединение 15 в табл. 2). Соединение 15 получают по методике, аналогично описанной в примере 6, взаимодействием этил-5-фтор-1-(3-фторбензил)-1H-индол-2-карбоксилата, полученного на стадии 2.1, и 7-аминооксазино[1,4][4,3-а]бензимидазола (Mullock E.B., J. Chem. Soc, Section С, 1970, (6), 829-833).tпл=169-174C. ЯМР 1 Н (ДМСО D6),(м.д.): 1,51 (с, 9 Н); 4,27 (м, 4 Н); 5,94 (с, 2 Н); 7,09-7,31 (м, 6 Н); 7,42 (дд, 1 Н); 7,58 (с, 1 Н); 7,71 (д, 1 Н); 7,84 (с, 1 Н); 8,29 (д, 1 Н); 10,52 (с, 1 Н). Пример 30. N-(2,3-Дигидроимидазо[1,2-a]бензимидазол-6-ил)-1-бензил-5-трифторметил-1H-пирроло[3,2-b]пиридин-2-карбоксамид (соединение 137 в табл. 2). Раствор 0,18 г (0,31 ммоль) соединения 133 (пример 29) в 10 мл 2 M раствора хлористо- 26014450 водородной кислоты в диэтиловом эфире перемешивают в течение 16 ч при 20 С. Затем выделяют требуемое соединение 137, отделяя фильтрованием желтый осадок, который сушат при пониженном давлении. ЯМР 1 Н (ДМСО D6),(м.д.): 4,3 (м, 4 Н); 5,98 (с, 2 Н); 7,11 (м, 1 Н); 7,25 (м, 3 Н); 7,41 (д, 1 Н); 7,59(дд, 1 Н); 7,68 (с, 1 Н); 7,78 (д, 1 Н); 7,89 (с, 1 Н); 8,35 (д, 1 Н); 9,39 (с, 1 Н); 10,82 (с, 1 Н); 13,35 (с, 1 Н). Следующие ниже табл. 2, 3 и 4 приведены для иллюстрации химической структуры и физических свойств некоторых соединений по настоящему изобретению. В указанных таблицах в столбце "G1" указаны атом или группа атомов в порядке чтения слева направо; в столбце "tпл (С) или [МН]+" указаны температуры плавления соединений в градусах Цельсия (С) или обозначение пика, полученного при масс-спектрометрии с химической ионизацией; в столбце "Соль/основание" знак "-" означает соединение в виде свободного основания, тогда как формула "HCl" означает соединение в виде гидрохлорида и соотношение, приведенное в скобках, означает соотношение (кислота:основание);
МПК / Метки
МПК: C07D 235/02, C07D 487/04, C07D 471/04, A61K 31/437, A61P 29/00, A61K 31/4188
Метки: применение, получение, бензимидазола, трициклических, n-гетероарилкарбоксамидов, группу, производные, содержащих, терапии
Код ссылки
<a href="https://eas.patents.su/30-14450-proizvodnye-triciklicheskih-n-geteroarilkarboksamidov-soderzhashhih-gruppu-benzimidazola-ih-poluchenie-i-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные трициклических n-гетероарилкарбоксамидов, содержащих группу бензимидазола, их получение и применение в терапии</a>
Предыдущий патент: Способ синтеза ингибиторов hmg-coa редуктазы
Следующий патент: Фармацевтическая композиция, содержащая розувастатин кальция
Случайный патент: Соединения и способы лечения или предупреждения инфекций flavivirus