Соединение 2-морфолино-4-пиримидона
Номер патента: 13839
Опубликовано: 30.08.2010
Авторы: Фукунага Кендзи, Ватанабе Казутоси, Кохара Тосиюки, Уехара Фумиаки, Йокосима Сатоси, Хики Синсуке
Формула / Реферат
1. Соединение, представленное формулой (I), его оптически активный изомер или фармацевтически приемлемая соль
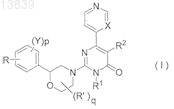
где каждый символ является таким, как определено далее:
X представляет собой СН или N;
R1 представляет собой С1-С12алкил
R2 представляет собой атом водорода;
q представляет собой 0;
р представляет собой 0;
R представляет собой карбоксильную группу, 2,3-дигидроиндолил, пергидроиндолил, пергидроизоиндолил, пергидрохинолинил, пергидроизохинолинил или формулы (1) или (2)

где в формуле (1) R3 представляет собой атом водорода, С1-С6алкил, который может быть замещен гидроксилом или C1-С6алкокси, С3-С7циклоалкил;
R4 представляет собой адамантил, С3-С7циклоалкил, который может быть замещен гидроксилом, гетероциклическую группу или формулу (3)
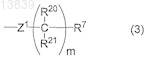
где m представляет собой 0 или целое число от 1 до 4;
Z1 представляет собой карбонильную группу, тиокарбонильную группу или сульфонильную группу;
R20 и R21 являются одинаковыми или разными и каждый представляет собой атом водорода или C1-С6алкил;
R7 представляет собой C1-С6алкил, который может быть замещен гидроксилом, атомом галогена или C1-С6алкокси, С3-С7циклоалкил, который может быть замещен C1-С6алкилом, гидроксилом или C1-С6алкокси, С6-С10арил, который может быть замещен ди(C1-С6алкил)амино, гетероциклическую группу, которая может быть замещена фенилом или С1-С6алкилом, C1-С6алкокси, который может быть замещен фенилом, группу, представленную -NRaRb;
где Ra и Rb являются одинаковыми или разными и каждый представляет собой атом водорода, C1-С6алкил, С3-С7циклоалкил, С6-С10арил, который может быть замещен ди(C1-С6алкил)амино, гетероциклическую группу,
или Ra и Rb связаны с образованием вместе со смежным атомом азота азотсодержащего гетероцикла, который может содержать атом серы или атом кислорода, или R7 и R3 могут быть связаны с образованием цикла, и дополнительно Ra и Rb могут связывать R3 с образованием цикла вместе со смежным атомом азота;
в формуле (2) Z представляет собой карбонильную группу, сульфонильную группу или группу, представленную -O-W-, где W представляет собой C1-С6алкиленовую группу;
R5 и R6являются одинаковыми или разными, и каждый представляет собой атом водорода,
C1-С6алкил, который может быть замещен гидроксилом,
С3-С7циклоалкил,
С6-С10арил или
гетероциклическую группу;
или R3и R4 могут объединяться вместе со смежным атомом азота с образованием циклической аминогруппы, представленной формулой (4)
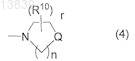
где R10 представляет собой C1-С6алкил, С3-С7циклоалкил, С6-С10арил, гетероциклическую группу, которая может быть замещена C1-С6алкилом или фенилом, C1-С6алкокси, гидроксил, оксогруппу, галоген, нитро, циано или формулу (5)
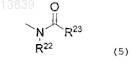
где R22 представляет собой атом водорода или C1-С6алкил, R23 представляет собой C1-С6алкил или С1-С6алкокси; Q представляет собой связь, атом кислорода, атом серы или формулу
![]()
где R24 представляет собой атом водорода, С1-Сбалкил, который может быть замещен гидроксилом или C1-С6алкокси, С6-С10арил, гетероциклическую группу, которая может быть замещена С1-С6алкилом или С6-С10арилом; C1-С6алкилкарбонил;
r представляет собой 0 или целое число от 1 до n+2;
n представляет собой целое число от 1 до 4;
при условии, что если n представляет собой 2 и Q представляет собой связь, то r не равен 0.
2. Соединение, его оптически активный изомер или фармацевтически приемлемая соль по п.1, где R1 представляет собой метильную группу.
3. Соединение, его оптически активный изомер или фармацевтически приемлемая соль по п.1, где R имеет формулу (1).
4. Соединение, его оптически активный изомер или фармацевтически приемлемая соль по п.1, где R имеет формулу (2).
5. Соединение, его оптически активный изомер или фармацевтически приемлемая соль по п.3, где R4 имеет формулу (3).
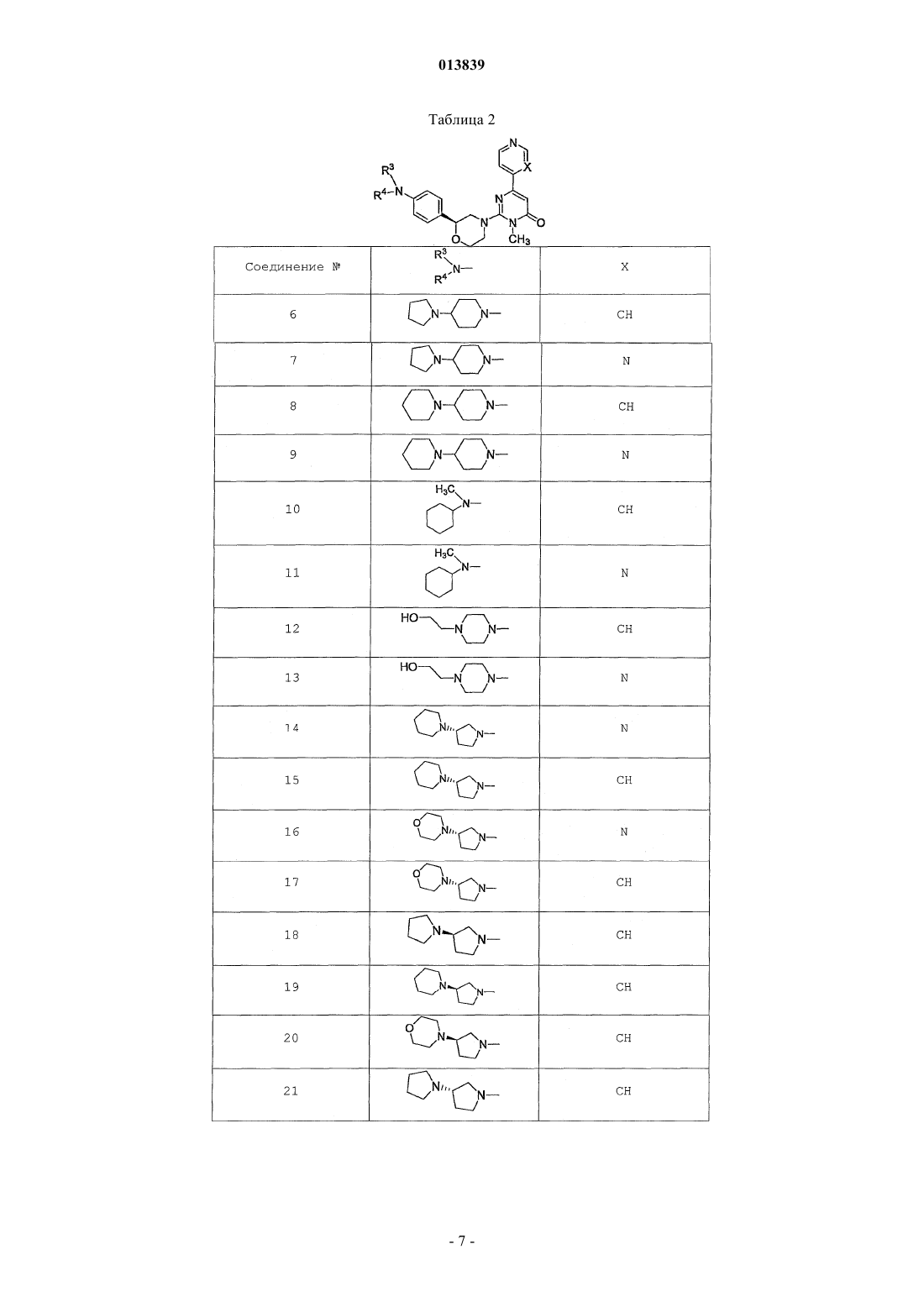
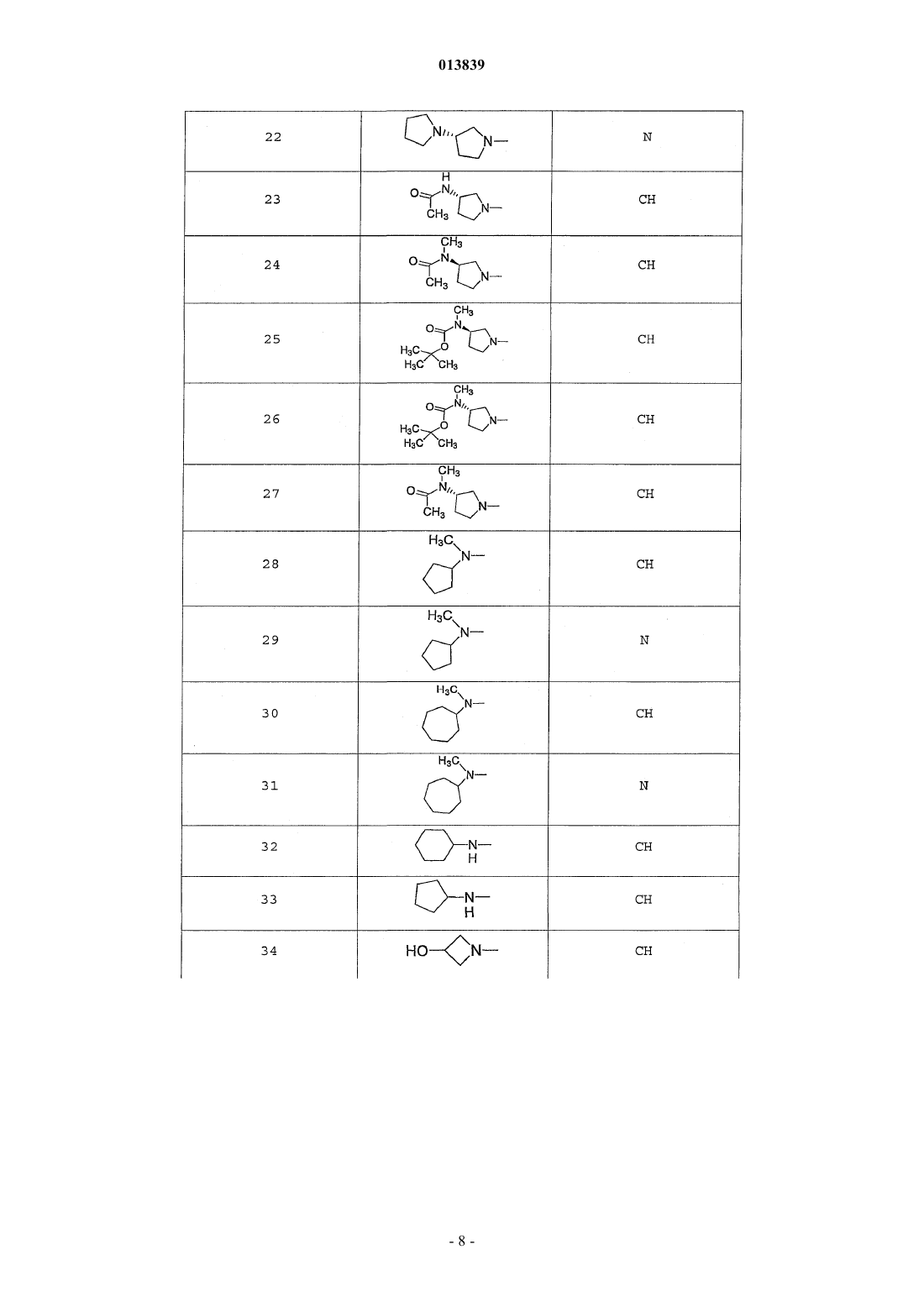
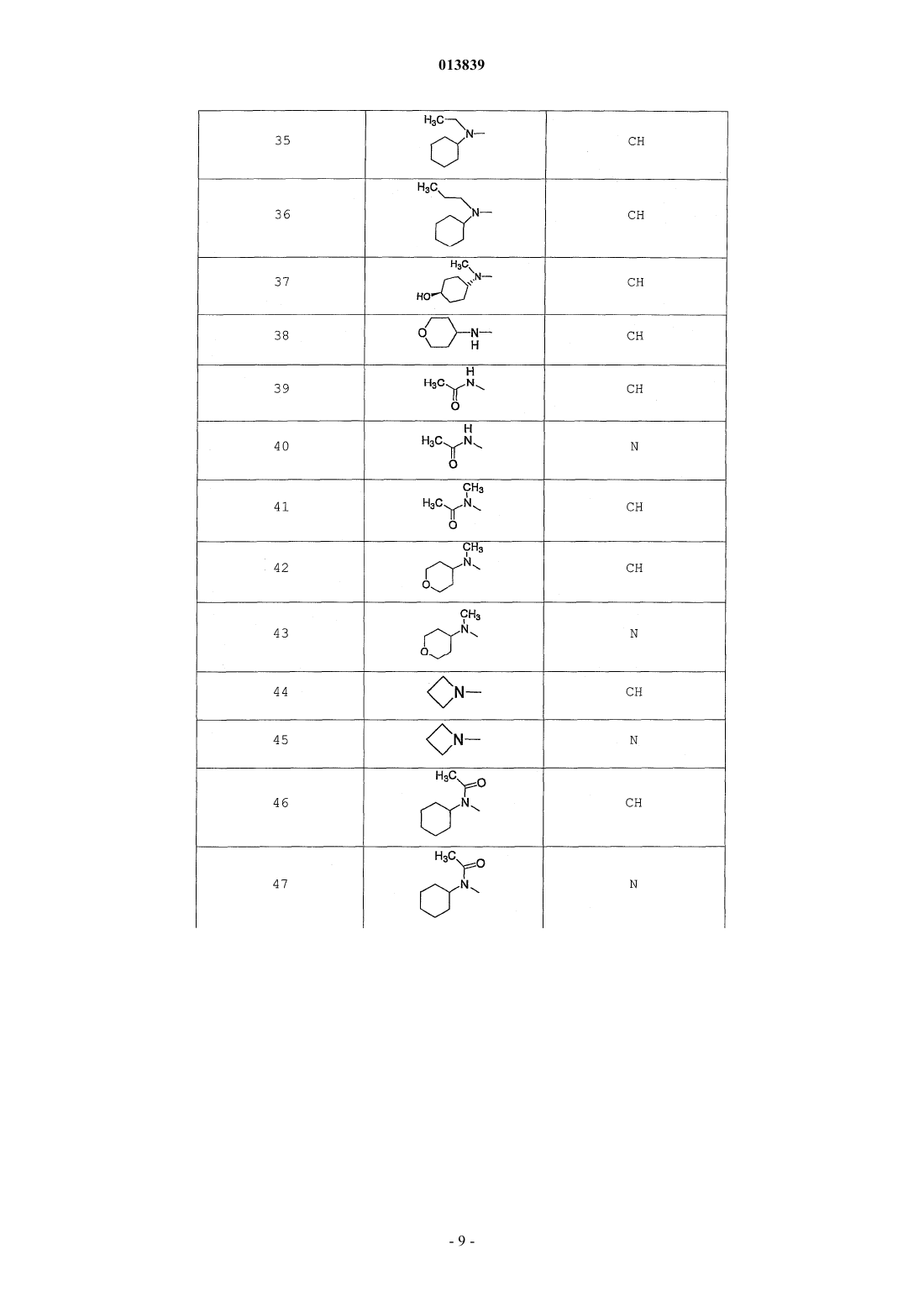
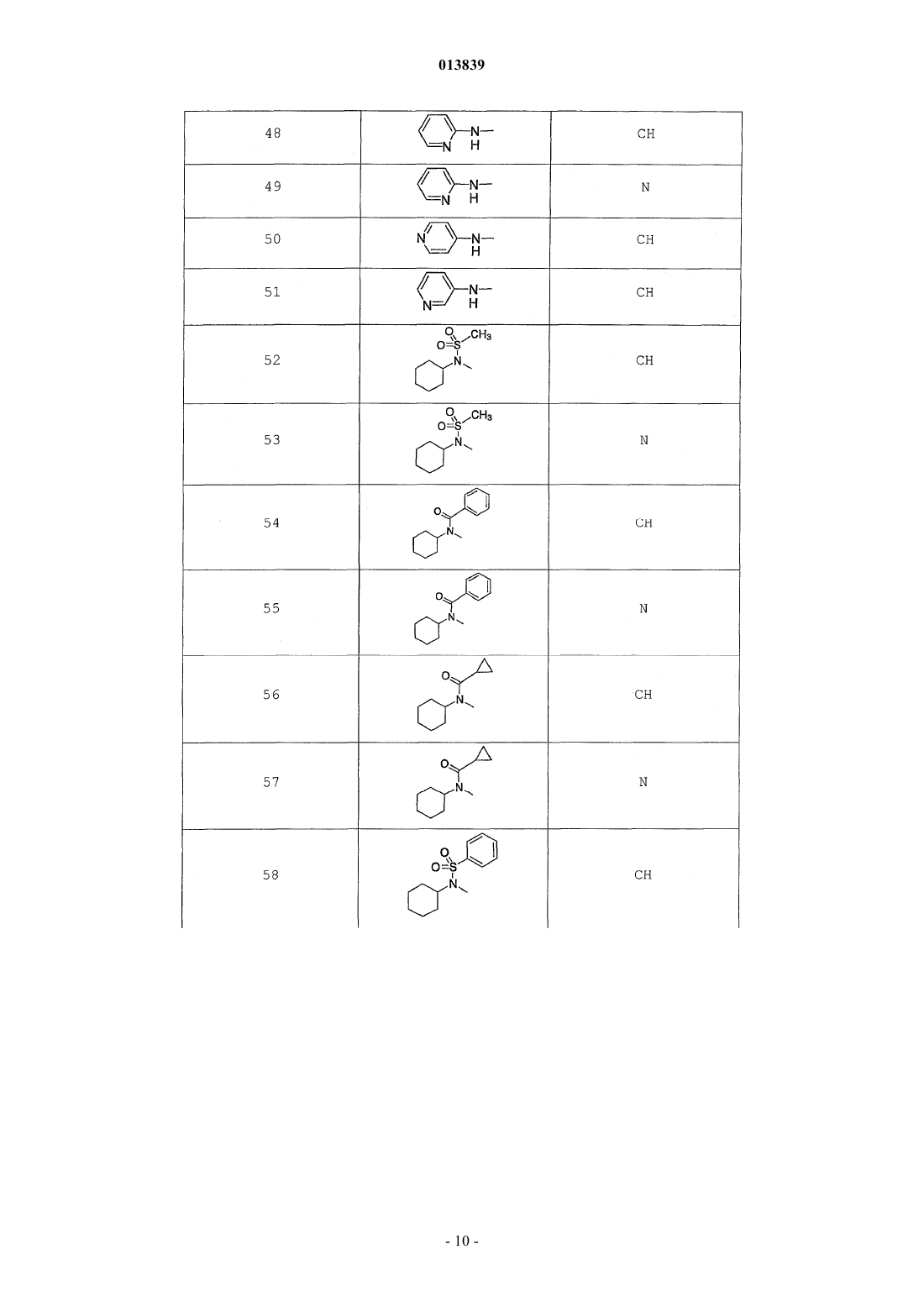
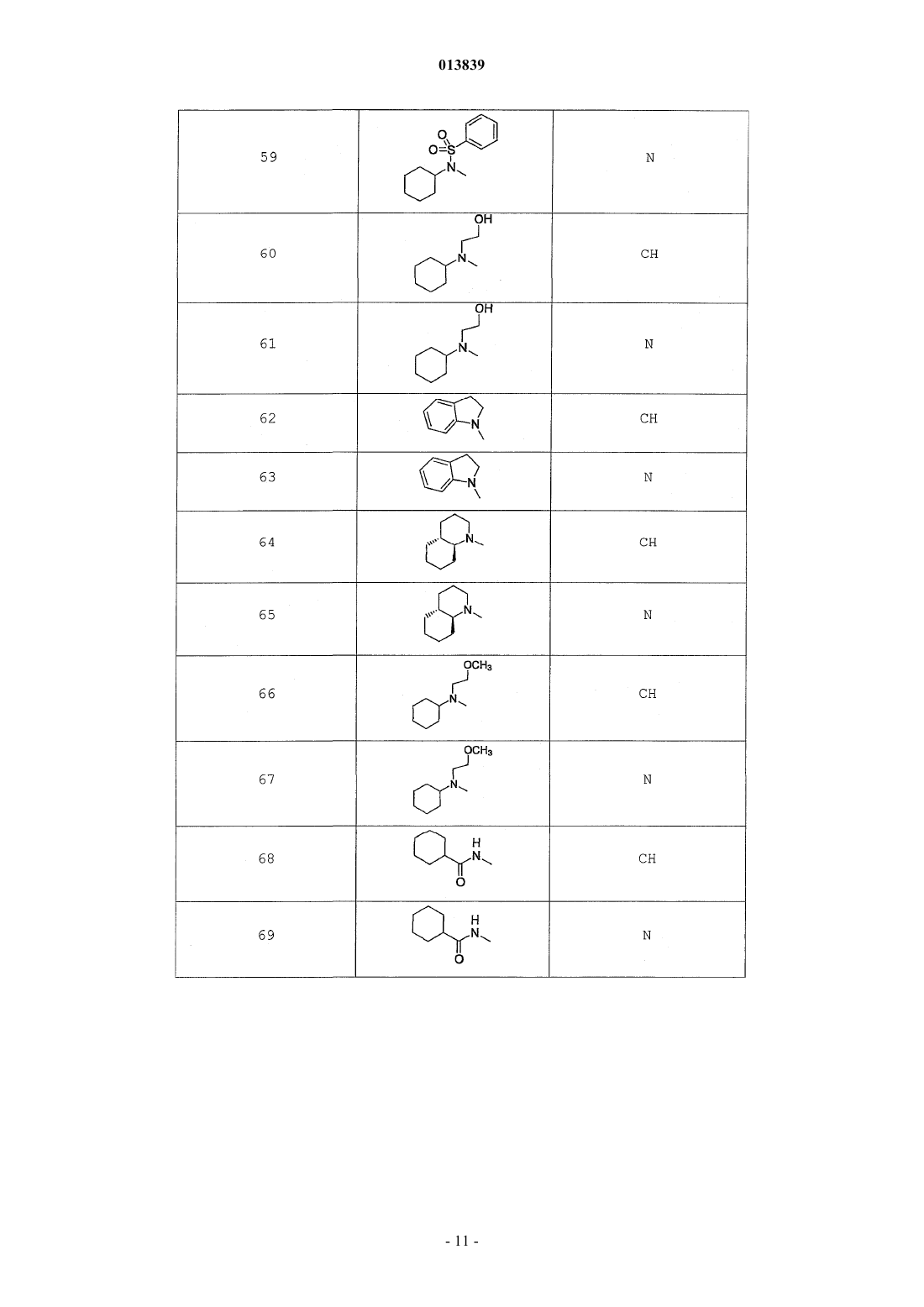
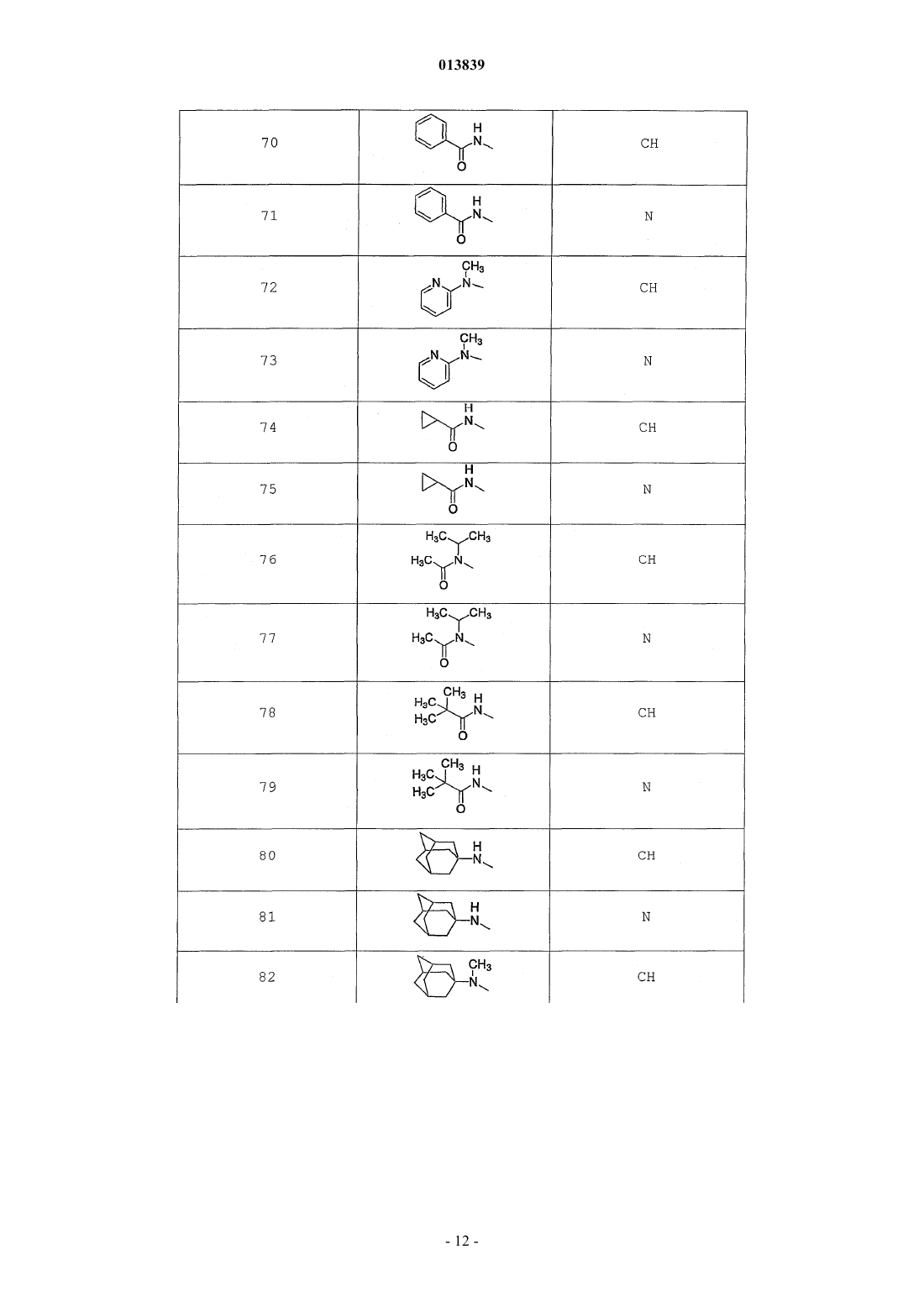
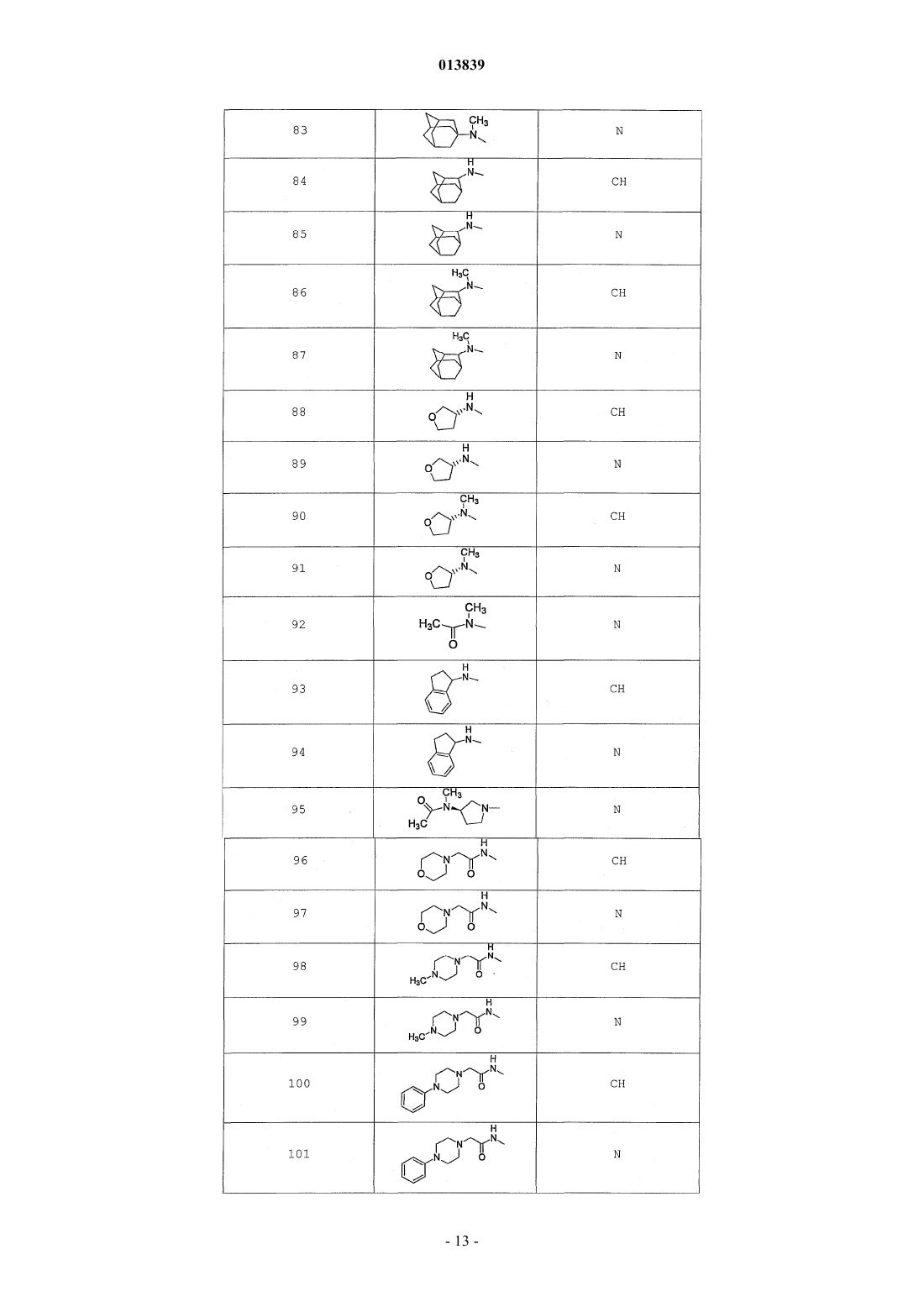
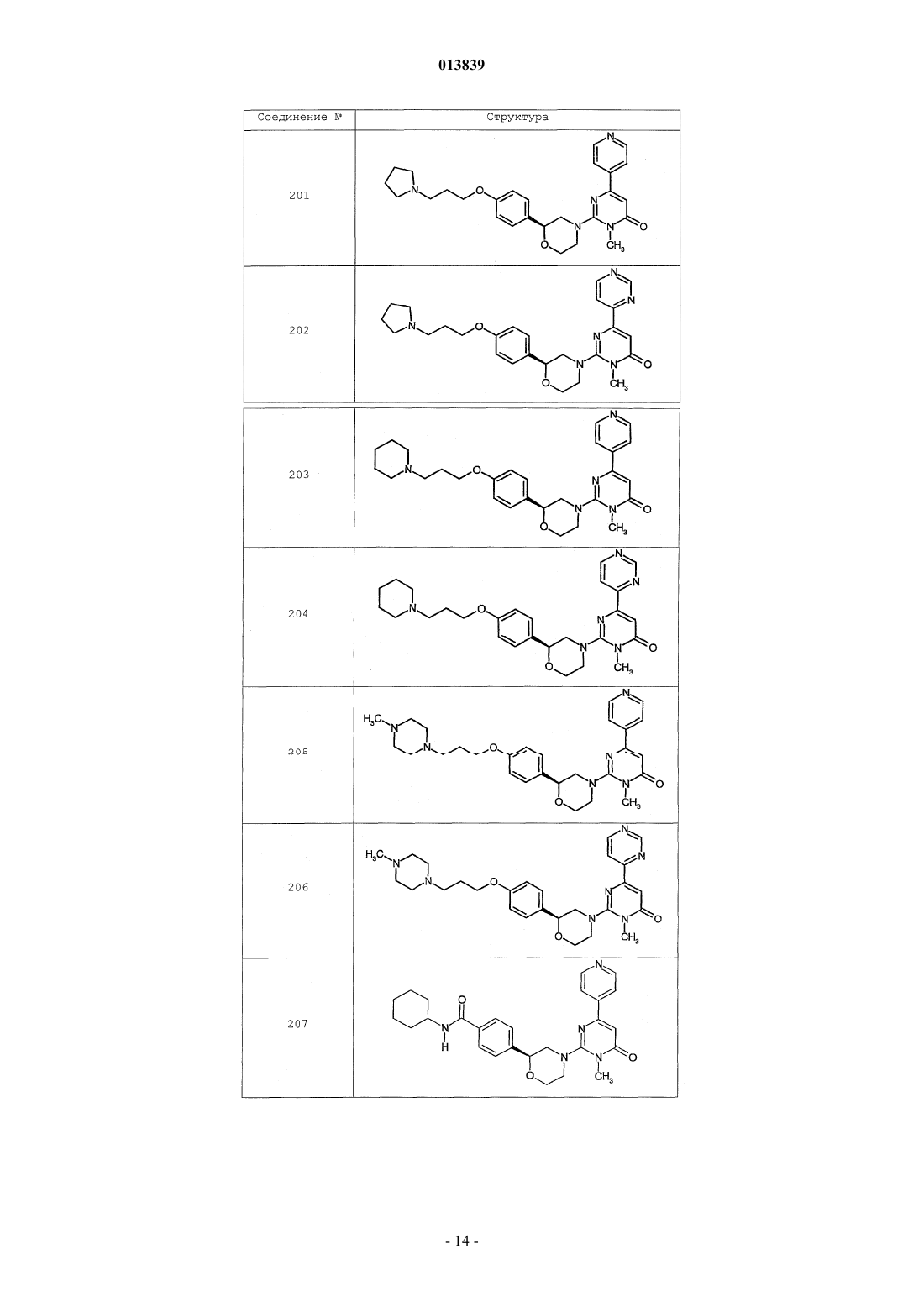
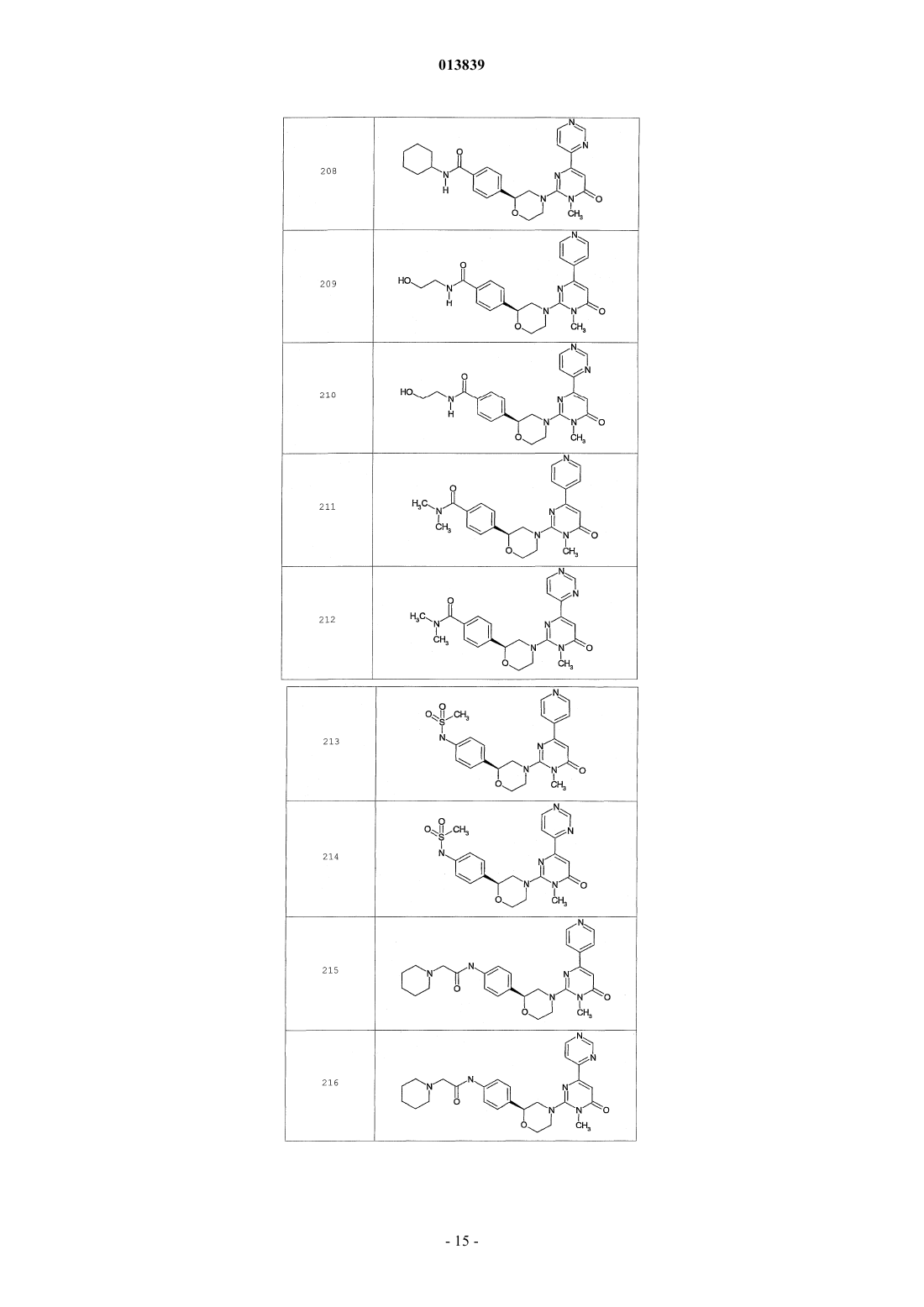
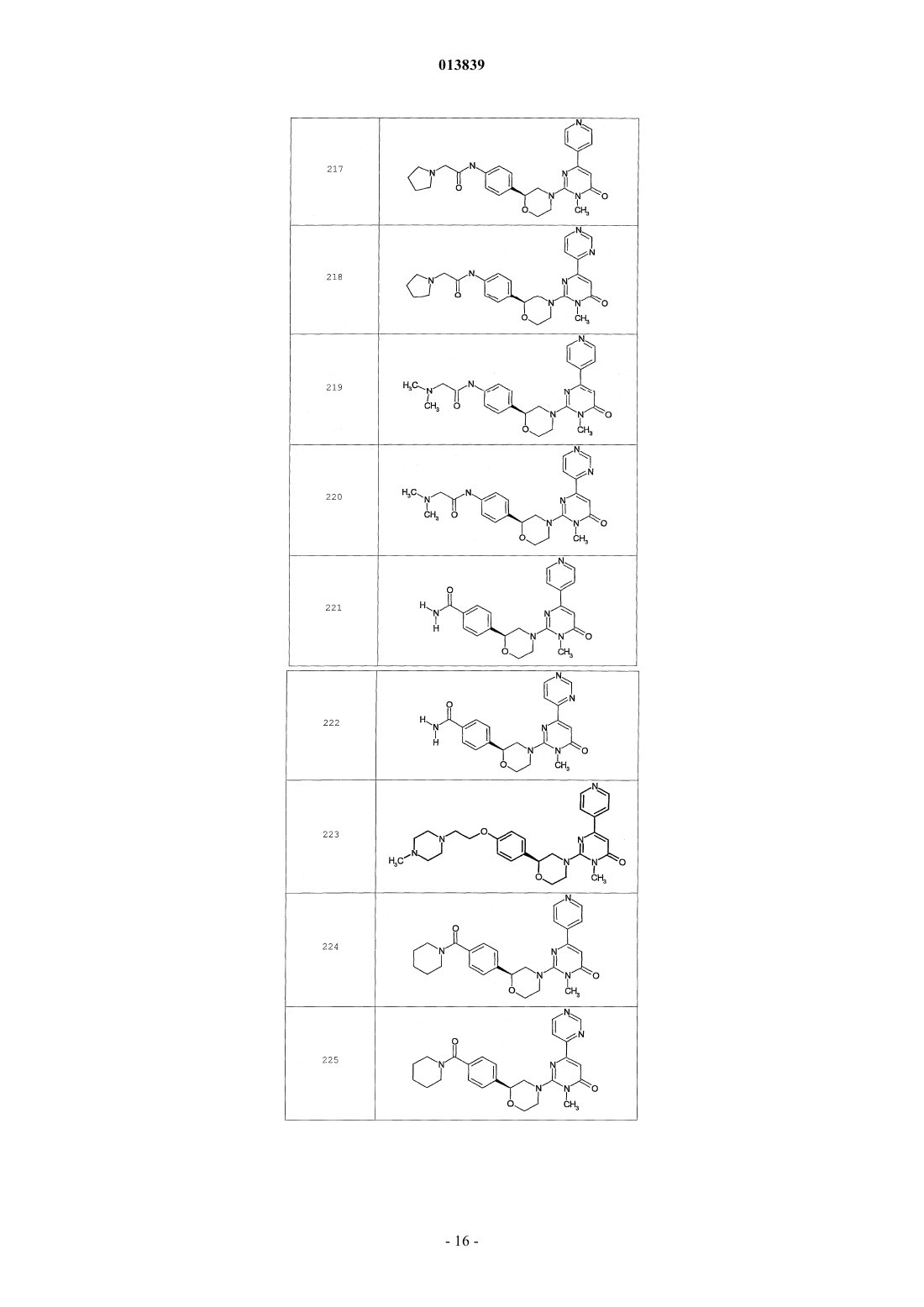
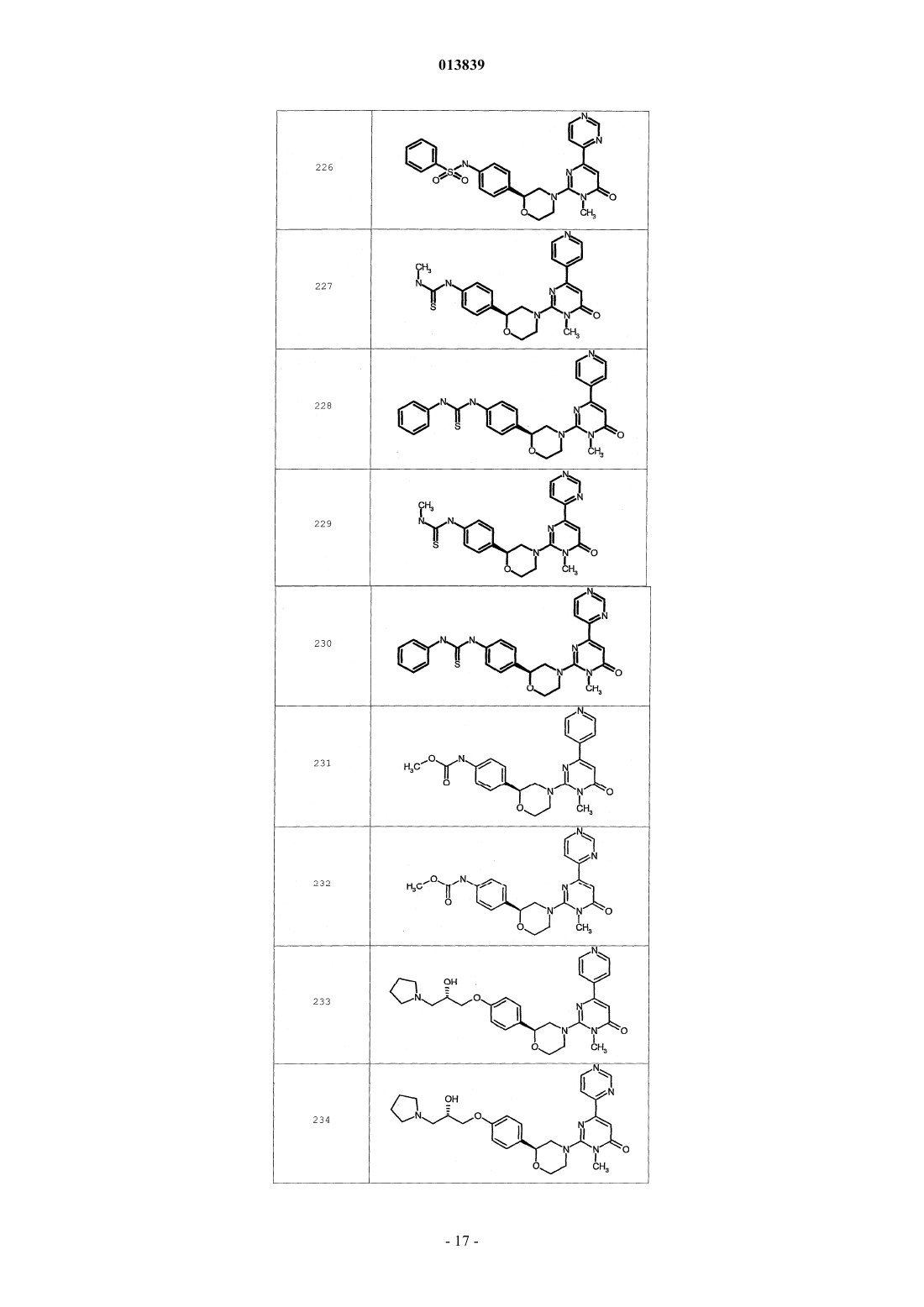
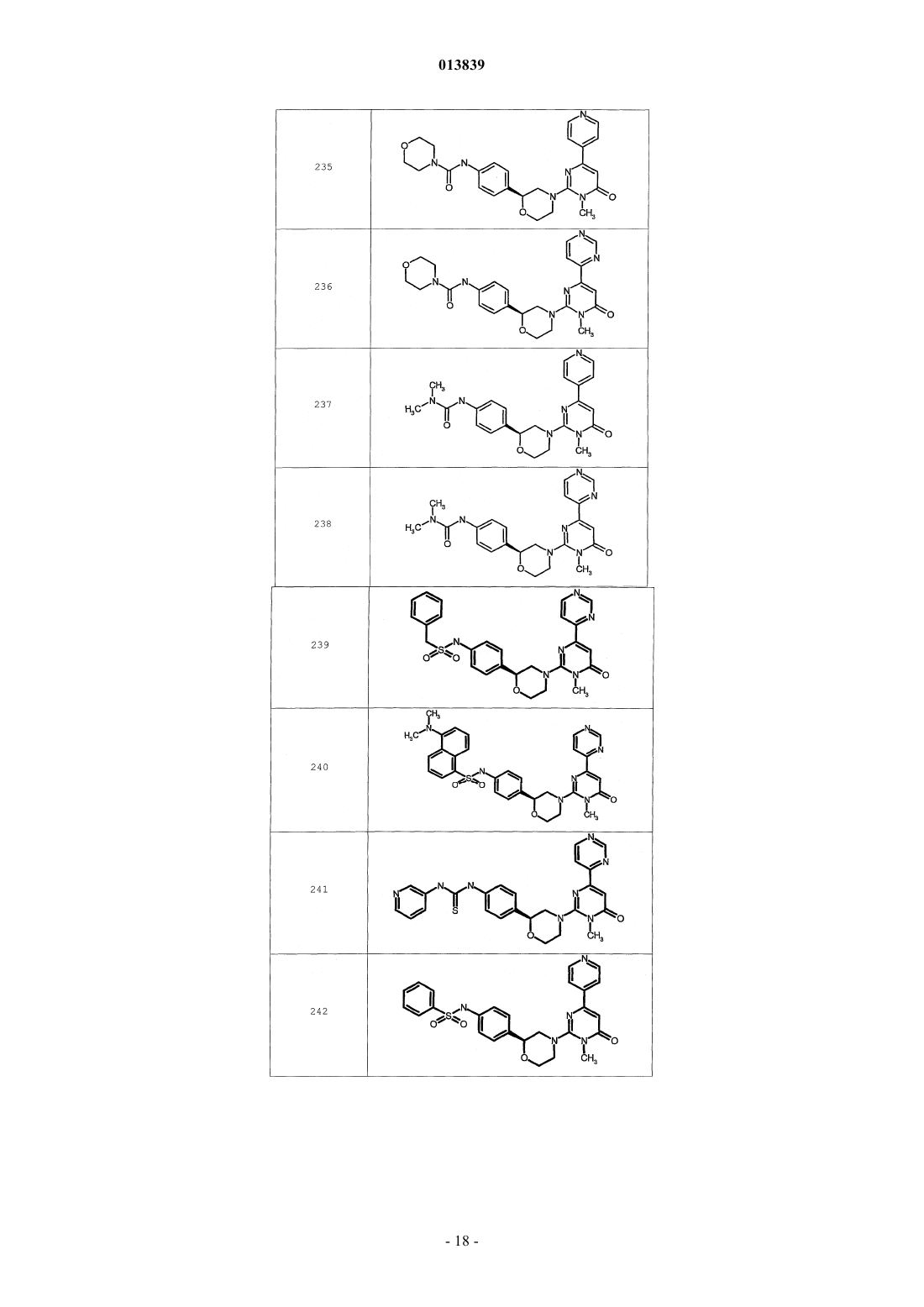
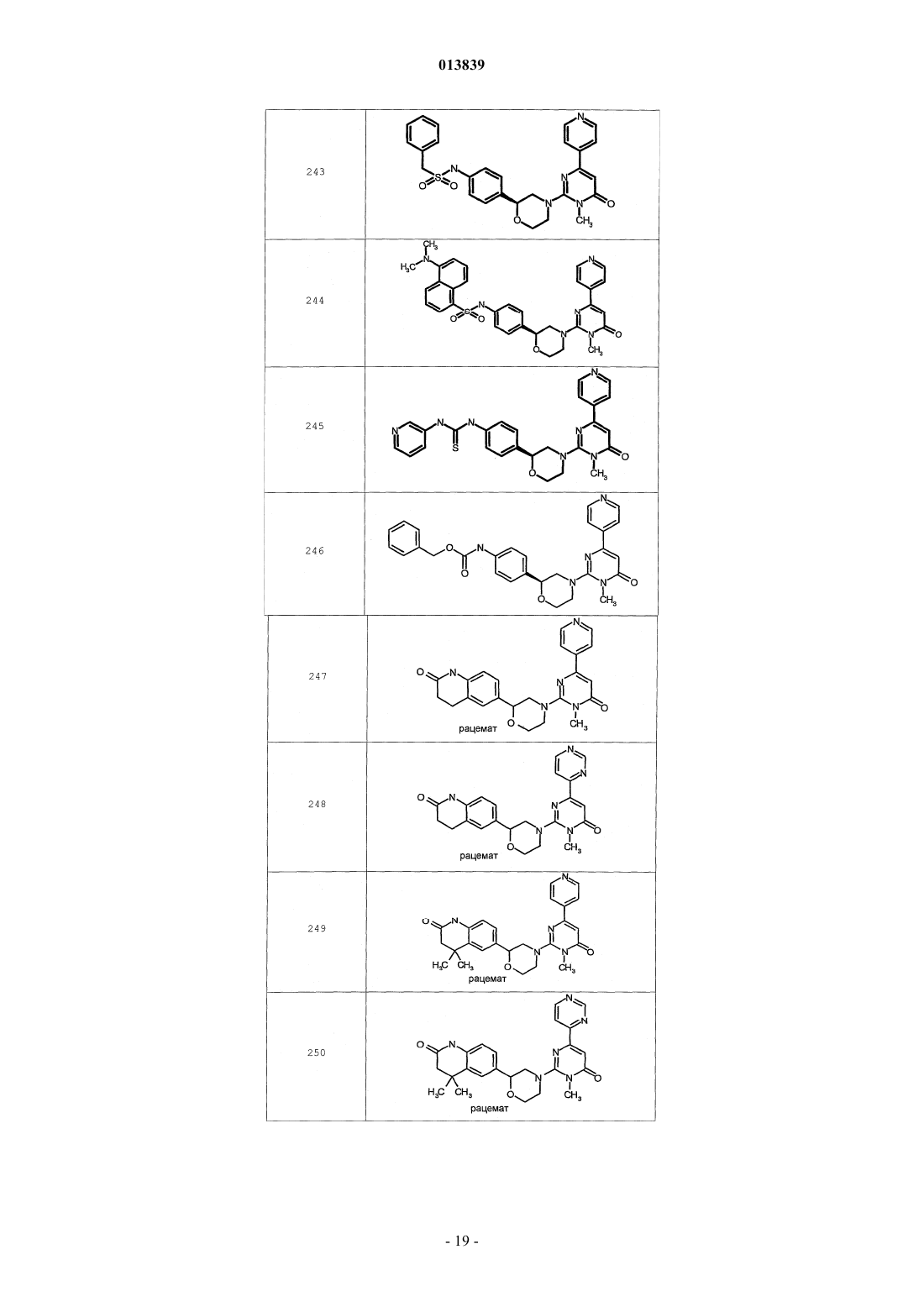
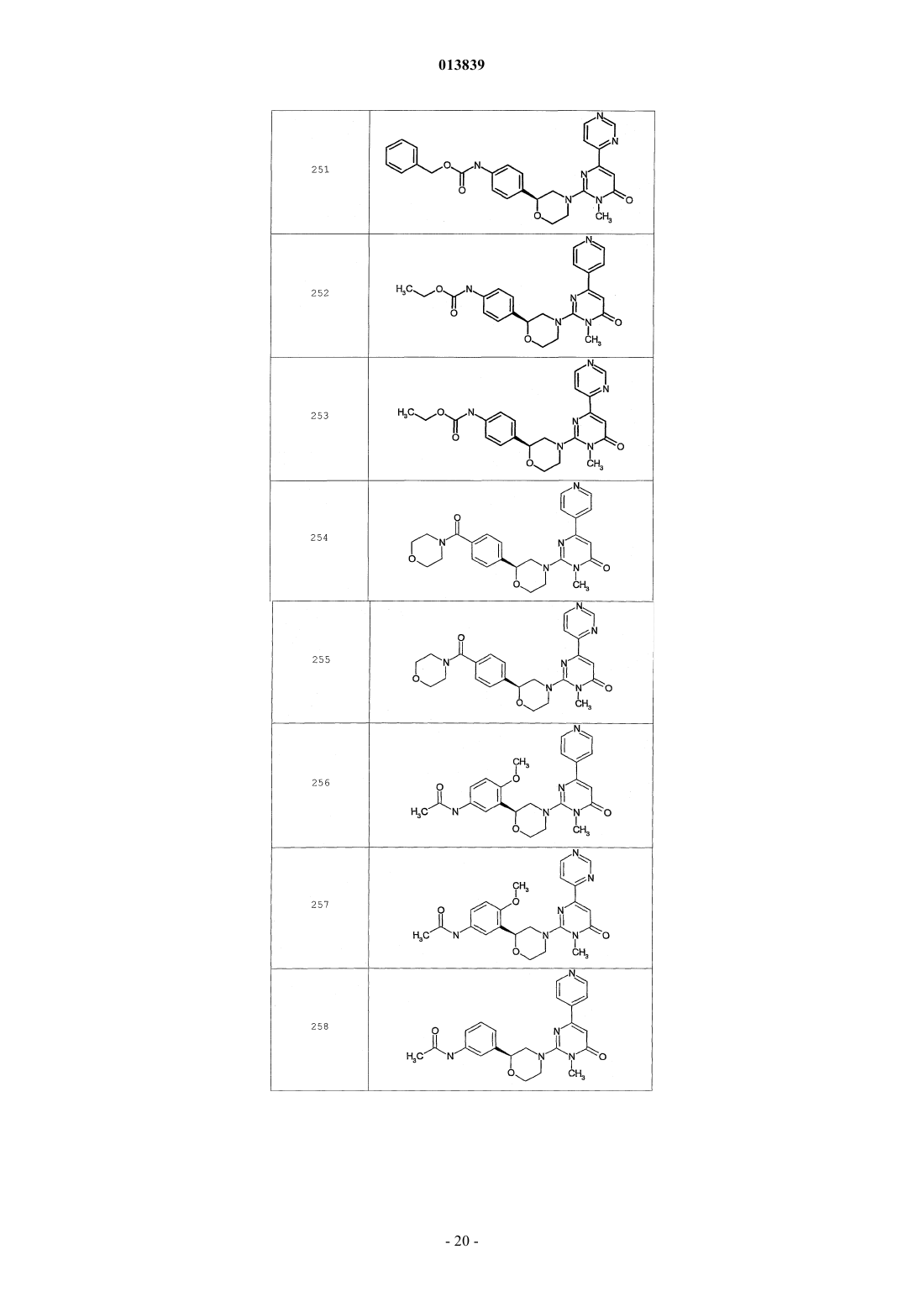
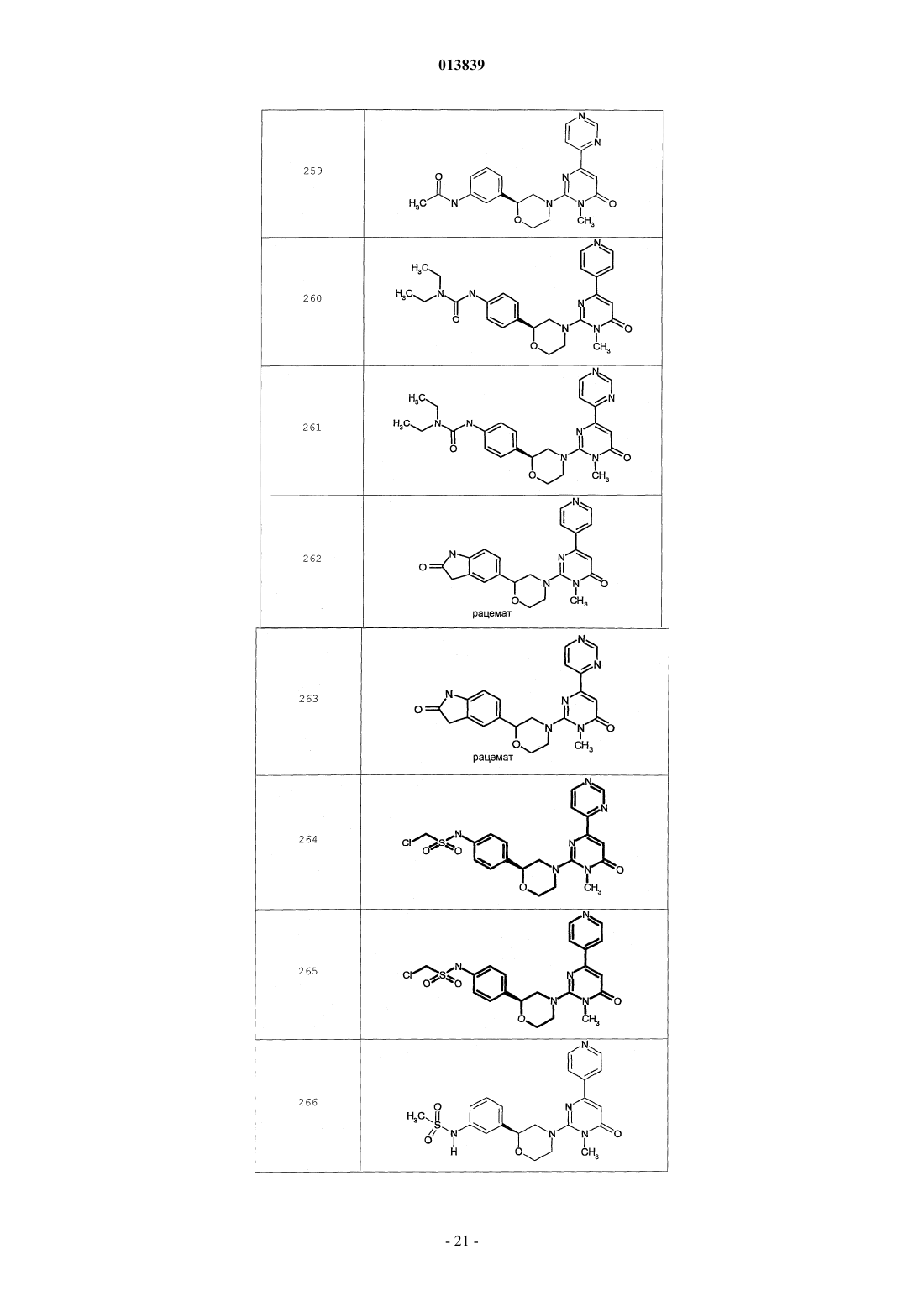
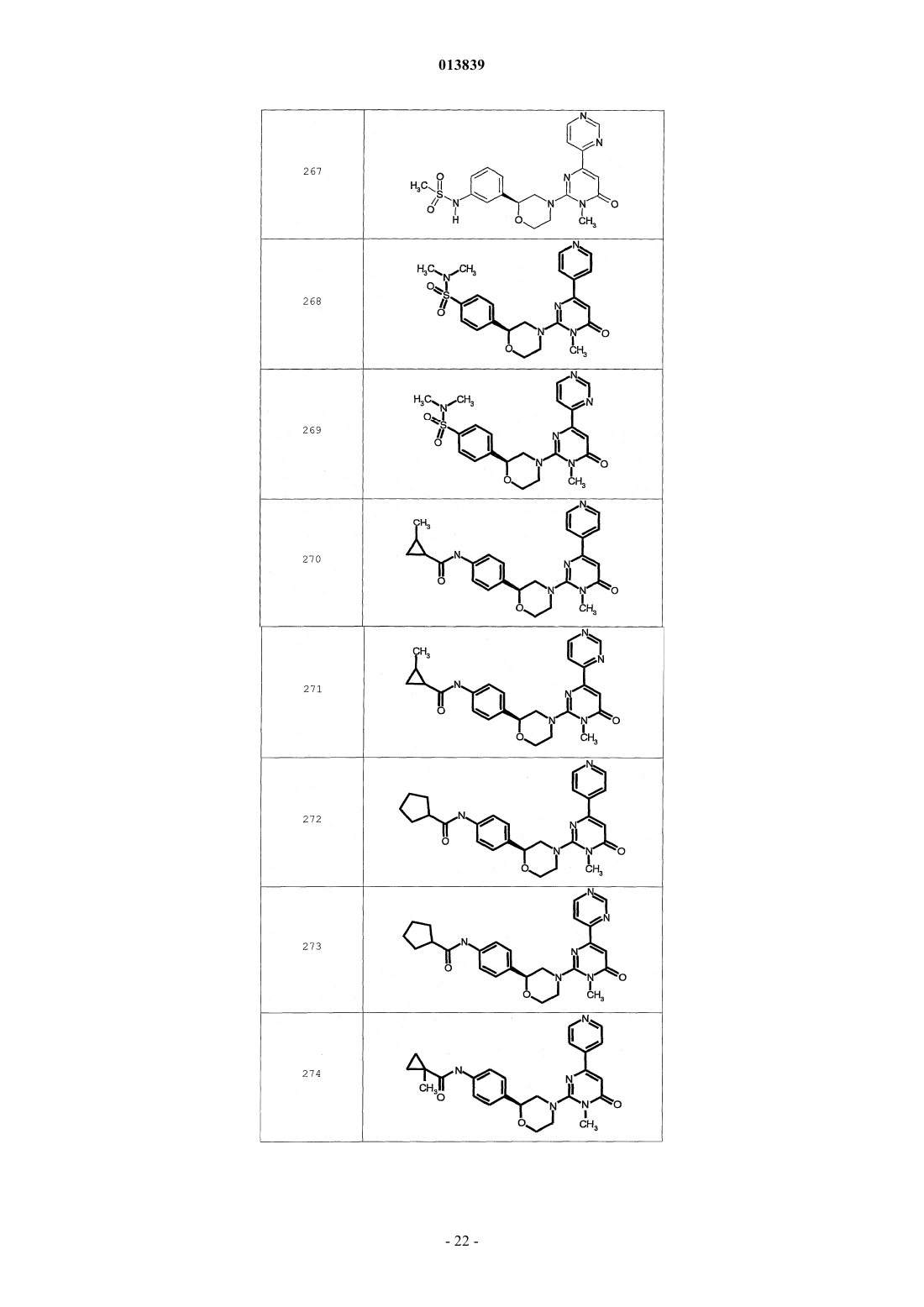
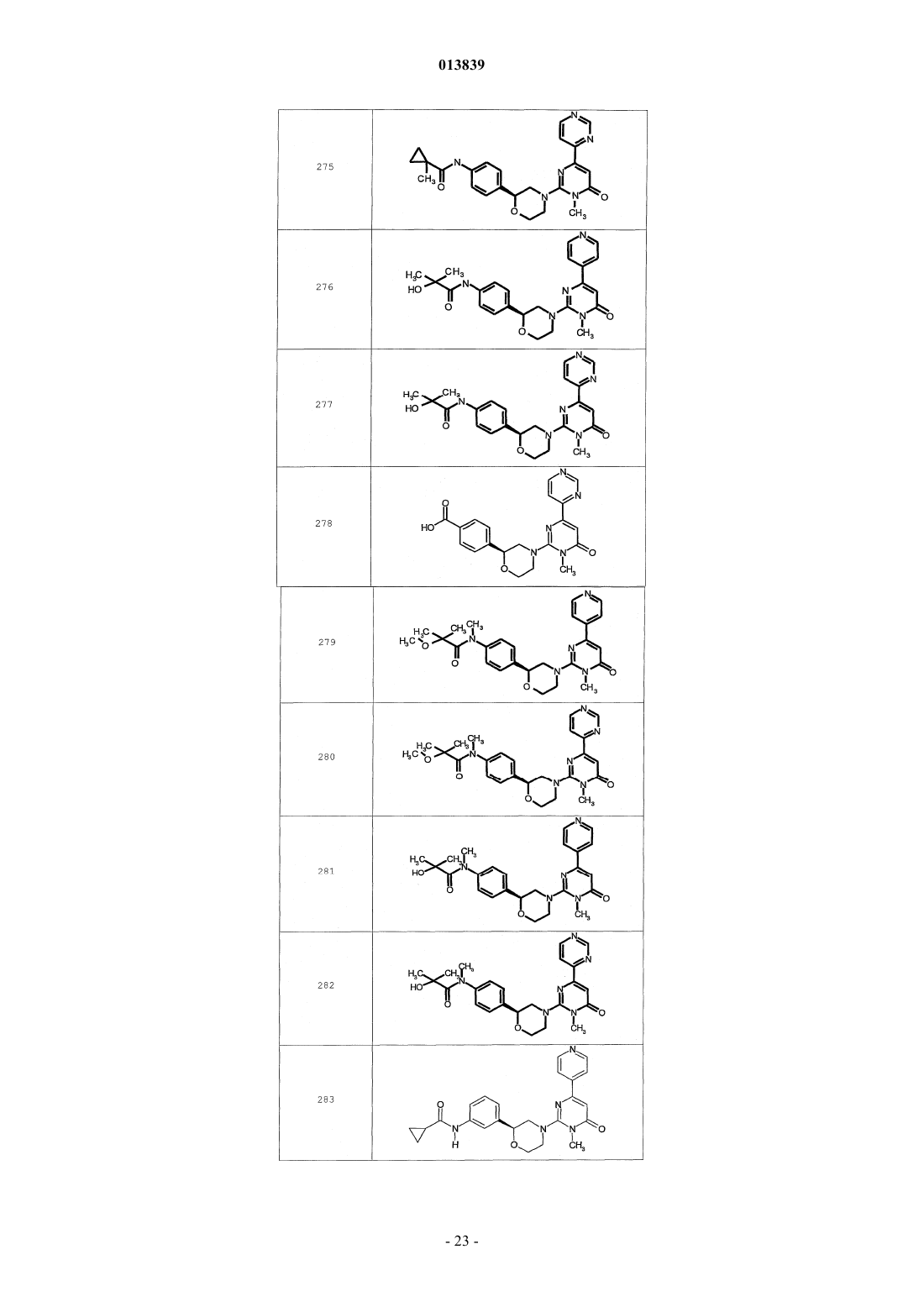
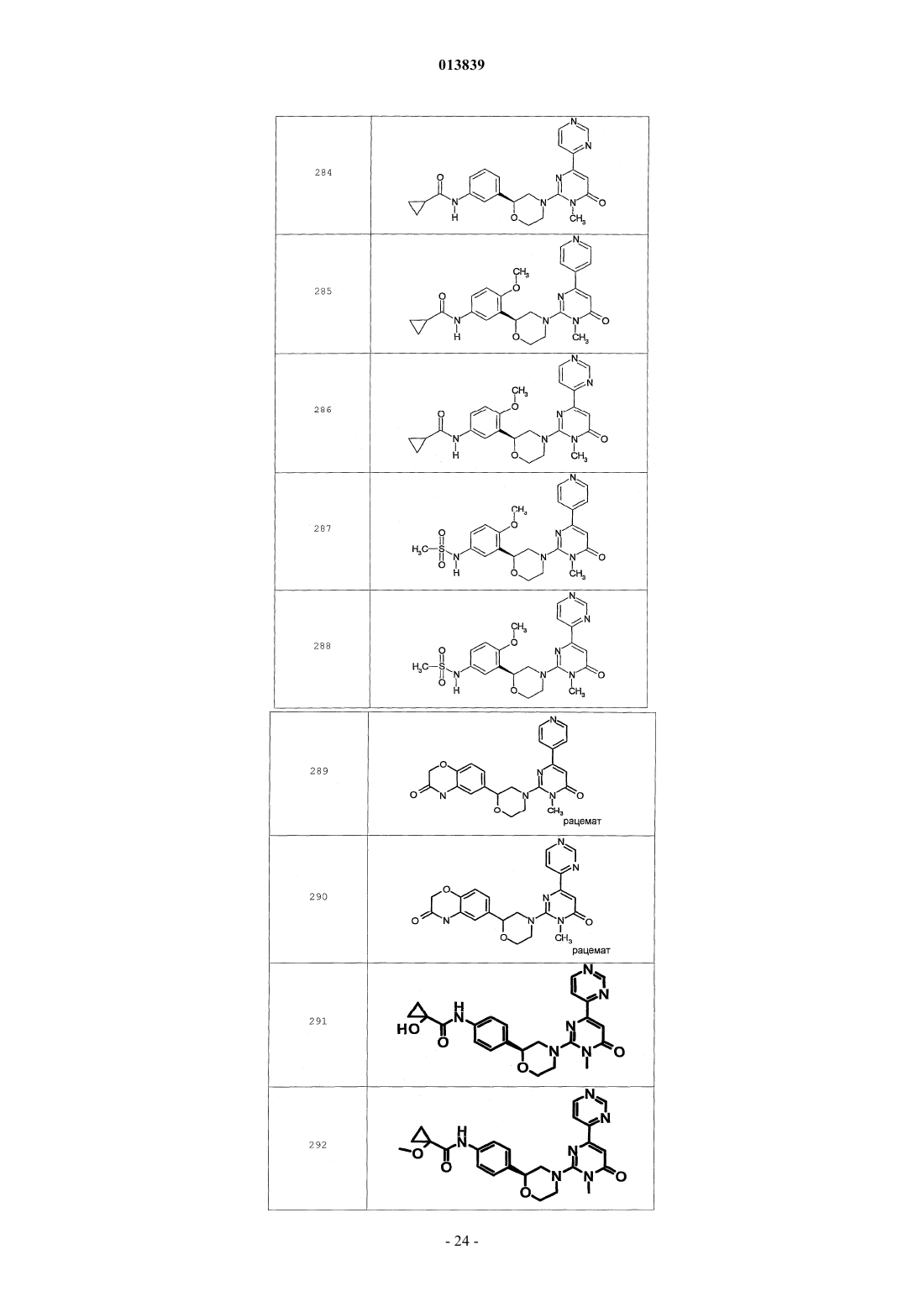
6. Соединение по п.1, выбранное из группы, включающей
2-(2-(4-((4-пирролидин-1-ил)пиперидин-1-ил)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил-3Н-пиримидин-4-он,
2-(2-(4-((4-пиперидин-1-ил)пиперидин-1-ил)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил-3Н-пиримидин-4-он,
2-(2-(4-(N-циклогексил-N-метиламино)фенил)морфолин-4-ил)-3-метил-6-пиридин-4-ил-3Н-пиримидин-4-он,
2-(2-(4-(4-(2-гидроксиэтил)пиперазин-1-ил)фенил)морфолин-4-ил)-3-метил-6-пиридин-4-ил-3Н-пиримидин-4-он,
2-(2-(4-((3-пирролидин-1-ил)пирролидин-1-ил)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил-3Н-пиримидин-4-он,
2-(2-(4-(3-N-ацетил-N-метиламинопирролидин-1-ил)фенил)морфолин-4-ил)-3-метил-6-пиридин-4-ил-3Н-пиримидин-4-он,
2-{2-[4-(3-гидроксиазетидин-1-ил)фенил]морфолин-4-ил}-3-метил-6-пиридин-4-ил-3Н-пиримидин-4-он,
N-(4-(4-(1-метил-6-оксо-4-(пиридин-4-ил)-1,6-дигидропиримидин-2-ил)морфолин-2-ил)фенил)ацетамид,
N-(4-(4-(1,6-дигидро-1-метил-6-оксо-4,4'-бипиримидин-2-ил)морфолин-2-ил)фенил)ацетамид,
2-(2-(4-(2-пиридиламино)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил-3Н-пиримидин-4-он,
2-((2-(4-циклопропилкарбониламино)фенил)морфолин-4-ил)-3-метил-6-пиридин-4-ил-3Н-пиримидин-4-он,
2-((2-(4-циклопропилкарбониламино)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил-3Н-пиримидин-4-он,
2-((2-(4-тетрагидрофуран-3-иламино)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил-3Н-пиримидин-4-он,
2-(2-(4-(N-тетрагидрофуран-3-ил-N-метиламино)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил-3Н-пиримидин-4-он,
N-{4-[(2S)-4-(1-метил-6-оксо-4-пиридин-4-ил-1,6-дигидропиримидин-2-ил)морфолин-2-ил]фенил}-2-пирролидин-1-илацетамид,
N-{4-[(2S)-4-(1-метил-6-оксо-1,6-дигидро-4,4'-бипиримидин-2-ил)морфолин-2-ил]фенил}-2-пирролидин-1-илацетамид,
N2,N2-диметил-N1-{4-[(2S)-4-(1-метил-6-оксо-1,6-дигидро-4,4'-бипиримидин-2-ил)морфолин-2-ил]фенил}глицинамид,
метил{4-[(2S)-4-(1-метил-6-оксо-4-пиридин-4-ил-1,6-дигидропиримидин-2-ил)морфолин-2-ил]фенил}карбамат,
этил{4-[(2S)-4-(1-метил-6-оксо-1,6-дигидро-4,4'-бипиримидин-2-ил)морфолин-2-ил]фенил}карбамат,
N-{4-метокси-3-[(2S)-4-(1-метил-6-оксо-4-пиридин-4-ил-1,6-дигидропиримидин-2-ил)морфолин-2-ил]фенил}ацетамид,
N-{4-метокси-3-[(2S)-4-(1-метил-6-оксо-1,6-дигидро-4,4'-бипиримидин-2-ил)морфолин-2-ил]фенил}ацетамид и
N-{3-[(2S)-4-(1-метил-6-оксо-4-пиридин-4-ил-1,6-дигидропиримидин-2-ил)морфолин-2-ил]фенил}ацетамид, его оптически активный изомер или фармацевтически приемлемую соль.
7. Лекарственное средство, содержащее в качестве активного ингредиента вещество, выбранное из группы, состоящей из соединения, представленного формулой (I), и его оптически активного изомера или фармацевтически приемлемой соли по п.1.
8. Ингибитор таупротеинкиназы 1, выбранный из группы, состоящей из соединения, представленного формулой (I), и его оптически активного изомера или фармацевтически приемлемой соли по п.1.
9. Лекарственное средство по п.7, используемое для профилактического и/или терапевтического лечения заболевания, вызванного гиперактивностью таупротеинкиназы 1.
10. Лекарственное средство по п.7, используемое для профилактического и/или терапевтического лечения нейродегенеративного заболевания.
11. Лекарственное средство по п.10, где заболевание выбирают из группы, состоящей из болезни Альцгеймера, ишемических инсультов, прогрессирующего супрануклеарного паралича, болезни Пика, кортикобазальной дегенерации, лобно-височного слабоумия, травматических повреждений, травмы мозга и спинного мозга.
12. Лекарственное средство по п.7, где заболевание представляет собой инсулинонезависимый диабет.
Текст
Соединение, представленное формулой (I), его оптически активный изомер или фармацевтически приемлемая соль, где X представляет собой СН или N; R1 представляет собой С 1-С 12 алкил; R2 представляет собой атом водорода или тому подобное; q равно 0; р равно 0; R представляет собой 2,3-дигидроиндолил или тому подобное, которое используется для профилактического и/или терапевтического лечения заболевания, вызванного гиперактивностью таупротеинкиназы 1, такого как нейродегенеративное заболевание (например, болезнь Альцгеймера).(71)(73) Заявитель и патентовладелец: МИЦУБИСИ ТАНАБЕ ФАРМА КОРПОРЕЙШН (JP); САНОФИ-АВЕНТИС (FR) 013839 Область техники Настоящее изобретение относится к соединениям, которые полезны в качестве активного ингредиента лекарственного средства для профилактического и/или терапевтического лечения заболеваний, вызванных главным образом аномальной активностью таупротеинкиназы 1, таких как нейродегенеративные заболевания (например, болезнь Альцгеймера). Предпосылки создания изобретения Болезнь Альцгеймера представляет собой прогрессирующее старческое слабоумие, при котором наблюдается заметная церебральная корковая атрофия вследствие дегенерации нервных клеток и снижения числа нервных клеток. Патологически в мозгу наблюдаются многочисленные старческие бляшки и нейрофибриллярные клубки. С возрастанием популяции пожилых людей число пациентов увеличивается, и заболевание становится серьезной общественной проблемой. Хотя выдвигались различные теории,причина заболевания все еще не выяснена. Желательным является выяснение причины в ближайшем будущем. Известно, что степень появления двух характерных патологических изменений при болезни Альцгеймера хорошо коррелирует со степенью интеллектуальной дисфункции. Поэтому с начала 1980 гг. для выявления причины заболевания проводились научно-исследовательские работы, включающие исследования на молекулярном уровне компонентов данных двух патологических изменений. Старческие бляшки накапливаются в межклеточном пространстве, и было выяснено, что их основным компонентом являетсяамилоидный белок (сокращенно называемый далее в описании как А: Biochem. Biophys. Res.Commun., 120, 885 (1984); EMBO J., 4, 2757 (1985); Proc. Natl. Acad. Sci. USA, 82, 4245 (1985. В другом патологическом изменении, т.е. в нейрофибриллярных клубках, внутри клеток накапливается волокнистое вещество с двойной спиралью, называемое сдвоенным спиральным волокном (сокращенно упоминаемое в описании как "PHF"), и таубелок, который представляет собой вид связанного с микротрубками белка, специфического для мозга, был выявлен в качестве его основного компонента (Proc. Natl. Acad.Sci. USA, 85, 4506 (1988); Neuron, 1, 827 (1988. Кроме того, на основе генетических исследований было установлено, что презенилины 1 и 2 представляют собой гены, являющиеся причиной наследственной болезни Альцгеймера (Nature, 375, 754(1995); Science, 269, 973 (1995); Nature. 376, 775 (1995, и было выяснено, что присутствие мутантов презенилинов 1 и 2 промотирует секретирование А (Neuron, 17, 1005 (1996); Proc. Natl. Acad. Sci. USA, 94,2025 (1997. На основании данных результатов считается, что при болезни Альцгеймера А накапливается в отклоняющихся от нормы количествах и образует агломераты вследствие определенной причины,которая связана с образованием PHF, вызывающим смерть нервных клеток. Также предполагается, что межклеточный поток глутаминовой кислоты и активация глутаматного рецептора, отвечающего за этот поток, вероятно могут быть важными факторами в раннем процессе смерти нервных клеток, вызываемой ишемическими инсультами. Сообщалось, что обработка каиновой кислотой, которая стимулирует рецептор АМРА, представляющий собой один из глутаматных рецепторов, увеличивает мРНК амилоидного белкапредшественника (сокращенно называемого далее в описании "АРР") в качестве предшественника А(Society for Neuroscience Abstracts, 17, 1445 (1991, и также промотирует метаболизм АРР (The Journal ofNeuroseience, 10, 2400 (1990. Следовательно, можно четко предположить, что накопление А вовлечено в клеточную смерть вследствие ишемических церебрально-сосудистых нарушений. Другие заболевания,при которых наблюдается аномальное накопление и агломерация А, включают, например, синдром Дауна, церебральное кровотечение вследствие отдаленной церебральной амилоидной ангиопатии, болезнь с тельцами Леви и тому подобные. Кроме того, примеры заболеваний, при которых наблюдаются нейрофибриллярные клубки вследствие накопления PHF, включают прогрессирующий супрануклеарный паралич, подострый склерозирующий панэнцефалитный паркинсонизм, постэнцефалитный паркинсонизм, травматический энцефалит, паркинсонизм Гуама - комплекс слабоумия, болезнь с тельцами Леви и тому подобные. Белок тау обычно состоит из группы родственных белков, которые образуют несколько полос с молекулярной массой 48-65 кДа при электрофорезе в SDS-полиакриламидном геле, и он промотирует образование микротрубочек. Подтверждается, что белок тау, включенный в PHF мозга пациентов, страдающих от болезни Альцгеймера, является аномально фосфорилированным по сравнению с обычным белком тау (J. Biochem., 99, 1807 (1986); Proc. Natl. Acad. Sci. USA, 83, 4913 (1986. Был выделен фермент, катализирующий аномальное фосфорилирование. Белок был назван таупротеинкиназой 1 (сокращенно называемый далее в описании как "ТРК 1") и были выяснены его физико-химические свойства (J. Biol. Chem.,267, 10897 (1992. Кроме того, была клонирована кДНК ТРК 1 крысы, полученная из библиотеки кДНК коры головного мозга крысы на основании частичной последовательности аминокислот ТРК 1, и была определена ее последовательность нуклеотидов и сделан вывод о последовательности аминокислот. В результате было установлено, что первичная структура ТРК 1 крысы соответствует таковой для фермента, известного как крысиный GSK-3 (гликогенсинтазакиназа 3, FEBS Lett., 325, 167 (1993. Сообщалось, что А, основной компонент старческих бляшек, является нейротоксичным (Science,-1 013839 250, 279 (1990. Однако выдвигались различные теории в отношении причины, по которой А вызывает смерть клетки, и ни одна достоверная теория до сих пор не установлена. Takashima и др. наблюдали, что смерть клетки вызывается обработкой с использованием А первичной культуральной системы фетального гиппокампуса крысы, а затем установили, что активность ТРК 1 повышается обработкой с использованием А, а смерть клетки, вызванная А, ингибируется посредством антисмысловой ТРК 1 (Proc. Natl.Acad. Sci. USA, 90, 7789 (1993); EP616032). Исходя из вышеизложенного, соединения, которые ингибируют активность ТРК 1, вероятно могут подавлять нейротоксичность А и образование PHF и ингибировать смерть нервных клеток при болезни Альцгеймера, таким образом приостанавливая и замедляя развитие заболевания. Также соединения возможно можно использовать в качестве лекарственного средства для терапевтического лечения ишемического церебрально-сосудистого нарушения, синдрома Дауна, церебральной амилоидной ангиопатии, церебрального кровотечения вследствие болезни с тельцами Леви и тому подобного за счет подавления цитотоксичности А. Кроме того, соединения, возможно, можно использовать в качестве лекарственного средства для терапевтического лечения нейродегенеративных заболеваний, таких как прогрессирующий супрануклеарный паралич, подострый склерозирующий панэнцефалитный паркинсонизм, постэнцефалитный паркинсонизм, травматический энцефалит, паркинсонизм Гуама - комплекс слабоумия, болезнь с тельцами Леви, болезнь Пика, кортикобазальная дегенерация и лобно-височное слабоумие, сосудистое слабоумие, травматические повреждения, травмы мозга и спинного мозга, периферические невропатии,ретинопатии и глаукома, а также других заболеваний, таких как инсулинонезависимый диабет, ожирение, маниакально-депрессивное заболевание, шизофрения, алопеция, рак молочной железы, немелкоклеточная карцинома легких, рак щитовидной железы, Т- или В-клеточная лейкемия и некоторые индуцированные вирусом опухоли. В качестве соединений, структурно аналогичных соединениям по настоящему изобретению, представленным описанной далее формулой (I), известны соединения, описанные в международных публикациях WO 01/70729, WO 03/037888 и WO 03/027080. Однако данные соединения не достаточны в качестве лекарственного средства по своей фармакокинетике и тому подобному. Описание изобретения Задача настоящего изобретения заключается в создании соединений, полезных в качестве активного ингредиента лекарственного средства для профилактического и/или терапевтического лечения заболеваний, таких как болезнь Альцгеймера. Более конкретно, задача заключается в создании новых соединений, полезных в качестве активного ингредиента лекарственного средства, которое дает возможность радикальной профилактики и/или лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера за счет ингибирования активности ТРК 1, для подавления нейротоксичности А и образованияPHF и за счет ингибирования смерти нервных клеток. Для достижения вышеуказанной цели, авторы настоящего изобретения провели скрининг различных соединений, обладающих ингибирующей активностью в отношении фосфорилирования ТРК 1. В результате ими было установлено, что соединения, представленные следующей формулой (I), обладали желаемой активностью и полезны в качестве активного ингредиента лекарственного средства для профилактического и/или терапевтического лечения вышеуказанных заболеваний. Настоящее изобретение было осуществлено на основании данных результатов. Таким образом, настоящее изобретение включает: 1. Соединение, представленное формулой (I), его оптически активный изомер или фармацевтически приемлемую соль где каждый символ является таким, как определено далее,X представляет собой СН или N;R2 представляет собой атом водорода;R представляет собой карбоксильную группу, 2,3-дигидроиндолил, пергидроиндолил, пергидроизоиндолил, пергидрохинолинил, пергидроизохинолинил или формулу (1) или (2): где в формуле (1) R3 представляет собой атом водорода, C1-С 6 алкил, который может быть замещен гидроксилом или C1-С 6 алкокси, С 3-С 7 циклоалкил; R4 представляет собой адамантил, С 3-С 7 циклоалкил,который может быть замещен гидроксилом, гетероциклическую группу или формулу (3): где m представляет собой 0 или целое число от 1 до 4;Z1 представляет собой карбонильную группу, тиокарбонильную группу или сульфонильную группу,R20 и R21 являются одинаковыми или разными, и каждый представляет собой атом водорода или C1 С 6 алкил;R7 представляет собой C1-С 6 алкил, который может быть замещен гидроксилом, атомом галогена или C1-С 6 алкокси,С 3-С 7 циклоалкил, который может быть замещен C1-С 6 алкилом, гидроксилом или C1-С 6 алкокси,С 6-С 10 арил, который может быть замещен ди(C1-С 6 алкил)амино,гетероциклическую группу, которая может быть замещена фенилом или C1-С 6 алкилом,C1-С 6 алкокси, который может быть замещен фенилом,группу, представленную -NRaRb; где Ra и Rb являются одинаковыми или разными, и каждый представляет собой атом водорода,C1-С 6 алкил,С 3-С 7 циклоалкил,С 6-С 10 арил, который может быть замещен ди (C1-С 6 алкил)амино,гетероциклическую группу,или Ra и Rb связаны с образованием вместе со смежным атомом азота азотсодержащего гетероцикла, который может содержать атом серы или атом кислорода, или R7 и R3 могут быть связаны с образованием цикла, и дополнительно Ra и Rb могут связывать R3 с образованием цикла вместе со смежным атомом азота; в формуле (2) Z представляет собой карбонильную группу, сульфонильную группу или группу,представленную -O-W-, где W представляет собой C1-С 6 алкиленовую группу;R5 и R6 являются одинаковыми или разными и каждый представляет собой атом водорода,C1-С 6 алкил, который может быть замещен гидроксилом,С 3-С 7 циклоалкил,С 6-С 10 арил, или гетероциклическую группу; или R3 и R4 могут объединяться вместе со смежным атомом азота с образованием циклической аминогруппы, представленной формулой (4): где R10 представляет собой С 1-С 6 алкил, С 3-С 7 циклоалкил, С 6-С 10 арил,гетероциклическую группу, которая может быть замещена С 1-С 6 алкилом или фенилом,C1-С 6 алкокси, гидроксил, оксогруппу, галоген, нитро, циано или формулу (5): где R22 представляет собой атом водорода или C1-С 6 алкил, R23 представляет собой С 1-Сбалкил илиC1-С 6 алкокси; Q представляет собой связь, атом кислорода, атом серы или формулу: где R24 представляет собой атом водорода,C1-С 6 алкил, который может быть замещен гидроксилом или C1-С 6 алкокси,С 6-С 10 арил,гетероциклическую группу, которая может быть замещена C1-С 6 алкилом или С 6-С 10 арилом;r представляет собой 0 или целое число от 1 до n+2;n представляет собой целое число от 1 до 4; при условии, что если n представляет собой 2 и Q представляет собой связь, то r не равен 0. 2. Соединение, его оптически активный изомер или фармацевтически приемлемая соль в соответствии с вышеуказанным п.1, где R1 представляет собой метильную группу. 3. Соединение, его оптически активный изомер или фармацевтически приемлемая соль в соответствии с вышеуказанным п.1, где R имеет формулу (1). 4. Соединение, его оптически активный изомер или фармацевтически приемлемая соль в соответствии с вышеуказанным п.1, где R имеет формулу (2). 5. Соединение, его оптически активный изомер или фармацевтически приемлемая соль в соответствии с вышеуказанным п.3, где R4 имеет формулу (3). 6. Соединение в соотвествии с п.1, выбранное из группы, включащей 2-(2-(4-4-пирролидин-1-ил)пиперидин-1-ил)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил 3 Н-пиримидин-4-он,2-(2-(4-4-пиперидин-1-ил)пиперидин-1-ил)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил-3 Нпиримидин-4-он,2-(2-(4-(N-циклогексил-N-метиламино)фенил)морфолин-4-ил)-3-метил-6-пиридин-4-ил-3 Нпиримидин-4-он,2-(2-(4-(4-(2-гидроксиэтил)пиперазин-1-ил)фенил)морфолин-4-ил)-3-метил-6-пиридин-4-ил-3 Нпиримидин-4-он,2-(2-(4-3-пирролидин-1-ил)пирролидин-1-ил)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил 3 Н-пиримидин-4-он,2-(2-(4-(3-N-ацетил-N-метиламинопирролидин-1-ил)фенил)морфолин-4-ил)-3-метил-6-пиридин-4 ил-3 Н-пиримидин-4-он,2-2-[4-(3-гидроксиазетидин-1-ил)фенил]морфолин-4-ил-3-метил-6-пиридин-4-ил-3 Н-пиримидин 4-он,N-(4-(4-(1-метил-6-оксо-4-(пиридин-4-ил)-1,6-дигидропиримидин-2-ил)морфолин-2 ил)фенил)ацетамид,N-(4-(4-(1,6-дигидро-1-метил-6-оксо-4,4'-бипиримидин-2-ил)морфолин-2-ил)фенил)ацетамид,2-(2-(4-(2-пиридиламино)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил-3 Н-пиримидин-4-он,2-(2-4-циклопропилкарбониламино)фенил)морфолин-4-ил)-3-метил-6-пиридин-4-ил-3 Нпиримидин-4-он,2-(2-4-циклопропилкарбониламино)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил-3 Нпиримидин-4-он,2-(2-4-тетрагидрофуран-3-иламино)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4-ил-3 Нпиримидин-4-он,2-(2-(4-(N-тетрагидрофуран-3-ил-N-метиламино)фенил)морфолин-4-ил)-3-метил-6-пиримидин-4 ил-3 Н-пиримидин-4-он,N-4-[(2S)-4-(1-метил-6-оксо-4-пиридин-4-ил-1,6-дигидропиримидин-2-ил)морфолин-2-ил]фенил 2-пирролидин-1-илацетамид,N-4-[(2S)-4-(1-метил-6-оксо-1,6-дигидро-4,4'-бипиримидин-2-ил)морфолин-2-ил]фенил-2 пирролидин-1-илацетамид,N2,N2-диметил-N1-4-[(2S)-4-(1-метил-6-оксо-1,6-дигидро-4,4'-бипиримидин-2-ил)морфолин-2 ил]фенилглицинамид,метил 4-[(2S)-4-(1-метил-6-оксо-4-пиридин-4-ил-1,6-дигидропиримидин-2-ил)морфолин-2-ил]фенил карбамат,этил 4-[(2S)-4-(1-метил-6-оксо-1,6-дигидро-4,4'-бипиримидин-2-ил)морфолин-2-ил]фенилкарбамат,N-4-метокси-3-[(2S)-4-(1-метил-6-оксо-4-пиридин-4-ил-1,6-дигидропиримидин-2-ил)морфолин-2 ил]фенилацетамид,N-4-метокси-3-[(2S)-4-(1-метил-6-оксо-1,6-дигидро-4,4'-бипиримидин-2-ил)морфолин-2-ил]фенил ацетамид иN-3-[(2S)-4-(1-метил-6-оксо-4-пиридин-4-ил-1,6-дигидропиримидин-2-ил)морфолин-2-ил]фенил ацетамид,его оптически активный изомер или фармацевтически приемлемую соль. 7. Лекарственное средство, содержащее в качестве активного ингредиента вещество, выбранное из группы, состоящей из соединения, представленного формулой (I), и его оптически активного изомера или фармацевтически приемлемой соли в соответствии с вышеуказанным п.1. 8. Ингибитор таупротеинкиназы 1, выбранный из группы, состоящей из соединения, представленного формулой (I), и его оптически активного изомера или фармацевтически приемлемой соли в соответствии с вышеуказанным п.1.-4 013839 9. Лекарственное средство в соответствии с вышеуказанным п.7, используемое для профилактического и/или терапевтического лечения заболевания, вызванного гиперактивностью таупротеинкиназы 1. 10. Лекарственное средство в соответствии с вышеуказанным п.7, используемое для профилактического и/или терапевтического лечения нейродегенеративного заболевания. 11. Лекарственное средство в соответствии с вышеуказанным п.10, где заболевание выбирают из группы, состоящей из болезни Альцгеймера, ишемических инсультов, прогрессирующего супрануклеарного паралича, болезни Пика, кортикобазальной дегенерации, лобно-височного слабоумия, травматических повреждений, травмы мозга и спинного мозга. 12. Лекарственное средство в соответствии с вышеуказанным п.7, где заболевание представляет собой инсулинонезависимый диабет. Осуществление изобретения Если не указано другого, следующие определения приведены для иллюстрации и определения значения и объема различных терминов, использованных для описания данного изобретения. Термин "C1-С 6 алкил" означает алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть либо линейной, либо разветвленной, например метил, этил, н-пропил, изопропил, н-бутил,изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, 1,1-диметилпропил, н-гексил, изогексил. Термин "С 1-С 12 алкил" означает алкильную группу, имеющую от 1 до 12 атомов углерода, которая может быть либо линейной, либо разветвленной, например метил, этил, н-пропил, изопропил, н-бутил,изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, 1,1-диметилпропил, н-гексил, изогексил, гептил, октил, нонил, децил, ундецил или додецил. Термин "С 3-С 7 циклоалкил" означает циклоалкил, имеющий от 3 до 7 атомов, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил. Термин "С 6-С 10 арил" означает группу, имеющую от 6 до 10 атомов углерода, полученную, например, из бензола, нафталина, индола, индена, тетрагидронафталина. Положение связи в цикле не ограничено. Термин "гетероциклическая группа" и "гетероцикл" означают циклическую группу, полученную,например, из фурана, дигидрофурана, тетрагидрофурана, пирана, дигидропирана, тетрагидропирана, бензофурана, дигидробензофурана, изобензофурана, хромена, хромана, изохромана, тиофена, бензотиофена,пиррола, пирролина, пирролидина, имидазола, имидазолина, имидазолидина, пиразола, пиразолина, пиразолидина, триазола, тетразола, пиридина, пиридиноксида, пиперидина, пиразина, пиперазина, пиримидина, пиридазина, индола, индолина, изоиндола, изоиндолина, индазола, бензимидазола, бензотриазола,тетрагидроизохинолина, бензотиазолинона, бензоксазолинона, пурина, хинолизина, хинолина, фталазина, нафтиридина, хоноксалина, хиназолина, циннолина, птеридина, оксазола, оксазолидина, изоксазола,изоксазолидина, оксадиазола, тиазола, бензотиазола, тиазилидина, изотиазола, изотиазолидина, бензодиоксола, диоксана, бензодиоксана, дитиана, морфолина, тиоморфолина, фталимид гомопиперидинила,гомопиперазинила. Положение связи в цикле не ограничено. Термин "C1-С 6 алкокси" означает алкоксигруппу, имеющую от 1 до 6 атомов углерода, которая может быть либо линейной, либо разветвленной, например метокси, этокси, н-пропокси, изопропокси, нбутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентилокси, изопентилокси, неопентилокси, 1,1 диметилпропокси, н-гексилокси, изогексилокси. Термин "С 2-С 6 алкенил" означает алкенильную группу, имеющую от 2 до 6 атомов углерода, например винил, пропенил, бутенил, пентенил, гексенил. Термин "С 2-С 6 алкинил" означает алкинильную группу, имеющую от 2 до 6 атомов углерода, например этинил, пропинил, бутинил, пентинил, гексинил. Термин "С 3-С 7 циклоалкенил" означает циклоалкенильную группу, имеющую от 3 до 7 атомов углерода, например циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил. Термин "азотсодержащий гетероцикл, образованный Ra и Rb вместе со смежным атомом азота" означает, например, пирролидинил, который может быть замещенным, пиперидинил, который может быть замещенным, морфолино, который может быть замещенным, тиоморфолино, который может быть замещенным, пиперазинил, который может быть замещенным, гомопиперазинил, который может быть замещенным. Термин "который может быть замещенным" означает группу, которая может иметь один или несколько заместителей. Заместители в настоящем описании означают, например, С 1-С 6 алкил, С 2-С 6 алкенил, С 2-С 6 алкинил, С 3-С 7 циклоалкил, С 3-С 7 циклоалкенил, С 6-С 10 арил, гетероциклы, С 1-С 5 алкокси, С 3-С 6 алкенилокси, С 3-С 6 алкинилокси, С 3-С 7 циклоалкилокси, С 3-С 7 циклоалкенилокси, С 6-С 10 арилокси, гетероциклокси, галоген (хлор, бром, фтор, иод), нитро, амино, циано, гидроксил, оксо, C1-С 6 алкилкарбонил,С 2-С 6 алкенилкарбонил, С 2-С 6 алкинилкарбонил, С 3-С 7 циклоалкилкарбонил, С 3- С 7 циклоалкенилкарбонил,С 5-С 10 арилкарбонил, гетероциклкарбонил, С 1-С 6 алкилсульфонил, С 2-С 6 алкенилсульфонил, С 2-С 6 алки нилсуль фонил, С 3-С 7 циклоалкилсульфонил, С 3-С 7 циклоалкенилсульфонил, С 6-С 10 арилсульфонил, гетероциклсульфонил, С 1-С 5 алкоксикарбонил, С 3-С 6 алкенилоксикарбонил, С 3-С 6 алкинилоксикарбонил, С 3-С 7 циклоалкилоксикарбонил, С 3-С 7 циклоалкенилоксикарбонил, C6-С 10 арилоксикарбонил, гетероциклокси-5 013839 карбонил, амино, С 1-С 6 алкиламино, С 3-С 6 алкениламино, С 3-С 6 алкиниламино, С 3-С 7 циклоалкиламино, С 3 С 7 циклоалкениламино, С 6-С 10 ариламино, гетероцикламино, N,N-ди-C1-С 6 алкиламино, аминокарбонил,C1-С 6 алкиламинокарбонил, С 3-С 6 алкениламинокарбонил, С 3-С 6 алкиниламинокарбонил, С 3-С 7 циклоалкиламинокарбонил, С 3-С 7 циклоалкениламинокарбонил, С 6-С 10 ариламинокарбонил, гетероцикламинокарбонил, N, N-ди-С 1-С 6 диалкиламинокарбонил. Число заместителей, а также их типы и положения замещения не ограничены конкретным образом, и когда присутствует два и более заместителей, они могут быть одинаковыми или разными. В вышеуказанных заместителях термины, выраженные как "С 1-С 6 алкил, С 2-С 6 алкенил, С 2-С 6 алкинил, С 3-С 7 циклоалкил, С 3-С 7 циклоалкенил, С 6-С 10 арил, гетероцикл или С 1 С 6 алкокси", имеют такие же значения, как определено выше. Данные заместители также могут быть замещены описанными выше заместителями.R1 предпочтительно может представлять собой С 1-С 3 алкильную группу, более предпочтительно,метильную группу.R2 предпочтительно может представлять собой атом водорода. р предпочтительно равен 0.R предпочтительно может представлять собой группу формулы (1). Фармацевтически приемлемая соль соединения, представленного вышеуказанной формулой (I),может включать соль неорганической кислоты, такой как хлористо-водородная кислота, бромистоводородная кислота и тому подобные, и соль органической кислоты, такой как уксусная кислота, пропионовая кислота, винная кислота, фумаровая кислота, малеиновая кислота, яблочная кислота, щавелевая кислота, янтарная кислота, лимонная кислота, бензойная кислота и тому подобные. В дополнение к соединению, представленному вышеуказанной формулой (I), его оптически активным изомерам или фармацевтически приемлемой соли, в объем настоящего изобретения также входят его сольваты и гидраты. Соединение, представленное формулой (I), может иметь один или несколько асимметрических атомов углерода. Что касается стереохимии таких асимметрических атомов углерода,они независимо могут находиться либо в (R), либо в (S) конфигурации, и производное пиримидона может существовать в виде стереоизомеров таких оптических изомеров или диастереомеров. Любые стереоизомеры в чистом виде, любые смеси стереоизомеров, рацематы и тому подобные попадают в объем настоящего изобретения. Примеры предпочтительных соединений по настоящему изобретению показаны в приведенных ниже таблицах. Однако объем изобретения не ограничен следующими соединениями. Таблица 1- 24013839 Особенно предпочтительные соединения по настоящему изобретению, представленные формулойN-3-[(2S)-4-(1-метил-6-оксо-4-пиридин-4-ил-1,6-дигидропиримидин-2-ил)морфолин-2-ил]фенил ацетамид,и их оптически активные изомеры и фармацевтически приемлемые соли. Соли вышеуказанного предпочтительного соединения и сольваты или гидраты вышеуказанных соединений и их соли также являются предпочтительными. Соединения, представленные вышеуказанной формулой (I), могут быть получены, например, в соответствии со способом, объясняемым далее. На вышеуказанной схеме определения каждого символа являются такими же, как определено ранее. 2-Хлорпиримидон, представленный вышеуказанной формулой (II), легко получают способом, приведенным в описании WO 2003/027080 и WO 2003/037888. Затем хлоридное производное (II) взаимодействует с амином (III) или его солями в присутствии основания, такого как гидроксид натрия, гидроксид калия, метоксид натрия, этоксид натрия, карбонат на- 25013839 трия, гидрокарбонат натрия, карбонат калия, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло[5,4,0]ундец-7-ен в течение от 1 до 100 ч при подходящей температуре, колеблющейся в диапазоне от 0 до 200 С в атмосфере азота или аргона, или в атмосфере обычного воздуха, давая целевое соединение (I). Примеры растворителя для реакций включают, например, спиртовой растворитель, такой как метанол, этанол, 1-пропанол, изопропанол, трет-бутанол, этиленгликоль, пропиленгликоль; растворители ряда простых эфиров, такие как диэтиловый эфир, трет-бутилметиловый эфир, тетрагидрофуран, изопропиловый эфир; углеводородные растворители, такие как бензол, толуол, ксилол; галогенированные углеводородные растворители, такие как дихлорметан, хлороформ, дихлорэтан; апротонные полярные растворители, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон,диметилсульфоксид, сульфолан, гексаметилфосфортриамид, вода и тому подобные. Обычно можно использовать единственный растворитель или смесь двух или более растворителей, так чтобы они были подходящими для используемого основания. Соединения по настоящему изобретению обладают ингибирующей активностью в отношении ТРК 1, и ингибируют активность ТРК 1 при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, подавляя таким образом нейротоксичность А и образование PHF и ингибируя смерть нервных клеток. Соответственно, соединения по настоящему изобретению полезны в качестве активного ингредиента лекарственного средства, которое по своей основе делает возможным профилактическое и/или терапевтическое лечение болезни Альцгеймера. Кроме того, соединения по настоящему изобретению также полезны в качестве активного ингредиента лекарственного средства для профилактического и/или терапевтического лечения ишемических инсультов, синдрома Дауна, мозгового кровотечения вследствие церебральной амилоидной ангиопатии, прогрессирующего супрануклеарного паралича, подострого склерозирующего панэнцефалита, постэнцефалитного паркинсонизма, травматического энцефалоза, паркинсонизма Гуама - комплекса слабоумия, болезни с тельцами Леви, болезни Пика, кортикобазальной дегенерации, лобно-височного слабоумия, сосудистого слабоумия, травматических повреждений, травмы мозга и спинного мозга, периферических невропатий, ретинопатий и глаукомы, инсулинонезависимого диабета, ожирения, маниакально-депрессивного заболевания, шизофрении, алопеции, рака молочной железы, немелкоклеточного рака легких, рака щитовидной железы, Т- или В-клеточного лейкоза и некоторых индуцированных вирусом опухолей. Поскольку соединение по настоящему изобретению обладает высокой безопасностью и хорошей фармакокинетикой, соединение обладает предпочтительными характеристиками в качестве лекарственного средства. В качестве активного ингредиента лекарственного средства по настоящему изобретению можно использовать вещество, которое выбирают из группы, состоящей из соединения, представленного вышеуказанной формулой (I), и его фармакологически приемлемых солей, а также сольватов и гидратов. Вещество, само по себе, можно вводить в качестве лекарственного средства по настоящему изобретению,однако, желательно вводить лекарственное средство в виде фармацевтической композиции, которая содержит вышеуказанное вещество в качестве активного ингредиента и одну или несколько фармацевтических вспомогательных добавок. В качестве активного ингредиента лекарственного средства по настоящему изобретению можно использовать сочетание двух или более вышеуказанных веществ. Тип фармацевтической композиции конкретно не ограничен и композиция может быть получена в виде любого препарата для перорального или парентерального введения. Например, фармацевтическая композиция может быть получена, например, в виде фармацевтических композиций для перорального введения, таких как гранулы, тонкодисперсные гранулы, порошки, твердые капсулы, мягкие капсулы,сиропы, эмульсии, суспензии, растворы и тому подобные или в виде фармацевтических композиций для парентерального введения, таких как инъекционные препараты для внутривенного, внутримышечного или подкожного введения, капельных вливаний, чрескожных препаратов, чресслизистых препаратов,капель для носа, средств для ингаляции, суппозиториев и тому подобного. Доза и частота введения лекарственного средства по настоящему изобретению не ограничены конкретным образом, и они могут быть выбраны подходящим образом в зависимости от условий, таких как цель профилактического и/или терапевтического лечения, масса тела и возраст пациента, тяжесть заболевания и тому подобных. Обычно дневная доза для перорального введения взрослому человеку может колебаться от 0,01 до 1000 мг (по весу активного ингредиента), и дозу можно вводить один раз в день или несколько раз в день в виде отдельных порций или один раз в несколько дней. Когда лекарственное средство используется в виде инъекции, введение предпочтительно можно проводить непрерывно или периодически в виде дневной дозы от 0,001 до 3000 мг (по весу активного ингредиента) для взрослого человека. Примеры Настоящее изобретение будет объяснено более конкретно со ссылкой на примеры. Однако объем настоящего изобретения не ограничен следующими примерами. Номера соединений в примерах соответствуют номерам в приведенной выше таблице. Пример 1. N-(4-2S)-4-(1-Метил-6-оксо-4-(пиридин-4-ил)-1,6-дигидропиримидин-2-ил)морфолин 2-ил)фенил)ацетамид (соединение 39). 2-Бром-(1S)-1-(4-бромфенил)этанол.- 26013839 Комплекс боран-тетрагидрофуран (1,0 М раствор в тетрагидрофуране, 270 мл, 270 ммоль) добавляли к раствору (S)-CBS S)-2-метил-CBS-оксазаборолидин, 50 мл, 1,0 М раствор в толуоле) при -30 С в течение 15 мин и раствор перемешивали в течение 15 мин. Добавляли по каплям 4-бромфенацилбромид (75,0 г, 270 ммоль) в дихлорметане (350 мл) в течение 70 мин, поддерживая температуру в диапазоне от -32 до-28 С. После перемешивания в течение одного часа раствор нагревали до комнатной темпмературы и медленно добавляли метанол (10 мл), а затем добавляли по каплям 0,5 М соляную кислоту (300 мл) в течение 10 мин. Раствор фильтровали после перемешивания в течение 40 мин и фильтрат экстрагировали дихлорметаном. Объединенный органический слой промывали 0,5 М соляной кислотой, 0,1 М водным раствором гидроксида натрия и насыщенным раствором соли и сушили над безводным сульфатом натрия. Концентрирование органического слоя давало 2-бром-(1S)-1-(4-бромфенил)этанол (77 г) в виде бледнокоричневого масла.(2S)-2-(4-Бромфенил)оксиран. Водный раствор гидроксида натрия (1 М, 400 мл) добавляли к 2-бром-(1S)-1-(4-бромфенил)этанолу(77,0 г) в диэтиловом эфире (400 мл) и перемешивали при комнатной температуре в течение 5 ч. Органический слой отделяли и водный слой экстрагировали простым эфиром. Объединенный органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Удаление растворителя давало (2S)-2-(4-бромфенил)оксиран (55,0 г) в виде бледно-коричневого масла.(1S)-1-(4-Бромфенил)-2-1R)-1-фенилэтиламино)этанол. Смесь (2S)-2-(4-бромфенил)оксирана (55,0 г) и (R)-1-фенилэтиламина (98,2 г, 810 ммоль) нагревали при 80 С в течение 6 ч. Добавление изопропилового эфира (200 мл) к остатку после отгонки избытка фенэтиламина и последующее фильтрование давали (1S)-1-(4-бромфенил)-2-1R)-1-фенилэтиламино) этанол (57,0 г) в виде белых кристаллов. Дальнейшую кристаллизацию проводили, концентрируя фильтрат в вакууме и охлаждая остаток в холодильнике. Фильтрование кристаллов из изопропилового эфира(30 мл) давало дополнительно указанное в заголовке соединение (5,60 г) в виде кристаллов (выход 72,4%, 3 стадии).(6S)-6-(4-Бромфенил)-4-1R)-1-фенэтил)морфолин-3-он. Раствор хлорацетилхлорида (24,3 г, 215 ммоль) в дихлорметане (100 мл) прибавляли по каплям к охлажденному льдом раствору (1S)-1-(4-бромфенил)-2-1R)-1-фенилэтиламино)этанолу (62,6 г, 215 ммоль) и триэтиламину (21,8 г, 215 ммоль) в дихлорметане (600 мл) в течение 30 мин и перемешивали в течение одного часа при той же температуре. Полученный раствор промывали 0,5 М соляной кислотой,насыщенным раствором гидрокарбоната натрия, насыщенным раствором соли и сушили над безводным сульфатом магния. Растворители удаляли при пониженном давлении и гидроксид калия (85%, 16,1 г, 244 ммоль) добавляли к раствору полученного бледно-коричневого масла в изопропиловом спирте (600 мл) и перемешивали в течение 16 ч. Растворитель удаляли в вакууме и остаток распределяли между водой и этилацетатом. Органический слой промывали 0,5 М соляной кислотой, насыщенным раствором гидрокарбоната натрия, насыщенным раствором соли и сушили над безводным сульфатом магния. Удаление растворителя при пониженном давлении давало (6S)-6-(4-бромфенил)-4-1R)-1-фенилэтил)морфолин-3 он (70,2 г) в виде коричневого масла.(2S)-2-(4-Бромфенил)-4-1R)-1-фенилэтил)морфолин. Комплекс боран-тетрагидрофуран (1,0 М раствор в тетрагидрофуране, 510 мл, 510 мм) добавляли к охлажденному льдом раствору (6S)-6-(4-бромфенил)-4-1R)-1-фенилэтил)морфолин-3-она (70,2 г) в тетрагидрофуране (500 мл) в течение 45 мин и раствор перемешивали при той же температуре в течение одного часа и при комнатной температуре в течение 30 мин. После осторожного добавления метанола(60 мл) к охлажденному льдом раствору растворитель удаляли при пониженном давлении и остаток в метаноле (750 мл) и 1 М водном растворе гидроксида натрия (280 мл) перемешивали при 80 С в течение одного часа, добавляя 1 М водный раствор гидроксида натрия (70 мл) каждые 15 мин. Растворители удаляли при пониженном давлении и остаток распределяли между водой и этилацетатом. Органический слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Удаление растворителя давало (2S)-2-(4-бромфенил)-4-1R)-1-фенилэтил)морфолин (65,0 г, 96,3% выход, 2 стадии) в виде белых кристаллов. Температура плавления 85-87 С. ИК: 1487, 1449, 1117, 1098, 809, 758, 699, 550 см-1. 1 Н-ЯМР (CDCl3) : 1,35 (3 Н, д), 2,10 (2 Н, м), 2,60 (1 Н, м), 3,05 (1 Н, м), 3,35 (1 Н, кв), 3,75 (1 Н, м),3,89 (1 Н, м), 4,55 (1 Н, м), 7,25 (7 Н, м), 7,46 (2 Н, д).(135 мл) перемешивали при 95 С в течение 4 ч. Растворитель удаляли в вакууме и остаток распределяли между водой и этилацетатом. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. К раствору полученного остатка в тетрагидрофуране (180 мл)- 27013839 добавляли 6 н. соляную кислоту (180 мл) и смесь перемешивали при комнатной температуре в течение одного часа. Растворитель удаляли в вакууме и остаток распределяли между водой и этилацетатом. Органический слой сушили над безводным сульфатом натрия и растворитель упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан-AcOEt, 2:1), получая (2S)-2-(4 аминофенил)-4-1R)-1-фенилэтил)морфолин (12,2 г, 96%) в виде масла.N-(4-2S)-4-1R)-1-Фенилэтил)морфолин-2-ил)фенил)ацетамид. К раствору (2S)-2-(4-аминофенил)-4-1R)-1-фенилэтил)морфолина (7,9 г, 28 ммоль) и триэтиламина (8,5 г, 84 ммоль) в тетрагидрофуране (180 мл) добавляли хлористый ацетил (4,4 г, 56 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч и распределяли между водой и хлороформом. Органический экстракт промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и выпавшие в осадок кристаллы собирали фильтрованием, промывали изопропиловым эфиром, получая N-(4-2S)-4-1R)-1-фенилэтил)морфолин 2-ил)фенил)ацетамид (6,47 г, 71%) в виде желтых кристаллов.N-(4-2S)-Морфолин-2-ил)фенил)ацетамид. К раствору N-(4-2S)-4-1R)-1-фенилэтил)морфолин-2-ил)фенил)ацетамида (6,47 г, 20 ммоль) и формиата аммония (6,3 г, 100 ммоль) в смеси тетрагидрофурана (136 мл), метанола (270 мл) и воды (70 мл) добавляли 10% палладий на угле (влажный, 27 0 мг) и раствор перемешивали при 95 С в течение 3 ч. После фильтрования растворитель удаляли в вакууме и остаток распределяли между водой и дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении, получая N-(4-2S)-морфолин-2-ил)фенил)ацетамид (5,78 г, колич.) в виде желтого масла.N-(4-2S)-4-(1-Метил-6-оксо-4-(пиридин-4-ил)-1,6-дигидропиримидин-2-ил)морфолин-2-ил)фенил) ацетамид. Раствор N-(4-2S)-морфолин-2-ил)фенил)ацетамида (2,63 г, 11,9 ммоль) 2-хлор-1-метил-6-оксо-4(пиридин-4-ил)-1,6-дигидропиримидина (2,60 г, 11,9 ммоль) и триэтиламина (3,60 г, 35,7 ммоль) в тетрагидрофуране (100 мл) перемешивали при 95 С в течение одного часа. Растворитель удаляли в вакууме и остаток распределяли между водой и дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ-метанол, 10:1), получая N-(4-2S)-4-(1-метил-6-оксо 4-(пиридин-4-ил)-1,6-дигидропиримидин-2-ил)морфолин-2-ил)фенил)ацетамид (2,8 г, 58%) в виде бледно-желтых кристаллов. Пример 2. N-(4-2S)-4-(1,6-Дигидро-1-метил-6-оксо-4,4'-бипиримидин-2-ил)морфолин-2-ил)фенил) ацетамид (соединение 40). Раствор N-(4-2S)-морфолин-2-ил)фенил)ацетамида (5,78 г, 26,2 ммоль) 2-хлор-1,6-дигидро-1 метил-6-оксо-4,4'-бипиримидина (4,00 г, 18 ммоль) и триэтиламина (6,00 г, 60 ммоль) в тетрагидрофуране (100 мл) перемешивали при 95 С в течение одного часа. Растворитель удаляли в вакууме и остаток распределяли между водой и дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ-метанол, 10:1), получая N-(4-2S)-4-(1,6-дигидро-1-метил-6 оксо-4,4'-бипиримидин-2-ил)морфолин-2-ил)фенил)ацетамид (5,7 г, 30%) в виде бледно-желтых кристаллов. Пример 3. (S)-2-(2-(4-(N-циклогексил-N-метиламино)фенил)морфолин-4-ил)-3-метил-6-(4-пиридил) пиримидин-4-он (соединение 10).(2S)-2-(4-(Циклогексиламино)фенил)-4-1R)-1-фенилэтил)морфолин. К суспензии (2S)-2-(4-бромфенил)-4-1R)-1-фенилэтил)морфолина (7,62 г, 22,0 ммоль), ацетата палладия (198 мг, 0,88 ммоль), 2-(ди-трет-бутилфосфино)бифенила (525 мг, 1,76 ммоль) и трет-бутоксида натрия (2,96 г, 30,8 ммоль) в толуоле (40 мл) добавляли циклогексиламин (3,78 мл, 33,0 ммоль) при комнатной температуре. После нагревания при 90 С в течение 2,5 ч полученную суспензию пропускали через колонку с целитом. Фильтрат концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле, элюируя 5-25% этилацетатом в гексане, получая (S)-2-(4(циклогексиламино)фенил)-4-R)-1-фенилэтил)морфолин (6,95 г, 87%) в виде белых кристаллов.(2S)-2-(4-(N-Циклогексил-N-метиламино)фенил)-4-1R)-1-фенилэтил)морфолин. К раствору (S)-2-(4-(циклогексиламино)фенил)-4-R)-1-фенилэтил)морфолина (6,95 г, 19,1 ммоль) и формалина (35%, 8,18 мл, 95,4 ммоль) добавляли, при комнатной температуре триацетоксиборгидрид натрия (12,1 г, 57,2 ммоль). После перемешивания в течение 30 мин полученную суспензию распределяли между этилацетатом и 1 н. гидроксидом натрия. Водный слой экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным раствором соли, сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, элюируя 520% этилацетатом в гексане, получая (2S)-2-(4-(N-циклогексил-N-метиламино)фенил)-4-1R)-1 фенилэтил)морфолин (7,27 г, колич.) в виде бледно-желтого масла.- 28013839 ммоль) и 10% палладий на угле (3,0 г) в этаноле (30 мл), загружали водород. Реакционную смесь интенсивно перемешивали при 50 С в течение 10 ч. Катализатор отфильтровывали через слой целита и фильтрат концентрировали при пониженном давлении, получая (2S)-2-(4-(N-циклогексил-N-метиламино)фенил)морфолин (4,95 г, 95%) в виде прозрачного масла. 2-2S)-2-(4-(N-Циклогексил-N-метиламино)фенил)морфолин-4-ил)-3-метил-6-(4-пиридил)пиримидин-4-он. К раствору (2S)-2-(4-(N-циклогексил-N-метиламино)фенил)морфолина (4,47 г, 16,30 ммоль) и триэтиламина (3,1 мл, 22,2 ммоль) в тетрагидрофуране (50 мл) добавляли порциями 2-хлор-3-метил-6-(4 пиридил)-3 Н-пиримидин-4-он (3,28 г, 14,82 ммоль). После исчезновения хлорпиримидона реакционную смесь концентрировали при пониженном давлении. Остаток распределяли между 1 н. гидроксидом натрия и дихлометаном. Органический слой промывали водой, сушили над безводным сульфатом натрия,фильтровали и концентрировали при пониженном давлении, получая бледно-желтое твердое вещество,которое перекристаллизовывали из этанола, получая 2-2S)-2-(4-(N-циклогексил-N-метиламино)фенил) морфолин-4-ил)-3-метил-6-(4-пиридил)пиримидин-4-он (5,15 г, 75,7%) в виде белых кристаллов. Пример 4. 3-Метил-2-2S)-2-(4-пиридин-2-ил)амино)фенил)морфолин-4-ил)-6-(пиридин-4-ил)пиримидин-4(3 Н)-он (соединение 48).(0,88 г, 7,8 ммоль) и хлорида 1,3-бис (2,6-диизопропилфенил)имидазолия (89,6 мг, 0,21 ммоль) в диоксане (17 мл) перемешивали при 90 С в течение 15 ч. Растворитель удаляли при пониженном давлении и остаток распределяли между водой и этилацетатом. Органический слой сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан-этилацетат, 1:2), получая N-(4-2S)-4-1R)-1 фенилэтил)морфолин-2-ил)фенил)пиридин-2-амин (0,68 г, 3 6%) в виде красных кристаллов.N-(4-2S)-Морфолин-2-ил)фенил)пиридин-2-амин. К раствору N-(4-2S)-4-1R)-1-фенилэтил)морфолин-2-ил)фенил)пиридин-2-амина (0,89 г, 2,5 ммоль) и формиата аммония (0,78 г, 12,5 ммоль) в смеси тетрагидрофурана (15 мл) метанола (24 мл) воды (18 мл) добавляли 10% палладий на угле (влажный, 200 мг) и смесь перемешивали при 95 С в течение одного часа. После фильтрования растворитель удаляли в вакууме и остаток распределяли между водой и дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель концентрировали при пониженном давлении, получая N-(4-2S)-морфолин-2-ил)фенил)пиридин-2-амин(0,2 г, 0,78 ммоль) 2-хлор-1-метил-6-оксо-4-(пиридин-4-ил)-1,6-дигидропиримидина (0,13 г, 0,62 ммоль) и триэтиламина (0,23 г, 2,3 ммоль) в тетрагидрофуране (10 мл) перемешивали при 95 С в течение 3 ч. Растворитель удаляли при пониженном давлении и остаток распределяли между водой и дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагелеN-Метил-N-(4-2S)-4-1R)-1-фенилэтил)морфолин-2-ил)фенил)пиридин-2-амин. К раствору N-(4-2S)-4-1R)-1-фенилэтил)морфолин-2-ил)фенил)пиридин-2-амина (0,57 г, 1,5 ммоль) и иодистого метана (1,6 г, 11,2 ммоль) в тетрагидрофуране (50 мл) добавляли трет-бутоксид калия (1,6 г, 9,45 ммоль). После перемешивания при комнатной температуре в течение 4 ч добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и упаривали. Неочищенный продукт очищали колоночной хроматографией на силикагеле (гексан-этилацетат, 1:1), получая N-метил-N-(4-2S)-4-1R)-1-фенилэтил) морфолин-2-ил)фенил)пиридин-2-амин (0,57 г, 81%) в виде желтого масла.N-Метил-N-(4-2S)-морфолин-2-ил)фенил)пиридин-2-амин. К раствору N-метил-N-(4-2S)-4-1R)-1-фенилэтил)морфолин-2-ил)фенил)пиридин-2-амина (0,57 г, 1,5 ммоль) и формиата аммония (0,48 г, 7,6 ммоль) в смеси тетрагидрофуран (15 мл)-метанол (30 мл)вода (16 мл) добавляли 10% палладий на угле (влажный, 200 мг) и перемешивали при 95 С в течение одного часа. После фильтрования растворитель удаляли при пониженном давлении и остаток распределяли между водой и дихлорметаном. Органический слой сушили над безводным сульфатом натрия и растворитель концентрировали при пониженном давлении, получая N-метил-N-(4-2S)-морфолин-2 ил)фенил)пиридин-2-амин (0,38 г, 94%) в виде желтого масла. 3-Метил-2-2S)-2-(4-(метил(пиридин-2-ил)амино)фенил)морфолин-4-ил)-6-(пиридин-4- 29
МПК / Метки
МПК: A61K 31/5377, A61P 25/28, C07D 413/14, C07D 413/04
Метки: 2-морфолино-4-пиримидона, соединение
Код ссылки
<a href="https://eas.patents.su/30-13839-soedinenie-2-morfolino-4-pirimidona.html" rel="bookmark" title="База патентов Евразийского Союза">Соединение 2-морфолино-4-пиримидона</a>
Следующий патент: Способ получения 1,2-дихлорэтана
Случайный патент: Содержащая ксантогумол композиция и способы её получения и применения