Новые ингибиторы дипептидилпептидазы iv, содержащие их фармацевтические композиции, способ их получения и способ лечения с их применением
Номер патента: 13463
Опубликовано: 30.04.2010
Авторы: Томас Абрахам, Гопалан Баласубраманиан, Лингам Прасада Рао В.С., Шах Дайси Маниш
Формула / Реферат
1. Соединение общей формулы (I)
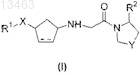
в которой Y представляет собой -S-, -СН2- или -CHF;
X представляет собой химическую связь, C1-C5-алкил или -С(=О)-;
пунктирная линия [----] в карбоциклическом кольце представляет собой необязательную двойную связь;
R1 представляет собой C6-C14-арил или (C6-C14-арил)(C1-C8-алкил), который может содержать в качестве заместителей C1-C8-алкокси; 3-15-членный гетероарил или гетероарил(C1-C8)алкил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, который может содержать в качестве заместителей галоген, C1-C8-алкил, C1-C8-алкокси, C6-C14-арил (возможно содержащий в качестве заместителя галоген), CN или нитро; 3-15-членное гетероциклическое кольцо или гетероциклил(C1-C8)алкил, содержащие от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, при этом каждый из указанных двух заместителей может содержать в качестве заместителей C1-C8-алкил, C6-C14-арил, (C6-C14-арил)(C1-C8-алкил), CN или CONH2; -CN, -CONR3R4, -NR3R4 или -NR3COR4;
R2 представляет собой водород или нитрил (-CN);
R3 и R4могут быть одинаковыми или разными и независимо друг от друга представляют собой водород, циано, аминогруппу, возможно содержащую в качестве заместителя C6-C14-арил (возможно содержащий в качестве заместителя галоген), C1-C8-алкокси, возможно содержащий в качестве заместителя C6-C14-арил, C3-C12-циклоалкил, C6-C14-арил, возможно содержащий в качестве заместителя галоген, или C6-C14-арил,
или таутомерная форма, стереоизомер, энантиомер, диастереомер, полиморф, сольват, N-оксид или фармацевтически приемлемая соль указанного соединения.
2. Соединение по п.1, отличающееся тем, что -X-R1 не является -(CH2)dR5-Z-R6, где
R5 и Z независимо друг от друга представляют собой -С(О)-, -NR7, -О- или -S-;
R6 представляет собой C1-C8-алкил, C6-C14-арил, C6-C14-арил(C1-C8)алкил, 3-15-членный гетероарил или гетероарил(C1-C8)алкил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, или 3-15-членное гетероциклическое кольцо или гетероциклил(C1-C8)алкил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы;
R7 представляет собой водород, гидрокси, ацетил, C1-C8-алкил или C1-C8-алкокси и
d равно 0, 1 или 2.
3. Соединение по п.1 или 2, отличающееся тем, что X представляет собой -СН2-.
4. Соединение по п.1 или 2, отличающееся тем, что X представляет собой -С(=О)-.
5. Соединение по п.3 или 4, отличающееся тем, что Y представляет собой -СН2-.
6. Соединение по п.3 или 4, отличающееся тем, что Y представляет собой -CHF-.
7. Соединение по любому из пп.1-5 или 6, отличающееся тем, что R1представляет собой циано, C6-C14-арил, который может содержать в качестве заместителей C1-C8-алкокси; 3-15-членный гетероарил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, который может содержать в качестве заместителей галоген, C1-C8-алкил, C1-C8-алкокси, C6-C14-арил (возможно содержащий в качестве заместителя галоген), CN или нитро; 3-15-членное гетероциклическое кольцо, содержащее от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, которое может содержать в качестве заместителей С1-С8-алкил, C6-C14-арил, (C6-C14-арил)(C1-C8-алкил), CN или CONH2; -NR3COR4или -NR3R4, причем R3и R4 могут быть одинаковыми или разными и независимо друг от друга представляют собой водород или аминогруппу, возможно содержащую в качестве заместителя C6-C14-арил (возможно содержащий в качестве заместителя галоген).
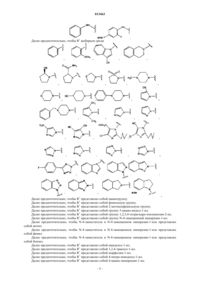
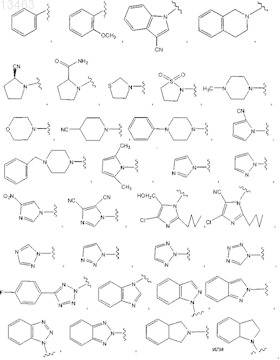
8. Соединение по п.7, отличающееся тем, что R1выбран среди
9. Соединение по пп.1-5 или 6, отличающееся тем, что R1представляет собой -NR3R4, причем R3 и R4 могут быть одинаковыми или разными и независимо друг от друга представляют собой водород или
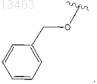
10. Соединение по п.7, отличающееся тем, что R1представляет собой -NR3COR4, причем R3 и R4 могут быть одинаковыми или разными и независимо друг от друга представляют собой водород
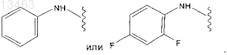
11. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой цианогруппу.
12. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой фенильную группу.
13. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 2-метоксифенил.
14. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1 представляет собой 3-цианоиндол-1-ил.
15. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 1,2,3,4-тетрагидроизохинолин-2-ил.
16. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой N-4-замещенный пиперазин-1-ил.
17. Соединение по п.16, отличающееся тем, что N-4-заместитель представляет собой метил.
18. Соединение по п.16, отличающееся тем, что N-4-заместитель представляет собой фенил.
19. Соединение по п.16, отличающееся тем, что N-4-заместитель представляет собой бензил.
20. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой имидазол-1-ил.
21. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 1,2,4-триазол-1-ил.
22. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой морфолин-1-ил.
23. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 4-нитроимидазол-1-ил.
24. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 4-цианопиперидин-1-ил.
25. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 4-карбоксамидопирролидин-1-ил.
26. Соединение по любому из пп. 3-6 или 7, отличающееся тем, что R1представляет собой 3-тиазол-1-ил.
27. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 2-цианопирролидин-1-ил.
28. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 1,1-диоксоизотиазолидин-2-ил.
29. Соединение по любому из пп. 3-6 или 7, отличающееся тем, что R1представляет собой 2-бутил-4-хлор-5-гидроксиметил-1H-имидазол-1-ил.
30. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 2-бутил-4-хлор-5-циано-1H-имидазол-1-ил.
31. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 1Н-бензо[d]имидазол-1-ил.
32. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 2Н-бензо[d][1,2,3]триазол-1-ил.
33. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 2Н-бензо[d][1,2,3]триазол-2-ил.
34. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 2,5-диметил-1Н-пиррол-1-ил.
35. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 2Н-1,2,3,4-тетразол-2-ил.
36. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 5-(4-фторфенил)-2Н-1,2,3,4-тетразол-2-ил.
37. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 4,5-дициано-1Н-имидазол-1-ил.
38. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 2-циано-1Н-пиррол-1-ил.
39. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 1Н-пиразол-1-ил.
40. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 1,2,3-триазол-1-ил.
41. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 1,2,3-триазол-2-ил.
42. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 1H-индазол-1-ил.
43. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 2Н-индазол-2-ил.
44. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 2,3-дигидро-1Н-индол-1-ил.
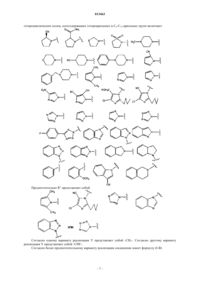
45. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой 2,3-дигидро-1Н-изоиндол-2-ил.
46. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой -NR3R4.
47. Соединение по п.46, отличающееся тем, что R3представляет собой О-бензил (бензилокси).
48. Соединение по п.46, отличающееся тем, что R3представляет собой водород.
49. Соединение по любому из пп.46, 47 или 48, отличающееся тем, что R4представляет собой водород.
50. Соединение по любому из пп.3-6 или 7, отличающееся тем, что R1представляет собой -NR3COR4.
51. Соединение по п.50, отличающееся тем, что R3представляет собой водород.
52. Соединение по п.50 или 51, отличающееся тем, что R4представляет собой анилин.
53. Соединение по п.50 или 51, отличающееся тем, что R4представляет собой 2,4-дифторанилин.
54. Соединение по любому из пп.1-52 или 53, отличающееся тем, что R2 представляет собой цианогруппу (-CN).
55. Соединение по любому из пп.1-52 или 53, отличающееся тем, что R2представляет собой водород.
56. Соединение по любому из пп.1-54 или 55, отличающееся тем, что пунктирная линия [----] в карбоциклическом кольце представляет собой возможную химическую связь.
57. Соединение общей формулы (I-A)
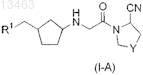
в которой Y представляет собой -СН2- или -CHF- и
R1 представляет собой C6-C14-арил, который может содержать в качестве заместителей C1-C8-алкокси; 3-15-членный гетероарил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, который может содержать в качестве заместителей галоген, C1-C8-алкил, C1-C8-алкокси, C6-C14-арил (возможно содержащий в качестве заместителя галоген), CN или нитро; или 3-15-членное гетероциклическое кольцо, содержащее от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, которое может содержать в качестве заместителей C1-C8-алкил, C6-C14-арил, (C6-C14-арил)(C1-C8-алкил), CN или CONH2.
58. Соединение общей формулы (I-B)
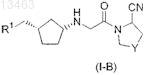
в которой Y представляет собой -СН2- или -CHF- и
R1 представляет собой C6-C14-арил, который может содержать в качестве заместителей C1-C8-алкокси; 3-15-членный гетероарил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, который может содержать в качестве заместителей галоген, C1-C8-алкил, C1-C8-алкокси, C6-C14-арил (возможно содержащий в качестве заместителя галоген), CN или нитро; или 3-15-членное гетероциклическое кольцо, содержащее от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, которое может содержать в качестве заместителей C1-C8-алкил, C6-C14-арил, (C6-C14-арил)(C1-C8-алкил), CN или CONH2.
59. Соединение общей формулы (I-C)
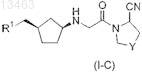
в которой Y представляет собой -СН2- или -CHF- и
R1 представляет собой C6-C14-арил, который может содержать в качестве заместителей C1-C8-алкокси; 3-15-членный гетероарил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, который может содержать в качестве заместителей галоген, C1-C8-алкил, C1-C8-алкокси, C6-C14-арил (возможно содержащий в качестве заместителя галоген), CN или нитро; или 3-15-членное гетероциклическое кольцо, содержащее от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, которое может содержать в качестве заместителей C1-C8-алкил, C6-C14-арил, (C6-C14-арил)(C1-C8-алкил), CN или CONH2.
60. Соединение по любому из пп.57, 58 или 59, отличающееся тем, что R1представляет собой азотсодержащее гетероциклическое кольцо, которое может содержать в качестве заместителей C1-C8-алкил, C6-C14-арил, (C6-C14-арил)(C1-C8-алкил), CN или CONH2; или азотсодержащий гетероарил, который может содержать в качестве заместителей галоген, C1-C8-алкил, C1-C8-алкокси, C6-C14-арил (возможно содержащий в качестве заместителя галоген), CN или нитро.
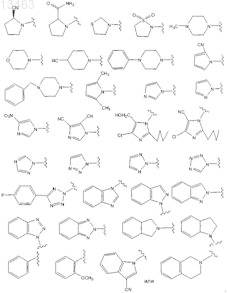
61. Соединение по п.60, отличающееся тем, что R1присоединен к соединению формулы (I-A), (I-B) или (I-C) через атом азота в гетероциклическом кольце или гетероариле.
62. Соединение по любому из пп.57, 58 или 59, отличающееся тем, что R1выбирают среди
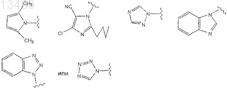
63. Соединение по п.62, отличающееся тем, что R1представляет собой
64. Соединение по любому из пп.57-62 или 63, отличающееся тем, что Y представляет собой -СН2-.
65. Соединение по любому из пп.57-62 или 63, отличающееся тем, что Y представляет собой -CHF-.
66. Соединение по п.1, отличающееся тем, что указанное соединение выбирают среди
(1SR,3RS)-3-{2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламиноциклопентан}-1-карбоксамида,
(2S)-1-{2-[(3SR,1RS)-3-цианоциклопентиламино]ацетил}-2-пирролидинкарбонитрила,
(2S)-1-{2-[(3SR,1RS)-3-цианометилциклопентиламино]ацетил}-2-пирролидинкарбонитрила,
(2S)-1-{2-[(3S,1R)-3-цианометилциклопентиламино]ацетил}-2-пирролидинкарбонитрила,
(2S)-1-{2-[(3R,1S)-3-цианометилциклопентиламино]ацетил}-2-пирролидинкарбонитрила,
(2S,4S)-1-{2-[(3S,1R)-3-цианометилциклопентиламино]ацетил}-4-фтор-2-пирролидинкарбонитрила,
(2S,4S)-1-{2-[(3R,1S)-3-цианометилциклопентиламино]ацетил}-4-фтор-2-пирролидинкарбонитрила,
3-((1R,3R)-3-{2-[(2S,4S)-2-циано-4-фторпирролидин-1-ил]-2-оксоэтиламино}циклопентил)пропионитрила,
(2S)-1-((1SR,3RS)-3-{2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламино}циклопентилметил)пирролидин-2-карбоксамида,
(2S)-1-(2-{(3SR,1RS)-3-[(2S)-2-цианопирролидин-1-илкарбонил]циклопентиламино}ацетил)пирролидин-2-карбонитрила,
N1-бензилокси-(1SR,3RS)-3-{2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламино}циклопентан-1-карбоксамида,
N1-фенил-N3-((1S,3R)-3-{2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламино}-циклопентилметил) мочевины,
N1-(2,4-дифторфенил)-N3-((1S,3R)-3-{2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламино}циклопентилметил)мочевины,
(2S,4S)-1-{2-[(1R,3R)-3-бензилциклопентиламино]ацетил}-4-фторпирролидин-2-илцианида,
(2S,4S)-4-фтор-1-{2-[(1R,3R)-3-(2-метоксибензилциклопентиламино)]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3RS,1RS)-3-(3-тиазолидинилметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3S,1R)-3-(1,1-диоксо-2-изотиазолидинилметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3S,1R)-3-морфолинометилциклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3SR,1RS)-3-(4-метилпиперазинометил)циклопентиламино]ацетил}пирролидина-2-карбонитрила,
(2S)-1-{2-[(3SR,1RS)-3-(4-цианопиперидинилметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3SR,1RS)-3-(4-бензилпиперазинометил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(1S,3R)-3-(4-фенилпиперазинометил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3S,1R)-3-(2,5-диметил-1Н-1-пирролилметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S,4S)-1-{2-[(3S,1R)-3-(2,5-диметил-1Н-1-пирролилметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила,
1-((1S,3R)-3-{2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламино}циклопентилметил)-1Н-пиррол-2-карбонитрила,
(2S,4S)-1-{2-[(3SR,1RS)-3-(2-циано-1Н-пиррол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила,
(2S)-1-{2-[(1S,3R)-3-(1Н-пиразол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3S,1R)-3-(1H-1-имидазолилметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3SR,1RS)-3-(1Н-4-нитро-1-имидазолилметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3SR,1RS)-3-(2-бутил-4-хлор-5-гидроксиметил-1H-1-имидазолилметил)циклопентиламино] ацетил}пирролидин-2-карбонитрила,
2-н-бутил-4-хлор-1-((1SR,3RS)-3-{2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламино}циклопентилметил)-1Н-5-имидазолкарбонитрила,
1-((1SR,3RS)-3-{2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламино}циклопентилметил)-1Н-4,5-имидазолдикарбонитрила,
1-((1S,3R)-3-{2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламино}циклопентилметил)-1Н-4,5-имидазолдикарбонитрила,
(2S)-1-{2-[(1S,3R)-3-(2H-1,2,3-триазол-2-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S,4S)-1-{2-[(1S,3R)-3-(1H-1,2,3-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила,
(2S,4S)-1-{2-[(1S,3R)-3-(2H-1,2,3-триазол-2-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила,
(2S)-1-(2-{(3S,1R)-3-[5-(4-фторфенил)-2Н-1,2,3,4-тетразол-2-илметил]циклопентиламино}ацетил)пирролидин-2-карбонитрила,
(2S)-1-{2-[(3S,1R)-3-(2,3-дигидро-1H-1-индолилметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
1-((1S,3R)-3-{2-[(2S,4S)-2-циано-4-фторпирролидин-1-ил]-2-оксоэтиламино}циклопентилметил)-1Н-3-индолкарбонитрила,
(2S)-1-{2-[(3S,1R)-3-(2,3-дигидро-1H-2-изоиндолилметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S,4S)-4-фтор-1-{2-[(3S,1R)-3-(1,2,3,4-тетрагидро-2-изохинолинилметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(1S,3R)-3-(2H-индазол-2-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(1S,3R)-3-(1Н-индазол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3S,1R)-3-(1Н-бензо[d]имидазол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3S,1R)-3-(2H-бензо[d][1,2,3]триазол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3S,1R)-3-(2H-бензо[d][1,2,3]триазол-2-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила
и их фармацевтически приемлемых солей.
67. Соединение, выбранное среди
(2S)-1-{2-[(1S,4R)-4-(1H-1,2,4-триазол-1-илметил)-2-циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3SR,1RS)-3-(1Н-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3S,1R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(3R,1S)-3-(1Н-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S,4S)-1-{2-[(3SR,1RS)-3-(1Н-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила,
(2S,4S)-1-{2-[(3S,1R)-3-(1Н-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила,
(2S,4S)-1-{2-[(1S,3R)-3-(1Н-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила,
(2S,4S)-4-фтор-1-{2-[(1R,3R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(4S)-3-{2-[(3S,1R)-3-(1Н-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-1,3-тиазолан-4-карбонитрила,
1-[(3S)-3-фторпирролидин-1-ил]-2-[(1S,3S)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]-1-этанона
и их фармацевтически приемлемых солей.
68. Соединение, выбранное среди 1-{2-[3-(1Н-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила и его фармацевтически приемлемых солей.
69. Соединение по п.68, отличающееся тем, что указанное соединение представляет собой (2S,4S)-1-{2-[(3S,1R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрил или его фармацевтически приемлемую соль.
70. Соединение по п.69, отличающееся тем, что указанное соединение выбирают среди
(2S,4S)-1-{2-[(3S,1R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила гидрохлорида,
(2S,4S)-1-{2-[(3S,1R)-3-(1Н-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила метансульфоната,
(2S,4S)-1-{2-[(3S,1R)-3-(1Н-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила оксалата,
(2S,4S)-1-{2-[(3S,1R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила сукцината,
(2S,4S)-1-{2-[(3S,1R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила 2-оксоглутарата,
(2S,4S)-1-{2-[(3S,1R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила бензоата,
(2S,4S)-1-{2-[(3S,1R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила салицилата,
(2S,4S)-1-{2-[(3S,1R)-3-(1Н-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрила бензолсульфоната и
(2S,4S)-1-{2-[(3S,1R)-3-(1Н-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрилнафталин-1,5-дисульфоновой кислоты.
71. Соединение, выбранное среди 1-{2-[3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила и его фармацевтически приемлемых солей.
72. Соединение по п.71, отличающееся тем, что указанное соединение представляет собой (2S)-1-{2-[(3S,1R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрил или его фармацевтически приемлемую соль.
73. Соединение по п.72, выбранное среди
(2S)-1-{2-[(3S,1R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила гидрохлорида и
(2S)-1-{2-[(3S,1R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила малеата.
74. Соединение, выбранное среди 1-{2-[3-[1Н-1,2,3,4-тетразол-1-илметил]циклопентиламино]ацетил}пирролидин-2-карбонитрила и его фармацевтически приемлемых солей.
75. Соединение по п.74, отличающееся тем, что указанное соединение выбирают среди
(2S)-1-{2-[(3S,1R)-3-(1Н-1,2,3,4-тетразол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила,
(2S)-1-{2-[(1S,3R)-3-(1Н-1,2,3,4-тетразол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила
и его фармацевтически приемлемых солей.
76. Соединение по п.75, отличающееся тем, что указанное соединение представляет собой (2S)-1-{2-[(3S,1R)-3-(1H-1,2,3,4-тетразол-1-илметил)циклопентиламино]ацетил}пирролидин-2-карбонитрила малеат.
77. Фармацевтическая композиция, содержащая соединение по любому из пп.1-76 и фармацевтически приемлемый наполнитель.
78. Фармацевтическая композиция по п.77, отличающаяся тем, что фармацевтически приемлемый наполнитель представляет собой носитель или разбавитель.
79. Способ лечения состояния, которое регулируется или нормализуется путем ингибирования ДПП-IV у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества соединения по любому из пп.1-76.
80. Способ лечения метаболического нарушения, диабета II типа, нарушенной толерантности к глюкозе, нарушенной гликемии натощак (НГН), ожирения или дислипидемии у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества соединения по любому из пп.1-76.
81. Способ лечения диабета II типа у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества соединения по любому из пп.1-76.
82. Способ для (i) снижения глюкозы в крови, (ii) предотвращения или лечения гипергликемии, (iii) замедления развития нарушенной толерантности к глюкозе в диабет II типа, (iv) замедления развития инсулиннезависимого диабета II типа в инсулинозависимый диабет II типа, (v) увеличения числа и/или размера бета-клеток, (vi) предотвращения или лечения дегенерации бета-клеток, такой как апоптоз бета-клеток, или (vii) регулирования аппетита или вызывания насыщения у субъекта, нуждающегося в этом, способ, включающий введение субъекту терапевтически эффективного количества соединения по любому из пп.1-76.
83. Способ лечения и/или профилактики нарушения, выбранного среди диабета, инсулиннезависимого сахарного диабета, нарушенного гомеостаза глюкозы, нарушенной толерантности к глюкозе, артрита, отторжения аллотрансплантата при трансплантации, аутоиммунных заболеваний, воспалительного заболевания кишечника, ожирения, гипергликемии, гиперинсулинемии и иммуномодуляторных заболеваний у субъекта, нуждающегося в этом, способ, включающий введение субъекту терапевтически эффективного количества соединения по любому из пп.1-76.
84. Способ лечения устойчивой к инсулину ненарушенной толерантности к глюкозе с целью предотвратить или замедлить возникновение инсулиннезависимого сахарного диабета у субъекта, включающий введение субъекту терапевтически эффективного количества соединения по любому из пп.1-76.
85. Способ изготовления фармацевтической композиции, включающий смешивание соединения по любому из пп.1-76 и фармацевтически приемлемого наполнителя.
86. Способ получения соединений общей формулы (I)
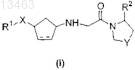
в которой Y представляет собой -S-, -СН2- или -CHF-;
X представляет собой химическую связь, C1-C5-алкил или -С(=О)-;
пунктирная линия [----] в карбоциклическом кольце представляет собой необязательную двойную связь;
R1 представляет собой C6-C14-арил или (C6-C14-арил)(C1-C8-алкил), который может содержать в качестве заместителей C1-C8-алкокси; 3-15-членный гетероарил или гетероарил(C1-C8)алкил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, который может содержать в качестве заместителей галоген, C1-C8-алкил, C1-C8-алкокси, C6-C14-арил (возможно содержащий в качестве заместителя галоген), CN или нитро; 3-15-членное гетероциклическое кольцо или гетероциклил(C1-C8)алкил, каждый из которых содержит от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, при этом каждый из указанных двух заместителей может содержать в качестве заместителей C1-C8-алкил, C6-C14-арил, (C6-C14-арил)(C1-C8-алкил), CN или CONH2; -CN, -CONR3R4, -NR3R4или -NR3COR4;
R2 представляет собой водород или нитрил (-CN);
R3 и R4могут быть одинаковыми или разными и независимо друг от друга представляют собой водород, циано, аминогруппу, возможно содержащую в качестве заместителя C6-C14-арил (возможно содержащий в качестве заместителя галоген), C1-C8-алкокси, возможно содержащий в качестве заместителя C6-C14-арил, C3-C12-циклоалкил или C6-C14-арил, возможно содержащий в качестве заместителя галоген, или C6-C14-арил,
или таутомерных форм, стереоизомеров, энантиомеров, диастереомеров, полиморфов, сольватов, N-оксидов или фармацевтически приемлемых солей указанных соединений; указанный процесс включает стадии сочетания соединения формулы
![]()
с соединением формулы
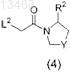
в которой L2 представляет собой уходящую группу, выбранную среди бромида, атома хлора, атома йода, О-толуолсульфонилов и О-метилсульфонилов,
с образованием соединения формулы (I).
87. Способ по п.86, отличающийся тем, что -X-R1 не является -(CH2)dR5-Z-R6, где
R5 и Z независимо друг от друга представляют собой -С(О)-, -NR7, -О- или -S-;
R6 представляет собой C1-C8-алкил, C6-C14-арил, C6-C14-арил(C1-C8)алкил, 3-15-членный гетероарил или гетероарил(C1-C8)алкил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, 3-15-членное гетероциклическое кольцо или гетероциклил(C1-C8)алкил, каждый из которых содержит от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы;
R7 представляет собой водород, гидрокси, ацетил, C1-C8-алкил или C1-C8-алкокси и
d равно 0, 1 или 2.
88. Способ по п.86 или 87, отличающийся тем, что реакцию сочетания проводят в инертном растворителе и в присутствии основания.
89. Способ по п.88, отличающийся тем, что указанный инертный растворитель выбирают среди тетрагидрофурана, диметилформамида и дихлорметана.
90. Способ по п.88 или 89, отличающийся тем, что указанное основание выбирают среди третичных аминов, карбонатов и гидроксидов.
91. Способ по любому из пп.86-89 или 90, отличающийся тем, что реакцию сочетания проводят в температурном интервале от примерно -15 до примерно 110°С.
92. Способ по любому из пп.86-90 или 91, отличающийся тем, что реакцию сочетания проводят в течение от примерно 2 ч до примерно 7 дней.
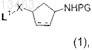
93. Способ по любому из пп. 86-92, отличающийся тем, что соединение формулы (3) получают путем сочетания соединения формулы
в которой L1 представляет собой уходящую группу, выбранную среди бромида, атома хлора, атома йода, О-толуолсульфонилов и О-метилсульфонилов,
с соединением формулы R1-H с образованием соединения формулы
![]()
в которой PG представляет собой защитную группу, выбранную среди Boc и CBZ,
с последующим снятием защиты с образованием соединения формулы (3)
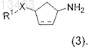
94. Способ по п.93, отличающийся тем, что реакцию сочетания для получения соединения (3) проводят в инертном растворителе и в присутствии основания.
95. Способ по п.94, отличающийся тем, что указанный инертный растворитель выбирают среди тетрагидрофурана, диметилформамида и дихлорметана.
96. Способ по п.94 или 95, отличающийся тем, что указанное основание выбирают среди третичных аминов, карбонатов и гидроксидов.
97. Способ по любому из пп.93-95 или 96, отличающийся тем, что реакцию сочетания проводят в температурном интервале от примерно -15 до примерно 110°С.
98. Способ по любому из пп.93-96 или 97, отличающийся тем, что реакцию сочетания проводят в течение от примерно 1 ч до примерно 7 дней.
99. Соединение формулы

в которой X представляет собой химическую связь или C1-C5-алкил;
пунктирная линия [----] в карбоциклическом кольце представляет собой необязательную двойную связь;
PG представляет собой аминозащитную группу, выбранную среди Boc и CBZ;
R1 представляет собой C6-C14-арил или арил(C1-C8)алкил, который может содержать в качестве заместителей оксо или C1-C8-алкокси; 3-15-членное гетероциклическое кольцо или гетероциклил(С1-С8)алкил, каждый из которых содержит от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, при этом каждый из указанных двух заместителей может содержать в качестве заместителей C1-C8-алкил, C6-C14-арил, (C6-C14-арил)(C1-C8-алкил), оксо, CN или CONH2; -OR3или циклическую структуру, выбранную из группы, включающей
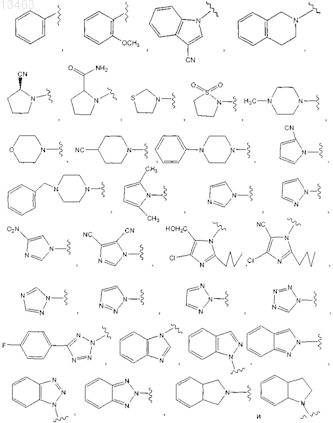
R3 и R4могут быть одинаковыми или разными и независимо друг от друга представляют собой водород, циано, аминогруппу, возможно содержащую в качестве заместителя С6-С14-арил (возможно содержащий в качестве заместителя галоген) или С1-С8-алкокси, возможно содержащий в качестве заместителя C6-C14-арил,
или таутомерная форма, стереоизомер, энантиомер, диастереомер, полиморф, сольват, N-оксид или фармацевтически приемлемая соль указанного соединения.
100. Соединение по п.99, отличающееся тем, что -X-R1 не является -(CH2)dR5-Z-R6, где
R5 и Z независимо друг от друга представляют собой -О-;
R6 представляет собой C1-C8-алкил, C6-C14-арил, C6-C14-арил(C1-C8)алкил, 3-15-членный гетероарил или гетероарил(C1-C8)алкил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, или 3-15-членное гетероциклическое кольцо или гетероциклил(C1-C8)алкил, каждый из которых содержит от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы;
R7 представляет собой водород, гидрокси, ацетил, C1-C8-алкил или C1-C8-алкокси и
d равно 0, 1 или 2.
101. Соединение по п.99 или 100, отличающееся тем, что указанное соединение выбирают среди
(2S)-1-[(1SR,3RS)-3-N-Boc-аминоциклопентилметил]пирролидин-2-карбоксамида;
(2S)-1-[(1SR,3RS)-3-N-Boc-аминоциклопентилкарбонил]пирролидин-2-илцианида;
N1-Boc-(3SR,1RS)-3-(3-тиазолидинилметилметил)циклопентиламина;
1-N-Boc-(3S,1R)-3-(1,1-диоксо-2-изотиазолидинилметил)циклопентиламина;
N1-Boc-(3S,1R)-3-морфолинометилциклопентиламина;
N1-Boc-(3SR,1SR)-3-(4-метилпиперазинометил)циклопентиламина;
N1-Boc-(3SR,1RS)-3-(4-карбоксамидопиперидинилметил)циклопентиламина;
N1-Boc-(3SR,1RS)-3-(4-цианопиперидинилметил)циклопентиламина;
N1-Boc-(3SR,1RS)-3-(4-бензилпиперазинометил)циклопентиламина;
N1-Boc-(1S,3R)-3-(4-фенилпиперазинометил)циклопентил-1-амина;
N1-Boc-(3S,1R)-3-(2,5-диметил-1Н-1-пирролилметил)циклопентиламина;
N1-Boc-(3S,1R)-3-(2-циано-1H-пиррол-1-илметил)циклопентиламина;
N1-Boc-(3SR,1RS)-3-(2-циано-1Н-пиррол-1-илметил)циклопентиламина;
N1-Boc-(1S,3R)-3-(1Н-1-пиразолилметил)циклопентил-1-амина;
N1-Boc-(1S,1R)-3-(1Н-имидазолилметил)циклопентиламина;
N1-Boc-(3SR,1RS)-3-(1H-4-нитро-1-имидазолилметил)циклопентиламина;
N1-Boc-(3SR,1RS)-3-(2-бутил-4-хлор-5-формил-1Н-1-имидазолилметил)циклопентиламина;
N1-Boc-(1SR,3RS)-3-(2-н-бутил-4-хлор-5-циано-1Н-1-имидазолилметил)циклопентиламина;
N1-Boc-(1SR,3RS)-3-(4,5-дициано-1Н-имидазол-1-илметил)циклопентиламина;
N1-Boc-(1R,3S)-3-(4,5-дициано-1Н-имидазол-1-илметил)циклопентиламина;
N1-Boc-(1S,3R)-3-(2Н-1,2,3-триазол-2-илметил)циклопентил-1-амина;
N1-Boc-(1S,3R)-3-(1Н-1,2,3-триазол-1-илметил)циклопентил-1-амина;
N1-Boc-(3S,1R)-3-(5-(4-фторфенил)-2Н-1,2,3,4-тетразол-2-илметил)циклопентиламина;
N1-Boc-(3S,1R)-3-(2,3-дигидро-1H-1-индолилметил)циклопентил-1-амина;
1-[(1S,3R)-3-N-Boc-аминоциклопентилметил]-1Н-3-индолкарбонитрила;
N1-Boc-(3S,1R)-3-(2,3-дигидро-1H-2-изоиндолилметил)циклопентил-1-амина;
N1-Boc-(3S,1R)-3-(1,2,3,4-тетрагидро-2-изохинолинилметил)циклопентил-1-амина;
N1-Boc-(1S,3R)-3-(2Н-индазол-2-илметил)циклопентил-1-амина;
N1-Boc-(1S,3R)-3-(1H-индазол-1-илметил)циклопентил-1-амина;
N1-Boc-(3S,1R)-3-(1Н-бензо[d]имидазол-1-илметил)циклопентиламина;
N1-Boc-(3S,1R)-3-(2H-бензо[d][1,2,3]триазол-1-илметил)циклопентиламина;
N1-Boc-(3S,1R)-3-(2H-бензо[d][1,2,3]триазол-2-илметил)циклопентиламина;
(2S)-1-[(1SR,3RS)-3-аминоциклопентилметил]пирролидин-2-карбоксамида п-толуолсульфоната;
(3SR,1RS)-3-(3-тиазолидинилметил)циклопентиламина трифторацетата;
(3S,1R)-3-(1,1-диоксо-2-изотиазолидинилметил)циклопентиламина трифторацетата;
(3S,1R)-3-морфолинометилциклопентиламина трифторацетата;
(3SR,1RS)-3-(4-метилпиперазинометил)циклопентиламина трифторацетата;
(3SR,1RS)-3-(4-цианопиперидинометил)циклопентиламина трифторацетата;
(3SR,1RS)-3-(4-бензилпиперазинометил)циклопентиламина трифторацетата;
(1S,3R)-3-(4-фенилпиперазинометил)циклопентиламина трифторацетата;
(3S,1R)-3-(2,5-диметил-1H-1-пирролилметил)циклопентиламина трифторацетата;
(3S,1R)-3-(2-циано-1Н-пиррол-1-илметил)циклопентиламина трифторацетата;
(3SR,1RS)-3-(2-циано-1H-пиррол-1-илметил)циклопентиламина трифторацетата;
(1S,3R)-3-(1H-1-пиразолилметил)циклопентил-1-амина трифторацетата;
(3S,1R)-3-(1H-имидазолилметил)циклопентиламина трифторацетата;
(3SR,1RS)-3-(1Н-4-нитро-1-имидазолилметил)циклопентиламина трифторацетата;
N1-(3SR,1RS)-3-(2-бутил-4-хлор-5-гидроксиметил-1Н-1-имидазолилметил)циклопентиламина;
(3SR,1RS)-3-(2-н-бутил-4-хлор-5-гидроксиметил-1Н-1-имидазолилметил)циклопентиламина трифторацетата;
(1SR,3RS)-3-(2-н-бутил-4-хлор-5-циано-1Н-1-имидазолилметил)циклопентиламина трифторацетата;
(1SR,3RS)-3-(4,5-дициано-1H-имидазол-1-илметил)циклопентиламина трифторацетата;
(1R,3S)-3-(4,5-дициано-1H-имидазол-1-илметил)циклопентиламина трифторацетата;
(1S,3R)-3-(2H-1,2,3-триазол-2-илметил)циклопентил-1-амина трифторацетата;
(1S,3R)-3-(1H-1,2,3-триазол-1-илметил)циклопентил-1-амина трифторацетата;
(3S,1R)-3-(5-(4-фторфенил)-2H,1,2,3,4-тетразол-2-илметил)циклопентиламина трифторацетата;
(3S,1R)-3-(2,3-дигидро-1H-1-индолилметил)циклопентил-1-амина трифторацетата;
1-[(1S,3R)-3-аминоциклопентилметил]-1H-3-индолкарбонитрила трифторацетата;
(3S,1R)-3-(2,3-дигидро-1H-2-изоиндолилметил)циклопентил-1-амина трифторацетата;
(3S,1R)-3-(1,2,3,4-тетрагидро-2-изохинолинилметил)циклопентил-1-амина трифторацетата;
(1S,3R)-3-(2H-индазол-2-илметил)циклопентил-1-амина трифторацетата;
(1S,3R)-3-(1Н-индазол-1-илметил)циклопентил-1-амина трифторацетата;
(1S,1R)-3-(1Н-бензо[d]имидазол-1-илметил)циклопентиламина трифторацетата;
(3S,1R)-3-(2H-бензо[d][1,2,3]триазол-1-илметил)циклопентиламина трифторацетата или
(3S,1R)-3-(2H-бензо[d][1,2,3]триазол-2-илметил)циклопентиламина трифторацетата.
102. Соединение, выбираемое среди
N1-Boc-(1S,4R)-4-(1Н-1,2,4-триазол-1-илметил)-2-циклопентенил-1-амина;
N1-Boc-(3SR,1RS)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламина;
N1-Boc-(3S,1R)-3-(1Н-1,2,4-триазол-1-илметил)циклопентиламина;
N1-Boc-(3R,1S)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламина;
N1-Boc-(1R,3R)-3-(1H-1,2,4-триазол-1-илметил)циклопентил-1-амина;
N1-Boc-(3S,1R)-3-[1H-1,2,3,4-тетразол-1-илметил]циклопентиламина;
(1S,4R)-4-(1H-1,2,4-триазол-1-илметил)-2-циклопентил-1-амина трифторацетата;
(3SR,1RS)-3-(1Н-1,2,4-триазол-1-илметил)циклопентиламина трифторацетата;
(3S,1R)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламина трифторацетата;
(3R,1S)-3-(1H-1,2,4-триазол-1-илметил)циклопентиламина трифторацетата;
(1R,3R)-3-(1H-1,2,4-триазол-1-илметил)циклопентил-1-амина трифторацетата или
(3S,1R)-(1Н-1,2,3,4-тетразол-1-илметил)циклопентиламина трифторацетата.
103. (2S,4S)-1-{2-[(3S,1R)-3-(1H-1,2,4-Триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрил или его фармацевтически приемлемая соль.
104. (2S,4S)-1-{2-[(3S,1R)-3-(1H-1,2,4-Триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрил гидрохлорид.
105. (2S,4S)-1-{2-[(3S,1R)-3-(1H-1,2,4-Триазол-1-илметил)циклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрил метансульфонат.
106. (2S,4S)-1-{2-[(3S,1R)-3-Цианометилциклопентиламино]ацетил}-4-фтор-2-пирролидинкарбонитрил или его фармацевтически приемлемая соль.
107. (2S,4S)-1-{2-[(3R,1S)-3-Цианометилциклопентиламино]ацетил}-4-фтор-2-пирролидинкарбонитрил или его фармацевтически приемлемая соль.
108. 1-{2-[3-Цианометилциклопентиламино]ацетил}-4-фторпирролидин-2-карбонитрил или его фармацевтически приемлемая соль.
109. Способ лечения диабета II типа у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества соединения по любому из пп.103-105 или 106-108.
110. Фармацевтическая композиция, содержащая соединение по любому из пп.103-105 или 106-108 и фармацевтически приемлемый наполнитель.
Текст
013463 Заявка на данный патент испрашивает приоритет согласно предварительной заявке США 60/618102, зарегистрированной 12 октября 2004 г., заявке на патент Индии 1096/MUM/2004, зарегистрированной 14 октября 2004 г., предварительной заявке США 60/635266, зарегистрированной 10 декабря 2004 г., и заявке на патент Индии 1332/MUM/2004, зарегистрированной 14 декабря 2004 г.,каждая из которых полностью включена в настоящее описание согласно ссылке. Область техники Настоящее изобретение относится к ингибиторам дипептидилпептидазы IV (ДПП-IV), содержащим их фармацевтическим композициям, способам их получения и способам лечения состояний, которые регулируются или нормализуются путем ингибирования ДПП-IV (таких как диабет II типа). Уровень техники Диабет в целом относится к заболеваниям, вызываемым множеством факторов и характеризуется повышенными уровнями глюкозы в плазме или гипергликемией в состоянии натощак или после введения глюкозы в процессе орального теста на переносимость глюкозы. Постоянная или неконтролируемая гипергликемия связана с повышенной и преждевременной заболеваемостью и смертностью. Часто анормальный гомеостаз глюкозы связан как прямо, так и косвенно с изменениями метаболизма липидов, липопротеинов и аполипопротеинов и другими нарушениями метаболизма и гемодинамики. Пациенты с сахарным диабетом II типа имеют повышенный риск осложнений, связанных с крупными и мелкими сосудами, включая ишемическую болезнь сердца, инсульт, болезни периферических сосудов, гипертонию,нефропатию, нейропатию и ретинопатию. Таким образом, терапевтический контроль гомеостаза глюкозы, метаболизма липидов и гипертонии важен в клиническом ведении и лечении сахарного диабета. Существует две общепризнанных формы диабета, тип I и II. У пациентов с диабетом I типа (также известным как инсулинозависимый сахарный диабет (ИЗСД вырабатывается мало или совсем не вырабатывается инсулин, гормон, который регулирует использование глюкозы. Пациенты с диабетом II типа(также известным как инсулиннезависимый сахарный диабет (ИНСД часто имеют уровни инсулина в плазме, такие же или даже повышенные по сравнению с уровнями инсулина у пациентов, не страдающими диабетом; однако у указанных пациентов развилась устойчивость к стимулирующему воздействию инсулина на метаболизм глюкозы и липидов в основных чувствительных к инсулину тканях, т.е. мышцах, печени и жировой ткани, и уровни инсулина в плазме, хотя и повышены, недостаточны для того,чтобы преодолеть явно выраженную устойчивость к инсулину. Устойчивость к инсулину обусловлена главным образом не уменьшенным числом инсулиновых рецепторов, а нарушенным механизмом связывания постинсулиновых рецепторов, который еще до конца не понят. Указанная устойчивость чувствительности к инсулину приводит к недостаточной активации инсулином усвоения глюкозы, окисления и запасания ее в мышцах и неадекватному подавлению инсулином липолиза в жировой ткани, а также производством и секрецией глюкозы в печени. Доступное лечение диабета II типа, которое существенно не менялось в течение многих лет, имеет явные ограничения. В то время как физические упражнения и сокращение калорийности пищевого рациона могут значительно улучшать состояние диабетика, выполнение указанного лечения очень плохое из-за прочно укоренившегося малоподвижного образа жизни и избыточного потребления пищи, особенно пищи, содержащей большие количества насыщенных жиров. Повышение уровня инсулина в плазме при введении сульфонилмочевин (например, толбутамида или глипизида) или меглитинида, которые стимулируют -клетки поджелудочной железы выделять больше инсулина, и/или при инъекции инсулина, если сульфонилмочевины или меглитинид становятся неэффективными, может привести к достаточно высоким концентрациям инсулина, чтобы стимулировать устойчивые к инсулину ткани. Однако результатом введения инсулина или стимуляторов секреции инсулина (сульфонилмочевины или меглитинида) могут оказаться опасно низкие уровни глюкозы в плазме, а повышенный уровень устойчивости к инсулину ведет к тому, что могут наблюдаться еще более высокие уровни инсулина в плазме. Бигуаниды могут повышать чувствительность к инсулину, что приводит к некоторой коррекции гипергликемии. Однако два бигуанида, фенформин и метформин, могут вызывать лактоцидоз и тошноту/диарею. Метформин имеет меньше побочных эффектов, чем фенформин, и его часто назначают для лечения диабетаII типа. Глитазоны (т.е. 5-бензилтиазолидин-2,4-дионы) представляют собой более недавно описанный класс с потенциалом для облегчения многих симптомов диабета II типа. Указанные агенты существенно увеличивают чувствительность к инсулину в мышцах, печени и жировой ткани в некоторых экспериментальных моделях диабета II типа на животных, приводя к полной или частичной коррекции повышенных уровней глюкозы в плазме без появления гипогликемии. Глитазоны, которые в настоящее время имеются в продаже, представляют собой агонисты рецепторов, активируемых пероксисомальным пролифератором (PPAR), в первую очередь подтипом PPAR-гамма. В целом считается, что агонизм к рецепторамPPAR-гамма ответственен за повышенную сенсибилизацию к инсулину, которая наблюдается при воздействии глитазонов. Никакие агонисты PPAR, которые тестировали для лечения диабета II типа, не были агонистами альфа, гамма или дельта подтипов, или их комбинации, и во многих случаях они химически отличались от глитазонов (т.е. они не являлись тиазолидиндионами). Серьезные побочные эффекты (например, печеночная токсичность) наблюдались для некоторых агонистов PPAR, таких как троглитазон.-1 013463 Другие способы лечения в настоящее время исследуются, включая лечение с использованием ингибиторов альфа-глюкозидазы (например, акарбозы) и ингибиторов протеинтирозинфосфатазы-1 В (ПТФ 1 В). Соединения, которые являются ингибиторами фермента дипептидилпептидазы IV (ДП-IV или ДПП-IV) также исследуются в настоящее время в качестве лекарств, которые могут быть применимы для лечения диабета и особенно диабета II типа. См., например, WO 97/40832, WO 98/19998, патент США 5939560, Bioorg. Med. Chem. Lett. 6(10): 1163-1166 (1996), и Bioorg. Med. Chem. Lett. 6(22):27452748 (1996). Полезность ингибиторов ДПП-IV для лечения диабета II типа основана на том факте, что ДПП-IV in vivo легко инактивирует глюкагоноподобный пептид-1 (ГПП-1) и гастроингибиторный пептид (ГИП). ГПП-1 и ГИП представляют собой инкретины и выделяются, когда поглощается пища. Инкретины стимулируют производство инсулина. Ингибирование ДПП-IV приводит к уменьшению инактивации инкретинов, а это, в свою очередь, приводит к повышенной эффективности инкретинов в стимулировании производства инсулина поджелудочной железой. Таким образом, ингибирование ДПП-IV приводит к повышенному уровню инсулина в сыворотке. Преимущественно, поскольку организм производит инкретины только при поступлении пищи, ингибирование ДПП-IV не предполагает увеличения уровня инсулина в неподходящее время, как например, между приемами пищи, что может привести к излишне низкому уровню сахара в крови (гипогликемии). Таким образом, ингибирование ДПП-IV, как предполагают, увеличит уровень инсулина без увеличения риска гипогликемии, которая является опасным побочным эффектом, связанным с использованием веществ, повышающих секрецию инсулина. Мы нуждаемся в усовершенствованных ингибиторах ДПП-IV для лучшего лечения диабета. Ниже показаны ингибиторы ДПП-IV, которые находятся на последних стадиях клинических испытаний на людяхNVP-LAF-237 соответственно. Другие антидиабетические агенты описаны в публикацияхWO 2003/084940, JMC (2003) 46(13):2774-2789, WO 03/037327, ЕР 1354882 А 1, патенте США 6011155,WO 00/34241 и патенте США 6166063. Японская Публикация заявки на патентJP 2004-26820, международная патентная публикацияWO 2002/0384541 и публикация заявки на патент США 2004/0072892 раскрывают производные цианопирролидина, обладающие ингибирующей активностью в отношении ДПП-IV. В соответствии с патентом США 2004/0072892 указанные соединения имеют формулу в которой R1 представляет собой атом галогена, гидроксильную группу, алкоксильную группу, содержащую от 1 до 5 атомов углерода, или алкильную группу, содержащую от 1 до 5 атомов углерода;R2 представляет собой атом водорода, атом галогена, гидроксильную группу, алкоксильную группу,содержащую от 1 до 5 атомов углерода, или алкильную группу, содержащую от 1 до 5 атомов углерода,илиR3 и R4, каждый, представляют собой атом водорода, атом галогена, гидроксильную группу, алкоксильную группу, содержащую от 1 до 5 атомов углерода, или алкильную группу, содержащую от 1 до 5 атомов углерода, илиX представляет собой атом кислорода или атом серы;Y представляет собой -CR5R6- (где R5 и R6 одинаковые или разные и каждый представляет собой атом водорода, атом галогена, алкильную группу, возможно, замещенную, содержащую от 1 до 10 атомов углерода, или алкенильную группу, возможно, замещенную, содержащую от 2 до 10 атомов углеро-2 013463 да) или -CR7R8-CR9R10- (где R7, R8, R9 и R10 одинаковые или разные и каждый представляет собой атом водорода, атом галогена или алкильную группу, возможно, замещенную, содержащую от 1 до 10 атомов углерода, или R7 и R9 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную группу, возможно, замещенную, содержащую от 3 до 8 атомов углерода, циклоалкенильную группу,возможно, замещенную, содержащую от 4 до 8 атомов углерода, бициклоалкильную группу, возможно,замещенную, содержащую от 5 до 10 атомов углерода, или бициклоалкенильную группу, возможно, замещенную, содержащую от 5 до 10 атомов углерода) иZ представляет собой атом водорода или алкильную группу, возможно, замещенную, содержащую от 1 до 10 атомов углерода, илиY и Z вместе с атомом азота, к которому они присоединены, образуют циклическую аминогруппу,возможно, замещенную, содержащую от 2 до 10 атомов углерода,или их фармацевтически приемлемую соль. В публикациях заявок на патент США 2004/0121964 и 2004/0259843 описаны соединения формулы в которой X представляет собой СН 2, CHF или CF2;R2 и R3 независимо друг от друга представляют собой водород, алкоксиалкил, алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, арил, арилалкил, гетероцикл, гетероциклоалкил или гидроксиалкил илиR2 и R3 вместе с теми атомами, к которым они присоединены, образуют отдельный моно- или бициклический гетероцикл,R4 и R5 независимо друг от друга представляют собой водород, алкил или арилалкил. Согласно заявкам указанные соединения ингибируют ДПП-IV и пригодны для предотвращения или лечения диабета (особенно диабета II типа), гипергликемии, синдрома X, гиперинсулинемии, ожирения,атеросклероза и различных аутоиммунных заболеваний. В публикации международной заявки WO 2005/023762 описаны соединения формулы в которой А представляет собой конкретную моноциклическую или бициклическую арильную или гетероарильную группу. Согласно заявке указанные соединения ингибируют ДПП-IV и пригодны для предотвращения или лечения диабета, гипергликемии, синдрома X, гиперинсулинемии, ожирения, расстройств насыщения, атеросклероза и различных аутоиммунных заболеваний. Краткое описание изобретения Настоящее изобретение относится к новым соединениям, пригодным в качестве ингибиторов дипептидилпептидазы IV (ДПП-IV), формулыX представляет собой химическую связь, C1-C5-алкил (например, -СН 2-) или -С(=О)-; пунктирная линия [] в карбоциклическом кольце представляет собой необязательную двойную связь;R1 представляет собой C6-C14-арил или (C6-C14-арил)(C1-C8-алкил), который может содержать в качесве заместителей C1-C8-алкокси, 3-15-членный гетероарил или гетероарил(C1-C8)алкил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, который может содержать в качестве заместителей галоген, C1-C8-алкил, C1-C8-алкокси, C6-C14-арил (возможно содержащий в качестве заместителя-3 013463 галоген), CN или нитро; 3-15-членное гетероциклическое кольцо или гетероциклил(C1-C8)алкил, содержащие от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, при этом каждый из указанных двух заместителей может содержать в качестве заместителей C1-C8-алкил, C6-C14-арил, (C6-C14-арил)(C1C8-алкил), CN или CONH2, -CN, -CONR3R4, -NR3R4 или -NR3COR4;R2 представляет собой водород или нитрил (-CN);R3 и R4 могут быть одинаковыми или разными и независимо друг от друга представляют собой водород, цианогруппу, аминогруппу, возможно содержащую в качестве заместителя C6-C14-арил (возможно содержащий в качестве заместителя галоген), C1-C8-алкокси, возможно содержащий в качестве заместителя C6-C14-арил, C3-C12-циклоалкил, C6-C14-арил, возможно содержащий в качестве заместителя галоген,или C6-C14-арил,или таутомерной форме, стереоизомеру, энантиомеру, диастереомеру, полиморфу, сольвату, N-оксиду и фармацевтически приемлемой соли указанного соединения. Согласно одному варианту реализации-X-R1 не является -(CH2)dR5-Z-R6, в которой R5 и Z независимо друг от друга представляют собойR6 представляет собой C1-C8-алкил, C6-C14-арил, C6-C14-арил(C1-C8)алкил, 3-15-членный гетероарил или гетероарил(C1-C8)алкил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода или серы, или 3-15-членное гетероциклическое кольцо или гетероциклил(C1-C8)алкил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы;d равно 0, 1 или 2. Согласно другому варианту реализации -X-R1 не является Предпочтительно, чтобы X представлял собой химическую связь. Далее предпочтительно, чтобы X представлял собой -СН 2-. Далее предпочтительно, чтобы X представлял собой -СН 2-СН 2-. Далее предпочтительно, чтобы X представлял собой -С(=О)-. Далее предпочтительно, чтобы Y представлял собой -СН 2-. Далее предпочтительно, чтобы Y представлял собой -CHF-. Далее предпочтительно, чтобы R1 выбирали среди цианогруппы, C6-C14-арила, который может содержать в качестве заместителей C1-C8-алкокси, 3-15-членного гетероарила, содержащего от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, который может содержать в качестве заместителей галоген, C1-C8-алкил, C1-C8-алкокси, C6-C14-арил (возможно содержащий в качестве заместителя галоген), CN или нитро, 3-15-членного гетероциклического кольца, содержащего от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, которое может содержать в качестве заместителей C1-C8-алкил, C6C14-арил, (C6-C14-арил)(C1-C8-алкил), CN или CONH2; -NR3COR4 или -NR3R4, где R3 и R4 могут быть одинаковыми или разными и их выбирают независимо друг от друга среди водорода, аминогруппы, возможно содержащей в качестве заместителя C6-C14-арил (возможно содержащий в качестве заместителя галоген). Например, R3 и R4 могут быть одинаковыми или разными и их выбирают независимо друг от друга среди водорода или аминогруппы, возможно содержащей в качестве заместителя C6-C14-арил (возможно содержащий в качестве заместителя галоген). Далее предпочтительно, чтобы R1 представлял собой -NR3R4, где R3 и R4 могут быть одинаковыми или различными и их выбирают независимо друг от друга среди водорода или следующих групп Далее предпочтительно, чтобы R1 представлял собой -NR3COR4, где R3 и R4 могут быть одинаковыми или разными и их выбирают независимо друг от друга среди водорода или замещенного или незамещенного амина, выбранного среди Далее предпочтительно, чтобы R1 представлял собой цианогруппу. Далее предпочтительно, чтобы R1 представлял собой фенильную группу. Далее предпочтительно, чтобы R1 представлял собой 2-метоксифенильную группу. Далее предпочтительно, чтобы R1 представлял собой группу 3-циано-индол-1-ил. Далее предпочтительно, чтобы R1 представлял собой группу 1,2,3,4-тетрагидро-изохинолин-2-ил. Далее предпочтительно, чтобы R1 представлял собой группу N-4-замещенный пиперазин-1-ил. Далее предпочтительно, чтобы N-4-заместитель в N-4-замещенном пиперазин-1-иле представлял собой метил. Далее предпочтительно, чтобы N-4-заместитель в N-4-замещенном пиперазин-1-иле представлял собой фенил. Далее предпочтительно, чтобы N-4-заместитель в N-4-замещенном пиперазин-1-иле представлял собой бензил. Далее предпочтительно, чтобы R1 представлял собой имидазол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 1,2,4-триазол-1-ил. Далее предпочтительно, чтобы R1 представлял собой морфолин-1-ил. Далее предпочтительно, чтобы R1 представлял собой 4-нитро-имидазол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 4-циано-пиперидин-1-ил.-5 013463 Далее предпочтительно, чтобы R1 представлял собой 4-карбоксамидо-пирролидин-1-ил. Далее предпочтительно, чтобы R1 представлял собой 3-тиазол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 2-циано-пирролидин-1-ил. Далее предпочтительно, чтобы R1 представлял собой 1,1-диоксо-изотиоазолидин-2-ил. Далее предпочтительно, чтобы R1 представлял собой 2-бутил-4-хлор-5-гидроксиметил-1 Нимидазол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 2-бутил-4-хлор-5-циано-1 Н-имидазол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 1 Н-бензо[d]имидазол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 2 Н-бензо[d][1,2,3]триазол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 2 Н-бензо[d][1,2,3]триазол-2-ил. Далее предпочтительно, чтобы R1 представлял собой 2,5-диметил-1 Н-пиррол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 2H-1,2,3,4-тетразол-2-ил. Далее предпочтительно, чтобы R1 представлял собой 5-(4-фторфенил)-2H-1,2,3,4-тетразол-2-ил. Далее предпочтительно, чтобы R1 представлял собой 4,5-дициано-1 Н-имидазол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 2-циано-1 Н-пиррол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 1H-пиразол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 1,2,3-триазол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 1,2,3-триазол-2-ил. Далее предпочтительно, чтобы R1 представлял собой 1 Н-индазол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 2 Н-индазол-2-ил. Далее предпочтительно, чтобы R1 представлял собой 2,3-дигидро-1 Н-индол-1-ил. Далее предпочтительно, чтобы R1 представлял собой 2,3-дигидро-1 Н-изоиндол-2-ил. Далее предпочтительно, чтобы R1 представлял собой -NR3R4. Далее предпочтительно, чтобы R1 представлял собой -NR3COR4. Далее предпочтительно, чтобы R3 представлял собой водород. Далее предпочтительно, чтобы R4 представлял собой водород. Далее предпочтительно, чтобы R4 представлял собой анилин. Далее предпочтительно, чтобы R4 представлял собой 2,4-дифтор-анилин. Далее предпочтительно, чтобы R2 представлял собой водород. Далее предпочтительно, чтобы R2 представлял собой цианогруппу (-CN). Далее предпочтительно, чтобы пунктирная линия [] в карбоциклическом кольце представляла собой возможную химическую связь. Далее предпочтительно, чтобы карбоциклическое кольцо формулы (I) не содержало ни одной двойной связи. Циклопентановое или циклопентеновое кольцо формулы (I), имеющее заместители в положениях 1 и 3, может существовать в виде цис- или трансгеометрических форм. Поскольку атом углерода в положениях 1 и 3 является хиральным, может существовать до 2 пар энантиомеров. Поэтому соединения согласно настоящему изобретению могут быть получены в виде отдельного диастереомера или в виде смеси диастереомеров (например, рацемическая смесь). Указанные отдельные диастереомеры и смеси диастереомеров попадают в объем изобретения. Соединения согласно настоящему изобретению также могут включать один или более дополнительных асимметрично замещенных атомов углерода. Это может служить причиной возникновения дополнительных стереоизомеров, и в каждом отдельном случае следует понимать, что изобретение распространяется на все указанные стереоизомеры, включая энантиомеры и диастереомеры, и их смеси, включая рацемические смеси. Согласно одному предпочтительному варианту реализации соединение согласно настоящему изобретению имеет формулу (I-A) в которой Y представляет собой -СН 2- или -CHF-,R1 представляет собой C6-C14-арил, который может содержать в качестве заместителей C1-C6 алкокси, 3-15-членный гетероарил, содержащий от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, который может содержать в качестве заместителей галоген, C1-C8-алкил, C1-C8-алкокси, C6-C14 арил (возможно содержащий в качестве заместителя галоген), CN или нитро, или 3-15-членное гетероциклическое кольцо, содержащее от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, которое может содержать в качестве заместителей C1-C8-алкил, C6-C14-арил, (C6-C14-арил)(C1-C8-алкил), CN илиCONH2. Предпочтительно R1 представляет собой азотсодержащее гетероциклическое кольцо или азотсодержащий гетероарил. Более предпочтительно R1 присоединен к остатку соединения через атом азота в гетероариле или гетероциклическом кольце. Не ограничивающие примеры подходящих азотсодержащих Согласно одному варианту реализации Y представляет собой -СН 2-. Согласно другому варианту реализации Y представляет собой -CHF-. Согласно более предпочтительному варианту реализации соединение имеет формулу (I-B) в которой Y и R1 такие, как определено ранее для формулы (I-A). Согласно другому более предпочтительному варианту реализации соединение имеет формулу (I-C) в которой Y и R1 такие, как определено ранее для формулы (I-A). Типичные соединения согласно настоящему изобретению определены ниже. Не следует делать вывод, что настоящее изобретение ограничено ими.(2S)-1-2-[(3S,1R)-3-(2H-бензо[d][1,2,3]триазол-2-илметил)циклопентиламино]ацетилпирролидин 2-карбонитрил; 1-1SR,3RS)-3-2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламиноциклопентилкарбоксамидо)адамантан; 1-1SR,3RS)-3-2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламиноциклопентилкарбоксамидо)2,5-дифторбензол; 1-1SR,3RS)-3-2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламиноциклопентилкарбоксамидо)2,4,5-трифторбензол; 1-1SR,3RS)-3-2-[(2S)-2-цианопирролидин-1-ил]-2-оксоэтиламиноциклопентилкарбоксамидо)-2 фенилбензол и фармацевтически приемлемые соли вышеуказанных соединений. Еще один вариант реализации представляет собой фармацевтическую композицию, содержащую одно или более соединений согласно настоящему изобретению и один или более фармацевтически приемлемых наполнителей (например, один или более носителей или разбавителей). Настоящее изобретение также включает способ лечения состояния, которое регулируется или нормализуется путем ингибирования ДПП-IV у субъекта при помощи введения субъекту терапевтически эффективного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно одному из вариантов реализации настоящее изобретение представляет способ:(НТГ), нарушенной гликемии натощак (НГН) или дислипидемии,(б) снижения уровня глюкозы в крови,(в) предотвращения или лечения гипергликемии,(г) замедления развития нарушенной толерантности к глюкозе (НТГ) в диабет II типа,(д) замедления развития инсулиннезависимого диабета II типа в инсулинозависимый диабет II типа,(е) увеличения числа и/или размера бета-клеток,(ж) предотвращения или лечения дегенерации бета-клеток, такого как апоптоз бета-клеток или(з) регулирования аппетита или вызывания сытости. Указанный способ включает введение субъекту терапевтически эффективного количества соединения или фармацевтической композиции согласно настоящему изобретению. Другой вариант реализации представляет собой способ лечения и/или профилактики диабета (такого как инсулиннезависимый сахарный диабет (ИНСД, нарушенного гомеостаза глюкозы, нарушенной толерантности к глюкозе (НТГ), артрита, отторжения аллотрансплантата, иммуномодуляторных заболеваний, воспалительных заболеваний кишечника (включая синдром воспаленного кишечника и хронические воспалительные заболевания кишечника (такие как болезнь Крона и язвенный колит, ожирения,гипергликемии, гиперинсулинемии и иммуномодуляторных заболеваний у субъекта путем введения субъекту терапевтически эффективного количества соединения или фармацевтической композиции согласно настоящему изобретению. Еще один вариант реализации представляет собой способ лечения устойчивой к инсулину ненарушенной толерантности к глюкозе с целью предотвратить или замедлить возникновение инсулиннезави- 10013463 симого сахарного диабета (ИНСД) у субъекта путем введения субъекту терапевтически эффективного количества соединения или фармацевтической композиции согласно настоящему изобретению. Еще один вариант реализации представляет собой способ получения соединения формулы (I), описанного выше, путем взаимодействия соединения формулы в которой R1 и X такие, как определено выше для формулы (I), с соединением формулы в которой L2 представляет собой уходящую группу, выбранную среди бромида, атома хлора, атома йода,О-толуолсульфонилов и О-метилсульфонилов, с образованием соединения формулы (I) Предпочтительно, чтобы реакцию сочетания проводили в инертном растворителе в присутствии основания. Реакцию сочетания предпочтительно проводят при температуре в пределах от около -15 до около 110 С. Реакцию сочетания предпочтительно проводят от примерно 1 ч до примерно 7 дней. Соединение формулы (3) можно получить путем снятия защиты с соединения формулы в которой PG представляет собой защитную группу, выбранную среди Boc и CBZ. Защищенное соединение можно получить путем взаимодействия соединения формулы R1-H с соединением формулы (1) в которой L1 представляет собой уходящую группу, выбранную среди бромида, атома хлора, атома йода,О-толуолсульфонилов, О-метилсульфонилов. Предпочтительно, чтобы указанную реакцию сочетания проводили в инертном растворителе в присутствии основания. Реакцию сочетания предпочтительно проводят при температуре в пределах от около -15 до около 110 С. Реакцию сочетания предпочтительно проводят от примерно 1 ч до примерно 7 дней. Подходящие инертные растворители для реакции сочетания включают, но не ограничены этим, тетрагидрофуран, диметилформамид, дихлорметан и их смеси. Подходящие уходящие группы L1 и L2 включают, но не ограничены этим, бром, хлор, йод, Отолуолсульфонилы и О-метилсульфонилы. Подробное описание изобретения Определения. Термин арил относится к ароматическому радикалу, содержащему от 6 до 14 атомов углерода,такому как фенил, нафтил, тетрагидронафтил, инданил, бифенил и т.п. Термин арилалкил относится к арильной группе, как определено выше, непосредственно связанной с алкильной группой, например -СН 2 С 6 Н 5, -С 2 Н 5 С 6 Н 5 и т.п. Термин гетероциклическое кольцо относится к стабильному радикалу от 3- до 15-членного кольца, который состоит из атомов углерода и от одного до пяти гетероатомов, на выбор из групп, содержащих азот, фосфор, кислород и серу. Для целей настоящего изобретения гетероциклический радикал может быть моноциклическим, бициклической или трициклической системой колец, которая может включать конденсированные, мостиковые и спиросистемы, и атомы азота, фосфора, углерода, кислорода и серы в остатке гетероциклического кольца могут опционально быть окислены до различных степеней окисления. В дополнение, атом азота может опционально быть четвертичным; и остаток кольца может быть частично или полностью насыщенным (т.е. гетероароматическим или гетероарильным). Примеры указанных остатков гетероциклических колец включают, но не ограничены этим, азетидиновый, акридиновый, бензодиоксоловый, бензодиоксановый, бензофурановый, карбазоловый, циннолиновый, диоксановый, индолизиновый, нафтилридиновый, пергидроазепиновый, феназиновый, фенотиазиновый, феноксазиновый, фталазиновый, пиридиновый, птеридиновый, пуриновый, хиназолиновый, хиноксалиновый,хинолиновый, изохинолиновый, тетразольный, имидазольный,тетрагидроизохинолиновый, пиперидиновый, пиперазиновый, 2-оксопиперазиновый, 2-оксопиперидиновый, 2-оксопирролидиновый, 2- 11013463 оксоазепиновый, азепиновый, пиррольный, 4-пиперидоновый, пирролидиновый, пиразиновый, пиримидиновый, пиридазиновый, оксазольный, оксазолиновый, оксазолидиновый, триазольный, индановый,изоксазольный, изоксазолидиновый, морфолиновый, тиазольный, тиазолиновый, тиазолидиновый, изотиазольный, хинуклидиновый, изотиазолидиновый, индольный, изоиндольный, индолиновый, изоиндолиновый, октагидроиндольный, октагидроизоиндольный, хинольный, изохинольный, декагидроизохинольный, бензимидазольный, тиадиазольный, безопирановый, бензотиазольный, бензооксазольный, фурановый, тетрагидрофурановый, тетрагидропирановый, тиенильный, бензотиенильный, тиоморфолиновый, тиомофолин-S-оксидный, тиоморфолин-S,S-диоксидный, диоксафосфолановый, оксадиазольный,хромановый, изохромановый и т.п. Остаток гетероциклического кольца может быть присоединен к основной структуре через любой гетероатом или атом углерода, если это приведет к созданию стабильной структуры. Термин гетероарил относится к остатку ароматического гетероциклического кольца. Остаток гетероарильного кольца может быть присоединен к основной структуре через любой гетероатом или атом углерода, если это приведет к созданию стабильной структуры. Термин гетероарилалкил относится к остатку гетероарильного кольца, как определено выше, непосредственно присоединенному к алкильной группе. Гетероарилалкильный радикал может быть присоединен к основной структуре через любой атом углерода алкильной группы, если это приведет к созданию стабильной структуры. Термин гетероциклический относится к остатку гетероциклического кольца, как определено выше. Остаток гетероциклического кольца может быть присоединен к основной структуре через любой гетероатом или атом углерода, если это приведет к созданию стабильной структуры. Термин гетероциклоалкил относится к остатку гетероциклического кольца, непосредственно присоединенному к алкильной группе. Гетероциклоалкильный радикал может быть присоединен к основной структуре через любой атом углерода алкильной группы, если это приведет к созданию стабильной структуры. Термин алкил относится к остатку прямой или разветвленной углеводородной цепи (только из атомов углерода и водорода), не содержащему ненасыщенности, содержащему от одного до восьми атомов углерода, который присоединен в остальной части молекулы при помощи одинарной химической связи, например метил, этил, н-пропил, 1-метилэтил (изопропил), н-бутил, н-пентил, 1,1-диметилэтил (mбутил) и т.п. Термин алкенил относится к алифатической углеводородной группе, содержащей двойную углерод-углеродную связь, которая может быть прямой или разветвленной, и содержит от 2 до 10 атомов углерода, например, этенил, 1-пропенил, 2-пропенил (аллил), изопропенил, 2-метил-1-пропенил, 1-бутенил,2-бутенил и т.п. Термин алкинил относится к углеводородному радикалу с прямой или разветвленной цепью, содержащему по меньшей мере одну тройную углерод-углеродную связь и содержащему от 2 до 12 атомов углерода (предпочтительными являются радикалы, содержащие от 2 до 10 атомов углерода), например этинил, пропинил, бутинил и т.п. Термин алкокси относится к алкильной группе, присоединенной через кислородную связь к остальной части молекулы. Типичными примерами указанных групп являются -ОСН 3, -ОС 2 Н 5 и т.п. Термин циклоалкил относится к неароматическому моно- или многоциклической кольцевой системе, содержащей от 3 до около 12 атомов углерода. Не ограничивающие примеры одноциклических циклоалкильных групп включают циклопропил, циклобутил, циклопентил и циклогексил. Не ограничивающие примеры многоциклических циклоалкильных групп включают пергидронафталиновую, адамантановую и норборнановую группы, мостиковые циклические группы и спироциклические группы, например спиро-(4,4)-нон-2-ил. Термин циклоалкилалкил относится к радикалу, содержащему циклическое кольцо, имеющее от 3 до около 8 атомов углерода, непосредственно присоединенное к алкильной группе, которая, в свою очередь, присоединена к основной структуре через любой атом углерода алкильной группы, если это приведет к созданию стабильной структуры, такому как циклопропилметил, циклобутилэтил, циклопентилэтил и т.п. Термин циклоалкенил относится к радикалу, содержащему циклическое кольцо, имеющее от 3 до около 8 атомов углерода и как минимум одну углерод-углеродную двойную связь, такому как циклопропенил, циклобутенил, циклопентенил и т.п. Если не определено иначе, термин замещенный, используемый здесь, относится к замещению любым или любой комбинацией следующих заместителей: гидрокси, галоген, карбоксил, циано, нитро,оксо (=O), тио (=S), замещенный или незамещенный алкил, замещенный или незамещенный алкокси,замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный амино, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенное или незамещенное гетероциклоалкильное кольцо, замещенный или незамещенный гетероарилалкил, замещенное или- 12013463 незамещенное гетероциклическое кольцо, замещенный или незамещенный гуанидин, -COORx, -C(O)Rx,-C(S)Rx, -C(O)NRxRy, -C(O)ONRxRy, -NRxCONRyRz, -N(Rx)SORy, -N(Rx)SO2Ry, -(=N-N(Rx)Ry),-NRxC(O)ORy, -NRxRy, -NRxC(O)Ry, -NRxC(S)Ry, -NRxC(S)NRyRz, -SONRxRy, -SO2NRxRy, -ORx,-ORxC(O)NRyRz, -ORxC(O)ORy, -OC(O)Rx, -OC(O)NRxRy, -RxNRyC(O)Rz, -RxORy, -RxC(O)ORy,-RxC(O)NRyRz, -RxC(O)Ry, -RxOC(O)Ry, -SRx, -SORx, -SO2Rx и -ONO2, причем Rx, Ry и Rz независимо выбирают среди водорода, замещенного или незамещенного алкила, замещенного или незамещенного алкоксила, замещенного или незамещенного алкенила, замещенного или незамещенного алкинила, замещенного или незамещенного арила, замещенного или незамещенного арилалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного циклоалкенила, замещенного или незамещенного амина, замещенного или незамещенного арила, замещенного или незамещенного гетероарила,замещенного гетероциклического кольца, замещенного или незамещенного гетероарилалкила или замещенного или незамещенного гетероциклического кольца. Согласно одному варианту реализации заместители в вышеуказанных замещенных группах не могут в свою очередь быть замещенными. Например, если заместителем замещенного алкила является замещенный арил, заместителем замещенного арила не может быть замещенный алкенил. Термин защитная группа или PG относится к заместителю, который блокирует или защищает отдельную функциональную группу, в то время как другие функциональные группы соединения могут участвовать в реакции. Например, амино-защитная группа представляет собой заместитель, присоединенный к аминогруппе, который блокирует или защищает аминную функциональность в соединении. Подходящие амино-защитные группы включают, но не ограничены этим, ацетил, трифторацетил, mбутоксикарбонил (Boc), бензилоксикарбонил (CBz) и 9-флуоренилметиленоксикарбонил (Fmoc). Сходным образом, гидроксизащитная группа относится к заместителю гидроксигруппы, который блокирует или защищает гидроксильную функциональность. Подходящие гидроксизащитные группы включают, но не ограничены этим, ацетил и силил. Карбоксизащитная группа относится к заместителю карбоксигруппы, который блокирует или защищает карбоксильную функциональность. Подходящие карбоксизащитные группы включают, но не ограничены этим, -CH2CH2SO2Ph, цианоэтил, 2-(триметилсилил)этил,2-(триметилсилил)этоксиметил, 2-(п-толуолсульфонил)этил, 2-(п-нитрофенилсульфонил)этил, 2(дифенилфосфино)этил, нитроэтил и т.п. Общее описание защитных групп и их применения см. в Т.W.Greene, Protective Groups in Organic Synthesis, John WileySons, New York, 1991. Лечение статуса, заболевания или состояния включает:(1) предотвращение или замедление проявления одного или более клинических симптомов статуса,заболевания или состояния, проявляющихся у субъекта, который страдает или предрасположен к указанному статусу, заболеванию или состоянию, но еще не испытывает или не проявляет клинических или субклинических симптомов статуса, заболевания или состояния;(2) замедление статуса, заболевания или состояния, т.е. остановка или уменьшение развития заболевания или, по меньшей мере, его клинических или субклинических симптомов; или(3) облегчение заболевания, т.е. вызывание обратного развития статуса, заболевания или состояния,или, по меньшей мере, его клинических или субклинических симптомов. Польза для субъекта, подвергающегося лечению, является либо статистически значимой, либо, по меньшей мере, ощутимой для субъекта или для терапевта. Термин субъект включает млекопитающих (особенно людей) и других животных, таких как домашние животные (например, домашние питомцы, включая собак и кошек) и не домашние животные(такие как дикие животные). Терапевтически эффективное количество означает такое количество соединения, которое при введении субъекту для лечения статуса, заболевания или состояния достаточно для того, чтобы указанное лечение дало результат. Терапевтически эффективное количество может меняться в зависимости от соединения, заболевания и его тяжести, а также возраста, веса, физического состояния и восприимчивости субъекта, подлежащего лечению. Фармацевтически приемлемые соли, являющиеся частью настоящего изобретения, включают соли,образованные неорганическими основаниями (такими как Li, Na, K, Са, Mg, Fe, Cu, Zn и Mn), соли органических оснований (таких как N,N'-диацетилэтилендиамин, глюкамин, триэтиламин, холина гидроксид,дициклогексиламин, метформин, бензиламин, триалкиламин и тиамин), соли хиральных оснований (таких как алкилфениламин, этаноламин и фенилэтаноламин), соли природных аминокислот (таких как глицин, аланин, валин, лейцин, изолейцин, норлейцин, тирозин, цистин, цистеин, метионин, пролин, гидроксипролин, гистидин, орнитин, лизин, аргинин и серин), соли неприродных аминокислот (таких как Dизомеры или замещенные аминокислоты), соли гуанидина, соли замещенного гуанидина (причем заместители выбирают среди групп нитро, амино, алкил, алкинил или алкенил), соли аммония, замещенные соли аммония и соли алюминия. Другие фармацевтически приемлемые соли включают соли, образованные добавлением кислоты (соответствующей), такие как сульфаты, нитраты, фосфаты, перхлораты, бораты, гидрогалогениды, ацетаты (такие как трифторацетат), тартраты, малеаты, цитраты, фумараты, сукцинаты, пальмитаты, метансульфонаты, бензоаты, салицилаты, бензолсульфонаты, аскорбаты, глицерофосфаты и кетоглутараты. Еще одни фармацевтически приемлемые соли включают, но не ограничены- 13013463 этим, четвертичные аммониевые соли соединений согласно изобретению с алкилгалогенидами или алкилсульфатами (такими как MeI или (Me)2SO4). Предпочтительные фармацевтически приемлемые соли соединений согласно изобретению включают, но не ограничены этим, гидрохлорид, малеат, метансульфонат, оксалат, сукцинат, 2-оксоглутарат, бензоат, салицилат, бензолсульфонат и нафталин-1,5 дисульфоновую кислоту. Фармацевтически приемлемые сольваты включают гидраты и другие кристаллизационные растворители (такие как спирты). Соединения согласно настоящему изобретению могут образовывать сольваты со стандартными низкомолекулярными растворителями с использованием известных способов. Фармацевтические композиции. Фармацевтическая композиция согласно настоящему изобретению содержит по меньшей мере одно соединение согласно настоящему изобретению и фармацевтически приемлемый наполнитель (такой как фармацевтически приемлемый носитель или разбавитель). Например, соединение согласно настоящему изобретению может быть связано с фармацевтически приемлемым наполнителем (таким как носитель или разбавитель), или быть разбавленным носителем, или включено в носитель, который может быть в форме капсулы, сашета, бумаги или другого контейнера. Примеры подходящих носителей включают, но не ограничены этим, воду, растворы солей, спирты,полиэтиленгликоли, полиэтиленгликоля касторовое масло гидрогенизированное, арахисовое масло,оливковое масло, желатин, лактозу, каолин, сахарозу, декстрин, карбонат магния, сахар, циклодекстрин,амилозу, стеарат магния, тальк, желатин, агар, пектин, гуммиарабик, стеариновую кислоту или низшие алкиловые эфиры целлюлозы, кремниевую кислоту, жирные кислоты, амины жирных кислот, моноглицериды и диглицериды жирных кислот, пентаэритритовые эфиры жирных кислот, полиоксиэтилен, гидроксиметилцеллюлозу и поливинилпирролидон. Носитель или разбавитель может включать вещество для замедленного освобождения, такое как глицерилмоностеарат или глицерилдистеарат, отдельно или в смеси с воском. Фармацевтическая композиция также может включать один или более фармацевтически приемлемых вспомогательных веществ, смачивателей, эмульгаторов, суспендирующих агентов, консервантов,солей, влияющих на осмотическое давление, буферных веществ, подсластителей, ароматизаторов, красителей или любую комбинацию вышеупомянутых веществ. Фармацевтическая композиция согласно изобретению может быть составлена таким образом, чтобы обеспечить быстрое, постоянное или замедленное освобождение активного компонента после введения субъекту при помощи известных в данной области методик. Фармацевтическая композиция согласно настоящему изобретению может быть приготовлена при помощи общеизвестных методик, например, как описано в Remington: The Science and Practice of Pharmacy, 20th Ed., 2003 (Lippincott WilliamsWilkins). Например, активное соединение может быть смешано с носителем, или разбавлено носителем, или включено в носитель, который может быть в форме ампулы, капсулы, сашета, бумаги или другого контейнера. Если носитель служит разбавителем, он может быть твердым, полутвердым или жидким веществом, которое служит носителем, наполнителем или средой для активного соединения. Активное соединение может быть адсорбировано в гранулированном твердом контейнере, например в сашете. Фармацевтическая композиция может существовать в общеизвестных формах, например капсулах,таблетках, аэрозолях, растворах, суспензиях или продуктах для местного применения. Способ введения может быть любым способом, который эффективно переносит соединение согласно изобретению, которое эффективно ингибирует ферментную активность ДПП-IV, в соответствующее или желаемое место действия. Подходящие способы введения включают, но не ограничены этим, оральный, назальный, внутрилегочный, трансбуккальный, подкожный, внутрикожный, трансдермальный, парентеральный, ректальный, в форме депо, подкожный, внутривенный, внутриуретральный, внутримышечный, интраназальный, офтальмический (такой как глазной раствор) или местный (такой как в виде местной мази). Оральный путь введения предпочтителен. Твердые оральные композиции включают, но не ограничены этим, таблетки, капсулы (мягкий или твердый желатин), драже (содержащие активный ингредиент в форме порошка или гранул), пастилки и леденцы. Таблетки, драже и капсулы, содержащие тальк и/или углеводородный носитель, или связующее, или т.п., особенно подходят для орального применения. Предпочтительные носители для таблеток,драже или капсул включают лактозу, кукурузный крахмал и/или картофельный крахмал. Можно использовать сироп или эликсир в тех случаях, когда можно применять подслащенный носитель. Типичная таблетка, которую можно приготовить по общеизвестным методикам таблетирования,может содержать:(1) ядро: активное соединение (в виде свободного соединения или его соли), 250 мг коллоидного диоксида кремния (Aerosil), 1,5 мг микрокристаллической целлюлозы (Avicel), 70 мг модифицированной карбоксиметилцеллюлозы (Ac-Di-Sol) и 7,5 мг стеарата магния;(2) покрытие: ГПМЦ (гидроксипропилметилцеллюлоза), приблизительно 9 мг Mywacett 9-40 Т и приблизительно 0,9 мг ацетилированного моноглицерида (используют в качестве пластификатора для- 14013463 пленочных покрытий). Жидкие композиции включают, но не ограничены этим, сиропы, эмульсии, мягкий желатин и стерильные жидкости для инъекций, такие как водные или неводные жидкие суспензии или растворы. Для парентерального применения особенно подходящими являются растворы или суспензии для инъекций, предпочтительно водные растворы, причем активное соединение растворено в полиэтиленгликоля касторовом масле гидрогенизированном. Способы лечения. Настоящее изобретение также включает способ лечения состояний, которые регулируются или нормализуются путем ингибирования ДПП-IV у субъекта при помощи введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно одному варианту реализации настоящее изобретение представляет способ лечения метаболического расстройства у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно другому варианту реализации настоящее изобретение представляет способ снижения глюкозы в крови субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ лечения диабета II типа у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ лечения нарушенной толерантности к глюкозе (НТГ) у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ лечения нарушенной гликемии натощак (НГН) у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ предотвращения или лечения гипергликемии у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ замедления развития нарушенной толерантности к глюкозе (НТГ) в диабет II типа у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ замедления развития инсулиннезависимого диабета типа II в инсулинозависимый диабет типа II у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ увеличения числа и /или размера бета-клеток у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ предотвращения или лечения дегенерации бета-клеток, такого как апоптоз бета-клеток, у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ лечения нарушений приема пищи у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ лечения у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ регулирования аппетита или вызывания насыщения у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ лечения дислипидемии у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ лечения функциональной диспепсии, такой как синдром раздраженного кишечника, у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Согласно еще одному варианту реализации настоящее изобретение представляет способ лечения и/или профилактики заболевания, выбранного среди диабета, инсулиннезависимого сахарного диабета,нарушенной толерантности к глюкозе, воспалительного заболевания кишечника, язвенного колита, бо- 15013463 лезни Крона, ожирения, и метаболического синдрома у субъекта путем введения терапевтически активного количества соединения или фармацевтической композиции согласно настоящему изобретению. Соединения согласно настоящему изобретению можно вводить млекопитающему, в частности человеку, при необходимости указанного лечения, предотвращения, устранения, облегчения или улучшения различных заболеваний, как отмечено выше, например, диабета II типа, НТГ, НГН, ожирения, регулирования аппетита или в качестве агента, понижающего глюкозу в крови. Соединения согласно настоящему изобретению эффективны в широких рамках дозировок. Например, при лечении взрослого человека можно использовать дозировку от около 0,05 до около 1000 мг,предпочтительно от около 0,1 до около 500 мг в день. Наиболее предпочтительная дозировка составляет от около 0,5 до около 250 мг в день. При выборе схемы для субъекта может часто быть необходимо начать с более высокой дозировки, а когда состояние взято под контроль, уменьшить дозировку. Точная дозировка зависит от способа введения, желаемого лечения, формы, в которой вводят соединение, субъекта, подлежащего лечению, и веса тела субъекта, подлежащего лечению. Соединения согласно настоящему изобретению можно распределять в форме дозировочной единицы, содержащей от около 0,05 до около 1000 мг активного компонента вместе с фармацевтически приемлемым носителем на дозировочную единицу. Дозировочные формы, подходящие для орального, назального, внутрилегочного или трансдермального введения, могут содержать от около 0,05 до около 1000 мг, предпочтительно от около 0,5 до около 250 мг соединения(ий), смешанного с фармацевтически приемлемым носителем или разбавителем. Настоящее изобретение также включает пролекарства соединений согласно изобретению, которые при введении подвергаются химическому превращению в процессе метаболизма, перед тем как стать активными фармакологическими субстанциями. В целом, указанные пролекарства могут быть функциональными производными соединения согласно изобретению, которые легко подвергаются превращениюin vivo в соединение согласно изобретению. Общепринятые процедуры для выбора и приготовления подходящих пролекарственных производных описаны, например, в Design of Prodrugs, ed. H. Bundgaard, Elsevier, 1985. Изобретение также включает активные метаболиты соединения согласно изобретению. Способы получения соединений согласно изобретению. Соединения согласно настоящему изобретению можно синтезировать в соответствии с общей схемой, приведенной ниже. Общая схема Стадия 1 где L и L2 представляют собой уходящие группы (такие как бром, хлор, йод, О-толуолсульфонилы и Ометилсульфонилы), a PG представляет собой защитную группу (такую как -Boc или -Cbz). Соединения формулы (I) можно получить способами, известными в данной области. Один подобный подход показан выше на общей схеме синтеза. Промежуточное соединение формулы (1) может присоединяться к однозащищенному бифункциональному промежуточному соединению формулы (2). Продукт присоединения затем может быть лишен защиты, чтобы получить промежуточное соединение формулы (3). Соединения формулы (I) можно получить путем взаимодействия промежуточных соединений формул (3) и (4). Предпочтительно, чтобы каждую реакцию присоединения проводили в присутствии основания. Подходящие основания включают, но не ограничены этим, третичные амины (например, триэтиламин),карбонаты (например, K2CO3), гидроксиды и их смеси. Реакции присоединения обычно проводят в инертном растворителе, таком как тетрагидрофуран, диметилформамид, дихлорметан и их смеси. Последовательность присоединения фрагментов (1)-(4) можно изменять и соединения общей формулы (I) можно получать другими известными в данной области способами. Соединение формулы (I), имеющее определенную стереохимию циклопентанового или циклопентенового кольца, можно получить из оптически активного 1-аминоциклопентана или 1-циклопентена формулы (2). Оптически активное соединение формулы (2) можно получить путем разделения, асимметрического синтеза или другими способами, известными в данной области. Соединения согласно настоящему изобретению можно выделять и/или очищать, как, например,способами, известными в данной области. Например, соединения можно выделять и/или очищать путем отгонки растворителя в вакууме и перекристаллизации полученного остатка из подходящего растворите- 16013463 ля или подвергая его способу очистки, такому как колоночная хроматография на подходящем носителе. Соли можно получать путем растворения свободного соединения в подходящем растворителе, например хлорированном углеводороде (например, метиленхлориде, хлороформе, 1,2-дихлорэтане, четыреххлористом углероде и т.п.) или алифатическом спирте с низким молекулярным весом (например, этаноле или изопропаноле), который содержит выбранную кислоту или основание или в который затем добавляют выбранную кислоту или основание. Затем соли могут быть выделены путем фильтрования, переосаждения, высаживания нерастворителем добавочной соли или путем выпаривания растворителя. Полученные соли затем можно превратить в свободные основания путем подщелачивания или путем подкисления в свободные соединения, которые, в свою очередь, можно превратить в другие соли. Соединения можно приготовит в чистой или практически чистой форме при помощи способов, известных в данной области, таких как кристаллизация с использованием таких растворителей, как пентан,диэтиловый эфир, изопропиловый эфир, хлороформ, дихлорметан, этилацетат, ацетон, метанол, этанол,изопропанол, вода или их сочетания, или колоночная хроматография с использованием оксида алюминия или силикагеля и элюированием колонки такими растворителями, как гексан, петролейный эфир, хлороформ, этилацетат, ацетон, метанол или их сочетания. Полиморфы соединений формулы (I), также относящиеся к настоящему изобретению, можно получить путем кристаллизации соединения в различных условиях (например, путем изменения температуры кристаллизации и/или скорости охлаждения) и из различных растворителей. Например, полиморфы модно получить путем нагревания или плавления соединения, а затем постепенного или быстрого охлаждения. Присутствие полиморфов можно определить при помощи спектроскопии ЯМР твердой пробы, ИКспектроскопии, дифференциальной сканирующей калориметрии и рентгеновской дифракции на порошке. Изобретение подробно описано в приведенных ниже примерах, которые представлены только для иллюстрации и поэтому их нельзя толковать как ограничивающие область действия изобретения. Промежуточные соединения. Промежуточное соединение 1. цис 4-N-Boc-аминоциклопент-2-ен-1-карбоновая кислота Стадия 1: -2-N-Boc-азабицикло[2,2,1]гепт-5-ен-3-он. Раствор ди-трет-бутилдикарбоната (144 г, 660,5 ммоль) в ТГФ (100 мл) добавляют (20 мин) при перемешивании к раствору -2-азабицикло[2,2,1]гепт-5-ен-3-она (60 г, 549,8 ммоль), триэтиламина(83,5 г, 824,6 ммоль) и 4-диметиламинопиридина (6,7 г, 54,8 ммоль) в ТГФ (500 мл) при комнатной температуре. Реакционную смесь перемешивают еще в течение 4 ч при комнатной температуре. Растворитель выпаривают при пониженном давлении и разбавляют остаток EtOAc (800 мл), промывают водой(3500 мл) и раствором соли (400 мл). Экстракт EtOAc высушивают (Na2SO4) и выпаривают при пониженном давлении, чтобы получить 115 г соединения в виде белого твердого вещества. ИК (KBr) 2979, 1755, 1705, 1455, 1331, 1305, 1149, 1117 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,50 (с, 9 Н), 2,13-2,16 (м, 1 Н), 2,33-2,37 (м, 1 Н), 3,38-3,40 (м, 1 Н), 4,944,96 (м, 1 Н), 6,64-6,66 (м, 1 Н), 6,88-6,90 (м, 1 Н). Стадия 2: цис 4-N-Boc-аминоциклопент-2-ен-1-карбоновая кислота. К раствору промежуточного соединения стадии 1 (30,0 г, 143,3 ммоль) в ТГФ (100 мл) добавляют при перемешивании 1N раствор гидроксида натрия (300 мл) и перемешивают смесь при 40 С в течение 20 ч. Реакционную смесь охлаждают до 0 С и подкисляют до рН 3,5 1N соляной кислотой. Смесь экстрагируют дихлорметаном (3200 мл) и объединенные экстракты промывают водой (2300 мл), раствором соли (300 мл) и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении, чтобы получить 31,5 г продукта в виде белого твердого вещества. ИК (KBr) 3408, 3222, 2982, 1724, 1681, 1504, 1392 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,45 (с, 9 Н), 1,87-2,03 (м, 1 Н), 2,37-2,60 (м, 1 Н), 3,49 (уш. с, 1 Н), 4,60(уш. с, 1 Н), 4,49 (уш. с, 1 Н), 5,90 (уш. с, 2 Н), 9,01 (уш. с, 1 Н). Промежуточное соединение 2. цис 3-N-Boc-аминоциклопентан-1-карбоновая кислота Способ А. К раствору промежуточного соединения 1 (15 г, 66,0 ммоль) в метаноле (100 мл) добавляют 5%Pd/C (1,0 г) и выдерживают смесь под давлением водорода (40 фунтов/кв.дюйм) в течение 2 ч при комнатной температуре. Затем отфильтровывают катализатор и концентрируют фильтрат при пониженном давлении, чтобы получить 14,9 г продукта в виде белого твердого вещества. ИК (KBr) 3304, 3249, 3098, 2978, 1705, 1646, 1403, 1164 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,42 (с, 9 Н), 1,53-2,20 (м, 5 Н), 2,11-2,35 (м, 1 Н), 2,73-3,01 (м, 1 Н), 4,05- 17013463 Стадия 1: цис 2-N-Boc-азабицикло[2,2,1]гептан-3-он. К раствору цис 2-N-Boc-азабицикло[2,2,1]гепт-5-ен-3-она (18,0 г, 86,02 ммоль), полученного из промежуточного соединения 1, стадия 1, в EtOAc (180 мл) добавляют 5% Pd/C (1,5 г) и выдерживают смесь под давлением водорода (40 фунтов/кв.дюйм) в течение 2 ч при комнатной температуре. Затем отфильтровывают катализатор и концентрируют фильтрат при пониженном давлении, чтобы получить 18,1 г (99,6%) соединения в виде белого твердого вещества. ИК (KBr) 2982, 1754, 1708, 1349, 1316, 1217, 1155, 1096, 921 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,42 (д, J=10,2 Гц, 1 Н), 1,52 (с, 9 Н), 1,73-1,96 (м, 5 Н), 2,86 (уш. с, 1 Н),4,53 (уш. с, 1 Н). Стадия 2: цис 3-N-Boc-аминоциклопентан-1-карбоновая кислота. К раствору промежуточного соединения стадии 1 (9,0 г, 42,60 ммоль) в ТГФ (45 мл) добавляют при перемешивании 1N раствор гидроксида натрия (90 мл) и перемешивают смесь при 50 С в течение 24 ч. Охлаждают реакционную смесь до 0 С и подкисляют до рН 3,5 1N соляной кислотой. Смесь экстрагируют дихлорметаном (3100 мл), объединенные экстракты промывают водой (2100 мл), раствором соли(100 мл) и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении, чтобы получить 9,5 г (97%) продукта в виде белого твердого вещества. Выделенный продукт полностью идентичен полученному в способе А. Промежуточное соединение 3. цис 3-N-Boc-аминоциклопентилметанол Способ А. Борогидрид натрия (1,43 г, 37,8 ммоль) добавляют при перемешивании к раствору -2-N-Bocазабицикло[2,2,1]гептан-3-она (8,0 г, 37,86 ммоль), полученного на стадии 1, способ Б промежуточного соединения 2 в 10% водном растворе ТГФ (100 мл) при 0 С. Вторую часть борогидрида натрия (1,43 г,37,8 ммоль) добавляют через 0,5 ч при той же температуре и перемешивают смесь при 0-10 С в течение 4 ч. Избыток реагента нейтрализуют 1N HCl и подкисляют реакционную смесь до рН 5,0. Смесь экстрагируют этилацетатом (3200 мл), объединенные экстракты промывают водой (3200 мл), раствором соли(200 мл) и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении, чтобы получить 6,9 г (85%) соединения в виде белого твердого вещества. ИК (KBr) 3361, 2969, 1683, 1524, 1366, 1271, 1172, 1017 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,11-1,16 (м, 1 Н), 1,40-1,53 (м, 2 Н), 1,44 (с, 9 Н), 1,71-1,79 (м, 1 Н), 1,871,95 (м, 1 Н), 2,15-2,01 (м, 2 Н), 3,57 (t, J=5,1 Гц, 2 Н), 3,94 (уш. с, 1 Н), 4,73 (уш. с, 1 Н). Способ Б. Этилхлорформиат (4,73 г, 43,58 ммоль) добавляют при перемешивании к раствору промежуточного соединения 2 (10 г, 43,66 ммоль) и триэтиламина (4,42 г, 43,76 ммоль) в сухом ТГФ (100 мл) при 0 С в течение 5 мин в атмосфере азота. Реакционную смесь перемешивают еще в течение 30 мин при той же температуре. Затем ее отфильтровывают, чтобы удалить выпавший в осадок гидрохлорид триэтиламина. Фильтрат, содержащий смешанный ангидрид, медленно добавляют при перемешивании к суспензииNaBH4 (4,95 г, 130,84 ммоль) в 20% водном ТГФ (100 мл), поддерживая температуру 10 С. Затем смесь перемешивают еще в течение 30 мин при той же температуре, а затем подкисляют 1N HCl до рН 4. Смесь экстрагируют EtOAc (3200 мл) и промывают органический слой 2N раствором NaOH (2250 мл), водой(2250 мл) и раствором соли (300 мл). Растворитель выпаривают при пониженном давлении, чтобы получить 7,01 г (75%) спирта в виде белого твердого вещества. ИК и 1 Н ЯМР спектры продукта идентичны во всех отношениях соединению, полученному в способе А. Промежуточное соединение 4. цис 3-N-Boc-аминоциклопентилметилметансульфонат Метансульфохлорид (15,23 г, 0,13 моль) добавляют при перемешивании к охлажденному (10 С) раствору промежуточного соединения 3 (26 г, 0,12 моль) и триэтиламина (15 г, 0,148 моль) в сухом дихлорметане (150 мл) в атмосфере азота. Смесь перемешивают при той же температуре в течение 15 мин,а затем разбавляют водой (150 мл). Разделяют органический и водный слои. Водный слой экстрагируют дихлорметаном (100 мл), объединенные экстракты промывают водой, раствором соли и высушивают(Na2SO4). Растворитель концентрируют при пониженном давлении, чтобы получить 35,4 г продукта в виде белого твердого вещества. ИК (KBr) 3361, 2969, 2870, 1678, 1529, 1349, 1286, 1252, 1167, 1052, 973 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,11-1,20 (м, 1 Н), 1,41-1,56 (м, 2 Н), 1,44 (с, 9 Н), 1,75-1,88 (м, 1 Н), 1,941,98 (м, 1 Н), 2,01-2,94 (м, 2 Н), 3,02 (с, 3 Н), 3,95 (уш. с, 1 Н), 4,15 (д, J=6,6 Гц, 2 Н), 4,53 (уш. с, 1 Н). Промежуточное соединение 5. (4S,1R)-4-N-Boc-аминоциклопент-2-ен-1-метанол- 18013463 Способ А. Стадия 1: (4S,1R)-(+)-4-N-Boc-аминоциклопент-2-ен-1-карбоновая кислота. Указанное промежуточное соединение получают путем оптического разделения промежуточного соединения 1 с использованием (S)-(-)-фенилэтиламина в смеси изопропанола и этанола; []D+48,0(с=1,0, МеОН). Стадия 2: этилхлорформиат (2,86 г, 26,4 ммоль) добавляют при активном перемешивании к раствору промежуточного соединения 1 (5,0 г, 22,0 ммоль) и триэтиламина (3,34 г, 33,0 ммоль) в сухом ТГФ(50 мл) при 0 С в течение 5 мин в атмосфере азота. Реакционную смесь перемешивают еще в течение 30 мин при той же температуре. Затем ее отфильтровывают, чтобы удалить выпавший в осадок гидрохлорид триэтиламина. Фильтрат, содержащий смешанный ангидрид, медленно добавляют при перемешивании к суспензии NaBH4 (2,50 г, 66,0 ммоль) в 20% водном ТГФ (20 мл), поддерживая температуру 10 С. Реакционную смесь перемешивают еще в течение 30 мин при той же температуре, а затем подкисляют 1N HCl до рН 4. Смесь экстрагируют EtOAc и промывают органический слой 2N NaOH, раствором соли и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении, чтобы получить 4,0 г спирта в виде белого твердого вещества. ИК (KBr) 3316, 1958, 1681, 1538, 1370, 1250, 1166, 1039, 997 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,34-1,42 (м, 1 Н), 1,44 (с, 9 Н), 2,44-2,51 (м, 1 Н), 2,83 (уш. с, 1 Н), 3,513,68 (м, 2 Н), 4,72 (уш. с, 1 Н), 4,88 (уш. с, 1 Н), 5,72-5,82 (м, 2 Н). Способ Б. Стадия 1: (1S,4R)-(+)-2-N-Boc-азабицикло[2,2,1]гепт-5-ен-3-он. Указанное промежуточное соединение синтезируют из (1S,4R)-(+)-2-азабицикло[2,2,1]гепт-5-ен-3 она (10,0 г, 91,74 ммоль) и ди-трет-бутилдикарбоната (26 г, 119,26 ммоль) с использованием триэтиламина (13,92 г, 137,5 ммоль) и 4-диметиламинопиридина (1,1 г, 9,17 ммоль) в ТГФ (50 мл), как описано для промежуточного соединения 1, стадия 1, чтобы получить 19,3 г соединения в виде белого твердого вещества. ИК и 1 Н ЯМР спектры продукта идентичны спектрам рацемического продукта для промежуточного соединения 1, стадия 1. Стадия 2: борогидирид натрия (2,71 г, 71,69 ммоль) добавляют при перемешивании к раствору промежуточного соединения стадии 1 (15,0 г, 71,69 ммоль) в 10% водном растворе ТГФ (50 мл) при 0 С. Вторую часть борогидрида натрия (2,71 г, 71,69 ммоль) добавляют через 0,5 ч при той же температуре и перемешивают смесь при 0-10 С в течение 4 ч. Избыток реагента нейтрализуют 1N HCl и подкисляют реакционную смесь до рН 5,0. Смесь экстрагируют этилацетатом, объединенные экстракты промывают водой, раствором соли и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении,чтобы получить 13,30 г (87%) продукта в виде белого твердого вещества. ИК и 1 Н ЯМР спектры продукта идентичны во всех отношениях соединению, полученному в способе А. Промежуточное соединение 6. (4S,1R)-4-N-Boc-аминоциклопент-2-ен-1-метилметансульфонат Метансульфохлорид (6,45 г, 56,27 ммоль) добавляют при перемешивании к охлажденному (10 С) раствору промежуточного соединения 5 (10,0 г, 46,89 ммоль) и триэтиламина (7,12 г, 70,33 ммоль) в сухом дихлорметане (50 мл) в атмосфере азота. Смесь перемешивают при той же температуре в течение 15 мин, а затем разбавляют водой. Органический и водный слои разделяют. Органический слой экстрагируют дихлорметаном, объединенные экстракты промывают водой, раствором соли и высушивают(Na2SO4). Растворитель удаляют при пониженном давлении, чтобы получить 12,9 г соединения в виде белого твердого вещества. ИК (KBr) 3352, 2984, 1678, 1515, 1343, 1239, 1168, 1060, 979 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,31-1,42 (м, 2 Н), 1,44 (с, 9 Н), 2,54-2,61 (м, 1 Н), 3,08 (с, 3 Н), 4,13 (дд,J=4,2, 1,5 Гц, 2 Н), 4,61 (уш. с, 1 Н), 4,72 (уш. с, 1 Н), 5,75-5,82 (м,2 Н). Промежуточное соединение 7. (1S,3R)-(+)-3-N-Boc-аминоциклопентан-1-карбоновая кислота Способ А. Стадия 1: (1R,4S)-(+)-2-N-Boc-азабицикло[2,2,1]гептан-3-он. Промежуточное соединение стадии 1, способ Б, промежуточное соединение 5 (9,0 г, 43,26 ммоль) гидрируют с использованием 5% Pd/C (1,0 г), как описано в способе Б, промежуточное соединение 2,чтобы получить 9,0 г продукта в виде белого твердого вещества. ИК и 1 Н ЯМР спектры идентичны спектрам рацемического продукта. Стадия 2: (1S,3R)-(+)-3-N-Boc-аминоциклопентан-1-карбоновая кислота. Гидролитическое расщепление промежуточного соединения стадии 1 (8,5 г, 40,26 ммоль), как описано для промежуточного соединения 2, способ Б, стадия 2, дает желаемый продукт в виде белого твердого вещества.- 19013463 ИК и 1 Н ЯМР спектры идентичны спектрам рацемического промежуточного продукта; [a]D+12,2(c=1,0, МеОН). Способ Б. Стадия 1: (4S,1R)-(+)-4-N-Boc-аминоциклопент-2-ен-1-карбоновая кислота. Указанное промежуточное соединение получают путем оптического разделения промежуточного соединения 1 с использованием (S)-(-)-фенилэтиламина в смеси изопропанола и этанола; []D+48,0(с=1,0, МеОН). Стадия 2: (1S,3R)-(+)-3-N-Boc-Ааминоциклопентан-1-карбоновая кислота. К раствору промежуточного соединения стадии 1 из способа А, промежуточное соединение 5 (8,0 г,35,2 ммоль) в этилацетате (150 мл) добавляют 5% Pd/C (1,0 г) и выдерживают смесь под давлением водорода (40 фунтов/кв.дюйм) в течение 3 ч при комнатной температуре, чтобы получить 8,0 г продукта в виде белого твердого вещества, идентичного во всех отношениях продукту, полученному в способе А. Промежуточное соединение 8. (1S,3R)-(+)-3-N-Boc-аминоциклопентилметанол Способ А. Указанное промежуточное соединение получают путем восстановительного расщепления (1R,4S)(+)-2-N-Boc-азабицикло[2,2,1]гептан-3-она (8,0 г, 37,86 ммоль) (промежуточное соединение стадии 1,способ А, промежуточное соединение 7) борогидридом натрия (2,86 г, 75,6 ммоль) в 10% водном растворе ТГФ (100 мл), как описано для промежуточного соединения 3, способ А, чтобы получить 6,95 г (85%) продукта в виде белого твердого вещества; []D+8,7 (с=1,0, МеОН). Способ Б. Смешанный ангидрид (1S,3R)-(+)-3-N-Boc-аминоциклопентан-1-карбоновой кислоты (9,0 г,39,3 ммоль), полученный с использованием этилхлорформиата (4,69 г, 43,21 ммоль) и триэтиламина(4,36 г, 43,08 ммоль) в сухом ТГФ, обрабатывают NaBH4 (4,45 г, 117,6 ммоль) в 20% водном растворе ТГФ, как описано для промежуточного соединения 3, способ Б, чтобы получить 7,0 г (83,3%) спирта в виде белого твердого вещества, которое идентично во всех отношениях продукту, полученному в способе А. Промежуточное соединение 9. (1S,3R)-(+)-3-N-Boc-аминоциклопентилметилметансульфонат Реакция промежуточного соединения 8 (6,5 г, 30,2 ммоль) с метансульфохлоридом (3,8 г,33,18 ммоль) в присутствии триэтиламина (3,97 г, 39,2 ммоль) в сухом дихлорметане (150 мл), как описано для промежуточного соединения 4, дает 8,5 г (96,5%) продукта в виде белого твердого вещества. ИК и 1 Н ЯМР спектры продукта идентичны во всех отношениях соединению, полученному из промежуточного соединения 4; []D+15,9 (с=1,0, МеОН). Промежуточное соединение 10. (1S,3R)-3-N-Boc-аминоциклопентилметиламин Стадия 1: (1S,3R)-3-N-Boc-аминоциклопентилметилазид. Азид натрия (3,1 г, 47,6 ммоль) добавляют при перемешивании к раствору промежуточного соединения 9 (7,0 г, 23,8 ммоль) в ДМФА (100 мл) и перемешивают смесь при 60 С в течение 6 ч в атмосфере азота. Смесь охлаждают до комнатной температуры и разбавляют EtOAc (500 мл) и водой (500 мл). Слои разделяют, промывают органический слой водой, раствором соли и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении, чтобы получить 5,7 г азида в виде масла. ИК (чистое вещество) 3338, 2965, 2870, 2096, 1696, 1515, 1453, 1365, 1251, 1171 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,06-1,13 (м, 1 Н), 1,37 -1,52 (м,2 Н), 1,44 (с, 9 Н), 1,75-1,86 (м, 1 Н), 1,942,05 (м, 1 Н), 2,14-2,29 (м, 2 Н), 3,28 (д, J=6,6 Гц, 2 Н), 3,94 (уш. с, 1 Н), 4,55 (уш с., 1 Н). Стадия 2: (1S,3R)-3-N-Boc-аминоциклопентилметиламин. К раствору промежуточного соединения стадии 1 (6,0 г, 25,0 ммоль) в метаноле (150 мл) добавляют 5% Pd/C (300 мг) и выдерживают смесь под давлением водорода 50 фунтов/кв.дюйм, чтобы получить 5,35 г амина в виде полутвердого вещества, которое используют как есть в реакции сочетания. Промежуточное соединение 11. N1-метокси-N1-метил(1S,3R)-3-N-Boc-аминоциклопентан-1 карбоксамид Стадия 1: этилхлорформиат (3,08 г, 26,2 ммоль) добавляют при перемешивании к охлажденному(-10 С) раствору промежуточного соединения 7 (5,0 г, 21,83 ммоль) и триэтиламина (5,51 г, 54,59 ммоль) в сухом ТГФ (15 мл) в течение 5 мин в атмосфере азота. Реакционную смесь перемешивают еще в течение 30 мин при той же температуре и добавляют раствор N,O-диметилгидроксиламина гидрохлорида(2,56 г, 26,64 ммоль) в смеси 20 мл ТГФ и 3 мл воды за 5 мин. Смесь оставляют нагреться до комнатной температуры и перемешивают в течение 12 ч. Растворитель удаляют при пониженном давлении и оставшийся водный раствор подщелачивают 1N NaOH до рН 10 и экстрагируют этилацетатом (3150 мл). Объединенные органические экстракты промывают 1N HCl, раствором соли и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении, чтобы получить 4,2 г продукта в виде белого твердого вещества. ИК (KBr) 3379, 2969, 1682, 1665, 1520, 1170, 618 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,43 (с, 9 Н), 1,71-1,79 (м, 2 Н), 1,81-1,98 (м, 3 Н), 2,05-2,11 (м, 1 Н), 3,21(с, 3 Н), 3,27 (уш. с, 1 Н), 3,70 (с, 3 Н), 4,10 (уш. с, 1 Н), 5,51 (уш. с, 1 Н). Промежуточное соединение 12. (3S,1R)-(-)-3-N-Boc-аминоциклопентан-1-карбоновая кислота Способ А. Стадия 1: (1R,4S)-(-)-2-N-Boc-азабицикло[2,2,1]гепт-5-ен-3-он. Указанное промежуточное соединение получают из (1R,4S)-(-)-2-азабицикло[2,2,1]гепт-5-ен-3-она(13,90 г, 137,3 ммоль) и диметиламинопиридина (DMAP) (1,1 г, 9,00 ммоль) в ТГФ (50 мл), как описано для промежуточного соединения 1, стадия 1, чтобы получить 19,1 г продукта в виде белого твердого вещества. ИК и 1 Н ЯМР спектры идентичны спектрам рацемического промежуточного соединения. Стадия 2: (4S,1R)-(-)-2-N-Boc-азабицикло[2,2,1]гептан-3-он. Промежуточное соединение стадии 1 (9,0 г, 43,01 ммоль) гидрируют с использованием Pd/C (1,0 г),как описано для промежуточного соединения 2, стадия 1 (способ Б), чтобы получить 9,0 г продукта в виде белого твердого вещества. ИК и 1 Н ЯМР спектры продукта идентичны спектрам рацемического промежуточного соединения. Стадия 3: (3S,1R)-(-)-3-N-Boc-аминоциклопентан-1-карбоновая кислота. Гидролитическое расщепление промежуточного соединения стадии 2 (8,0 г, 37,8 ммоль), как описано для промежуточного соединения 2, стадия 2 (способ Б) дает 6,5 г желаемого продукта в виде белого твердого вещества. ИК и 1 Н ЯМР спектры идентичны спектрам рацемического промежуточного соединения. []D48,3(c=1,0, МеОН). Способ Б. Стадия 1: (1S,4R)-(-)-4-N-Boc-аминоциклопент-2-ен-1-карбоновая кислота. Указанное промежуточное соединение получают путем оптического разделения промежуточного соединения 1 с использованием (R)-(+)-1-фенилэтиламина в смеси изопропанола и этанола; []D-48,0(с=1,0, МеОН). Стадия 2: (3S,1R)-(-)-3-N-Boc-аминоциклопентан-1-карбоновая кислота. Промежуточное соединение стадии 1 (8,0 г, 35,2 ммоль) в этилацетате (100 мл) восстанавливают 5%Pd/C (1,0 г), как описано для промежуточного соединения 2, способ А, чтобы получить 8,01 г продукта в виде белого твердого вещества, которое идентично во всех отношениях продукту, полученному в способе А. Промежуточное соединение 13. (3S,1R)-(-)-3-N-Boc-аминоциклопентилметанол Способ А. Восстановительное расщепление (1R,4S)-(-)-2-N-Boc-азабицикло[2,2,1]гептан-3-она (10 г, 47,33 ммоль) с использованием борогидрида натрия (3,58 г, 94,6 ммоль) в 10% водном растворе ТГФ (100 мл),как описано для промежуточного соединения 3, способ А, дает 8,5 г продукта в виде белого твердого вещества, которое идентично во всех отношениях его рацемату; []D-8,7 (с=1,0, МеОН). Способ Б. Восстановление (3S,1R)-(-)-3-N-Boc-аминоциклопентан-1-карбоновой кислоты (8,5 г, 37,07 ммоль),как описано при получении промежуточного соединения 3, способ Б, дает 7,0 г спирта в виде белого твердого вещества, которое идентично во всех отношениях продукту, полученному в способе А. Промежуточное соединение 14. (3S,1R)-(-)-3-N-Boc-аминоциклопентилметилметансульфонат Взаимодействие промежуточного соединения 13 (6,5 г, 30,2 ммоль) с метансульфохлоридом (3,8 г,33,18 ммоль) в присутствии триэтиламина (3,97 г, 39,2 ммоль) в сухом дихлорметане (100 мл) в атмосфере азота, как описано для промежуточного соединения 4, дает 8,5 г (96,5%) продукта в виде белого твердого вещества; []D-15,5 (с=1,0, МеОН). Промежуточное соединение 15. (3S,1R)-(-)-3-N-Boc-аминоциклопентилметиламин Стадия 1: (3S,1R)-3-N-Boc-аминоциклопентилметилазид. Взаимодействие промежуточного соединения 14 (8,0 г, 27,3 ммоль) с азидом натрия (3,5 г,54,4 ммоль) в ДМФА (150 мл), как описано для промежуточного соединения 10, стадия 1, дает 6,5 г(100%) азида в виде масла. ИК и 1 Н ЯМР спектры продукта идентичны спектрам продукта из промежуточного соединения 10,стадия 1. Стадия 2: (3S,1R)-3-N-Boc-аминоциклопентилметиламин. Азид (6,0 г, 25,0 ммоль) из стадии 1 в метаноле (150 мл) восстанавливают 5% Pd/C (300 мг), как описано для промежуточного соединения 10, стадия 2, чтобы получить 5,35 г (100%) амина в виде полутвердого вещества, которое используют как есть в реакции сочетания. Промежуточное соединение 16. (1R,3R)-3-N-Boc-аминоциклопентилметилметансульфонат Стадия 1: (1S,3R)-метил-3-N-Boc-аминоциклопентан-1-карбоксилат. Указанное промежуточное соединение получают путем гидролитического расщепления (1S,4R)-(2 азабицикло[2,2,1]гептан-3-она с последующей этерификацией и защитой аминогруппы, как описано вTetrahedron Lett. 1997, 38, 5371-5374. ИК (KBr) 3375, 2976, 2875, 1713, 1519, 1366, 1249, 1201, 1171 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,44 (с, 9 Н), 1,58-1,79 (м, 2 Н), 1,87-2,01 (м, 2 Н), 2,10-2,28 (м, 1 Н), 2,782,95 (м, 1 Н), 3,69 (с, 3 Н), 4,08 (уш. с, 1 Н), 4,95 (уш.с., 1 Н). Стадия 2: (1R,3R)-метил-3-N-Boc-аминоциклопентил-1-карбоксилат. К раствору промежуточного соединения стадии 1 (20 г, 82,20 ммоль) в сухом метаноле (200 мл) добавляют метилат натрия (6,65 г, 123,30 ммоль) и перемешивают смесь при 50 С в течение 6 ч, чтобы получит равновесную смесь цис- и транс-сложных эфиров. Более полярный транс-сложный эфир отделяют от цис-изомера путем осторожной колоночной хроматографии на силикагеле с использованием 5%EtOAc в петролейном эфире в качестве элюента. Стадия 3: (1R,3R)-3-N-Boc-аминоциклопентилметанол. К охлажденному (0 С) раствору промежуточного соединения стадии 2 (8,0 г, 34,89 ммоль) в сухом ТГФ (100 мл) добавляют при перемешивании борогидрид лития (2,64 г, 69,8 ммоль) по частям в течение 30 мин. Далее перемешивают смесь при комнатной температуре в течение 12 ч. Избыток борогидрида лития нейтрализуют 1N HCl при 0 С. Смесь экстрагируют дихлорметаном (2100 мл), объединенные экстракты промывают водой (200 мл), раствором соли (100 мл) и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении, чтобы получить 4,3 г продукта в виде белого твердого вещества. ИК (KBr) 3338, 2973, 1688, 1526, 1391, 1366, 1300, 1250, 1171, 1047 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,27-1,47 (м, 2 Н), 1,44 (с, 9 Н), 1,51-1,65 (м, 1 Н), 1,67-1,91 (м,2 Н), 2,002,05 (м, 1 Н), 2,18-2,30 (м, 1 Н), 3,51 (д, J=7,2 Гц, 2 Н), 3,98 (уш. с, 1 Н), 4,58 (уш. с, 1 Н). Стадия 4: (1R,3R)-3-N-Boc-аминоциклопентилметилметансульфонат. Взаимодействие промежуточного соединения стадии 3 (4,0 г, 18,57 ммоль) с метансульфохлоридом(2,34 г, 20,4 ммоль) в присутствии триэтиламина (2,44 г, 24,1 ммоль) в сухом дихлорметане (80 мл), как описано для промежуточного соединения 4, дает 5,2 г продукта в виде белого твердого вещества. ИК (KBr) 3342, 1977, 1681, 1532, 1359, 1346, 1248, 1170, 1103, 976, 950 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,32-1,51 (м, 2 Н), 1,44 (с, 9 Н), 1,68-1,75 (м, 2 Н), 1,91-1,96 (м, 1 Н), 2,042,08 (м, 1 Н), 2,47 (квинт, J=7,5 Гц, 1 Н), 3,01 (с, 3H), 4,00 (уш. с, 1 Н), 4,10 (д, J=6,6 Гц, 2 Н), 4,50 (уш. с,1 Н). Промежуточное соединение 17. (2S)-1-(2-хлорацетил)-2-пирролидинкарбонитрил Указанное соединение получают из L-(-)-пролина с использованием описанной в литературе методики (J. Med. Chem., 2003, 46, 2774-2789). Промежуточное соединение 18. (2S,4S)-1-(2-хлорацетил)-4-фторпирролидин-2-карбонитрил Стадия 1: (2S,4S)-N-Boc-4-фторпирролидин-2-карбоксамид. Указанное промежуточное соединение получают за 5 стадий из L-(-)-4-гидроксипролина с использованием описанной в литературе методики (WO 03/002553 А 2) Стадия 2: (2S,4S)-N-Boc-4-фторпирролидин-2-карбонитрил.- 22013463 К охлажденному (0 С) раствору промежуточного соединения стадии 1 (10 г, 43,10 ммоль) в сухом ТГФ (50 мл) добавляют при перемешивании триэтиламин (13,93 г, 138 ммоль) и трифторуксусный ангидрид (14,5 г, 69,05 ммоль). Полученный прозрачный раствор перемешивают при той же температуре в течение 1 ч. Реакцию останавливают водой (100 мл) и экстрагируют хлороформом (2100 мл). Объединенные органические экстракты промывают водой (2100 мл), раствором соли (50 мл) и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении, чтобы получить 9,0 г (97,6%) продукта в виде кремового твердого вещества. ИК (KBr) 2979, 2243, 1387, 1240, 1168, 1123, 1072, 960 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,49-1,53 (д, ротамер, 9 Н), 2,25-2,47 (м, 1 Н), 2,64 (т, J=14,7 Гц, 1 Н), 3,52(дд, J=9,6, 3,6 Гц, 0,5 Н, ротамер), 3,64 (дд, J=9,3, 3,3 Гц, 0,5 Н, ротамер), 3,73-3,94 (м, 1 Н), 4,64 (д, J=8,7 Гц, 0,6 Н, ротамер), 4,76 (д, J=8,7 Гц, 0,4 Н, ротамер), 5,31 (уш. с, J=51,3 Гц, 1 Н). Стадия 3: (2S,4S)-4-фторпирролидин-2-карбонитрил п-метилбензолсульфонат. Моногидрат 4-метил-бензолсульфокислоты (15,2 г, 79,91 ммоль) добавляют к раствору промежуточного соединения стадии 2 (8,5 г, 39,72 ммоль) в ацетонитриле (170 мл) и перемешивают смесь при комнатной температуре в течение 48 ч. Затем растворитель выпаривают при пониженном давлении, чтобы получить коричневый остаток, который помещают в сухой диэтиловый эфир (200 мл) и перемешивают в течение 1 ч. Выделившийся белый кристаллический продукт собирают путем фильтрации и высушивают в вакууме, чтобы получить 10,5 г (87%) продукта в виде бледно-розового твердого вещества. ИК (KBr) 3304, 2927, 2249, 1393, 1167, 1123, 1034, 1010 см-1. 1 Н ЯМР (CDCl3, 300 МГц)2,31 (с, 3H), 2,37-2,65 (м, 2 Н), 3,76-3,87 (м, 2 Н), 5,10 (уш. с, 2 Н), 5,33(уш. с, J=51,6 Гц, 1 Н), 7,19 (д, J=8,1 Гц, 2 Н), 7,75 (д, J=8,1 Гц, 2 Н). Стадия 4: (2S,4S)-1-(2-хлорацетил)-4-фторпирролидин-2-карбонитрил. Раствор промежуточного соединения стадии 3 (10 г, 32,89 ммоль) и триэтиламина (4,32 г,42,77 ммоль) в дихлорметане (200 мл) добавляют по каплям при перемешивании к охлажденному (0 С) раствору хлорацетилхлорида (4,81 г, 32,95 ммоль) в дихлорметане (50 мл) в течение 10 мин. Смесь перемешивают при той же температуре в течение 2 ч и разбавляют, не прекращая перемешивания, дихлорметаном (100 мл) и водой (100 мл). Слои разделяют. Органический слой промывают водой (250 мл), раствором соли (50 мл) и высушивают (Na2SO4). Полученный после выпаривания растворителя остаток растирают с диэтиловым эфиром, чтобы получить 5,89 г (94%) продукта в виде кремового твердого вещества. ИК (KBr) 2924, 2241, 1678, 1407, 1281, 1225, 1076, 1051, 958 см-1. 1 Н ЯМР (CDCl3, 300 МГц)2,26-2,48 (м, 1 Н), 2,66-2,80 (м, 1 Н), 4,06 (с, 2 Н), 3,81-4,29 (м, 2 Н), 4,95 Стадия 1: (4S)-1,3-тиазолан-4-карбоновая кислота. Указанное промежуточное соединение получают из L-цистеина гидрохлорида при помощи описанной в литературе методики (J. Am. Chem. Soc., 1937, 59, 200-206). Стадия 2: (4S)-N-Boc-1,3-тиазолан-4-карбоновая кислота. Раствор ди-трет-бутилдикарбоната (21,3 г, 0,977 моль) в ацетонитриле (20 мл) добавляют при перемешивании к раствору промежуточного соединения стадии 1 (10,0 г, 0,075 моль) и триэтиламина(18,98 г, 0,188 моль) в 50% водном ацетонитриле (100 мл) и перемешивают раствор при комнатной температуре в течение 18 ч. Ацетонитрил выпаривают при пониженном давлении и подкисляют оставшийся водный раствор 1N HCl до рН 3-4. Раствор экстрагируют дихлорметаном (2100 мл), объединенные органические экстракты промывают водой (2100 мл), раствором соли (100 мл) и высушивают (Na2SO4). Остаток, полученный после выпаривания растворителя, растирают с н-пентаном, чтобы получить 17,5 г продукта в виде белого твердого вещества. ИК (KBr) 1746, 1634, 1417, 1367, 1309, 1216, 1119, 1142, 894 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,48 (с, 9 Н), 3,24-3,33 (м, 2 Н), 4,42-4,84 (м, 3H), 5,26 (уш. с, 1 Н). Стадия 3: (4S)-N-Boc-1,3-тиазолан-4-карбоксамид. К охлажденному (-15 С) раствору промежуточного соединения стадии 2 (10 г, 42,918 ммоль) и триэтиламина (7,15 г, 70,79 ммоль) в сухом тетрагидрофуране (100 мл) добавляют при перемешивании этилхлорформиат (7,68 г, 70,79 ммоль) в атмосфере азота, чтобы получить белый осадок. Перемешивают смесь при той же температуре в течение 30 мин и добавляют 30% водный раствор NH4OH (100 мл) по каплям в течение 20 мин. Оставляют реакционную смесь постепенно согреться до комнатной температуры и продолжают перемешивание еще в течение 18 ч. Затем смесь экстрагируют дихлорметаном(2100 мл), объединенные органические экстракты промывают водой (100 мл), раствором соли (100 мл)- 23013463 и высушивают (Na2SO4). Остаток, полученный после выпаривания растворителя, растирают с н-пентаном(50 мл), чтобы получить 7,1 г (71%) продукта в виде белого твердого вещества. ИК (KBr) 3406, 1666, 1405, 1365, 1163, 1109 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,49 (с, 9 Н), 3,20-3,51 (м, 2 Н), 4,51-4,54 (м, 2 Н), 5,61 (м, 1 Н), 6,50 (уш. с, 2 Н). Стадия 4: (4S)-N-Boc-1,3-тиазолан-4-карбонитрил. К охлажденному (0 С) раствору промежуточного соединения стадии 3 (7,0 г, 30,04 ммоль) и триэтиламина (9,2 г, 91,09 ммоль) в сухом тетрагидрофуране (35 мл) добавляют при перемешивании трифторуксусный ангидрид (9,46 г, 45,05 ммоль) и перемешивают смесь при той же температуре в течение 1 ч. Реакционную смесь разбавляют водой (50 мл) и экстрагируют хлороформом (250 мл). Объединенные органические экстракты промывают водой (2100 мл), раствором соли (50 мл) и высушивают(Na2SO4). Растворитель выпаривают при пониженном давлении, чтобы получить 5,98 г (92,6%) продукта в виде белого твердого вещества. ИК (KBr) 2988, 2243, 1693, 1368, 1271, 1166, 1142, 1113, 970 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,51 (с, 9 Н), 3,28 (м, 2 Н), 4,46 (м, 1 Н), 4,57 (д, J=9,0 Гц, 1 Н), 4,87 (м,0,5 Н), 5,11 (м, 0,5 Н). Стадия 5: (4S)-1,3-тиазолан-4-карбонитрила п-метилбензолсульфонат. Моногидрат 4-метилбензолсульфокислоты (7,73 г, 40,68 ммоль) добавляют при перемешивании к раствору промежуточного соединения стадии 4 (5,8 г, 27,10 ммоль) в сухом ацетонитриле (50 мл) и перемешивают смесь при комнатной температуре в течение 24 ч в атмосфере азота. Растворитель выпаривают при пониженном давлении и полученный маслянистый остаток растирают с сухим диэтиловым эфиром (100 мл), чтобы получить 7,21 г (93%) продукта в виде кристаллического белого твердого вещества. ИК (KBr) 2988, 2243, 1693, 1368, 1271, 1166, 1142, 1113, 970 см-1. 1 Н ЯМР (CDCl3, 300 МГц)2,37 (с, 3H), 3,33 (дд, J=9,0, 3,3 Гц, 1 Н), 3,46 (дд, J=12,3, 3,3 Гц, 1 Н),4,51 (с, 2 Н), 5,27-5,30 (м, 1 Н), 6,15 (уш. с, 2 Н), 7,20 (д, J=8,1 Гц, 2 Н), 7,76 (д, J=8,1 Гц, 2 Н). Стадия 6: (4S)-3-(2-хлорацетил)-1,3-тиазолан-4-карбонитрил. Смесь промежуточного соединения стадии 5 (7,0 г, 23,03 ммоль) и триэтиламина (3,02 г,29,90 ммоль) в сухом дихлорметане (25 мл) добавляют по каплям при перемешивании (10 мин) к охлажденному (0 С) раствору хлорацетилхлорида (2,58 г, 23,03 ммоль) в сухом дихлорметане (25 мл) в течение 20 мин. Полученную смесь перемешивают при 0 С в течение 2 ч и разбавляют водой (100 мл). Отделяют органический слой, промывают водой (250 мл), раствором соли (50 мл) и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении и растирают полученный остаток с сухим диэтиловым эфиром (30 мл), чтобы получит 4,01 г (91%) продукта в виде белого твердого вещества. ИК (KBr) 2953, 2246, 1667, 1393, 1284, 1262, 1182, 985 см-1. 1 Н ЯМР (CDCl3, 300 МГц)3,32 (д, J=4,2 Гц, 2 Н), 4,13 (с, 2 Н), 4,67 (д, J=8,4 Гц, 1 Н), 4,73 (д, J=9,0 Гц, 1 Н), 5,27 (дд, J=3,6, 1,5 Гц, 1 Н). Промежуточное соединение 20. 2-Хлор-1-[(3S)-3-фторпирролидин-1-ил]-1-этанон Стадия 1: (3R)-N-Boc-3-гидроксипирролидин. Раствор ди-трет-бутилдикарбоната (7,5 г, 34,40 ммоль) в ТГФ (50 мл) добавляют при перемешивании (10 мин) к раствору (R)-(+)-3-пирролидинола (2,5 г, 28,70 ммоль) и триэтиламина (6,0 г, 57,40 ммоль) в ТГФ (60 мл) при комнатной температуре. Реакционную смесь перемешивают еще в течение 18 ч при комнатной температуре. Растворитель выпаривают при пониженном давлении и полученный остаток разбавляют EtOAc (200 мл) и промывают водой (2100 мл) и раствором соли (100 мл). Экстракт EtOAc высушивают (Na2SO4) и выпаривают при пониженном давлении, чтобы получить 4,0 г продукта в виде белого твердого вещества. ИК (чистое вещество) 3422, 2977, 1676, 1420, 1167 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,46 (с, 9 Н), 1,93-2,08 (м, 2 Н), 3,34-3,49 (м, 4 Н), 4,43-4,48 (м, 1 Н). Стадия 2: (3S)-N-Boc-3-фторпирролидин. К охлажденному (-30 С) раствору промежуточного соединения стадии 1 (1,5 г, 8,01 ммоль) в дихлорэтане (50 мл) добавляют при активном перемешивании диэтиламиносератрифторид (1,94 мг,12,01 ммоль) в атмосфере азота и выдерживают реакционную смесь при этой температуре в течение 1 ч. Оставляют реакционную смесь постепенно согреться до комнатной температуры и продолжают перемешивание еще в течение 14 ч. Реакционную смесь выливают в смесь льда и твердого NaHCO3 и перемешивают, пока не прекратится выделение газа. Смесь разбавляют водой и экстрагируют дихлорметаном (3100 мл). Объединенные органические экстракты промывают водой, раствором соли и высушивают (Na2SO4). Растворитель- 24013463 выпаривают при пониженном давлении и полученный остаток очищают при помощи колоночной хроматографии на силикагеле (25% этилацетат в петролейном эфире), чтобы получить 840 мг желаемого соединения в виде желтого масла. ИК (чистое вещество) 3500, 2978, 1698, 1407 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,44 (с, 9 Н), 1,89-2,28 (м, 2 Н), 3,44-3,77 (м, 4 Н), 5,11-5,31 (м, 1 Н). Стадия 3: (3S)-3-фторпирролидина 4-метилбензолсульфонат. Моногидрат 4-метилбензолсульфокислоты (752 мг, 3,95 ммоль) добавляют при перемешивании к раствору промежуточного соединения стадии 2 (280 мг, 1,48 ммоль) в сухом ацетонитриле (20 мл) и перемешивают реакционную смесь при комнатной температуре в течение 24 ч в атмосфере азота. Растворитель выпаривают при пониженном давлении и полученный маслянистый остаток растирают с сухим диэтиловым эфиром (10 мл), чтобы получить 563 мг продукта в виде белого твердого кристаллического вещества, которое используют как есть на следующей стадии. ИК (чистое вещество) 3443, 3019, 2783, 1626, 1434, 1215, 1034 см-1. Стадия 4: смесь промежуточного соединения стадии 3 (563 мг, 1,48 ммоль) и триэтиламина (196 мг,1,93 ммоль) в сухом дихлорметане (20 мл) добавляют по каплям при перемешивании (10 мин) к охлажденному (0 С) раствору хлорацетилхлорида (186 мг, 1,63 ммоль) в сухом дихлорметане (5 мл) в течение 20 мин. Полученную смесь перемешивают при 0 С в течение 2 ч и разбавляют водой (50 мл). Органический слой отделяют, промывают водой (250 мл), раствором соли и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении, чтобы получить 124 мг желаемого соединения в виде кремового твердого вещества. 1 Н ЯМР (CDCl3, 300 МГц)1,35 (уш. с, 2 Н), 1,20-2,41 (м,2 Н), 3,52-4,11 (м, 4 Н), 5,19-5,43 (м, 1 Н). Пример 1. Стадия 1: (1SR,3RS)-3-N-Boc-аминоциклопентан-1-карбоксамид. Этилхлорформиат (1,06 г, 9,825 ммоль) добавляют при перемешивании к раствору промежуточного соединения 2 (1,5 г, 6,550 ммоль) и триэтиламина (0,99 г, 9,825 ммоль) в сухом ТГФ (15 мл) при 0 С в течение 5 мин в атмосфере азота. Реакционную смесь перемешивают еще в течение 30 мин при той же температуре и добавляют 25% водный раствор гидроксида аммония (15 мл) в течение 5 мин. Затем смесь перемешивают при комнатной температуре в течение 18 ч. Смесь разбавляют водой (50 мл) и экстрагируют этилацетатом (330 мл). Объединенные органические экстракты промывают 1N NaOH (50 мл), водой (100 мл) и раствором соли (50 мл). Органический экстракт высушивают (Na2SO4) и концентрируют в вакууме, чтобы получить 1,49 г продукта в виде белого твердого вещества. ИК (KBr) 3376, 3316, 1661, 1533, 1308 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,43 (с, 9 Н), 1,68-1,98 (м, 5 Н), 2,08-2,18 (м, 1 Н), 2,69-2,74 (м, 1 Н) 4,08(уш. с, 1 Н), 5,45 (уш. с, 3H). Стадия 2: (1SR,3RS)-3-аминоциклопентан-1-карбоксамида трифторацетат. Трифторуксусную кислоту (3 мл) добавляют к раствору промежуточного соединения стадии 1 (400 мг, 1,754 ммоль) в сухом дихлорметане (3,0 мл) при 10 С и перемешивают реакционную смесь при той же температуре в течение 30 мин в атмосфере азота. Смесь выпаривают при пониженном давлении, чтобы получить соль амина и ТФУК, которую используют на следующей стадии как есть. Стадия 3: раствор промежуточного соединения 17 (157 мг, 0,876 ммоль) в ТГФ (10 мл) добавляют при перемешивании к суспензии промежуточного соединения стадии 2 (424 мг, 1,754 ммоль), карбоната натрия (967 мг, 7,008 ммоль) и NaI (131 мг, 0,876 ммоль) в ТГФ (15 мл) при 10 С в течение 2 ч. Далее перемешивают при комнатной температуре в течение 2 ч в атмосфере азота. Смесь отфильтровывают и концентрируют при пониженном давлении. Полученный остаток очищают при помощи колоночной хроматографии на силикагеле с использованием 2% метанола в хлороформе, чтобы получить 90 мг продукта в виде полутвердого вещества. ИК (чистое вещество) 3314, 3196, 2240, 1656, 1419 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,71-2,34 (м, 11 Н), 2,77 (уш. с, 1 Н), 3,25-3,64 (м, 5 Н), 4,74-4,78 (м, 1 Н),5,24 (уш. с, 1 Н), 7,54 (уш. с, 1 Н). Пример 2. (2S)-1-2-[(3SR,1RS)-3-цианоциклопентиламино]ацетил-2-пирролидинкарбонитрил Стадия 1: (1SR,3RS)-3-N-Boc-аминоциклопентан-1-карбонитрил. Трифторуксусный ангидрид (1,18 г, 5,613 ммоль) добавляют к раствору промежуточного соединения стадии 1 из примера 1 (800 мг, 3,507 ммоль) и триэтиламина (1,7 г, 16,84 ммоль) в сухом ТГФ (20 мл) при 10 С в атмосфере азота. Реакционную смесь перемешивают в течение 1 ч и разбавляют ледяной во- 25013463 дой (40 мл). Продукт экстрагируют дихлорметаном (100 мл), промывают водой (100 мл), раствором соли(50 мл) и высушивают (Na2SO4). Выпаривание растворителя при пониженном давлении дает 920 мг продукта в виде полутвердого вещества. ИК (чистое вещество) 3361, 2982, 2239, 1680, 1628, 1165 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,44 (с, 9 Н), 1,59-1,81 (м, 3H), 2,00-2,10 (м, 2 Н), 2,39-2,49 (м, 1 Н), 2,792,85 (м, 1 Н), 4,03 (уш. с, 1 Н), 4,60 (уш. с, 1 Н). Стадия 2: (1SR,3RS)-3-аминоциклопентан-1-карбонитрила трифторацетат. Снятие защиты с промежуточного соединения стадии 1 (620 мг, 2,95 ммоль), как описано в примере 1, стадия 2, дает 660 мг амина в виде соли ТФУК, которую используют на следующей стадии как есть. Стадия 3: реакция сочетания промежуточного соединения стадии 2 (660 мг, 2,946 ммоль) и промежуточного соединения 17 (254 мг, 1,437 ммоль) с использованием K2CO3 (1,62 г, 11,782 ммоль) и NaI Стадия 1: (1SR,3RS)-3-N-Boc-аминоциклопентилцианид. К раствору промежуточного соединения 4 (1,5 г, 6,55 ммоль) в ДМФА (15 мл) добавляют NaCN(321 мг, 6,55 ммоль) и нагревают смесь при 80 С в течение 18 ч. Смесь охлаждают и разбавляют водой(100 мл). Смесь экстрагируют этилацетатом (330 мл), промывают водой (100 мл), раствором соли (50 мл) и высушивают (Na2SO4). Остаток, полученный после выпаривания растворителя, растирают с петролейным эфиром, чтобы получить 1,01 г (80%) продукта в виде кремового твердого вещества. ИК (чистое вещество) 3368, 2973, 2247, 1691, 1521, 1365, 1249, 1171 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,11-1,25 (м, 1 Н), 1,44 (с, 9 Н), 1,46-1,59 (м, 2 Н), 1,86-2,05 (м, 2 Н), 2,182,41 (м, 2 Н), 2,41 (д, J=6,6 Гц, 2 Н), 3,98 (уш. с, 1 Н), 4,57 (уш. с, 1 Н). Стадия 2: (1SR,3RS)-3-аминоциклопентилметилцианид. К раствору промежуточного соединения стадии 1 (480 мг, 2,142 ммоль) в ацетонитриле (25 мл) добавляют моногидрат п-толуолсульфокислоты (815 мг, 4,285 ммоль) и перемешивают смесь при комнатной температуре в течение 6 ч в атмосфере азота. Растворитель выпаривают при пониженном давлении и полученный остаток растворяют в воде (50 мл). рН полученного водного раствора доводят до 9 при помощи избытка твердого K2CO3. Раствор экстрагируют дихлорметаном (430 мл) и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении, чтобы получить 265 мг (100%) амина в виде вязкой коричневой массы, которую используют на следующей стадии как есть. Стадия 3: реакция сочетания амина из стадии 2 и промежуточного соединения 17 (180 мг,1,043 ммоль) с использованием карбоната калия (289 мг, 2,094 ммоль) и NaI (157 мг, 1,46 ммоль) в ТГФ Стадия 1: (1S,3R)-3-N-Boc-аминоциклопентилметилцианид. Указанное соединение получают из промежуточного соединения 9 (1,5 г, 6,55 ммоль) и NaCN(321 мг, 6,55 ммоль) в ДМФА (15 мл), как описано в примере 3, стадия 1, чтобы получить 1,0 г (80%) продукта в виде белого твердого вещества. ИК (чистое вещество) 3379, 2976, 2243, 1681, 1518, 1303, 1170 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,11-1,22 (м, 1 Н), 1,44 (с, 9 Н), 1,48-1,59 (м, 2 Н), 1,90-2,05 (м, 2 Н), 2,202,41 (м, 2 Н), 2,43 (д, J=6,3 Гц, 2 Н), 3,98 (уш. с, 1 Н), 4,57 (уш. с, 1 Н). Стадия 2: (1S,3R)-3-аминоциклопентилметилцианида п-толуолсульфонат. Снятие защиты с промежуточного соединения стадии 1 (800 мг, 3,571 ммоль) с использованием ПТСКН 2 О (ПТСК=п-толуолсульфокислота) (1,36 г, 7,143 ммоль) в ацетонитриле (15 мл), как описано в примере 3, стадия 2, дает 442 мг продукта в виде полутвердого вещества, которое используют на следующей стадии как есть. Стадия 3: реакция сочетания промежуточного соединения стадии 2 (440 мг, 3,57 ммоль) и промежу- 26013463 точного соединения 17 (308 мг, 1,785 ммоль) в присутствии карбоната калия (493 мг, 3,571 ммоль) и NaI К охлажденному (0 С) раствору промежуточного соединения стадии 3, пример 4 (200 мг,0,80 ммоль) в EtOAc (3 мл) добавляют при активном перемешивании насыщенный раствор сухого газообразного HCl в EtOAc (3 мл). Полученный раствор перемешивают при комнатной температуре в течение 30 мин, в результате чего выпадает белый осадок. Продукт собирают путем фильтрования и высушивают в вакууме, чтобы получить 228 мг продукта в виде белого твердого вещества. 1 Н ЯМР (D2O, 300 МГц)1,12-1,59 (м, 2 Н), 1,75-2,01 (м, 3H), 2,11-2,45 (м, 7 Н), 2,58-2,60 (м, 2 Н),3,40-3,49 (м, 1 Н), 3,56-3,72 (м, 2 Н), 3,96-4,09 (м, 2 Н), 4,65-4,95 (м, 1 Н). Пример 6. (2S)-1-2-[(3R,1S)-3-цианометилциклопентиламино]ацетил-2-пирролидинкарбонитрил Стадия 1: N1-Boc-(3R,1S)-аминоциклопентилметилцианид. Указанное промежуточное соединение синтезируют из промежуточного соединения 14 (1,5 г, 6,55 ммоль) и цианида натрия (321 мг, 6,55 ммоль) в ДМФА (15 мл), как описано в примере 3, стадия 1, чтобы получить 1,0 г продукта в виде белого твердого вещества. ИК (KBr) 3379, 2979, 2243, 1681, 1518, 1366, 1303, 1169 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,12-1,22 (м, 1 Н), 1,44 (с, 9 Н), 1,47-1,57 (м, 2 Н), 1,86-2,09 (м, 2 Н), 2,182,39 (м, 2 Н), 2,43 (д, J=6,9 Гц, 2 Н), 3,98 (уш. с, 1 Н), 4,56 (уш. с, 1 Н). Стадия 2: (1S,3R)-3-аминоциклопентилметилцианида трифторацетат. Снятие защиты с промежуточного соединения стадии 1 (600 мг, 2,64 ммоль) с использованием ТФУК (3 мл) в сухом дихлорметане (3 мл), как описано в примере 1, стадия 2, дает 637 мг (100%) амина в виде соли ТФУК, который используют как есть на следующей стадии. Стадия 3: реакция сочетания промежуточного соединения стадии 2 (637 мг, 2,64 ммоль) и промежуточного соединения 17 (231 мг, 1,33 ммоль) в присутствии карбоната калия (1,47 г, 10,66 ммоль) и NaI Реакция сочетания промежуточного соединения стадии 2 из примера 4 (260 мг, 1,78 ммоль) и промежуточного соединения 18 (153 мг, 0,89 ммоль) в присутствии карбоната калия (244 мг, 1,78 ммоль) иNaI (133 мг, 0,89 ммоль) дает 60 мг продукта в виде кремового твердого вещества. ИК (чистое вещество) 3336, 2966, 2945, 2246, 1654, 1404, 1317, 1077 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,17-1,26 (м, 1 Н), 1,48-1,63 (м,2 Н), 1,88-1,95 (м, 2 Н), 2,11-2,31 (м, 3H),2,35-2,45 (м, 2 Н), 2,63-2,74 (м, 1 Н), 3,14-3,21 (м, 1 Н), 3,38 (с, 2 Н), 3,61-3,66 (м, 1 Н), 3,73-4,06 (м, 2 Н), 4,95 Реакция сочетания промежуточного соединения стадии 2, пример 6 (637 мг, 2,64 ммоль) и проме- 27013463 жуточного соединения 18 (255 мг, 1,34 ммоль) в присутствии карбоната калия (1,47 г, 10,71 ммоль) и NaI Стадия 1: 2-диазо-1-[(1S,3R)-3-N-Boc-аминоциклопентил]-1-этанон. Изобутилхлорформиат (1,21 г, 8,90 ммоль) добавляют при активном перемешивании к раствору промежуточного соединения 7 (2,09 г, 8,72 ммоль) и триэтиламина (890 мг, 8,72 ммоль) в сухом эфире(15 мл) при -20 С в течение 5 мин в атмосфере азота. Реакционную смесь перемешивают еще в течение 30 мин при той же температуре, а затем фильтруют, чтобы удалить выпавший в осадок гидрохлорид триэтиламина. К фильтрату, содержащему смешанный ангидрид, медленно добавляют раствор диазометана в диэтиловом эфире до появления желтой окраски (около 20 мл). Оставляют реакционную смесь постепенно согреться до комнатной температуры и оставляют при этой температуре на ночь. Избыток диазометана нейтрализуют несколькими каплями ледяной уксусной кислоты, а затем 10% раствором лимонной кислоты. Отделяют органический слой и экстрагируют водный слой эфиром (2100 мл). Объединенные органические экстракты промывают насыщенным раствором NaHCO3, раствором соли и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении и полученный остаток очищают при помощи колоночной хроматографии на силикагеле (30% этилацетат в петролейном эфире), чтобы получить 1,12 г желаемого соединения в виде бледно-желтого твердого вещества. ИК (KBr) 3355, 3079, 2136, 1685, 1614, 1530 см-1. 1 Н ЯМР (CDCl3) 1,44 (с, 9H), 1,60-1,93 (м, 5 Н), 2,04-2,14 (м, 1 Н), 2,82 (уш. с, 1 Н), 4,06 (уш. с, 1 Н),5,28 (уш. с, 1 Н). Стадия 2: 2-[(1S,3R)-3-N-Boc-аминоциклопентил]уксусная кислота. К охлажденному (-25 С) раствору промежуточного соединения стадии 1 (1,0 г, 3,95 ммоль) в 10% водном ТГФ (20 мл) добавляют при активном перемешивании раствор бензоата серебра (90 мг, 0,40 ммоль) в триэтиламине (1,19 мг, 11,84 ммоль) в атмосфере азота и не допуская попадания света. Реакционную смесь оставляют согреться до комнатной температуры в течение 3 ч. Удаляют растворитель при пониженном давлении и оставшийся водный раствор отфильтровывают. Фильтрат экстрагируют этилацетатом; слой этилацетата промывают насыщенным раствором NaHCO3, насыщенным растворомNH4Cl, раствором соли и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении,чтобы получить 670 мг соединения в виде белого твердого вещества. ИК (KBr) 3373, 2974, 1686, 1530, 1182 см-1. 1 Н ЯМР (DMSO-d6) 0,95-1,02 (м, 1 Н), 1,20-1,30 (м, 1 Н), 1,37 (с, 9 Н), 1,66-1,78 (м, 2 Н), 1,98-2,25 (м,4 Н), 3,71-3,76 (м, 1 Н), 6,85 (д, J=7,5 Гц, 1 Н), 12,01 (с, 1 Н). Стадия 3: 2-[(1S,3R)-3-N-Boc-аминоциклопентил]-1-этанол. Указанное соединение синтезируют из промежуточного соединения стадии 2 (1,0 г, 4,11 ммоль) с использованием триэтиламина (625 мг, 6,17 ммоль), этилхлорформиата (670 мг, 6,17 ммоль) и NaBH4(467 мг, 12,34 ммоль), как описано для промежуточного соединения 3, способ Б, чтобы получить 845 мг желаемого соединения в виде белого твердого вещества. ИК (чистое вещество) 3434, 2977, 2072, 1634, 771 см-1. 1 Н ЯМР (CDCl3, 300 МГц)0,89-1,02 (м, 1 Н), 1,23-1,42 (м, 3H), 1,44 (с, 9 Н), 1,49-1,67 (м, 2 Н), 1,771,90 (м, 1 Н), 1,93-1,98 (м, 2 Н), 2,00-2,28 (м, 1 Н), 3,63-3,69 (м, 2 Н), 3,92 (уш. с, 1 Н), 4,50 (уш. с, 1 Н). Стадия 4: 2-[(1S,3R)-3-N-Boc-аминоциклопентил]этилметансульфонат. Указанное соединение синтезируют из промежуточного соединения стадии 3 (845 мг, 3,68 ммоль) с использованием триэтиламина (746 мг, 7,37 ммоль) и метансульфохлорида (549 мг, 4,79 ммоль), как описано для промежуточного соединения 4, чтобы получить 1,1 г желаемого соединения в виде белого твердого вещества. ИК (KBr) 3365, 2960, 2317, 1675, 1525, 1165 см-1. 1 Н ЯМР (CDCl3, 300 МГц)0,94-1,04 (м, 1 Н), 1,26-1,37 (м, 1 Н), 1,78-1,93 (м, 3H), 1,95-2,04 (м, 2 Н),2,25-2,33 (м, 1 Н), 3,00 (с, 3H), 3,93 (уш. с, 1 Н), 4,23 (т, J=13,2 Гц, 2 Н), 4,47 (уш. с, 1 Н). Стадия 5: 2-[(1R,3R)-3-N-Boc-аминоциклопентил]этилцианид. Указанное промежуточное соединение синтезируют из промежуточного соединения стадии 4(1,12 г, 3,64 ммоль) и цианида натрия (360 мг, 7,34 ммоль) в сухом ДМФА (30 мл), как описано в примере 3, стадия 1, чтобы получить 700 мг продукта в виде желтого твердого вещества. ИК (KBr) 3371, 2975, 2247, 1709, 1525, 1449, 1366, 1250, 1173,1083, 1015 см-1. 1 Н ЯМР (CDCl3, 300 МГц)0,94-1,02 (м, 1 Н), 1,22-1,39 (м, 4 Н), 1,44 (с, 9 Н), 1,65-1,75 (м, 2 Н), 1,832,05 (м, 3H), 2,25-2,37 (м, 3H), 3,93 (м, 1 Н), 4,48 (м, 1 Н). Стадия 6: 2-[(1R,3R)-3-аминоциклопентил]этилцианида трифторацетат. Снятие защиты с промежуточного соединения стадии 5 (500 мг, 2,11 ммоль) с использованием 50% раствора ТФУК в ДХМ (6 мл), как описано в примере 1, стадия 2, дает 289 мг свободного основания, которое используют на следующей стадии как есть. Стадия 7: реакция сочетания промежуточного соединения стадии 6 (289 мг, 2,11 ммоль) и промежуточного соединения 18 (200 мг, 1,04 ммоль) с использованием K2CO3 (290 мг, 2,11 ммоль) и NaI (157 мг,0,79 ммоль) в сухом ТГФ (20 мл), как описано в примере 1, стадия 3, дает 90 мг продукта в виде белого твердого вещества. ИК (KBr) 3434, 3332, 2958, 2925, 2853, 2244, 1652, 1419, 1368, 1330, 1297, 1230, 1190, 1153, 1082,1057 см-1. 1 Н ЯМР (CDCl3, 300 МГц)0,94-1,04 (м, 1 Н), 1,20-1,55 (м, 2 Н), 1,69-1,76 (м, 3H), 1,82-2,05 (м, 3H),2,11-2,29 (м, 1 Н), 2,35 (т, J=14,1 Гц, 2 Н), 2,64-2,75 (м, 1 Н), 3,11-3,13 (м, 1 Н), 3,31-3,44 (м, 2 Н), 3,50-4,02 Стадия 1: (2S)-1-[(1SR,3RS)-3-N-Boc-аминоциклопентилметил]пирролидин-2-карбоксамид. К раствору промежуточного соединения 4 (2,0 г, 6,826 ммоль) в изопропиловом спирте (50 мл) добавляют L-пролинамид (2,7 г, 23,6 ммоль) и кипятят смесь с обратным холодильником в течение 48 ч в атмосфере азота. Растворитель отгоняют в вакууме и полученный остаток помещают в этилацетат. Этилацетатный раствор промывают водой, раствором соли и высушивают (Na2SO4). Растворитель выпаривают при пониженном давлении, чтобы получить 2,1 г продукта в виде белого твердого вещества. ИК (KBr) 3371, 2968, 1685, 1634, 1522, 1365, 1175 см-1. 1 Н ЯМР (CDCl3, 300 МГц)0,94-1,01 (м, 1 Н), 1,30-1,50 (м, 2 Н), 1,44 (с, 9 Н), 1,74-2,32 (м, 9 Н), 2,452,52 (м, 2 Н), 2,95-3,02 (м, 1 Н), 3,15-3,20 (м, 1 Н), 3,93 (уш. с, 1 Н), 4,47 (уш. с, 1 Н), 5,31 (уш. с, 1 Н), 7,21(уш. с, 1 Н). Стадия 2: (2S)-1-[(1SR,3RS)-3-аминоциклопентилметил]пирролидин-2-карбоксамид. Снятие защиты с промежуточного соединения стадии 1 (875 мг, 2,81 ммоль) с использованием ПТСКН 2 О (1,1 г, 5,78 ммоль) в ацетонитриле (20 мл), как описано в примере 3, стадия 2, дает 600 мг амина, который используют как есть на следующей стадии. Стадия 3: реакция сочетания промежуточного соединения стадии 2 (600 мг, 2,84 ммоль) и промежуточного соединения 17 (245 мг, 1,42 ммоль) в ТГФ (20 мл) в присутствии карбоната калия (392 мг, 2,84 ммоль) и NaI (213 мг, 1,42 ммоль), как описано в примере 1, стадия 3, дает 160 мг продукта в виде полутвердого вещества. ИК (чистое вещество) 3430, 2946, 2231, 1664, 1412, 1311, 1192 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,02-1,09 (м, 1 Н), 1,36-1,50 (м, 2 Н), 1,70-1,92 (м, 6 Н), 2,04-2,34 (м, 8 Н),2,44-2,58 (м, 2 Н), 2,95-3,02 (м, 1 Н), 3,09-3,20 (м, 2 Н), 3,39-3,70 (м, 4 Н), 4,76-4,78 (м, 1 Н), 5,44 (уш. с, 1 Н),7,25 (уш. с, 1 Н). Пример 11. (2S)-1-(2-[(3SR,1RS)-3-(2S)-2-цианопирролидин-1-илкарбонил]циклопентиламиноацетил)пирролидин-2-карбонитрил Стадия 1: (2S)-1-[(1SR,3RS)-3-N-Boc-аминоциклопентилкарбонил]пирролидин-2-илцианид. Реакция сочетания промежуточного соединения 2 (1,0 г, 4,367 ммоль) и (2S)-цианопирролидиновой соли ПТСК (1,75 г, 6,55 ммоль) с использованием этилхлорформиата (706 мг, 6,505 ммоль) и триэтиламина (0,661 г, 6,55 ммоль) в сухом ТГФ (20 мл), как описано в примере 1, стадия 1, дает 1,34 г продукта в виде белого твердого вещества. ИК (чистое вещество) 3324, 2980, 1704, 1964, 1623, 1532, 1420, 1169 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,44 (с, 9 Н), 1,64-1,99 (м, 5 Н), 2,04-2,33 (м, 5 Н), 2,9-2,94 (м, 1 Н), 3,453,53 (м, 1 Н), 3,64-3,73 (м, 1 Н), 4,08-4,13 (м, 1 Н), 4,73-4,76 (м, 1 Н), 5,41-5,51 (м, 1 Н). Стадия 2:- 29013463 Снятие защиты с промежуточного соединения стадии 1 (690 мг, 2,247 ммоль) с использованием ПТСКН 2 О (640 мг, 3,371 ммоль) в ацетонитриле (20 мл), как описано в примере 3, стадия 2, дает 465 мг(100%) амина в виде соли ПТСК, который используется как есть на следующей стадии. Стадия 3: реакция сочетания промежуточного соединения 17 (192 мг, 1,11 ммоль) и промежуточного соединения стадии 2 (460 мг, 2,22 ммоль) в присутствии карбоната калия (306 мг, 2,22 ммоль) и NaI Стадия 1: N1-бензилокси-(3SR,1RS)-N3-Boc-3-аминоциклопентан-1-карбоксамид. Указанное соединение синтезируют из промежуточного соединения 2 (1,0 г, 4,37 ммоль) и Обензилгидроксиламина (806 мг, 6,55 ммоль) с использованием этилхлорформиата (710 мг, 6,55 ммоль) и триэтиламина (661 мг, 6,55 ммоль) в сухом ТГФ (20 мл), как описано в примере 1, стадия 1, чтобы получить 700 мг продукта в виде белого твердого вещества. ИК (KBr) 3305, 2974, 1675, 1651, 1539, 1176 см-1. 1 Н ЯМР 1,44 (с, 9 Н), 1,71-1,91 (м, 5 Н), 2,01-2,11 (м, 1 Н), 2,42-2,46 (м, 1 Н), 4,08 (уш. с, 1 Н), 4,92 (с,2 Н), 5,54 (уш. с, 1 Н), 7,35-7,45 (м, 5 Н), 8,09 (уш. с, 1 Н). Стадия 2: N1-бензилокси-(3SR,1RS)-3-аминоциклопентан-1 карбоксамида трифторацетат. Снятие защиты промежуточного соединения стадии 1 (700 мг, 2,10 ммоль) с использованием 50% ТФУК в ДХМ (6 мл), как описано в примере 1, стадия 2, дает 725 мг амина в виде соли ТФУК, который используют как есть на следующей стадии. Стадия 3: реакция сочетания промежуточного соединения стадии 2 (460 мг, 1,97 ммоль) и промежуточного соединения 17 (169 мг, 0,98 ммоль) в присутствии карбоната калия (271 мг, 1,97 ммоль) и NaI Стадия 1: N1-фенил-N3-[(1S,3R)-3-N-Boc-аминоциклопентилметил]мочевина. К охлажденному (0 С) раствору промежуточного соединения 10 (1,78 г, 8,32 ммоль) в сухом CHCl3(20 мл) добавляют при перемешивании фенилизоцианат (1,0 г, 8,32 ммоль). Реакционную смесь перемешивают в течение ночи при комнатной температуре. Растворитель удаляют при пониженном давлении и полученное таким образом серое твердое вещество растирают с диэтиловым эфиром, чтобы получить чистый продукт (2,4 г) в виде белого твердого вещества. ИК (KBr) 3380, 2966, 1682, 1564, 1518 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,02-1,05 (м, 1 Н), 1,37 (с, 9 Н), 1,59-1,63 (м, 1 Н), 1,74-1,76 (м, 1 Н) ,1,972,01 (м, 2 Н), 3,02-3,06 (м, 2 Н), 3,71 (уш. с, 1 Н), 6,14 (уш. с, 1 Н), 6,85-6,90 (т, J=7,5 Гц, 1 Н), 7,18-7,23 (м,2 Н), 7,35-7,38 (д, J=7,2 Гц, 2 Н), 8,36 (с, 1 Н). Стадия 2: N1-фенил-N3-[(1S,3R)-3-аминоциклопентилметил]мочевина. Указанное соединение получают из промежуточного соединения стадии 1 (1,2 г, 3,60 ммоль) с использованием 50% раствора трифторуксусной кислоты в ДХМ (8 мл), как описано в примере 1, стадия 2,чтобы получить 729 мг амина в виде соли ТФУК, который используют как есть на следующей стадии. Стадия 3: реакция сочетания промежуточного соединения 17 (222 мг, 1,29 ммоль) и промежуточного соединения стадии 2 (600 мг, 2,58 ммоль), как описано в примере 1, стадия 3, с использованием K2CO3(355 мг, 2,58 ммоль) и NaI (193 мг, 1,29 ммоль) дает 162 мг продукта в виде липкого белого твердого вещества. ИК (чистое вещество) 3316, 2951, 2241, 1649, 1550, 1439 см-1. 1 Н ЯМР (CDCl3, 300 МГц)1,26-1,41 (м, 2 Н), 1,49-1,69 (м, 3H), 1,71-2,35 (м, 4 Н), 2,47-2,50 (м, 1 Н),3,13-3,49 (м, 5 Н), 3,55-3,66 (м, 1 Н), 4,51-4,53 (м, 0,1 Н, ротамер), 4,76-4,78 (м, 0,9 Н, ротамер), 6,90-6,95 (м,1 Н), 7,20-7,27 (м, 2 Н), 7,52-7,59 (м, 2 Н).
МПК / Метки
МПК: C07C 309/66, C07C 271/24, C07D 401/12, C07D 207/32, C07D 207/34, C07D 207/16, A61K 31/4025, C07D 417/12, A61K 31/4015, C07D 403/12, C07C 237/24
Метки: ингибиторы, фармацевтические, применением, содержащие, лечения, дипептидилпептидазы, способ, получения, композиции, новые
Код ссылки
<a href="https://eas.patents.su/30-13463-novye-ingibitory-dipeptidilpeptidazy-iv-soderzhashhie-ih-farmacevticheskie-kompozicii-sposob-ih-polucheniya-i-sposob-lecheniya-s-ih-primeneniem.html" rel="bookmark" title="База патентов Евразийского Союза">Новые ингибиторы дипептидилпептидазы iv, содержащие их фармацевтические композиции, способ их получения и способ лечения с их применением</a>
Предыдущий патент: Применение агомелатина для приготовления лекарственных средств, предназначенных для лечения маниакально – депрессивных расстройств
Следующий патент: Кристаллические формы 4-метил-n-[3-(4-метилимидазол-1-ил)-5- трифторметилфенил]-3-(4-пиридин-3-илпиримидин-2-иламино)бензамида
Случайный патент: Система низкотемпературного контроля для подземных барьеров