Ингибиторы металлопротеаз, способ их получения и содержащие их фармацевтические композиции
Номер патента: 4254
Опубликовано: 26.02.2004
Авторы: Сабатини Массимо, Хикман Джон, Бенуа Ален, Пьерре Ален, Пастуро Филипп, Такер Гордон, Де-Нантёй Гийом
Формула / Реферат
1. Соединения формулы (I)
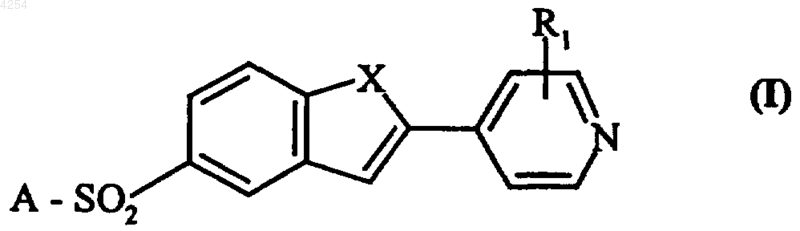
в которой R1 представляет собой атом водорода, атом галогена, линейную или разветвленную (C1-C6)алкильную группу, линейную или разветвленную (C1-C6)алкокси группу,
X представляет собой атом кислорода, атом серы или группу NR, в которой R представляет собой атом водорода, линейную или разветвленную (C1-C6)алкильную группу, A представляет собой любую из следующих групп:

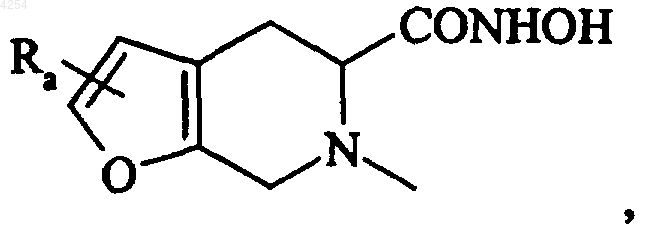
в которой Ra представляет собой атом водорода, атом галогена, линейную или разветвленную (C1-C6)алкильную группу, линейную или разветвленную (C1-C6)алкокси группу,
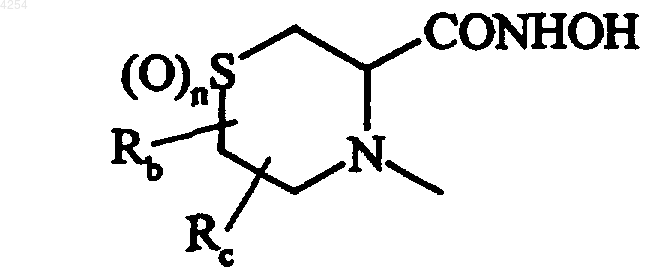
в которой Rb и Rc, которые могут быть идентичны или различны, представляют собой атом водорода, линейную или разветвленную (C1-C6)алкильную группу и n равняется 0,1 или 2,
или
их изомеры, N-оксиды, и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы (I) по п.1, отличающиеся тем, что A представляет собой группу
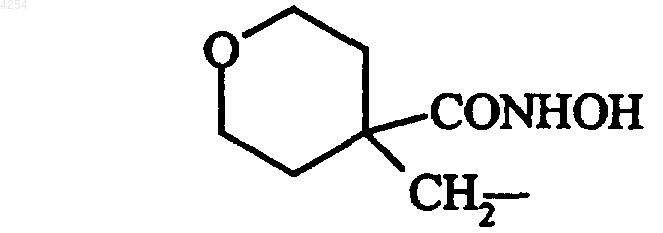
их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, отличающиеся тем, что A представляет собой группу
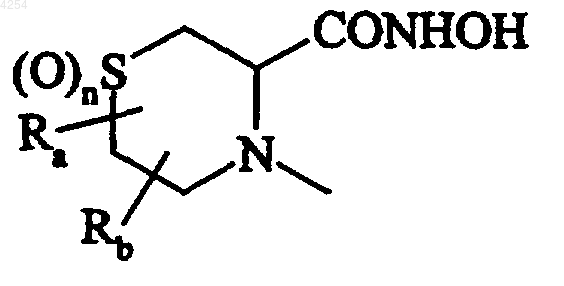
их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по п.1, отличающиеся тем, что A представляет собой группу
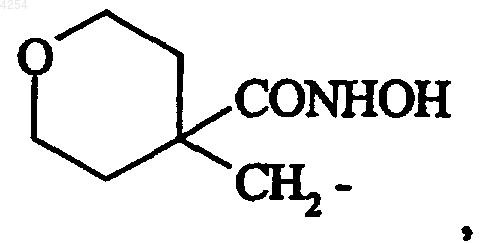
их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по п.3, отличающиеся тем, что A представляет собой группу
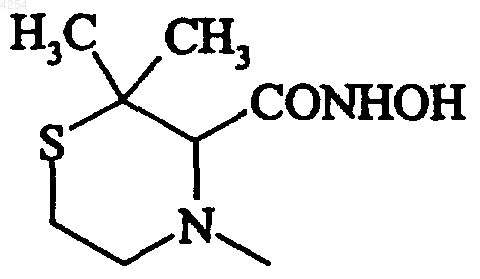
их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Соединение формулы (I) по п.1 либо 2, которое представляет собой N-гидрокси-(5R)-6-{[2-(4-пиридил)-1-бензофуран-5-ил]сульфонил}-4,5,6,7-тетрагидро[2,3-c]-пиридин-5-карбоксамид, его изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Соединение формулы (I) по любому из пп.1, 3 или 5, которое представляет собой N-гидрокси-(3S)-2,2-диметил-4-{[2-(4-пиридил)-1-бензофуран-5-ил]сульфонил}-3-тиоморфолинкарбоксамид, его изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
8. Соединение формулы (I) по п.1 либо 4, которое представляет собой N-гидрокси-4-{{[2-(4-пиридил)-1-бензофуран-5-ил]сульфонил}метил}тетрагидро-277-пиран-4-карбоксамид, его изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
9. Способ получения соединений формулы (I) по п.1, отличающийся тем, что, если в соединениях формулы (I) A представляет собой любую из групп
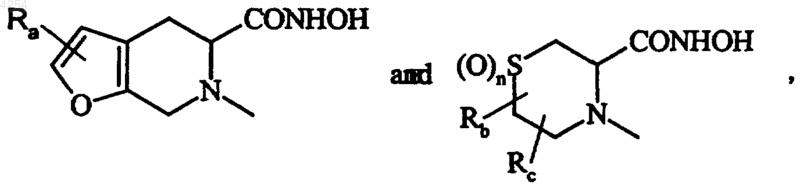
в качестве исходного используют соединение формулы (II)
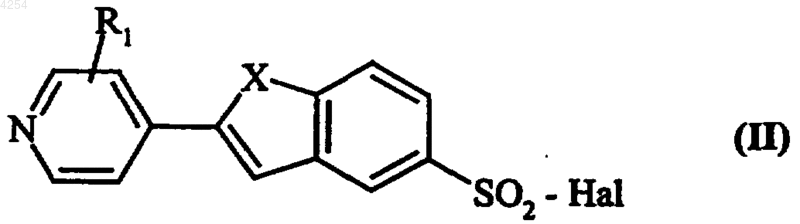
в которой R1 и X имеют значения, указанные для формулы (I), и Hal представляет собой атом галогена, которое подвергают реакции с любым из соединений (IIIa) и (IIIb), в рацемической форме или в виде конкретного изомера
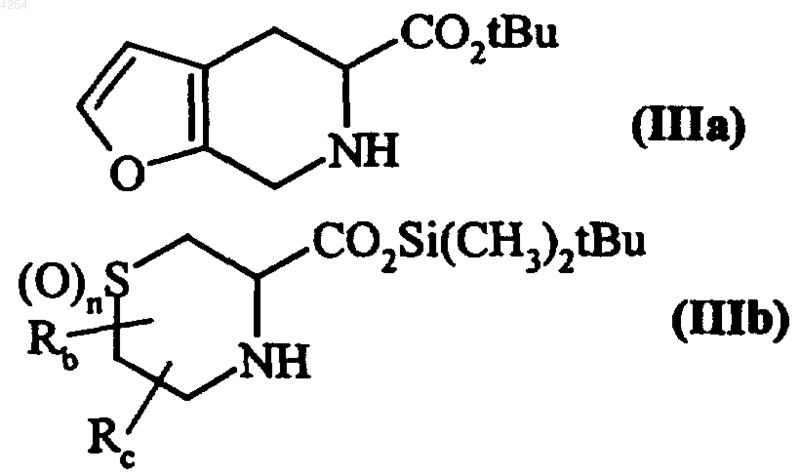
в которых Rb, Rc и n имеют значения, указанные для формулы (I), получая соединения формул (IVa) и (IVb) соответственно
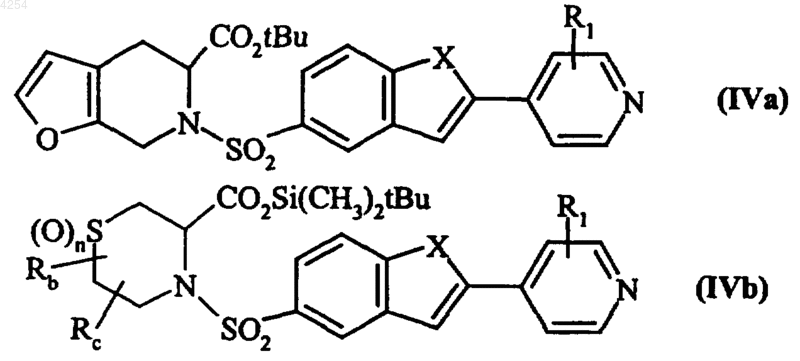
в которых X, R1, Rb, Rc и n имеют значения, указанные для формулы (I), из которых удаляют защитные группы, получая соединения формул (Va) и (Vb) соответственно
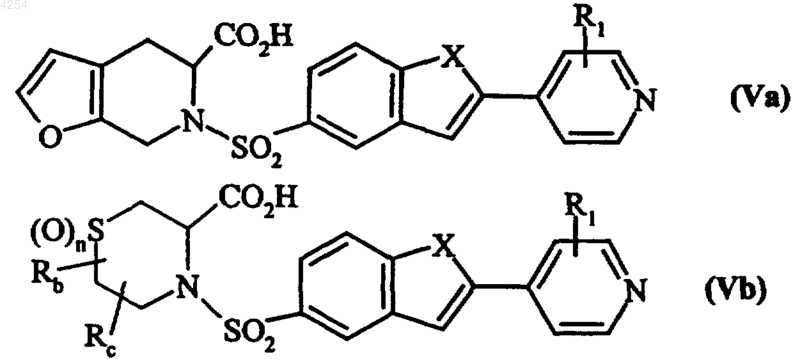
в которых X, R1, Rb, Rc и n имеют значения, указанные для формулы (I), которые подвергают действию O-замещенного гидроксиламина, получая после удаления защитных групп гидроксаматной функции соединения формул (I/a) и (I/b) соответственно
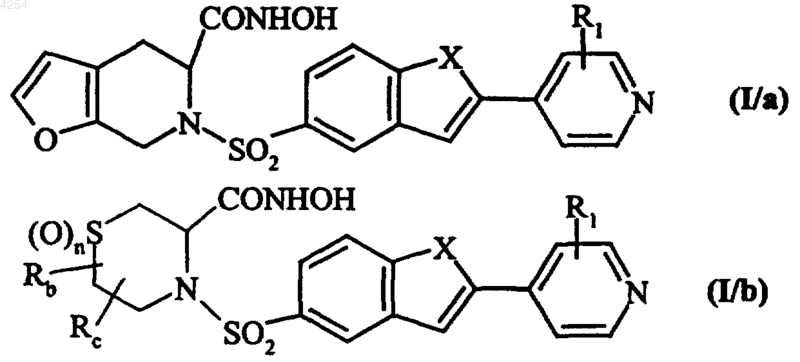
в которых X, R1, Rb, Rc и n имеют значения, указанные для формулы (I),
эти соединения формул (I/a) и (I/b)
необязательно переводят в соответствующие N-оксиды,
очищают, при необходимости, согласно обычной методике очистки,
разделяют, где это уместно, на их изомеры согласно обычной разделительной методике и
переводят при желании в аддитивные соли с фармацевтически приемлемой кислотой или основанием.
10. Способ получения соединений формулы (I) по п.1, отличающийся тем, что, если в соединениях формулы (I) A представляет собой группу
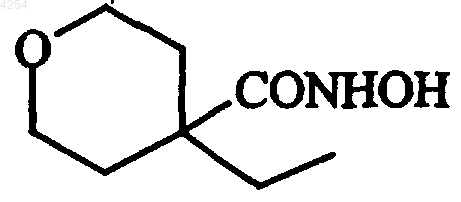
в качестве исходного используют соединение формулы (VI)
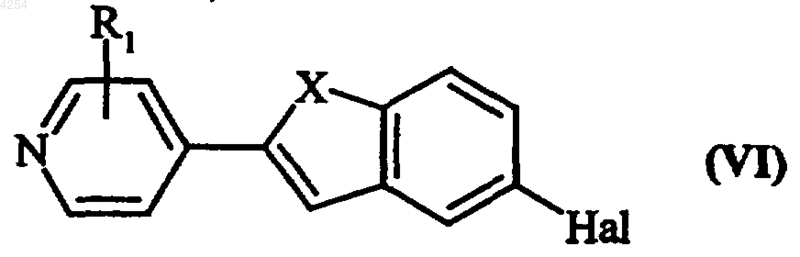
в которой R1 и X имеют значения, указанные для формулы (I), и Hal представляет собой атом галогена, которое подвергают реакции с соединением формулы (VII)
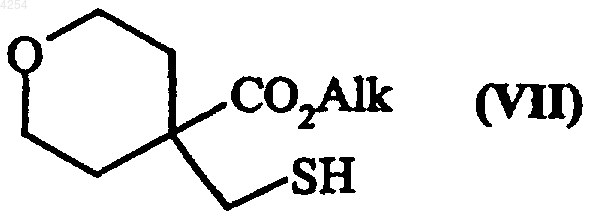
в которой Alk представляет собой линейную или разветвленную (C1-C6)алкильную группу, получая после реакции в кислой среде соединение формулы(VIII)
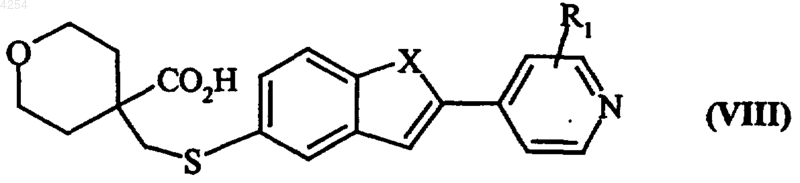
в которой R1 и X имеют значения, указанные для формулы (I), которое подвергают реакции с окислителем, получая соединение формулы (IX)
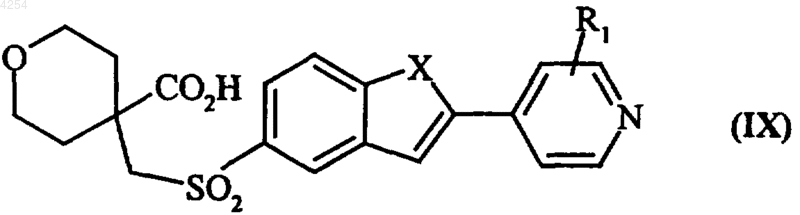
в которой X и R1 имеют значения, указанные для формулы (I), которое подвергают воздействию O-замещенного гидроксиламина, получая после удаления защитных групп гидроксаматной функции соединение формулы (I/c), частный случай формулы (I)
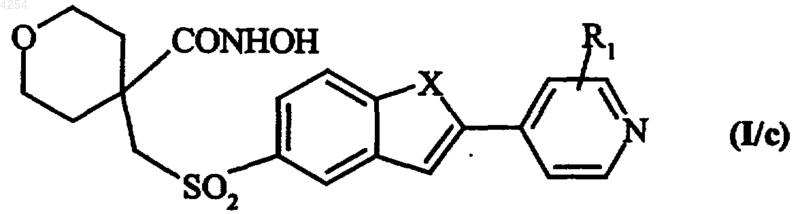
в которой R1 и X имеют значения, указанные для формулы (I);
это соединение необязательно переводят в соответствующий N-оксид, который при необходимости очищают согласно обычной методике очистки, разделяют, где это имеет смысл, на его изомеры согласно обычной методике разделения, переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
11. Фармацевтическая композиция, включающая в качестве активного ингредиента по меньшей мере одно соединение по любому из пп.1-8 отдельно или в комбинации с одним или более инертным, нетоксичным, фармацевтически приемлемым эскципиентом или носителем.
12. Фармацевтическая композиция по п.11, включающая по меньшей мере один активный ингредиент по любому из пп.1-8 для применения в качестве ингибитора металлопротеаз.
Текст
1 Настоящее изобретение относится к новым ингибиторам металлопротеаз, способу их получения и содержащим их фармацевтическим композициям. В физиологическом состоянии синтез соединительных тканей находится в динамическом равновесии с деградацией внешнеклеточного матрикса. Деградацию вызывают цинкпротеазы (металлопротеазы), выделяемые клетками существующего матрикса: ими являются, без какого-либо ограничения, коллагены (ММР-1,ММР-8, ММР-13), желатины и коллагены типа(ММР-3). В нормальном состоянии эти катаболические энзимы регулируются на стадии их синтеза и секреции, а также на стадии их внеклеточной активности природными ингибиторами, такими как 2-макроглобулин или ТИМПы (Тканевые ингибиторыМеталлоПротеиназ), образующими с металлопротеазами неактивные комплексы. Обычным фактором при патологиях, в которые вовлечены эти энзимы, является дисбаланс между активностью активированных энзимов и их природных ингибиторов, следствием чего является избыточная деградация тканей. Неконтролируемая и ускоренная мембранная деградация при перемещении внеклеточного матрикса, катализируемая металлопротеазами,является параметром, обычным при некоторых патологических состояниях, таких как ревматоидный артрит, артроз, распространение и рост опухолей, включая злокачественное распространение и образование метастаз, язвы, атеросклероз, пр. Ингибитор металлопротеазы ВВ 94 недавно показал антиопухолевую активность при клиническом применении, он оказался активным против раков яичников (Becket и др, DDT 1996,1(1), 16). Таким образом, можно ожидать, что ингибитор металлопротеазы восстановит равновесие между протеазой и ингибитором, и таким образом благоприятно повлияет на развитие таких патологий. Некоторое количество ингибиторов металлопротеазы было описано в литературе. Особенно стоит упомянуть соединения, описанные в описаниях патентов WO 95/35275, WO 95/35276, ЕР 606 046, WO 96/00214, ЕР 803 505,WO 97/20824 и ЕР 780 386. Соединения по данному изобретению не только новы, но и оказались более мощными,чем описанные в литературе ингибиторы металлопротеазы, таким образом становясь потенциально полезными при лечении рака, ревматических заболеваний, таких как артроз и ревматоидный артрит, атеросклероз, пр. Более конкретно, данное изобретение относится к соединениям формулы (I)R1 представляет собой атом водорода, атом галогена, линейную или разветвленную (С 1-Сe)алкильную группу или линейную или разветвленную(С 1-С 6)алкоксигруппу,Х представляет собой атом кислорода,атом серы или группу NR, в которой R представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу,А представляет собой любую из следующих групп: в которой Ra представляет собой атом водорода,атом галогена, линейную или разветвленную(С 1-С 6)-алкильную группу, линейную или разветвленную (C1-С 6)алкоксигруппу, в которой Rb и Re, которые могут быть идентичны или различны, представляют собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, и n равняется 0, 1 или 2, или их изомеры, N-оксиды, и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. Из фармацевтически приемлемых солей можно упомянуть в виде неограничивающего примера соляную кислоту, бромоводородную кислоту, серную кислоту, фосфоновую кислоту,фосфорную кислоту, уксусную кислоту, трифтороуксусную кислоту, молочную кислоту, пирувоновую кислоту, малоновую кислоту, сукциновую кислоту, глутаровую кислоту, фумаровую кислоту, виннокаменную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфоновую кислоту, камфорную кислоту, др. Из фармацевтически приемлемых оснований в качестве неограничивающего примера можно упомянуть гидроксид натрия, гидроксид калия, гидроксид лития, триэтиламин, тертбутиламин, др. Предпочтительными соединениями по изобретению являются соединения формулы (I) в которой Х представляет собой атом кислорода.R1 предпочтительно является атомом водорода. Когда А является группой, эта группа предпочтительно представляет собой группу 3 Предпочтительными соединениями по изобретению являются:N-гидрокси-(5R)-6-[2-(4-пиридил)-1 бензофуран-5-ил]сульфонил-4,5,6,7-тетрагидрофуро[2,3-с]пиридин-5-карбоксамид,-N-гидрокси-(3S)-2,2-диметил-4-[2-(4 пиридил)-1-бензофуран-5-ил]сульфонил-3 тиоморфолинкарбоксамид,-N-гидрокси-4-[2-(4-пиридил)-1-бен-зофуран-5-ил]сульфонилметилтетрагидро-2Hпиран-4-карбоксамид,и их аддитивные соли. Изобретение также относится к способу получения соединений формулы (I). Если в соединениях формулы (I) А представляет собой любую из групп метод отличается тем, что в качестве исходного материала применяют соединение формулы (II) в которой R1 и Х имеют значения, указанные для формулы (I), и Hal представляет собой атом галогена, которое подвергают реакции с любым из соединений (IIIа) и (IIIb), в рацемической форме или в форме конкретного изомера: 4 в которых X, R1, Rb, Rc и n имеют значения, указанные для формулы (I), эти соединения формул(I/a) и (I/b) необязательно переведены в соответствующие N-оксиды,очищены, при необходимости, согласно обычной методике очистки,разделены, где это уместно, на их изомеры согласно обычной разделительной методике, и переведены при желании в аддитивные соли с фармацевтически приемлемой кислотой или основанием. Если в соединениях формулы (I) А представляет собой группу способ отличается тем, что в качестве исходного материала используют соединение формулы в которой R1 и Х имеют значения, указанные для формулы (I), и Hal представляет собой атом галогена, которое подвергают реакции с соединением формулы (VII) в которой Alk представляет собой линейную или разветвленную (C1-С 6)алкильную группу,получая после гидролиза кислоты соединение формулы (VIII) в которых Rb, Rc и n имеют значения, указанные для формулы (I), для получения соединений формулы (IVa) и (IVb), соответственно в которых X, R1, Rb, Rc и n имеют значения, указанные для формулы (I), которые избавляют от защитных групп, получая соединения формул(Va) и (Vb), соответственно, в которых X, R1, Rb, Rc и n имеют значения, указанные для формулы (I), которые подвергают воздействию O-защищенного гидроксиламина,получая после отщепления защитных групп от гидроксаматной функции соединения формул в которой R1 и Х имеют значения, указанные для формулы (I), которое подвергают реакции с окисляющим агентом, получая соединение формулы (IX) в которой Х и R1 имеют значения, указанные для формулы (I), которое подвергают воздействию O-замещенного гидроксиламина, получая после удаления защитных групп гидроксаматной функции соединение формулы (I/с), частный случай соединения формулы (I) в которой R1 и Х имеют значения, указанные для формулы (I), необязательно переведенное в соответствующий N-оксид, который очищают при необходимости согласно обычной методике очистки, разделяют, где это уместно, на изомеры согласно обычной разделительной методике,и переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5 Соединения формул (II) и (VI) получают,используя в качестве исходного материала соединение формулы (X) в которой Hal представляет собой атом галогена и Х имеет значения, указанные для формулы (I),которое подвергают реакции с бромидом трифенилфосфина, получая соединение формулы (XI) в которой Hal и Х имеют значения, указанные здесь ранее, которое подвергают реакции с хлоридом изоникотиноила формулы (XII) в которой R1 имеет значения, указанные для формулы (I), получая соединение формулы (VI) в которой Hal, Х и R1 имеют значения, указанные здесь ранее,которое затем переводят в соединение формулы (ХIII) в присутствии гидроксида серы и н-бутиллития в которой Hal, Х и R1 имеют значения, указанные здесь ранее. Изобретение также относится к фармацевтическим композициям, включающим в качестве активного ингредиента по меньшей мере одно соединение формулы (I), с одним или более подходящих инертных нетоксичных эксципиентов. Среди фармацевтических композиций по изобретению можно упомянуть более конкретно композиции, пригодные для орального, парентерального (внутривенного или подкожного) или назального применения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки, суппозитории, кремы, мази, кожные гели, инъекционные препараты, питьевые суспензии, др. Полезную дозу можно адаптировать к природе и сложности расстройства, графику приема и возрасту и весу пациента. Дозировка колеблется от 0,01 до 2 г/день при одном или более приемах. Нижеследующие примеры иллюстрируют изобретение, не ограничивая его никоим образом. 6 Применяемые исходные материалы являются известными продуктами или получаются по известным методам. В подготовительных примерах получают промежуточные продукты для применения в получении соединений по изобретению. Структуры соединений, описанных в примерах и подготовительных примерах, получали согласно обычным спектрофотометрическим методикам (инфракрасный, ЯМР, масс-спектрометрия, др.). Подготовительный пример А. Этил 4(сульфанилметил)тетрагидро-2H-пиран-4-карбоксилат. Стадия А. Этил 4-[(ацетилсульфанил)метил]тетрагидро-2 Н-пиран-4-карбоксилат. В атмосфере аргона 47 г трифенилфосфина растворяют в 350 мл тетрагидрофурана (ТГФ). После охлаждения до 0 С в этот раствор добавляют 34,9 мл диизопропилазодикарбоксилата(ДИАД). После 30 минутного перемешивания добавляют раствор, содержащий 89 ммоль этил 4-(гидроксиметил)тетрагидро-2H-пиран-4-карбоксалат и 12,8 тиоуксусной кислоты в 300 мл ТГФ. После перемешивания при комнатной температуре на протяжении ночи и выпаривания до сухого состояния остаток отбирают в эфир. После фильтрации фильтрат выпаривают и получают ожидаемый продукт в виде масла,которое очищают хроматографией над силикагелевой колонке, применяя смесь дихлорометана/этилацетата (90/10) в качестве элюанта. Стадия В. Этил 4-(сульфанилметил)тетрагидро-2 Н-пиран-4-карбоксилат. 92 мл раствора 2,2 Н соляной кислоты в этаноле добавляют к 67,4 ммоль соединения,полученного в предыдущей стадии и растворенного в 50 мл этанола. После перемешивания на протяжении ночи все выпаривают до сухого состояния, получая ожидаемый продукт в виде масла. Подготовительный пример В. 5-Бромо-2(4-пиридил)бензофуран. Стадия А. Бромид (5-бромо-2-гидроксибензил)трифенилфосфония. 169 г бромида трифенилфосфина добавляют к 490 ммоль 4-бромо-2-(гидроксиметил)фенола, суспензированного в 500 мл ацетонитрила. Все нагревают при 100 С в течение 2 ч. После охлаждения образовавшийся осадок отфильтровывают и сушат, получая ожидаемый продукт. Точка плавления: 260C Стадия В. 5-Бромо-2-(4-пиридил)бензофуран. 256 мл триэтиламина добавляют к 243 г продукта, полученного на предыдущей стадии, в 2 л толуола в присутствии 90,1 г изоникотиноил хлорида. Все нагревают при 100 С 24 ч. После охлаждения образовавшийся осадок отфильтровывают, получая ожидаемый продукт после рекристаллизации из этилацетата. 7 Точка плавления: 160 С Подготовительный пример С. 2-(4-Пиридил)-1-бензофуран-5-сульфонилхлорид. Стадия А. [2-(4-Пиридил)-1-бензофуран 5-ил]сульфониллитий. н-Бутиллитий при -72 С добавляют к 60,2 ммоль соединения, полученного в подготовительном примере В, суспензированного в тетрагидрофуране. После 90 мин при -72 С, в течение часа через смесь пропускают поток SO2. Через 2 дня при комнатной температуре образовавшееся твердое вещество отфильтровывают и промывают, получая ожидаемый продукт. Стадия В. 2-(4-Пиридил)-1-бензофуран-5 сульфонилхлорид. 59 ммоль продукта, полученного на предыдущей стадии, суспендируют в 80 мл дихлорометана. После охлаждения до 0 С по каплям добавляют 5,7 мл сульфурилхлорида. После ночи при комнатной температуре образовавшийся осадок отфильтровывают и промывают эфиром, получая ожидаемый продукт. Точка плавления: 210 С Пример 1. N-Гидрокси-(5R)-6-[2-(4-пиридил)-]-бензофуран-5-илсульфонил-4,5,6,7-тетрагидрофуро[2,3-с]пиридин-5-карбоксамидгидрохлорид. Стадия А. Трет-бутиловый эфир (5R)-6[2-(4-пиридил)-1-бензофуран-5-ил]сульфонил-4,5,6,7-тетрагидрофуро[2,3-с]пиридин-5 карбоксиловой кислоты 30 ммоль гидрохлорида трет-бутилового эфира (5R)-4,5,6,7-тетрагидрофуро[2,3-с]пиридин-5-карбоксиловой кислоты помещают в 150 пиридина. Затем добавляют при комнатной температуре 30 ммоль 2-(4-пиридил)-1-бензофуран-5-сульфонилхлорида, описанного в получении С, все нагревают при 60 С на протяжении ночи. После удаления пиридина выпариванием,отбиранием остатка в дихлорометан, промыванием водой, сушкой и выпариванием, получают ожидаемый продукт в виде масла, которое очищают хроматографией над силикагелем, применяя смесь дихлолрометана/этанола (98/2) в качестве элюанта. Стадия В. (5R)-6-[2-(4-Пиридил)-1-(бензофуран-5-ил)сульфонил-4,5,6,7-тетрагидрофуро[2,3-с]пиридин-5-карбоновая кислота. 2,4 мл анизола добавляют к 22 ммоль сложного эфира, полученного на предыдущей стадии, растворенного в 250 мл дихлорометана. Все охлаждают до 0 С и добавляют 17 мл трифтороуксусной кислоты. Все выдерживают при комнатной температуре на протяжении ночи. После выпаривания до сухого состояния остаток очищают хроматографией на силикагеле, применяя смесь дихлорометана/метанола (85/15) в качестве элюанта, получая ожидаемый продукт. Стадия С. N-Аллилокси-(5R)-6-[2-(4-пиридил)-1-бензофуран-5-ил]сульфонил-4,5,6,7 тетрагидрофуро[23-с]пиридин-5-карбоксамид. К охлажденному до 0 С раствору, содержащему 12 ммоль кислоты, полученной на предыдущей стадии, в 150 мл дихлорометана добавляют 10,3 мл диизопропилэтиламина, 1,65 г 1-гидроксибензотриазола, раствор, содержащий 1,6 г хлорида O-аллилгидроксиамина в 50 мл диметилформамида, и 4,65 г тетрафтороборатаO-бензотриазолилтетраметилизоурония (ТБТУ). Все выдерживают при комнатной температуре на протяжении ночи. После выпаривания до сухого состояния остаток отбирают в дихлорометан. После промывания водой, сушки и выпаривания получают остаток, из которого получается ожидаемый продукт после очищения на силикагелевой колонке с применением смеси дихлорометана/этанола/аммиака (98/2/0,2) в качестве элюанта. Стадия D. Гидрохлорид N-гидрокси-(5R)6-[2-(4-пиридил)-1-бензофуран-5-ил]сульфонил-4,5,6,7-тетрагидрофуро[2,3-с]пиридин-5 карбоксамида. 300 мг Рd катализатора (PPh3)2Cl2 и 1,5 мл уксусной кислоты добавляют к продукту, полученному на предыдущей стадии, в 150 мл дихлорометана. Через 5 мин добавляют 4,9 мл трибутилтингидрида. Все выдерживают при комнатной температуре 30 мин, а затем выпаривают. После отбирания остатка в ацетонитрил добавляют 20 мл 1 Н соляной кислоты и все разбавляют водой. Водную фазу промывают эфиром и затем лиофилизируют, получая ожидаемый продукт. Элементарный микроанализ: Расчетный Полученный Пример 2. N-Гидрокси-(3S)-2,2-диметил-4[2-(4-пиридин)-1-бензофуран-5-ил]сульфонил-3-тиоморфолинкарбоксамид. Стадия А. Трет-бутил(диметил)силиловый эфир 4-[2-(4-аминофенил)-1-бензофуран 5-ил]сульфонил-2,2-диметил-3-тиоморфолинкарбоновой кислоты. 58,7 ммоль трет-бутил(диметил)силилового эфира 2,2-диметил-3-тиоморфолинкарбоновой кислоты растворяют в 500 мл безводного дихлорометана. При -20 С добавляют 16 мл N-метилморфолина, после чего 57,5 ммоль 2(4-пиридил)-1-бензофуран-5-сульфонилхлорида,описанного в получении С. Все перемешивают 48 ч при комнатной температуре, а затем выливают в 300 мл воды. После сцеживания, промывания водой, сушки и выпаривания получают ожидаемый продукт в виде масла. Стадия В. 4-[2-(4-Аминофенил)-1-бензофуран-5-ил-2,2-диметил-3-тиоморфолинкарбоновая кислота. 33 г соединения, полученного на предыдущей стадии, растворяют в 400 мл безводного метанола. Все нагревают с обратным холодильником в течение 2 ч и затем выпаривают. Ожи 9 даемый продукт получают рекристаллизацией остатка из эфира. Стадия С. N-(Аллилокси)-4-[2-(4-аминофенил)-1-бензофуран-5-ил]сульфонил-2,2-диметил-3-тиоморфолинкарбоксамид. Ожидаемый продукт получают согласно способу, описанному в стадии С примера 1, исходя из продукта, описанного на предыдущей стадии. Стадия D. N-Гидрокси-(3S)-2,2-диметил-4[2-(4-пиридил)-1-бензофуран-5-ил]-сульфонил-3-тиоморфолинкарбоксамид. К 10,2 ммоль соединения, описанного на предыдущей стадии, растворенного в 70 мл дихлорометана, добавляют 360 мг Pd катализатора(РРh3)2 Сl2 и 1,75 мл уксусной кислоты, через 5 мин, после чего добавляют 5,8 мл гидрида трибутилтина. После 20 минутного перемешивания добавляют 70 мл эфира. Нерастворимый продукт отфильтровывают и промывают эфиром,отбирают в смесь ацетонитрила/воды (50/50) и после лиофилизации получают ожидаемый продукт. Элементарный микроанализ: Расчетный Полученный Пример 3. N-Гидрокси-4-[2-(4-пиридил)1-бензофуран-5-ил]сульфонилметилтетрагидро-2H-пиран-4-карбоксамид. Стадия А. Этиловый эфир 4-[2-(4-пиридил)-1-бензофуран-5-ил]сульфонилметилтетрагидро-2 Н-пиран-4-карбоновой кислоты. 23,9 ммоль 5-бромо-2-(4-пиридил)бензофурана, описанного в получении В, 7,32 г соединения, описанного в получении А, 431 мг трис-(дибензилиденацетон)дипалладия и 1,05 г 1,1'-бис(дифенил)фосфиноферроцена помещают в 75 мл N-метилпирролидона. Все нагревают при 100 С на протяжении 48 ч. После выпаривания остаток отбирают в этилацетат и концентрированный раствор хлорида натрия. После фильтрации, экстрагирования этилацетатом и выпаривания остаток очищают хроматографией на силикагелевой колонке с применением смеси дихлорометана/этилацетата (9/1) в качестве элюанта. Ожидаемый продукт затем выкристаллизовывают. Точка плавления: 92 С Стадия В. 4-[2-(4-Пиридил)-1-бензофуран-5-ил]сульфанилметилтетрагидро-2 Нпиран-4-карбоновая кислота. 7,5 г эфира, полученного на предыдущей стадии, помещают в 200 мл 6 Н соляной кислоты. Все нагревают с обратным холодильником на протяжении ночи. После охлаждения рН раствора устанавливают на 7 добавлением гидроксида натрия. 10 Образовавшийся осадок отфильтровывают и промывают водой, получая ожидаемый продукт. Точка плавления: 227 С Стадия С. 4-[2-(4-Пиридил)-1-бензофуран-5-ил]сульфонилметилтетрагидро-2 Н-пиран-4-карбоновая кислота. 18 ммоль соединения, полученного на предыдущей стадии, помещают в 116 мл воды и 140 мл ацетонитрила. Все охлаждают на водяной ванне и по частям добавляют 17,65 г оксона. Смесь оставляют при комнатной температуре на 48 ч. После выпаривания рН устанавливают на 7, и ожидаемый продукт выпадает в осадок. Точка плавления: 217 С Стадия D. 4-[2-(4-Пиридил)-1-бензофуран-5-ил]сульфонилметил-N-(аллилокси)-тетрагидро-2 Н-пиран-4-карбоксамид. Ожидаемый продукт получают согласно способу, описанному в стадии С примера 1, исходя из соединения, описанного в предыдущей стадии. Стадия Е. N-Гидрокси-4-[2-(4-пиридил)1-бензофуран-5-ил]сулфонилметилтетрагидро-2 Н-пиран-4-карбоксамид. Ожидаемый продукт получают согласно способу, описанному на стадии D примера 1,исходя из соединения, описанного в предыдущей стадии. Элементарный микроанализ: Расчетный Полученный Пример 4. 1-оксид N-Гидрокси-(3S)-2,2 диметил-4-[2-(4-пиридил)-1-бензофуран-5-ил] сульфонил-3-тиоморфолинкарбоксамида. Ожидаемый продукт получают согласно способу, описанному в примере 2 в стадии А,заменив 2,2-диметил-3-тиоморфолинкарбоновую кислоту 1-оксидом 2,2-диметил-3-тиоморфолинкарбоновой кислоты. Пример 5. N-Гидрокси-(3S)-2,2-диметил-4[2-(4-пиридил)-1-бензофуран-5-ил]сульфонил-3-тиоморфолинкарбоксамид 1,1-диоксид. Ожидаемый продукт получают согласно способу, описанному в примере 2 в стадии А,заменив 2,2-диметил-3-тиоморфолинкарбоновую кислоту 1,1-диоксидом 2,2-диметил-3-тиоморфолинкарбоновой кислоты. Пример 6. N-Гидрокси-(3S)-2,2-диметил-4[2-(4-пиридилоксид)-1-бензофуран-5-ил]сульфонил-3-тиоморфолинкарбоксамид. Ожидаемый продукт получают окислением соединения, описанного в примере 2. Фармакологическое изучение соединений по изобретению Пример А. Энзиматическое ингибирование металлопротеаз. Шесть человеческих энзимов, ММР-1(промежуточная коллагеназа), ММР-2 (желати 11 наза А), ММР-3 (стромелизин 1), ММР-8 (нейтрофильная коллагеназа), ММР-9 (желатиназа В) и ММР-13 (коллагеназа 3) активируют при помощи АФРА (4-аминофенилртутный ацетат). Энзиматические тесты на ММР-1, -2, -8, -9 и -13 проводили, применяя следующий пептидомиметический субстрат:DnpProGhaGlyCys(Me)HisAlaLys(Nma)NH2,который разделяют между глицином и цистеином, получая флуоресцентный продукт, описанный D.M. BICKETT и др. (Anal. Biochem.,212,58-64,1993). Энзиматический тест на ММР 3 проводят, применяя следующий пептидомиметический субстрат:McaArgProLysProTyrAlaNvaTrpMetLys(Dnp)NH2,который разделяют между глицином и цистеином, получая флуоресцентный продукт, описанный Н. NAGASE и др. (J. Biol. Chem., 269,20952-20957, 1994). Реакции, проводимые в буфере 50 мМ Трис, 200 мМ NaCI, 5 мМ CaCl2, 0,1% Brij 35 при рН 7,7, инициируют, используя 20 М субстрата в общем объеме 100 л при 37 С. Флуоресценцию, полученную через 6 ч,проверяют на 96-порной пластине в флуорометре, оборудованном комбинацией 360 нм и 460 нм фильтров для эксикации и эмиссии. Соединения по изобретению имеют значения IC50 от 10-10 до 10-8 М для всех ММР, за исключением ММР-1, коллагеназы ММР-13 и ММР-8 проявляют специфичность в 1000 большую по сравнению с коллагеназой ММР-1. Пример В. Деградация In vitro хрящевого матрикса. Соединения по изобретению изучали на модели разрушения хрящевого матрикса, индуцированного IL-1. Тесты, проведенные на хряще кролика, относятся с одной стороны к деградации коллагена: калориметрический анализ, согласно методу Гранта (GRANT R.A. Estimation of OH-proline bythe autoanalyser, J. Clin. Path., 17, 685,1964),фракции ОН-пролина, выделенной тканью при контакте с IL-1 (10 нг/мл) и плазмина (0,1U/мл) в течение 2 дней; с другой стороны, к деградации протеогликанов: радиоизотопное измерение фракции гликозаминогликанов, выделенной после 24-часового стимулирования при помощи IL-1 (10 нг/мл) ткани, предварительно маркированной 35SO4, в течение 24 ч контакта с АФРА(5 х 10-4 М). Соединения по изобретению изучали, добавляя их к субстрату в течение 3 дней проведения теста. Для концентраций от 10-9 до 10-6 М они сильно ингибировали деградацию коллагена и протеогликанов. Пример С. Ангиогенез In vitro Части горловой аорты самцов крыс Фишера 344, возрастом от 8 до 12 недель погружали в коллагеновый гель типа I, согласно способу Никосиа и Оттинетти (Lab. Invest., 63, 115, 1990). Через 5 дней культивирования в субстрате без 12 сыворотки препараты изучали под микроскопом и определяли количество образования псевдососудов в единицах плотности сосудов после оцифровки и анализа изображения. Пример D. Фармацевтическая композиция Формула для получения 1000 таблеток, в каждой из которых содержится доза по 100 мг активного ингредиента Соединение по примеру 1 100 г Гидpoкcипpoпилцeллюлoзa 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I)R1 представляет собой атом водорода, атом галогена, линейную или разветвленную (С 1-С 6) алкильную группу, линейную или разветвленную (С 1-С 6)алкоксигруппу,Х представляет собой атом кислорода,атом серы или группу NR, в которой R представляет собой атом водорода, линейную или разветвленную (C1-С 6)алкильную группу,А представляет собой любую из следующих групп в которой Ra представляет собой атом водорода,атом галогена, линейную или разветвленную(С 1-С 6)алкильную группу, линейную или разветвленную (C1-С 6)алкоксигруппу, в которой Rb и Rc, которые могут быть идентичны или различны, представляют собой атом водорода, линейную или разветвленную (С 1-С 6)алкильную группу и n равняется 0,1 или 2,или их изомеры, N-оксиды, и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) по п.1, отличающиеся тем, что А представляет собой группу их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по п.1, отличающиеся тем, что А представляет собой группу 14 в которых Rb, Rc и n имеют значения, указанные для формулы (I), получая соединения формул их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по п.1, отличающиеся тем, что А представляет собой группу их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по п.3, отличающиеся тем, что А представляет собой группу их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 6. Соединение формулы (I) по п.1 либо 2,которое представляет собой N-гидрокси-(5R)-6[2-(4-пиридил)-1-бензофуран-5-ил]сульфонил-4,5,6,7-тетрагидро[2,3-с]-пиридин-5-карбоксамид, его изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 7. Соединение формулы (I) по любому из пп.1, 3 или 5, которое представляет собой Nгидрокси-(3S)-2,2-диметил-4-[2-(4-пиридил)-1 бензофуран-5-ил]сульфонил-3-тиоморфолинкарбоксамид, его изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 8. Соединение формулы (I) по п.1 либо 4,которое представляет собой N-гидрокси-4-[2(4-пиридил)-1-бензофуран-5-ил]сульфонилметилтетрагидро-277-пиран-4-карбоксамид, его изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 9. Способ получения соединений формулы(I) по п.1, отличающийся тем, что, если в соединениях формулы (I) А представляет собой любую из групп в качестве исходного используют соединение формулы (II) в которой R1 и Х имеют значения, указанные для формулы (I), и Hal представляет собой атом галогена, которое подвергают реакции с любым из соединений (IIIa) и (IIIb), в рацемической форме или в виде конкретного изомера в которых X, R1, Rb, Rc и n имеют значения, указанные для формулы (I), из которых удаляют защитные группы, получая соединения формул в которых X, R1, Rb, Rc и n имеют значения, указанные для формулы (I), которые подвергают действию O-замещенного гидроксиламина, получая после удаления защитных групп гидроксаматной функции соединения формул (I/a) и в которых X, R1, Rb, Rc и n имеют значения, указанные для формулы (I),эти соединения формул (I/a) и (I/b) необязательно переводят в соответствующие N-оксиды,очищают, при необходимости, согласно обычной методике очистки,разделяют, где это уместно, на их изомеры согласно обычной разделительной методике и переводят при желании в аддитивные соли с фармацевтически приемлемой кислотой или основанием. 10. Способ получения соединений формулы (I) по п.1, отличающийся тем, что, если в соединениях формулы (I) А представляет собой группу в качестве исходного используют соединение формулы (VI) в которой R1 и Х имеют значения, указанные для формулы (I), и Hal представляет собой атом галогена, которое подвергают реакции с соединением формулы (VII) в которой Alk представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,получая после реакции в кислой среде соединение формулы(VIII) в которой R1 и Х имеют значения, указанные для формулы (I), которое подвергают реакции с окислителем, получая соединение формулы (IX) в которой Х и R1 имеют значения, указанные для формулы (I), которое подвергают воздействию O-замещенного гидроксиламина, получая после удаления защитных групп гидроксаматной функции соединение формулы (I/с), частный случай формулы (I) 16 в которой R1 и Х имеют значения, указанные для формулы (I); это соединение необязательно переводят в соответствующий N-оксид, который при необходимости очищают согласно обычной методике очистки, разделяют, где это имеет смысл, на его изомеры согласно обычной методике разделения, переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 11. Фармацевтическая композиция, включающая в качестве активного ингредиента по меньшей мере одно соединение по любому из пп.18 отдельно или в комбинации с одним или более инертным, нетоксичным, фармацевтически приемлемым эскципиентом или носителем. 12. Фармацевтическая композиция по п.11,включающая по меньшей мере один активный ингредиент по любому из пп.1-8 для применения в качестве ингибитора металлопротеаз.
МПК / Метки
МПК: A61P 35/00, A61K 31/443, C07D 417/14, C07D 405/14, C07D 491/048
Метки: композиции, способ, металлопротеаз, фармацевтические, получения, содержащие, ингибиторы
Код ссылки
<a href="https://eas.patents.su/9-4254-ingibitory-metalloproteaz-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы металлопротеаз, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Способ получения апомиктичных растений (варианты)
Случайный патент: Суспензионные концентраты на масляной основе












