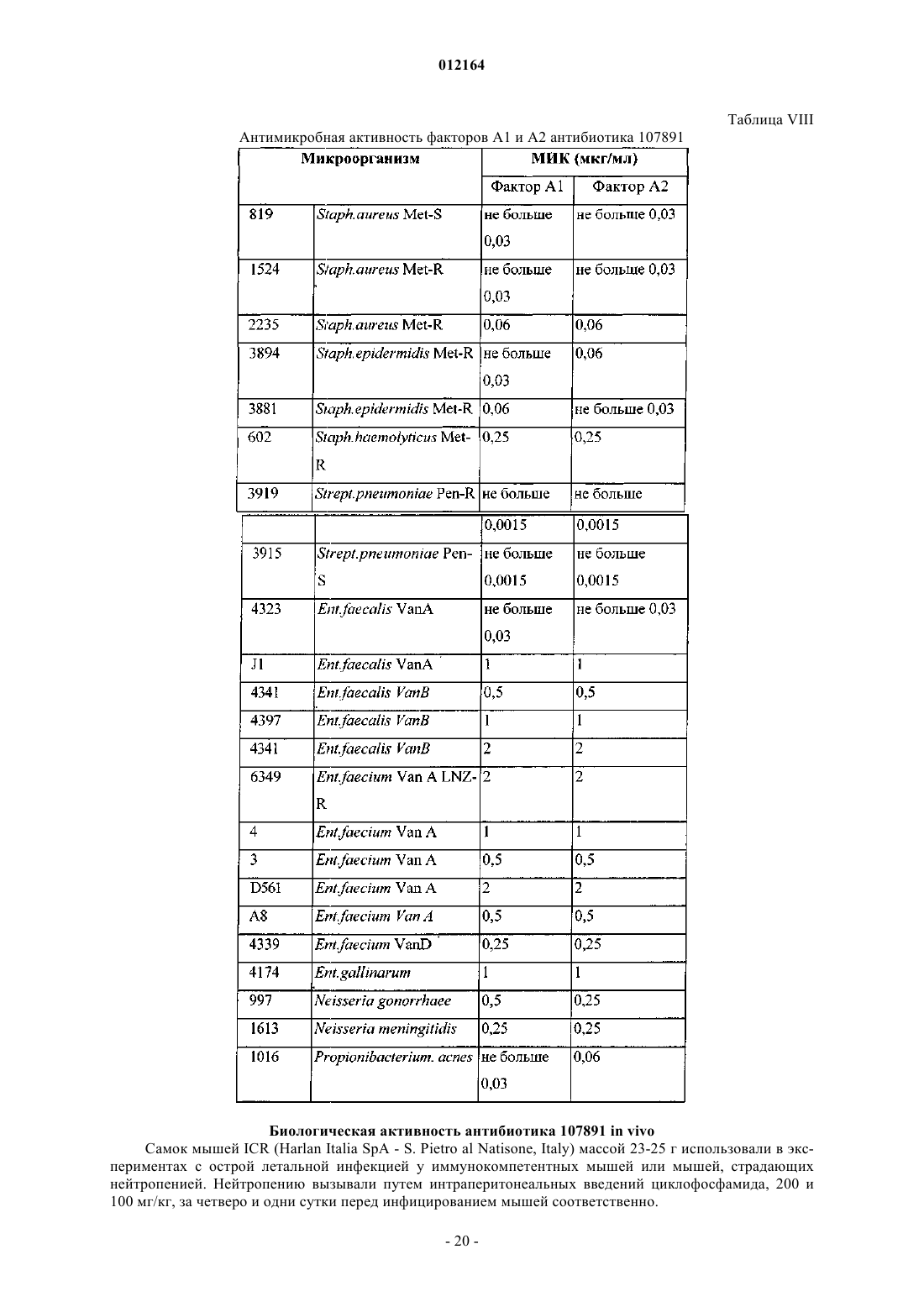
Антибиотик 107891, его факторы а1 и а2, фармацевтически приемлемые соли и композиции и их применение
Номер патента: 12164
Опубликовано: 28.08.2009
Авторы: Лози Даниеле, Чичилиато Исмаэла, Паренти Франко, Кандиани Джанпаоло, Сельва Энрико, Ладзарини Америга, Гастальдо Лучано, Маринелли Флавия
Формула / Реферат
1. Соединение формулы
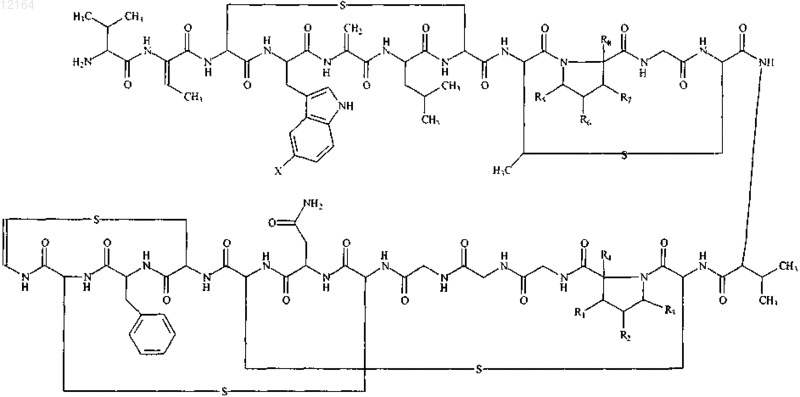
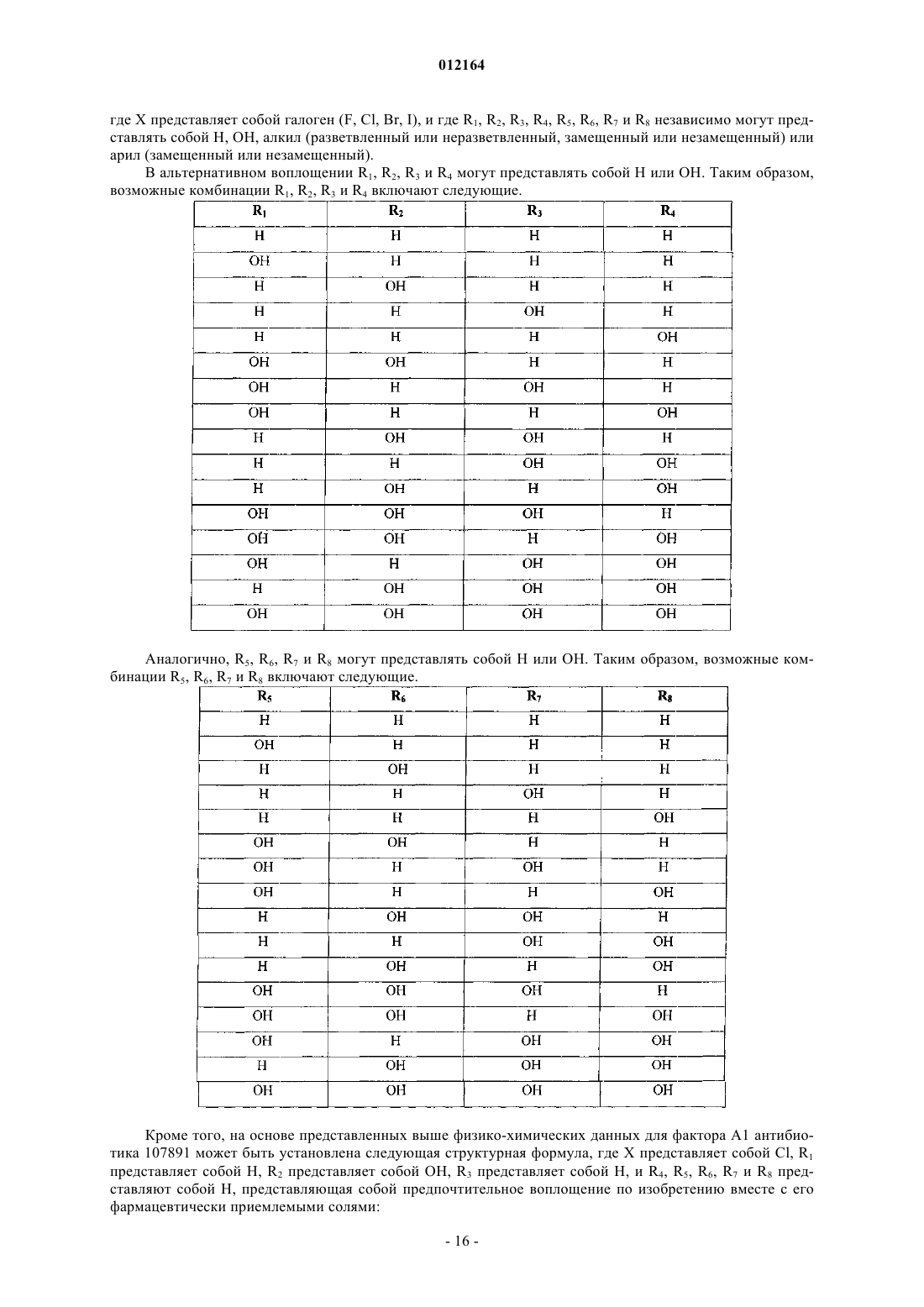
где X выбран из группы, состоящей из F, Cl, Br и I; и
где R1, R2, R3, R4, R5, R6, R7 и R8 независимо выбраны из группы, состоящей из Н и ОН.
2. Соединение по п.1, где X представляет собой Cl, R2 представляет собой ОН и R1, R3, R4, R5, R6, R7 и R8 представляют собой Н.
3. Соединение по п.1, где X представляет собой Cl, R1 представляет собой ОН, R2 представляет собой ОН и R3, R4, R5, R6, R7 и R8 представляют собой Н.
4. Соединение по п.1, где R4, R5, R6, R7 и R8 представляют собой Н.
5. Соединение по п.4, где R1 представляет собой Н, R2 представляет собой Н и R3 представляет собой Н.
6. Соединение по п.4, где R1 представляет собой Н, R2 представляет собой Н и R3 представляет собой ОН.
7. Соединение по п.4, где R1 представляет собой Н, R2 представляет собой ОН и R3 представляет собой ОН.
8. Соединение по п.4, где R1 представляет собой ОН, R2 представляет собой ОН и R3 представляет собой ОН.
9. Соединение по п.4, где R1 представляет собой ОН, R2 представляет собой Н и R3 представляет собой Н.
10. Соединение по п.4, где R1 представляет собой ОН, R2 представляет собой Н и R3 представляет собой ОН.
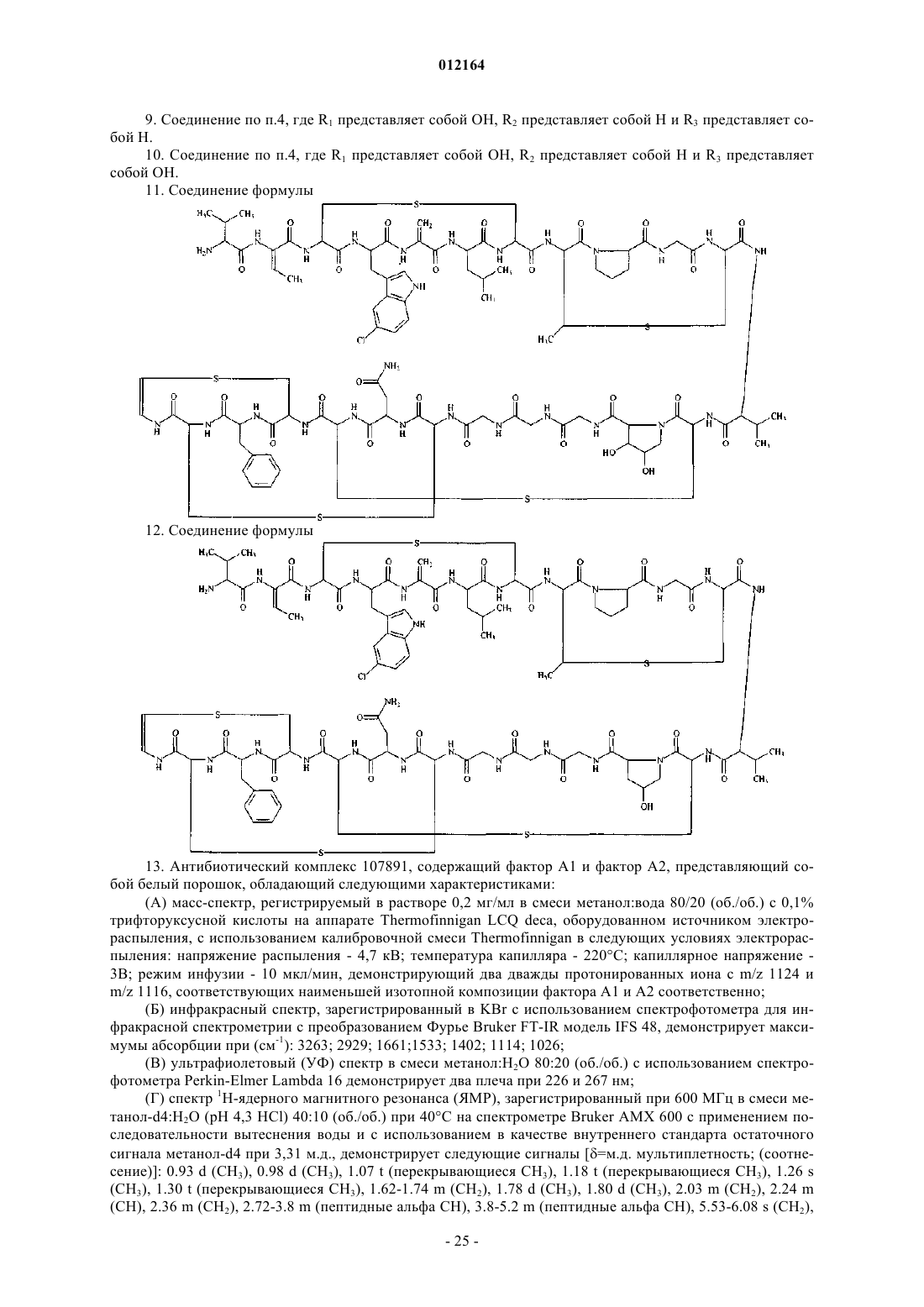
11. Соединение формулы

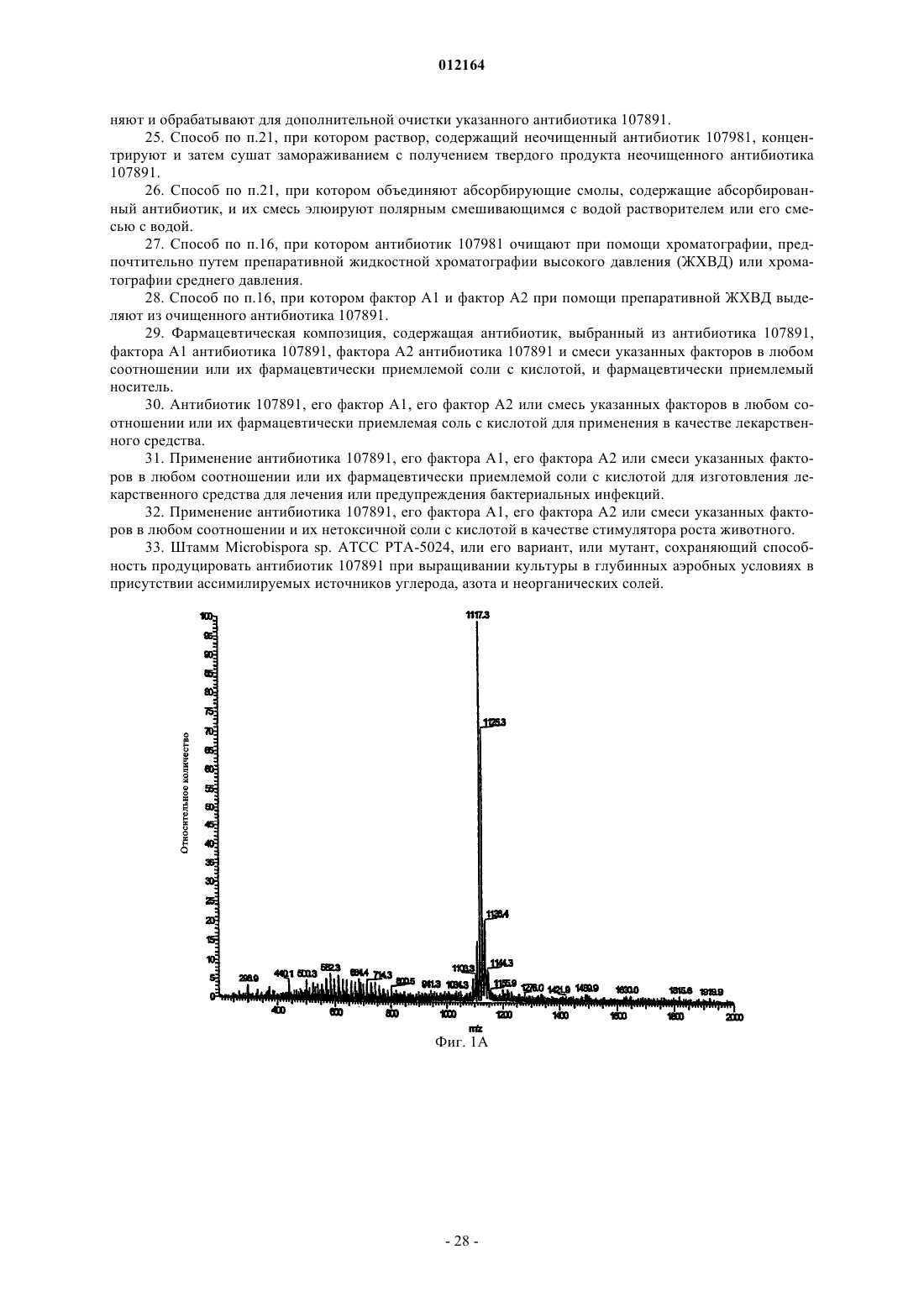
12. Соединение формулы
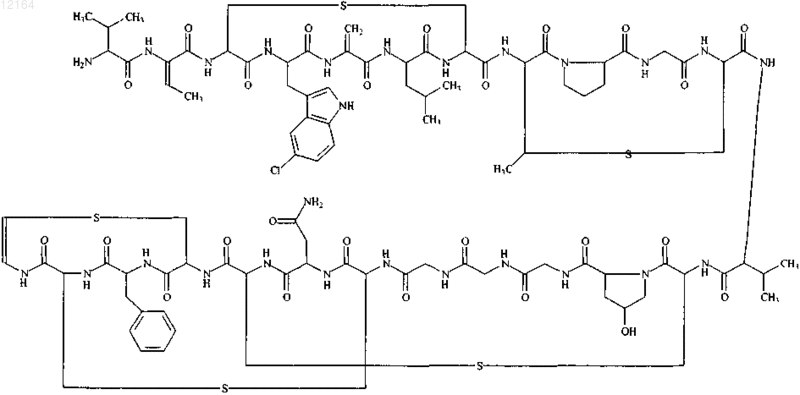
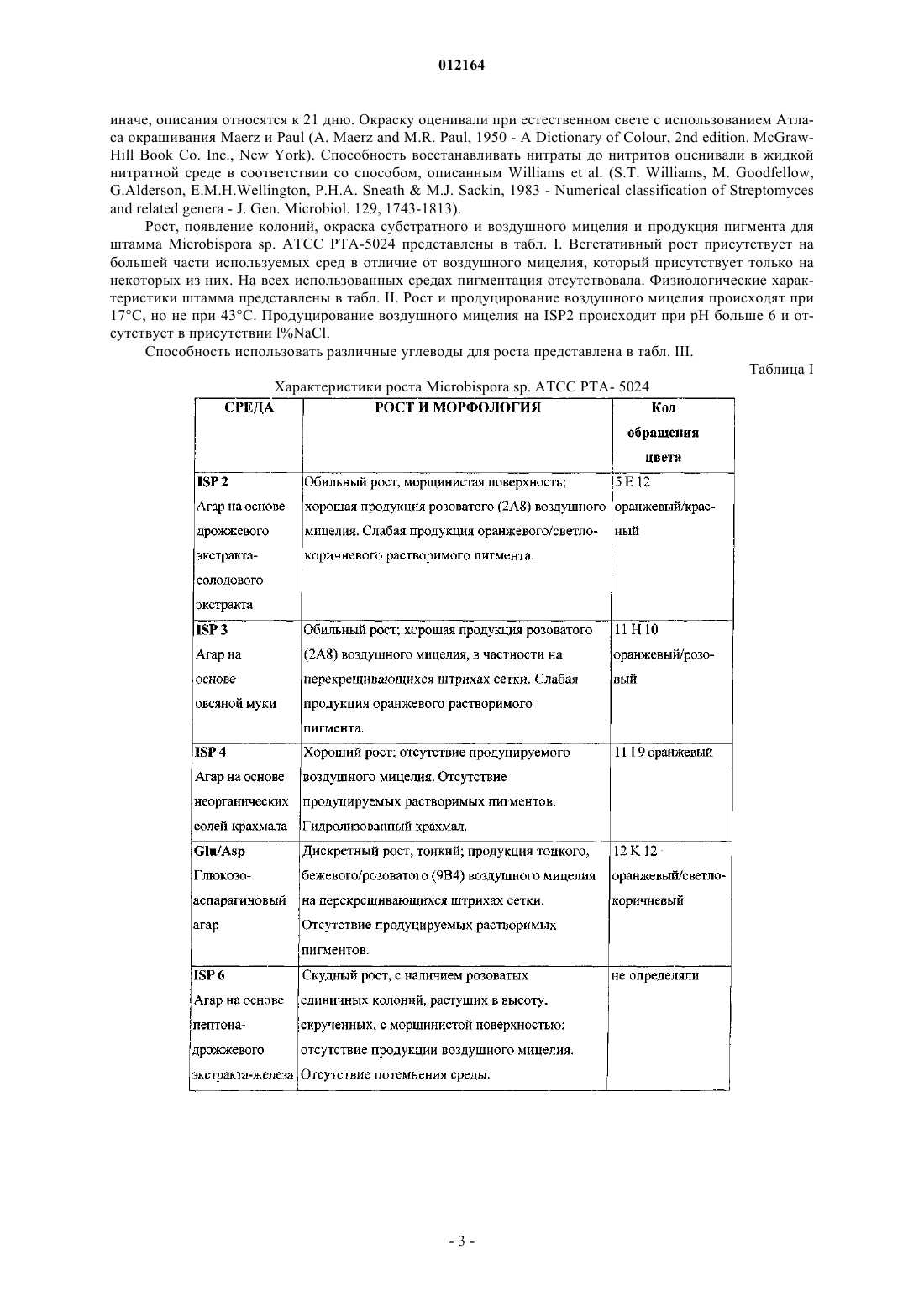
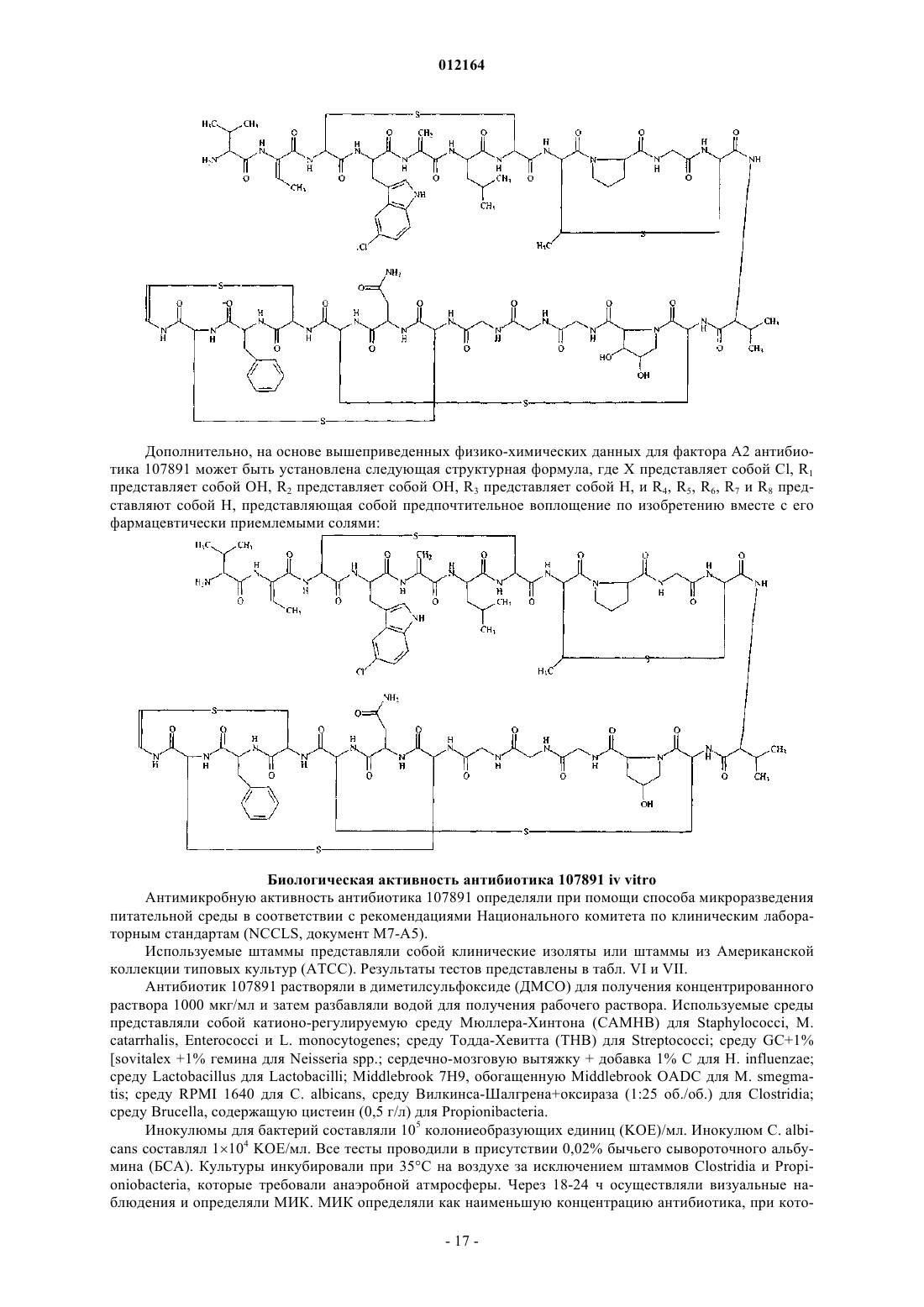
13. Антибиотический комплекс 107891, содержащий фактор А1 и фактор А2, представляющий собой белый порошок, обладающий следующими характеристиками:
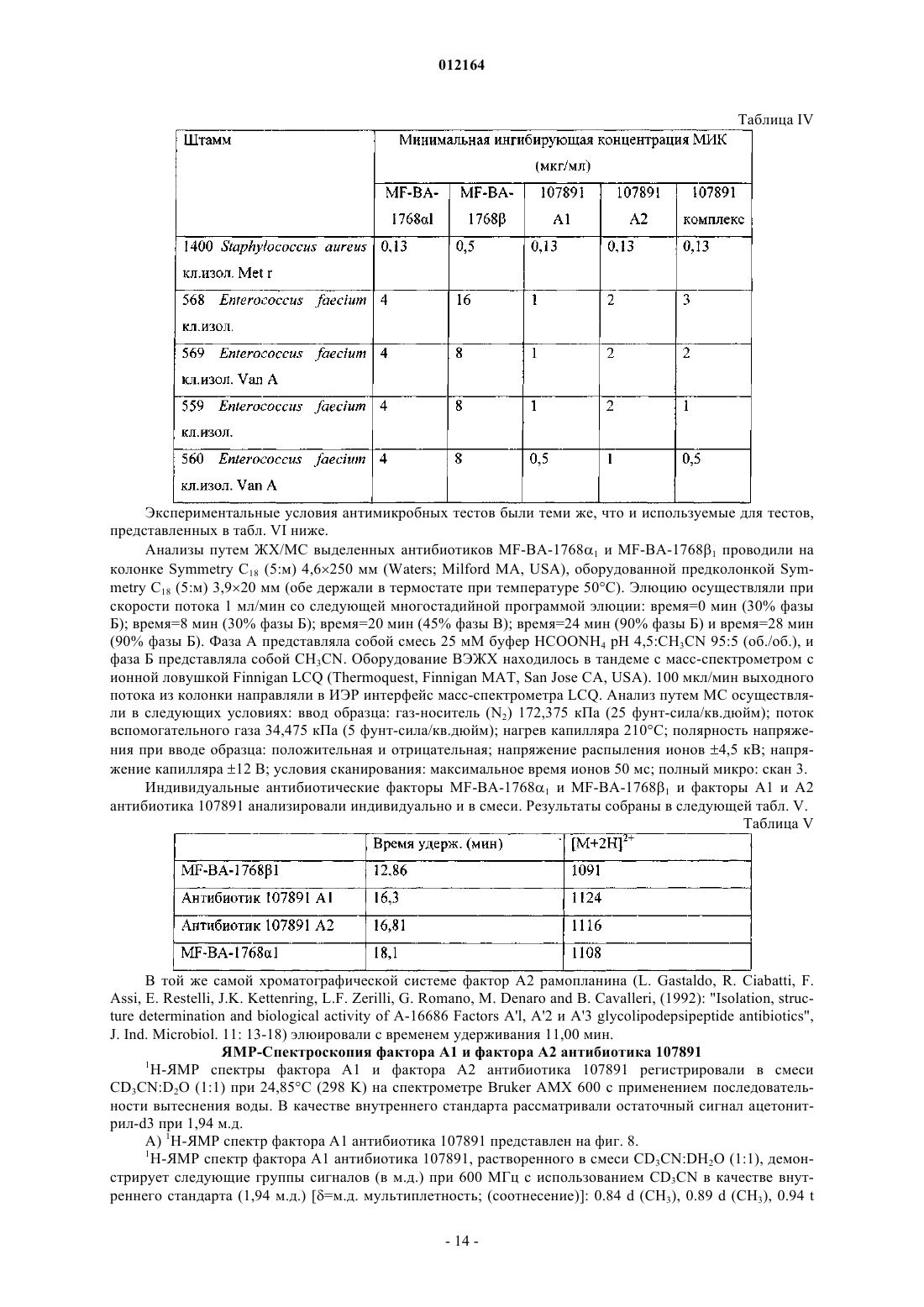
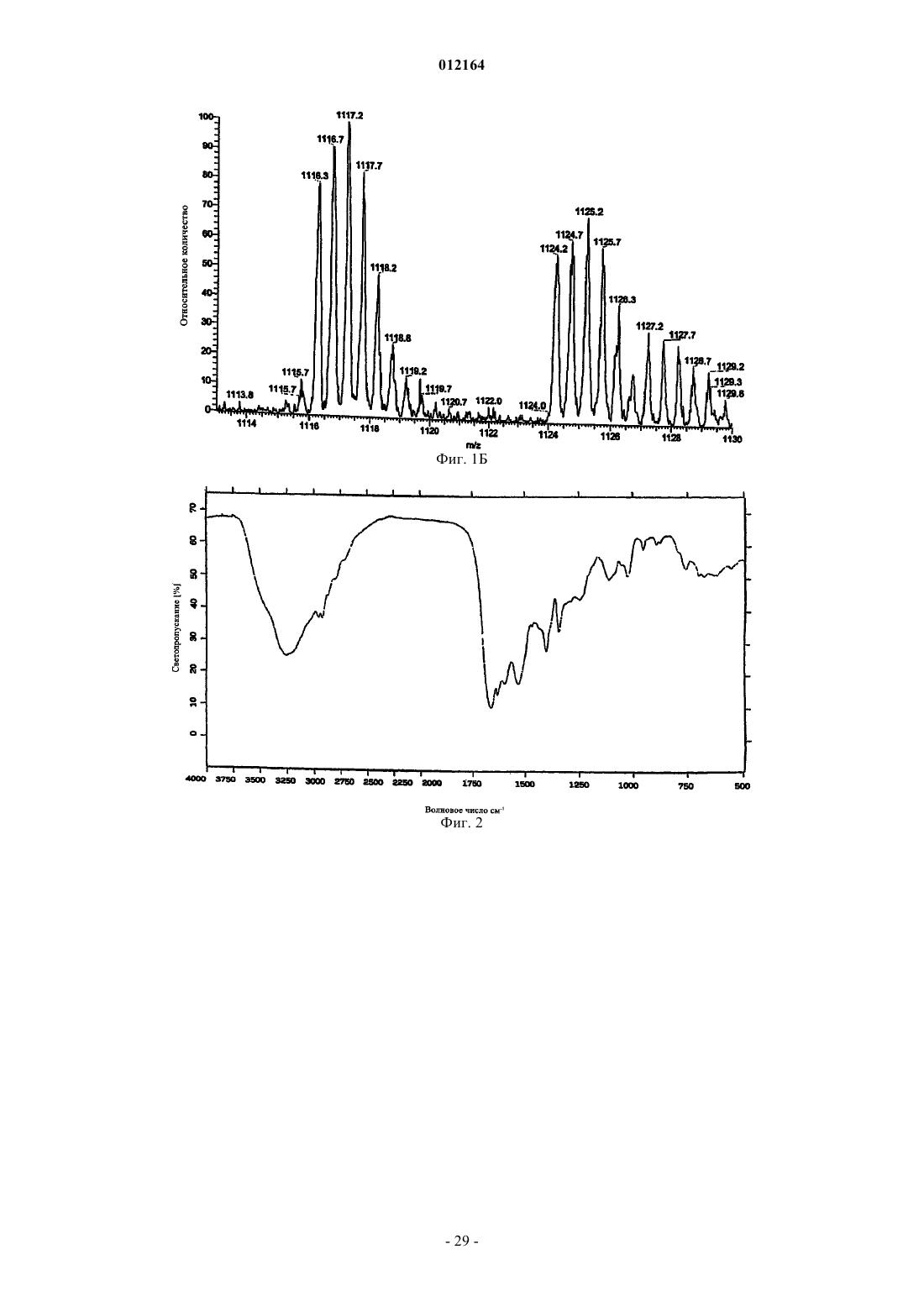
(А) масс-спектр, регистрируемый в растворе 0,2 мг/мл в смеси метанол:вода 80/20 (об./об.) с 0,1% трифторуксусной кислоты на аппарате Thermofinnigan LCQ deca, оборудованном источником электрораспыления, с использованием калибровочной смеси Thermofinnigan в следующих условиях электрораспыления: напряжение распыления - 4,7 кВ; температура капилляра - 220шС; капиллярное напряжение - 3В; режим инфузии - 10 мкл/мин, демонстрирующий два дважды протонированных иона с m/z 1124 и m/z 1116, соответствующих наименьшей изотопной композиции фактора А1 и А2 соответственно;
(Б) инфракрасный спектр, зарегистрированный в KBr с использованием спектрофотометра для инфракрасной спектрометрии с преобразованием Фурье Bruker FT-IR модель IFS 48, демонстрирует максимумы абсорбции при (см-1): 3263; 2929; 1661;1533; 1402; 1114; 1026;
(В) ультрафиолетовый (УФ) спектр в смеси метанол:Н2О 80:20 (об./об.) с использованием спектрофотометра Perkin-Elmer Lambda 16 демонстрирует два плеча при 226 и 267 нм;
(Г) спектр 1Н-ядерного магнитного резонанса (ЯМР), зарегистрированный при 600 МГц в смеси метанол-d4:Н2О (рН 4,3 HCl) 40:10 (об./об.) при 40шС на спектрометре Bruker AMX 600 с применением последовательности вытеснения воды и с использованием в качестве внутреннего стандарта остаточного сигнала метанол-d4 при 3,31 м.д., демонстрирует следующие сигналы [d=м.д. мультиплетность; (соотнесение)]: 0.93 d (CH3), 0.98 d (CH3), 1.07 t (перекрывающиеся СН3), 1.18 t (перекрывающиеся СН3), 1.26 s (CH3), 1.30 t (перекрывающиеся СН3), 1.62-1.74 m (СН2), 1.78 d (СН3), 1.80 d (СН3), 2.03 m (СН2), 2.24 m (CH), 2.36 m (CH2), 2.72-3.8 m (пептидные альфа СН), 3.8-5.2 m (пептидные альфа СН), 5.53-6.08 s (СН2), 5.62 d (CH двойной связи), 6.42 m (СН), 6.92 d (CH двойной связи), 7.0-7.55 m (ароматические СН), 7.62-10.4 d и m (ароматические и пептидные NH);
(Д) 13С-ЯМР спектр, зарегистрированный в смеси метанол-d4:Н2О (рН 4,3 HCl) 40:10 (об./об.) при 40шС на спектрометре Bruker AMX 600, с использованием в качестве внутреннего стандарта остаточного сигнала метанола-d4 при 49,15 м.д., демонстрирует следующие сигналы: [d=м.д.; (соотнесение)]: 13.6-23.2 (алифатические СН3), 26.16-73 (алифатические СН2 и пептидные альфа СН), 105-136 (ароматические СН и СН двойных связей и четвертичные атомы углерода), 164.3-176.3 (пептидные карбонилы);
(Е) кислотный гидролизат в 6н. HCl (105шС, 24 ч) демонстрирует присутствие следующих аминокислот наряду с другими неидентифицированными пиками после дериватизации с использованием 6-аминохинолил-N-гидроксисукцинимидилкарбамата: лантионин, метиллантионин, глицин, пролин, валин, аспарагиновая кислота (продукт гидролиза аспарагина), фенилаланин и лейцин;
(Ж) кислотный гидролизат в 4н. метансульфоновой кислоте, содержащей 0,2% (мас./об.) 3-(2-аминоэтил)индола в качестве катализатора (115шС, 16 ч), демонстрирует присутствие 5-хлортриптофана; и
(З) основная ионизируемая функция, обнаруживаемая путем кислотного/основного титрования, осуществляемого 0,01н. гидроксидом калия в смеси 2-метоксиэтанол (MCS):H2O 12:3 (об./об.), содержащей молярный избыток 0,01н. соляной кислоты.
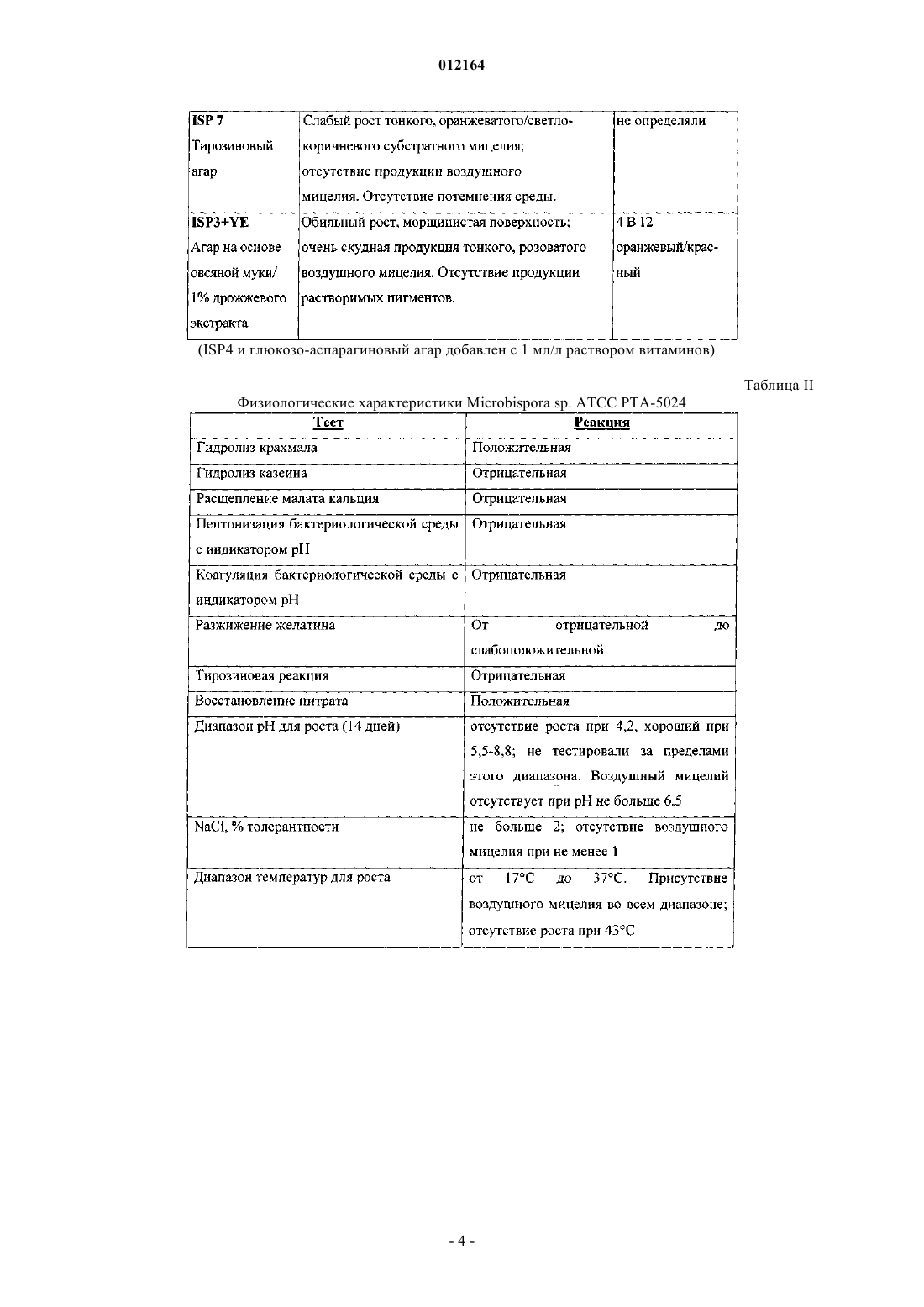
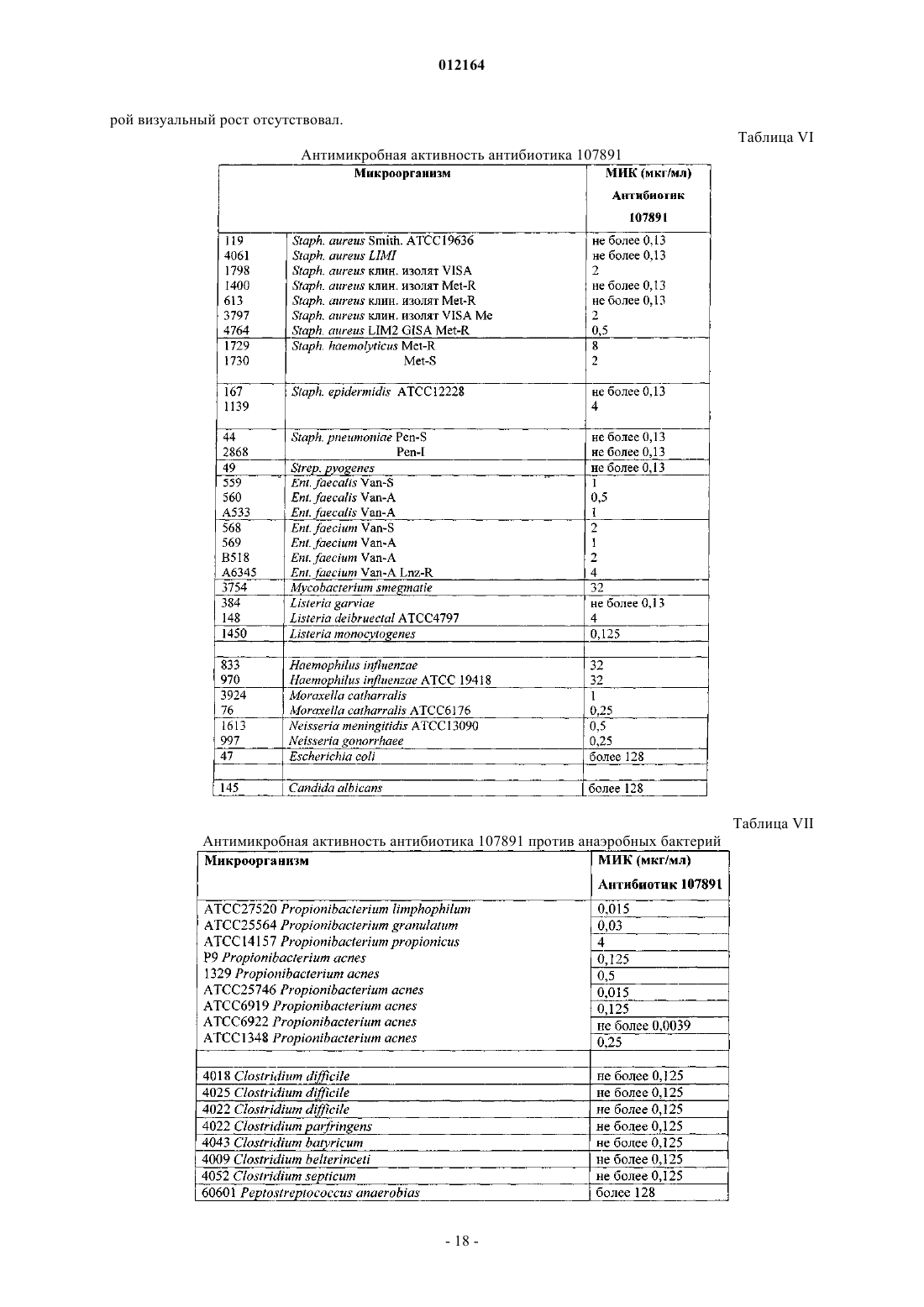
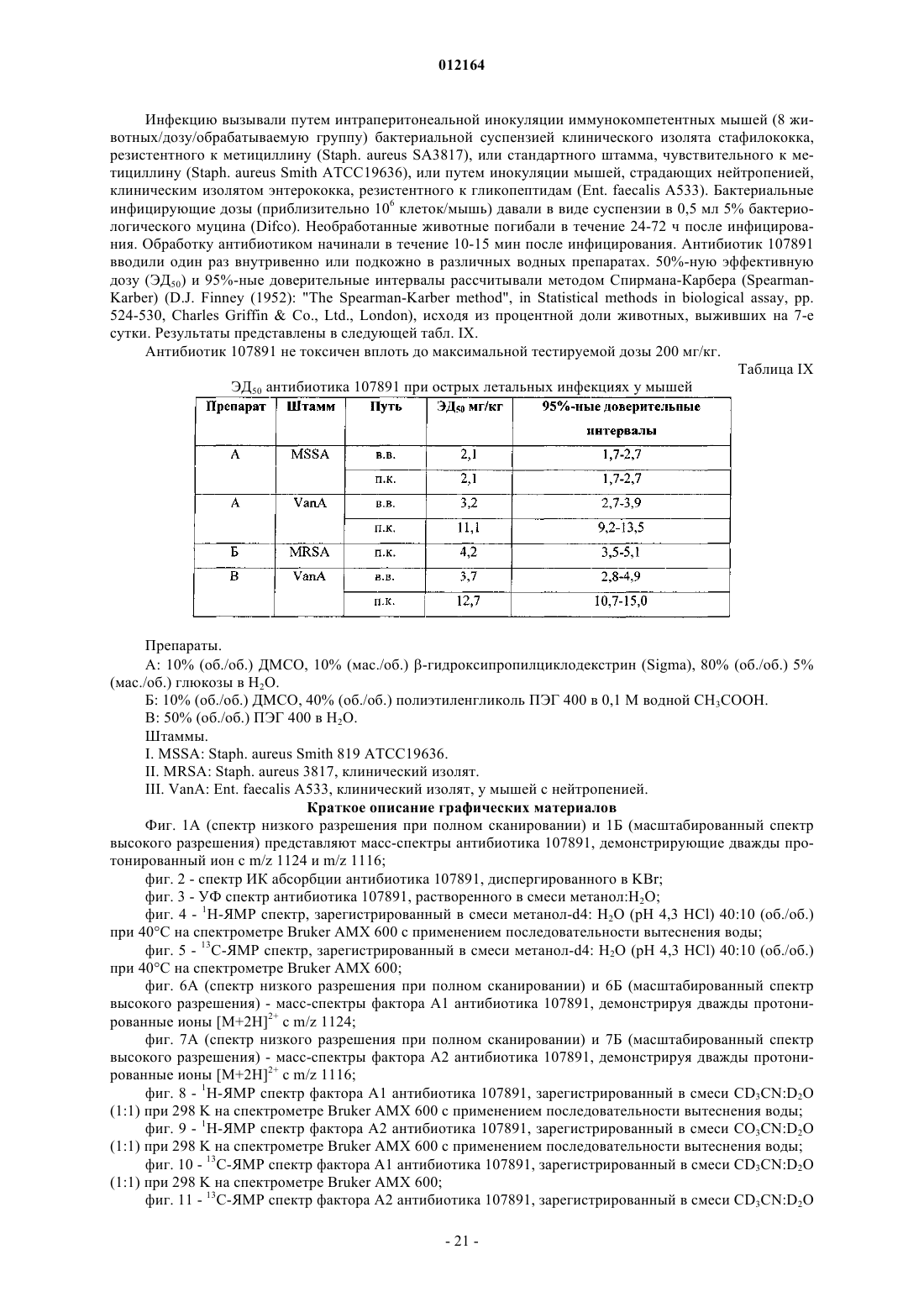
14. Фактор А1 антибиотика 107891, представляющий собой белый порошок, обладающий следующими характеристиками:
A) дважды протонированный ион с m/z 1124, соответствующий наименьшей изотопной композиции в масс-спектре, зарегистрированном в 0,1 мг/мл растворе в смеси ацетонитрил:вода 50:50 (об./об.) с 0,5% уксусной кислоты на аппарате Thermofinnigan LCQ deca, оборудованном источником электрораспыления, с использованием калибровочной смеси Thermofinnigan в следующих условиях электрораспыления: напряжение распыления - 4,7 кВ; температура капилляра - 250шС; капиллярное напряжение - 8В; режим введения - 10 мкл/мин;
Б) точная масса антибиотика, определенная с использованием 4,7 Т спектрометра Bruker Daltonics APEX II, оборудованного источником электрораспыления, соответствует молекулярной массе 2246,71+0,06, рассчитанной моноизотопной массе из [М+2Н]2+ с m/z 1124,36124 (точность 30 м.д.);
B) при растворении в смеси CD3CN:D2O (1:1) 1Н ЯМР спектр демонстрирует следующие группы сигналов (в м.д.) при 600 МГц с использованием CD3CN в качестве внутреннего стандарта (1,94 м.д.), [d=м.д., мультиплетность; (соотнесение)]: 0.84 d (СН3), 0.89 d (СН3), 0.94 t (перекрывающиеся СН3), 1.1 d (CH3), 1.13 d (CH3), 1.15 t (перекрывающиеся СН3), 149 m (СН2), 1.69 d (СН3), 1.75 m (СН2), 2.11 m (CH), 2.26 m (СН), 2.5 m (CH2), 2.68-3.8 m (пептидные СНb), 3.8-5.0 m (пептидные СНa), 5.45-6.17 s (СН2), 5.58 d (СН двойной связи), 6.36 m (СН), 6.86 d (CH двойной связи), 7.0-7.45 m (ароматические СН);
Г) при растворении в смеси CD3CN:D2O (1:1), 13С ЯМР спектр демонстрирует следующие сигналы (в м.д.) при 600 МГц с использованием CD3CN в качестве внутреннего стандарта (1,39 м.д.), [d=млн-1; (соотнесение)]: 13.6-23.03 (алифатические СН3), 25.69-77.9 (алифатические СН2 и пептидные СНa), 105-137.3 (ароматические СН и СН двойной связи и четвертичные атомы углерода), 165.6-176.6 (пептидные карбонилы);
Д) инфракрасный спектр, зарегистрированный в KBr с использованием спектрофотометра Bruker FT-IR модель IFS 48, демонстрирует максимумы абсорбции яЁш (см-1): 3294; 3059; 2926; 1661; 1529; 1433; 1407; 1287; 1114; 1021;
Е) ультрафиолетовый (УФ) спектр в смеси метанол:Н2О 80:20 (об./об.) с использованием спектрофотометра Perkin-Elmer Lambda 16 демонстрирует два плеча при 226 и 267 нм;
Ж) кислотный гидролизат в 6н. HCl (105шС, 24 ч) демонстрирует присутствие следующих аминокислот наряду с другими неидентифицированными пиками после дериватизации с использованием 6-аминохинолил-N-гидроксисукцинимидилкарбамата: лантионин, метиллантионин, глицин, пролин, валин, аспарагиновая кислота (продукт гидролиза аспарагина), фенилаланин и лейцин; и
З) кислотный гидролизат в 4н. метансульфоновой кислоте, содержащей 0,2% (мас./об.) 3-(2-аминоэтил)индола в качестве катализатора (115шС, 16 ч), демонстрирует присутствие 5-хлортриптофана.
15. Фактор А2 антибиотика 107891, представляющий собой белый порошок, обладающий следующими характеристиками:
A) дважды протонированный ион с m/z 1116, соответствующий наименьшей изотопной композиции в масс-спектре, зарегистрированном в 0,1 мг/мл растворе в смеси ацетонитрил:вода 50:50 (об./об.) с 0,5% уксусной кислоты на аппарате Thermofinnigan LCQ deca, оборудованном источником электрораспыления, с использованием калибровочной смеси Thermofinnigan в следующих условиях электрораспыления: напряжение распыления - 4,7 кВ; температура капилляра - 250шС; капиллярное напряжение - 8В; режим введения - 10 мкл/мин;
Б) точная масса, определенная с использованием 4,7 Т спектрометра Bruker Daltonics APEX II, оборудованного источником электрораспыления, соответствует молекулярной массе 2230,71+0,06, рассчитанной моноизотопной массе из [М+2Н]2+ с m/z 1115,36260 (точность 30 м.д.);
B) при растворении в смеси CD3CN:D2O (1:1) 1Н ЯМР спектр демонстрирует следующие группы сигналов (в м.д.) при 600 МГц с использованием CD3CN в качестве внутреннего стандарта (1,94 м.д.), [d=м.д., мультиплетность; (соотнесение)]: 0.84 d (СН3), 0.88 d (СН3), 0.94 d (СН3), 1.06 d (СН3), 1.14 d (CH3), 148 m (CH2), 1.65-1.75 m (СН2), 1.67 d (СН3), 2.15 m (СН), 2.25 m (СН), 2.5 m (CH2), 2.77-3.8 m (пептидные СНb), 3.8-4.9 m (пептидные СНa), 5.45-6.14 s (CH2), 5.59 d (CH двойной связи), 6.34 m (CH), 6.84 d (CH двойной связи), 7.0-7.42 m (ароматические СН);
Г) при растворении в смеси CD3CN:D2O (1:1), 13С ЯМР спектр демонстрирует следующие сигналы (в м.д.) при 600 МГц с использованием CD3CN в качестве внутреннего стандарта (1,39 м.д.), [d=м.д..; (соотнесение)]: 13.6-22.9 (алифатические СН3), 25.65-73 (алифатические СН2 и пептидные СНa), 105-137.3 (ароматические СН и СН двойной связи и четвертичные атомы углерода), 165.7-176.1 (пептидные карбонилы);
Д) инфракрасный спектр, зарегистрированный в KBr с использованием спектрофотометра Bruker FT-IR модель IFS 48, демонстрирует максимумы абсорбции при (см-1): 3296; 3060; 2928; 1661; 1529; 1433; 1407; 1288; 1116;
Е) ультрафиолетовый (УФ) спектр в смеси метанол:H2O 80:20 (об./об.) с использованием спектрофотометра Perkin-Elmer Lambda 16 демонстрирует два плеча при 226 и 267 нм;
Ж) кислотный гидролизат в 6н. HCl (105шС, 24 ч) демонстрирует присутствие следующих аминокислот наряду с другими неидентифицированными пиками после дериватизации с использованием 6-аминохинолил-N-гидроксисукцинимидилкарбамата: лантионин, метиллантионин, глицин, пролин, валин, аспарагиновая кислота (продукт гидролиза аспарагина), фенилаланин и лейцин; и
З) кислотный гидролизат в 4н. метансульфоновой кислоте, содержащей 0,2% (мас./об.) 3-(2-аминоэтил)индола в качестве катализатора (115шС, 16 ч), демонстрирует присутствие 5-хлортриптофана.
16. Способ получения антибиотика 107891 и его факторов А1 и А2 и их солей с кислотами, включающий стадии
культивирования культуры Microbispora sp. АТСС РТА-5024 или его варианта или мутанта с сохранением способности продуцировать указанный антибиотик в аэробных условиях в водной питательной среде, содержащей ассимилируемый источник углерода, азота и неорганических солей;
выделения получающегося в результате антибиотика из мицелия и/или профильтрованного ферментационного бульона и
очистки выделенного антибиотика 107891.
17. Способ по п.16, при котором штамм Microbispora sp. АТСС РТА-5024 или его вариант или мутант, продуцирующий антибиотик 107891, подвергают предварительному культивированию.
18. Способ по п.16, при котором выделение антибиотика 107891 осуществляют путем фильтрования ферментационного бульона и антибиотик выделяют из профильтрованного ферментационного бульона методом, выбранным из группы, состоящей из экстракции не смешивающимся с водой растворителем, осаждения путем добавления нерастворителя или путем изменения рН раствора, абсорбционной хроматографии, распределительной хроматографии, распределительной хроматографии с обращенной фазой, ионообменной хроматографии, молекулярной вытеснительной хроматографии и комбинации двух или более указанных методов.
19. Способ по п.16, при котором выделение антибиотика 107891 осуществляют путем отделения мицелия от супернатанта ферментационного бульона и мицелий экстрагируют смешивающимся с водой растворителем, посредством чего после удаления отработанного мицелия получают смешивающийся с водой раствор, содержащий неочищенный антибиотик, который может быть обработан отдельно или вместе с профильтрованным ферментационным бульоном для выделения антибиотика 107891 методом, выбранным из группы, состоящей из экстракции растворителем, осаждения путем добавления нерастворителя или путем изменения рН раствора, абсорбционной хроматографии, распределительной хроматографии, распределительной хроматографии с обращенной фазой, ионообменной хроматографии и молекулярной вытеснительной хроматографии и комбинации двух или более указанных методов.
20. Способ по п.19, при котором концентрацию смешивающегося с водой растворителя в экстракте мицелия понижают до того, как его подвергают обработке для выделения из него антибиотика.
21. Способ по п.18, при котором профильтрованный ферментационный бульон приводят в контакт с абсорбирующей смолой и указанную смолу подвергают элюции полярным смешивающимся с водой растворителем или его смесью с водой, в результате чего получают раствор, содержащий неочищенный антибиотик 107981.
22. Способ по п.21, при котором абсорбирующая смола выбрана из группы, состоящей из полистирола, смешанного полистирола-дивинилбензола и полиамидной смолы.
23. Способ по п.19, при котором мицелий экстрагируют С1-С3алканолом и экстракт мицелия приводят в контакт с абсорбирующей смолой и элюируют из нее полярным смешивающимся с водой растворителем или его смесью с водой, в результате чего получают раствор, содержащий неочищенный антибиотик 107891.
24. Способ по п.18, при котором растворы, содержащие неочищенный антибиотик 107891, объединяют и обрабатывают для дополнительной очистки указанного антибиотика 107891.
25. Способ по п.21, при котором раствор, содержащий неочищенный антибиотик 107981, концентрируют и затем сушат замораживанием с получением твердого продукта неочищенного антибиотика 107891.
26. Способ по п.21, при котором объединяют абсорбирующие смолы, содержащие абсорбированный антибиотик, и их смесь элюируют полярным смешивающимся с водой растворителем или его смесью с водой.
27. Способ по п.16, при котором антибиотик 107981 очищают при помощи хроматографии, предпочтительно путем препаративной жидкостной хроматографии высокого давления (ЖХВД) или хроматографии среднего давления.
28. Способ по п.16, при котором фактор А1 и фактор А2 при помощи препаративной ЖХВД выделяют из очищенного антибиотшър 107891.
29. Фармацевтическая композиция, содержащая антибиотик, выбранный из антибиотика 107891, фактора А1 антибиотика 107891, фактора А2 антибиотика 107891 и смеси указанных факторов в любом соотношении или их фармацевтически приемлемой соли с кислотой, и фармацевтически приемлемый носитель.
30. Антибиотик 107891, его фактор А1, его фактор А2 или смесь указанных факторов в любом соотношении или их фармацевтически приемлемая соль с кислотой для применения в качестве лекарственного средства.
31. Применение антибиотика 107891, его фактора А1, его фактора А2 или смеси указанных факторов в любом соотношении или их фармацевтически приемлемой соли с кислотой для изготовления лекарственного средства для лечения или предупреждения бактериальных инфекций.
32. Применение антибиотика 107891, его фактора А1, его фактора А2 или смеси указанных факторов в любом соотношении и их нетоксичной соли с кислотой в качестве стимулятора роста животного.
33. Штамм Microbispora sp. АТСС РТА-5024, или его вариант, или мутант, сохраняющий способность продуцировать антибиотик 107891 при выращивании культуры в глубинных аэробных условиях в присутствии ассимилируемых источников углерода, азота и неорганических солей.
Текст
012164 Эта заявка представляет собой международную заявку, основанную на заявке на патент США, поданной 12 января 2005 г., которая представляет собой частично продолжающуюся заявку заявки на патент США, поданной 11 января 2005 г., представляющей собой 371 национальной заявки РСТ/ЕР 2004/007658, поданной 12 июля 2004 г., заявляющей о приоритете согласно заявке на европейский патент 03016306.7, поданной 18 июля 2003 г., все из которых определенно включены путем ссылки. Настоящее изобретение относится к антибиотическому веществу микробного происхождения, произвольно обозначаемому как антибиотик 107891, представляющему собой комплекс, содержащий факторы А 1 и А 2, его фармацевтически приемлемым солям, фармацевтическим композициям и их применению в качестве антибактериального агента. Еще одним объектом настоящего изобретения является способ получения антибиотика 107891,включающий культивирование Microbispora sp. 107891 (далее идентифицированного как Microbispora sp. АТСС РТА-5024) или его варианта или мутанта, с сохранением его способности продуцировать указанный антибиотик, выделение антибиотика по изобретению из мицелия и/или из ферментационного бульона, выделение чистого вещества при помощи хроматографических средств и отделение факторов А 1 и А 2. Антибиотик 107891 представляет собой новый антимикробный агент, имеющий пептидную структуру, содержащую в качестве составляющих лантионин и метиллантионин. Они представляют собой типичные характеристики лантибиотиков и, в частности, подгруппы, действующей прежде всего на биосинтез клеточной стенки. Лантибиотики представляют собой пептиды, содержащие тиоэфирную аминокислоту лантионин, а также несколько других модифицированных аминокислот (Н.G. Sahl and G. Bierbaum, (1998) "Lantibiotics: biosynthesis and biological activities of uniquely modified peptides from gram-positive bacteria", Ann. Rev.Microbiol. 52: 41-79). Большая часть известных лантибиотиков обладает антибактериальной активностью,хотя о некоторых сообщалось, что они являются активными в отношении других фармакологических мишеней. Антибактериальные лантибиотики могут быть в общем виде разделены на две группы на основе их структур: лантибиотики типа-А представляют собой, как правило, удлиненные амфифильные пептиды, тогда как лантибиотики типа-В являются компактными и глобулярными (О. McAuliffe, R.P. Rossand С. Hill, (2001): "Lantibiotics: structure, biosynthesis and mode of action", FEMS Microb. Rev. 25: 285308). Низин является типичным представителем лантибиотиков типа А, тогда как актагардин (гардимицин) и мерсацидин относятся к подклассу лантибиотиков типа В. Лантибиотики типа низина и типа мерсацидина взаимодействуют с липидом II, предшественником связанных с мембраной пептидогликанов,хотя эти два класса отличаются действиями, которые они оказывают в процессе бактериальной пролиферации. Лантибиотики низинового типа прежде всего убивают бактерии путем пермеабилизации цитоплазматической мембраны (Н. Brotz, M. Josten, I. Wiedemann, U. Schneider, F. Gotz, G. Bierbaum and H.G.other lantibiotics", Mol. Microbiol. 30: 317-27), тогда как лантибиотики мерсацидинового типа прежде всего убивают бактериальную клетку путем ингибирования биосинтеза клеточной стенки (Н. Brotz, G. Bierbaum, K. Leopold, P.E. Reynolds and H.G. Sahl (1998): "The lantibiotic mersacidin inhibits peptidoglycan synthesis by targeting lipid II", Antimicrob Agents Chemother. 42: 154-60). Два антибиотика, продуцируемых Microbispora corallina штамм NRRLL 30420, идентифицированные соответственно как антибиотик MF-BA-17681 и MF-BA-17681, описаны в US 6551591 В 1. Физикохимические данные, представленные в вышеуказанном патенте (например, данные масс-спектрометрии,молекулярная масса, содержание аминокислот) и сравнение времен удерживания в экспериментальных анализах путем жидкостной хроматографии/масс-спектрометрии (ЖХ-МС) ясно демонстрируют, что антибиотический комплекс 107891, а также его компоненты фактор А 1 и фактор А 2 представляют собой химические соединения, отличающиеся от антибиотиков MF-BA 17681 и MF-BA-17681. ЕР 0592835 А 2 описывает противоопухолевые антибиотики BU-4803TA1, А 2, В, C1, C2 и D. Антибиотики BU-4803TA1A2, и В выделяют из ферментационного бульона Microbispora АТСС 55327 (АА 9966), тогда как антибиотики BU4803TC1 C2 и D представляют собой продукты трансформации антибиотика BU 4803 ТА 1, А 2 и В соответственно, когда эти продукты хранят в диметилсульфоксиде. Физико-химические данные, о которых сообщается в ЕР 0592835 А для вышеприведенных антибиотиков (например, поглощение ультрафиолета (УФ), молекулярная масса, противоопухолевая активность) очевидно демонстрируют, что они представляют собой химические вещества, отличающиеся от антибиотического комплекса 107891 и его факторов А 1 и А 2. Штамм и ферментацияMicrobispora sp. 107891 выделили из окружающей среды и 27 февраля 2003 г. депонировали в Американской коллекции типовых культур (American Type Culture Collection) (ATCC), 10801 University Blvd,Manassas VA, 20110-2209 USA, в соответствии с Будапештским договором. Штамму был присвоен номер РТА-5024. Продукцию антибиотика 107891 осуществляют путем культивирования штамма Microbispora sp.,способного продуцировать его, т.е. Microbispora sp. ATCC РТА-5024 или его варианта или мутанта, с-1 012164 поддержанием их способности продуцировать указанный антибиотик; выделения получающегося в результате антибиотика из цельного культурального бульона и/или из выделенного мицелия, и/или из профильтрованного ферментационного бульона; и очистки выделенного антибиотика при помощи хроматографических средств. В любом случае предпочтительно продуцировать антибиотик 107891 в аэробных условиях в водной питательной среде, содержащей легко ассимилируемые источники углерода, азота и неорганические соли. Может быть использовано множество питательных сред, обычно используемых в области ферментации, тем не менее, предпочтительны некоторые среды. Предпочтительные источники углерода представляют собой сахарозу, фруктозу, глюкозу, ксилозу и т.п. Предпочтительные источники азота представляют собой соевую муку, пептон, мясной экстракт,дрожжевой экстракт, триптон, аминокислоты, гидролизованный казеин и т.п. Среди неорганических солей, которые могут быть включены в культуральные среды, имеются традиционные растворимые соли,способные к обеспечению ионами натрия, калия, железа, цинка, кобальта, магния, кальция, аммония,хлоридом, карбонатом, сульфатом, фосфатом, нитратом и подобными ионами. Предпочтительно штамм, продуцирующий антибиотик 107891, предварительно культивируют в бродильной трубке или качалочной колбе, затем культуру используют для инокуляции ферментационных сосудов для продуцирования значительных количеств веществ. Среда, используемая для предварительного культивирования, может быть той же самой, что и используемая для более масштабных ферментаций, но также могут быть использованы другие среды. Штамм, продуцирующий антибиотик 107891, можно выращивать при температуре от 17 до 37 С, причем оптимальная температура составляет приблизительно 28-30 С. Продуцирование антибиотика 107891 в ходе ферментации можно контролировать путем биоанализа на чувствительных микроорганизмах и/или посредством ВЭЖХ (высокоэффективная жидкостная хроматография) анализов. Максимальная продукция антибиотика 107891 как правило имеет место приблизительно между 90 и 200 часами ферментации. Антибиотик 107891 продуцируют путем культивирования Microbispora sp. АТСС РТА-5024 или его варианта или мутанта, способного продуцировать антибиотик 107891, и он обнаружен в культуральных бульонах и/или в мицелии. В этом описании и формуле изобретения термин "антибиотик 107891", если не указано иначе, определяет антибиотический комплекс 107891, содержащий факторы А 1 и А 2. Морфологические характеристики Microbispora sp. АТСС РТА-5024Microbispora sp. АТСС РТА-5024 хорошо растет в различных стандартных твердых средах. Микроскопические размеры измеряли с использованием культуры, выращенной на агаре с гуминовой кислотой и солями микроэлементов (состав в г/д: гуминовая кислота 0,5, FeSO47H2O 0,001, MnCl24 Н 2 О 0,001,ZnSO47H2O 0,001, NiSO46H2O 0,001, MOPS 2, агар 20) с добавлением 1 мл/л раствора витаминов (тиамина гидрохлорид 25 мг/л, пантотенат кальция 250 мг/л, никотиновая кислота 250 мг/л, биотин 0,5 мг/л,рибофлавин 1,25 г/л, цианокобаламин 6,25 мг/л, парааминобензойная кислота 25 мг/л, фолиевая кислота 500 мг/л, пиридоксаля гидрохлорид 500 мг/л). В жидкой культуре (среда V6, состав в г/л: декстроза 22, мясной экстракт 5, дрожжевой экстракт 5,казеин 3, NaCl 1,5) не обнаружена фрагментация мицелия после 6 дней роста при 28 С. Микроскопическое исследование на агаре с гуминовой кислотой и солями микроэлементов (через 21 день инкубации при 28 С) выявляет разветвленный нефрагментированный субстратный мицелий и моноподиально разветвленный воздушный мицелий; также различимо множество длинных, прямых и слаборазветвленных воздушных гиф. Характерные продольные пары спор закачанчиваются короткими спорофорами, латерально происходящими из ветвей или непосредственно из основных воздушных гиф. Споры сферические и неподвижные. Тельца, напоминающие спорангий, или другие особые структуры не обнаружены. Культуральные характеристики Microbispora sp. АТСС РТА-5024Microbispora sp. АТСС РТА-5024 в течение шести дней выращивали в жидкой среде AF/MS (см. пример 1) при 28 С и 200 об./мин, затем переносили (5% инокулюма) в новую жидкую среду AF/MS и выращивали в течение еще 6 дней и затем инокулировали (7% инокулюма) в 100 мл жидкой среды V6(см. пример 1). После выращивания в течение 6 дней при 28 С и 200 об./мин мицелий собирали путем центрифугирования и трижды промывали стерильным физиологическим раствором, затем разбавляли с получением подходящего инокулюма. Аликвоты суспензии поперечными штрихами наносили на различные среды, рекомендованные Shirling и Gottlieb (E.В. Shirling and D. Gottlieb, (1966): "Method forS.A. Waksman (1961): "The Actinomycetes", The Williams and Wilkins Co., Baltimore. Vol.2: 328-334). Способность использовать различные углеводы в качестве источника углерода и энергии определяли с использованием среды ISP4 без крахмала с добавлением 1 мл/л описанного выше раствора витаминов в качестве базовой среды; каждый источник углерода добавляли в конечной концентрации 1%(мас./об.). Устойчивость к NaCl, диапазон рН для роста, а также способность расти при различных температурах определяли на среде ISP2. Все среды инкубировали при 28 С в течение трех недель; если не указано-2 012164 иначе, описания относятся к 21 дню. Окраску оценивали при естественном свете с использованием Атласа окрашивания Maerz и Paul (A. Maerz and M.R. Paul, 1950 - A Dictionary of Colour, 2nd edition. McGrawHill Book Co. Inc., New York). Способность восстанавливать нитраты до нитритов оценивали в жидкой нитратной среде в соответствии со способом, описанным Williams et al. (S.Т. Williams, M. Goodfellow,G.Alderson, E.M.H.Wellington, P.H.A. SneathM.J. Sackin, 1983 - Numerical classification of Streptomycesand related genera - J. Gen. Microbiol. 129, 1743-1813). Рост, появление колоний, окраска субстратного и воздушного мицелия и продукция пигмента для штамма Microbispora sp. АТСС РТА-5024 представлены в табл. I. Вегетативный рост присутствует на большей части используемых сред в отличие от воздушного мицелия, который присутствует только на некоторых из них. На всех использованных средах пигментация отсутствовала. Физиологические характеристики штамма представлены в табл. II. Рост и продуцирование воздушного мицелия происходят при 17 С, но не при 43 С. Продуцирование воздушного мицелия на ISP2 происходит при рН больше 6 и отсутствует в присутствии l%NaCl. Способность использовать различные углеводы для роста представлена в табл. III. Таблица I Характеристики роста Microbispora sp. ATCC РТА- 5024-4 012164 Таблица III Использование источников углерода Microbispora sp. АТСС РТА-5024 обильный;хороший рост; + умеренный рост; +/- ограниченный рост; - отсутствие роста; воздушный мицелий всегда отсутствует. Хемотаксономические характеристики Microbispora sp. ATCC РТА-5024Microbispora sp. ATCC РТА-5024 выращивали в среде GYM (глюкоза 4 г/л; дрожжевой экстракт 4 г/л; солодовый экстракт 10 г/л) при 28 С на роторной качалке, мицелий собирали, дважды промывали стерильной дистиллированной водой и затем сушили замораживанием. Анализы аминокислот осуществляли в соответствии со способом Staneck и Roberts (J.L. Staneck and G.D. Roberts (1974): "Simplified approach to identification of aerobic actinomycetes by thin-layer chromatography", Appl. Microbiol. 28: 226-231). Менахиноны и полярные липиды экстрагировали в соответствии со способом Minnikin et al. (D.E. Minnikin, A.G. O'Donnell, M. Goodfellow, G. Alderson, M. Athalye, A. Schaal и J.H. Parlett (1984): "An integratedprocedure of isoprenoid quinones and polar lipids", J. Microbiol. Meth. 2: 233-241). Полярные липиды анализировали соответственно посредством тонкослойной хроматографии (D.Е. Minnikin, V. Patel, L. Alshamaony, and M. Goodfellow (1977): "Polar lipid composition in the classification of Nocardia and relatedbacteria", Int. J. Syst. Bacteriol. 27: 104-117), менахиноны - посредством высокоэффективной жидкостной хроматографии (ВЭЖХ) (R.M. Kroppenstedt (1982): "Separation of bacterial menaquinones by HPLC usingMinnikin eds, Academic Press, London), а метиловые эфиры жирных кислот - посредством газожидкостной хроматографии (L.Т. Miller (1982): "A single derivatization method for bacterial fatty acid methyl esters including hydroxy acids", J. Clin. Microbiol. 16: 584-586; M. Sasser (1990): "Identification of bacteria by gaschromatography of cellular fatty acids", USFCC News Letters 20: 1-6). Присутствие миколовых кислот проверяли с помощью метода, предложенного Minnikin et al. (D.E. Minnikin, L. Alshamaony, and M. Goodfellow (1975): "Differentiation of Mycobacterium, Nocardia and related taxa by thin layer chromatographic analysis of whole organism methanolyzates", J. Gen. Microbiol. 88: 200-204). Гидролизаты целых клеток штамма Microbispora sp. ATCC PTA-5024 содержат мезодиаминопимелиновую кислоту в виде диаминокислоты пептидогликана. Преобладающие менахиноны представляют собой MK-9 (III, VIII-H4), MK-9 (Н 2) и MK-9 (Н 0). Картина полярных липидов характеризуется наличием фосфолипида, содержащего фосфатидилэтаноламин, метилфосфатидилэтаноламин,фосфатидилглицерин, дифосфатидилглицерин, фосфатидилинозит, фосфатидилинозитманнозиды и Nацетилглюкозамин, т.е. фосфолипида IV типа в соответствии с Lechevalier et al. (H.A. Lechevalier, С. DeBrieve and M.P. Lechevalier (1977): "Chemotaxonomy of aerobic actinomycetes: phospholipid composition",Biochem. Syst. Ecol. 5: 246-260). Основные компоненты паттерна жирных кислот представляют собойGoodfellow and D.E. Minnikin eds, Academic Press, London). Миколовые кислоты не обнаружены. Определение последовательности 16S рДНК Microbispora sp. ATCC PTA-5024 Частичную последовательность гена 16 рРНК (16S рДНК), т.е. 1443 нуклеотида, соответствующей 95% полноразмерной рРНК штамма Microbispora sp. ATCC PTA-5024, получили в соответствии с опуб-5 012164 ликованными методами (P. Mazza, P. Monciardini, L. Cavalettu M. Sosio and S. Donadio (2003): "DiversitySEQ ID NO 1. Эту последовательность сравнивали с последовательностью штамма Microbispora corallina NRRL 30420 (MF-BA-1768), которая приведена в US 6551591 В 1. Две последовательности выравнивали и различия обнаружили в 3.1 из 1456 выровненных позиций, что составляло общее различие в последовательности 2,13%. Любые два штамма, имеющие менее чем 97,5%-ную идентичность последовательностей,обычно относятся к различным видам (Stackebrandt, E. and Embley, M.Т. (2000) "Diversity of UnculteredD.J. Grimes (eds). ASM, Press, Washington DC, pp. 57-75). Таким образом, 2%-ный уровень различия последовательностей является весьма высоким (Rossello-Mora, R., and Amann, R. (2001). "The Species Concept for Prokaryotes". FEMS Microbiol. Rev. 25: 39-67) и указывает на то, что Microbispora sp. АТСС РТА 5024 и Microbispora corallina NRRL 30420 (MF-BA-1768) представляют собой различные штаммы. Идентификация штамма Microbispora sp. АТСС РТА-5024 Штамм, продуцирующий антибиотик 107891, относят к роду Microbispora, семейство Streptosporangiaceae, в силу следующих хемотаксономических и морфологических характеристик: присутствие мезодиаминопимелиновой кислоты в клеточной стенке; большое количество MK-9 (III, VIII-H4) и фосфолипидов IV типа в соответствии с Lechevalier et al.phospholipid composition", Biochem. Syst. Ecol. 5:246-260); профиль жирных кислот 3 с sensu Kroppenstedt (R.M. Kroppenstedt (1992): "The genus Nocardiopsis",in: The Prokariotes, Vol. II, pp. l 139-1156, A. Balows, H. Truper, M. Dworkin, W. Harder and K.H. Schleifereds; New York, Springer-Verlag); отсутствие миколовых кислот; образование характерных продольных пар спор на верхушках коротких спорофоров, латерально ветвящихся от воздушных гиф. Неподвижные споры; частичная последовательность гена 16 рРНК (16S рДНК), т.е. 1443 нуклеотидов, соответствующая 95% полноразмерной рРНК, представленная в SEQ ID No. 1, демонстрирующая более чем 97%-ную идентичность с последовательностями 16S рДНК описанных видов Microbispora. Как с другими микроорганизмами, характеристики штамма, продуцирующего антибиотик 107891,подвержены вариации. Например, искусственные варианты и мутанты штамма могут быть получены путем обработки различными известными мутагенами, такими как ультрафиолетовые (УФ) лучи, химические вещества, такие как азотистая кислота, N-метил-N'-нитро-N-нитрозогуанидин, и множество других. Все природные и искусственные варианты и мутанты штамма Microbispora sp. АТСС РТА-5024, способные продуцировать антибиотик 107891, считаются эквивалентными ему для целей данного изобретения и, таким образом, входят в объем изобретения. Экстракция и очистка антибиотика 107891 Как упомянуто выше, обнаружено, что антибиотик 107891 почти равным образом распределен как в мицелии, так и в профильтрованной фракции ферментационного бульона. Собранный бульон может быть подвергнут отделению мицелия от супернатанта ферментационного бульона, и мицелий может быть экстрагирован смешивающимся с водой растворителем с получением раствора, содержащего антибиотик 107891, после удаления истощенного мицелия. Этот экстракт мицелия затем может быть обработан отдельно или вместе с супернатантом в соответствии со способами, которые приведены далее для фракции супернатанта. Когда смешивающийся с водой растворитель может оказывать влияние на операции выделения антибиотика из экстракта мицелия, этот смешивающийся с водой растворитель может быть удален путем отгонки или может быть разбавлен водой до концентрации, которая не оказывает влияния. Используемый в данной заявке термин "смешивающийся с водой растворитель" имеет значение, в настоящее время присвоенное в области техники этому термину и относится к растворителям, которые в условиях применения смешиваются с водой в достаточно широком диапазоне концентраций. Примеры смешивающихся с водой органических растворителей, которые могут быть использованы в экстракции соединений по изобретению, представляют собой низшие алканолы, например (С 1-С 3)алканолы, такие как метанол, этанол и пропанол; фенил(С 1-С 3)алканолы, такие как бензиловый спирт; низшие кетоны,например (С 3-С 4)кетоны, такие как ацетон и этилметилкетон; циклические эфиры, такие как диоксан и тетрагидрофуран; гликоли и их продукты частичной этерификации, такие как этиленгликоль, пропиленгликоль и монометиловый эфир этиленгликоля, низшие амиды, такие как диметилформамид и диэтилформамид; диметилсульфоксид уксусной кислоты и ацетонитрил. Выделение соединения из супернатанта ферментационного бульона продуцирующего микроорганизма осуществляют в соответствии с известными методами, включающими экстракцию растворителями, осаждение путем добавления нерастворителей или путем изменения рН раствора, путем распределительной хроматографии, распределительной хроматографии с обращенной фазой, ионообменной хроматографии, молекулярной вытеснительной хроматографии и т.п. или комбинации двух или более чем двух-6 012164 из указанных способов. Процедура выделения соединений по изобретению из отфильтрованного ферментационного бульона включает экстракцию антибиотика 107891 смешивающимися с водой органическими растворителями с последующим осаждением из концентрированных экстрактов, возможно путем добавления осаждающего агента. Также в этом случае используемый в этой заявке термин "несмешивающийся с водой растворитель" имеет значение, в настоящее время присвоенное в области техники указанному термину и относится к растворителям, которые в условиях применения слабо смешиваются или практически не смешиваются с водой в достаточно широком диапазоне концентраций, подходящих для предполагаемого применения. Примеры несмешивающихся с водой органических растворителей, которые могут быть использованы в экстракции соединений по изобретению из ферментационного бульона, представляют собой алканолы, состоящие по меньшей мере из четырех атомов углерода, которые могут быть линейными, разветвленными или циклическими, такие как н-бутанол, 1-пентанол, 2-пентанол, 3-пентанол, 1-гексанол, 2 гексанол, 3-гексанол, 3,3-диметил-1-бутанол, 4-метил-1-пентанол, 3-метил-1-пентанол, 2,2-диметил-3 пентанол, 2,4-диметил-3-пентанол, 4,4-диметил-2-пентанол, 5-метил-2-гексанол, 1-гептанол, 2-гептанол,5-метил-1-гексанол, 2-этил-1-гексанол, 2-метил-3-гексанол, 1-октанол, 2-октанол, циклопентанол, 2 циклопентилэтанол, 3-циклопентил-1-пропанол, циклогексанол, циклогептанол, циклооктанол, 2,3 диметилциклогексанол, 4-этилциклогексанол, циклооктилметанол, -метил-5-гептен-2-ол, 1-нонанол, 2 нонанол, 1-деканол, 2-деканол и 3-деканол; кетоны, состоящие по меньшей мере из пяти атомов углерода, такие как метилизопропилкетон, метилизобутилкетон, метил-н-амилкетон, метилизоамилкетон и их смеси. Как известно в области техники, экстракция продукта из профильтрованного ферментационного бульона может быть улучшена путем доведения рН до подходящего значения и/или путем добавления подходящей органической соли, образующей ионную пару с антибиотиком, растворимым в экстрагирующем растворителе. Как известно в области техники, фазовое разделение может быть улучшено путем высаливания водной фазы. Когда после экстракции выделенная органическая фаза содержит большое количество воды, может быть удобным азеотропно отгонять из нее воду. Как правило, для этого требуется добавление растворителя, способного образовывать минимальные азеотропные смеси с водой, с последующим добавлением осаждающего агента для осаждения при необходимости желаемого продукта. Типичные примеры органических растворителей, способных образовывать минимальные азеотропные смеси с водой, представляют собой н-бутанол, бензол, толуол, бутиловый эфир, тетрахлорид углерода, хлороформ, циклогексан,2,5-диметилфуран, гексан и м-ксилол; предпочтительный растворитель представляет собой н-бутанол. Примеры осаждающих агентов представляют собой петролейный эфир, низшие алкиловые эфиры,такие как этиловый эфир, пропиловый эфир и бутиловый эфир, и низшие алкилкетоны, такие как ацетон. В соответствии с предпочтительным способом выделения антибиотика 107891 отфильтрованный ферментационный бульон может быть приведен в контакт с адсорбирующей матрицей с последующей элюцией полярным смешивающимся с водой растворителем или их смесью, концентрированием до маслянистого остатка при пониженном давлении и осаждением осаждающим агентом, имеющим тип, уже упомянутый выше. Примеры адсорбирующих матриц, которые могут быть удобным образом использованы при выделении соединений по изобретению, представляют собой полистирольные или смешанные полистиролдивинилбензольные смолы (например, M112 или S112, Dow Chemical Co.; Amberlite XAD2 или XAD4,RohmHaas; Diaion HP 20, Mitsubishi), акриловые смолы (например, XAD7 или XAD8, RohmHaas),полиамиды, такие как поликапролактамы, нейлоны и поперечно-сшитые поливинилпирролидоны (например, полиамид-СС 6, полиамид-SC 6, полиамид-СС 6.6, полиамид-СС 6 АС и полиамид-SC 6 АС, Macherey-NagelCo., Germany; PA 400, M. Woelm AG, Germany); и поливинилпирролидоновую смолуPVP-CL (Aldrich Chemie GmbHCo., KG, Germany) и поперечно-сшитые декстраны с контролируемыми порами (например, Sephadex LH-20, Pharmacia Fine Chemicals, AB). Предпочтительно используют полистирольные смолы, особенно предпочтительна смола Diaion HP 20. В случае полистирольных смол, полистирол-дивинилбензольных смол, полиамидных смол или акриловых смол предпочтительный элюент представляет собой смешивающийся с водой растворитель или его водные смеси. Водные смеси могут содержать буферы при подходящем значении рН. Также в этом случае используемый в этом описании и формуле изобретения термин "смешивающийся с водой растворитель" имеет значение, присвоенное в настоящее время в области техники указанному термину как описано выше. Успешные процедуры выделения и очистки антибиотика могут быть осуществлены в объединенных экстрактах из супернатанта бульона и из мицелия. Например, когда часть антибиотического продукта, содержащегося в отфильтрованном ферментационном бульоне или супернатанте, выделяют путем абсорбции на абсорбирующей смоле, а часть антибиотического продукта, содержащегося в мицелии,экстрагируют из него смешивающимся с водой растворителем с последующей адсорбцией на абсорби-7 012164 рующей смоле, элюированные фракции с каждого из двух наборов абсорбирующих смол могут быть объединены, возможно после концентрирования, и затем дополнительно обработаны в виде единой партии. Альтернативно, когда два набора абсорбирующих смол, использованных для отдельных стадий экстракции, имеют одинаковый тип и обладают одинаковыми функциональными характристиками, они могут быть объединены вместе и смесь может быть подвергнута единой стадии элюции, например, смешивающимся с водой растворителем или его смесью с водой. В любом случае, не зависимо от того, какая процедура адаптирована для выделения сырого антибиотика 107981, успешную стадию очистки обычно осуществляют из смеси сырых веществ, являющейся результатом объединения продуктов с отдельных стадий экстракции. Очистка сырого антибиотика 107891 может быть осуществлена при помощи любого из известных способов, но предпочтительно ее осуществляют при помощи хроматографических процедур. Примеры этих хроматографических процедур представляют собой способы, о которых сообщали в связи со стадией выделения, и включают также хроматографию на стационарных фазах, таких как хроматография на силикагеле, оксиде алюминия, активированном силикате магния и т.п., или хроматографию с обращенной фазой на силанизированном силикагеле, имеющем различные функциональные дериватизации, и элюцию смешивающимися с водой растворителями или водной смесью смешивающихся с водой растворителей, имеющих упомянутый выше тип. Например, может быть использована препаративная ВЭЖХ хроматография с использованием RP-8 или RP-18 в качестве стационарной фазы и смеси буфера HCOONH4:CH3CN в качестве системы элюции. Активные фракции, выделенные на стадии очистки, объединяют, концентрируют в вакууме, осаждают путем добавления осаждающего агента упомянутых выше типов и сушат или лиофилизируют в единичном или повторяющихся циклах. В случае, когда продукт содержит остаточные количества формиата аммония или других буферных солей, они могут быть удалены путем абсорбции антибиотика 107891 на колонке для твердофазной экстракции, например колонке с обращенно-фазовой смолой, такой как SPE Superclean LCP18 Supelco (Bellefonte PA, USA), с последующей промывкой дистиллированной водой и элюцией подходящей водной смесью растворителей, например этанол:вода. Затем антибиотик выделяют путем удаления элюирующих растворителей. Соответственно получают высушенный препарат очищенного антибиотического комплекса 107891 в виде белого порошка. Как обычно в этой области техники, стадию продуцирования, а также выделения и очистки можно контролировать при помощи различных аналитических процедур, включающих ингибиторный анализ против чувствительных микроорганизмов и аналитический контроль с использованием ВЭЖХ или ВЭЖХ в сочетании с масс-спектрометрией. Предпочтительный аналитический метод ВЭЖХ осуществляют на аппарате Waters (Waters Chromathography, Milford, MA), оборудованном колонкой Waters Simmetry-shield RP8, 5 мкм (2504,6 мм),элюируя со скоростью потока 1 мл/мин при температуре 50 С. Элюцию осуществляли в соответствии с многостадийной программой: время=0 (30% фаза Б); время=8 мин (30% фаза Б); время =28 мин (40% фаза Б). Фаза А представляла собой ацетонитрил: 100 мМ буфер формиата аммония (рН:5,0) 5:95 (об./об.), и фаза Б представляла собой ацетонитрил. УФ детектор установлен на 282 нм. Вытекающий поток с колонки разделяли в отношении 5:95 и большую часть (приблизительно 950 мкл/мин) направляли в детектор на основе фотодиодной матрицы. Оставшееся количество (50 мкл/мин) направляли в интерфейс ESI (электрораспылительная ионизация) масс-спектрометра с ионной ловушкойFinnigan LCQ (Thermoquest, Finnigan MAT, San Jose CA). Масс-спектрометрический анализ осуществляли в следующих условиях. Условия при введении образца: Струя газа (N2) 413,7 кПа (60 фунт-сила/кв.дюйм); Вспомогательный газ (N2) 34,45 кПа (5 фунт-сила/кв.дюйм); Нагрев капилляра 250 С; Установки потенциала при введении образца: Полярность положительная и отрицательная; Потенциал ионораспыления +/-5 кВ; Капиллярный потенциал +/-19 В; Условия сканирования: максимальное ионное время 200 мс; Ионное время 5 мс; Полное микросканирование 3; Сегмент: длительность 30 мин, сканы положительные (150-2000 m/z) и отрицательные (150-2000m/z). В этих аналитических условиях ВЭЖХ факторы А 1 и А 2 антибиотика 107891 демонстрировали времена удерживания, соответственно, 13,2 мин и 13,9 мин. В той же самой системе ВЭЖХ фактор А 2 рамопланина (L. Gastaldo, R. Ciabatti, F.Assi, E. Restelli, J.K. Kettenring, L.F. Zerilli, G. Romano, M. DenaroA'3 glycolipodepsipeptide antibiotics", J. Ind. Microbiol. 11: 13-18), элюировался с временем удерживания 7,5 мин. Факторы А 1 и А 2 антибиотика 107891 могут быть выделены из очищенного образца антибиотического 107891 комплекса посредством препаративной ВЭЖХ. Фактор А 1 выделяли и очищали на колонке Symmetry Prep. C18 из очищенного антибиотического комплекса 107891, растворенного в смеси диметилсульфоксид (ДМСО):муравьиная кислота 95:5 (об./об.) с использованием линейного градиента элюции длительностью 25 мин от 30 до 45% фазы Б со скоростью потока 3,5 мл. Фаза Б представляла собой ацетонитрил. Фаза А представляла собой смесь 25 мМ буфер формиата аммония рН 4,5:ацетонитрил 95:5 (об./об.). Элюируемые фракции, содержащие чистый фактор А 1 антибиотика 107891, объединяли и концентрировали в вакууме. Оставшийся раствор лиофилизировали с получением чистого фактора А 1 в виде белого порошка. Фактор А 2 выделяли и очищали посредством изократической элюции на колонке Symmetry Prep.C18 из образца очищенного антибиотичского комплекса 107891, растворенного в смеси уксусная кислота:ацетонитрил:100 мМ буфер формиат аммония (рН 4) 50:120:80 (об./об.). Изократическую элюцию осуществляли со скоростью потока 7 мл смесью 100 мМ буфер формиат аммония рН 4:ацетонитрил в отношении 82,5:17,5 (об./об.). Элюированные фракции, содержащие чистый фактор А 2 антибиотика 107891, объединяли и концентрировали в вакууме. Оставшийся раствор лиофилизировали с получением чистого фактора А 2 в виде белого порошка. Поскольку в соответствии с результатами кислотного/основного титрования в смеси 2 метоксиэтаноле(MCS):Н 2 О 12:3 (об./об.) антибиотик 107891 и его факторы А 1 и А 2 содержат основную функцию, они способны образовывать соли с подходящими кислотами в соответствии с обычными способами и могут существовать также в форме свободного основания. Антибиотик 107891 и его факторы А 1 и А 2, полученные в форме свободного основания, могут быть превращены с использованием кислот в соответствующие соли, включающие нетоксичные фармацевтически приемлемые соли. Подходящие соли включают соли, образованные путем стандартной реакции с органическими и неорганическими кислотами, такими как, например, соляная, бромисто-водородная,серная, ортофосфорная, уксусная, трифторуксусная, трихлоруксусная, янтарная, лимонная, аскорбиновая, молочная, малеиновая, фумаровая, пальмитиновая, холевая, памоевая, муциновая, глутамовая, камфорная, глутаровая, гликолевая, фталевая, винная, лауриновая, стеариновая, салициловая, метансульфоновая, бензолсульфоновая, сорбиновая, пикриновая, бензойная, коричная кислоты и т.п. Соли присоединения кислот антибиотика 10789.1 и его факторов А 1 и А 2 могут быть получены в соответствии с обычными способами. В качестве примера антибиотик 107891 или его фактор А 1 или его фактор А 2 в форме свободного основания растворяют в минимальном количестве подходящего растворителя, типично низшего алканола или смеси низший алканол/вода, стехиометрическое количество подходящей выбранной кислоты постепенно добавляют к полученному раствору и полученную соль осаждают путем добавления нерастворителя. Образовавшуюся соль присоединения затем выделяют путем фильтрации или выпаривания растворителей. Альтернативно, эти соли могут быть получены, по существу, в безводной форме путем лиофилизации; в этом случае соль антибиотика 107891 или его фактора А 1 или его фактора А 2 с летучей кислотой растворяют в подходящем количестве нелетучей кислоты. Затем из раствора отфильтровывают все нерастворимые вещества и раствор лиофилизируют в течение единичного или повторяющихся раундов. Конкретная соль присоединения также может быть получена из раствора другой солевой формы антибиотика 107891 или его фактора А 1 или его фактора А 2, если желаемая соль осаждается при добавлении подходящего аниона. Превращение несолевого соединения по изобретению в соответствующие соли присоединения и наоборот, т.е. превращение соли присоединения соединения по изобретению в несолевую форму, находятся в пределах знаний специалиста в данной области техники и охвачены настоящим изобретением. Образование солей антибиотика 107891 и его факторов А 1 и А 2 может решать несколько задач,включая выделение, очистку указанного антибиотика 107891 и его факторов А 1 и А 2 и их применение в качестве терапевтических агентов или промоторов роста животного. Для терапевтических задач обычно используют фармацевтически приемлемые соли. Термин "фармацевически приемлемые соли" относится к нетоксичным солям, которые могут быть использованы в терапии теплокровных животных. Антибиотический комплекс 107981, его факторы А 1 и А 2 и смесь указанных факторов в любом соотношении могут быть введены сами по себе или в смесях с фармацевтически приемлемыми носителями и также могут быть введены в сочетании с другими антимикробными агентами, такими как пенициллины, цефалоспорины, аминогликозиды и гликопептиды. Таким образом, комбинированная терапия включает последовательное, одновременное и раздельное введение активного соединения таким образом, что терапевтические эффекты первого вводимого соединения полностью не исчезают к тому моменту, когда вводят последующее. Соединения по изобретению или их фармацевтически приемлемые соли присоединения могут быть-9 012164 приготовлены в формах, подходящих для парентерального, перорального или местного введения. Для внутривенного (в.в.) введения при лечении любой инфекции, включающей микроорганизм, чувствительный к антибиотику, препарат для парентерального введения находится, например, в воде с подходящим солюбилизирующим агентом, таким как полипропиленгликоль или диметилацетамид и поверхностноактивный агент (например, полиоксиэтиленсорбитана моноолеат или полиэтокилированное касторовое масло) или в композициях на основе циклодекстринов или фосфолипидов в стерильной воде для инъекции. Инъецируемый препарат также может быть приготовлен с подходящим циклодекстрином. Антибиотический комплекс 107981, его факторы А 1 и А 2 и смесь указанных факторов в любом соотношении также могут быть использованы в подходящей фармацевтической форме, такой как капсула,таблетка или водная суспензия для перорального введения, или с обычными кремами или гелями для местных применений. Помимо применения в качестве лекарственных средств в терапии и ветеринарии,соединения по изобретению также могут быть использованы в качестве промотора роста животных. Для этой задачи соединение по изобретению вводят перорально в подходящем корме. Точная используемая концентрация представляет собой концентрацию, которая требуется для обеспечения активного агента в количестве, эффективном для стимуляции роста, когда потребляют нормальные количества корма. Добавление активного соединения по изобретению в корм животных предпочтительно осуществляют путем приготовления подходящего кормового премикса, содержащего активное соединение в эффективном количестве, и включения премикса в полный рацион. Альтернативно, промежуточный концентрат или пищевая добавка, содержащая активный ингредиент, может быть смешана с кормом. Способ, при помощи которого такие кормовые премиксы и полные рационы могут быть приготовлены и введены, описаны в книгах (таких как "Applied Animal Nutrition", W.H. Freedman and CO., S. Francisco, U.deca, оборудованном источником электрораспыления, с использованием калибровочной смеси Thermofinnigan антибиотик 107891 давал два дважды протонированных иона с m/z=1124 и с m/z=1116, соответствующие наименьшей изотопной композиции факторов А 1 и А 2 комплекса соответственно. Условия электрораспыления: напряжение при распылении: 4,7 кВ; температура капилляра: 220 С; капиллярное напряжение: 3 В; режим введения 10 мкл/мин. Спектры регистрировали в растворе 0,2 мг/мл в смеси метанол/вода 80/20 (об./об.) с трифторуксусной кислотой 0,1%, и они представлены на фиг. 1 А (спектр низкого разрешения при полном сканировании) и 1 Б (спектр высокого разрешения при сканировании с масштабированием). Б) Инфракрасный спектр антибиотика 107891, снятый в KBr с использованием спектрофотометра для инфракрасной спектрометрии с преобразованием Фурье Bruker FT-IR модель IFS 48, демонстрирует максимумы абсорбции при (см-1): 3263; 2929; 1661; 1533; 1402; 1114; 1026. Инфракрасный спектр представлен на фиг. 2. Полосы абсорбции при 1631, 1596 и 1346 относятся к остаточным количествам формиата аммония. В) УФ спектр антибиотика 1087891 в смеси метанол/Н 2 О (в отношении 80:20) с использованием спектрофотометра Perkin-Elmer Lambda 16 демонстрирует два плеча при 226 и 267 нм. УФ спектр представлен на фиг. 3. Г) Спектр 1 Н-ядерного магнитного резонанса (ЯМР) регистрировали в смеси метанол-d4:Н 2 О (рН 4,3 HCl) 40:10 (об./об.) при 40 С на спектрометре Bruker AMX 600 с применением последовательности вытеснения воды. В качестве внутреннего стандарта рассматривали остаточный сигнал метанол-d4 при 3,31 м.д. 1 Н-ЯМР спектр антибиотика 107891 представлен на фиг. 4. 1 Н-ЯМР спектр антибиотика 107891,растворенного в смеси метанол-d4:Н 2 О (0,01 н. HCl) 40:10 (об./об.) демонстрирует следующие группы сигналов (в м.д.) при 600 МГц с использованием MeOH-d4 в качестве внутреннего стандарта (3,31 м.д.)(перекрывающиеся СН 3), 1.26 s (СН 3), 1-30 t (перекрывающиеся СН 3), 1.62-1.74 m (СН 2), 1.78 d (СН 3),1.80 d (СН 3), 2.03 m (СН 2), 2.24 m (CH), 2.36 m (CH2), 2.72-3.8 m (пептидные альфа СН), 3.8-5.2 m (пептидные альфа-СН), 5.53-6.08 s (СН 2), 5.62 d (СН двойной связи), 6.42 m (СН), 6.92 d (CH двойной связи),7.0-7.55 m (ароматические СН), 7.62-10.4 d и m (ароматические и пептидные NH). Д) 13 С-ЯМР спектр регистрировали в смеси метанол-d4:Н 2 О (рН 4,3 HCl) 40:10 (об./об.) при 40 С на спектрометре Bruker AMX 600, с использованием в качестве внутреннего стандарта остаточного сигнала метанол-d4 при 49,15 м.д. 13 С-ЯМР bb-несвязанный спектр антибиотика 107891, представлен на фиг. 5. 13 С-ЯМР спектр антибиотика 107891, растворенного в смеси метанол-4:Н 2 О (0,01 н. HCl) 40:10(об./об.) демонстрирует следующие группы сигналов (в м.д.) при 600 МГц с использованием MeOH-d4 в качестве внутреннего стандарта (49,15 м.д ), [=м.д.; (соотнесение)]: 13.6-23.2 (алифатические СН 3),26.16-73 (алифатические СН 2 и пептидные альфа СН), 105-136 (ароматические СН и СН двойных связей и четвертичные атомы углерода), 164.3-176.3 (пептидные карбонилы).(об./об.), содержащем молярный избыток 0,01 М соляной кислоты. Раствор затем вновь титровали раствором 0,01 н. гидроксида калия. Получающаяся в результате кривая титрования демонстрировала одну основную ионизируемую функцию. Аминокислотный состав антибиотика 107891 и его факторов А 1 и А 2 А) Определение "кислотоустойчивых" аминокислот в антибиотическом комплексе 107891. Антибиотик 107891 подвергали полному кислотному гидролизу (HCl 6 н., 105 С, 24 ч) и идентифицировали аминокислотные компоненты антибиотика, устойчивые к обработке кислотой. Кислотолабильные аминокислоты при использовании этого подхода не обнаружимы. Гидролизат исследовали при помощи анализа путем ВЭЖХ-МС и газовой хроматографии/масс-спектрометрии (ГХ-МС) после соответствующей дериватизации в сравнении со смесью стандартных аминокислот, дериватизированных аналогичным образом. Для анализа путем ВЭЖХ гидролизованный образец обрабатывали 6-аминохинолил-Nгидроксисукцинимидилкарбаматом (набор реагентов AccQ-Tag Fluor), для анализа путем ГХ - смесью 3 н. HCl в безводном метаноле и трифторуксусном ангидриде. Количественный анализ путем ВЭЖХ осуществляли на системе жидкостной хроматографии с одновременной детекцией с помощью диодной матрицы (ДДМ) и МС. Условия для ВЭЖХ: Колонка: AccQ-Tag (Waters С 18 NovoPak 4 мкм 3,9150 мм); Температура колонки: 37 С; Поток: 1 мл/мин. Фаза А: Ацетат аммония 140 мМ рН 5 (уксусная кислота). Фаза Б: вода:ацетонитрил 60:40 (об./об.). Программа элюции: УФ детекция: 254 нм; Условия МС: Спектрометр: Finnigan LCQ Deca, оборудованный стандартным источником электрораспыления. Температура капилляра: 250 С. Напряжение источника: 4,70 кВ. Ток источника: 80 мкА. Капиллярное напряжение: -15 В. Количественный анализ путем ГХ осуществляли на газовом хроматографе с МС-ЭИ (электрораспыление) детекцией. Условия ГХ: Колонка: JW Scientific DB-5, 30 м 0,254 мм внутренний диаметр (В.Д.)0,25 мкм FT; Газ-носитель: гелий; Режим инъекции: без разделения; Температура инжектора: 200 С; Температура трубок: 300 С; Температурная программа: от 50 до 100 С со скоростью 2,5 С/мин (10 мин), от 100 до 250 С со скоростью 10 С/мин (15 мин), 15 мин при 250 С; Инъецируемый объем: 1 мкл. Условия МС: Спектрометр: Finnigan TSQ700; Режим ионизации: электронный удар. Параметры напряжения: Ток накала: 400 мА; Электронный умножитель: 1400 В; Энергия электрона: 70 эВ; Режим положительных ионов. Условия сканирования: Диапазон сканирования: 40-650 amu. Время сканирования: 1 с. В хроматограммах ЖХ/МС и ГХ/МС, полученных на гидролизате антибиотика 107891, вместе с другими неидентифицированными пиками были идентифицированы следующие аминокислоты: лантионин, метиллантионин, глицин, пролин, валин, аспарагиновая кислота (исследования путем ЯМР указывают на то, что она представляет собой продукт превращения аспарагина, приводящего к образованию аспарагиновой кислоты путем гидролиза), фенилаланин и лейцин.- 11012164 Факторы А 1 и А 2 антибиотика 107891 подвергали полному кислотному гидролизу в тех же самых условиях (дериватизация и ВЭЖХ-МС), которые приведены для комплекса. Анализ путем ГХ-МС проводили на приборе для ГХ/МС Thermo Finnigan Trace, оборудованном инжектором-испарителем с программируемой температурой (PTV). Способ путем ГХ осуществляли в следующих условиях: Колонка: Restek RTX-5MS, 15 м 0,25 мм В.Д.0,25 мкм FT. Газ-носитель: гелий. Температура границы: 250 С. Температурная программа: 1,5 мин при 50 С, от 50 до 100 С при 20 С/мин, 1 мин при 100 С, от 100 до 135 С при 20 С/мин, 1 мин при 135 С, от 135 до 250 С при 20 С/мин, 1 мин при 250 С. Инъецируемый объем: 1 мкл. Инжектор: режим без разделения, базовая температура 50 С, температура переноса 280 С, скорость увеличения температуры 14,5 С/мин. Условия МС: Режим ионизации: электронный удар. Установки напряжения: Ток накала: 149 мкА. Электронный умножитель: 200 В. Энергия электрона: 70 эВ. Режим положительных ионов. Условия сканирования: Диапазон сканирования: 33-500 amu. Время сканирования: 0,6 с. В гидролизате фактора А 1 антибиотика 107891 хроматограммы ВЭЖХ/МС и ГХ/МС демонстрировали вместе с другими неидентифицированными пиками присутствие следующих аминокислот: лантионина, метиллантионина, глицина, пролина, валина, аспарагиновой кислоты (исследования путем ЯМР указывают на то, что она представляет собой продукт превращения аспарагина, приводящего к образованию аспарагиновой кислоты путем гидролиза), фенилаланина и лейцина. Вышеприведенный способ, использованный для фактора А 2, выявил вместе с другими неидентифицированными пиками присутствие следующих аминокислот: лантионина, метиллантионина, глицина,пролина, валина, аспарагиновой кислоты (исследования путем ЯМР указывают на то, что она представляет собой продукт превращения аспарагина, приводящего к образованию аспарагиновой кислоты путем гидролиза), фенилаланина и лейцина. Б) Определение 5-хлортриптофана в антибиотическом комплексе 107891 и в его факторе А 1 и факторе А 2. Полный гидролиз очищенного комплекса 107891 и его отдельных факторов А 1 и А 2 осуществляли в соответствии со способом, описанным Simpson R.J., Neuberger M.R., Liu T.Y., "Complete AminoacidAnalysis of Proteins from a Single Hydrolysate". Journal Biol. Chem (United States), April 10, 1976, 251 (7),1936-40. Эта процедура гидролиза позволяет предотвратить деградацию аминокислот, обычно нестабильных во время расщепления неорганическими кислотами, и таким образом дает возможность для определения этих аминокислот, включающих триптофан, из гидролизата пептида. Стандартный образец 5-хлор-DLтриптофана был приобретен в Biosynt AG, Staad, Switzerland и его структура подтверждена при помощи анализа путем ЯМР; DL-триптофан был приобретен в Merck KGaA, Darmstadt, Germany. Фактор А 1 (1,5 мг) суспендировали в 0,6 мл 4 н. метансульфоновой кислоты, содержащей 0,2%(мас./об.) 3-(2-аминоэтил)индола в качестве катализатора для гидролиза. Гидролиз осуществляли при 115 С в течение 16 ч. Гидролизат затем нейтрализовали 5 н. NaOH и разбавляли равным количеством дистиллированной воды. 100 мкл этого раствора анализировали путем ЖХ/МС. Разделение осуществляли на колонке Symmetry C18 (5 мкм) 4,6250 мм (Waters Co. Milford M.A., USA), оборудованной предколонкой Symmetry С 18 (5 мкм) 3,920 мм. Элюцию осуществляли при скорости потока 1 мл/мин в течение 25 мин. Линейный градиент от 0 до 50% фазы Б. Фаза А представляла собой смесь 25 мМ буферHCOONH4 рН 4,5:CH3CN 95:5 (об./об.), и фаза Б представляла собой CH3CN. УФ-обнаружение проводили при 280 нм. Оборудование для ВЭЖХ находилось в тандеме с масс-спектрометром с ионной ловушкой Finnigan LCQ (Thermoquest, Finnigan MAT, San Jose, CA, USA). 50 мкл/мин вытекающего потока с колонки направляли в интерфейс ионизации электрораспылением (ИЭР) масс-спектрометра LCQ. Анализ путем МС осуществляли в следующих условиях: ввод образца: газ-носитель (N2) 413,7 кПа (60 ф.сила/кв.дюйм); нагрев капилляра 210 С; полярность напряжения при вводе образца: положительная и отрицательная; напряжение распыления ионов 4,5 кВ; напряжение капилляра 21 В; условия сканирования: максимальное время ионов 50 мс; полный микро: скан 3. Стандарты триптофана и 5-хлортриптофана элюировали с временами удерживания 8,1 и 11,5 мин,соответствующими М+Н+ с m/z 205 и 239 соответственно. В гидролизате фактора А 1 антибиотика- 12012164 107891 присутствие пика на 11,5 мин для m/z с 238,97 указывало на присутствие 5-хлортриптофана. Стандарт триптофана обнаруживали при помощи хроматографической системы с пределом обнаружения 0,3 мкг/мл. Это значение было ниже значения, которое указывало бы на присутствие указанной аминокислоты в тестируемом образце антибиотика. Триптофан не был обнаружен выше указанного предела на хроматограмме гидролизата фактора А 1 антибиотика 107891. Идентичные результаты были получены в результате анализа путем ЖХ/МС гидролизата фактора А 2 и гидролизата очищенного образца антибиотического комплекса 107891. Масс-спектрометрия фактора А 1 и фактора А 2 антибиотика 107891 Фактор А 1 антибиотика 107891 дает дважды протонированный ион с m/z=1124, а фактор А 2 - с m/z 1116, соответствующим композиции с наименьшей изотопной массой, в экспериментах МС на прибореThermofinnigan LCQ deca, оборудованном источником электрораспыления, с использованием калибровочной смеси Thermofinnigan. Условия электрораспыления: напряжение распыления: 4,7 кВ; температура капилляра: 250 С; напряжение капилляра: 8 В; режим введения 10 мкл/мин. Спектры регистрировали в растворе 0,1 мг/мл в смеси ацетонитрил:вода 50:50 (об./об.) с 0,5% уксусной кислоты, и они представлены на фиг. 6 А (полный спектр низкого разрешения) и 6 Б (масштабированный спектр высокого разрешения), а также на фиг. 7 А (полный спектр низкого разрешения) и Б (масштабированный спектр высокого разрешения). Точную массу фактора А 1 и фактора А 2 антибиотика определяли путем использования спектрометра Bruker Daltonics APEX II, 4.7 Tesla, оборудованного источником электрораспыления. На основе этих данных для фактора А 1 установлена молекулярная масса 2246,7110,06, рассчитанная моноизотопная масса от [М+2 Н]2+ с m/z 1124,36124 (точность 30 м.д.), определенная при помощи ИЭР-массспектрометрии с преобразованием Фурье (МСПФ). Для фактора А 2 установлена молекулярная масса 2230,710,06, рассчитанная моноизотопная масса от [М+2 Н]2+ с m/z 1116,36260 (точность 30 млн-1), определенная при помощи ИЭР-МСПФ. Сравнение факторов А 1 и А 2 антибиотика 107891 с антибиотиками MF-BA-1768l и MF-BA-17681A) Microbispora corallina NNRL 30420 (MF-BA-1768), описанная в US 6551591 В 1, приобрели из коллекции NNRL. В пробном эксперименте штамм М. corallina NNRL 30420 (MF-BA-1768) ферментировали в колбе Эрленмейера в условиях, описанных в US 6551591 В 1. Собранный бульон экстрагировали путем разбавления метанолом. После центрифугирования мицелия супернатант наносили на полистирольную абсорбирующую смолу НР 20, элюируя смесью метанол:вода 70:30, объем которой уменьшали до небольшого объема и затем лиофилизировали. На хроматограмме два пика демонстрировали сигналы 1091 и 1108 [М+2 Н]2+, соответствующие[М+2 Н]2+, о которых сообщали в US 6551581 В 1 для MF-BA-17681 и MF-BA-17681 соответственно. В вышеприведенный экстракт затем добавляли факторы А 1 и А 2 антибиотика 107891 и смесь анализировали путем ЖХ/МС. Обнаружили, что пики антибиотиков MF-BA-17681 и MF-BA-17681 и факторов А 1 и А 2 антибиотика 107891 обладают различными временами удерживания и различными фрагментами МС [М+2 Н]2+. Б) В еще одном эксперименте ферментацию Microbispora sp. штамм NRRL 30420 (MF-BA-1768) проводили в тэнке объемом 30 л и собранный бульон обрабатывали в соответствующим с описанием US 6551591 В 1. После стадий последовательной очистки на полистирольной смоле НР 20 и полиамидной смоле СС 6 0,1-0,3 мм (Macherey-Nagel) получали два индивидуальных вещества в чистой форме при помощи препаративной ВЭЖХ на колонке С 18 Phenomenex (Torrance CA, USA) Luna (25012,2 мм) с размером частиц 10 мкм, элюируя при скорости потока 27 мл/мин в соответствии со следующей многостадийной программой: Время=0 мин (32% фазы Б); Время=8 мин (32% фазы Б); Время=20 мин (36% фазы Б); Время=32 мин (90% Фазы Б). Фаза А представляла собой 0,05%-ную (об./об.) муравьиную кислоту в воде, фаза Б представляла собой CH3CN. Эти вещества демонстрировали антибактериальную активность против стафилококков и энтерококков, как представлено в табл. IV. В экспериментах с использованием ЖХ/МС эти два вещества продемонстрировали сигналы для двойных протонированных ионов [М+2 Н], соответствующие антибиотику Экспериментальные условия антимикробных тестов были теми же, что и используемые для тестов,представленных в табл. VI ниже. Анализы путем ЖХ/МС выделенных антибиотиков MF-BA-17681 и MF-BA-17681 проводили на колонке Symmetry C18 (5:м) 4,6250 мм (Waters; Milford MA, USA), оборудованной предколонкой Symmetry C18 (5:м) 3,920 мм (обе держали в термостате при температуре 50 С). Элюцию осуществляли при скорости потока 1 мл/мин со следующей многостадийной программой элюции: время=0 мин (30% фазы Б); время=8 мин (30% фазы Б); время=20 мин (45% фазы В); время=24 мин (90% фазы Б) и время=28 мин(90% фазы Б). Фаза А представляла собой смесь 25 мМ буфер HCOONH4 pH 4,5:CH3CN 95:5 (об./об.), и фаза Б представляла собой CH3CN. Оборудование ВЭЖХ находилось в тандеме с масс-спектрометром с ионной ловушкой Finnigan LCQ (Thermoquest, Finnigan MAT, San Jose CA, USA). 100 мкл/мин выходного потока из колонки направляли в ИЭР интерфейс масс-спектрометра LCQ. Анализ путем МС осуществляли в следующих условиях: ввод образца: газ-носитель (N2) 172,375 кПа (25 фунт-сила/кв.дюйм); поток вспомогательного газа 34,475 кПа (5 фунт-сила/кв.дюйм); нагрев капилляра 210 С; полярность напряжения при вводе образца: положительная и отрицательная; напряжение распыления ионов 4,5 кВ; напряжение капилляра 12 В; условия сканирования: максимальное время ионов 50 мс; полный микро: скан 3. Индивидуальные антибиотические факторы MF-BA-17681 и MF-BA-17681 и факторы А 1 и А 2 антибиотика 107891 анализировали индивидуально и в смеси. Результаты собраны в следующей табл. V. Таблица V В той же самой хроматографической системе фактор А 2 рамопланина (L. Gastaldo, R. Ciabatti, F.CD3CN:D2O (1:1) при 24,85 С (298 K) на спектрометре Bruker AMX 600 с применением последовательности вытеснения воды. В качестве внутреннего стандарта рассматривали остаточный сигнал ацетонитрил-d3 при 1,94 м.д. А) 1 Н-ЯМР спектр фактора А 1 антибиотика 107891 представлен на фиг. 8. 1 Н-ЯМР спектр фактора А 1 антибиотика 107891, растворенного в смеси CD3CN:DH2O (1:1), демонстрирует следующие группы сигналов (в м.д.) при 600 МГц с использованием CD3CN в качестве внутреннего стандарта (1,94 м.д.) [=м.д. мультиплетность; (соотнесение)]: 0.84 d (CH3), 0.89 d (CH3), 0.94 t(СН 3), 1.75 m (CH2), 2.11 m (CH), 2.26 m (CH), 2.5 m (CH2), 2.68-3.8 m (пептидные СН), 3.8-5.0 m (пептидные СН), 5.45-6.17 s (СН 2), 5.58 d (CH двойной связи), 6.36 m (CH), 6.86 d (CH двойной связи), 7.07.45 m (ароматические CH). В качестве примесей также присутствуют сигнал для диметилсульфоксида при 2,58 м.д. и сигнал для формиата при 8,33 м.д. Б) 1 Н ЯМР bb несвязанный спектр фактора А 2 антибиотика 107891 представлен на фиг. 9. 1 Н ЯМР спектр фактора А 2 антибиотика 107891, растворенного в смеси CD3CN:D2O (1:1), демонстрирует следующие группы сигналов (в м.д.) при 600 МГц с использованием CD3CN в качестве внутреннего стандарта (1,94 м.д.), [=м.д., мультиплетность; (соотнесение)]: 0.84 d (СН 3), 0.88 d (СН 3), 0.94 d(CH3), 1.06 d (CH3), 1.14 d (СН 3), 148 m (СН 2), 1.65-1.75 m (СН 2), 1.67 d (СН 3), 2.15 m (CH), 2.25 m (CH),2.5 m (CH2), 2.77-3.8 m (пептидные СН), 3.8-4.9 m (пептидные СН), 5.45-6.14 s (CH2), 5.59 d (CH двойной связи), 6.34 m (CH), 6.84 d (CH двойной связи), 7.0-7.42 m (ароматические СН). В качестве примесей также присутствуют сигнал для диметилсульфоксида при 2,58 м.д. и сигнал для формиата при 8,32 м.д. 13 С-ЯМР спектры фактора А 1 и фактора А 2 антибиотика 107891 регистрировали в смеси CD3CN:D2O (1:1) при 24,85 С (298 K) на спектрометре Bruker AMX 600 с применением в качестве внутреннего стандарта остаточного сигнала ацетонитрил-d3 при 1,39 м.д. В) 13 С-ЯМР спектр фактора А 1 антибиотика 107891 представлен на фиг. 10. 13 С ЯМР спектр фактора А 1 антибиотика 107891, растворенного в смеси CD3CN:D2O (1:1), демонстрирует следующие группы сигналов (в м.д.) при 600 МГц с использованием CD3CN в качестве внутреннего стандарта (1,39 м.д.). [=м.д.; (соотнесение)]: 13.6-23.03 (алифатические СН 3), 25.69-77.9 (алифатические СН 2 и пептидные СН), 105-137.3 (ароматические и двойные связи СН и четвертичные атомы углерода), 165.6-176.6 (пептидные карбонилы). Г) 13 С-ЯМР bb несвязанный спектр фактора А 2 антибиотика 107891, представлен на фиг. 11. 13 С-ЯМР спектр фактора А 2 антибиотика 107891, растворенного в смеси CD3CN:D2O (1:1), демонстрирует следующие группы сигналов (в м.д.) при 600 МГц с использованием CD3CN в качестве внутреннего стандарта (1,39 м.д.), [=м.д.; (соотнесение)]: 13.6-22.9 (алифатические СН 3), 25.65-73 (алифатические СН 2 и пептидные СН), 105-137.3 (ароматические СН и СН двойных связей и четвертичные атомы углерода), 165.7-176.1 (пептидные карбонилы). УФ и инфракрасные (ИК) спектры фактора А 1 и фактора А 2 антибиотика 107891 А) Инфракрасный спектр фактора А 1 антибиотика 107891, зарегистрированный в KBr с использованием спектрофотометра Bruker FT-IR модели IFS 48, демонстрирует максимумы абсорбции при (см-1): 3294; 3059; 2926; 1661; 1529; 1433; 1407; 1287; 1114; 1021. Инфракрсный спектр представлен на фиг. 12. Б) УФ спектр фактора А 1 антибиотика 107891, зарегистрированный в смеси метанол:H2O 80:20(об./об.) с использованием спектрофотометра Perkin-Elmer Lambda 16, демонстрирует два плеча при 226 и 267 нм. УФ спектр представлен на фиг. 13. В) Инфракрасный спектр фактора А 2 антибиотика 107891, зарегистрированный в KBr с использованием спектрофотометра Bruker FT-IR, модели IFS 48, демонстрирует максимум абсорбции при (см-1): 3296; 3060; 2928; 1661; 1529; 1433; 1407; 1288; 1116. Инфракрасный спектр представлен на фиг. 14. Г) УФ спектр фактора А 2 антибиотика 107891, зарегистрированный в смеси метанол:Н 2 О 80:20(об./об.) с использованием спектрофотометра Perkin-Elmer Lambda 16, демонстрирует два плеча при 226 и 267 нм. УФ спектр представлен на фиг. 15. На основе вышеприведенных физико-химических данных для антибиотика 107891 может быть установлена следующая структурная формула:- 15012164 где X представляет собой галоген (F, Cl, Br, I), и где R1, R2, R3, R4, R5, R6, R7 и R8 независимо могут представлять собой Н, ОН, алкил (разветвленный или неразветвленный, замещенный или незамещенный) или арил (замещенный или незамещенный). В альтернативном воплощении R1, R2, R3 и R4 могут представлять собой Н или ОН. Таким образом,возможные комбинации R1, R2, R3 и R4 включают следующие. Аналогично, R5, R6, R7 и R8 могут представлять собой Н или ОН. Таким образом, возможные комбинации R5, R6, R7 и R8 включают следующие. Кроме того, на основе представленных выше физико-химических данных для фактора А 1 антибиотика 107891 может быть установлена следующая структурная формула, где X представляет собой Cl, R1 представляет собой Н, R2 представляет собой ОН, R3 представляет собой Н, и R4, R5, R6, R7 и R8 представляют собой Н, представляющая собой предпочтительное воплощение по изобретению вместе с его фармацевтически приемлемыми солями: Дополнительно, на основе вышеприведенных физико-химических данных для фактора А 2 антибиотика 107891 может быть установлена следующая структурная формула, где X представляет собой Сl, R1 представляет собой ОН, R2 представляет собой ОН, R3 представляет собой Н, и R4, R5, R6, R7 и R8 представляют собой Н, представляющая собой предпочтительное воплощение по изобретению вместе с его фармацевтически приемлемыми солями: Биологическая активность антибиотика 107891 iv vitro Антимикробную активность антибиотика 107891 определяли при помощи способа микроразведения питательной среды в соответствии с рекомендациями Национального комитета по клиническим лабораторным стандартам (NCCLS, документ М 7-А 5). Используемые штаммы представляли собой клинические изоляты или штаммы из Американской коллекции типовых культур (АТСС). Результаты тестов представлены в табл. VI и VII. Антибиотик 107891 растворяли в диметилсульфоксиде (ДМСО) для получения концентрированного раствора 1000 мкг/мл и затем разбавляли водой для получения рабочего раствора. Используемые среды представляли собой катионо-регулируемую среду Мюллера-Хинтона (САМНВ) для Staphylococci, M.[sovitalex +1% гемина для Neisseria spp.; сердечно-мозговую вытяжку + добавка 1% С для H. influenzae; среду Lactobacillus для Lactobacilli; Middlebrook 7H9, обогащенную Middlebrook OADC для М. smegmatis; среду RPMI 1640 для С. albicans, среду Вилкинса-Шалгрена+оксираза (1:25 об./об.) для Clostridia; среду Brucella, содержащую цистеин (0,5 г/л) для Propionibacteria. Инокулюмы для бактерий составляли 105 колониеобразующих единиц (KOE)/мл. Инокулюм С. albicans составлял 1104 KOE/мл. Все тесты проводили в присутствии 0,02% бычьего сывороточного альбумина (БСА). Культуры инкубировали при 35 С на воздухе за исключением штаммов Clostridia и Propioniobacteria, которые требовали анаэробной атмросферы. Через 18-24 ч осуществляли визуальные наблюдения и определяли МИК. МИК определяли как наименьшую концентрацию антибиотика, при кото- 17012164 рой визуальный рост отсутствовал. Таблица VI Антимикробная активность антибиотика 107891 Таблица VII Антимикробная активность антибиотика 107891 против анаэробных бактерий- 18012164 Антибиотик 107891 демонстрирует хорошую антибактериальную активность против грамположительных бактерий. Диапазон МИК против Staphylococcus spp., включая штаммы, резистентные к метициллину (MRSA) и гликопептидным промежуточным соединениям (GISA), составляет 0,13-4 мкг/мл, а против полученных недавно клинических изолятов Enterococcus spp., включая резистентные к ванкомицину (VRE), составляет 0,5-4 мкг/мл. МИК против Streptococcus spp. составляют не более 0,13 мкг/мл. Антибиотик 107891 также активен против анаэробных грамположительных штаммов; величины МИК составляют не более 0,13 мкг/мл против Clostridia и не более 0,004-4 мкг/мл против Propionibacteria. Антимикробные активности продемонстрированы против L.monocytogenes (МИК 0,125 мкг/мл) и штаммов Lactobacilli (диапазон МИК не более 0,13-4 мкг/мл). Некоторые грамотрицательные бактерии чувствительны к антибиотику 107891; МИК составляют 10,25 мкг/мл против М. catharralis, 0,5-0,25 мкг/мл против Neisseria spp. и 32 мкг/мл против Н. influenzae. Антибиотик 107891 не активен против тестированных штаммов Е. coli и С. albicans. В экспериментах с киллингом в зависимости от времени антибиотик 107891 демонстрирует бактерицидную активность против штамма S. aureus GISA и Е. faecalis VanA; через 24 ч бактерицидная концентрация представляет собой значение МИК в среде Мюллера-Хинтона.S. aureus может вызывать угрожающие жизни инфекции, и MRSA имеет особенную клиническую значимость, поскольку он резистентен ко всем пенициллинам и цефалоспоринам, а также ко множеству других антибиотиков; дополнительно он легко передается от пациента к пациенту, вызывая вспышку инфекции с серьезными осложнениями для здравоохранения (W. Witte (1999): "Antibiotic resistance inGram-positive bacteria: epidemiological aspects", Journal of Antimicrobial Chemotherapy 44: 1-9). Центр по контролю за заболеваниями (CDC) Национальной системы по контролю за нозокомиальными инфекциями (NNIS) сообщает от том, что резистентность к метициллину у S. aureus в госпиталях США увеличилась с 2,4% в 1975 до 29% в 1991, с большей степенью резистентности в отделениях интенсивной терапии (L. Archibald, L. Philips, D. Monnet, J.E. Jr Mc Gowan, F. Tenover, R. Gaynes, (1997): "Antimicrobialcare unit", Clinic Infect. Dis. 24: 211-5). Нозокомиальные стафилококковые инфекции ассоциируются со значительной заболеваемостью и смертностью, увеличивая длительность пребывания в госпитале и повышая стоимость госпитализации. Большая часть штаммов MRSA резистентна к нескольким из наиболее часто используемых антимикробных агентов, включающих используемые в настоящее время макролиды,аминогликозидные и -лактамовые антибиотики, включая самое последнее поколение цефалоспоринов. Приобретаемые в госпитале резистентные к ванкомицину патогены, ответственные за инфекции(такие как эндокардит, менингит и септицемия), составляют прогрессирующую терапевтическую проблему (Y. Cetinkaya, P. Falk and С.G. Mayhall (2000): "Vancomycin - resistant enterococci", Clin. Microbiol.S. pneumoniae и М. catarrhalis представляют собой известные серьезные патогены людей. Они являются распространенной причиной инфекций респираторного тракта, в частности отита среднего уха у детей и инфекций нижнего отдела респираторного тракта у пожилых людей. М. catarrhalis и S. pneumoniae недавно были признаны самыми распространенными патогенами респираторного тракта (М.С. Enright and H. McKenzy (1997): "Moraxella (Branhamella) catarrhalis. Clinical and molecular aspect of a rediscovered pathogen", J. Med. Microbiol. 46: 360-71).Clostridia ответственны за различные заболевания: газовую гангрену и родственные раневые инфекции, столбняк, ботулизм, диарею, ассоциирующуюся с антибиотиками (CDAD) и псевдомембранозный колит. Большая часть этих микроорганизмов продуцирует экзотоксины, играющие важную роль в патогенезе заболеваний. С. difficile представляет собой возбудитель, ответственный за 25% случаевCDAD и, по существу, за все случаи псевдомембранозного колита. В течение последних нескольких лет случаи коинфекции С. difficile наблюдали у пациентов, страдающих от резистентной к ванкомицину энтерококковой инфекции или колонизации (J.G. Bartlett (1992): "Antibiotic associated diarrhea", Clinic. Infect. Dis. 15: 573-581). Биологическая активность факторов A1 и А 2 антибиотика 107891 in vitro В табл. VIII представлены антимикробные активности индивидуальных факторов А 1 и А 2 антибиотика 107891. МИК определяли при помощи способа микроразведения среды, как описано выше.- 19012164 Таблица VIII Антимикробная активность факторов А 1 и А 2 антибиотика 107891 Биологическая активность антибиотика 107891 in vivo Самок мышей ICR (Harlan Italia SpA - S. Pietro al Natisone, Italy) массой 23-25 г использовали в экспериментах с острой летальной инфекцией у иммунокомпетентных мышей или мышей, страдающих нейтропенией. Нейтропению вызывали путем интраперитонеальных введений циклофосфамида, 200 и 100 мг/кг, за четверо и одни сутки перед инфицированием мышей соответственно.- 20012164 Инфекцию вызывали путем интраперитонеальной инокуляции иммунокомпетентных мышей (8 животных/дозу/обрабатываемую группу) бактериальной суспензией клинического изолята стафилококка,резистентного к метициллину (Staph. aureus SA3817), или стандартного штамма, чувствительного к метициллину (Staph. aureus Smith АТСС 19636), или путем инокуляции мышей, страдающих нейтропенией,клиническим изолятом энтерококка, резистентного к гликопептидам (Ent. faecalis A533). Бактериальные инфицирующие дозы (приблизительно 106 клеток/мышь) давали в виде суспензии в 0,5 мл 5% бактериологического муцина (Difco). Необработанные животные погибали в течение 24-72 ч после инфицирования. Обработку антибиотиком начинали в течение 10-15 мин после инфицирования. Антибиотик 107891 вводили один раз внутривенно или подкожно в различных водных препаратах. 50%-ную эффективную дозу (ЭД 50) и 95%-ные доверительные интервалы рассчитывали методом Спирмана-Карбера (SpearmanKarber) (D.J. Finney (1952): "The Spearman-Karber method", in Statistical methods in biological assay, pp. 524-530, Charles GriffinCo., Ltd., London), исходя из процентной доли животных, выживших на 7-е сутки. Результаты представлены в следующей табл. IX. Антибиотик 107891 не токсичен вплоть до максимальной тестируемой дозы 200 мг/кг. Таблица IX ЭД 50 антибиотика 107891 при острых летальных инфекциях у мышейIII. VanA: Ent. faecalis A533, клинический изолят, у мышей с нейтропенией. Краткое описание графических материалов Фиг. 1 А (спектр низкого разрешения при полном сканировании) и 1 Б (масштабированный спектр высокого разрешения) представляют масс-спектры антибиотика 107891, демонстрирующие дважды протонированный ион с m/z 1124 и m/z 1116; фиг. 2 - спектр ИК абсорбции антибиотика 107891, диспергированного в KBr; фиг. 3 - УФ спектр антибиотика 107891, растворенного в смеси метанол:Н 2 О; фиг. 4 - 1 Н-ЯМР спектр, зарегистрированный в смеси метанол-d4: Н 2 О (рН 4,3 HCl) 40:10 (об./об.) при 40 С на спектрометре Bruker AMX 600 с применением последовательности вытеснения воды; фиг. 5 - 13 С-ЯМР спектр, зарегистрированный в смеси метанол-d4: Н 2 О (рН 4,3 HCl) 40:10 (об./об.) при 40 С на спектрометре Bruker AMX 600; фиг. 6 А (спектр низкого разрешения при полном сканировании) и 6 Б (масштабированный спектр высокого разрешения) - масс-спектры фактора А 1 антибиотика 107891, демонстрируя дважды протонированные ионы [М+2 Н]2+ с m/z 1124; фиг. 7 А (спектр низкого разрешения при полном сканировании) и 7 Б (масштабированный спектр высокого разрешения) - масс-спектры фактора А 2 антибиотика 107891, демонстрируя дважды протонированные ионы [М+2 Н]2+ с m/z 1116; фиг. 8 - 1 Н-ЯМР спектр фактора А 1 антибиотика 107891, зарегистрированный в смеси CD3CN:D2O(1:1) при 298 K на спектрометре Bruker AMX 600 с применением последовательности вытеснения воды; фиг. 9 - 1 Н-ЯМР спектр фактора А 2 антибиотика 107891, зарегистрированный в смеси CO3CN:D2O(1:1) при 298 K на спектрометре Bruker AMX 600 с применением последовательности вытеснения воды; фиг. 10 - 13 С-ЯМР спектр фактора А 1 антибиотика 107891, зарегистрированный в смеси CD3CN:D2O(1:1) при 298 K на спектрометре Bruker AMX 600; фиг. 12 - спектр ИК абсорбции фактора А 1 антибиотика 107891, диспергированного в KBr; фиг. 13 - УФ спектр фактора А 1 антибиотика 107891, растворенного в смеси метанол:Н 2 О; фиг. 14 - спектр ИК абсорбции фактора А 2 антибиотика 107891, диспергированного в KBr; фиг. 15 - УФ спектр фактора А 2 антибиотика 107891, растворенного в смеси метанол:Н 2 О. Примеры Пример 1. Способ ферментации Microbispora sp. АТСС РТА-5024.Microbispora sp. штамм АТСС РТА-5024 поддерживали на косяках из агара на основе овсяной муки в течение 2-3 недель при 28 С. Содержимое с микробами с одного косяка смывали 5 мл стерильной воды и инокулировали в колбы Эрленмейера объемом 500 мл, содержащие 100 мл посевной среды (AF/MS),состоящей из (г/л): дектроза - 20, дрожжевой экстракт - 2, соевая мука - 8, NaCl - 1 и карбонат кальция 4. Среду готовили в дистиллированной воде и рН доводили до 7,3 перед стерилизацией при 121 С в течение 20 мин. Инокулированное содержимое колб выращивали при 28 С на роторной качалке, функционирующей при 200 об./мин. Через 4-6 дней 5% этой культуры инокулировали во вторую серию колб, содержащих ту же самую ферментационную среду. После инкубации в течение 72 ч 200 мл переносили в биореактор объемом 4 л, содержащий 3 л той же самой вегетативной среды. Ферментацию осуществляли при 30 С с перемешиванием при 700 об./мин и аэрации 0,5 vvm (отношение количества подводимого воздуха к емкости реактора). Через 72 ч культуру (1,5 л) переносили в биореактор объемом 20 л, содержащий 15 л той же самой вегетативной среды. Ферментацию осуществляли в течение 48 ч при 30 С при перемешивании при 500 об./мин и аэрации 0,5 vvm и затем переносили в производственный танк. Продукцию антибиотика 107891 проводили в ферментаторе объемом 300 л, содержащем 200 л продуцирующей среды М 8, состоящей из (г/л): крахмал - 20, глюкоза - 10, дрожжевой экстракт - 2, гидролизованный казеин - 4, мясной экстракт - 2 и карбонат кальция - 3. Среду готовили в деионизированной воде, рН доводили до 7,2 перед стерилизацией при 121 С в течение 25 мин. После охлаждения ферментатор инокулировали приблизительно 14 л (7%) предкультуры. Ферментатор запускали при 29 С, при перемешивании 180 об./мин и аэрации 0,5 vvm при давлении на выходе 36 КПа (0,36 бар). Содержимое ферментатора собирали после 98 ч ферментации. Продукцию антибиотика 107891 контролировали путем ВЭЖХ как описано ранее, после экстракции цельной культуральной жидкости таким же объемом метанола. Экстракцию проводили при комнатной температуре при перемешивании в течение 1 ч. Пример 2. Альтернативный способ ферментации Microbispora sp. ATCC РТА-5024.Microbispora sp. ATCC РТА-5024 инокулировали в колбы Эрленмейера объемом 500 мл, содержащие 100 мл ростовой среды (G1), состоящей из г/л: глюкоза - 10, мальтоза - 10, соевое масло - 10, соевая мука - 8, дрожжевой экстракт - 2 и карбонат кальция - 4. Среду готовили в деионизированной воде и стерилизовали при 120 С 20 мин без доведения рН. Инокулированные колбы инкубировали в течение 120168 ч при 28 С с перемешиванием при 200 об./мин до тех пор, пока не будет обнаружен хороший рост. Колбы затем использовали для инокуляции (3%) биореактора объемом 4 л, содержащего 3 л посевной среды AF/MS, приготовленной как описано в примере 1. После ферментации в течение 120 ч при 30 С с перемешиванием при 700 об./мин и аэрацией 0,5 vvm 1,5 л культуры переносили в биореактор объемом 20 л, содержащий 15 л такой же вегетативной среды. Ферментацию осуществляли в течение 96 ч при 30 С при перемешивании при 600 об./мин и аэрации 0,5 vvm и затем переносили в производственный танк. Продукцию антибиотика осуществляли в ферментаторе объемом 300 л, содержащем 200 л продуцирующей среды (V6), состоящей из (г/л): дектроза - 20, дрожжевой экстракт - 5, мясной экстракт - 5,гидролизованный казеин - 3, пептон - 5 и NaCl - 1,5. Среду готовили в деионизированной воде с рН, доведенным до 7,5 с помощью NaOH, и стерилизовали при 121 С в течение 20 мин. Ферментатор инокулировали 14 л посевной культуры (7%) и ферментацию осуществляли при 29 С,перемешивали при 180 об./мин, аэрировали 100 л обычного воздуха в минуту (0,5 vvm). Продукцию антибиотика 107891 контролировали путем ВЭЖХ, как описано ранее. Ферментационную среду собирали приблизительно через 160 ч. Пример 3. Выделение антибиотика 107891. Ферментационный бульон, описанный в примере 1, фильтровали при помощи системы тангенциальной фильтрации (размер пор мембраны 0,1 мкм, Koch Carbo-Cor, Koch Wilmington, USA) с получением 170 л супернатанта и 30 л концентрированного мицелия. Антибиотический комплекс 107891 был обнаружен в фильтрате (А) и в мицелии (Б).(А) Профильтрованный бульон перемешивали в течение ночи при комнатной температуре в присутствии полистирольной смолы Diaion HP-20 (4 л). Смолу затем отделяли, промывали 10 л смеси метанол:вода 4:6 (об./об.) и партиями элюировали сначала 10 л смеси метанол:вода 9:1 (об./об.), а затем 10 л смеси метанол:бутанол:вода 9:1:1 (об./об.). Объединенные элюированные фракции, содержащие антибиотик 107891, концентрировали до небольшого объема на роторном испарителе и затем сушили замораживанием с получением 32 г неочищенного материала. Этот неочищенный материал растворяли в н- 22012164 бутаноле (1 л) и затем трижды последовательно экстрагировали 800 мл воды. Органический слой концентрировали при пониженном давлении до маслянистого остатка, который растворяли в метаноле. После добавления петролейного эфира путем осаждения получали 5 г неочищенного препарата антибиотика.(Б) После добавления 25 л метанола порцию ретентата, содержащего мицелий, перемешивали в течение 1 ч и фильтровали с получением 45 л экстракта мицелия. Этот раствор затем разбавляли водой (20 л) и перемешивали в течение ночи при комнатной температуре с полистирольной смолой Diaion HP-20 (1 л). Затем смолу отделяли, промывали 2 л смеси метанол:вода 40:60 (об./об.) и партиями последовательно элюировали 3 л смеси метанол:вода 85:15 (об./об.) и затем 2 л смеси метанол:вода 90:10 (об./об.). Элюируемые фракции контролировали в отношении присутствия антибиотика 107891 при помощи анализа диффузии на агаре с Staphylococcus aureus и при помощи способа аналитической ВЭЖХ, о чем сообщали ранее. Элюированные фракции, содержащие антибиотик 107891, объединяли, концентрировали при пониженном давлении и сушили замораживанием с получением 8,1 г неочищенного антибиотика 107891. Пример 4. Альтернативное выделение антибиотика 107891. Собранную среду из описанного в примере 2 ферментационного танка объемом 200 л доводили до рН 6,8 и среду фильтровали путем тангенциальной фильтрации (размер пор мембраны 0,1 мкм, KochCarbo-Cor). Фильтрат (180 л) партиями перемешивали в течение ночи при комнатной температуре с 2 л смолы Diaion HP20 (Mitsubishi Chemical) и смолу затем собирали. К порции ретентата, содержащего концентрированный мицелий, в аппарате для тангенциальной фильтрации (приблизительно 20 л) добавляли метанол (25 л). Эту суспензию перемешивали в течение 1 ч и затем фильтровали при помощи системы микрофильтрации до остаточного объема ретентата приблизительно 20 л. Затем добавляли дополнительную порцию метанола (25 л) и вышеприведенный способ последовательно повторяли в течение в общей сложности 5 циклов. Объединенные метанольные экстракты (приблизительно 125 л) разбавляли 160 л деионизированной воды и партиями в течение ночи перемешивали при комнатной температуре с 3 л смолы Diaion HP 20. Смолу затем собирали и объединяли со смолой Diaion HP 20, использованной для экстракции фильтрата среды в соответствии с вышеописанным способом. Объединенную смолу промывали в хроматографической колонке 20 л смеси вода:метанол 6:4 (об./об.). Антибиотик 107891 элюировали 23 л смеси метанол:50 мМ буфер формиата аммония рН 3,5:н-бутанол 9:1:1 (об./об.). Этот элюат затем концентрировали в вакууме до конечного объема 3 л. Затем концентрированный раствор при рН 4,5 наносили на колонку 2,5 л полиамида СС 6 0,1-0,3 мм (Macherey-Nagel), уравновешенную смесью вода:метанол 7:3 (об./об.). Колонку промывали смесью вода:метанол 7:3 (об./об.) и затем смесью 25 мМ буфер формиата аммония рН 3,5:метанол 7:3 (об./об.). Антибиотик элюировали смесью вода:метанол 3:7 (об./об.) и затем смесью 1:9 (об./об.). Элюцию завершали смесью 25 мМ буфер формиата аммония рН 2,8:метанол в отношении 1:9 (об./об.). Элюаты, содержащие антибиотик 107891, объединяли и концентрировали в вакууме до конечного объема 1 л. рН концентрированного раствора доводили до величины от 4 до 5,7 с использованием 7 М гидроксида аммония и затем смесь центрифугировали для сбора осадка. Это твердое вещество суспендировали в воде и сушили замораживанием с получением 6,96 г препарата антибиотика 107891. Пример 5. Очистка антибиотика 107891. Неочищенный антибиотик 107891 (3,6 г), полученный в соответствии с описанным в примере 3,очищали путем хроматографии среднего давления на 100 г частиц размера 40-70 мкм обращенной фазы С 8 (ЕС), размер пор 60 , IST (International Sorbent Technology, MidGlamorgan, UK) путем использования системы хроматографии среднего давления Buchi B-680 (Buchi laboratoriums-technik AG, Flawil Switzerland), оборудованной градиентообразователем В-687, коллектором фракций В-684, стеклянной колонкой В-685 70460 мм. Смолу предварительно уравновешивали смесью фаза А:фаза Б 8:2 (об./об.) и затем элюировали при скорости 25 мл/мин с использованием линейного градиента от 20% до 60% фазы Б в течение 60 мин. Фаза А представляла собой смесь ацетонитрил:20 мМ буфер формиата аммония (рН 6,6) 10:90(об./об.); а фаза Б представляла собой смесь ацетонитрил:20 мМ буфер формиата аммония (рН 6,6) 90:10(об./об.). Фракции, содержащие антибиотик 107891, объединяли, концентрировали в вакууме и дважды лиофилизировали из воды с получением 430 мг очищенного антибиотика 107891. Пример 6. Очистка антибиотика 107891 путем препаративной ВЭЖХ. Антибиотик 107891 дополнительно очищали путем препаративной ВЭЖХ на колонке RT Hibar,предварительно упакованной лихросорбом RP8 (размер частиц 7 мкм) 250-25 мм, Merck, путем использования линейного элюирующего градиента от 30 до 45% фазы Б при скорости 30 мл/мин в течение 25 мин. Фаза А представляла собой смесь 25 мМ буфер формиата аммония рН 4,5:ацетонитрил 95:5(об./об.), а фаза Б представляла собой ацетонитрил. Образец антибиотика 107891 по примеру 5 (300 мг) растворяли в 1,5 мл 350 л смеси ДМСО:муравьиная кислота 95:5 (об./об.) и 300 мкл подвергали хроматографическому разделению. Антибиотик 107891, как правило, элюировали в течение 15-16 мин. Элюируемые фракции с 5 хроматогра- 23012164 фических разделений, содержащих антибиотик 107891, объединяли и концентрировали в вакууме. Оставшийся раствор последовательно трижды лиофилизировали из воды с получением 31 мг антибиотика 107891 в виде белого порошка. Пример 7. Разделение и очистка индивидуальных факторов А 1 и А 2 антибиотика 107891. Факторы А 1 и А 2 разделяли и очищали из антибиотического комплекса 107891 по примеру 5 при помощи препаративной ВЭЖХ на колонке Symmetry Prep C18 (размер частиц 7 мкм) 7,8300 мм Waters(Mildfold USA) с использованием различных программ элюции. А) Фактор А 1 очищали при помощи линейного элюирующего градиента от 30 до 45% фазы Б при скорости потока 3,5 мл в течение 25 мин. Фаза А представляла собой 25 мМ буфер формиата аммония рН 4,5:ацетонитрил 95:5 (об./об.), а фаза Б представляла собой ацетонитрил. Очищенный антибиотический комплекс 107891 (15 мг) растворяли в 350 мкл смеси ДМСО:муравьиная кислота 95:5 (об./об.) и подвергали хроматографическому разделению. Факторы А 1 и А 2, как правило, элюировали во временном интервале 11-13 мин. Элюированные фракции затем анализировали при помощи ВЭЖХ в вышеописанных аналитических условиях. Фракции после 14 хроматографических разделений, содержащие чистый фактор А 1 антибиотика 107891, объединяли и концентрировали в вакууме. Оставшийся раствор трижды последовательно лиофилизировали из воды с получением 15 мг чистого фактора А 1 в виде белого порошка. Б) Фактор А 2 очищали путем изократической элюции при скорости потока 7 мл смесью 100 мМ буфер формиата аммония рН 4:ацетонитрил 82,5:17,5 (об./об.). Очищенный антибиотитический комплекс 107891 (5 мг) растворяли в 250 мкл смеси уксусная кислота:ацетонитрил:100 мМ буфер формиата аммония рН 4 50:120:80 (об./об.) и подвергали хроматографическому разделению. Факторы А 1 и А 2 как правило элюировали в течение временного интервала 9-10 мин. Элюированные фракции затем анализировали путем ВЭЖХ в вышеописанных аналитических условиях. Фракции после 20 хроматографических разделений, содержащие чистый фактор А 2 антибиотика 107891, объединяли и концентрировали в вакумме. Оставшийся раствор дважды лиофилизировали из воды с получением 8 мг чистого фактора А 2 в виде белого порошка. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы где X выбран из группы, состоящей из F, Cl, Br и I; и где R1, R2, R3, R4, R5, R6, R7 и R8 независимо выбраны из группы, состоящей из Н и ОН. 2. Соединение по п.1, где X представляет собой Cl, R2 представляет собой ОН и R1, R3, R4, R5, R6, R7 и R8 представляют собой Н. 3. Соединение по п.1, где X представляет собой Cl, R1 представляет собой ОН, R2 представляет собой ОН и R3, R4, R5, R6, R7 и R8 представляют собой Н. 4. Соединение по п.1, где R4, R5, R6, R7 и R8 представляют собой Н. 5. Соединение по п.4, где R1 представляет собой Н, R2 представляет собой Н и R3 представляет собой Н. 6. Соединение по п.4, где R1 представляет собой Н, R2 представляет собой Н и R3 представляет собой ОН. 7. Соединение по п.4, где R1 представляет собой Н, R2 представляет собой ОН и R3 представляет собой ОН. 8. Соединение по п.4, где R1 представляет собой ОН, R2 представляет собой ОН и R3 представляет собой ОН. 13. Антибиотический комплекс 107891, содержащий фактор А 1 и фактор А 2, представляющий собой белый порошок, обладающий следующими характеристиками:(А) масс-спектр, регистрируемый в растворе 0,2 мг/мл в смеси метанол:вода 80/20 (об./об.) с 0,1% трифторуксусной кислоты на аппарате Thermofinnigan LCQ deca, оборудованном источником электрораспыления, с использованием калибровочной смеси Thermofinnigan в следующих условиях электрораспыления: напряжение распыления - 4,7 кВ; температура капилляра - 220 С; капиллярное напряжение 3 В; режим инфузии - 10 мкл/мин, демонстрирующий два дважды протонированных иона с m/z 1124 иm/z 1116, соответствующих наименьшей изотопной композиции фактора А 1 и А 2 соответственно;(Б) инфракрасный спектр, зарегистрированный в KBr с использованием спектрофотометра для инфракрасной спектрометрии с преобразованием Фурье Bruker FT-IR модель IFS 48, демонстрирует максимумы абсорбции при (см-1): 3263; 2929; 1661;1533; 1402; 1114; 1026;(В) ультрафиолетовый (УФ) спектр в смеси метанол:Н 2 О 80:20 (об./об.) с использованием спектрофотометра Perkin-Elmer Lambda 16 демонстрирует два плеча при 226 и 267 нм;(Г) спектр 1 Н-ядерного магнитного резонанса (ЯМР), зарегистрированный при 600 МГц в смеси метанол-d4:Н 2 О (рН 4,3 HCl) 40:10 (об./об.) при 40 С на спектрометре Bruker AMX 600 с применением последовательности вытеснения воды и с использованием в качестве внутреннего стандарта остаточного сигнала метанол-d4 при 3,31 м.д., демонстрирует следующие сигналы [=м.д. мультиплетность; (соотнесение)]: 0.93 d (CH3), 0.98 d (CH3), 1.07 t (перекрывающиеся СН 3), 1.18 t (перекрывающиеся СН 3), 1.26 s(Д) 13 С-ЯМР спектр, зарегистрированный в смеси метанол-d4:Н 2 О (рН 4,3 HCl) 40:10 (об./об.) при 40 С на спектрометре Bruker AMX 600, с использованием в качестве внутреннего стандарта остаточного сигнала метанола-d4 при 49,15 м.д., демонстрирует следующие сигналы: [=м.д.; (соотнесение)]: 13.623.2 (алифатические СН 3), 26.16-73 (алифатические СН 2 и пептидные альфа СН), 105-136 (ароматические СН и СН двойных связей и четвертичные атомы углерода), 164.3-176.3 (пептидные карбонилы);(Е) кислотный гидролизат в 6 н. HCl (105 С, 24 ч) демонстрирует присутствие следующих аминокислот наряду с другими неидентифицированными пиками после дериватизации с использованием 6 аминохинолил-N-гидроксисукцинимидилкарбамата: лантионин, метиллантионин, глицин, пролин, валин,аспарагиновая кислота (продукт гидролиза аспарагина), фенилаланин и лейцин;(З) основная ионизируемая функция, обнаруживаемая путем кислотного/основного титрования,осуществляемого 0,01 н. гидроксидом калия в смеси 2-метоксиэтанол (MCS):H2O 12:3 (об./об.), содержащей молярный избыток 0,01 н. соляной кислоты. 14. Фактор А 1 антибиотика 107891, представляющий собой белый порошок, обладающий следующими характеристиками:A) дважды протонированный ион с m/z 1124, соответствующий наименьшей изотопной композиции в масс-спектре, зарегистрированном в 0,1 мг/мл растворе в смеси ацетонитрил:вода 50:50 (об./об.) с 0,5% уксусной кислоты на аппарате Thermofinnigan LCQ deca, оборудованном источником электрораспыления, с использованием калибровочной смеси Thermofinnigan в следующих условиях электрораспыления: напряжение распыления - 4,7 кВ; температура капилляра - 250 С; капиллярное напряжение - 8 В; режим введения - 10 мкл/мин; Б) точная масса антибиотика, определенная с использованием 4,7 Т спектрометра Bruker DaltonicsAPEX II, оборудованного источником электрораспыления, соответствует молекулярной массе 2246,710,06, рассчитанной моноизотопной массе из [М+2 Н]2+ с m/z 1124,36124 (точность 30 м.д.);B) при растворении в смеси CD3CN:D2O (1:1) 1 Н ЯМР спектр демонстрирует следующие группы сигналов (в м.д.) при 600 МГц с использованием CD3CN в качестве внутреннего стандарта (1,94 м.д.),[=м.д., мультиплетность; (соотнесение)]: 0.84 d (СН 3), 0.89 d (СН 3), 0.94 t (перекрывающиеся СН 3), 1.1 dd (СН двойной связи), 6.36 m (СН), 6.86 d (CH двойной связи), 7.0-7.45 m (ароматические СН); Г) при растворении в смеси CD3CN:D2O (1:1), 13 С ЯМР спектр демонстрирует следующие сигналы(в м.д.) при 600 МГц с использованием CD3CN в качестве внутреннего стандарта (1,39 м.д.), [=млн-1;(соотнесение)]: 13.6-23.03 (алифатические СН 3), 25.69-77.9 (алифатические СН 2 и пептидные СН), 105137.3 (ароматические СН и СН двойной связи и четвертичные атомы углерода), 165.6-176.6 (пептидные карбонилы); Д) инфракрасный спектр, зарегистрированный в KBr с использованием спектрофотометра BrukerFT-IR модель IFS 48, демонстрирует максимумы абсорбции при (см-1): 3294; 3059; 2926; 1661; 1529; 1433; 1407; 1287; 1114; 1021; Е) ультрафиолетовый (УФ) спектр в смеси метанол:Н 2 О 80:20 (об./об.) с использованием спектрофотометра Perkin-Elmer Lambda 16 демонстрирует два плеча при 226 и 267 нм; Ж) кислотный гидролизат в 6 н. HCl (105 С, 24 ч) демонстрирует присутствие следующих аминокислот наряду с другими неидентифицированными пиками после дериватизации с использованием 6 аминохинолил-N-гидроксисукцинимидилкарбамата: лантионин, метиллантионин, глицин, пролин, валин,аспарагиновая кислота (продукт гидролиза аспарагина), фенилаланин и лейцин; и З) кислотный гидролизат в 4 н. метансульфоновой кислоте, содержащей 0,2% (мас./об.) 3-(2 аминоэтил)индола в качестве катализатора (115 С, 16 ч), демонстрирует присутствие 5-хлортриптофана. 15. Фактор А 2 антибиотика 107891, представляющий собой белый порошок, обладающий следующими характеристиками:A) дважды протонированный ион с m/z 1116, соответствующий наименьшей изотопной композиции в масс-спектре, зарегистрированном в 0,1 мг/мл растворе в смеси ацетонитрил:вода 50:50 (об./об.) с 0,5% уксусной кислоты на аппарате Thermofinnigan LCQ deca, оборудованном источником электрораспыления, с использованием калибровочной смеси Thermofinnigan в следующих условиях электрораспыления: напряжение распыления - 4,7 кВ; температура капилляра - 250 С; капиллярное напряжение - 8 В; режим введения - 10 мкл/мин; Б) точная масса, определенная с использованием 4,7 Т спектрометра Bruker Daltonics APEX II, оборудованного источником электрораспыления, соответствует молекулярной массе 2230,710,06, рассчитанной моноизотопной массе из [М+2 Н]2+ с m/z 1115,36260 (точность 30 м.д.);B) при растворении в смеси CD3CN:D2O (1:1) 1 Н ЯМР спектр демонстрирует следующие группы сигналов (в м.д.) при 600 МГц с использованием CD3CN в качестве внутреннего стандарта (1,94 м.д.),[=м.д., мультиплетность; (соотнесение)]: 0.84 d (СН 3), 0.88 d (СН 3), 0.94 d (СН 3), 1.06 d (СН 3), 1.14 d(пептидные СН), 3.8-4.9 m (пептидные СН), 5.45-6.14 s (CH2), 5.59 d (CH двойной связи), 6.34 m (CH),6.84 d (CH двойной связи), 7.0-7.42 m (ароматические СН); Г) при растворении в смеси CD3CN:D2O (1:1), 13 С ЯМР спектр демонстрирует следующие сигналы(в м.д.) при 600 МГц с использованием CD3CN в качестве внутреннего стандарта (1,39 м.д.), [=м.д;(соотнесение)]: 13.6-22.9 (алифатические СН 3), 25.65-73 (алифатические СН 2 и пептидные СН), 105137.3 (ароматические СН и СН двойной связи и четвертичные атомы углерода), 165.7-176.1 (пептидные карбонилы); Д) инфракрасный спектр, зарегистрированный в KBr с использованием спектрофотометра BrukerFT-IR модель IFS 48, демонстрирует максимумы абсорбции при (см-1): 3296; 3060; 2928; 1661; 1529; 1433; 1407; 1288; 1116; Е) ультрафиолетовый (УФ) спектр в смеси метанол:H2O 80:20 (об./об.) с использованием спектрофотометра Perkin-Elmer Lambda 16 демонстрирует два плеча при 226 и 267 нм; Ж) кислотный гидролизат в 6 н. HCl (105 С, 24 ч) демонстрирует присутствие следующих аминокислот наряду с другими неидентифицированными пиками после дериватизации с использованием 6 аминохинолил-N-гидроксисукцинимидилкарбамата: лантионин, метиллантионин, глицин, пролин, валин,аспарагиновая кислота (продукт гидролиза аспарагина), фенилаланин и лейцин; и З) кислотный гидролизат в 4 н. метансульфоновой кислоте, содержащей 0,2% (мас./об.) 3-(2 аминоэтил)индола в качестве катализатора (115 С, 16 ч), демонстрирует присутствие 5-хлортриптофана. 16. Способ получения антибиотика 107891 и его факторов А 1 и А 2 и их солей с кислотами, включающий стадии культивирования культуры Microbispora sp. АТСС РТА-5024 или его варианта или мутанта с сохранением способности продуцировать указанный антибиотик в аэробных условиях в водной питательной среде, содержащей ассимилируемый источник углерода, азота и неорганических солей; выделения получающегося в результате антибиотика из мицелия и/или профильтрованного ферментационного бульона и очистки выделенного антибиотика 107891. 17. Способ по п.16, при котором штамм Microbispora sp. АТСС РТА-5024 или его вариант или мутант, продуцирующий антибиотик 107891, подвергают предварительному культивированию. 18. Способ по п.16, при котором выделение антибиотика 107891 осуществляют путем фильтрования ферментационного бульона и антибиотик выделяют из профильтрованного ферментационного бульона методом, выбранным из группы, состоящей из экстракции не смешивающимся с водой растворителем,осаждения путем добавления нерастворителя или путем изменения рН раствора, абсорбционной хроматографии, распределительной хроматографии, распределительной хроматографии с обращенной фазой,ионообменной хроматографии, молекулярной вытеснительной хроматографии и комбинации двух или более указанных методов. 19. Способ по п.16, при котором выделение антибиотика 107891 осуществляют путем отделения мицелия от супернатанта ферментационного бульона и мицелий экстрагируют смешивающимся с водой растворителем, посредством чего после удаления отработанного мицелия получают смешивающийся с водой раствор, содержащий неочищенный антибиотик, который может быть обработан отдельно или вместе с профильтрованным ферментационным бульоном для выделения антибиотика 107891 методом,выбранным из группы, состоящей из экстракции растворителем, осаждения путем добавления нерастворителя или путем изменения рН раствора, абсорбционной хроматографии, распределительной хроматографии, распределительной хроматографии с обращенной фазой, ионообменной хроматографии и молекулярной вытеснительной хроматографии и комбинации двух или более указанных методов. 20. Способ по п.19, при котором концентрацию смешивающегося с водой растворителя в экстракте мицелия понижают до того, как его подвергают обработке для выделения из него антибиотика. 21. Способ по п.18, при котором профильтрованный ферментационный бульон приводят в контакт с абсорбирующей смолой и указанную смолу подвергают элюции полярным смешивающимся с водой растворителем или его смесью с водой, в результате чего получают раствор, содержащий неочищенный антибиотик 107981. 22. Способ по п.21, при котором абсорбирующая смола выбрана из группы, состоящей из полистирола, смешанного полистирола-дивинилбензола и полиамидной смолы. 23. Способ по п.19, при котором мицелий экстрагируют С 1-С 3 алканолом и экстракт мицелия приводят в контакт с абсорбирующей смолой и элюируют из нее полярным смешивающимся с водой растворителем или его смесью с водой, в результате чего получают раствор, содержащий неочищенный антибиотик 107891. 24. Способ по п.18, при котором растворы, содержащие неочищенный антибиотик 107891, объеди- 27012164 няют и обрабатывают для дополнительной очистки указанного антибиотика 107891. 25. Способ по п.21, при котором раствор, содержащий неочищенный антибиотик 107981, концентрируют и затем сушат замораживанием с получением твердого продукта неочищенного антибиотика 107891. 26. Способ по п.21, при котором объединяют абсорбирующие смолы, содержащие абсорбированный антибиотик, и их смесь элюируют полярным смешивающимся с водой растворителем или его смесью с водой. 27. Способ по п.16, при котором антибиотик 107981 очищают при помощи хроматографии, предпочтительно путем препаративной жидкостной хроматографии высокого давления (ЖХВД) или хроматографии среднего давления. 28. Способ по п.16, при котором фактор А 1 и фактор А 2 при помощи препаративной ЖХВД выделяют из очищенного антибиотика 107891. 29. Фармацевтическая композиция, содержащая антибиотик, выбранный из антибиотика 107891,фактора А 1 антибиотика 107891, фактора А 2 антибиотика 107891 и смеси указанных факторов в любом соотношении или их фармацевтически приемлемой соли с кислотой, и фармацевтически приемлемый носитель. 30. Антибиотик 107891, его фактор А 1, его фактор А 2 или смесь указанных факторов в любом соотношении или их фармацевтически приемлемая соль с кислотой для применения в качестве лекарственного средства. 31. Применение антибиотика 107891, его фактора А 1, его фактора А 2 или смеси указанных факторов в любом соотношении или их фармацевтически приемлемой соли с кислотой для изготовления лекарственного средства для лечения или предупреждения бактериальных инфекций. 32. Применение антибиотика 107891, его фактора А 1, его фактора А 2 или смеси указанных факторов в любом соотношении и их нетоксичной соли с кислотой в качестве стимулятора роста животного. 33. Штамм Microbispora sp. АТСС РТА-5024, или его вариант, или мутант, сохраняющий способность продуцировать антибиотик 107891 при выращивании культуры в глубинных аэробных условиях в присутствии ассимилируемых источников углерода, азота и неорганических солей.
МПК / Метки
МПК: A61K 38/12, A61P 31/04
Метки: факторы, приемлемые, 107891, применение, фармацевтически, антибиотик, соли, композиции
Код ссылки
<a href="https://eas.patents.su/30-12164-antibiotik-107891-ego-faktory-a1-i-a2-farmacevticheski-priemlemye-soli-i-kompozicii-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Антибиотик 107891, его факторы а1 и а2, фармацевтически приемлемые соли и композиции и их применение</a>
Предыдущий патент: Способ получения хиральных 8-(3-аминопиперидин-1-ил)ксантинов
Следующий патент: Ферментативное получение витамина с
Случайный патент: Пролекарства производных имидазопиридина