Пролекарства производных имидазопиридина
Номер патента: 5597
Опубликовано: 28.04.2005
Авторы: Бур Вильм, Зенн-Билфингер Йёрг, Зимон Вольфганг-Александер, Кромер Вольфганг, Хубер Райнхард, Постиус Штефан
Формула / Реферат
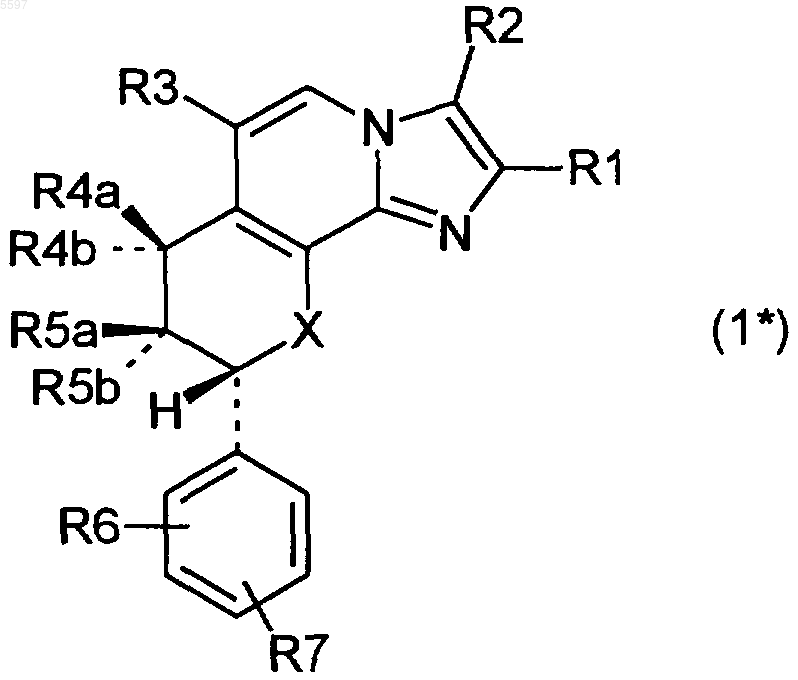
1. Соединение формулы 1

в котором
R1 означает водород, C1-C4алкил или гидрокси(C1-C4)алкил,
R2 означает водород, C1-C4алкил, гидрокси(C1-C4)алкил, галоген, C2-C4алкенил или C2-C4алкинил,
R3 означает водород, галоген, трифторметил, C1-C4алкил, C2-C4алкенил, C2-C4алкинил, карбоксил, -CO-(C1-C4)алкокси, гидрокси(C1-C4)алкил, C1-C4алкокси(C1-C4)алкил, фтор(C1-C4)алкокси(C1-C4)алкил или радикал -CO-NR3aR3b,
один из заместителей R4a и R4b означает водород, а другой означает гидроксил, C1-C4алкокси, C1-C4алкокси(C1-C4)алкокси, C1-C4алкилкарбонилокси или радикал R4', или R4a и R4b вместе означают O (кислород),
где R4' означает радикал, образующий гидроксильную группу в физиологических условиях,
один из заместителей R5a и R5b означает водород, а другой означает водород, гидроксил, C1-C4алкокси, C1-C4алкокси(C1-C4)алкокси, C1-C4алкилкарбонилокси или радикал R5', или R5a и R5b вместе означают O (кислород),
где R5' означает радикал, образующий гидроксильную группу в физиологических условиях,
где один из заместителей R4a и R4b должен означать R4' и/или один из заместителей R5a и R5b должен означать R5',
R6 означает водород, галоген, C1-C4алкил, C1-C4алкокси, C1-C4алкоксикарбониламино, C1-C4алкокси(C1-C4)алкоксикарбониламино или трифторметил,
R7 означает водород, галоген, C1-C4алкил или C1-C4алкокси, а
X означает O (кислород) или NH,
где R3a означает водород, C1-C7алкил, гидрокси(C1-C4)алкил или C1-C4алкокси(C1-C4)алкил, и
R3b означает водород, C1-C7алкил, гидрокси(C1-C4)алкил или C1-C4алкокси(C1-C4)алкил, или где
R3a и R3b вместе, включая атом азота, к которому они присоединены, означают радикал пирролидино, пиперидино или морфолино;
или его соли.
2. Соединение формулы 1 по п.1, в котором
R1 означает C1-C4алкил,
R2 означает C1-C4алкил или гидрокси(C1-C4)алкил,
R3 означает водород, галоген, карбоксил, -CO-(C1-C4)алкокси, гидрокси(C1-C4)алкил, C1-C4алкокси(C1-C4)алкил, фтор(C1-C4)алкокси(C1-C4)алкил или радикал -CO-NR3aR3b,
один из заместителей R4a и R4b означает водород, а другой означает гидроксил, C1-C4алкокси, C1-C4алкокси(C1-C4)алкокси или радикал -OR', или R4a и R4b вместе означают O (кислород),
один из заместителей R5a и R5b означает водород, а другой означает водород, гидроксил, C1-C4алкокси, C1-C4алкокси(C1-C4)алкокси или радикал -OR', или R5a и R5b вместе означают O (кислород),
где один из заместителей R4a и R4b должен иметь значение -OR' и/или один из заместителей R5a и R5b должен иметь значение -OR',
R6 означает водород, галоген, C1-C4алкил, C1-C4алкокси, C1-C4алкоксикарбониламино, C1-C4алкокси(C1-C4)алкоксикарбониламино или трифторметил,
R7 означает водород, галоген, C1-C4алкил или C1-C4алкокси, а
X означает O (кислород) или NH,
где R3a означает водород, C1-C7алкил, гидрокси(C1-C4)алкил или C1-C4алкокси(C1-C4)алкил, и
R3b означает водород, C1-C7алкил, гидрокси(C1-C4)алкил или C1-C4алкокси(C1-C4)алкил, или где
R3a и R3b вместе, включая атом азота, к которому они присоединены, означают радикал пирролидино, пиперидино или морфолино и где
радикал R' выбирают из группы, включающей
-C(O)-NR8R9,
-C(O)-алк-NR8R9,
-C(O)-алк-C(O)-NR8R9,
-P(O)(OH)2,
-S(O)2NR8R9,
-C(O)-R8,
-C(O)-C6H3R10R11,
-C(O)-OR8,
-C(O)-алк-C(O)-R8,
-C(O)-алк-C(O)-OR8,
-C(O)-C(O)-R8,
-C(O)-C(O)-OR8 и
-CH2-OR8, где
алк означает C1-C7алкилен,
R8 означает водород, C1-C10алкил или C1-C4алкил, замещенный группой галоген, карбоксил, гидроксил, сульфо (-SO3H), сульфамоил (-SO2NH2), карбамоил (-CONH2), C1-C4алкокси или C1-C4алкоксикарбонил,
R9 означает водород или C1-C4алкил,
R10 означает водород, галоген, нитро, C1-C4алкил, C1-C4алкокси, C1-C4алкоксикарбонил, C1-C4алкоксикарбониламино, C1-C4алкокси(C1-C4)алкоксикарбониламино или трифторметил, и
R11 означает водород, галоген, C1-C4алкил или C1-C4алкокси,
и его соли.
3. Соединение по п.1 формулы 1*
в котором
R1 означает C1-C4алкил,
R2 означает C1-C4алкил,
R3 означает водород, хлор, фтор, гидроксиметил, дифторметоксиметил или радикал -CO-NR3aR3b,
один из заместителей R4a и R4b означает водород, а другой означает гидроксил, C1-C4алкокси, C1-C4алкокси(C1-C4)алкокси или радикал -OR', или R4a и R4b вместе означают O (кислород),
один из заместителей R5a и R5b означает водород, а другой означает гидроксил, C1-C4алкокси, C1-C4алкокси(C1-C4)алкокси или радикал -OR', или R5a и R5b вместе означают O (кислород),
где один из заместителей R4a и R4b должен иметь значение -OR' и/или один из заместителей R5a и R5b должен иметь значение -OR',
R6 означает водород,
R7 означает водород и
X означает O (кислород) или NH,
где R3a означает водород, C1-C4алкил, гидрокси(C1-C4)алкил или C1-C4алкокси(C1-C4)алкил, и
R3b означает водород, C1-C4алкил, гидрокси(C1-C4)алкил или C1-C4алкокси(C1-C4)алкил,
и где
R' выбирают из группы, включающей
-C(O)-NR8R9,
-C(O)-алк-NR8R9,
-C(O)-алк-C(O)-NR8R9,
-P(O)(OH)2,
-S(O)2NR8R9,
-C(O)-R8,
-C(O)-C6H3R10R11,
-C(O)-OR8,
-C(O)-алк-C(O)-OR8,
-C(O)-C(O)-OR8, и
-CH2-OR8, где
алк означает C1-C7алкилен,
R8 означает водород, C1-C10алкил или C1-C4алкил, замещенный группой карбоксил или сульфо(-SO3H),
R9 означает водород или C1-C4алкил,
R10 означает водород, галоген, нитЁю, C1-C4алкил, C1-C4алкокси, C1-C4алкоксикарбонил, C1-C4алкоксикарбониламино, C1-C4алкокси(C1-C4)алкоксикарбониламино или трифторметил, и
R11 означает водород, галоген, C1-C4алкил или C1-C4алкокси,
или его соли.
4. Соединение по п.1 формулы 1* по п.3, в котором
R1 означает метил,
R2 означает метил,
R3 означает водород, хлор, фтор, гидроксиметил, дифторметоксиметил или радикал -CO-NR3aR3b,
один из заместителей R4a и R4b означает водород, а другой означает C1-C4алкокси или C1-C4алкокси(C1-C4)алкокси,
один из заместителей R5a и R5b означает водород, а другой означает радикал -OR',
R6 означает водород,
R7 означает водород, а
X означает O (кислород) или NH,
где R3a означает водород, метил, этил, пропил, 2-гидроксиэтил или 2-метоксиэтил, а
R3b означает водород, метил или этил и где R' выбирают из группы, включающей
-C(O)-NR8R9,
-C(O)-алк-NR8R9,
-C(O)-алк-C(O)-NR8R9,
-P(O)(OH)2,
-S(O)2NR8R9,
-C(O)-R8,
-C(O)-C6H3R10R11,
-C(O)-OR8,
-C(O)-алк-C(O)-OR8,
-C(O)-C(O)-OR8, и
-CH2-OR8, где
алк означает C1-C7алкилен,
R8 означает водород, C1-C10алкил или C1-C4алкил, замещенный группой карбоксил или сульфо(-SO3H),
R9 означает водород или C1-C4алкил,
R10 означает водород, галоген, нитро, C1-C4алкил, C1-C4алкокси, C1-C4алкоксикарбонил или трифторметил, и
R11 означает водород или галоген,
или его соли.
5. Соединение по п.4, в котором R' означает -C(O)-N(CH3)2, -C(O)-N(C2H5)2, -C(O)-NHC2H5, -C(O)-CH2CH2NH2, -C(O)-(CH2)3NH2, -C(O)-C(CH3)2NH2, -C(O)-CH2N(CH3)2, -C(O)-CH(NH2)-CH(CH3)2, -C(O)-CH(NH2)CH(CH3)C2H5, -C(O)-(CH2)6C(O)N(CH3)CH2CH2SO3H, -P(O)(OH)2, -S(O)2NH2, -C(O)-H, -C(O)-C(CH3)3, -C(O)-CH2CH2COOH, -C(O)-CH3, -C(O)-C2H5, -C(O)-CH2OCH3, -C(O)-C6H5, -C(O)-C6H4-4-NO2, -C(O)-C6H4-3-NO2, -C(O)-C6H4-4-OCH3, -C(O)-C6H4-4-C(O)-OCH3, -C(O)-OCH3, -C(O)-O-ментил, -C(O)-CH2-C(O)-OCH3, -C(O)-CH2CH2-C(O)-OCH3, -C(O)-C(O)-OCH3, -C(O)-C(O)-OC2H5 или -CH2OCH(CH3)2.
6. Соединение по п.1 формулы 1* по п.3, в котором
R1 означает метил,
R2 означает метил,
R3 означает водород, хлор, фтор, гидроксиметил, дифторметоксиметил или радикал -CO-NR3aR3b,
один из заместителей R4a и R4b означает водород, а другой означает C1-C4алкокси или C1-C4алкокси(C1-C4)алкокси,
R5a означает радикал -OR',
R5b означает водород,
R6 означает водород,
R7 означает водород, а
X означает O (кислород) или NH,
где R3a означает водород, метил, этил, пропил, 2-гидроксиэтил или 2-метоксиэтил, а
R3b означает водород, метил или этил и где
R' выбирают из группы, включающей
-C(O)-NR8R9,
-C(O)-алк-NR8R9,
-C(O)-R8,
-C(O)-C6H3R10R11,
-C(O)-OR8,
-C(O)-алк-C(O)-OR8, и
-C(O)-C(O)-OR8,
где алк означает C1-C4алкилен,
R8 означает водород, C1-C10алкил или C1-C4алкил, замещенный группой C1-C4алкокси,
R9 означает водород или C1-C4алкил,
R10 означает водород, галоген, нитро, C1-C4алкил, C1-C4алкокси, C1-C4алкоксикарбонил или трифторметил и
R11 означает водород или галоген,
или его соли.
7. Соединение по п.1 формулы 1* по п.3, в котором
R1 означает метил,
R2 означает метил,
R3 означает водород,
один из заместителей R4a и R4b означает водород, а другой означает C1-C4алкокси или C1-C4алкокси(C1-C4)алкокси,
R5a означает радикал -OR',
R5b означает водород,
R6 означает водород,
R7 означает водород, а
X означает O (кислород) или NH,
где R' выбирают из группы, включающей
-C(O)-NR8R9,
-C(O)-алк-NR8R9,
-C(O)-R8,
-C(O)-C6H3R10R11,
-C(O)-OR8,
-C(O)-алк-C(O)-OR8, и
-C(O)-C(O)-OR8,
где алк означает C1-C4алкилен,
R8 означает водород, C1-C10алкил или C1-C4алкил, замещенный группой C1-C4алкокси,
R9 означает водород или C1-C4алкил,
R10 означает водород, нитро, C1-C4алкокси или C1-C4алкоксикарбонил, и R11 означает водород, или его соли.
8. Соединение по п.7, в котором R' означает -C(O)-N(CH3)2, -C(O)-N(C2H5)2, -C(O)-NHC2H5, -C(O)-CH2N(CH3)2, -C(O)-H, -C(O)-CH3, -C(O)-C2H5, -C(O)-CH2OCH3, -C(O)-C6H5, -C(O)-C6H4-4-NO2, -C(O)-C6H4-3-NO2, -C(O)-C6H4-4-OCH3, -C(O)-C6H4-4-C(O)-OCH3, -C(O)-OCH3, -C(O)-O-ментил, -C(O)-CH2-C(O)-OCH3, -C(O)-CH2CH2-C(O)-OCH3, -C(O)-C(O)-OCH3 или -C(O)-C(O)-OC2H5.
9. Лекарственный препарат, включающий соединение по п.1 и/или его фармакологически приемлемую соль в смеси с обычными фармацевтическими эксципиентами и/или наполнителями.
10. Применение соединений по п.1 и их фармакологически приемлемых солей для профилактики и лечения заболеваний желудочно-кишечного тракта.
Текст
005597 Область применения изобретения Изобретение относится к новым соединениям, которые используют в фармацевтической промышленности в качестве активных соединений для изготовления лекарственных препаратов. Уровень техники В патенте US4468400 описаны трициклические имидазо[1,2-а]пиридины с различными циклическими системами, конденсированными с базовой структурой, имидазопиридином, которые могут быть использованы для терапии пептической язвы. В международной заявке WO 95/27714 описаны некоторые замещенные трициклические имидазо[1,2-а]пиридины, которые, как считают, обратимо ингибируют секрецию соляной кислоты желудочного сока и используются для профилактики и лечения воспалительных заболеваний желудочно-кишечного тракта. В международной заявке WO 98/42707 описаны тетрагидроимидазо[1,2-h][1,7]нафтиридины, которые могут быть использованы для профилактики и лечения заболеваний желудочно-кишечного тракта. В WO 98/54188 описаны конденсированные дигидропираны,которые, как считают, могут быть использованы для терапии нарушений типа пептической язвы. В германском выкладном описании изобретения в неакцептованной заявке 4308095 описаны некоторые пролекарства фармацевтически активных агентов с гидроксильными группами. Описание изобретения Изобретение относится к соединениям формулы 1R1 означает водород, С 1-С 4 алкил или гидрокси(С 1-С 4)алкил,R2 означает водород, С 1-С 4 алкил, гидрокси(С 1-С 4)алкил, галоген, С 2-С 4 алкенил или С 2-С 4 алкинил,R3 означает водород, галоген, трифторметил, С 1-С 4 алкил, С 2-С 4 алкенил, С 2-С 4 алкинил, карбоксил,-СО-(С 1-С 4)алкокси, гидрокси(С 1-С 4)алкил, С 1-С 4 алкокси(С 1-С 4)алкил, фтор(С 1-С 4)алкокси(С 1-С 4)алкил или радикал -CO-NR3aR3b,один из заместителей R4a и R4b означает водород, а другой означает гидроксил, С 1-С 4 алкокси, С 1 С 4 алкокси(С 1-С 4)алкокси, С 1-С 4 алкилкарбонилокси или радикал R4', или R4a и R4b вместе означают О(кислород),где R4' означает радикал, образующий гидроксильную группу в физиологических условиях,один из заместителей R5a и R5b означает водород, а другой означает водород, гидроксил, С 1-С 4 алкокси, С 1-С 4 алкокси(С 1-С 4)алкокси, C1-С 4 алкилкарбонилокси или радикал R5', или R5a и R5b вместе означают О (кислород),где R5' означает радикал, образующий гидроксильную группу в физиологических условиях,где один из заместителей R4a и R4b должен означать R4' и/или один из заместителей R5a и R5b должен означать R5',R6 означает водород, галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 алкоксикарбониламино, С 1-С 4 алкокси(С 1-С 4)алкоксикарбониламино или трифторметил,R7 означает водород, галоген, С 1-С 4 алкил или С 1-С 4 алкокси, а Х означает О (кислород) или NH,гдеR3a и R3b вместе, включая атом азота, к которому они присоединены, означают радикал пирролидино, пиперидино или морфолино; и к их солям. С 1-С 4 алкил означает прямые или разветвленные алкильные радикалы, содержащие от 1 до 4 атомов углерода, примерами которых являются радикалы бутил, изобутил, втор-бутил, трет-бутил, пропил, изопропил, этил и метил. Гидрокси(С 1-С 4)алкил означает вышеупомянутые С 1-С 4 алкильные радикалы, замещенные гидроксильной группой. Примеры включают радикалы гидроксиметил, 2-гидроксиэтил и 3-гидроксипропил. Галоген в контексте изобретения означает бром, хлор или фтор. С 2-С 4 алкенил означает прямые или разветвленные алкенильные радикалы, содержащие от 2 до 4 атомов углерода. Примеры включают радикалы 2-бутенил, 3-бутенил,1-пропенил и 2-пропенил (аллил).-1 005597 С 2-С 4 алкинил означает прямые или разветвленные алкинильные радикалы, содержащие от 2 до 4 атомов углерода. Примеры включают радикалы 2-бутинил, 3-бутинил и предпочтительно 2-пропинил(пропаргил). С 1-С 4 алкокси означает радикалы, которые наряду с атомом кислорода содержат прямые или разветвленные алкильные радикалы, содержащие от 1 до 4 атомов углерода. Примеры включают радикалы бутокси, изобутокси, втор-бутокси, трет-бутокси, пропокси, изопропокси, предпочтительно этокси и метокси. С 1-С 4 алкокси(С 1-С 4)алкил означает один из вышеупомянутых С 1-С 4 алкильных радикалов, замещенный одним из вышеупомянутых радикалов С 1-С 4 алкокси. Примеры включают радикалы метоксиметил,метоксиэтил и бутоксиэтил. Фтор(С 1-С 4)алкокси(С 1-С 4)алкил означает один из вышеупомянутых С 1-С 4 алкильных радикалов,замещенный радикалом фтор(С 1-С 4)алкокси. В этом случае фтор(С 1-С 4)алкокси означает один из вышеупомянутых радикалов С 1-С 4 алкокси, полностью или частично замещенный фтором. Примеры С 1 С 4 алкокси, полностью или частично замещенного фтором, включают радикалы 1,1,1,3,3,3 -гексафтор-2 пропокси, 2-трифторметил-2-пропокси, 1,1,1-трифтор-2-пропокси, перфтор-трет-бутокси, 2,2,3,3,4,4,4 гептафтор-1-бутокси, 4,4,4-трифтор-1-бутокси, 2,2,3,3,3-пентафторпропокси, перфторэтокси, 1,2,2 трифторэтокси, прежде всего, 1,1,2,2-тетрафторэтокси, 2,2,2-трифторэтокси, трифторметокси, и предпочтительно дифторметокси. С 1-С 4 алкокси(С 1-С 4)алкокси означает один из вышеупомянутых радикалов С 1-С 4 алкокси, замещенный, кроме того, радикалом С 1-С 4 алкокси. Примеры включают радикалы 2-(метокси)этокси(СН 3-О-СН 2 СН 2-О-) и 2-(этокси)этокси (СН 3-СН 2-О-СН 2-СН 2-О-). С 1-С 4 алкилкарбонил означает радикал, который наряду с карбонильной группой содержит один из вышеупомянутых С 1-С 4 алкильных радикалов. Примером является радикал ацетил. С 1-С 4 алкилкарбонилокси означает группу С 1-С 4 алкилкарбонил, присоединенную к атому кислорода. Примером является радикал ацетокси (СН 3-СО-O-). Радикал, образующий в физиологических условиях гидроксильную группу, означает радикал -OR',от которого группа R' удаляется гидролизом в организме человека или животного с образованием радикала -ОН и нетоксичного соединения R'OH. Таким образом, радикал R' может также означать защитную группу гидроксильной группы или радикал "пролекарство". Такие защитные группы гидроксильной группу или радикалы "пролекарство" описаны в патентных заявках DE 4308095, WO 95/14016, ЕР 694547, WO 95/11884, WO 94/05282 и в патенте США 5432183. Например, можно упомянуть радикалыR' общей структуры -C(O)R, -C(O)NRaRb, -P(O)ORaORb или -S(O)2OR, где R, Ra и Rb означают любые соответствующие органические радикалы, или необязательно водород. В одном из вариантов осуществления изобретения R4' и R5' содержат общую защитную группу гидроксильной группы R', которая может иметь строение, например, -CRaRb-, -CRa(ORb)-, -C(ORa)(ORb)- или -P(O)OR-. С 1-С 4 алкоксикарбонил означает группу карбонил, к которой присоединен один из вышеупомянутых радикалов С 1-С 4 алкокси. Примеры включают радикалы метоксикарбонил (СН 3 О-С(О)-) и этоксикарбонил (СН 3 СН 2O-С(O)-). С 1-С 4 алкоксикарбониламино означает радикал амино, замещенный одним из вышеупомянутых радикалов С 1-С 4 алкоксикарбонил. Примеры включают радикалы этоксикарбониламино и метоксикарбониламино. С 1-С 4 алкокси(С 1-С 4)алкоксикарбонил означает карбонильную группу, связанную с одним из вышеупомянутых радикалов С 1-С 4 алкокси(С 1-С 4)алкокси. Примеры включают радикалы 2(метокси)этоксикарбонил (СН 3-О-СН 2 СН 2-О-СО-) и 2-(этокси)этоксикарбонил (СН 3 СН 2-O-СН 2 СН 2-OСО-). С 1-С 4 алкокси(С 1-С 4)алкоксикарбониламино означает радикал амино, замещенный одним из вышеупомянутых радикалов С 1-С 4 алкокси(С 1-С 4)алкоксикарбонил. Примеры включают радикалы 2(метокси)этоксикарбониламино и 2-(этокси)этоксикарбониламино. Радикалы R', упомянутые в контексте изобретения, например, означают группы-2 005597 алк означает С 1-С 7 алкилен,R8 означает водород, C1-С 10 алкил или C1-С 4 алкил, замещенный группой галоген, карбоксил, гидроксил, сульфо (-SО 3 Н), сульфамоил (-SO2NH2), карбамоил (-CONH2), C1-С 4 алкокси или C1-С 4 алкоксикарбонил,R9 означает водород или C1-С 4 алкил,R10 означает водород, галоген, нитро, C1-С 4 алкил, C1-С 4 алкокси, C1-С 4 алкоксикарбонил, C1-С 4 алкоксикарбониламино, C1-С 4 алкокси(C1-С 4)алкоксикарбониламино или трифторметил, иC1-С 7 алкилен означает прямые или разветвленные C1-С 7 алкиленовые радикалы, например, радикалы метилен (-СН 2-), этилен (-СН 2-СН 2-), триметилен (-СН 2-СН 2-СН 2-), тетраметилен (-СН 2-СН 2-СН 2-СН 2-),1,2-диметилэтилен [-СН(СН 3)-СН(СН 3)-], 1,1-диметилэтилен [-С(СН 3)2-СН 2-], 2,2-диметилэтилен [-СН 2 С(СН 3)2-], изопропилиден [-С(СН 3)2-], 1-метилэтилен [-СН(СН 3)-СН 2-], пентаметилен (-СН 2-СН 2-СН 2 СН 2-СН 2-), гексаметилен (-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2-) и гептаметилен (-СН 2-СН 2-СН 2-СН 2-СН 2-СН 2 СН 2-).C1-С 10 алкил, используемый в настоящем изобретении, означает прямые, разветвленные или циклические алкильные радикалы, содержащие от 1 до 10 атомов углерода. Примеры включают радикалы ментил, неоментил, изоментил, неоизоментил, октил, изооктил (6-метилгептил), гептил, изогептил (5 метилгексил), гексил, изогексил (4-метилпентил), неогексил (3,3-диметилбутил), пентил, изопентил (3 метилбутил), неопентил (2,2-диметилпропил), бутил, изобутил, втор-бутил, трет-бутил, пропил, изопропил, этил и метил. В этой связи примерами предпочтительных радикалов R' являются группы -C(O)-N(CH3)2, -C(O)N(C2H5)2, -C(O)-NHC2H5, -C(O)-CH2CH2NH2, -C(O)-(CH2)3NH2, -С(O)-С(СН 3)2NН 2, -С(O)-СН 2N(СН 3)2,-C(O)-CH(NH2)-СН(СН 3)2,-С(O)-СН(NН 2)СН(СН 3)С 2 Н 5,-С(O)-(СН 2)6 С(O)N(СН 3)СН 2 СН 2SO3 Н,-Р(O)(ОН)2, -S(O)2NH2, -С(O)-Н, -С(O)-С(СН 3)3, -С(O)-СН 2 СН 2 СООН, -С(O)-СН 3, -С(O)-С 2 Н 5, -С(O)-С 6 Н 5,-С(O)-С 6 Н 4-4-NO2, -С(O)-С 6 Н 4-3-NO2, -С(O)-С 6 Н 4-4-ОСН 3, -С(O)-С 6 Н 4-4-С(O)-ОСН 3, -С(O)-ОСН 3, -С(O)O-ментил, -С(O)-СН 2-С(O)-ОСН 3, -С(O)-СН 2 СН 2-С(O)-ОСН 3, -С(O)-С(O)-ОСН 3, -С(O)-С(O)-ОС 2 Н 5 и-СН 2OСН(СН 3)2, или (если R4' и R5' содержат общую защитную группу гидроксильной группы) группы-С(СН 3)2-, -Р(O)(ОН)- и -СН[С(СН 3)3]-. Возможными солями соединений формулы I, в зависимости от типа замещения, являются, прежде всего, все кислотно-аддитивные соли. Прежде всего, следует отметить фармакологически приемлемые соли неорганических и органических кислот, обычно используемые в фармацевтике. Эти пригодные соли являются растворимыми и нерастворимыми в воде кислотно-аддитивными солями с кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота, фосфорная кислота, азотная кислота,серная кислота, уксусная кислота, лимонная кислота, D-глюконовая кислота, бензойная кислота, 2-(4 гидроксибензоил)бензойная кислота, масляная кислота, сульфосалициловая кислота, малеиновая кислота, лауриновая кислота, яблочная кислота, фумаровая кислота, янтарная кислота, щавелевая кислота,винная кислота, эмбоновая кислота, стеариновая кислота, толуолсульфоновая кислота, метансульфоновая кислота или 3-гидрокси-2-нафтоевая кислота, причем при получении соли кислоты используют в эквимолярном или ином соотношении, в зависимости от их основности (моно- или полиосновные) или необходимого типа соли. Фармакологически неприемлемые соли, которые могут быть первоначально получены, например, в качестве промежуточных продуктов при получении соединений по изобретению в промышленном масштабе, превращают в фармакологически приемлемые соли способами, известными специалисту в данной области. Специалисту в данной области известно, что соединения по изобретению и их соли, если они выделены, например, в кристаллической форме, могут содержать различные количества растворителей. Следовательно изобретение также включает все сольваты и, прежде всего, все гидраты соединений формулыI, а кроме того, все сольваты и, прежде всего, гидраты солей соединений формулы I. Соединения формулы I имеют по меньшей мере два хиральных центра. Изобретение относится ко всем возможным стереоизомерам в любом требуемом соотношении, включая чистые энантиомеры, которые являются предпочтительным предметом изобретения. Один вариант изобретения (вариант а) относится к соединениям формулы 1, в которых R3 означает водород. Другой вариант изобретения (вариант б) относится к соединениям формулы 1, в которых R3 означает галоген. Еще один вариант изобретения (вариант в) относится к соединениям формулы 1, в которых R3 означает карбоксил, -СО-(С 1-С 4)алкокси, гидрокси(C1-С 4)алкил, C1-С 4 алкокси(C1-С 4)алкил, фтор(C1-С 4) алкокси(C1-С 4)алкил или радикал -CO-NR3aR3b. Примером предпочтительного радикала R1 является радикал метил. Примерами предпочтительных радикалов R2 являются радикал гидроксиметил, и, прежде всего, радикал метил.-3 005597 В контексте настоящего изобретения R3 предпочтительно означает водород, галоген, карбоксил,-СО-(C1-С 4)алкокси, гидрокси(C1-С 4)алкил, C1-С 4 алкокси(C1-С 4)алкил, фтор(C1-С 4)алкокси(C1-С 4)алкил или радикал -CO-NR3aR3b. В контексте настоящего изобретения, прежде всего, целесообразно упомянуть соединения формулы 1, в которыхR1 означает C1-С 4 алкил,R2 означает C1-С 4 алкил или гидрокси(C1-С 4)алкил,R3 означает водород, галоген, карбоксил, -СО-(C1-С 4)алкокси, гидрокси(C1-С 4)алкил, C1-С 4 алкокси(C1-С 4)алкил, фтор(C1-С 4)алкокси(C1-С 4)алкил или радикал -CO-NR3aR3b,один из заместителей R4a и R4b означает водород, а другой означает гидроксил, C1-С 4 алкокси,C1-С 4 алкокси(C1-С 4)алкокси или радикал -OR', или R4a и R4b вместе означают О (кислород),один из заместителей R5a и R5b означает водород, а другой означает водород, гидроксил, C1-С 4 алкокси, C1-С 4 алкокси(C1-С 4)алкокси или радикал -OR', или R5a и R5b вместе означают О (кислород),где один из заместителей R4a и R4b должен иметь значение -OR' и/или один из заместителей R5a иR5b должен иметь значение -OR',R6 означает водород, галоген, C1-С 4 алкил, C1-С 4 алкокси, C1-С 4 алкоксикарбониламино, C1-С 4 алкокси(C1-С 4)алкоксикарбониламино или трифторметил,R7 означает водород, галоген, C1-С 4 алкил или C1-С 4 алкокси, а Х означает О (кислород) или NH, где-CH2-OR8, где алк означает C1-С 7 алкилен,R8 означает водород, C1-С 10 алкил или C1-С 4 алкил, замещенный группой галоген, карбоксил, гидроксил, сульфо (-SO3 Н), сульфамоил (-SO2NH2), карбамоил (-CONH2), C1-С 4 алкокси или C1-С 4 алкоксикарбонил,R9 означает водород или C1-С 4 алкил,R10 означает водород, галоген, нитро, C1-С 4 алкил, C1-С 4 алкокси, C1-С 4 алкоксикарбонил, C1-С 4 алкоксикарбониламино, C1-С 4 алкокси(C1-С 4)алкоксикарбониламино или трифторметил, иR11 означает водород, галоген, C1-С 4 алкил или C1-С 4 алкокси; и соли указанных соединений. Из соединений по изобретению следует отметить соединения формулы 1R1 означает C1-С 4 алкил,R2 означает C1-С 4 алкил,R3 означает водород, хлор, фтор, гидроксиметил, дифторметоксиметил или радикал -CO-NR3aR3b,-4 005597 один из заместителей R4a и R4b означает водород, а другой означает гидроксил, C1-С 4 алкокси, C1 С 4 алкокси(C1-С 4)алкокси или радикал -OR', или R4a и R4b вместе означают О (кислород),один из заместителей R5a и R5b означает водород, а другой означает гидроксил, C1-С 4 алкокси, C1 С 4 алкокси(C1-С 4)алкокси или радикал -OR', или R5a и R5b вместе означают О (кислород),где один из заместителей R4a и R4b должен иметь значение -OR' и/или один из заместителей R5a иR5b должен иметь значение -OR',R6 означает водород,R7 означает водород, и Х означает О (кислород) или NH, где-CH2-OR8, где алк означает C1-С 7 алкилен,R8 означает водород, C1-С 10 алкил или C1-С 4 алкил, замещенный группой карбоксил или сульфо(-SO3H),R9 означает водород или C1-С 4 алкил,R10 означает водород, галоген, нитро, C1-С 4 алкил, C1-С 4 алкокси, C1-С 4 алкоксикарбонил, C1-С 4 алкоксикарбониламино, C1-С 4 алкокси(C1-С 4)алкоксикарбониламино или трифторметил, иR11 означает водород, галоген, C1-С 4 алкил или C1-С 4 алкокси. и соли указанных соединений. Из соединений по изобретению, прежде всего, следует отметить соединения формулы 1, в которыхR1 означает метил,R2 означает метил,R3 означает водород, хлор, фтор, гидроксиметил, дифторметоксиметил или радикал -CO-NR3aR3b,один из заместителей R4a и R4b означает водород, а другой означает C1-С 4 алкокси или C1-С 4 алкокси(C1-С 4)алкокси,один из заместителей R5a и R5b означает водород, а другой означает радикал -OR',R6 означает водород, R7 означает водород, а Х означает О (кислород) или NH, где-CH2-OR8, где алк означает C1-С 7 алкилен,R8 означает водород, C1-С 10 алкил или C1-С 4 алкил, замещенный группой карбоксил или сульфо(-SO3 Н),R9 означает водород или C1-С 4 алкил,R10 означает водород, галоген, нитро, C1-С 4 алкил, C1-С 4 алкокси, C1-С 4 алкоксикарбонил или трифторметил, иR11 означает водород или галоген,и соли указанных соединений. Примерами соединений формулы 1, прежде всего, являются соединения, в которых радикал R' означает -С(O)-N(СН 3)2, -C(O)-N(C2H5)2, -С(O)-NHC2H5, -C(O)-CH2CH2NH2, -С(O)-(СН 2)3NН 2,-С(O)-С(СН 3)2NН 2,-С(O)-СН 2N(СН 3)2,-С(O)-СН(NН 2)-СН(СН 3)2,-С(O)-СН(NН 2)СН(СН 3)С 2 Н 5,-С(O)-(СН 2)6 С(O)N(СН 3)СН 2 СН 2SO3 Н,-Р(O)(ОН)2,-S(O)2NH2,-C(O)-H,-С(O)-С(СН 3)3,-С(O)-СН 2 СН 2 СООН, -С(O)-СН 3, -С(O)-С 2 Н 5, -С(O)-С 6 Н 5, -C(O)-C6H4-4-NO2, -С(O)-С 6 Н 4-3-NO2,-С(O)-С 6 Н 4-4-ОСН 3, -С(O)-С 6 Н 4-4-С(O)-ОСН 3, -С(O)-ОСН 3, -С(O)-O-ментил, -С(O)-СН 2-С(O)-ОСН 3,-С(O)-СН 2 СН 2-С(O)-ОСН 3, -С(O)-С(O)-ОСН 3, -С(O)-С(O)-ОС 2 Н 5 или -СН 2OСН(СН 3)2. Предпочтительными соединениями по изобретению являются такие соединения формулы 1, в которыхR1 означает метил,R2 означает метил,R3 означает водород, хлор, фтор, гидроксиметил, дифторметоксиметил или радикал -CO-NR3aR3b,один из заместителей R4a и R4b означает водород, а другой означает C1-С 4 алкокси или C1-С 4 алкокси(C1-С 4)алкокси,R5a означает радикал -OR',R5b означает водород,R6 означает водород,R7 означает водород, а Х означает О (кислород) или NH, где-C(O)-NR8R9,-C(O)-алк-NR8R9,-C(O)-R8,-С(O)-С 6 Н 3R10R11,-C(O)-OR8,-С(O)-алк-С(O)-ОR8,-C(O)-C(O)-OR8, и где алк означает С 1-С 4 алкилен,R8 означает водород, С 1-С 4 алкил или ментил,R9 означает водород или С 1-С 4 алкил,R10 означает водород, галоген, нитро, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 алкоксикарбонил или трифторметил, иR11 означает водород или галоген,и соли указанных соединений. В нижеописанных примерах абсолютную конфигурацию "R" в положениях 8 и 9 имеют те предпочтительные соединения формулы 1, в которых R5a означает радикал -OR', a R5b означает водород. В варианте (а) осуществления изобретения предпочтительны те соединения формулы 1, в которыхR3 означает водород. В варианте (б) осуществления изобретения предпочтительны те соединения формулы 1, в которыхR3 означает хлор или фтор. В варианте (в) осуществления изобретения с предпочтительны те соединения формулы 1, в которых R3 означает гидроксилметил, дифторметоксиметил или радикал -CO-NR3aR3b. Типичные предпочтительные соединения по изобретению (и соли указанных соединений) могут быть представлены, прежде всего, с использованием общей формулы 1, в которой R1 означает метил,R2 означает метил, R5b означает водород, R6 означает водород и R7 означает водород, а заместители R3,R4a, R4b, R5a и X имеют значения, указанные в табл. 1, причем Ph означает фенил. Таким образом, соединения по изобретению могут быть получены, как описано в следующих примерах, или с использованием аналогичных стадий способа, из соответствующих исходных соединений(см. например, WO 98/42707, WO 98/54188, ЕР-А-299470 или статьи Kaminski и др., J. Med. Chem., 28,876-892 (1985) и Angew. Chem. 108, 589-591 (1996. Исходные соединения известны или они могут быть получены аналогично получению известных соединений. Соединения по изобретению могут быть получены, например, по следующим схемам реакций. Схема 1. На следующей схеме показан пример получения соединений формулы I по изобретению, в которых На вышеуказанной схеме 1 показан пример энантиоселективного синтеза 7,8-диола (R4a или R4b иR5a или R5b в каждом случае означают гидроксил), который затем может быть, если необходимо, дополнительно этерифицирован соответствующим способом. В вышеупомянутом соединении 3 группа Y означает соответствующую уходящую группу, например, атом галогена, предпочтительно хлора. Если уходящая группа означает атом хлора, ацилирование проводят общепринятым способом, известным специалистам в данной области, предпочтительно с использованием бис(триметилсилил)амида натрия или аналогичного производного амида калия.-12 005597 Следующее за ацилированием окисление также проводят в обычных условиях с использованием в качестве окислителя хлоранила, кислорода воздуха или диоксида марганца. При последующем удалении защитной группы и циклизации должны выполняться определенные условия в зависимости от используемой вспомогательной кислоты. В качестве вспомогательной кислоты по изобретению предпочтительно используют муравьиную кислоту. Восстановление в диол также проводят в стандартных условиях (см., например, WO 98/54188), где,например, в качестве восстанавливающего агента используют боргидрид натрия, при этом указанный 7,8-трансдиол может быть получен в виде диастереомера с чистотой более 90%. Последующая в случае необходимости этерификация, которую также проводят с использованием известных методов, приводит к образованию соединений формулы 1, в которых R4a и R4b означают водород. Для получения вместо соединения 3 соединений формулы 1, в которых R5a и R5b означают водород, необходимо в качестве исходных материалов использовать производные 3-гидрокси-3 фенилпропионовой кислоты, содержащей соответственно защищенную гидроксильную группу, в которых Y (аналогично вышеуказанной схеме) означает соответствующую уходящую группу. Схема 2. На нижеуказанной схеме 2 показан пример получения соединений формулы 1, в которых R1 означает СН 3, R2 означает СН 3, R4a или R4b означают гидроксил, а Х означает NH, из соединений формулы 2 ( см. схему 1). На вышеуказанной схеме 2 также показан пример энантиоселективного синтеза. Y также означает соответствующую уходящую группу, например, группу метокси. Группа G (в зависимости от типа необходимого соединения, такого, где R5a и R5b означают водород, или такого, где R5a или R5b означают гидроксил) означает водород или гидроксильную группу (например, защищенную соответствующим силильным радикалом). Восстановление кетогруппы боргидридом натрия и последующая циклизация приводят, в случае,если G означает гидроксильную группу, к получению 7,8-трансдиола в виде диастереомера с чистотой более 90%. Последующая в случае необходимости этерификация, которую проводят с использованием известных методов, приводит к образованию конечных продуктов формулы 1, в которых R5a и R5b означают водород. Соответствующее 7,8-цис-соединение получают из маточного раствора, который остается после выделения 7,8-транс-соединения, с использованием хроматографической очистки. По зовершению синтеза введение радикала "пролекарства" R' по схемам 1 и 2 проводят ацилированием исходных соединений формулы 1, в которых по меньшей мере один из радикалов R4a, R4b, R5a иR5b означает гидроксильную группу, соединениями формулы R'-Z, где Z означает соответствующую уходящую группу, например, атом галогена. Реакцию проводят известным способом, например, как описано в примерах, предпочтительно в присутствии соответствующего вспомогательного основания. Для получения соединений формулы 1, в которых R4a или R4b означает С 1-С 4 алкокси или С 1-С 4 алкокси(С 1 С 4)алкокси, а R5a или R5b означает радикал R5', соединения формулы 1, в которых R4a или R4b означает С 1-С 4 алкокси или С 1-С 4 алкокси(С 1-С 4)алкокси, а R5a или R5b означает гидроксил, вводят в реакцию с соединениями формулы R'-Z. Для получения соединений формулы 1, в которых R4a или R4b означает гидроксил, R5a или R5b означает радикал R5', соединения формулы 1, в которых R4a и R4b вместе означают О (кислород), а R5a или R5b означает гидроксил, вводят в реакцию с соединениями формулы R'-Z. Затем проводят восстановление кетогруппы до гидроксильной группы. Аналогичным способом получают соединения формулы 1, в которых радикал "пролекарство" находится в положении 7, а гидроксильная группа или радикал С 1-С 4 алкокси или С 1-С 4 алкокси(С 1-С 4)алкокси находится в положении 8.-13 005597 Выделение и очистку соединений по изобретению проводят известными методами, например, упариванием растворителя в вакууме и перекристаллизацией полученного остатка в соответствующем растворителе, или с использованием одного из обычных методов очистки, например, такого, как хроматография на колонке с соответствующим материалом-носителем. Соли получают растворением свободного соединения в соответствующем растворителе, например,хлорированном углеводороде, таком, как хлористый метилен или хлороформ, или низкомолекулярном алифатическом спирте (этаноле, изопропаноле), содержащем необходимую кислоту, или в который затем добавляют соответствующую кислоту. Соли получают фильтрованием, переосаждением, осаждением осадителем кислотно-аддитивной соли или выпариванием растворителя. Полученные соли могут быть превращены подкислением или подщелачиванием в свободные соединения, из которых в свою очередь могут быть получены соли. Таким способом фармакологически неприемлемые соли могут быть превращены в фармакологически приемлемые соли. Чистые энантиомеры, прежде всего, чистые энантиомеры формулы 1, которые являются предпочтительным предметом изобретения, могут быть получены способами, известными специалисту в данной области, например, энантиоселективным синтезом (см. например, приведенные схемы), хроматографическим разделением на колонках с хиральным сорбентом, получением производных с хиральными вспомогательными реагентами, последущим отделением диастереомера и удалением хиральной вспомогательной группы, образованием солей с хиральными кислотами, последующим разделением солей и высвобождением необходимого соединения из его соли, или (фракционной) кристаллизацией из соответствующего растворителя. Полученные транс-изомеры (например, соединения формулы 1, в которых R4a иR5b означают водород) могут быть превращены, по меньшей мере частично, в соответствующие цисизомеры (например, в которых R4b и R5b означают водород) обработкой кислотами (например, двумя эквивалентами кислоты, такой, как серная кислота) в соответствующем спирте R4a-OH. Аналогичным образом, цис-изомеры могут быть превращены в соответствующие трансизомеры. Цис- и транс-изомеры разделяют, например, хроматографией или кристаллизацией. Исходные соединения формулы 2 могут быть получены из соединений, известных в литературе или аналогичным использованием способов, известных в литературе (например, см. статью Kaminski и др., J.Med. Chem., 28, 876-892 (1885, например, по общей схеме 3, приведенной ниже. Схема 3. На схеме показан пример получения исходного соединения 2, в котором R3 означает СООС 2 Н 5. Для получения соединения 4 реакцию проводят способом, известным специалисту в данной области. Соединение 5 может быть получено из соединения 4 различными способами, например, с использованием реакции Хека (в присутствии Pd(II), монооксида углерода и этанола) или металлированием в положение 6 (литием или магнием) и последующей реакции Гриньяра. Металлирование также позволяет ввести еще одну необходимую группу R3 в положение 6, например, фтор, хлор или карбоксильную группу. Дебензилирование/восстановление соединения 5 также проводят известным способом, например,с использованием водорода/Рd(0). Если необходимы соединения, в которых R3 означает -CO-NR5R6,получение соответствующего производного может быть проведено известным способом (превращение сложного эфира в амид) на стадии соединения 5 или после дебензилирования/восстановления. Следующие примеры иллюстрируют изобретение, не ограничивая его объем. Более того, аналогичным способом или способом, известным специалисту в данной области, с использованием обычных методов, могут быть получены другие соединения формулы 1, получение которых описано недостаточно подробно.-14 005597 Примеры Конечные продукты 1.[1,2-h][1,7]нафтиридин. Смесь 1 г (7S,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина, 0,1 г ацетата натрия (безводного) и 12 мл уксусного ангидрида тщательно перемешивали при комнатной температуре в течение 4 ч, затем выливали в ледяную воду, нейтрализовали 2 М водным раствором гидроксида натрия и трижды порциями по 50 мл экстрагировали этилацетатом, объединенные органические экстракты сушили над карбонатом калия, растворитель выпаривали в вакууме и остаток тщательно сушили в высоком вакууме, при этом получали 0,9 г указанного в заголовке соединения. 1 Н-ЯМР (200 МГц, CDCl3):1,9 (s, 3H), 2,26 (s, 3 Н), 2,35 (s, 3H), 3,21 (s, 3 Н), 3,48 (d, 2H), 3,65 (m,2 Н), 4,35 (d, 1H), 4,72 (dd, 1H), 5,3 (dd, 1H), 6,5 (d, 1H), 6,76 (d, 1H), 7,33 (s, 5H), 7,45 (d, 1H). 2.(7R,8R,9R)-7-(2-Метоксиэтокси)-2,3-диметил-9-фенил-8-пропионилокси-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Смесь 2 г (7R,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина и 24 мл пропионового ангидрида нагревали при 60 С в течение 6 ч, после охлаждения выливали в ледяную воду, добавляли разбавленный водный раствор гидроксида натрия до рН 7,5 и трижды порциями по 50 мл экстрагировали этилацетатом, объединенные органические фазы сушили над карбонатом калия и летучие компоненты отгоняли в вакууме. Полученный маслообразный остаток тщательно сушили в высоком вакууме и затем растирали в небольшом количестве циклогексана,при этом получали 1,2 г указанного в заголовке соединения в виде бесцветных кристаллов, tпл. 106-107C[1,2-h][1,7]нафтиридин. Смесь 5 г (7R,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина, 2,1 г бензоилхлорида и 1,5 г триэтиламина в 60 мл сухого тетрагидрофурана нагревали при 60 С в течение 4 ч, после охлаждения выливали в ледяную воду и трижды порциями по 50 мл экстрагировали этилацетатом, объединенные органические фазы промывали небольшим количеством воды, сушили над карбонатом калия и растворитель выпаривали в вакууме. Полученный маслообразный остаток очищали хроматографией на силикагеле (элюент: диэтиловый эфир), при этом получали 2,5 г указанного в заголовке соединения в виде бесцветного пенообразного вещества. 1(7R,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3-диметил-9-фенил-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридина в 30 мл сухого тетрагидрофурана обрабатывали небольшими порциями 0,34 г суспензии гидрида натрия (80% в парафине) и перемешивали при комнатной температуре в течение 30 мин, затем по каплям добавляли 0,66 г метилхлорформиата и смесь перемешивали в течение 3 ч. Затем реакционную смесь выливали в ледяную воду, нейтрализовали разбавленной вдвое конц. соляной кислотой и трижды экстрагировали небольшими количествами этилацетата, объединенные органические фазы промывали небольшим количеством воды и сушили над карбонатом калия. Летучие компоненты отгоняли в вакууме и твердый остаток очищали хроматографией на силикагеле (элюент: диэтиловый эфир), при этом получали 1,2 г указанного в заголовке соединения, tпл. 176-177 С (диэтиловый эфир). 9.(7S,8R,9R)-7-(2-Метоксиэтокси)-2,3-диметил-8-(4-нитробензоилокси)-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение получали в виде бесцветного пенообразного вещества аналогично тому, как описано в примере 6, по реакции (7S,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3-диметил-9 фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с пара-нитробензоилхлоридом. 1 Н-ЯМР (200 МГц, CDCl3):2,29 (s, 3H), 2,38 (s, 3 Н), 3,11 (d, 3H), 3,38-3,42 (m, 2 Н), 3,61-3,78 (m,2H), 4,52 (d, 1H), 4,9-4,92 (dd, 1H), 5,58-5,6 (dd, 1H), 6,59 (d, 1H), 6,79-6,82 (d, 1H), 7,22-7,48 (m, 5H), 7,457,50 (d, 1H), 8,00-8,05 (d, 2H), 8,30-8,35 (d, 2H). 14.(7S,8R,9R)-7-(2-Метоксиэтокси)-2,3-диметил-8-(3-нитробензоилокси)-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение получали в виде бесцветного вязкого маслообразного вещества аналогично тому, как описано в примере 6, по реакции (7S,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3 диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с 3-нитробензоилхлоридом. 1 Н-ЯМР (200 МГц, CDCl3):2,3 (s, 3H), 2,39 (s, 3 Н), 3,15 (s, 3 Н), 3,39-3,47 (m, 2H), 3,61-3,80 (m,2H), 4,55-4,59 (d, 1H), 4,91-4,99 (dd, 1H), 5,55-5,61 (dd, 1H), 6,57-6,58 (d, 1H), 6,80-6,82 (d, 1H), 7,25-7,52(7R,8R,9R)-7-(2-Метоксиэтокси)-8-(N,N-диэтиламинокарбонилокси)-2,3-диметил-9-фенил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение получали в виде пенообразного вещества желтоватого цвета аналогично тому, как описано в примере 8, по реакции (7R,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3 диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с N,N-диэтилкарбамоилхлоридом. 1 Н-ЯМР (200 МГц, CDCl3):0,9 (m, 6H), 2,3 (s, 3 Н), 2,4 (s, 3H), 3,08 (m, 4 Н), 3,1 (s, 3 Н), 3,12 (m,2 Н), 3,29-3,50 (m, 2H), 4,5 (d, 1H), 4,76 (dd, 1H), 5,38 (dd, 1H), 6,43 (d, 1H), 6,7 (d, 1H), 7,3 (m, 5 Н), 7,46 (d,1H). 24. (7R,8R,9R)-8-Этиламинокарбонилокси-7-(2-метоксиэтокси)-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение получали в виде твердого вещества желтоватого цвета аналогично тому, как описано в примере 5, по реакции (7R,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3-диметил-9 фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с этилизоцианатом. 1 Н-ЯМР (200 МГц, CDCl3):0,91-1,0 (m, 3H), 2,29 (s, 3 Н), 2,32 (s, 3H), 3,02 (m, 5 Н), 3,32-3,45 (m,4 Н), 4,38 (d, 1H), 4,8 (s, 1H), 5,39 (m, 1H), 6,62-6,70 (d, 2H), 7,12-7,32 (m, 5H), 7,40-7,45 (d, 1H). 25. (7S,8R,9R)-8-Этиламинокарбонилокси-7-(2-Метоксиэтокси)-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение получали в виде твердого вещества светло-коричневого цвета аналогично тому, как описано в примере 5, по реакции (7S,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3 диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с этилизоцианатом. 1(7S,8R,9R)-7-(2-Метоксиэтокси)-8-(O-метилсукциноилокси)-2,3-диметил-9-фенил-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение, tпл. 50-51C (диэтиловый эфир), получали аналогично тому, как описано в примере 8, по реакции (7S,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3-диметил-9-фенил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с монометилсукцинилхлоридом. 30. (7R,8R,9R)-7-(2-Метоксиэтокси)-8-(O-метилмалонилокси)-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение, tпл. 70-71 С (диэтиловый эфир/диизопропиловый эфир), получали аналогично тому, как описано в примере 8, по реакции (7R,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с монометилмалонилхлоридом. 31. (7S,8R,9R)-7-(2-Метоксиэтокси)-8-(O-метилмалонилокси)-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-H][1,7]нафтиридин. Указанное в заголовке соединение получали в виде аморфного твердого вещества аналогично тому,как описано в примере 8, по реакции (7S,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3-диметил-9-фенил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с монометилмалонилхлоридом. 1H-ЯМР (200 МГц, CDCl3):2,1 (s, 3H), 2,35 (s, 3 Н), 3,21 (s, 3H), 3,39 (s, 2 Н), 3,46 (s. 2H), 3,57 (s,3 Н), 3,60-3,71 (m, 2 Н), 4,39 (d, 1H), 4,70-4,78 (dd, 1H), 5,31-5,39 (dd, 1H), 6,48 (d, 1H), 6,77-6,79 (d, 1H),7,31 (s, 5H), 7,45-7,50 (d, 1H). 32. (7R,8R,9R)-7-(2-Метоксиэтокси)-8-(O-этилоксалоилокси)-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение получали в виде аморфного твердого вещества аналогично тому,как описано в примере 8, по реакции (7R,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3 -диметил-9-фенил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с моноэтилоксалилхлоридом. 1 Н-ЯМР (200 МГц, CDCl3):1,19-1,22 (m, 3 Н), 2,3 (s, 3 Н), 2,36 (s, 3H), 3,09 (s, 5H), 3,19 (s, 2H), 3,513,64 (m, 2H), 4,19-4,29 (dd, 2H), 4,61 (d, 1H), 4,81-4,90 (m, 1H), 5,50-5,57 (m, 1H), 6,6 (d, 1H), 6,69-6,71 (d,1H), 7,21-7,39 (m, 5H), 7,50-7,52 (d, 1H). 33.(7S,8R,9R)-8-(O-Этилоксалоилокси)-7-(2-метоксиэтокси)-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение получали в виде твердого вещества желтоватого цвета аналогично тому, как описано в примере 8, по реакции (7S,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3-диметил-9 фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с моноэтилоксалилхлоридом. 1 Н-ЯМР (200 МГц, CDCl3):1,20-1,28 (m, 3H), 2,3 (s, 3 Н), 2,38 (s, 3H), 3,2 (s, 3 Н), 3,41-3,49 (m, 2 Н),3,60-3,71 (m, 2H), 4,19-4,29 (dd, 2H), 4,42-4,48 (s, 1H), 4,80-4,88 (dd, 1H), 5,48-5,51 (dd, 1H), 6,6 (d, 1H),6,78-6,80 (d, 1H), 7,35 (s, 5H), 7,49-7,51 (d, 1H). 34. (7R,8R,9R)-8-Формилокси-(2-метоксиэтокси)-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение получали в виде твердого вещества зеленовато-желтого цвета аналогично тому, как описано в примере 5, по реакции (7S,8R,9R)-8-гидрокси-7-(2-метоксиэтокси)-2,3 диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с фенилформиатом. 36. (7R,8R,9R)-8-Бензоилокси-2,3-диметил-7-(2-метоксиэтокси)-9-фенил-7 Н-8,9-дигидропирано[2,3 с]имидазо[1,2-а]пиридин. К раствору 0,50 г (1,36 ммоля) (7R,8R,9R)-2,3-диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил 7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридина, 1,0 мл (6,80 ммоля) триэтиламина и 1,60 г (0,01 ммоля) диметиламинопиридина (ДМАП) в дихлорметане (5,0 мл) при 0 С добавляли 0,48 мл (4,08 ммоля) бензоилхлорида. Смесь нагревали до 25 С и перемешивали при указанной температуре в течение 2 ч. Затем реакцию останавливали добавлением насыщенного водного раствора гидрокарбоната натрия. После отделения органического слоя водный слой дважды экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и упаривали в вакууме.-18 005597 Неочищенный продукт очищали хроматографией на колонке (диэтиловый эфир/триэтиламин, 9:1), при этом получали 0,59 г (1,25 ммоля, 91%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл. 130-133 С (диэтиловый эфир). 37. (7S,8R,9R)-8-Бензоилокси-2,3-диметил-7-(2-метоксиэтокси)-9-фенил-7 Н-8,9-дигидропирано[2,3 с]имидазо[1,2-а]пиридин. Указанное в заголовке соединение, tпл. 135-136 С (диэтиловый эфир), получали аналогично тому,как описано в примере 36, по реакции (7R,8R,9R)-2,3-диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил 7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридина с бензоилхлоридом. 38. (7R,8R,9R)-8-[4-(Метоксикарбонил)бензоилокси]-2,3-диметил-7-(2-метоксиэтокси)-9-фенил-7 Н 8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин. К раствору 0,50 г (1,36 ммоля) (7R,8R,9R)-2,3-диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил 7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридина, 1,0 мл (6,80 ммоля) триэтиламина и 1,60 г (0,01 ммоля) ДМАП в дихлорметане (5,0 мл) при 0 С добавляли 0,83 г (4,08 ммоля) терефталоилхлорида. Смесь нагревали до 25 С и перемешивали при указанной температуре в течение 2 ч, затем добавляли метанол (5,0 мл) и перемешивали в течение дополнительных 2 ч. Затем реакцию останавливали добавлением насыщенного водного раствора гидрокарбоната натрия. После отделения органического слоя водный слой дважды экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке (диэтиловый эфир/триэтиламин, 9:1), при этом получали 0,21 г (1,40 ммоля,29%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл. 156-160C (диэтиловый эфир). 39. (7S,8R,9R)-8-[4-(Метоксикарбонил)бензоилокси]-2,3-диметил-7-(2-метоксиэтокси)-9-фенил-7 Н 8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридин. Указанное в заголовке соединение, tпл. 71 С (спекание), получали аналогично тому, как описано в примере 38, по реакции (7S,8R,9R)-2,3-диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил-7 Н-8,9-дигидропирано[2,3-с]имидазо[1,2-а]пиридина с монометилтерефталоилхлоридом. 40. (7S,8R,9R)-2,3-Диметил-7-метокси-8-метоксиацетилокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение, tпл. 73-75 С, получали аналогично тому, как описано в примере 6, после очистки на силикагеле. 41. (7R,8R,9R)-8-(N,N-Диэтиламинокарбонилокси)-2,3-диметил-7-метокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение, tпл. 123-124C, получали аналогично тому, как описано в примере 6, после очистки на силикагеле. 42. (7S,8R,9R)-8-(N,N-Диэтиламинокарбонилокси)-2,3-диметил-7-метокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение, tпл. 97-98C, получали аналогично тому, как описано в примере 6, после очистки на силикагеле. 43.(7R,8R,9R)-7-Метокси-8-метоксикарбонилокси-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение, tпл. 178-179 С, получали аналогично тому, как описано в примере 6, после очистки на силикагеле. 44.(7S,8R,9R)-7-Метокси-8-метоксикарбонилокси-2,3-диметил-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение, tпл. 90-91 С, получали аналогично тому, как описано в примере 6, после очистки на силикагеле. 45.[1,7]нафтиридин. Указанное в заголовке соединение, tпл. 152-153 С, получали аналогично тому, как описано в примере 6, после очистки на силикагеле. 46.[1,7]нафтиридин. Указанное в заголовке соединение получали в виде твердого вещества желтоватого цвета аналогично тому, как описано в примере 6, после очистки на силикагеле. 47.[1,7]нафтиридин. Указанное в заголовке соединение, tпл. 92-93 С, получали аналогично тому, как описано в примере 6, после очистки на силикагеле. Исходные соединения А. 6,8-Дибром-2,3-диметилимидазо[1,2-а]пиридин. Смесь 31,8 г 2-амино-3,5-дибромпиридина, 22 г 3-бром-2-бутанона и 350 мл тетрагидрофурана кипятили с обратным холодильником в течение 9 сут, полученный осадок отделяли фильтрованием и су-19 005597 шили в вакууме. Затем осадок суспендировали в 1 л воды и добавляли 6 М гидроксид натрия до рН 8. Полученный осадок отделяли фильтрованием и промывали водой. При этом получали 28 г указанного в заголовке соединения, tпл. 90C (спекание). Б. 8-Бензилокси-6-бром-2,3-диметилимидазо[1,2-а]пиридин. 34,8 мл бензилового спирта при охлаждении льдом по каплям добавляли к суспензии 13,5 г гидрида натрия (60% суспензия в парафине) в 510 мл диметилформамида и смесь перемешивали в течение 1 ч до завершения выделения газа. Затем небольшими порциями добавляли 51,2 г 6,8-дибром-2,3 диметилимидазо[1,2-а]пиридина и смесь перемешивали при комнатной температуре в течение 40 ч. Смесь выливали в 1 л ледяной воды и трижды порциями по 100 мл экстрагировали дихлорметаном. Объединенные органические экстракты промывали насыщенным раствором хлорида аммония и дважды водой, концентрировали досуха в вакууме, полученный остаток перемешивали с небольшим количеством этилацетата. Полученный осадок отделяли фильтрованием и сушили в вакууме. При этом получали 43,2 г указанного в заголовке соединения, tпл. 151-153 С (этилацетат). В. 8-Бензилокси-6-этоксикарбонил-2,3-диметилимидазо[1,2-а]пиридин. Смесь 4 г 8-бензилокси-6-бром-2,3-диметилимидазо[1,2-а]пиридина, 0,4 г ацетата палладия (II), 1,33 г трифенилфосфина, 10 мл триэтиламина и 50 мл этанола нагревали в атмосфере монооксида углерода в автоклаве (5 бар) в течение 16 ч, летучие компоненты отгоняли в вакууме и остаток хроматографировали на силикагеле (элюент: этилацетат). При этом получали 2,4 г указанного в заголовке соединения, tпл. 140141 С (диэтиловый эфир). Г. 6-Этоксикарбонил-2,3-диметил-5,6,7,8-тетрагидроимидазо[1,2]пиридин-8-он. 3 г 8-Бензилокси-6-этоксикарбонил-2,3-диметилимидазо[1,2-а]пиридина, суспендированного в 50 мл этанола, обрабатывали 0,5 г 10% палладия на активированном угле и гидрировали при давлении водорода 50 бар в течение 20 ч при нагревании на масляной бане при температуре 75 С. После охлаждения катализатор отделяли фильтрованием, фильтрат концентрировали до 1/5 объема в вакууме и отфильтровывали образующийся бесцветный осадок. Фильтрат концентрировали досуха и хроматографировали на силикагеле (элюент: хлористый метилен/метанол, 100:3). При этом получали 0,32 г 6-этоксикарбонил-8 гидрокси-2,3-диметил-5,6,7,8-тетрагидроимидазо[1,2-а]пиридина. Для превращения в указанное в заголовке соединение вещество растворяли в хлороформе, обрабатывали 1,6 г диоксида марганца и перемешивали при комнатной температуре в течение 20 ч. Твердое вещество отделяли фильтрованием, фильтрат концентрировали досуха в вакууме, полученный остаток очищали хроматографией на силикагеле(элюент: хлористый метилен/метанол, 13:1). При этом получали 0,2 г указанного в заголовке соединения,tпл. 138-140 С (диэтиловый эфир). Д. 8-Бензилокси-6-гидроксиметил-2,3-диметилимидазо[1,2-а]пиридин. Раствор 1,2 г 8-бензилокси-6-этоксикарбонил-2,3-диметилимидазо[1,2-а]пиридина в 20 мл тетрагидрофурана обрабатывали небольшими порциями 0,2 г алюмогидрида лития при комнатной температуре, перемешивали в течение 1 ч и последовательно обрабатывали 0,2 мл воды, 0,2 мл 6 М раствора гидроксида натрия и 0,6 мл воды. Затем смесь дважды порциями по 50 мл экстрагировали хлористым метиленом , объединенные органические фазы концентрировали досуха в вакууме, остаток очищали хроматографией на силикагеле (элюент: хлористый метилен/метанол, 13:1). При этом получали 0,4 г указанного в заголовке соединения, tпл. 213-215 С (ацетон). Е. 6-Гидроксиметил-2,3-диметил-5,6,7,8-тетрагидроимидазо[1,2-а]пиридин-8-он. Указанное в заголовке соединение получали аналогично тому, как описано в примере Г, дебензилированием/гидрированием 8-бензилокси-6-гидроксиметил-2,3-диметилимидазо[1,2-а]пиридина в присутствии палладия на активированном угле. Ж. 2,3-Диметил-6,7-дигидро-5 Н-имидазо[1,2-а]пиридин-8-он. а) 500 г (2,35 моля) 8-амино-2,3-диметилимидазо[1,2-а]пиридина (см. ЕР-А-299470) и 150 г палладия на активированном угле (10% Pd), суспендированных в 5,0 л 6 н. соляной кислоты, перемешивали при 50 С в течение 24 ч при давлении водорода 10 бар. Катализатор отделяли фильтрованием и реакционную смесь концентрировали до 2,0 л в вакууме. Полученный раствор экстрагировали дихлорметаном. К водной фазе добавляли конц. раствор аммиака до рН 4,8-5,0 и снова экстрагировали дихлорметаном. Данную процедуру повторяли 10 раз. Объединенные органические фазы сушили над сульфатом натрия и концентрировали. Неочищенный продукт кристаллизовали из изопропанола, при этом получали 334,1 г указанного в заголовке соединения в виде кристаллов светло-коричневого цвета, tпл. 178,5 С (изопропанол). Указанное в заголовке соединение может быть получено также по следующеей методике: б) Смесь 252 г 8-бензилокси-2,3-диметилимидазо[1,2-а]пиридина, 84 г гидрокарбоната натрия, 27 г палладия на угле (10%) в качестве катализатора в 500 мл метанола сначала гидрировали водородом (5 бар) в автоклаве при 40 С (20 ч). Затем температуру понижали до 20 С и давление водорода до 2 бар, и гидрирование продолжали до завершения медленного поглощения водорода (около 10 ч, контроль методом ТСХ). Катализатор отделяли фильтрованием, осадок на фильтре промывали 200 мл метанола,фильтрат концентрировали досуха в вакууме, остаток перемешивали с 200 мл хлороформа и нерастворимое вещество отфильтровывали. Осадок на фильтре тщательно промывали 150 мл хлороформа и фильт-20 005597 рат концентрировали досуха в вакууме. При этом получали 142 г указанного в заголовке соединения, tпл. 178-179 С (2-пропанол). З. 2-Метил-6,7-дигидро-5 Н-имидазо[1,2-а]пиридин-8-он. Указанное в заголовке соединение получали аналогично тому, как описано в примере Жа), из 8 амино-2-метилимидазо[1,2-а]пиридина, описанного в ЕР-А-299470. И. 3-Формил-2-метил-6,7-дигидро-5 Н-имидазо[1,2-а]пиридин-8-он. Указанное в заголовке соединение получали аналогично тому, как описано в примере Жа), из 8 амино-2-формил-2-метилимидазо[1,2-а]пиридина, описанного в ЕР-А-299470. К. 6-Хлор-2-метил-6,7-дигидро-5 Н-имидазо[1,2-а]пиридин-8-он. Указанное в заголовке соединение получали аналогично тому, как описано в примере Г, дебензилированием/гидрированием 8-бензилокси-2-хлор-2-метилимидазо[1,2-а]пиридина (ЕР-А-299470) в присутствии палладия на активированном угле. Л. 6-Хлор-3-формил-2-метил-6,7-дигидро-5 Н-имидазо[1,2-а]пиридин-8-он. Указанное в заголовке соединение получали аналогично тому, как описано в примере Г, дебензилированием/гидрированием 8-бензилокси-2-хлор-3-формил-2-метилимидазо[1,2-а]пиридина (ЕР-А-299470) в присутствии палладия на активированном угле. М. (7R,8R,9R)-2,3-Диметил-8-гидрокси-7-метокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин. Методика а. 20 г (65 ммолей) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2h][1,7]нафтиридина (WO 98/42707) растворяли в 350 мл метанола. К смеси добавляли 13,5 г серной кислоты и раствор перемешивали при 50 С в течение 48 ч. После охлаждения реакционную смесь выливали в 250 мл воды и нейтрализовали добавлением насыщенного водного раствора гидрокарбоната натрия. Осадок собирали и очищали хроматографией на силикагеле (элюент: диэтиловый эфир). При этом получали 2,5 г указанного в заголовке соединения в виде бесцветных кристаллов, tпл. 164-165C (2-пропанол). Методика б. 10 г (32,5 ммоля) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2h][1,7]нафтиридина растворяли в 200 мл сухого диметилформамида. К смеси набольшими порциями при комнатной температуре добавляли 1,9 г коммерчески доступного гидрида натрия в парафине (80%). Через 1 ч добавляли 9,1 г (65 ммолей) метилиодида, растворенного в 4 мл диметилформамида, и смесь перемешивали в течение 1 ч. Затем реакционную смесь выливали в холодную воду и добавляли 20 мл насыщенного водного раствора хлорида аммония, образующийся осадок желтого цвета собирали и отбрасывали. Фильтрат несколько раз экстрагировали этилацетатом, объединенные органические фазы промывали несколько раз водой и растворитель выпаривали в вакууме. Остаток в виде твердого вещества очищали хроматографией на силикагеле (диэтиловый эфир). При этом получали 2 г указанного в заголовке соединения в виде бесцветных кристаллов, tпл. 164-165 С (2 пропанол). Н. (7S,8R,9R)-2,3-Диметил-8-гидрокси-7-метокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин. Указанное в заголовке соединение (6 г) получали в виде бесцветного порошка, tпл. 108-110C, из(7S,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина после очистки хроматографией на силикагеле аналогично тому, как описано в примере М (методика а). О.(7R,8R,9R)-2,3-Диметил-7-этокси-8-гидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин. Указанное в заголовке соединение, 500 мг, tпл. 188-190 С, получали аналогично тому, как описано в примере М (методика а), по реакции (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10 тетрагидроимидазо[1,2-h][1,7]нафтиридина с метанолом и серной кислотой с последующей очисткой хроматографией на силикагеле (элюент: диэтиловый эфир). П.(7S,8R,9R)-2,3-Диметил-7-этокси-8-гидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин. Указанное в заголовке соединение получали в виде твердого вещества, 800 мг, tпл. 143-144C, после дальнейшей очистке маточного раствора, полученного в примере О, хроматографией на силикагеле. Р.[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение получали в виде твердого вещества, 7,8 г, tпл. 131-132 С, из маточного раствора, полученного в примере Р, после очистки хроматографией на силикагеле (элюент: диэтиловый эфир).-21 005597 Т. (7R,8R,9R)-2,3-Диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил-7 Н-8,9-дигидропирано[2,3-h] имидазо[1,2-а]пиридин. 0,51 мл (9,67 ммоля) серной кислоты добавляли по каплям к суспензии 1,50 г (4,83 ммоля)(см. WO 98/54188) в 2-метоксиэтаноле (7,0 мл). Затем смесь перемешивали при 120 С в течение 6 ч, разбавляли 100 мл воды, нейтрализовали насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Объединенные органические фазы промывали солевым раствором, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке (диэтиловый эфир/триэтиламин, 1:1), при этом получали 0,40 г (1,08 ммоля, 22%) указанного в заголовке соединения в виде бесцветного твердого вещества, tпл. 155-157 С (диэтиловый эфир). Промышленная применимость Соединения формулы 1 и их соли обладают ценными фармакологическими свойствами, что определяет их коммерческое применение. Прежде всего, они проявляют резко выраженное ингибирование секреции соляной кислоты желудочного сока и обладают чрезвычайно сильным защитным действием в желудочно-кишечном тракте у теплокровных животных, прежде всего, человека. В связи с этим, соединения по настоящему изобретению характеризуются высокой селективностью, благоприятной продолжительностью действия, прежде всего, достаточно высокой энтеральной активностью, отсутствием заметного побочного действия и широким спектром терапевтического использования. Термин защитное действие в желудочно-кишечном тракте в данном контексте означает профилактику и лечение желудочно-кишечных заболеваний: прежде всего, воспалительных процессов и поражений желудочно-кишечного тракта, а также заболеваний, вызванных соляной кислотой желудочного сока, (например таких, как язва желудка, язва двенадцатиперстной кишки, гастриты, гиперкислотная или вызванная медикаментозным лечением функциональная гастропатия, рефлюкс-эзофагит (воспаление пищевода), синдром Золлингера-Эллисона, изжога), у млекопитающих, включая человека, причем упомянутые заболевания могут быть вызваны, например, микроорганизмами (например, Helicobacter pylori),бактериальными токсинами, лекарственными средствами (например, определенными противовоспалительными и антиревматическими средствами), химикатами (например, этанолом), соляной кислотой желудочного сока или стрессовыми ситуациями. Неожиданно оказалось, что по своим чрезвычайно полезным свойствам, соединения по настоящему изобретению значительно превосходят соединения, известные в предшествующем уровне техники, при испытании на различных моделях, с использованием которых определяли их противоязвенные и противосекреторные свойства. Благодаря этим свойствам соединения формулы 1 и их фармацевтически приемлемые соли, прежде всего, наиболее пригодны для использования в ветеринарной практике и медицине, где они используются, прежде всего, для лечения и/или профилактики нарушений в желудочном и/или кишечном тракте. Следовательно, изобретение, кроме того, относится к соединениям по настоящему изобретению для использования при лечении и/или профилактике вышеупомянутых заболеваний. Изобретение включает также использование соединений по настоящему изобретению для получения лекарственных препаратов, используемых для лечения и/или профилактики вышеупомянутых заболеваний. Изобретение, кроме того, включает использование соединений по настоящему изобретению для лечения и/или профилактики вышеупомянутых заболеваний. Изобретение, кроме того, относится к лекарственным препаратам, которые содержат одно или более соединений формулы 1 и/или их фармацевтически приемлемых солей. Лекарственные препараты получают с использованием известных способов, в том числе способов,известных специалистам в данной области техники. Фармакологически активные соединения (=активные соединения) по настоящему изобретению могут быть использованы в качестве лекарственных средств в отдельности или предпочтительно в смеси с соответствующими фармацевтическими эксципиентами и носителями в форме таблеток, таблеток с покрытием, капсул, суппозиториев, дисков (например, таких,как трансдерм, transdermal therapeutic system, TTS), эмульсий, суспензий или растворов, причем содержание активного соединения предпочтительно составляет от 0,1 до 95%, а фармацевтическая форма для введения (например, пролонгированная форма или энтеральная форма), созданная специально для активного соединения и/или с необходимым началом действия и/или с необходимой продолжительностью действия, может быть получена с использованием соответствующего набора эксципиентов и носителей. Специалисту в данной области техники на основании его/ее квалификации известно, какие эксципиенты и носители приемлемы для соответствующих фармацевтических составов. Кроме того, наряду с растворителями, гелеобразователями, основами для суппозиториев, эксципиентами для таблеток и другими носителями активного соединения можно использовать, например, антиоксиданты, диспергирующие агенты, эмульгаторы, пеногасители, ароматизаторы, консерванты, солюбилизирующие агенты, красители или, прежде всего, стимуляторы всасывания через кожу и комплексообразователи (например,циклодекстрины).-22 005597 Активные соединения могут быть введены пероральным, парентеральным или чрескожным способом. В основном, как показано в медицинской практике, при лечении человека для получения требуемого результата при пероральном введении целесообразно вводить активное соединение (=активные соединения) в суточной дозе от приблизительно 0,01 до приблизительно 20 мг/кг, предпочтительно от 0,05 до 5 мг/кг, прежде всего, от 0,1 до 1,5 мг/кг массы тела, в соответствующих случаях в виде нескольких,предпочтительно от 1 до 4, отдельных доз. При парентеральном введении могут быть использованы аналогичные или, прежде всего, при внутривенном введении, как правило, более низкие дозы. Оптимальная доза и способ введения активного соединения в каждом конкретном случае легко определяется специалистом в данной области на основании его/ее квалификации. Если соединения по настоящему изобретению и/или их соли используют для лечения вышеупомянутых заболеваний, фармацевтические препараты могут также содержать один или более фармацевтически активных составляющих из других фармацевтических групп. В качестве примеров можно привести транквилизаторы (например, группа бензодиазепинов, например диазепам), спазмолитики (например,биетамиверин или камилофин), антихолинергические средства (например, оксифенциклимин или фенкарбамид), местные обезболивающие средства (например, тетракаин или прокаин) и, в соответствующих случаях, также ферменты, витамины или аминокислоты. В связи с этим, прежде всего, следует отметить, что, с целью потенциирования (усиления) основного действия в качестве добавок или супердобавок и/или исключения или снижения побочного действия используют комбинацию соединений по настоящему изобретению с фармацевтическими средствами,которые ингибируют кислотную секрецию, такие как, блокаторы H2-рецепторов (например, циметидин,ранитидин), ингибиторы Н+/К+-АТФазы (например, омепразол, пантопразол) или, кроме того, с так называемыми периферическими антихолинергическими средствами (например, пирензепин, телензепин), а также с желудочными антагонистами или, кроме того, с целью подавления Helicobacter pylory в комбинации с антибактериальными соединениями (такими, как, цефалоспорины, тетрациклины, пенициллины,макролиды, нитроимидазолы или в другом варианте соли висмута). В качестве примеров антибактериальных активных компонентов, используемых в комбинации, можно упомянуть мезлоциллин, ампициллин, амоксициллин, цефалотин, цефокситин, цефотаксим, имипинем, гентамицин, амикацин, эритромицин, ципрофлоксацин, метронидазол, кларитромицин, азитромицин, и их комбинации (например, кларитромицин+метронидазол). Фармакология Чрезвычайно высокое защитное и ингибирующее действие соединений по настоящему изобретению в отношении секреции соляной кислоты желудочного сока можно продемонстрировать при испытаниях на экспериментальных моделях животных. Для соединений по настоящему изобретению, исследованных в нижеупомянутых моделях, сохранена нумерация, приведенная в примерах. Определение ингибирующего действия на секрецию соляной кислоты желудочного сока на перфузионном желудке крысы В табл. А ниже показано влияние соединений по настоящему изобретению после внутривенного введения (в/в) на секрецию соляной кислоты в перфузионном желудке крысы, индуцированную пентагастрином. Таблица А Методика Брюшную полость анестезированных крыс (крысы CD, самки, 200-250 г, после введения 1,5 г/кг уретана внутримышечно) вскрывали после трахеотомии, делая надрез в центре верхнего отдела брюшины, и в пищевод через рот вводили катетер из ПВХ. Другой катетер вводили через привратник таким образом, чтобы концы трубок катетеров слегка входили в полость желудка, причем катетер из привратника выходил на поверхность через боковое отверстие в правой стенке брюшины. После тщательной промывки (приблизительно 50-100 мл) через желудок пропускали непрерывный поток теплого физиологического раствора NaCl (0,5 мл/мин, рН 6,8-6,9, фирмы Braun-Unita I) при 37 С. Затем определяли рН в каждой фракции вытекающего потока, которые собирали через интервал, равный 15 мин (рН-метр 632, стеклянный электрод ЕА 147, диаметр 5 мм, фирма Metrohom), а секретированную НСl определяли титрованием свежеприготовленным 0,01 н. раствором NaOH до рН 7 (дозатор Dosimat 665, фирма Metrohom). Желудочную секрецию стимулировали непрерывным внутривенным вливанием пентагастрина (в левую бедренную вену) в дозе 1 мкг/кг (1,65 мл/ч) в течение приблизительно 30 мин после завершения-23 005597 операции (то есть после анализа двух предварительных фракций). Анализируемые соединения вводили внутривенно в объеме раствора 1 мл/кг через 60 мин после начала непрерывного вливания пентагастрина. Температуру тела животных поддерживали постоянной на уровне 37,8-38 С с использованием инфракрасного излучения и электрогрелки (автоматическая плавная регулировка с помощью ректального температурного датчика). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы 1R1 означает водород, C1-С 4 алкил или гидрокси(C1-С 4)алкил,R2 означает водород, C1-С 4 алкил, гидрокси(C1-С 4)алкил, галоген, С 2-С 4 алкенил или C2-С 4 алкинил,R3 означает водород, галоген, трифторметил, C1-С 4 алкил, C2-С 4 алкенил, C2-С 4 алкинил, карбоксил,-СО-(C1-С 4)алкокси, гидрокси(C1-С 4)алкил, C1-С 4 алкокси(C1-С 4)алкил, фтор(C1-С 4)алкокси(C1-С 4)алкил или радикал -СО-NR3aR3b,один из заместителей R4a и R4b означает водород, а другой означает гидроксил, C1-С 4 алкокси, C1 С 4 алкокси(C1-С 4)алкокси, C1-С 4 алкилкарбонилокси или радикал R4', или R4a и R4b вместе означают О(кислород),где R4' означает радикал, образующий гидроксильную группу в физиологических условиях,один из заместителей R5a и R5b означает водород, а другой означает водород, гидроксил, C1-С 4 алкокси, C1-С 4 алкокси(C1-С 4)алкокси, C1-С 4 алкилкарбонилокси или радикал R5', или R5a и R5b вместе означают О (кислород),где R5' означает радикал, образующий гидроксильную группу в физиологических условиях,где один из заместителей R4a и R4b должен означать R4' и/или один из заместителей R5a и R5b должен означать R5',R6 означает водород, галоген, C1-С 4 алкил, C1-С 4 алкокси, C1-С 4 алкоксикарбониламино, C1-С 4 алкокси(C1-С 4)алкоксикарбониламино или трифторметил,R7 означает водород, галоген, C1-С 4 алкил или C1-С 4 алкокси, а Х означает О (кислород) или NH,где R3a означает водород, C1-С 7 алкил, гидрокси(C1-С 4)алкил или C1-С 4 алкокси(C1-С 4)алкил и(C1-С 4)алкил, фтор(C1-С 4)алкокси(C1-С 4)алкил или радикал -CO-NR3aR3b,один из заместителей R4a и R4b означает водород, а другой означает гидроксил, C1-С 4 алкокси, C1 С 4 алкокси(C1-С 4)алкокси или радикал -OR', или R4a и R4b вместе означают О (кислород),один из заместителей R5a и R5b означает водород, а другой означает водород, гидроксил, C1-С 4 алкокси, C1-С 4 алкокси(C1-С 4)алкокси или радикал -OR', или R5a и R5b вместе означают О (кислород),где один из заместителей R4a и R4b должен иметь значение -OR' и/или один из заместителей R5a иR5b должен иметь значение -OR',R6 означает водород, галоген, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 алкоксикарбониламино, С 1-С 4 алкокси(С 1-С 4)алкоксикарбониламино или трифторметил,R7 означает водород, галоген, С 1-С 4 алкил или С 1-С 4 алкокси, а Х означает О (кислород) или NH,где R3a означает водород, С 1-С 7 алкил, гидрокси(С 1-С 4)алкил или С 1-С 4 алкокси(С 1-С 4)алкил, иR3a и R3b вместе, включая атом азота, к которому они присоединены, означают радикал пирролидино, пиперидино или морфолино и где радикал R' выбирают из группы, включающей-CH2-OR8, где алк означает С 1-С 7 алкилен,R8 означает водород, C1-С 10 алкил или C1-С 4 алкил, замещенный группой галоген, карбоксил, гидроксил, сульфо (-SO3 Н), сульфамоил (-SO2NH2), карбамоил (-CONH2), C1-С 4 алкокси или C1-С 4 алкоксикарбонил,R9 означает водород или С 1-С 4 алкил,R10 означает водород, галоген, нитро, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 алкоксикарбонил, С 1-С 4 алкоксикарбониламино, С 1-С 4 алкокси(С 1-С 4)алкоксикарбониламино или трифторметил, иR1 означает С 1-С 4 алкил,R2 означает С 1-С 4 алкил,R3 означает водород, хлор, фтор, гидроксиметил, дифторметоксиметил или радикал -CO-NR3aR3b,один из заместителей R4a и R4b означает водород, а другой означает гидроксил, С 1-С 4 алкокси, С 1 С 4 алкокси(С 1-С 4)алкокси или радикал -OR', или R4a и R4b вместе означают О (кислород),один из заместителей R5a и R5b означает водород, а другой означает гидроксил, С 1-С 4 алкокси, С 1 С 4 алкокси(С 1-С 4)алкокси или радикал -OR', или R5a и R5b вместе означают О (кислород),где один из заместителей R4a и R4b должен иметь значение -OR' и/или один из заместителей R5a иR5b должен иметь значение -OR',R6 означает водород,R7 означает водород, и Х означает О (кислород) или NH,где R3a означает водород, С 1-С 4 алкил, гидрокси(С 1-С 4)алкил или С 1-С 4 алкокси(С 1-С 4)алкил, и-CH2-OR8, где алк означает С 1-С 7 алкилен,R8 означает водород, С 1-С 10 алкил или С 1-С 4 алкил, замещенный группой карбоксил или сульфо(-SO3 Н),R9 означает водород или С 1-С 4 алкил,R10 означает водород, галоген, нитро, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 алкоксикарбонил, С 1-С 4 алкоксикарбониламино, С 1-С 4 алкокси(С 1-С 4)алкоксикарбониламино или трифторметил, иR1 означает метил,R2 означает метил,R3 означает водород, хлор, фтор, гидроксиметил, дифторметоксиметил или радикал -CO-NR3aR3b,один из заместителей R4a и R4b означает водород, а другой означает С 1-С 4 алкокси или С 1-С 4 алкокси(С 1-С 4)алкокси,один из заместителей R5a и R5b означает водород, а другой означает радикал -OR',R6 означает водород,R7 означает водород, а Х означает О (кислород) или NH,где R3a означает водород, метил, этил, пропил, 2-гидроксиэтил или 2-метоксиэтил, аR3b означает водород, метил или этил и где R' выбирают из группы, включающей-CH2-OR8, где алк означает С 1-С 7 алкилен,R8 означает водород, С 1-С 10 алкил или С 1-С 4 алкил, замещенный группой карбоксил или сульфо(-SO3 Н),R9 означает водород или С 1-С 4 алкил,R10 означает водород, галоген, нитро, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 алкоксикарбонил или трифторметил, иR11 означает водород или галоген,или его соли. 5. Соединение по п.4, в котором R' означает -С(O)-N(СН 3)2, -С(O)-N(C2H5)2, -C(O)-NHC2H5,-C(O)-CH2CH2NH2, -С(O)-(СН 2)3NН 2, -С(O)-С(СН 3)2NН 2, -C(O)-CH2N(CH3)2, -С(O)-СН(NН 2)-СН(СН 3)2,-С(O)-СН(NН 2)СН(СН 3)С 2 Н 5, -С(O)-(СН 2)6 С(O)N(СН 3)СН 2 СН 2SO3 Н, -Р(O)(ОН)2, -S(O)2NH2, -С(O)-Н,-С(O)-С(СН 3)3,-С(O)-СН 2 СН 2 СООН,-С(O)-СН 3,-С(O)-С 2 Н 5,-С(O)-СН 2OСН 3,-С(O)-С 6 Н 5,-C(O)-C6H4-4-NO2, -C(O)-C6H4-3-NO2, -С(O)-С 6 Н 4-4-ОСН 3, -С(O)-С 6 Н 4-4-С(O)-ОСН 3, -С(O)-ОСН 3,-С(O)-O-ментил, -С(O)-СН 2-С(O)-ОСН 3, -С(O)-СН 2 СН 2-С(O)-ОСН 3, -С(O)-С(O)-ОСН 3, -С(O)-С(O)-ОС 2 Н 5 или -СН 2OСН(СН 3)2. 6. Соединение по п.1 формулы 1 по п.3, в которомR1 означает метил,R2 означает метил,R3 означает водород, хлор, фтор, гидроксиметил, дифторметоксиметил или радикал -CO-NR3aR3b,один из заместителей R4a и R4b означает водород, а другой означает С 1-С 4 алкокси или С 1-С 4 алкокси(С 1-С 4)алкокси,R5a означает радикал -OR',R5b означает водород,R6 означает водород,R7 означает водород, а Х означает О (кислород) или NH,где R3a означает водород, метил, этил, пропил, 2-гидроксиэтил или 2-метоксиэтил, аR3b означает водород, метил или этил и где-C(O)-C(O)-OR8,где алк означает С 1-С 4 алкилен,R8 означает водород, С 1-С 10 алкил или С 1-С 4 алкил, замещенный группой С 1-С 4 алкокси,R9 означает водород или С 1-С 4 алкил,R10 означает водород, галоген, нитро, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 алкоксикарбонил или трифторметил иR11 означает водород или галоген,или его соли. 7. Соединение по п.1 формулы 1 по п.3, в котором-C(O)-C(O)-OR8,где алк означает С 1-С 4 алкилен,R8 означает водород, С 1-С 10 алкил или С 1-С 4 алкил, замещенный группой С 1-С 4 алкокси,R9 означает водород или С 1-С 4 алкил,R10 означает водород, нитро, С 1-С 4 алкокси или С 1-С 4 алкоксикарбонил, и R11 означает водород, или его соли. 8. Соединение по п.7, в котором R' означает -С(O)-N(СН 3)2, -С(O)-N(C2H5)2, -C(O)-NHC2H5,-C(O)-CH2N(CH3)2, -C(O)-H, -С(O)-СН 3, -С(O)-С 2 Н 5, -С(O)-СН 2OСН 3, -С(O)-С 6 Н 5, -С(O)-С 6 Н 4-4-NO2,-С(O)-С 6 Н 4-3-NO2, -С(O)-С 6 Н 4-4-ОСН 3, -С(O)-С 6 Н 4-4-С(O)-ОСН 3, -С(O)-ОСН 3, -С(O)-O-ментил,-С(O)-СН 2-С(O)-ОСН 3, -С(O)-СН 2 СН 2-С(O)-ОСН 3, -С(O)-С(O)-ОСН 3 или -С(O)-С(O)-ОС 2 Н 5. 9. Лекарственный препарат, включающий соединение по п.1 и/или его фармакологически приемлемую соль в смеси с обычными фармацевтическими эксципиентами и/или наполнителями. 10. Применение соединений по п.1 и их фармакологически приемлемых солей для профилактики и лечения заболеваний желудочно-кишечного тракта.
МПК / Метки
МПК: C07D 491/14, A61K 31/435, A61P 1/04, C07D 471/14
Метки: имидазопиридина, производных, пролекарства
Код ссылки
<a href="https://eas.patents.su/28-5597-prolekarstva-proizvodnyh-imidazopiridina.html" rel="bookmark" title="База патентов Евразийского Союза">Пролекарства производных имидазопиридина</a>
Предыдущий патент: Твёрдая лекарственная форма, включающая циталопрам
Следующий патент: Ненуклеозидные ингибиторы обратной транскриптазы
Случайный патент: Селективный антагонист опиоидных рецепторов каппа